Спосіб одержання естерів 2-оксо-4-трифторометил-1,2-дигідропіримідин-5-карбонової кислоти
Номер патенту: 62422
Опубліковано: 25.08.2011
Автори: Ткачук Віктор Миколайович, Вовк Михайло Володимирович, Сукач Володимир Андрійович
Формула / Реферат
Спосіб одержання естерів 2-оксо-4-трифторометил-1,2-дигідропіримідин-5-карбонової кислоти загальної формули: 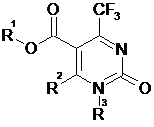 ,
,
де R1 = Me, Et, тpeт-Bu; R2= H, Me, Ph; R3= H, Me, 4-MeOC6H4CH2, який характеризується тим, що b-амінокротонати(цинамати) піддають взаємодії з бензил N-(1-хлоро-2,2,2-трифтороетилiден)карбаматом в присутності органічної основи в апротонному розчиннику при кімнатній температурі з подальшим виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання естерів 2-оксо-4трифторометил-1,2-дигідропіримідин-5-карбонової кислоти загальної формули: 2 3 62422 нокетонів із О-метилізосечовиною з подальшим гідролізом утворених 2-метоксипіримідинів. Недоліком цього способу є нестабільність субстратів трифторометиленамінокетонів-, що суттєво обмежує його синтетичні та технологічні можливості. Окрім цього, очистка цільових продуктів здійснюється методом колонкової хроматографії і в деяких випадках їх виходи не перевищують 16%. Недоліком другого підходу [12], який ґрунтується на циклізації -трифторометил-,-дiацетиленамiну з ароматичними ізоціанатами, також є посередній вихід та хроматографічне розділення цільових 1арил-5-ацетил-6-метил-4-трифторометил-1Hпіримідин-2-онів. Описані методи, окрім наведених суттєвих синтетичних обмежень, не дають можливості отримувати 4-трифторометил-1,2дигідропіримідини з алкоксикарбонільною групою в положенні 5, що може значно розширити спектр фізіологічних та фармакологічних властивостей цільових продуктів. O 1 + O Задачею корисної моделі є спосіб отримання нових похідних 4-трифторометил-2-оксо-1,2дигідропіримідин-5-карбонової кислоти загальної формули: O R O 2 R N O 3 R , 1 2 3 де R =Me, Et, тpeт-Bu; R =H, Me, Ph; R =H, Me, 4-MeOC6H4CH2 Спосіб отримання сполук, які заявляються, полягає в тому, що -амінокротонати(цинамати) піддають взаємодії з бензил N-(1-хлopo-2,2,2трифтороетиліден)карбаматом в присутності органічної основи в апротонному розчиннику при кімнатній температурі. Цільові продукти виділяють з реакційної суміші стандартними методами. Виходи складають 64-82%. O 1 CF3 Ph O 3 NHR3 R O O N O 3 R N R O N CF3 1 CF3 Cl R 4 NHR3 Ph 1 CF3 -Ph R OH N 2 R N O 3 R 1 2 3 де R - Me, Et, тpeт-Bu; R = Me, н-Вu, Ph; R =H, Me, 4-MeOC6H4CH2. Запропонований спосіб є реалізацією нового підходу до трифторометилзаміщених 1,2дигідропіримідин-2-онів, трифторометильна група яких, завдяки своїм стереоелектронним та ліпофільним властивостям, може значно поліпшити їх терапевтичну ефективність. В запропонованому методі в ролі електрофільних компонент формування трифторометилпіримідинового циклу вперше використаний препаративно доступний бензил N-(1-хлоро-2,2,2трифтороетилiден)карбамат [13], що дозволяє вирішити проблему синтезу цільових сполук в потрібних як для випробовування, так і для впровадження об'ємах. Отриманий результат не був заздалегідь передбачуваним, оскільки, завдяки наявності в структурі -амінокротонатів(цинаматів) двох нуклеофільних центрів - атомів азоту аміногрупи і вуглецю алкенільного фрагмента - та біелектрофільному характеру бензил 1N-(1-хлоро-2,2,2трифтороетиліден)карбамату не виключалась можливість перебігу конкуруючої реакції циклізації, яка могла б приводити до ізомерних похідних 2 , трифторометил-4-оксо-1,2-дигідропiримідин-5карбонової кислоти. Можна достовірно вважати, що перебіг процесу циклоконденсації -амінокротонатів(цинаматів) із бензил N-(1-хлоро-2,2,2трифтороетиліден)карбаматом є двостадійним і на першому етапі характеризується утворенням продуктів С-iміноацилювання, які в м'яких умовах схильні до внутрішньомолекулярної циклізації за рахунок атаки аміногрупи на електрофільну карбонільну групу N-алкiліденкарбаматного фрагмента. Індивідуальність та склад синтезованих продуктів доведені результатами хроматомас1 19 13 спектрометрії, структура - 14, ЯМР Н, F та С спектрами, а також на прикладі етилового естеру 1,6-диметил-2-оксо-4-трифторометил-1,2дигідропіримідин-5-карбонової кислоти - рентгеноструктурним дослідженням. Корисна модель ілюструється загальним способом отримання естерів 2-оксо-4трифторометил-1,2-дигідропіримідин-5-карбонової кислоти і фізико-хімічними характеристиками всіх синтезованих сполук. 5 62422 6 4 Загальний вигляд молекули етилового естеру 1,6-диметил-2-оксо-4-трифторометил-1,2дигідропіримідин-5-карбонової кислоти. Загальний спосіб одержання естерів 2-оксо-4трифторометил-1,2-дигідропіримідин-5-карбонової кислоти. До розчину 0,0026 моль бензил 1N-(1-хлор2,2,2-трифторетиліден)-карбамату в 30мл безводного толуолу послідовно додавали при перемішуванні 0,0026 моль відповідного (3амінокротонату(цинамату) та 0,3г (0,0029 моль) триетиламіну. Реакційну суміш перемішували при кімнатній температурі протягом 2,5год., утворений осад хлорогідрату триетиламіну відфільтрували, фільтрат упарювали. Залишок кристалізували із -1 суміші гексан - ізопропанол, 4:1. ІЧ-спектр, ν, см Приклад 1. Метиловий естер 6-метил-2-оксо-4трифторметил-1,2-дигідропіримідин-5-карбонової кислоти. Вихід 65%, т. пл. 128-129 °С. ІЧ-спектр, ν, -1 см 1675 (С=О), 1750 (С=О), 3155 (N-H). Спектр 1 ЯМР Н, CDCl3, , м. ч.: 2,64 с (3Н, СН3), 3,94 с (3Н, 19 СН3О), 7,29 с (1Н, NH). Спектр ЯМР F, CDCL3, 5, 13 м. ч.: - 67,51. Спектр ЯМР С, CDCl3, 5, м. ч.: 18,66 5 6 (СН3), 53,27 (СН3О), 109,64 (С ), 157,48 (С ), 4 119,13 кв. (CF3, J=277,5Гц), 161,30 кв. (С , J=36,3 Гц) 163,06 (С=О), 163,69 (С=О). Знайдено, %: С 40,88; Н 3,08; N 11,99. C8H7F3N2O3. Вирахуваного: С 40,69; Н 2,99; N 11,86. Приклад 2. Метиловий естер 1-(4-метоксибензил)-2-оксо4-трифторометил-1,2-дигідропіримідин-5карбонової кислоти. Вихід 70%, т. пл. 122-123Т. ІЧ-1 спектр, ν, см 1680 (С=О), 1745 (С=О). Спектр 1 ЯМР Н, CDCl3, , м. ч.: 3,80 с (3Н, СН3О), 3,84 с (3Н, СН3О), 5,09 с (2Н, СН2), 6,92 д (2Н аром., J=8,4Гц), 7,31 д (2Н аром., J=8,4Гц), 8,45 с (1H, 19 =СН). Спектр ЯМР F, CDCl3, , м. ч.: - 69,273. 13 Спектр ЯМР С, CDCl3, , м. ч.: 52,85 (СН3О), 54,39 (CH2N), 55,38 (СН3О), 106,54, 115,06, 130,68, 5 6 153,63 (С аром.), 124,85 (С ), 154,32 (С ), 121,14кв. (CF3, J=277,5 Гц), 160,01кв. (С , J=37,5Гц) 160,52 (С=О), 161,63 (С=О). Знайдено, %: С 52,83; Н 3,75; N 8,25. C15H13F3N2O4. Вирахуваного: С 52,64; Н 3,83; N8,18. Приклад 3. Метиловий естер 1,6-диметил-2-оксо-4трифторометил-1,2-дигідропіримідин-5-карбонової кислоти. Вихід 75%, т. пл. 103-104°С. ІЧ-спектр, ν, -1 1 см 1675 (С=О), 1745 (С=О). Спектр ЯМР Н, CDCl3, , м. ч.: 2.54 с ( СН3), 3,66 с (3Н, CH3N), 3,90 19 с (3Н, СН3О). Спектр ЯМР F, CDCl3, , м. ч.: 13 67,75. Спектр ЯМР С, CDCl3, , м. ч.: 18,77 (СН3), 5 33,77 (CH3N), 53,32 (СН3О), 108,92 (С ), 154,50 6 4 (С ), 119,24кв. (CF3, J=277,5 Гц), 158,21 кв. (С , J=35Гц), 161,78 (C=O), 164,57 (C=O). Знайдено, %: С 43,45; H 3,58; N 11,43. C9H9F3N2O3. Вирахуваного: С 43,21; Н 3,63; N 11,20. Приклад 4. Метиловий естер 6-метил-1-(4метоксибензил)-2-оксо-4-трифторо-метил-1,2дигідропіримідин-5-карбонової кислоти. Вихід 76%, -1 т. пл. 110-111 С. ІЧ-спектр, ν, см 1675 (С=О), 1 1740 (СО). Спектр ЯМР Н, CDCl3, , м. ч.: 2,49 с (3Н, СН3), 3,80 с (3Н, СН3О), 3,88 с (3Н, СН3О), 5,33 с (2Н, CH2N), 6,88 д (2Наром., J=8,4 Гц), 7,21 19 д (2Н аром., J=8,4Гц). Спектр ЯМР F, CDCl3, , м. 13 ч.: - 67,43. Спектр ЯМР С, CDCl3, , м.ч.: 18,41 (СН3), 49,67 (СН2), 53,29 (СН3О), 55,35(СН3О), 109,18, 114,65, 128,59, 154,88, (С аром.), 125,60 5 6 (С ), 159,72 (С ), 119,22 кв. (CF3, J=277,5Гц), 4 159,12 кв. (С , J-36,2Гц) 162,16 (СО), 164,54 (СО). Знайдено, %: С 54,13; Н 4,31; N 7,73. C16H15F3N2O4. Вирахуваного: С 53,94; Н 4,24; N 7,86. Приклад 5. Етиловий естер 2-оксо-4-трифторометил-6феніл-1,2-дигідро-піримідин-5-карбонової кислоти. -1 Вихід 64%, т. пл. 162-162°С. ІЧ-спектр, ν, см 1680 1 (СО), 1740 (СО); 3160 (N-H). Спектр ЯМР Н, CDCl3, , м. ч.: 0,98 т (3Н, СН3, J-7,2 Гц), 4,09 кв (2Н, СН2, J-7,2Гц,), 7,53-7,59м (5Н аром.), 13,23 ш. 19 с (1Н, NH). Спектр ЯМР F, CDCl3, , м. ч.: - 68,63. 13 Спектр ЯМР С, CDCl3, , м. ч.: 13,46 (СН3), 62,72 (СН2), 110,10, 128,06, 129,36, 132,52 (С аром.), 130 5 6 (С ), 157,15 (С ), 119,25 кв. (CF3, J=277,5 Гц), 4 160,47 кв. (С , J=36,3Гц), 161,63 (СО), 163,52 (СО). Знайдено, %: С 53,53; Н 3,45; N 9,03. C14H11F3N2O3. Вирахувано, %: С 53,85; Н 3,55; N 8,97. Приклад 6. Етиловий естер 1,6-диметил-2-оксо-4трифторметил-1,2-дигідропіримідин-5-карбонової кислоти. Вихід 82 %, т. пл. 88-89 °С. ІЧ-спектр, ν, -1 1 см 1670 (СО), 1740 (СО).Спектр ЯМР Н, CDCl3, , м. ч.: 1,36 т (3Н, СН3, J=7,2 Гц), 2,54 с (3Н, СН3), 3,66 с (3Н, CH3N), 4,35 кв (2Н, СН2О, J=7,2 Гц). 19 Спектр ЯМР F, CDCl3, , м. ч.: - 68,23. Спектр 13 ЯМР С, CDCl3, , м. ч.: 13,70 (СН3), 18,76 (СН3), 5 33,79 (CH3N), 62,86 (СН2О), 109,36 (С ), 154,60 6 4 (С ), 119,28 кв. (CF3, J=277,5 Гц), 158,04 кв. (С , J=36,2 Гц) 161,89 (С=О), 164,09 (С=О). Знайдено, %: С 45,22; Н 4,35; N 10,53. C10H11F3N2O3. Вирахувано, %: С 45,46; Н 4,20; N 10,60. Приклад 7. 7 Трет-бутиловий естер 1,6-диметил-2-оксо-4трифторметил-1,2-дигідропіримідин-5-карбонової кислоти. Вихід 73%, т. пл. 110-111°С. ІЧ-спектр, ν, -1 1 см 1680 (С=О), 1745 (С=О).Спектр ЯМР Н, CDCl3, , м. ч.: 1.52 с (9Н, 3СН3), 2,50 с (3Н, СН3), 19 3,62 с (3Н, CH3N), Спектр ЯМР F (CDCl3, м. д.): 13 67,55. Спектр ЯМР С, CDCl3, м. ч.: 18,55 (СН3), 27,68(ЗСН3), 33,75(CH3N), 84.44 [С(СН3)3], 111,05 5 6 (С ), 154,62 (С ), 121,59 кв. (CF3, J=277,5 Гц), 4 157,76 кв. (С , J=36,25 Гц), 161,02 (С=О), 163,04 (С=О). Знайдено, %: С 49,53; Н 5,29; N 9,43. C12H15F3N2O3. Вирахуваного: С 49,32; Н 5,17; N 9,59. Джерела інформації: 1. Pat. ЕР 834513. 08 April 1998 Pees К., Liers P., Karla С Pentafluorophenyl azolopyrimidines / American Cyanamid CO. Chem. Abstr.- 1998.- Vol. 128.-257444a. http://ep.espacenet. сom. 2. Pat. WO 9854155. 03 December 1998 Drewes M. W., Andree M., Dollinger M. Substituted iminoalkoxy-phenyluracils, the production and use there of as herbicides / Bayer AG. Chem. Abstr. 1999.- Vol. 130.- 38393w. http://v3 .espacenet.com. 3. Pat. EP 338686. 25 October 1989 Perrior T. R., Tapolkzay D.J., Whittle A. J. Pyrimidinone derivatives / ICI PLC. Chem. Abstr.- 1990.- Vol.112.179009г. http ://ep. espacenet. сom. 4. Pat. Jpn. 03197467. 28 August 1991 Inoue Y., Kobayashi Т., Masu A., Asahina K. Preparation of (2alkylthio)-6-amino-5-(trifluoromethyl)-4(3H)pyrimidinone derivatives as insecticides, acaricides, or agrochemical fungicides / Nippon Kayaku Co., Ltd. Chem. Abstr.- 1991.- Vol.115.- 280054р. 5. Pat. Jpn. 06172377. 21 June 1994 Kawaushi K., Fukuzazawa D., Ishibashi D., Yano O., Iwata D., Etatsugu H., Sobashima T. Preparation of 3 propargyl-,,-trifluorothymidines as antitumors / Chem. Abstr. 1995.- Vol.123.- 33585f. 6. Magnus N.A., Confalone L., Storace L. A new asymmetric 1,4-addition method: application to the synthesis of the HIV non-nucleoside reverse transcriptase inhibitor // Tetrahedron Lett.- 2000.Vol.41, № 17.- P. 3015-3019. 7. Pat. WO 2004080981 (A 1). 23 Septembre 2004. Geneste H., Klmg A., Braje W., Haupt A., Unger L. Pyrimidin-2-one compounds and their use Комп’ютерна верстка Н.Лисенко 62422 8 as dopamine D3 receptor ligands http://v3.espacenet.com/publicationDetails/biblio? DB=EPODOC&adiacenttrue&locale=en_EP&FT=D&date-20040923&CC=W O&NR-2004080981A1 &KOA 1. 8. Pat. WO 2008124614(Al). 16 October 2008 AshweekN., Chen M., Coon T. R., Ewing Т., Jiang W., Moree W., Rowbottom M, Wade W., Zhao L., Zhu Y.-F., Beaton G. Gonadotropin-releazing hormone receptor antagonists and method relating thereto / Neurocrme Biosciences INC / http;//v3.espacenet.com/publicationDetails/biblio?DB= EPODOC&adiacent=true &locale=en EP&FT=D&date=20081016&CC=WO&NR=20Q8124 614A1 &KX> Al. 9. Pat. WO 2008124610(Al). 16 October 2008 Beaton G., Chen M, Coon T.R., Jiang W., Lowe R., Moree W., Smith N., Wade W., Zhao L., Zhu Y.-F. Gonadotropin-releazing hormone receptor antagonists and method relating thereto /Neurocrine Biosciences INC/ http://v3.espacenet.com/ublicationDetails/biblio?DB= EPODOC&adiacent=true&locale=en EP&FT=D &date=20081016&CC=WO&NR=2008124610 A1 &KC=A 1. 10. Pat. WO 2010037210(Al). 08 April 2010 Beaulieu P., Bonneau P., Coulombe R., Forgione P., Gillard J., Jakalian A., Roncourt J. Viral polymerase inhibitors /Boehringer Ingelheim INT/http://v3.espacenet.com/ publication Details/biblio?DB=EPQDOC&adiacent=true&locale=e n EP&FT=D&date=201 00408&CC=WO&NR=2010037210A1 &KC=A 1 11. Berber H., Soufyane M., Mirand С, Schhmidt S., Aubertin A-M. Synthesis о some cyclic and acyclic nucleoside analogues derived from 4(trifluoromethyl)pyrimidines // Tetrahedron.- 2001.Vol.57.- P.7369-7375. 12. Дорохов В.А., Комков А.В., Васильев Л.С., Азаревич О.Г., Гордеев М.Ф. Синтез функционализированных трифторметилпиримидинов на основе ацетилацетона, трифторацетонитрила и арилизоцианатов // Изв. АН СССР.- Сер. хим.1991.- №11.- С.2639-2642. Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 2-oxo-4-trifluoromethyl-1,2-dihydropyrimidine-5-carboxylic esters
Автори англійськоюVovk Mykhailo Volodymyrovych, Sukach Volodymyr Andriiovych, Tkachuk Viktor Mykolaiovych
Назва патенту російськоюСпособ получения эстеров 2-оксо-4-трифторометил-1,2-дигидропиримидин-5-карбоновой кислоты
Автори російськоюВовк Михаил Владимирович, Сукач Владимир Андреевич, Ткачук Виктор Николаевич
МПК / Мітки
МПК: C07D 239/00
Мітки: 2-оксо-4-трифторометил-1,2-дигідропіримідин-5-карбонової, естерів, спосіб, кислоти, одержання
Код посилання
<a href="https://ua.patents.su/4-62422-sposib-oderzhannya-esteriv-2-okso-4-triftorometil-12-digidropirimidin-5-karbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання естерів 2-оксо-4-трифторометил-1,2-дигідропіримідин-5-карбонової кислоти</a>
Попередній патент: Спосіб одержання естерів та нітрилів n-ацилімінотрихлоропропанових кислот
Наступний патент: Спосіб лазерної розробки газогідратних родовищ
Випадковий патент: Електромагнітний двигун








