Похідні 3,6-діарил-1н-піразоло[3,4-b]піридин-4-карбонової кислоти і спосіб їх одержання
Номер патенту: 81201
Опубліковано: 10.12.2007
Автори: Черненко Віталій Миколайович, Десенко Сергій Михайлович, Афанасіаді Людмила Михайлівна, Сахно Яна Ігорівна, Чебанов Валентин Анатолійович
Формула / Реферат
1. Похідні 3,6-діарил-1Н-піразоло[3,4-b]піридин-4-карбонової кислоти загальної формули І
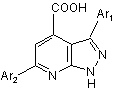 , І
, І
де Аr1 = С6H5; 4-Сl-С6Н4; 4-СН3-С6Н4; 4-СH3О-С6H4;
Ar2 = С6H5; 4-F-С6H4; 4-Сl-С6H4; 4-СН3-С6Н4; 4-СН3О-С6H4; 3,4-ди-СН3О-С6H3.
2. Спосіб одержання сполуки загальної формули І
 , І
, І
де Аr1 = С6H5; 4-Сl-С6Н4; 4-СН3-С6Н4; 4-СH3О-С6H4;
Ar2= С6H5; 4-F-С6H4; 4-Сl-С6H4; 4-СН3-С6Н4; 4-СН3О-С6H4; 3,4-ди-СН3О-С6H3,
який відрізняється тим, що включає конденсацію відповідного аміноазолу з заміщеним ароматичним альдегідом і піровиноградною кислотою у рівномолярному співвідношенні при кипінні у льодяній оцтовій кислоті, причому як аміноазол беруть відповідний заміщений 5-амінопіразол і конденсацію проводять в одну стадію протягом 10-15 хвилин, реакційну масу охолоджують і відфільтровують відповідний продукт структури І.
Текст
1. Похідні 3,6-діарил-1Н-піразоло[3,4b]піридин-4-карбонової кислоти загальної формули І КИСЛОТИ UA (54) ПОХІДНІ ОДЕРЖАННЯ ОПИС (19) ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 таким чином переходити до більш складних гетероциклічних систем, потенціальних біологічно активних речовин з різними фармакофорними фрагментами, які виконують важливу роль у життєдіяльності людини. Зокрема, багато із відомих структур подібної будови мають високу фізіологічну активність як кардіоваскулярні аналептики, кардіопротектори і фібрінолітики [РСТ Int. Patent 8504172, 1985; Jpn. Patent 61263977,1986]. Сполуки, що заявляються, погано розчинюються у неполярних органічних розчинниках (толуол, бензол), розчинюються у сильно полярних розчинниках (диметилформамід, диметилсульфоксид), добре розчинюються у лужних середовищах з утворенням солей за участю карбоксильної групи. Це забезпечує появу розчинності у водних середовищах. Сполуки І стійки до дії кисню повітря і інших окислювачей. Сполуки, що заявляються, і спосіб їх одержання у джерелах інформації не виявлено. Відомий близький за структурою аналог сполук, що заявляються,-2,5,7трифенілпіразоло[1,5-а]піримідин сполука формули II описаний в [В.Д.Орлов, X.Кирога, Н.Н.Колос, С.М.Десенко, Химия гетероциклических соединений, №7, с.962 (1988)]. Сполука II розчиняється у хлороформі, спиртах, у сильно полярних розчинниках (диметилформамід, диметилсульфоксид), нестійка до дії окислювачів. Спосіб одержання відомої сполуки складається із трьох стадій і здійснюється за схемою: Автори стверджують, що у даній реакції однозначно виключається утворення альтернативної гетероароматичної структури піразоло[4,5-в]піридину, яка подібна сполукам, що заявляються. На першій стадії незаміщений ацетофенон вводять до реакції з бензальдегідом у присутності 10% розчину їдкого натру в етиловому спирті. Кетон-бензальацетофенон, що утворюється, кристалізують із метанолу. На другій стадії 5-амінопіразол і незаміщений бензальацетофенон у рівномолярному співвідношенні нагрівають у диметилформаміді, одержують 6,7-дигідропохідне піразолопіримідину 81201 4 з невеликою кількістю продукту його дегідрування. Суміш, що утворилася, складається із дигідро- і гетероароматичних напівпродуктів, її хроматографують на колонці з Аl2О3 у хлороформі, виділяють основну фракцію дигідросполуки після відгону хлороформу і кристалізації залишку із метанолу. На третій стадії дигідропиразолопіримідин, що утворився, і бромсукцинімід (у співвідношенні 1:2) протягом 1 години кип'ятять у метанолі. Продукт II, що утворився після окислення, хроматографують на колонці з Аl2О3 у хлороформі. Загальний час реакції складає приблизно 1516 годин. Вихід продукту за аналогом II з урахуванням трьох технологічних стадій складає приблизно 35%. Сполука II у процесі реакції завжди випадає у вигляді суміші двох продуктів - дигідропродукт (переважно) і деякий відсоток гетероароматичного (окисненого) продукту. Така суміш продуктів завжди потребує додаткового розділення або шляхом дрібної кристалізації, або хроматографуванням за фракціями. Все це ускладнює синтез, подовжує час його ведення, потребує додаткового використання реактивів, що робить кінцевий продукт більш дорожчим за ціною. До недоліків способу одержання відомого аналога II слід віднести багатостадійність синтезу з виділенням проміжних продуктів на кожній стадії, хроматографування їх (розділення за фракціями двох сполук) і подальшій перекристалізації із метанолу. Це приводить до додаткових витрат реактивів, подовження часу синтезу, зменшення виходів кінцевих продуктів. Суттєвим недоліком є застосування у реакції метанолу для очистки проміжного і кінцевих продуктів на першій і другій стадіях синтезу. Метанол - сильна отрута, що діє на нервову і судинну системи, у травному тракті утворюються отруйні для організму людини сполуки формальдегід і мурашина кислота. У пароподібному стані подразнює дихальні шляхи і слизові оболонки очей, уражає зорові нерви і сітківку очей, проникає крізь шкіру. Основним недоліком відомого способу одержання піразолопіримідинів є те, що одержати відразу, без окислення гетероароматичний продукт II за цим способом неможливо, а лише тільки через стадію окислення дигідросполуки бромсукцинімідом. Відомий аналог за структурою - 5-феніл-5,8дигідротетразоло[1,5-а]-піримідин-7-карбонова кислота формули III Сполуки III і спосіб її одержання описано в [В.А.Чебанов, С.М.Десенко, Я.И.Сахно і ін. Фізіологічно активні речовини, 33, №1,10 (2002)]. Сполука III, як і сполуки, що заявляються, мають у структурі вільну карбоксильну групу. 5 Важливою особливістю цієї сполуки є можливість модифікації структури за цією вільною карбоксильною групою - легко вступати до реакції етерифікації при кип'ятінні у спиртах з додаванням каталітичних кількостей НСІ, утворювати відповідні хлорангідриди і аміди. Одним із структурних недоліків є неможливість варіювання замісників в азольному фрагменті сполуки III. Комп'ютерний аналіз можливої фармакологічної активності сполуки III виявив перспективність використання цієї сполуки як кардіоваскулярного аналептика, конвульсанта і фібрінолітіка. Спосіб одержання відомого аналога III здійснюється за схемою: На першій стадії реакції одержання сполуки III синтезують бензиліденпіровиноградну кислоту (2оксо-4-феніл-3-бутенову кислоту). Для цього КОН розчиняють у метанолі, додають до суміші піровиноградної кислоти і бензальдегіду (у рівномолярному співвідношенні) і перемішують суміш протягом 6 годин. Сіль бензиліденпіровиноградної кислоти, що випадає в осад, переводять у кислоту, розчиняючи у воді з додаванням 2N H2SO4. Бензиліденпіровиноградну кислоту кристалізують із бензолу або толуолу, сушать у вакуум-ексикаторі. Вихід цієї кислоти складає лише 25%. На другій стадії бензиліденпіровиноградну кислоту, що одержано на першій стадії вводять до реакції з 5-амінотетразолом у диметилформаміді при нагріванні продовж 5 хвилин. Одержують сполуку III, яку виділяють ацетоном при нагріванні ще протягом 5 хвилин і охолоджують. Одержують дигідропохідне тетразоло[1,5-а]піримідин-7карбонової кислоти. Для перетворення дигідропохідного III в окислений продукт, аналогічний за будовою сполукам І, що заявляються, необхідно ще додаткові стадії синтезу (так само як і у випадку сполуки II) - окислення бромом в середовищі оцтової кислоти з наступним дегідробромуванням. Вихід сполуки III складає 62%. Загальний час синтезу з урахуванням перекристалізацій приблизно 10-11 годин. Основними недоліками відомого способу є багатостадійність синтезу з виділенням проміжних продуктів і їх очищенням, що подовжує час проведення реакції, використання у синтезі легкозаймистих, подразнюючих і вогненебезпечних розчинників - бензолу, толуолу, брому, метанолу, ацетону, що являються кров'яними отрутами. Указані недоліки утруднюють використання даного способу, наприклад, в промислових 81201 6 масштабах, тому що приводять до утворення великих кількостей шкідливих технологічних стоків, що потребують утилізації. Найбільш близькими за хімічною будовою і технічному здійсненню є 5-арил-5,8-дигідро-1,2,4тріазоло[1,5-а]піримідин-7-карбонові кислоти сполуки IV, прийняті нами за прототип, описані в [V. Chebanov, Ya. Sakhno, S. Desenko et al, Synthesis, №15, 2597-2601 (2005)]. Сполуки IV, як і аналогічні структури II і III, не розчиняються у воді, аналоги II і IV розчиняються у водних лужних середовищах завдяки наявності СООН-групи, мало розчиняються у неполярних розчинниках (бензол, толуол), розчиняються у сильно полярних розчинниках (диметилформамід, диметилсульфоксид). Недоліком відомої структури IV є недостатня стійкість до дії окислювачів (бромсукцинімід, брому і т. ін.). Спосіб одержання сполук IV реалізується за схемою: Спосіб одержання сполук IV складається в тому, що суміш 5-аміно-тріазолу, ароматичного альдегіду і піровиноградної кислоти у рівномолярному співвідношенні нагрівають 4 години у льодяній оцтовій кислоті, охолоджують і при охолоджуванні додають ацетон і витримують 12 годин. Утворюються індивідуальні дигідросполуки IV - 5-арил-5,8-дигідро-1,2,4-тріазоло[1,5-а]піримідин-7-карбонові кислоти, які потім для одержання сполук з гетероароматичною системою окислюють бромом у оцтовій кислоті кип'ятінням протягом 10 хвилин з подальшим дегідробромуванням в етанолі з їдким натром впродовж 2 годин. Останні дві стадії синтезу гетероароматичних сполук приводять до подовження тривалості процесу і зменшенню виходів кінцевих продуктів. Виходи неокислених дигідропродуктів IV складають 51-65%, після окислення вихід гетероароматичних продуктів складає 25-37%. Час синтезу з урахуванням трьох стадій складає 20-25 годин. До недоліків способу одержання вказаних сполук IV слід віднести багатостадійність і тривалість процесу, нестійкість цих сполук до дії сильних окислювачів. Крім того, використання 7 брому у синтезі є недоліком даного аналога. Бром - дуже сильна отрута подразнюючої і дихальної дії. Рідкий бром вже після короткотривалої дії утворює на шкірі пухирі, при більш тривалій дії - болісні, важко загоюванні нариви і виразки. Задачею винаходу є пошук нових похідних піразолопіридинкарбонових кислот та розробка більш простого способу одержання сполук, що заявляються, в якому за рахунок зміни компонентів суміші, що реагує (заміни 5амінотріазолу на 5-амінопіразол), і умов проведення синтезу значно скоротити тривалість процесу, підвищити вихід і якість кінцевих продуктів. Поставлена задача досягається розробкою нових похідних 3,6-діарил-1Н-піразоло[3,4в]піридин-4-карбонових кислот загальної формули І 81201 8 Одержані сполуки являють собою індивідуальні гетероароматичні системи з загальною довгою системою спряження (а не дигідросистеми, як за прототипом), більш стійкою до дії окислювачів, що не змінюють структуру у присутності сильних окислювачів і тривалому зберіганні на повітрі. Структуру, що заявляється, підтверджено спектрами ЯМР1Н. Сполуки, що заявляються, здатні до реакцій алкілування і ацілювання за іміногрупою піразолу з утворенням нових, більш складних гетероструктур. Вільна карбоксигрупа дає можливість легко одержувати хлорангідриди, аміди і різні естери. Сполуки І добре розчинні у сильно полярних розчинниках і лугах. Можливість модифікації хімічної структури як аміноазольного фрагмента, так і варіабільність альдегідної складової дозволяють одержувати дуже широкий асортимент нових складних гетероциклічних піразолопіримідинових систем потенціальних біологічно активних речовин. Спосіб, що заявляється, реалізується за схемою: і способом їх одержання. Спосіб одержання сполук формули І що включає конденсацію відповідного 5аміноазолу з заміщеними ароматичними альдегідами і піровиноградною кислотою у рівномолярному співвідношенні при кипінні у середовищі льодяної оцтової кислоти, згідно винаходу, в якості аміноазолу беруть відповідні заміщені 5-амінопіразолу і конденсацію проводять в одну стадію впродовж 10-15 хвилин до утворення відповідного продукту структури І, що заявляється. Видозмінення структури аміноазольної складової, а саме використання 5амінопіразолу, привело до появи нових властивостей структури. Виявилося, що слабкі акцепторні властивості піразолу у порівнянні з тріазолом обумовлюють дестабілізацію дигідропіразолопіримідинових систем і запобігають утворенню дигідропохідних і, як результат, утворення тільки гетероароматичних сполук І, що не можна було передбачити заздалегідь. Сполучення заміщених 5амінопіразолу з компонентами реакційної суміші забезпечило можливість проведення процесу безперервно в одну стадію з утворенням указаних гетероароматичних продуктів. Розроблені умови синтезу дозволяють зменшити кількість стадій за рахунок виключення стадії окислення дигідропохідного і скоротити тривалість процесу, забезпечити одержання достатньо чистих продуктів, що не потребують перекристалізації, і з достатньо високими виходами. Одержання сполук формули І - 3,6-діарил-1Нпіразоло[3,4-в]піридин-4-карбонових кислот здійснюють в одну стадію. Еквімолярні співвідношення реагуючих речовин - заміщених 5амінопіразолу, піровиноградної кислоті і відповідних ароматичних альдегідів нагрівають у льодяній оцтовій кислоті протягом 10-15 хвилин до утворення кінцевих продуктів, які охолоджують, відфільтровують та сушать. Продукти достатньо чисті і не потребують перекристалізації, що виключає додаткові витрати розчинників і часу, здешевлює їх вартість. Загальна тривалість технологічного процесу за способом, що заявляється, складає не більше 1 години (за способом-прототипом 20-25 годин). Вихід сполук загальної формули І складає 37-50% (у способі-прототипі - 25-37%). У таблиці 1 наведено порівняльні дані способу одержання сполук І і способу-прототипу. У таблиці 2 дано характеристики сполук І, що заявляються, і сполук за прототипом, представлено спектральні дані, що підтверджують структуру і чистоту сполук І. Нижче дано приклади конкретного виконання. Приклад 1. Одержання 3,6-дифеніл-1Нпіразоло[3,4-в]піридин-4-карбонової кислоти. Суміш 0,2г (1,3ммоль) 3-феніл-1Н-5амінопіразолу, 0,13мл (1,3ммоль) бензальдегіду і 0,09мл (1,3ммоль) піровиноградної кислоти кип’ятять в 5мл льодяної оцтової кислоти протягом 10 хвилин. Через 10 хвилин з початку кип’ятіння випадає осад, що охолоджують, відфільтровують і промивають етанолом. Одержують продукт у вигляді кристалів жовтого кольору. Вихідні дані: вихід 0,17г (42%), Т. пл. >300°С. 9 Елементний аналіз - знайдено %: N 13,2, С19Н13K3О2. Обчислено %: 13,33. Структуру 3,6-дифеніл-1Н-піразоло[3,4в]піридин-4-карбонової кислоти підтверджено також спектральними даними. Спектри ядерного магнітного резонансу (ЯМР Н1) виміряно на спектрометрі VARIAN Mercury VX200 (200МГц) у розчинах дейтеродиметилсульфоксиду (ДМСО-d6), внутрішній стандарт - тетраметилсилан; δ (м.ч.): 7.96 (1Н, с, СН піримідин), 14.13 (1Н, у.с, ΝΗ), 7.308.30 (10Η, м, АrН). Приклад 2. Одержання 3,6-ди(4фенілметоски)-1Н-піразоло[3,4-в]піридин-4карбонової кислоти. Синтез проводять аналогічно прикладу 1. Для реакції беруть: 0,25г (1,3ммоль) 3-(4фенілметоски)-1H-5-аміно-піразолу, 0,16мл (1,3ммоль) 4-метоксибензальдегіду і 0,09мл (1,3ммоль) піровиноградної кислоти. Кристали мають жовтий колір. Вихідні дані: вихід 0,24г (49%), Т. пл. >300°С. Елементний аналіз - знайдено %: N 11,2, C21H17N3O4. Обчислено %: 11,19. Спектр ЯМР 1Η, δ (м.ч.): 7.88 (1H, с, СН піримідин), 13.90 (1Н, у.с, ΝΗ), 13.60 (1Н, у.с, СООН), 6.90-8.30 (8Н, м, АrН) , 3.80 (3Н, с, ОСН3), 3.83 (3Н, с, ОСН3). Решта прикладів зведено у таблицю 2. Як видно із тексту опису матеріалів заявки і даних таблиць 1, 2, технічне рішення, що пропонується, у порівнянні з прототипом має такі переваги: - структура, що заявляється, більш рухлива і забезпечує більш широкий асортимент піразолопіридинкарбонових кислот завдяки варіації замісників у піразольному і альдегідному фрагментах (у структурі прототипу тільки модифікація альдегідної складової); - структура сполук І, що заявляються, завжди гетероароматична, має довгий ланцюг спряжених подвійних зв'язків (у структурі прототипу - завжди дигідросполуки, що потребують додаткового окислення у гетероароматичні структури); - сполуки, що заявляються, стійкі до дії окислювальних агентів, мають постійний склад (у структурі прототипу співвідношення дигідросплуки до гетероароматичної сполуки коливається у залежності від ступеня окисненості). Спосіб одержання сполук І дозволяє: - зменшити кількість технологічних стадій до 1 (у прототипі - 3), див. таблицю 1; - зменшити тривалість процесу одержання до 1 години (у способі-прототипі 20-25 годин); - підвищити вихід кінцевих продуктів до 3750% (у способі-прототипі-25-37%); - використовувати у синтезі доступні реактиви; - виключити очистку сполук, що заявляються; - здешевіти вартість кінцевих продуктів. У зв'язку з вказаними перевагами способу одержання сполук І значно розширюються можливості використання цих сполук у медицині, біології і фармації. 81201 10 Спосіб одержання сполук І, що заявляється, простий, дешевий і доступний як у лабораторних умовах, так і в умовах промислового виробництва. 11 81201 12
ДивитисяДодаткова інформація
Назва патенту англійською3,6-diaryl-1н-pyrazolo[3,4-b]pyridin-4-carboxylic acid derivatives and process for the preparation thereof
Автори англійськоюSakhno Yana Ihorivna, Chebanov Valentyn Anatoliiovych, Chernenko Vitalii Mykolaiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюПроизводные 3,6-диарил-1н-пиразоло[3,4-b]пиридин-4-карбоновой кислоты и способ их получения
Автори російськоюСахно Яна Игоревна, Чебанов Валентин Анатолиевич, Черненко Виталий Николаевич, Десенко Сергей Михайлович, Дэсэнко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 471/04
Мітки: похідні, кислоти, 3,6-діарил-1н-піразоло[3,4-b]піридин-4-карбонової, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/6-81201-pokhidni-36-diaril-1n-pirazolo34-bpiridin-4-karbonovo-kisloti-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 3,6-діарил-1н-піразоло[3,4-b]піридин-4-карбонової кислоти і спосіб їх одержання</a>
Попередній патент: Композиція інгредієнтів для горілки особливої “катеринославська (екатеринославская)”
Наступний патент: Спосіб прокатки стрічок в прокатній кліті
Випадковий патент: Склад для обробки привибійної зони пласта










