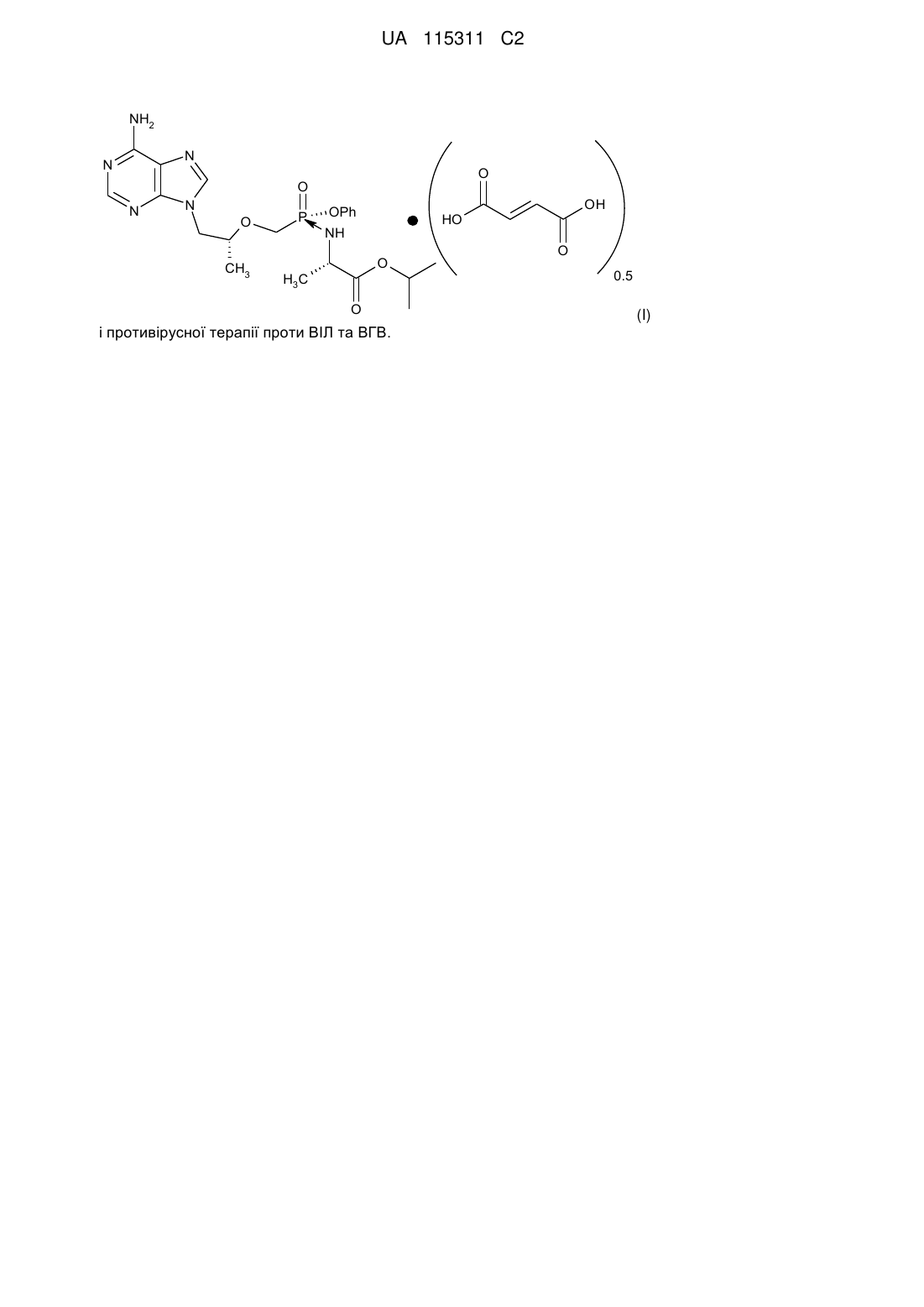
Геміфумарат тенофовіру алафенаміду
Номер патенту: 115311
Опубліковано: 25.10.2017
Автори: Ванг Фанг, Ліу Дажан, Йу Річард Хунг Чіу, Ші Бінг
Формула / Реферат
1. Геміфумарат тенофовіру алафенаміду.
2. Геміфумарат за п. 1, який має температуру початку ендотермічного ефекту на кривій диференціальної скануючої калориметрії (ДСК), рівну 131±2 °C.
3. Геміфумарат за п. 2, який має температуру початку ендотермічного ефекту на кривій ДСК, рівну 131±1 °C.
4. Геміфумарат тенофовіру алафенаміду, дифрактограма рентгенівської порошкової дифракції (РПД) якого містить піки при значеннях 2-тета 6,9±0,2° і 8,6±0,2°.
5. Геміфумарат за п. 4, який відрізняється тим, що дифрактограма РПД містить піки при значеннях 2-тета 6,9±0,2°, 8,6±0,2°, 11,0±0,2°, 15,9±0,2° і 20,2±0,2°.
6. Композиція, що містить геміфумарат тенофовіру алафенаміду, у якому відношення фумарової кислоти до тенофовіру алафенаміду у зазначеній композиції становить 0,5±0,1.
7. Композиція за п. 6, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,05.
8. Композиція за п. 6, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,01.
9. Композиція за п. 6, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить приблизно 0,5.
10. Композиція за будь-яким з пп. 6-9, яка являє собою тверду речовину.
11. Фармацевтична композиція, що містить геміфумарат за будь-яким з пп. 1-5 або композицію за будь-яким з пп. 6-10 та фармацевтично прийнятну допоміжну речовину.
12. Фармацевтична композиція за п. 11, що додатково містить додатковий терапевтичний агент.
13. Фармацевтична композиція за п. 12, у якій додатковий терапевтичний агент вибраний із групи, що складається зі сполук, які інгібують протеазу вірусу імунодефіциту людини (ВІЛ), ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5.
14. Спосіб лікування інфекції вірусу імунодефіциту людини (ВІЛ), що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10, або фармацевтичної композиції за будь-яким з пп. 11-13.
15. Спосіб лікування ВІЛ-інфекції за п. 14, який додатково включає введення суб'єкту одного або більше додаткових терапевтичних агентів, вибраних із групи, що складається зі сполук, які інгібують протеазу вірусу імунодефіциту людини (ВІЛ), ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5.
16. Спосіб лікування ВІЛ-інфекції за п. 14, у якому геміфумарат або композицію, або фармацевтичну композицію вводять у вигляді багаторазових денних доз.
17. Спосіб лікування ВІЛ-інфекції за п. 14, у якому геміфумарат або композицію, або фармацевтичну композицію вводять у вигляді однократної денної дози.
18. Спосіб лікування інфекції вірусу гепатиту В (ВГВ), що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10, або фармацевтичної композиції за будь-яким з пп. 11-13.
19. Спосіб лікування інфекції ВГВ за п. 18, у якому геміфумарат або композицію, або фармацевтичну композицію вводять у вигляді багаторазових денних доз.
20. Спосіб лікування інфекції ВГВ за п. 18, у якому геміфумарат або композицію, або фармацевтичну композицію вводять у вигляді однократної денної дози.
21. Геміфумарат за будь-яким з пп. 1-5 або композиція за будь-яким з пп. 6-10 для застосування в медичній терапії.
22. Геміфумарат за будь-яким з пп. 1-5 або композиція за будь-яким з пп. 6-10 для застосування у лікуванні ВІЛ-інфекції.
23. Геміфумарат за будь-яким з пп. 1-5 або композиція за будь-яким з пп. 6-10 для застосування у лікуванні інфекції ВГВ.
24. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для профілактичного або терапевтичного лікування ВІЛ-інфекції.
25. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для лікування ВІЛ-інфекції.
26. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для одержання або виготовлення лікарського засобу для лікування ВІЛ-інфекції.
27. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для профілактичного або терапевтичного лікування інфекції ВГВ.
28. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для лікування інфекції ВГВ.
29. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для одержання або виготовлення лікарського засобу для лікування інфекції ВГВ у людини.
30. Композиція, що складається по суті з геміфумарату тенофовіру алафенаміду.
31. Композиція за п. 30, яка має температуру початку ендотермічного ефекту на кривій ДСК, рівну 131±2 °C.
32. Композиція за п. 31, яка має температуру початку ендотермічного ефекту на кривій ДСК, рівну 131±1 °C.
33. Композиція, що складається по суті з геміфумарату тенофовіру алафенаміду, причому відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,1.
34. Композиція за п. 33, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,05.
35. Композиція за п. 33, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,01.
36. Композиція за п. 33, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить приблизно 0,5.
37. Композиція за будь-яким з пп. 30-36, яка являє собою тверду речовину.
38. Композиція, що складається по суті з геміфумарату тенофовіру алафенаміду, дифрактограма РПД якого містить піки при значеннях 2-тета 6,9±0,2° і 8,6±0,2°.
39. Композиція за п. 38, яка відрізняється тим, що дифрактограма РПД містить піки при значеннях 2-тета 6,9±0,2°, 8,6±0,2°, 11,0±0,2°, 15,9±0,2° і 20,2±0,2°.
40. Фармацевтична композиція, що містить композицію за будь-яким з пп. 30-39 і фармацевтично прийнятну допоміжну речовину.
41. Фармацевтична композиція за п. 40, що додатково містить додатковий терапевтичний агент.
42. Фармацевтична композиція за п. 41, у якій додатковий терапевтичний агент вибраний із групи, що складається зі сполук, які інгібують протеазу ВІЛ, ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5.
43. Спосіб лікування ВІЛ-інфекції, що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості композиції за будь-яким з пп. 30-39 або фармацевтичної композиції за будь-яким з пп. 40-42.
44. Спосіб лікування ВІЛ-інфекції за п. 43, який додатково включає введення суб'єктові одного або більше додаткових терапевтичних агентів, вибраних із групи, що складається зі сполук, які інгібують протеазу ВІЛ, ненуклеозидних інгібіторів зворотної транскриптазиВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5.
45. Спосіб лікування ВІЛ-інфекції за п. 43, у якому композицію або фармацевтичну композицію вводять у вигляді багаторазових денних доз.
46. Спосіб лікування ВІЛ-інфекції за п. 43, у якому композицію або фармацевтичну композицію вводять у вигляді однократної денної дози.
47. Спосіб лікування інфекції ВГВ, що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості композиції за будь-яким з пп. 30-39 або фармацевтичної композиції за будь-яким з пп. 40-42.
48. Спосіб лікування інфекції ВГВ за п. 47, у якому композицію або фармацевтичну композицію вводять у вигляді багаторазових денних доз.
49. Спосіб лікування інфекції ВГВ за п. 47, у якому композицію або фармацевтичну композицію вводять у вигляді однократної денної дози.
50. Композиція за будь-яким з пп. 30-39 для застосування в медичній терапії.
51. Композиція за будь-яким з пп. 30-39 для застосування для лікування ВІЛ-інфекції.
52. Композиція за будь-яким з пп. 30-39 для застосування для лікування інфекції ВГВ.
53. Застосування композиції за будь-яким з пп. 30-39 для профілактичного або терапевтичного лікування ВІЛ-інфекції.
54. Застосування композиції за будь-яким з пп. 30-39 для лікування ВІЛ-інфекції.
55. Застосування композиції за будь-яким з пп. 30-39 для одержання або виготовлення лікарського засобу для лікування ВІЛ-інфекції.
56. Застосування композиції за будь-яким з пп. 30-39 для профілактичного або терапевтичного лікування інфекції ВГВ.
57. Застосування композиції за будь-яким з пп. 30-39 для лікування інфекції ВГВ.
58. Застосування композиції за будь-яким з пп. 30-39 для одержання або виготовлення лікарського засобу для лікування інфекції ВГВ у людини.
59. Спосіб одержання фармацевтичної композиції, що включає комбінування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 і фармацевтично прийнятної допоміжної речовини із забезпеченням фармацевтичної композиції.
60. Спосіб за п. 59, який також включає додавання додаткового терапевтичного агента.
61. Спосіб за п. 60, у якому додатковий терапевтичний агент вибирають з групи, яка складається зі сполук, які інгібують протеазу вірусу імунодефіциту людини (ВІЛ), ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5.
62. Спосіб одержання фармацевтичної композиції, що включає комбінування композиції за будь-яким з пп. 30-39 і фармацевтично прийнятної допоміжної речовини для забезпечення фармацевтичної композиції.
63. Спосіб за п. 62, який також включає додавання додаткового терапевтичного агента.
64. Спосіб за п. 63, у якому додатковий терапевтичний агент вибирають з групи, яка складається зі сполук, які інгібують протеазу вірусу імунодефіциту людини (ВІЛ), ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5.
65. Спосіб одержання геміфумарату тенофовіру алафенаміду, згідно з яким розчин, що містить: а) прийнятний розчинник; b) фумарову кислоту; с) тенофовіру алафенамід; і d) одну або більше затравок геміфумарату тенофовіру алафенаміду, піддають дії умов, які забезпечують кристалізацію фумарової кислоти і тенофовіру алафенаміду.
66. Спосіб за п. 65, у якому розчинник містить ацетонітрил.
67. Спосіб за п. 65, у якому розчин піддають кристалізації при температурі в діапазоні від приблизно 0 °C до приблизно 75 °C.
68. Спосіб одержання геміфумарату тенофовіру алафенаміду, який включає стадії: змішування: а) апротонного органічного розчинника; b) фумарової кислоти; с) тенофовіру алафенаміду і d) однієї або більше затравки геміфумарату тенофовіру алафенаміду; та кристалізації додаткового геміфумарату тенофовіру алафенаміду.
69. Спосіб одержання геміфумарату тенофовіру алафенаміду, який включає стадії: змішування: а) розчинника, вибраного з групи, що містить воду, ізопропіловий спирт, ацетон, ацетонітрил, толуол, етилацетат, ізопропілацетат, гептан, тетрагідрофуран, 2-метилтетрагідрофуран, метил-етил-кетон, метил-ізобутил-кетон, метиленхлорид або їх суміші; b) фумарової кислоти; с) тенофовіру алафенаміду і d) однієї або більше затравок геміфумарату тенофовіру алафенаміду; та
кристалізації додаткового геміфумарату тенофовіру алафенаміду при температурі від приблизно 0 °C до приблизно 70 °C.
70. Спосіб за п. 69, у якому розчинник включає ацетонітрил та до приблизно 50 % за об'ємом метиленхлориду.
Текст
Реферат: Винахід стосується геміфумаратної форми тенофовіру алафенаміду формули (І) UA 115311 C2 (12) UA 115311 C2 NH2 N N O O N N O CH3 P OPh NH O H3 C OH HO O і противірусної терапії проти ВІЛ та ВГВ. O 0.5 (I) UA 115311 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднені заявки [0001] Ця заявка заявляє пріоритет на підставі попередньої заявки на патент США № 61/524224, поданої 16 серпня 2011 року, зміст якої включено в даний документ шляхом посилання в повному обсязі. РІВЕНЬ ТЕХНІКИ Опис рівня техніки [0002] У патентах США №№ 7390791 і 7803788 (зміст кожного з яких включено в даний документ шляхом посилання в повному обсязі) описані деякі проліки фосфонатних нуклеотидних аналогів, які прийнятні для застосування в терапії. Одне з таких проліків являє собою 9-[(R)-2-[[(S)-[[(S)-1(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденін. Ця сполука також відома за назвою в Хімічній реферативній службі (Chemical Abstract) як L-аланін, N-[(S)-[[(1R)-2(6-аміно-9H-пурин-9-іл)-1-метилетокси]метил]феноксифосфініл]-, 1-метилетиловий ефір. У патентах США №№ 7390791 і 7803788 запропонована також монофумаратна форма цієї сполуки і спосіб її одержання (див., наприклад, Приклад 4). КОРОТКИЙ ОПИС ВИНАХОДУ [0003] Описана геміфумаратна форма 9-[(R)-2-[[(S)-[[(S)-1(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденіну. 9-[(R)-2-[[(S)-[[(S)-1(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденін називається тенофовір алафенамідом. Геміфумаратну форму тенофовір алафенаміду в даному документі також називають тенофовір алафенаміду геміфумаратом. [0004] В одному з варіантів реалізації цього винаходу запропонований тенофовір алафенаміду геміфумарат. [0005] В іншому варіанті реалізації запропонований тенофовір алафенаміду геміфумарат, причому відношення фумарової кислоти до тенофовір алафенаміду становить 0,5±0,1 або 0,5±0,05, або 0,5±0,01, або приблизно 0,5. [0006] В одному з варіантів реалізації запропонований тенофовір алафенаміду геміфумарат у твердій формі. [0007] В одному з варіантів реалізації запропонований тенофовір алафенаміду геміфумарат, який характеризується дифрактограмою рентгенівської порошкової дифракції (РПД), що має піки при значеннях 2-тета 6,9±0,2, 8,6±0,2, 11,0±0,2, 15,9±0,2 і 20,2±0,2. [0008] В одному з варіантів реалізації запропонований тенофовір алафенаміду геміфумарат, який має температуру початку ендотермічного ефекту на кривій диференціальної скануючої калориметрії (ДСК), рівну 131±2 C або 131±1 С. [0009] В одному з варіантів реалізації запропонована фармацевтична композиція, що містить тенофовір алафенаміду геміфумарат і фармацевтично прийнятна допоміжна речовина. В іншому варіанті реалізації запропонована фармацевтична композиція, що додатково містить додатковий терапевтичний агент. У наступному варіанті реалізації додатковий терапевтичний агент обраний із групи, що складається зі сполук, які інгібують протеазу вірусу імунодефіциту людину (ВІЛ), ненуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеотидні інгібітори зворотної транскриптази ВІЛ, інгібітори ВІЛ інтегрази ВІЛ та інгібітори CCR5. [0010] В одному з варіантів реалізації запропонований спосіб лікування інфекції вірусу імунодефіциту людини (ВІЛ), що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості тенофовір алафенаміду геміфумарату. В іншому варіанті реалізації запропонований спосіб лікування ВІЛ-інфекції, що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості фармацевтичної композиції, що містить тенофовір алафенаміду геміфумарат. У наступному варіанті реалізації зазначений спосіб включає введення суб'єктові одного або більш додаткових терапевтичних агентів, обраних із групи, що складається зі сполук, які інгібують протеазу ВІЛ, ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5. [0011] В одному з варіантів реалізації запропонований спосіб лікування інфекції вірусу гепатиту В (ВГВ), що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості тенофовір алафенаміду геміфумарату. В іншому варіанті реалізації запропонований спосіб лікування інфекції ВГВ, що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості фармацевтичної композиції, що містить тенофовір алафенаміду геміфумарат. [0012] В одному з варіантів реалізації запропонований спосіб одержання фармацевтичної композиції, що включає комбінування тенофовір алафенаміду геміфумарату і фармацевтично 1 UA 115311 C2 5 10 15 20 25 30 35 40 45 50 55 60 прийнятної допоміжної речовини із забезпеченням фармацевтичної композиції. [0013] В одному з варіантів реалізації запропонований спосіб одержання тенофовір алафенаміду геміфумарату, згідно з яким розчин, що містить відповідний розчинник; фумарову кислоту; тенофовір алафенамід; і необов'язково один або більше запалів тенофовір алафенаміду геміфумарату, піддають впливу умов, які забезпечують кристалізацію фумарової кислоти і тенофовір алафенаміду. В одному з варіантів реалізації розчинник містить ацетонітрил. В іншому варіанті реалізації розчин піддають впливу температури в діапазоні від приблизно 0 С до приблизно 75 С. [0014] В одному з варіантів реалізації запропонований тенофовір алафенаміду геміфумарат для застосування в медичній терапії. [0015] В одному з варіантів реалізації запропоноване застосування тенофовір алафенаміду геміфумарату для профілактичного або терапевтичного лікування ВІЛ-інфекції. В іншому варіанті реалізації запропоноване застосування тенофовір алафенаміду геміфумарату для лікування ВІЛ-інфекції. У наступному варіанті реалізації запропоноване застосування тенофовір алафенаміду геміфумарату для одержання або виробництва лікарського засобу для лікування ВІЛ-інфекції. В іншому додатковому варіанті реалізації запропонований тенофовір алафенаміду геміфумарат для застосування для лікування ВІЛ-інфекції. [0016] В одному з варіантів реалізації запропоноване застосування тенофовір алафенаміду геміфумарату для профілактичного або терапевтичного лікування інфекції ВГВ. В іншому варіанті реалізації запропоноване застосування тенофовір алафенаміду геміфумарату для лікування інфекції ВГВ. У наступному варіанті реалізації запропоноване застосування тенофовір алафенаміду геміфумарату для одержання або виробництва лікарського засобу для лікування інфекції ВГВ. В іншому додатковому варіанті реалізації запропонований тенофовір алафенаміду геміфумарат для застосування для лікування інфекції ВГВ. [0017] У деяких варіантах реалізації цього винаходу, способи лікування і тому подібного включають введення багаторазових денних доз. В інших варіантах реалізації, способи лікування і тому подібного включають введення однократної денної дози. [0018] В одному з варіантів реалізації цього винаходу запропонована композиція, що складається по суті з тенофовір алафенаміду геміфумарату. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ [0019] На Фіг. 1 наведена рентгенівська порошкова дифрактограма (РПД) тенофовір алафенаміду геміфумарату. [0020] На Фіг. 2 наведена крива ДСК-аналізу тенофовір алафенаміду геміфумарату. [0021] На Фіг. 3 наведена крива термогравіметричного аналізу (ТГА) тенофовір алафенаміду геміфумарату. [0022] На Фіг. 4 наведена крива аналізу динамічної сорбції пару (ДСП) тенофовір алафенаміду геміфумарату. ДОКЛАДНИЙ ОПИС ВИНАХОДУ [0023] Конкретні значення, перераховані в даному описі для радикалів, замісників і діапазонів, є лише ілюстративними; вони не виключають інші визначені значення або інші значення в межах визначених діапазонів для радикалів і замісників. [0024] В одному з варіантів реалізації запропонована геміфумаратна форма тенофовір алафенаміду (тобто тенофовір алафенаміду геміфумарат). Ця форма може мати співвідношення (тобто стехіометричне відношення або мольне відношення) фумарової кислоти до тенофовір алафенаміду 0,5±0,1, 0,5±0,05, 0,5±0,01 або приблизно 0,5, або тому подібне. [0025] В одному з варіантів реалізації, тенофовір алафенаміду геміфумарат складається з фумарової кислоти і тенофовір алафенаміду у співвідношенні 0,5±0,1. [0026] В одному з варіантів реалізації, тенофовір алафенаміду геміфумарат складається по суті з фумарової кислоти і тенофовір алафенаміду у співвідношенні 0,5±0,1. [0027] В одному з варіантів реалізації, тенофовір алафенаміду геміфумарат має картину РПД, що містить значення 2-тета 6,9±0,2, 8,6±0,2, 10,0±0,2, 11,0±0,2, 12,2±0,2, 15,9±0,2, 16,3±0,2, 20,2±0,2 і 20,8±0,2. [0028] В одному з варіантів реалізації, тенофовір алафенаміду геміфумарат має картину РПД, що містить щонайменше чотири значення 2-тета, обраних з 6,9±0,2, 8,6±0,2, 10,0±0,2, 11,0±0,2, 12,2±0,2, 15,9±0,2, 16,3±0,2, 20,2±0,2 і 20,8±0,2. [0029] В одному з варіантів реалізації, тенофовір алафенаміду геміфумарат має температуру початку ендотермічного ефекту на кривій ДСК, рівну 131±2 С або 131±1 С. [0030] В одному з варіантів реалізації, композиція тенофовір алафенаміду геміфумарату містить менш ніж приблизно 5% за вагою тенофовір алафенаміду монофумарату. [0031] В одному з варіантів реалізації, композиція тенофовір алафенаміду геміфумарату 2 UA 115311 C2 5 10 15 20 25 30 35 40 містить менш ніж приблизно 1% за вагою тенофовір алафенаміду монофумарату. [0032] В одному з варіантів реалізації, композиція тенофовір алафенаміду геміфумарату містить менш ніж приблизно 0,5% за вагою тенофовір алафенаміду монофумарату. [0033] В одному з варіантів реалізації, композиція тенофовір алафенаміду геміфумарату не містить тенофовір алафенаміду монофумарату, що піддається виявленню. [0034] Тенофовір алафенамід (тобто сполука 9-[(R)-2-[[(S)-[[(S)-1(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденін) може бути отриманий так, як описано в патенті США № 7390791. Селективна кристалізація [0035] В одному з варіантів реалізації, тенофовір алафенаміду геміфумарат може бути отриманий за допомогою селективної кристалізації. Приклад схеми такого способу одержання представлений нижче. [0036] Цей спосіб може бути здійснений впливом на розчин, що містить: а) відповідний розчинник; b) фумарову кислоту; с) тенофовір алафенамід; і, необов'язково, d) один або більше запалів, що містять тенофовір алафенаміду геміфумарат, умов, які забезпечують кристалізацію фумарової кислоти і тенофовір алафенаміду. Вихідний розчин може містити один диастереомер тенофовір алафенаміду або суміш тенофовір алафенаміду і одного або більше з його диастереомерів (наприклад, GS-7339, описаний у патенті США № 7390791). [0037] Селективна кристалізація може бути виконана в будь-якому прийнятному розчиннику. Наприклад, вона може бути здійснена в протонному розчиннику або в апротонному органічному розчиннику, або в їх суміші. В одному з варіантів реалізації, розчинник містить протонний розчинник (наприклад, воду або ізопропіловий спирт). В іншому варіанті реалізації, розчинник містить апротонний органічний розчинник (наприклад, ацетон, ацетонітрил (ACN), толуол, етилацетат, ізопропілацетат, гептан, тетрагідрофуран (ТГФ), 2-метил ТГФ, метилетилкетон або метилізобутилкетон, або їх суміш). В одному з варіантів реалізації, розчинник може містити ACN або суміш ACN і до 50% метиленхлориду (за обсягом). Селективна кристалізація також може бути виконана при будь-якій прийнятній температурі, наприклад, при температурі в діапазоні від приблизно 0 С до приблизно 70 С. В одному конкретному варіанті реалізації, поділ виконують при температурі приблизно 0 С. [0038] Одна з основних переваг геміфумаратної форми тенофовір алафенаміду у порівнянні з монофумаратною формою полягає в її винятковій здатності усувати GS-7339 (тобто 9-[(R)-2[[(R)-[[(S)-1-(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденін; описаний, наприклад, у патенті США № 7390791), який являє собою основну диастереомерну домішку в активному фармацевтичному інгредієнті. Отже, геміфумаратна форма тенофовір алафенаміду може бути простіше і легше відділена від домішок, ніж монофумаратна форма. Інші основні переваги тенофовір алафенаміду геміфумарату у порівнянні з монофумаратною формою включають поліпшену термодинамічну і хімічну стабільність (включаючи стабільність при тривалому зберіганні), чудову відтворюваність процесу, виняткову сталість сполуки лікарського продукту і більш високу температуру плавлення. [0039] Тенофовір алафенаміду геміфумарат прийнятний для лікування і/або профілактики однієї або більше вірусних інфекцій у людей або тварин, включаючи інфекції, викликані ДНКвірусами, РНК-вірусами, вірусами герпесу (наприклад, цитомегаловірус (CMV), вірус простого 3 UA 115311 C2 5 10 15 20 25 30 35 40 45 50 55 60 герпесу (HSV) 1, вірусами простого герпесу (HSV) 2, вірусами варицела-зостер (VZV)), ретровірусами, гепаднавірусами (наприклад, ВГВ), вірусами папіломи, хантавірусом, аденовірусом і ВІЛ. У патенті США № 6043230 (включеному в даний документ за допомогою посилання в повному обсязі) і в інших публікаціях описана противірусна специфічність нуклеотидних аналогів, таких як тенофовір дизопроксил. Як і тенофовір дизопроксил, тенофовір алафенамід являє собою іншу пролікарську форму тенофовіру і може бути використаний при лікуванні і/або профілактиці таких же станів. [0040] Тенофовір алафенаміду геміфумарат може бути введений будь-яким способом, прийнятним для стану, що підлягає лікуванню. Прийнятні шляхи включають пероральний, ректальний, назальний, місцевий (включаючи окулярний, буккальний і сублінгвальний), вагінальний і парентеральний (включаючи підшкірний, внутрішньом'язовий, внутрішньовенний, внутрішньошкірний, інтратекальний і епідуральний). Як правило, тенофовір алафенаміду геміфумарат вводять перорально, але він може бути введений кожним з інших способів, згаданих у даному документі. [0041] Відповідно, фармацевтичні композиції включають композиції, прийнятні для місцевого або системного введення, включаючи пероральне, ректальне, назальне, буккальне, сублінгвальне, вагінальне або парентеральне (включаючи підшкірне, внутрішньом'язове, внутрішньовенне, внутрішньошкірне, інтратекальне і епідуральне) введення. Композиції представлені в одиничній лікарській формі і отримані по кожному зі способів, добре відомих в галузі фармації. [0042] Для перорального терапевтичного введення тенофовір алафенаміду геміфумарат може бути змішаний з однією або більше допоміжних речовин і використаний у формі таблеток для проковтування, буккальних таблеток, пастилок, капсул, еліксирів, суспензій, сиропів, облаток і тому подібного. Такі фармацевтичні композиції і препарати звичайно містять щонайменше 0,1% тенофовір алафенаміду геміфумарату. Процентний вміст цієї активної сполуки в композиціях і препаратах, звичайно, може варіюватися і звичайно може становити в діапазоні від приблизно 2% до приблизно 60% або більше від ваги даної разової лікарської форми. Кількість активної сполуки в таких терапевтичних придатних фармацевтичних композиціях, краще, є таким, що досягається ефективний рівень дози при введенні однократної дози (наприклад, таблетки). Інші дозовані сполуки можуть забезпечувати терапевтично ефективні кількості тенофовір алафенаміду геміфумарату при повторному введенні його субклінічно ефективних кількостей. Кращі одиничні дозовані сполуки включають композиції, які містять денну дозу (наприклад, одну денну дозу), а також композиції, що містять разову денну субклінічну дозу або її відповідну частину (наприклад, багаторазові денні дози), тенофовір алафенаміду геміфумарату. [0043] Фармацевтичні композиції, прийнятні для перорального введення, можуть бути представлені у вигляді дискретних одиниць, таких як капсули, пастилки або таблетки, кожна з яких містить заздалегідь задану кількість тенофовір алафенаміду геміфумарату; у вигляді порошку або гранул; у вигляді розчину або суспензії у водній рідині або неводній рідині; або у вигляді рідкої емульсії «олія у воді» або рідкої емульсії «вода в олії». Тенофовір алафенаміду геміфумарат також може бути представлений у вигляді болюсу, електуарію або пасти. [0044] Тенофовір алафенаміду геміфумарат краще вводять як частину фармацевтичної композиції або препарату. Така фармацевтична композиція або препарат містить тенофовір алафенаміду геміфумарат разом з одним або більше фармацевтично прийнятними носіями / допоміжними речовинами і, необов'язково, іншими терапевтичними інгредієнтами. Допоміжна речовина(и) / носій(ї) повинна бути «прийнятна» з погляду сумісності з іншими інгредієнтами композиції і не бути шкідливою для пацієнта. Допоміжні речовини включають, але не обмежуючись цим, речовини, які можуть служити як рідкий носій або середовище для тенофовір алафенаміду геміфумарату (наприклад, носій-розріджувач). Вони можуть бути укладені у тверду або м'яку оболонку желатинових капсул, можуть бути спресовані в таблетки або можуть бути введені безпосередньо з їжею раціону пацієнта. [0045] Відповідно, таблетки, пастилки, пігулки, капсули і тому подібні також можуть містити, без обмеження, наступні: зв'язувальна речовина(и), така як гідроксипропілцелюлоза, повідон або гідроксипропілметилцелюлоза; наповнювач(і), такий як мікрокристалічна целюлоза, пептизований крохмаль, крохмаль, маніт або моногідрат лактози; агент(и) для поліпшення розпаду таблеток, такої як кроскармелоза натрію, поперечно зшитий повідон або натрію крохмальгліколят; змащувальна речовина(и), така як стеарат магнію, стеаринова кислота або інші стеарати металів; підсолоджувач(і), такий як сахароза, фруктоза, лактоза або аспартам; і/або смаковий агент(и), такий як перцева м'ята, вінтергренова олія або вишневий ароматизатор. Якщо разова лікарська форма являє собою капсулу, вона може містити, крім 4 UA 115311 C2 5 10 15 20 25 30 35 40 45 50 55 60 матеріалів перерахованих вище типів, рідкий носій, такий як рослинна олія або поліетиленгліколь. Можуть бути присутні різні інші матеріали як покриття або для іншої модифікації фізичної форми твердої разової лікарської форми. Наприклад, таблетки, пігулки або капсули можуть бути покриті желатином, полімерами, воском, шелаком або цукром і тому подібними. Звичайно, будь-який матеріал, що застосовується при одержанні будь-якої разової лікарської форми, звичайно є фармацевтично прийнятним і в основному нетоксичним у кількостях, що використовуються. Крім того, тенофовір алафенаміду геміфумарат може бути введений до складу препаратів і приладів, що забезпечують уповільнене вивільнення. [0046] Для лікування інфекцій очей або інших зовнішніх тканин, наприклад, роту і шкіри, фармацевтичні композиції краще наносять у вигляді місцевої мазі або крему, що містить тенофовір алафенаміду геміфумарат у кількості, наприклад, 0,01-10% мас./мас. (включаючи активний інгредієнт у діапазоні від 0,1% до 5% зі збільшеннями 0,1%, така кількість як 0,6% мас./мас., 0,7% мас./мас. і так далі), краще, 0,2-3% мас./мас. і найкраще 0,5-2% мас./мас. При складанні композиції у вигляді мазі, активний інгредієнт може бути використаний з парафіновою або мазевою основою, що змішується з водою. Альтернативно, активний інгредієнт може бути складений у композицію крему з кремовою основою «олія у воді». [0047] Фармацевтичні композиції, що прийнятні для місцевого застосування в порожнині рота, включають пастилки, що містять тенофовір алафенаміду геміфумарат у смаковій основі, наприклад, сахарозі і гуміарабіку або трагакантової камеді; пастилки, що містять активний інгредієнт в інертній основі, такій як желатин і гліцерин, або сахароза і гуміарабік; і засоби для полоскання роту, що містять активний інгредієнт у відповідному рідкому носії. [0048] Композиції для ректального введення можуть бути представлені у вигляді супозиторію з відповідною основою, що включає, наприклад, масло какао або саліцилат. [0049] Фармацевтичні композиції, що прийнятні для парентерального введення, є стерильними і включають водні та неводні розчини для ін'єкцій, які можуть містити антиоксиданти, буфери, бактериостати і розчинені речовини, які надають композиції ізотонічність з кров'ю призначеного реципієнта; і водні та неводні стерильні суспензії, які можуть містити суспендуючі агенти і загущувачі. Композиції можуть бути представлені в упаковках однократної дози або багаторазових доз, наприклад, у запаяних ампулах і пробірках з еластомерними пробками, і можуть зберігатися у висушеному заморожуванням (ліофілізованому) стані, що вимагає лише додавання стерильного рідкого носія (наприклад, води для ін'єкцій) безпосередньо перед застосуванням. Розчини і суспензії для ін'єкцій можуть бути приготовлені зі стерильних порошків, гранул і таблеток раніше описаних видів. [0050] Крім інгредієнтів, конкретно згаданих вище, фармацевтичні композиції / препарати можуть містити інші інгредієнти, традиційні в цій галузі техніки, що мають відношення до сполук розглянутого типу. [0051] В іншому варіанті реалізації запропоновані ветеринарні композиції, що містять тенофовір алафенаміду геміфумарат разом з прийнятним ветеринарним носієм. Ветеринарні носії являють собою матеріали, прийнятні для цілей введення композиції кішкам, собакам, коням, кроликам та іншим тваринам, і можуть бути твердими, рідкими або газоподібними матеріалами, які інакше є інертними або прийнятними в галузі ветеринарії і сумісними з активним інгредієнтом. Ці ветеринарні композиції можуть бути введені перорально, парентерально або будь-яким іншим заданим способом. [0052] Тенофовір алафенаміду геміфумарат може бути використаний для забезпечення фармацевтичних композицій з контрольованим вивільненням, що містять матрицю або абсорбуючий матеріал і активний інгредієнт цього винаходу, у яких вивільнення активного інгредієнта може контролюватися і регулюватися для забезпечення можливості більш рідкого дозування або для поліпшення профілю фармакокінетики або токсичності сполуки. Композиції з контрольованим вивільненням, адаптовані для перорального введення, у яких дискретні одиниці містять сполуки згідно з цим винаходом, можуть бути отримані згідно з традиційними способами. [0053] Прийнятні дози тенофовір алафенаміду геміфумарату можуть бути визначені порівнянням in vitro активності і in vivo активності у тваринних моделях. Способи екстраполяції ефективних кількостей / доз для мишей та інших тварин до терапевтично ефективних кількостей / доз для людей відомі в цій галузі. [0054] Кількість тенофовір алафенаміду геміфумарату, необхідна для застосування для лікування, варіюється залежно від декількох факторів, включаючи, але не обмежуючись цим, спосіб введення, природу стану, що підлягає лікуванню, і вік і стан пацієнта; насамперед, введену кількість визначає лікар, що лікує, або клініцист. Терапевтично ефективна кількість/доза тенофовір алафенаміду геміфумарату залежить щонайменше від природи стану, 5 UA 115311 C2 5 10 15 20 25 30 35 40 45 50 55 60 що підлягає лікуванню, наслідків якої-небудь токсичності або взаємодії ліків, застосування сполуки для профілактики (наприклад, що вимагає в деяких випадках більш низьких доз) або проти активного захворювання або стану, способу доставки і фармацевтичної композиції, і визначається клініцистом за допомогою стандартних досліджень підвищення доз. [0055] В одному з варіантів реалізації, пероральна доза тенофовір алафенаміду геміфумарату може бути в діапазоні від приблизно 0,0001 до приблизно 100 мг/кг маси тіла на день, наприклад, від приблизно 0,01 до приблизно 10 мг/кг маси тіла на день, від приблизно 0,01 до приблизно 5 мг/кг маси тіла на день, від приблизно 0,5 до приблизно 50 мг/кг маси тіла на день, від приблизно 1 до приблизно 30 мг/кг маси тіла на день, від приблизно 1,5 до приблизно 10 мг/кг маси тіла на день або від приблизно 0,05 до приблизно 0,5 мг/кг маси тіла на день. Як необмежуючий приклад, можлива денна доза для дорослої людини вагою приблизно 70 кг варіюється від приблизно 0,1 мг до приблизно 1000 мг, або від приблизно 1 мг до приблизно 1000 мг, або від приблизно 5 мг до приблизно 500 мг, або від приблизно 1 мг до приблизно 150 мг, або від приблизно 5 мг до приблизно 150 мг, або від приблизно 5 мг до приблизно 100 мг, і може приймати форму однократної або багаторазових доз. [0056] Фармацевтичні композиції, описані в даному документі, можуть додатково містити один або більше терапевтичних агентів крім тенофовір алафенаміду геміфумарату. В одному конкретному варіанті реалізації цього винаходу, додатковий терапевтичний агент може бути обраний із групи, що складається зі сполук, які інгібують протеазу ВІЛ, ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5. [0057] Терапевтичні способи включають введення тенофовір алафенаміду геміфумарату суб'єктові/пацієнтові, що потребує цього, як терапевтичне або профілактичне лікування. Так, тенофовір алафенаміду геміфумарат може бути введений суб'єктові/пацієнтові, що страждає від медичного розладу, або суб'єктові, який може одержати цей розлад. Фахівцям у цій галузі зрозуміло, що таке лікування спрямоване на полегшення, запобігання, відстрочку, лікування і/або зниження тяжкості симптому або симптомокомплексу розладу (включаючи рецидивуючий розлад). Лікування також може бути спрямоване на збільшення тривалості життя суб'єкта, наприклад, протягом більшого часу, ніж тривалість життя, прогнозована під час відсутності такого лікування. Медичні розлади, які можна лікувати тенофовір алафенаміду геміфумаратом, включають розлади, розглянуті в даному документі, включаючи, без обмеження, ВІЛ-інфекцію та інфекцію ВГВ. [0058] Нижче представлені необмежуючі ілюстративні Приклади. Приклад 1 [0059] Твердий тенофовір алафенаміду монофумарат (5,0 г) і твердий 9-[(R)-2-[[(R)-[[(S)-1(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденіну монофумарат (GS7339) (0,75 г) поміщали в 35 г МТБЕ при 22 С і перемішували суміш протягом 1 години. Утворювалася суспензія, і її висушували на ротаційному випарнику. У тверді речовини поміщали 58 г ацетонітрилу (ACN) і нагрівали суміш зі зворотним холодильником для розчинення твердих речовин. Отриманий розчин залишали остигати природно при перемішуванні. Утворювалася суспензія, і цю суспензію додатково прохолоджували на воднокрижаній лазні. Тверді речовини відокремлювали фільтрацією і промивали 5 г ACN. Тверді речовини висушували у вакуумній печі при 40 С протягом ночі. Одержували 5,52 г бруднуватобілої твердої речовини. Цю тверду речовину аналізували по РПД і виявили, що воно містить тенофовір алафенаміду монофумарат, GS-7339 монофумарат і тенофовір алафенаміду геміфумарат. Приклад 2: Одержання тенофовір алафенаміду геміфумарату за допомогою селективної кристалізації [0060] 9-[(R)-2-[[[[(S)-1(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденін у вигляді суспензії в ACN (9,7 кг суспензії, 13,8 мас.%, диастереомерна суміш 1,0 кг (2,10 моль, 1 мол. екв.) 9-[(R)-2[[(S)-[[(S)-1-(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденіну і 0,35 кг 9[(R)-2-[[(R)-[[(S)-1-(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденіну поміщали в реактор і промили дихлорметаном (5 кг). Суміш концентрували під вакуумом приблизно до 3 л при температурі сорочки менше 40 С. Потім концентрат спільно упарювали з ACN (6 кг) під вакуумом приблизно до 3 л при температурі сорочки менше 40 С. Концентрат розбавляли ACN (8,5 кг) і нагрівали до 40-46 С. Теплу суміш відфільтровували в другий реактор і прохолоджували фільтрат до 19-25 С. [0061] В отриманий вище розчин поміщали фумарову кислоту (0,13 кг, 1,12 моль, 0,542 мол. 6 UA 115311 C2 5 10 15 20 25 30 35 40 екв.), потім ACN (1 кг), і нагрівали суміш до 67-73 С. Гарячу суміш переносили в реактор через фільтр тонкого очищення, а потім доводили до 54-60 С. Вносили запальні кристали (5 г) геміфумаратної форми тенофовір алафенаміду (наприклад, у суміш можуть бути введені запали тенофовір алафенаміду геміфумарату, отриманого в Прикладі 1 або при наступному приготуванні), і отриману суміш перемішували при 54-60 С протягом приблизно 30 хвилин. Суміш прохолоджували протягом не менше 4 годин до 0-6 С, а потім перемішували при 0-6 С протягом не менше 1 години. Отриману суспензію відфільтровували і промивали холодним (0-6 С) ACN (2 кг). Продукт висушували під вакуумом при температурі нижче 45 С до відповідності вимогам меж втрат при висушуванні (ВПВ) і органічних летучих домішок (ОЛД) (ВПВ ≤ 1,0%, вміст дихлорметану ≤ 0,19%, вміст ацетонітрилу ≤ 0,19%) з одержанням кінцевої сполуки, геміфумаратної форми тенофовір алафенаміду у вигляді порошку від білого до бруднувато1 білого кольору (стандартний вихід приблизно 0,95 кг). H ЯМР (400 МГц, d6 ДМСО): 1,06 (д, J = 5,6 Гц, 3Н), 1,12-1,16 (м, 9Н), 3,77 (дд, J = 10,4, 11,6 Гц, 1Н), 3,84-3,90 (м, 2Н), 3,94 (м, 1Н), 4,14 (дд, J = 6,8, 14,8 Гц, 1Н), 4,27 (м, 1Н), 4,85 (гептет, J = 6,0 Гц, 1Н), 5,65 (т, J = 11,2 Гц, 1Н), 6,63 (с, 1Н), 7,05 (д, J = 7,6 Гц, 2Н), 7,13 (т, J = 7,2 Гц, 1Н), 7,24 (с, 2Н), 7,29 (т, J = 7,6 Гц, 2Н), 8,13 (т, 31 J = 13,6 Гц, 2Н), P ЯМР (162 МГц, d6 ДМСО): 23,3. Приклад 3: Одержання тенофовір алафенаміду геміфумарату [0062] У реактор з сорочкою, обладнаний верхньою мішалкою, завантажували 9-[(R)-2-[[(S)[[(S)-1-(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденін (10 г), фумарову кислоту (1,22 г) і ACN (100 мл). Суміш нагріли до 70-75 с для розчинення твердих речовин. Усі нерозчинені частинки видаляли фільтрацією через патронний фільтр. Відфільтрований розчин прохолоджували до 60-65 С і внесли запал 1% (за вагою) тенофовір алафенаміду геміфумарату. Суспензію залишали визрівати протягом 30 хвилин і прохолоджували до 0-5 С протягом 2 годин. Температуру підтримували протягом 1-19 годин, а отриману суспензію відфільтровували і промили 2 мл холодного ACN (0-5 С). Тверді речовини висушували під вакуумом при 50 С для одержання геміфумаратної форми тенофовір алафенаміду, який аналізували так, як описано нижче. Аналіз тенофовір алафенаміду геміфумарату з Прикладу 3 [0063] Тенофовір алафенаміду геміфумарат з Прикладу 3 складається з 9-[(R)-2-[[(S)-[[(S)-1(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденіну і половини еквіваленту фумарової кислоти. Тенофовір алафенаміду геміфумарат є безводним, негігроскопічним і має температуру початку ендотермічного ефекту на кривій ДСК, рівну приблизно 131 С. Рентгенівська порошкова дифракція [0064] РПД картину тенофовір алафенаміду геміфумарату записали при наступних експериментальних налаштуваннях: 45 кВ, 45 мМ, Кα1 = 1,5406 Å, діапазон сканування 2. - 40, величина кроку 0,0084, час рахунку: 8,25 с. РПД дифрактограма тенофовір алафенаміду геміфумарату представлена на Фіг. 1. Характеристичні піки включають: 6,9±0,2, 8,6±0,2, 10,0±0,2, 11,0±0,2, 12,2±0,2, 15,9±0,2, 16,3±0,2, 20,2±0,2 і 20,8±0,2. Рентгенівська дифракція монокристала 3 [0065] Розмір кристала склав 0,32 х 0,30 х 0,20 мм . Зразок тримали при 123 К, а дані одержували за допомогою джерела випромінювання з довжиною хвилі 0,71073 Å у тетадіапазоні 1,59-25,39. Умови і дані, отримані з рентгенівської дифракції монокристала, представлено в Таблиці 1. 45 7 UA 115311 C2 Таблиця 1 Рентгенівська дифракція монокристалу Емпірична формула Маса згідно з формулою Температура Розмір кристала Тета-діапазон для збору даних Довжина хвилі Кристалічна система Просторова група C23H31N6O7P 534,50 123(2) К 3 0,32 х 0,30 х 0,20 мм 1,59-25,39 0,71073 Å Тетрагональна Р4(2)2(1)2 а = 18,1185(12) Å = 90 b = 18,1185(12) Å = 90 с = 17,5747(11) Å = 90 3 5769,4(6) Å 8 3 1,231 г/см Розміри елементарної комірки Об'єм Z Щільність (розрахункова) 5 10 15 20 25 ДСК-аналіз [0066] ДСК-аналіз виконували з використанням 2,517 мг тенофовір алафенаміду геміфумарату. Його нагрівали зі швидкістю 10 С/хв. у діапазоні 40-200 С. Визначили, що температура початку ендотермічного ефекту на кривій ДСК склала приблизно 131 С (Фіг. 2). Дані для ТГА [0067] Дані ТГА одержували з використанням 4,161 мг тенофовір алафенаміду геміфумарату. Його нагрівали зі швидкістю 10 С/хв. у діапазоні 25-200 С. До температури плавлення втрата маси зразка склала 0,3% (Фіг. 3). Визначили, що речовина являє собою безводну форму. ДСП-аналіз [0068] ДСП-аналіз виконали з використанням 4,951 мг тенофовір алафенаміду геміфумарату. Матеріал витримували при 25 С в азоті з вологістю в діапазоні від 10% до 90% відносної вологості; кожну стадію врівноважували протягом 120 хвилин. Ізотерма сорбції представлена на Фіг. 4. Було виявлено, що матеріал є негігроскопічним і абсорбує 0,65% води при відносній вологості 90%. Усунення диастереомерної домішки [0069] У попередньому синтезу тенофовір алафенаміду, одна з основних домішок, як правило, являє собою диастереомер 9-[(R)-2-[[(R)-[[(S)-1(ізопропоксикарбоніл)етил]аміно]феноксифосфініл]метокси]пропіл]аденін. Геміфумаратна форма тенофовір алафенаміду з Прикладу 3 має виняткову здатність усувати цю диастереомерну домішку, у порівнянні зі здатністю монофумаратної форми (описаною в патенті США № 7390791). Дані в Таблиці 2 (нижче) демонструють, що тенофовір алафенаміду геміфумарат (партія 2) очищений від диастереомерної домішки до менше однієї десятої від вихідної концентрації, тоді як монофумаратна форма тенофовір алафенаміду (партія 1) лише незначно очищена від диастереомерної домішки. Таблиця 2 Порівняння здатності до очищення Партія Диастереомерна домішка у вихідному матеріалі Розчинник Завантаження фумарової кислоти (мольні еквіваленти) 1 9,3% ACN 0,9 2 10,0% ACN 0,5 8 Отриманий продукт Монофумаратна форма Геміфумаратна форма Диастереомерна домішка в продукті 7,6% 0,65% UA 115311 C2 5 Хімічна стабільність [0070] Хімічну стабільність геміфумаратної форми тенофовір алафенаміду порівнювали з монофумаратною формою. Як показано в Таблиці 3 (нижче), при однакових умовах геміфумаратна форма тенофовір алафенаміду була хімічно більш стабільною і демонструвала більш високу стабільність при тривалому зберіганні, з суттєво меншим розкладанням (загальний % продуктів розкладання), ніж монофумаратна форма. Умови, що аналізуються, включають температуру, відносну вологість (ВВ) і відкритий або закритий стан кришки контейнера. Таблиця 3 Порівняння хімічної стабільності Умови зберігання 40С / 75% ВВ Закрита кришка 40С / 75% ВВ Відкрита кришка 70С Закрита кришка Тимчасові точки (тижні) 0 1 2 4 8 0 1 2 4 8 0 2 4 Монофумаратна форма Загальний % % нормованої продуктів площі ТА* розкладання 97,1 0,69 97,0 0,87 96,6 1,18 96,4 1,49 95,4 2,36 97,1 0,69 96,9 0,90 96,6 1,10 96,2 1,69 95,0 2,74 97,1 0,69 96,2 1,83 93,3 4,78 Геміфумаратна форма Загальний % % нормованої продуктів площі ТА* розкладання 98,4 0,05 98,4 0,14 98,5 0,14 98,4 0,25 98,0 0,49 98,4 0,05 98,5 0,15 98,5 0,14 98,4 0,26 98,1 0,50 98,4 0,05 98,5 0,22 98,4 0,33 10 *ТА являє собою тенофовір алафенамід 15 20 25 30 Термодинамічна стабільність [0071] Дослідження стабільної форми тенофовір алафенаміду геміфумарату показало, що він є термодинамічно стабільним у більшості розчинників, таких як ACN, толуол, етилацетат, метилтретбутиловий ефір (МТБЕ), ацетон, ТГФ і 2-метил ТГФ. Таке ж дослідження стабільної форми монофумаратної форми показало, що ця форма не є термодинамічно стабільною в перерахованих вище розчинниках. При суспендуванні в цих розчинниках, монофумаратна форма тенофовір алафенаміду повністю перетворюється в геміфумаратну форму в ТГФ і 2метил ТГФ і частково перетворюється в геміфумаратну форму в ACN, етилацетаті, МТБЕ і ацетоні, а також при кімнатних температурах. Термічна стабільність [0072] Як продемонстровано за допомогою даних ДСК, геміфумаратна форма тенофовір алафенаміду має температуру плавлення, яка приблизно на 10 С вище, ніж температура плавлення монофумаратної форми, що вказує на те, що геміфумаратна форма має поліпшену термічну стабільність у порівнянні з монофумаратною формою. [0073] Усі публікації, патенти і патентні документи включені в даний документ за допомогою посилання, як якби кожний з них був включений шляхом посилання індивідуально. Даний винахід був описаний з посиланням на різні конкретні і кращі варіанти реалізації та приймання. Однак слід розуміти, що в рамках суті і обсягу цього винаходу можливі численні варіації та модифікації. ФОРМУЛА ВИНАХОДУ 35 1. Геміфумарат тенофовіру алафенаміду. 2. Геміфумарат за п. 1, який має температуру початку ендотермічного ефекту на кривій диференціальної скануючої калориметрії (ДСК), рівну 131±2 °C. 9 UA 115311 C2 5 10 15 20 25 30 35 40 45 50 55 3. Геміфумарат за п. 2, який має температуру початку ендотермічного ефекту на кривій ДСК, рівну 131±1 °C. 4. Геміфумарат тенофовіру алафенаміду, дифрактограма рентгенівської порошкової дифракції (РПД) якого містить піки при значеннях 2-тета 6,9±0,2° і 8,6±0,2°. 5. Геміфумарат за п. 4, який відрізняється тим, що дифрактограма РПД містить піки при значеннях 2-тета 6,9±0,2°, 8,6±0,2°, 11,0±0,2°, 15,9±0,2° і 20,2±0,2°. 6. Композиція, що містить геміфумарат тенофовіру алафенаміду, у якому відношення фумарової кислоти до тенофовіруалафенаміду у зазначеній композиції становить 0,5±0,1. 7. Композиція за п. 6, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,05. 8. Композиція за п. 6, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,01. 9. Композиція за п. 6, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить приблизно 0,5. 10. Композиція за будь-яким з пп. 6-9, яка являє собою тверду речовину. 11. Фармацевтична композиція, що містить геміфумарат за будь-яким з пп. 1-5 або композицію за будь-яким з пп. 6-10 та фармацевтично прийнятну допоміжну речовину. 12. Фармацевтична композиція за п. 11, що додатково містить додатковий терапевтичний агент. 13. Фармацевтична композиція за п. 12, у якій додатковий терапевтичний агент вибраний із групи, що складається зі сполук, які інгібують протеазу вірусу імунодефіциту людини (ВІЛ), ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5. 14. Спосіб лікування інфекції вірусу імунодефіциту людини (ВІЛ), що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10, або фармацевтичної композиції за будь-яким з пп. 11-13. 15. Спосіб лікування ВІЛ-інфекції за п. 14, який додатково включає введення суб'єкту одного або більше додаткових терапевтичних агентів, вибраних із групи, що складається зі сполук, які інгібують протеазу вірусу імунодефіциту людини (ВІЛ), ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5. 16. Спосіб лікування ВІЛ-інфекції за п. 14, у якому геміфумарат або композицію, або фармацевтичну композицію вводять у вигляді багаторазових денних доз. 17. Спосіб лікування ВІЛ-інфекції за п. 14, у якому геміфумарат або композицію, або фармацевтичну композицію вводять у вигляді однократної денної дози. 18. Спосіб лікування інфекції вірусу гепатиту В (ВГВ), що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10, або фармацевтичної композиції за будь-яким з пп. 11-13. 19. Спосіб лікування інфекції ВГВ за п. 18, у якому геміфумарат або композицію, або фармацевтичну композицію вводять у вигляді багаторазових денних доз. 20. Спосіб лікування інфекції ВГВ за п. 18, у якому геміфумарат або композицію, або фармацевтичну композицію вводять у вигляді однократної денної дози. 21. Геміфумарат за будь-яким з пп. 1-5 або композиція за будь-яким з пп. 6-10 для застосування в медичній терапії. 22. Геміфумарат за будь-яким з пп. 1-5 або композиція за будь-яким з пп. 6-10 для застосування у лікуванні ВІЛ-інфекції. 23. Геміфумарат за будь-яким з пп. 1-5 або композиція за будь-яким з пп. 6-10 для застосування у лікуванні інфекції ВГВ. 24. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для профілактичного або терапевтичного лікування ВІЛ-інфекції. 25. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для лікування ВІЛ-інфекції. 26. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для одержання або виготовлення лікарського засобу для лікування ВІЛ-інфекції. 27. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для профілактичного або терапевтичного лікування інфекції ВГВ. 28. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для лікування інфекції ВГВ. 10 UA 115311 C2 5 10 15 20 25 30 35 40 45 50 55 29. Застосування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 для одержання або виготовлення лікарського засобу для лікування інфекції ВГВ у людини. 30. Композиція, що складається по суті з геміфумарату тенофовіру алафенаміду. 31. Композиція за п. 30, яка має температуру початку ендотермічного ефекту на кривій ДСК, рівну 131±2 °C. 32. Композиція за п. 31, яка має температуру початку ендотермічного ефекту на кривій ДСК, рівну 131±1 °C. 33. Композиція, що складається по суті з геміфумарату тенофовіру алафенаміду, причому відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,1. 34. Композиція за п. 33, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,05. 35. Композиція за п. 33, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить 0,5±0,01. 36. Композиція за п. 33, яка відрізняється тим, що відношення фумарової кислоти до тенофовіру алафенаміду становить приблизно 0,5. 37. Композиція за будь-яким з пп. 30-36, яка являє собою тверду речовину. 38. Композиція, що складається по суті з геміфумарату тенофовіру алафенаміду, дифрактограма РПД якого містить піки при значеннях 2-тета 6,9±0,2° і 8,6±0,2°. 39. Композиція за п. 38, яка відрізняється тим, що дифрактограма РПД містить піки при значеннях 2-тета 6,9±0,2°, 8,6±0,2°, 11,0±0,2°, 15,9±0,2° і 20,2±0,2°. 40. Фармацевтична композиція, що містить композицію за будь-яким з пп. 30-39 і фармацевтично прийнятну допоміжну речовину. 41. Фармацевтична композиція за п. 40, що додатково містить додатковий терапевтичний агент. 42. Фармацевтична композиція за п. 41, у якій додатковий терапевтичний агент вибраний із групи, що складається зі сполук, які інгібують протеазу ВІЛ, ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5. 43. Спосіб лікування ВІЛ-інфекції, що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості композиції за будь-яким з пп. 30-39 або фармацевтичної композиції за будь-яким з пп. 40-42. 44. Спосіб лікування ВІЛ-інфекції за п. 43, який додатково включає введення суб'єктові одного або більше додаткових терапевтичних агентів, вибраних із групи, що складається зі сполук, які інгібують протеазу ВІЛ, ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5. 45. Спосіб лікування ВІЛ-інфекції за п. 43, у якому композицію або фармацевтичну композицію вводять у вигляді багаторазових денних доз. 46. Спосіб лікування ВІЛ-інфекції за п. 43, у якому композицію або фармацевтичну композицію вводять у вигляді однократної денної дози. 47. Спосіб лікування інфекції ВГВ, що включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості композиції за будь-яким з пп. 30-39 або фармацевтичної композиції за будь-яким з пп. 40-42. 48. Спосіб лікування інфекції ВГВ за п. 47, у якому композицію або фармацевтичну композицію вводять у вигляді багаторазових денних доз. 49. Спосіб лікування інфекції ВГВ за п. 47, у якому композицію або фармацевтичну композицію вводять у вигляді однократної денної дози. 50. Композиція за будь-яким з пп. 30-39 для застосування в медичній терапії. 51. Композиція за будь-яким з пп. 30-39 для застосування для лікування ВІЛ-інфекції. 52. Композиція за будь-яким з пп. 30-39 для застосування для лікування інфекції ВГВ. 53. Застосування композиції за будь-яким з пп. 30-39 для профілактичного або терапевтичного лікування ВІЛ-інфекції. 54. Застосування композиції за будь-яким з пп. 30-39 для лікування ВІЛ-інфекції. 55. Застосування композиції за будь-яким з пп. 30-39 для одержання або виготовлення лікарського засобу для лікування ВІЛ-інфекції. 56. Застосування композиції за будь-яким з пп. 30-39 для профілактичного або терапевтичного лікування інфекції ВГВ. 57. Застосування композиції за будь-яким з пп. 30-39 для лікування інфекції ВГВ. 58. Застосування композиції за будь-яким з пп. 30-39 для одержання або виготовлення лікарського засобу для лікування інфекції ВГВ у людини. 11 UA 115311 C2 5 10 15 20 25 30 35 59. Спосіб одержання фармацевтичної композиції, що включає комбінування геміфумарату за будь-яким з пп. 1-5 або композиції за будь-яким з пп. 6-10 і фармацевтично прийнятної допоміжної речовини із забезпеченням фармацевтичної композиції. 60. Спосіб за п. 59, який також включає додавання додаткового терапевтичного агента. 61. Спосіб за п. 60, у якому додатковий терапевтичний агент вибирають з групи, яка складається зі сполук, які інгібують протеазу вірусу імунодефіциту людини (ВІЛ), ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5. 62. Спосіб одержання фармацевтичної композиції, що включає комбінування композиції за будь-яким з пп. 30-39 і фармацевтично прийнятної допоміжної речовини для забезпечення фармацевтичної композиції. 63. Спосіб за п. 62, який також включає додавання додаткового терапевтичного агента. 64. Спосіб за п. 63, у якому додатковий терапевтичний агент вибирають з групи, яка складається зі сполук, які інгібують протеазу вірусу імунодефіциту людини (ВІЛ), ненуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ, інгібіторів інтегрази ВІЛ та інгібіторів CCR5. 65. Спосіб одержання геміфумарату тенофовіру алафенаміду, згідно з яким розчин, що містить: а) прийнятний розчинник; b) фумарову кислоту; с) тенофовіру алафенамід; і d) одну або більше затравок геміфумарату тенофовіру алафенаміду, піддають дії умов, які забезпечують кристалізацію фумарової кислоти і тенофовіру алафенаміду. 66. Спосіб за п. 65, у якому розчинник містить ацетонітрил. 67. Спосіб за п. 65, у якому розчин піддають кристалізації при температурі в діапазоні від приблизно 0 °C до приблизно 75 °C. 68. Спосіб одержання геміфумарату тенофовіру алафенаміду, який включає стадії: змішування: а) апротонного органічного розчинника; b) фумарової кислоти; с) тенофовіру алафенаміду і d) однієї або більше затравки геміфумарату тенофовіру алафенаміду; та кристалізації додаткового геміфумарату тенофовіру алафенаміду. 69. Спосіб одержання геміфумарату тенофовіру алафенаміду, який включає стадії: змішування: а) розчинника, вибраного з групи, що містить воду, ізопропіловий спирт, ацетон, ацетонітрил, толуол, етилацетат, ізопропілацетат, гептан, тетрагідрофуран, 2-метилтетрагідрофуран, метилетил-кетон, метил-ізобутил-кетон, метиленхлорид або їх суміші; b) фумарової кислоти; с) тенофовіру алафенаміду і d) однієї або більше затравок геміфумарату тенофовіру алафенаміду; та кристалізації додаткового геміфумарату тенофовіру алафенаміду при температурі від приблизно 0 °C до приблизно 70 °C. 70. Спосіб за п. 69, у якому розчинник включає ацетонітрил та до приблизно 50 % за об'ємом метиленхлориду. 12 UA 115311 C2 13 UA 115311 C2 Комп’ютерна верстка А. Крулевський Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюTenofovir alafenamide hemifumarate
Автори англійськоюLiu, Dazhan, Shi, Bing, Wang, Fang, Yu, Richard, Hung Chiu
Автори російськоюЛиу Дажан, Ши Бинг, Ванг Фанг, Йу Ричард Хунг Чиу
МПК / Мітки
МПК: C07D 473/34, A61K 31/52
Мітки: алафенаміду, тенофовіру, геміфумарат
Код посилання
<a href="https://ua.patents.su/16-115311-gemifumarat-tenofoviru-alafenamidu.html" target="_blank" rel="follow" title="База патентів України">Геміфумарат тенофовіру алафенаміду</a>