Спіроциклічні сполуки на основі похідних 2-оксіндолу, які містять ядро спіро[індоло-3,1′-піроло[3,4-c]піролу] та залишки біогенних сірковмісних амінокислот, спосіб їх одержання та фармацевтичні композиції на їх основі
Формула / Реферат
1. Спіроциклічна сполука 5'-(4-метилфеніл)-3'-[2-(метилтіо)етил]-3а',6а'-дигідро-2'Н-спіро[індоло-3,1'-піроло[3,4-с]пірол]-2,4',6'(1Н,3'Н,5'Н)тріон, що має структурну формулу:
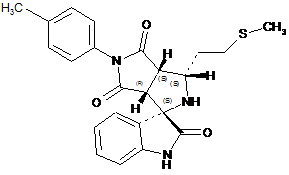 .
.
2. Спіроциклічна сполука за п. 1, де вказана сполука проявляє глюкокортикоїдомоделюючу активність.
3. Спіроциклічна сполука за будь-яким з пп. 1, 2, де вказана сполука проявляє антиоксидантну, антигіпоксантну, церебропротекторну або цитопротекторну дію.
4. Застосування сполуки за будь-яким з пп. 1-3 для лікування захворювань, асоційованих з підвищеним продукуванням кортизолу.
5. Застосування за п. 4, де вказане захворювання є вибраним з групи, що складається з інсульту, черепно-мозкової травми, хронічної цереброваскулярної патології, хвороби Альцгеймера, енцефалопатії, цукрового діабету, ретинодегенеративних захворювань ока, метаболічного синдрому, ожиріння, синдрому Кушинга, метаболічного синдрому Рівена, стійкості до інсуліну; гіперглікемії; гіпертензії; гіперліпідемії; когнітивних порушень; депресії; деменції; глаукоми; серцево-судинних захворювань; остеопорозу; запалення; надлишку чоловічих статевих гормонів або синдрому полікістозних яєчників (PCOS).
6. Фармацевтична композиція, що як активний агент містить сполуку за п. 1 та фармацевтично прийнятний носій.
7. Фармацевтична композиція за п. 6, де вказана композиція виконана у формі, вибраній з групи, що включає таблетки, пілюлі, порошки, пастилки, саше, суспензії, емульсії, розчини для перорального застосування, сиропи, аерозолі, дисперсії, мазі, краплі, м'які або тверді желатинові капсули, супозиторії, розчини для ін'єкцій або інфузій.
8. Фармацевтична композиція за п. 6 або 7, де вказана композиція призначена для лікування захворювання, вибраного з групи, що складається з інсульту, черепно-мозкової травми, хронічної цереброваскулярної патології, хвороби Альцгеймера, енцефалопатії, цукрового діабету, ретинодегенеративних захворювань ока, метаболічного синдрому, ожиріння, синдрому Кушинга, метаболічного синдрому Рівена, стійкості до інсуліну; гіперглікемії; гіпертензії; гіперліпідемії; когнітивних порушень; депресії; деменції; глаукоми; серцево-судинних захворювань; остеопорозу; запалення; надлишку чоловічих статевих гормонів або синдрому полікістозних яєчників (PCOS).
9. Фармацевтична композиція за п. 6 або 7, де разова доза сполуки за п. 1 складає від 0,25 до 50 мг на кг ваги тіла.
Текст
Реферат: Даний винахід стосується спіроциклічних сполук на основі похідних 2-оксіндолу, що містять ядро спіро[індоло-3,1'-піроло[3,4-с]-піролу] та залишки біогенних сірковмісних амінокислот, які проявляють глкокортикоїдмоделюючу активність шляхом дії на фермент 11-HSD1 конверсії кортизон→кортизол, і мають загальну формулу І: UA 115310 C2 (12) UA 115310 C2 O H R5 N O R2 (CH2)n N H S R4 R3 O N R1 ,I або їх фармацевтично прийнятних солей. Також винахід стосується фармацевтичних композицій на основі вказаних сполук та їх застосування для лікування захворювань, асоційованих з підвищеним продукуванням кортизолу. O H R N) 5 n C H (4 S R 2 N R O 3 H O R 2 N R 1 UA 115310 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується фармації, зокрема розробки нових фармакологічних засобів сполук на основі похідних 2-оксіндолу, що містять ядро спіро[індоло-3,1'-піроло[3,4-с]піролу] та залишки біогенних сірковмісних амінокислот, які проявляють глюкокортикоїдмодулюючу активність шляхом дії на фермент 11β-гідроксистероїддегідрогеназу (11β-HSD1), що відповідає за конверсію кортизон→кортизол, або шляхом пригнічення глюкокортикоїдних - (GRs), або глюкокортикостероїд-TNF-індукованих - (GITR), або мінералокортикоїдних рецепторів, або інших мішеней, але без втручання у стероїдний гемостаз у гіпоталамо-гіпофізарно-наднирковій системі (НРА) та композицій, що їх містять, і їх застосування для лікування захворювань, у патогенезі яких важливу роль відіграють глюкокортикоїдні гормони. Останнім часом увагу науковців привертає пошук селективних інгібіторів ферменту 11βHSD1, який відіграє ключову роль у периферичній конверсії неактивного кортизону у кортизол у людей (або 11-дегідро-кортикостерону у 11β-кортикостерон у гризунів та деяких інших вищих ссавців) у клітинах. Оскільки підвищена експресія цього ферменту є важливою ланкою патогенезу ряду хвороб (цукрового діабету, метаболічного синдрому (ожиріння, пацієнтів з синдромом Кушинга, метаболічного синдрому Рівена (також відомий як синдром X або синдром стійкості до інсуліну), порушеної толерантності до глюкози, підвищеного рівня тригліцеридів у плазмі, резистентності до інсуліну, артеріальної гіпертензії, хронічного субклінічного запалення, тромбозів, інсульту та деяких інших серцево-судинних захворювань), то зниження активності цього ферменту може бути використано для терапії цих захворювань [С. Fotsch and M. Wang, J. Med. Chem., 51, 4851-4857 (2008)]. Достовірно встановлено, що патогенетично 11β-HSD1 активується в жировій тканині у людей і гризунів з ожирінням (Livingstone et al. (2000) Endocrinology 131: 560-563; Rask et al. (2001) J. Clin. Endocrinol. Metab. 86: 1418-1421; Lindsay et al. (2003) J. Clin. Endocrinol. Metab. 88: 2738-2744; Wake et al. (2003) J. Clin. Endocrinol. Metab. 88: 3983-3988). Підвищена активність 11β-HSD1 у даних мишей (2-3-кратна) є дуже схожою на підвищену активність, що спостерігається при ожирінні у людини (Rask et al. (2001) J. Clin. Endocrinol. Metab. 86: 14181421). Це наводить на думку, що місцеве перетворення, опосередковане 11β-HSD1, неактивного глюкокортикоїду в активний глюкокортикоїд може впливати складним чином на чутливість до інсуліну всього тіла. Тому, блокада ферменту 11β-HSD1 могла б привести до підвищення інсулінової чутливості і толерантності та знизити глюкокортикоїдну ексайтотоксичність у мозку [Kato et al (2013) Front Integr Neurosci. 7:53]. Також відомо, що глюкокортикоїди інгібують секрецію інсуліну (контрінсулярна дія), що стимулюється глюкозою у панкреатичних бета-клітин [Billaudel and Sutter (1979) Horm. Metab. Res. 11: 555-560]. До того ж, як у щурів з синдромом Кушинга, та і у fa/fa щурів Цукера з діабетом, секреція інсуліну, що стимулюється глюкозою, помітно знижується [Ogawa et al. (1992) J. Clin. Invest. 90: 497-504]. Таким чином, передбачається, що пригнічення ферменту 11β-HSD1 буде справляти корисну дію на підшлункову залозу, включаючи посилення вивільнення інсуліну, що стимулюється глюкозою. У світлі експериментальних даних, що вказують на спорідненість патогенезу цукрового діабету 2-го типу та метаболічного синдрому (МС), а також роль 11β-HSD1 при цих патологічних станах [С. Day, Diabetes Vase. Dis. Res., 4, 32-38 (2007); R.H. Eckel, S.M. Grundy and P.Z. Zimmet, Lancet, 365, 1415-1428 (2005)], також пов'язаних з глюкокортикоїдами, зокрема, гіпертензії, ожирінні, стійкості до інсуліну, гіперглікемії, гіперліпідемії, надлишку чоловічих статевих гормонів (гірсутизм, порушення менструального циклу, гіперандрогенізм) і синдромі полікістозних яєчників (PCOS), терапевтичні агенти, направлені на інтенсифікацію або придушення даних метаболічних шляхів, модулюванням сигнальної трансдукції глюкокортикоїдів на рівні 11βHSD1, є бажаними. Фермент 11β-HSD1 експресується, головним чином, в органах і тканинах, що володіють високою чутливістю до глюкокортикоїдів, зокрема, у печінці, жировій тканині, легенях, ЦНС, ендотелії аорти [J.R. Seckl and В.R. Walker, Endocrinology, 142 (4), 1371-1376 (2001); М. Wamil and J.R. Seckl, Drug Discovery Today, 12 (13/14), 504-520 (2007)], в той час як 11β-HSD2 активується в органах-мішенях мінералокортикоїдів - у нирках, кишечнику, слинних залозах, плаценті, ендотелії судин [Р.М. Stewart and Z.S. Krozowski, Vitam. Horm., 57, 249-324 (1999)]. Крім того, у людини експресія 11β-HSD1 в адипоцитах корелює зі ступенем ожиріння і не залежить від генетичних факторів. Це було підтверджено дослідженням активності даного ферменту у монозиготних близнюків, один з яких страждав ожирінням, а інший мав нормальну статуру [К. Kannisto, К.Н. Pietilainen, and E. Ehrenborg et al., J. Clin. Endocrinol. Metab., 89, 44144421 (2004)]. У печінці при ожирінні функціонування 11β-HSD1 пригнічено, що призводить до зниження концентрації глюкокортикоїдів, зменшенню глюконеогенезу і адипогенезу. Ймовірно, це є захисним чинником, що запобігає приросту маси тіла і розвитку інтолерантності до глюкози 1 UA 115310 C2 5 10 15 20 25 30 35 40 45 50 55 60 [W. Artl and P.M. Stewart, Endocrinol. Metab. Clin. North. Am., 34, 293-313 (2005)]. Однак цей адаптаційний механізм ослаблення активності 11β-HSD1 у печінці і, як наслідок, зменшення продукції кортизолу, відсутній при ЦД 2 типу, котрий супроводжується ожирінням, а підвищення рівня глюкокортикоїдів може вносити свій внесок в патогенез захворювання. У цьому випадку адипоцити можуть розглядатися як первинна, а гепатоцити - як вторинна клітинна мішень для потенційних засобів впливу на інсулінорезистентність [P.M. Stewart, A. Boulton, and S. Kumar et al., J. Clin. Endocrinol Metab., 84, 1022-1027 (1999)]. При МС причиною локального надлишку кортизолу та інсулінорезистентності є підвищена активність 11β-HSD1 у жировій тканині. Також відомо про існування цілої низки рецепторів для кортикостероїдів, які розташовані в нейронах гіпокампа, гіпоталамуса та кори головного мозку (De Kloet et (1998) Endocr Rev. 19(3): 269-301). Кортикостероїди мають здатність проникати через гематоенцефалічний бар'єр та зв'язуватись у мозку з двома типами рецепторів - відповідно до глюко- та мінералокортикоїдів. Рецептори до мінералокортикоїдів реалізують свій вплив через підвищення клітинної збудливості, тоді як глюкокортикоїдні рецептори (GRs) мають гальмівний вплив на нейрональну активність, а опосередкований стероїдами контроль збудливості нейронів є необхідним для обробки інформації в мозку. Кортикостероїдні рецептори мають суттєвий вплив на функціонування гіпокампа та структур, що безпосередньо приймають участь у формуванні настрою, пам'яті та здійснення контролю за функціонуванням гіпоталамо-гіпофізарнонаднирникової системи (НРА). Важливість НРА вісі в контролюванні концентрації глюкокортикоїдів є очевидною з того факту, що порушення гомеостазу в НРА петлі при або надмірній або недостатній секреції або дії приводить в результаті до синдрому Кушинга або хвороби Адісона, відповідно (Miller and Chrousos (2001) Endocrinology and Metabolism, eds. Felig and Frohman (McGraw-Hill, New York), 4th Ed. 387-524). Крім того, хронічний вплив високого рівня глюкокортикостероїдів призводить до когнітивних порушень та є ознакою старіння, які пов'язуються з прогресуванням деменції (Wyrwoll et al (2011) Front Neuroendocrinol. 32(3): 265-286.). Як у старих тварин так і у людей похилого віку зниження загальних пізнавальних функцій пов'язують з тривалим впливом глюкокортикоїдів та рівнем експресії 11β-HSD1 (Alasdair M.J. MacLullich (2012), Neurobiology of Aging 33(1): 207-207). У людей похилого віку з хронічно високим рівнем кортизолу відмічається зменшення щільності нейронів гіпокампа та розвитком його атрофії (Bauer (2005) Stress. 8(1): 69-83). Підвищення з віком рівня глюкокортикоїдів супроводжується зниженням порогу збудження нейронів гіпокампа, що викликає порушення процесів консолідації пам'яті у старих щурів. Подібна ситуація має місце при нейродегенеративних захворюваннях (зокрема при хворобі Альцгеймера) і супроводжується зниженням когнітивно-мнестичних функцій (McCormick and Mathews (2010) Prog Neuropsychopharmacol Biol Psychiatry. 34(5): 756-65). Обробка первинних клітин гіпокампа карбенооксолоном, що є 11β-HSD1 інгібітором, захищає клітини від опосередкованого глюкокортикоїдами загострення нейротоксичності глутамату (Rajan et al. (1996) J. Neurosci. 16: 65-70). Додатково було встановлено, що генетичний дефіцит 11β-HSD1 у мишей захищає від пов'язаної з глюкокортикоїдами дисфункції гіпокампа, яка пов'язана зі старінням (Yau et al. (2001) Proc. Natl. Acad. Sci. 98: 4716-4721). Таким чином, вважають, що інгібування 11β-HSD1 ослабить вплив глюкокортикоїдів в мозку і захистить його тканини від шкідливої дії глюкокортикоїдів на нейронну функцію, включаючи когнітивні порушення, деменцію, і/або депресію. Так, при експериментальному цукровому діабеті та гострому порушенні мозкового кровотоку, призначення метирапону (нестероїдного блокатора стероїдної 11β-гідроксилази), у зоні СА1 гіпокампа та сомато-сенсорній корі головного мозку щурів відмічається зниження щільності деструктивно-змінених нейронів поряд із збереженням площі та щільності морфологічно неушкоджених нейроцитів, захищає від ішемії та ексайтотоксичності індукованих пошкодженням мозку у гризунів [Drouet (2012) Eur J Pharmacol. 5, 682(1-3): 92-8]. Підвищений рівень кортикостерону у мозку щурів при гіпобарічній гіпоксії викликає нейродегенеративні зміни і пов'язується із впливом на центральні GRs, тоді як інгібування GRs може забезпечити терапевтичний ефект у поліпшенні індукованого погіршення пам'яті на тлі гіпобарічної гіпоксії [Baitharu et al (2013) Behav Brain Res. 240:76-86]. Введення метирапону з 3 по 7-й день на тлі гіпобаричної гіпоксії у щурів, дозволяє усунути індуковане гіпоксією збільшення рівня кортикостерону, та призводить до зниження перекісного окиснення, нейродегенерації і поліпшення стану внутрішньоклітинного енергетичного обміну. Крім того, введення екзогенного кортикостерону поряд з метирапоном при гіпоксії знижує нейрозахисну дію метирапону, що вказує на роль кортикостерону в посередництві індукованих гіпобаричною гіпоксієї нейродегенерації та погіршення пам'яті [Schaaf et al (2000) Stress. 3(3): 201-208. Review; Baitharu et al (2012) Behav Brain Res. 228(1): 53-65]. Застосування метирапону або антагоністів 2 UA 115310 C2 5 10 15 20 25 30 35 40 45 50 55 60 глюкокортикоїдними рецепторів (GRA) і антагоністів рецепторів прогестерону (PRA) - RU38486 (mifepristone) чи непептидного антагоніста глюкокортикоїдних рецепторів 1 типу (CRH-R1) R121919 хоча і підтвердило перспективність корекції рівня глюкокортикостероїдів з метою нейропротекції, однак у клініці їх використання не доцільне, оскільки вони порушують гомеостаз в НРА [Belda et al (2012) Horm Behav. 62(4): 515-524; Bluthgen et (2013) Aquat Toxicol. 144-145C: 96-104]. Першим і найбільш вивченим екзогенним неселективним інгібітором 11β-HSD рослинного походження є тритерпеноїди (сапогенін) - гліциретова кислота та її диглюкуронід гліциризинова кислота, яка міститься у коренях з кореневищами солодки голої Glycyrrhiza glabra L. і уральської G. uralensis F [Г.А. Толстиков, Л.А. Балтина, Н.Г. Сердюк, Хим. фарм. журн., 8, 514 (1998)]. Гемісукцинат гліциретової кислоти (карбеноксолон), відомий з середини 50-х pp. минулого століття як противиразковий засіб, також демонструє в експерименті на опасистих мишах ефективне зниження рівня інсуліну і ліпідів у плазмі [А.М. Nuotio-Antar, D.L. Hachey, and A.H. Hasty, Am. J. Physiol.: Endocrinol. Metab., 293, E1517-E1528 (2007).]. У здорових добровольців і пацієнтів з ЦД 2 типу застосування карбеноксолону підвищує чутливість печінки до інсуліну, а також спричиняє нейропротекторну дію на моделі ішемічного інсульту внаслідок зниження рівня продукції глюкокортикоїдів у тканинах мозку [Beraki et al (2013) PLoS ONE 8(7): е69233]. В двох плацебо контрольованих перехресних дослідженнях введення карбеноксолону посилювало швидкість мовлення і вербальну пам'ять (Sandeep et al. (2004) Proc. Natl. Acad. Sci. Early Edition: 1-6). Однак препарат не отримав клінічного застосування як антидіабетичний засіб через здатність поряд з інгібуванням 11β-HSD1 знижувати активність ще й 11β-HSD, що призводить до ренального надлишку мінералокортикоїдів і, як наслідок, до реабсорбції іонів натрію, до гіпокаліємії і гіпертензії. Крім того, карбеноксолон характеризується низькою ліпофільністю, адже він погано проникає у жирову тканину - місце основної експресії 11β-HSD1 [K.A. Hughes, S.P. Webster and В.R. Walker, Expert Opin. Investig. Drugs, 17 (4), 481-496 (2008).]. Нещодавно була показана патогенетична доцільність блокування тканинної активності глюкокортикостероїдів введенням експериментальних сполук GRA-CORT 108297 або LLY-2707 [Belanoff et al (2011) Eur J Pharmacol. 655(1-3): 117-120; Belanoff et al (2012) Diabetes Obes Metab. 12(6): 545-7; Sindelar et al (2013) J Pharmacol Exp Ther. 25: 1-25] для лікування метаболічного синдрому подібного до цукрового діабету та збільшення ваги, індукованих при застосуванні атипових антипсихотиків (AAPDs), наприклад, olanzapine. Аналогічну позитивну дію відносно зменшення ваги щурів спостерігали й при застосуванні RU38486 (mifepristone) на тлі порушень НРА гомеостазу глюкокортикостероїдів, викликаних olanzapine (Beebe et al (2006) Behav Brain Res. 171(2): 225-229). Про інгібітори 11β-HSD1 нестероїдної структури на основі амідів іншої структури повідомляють у ЕР2540723А1, WO 2004/089470, WO 2004/089896, WO 2004/056745 і WO 2004/065351. Додатково про інгібітори 11β-HSD1, що є нестероїдними структурами, повідомляють в US 2005/0282858, US 2006/0009471, US 2005/0288338, US 2006/0009491, US 2006/0004049, US 2005/0288317, US 2005/0288329, US 10 2006/0122197, US 2006/0116382 і US 2006/0122210), INCY0035 (US 2007/0066584). Найбільш близькою за структурою до представлених у даному винаході сполук є аналоги на основі 2-оксіндоло-спіропіперидинамідів (US 20080306102 А1), однак, автори не вказують на їх церебропротекторні, цитопротекторні, антиоксидантні, антигіпоксантні, антидіабетичні властивості та рівень токсичності, до того ж сполуки, які містять фрагмент спіро[індолінон-3,4'-піперидину] можуть потенційно викликати небажані ефекти з боку нервової системи, зокрема, характерні для речовин зі спорідненою до них будовою природних алкалоїдів, які проявляють токсичні властивості стосовно нервової провідності, наприклад, сурогатоксин, просурогатоксин та неосурогатоксин з молюску (Babylonia japonica) справляють холіно- та адреноблокуючу дію [Ayajiki et al (1998) Jpn J Pharmacol. 78(2): 217-23], до того ж дуже близькі за хімічною структурою речовини були описані раніше як місцево анестезуючі засоби [Kornet MJ, Thio АР (1976) J. Med. Chem 19 (7): 892-898]. Перша фаза клінічних випробувань іншого нестероїдного інгібітора 11β-HSD1 - фторованого тіазолону (AMG-221) підтвердила його добру переносимість та пригнічуючу активність щодо 11β-HSD1 у пацієнтів з ожирінням. Друга фаза досліджень AMG-221 стартувала в 2007 p., проте два роки потому розробники як і раніше позиціонували його як речовину, що знаходиться на першій фазі клінічних випробувань [S.P. Webster and T.D. Pallin, Expert Opin. Ther. Patents, 17(12), 1407-1422 (2007)]. До того ж деякі із запропонованих інгібіторів 11β-HSD1 є недостатньо активними порівняно із запропонованими у даному патенті сполуками. Так, сполука нестероїдної природи BVT-2733 (3хлор-2-метил-N-(4-(2-(4-метилпіперазин-1-іл)-2-оксоетил)тіазол-2-іл)бензолсульфонамід гідрохлорид-специфічний інгібітор 11β-HSD1) при введенні на 3 та 7 години після реперфузії в 3 UA 115310 C2 5 10 15 20 25 30 дозах 60 мг/кг і 30 мг/кг зменшує об'єм ішемічного ураження мозку у щурів (Beraki et al (2013) PLoS ONE 8(7): e69233). Однак ця сполука потребує введення у 3-6 разів більших дозах, ніж сполуки представлені у даному винаході. До того ж не відомі його властивості щодо апоптозу. Ще одним перспективним напрямком застосування інгібіторів 11β-HSD1 є лікування глаукоми, адже продукція водянистої вологи ока здійснюється у непігментованих епітеліальних клітинах (NPE), і її стік здійснюється через клітини трабекулярної мережі. 11β-HSD1 локалізована в NPE клітинах (Stokes et al. (2000) Invest. Ophthalmol. Vis. Sci. 41: 1629-1683; Rauz et al. (2001) Invest. Ophthalmol. Vis. Sci. 42: 2037-2042) і її функція, ймовірно, стосується збільшення глюкокортикоїдної активності у цих клітинах. Це підтверджується тим, що концентрація вільного кортизолу значно перевищує концентрацію кортизону у водянистій волозі ока (14:1 співвідношення). Функціональне значення 11β-HSD1 в оці оцінене, застосовуючи інгібітор-карбенооксолон на здорових добровольцях (Rauz et al. (2001) Invest. Ophthalmol. Vis. Sci. 42: 2037-2042). Через сім днів після обробки карбенооксолоном внутрішньоочний тиск (IOР) знизився на 18 %. Таким чином, передбачають, що інгібування 11β-HSD1 у оці знизить місцеві концентрації глюкокортикоїдів та IOР, надаючи корисну дію в лікуванні глаукоми. Таким чином, існує постійна потреба в нових і поліпшених лікарських засобах, які мають глюкокортикостероїдмодулюючою активністю, у тому числі антидіабетичною, нейропротекторною дією при недиференційованій терапії інсульту (без остаточної верифікації його підтипу) у різні періоди гострого порушення мозкового кровообігу (ГПМК), у відновний період інсульту та черепно-мозкової травми, у пацієнтів з хронічною цереброваскулярною патологією (на тлі цукрового діабету), для комплексної терапії хвороби Альцгеймера та енцефалопатії різного походження (дисциркуляторна, алкогольна, інфекційно-токсична), для комплексної терапії цукрового діабету, ретинодегенеративних захворювань ока, у складі комплексного лікування метаболічного синдрому, ожиріння, пацієнтів з синдромом Кушинга, метаболічного синдрому Рівена (також відомого як синдром X або синдром стійкості до інсуліну) і інших захворювань. Як очікується, такі терапевтичні агенти знижуватимуть концентрацію гідрокортизолу шляхом дії на фермент конверсії кортизон→кортилол - 11β-HSD1, або пригнічення GRs-, або GITR, або інші мішені, але без втручання у стероїдний гемостаз. Винахідники поставили перед собою задачу створити сполуки та фармацевтичні композиції, які б допомогли задовольнити вказані потреби. Поставлена задача вирішується створенням спіроциклічних сполук на основі похідних 2оксіндолу, які містять ядро спіро[індоло-3,1'-піроло[3,4-с]-піролу] та залишки біогенних сірковмісних амінокислот, загальної формули І: O H R5 N O R2 (CH2)n N H 40 R4 R3 O N R1 35 S ,I де: R1 являє собою Н, Me-, Et-, Alyl-, -Bn; R2 являє собою Н, 5-Ме, 5-F, 5-Br, -5-OCF3, 5-NO2; R3 являє собою Н або -N=O; R4 являє собою залишки біогенних сірковмісних амінокислот, вибраних з метіоніну (n=2, R4=Me), етіоніну (n=2, R4=Et), цистеїну (n=1, R4=H) чи алкілпохідних цистеїну, де R4=Bn або CH2CO2Et, або Alyl-; R5 являєсобою Н, або залишки Аr, де Аr являє собою p-Tolyl, m-Tolyl, 2-(HO)Ph-, 3-(HO)Ph-, 4-Br-Ph-; 4-NO2-Ph-; 2-NO2-Ph-; 2-Br-Ph- або 4-(HOOC)Ph-, та їх фармацевтично прийнятні солі формули II: 4 UA 115310 C2 O R5 O R2 H N (CH2)n NH R 3 H S R4 An O N R1 5 10 15 20 25 30 35 40 45 II , де An є вибраним з групи, що складається з хлориду, броміду, йодиду, сукцинату, гемісукцинату, L-аспартату, тартрату або гідротартрату, нікотинату, L-аскорбату, малеату або гідромалеату, фумарату, гідрофумарату, цитратів, L-лактату, L-малату, фосфату, сульфату, бензоату, ацетату, піволату, глутарату, глутамату, аспарагінату. А також відповідні їм сольвати, гідрати, енантіомери тощо. Вказані сполуки проявляють глкокортикоїдмоделюючу активність шляхом дії на фермент 11β-HSD1 конверсії кортизон→кортизол, або пригнічення GRs-, або GITR-рецепторів або інші мішені, але без втручання у стероїдний гемостаз у НРА, а також проявляють антиоксидантну, антигіпоксантну, церебропротекторну та цитопротекторну дію. Згідно з одним з варіантів втілення винаходу пропонується застосовувати вищевказані сполуки для лікування захворювань, в патогенезі яких ключову роль відіграє підвищення продукції кортизолу. Зокрема, для лікування будь-якого одного з наступних захворювань або будь-якої комбінації двох або більше з наступних захворювань: для комплексної терапії цукрового діабету, у складі недиференційованої терапії інсульту (без остаточної верифікації його підтипу) у різні періоди ГПМК, у відновний період інсульту та черепно-мозкової травми, у пацієнтів хронічною цереброваскулярною патологією (у тому числі й на тлі цукрового діабету), для комплексної терапії хвороби Альцгеймера та енцефалопатії різного походження (дисциркуляторна, алкогольна, інфекційно-токсична), ретинодегенеративних захворювань ока, у складі комплексного лікування метаболічного синдрому (ожиріння, пацієнтів з синдромом Кушинга, метаболічного синдрому Рівена (також відомий як синдром X або синдром стійкості до інсуліну) і інших захворювань, стійкість до інсуліну; гіперглікемія; гіпертензія; гіперліпідемія; когнітивні порушення; депресія; деменція; глаукома; серцево-судинні захворювання; остеопороз; запалення; метаболічний синдром; надлишок чоловічих статевих гормонів або синдром полікістозних яєчників (PCOS). Згідно ще з одним варіантом втілення винаходу сполуки загальної формули І або II пропонується застосовувати для виробництва фармацевтичних композицій у комбінації з фармацевтично прийнятними допоміжними речовинами, які забезпечують їх застосування як готових лікарських засобів у вигляді відповідних лікарських форм, таких як таблетки, пілюлі, порошки, пастилки, саше, суспензії, емульсії, розчини для перорального застосування, сиропи, аерозолі (в твердому вигляді або в рідкому середовищі), мазі, краплі, м'які і тверді желатинові капсули, супозиторії, розчини для ін'єкцій, інфузій. Крім того, пропонується використання зазначених сполук для створення лікарських засобів в ефективній разової дозі від 0,25 до 50 мг/кг (кратність прийому в залежності від захворювання, але не більш ніж 200 мг/кг). Винахід також пропонує спосіб одержання сполук загальної формули І шляхом двостадійного синтезу на основі трикомпонентної енентіоселективної реакції конденсації, яка полягає у one-pot конденсації відповідних пірол-2,5-діонів з 1Н-індол-2,3-діонами та біогенними сірковмісними амінокислотами у середовищі полярних розчинників у суміші з водою. Придатними розчинниками зокрема є метиловий або ізопропіловий, або етиловий спирти або ацетонітрил, які використовують в суміші з водою у співвідношеннях від 2:1 до 10:1. Зокрема, найбільш прийнятним є спосіб одержання зазначених сполук, де найбільш переважним співвідношенням органічного розчинника та води є співвідношення 3:1. Згідно з іншим варіантом втілення винахід пропонує спосіб одержання солей загальної формули II, який полягає у розчиненні відповідної основи сполук формули І у етанолі, або суміші етанолу з водою, або бутанолі та додаванні водного або спиртового розчину відповідної 5 UA 115310 C2 5 10 15 20 25 30 35 40 45 органічної або неорганічної кислоти відповідно до формули II з наступним випарюванням у вакуумі. Крім того, даний винахід стосується композицій, що містять сполуки формули (І) або їх фармацевтично прийнятні солі формули II і щонайменше один фармацевтично прийнятний носій. Крім того, даний винахід, стосується способів нейропротекції, зокрема, шляхом впливу на гіпоксію, перекисне окиснення ліпідів та глюкокортикоїдну ексайтотоксичність, зниженням продукції гідрокортизолу у мозку та інших тканинах, у тому числі при дії на фермент конверсії кортизон→кортилол - 11β-HSD1, або пригніченням GRs-, або GITR-рецепторів, або блокуванням тканинної активності глюкокортикостероїдів опосередковано через інші мішені, але без порушення стероїдного гемостазу, сполук формули І або їх фармацевтично прийнятними солями II. Крім того, даний винахід стосується способів інгібування активності 11β-HSD1, що включає взаємодію 11β-HSD1 із сполукою формули І або їх фармацевтично прийнятними солями формули II. Крім того, даний винахід стосується способів інгібування перетворення кортизону в кортизол (чи 11-дегідрокортикостерону у 11β-кортикостерон у гризунів та деяких інших ссавців) у клітинах тканин людини та тварин, що включає взаємодію клітин із сполуками формули І або їх фармацевтично прийнятними солями формули II. Крім того, даний винахід стосується способів інгібування синтезу кортизолу в клітинах людини та тварин, що включають взаємодію клітин із сполуками формули І або їх фармацевтично прийнятними солями формули II. Крім того, даний винахід стосується способів лікування різних захворювань, включаючи будь-яке одне з наступних захворювань або будь-яку комбінацію двох або більше з наступних захворювань: у складі недиференційованої терапії інсульту (без остаточної верифікації його підтипу) у різні періоди ГПМК, у відновний період інсульту та черепно-мозкової травми, у пацієнтів хронічною цереброваскулярною патологією (у тому числі й на тлі цукрового діабету), для комплексної терапії хвороби Альцгеймера та енцефалопатії різного походження (дисциркуляторна, алкогольна, інфекційно-токсична), цукрового діабету, для комплексної терапії ретинодегенеративних захворювань ока, у складі комплексного лікування метаболічного синдрому (ожиріння, пацієнтів з синдромом Кушинга, метаболічного синдрому Рівена (також відомий як синдром X або синдром стійкості до інсуліну) і інших захворювань, стійкість до інсуліну; гіперглікемія; гіпертензія; гіперліпідемія; когнітивні порушення; депресія; деменція; глаукома; серцево-судинні захворювання; остеопороз; запалення; метаболічний синдром; надлишок чоловічих статевих гормонів або синдром полікістозних яєчників (PCOS), що включає введення пацієнту терапевтично ефективної кількості сполук формули І або їх фармацевтично прийнятних солей формули II. Крім того, даний винахід стосується сполуки формули І або їх фармацевтично прийнятних солей формули II для застосування в лікуванні тварин. Крім того, даний винахід стосується застосування сполук формули І або їх фармацевтично прийнятних солей формули II для одержання лікарського засобу для застосування для терапії зазначених вище хворобливих станів. Даний винахід пропонує нові фармакологічні засоби - спіроциклічні сполуки похідних 2оксіндолу, що містять ядро спіро[індоло-3,1'-піроло[3,4-с]-піролу] та залишки біогенних сірковмісних амінокислот (метіоніну, етіоніну, цистеїну та алкілпохідних цистеїну), які мають формулу І: O 5' R5 N 6' O R2 H 4' 3a' H (CH2)n 3' 6a' 2' 1' 3a 4 3 6 7 1 N 5 7a S R4 R3 O 2 N R1 або їх фармацевтично прийнятні солі формули II: 6 ,I UA 115310 C2 O R5 O R2 H N (CH2)n NH R 3 H S R4 An O N R1 5 10 15 20 25 30 35 40 45 II , де R1 являє собою Н, Me-, Et-, Alyl-, -Bn; R2 являє собою Н, 5-Ме, 5-F, 5-Br, -5-OCF3, 5-NO2; R3 являє собою Н або -N=O; R4 являє собою залишки біогенних сірковмісних амінокислот (метіоніну (n=2, R 4=Me), або етіоніну (n=2, R4=Et), або цистеїну (n=1, R4=H) чи алкілпохідних цистеїну, де R4=Bn або CH2CO2Et, або Alyl-); R5 являє собою Н або залишки Аr, де Аr являє собою p-Tolyl, m-Tolyl, 2-(HO)Ph-, 3-(HO)Ph-, 4-Br-Ph-; 4-NO2-Ph-; 2-NO2-Ph-; 2-Br-Ph-; 4-(HOOC)Ph-; причому An є вибраним з групи, що складається з хлориду, броміду, йодиду, сукцинату, гемісукцинату, L-аспартату, тартрату або гідротартрату, нікотинату, L-аскорбату, малеату або гідромалеату, фумарату, гідрофумарату, цитратів, L-лактату, L-малату, фосфату, сульфату, бензоату, ацетату, піволату, глутарату, глутамату, аспарагінату. Наведені приклади фармацевтично прийнятних солей включають, але не обмежуються наведеними, солі мінеральних або органічних кислот з основними залишками, такими як аміни; солі лужних металів або органічні солі кислотних залишків, таких як карбонові кислоти; і подібні. Фармацевтично прийнятні солі згідно з даним винаходом включають загальноприйняті нетоксичні солі вихідної сполуки, одержані, наприклад, з нетоксичних неорганічних або органічних кислот. Фармацевтично прийнятні солі, згідно з даним винаходом, можна синтезувати з вихідної сполуки, яка є основою, загальноприйнятими хімічними способами. Зазвичай дані солі можна одержати шляхом реакції форми вільної основи даних сполук із стехіометричною кількістю відповідної кислоти у воді або в органічному розчиннику, або в їх суміші; зазвичай неводне середовище етанолу, ізопропанолу або ацетонітрилу є переважним. Список відповідних солей можна знайти в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, p. 1418 і J. Pharm. Sci., 66, 2 (1977), кожен з яких включений в даний документ в повному обсязі шляхом посилання. Термін "фармацевтично прийнятний" застосовують в даному документі відносно тих сполук, матеріалів, композицій, і/або лікарських форм, які є безпечними та ефективними в межах ретельної медичної оцінки, придатними для застосування в контакті з тканинами людини і тварини без перевищуючої норму токсичності, подразнення, алергічної реакції або іншої проблеми або ускладнення з порівняним прийнятним співвідношенням ризик/очікувана користь. Всі сполуки та їх фармацевтично прийнятні солі можна одержати в різних твердих формах, включаючи сольватовані або гідратовані форми. У деяких варіантах винаходу тверда форма являє собою кристалічну форму. Зокрема, спосіб одержання полягає у екологічно прийнятній one-pot енантіоселективній конденсації відповідних пірол-2,5-діонів з 1Н-індол-2,3-діонами та біогенними сірковмісними амінокислотами у полярному середовищі, у тому числі, у середовищі метилового або ізопропілового, або етилового спиртів або ацетонітрилу у суміші з водою у співвідношеннях від 2:1 до 10:1. Найбільш прийнятним співвідношенням спирт:вода є співвідношення 3:1. Спосіб одержання солей сполук загальної формули І полягає у розчиненні відповідної основи цих сполук у етанолі, або суміші етанолу з водою, або бутанолі та додаванні водного або спиртового розчину відповідної органічної або неорганічної кислоти з наступним випаровуванням у вакуумі. 7 UA 115310 C2 5 10 15 20 25 30 35 40 45 50 55 Способи одержання, очищення і аналізу різних твердих форм є стандартними в даній галузі техніки і включають, наприклад, рентгенівську порошкову дифракцію, диференціальну скануючу колориметрію, термогравіметричний аналіз, динамічну сорбцію пари, FT-IR, способи комбінаційного розсіювання, ЯМР, титрування по Карлу-Фішеру і т.д. У деяких варіантах втілення винаходу сполуки згідно з даним винаходом і їх солі є практично повністю виділеними. Під "практично повністю виділеними" мають на увазі те, що сполука щонайменше частково або практично повністю відділена від оточення, в якому вона утворюється або виявлена. Часткове виділення може включати, наприклад, композицію, збагачену сполукою згідно з даним винаходом. Практично повне виділення може включати композицію, що містить щонайменше приблизно 50 %, щонайменше приблизно 60 %, щонайменше приблизно 70 %, щонайменше приблизно 80 %, щонайменше приблизно 90 %, щонайменше приблизно 95 %, щонайменше приблизно 97 % або щонайменше приблизно 99 % за вагою відповідної сполуки згідно з даним винаходом або її солі. Способи виділення сполуки і її солей є стандартними в даній галузі техніки. Сполуки, що пропонуються даним винаходом, вже у наномолярних концентраціях можуть спричиняти нейропротекторну дію, у тому числі, шляхом зниження концентрації гідрокортизолу у мозку, шляхом дії на фермент 11β-HSD1 конверсії кортизон→кортилол, або пригнічення GRs-, або GITR-рецепторів або інші мішені, але без втручання у стероїдний гемостаз у НРА. Сполуки, їх композиції, а також способи, описані в даному винаході, допомагають знизити концентрації гідрокортизону. Мається на увазі, що термін "зниження концентрації гідрокортизону (кортикостерону)" стосується здатності зменшувати активність відповідного фермента або рецептора. Крім того, даний винахід стосується способів інгібування перетворення кортизону в кортизол в клітині або інгібування синтезу кортизолу в клітині, де перетворення або синтез кортизолу опосередкований, щонайменше частково, 11β-HSD1 активністю. Крім того, даний винахід стосується способів інгібування перетворення кортизону в кортизол в клітині або інгібування синтезу кортизолу в клітині, де перетворення або синтез кортизолу опосередкований, щонайменше частково, 11β-HSD1 активністю. Способи вимірювання швидкості перетворення кортизону в кортизол і навпаки, також як способи вимірювання концентрацій кортизону і кортизолу в клітинах, є стандартними в даній галузі техніки. Крім того, даний винахід стосується способів підвищення чутливості до інсуліну клітин за рахунок зняття контрінсулярної дії глікокортикостероїдів при взаємодії клітин із сполуками, представленим у даному документі. Способи вимірювання чутливості до інсуліну є стандартними у даній галузі техніки. Крім того, даний винахід стосується способів лікування захворювання, пов'язаного з активністю або експресією, включаючи аномальну активність і підвищену експресію 11β-HSD1, в індивідуума введенням йому терапевтично ефективної кількості або дози відповідної сполуки згідно з даним винаходом або її фармацевтично прийнятної солі, або фармацевтичної композиції на їх основі. Приклади захворювань можуть включати будь-яке захворювання, розлад або стан, який безпосередньо або непрямо пов'язаний з експресією або активністю 11βHSD1. Захворювання, пов'язане з 11β-HSD1, може також включати будь-яке захворювання, розлад або стан, якого можна запобігти, полегшити або вилікувати модулюванням активності вказаного фермента. Сполуки заявленої формули І здатні виступати інгібіторами фермента 11β-HSD1. Заявлені сполуки І та II достовірно сприяють нормалізації титрів кортизолу при модельному ішемічному інсульті, що вказує на наявність у них позитивної модулюючої дії на формування стероїдної ексайтотоксичності. Введення сполук згідно з даним винаходом знижує тільки підвищений рівень кортизолу, а його титр не відрізняється від фізіологічного навіть при курсовій терапії, що доводить відсутність дії на гормональну вісь НРА. Приклади захворювань, пов'язаних з 11β-HSD1, включають ожиріння, діабет, непереносимість глюкози, стійкість до інсуліну, гіперглікемію, гіпертензію, гіперліпідемію, когнітивне порушення, деменцію, інсульт, депресію (наприклад, психотичну депресію), глаукому, серцево-судинні захворювання, остеопороз і запалення. Додаткові приклади захворювань, пов'язаних з 11β-HSD1, включають метаболічний синдром, діабет 2 типу, надлишок чоловічих статевих гормонів (гірсутизм, порушення менструального циклу, гіперандрогенізм) і синдром полікістозних яєчників (PCOS). Термін "клітина", який застосовують в даному документі, стосується клітини, яка існує in vitro, ex vivo або in vivo. У деяких варіантах втілення винаходу ex vivo клітина може бути частиною зразка тканини, отриманого з організму, такого як ссавець. У ще інших варіантах втілення винаходу in vitro клітина може бути клітиною в клітинній культурі. У деяких інших 8 UA 115310 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантах втілення винаходу in vivo клітина є клітиною, що знаходиться в організмі, такому як ссавець, і являє собою жирову клітину, панкреатичну клітину, гепатоцит, нейрон або клітину ока. Як застосовано у даному документі, термін "взаємодія" стосується зближення вказаних вище агентів - сполук, ферментів, клітин тощо в in vitro системі або in vivo системі. Наприклад, "взаємодія" ферменту 11β-HSD1 з сполукою згідно з даним винаходом включає введення вказаної сполуки індивідууму або пацієнту, такому як людина, що має 11β-HSD1, також як, наприклад, введення цієї сполуки в зразок, що містить клітинний або очищений препарат, або фермент 11β-HSD1. Як застосовано у даному документі, термін "індивідуум" або "пацієнт", що є взаємозамінними, стосується будь-якої тварини, включаючи ссавців, переважно мишей, щурів, інших гризунів, кроликів, собак, кішок, свиней, рогатої худобі, овець, коней або приматів, і найбільш переважно, людей. Як застосовано у даному документі, термін "лікувати" або "лікування" стосується одного або більше з: (1) запобігання захворюванню, наприклад, запобігання захворюванню, стану або розладу в індивідуума, який схильний до вказаних захворювання, стану або розладу, але ще не відчув або не виявив їх патологію або симптоматологію; (2) припинення захворювання; наприклад, припинення захворювання, стану або розладів в індивідуума, який відчув або виявляє патологію або симптоматологію вказаних захворювання, стану або розладів; і (3) полегшення захворювання; наприклад, полегшення захворювання, стану або розладів в індивідуума, який відчув або виявляє патологію або симптоматологію вказаних захворювання, стану або розладів (тобто реверсії патології і/або симптоматологію), такому як зниження тяжкості захворювання. При застосуванні як лікарські засоби сполуки, згідно з даним винаходом, можна вводити в формі фармацевтичних композицій, які є комбінацією сполуки згідно з даним винаходом і щонайменше одного фармацевтично прийнятного носія. Дані композиції можна одержати способом, добре відомим в галузі фармацевтики, і можна вводити різними способами, в залежності від бажаного лікування - місцевого чи системного та від захворювання, яке потребує лікування. Введення може бути місцевим (включаючи тканини ока, слизових оболонок, включаючи інтраназальну, вагінальну і ректальну доставку), легеневим (наприклад, інгаляцією або інсуфляцією порошків або аерозолів, включаючи аерозольний препарат; інтратекальним, інтраназальним, епідермальним і трансдермальним), пероральним або парентеральним. Способи введення в офтальмології можуть включати: місцеве введення (краплі для очей), підкон'юнктивальний, періокулярний ін'єкційний розчин або розчин для введення в скловидне тіло, або введення балонним катетером, або введення офтальмологічних плівок, уведених у кон'юнктивальний мішок. Парентеральне введення включає внутрішньовенну, внутрішньоартеріальну, підшкірну, внутрішньочеревинну або внутрішньом'язову ін'єкцію або інфузію; або внутрішньочерепне, наприклад, інтратекальне або інтравентрикулярне, введення. Парентеральне введення може бути у формі одиничної болюсної дози або може здійснюватися, наприклад, за допомогою безперервного перфузійного насосу. Фармацевтичні композиції і склади для місцевого введення можуть включати трансдермальні пластирі, мазі, лосьйони, креми, гелі, краплі, супозиторії, спреї, рідини і порошки. Загальноприйняті фармацевтичні носії, водні, порошкові або масляні основи, загусники і подібні їм допоміжні речовини можуть бути необхідні і бажані. Даний винахід також пропонує фармацевтичні композиції, які містять як активний інгредієнт одну або більше вищезгаданих сполук загальної формули І в комбінації з одним або більше фармацевтично прийнятними носіями. При одержанні композицій згідно з даним винаходом активний інгредієнт зазвичай змішують з допоміжною речовиною, розбавляють допоміжною речовиною або вміщують у відповідний носій в формі, наприклад, капсули, саше, паперової або іншої місткості. Коли допоміжна речовина є розріджувачем, то вона може бути твердою, напівтвердою або рідким матеріалом, який діє як розчинник, носій або середовище для активного інгредієнта. Таким чином, композиції можуть бути в формі таблеток, пілюль, порошків, пастилок, саше, крохмальних капсул, еліксирів, суспензій, емульсій, розчинів, сиропів, аерозолів (в твердому вигляді або в рідкому середовищі), мазей, що містять, наприклад, аж до 10 % за вагою активної сполуки, м'яких і твердих желатинових капсул, супозиторіїв, стерильних розчинів для ін'єкції і упакованих в стерильних умовах порошків. Сполуки згідно з даним винаходом можна подрібнювати, застосовуючи відомі способи подрібнення, такі як мокре подрібнення, для одержання розміру частинок, відповідних для одержання таблеток і інших типів складів. Дрібноподрібнені (наночастинки) препарати сполук 9 UA 115310 C2 5 10 15 20 25 30 35 40 45 50 55 60 згідно з даним винаходом можна одержати способами, відомими в даній галузі техніки, наприклад, див. міжнародну патентну заявку № WO 2002/000196. Деякі приклади відповідних допоміжних речовин включають лактозу, декстрозу, сукрозу, сорбіт, маніт, крохмаль, аравійська камедь, фосфат кальцію, альгінати, трагакант, желатин, силікат кальцію, мікрокристалічну целюлозу, полівінілпіролідон, целюлозу, воду, сироп і метилцелюлозу. Склади можуть додатково містити змащувальні речовини, такі як тальк, стеарат магнію і мінеральне масло; зволожуючі агенти; емульгатори і суспендуючі агенти; консерванти, такі як метил- і пропілгідроксибензоат; підсолоджувачі і ароматизуючі речовини. Композиції згідно з даним винаходом можна формулювати так, щоб забезпечити швидке, стабільне або уповільнене вивільнення активного інгредієнта після введення пацієнту застосуванням способів, відомих в даній галузі техніки. Композиції можна формувати у вигляді одиничної дозованої лікарської форми, причому кожна доза містить від приблизно 5 до приблизно 100 мг, більш переважно від приблизно 10 до приблизно 50 мг активного інгредієнта. Термін "одиничні дозовані лікарські форми" стосується фізично дискретних одиничних форм, придатних як одиничні дози для людини і інших ссавців, причому кожна одинична форма містить попередньо визначену кількість активного матеріалу, обчислену для того, щоб надати необхідну терапевтичну дію спільно з відповідною фармацевтичною допоміжною речовиною. Активна сполука може бути ефективною в широкому діапазоні доз, і її звичайно вводять у фармацевтично ефективній кількості. Проте, загальновідомо, що терапевтично ефективна кількість сполуки може коригуватись лікуючим лікарем з урахуванням супутніх обставин, які включають стан, який потребує лікування, шлях введення терапевтичного агента, конкретну сполуку, що вводиться, вік, вагу і реакцію конкретного пацієнта, тяжкість симптомів у пацієнта і подібні. Для одержання твердих композицій, таких як таблетки, основний активний інгредієнт змішують з фармацевтичною допоміжною речовиною для одержання твердої попередньої композиції, що містить гомогенну суміш сполуки згідно з даним винаходом. При згадці даних попередніх композицій як гомогенних активний інгредієнт звичайно рівномірно розподіляють в композиції так, щоб композицію можна було легко розділяти на рівні ефективні одиничні лікарські форми, такі як таблетки, пілюлі і капсули. Потім дані тверді попередні склади розділяють на одиничні лікарські форми описаного вище типу, що містять від, наприклад, 0,1 до приблизно 500 мг активного інгредієнта згідно з даним винаходом. Таблетки або пілюлі згідно з даним винаходом можна покривати або в інших випадках змішувати для одержання лікарської форми, одержуючи ефект тривалої дії. Наприклад, таблетка або пілюля може містити внутрішню дозову і зовнішню дозову компоненту, причому остання являє собою покриття першої. Два компоненти можна розділити ентеросолюбільним шаром, який служить для опору розпаду в шлунку і дозволяє внутрішньому компоненту пройти непошкодженим в дванадцятипалу кишку або служить для сповільнення вивільнення. Можна застосовувати множину матеріалів для даних ентеросолюбільних шарів або покриттів, і дані матеріали включають ряд полімерних кислот і суміші полімерних кислот з такими матеріалами, як шелак, цетиловий спирт і та похідні целюлози, зокрема гідроксипропілметилцелюлоза або етилцелюлоза тощо. Рідкі форми, в які можна вводити сполуки і композиції згідно з даним винаходом для перорального введення або введення за допомогою ін'єкції, включають водні розчини, відповідні ароматизовані сиропи, водні або масляні суспензії і ароматизовані емульсії з харчовими оліями, такими як бавовняна олія, кунжутна олія, кокосова олія або арахісова олія, також як еліксири і аналогічні фармацевтичні розчинники. Композиції для інгаляції або інсуфляції включають розчини і суспензії в фармацевтично прийнятних водних або органічних розчинниках, або їх сумішах, і порошки. Рідкі або тверді композиції можуть містити відповідні фармацевтично прийнятні допоміжні речовини, як описано вище. У деяких варіантах здійснення композиції вводять пероральним або назальним 20 респіраторним шляхом для місцевої або загальної дії. Композиції можна розпилювати застосуванням інертних газів. Розчини, що розпилюються, можна вдихати безпосередньо з розпилюючого пристрою або розпилюючий пристрій можна приєднувати до масок для обличчя або пристрою для дихання з позитивним тиском, що перемежається. Композиції у вигляді розчину, суспензії або порошку можна вводити перорально або назально за допомогою пристрою, який відповідним способом доставляє вказану композицію. Кількість сполуки або композиції, що вводиться пацієнту, буде залежати від того, в якій формі вводять сполуку або композицію, мети введення, такої як профілактика або лікування, стану пацієнта, способу введення тощо. З терапевтичною метою композиції можна вводити 10 UA 115310 C2 5 10 15 20 25 30 35 40 45 50 55 пацієнту, вже страждаючому від захворювання, в кількості, достатній для того, щоб вилікувати або щонайменше частково зупинити симптоми захворювання і його ускладнення. Ефективні дози будуть залежати від стану захворювання, який треба лікувати, а також від тяжкості захворювання, віку, ваги і загального стану здоров'я пацієнта тощо. Композиції, що вводяться пацієнту, можуть бути в формі фармацевтичних композицій, описаних вище. Дані композиції можна стерилізувати загальноприйнятими способами стерилізації або їх можна стерилізувати стерилізуючою фільтрацією. Водні розчини можна упаковувати для застосування, як є, або ліофілізувати, причому ліофілізований препарат змішують зі стерильним водним носієм перед введенням. рН таких препаратів зазвичай буде складати від 3 до 11, більш переважно від 5 до 9 і найбільш переважно від 7 до 8. Ясно, що застосування визначених 40 речовин з вищезгаданих допоміжних речовин, носіїв або стабілізаторів буде приводити до утворення фармацевтичних солей. Терапевтичні дози сполук згідно з даним винаходом можуть змінюватися в залежності, наприклад, від конкретного застосування, для якого проводиться лікування, способу введення сполуки, здоров'я і стану пацієнта і рішення лікуючого лікаря. Кількісне співвідношення або концентрація сполуки згідно з даним винаходом в фармацевтичній композиції може змінюватися в залежності від ряду факторів, включаючи дозу, хімічні характеристики (наприклад, гідрофобність) і спосіб введення. Наприклад, сполуки згідно з даним винаходом можна одержувати у вигляді водного фізіологічного буферного розчину, що містить від приблизно 0,1 до приблизно 10 % ваг./об. сполуки для парентерального введення. Деякі діапазони стандартних доз складають від приблизно 1 мкг/кг до приблизно 1 г/кг ваги тіла на день. У деяких варіантах діапазон доз складає від приблизно 0,01 мг/кг до приблизно 100 мг/кг ваги тіла на день. Доза, ймовірно, залежить від таких змінних, як тип і міра прогресування захворювання або розладу, загального статусу здоров'я конкретного пацієнта, відносної біологічної активності вибраної сполуки, складу допоміжної речовини і шляху її введення. Ефективні дози можна екстраполювати, виходячи з кривих доза-ефект, одержаних в системах для випробувань in vitro або на модельних тваринах. Сполуки згідно з даним винаходом можна також застосовувати у комбінації з одним або більше додаткових активних фармацевтичних інгредієнтів, які можуть включати будь-який фармацевтичний агент, такий як противірусні агенти, вакцини, антибіотики, агенти, що посилюють імунітет, імуносупресори, протизапальні агенти, анальгетики і лікарські засоби для лікування інсульту, інфаркту, діабету та ожиріння, гіперглікемії, гіпертензії, гіперліпідемії і подібних. Агенти для лікування метаболічних розладів, з якими сполуки згідно з даним винаходом можна змішувати, включають, але не обмежуються, амілінові аналоги, інкретинові міметики, інгібітори дипептидилпептидази-IV, що є ферментом, який руйнує інкретин, агоністи рецептора, що активується проліфератором пероксисом (PPAR)-a і PPAR-g, і інгібітори СВ1 канабіноїдного рецептора. Даний винахід буде описаний більш детально за допомогою конкретних прикладів. Наступні приклади представлені з ілюстративною метою, і не передбачається, що вони обмежують даний винахід будь-яким способом. Фахівцям зрозуміло, що множини некритичних параметрів, які можна змінити або модифікувати, будуть давати, по суті, ті ж самі результати. Приклади Всі сполуки очищали або колонковою флеш-хроматографією або зворотно-фазовою рідинною хроматографією, застосовуючи Waters FractionLynx LC-MS систему з фракціонуванням по масі. Column: Waters XBridge C18 5 мкм, 19×100 мм; рухома фаза А: 0,15 % NH4OH у воді і рухома фаза В: 0,15 % NH4OH в ацетонітрилі; швидкість потоку була 30 мл/хв., розділяючий градієнт підбирали для кожної сполуки, застосовуючи Compound Specific 15 Method Optimization protocol, як описано в літературі ["Preparative LC-MS Purification: Improved Compound Specific Method Optimization", K. Blom, B. Glass, R. Sparks, A. Combs, J. Combi. Chem., 2004, 6, 874-883]. Потім виділений продукт звичайно піддавали аналітичній LC/MS для перевірки чистоти при наступних умовах: Instrument; Agilent 1100 series, LC/MSD, колонка: Waters Sunfire™ C18 5 мкм, 20 2,1×5,0 мм, буфери: рухома фаза А: 0,025 % TFA у воді і рухома фаза В: 0,025 % TFA в ацетонітрилі; градієнт 2-80 % буфера В протягом 3 хвилин при швидкості потоку 1,5 мл/хв. Приклад 1 5'-(4-Метилфеніл)-3'-[2-(метилтіо)етил]-3а',6а'-дигідро-2'Н-спіро[індол-3,1'-піроло[3,4-с]пірол]2,4',6'-(1Н, 3'Н, 5'Н)тріон (SI-86) 11 UA 115310 C2 H3C O S H N (R) O CH3 H (S) H (S) (S) NH O N H Стадія 1: 1-р-Толіл-пірол-2,5-діон (1-р-толіл-пірол-2,5-діон) O N H3C O 5 10 15 20 25 30 35 Малеїновий ангідрид (98,1 г, 1,0 моль) і р-толуїдину (137,1 г, 1,0 моль) розчиняли у N, N,диметилформаміді (ДМФ, 320 мл), потім суміш перемішували при кімнатній температурі протягом 5 год. в атмосфері азоту. Отриманий розчин виливають у велику кількість води, щоб осадити сиру п-толілмалеамінову кислоту (N-(4-метилфеніл)малеамінову кислоту, р-ТМА). Сиру р-толілмалеамінову кислоту відфільтровували, сушили, а потім тричі перекрісталлізовували з суміші води з одержанням чистого продукту (97 %), Т.пл. 160-162 °C Суміш р-ТМА (43,5 г, 0,2 моль), оцтового ангідриду (100 мл) і (2,5 г) ацетату натрію перемішували при 55-60 °C протягом 2 годин. Реакційну суміш виливають у велику кількість води та льоду з одержанням неочищеного 1-р-толіл-пірол-2,5-діону у вигляді маслоподібного осаду, який застигає у аморфну масу при перемішуванні. Після чого осад декантують, а сирий 1-р-толіл-пірол-2,5-діон розчиняють у мінімальній кількості етанолу, залишають при 0-+10 °C до випадіння осаду, який відфільтровували, промивали водою, сушили і перекрісталізовували три рази з етанолу. Вихід 85 %. Тпл = 144-146 °C. Жовтий кристалічний порошок. LC/MS m/e 188 + 1 (М+Н) . ЯМР Н, δ, м. ч. (TMS, DMSO-d6): 8.03-7.49 (2d, J=8.24 Hz, 4H, Ph); 7.22 (s, 2H, -CO13 CH=CH-CO-), 2.33 (3H, s, РhСН3). C NMR (CDCl3) δ 21.1, 126.0, 128.5, 129.8, 134.2, 138.1, -1 169.7. IR (CHCl3, cm ) 1708, 1390. Стадія 2: 5'-(4-Метилфеніл)-3'-[2-(метилтіо)етил]-3а',6а'-дигідро-2'Н-спіро[індол-3,1'піроло[3,4-c]пірол]-2,4',6'-(1Н, 3'Н, 5'Н)тріон (SI-86) Суміш (1 моль, 147 г) ізатину, (1 моль, 147 г) L-метіоніну (≥ 99.0 % (NT) (Fluka) і (1 моль, 187 г) 1-р-толіл-пірол-2,5-діону, у 40 мл суміші пропан-2-ол: вода (3:1) кип'ятять протягом 2,5-3 годин, проходження реакції контролюють по ТШХ і зміні забарвлення реакційної суміші (від червоного до блідо-жовтого). Розчин охолоджують, осад, що випав фільтрують, промивають пропан-2-олом і кристалізують з н-бутанолу з розрахунку 70 мл на 1 г. Вихід 366 г, 87 %. Білий кристалічний порошок, Т. пл. 184-186 °C (n-ВuОН), максимум поглинання λmах 225 нм (Іgε ~ + 1 3,703) у метанолі. LC/MS m/e 421 (М+Н) . ЯМР Н, δ, м.д (TMS, DMSO-D6): 10.39 (1Н, s, 1Н, NH), 7.26-7.38 (2Н, m, Аr), 7.11-7.23 (3Н, m, Аr), 6.74-7.02 (3Н, m, Аr), 4.26 (1Н, t, J=7 Hz, 3’-СН), 3.85 (1Н, d, J=7 Hz, 2’-NH), 3.61 (1H, t, J=8 Hz, 3a’-CH), 3.41 (1H, d, J=8 Hz, 6a’-CH), 3.27-3.33 (2H, m, CH2CH2SCH3), 2.54-2.68 (2H, m, CH2CH2SCH3), 2.34 (3H, s, PhCH3), 1-94-2.17 (3H, m, CH2CH2SCH3), 1-72 (1H, dd, J=14 and 7 Hz). Знайдено, %: С - 65,53; H-5,50; N-9,95; S-7,62. C23H23N3O3S. Обчислено, %: С - 65,54; H-5,50; N-9,97; S-7,61. Приклад 2 5'-(4-Метилфеніл)-3'-[2-(етилтіо)етил]-3а',6а'-дигідро-2'H-спіро[індол-3,1'-піроло[3,4-с]пірол]2,4',6'-(1H, 3Н',5H')тріон (SI-34). 12 UA 115310 C2 H3C O H N (S) (R) O (S) H (S) H NH S CH3 O N H 5 10 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 і 2, а замість L-метіоніну використовували L-етіонін. Вихід 88 %. Білий кристалічний порошок, Т.пл. 209-210 °C (з розкладанням, n-ВuОН), максимум поглинання + 1 λmах 291 нм (Іgε ~ 0,618) у метанолі. LC/MS m/e 435 (М+Н) . ЯМР Н, δ, м.д (TMS, DMSO-D6): 10.39 (1Н, s, 1Н, NH), 7.18 (4-Аr, 1Н, т; J=7.6) 6.98 (4-Аr, 1Н, д J=7.9 Hz), 6.88 (5-Ar, 1H, т J=7.9), 6.80 (7-Ar, 1H, д J=7.9), 4.31-4.24 (3'-СН, 1Н, м, ), 3.86 (1Н, d, J=6,7 Hz, 2'-NH), 3.62 (3'а-СН 1H, т J=7.6), 3.41 (1Н, d, J=8 Hz, 6a'-CH), 2.13-2.04; 1.78-1.69 (2H, м, 3'-CHaHb-CH2S), 2.72-2.62 (2Н, м, 3'-СНаНb-CH2S), 2.54-2.50 (3'-SCH2Me, 2H, м), (3'-SCH2Me J=7.3), 2.35 (3Н, s, РhСН3), 1.18 (3Н, д 3’-SCH2Me т J=7.3). Знайдено, %: С - 66.20; Н - 5.79; N-9.67; S-7.37. C24H25N3O3S. Обчислено, %: С - 66.18; Н - 5.79; N-9.65; S-7.36. Приклад 3 5-Бром-5'-(4-метилфеніл)-3'-[2-(етилтіо)етил]-3а',6а'-дигидро-2'H-спіро[індол-3,1'-піроло[3,4с]пірол]-2,4',6'-(1H, 3'Н, 5'H)тріон (SI-76 5t). H3C O H N (S) (R) Br O H (S) (S) H NH O 15 20 25 30 N H S CH3 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 і 2, а замість L-метіоніну та ізатину використовували L-етіонін та 5-бромізатин відповідно. Вихід 90 %. Кремовий кристалічний порошок, Т.пл. 243-245 °C (n+ 1 BuOH). LC/MS m/e 514 (М+Н) . Спектр ЯМР Н, δ, м.д (J, Гц): 1.17 (т, 3Н, CH2CH2SCH2CH3, J=7.5), 1.66-2.12 (м, 2Н, CH2CH2SCH2CH3), 2.34 (с, 3Н, РhСН3), 2.50-2.73 (м, 4Н, CH2CH2SCH2CH3), 3.46 (д, 1Н, 6а’-СН, J=7.7), 3.64 (т, 1Н, 3а’-СН, J=7.7), 3.98 (д, 1Н, 2’-NH, J=7.0), 4.12-4.23 (м, 1Н, 3’-СН), 6.76 (д, 1Н, 7-СН, J=8.4), 7.12 (д, 1Н, 4-СН, J=1.5), 7.17 (д, 2,6-СН (PhMe), J=8.1), 7.31 (д, 2Н, 3,5-СН (PhMe), J=8.1), 7.37 (дд, 1Н, 6-СН, Jмета=1.5, Jорто=8.4), 10.57 13 (с, 1Н, NH). C NMR (DMSO-d6) δ: 180.1, 176.0, 174.6, 142.0, 138.5, 132.3, 130.4, 130.3, 129.9, 129.5, 127.2, 113.2, 111.8, 68.8, 58.1, 53.2, 49.3, 40.6, 40.5, 40.4, 40.3, 40.3, 40.2, 40.1, 40.0, 39.9, 39.8, 39.7, 39.5, 31.8, 29.1, 25.4, 21.2, 15.3. Знайдено, %: С - 56,02; Н - 4,69; N-8,16; S-6,22. С24H24ВrN3О3S. Обчислено, %: С - 56,03; Н - 4,70; N-8,17; S-6,23. Приклад 4 5-Бром-5'-(4-метилфеніл)-3'-[2-(метилтіо)етил]-3а',6а'-дигідро-2'Н-спіро[індол-3,1-піроло[3,4с]пірол]-2,4',6'-(1Н, 3'Н, 5'Н)тріон (SI-87 6v) 13 UA 115310 C2 H3C O H N (S) (R) Br O (S) (S) H H NH S CH3 O N H 5 10 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість ізатину використовували 5-бромізатин відповідно. Вихід 90 %. Кремовий кристалічний порошок, Т.пл. 242-244 °C (n-BuOH). LC/MS m/e + 1 500 (М+Н) . Н NMR (200 MHz, DMSO-d6, TMS) δ: 10.56 (с, 1Н, NH), 7.42-7.08 (м, 6Н, Аr) 6.836.73 (м, 1Н, Аr), 4.33-4.16 (м, 1Н, NH), 3.93-3.83 (м, 1Н, СН), 3.65-3.46 (м, 2Н, СН), 2.34 (с, 3Н, СН3), 1.25 (д, 3Н, СН3). Знайдено, %: С - 55.23; Н - 4.50; N-8.40. С23H22ВrN3О3S, %. Обчислено, %: С - 55.20; Н - 4.43; N-8.40. Приклад 5: 1-Метил-5'-(4-Метилфеніл)-3'-[2-(метилтіо)етил]-3а',6а'-дигідро-2'Н-спіро[індол3,1'-піроло[3,4-с]пірол]-2,4',6'-(1Н, 3'Н, 5'Н)тріон (SI-176N) H3C S O H N (R) O CH3 H H (S) (S) (S) NH O N CH3 15 20 Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість ізатину використовували 1-метил-ізатин відповідно. Вихід 95 %. Білий кристалічний порошок, Т.пл. 257-259 °C (n-BuOH). LC/MS m/e 435 + 1 (М+Н) . Н NMR (400 MHz, DMSO-d6, TMS): δ 7.33 (d, J=7.9 Hz, 3Н), 7.22 (d, J=8.3 Hz, 2H), 6.917.08 (m, 3H), 4.31 (br. s., 1H), 3.84-3.95 (m, 1H), 3.66 (t, J=7.5 Hz, 1H), 3.45 (d, J=7.9 Hz, 1H), 3.32 (br. s., 2H), 3.13 (s, 3H), 2.58-2.73 (m, 2H), 2.51 (br. s., 1H), 2.37 (br. s., 3H), 2.01-2.13 (m, 4H), 1.691.83 (m, 1H). Знайдено, %: С - 66,19; H-5,80; N-9,66; S-7,37. C24H25N3O3S. Обчислено, %: С 66,18; H-5,79; N-9,65; S-7,36. Приклад 6 1-(4-Хлорбензил)-3'-[2-(етилтіо)етил]-5'-(4-метилфеніл)-3а',6а'дигідро-2'Н-спіро[індол-3,1'піроло[3,4-с]пірол]-2,4',6'-(1Н, 3'Н, 5'Н)тріон (SI-108 6x). 14 UA 115310 C2 H3C O H N (S) (R) O (S) (S) H H NH S CH3 O N Cl 5 10 Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість L-метіоніну та ізатину використовували L-етіонін та 1-хлорбензил-ізатин відповідно. Вихід: 63 %. Білий аморфний порошок з Т.пл. 158-160 °C (n+ 1 BuOH). LC/MS m/е 559 (М+Н) . Н NMR (200 MHz, DMSO-d6, TMS): δ 7.44-6.83 (m, 12Н, Аr), 4.85 (d, 2Н, СН2), 4.42-4.23 (m, 1H, NH), 3.98 (d, 1H, СН), 3.76-3.60 (m, 2H, СН), 3.50 (d, 3Н, СН, СН2), 2.74-2.53 (d, 2H, СН2), 2.34 (s, 3Н, СН3), 2.16-1.64 (m, 4Н, СН2), 1.17 (t, 3Н, СН3). Обчислено, %: С - 66.48; Н - 5.40; N-7.50. C31H30CIN3O3S. Знайдено, %: С - 66.50; Н - 5.43; N-7.49. Приклад 7 5-Бром-3'-[2-(етилтіо)етил]-3a',6а'-дигідро-2'Н-спіро[індоло-3,1'-піроло[3,4-c]пірол]-2,4',6'-(1Н, 3'H, 5'Н)тріон (SI-81 7c) CH3 S O H HN (R) O Br H (S) (S) (S) NH O NH 15 20 25 Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість 1-р-толіл-пірол-2,5-діону L-метіоніну та ізатину використовували пірол-2,5-діон, L-етіонін та 5-бром-ізатин відповідно. Вихід: 75 %. Білий + 1 кристалічний порошок з Т.пл. 228-230 °C (n-ВuOН). LC/MS m/е 424 (М+Н) . Н NMR (200 MHz, DMSO-d6, TMS) δ: 1.17 (т, J=7.32 Hz, 4H) 1.47-1.71 (м, 1Н) 1.88-2.11 (м, 1Н) 2.34-2.72 (м, 7Н) 3.24 (д, J=7.69 Hz, 3Н) 3.38-3.53 (м, 1Н) 3.86 (д, J=5.86 Hz, 1Н) 4.03-4.21 (м, 1Н) 6.74 (д, J=8.42 Hz, 13 1Н) 7.04 (с, 1Н) 7.37 (д, J=8.06 Hz, 1Н) 10.49 (с, 1Н) 11.39 (с, 1Н). С NMR (DMSO-d6) δ: 180.3, 178.3, 176.8, 141.9, 132.1, 130.6, 129.3, 113.2, 111.6, 68.1, 57.3, 53.9, 49.8, 40.5, 40.3, 40.2, 40.0, 39.8, 39.7, 39.5, 32.0, 29.0, 25.4, 15.3. Обчислено, %: С, 48.12; Н, 4.28; N, 9.90. C 17H18BrN3O3S. Знайдено, %: С - 48.15; Н - 4.30; N-9.95. Приклад 8 1-Аліл-3'-[2-(метилтіо)етил]-3а',6а'-дигідро-2'Н-спіро[індол-3,1'-піроло[3,4-с]пірол]-2,4',6'-(1Н, 3'Н, 5'Н)тріон (SI-149 7d) 15 UA 115310 C2 S O H HN (R) O CH3 H H (S) (S) NH (S) O N 5 10 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість 1-р-толіл-пірол-2,5-діону та ізатину використовували пірол-2,5-діон, та 1-аліл-ізатин відповідно. Вихід: 75 %. Білий кристалічний + 1 порошок з Т.пл. 300 °C (з розкладанням, n-BuOH). LC/MS m/e 371 (М+Н) . Н NMR (200 MHz, DMSO-d6, TMS): δ 1.18 (д, J=6.59 Hz, 4Н) 3.10-3.27 (м, 2Н) 3.35-3.46 (м, 2Н) 3.70 (д, J=5.49 Hz, 1Н) 4.11-4.35 (м, 3Н) 5.00-5.28 (м, 2Н) 5.68-5.94 (м, 1Н)6.81-7.10 (м, 3Н) 7.25 (д, J=7.32, 1.83 Hz, 1Н) 11.29 (уш. с, 1Н). Обчислено, %: С - 61.44; Н - 5.70; N-11.31. C19H21N3O3S. Знайдено, %: С 61.48; Н - 5.77; N-11.36. Приклад 9 1-Аліл-3'-(меркаптометилен)-3а',6а'-дигідро-2'Н-спіро[індол-3,1'-піроло[3,4-пірол]-2,4',6'-(1Н, 3'Н, 5'Н)тріон (SI-123) O H3C SH H N H O NH H O N 15 20 25 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість L-метіоніну та ізатину використовували L-цистеїн гідрохлорид та 1-аліл-ізатин відповідно, витримуючи реакційну суміш за температури не вище 80-90 °C. Реакційну суміш фільтрували, концентрували під вакуумом і залишок очищували флеш-хроматографією на колонці з силікагелем (елююючи сумішшю етилацетат: гексан (1:1)) для того, щоб одержати необхідний продукт. Вихід: 52 %. Злегка жовтуватий кристалічний + 1 порошок з Т.пл. 158 °C (з розкладанням, n-ВuОН). LC/MS m/e 371 (М+Н) . Н NMR (200 MHz, DMSO-d6, TMS): δ 1.03 (уш. с, 11Н), 2.33 (уш. с, 12Н), 4.07-4.60 (м, 9Н), 5.10-5.34 (м, 4Н), 5.80 (уш. с, 2Н), 6.86-7.03 (м, 4Н), 7.11 (м, J=7.32 Hz, 5Н) 7.28 (м., 3Н). Обчислено, %: С - 66,49; Н 5,35; N-9,69; S-7,40. C24H23N3O3S. Знайдено, %: С - 66,47; Н - 5,36; N-9,70; S-7,42. Приклад 10 1-Метил-3'-(меркаптометилен)-3а',6а'-дигідро-2'Н-спіро[індол-3,1'-піроло[3,4-с]пірол]-2,4',6'(1Н, 3'Н, 5'Н)тріон (SI-124) 16 UA 115310 C2 O H3C SH H N H O NH H O N CH3 5 10 . R-124 Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість L-метіоніну та ізатину використовували L-цистеїн гідрохлорид та 1-метил-ізатин відповідно, витримуючи реакційну суміш за температури не вище 80-90 °C. Реакційну суміш фільтрували, концентрували під вакуумом і залишок очищували флеш-хроматографією на колонці з силікагелем (елююючи сумішшю етилацетат:гексан (1:1)) для того, щоб одержати необхідний продукт. Вихід: 45 %. Злегка жовтуватий кристалічний 1 порошок з Т.пл. 167-169 °C (з розкладанням, n-BuOH). LC/MS m/e 407. Н NMR (200 MHz, DMSO-d6, TMS) δ: 1.05 (д, J=5.86 Hz, 2H) 2.36 (уш. с, 4Н) 2.51 (м., 4Н) 3.14 (уш. с, 3Н) 3.78 (уш. с, 2Н) 4.18 (уш. с, 2Н) 4.56 (уш. с, 2Н) 7.15 (уш. с, 3Н) 7.30 (д, J=7.69 Hz, 5Н). Обчислено, %: С 64,85; Н - 5,19; N-10,31; S-7,87. C22H21N3O3S. Знайдено, %: С - 64,86; Н - 5,20; N-10,32; S-7,88. Приклад 11 3'-(Меркаптометилен)-3а',6а'-дигідро-2'Н-спіро[індол-3,1'-піроло[3,4-с]пірол]-2,4',6'-(1Н, 3'H, 5'Н)тріон (SI-121) O H3C SH H N H O NH H O NH 15 20 25 R-121 Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість L-метіоніну використовували L-цистеїн гідрохлорид, витримуючи реакційну суміш за температури не вище 80-90 °C. Реакційну суміш фільтрували, концентрували під вакуумом і залишок очищували флеш-хроматографією на колонці з силікагелем (елююючи сумішшю етилацетат: гексан (1:1)) для того, щоб одержати необхідний продукт. Вихід: 43 %. Злегка жовтуватий кристалічний порошок з Т.пл. 178 °C (з 1 розкладанням, n-BuOH). LC/MS m/e 393. Н NMR (200 MHz, DMSO-d6, TMS): 2.33 (с, 3Н) 3.26 (уш с, 3Н) 3.67-3.87 (м, 1Н) 4.07-4.24 (m, 1Н) 4.51 (д, J=5.04 Hz, 1Н) 6.74-6.99 (м, 1Н) 6.99-7.39 (м, 8Н) 10.55 (уш. с, 1Н). Обчислено, %: С - 64,10; Н - 4,87; N-10,68; S-8,15. C21H19N3O3S. Знайдено, %: С - 64,08; Н - 4,88; N-10,69; S-8,14. Приклад 12 1-Аліл-3'-[2-(етилтіо)етил]-5'-(4-метилфеніл)-3а',6а'-дигідро-2'Н-спіро[індол-3,1'-піроло[3,4с]пірол]-2,4',6'-(1Н, 3'Н, 5'Н)тріон (SI-175) 17 UA 115310 C2 CH3 H3C S O H N (R) O (S) H H (S) (S) NH O N 5 10 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість L-метіоніну та ізатину використовували, L-етіонін та 1-аліл-ізатин відповідно. Вихід: 85 %. Білий кристалічний порошок з Т.пл. 275-277 °C (з + 1 розкладанням, n-BuOH). LC/MS m/e 475 (М+Н) . Н NMR (200 MHz, DMSO-d6, TMS): 7.08-7.37 (5Н, m), 6.86-7.06 (3Н, m), 5.73-5.94 (1H, m), 5.10-5.30 (2Н, m), 4.27 (3Н, br. s.), 3.93 (1H, d, J=7 Hz), 3.57-3.72 (1H, m, M07), 3.41 (1H, d, J=8 Hz), 2.56-2.73 (2H, m), 2.34 (3H, s), 1.96-2.17 (2H, m), 1.61-1.82 (1H, m), 1.09-1.23 (3H, m). Обчислено, %: С - 68,18; H-6,15; N-8,84; S-6,74. C27H29N3O3S. Знайдено, %: С - 68,19; H-6,17; N-8,85; S-6,74. Приклад 13: 5-Фтор-3'-[2-(етилтіо)етил]-5'-(4-метилфеніл)-3а',6а'-дигідро-2'Н-спіро[індоло-3,1'-піроло[3,4с]пірол]-2,4',6'-(1Н, 3'Н, 5'Н)тріон (SI-180F) CH3 H3C S O H N (R) O F H H (S) (S) (S) NH O NH 15 20 25 Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість L-метіоніну та ізатину використовували, L-етіонін та 5-фтор-1H-індол-2,3-діон відповідно. Вихід: 85 %. Білий кристалічний порошок з Т.пл. 285+ 1 287 °C (з розкладанням, n-BuOH). LC/MS m/e 453 (М+Н) . Н NMR (200 MHz, DMSO-d6, TMS) δ: 10.46 (1Н, s, NH), 6.90-7.38 (6Н, m, Ar), 6.70-6.90 (2Н, m, Аr), 4.24 (1Н, t, J=7 Hz, 1Н, 3’-СН), 3.94 (1Н, d, J=7 Hz, 2’-NH), 3.62 (1H, t, J=8 Hz, 3а’-СН), 3.45 (1H, d, J=8 Hz, 6a’-CH), 2.55-2.72 (2H, m, CH2CH2SCH2CH3), 2.27-2.39 (4H, m, РhСH3+СН2СH2SСH2СН3), 2.06 (1H, dq, J=14 та 7 Hz, ), 1.5713 1.80 (1H, с, СН2СН2SСН2СН3), 1.09-1.23 (3Н, d, CH2CH2SCH2CH3). C NMR (DMSO-d6) δ: 180.5, 135.1, 129.9, 129.8, 127.3, 127.1, 69.0, 57.9, 53.1, 49.1, 40.6, 40.5, 40.4, 40.3, 40.3, 40.2, 40.1, 40.0, 39.9, 39.8, 39.7, 39.5, 31.9, 29.1, 25.4, 21.2, 15.3 Обчислено, %: С - 63,56; H-5,33; N-9,27; S-7,07. C24H24FN3O3S. Знайдено, %: С - 63,55; H-5,34; N-9,26; S-7,06. Приклад 14 5-Фтор-3'-[2-(етилтіо)етил]-3а',6а'-дигідро-2'Н-спіро[індоло-3,1'-піроло[3,4-с]пірол]-2,4',6'-(1Н, 3'H, 5'Н)тріон (SI-183F) 18 UA 115310 C2 S O H HN O H (S) (S) (R) F CH3 NH (S) H O NH 5 10 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість 1-р-толіл-пірол-2,5-діону L-метіоніну та ізатину використовували, пірол-2,5-діон, L-етіонін та 5-фтор-1Н-індол-2,3-діон відповідно. Вихід: 80 %. Білий кристалічний порошок з Т.пл. 285-287 °C (з розкладанням, n-BuOH). LC/MS m/e 363 + 1 (М+Н) . Н NMR (200 MHz, DMSO-d6, TMS): 11.34 (1Н, br. s., NH), 10.37 (1Н, s, NH), 7.03 (1Н, td, J=9 and 3 Hz, F-CH-), 6.67-6.83 (2H, m, Аr), 4.33 (1H, br. s., 3'-СН), 4.04-4.20 (1H, m, 2'-NH), 3.673.90 (2H, m, 3а'-CH), 3.37-3.49 (3Н, m, 6а'-СН), 2.52-2.67 (3Н, m, CH2CH2SCH2CH3), 2.31-2.43 (1Н, m), 1.98 (1Н, dd, J=14 and 7 Hz, СH2СН2SCH2СН3), 1.64 (1H, dt, J=14 and 7 Hz, CH2CH2SCH2CH3), 1.26 (3Н, с, СН2СН2SСН2СНз). Обчислено, %: С, 56,19; Н, 4,99; N, 11,56; S, 8,82. C 17H18FN3O3S. Знайдено, %: С - 63,55; Н - 5,34; N-9,26; S-7,06. Приклад 15: 5-Бром-3'-[2-(метилтіо)етил]-3а',6а'-дигідро-2'Н-спіро[індоло-3,1'-піроло[3,4-с]пірол]-2,4',6'(1Н, 3'Н, 5'Н)тріон (SI-173N) S O H HN (R) O Br CH3 H (S) (S) (S) H NH O NH 15 20 25 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість 1-р-толіл-пірол-2,5-діону та ізатину використовували пірол-2,5-діон та 5-бром-ізатин відповідно. Вихід: 75 %. Білий кристалічний + 1 порошок з Т.пл. 225-226 °C (n-BuOH). LC/MS m/e 410 (М+Н) . Н NMR (400 MHz, DMSO-d6, TMS) δ: 11.40 (br. s., 1H), 10.50 (br. s., 1H), 7.40 (d, J=8.3 Hz, 1H), 7.08 (s, 1H), 6.77 (d, J=7.9 Hz, 1H), 4.15 (br. s., 1H), 3.87 (br. s., 1H), 3.44 (t, J=7.7 Hz, 1H), 3.21-3.32 (m, 2H), 2.50-2.66 (m, 3H), 2.012.14 (m, 4H), 1.58-1.75 (m, 1H), 1.05 (d, J=6.2 Hz, 1H). Обчислено, %: С, 46,84; H, 3,93; N, 10,24; S, 7,82. C16H16BrN3O3S. Знайдено, %: С - 46,85; H-3,95; N-10,25; S-7,83. Приклад 16: 3'-[2-(Метилтіо)етил]-3а",6а'-дигідро-2'Н-спіро[індоло-3,1'-піроло[3,4-с]пірол]-2,4',6'-(1Н, 3’H, 5'Н)тріон (SI-148N) S O H HN (R) O CH3 H H (S) (S) (S) NH O NH 30 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість 1-p-толіл-пірол-2,5-діону використовували пірол2,5-діон. Вихід: 89 %. Білий кристалічний порошок з Т.пл. 234-236 °C (i-РrОН). LC/MS m/e 331 19 UA 115310 C2 + 1 5 10 (М+Н) . Н NMR (500 MHz, DMSO-d6, TMS) δ: 11.32 (br. s., 1H), 10.33 (s, 1H), 7.20 (t, J=7.5 Hz, 1H), 6.96 (d, J=7.3 Hz, 1H), 6.90 (t, J=7.5 Hz, 1H), 6.79 (d, J=7.8 Hz, 1H), 4.35 (br. s., 1H), 4.14-4.22 (m, 1H), 3.70-3.83 (m, 2H), 3.44 (t, J=7.5 Hz, 1H), 3.23 (d, J=7.8 Hz, 1H), 2.55-2.70 (m, 3H), 1.98-2.11 13 (m, 4H), 1.68 (dd, J=14.0, 5.7 Hz, 1H), 1.05 (d, J=6.2 Hz, 6H) C NMR (DMSO-d6) δ: 180.9, 178.5, 176.8, 142.6, 129.4, 128.3, 126.5, 121.5, 109.6, 68.0, 62.5, 56.9, 53.6, 49.8, 40.6, 40.5, 40.4, 40.3, 40.3, 40.2, 40.1,40.0, 39.9, 39.8, 39.7, 39.5, 31.6, 31.5, 25.9, 15.2. Обчислено, %: С, 57,99; H, 5,17; N, 12,68; S, 9,68. C16H17N3O3S. Знайдено, %: С - 58,00; H-5,17; N-12,69; S-9,69. Приклад 17 1-Метил-3'-[2-(етилтіо)етил]-3а",6а'-дигідро-2'Н-спіро[індоло-3,1'-піроло[3,4-с]пірол]-2,4",6'(1Н, 3’H, 5'Н)тріон (SI-179) CH3 S O H HN (R) O H H (S) (S) (S) NH O N CH3 15 20 25 30 35 40 45 . Дану сполуку одержували, застосовуючи методики, які були аналогічні методикам, описаним для синтезу прикладу 1, стадії 1 та 2, а замість 1-р-толіл-пірол-2,5-діону та ізатину використовували пірол-2,5-діон та 1-метил-ізатин відповідно. Вихід: 75 %. Білий кристалічний + 1 порошок з Т.пл. 217-218 °C (n-BuOH). LC/MS m/e 359 (М+Н) . Н NMR (500 MHz, DMSO-d6, TMS) δ: 11.34 (br. s., 1Н), 7.27-7.36 (m, 1Н), 6.91-7.10 (m, 3Н), 4.20 (d, J=6.7 Hz, 1H), 3.77 (br. s., 1H), 3.47 (t, J=7.5 Hz, 1H), 3.30-3.39 (m, 1H), 3.23 (d, J=7.8 Hz, 1H), 3.10 (s, 3H), 2.57-2.69 (m, 2H), 13 1.97-2.08 (m, 1H), 1.61-1.70 (m, 1H), 1.14-1.26 (m, 3H). C NMR (DMSO-d6) δ: 178.8, 178.4, 176.7, 144.1, 129.6, 127.5, 126.2, 122.1, 108.6, 67.7, 57.1, 53.7, 49.8, 40.5, 40.4, 40.2, 40.0, 39.9, 39.7, 39.5, 32.1,29.0, 26.2, 25.4, 15.3. Обчислено, %: С - 60,15; H-5,89; N-11,69; S-8,92. C18H21N3O3S. Знайдено, %: С - 60,14; H-5,90; N-11,70; S-8,93. Приклад 18 Одержання солі L-аскорбінової та 5'-(4-метилфеніл)-3'-[2-(метилтіо)етил]-3а",6а’-дигідро-2’Нспіро[індол-3,1’-піроло[3,4-с]пірол]-2,4",6'-(1Н, 3'Н, 5'Н)тріону Наважку 5'-(4-метилфеніл)-3’-[2-(метилтіо)етил]-3а',6а'-дигідро-2’H-спіро[індол-3,1’піроло[3,4-c]пірол]-2,4",6’-(1H, 3’H, 5'H)тріону (10 г, 24 ммоль) у 540 мл етанолу 96 % нагрівають при перемішуванні на водяному нагрівнику до утворення прозорого розчину, до якого додають еквімолярну кількість L-аскорбінової кислоти (4,18 г), розчиненої у 105 мл води очищеної (з розрахунку 1 г у 25 мл води очищеної). Отриманий розчин обережно випарюють на роторному випаровувачі у вакуумі, отримуючи ледь жовтуватого кольору сіль. За необхідності сіль перекристалізовують із суміші вода: спирт (1:4). Вихід кількісний. Т.пл. 178 °C (з розкладанням). + + LC/MS m/e 421 (M+H) , 176 (M+H) . Обчислено, %: С - 58,28; Н - 5,23; N-7,03; S-5,37. Знайдено. %: С - 58,29; Н - 5,24; N-7,04; S-5,38. Приклад 19 Одержання солі янтарної кислоти та 5'-(4-метилфеніл)-3'-[2-(метилтіо)етил]-3а",6а’-дигідро2’Н-спіро[індол-3,1’-піроло[3,4-с]пірол]-2,4",6'-(1H, 3’H, 5'H)тріону Наважку 5'-(4-метилфеніл)-3'-[2-(метилтіо)етил]-3а",6а’-дигідpo-2'H-cпіpo[індол-3,1’піроло[3,4-c]пірол]-2,4",6’-(1H, 3'H, 5'H)тріонy (10 г, 24 ммоль) у 540 мл етанолу 96 % нагрівають при перемішуванні на водяному огрівнику до утворення прозорого розчину, до якого додають еквімолярну кількість янтарної кислоти (2,83 г) та перемішують до розчинення. Отриманий розчин обережно випарюють на роторному випаровувачі у вакуумі, отримуючи практично білу з ледь кремовим відтінком сіль. За необхідності сіль перекристалізовують із суміші вода: спирт + + (1:4). Т.пл. 179-182 °C (з розкладанням). LC/MS m/e 421 (М+Н) , 118 (М+Н) . Вихід кількісний. Обчислено, %: С - 60,10; Н - 5,42; N-7,79; S-5,94. Знайдено, %: С - 60,12; Н - 5,43; N-7,78; S-5,92. Приклад 20: Специфічна активність відносно 11β-HSD1 людини Скринінг спіро[піролідино-3,2-оксіндолів] загальної формули І або II шляхом прецизійного молекулярного докінгу на 3D-моделі оксидоредуктази 11β-HSD1 людини (PDB ID 3BZU загально доступної (Berman, et al. Announcing the worldwide Protein Data Bank, Nat. Struct. Biol. 10 (12) 20 UA 115310 C2 5 10 15 20 (2003) 980; R.A. Schweizer, A.G. Atanasov, B.M. Frey, A. Odermatt, A rapid screening assay for inhibitors of 11β-hydroxysteroid dehydrogenases (11β-HSD): flavanone selectively inhibits 11β-HSD1 reductase activity, Моl. Cell. Endocrinol. 212 (1-2) (2003) 41-49)) з використанням пакету програм AutoDock 4.2 та AutoDock Vina виявив здатність сполук заявленої формули І виступати інгібіторами зазначеного ферменту, що є ключовим у екстра наднирковому тканиноспецифічному метаболізмі глюкокортикостероїдів та визнаною мішенню для конструювання анти діабетичних лікарських засобів (Schuster et al. J. Steroid Biochemistry & Molecular Biology 125 (2011) - P. 148-161). В результаті процедури докінгу з використанням комплексу програми AutoDock було піддано 1318 гіпотетичних структур, з яких для 1305 структур одержано менші значення вільної енергії взаємодії з сайтом молекули 11β-HSD1 А та В (EDoc=-5,47 ккал/моль) ніж для комплексу такого відомого нестероїдного інгібітора 11β-HSD1 як S-28, а 13 сполук виявилися неактивними, тобто мали значення вільної енергії від -0,2 до -5,46 ккал/моль для сайту A 11β-HSD1, та від -0,9 до 5,39 ккал/моль - для сайту В 11β-HSD1. Для бази з 1318 структур 95,91 % структур виявилися активними, тобто мали значення вільної енергії для сайту А від -11,37 до -5,48 ккал/моль, та від -10,93 до -5,51 ккал/моль - для сайту В. Найбільш активними виявилися сполуки, що містили залишки аліфатичних сірковмісних амінокислот за положенням 2' піролідинового циклу, та мали наномолярні константи інгібування. Так, наприклад, сполука SI-86 виявляє інгібуючу активність відносно 11β-HSD1 з константою інгібування ферменту, що становить Кi=4,14 нМ (Е, kkal/mol8,87 та -8,54 при Т=298,15 KJ, що перевищує аналогічний показник відомих нестероїдних інгібіторів (табл. 1). Таблиця 1 Активність відносно людської 11β-HSD1 Сполука Кi, нМ 4,14±0,25 4,41±0,32 2,55±0,22 9,76±1,11 12,80±1,70 SI-86 SI-34 SI-176N SI-0076 AMG 221 25 30 35 40 45 50 Приклад 21 Оцінка протиішемічних та мнемотропних властивостей на прикладі сполуки SI-86 при модельному геморагічному інсульті. У дослідах на щурах із внутрішньомозковим крововиливом середнього ступеня тяжкості, який моделювали шляхом ін'єкції у внутрішню капсулу головного мозку автокрові (20 мкл/100 г) встановлено, що введення похідного 3,2'-спіро-піроло-2-оксіндолу (сполука SI-86) у дозі 10 мг/кг внутрішньошлунково в лікувальному режимі (через 1 годину після відтворення інсульту та далі через кожні 24 год. упродовж 21 доби) ефективніше за внутрішньоочеревинне введення цитиколіну (250 мг/кг), актовегіну (16 мг/кг) та пірацетаму (400 мг/кг) зменшує летальність та неврологічний дефіцит у гострому та відновлювальному періодах інсульту, а також покращує мнестичні функції. За величиною своїх церебропротекторних властивостей сполука SI-86 співставлялась з мексидолом (100 мг/кг внутрішньоочеревинно). Отримані дані експериментально обґрунтовують доцільність використання цієї речовини як церебропротекторного засобу. Нейропротективну дію похідного 3,2'-спіро-піроло-2-оксіндолу (сполука SI-86) вивчали на моделі ВМК середнього ступеня тяжкості, який моделювали під пропофоловим наркозом (60 мг/кг ввнутрішньоочеревинно (в/о)) шляхом введення у внутрішню капсулу головного мозку (стереотоксичні координати проекції: Н=7,0 мм, L=3,0 мм, А=1,5 мм від брегми) автокрові (20 мкл/100 г) (Метод відтворення інтрацеребральної геморагії у білих щурів/ О.К. Ярош, С.В. Кириченко, С.П. Халімончик [та інш.]// Кровообіг та гемостаз. - 2005. - № 1. - С. 77-81). Вибрана модель дозволяє відтворити клінічну картину ішемічного інсульту і є адекватною для клінічного вивчення потенційних нейропротекторних речовин. Як препарати порівняння використовували такі препарати: мексидол ("Мексидол", НВК Фармасофт, Росія), 100 мг/кг; цитиколін ("Сомазіна" Ferrer Snternational, S.A., Іспанія), 250 мг/кг; актовегін ("Актовегін", Nycomed, Австрія), 16 мг/кг пірацетам ("Пірацетам" Дарниця, Україна), 400 мг/кг. Згідно останніх клінічних настанов стосовно лікування хворих з ГПМК, схвалених Міністерством охорони здоров'я України (наказ № 602 від 03.08.2012), всі ці препарати 21 UA 115310 C2 5 10 15 20 25 30 35 40 45 50 55 60 дозволено включати до схем інтенсивної терапії хворих з ГПМК у якості нейропротекторів. їх застосовували в рекомендованих для доклінічних досліджень дозах (McGrow С.Р. Experimental Cerebral Infarction Effects of Pentobarbital in Mongolian Gerbils/ C.P. McGrow// Arch. Neurol. - 1977. - Vol. 34, № 6. - P. 334-336). Експериментальну терапію гострої церебральної ішемії сполукою SI-86 та препаратами порівняння розпочинали через 1 год. після ВМК один раз на день упродовж 21 доби. Похідне SI-86 досліджували в умовно-ефективній дозі 10 мг/ кг внутрішньошлунково (в/ш) - доза, яка за результатами наших попередніх дослідження забезпечує максимальну антигіпоксичну активність сполуки SI-86. Референс-препарати вводили внутрішньоочеревинно (в/о). Щурам групи контрольної патології вводили автокров та як терапію вводили 0,9 % розчин NaCl із розрахунку 2 мл/кг в/о. Псевдооперованих щурів піддавали всім втручанням (наркоз, трепанація черепа) за виключенням введення автокрові, що нівелювало вплив травматичних умов експерименту. Неврологічний дефіцит у тварин із ГПМК відповідно у гострому (4-та доба) та відновлювальному (21-ша доба) періодах визначали за шкалою stroke-index C.P. McGrow [13]. Тяжкість стану визначали за сумою відповідних балів: до 3 балів - легкий ступінь, від 3 до 7 балів - середній ступінь, вище 7 балів - тяжкий ступінь. Відмічали парези, паралічі кінцівок, тремор, манежні рухи, птоз, положення на боці, здатність щурів утримуватися на стрижні діаметром 15 см, що обертався зі швидкістю 3 об/хв. Тварин тестували щоденно, виставляючи суму балів: однобічний напівптоз - 0,5 бала; однобічний птоз - 1 бал; тремор - 0,5 бала; манежні рухи - 0,5 бала; парези кінцівок (за кожну кінцівку) - 1 бал; параліч кінцівок (за кожну кінцівку) - 2 бали; бокове положення - 3 бали; нездатність утриматись на обертовому стрижні протягом 4 хв. - 3 бали. Оцінку здатності тварин до навчання та запам'ятовування аверсивного стимулу досліджували в тесті умовної реакції пасивного уникання (УРПУ) [2]. Методика заснована на вродженому інстинкті щурів до обмеженого затемненого простору. Навчання щурів проводили в двокамерній установці, що складається з двох відсіків - світлого та темного. Тварину вміщували до світлого відсіку, фіксували латентний час входу в темний відсік, де щур отримував подразнення електричним струмом та вибігав у світлий відсік. Збереження УРПУ перевіряли через добу за зміною латентного часу входу щура до темного відсіку. Також відмічали кількість тварин, які повністю не зайшли в темну камеру. Критеріями церебропротекторної ефективності досліджуваних сполук служили також термін загибелі тварин (у днях) та їх летальність (у %). Будь-які травматичні маніпуляції та евтаназію тварин шляхом декапітації виконували в умовах пропофолового наркозу ("Fresenius Kabi", Австрія). Кількісні дані обробляли за допомогою програми статистичної обробки StatPlus 2009. Статистичну значущість відмінностей оцінювали за кутовим перетворенням Фішера (летальність), також використовували параметричний критерій t Стьюдента у випадках нормального розподілу варіаційного ряду, непараметричний критерій W Уайта - за його відсутності. Як видно із даних, представлених у таблиці 2, при модельному ВМК усі досліджувані речовини, за винятком пірацетаму, сприяли зменшенню показника летальності тварин в умовах даного патологічного стану, що вказувало на наявність у них церебропротекторного ефекту. Однак, за величиною захисного впливу на ішемізований головний мозок вони мали певні якісні відмінності. Найбільш потужні нейропротекторні властивості продемонструвало похідне 3,2'спіро-піроло-2-оксіндолу (сполука SI-86) (10 мг/кг в/ш), мексидол (100 мг/кг в/о) та цитиколін (250 мг/кг в/о), забезпечуючи 100 % церебропротекторний захист (на 24 год. спостереження показник летальності у групах тварин, які отримували ці препарати дорівнював 0 % проти 17,4 % у контролі). Впродовж 48 год. спостереження у щурів, яким проводили терапію сполукою SI-86 не було відмічено жодного летального випадку, на відміну від лікування мексидолом та цитиколіном де смертність тварин з ВМК сягала відповідно 7,9 та 8,5 %. За величиною церебропротектрної дії в зазначений термін експериментального ГІ сполука SI-86 (10 мг/кг в/ш) вірогідно перевершувала мексидол (100 мг/кг в/о), цитиколін (250 мг/кг в/о) та актовегін (16 мг/кг в/о). Курсове введення похідного 3,2'-спіро-піроло-2-оксіндолу, так само, як і мексидолу, цитиколіну та актовегіну впродовж 4 діб терапії, починаючи з моменту відтворення патології, забезпечило зменшення летальності щурів в кінці терміну спостереження відносно контролю в середньому відповідно на 18,6; 17,2; 15,1 та 9,3 % (р
ДивитисяДодаткова інформація
Автори англійськоюZahorii Hlib Volodymyrovych
Автори російськоюЗагорий Глеб Владимирович
МПК / Мітки
МПК: C07D 209/04, A61K 31/33, A61K 31/438, C07D 487/20, C07D 487/04, A61K 31/404, C07D 487/10, C07D 209/96
Мітки: 2-оксіндолу, спосіб, спіро[індоло-3,1'-піроло[3,4-c]піролу, ядро, містять, сполуки, біогенних, залишки, композиції, сірковмісних, похідних, спіроциклічні, фармацевтичні, амінокислот, основі, одержання
Код посилання
<a href="https://ua.patents.su/36-115310-spirociklichni-spoluki-na-osnovi-pokhidnikh-2-oksindolu-yaki-mistyat-yadro-spiroindolo-31-pirolo34-cpirolu-ta-zalishki-biogennikh-sirkovmisnikh-aminokislot-sposib-kh-oderzhannya-ta.html" target="_blank" rel="follow" title="База патентів України">Спіроциклічні сполуки на основі похідних 2-оксіндолу, які містять ядро спіро[індоло-3,1′-піроло[3,4-c]піролу] та залишки біогенних сірковмісних амінокислот, спосіб їх одержання та фармацевтичні композиції на їх основі</a>
Попередній патент: Модуляція експресії аполіпопротеїну ciii (apociii)
Наступний патент: Геміфумарат тенофовіру алафенаміду
Випадковий патент: Спосіб діагностики психогенних парезів поперечно-смугастих м'язів людини за а.вислим












