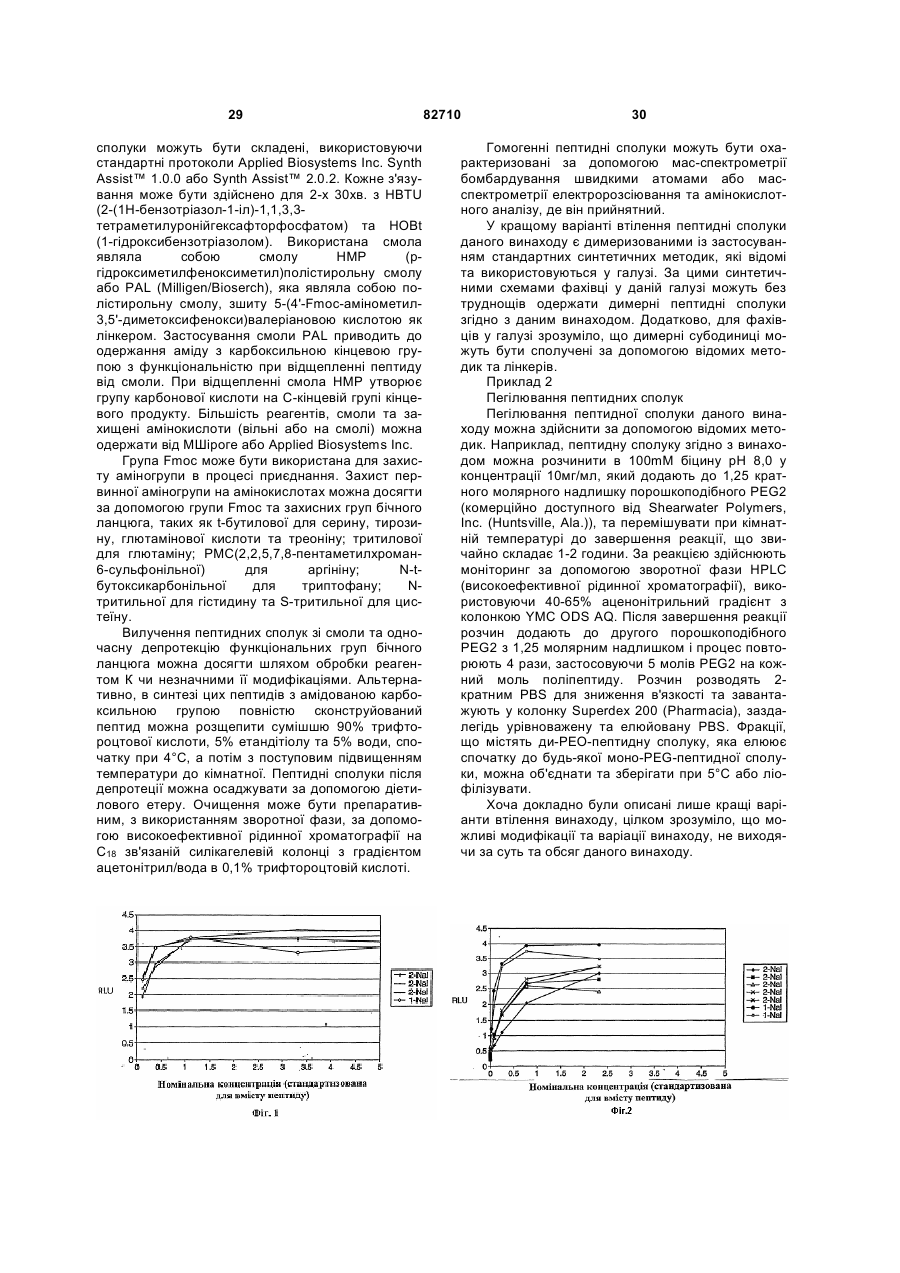
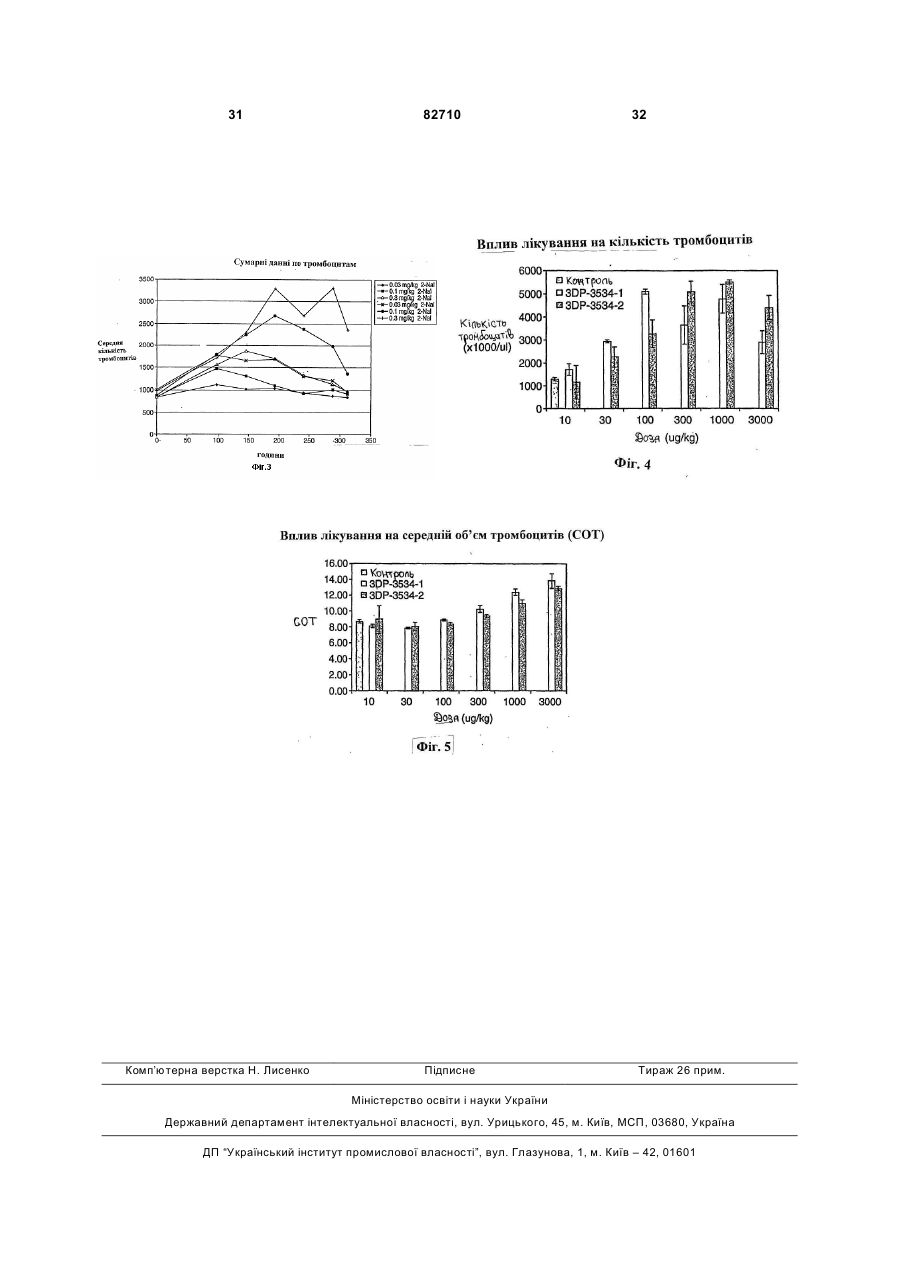
Пептид, що зв’язується з тромбопоетиновим рецептором (варіанти), та спосіб лікування тромбоцитопенії (варіанти)
Номер патенту: 82710
Опубліковано: 12.05.2008
Автори: Юрков Едвард Джон, МакДональд Брайен Ар, Вейс Джеффри Кеннет
Формула / Реферат
1. Пептидна сполука, що зв'язується з тромбопоетиновим рецептором, де вказана пептидна сполука містить (H-IEGPTLRQ(2-Nal)LAARX10)2-K-NH2, де Х10 вибраний з групи, яка включає саркозин та ![]() -аланін.
-аланін.
2. Пептидна сполука за п. 1, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з гідрофільним полімером.
3. Пептидна сполука за п. 2, яка відрізняється тим, що вказаний гідрофільний полімер має середню молекулярну масу від приблизно 500 до приблизно 40000 дальтон.
4. Пептидна сполука за п. 2, яка відрізняється тим, що вказаний гідрофільний полімер має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон.
5. Пептидна сполука за п. 2, яка відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту.
6. Пептидна сполука за п. 5, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з поліетиленгліколем.
7. Пептидна сполука за п. 1, яка відрізняється тим, що кожна з димерних субодиниць вказаної пептидної сполуки ковалентно зв'язана з гідрофільним полімером.
8. Фармацевтична композиція, що містить пептидну сполуку за п. 1 у комбінації з фармацевтично прийнятним носієм.
9. Спосіб лікування пацієнта, який страждає на розлад, сприйнятливий до лікування тромбопоетиновим агоністом, який включає введення пацієнту терапевтично ефективної дози або кількості пептидної сполуки за п. 1.
10. Фізіологічно активна, по суті не імуногенна водорозчинна поліпептидна композиція, яка містить пептидну сполуку за п. 1, приєднану зі зв'язувальним агентом до принаймні одного полімеру, який має молекулярну масу від приблизно 500 до приблизно 20000 дальтон, та вибраний з групи, яка включає поліетиленгліколь та поліпропіленгліколь, де вказаний полімер є незаміщений чи заміщений алкокси- або алкільними групами, причому вказані алкокси- або алкільні групи включають менше 5 атомів вуглецю.
11. Поліпептидна композиція за п. 10, яка відрізняється тим, що вказаний полімер має молекулярну масу від приблизно 750 до приблизно 15000 дальтон.
12. Поліпептидна композиція за п. 10, яка відрізняється тим, що вказаний полімер має молекулярну масу від приблизно 5000 до приблизно 10000 дальтон.
13. Поліпептидна композиція за п. 10, яка відрізняється тим, що вказаний полімер являє собою поліетиленгліколь.
14. По суті не імуногенна водорозчинна поліпептидна композиція за п. 10, яка відрізняється тим, що містить композицію за п. 10 та фармацевтично прийнятний носій.
15. Спосіб активації тромбопоетинового рецептора у клітині, який включає контактування вказаної клітини з ефективною кількістю пептидної сполуки, що містить (H-IEGPTLRQ(2-Nal)LAARX10)2-K-NH2, де X10 вибраний з групи, яка включає саркозин та ![]() -аланін.
-аланін.
16. Спосіб за п. 15, який відрізняється тим, що вказаними клітинами є мегакаріоцити людини, тромбоцити та клітини CD34+.
17. Спосіб за п. 15, який відрізняється тим, що вказані клітини включають ТРО-залежні клітини.
18. Спосіб лікування тромбоцитопенії у суб'єкта, який включає:
(a) одержання популяції клітин суб'єкта, які містять мегакаріоцитні клітини-попередники;
(b) обробку вказаних клітин згідно зі способом за п. 15;
(c) введення вказаних оброблених клітин вказаному суб'єкту для підвищення кількості мегакаріоцитів, присутніх у вказаного суб'єкта, у порівнянні з кількістю клітин, яка була б присутня без вказаного лікування.
19. Спосіб за п. 18, який відрізняється тим, що вказана тромбоцитопенія викликана хіміотерапією.
20. Спосіб за п. 19, який відрізняється тим, що вказану популяцію клітин одержують до вказаної хіміотерапії.
21. Спосіб за п. 18, який відрізняється тим, що вказана тромбоцитопенія викликана радіаційною терапією.
22. Спосіб за п. 21, який відрізняється тим, що вказану популяцію клітин одержують до вказаної радіаційної терапії.
23. Спосіб лікування пацієнта, який страждає на тромбоцитопенію, який включає введення пацієнту терапевтично ефективної дози пептидної сполуки, яка містить (H-IEGPTLRQ(2-Nal)LAARX10)2-K-NH2, де X10 вибраний з групи, яка включає саркозин та ![]() -аланін.
-аланін.
24. Спосіб за п. 23, який відрізняється тим, що вказана тромбоцитопенія викликана хіміотерапією чи радіаційною терапією.
25. Спосіб за п. 24, який відрізняється тим, що ТРО антагоніст вводять вказаному пацієнту до вказаної хіміотерапії чи радіаційної терапії.
26. Спосіб за п. 23, який відрізняється тим, що вказана тромбоцитопенія викликана трансфузією кісткового мозку.
27. Спосіб профілактичного лікування пацієнта з ризиком тромбоцитопенії, який включає введення пацієнту профілактично ефективної кількості пептидної сполуки, яка містить (H-IEGPTLRQ(2-Nal)LAARX10)2-K-NH2, де X10 вибраний з групи, яка включає саркозин та ![]() -аланін.
-аланін.
28. Спосіб за п. 27, який відрізняється тим, що вказану пептидну сполуку вводять вказаному пацієнту до вказаної трансплантації кісткового мозку, хіміотерапії чи радіаційної терапії.
29. Пептидна сполука, яка зв'язується з тромбопоетиновим рецептором, де вказана пептидна сполука має:
(1) молекулярну масу менше за приблизно 8000 дальтон і
(2) зв'язувальну активність до тромбопоетинового рецептора, виражену через IC50, не більше ніж приблизно 100 mМ, де вказана пептидна сполука включає наступну послідовність амінокислот:
X9 X8 G Х1 X2 X3 X4 X5 Х6 Х7,
де Х9 являє собою А, С, Е, G, I, L, М, Р, R, Q, S, Т чи V; і X8 являє собою А, С, D, Е, К, L, Q, R, S, Т чи V; Х1 являє собою С, L, М, Р, Q, V; Х2 являє собою F, К, L, N, Q, R, S, Т чи V; Х3 являє собою C, F, I, L, М, R, S, V чи W; Х4 являє собою будь-яку з 20 генетично модифікованих L-амінокислот; Х5 являє собою A, D, E, G, К, М, Q, R, S, Т чи Y; X7 являє
собою С, G, І, К, L, М, N, R чи V; і Х6 являє собою ![]() -(2-нафтил)аланін.
-(2-нафтил)аланін.
30. Пептидна сполука за п. 29, яка відрізняється тим, що вказана послідовність амінокислот є циклізованою.
31. Пептидна сполука за п. 29, яка відрізняється тим, що вказана послідовність амінокислот є димеризованою.
32. Спосіб активації тромбопоетинового рецептора у клітині, який включає контактування вказаної клітини з ефективною кількістю пептидної сполуки, що має молекулярну масу меншу за приблизно 8000 дальтон, причому вказана пептидна сполука включає наступну послідовність амінокислот:
X9 X8 G Х1 X2 X3 X4 X5 Х6 Х7,
де Х9 являє собою А, С, Е, G, I, L, М, Р, R, Q, S, Т чи V; і X8 являє собою А, С, D, Е, К, L, Q, R, S, Т чи V; Х1 являє собою С, L, М, Р, Q, V; Х2 являє собою F, К, L, N, Q, R, S, Т чи V; Х3 являє собою C, F, I, L, М, R, S, V чи W; Х4 являє собою будь-яку з 20 генетично модифікованих L-амінокислот; Х5 являє собою A, D, E, G, К, М, Q, R, S, Т чи Y; X7 являє
собою С, G, І, К, L, М, N, R чи V; і Х6 являє собою ![]() -(2-нафтил)аланін.
-(2-нафтил)аланін.
33. Пептидна сполука за п. 32, яка відрізняється тим, що вказана послідовність амінокислот є циклізованою.
34. Пептидна сполука за п. 32, яка відрізняється тим, що вказана послідовність амінокислот є димеризованою.
35. Спосіб активації тромбопоетинового рецептора у клітині, який включає контактування вказаної клітини з ефективною кількістю пептидної сполуки, що ковалентно зв'язана з гідрофільним полімером, причому вказана пептидна сполука включає наступну амінокислотну послідовність: ІЕGРТLRQ(2-Nal)LAAR(Sar).
36. Спосіб за п. 35, який відрізняється тим, що вказаний гідрофільний полімер має середню молекулярну масу від приблизно 500 до приблизно 40000 дальтон.
37. Спосіб за п. 35, який відрізняється тим, що вказаний гідрофільний полімер має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон.
38. Спосіб за п. 35, який відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту.
39. Пептидна сполука за п. 38, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з поліетиленгліколем.
40. Спосіб за п. 35, який відрізняється тим, що вказані клітини знаходяться in vivo.
41. Спосіб за п. 35, який відрізняється тим, що вказані клітини знаходяться in vitro.
42. Спосіб за п. 35, який відрізняється тим, що вказані клітини включають мегакаріоцити людини, тромбоцити та клітини CD34+.
43. Спосіб за п. 35, який відрізняється тим, що вказані клітини включають ТРО-залежні клітини.
44. Спосіб лікування тромбоцитопенії у суб'єкта, який включає:
(a) одержання популяції вказаних клітин суб'єкта, які містять мегакаріоцитні клітини-попередники;
(b) обробку вказаних клітин згідно зі способом за п. 35;
(c) введення вказаних оброблених клітин вказаному суб'єкту для підвищення кількості мегакаріоцитів, присутніх у вказаного суб'єкта, у порівнянні з кількістю клітин, яка була б присутня без вказаного лікування.
45. Спосіб за п. 44, який відрізняється тим, що вказана тромбоцитопенія викликана хіміотерапією.
46. Спосіб за п. 45, який відрізняється тим, що вказану популяцію клітин одержують до вказаної хіміотерапії.
47. Спосіб за п. 44, який відрізняється тим, що вказана тромбоцитопенія викликана радіаційною терапією.
48. Спосіб за п. 47, який відрізняється тим, що вказану популяцію клітин одержують до вказаної радіаційної терапії.
49. Пептидна сполука за п. 29, яка відрізняється тим, що вказана пептидна сполука включає наступну амінокислотну послідовність: ІЕGРТLRQ(2-Nal)LAAR(Sar).
50. Пептидна сполука, яка зв'язується з тромбопоетиновим рецептором, де вказана пептидна сполука включає (H-IEGPTLRQ(2-Nal)LAAR(Sar))2K-NH2.
51. Пептидна сполука за п. 50, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з гідрофільним полімером.
52. Пептидна сполука за п. 51, яка відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту.
53. Пептидна сполука за п. 52, яка відрізняється тим, що вказаний гідрофільний полімер являє собою поліетиленгліколь.
54. Пептидна сполука за п. 53, яка відрізняється тим, що вказаний поліетиленгліколь має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон.
55. Пептидна сполука за п. 53, яка відрізняється тим, що поліетиленгліколь вибраний з групи, яка включає монометоксиполіетиленгліколь (MePEG-OH), монометоксиполіетиленгліколь-сукцинат (MePEG-S), монометоксиполіетиленгліколь-сукцинімідилсукцинат (MePEG-S-NHS), монометоксиполіетиленгліколь-амін (MePEG-NH2), монометоксиполіетиленгліколь-трезилат (MePEG-TRES) та монометоксиполіетиленгліколь-імідазолілкарбоніл (MePEG-IM).
56. Пептидна сполука, що зв'язується з тромбопоетиновим рецептором і має наступну формулу:
 ,
,
де (2-Nal) являє собою ![]() -(2-нафтил)аланін і (Sar) являє собою саркозин.
-(2-нафтил)аланін і (Sar) являє собою саркозин.
57. Пептидна сполука за п. 56, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з гідрофільним полімером.
58. Пептидна сполука за п. 57, яка відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту.
59. Пептидна сполука за п. 57, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з поліетиленгліколем.
60. Пептидна сполука за п. 59, яка відрізняється тим, що вказаний поліетиленгліколь має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон.
61. Пептидна сполука за п. 59, яка відрізняється тим, що поліетиленгліколь вибраний з групи, яка включає монометоксиполіетиленгліколь (MePEG-OH), монометоксиполіетиленгліколь-сукцинат (MePEG-S), монометоксиполіетиленгліколь-сукцинімідилсукцинат (MePEG-S-NHS), монометоксиполіетиленгліколь-амін (MePEG-NH2), монометоксиполіетиленгліколь-трезилат (MePEG-TRES) та монометоксиполіетиленгліколь-імідазолілкарбоніл (MePEG-IM).
62. Пептидна сполука за п. 56, яка відрізняється тим, що кожна з димерних субодиниць вказаної пептидної сполуки ковалентно зв'язана з гідрофільним полімером.
63. Пептидна сполука за п. 62, яка відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту.
64. Пептидна сполука за п. 63, яка відрізняється тим, що вказаний гідрофільний полімер являє собою поліетиленгліколь.
65. Пептидна сполука за п. 64, яка відрізняється тим, що вказаний поліетиленгліколь має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон.
66. Пептидна сполука за п. 65, яка відрізняється тим, що поліетиленгліколь вибраний з групи, яка включає монометоксиполіетиленгліколь (MePEG-OH), монометоксиполіетиленгліколь-сукцинат (MePEG-S), монометоксиполіетиленгліколь-сукцинімідилсукцинат (MePEG-S-NHS), монометоксиполіетиленгліколь-амін (MePEGNH2), монометоксиполіетиленгліколь-трезилат (MePEG-TRES) та монометоксиполіетиленгліколь-імідазолілкарбоніл (MePEG-IM).
Текст
1. Пептидна сполука, що зв'язується з тромбопоетиновим рецептором, де вказана пептидна сполука містить (H-IEGPTLRQ(2-Nal)LAARX10)2-KNH2, де Х10 вибраний з групи, яка включає саркозин та b -аланін. 2. Пептидна сполука за п.1, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з гідрофільним полімером. 3. Пептидна сполука за п.2, яка відрізняється тим, що вказаний гідрофільний полімер має середню молекулярну масу від приблизно 500 до приблизно 40000 дальтон. 4. Пептидна сполука за п.2, яка відрізняється тим, що вказаний гідрофільний полімер має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон. 5. Пептидна сполука за п.2, яка відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту. 6. Пептидна сполука за п.5, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з поліетиленгліколем. 7. Пептидна сполука за п.1, яка відрізняється тим, що кожна з димерних субодиниць вказаної пептидної сполуки ковалентно зв'язана з гідрофільним полімером. 8. Фармацевтична композиція, що містить пептидну сполуку за п.1 у комбінації з фармацевтично прийнятним носієм. 9. Спосіб лікування пацієнта, який страждає на розлад, сприйнятливий до лікування тромбопое 2 (19) 1 3 (c) введення вказаних оброблених клітин вказаному суб'єкту для підвищення кількості мегакаріоцитів, присутніх у вказаного суб'єкта, у порівнянні з кількістю клітин, яка була б присутня без вказаного лікування. 19. Спосіб за п.18, який відрізняється тим, що вказана тромбоцитопенія викликана хіміотерапією. 20. Спосіб за п.19, який відрізняється тим, що вказану популяцію клітин одержують до вказаної хіміотерапії. 21. Спосіб за п.18, який відрізняється тим, що вказана тромбоцитопенія викликана радіаційною терапією. 22. Спосіб за п.21, який відрізняється тим, що вказану популяцію клітин одержують до вказаної радіаційної терапії. 23. Спосіб лікування пацієнта, який страждає на тромбоцитопенію, який включає введення пацієнту терапевтично ефективної дози пептидної сполуки, яка містить (H-IEGPTLRQ(2-Nal)LAARX10)2-K-NH2, де X10 вибраний з групи, яка включає саркозин та b -аланін. 24. Спосіб за п.23, який відрізняється тим, що вказана тромбоцитопенія викликана хіміотерапією чи радіаційною терапією. 25. Спосіб за п.24, який відрізняється тим, що ТРО антагоніст вводять вказаному пацієнту до вказаної хіміотерапії чи радіаційної терапії. 26. Спосіб за п.23, який відрізняється тим, що вказана тромбоцитопенія викликана трансфузією кісткового мозку. 27. Спосіб профілактичного лікування пацієнта з ризиком тромбоцитопенії, який включає введення пацієнту профілактично ефективної кількості пептидної сполуки, яка містить (H-IEGPTLRQ(2Nal)LAARX10)2-K-NH2, де X10 вибраний з групи, яка включає саркозин та b -аланін. 28. Спосіб за п.27, який відрізняється тим, що вказану пептидну сполуку вводять вказаному пацієнту до вказаної трансплантації кісткового мозку, хіміотерапії чи радіаційної терапії. 29. Пептидна сполука, яка зв'язується з тромбопоетиновим рецептором, де вказана пептидна сполука має: (1) молекулярну масу менше за приблизно 8000 дальтон і (2) зв'язувальну активність до тромбопоетинового рецептора, виражену через IC50, не більше ніж приблизно 100mМ, де вказана пептидна сполука включає наступну послідовність амінокислот: X9 X8 G Х1 X2 X3 X4 X5 Х6 Х7, де Х9 являє собою А, С, Е, G, I, L, М, Р, R, Q, S, Т чи V; і X8 являє собою А, С, D, Е, К, L, Q, R, S, Т чи V; Х1 являє собою С, L, М, Р, Q, V; Х2 являє собою F, К, L, N, Q, R, S, Т чи V; Х3 являє собою C, F, I, L, М, R, S, V чи W; Х4 являє собою будь-яку з 20 генетично модифікованих L-амінокислот; Х5 являє собою A, D, E, G, К, М, Q, R, S, Т чи Y; X7 являє собою С, G, І, К, L, М, N, R чи V; і Х6 являє собою b -(2-нафтил)аланін. 30. Пептидна сполука за п.29, яка відрізняється тим, що вказана послідовність амінокислот є циклізованою. 82710 4 31. Пептидна сполука за п.29, яка відрізняється тим, що вказана послідовність амінокислот є димеризованою. 32. Спосіб активації тромбопоетинового рецептора у клітині, який включає контактування вказаної клітини з ефективною кількістю пептидної сполуки, що має молекулярну масу меншу за приблизно 8000 дальтон, причому вказана пептидна сполука включає наступну послідовність амінокислот: X9 X8 G Х1 X2 X3 X4 X5 Х6 Х7, де Х9 являє собою А, С, Е, G, I, L, М, Р, R, Q, S, Т чи V; і X8 являє собою А, С, D, Е, К, L, Q, R, S, Т чи V; Х1 являє собою С, L, М, Р, Q, V; Х2 являє собою F, К, L, N, Q, R, S, Т чи V; Х3 являє собою C, F, I, L, М, R, S, V чи W; Х4 являє собою будь-яку з 20 генетично модифікованих L-амінокислот; Х5 являє собою A, D, E, G, К, М, Q, R, S, Т чи Y; X7 являє собою С, G, І, К, L, М, N, R чи V; і Х6 являє собою b -(2-нафтил)аланін. 33. Пептидна сполука за п.32, яка відрізняється тим, що вказана послідовність амінокислот є циклізованою. 34. Пептидна сполука за п.32, яка відрізняється тим, що вказана послідовність амінокислот є димеризованою. 35. Спосіб активації тромбопоетинового рецептора у клітині, який включає контактування вказаної клітини з ефективною кількістю пептидної сполуки, що ковалентно зв'язана з гідрофільним полімером, причому вказана пептидна сполука включає наступну амінокислотну послідовність: ІЕGРТLRQ(2Nal)LAAR(Sar). 36. Спосіб за п.35, який відрізняється тим, що вказаний гідрофільний полімер має середню молекулярну масу від приблизно 500 до приблизно 40000 дальтон. 37. Спосіб за п.35, який відрізняється тим, що вказаний гідрофільний полімер має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон. 38. Спосіб за п.35, який відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту. 39. Пептидна сполука за п.38, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з поліетиленгліколем. 40. Спосіб за п.35, який відрізняється тим, що вказані клітини знаходяться in vivo. 41. Спосіб за п.35, який відрізняється тим, що вказані клітини знаходяться in vitro. 42. Спосіб за п.35, який відрізняється тим, що вказані клітини включають мегакаріоцити людини, тромбоцити та клітини CD34+. 43. Спосіб за п.35, який відрізняється тим, що вказані клітини включають ТРО-залежні клітини. 44. Спосіб лікування тромбоцитопенії у суб'єкта, який включає: (a) одержання популяції вказаних клітин суб'єкта, які містять мегакаріоцитні клітини-попередники; (b) обробку вказаних клітин згідно зі способом за п.35; (c) введення вказаних оброблених клітин вказаному суб'єкту для підвищення кількості мегакаріоци 5 82710 тів, присутніх у вказаного суб'єкта, у порівнянні з кількістю клітин, яка була б присутня без вказаного лікування. 45. Спосіб за п.44, який відрізняється тим, що вказана тромбоцитопенія викликана хіміотерапією. 46. Спосіб за п.45, який відрізняється тим, що вказану популяцію клітин одержують до вказаної хіміотерапії. 47. Спосіб за п.44, який відрізняється тим, що вказана тромбоцитопенія викликана радіаційною терапією. 48. Спосіб за п.47, який відрізняється тим, що вказану популяцію клітин одержують до вказаної радіаційної терапії. 49. Пептидна сполука за п.29, яка відрізняється тим, що вказана пептидна сполука включає наступну амінокислотну послідовність: ІЕGРТLRQ(2Nal)LAAR(Sar). 50. Пептидна сполука, яка зв'язується з тромбопоетиновим рецептором, де вказана пептидна сполука включає (H-IEGPTLRQ(2-Nal)LAAR(Sar))2KNH2. 51. Пептидна сполука за п.50, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з гідрофільним полімером. 52. Пептидна сполука за п.51, яка відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту. 53. Пептидна сполука за п.52, яка відрізняється тим, що вказаний гідрофільний полімер являє собою поліетиленгліколь. 54. Пептидна сполука за п.53, яка відрізняється тим, що вказаний поліетиленгліколь має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон. 55. Пептидна сполука за п.53, яка відрізняється тим, що поліетиленгліколь вибраний з групи, яка включає монометоксиполіетиленгліколь (MePEGOH), монометоксиполіетиленгліколь-сукцинат (MePEG-S), монометоксиполіетиленглікольсукцинімідилсукцинат (MePEG-S-NHS), монометоксиполіетиленгліколь-амін (MePEG-NH2), монометоксиполіетиленгліколь-трезилат (MePEG-TRES) та монометоксиполіетиленглікольімідазолілкарбоніл (MePEG-IM). 56. Пептидна сполука, що зв'язується з тромбопоетиновим рецептором і має наступну формулу: IEGPTLRQ(2-Nal)LAAR-(Sar) K(NH2) IEGPTLRQ(2-Nal)LAAR-(Sar) , Дана заявка заявляє пріоритет заявки США , яка має порядковий номер 60/498,740 і була подана 28 серпня 2003 р. Даний винахід пропонує пептидні сполуки, що зв'язуються з та активують тромбопоіетиновий рецептор (c-mpl чи TPO-R) або інакше виступають як агоніст ТРО. Винахід має застосування в галузях біохімії та медичної хімії та, зокрема, пропонує 6 де (2-Nal) являє собою b -(2-нафтил)аланін і (Sar) являє собою саркозин. 57. Пептидна сполука за п.56, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з гідрофільним полімером. 58. Пептидна сполука за п.57, яка відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту. 59. Пептидна сполука за п.57, яка відрізняється тим, що вказана пептидна сполука ковалентно зв'язана з поліетиленгліколем. 60. Пептидна сполука за п.59, яка відрізняється тим, що вказаний поліетиленгліколь має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон. 61. Пептидна сполука за п.59, яка відрізняється тим, що поліетиленгліколь вибраний з групи, яка включає монометоксиполіетиленгліколь (MePEGOH), монометоксиполіетиленгліколь-сукцинат (MePEG-S), монометоксиполіетиленглікольсукцинімідилсукцинат (MePEG-S-NHS), монометоксиполіетиленгліколь-амін (MePEG-NH2), монометоксиполіетиленгліколь-трезилат (MePEG-TRES) та монометоксиполіетиленглікольімідазолілкарбоніл (MePEG-IM). 62. Пептидна сполука за п.56, яка відрізняється тим, що кожна з димерних субодиниць вказаної пептидної сполуки ковалентно зв'язана з гідрофільним полімером. 63. Пептидна сполука за п.62, яка відрізняється тим, що вказаний гідрофільний полімер вибраний з групи, яка включає поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту та полігліколеву кислоту. 64. Пептидна сполука за п.63, яка відрізняється тим, що вказаний гідрофільний полімер являє собою поліетиленгліколь. 65. Пептидна сполука за п.64, яка відрізняється тим, що вказаний поліетиленгліколь має середню молекулярну масу від приблизно 5000 до приблизно 20000 дальтон. 66. Пептидна сполука за п.65, яка відрізняється тим, що поліетиленгліколь вибраний з групи, яка включає монометоксиполіетиленгліколь (MePEGOH), монометоксиполіетиленгліколь-сукцинат (MePEG-S), монометоксиполіетиленглікольсукцинімідилсукцинат (MePEG-S-NHS), монометоксиполіетиленгліколь-амін (MePEGNH2), монометоксиполіетиленгліколь-трезилат (MePEG-TRES) та монометоксиполіетиленглікольімідазолілкарбоніл (MePEG-IM). агоністи ТРО для застосування у лікуванні захворювань людини. Мегакаріоцити являють собою клітини, що походять з кісткового мозку і є відповідальним» за продукування циркулюючих тромбоцитів крові. Хоча вони складають 10 разів об'єму звичайних клітин кісткового мозку. 7 [Див. Kuter, et al., Proc. Natl. Acad. Sci. USA 91:11104-11108 (1994)]. Мегакаріоцити піддаються процесу, відомому як ендомітоз, в результаті якого вони реплікують свої ядра, але не проходять розділення клітини, в результаті якого виникають поліплоїдні клітини. У відповідь на зменшення числа тромбоцитів, збільшується швидкість ендотомітозу, утворюються більша кількість плоїдних мегакаріоцитів і кількість мегакаріоцитів може збільшитись до 3 разів. [Див. Harker, J. Clin. Invest., 47:458465 (1968)]. На відміну цього у відповідь на збільшення числа тромбоцитів, зменшується швидкість ендотомітозу, утворюються менша кількість плоїдних мегакаріоцитів і кількість мегакаріоцитів може зменшитись на 50%. Точний фізіологічний механізм зворотного зв'язку, яким маса циркулюючих тромбоцитів регулює швидкість ендомітозу та кількість мегакаріоцитів кісткового мозку невідомий. Циркулюючим тромбопоіетиновим фактором, який бере участь в опосередкуванні цієї зворотної петлі, у даний час вважається тромбопоіетин (ТРО). Більш точно показано, що ТРО являє собою головний гуморальний регулятор в ситуаціях, де має місце тромбоцитопенія. [Див., напр., Metcalf, Nature, 369:519520 (1994)]. В декількох дослідженнях показано, що ТРО збільшує кількість тромбоцитів, збільшує розмір тромбоцитів та збільшує введення ізотопів в тромбоцити тварин-реципієнтів. Більш точно вважають, що ТРО впливає на мегакаріоцитопоез кількома способами: 1) він сприяє збільшенню розміру та числа мегакаріоцитів; 2) він сприяє збільшенню кількості ДНК у поліплоїдній формі у мегакаріоцитах; 3) він сприяє ендомітозу мегакаріоцитів; 4) він сприяє дозріванню мегакаріоцитів; та 5) він сприяє збільшенню вмісту у відсотках клітинпопередників у формі невеликих ацетилхолінестераза-позитивних клітин у кістковому мозку. Кров'яні пластинки (тромбоцити) необхідні для згортання крові. Коли їх кількість є дуже малою, у хворого є великий ризик померти від катастрофічної кровотечі. Таким чином, ТРО має потенціал, корисний для застосування як у діагностиці, так і у лікуванні різних гематологічних розладів, наприклад, хвороб, пов'язаних, головним чином, з дефектами тромбоцитів. Клінічні дослідження, які проводяться з ТРО, показали, що ТРО можна безпечно вводити пацієнтам. Крім того недавні дослідження заклали основу перспективі застосування ТРО терапії в лікуванні тромбоцитопенії і, зокрема, тромбоцитопенії, яка виникає в результаті хіміотерапії, радіаційної терапії, або трансплантації кісткового мозку в лікуванні раку або лімфоми. Див., напр., McDonald, Am. J. Ped. Hematology/Oncology, 14:821 (1992). ТРО, який кодує гени, клонували та характеризували. [Див. Kuter, et al., Proc. Natl. Acad. Sci. USA, 91:11104-11108 (1994); Barley, et al., Cell 77:1117-1124 (1994); Kaushansky et al., Nature 369:568-571 (1994); Wendling, et al., Nature, 369:571-574 (1994); та Sauvage et al., Nature 369:533-538 (1994)]. Тромбопоіетин являє собою глікопротеїн з принаймні двома формами з уявними молекулярними масами 25 kDa та 31 kDa та зі спільною N-кінцевою амінокислотною послідовніс 82710 8 тю. Аміно-кінцева область є високо консервованою у людини та миші і має деяку гомологію з еритропоіетином та інтерфероном-а і інтерфероном-b. Карбокси-кінцева область показує широке варіювання у різних видів. ДНК послідовності та кодуючи пептидні послідовності для TPO-R людини (також відомого як cmpl) описані. [Див. Vigon, et al., Proc. Natl. Acad. Sci. USA, 89:5640-5644 (1992)]. TPO-R є членом гемапоіетинового сімейства рецепторів фактору росту, сімейства, яке характеризується спільною структурною будовою есктраклітинного домену, включаючи чотири консервовані С залишки в Nкінцевій частині та WSXWS елемент (SEQ ID N0:1) ближче до трансмембранної області. [Див. Bazan, Proc. Natl. Acad. Sci. USA, 87:6934-6938 (1990)]. Доказом того, що цей рецептор відіграє функціональну роль у кровотворенні включають спостереження, що його експресія обмежується до селезінки, кісткового мозку або плодової печінки у мишей [див. Souyri, et al., Cell 63:1137-1147 (1990) та до мегакаріоцитів, тромбоцитів та CD34+ клітин у людей [див. Methia, et al., Blood 82:1395-1401 (1993)]. Більш того, вплив CD34+ клітин на синтетичні олігонуклеотиди, нечутливі до mpl PHK, суттєво інгібує появу колоній мегакаріоцитів, не впливаючи при цьому на формування еритроїдних або мієлоїдних колоній. Деякі дослідники допускають, що рецептор функціонує як гомодимер, подібно до ситуації з рецепторами для G-CSF та еритропоіетину. Доступність клонованих генів для TPO-R прискорює пошук агоністів для цього важливого рецептора. Доступність рекомбінантного рецепторного протешу дозволяє досліджувати взаємодію рецептор-ліганд у різних генераційних системах з безладною та напівбезладною пептидною різноманітністю. Ці системи [описані в патентах US Nos. 6251864, 6083913, 6121238, 5932546, 5869451, 6506362 та 6465430 і у Cwirla et al., Pro. Natl. Acad. Sci. USA 87:6378-6382 (1990)], де кожне з вищевказаних джерел включено шляхом посилання. Повільне відновлення рівнів тромбоцитів у пацієнтів, які страждають на тромбоцитопецію, є серйозною проблемою і існує термінова потреба в дослідженні агоніста кров'яного фактора росту, здатного прискорити регенерацію тромбоцитів. Даний винахід пропонує такий агоніст. Даний винахід направлений на створення пептидних сполук з низькою молекулярною масою які характеризуються сильною зв'язувальною здатність до TPO-R, можуть активувати TPO-R та мають знижені побічні ефекти в порівнянні з відомими ТРО агоністами. Таким чином, пептидні сполуки можуть бути корисними для терапевтичних цілей у лікуванні станів, опосередкованих ТРО (наприклад, тромбоцитопенії, яка виникла в результаті хіміотерапії, радіаційної терапії та трансфузій кісткового мозку), а також для діагностичних цілей для дослідження кровотворення та для in vitro розмноження мегакаріоцитів та комітованих прогеніторних клітин. Пептидні сполуки, придатні для терапевтичних і/або діагностичних цілей, мають ІС50 приблизно 2mМ чи менше, як визначено, наприклад, тестом 9 на зв'язувальну спорідненість, який описано в Прикладі 3 патенту US 5869451, де нижче значення ІС50 корелюється з більш сильною зв'язувальною спорідненістю до TPO-R. Приклад, описаний в патенті US 5869451, є таким: зв'язувальну спорідненість пептидних сполук визначали у конкурентному досліді на зв'язування. Стінки мікротитраційного планшету покривали 1 мг стрептавідину, блокованого PBS/1% BSA, а потім - 50нг біотинульованого антирецепторного імобілізуючого антитіла (АЬ 179). Потім стінки обробляли 1:10 розчином розчинного харвесту TPO-R. Пептидні сполуки змішували у різних концентраціях з постійною кількістю ТРО, який складався із залишків 1-156, злитих з С-кінцем протешу, який зв'язує мальтозу (МВР-ТРО156). Суміші пептиду та МВР-ТРО156 додавали у лунки, покриті TPO-R, інкубували протягом 2 годин при 4°С, а потім промивали PBS. Кількість, зв'язаного при рівновазі МВР-ТРО156, визначали шляхом додавання антисироватки кролика проти МВР, а потім зв'язаного лужною фосфатазою козлиного анти-кроличого IgC. Кількість лужної фосфатази в кожній лунці визначали за допомогою стандартних методів. Дослід проводили з пептидними сполуками різної концентрації, а результати представили у формі графіка, де вісь у представляла кількість зв'язаного МВР-ТРО156, а вісь х представляла концентрацію пептидної сполуки. Будь-хто може потім визначити концентрацію, при якій пептидна сполука буде знижувати на 50% (ІС50) кількість МВР-ТРО156, зв'язаного з імобілізованим TPO-R. Константа дисоціації (Kd) для пептиду буде подібна на величину ІС50, визначену у вказаних умовах. Для фармацевтичних цілей треба, щоб пептидні сполуки мали IC50 не більше ніж приблизно 100mМ, а краще - не більше ніж 500nМ. В кращому варіанті втілення молекулярна маса пептидної сполуки складає від приблизно 250 до приблизно 8000 дальтон. Якщо пептидні сполуки даного винаходу є олігомеризованими, димеризованими і/або дериватизованими з гідрофільним полімером, як описано, молекулярні маси таких пептидних сполук будуть знано вищими і можуть знаходитись в межах від приблизно 500 до приблизно 120000 дальтон, краще - від приблизно 8000 до приблизно 80000 дальтон. При використанні для діагностичних цілей сполуки даного винаходу помічають міткою, яку можна визначити, і, таким чином, пептидні сполуки без такої мітки слугують як проміжні сполуки для одержання мічених пептидних сполук. Пептидна сполука, яка відповідає зазначеним критеріям щодо молекулярної маси та зв'язувальної спорідненості для TPO-R містить 9 чи більше амінокислот, де амінокислоти являють собою природні або синтетичні (неприродні) амінокислоти. Таким чином, кращі пептидні сполуки являють собою сполуку, яка має: (1) молекулярну масу менше приблизно 5000 дальтон; (2) зв'язувальну спорідненість до TPO-R, як виражено за допомогою ІС50, - не вище ніж приблизно 100mМ, де від нуля до всіх зв'язків -C(O)NH— пептидної сполуки заміщені зв'язком, вибраним з 82710 10 групи, яка складається зі зв'язку -CH2OC(O)NR-; фосфонатного зв'язку; зв'язку -CH2S(O)2 NR-; зв'язку -CH2NR-; зв'язку -C(O)NR6-; та зв'язку NHC(O)NH-, де R являє собою водень чи нижчий алкіл, a R6 являє собою нижчий алкіл, причому N-кінцева частина вказаної пептидної сполуки вибрана з групи, яка складається з групи -NRR1; групи NRC(O)R; групи -NRC(O)OR; групи NRS(O)2R; групи -NHC(O)NHR; сукцинимідної групи; бензилоксикарбонільної -NH-- групи; та бензилоксикарбонільної -NH-- групи, яка має від 1 до 3 замісників на фенільному кільці, вибраних з групи, яка складається з нижчого алкілу, нижчого алкокси, хлору та брому, де R та R1 незалежно вибрані з групи, яка складається з водню та нижчого алкілу, і далі С-кінцева частина вказаної пептидної сполуки має формулу -C(O)R2, де R2 вибраний з групи, яка складається з гідрокси, нижчого алкокси, та NR3R4, де R3 та R4 незалежно вибрані з групи, яка складається з водню та нижчого алкілу і де атом азоту групи -NR3R4 може необов'язково являти собою групу аміну N-кінцевої частини пептиду для утворення циклічного пептиду, та її фізіологічно прийнятні солі. У спорідненому варіанті втілення винахід стосується мічених пептидних сполук, які включають вищеописану пептидну сполуку, з якою ковалентно зв'язана мітка, яку можна визначити. В одному варіанті втілення ядро з пептидної сполуки містить послідовність амінокислот (SEQIDNO:2): Х9 Х8 G Х1 Х2 Х3 X4 X5 Х6 Х7 де Хд являє собою А, С, Е, G, I, L, M, P, R, Q, S, Т, чи V; і X8 являє собою А, С, D, E, K, L, Q, R, S, Т, чи V; і Х6 являє собою (3-(2-нафтил)аланіновий (далі „2-Nal”) залишок. Краще, коли Х9 являє собою А або І; і X8 являє собою D, Е або К. Крім того, Х1 являє собою С, L, M, P, Q, V; Х2 являє собою F, K, L, N, Q, R, S, Т або V; Х3 являє собою С, F, I, L, M, R, S, V або W; X4 являє собою будь-яку з 20 генетично кодованих L-амінокислот; Х5 являє собою A, D, E, G, К, М, Q, R, S, Т, V або Y; і Х7 являє собою С, G, I, K, L, M, N, R, або V. Краща пептидна сполука включає амінокислотну послідовність IEGPTLRQ (2-Nal) L А А R (Sar) (SEQ ID NO:7), де (2-Nal) являє собою b(нафтил)аланін і (Sar) являє собою саркозин. В іншому варіанті втілення пептидні сполуки даного винаходу являються переважно димеризованими чи олігомеризованими для підвищення спорідненості і/або активності сполук. Приклад кращої димеризованої пептидної сполуки включає, але без обмеження: Де Х10 являє собою саркозин або b-аланіновий залишок (SEQ ID NO:7). Вищевказану структуру можна представити такою структурою: (HIEGPTLRQ(2-Nal)LAARX10)2K-NH2. Коли Х10 являє собою саркозин, сполука має таку структуру: 11 Де (2-Nal) являє собою b-(2-нафтил)аланін і і (Sar) являє собою саркозин (SEQ ID NO:7). Цю пептидну сполуку також можна представити наступною структурою (H-IEGPTLRQ(2Nal)LAAR(Sar))2K-NH2, яку далі скорочено як „ТРО Сполука No. 1”. У подальшому варіанті втілення даного винаходу кращі пептидні сполуки для використання у даному винаході включають пептидні сполуки, які коваленто зв'язані з одним або більше різноманітними гідрофільними полімерами. Придатні гідрофільні полемери включають, але без обмеження, поліетиленгліколь, поліпропіленгліколь, полімолочну кислоту, полігліколеву кислоту, поліоксиалкени, полівініловий спирт, полівінілпіролідон, целюлозу та похідні целюлози, декстран та похідні декстрану, тощо, як [описано в патенті US 5869451], який включено шляхом посилання на його зміст. Описані пептидні сполуки є корисними для попередження та лікування захворювань, опосередкованих ТРО і, зокрема, - для лікування тромбоцитопенії, яка є наслідком хіміотерапії, радіаційної терапії, або трансфузій кісткового мозку. Таким чином, даний винахід також включає спосіб лікування, де пацієнт із захворюванням, сприйнятливим до лікування агоністом ТРО, одержує, або якому вводять, терапевтично ефективну дозу або кількість пептидної сполуки даного винаходу. Винахід також пропонує фармацевтичні композиції, які включають одну чи більше описаних пептидних сполук, та фізіологічно прийнятний носій. Ці фармацевтичні композиції можуть бути у різноманітних формах, включаючи дозовані форми для орального прийому, а також порошки та розчини для інгаляції, розчини для ін'єкцій або інфузій, Фіг.1 показує і порівнює активність ТРО Сполуки №1 з пептидною сполукою з рівня техніки (далі „пептидна сполука з рівня техніки"). Відмінність ТРО Сполуки №1 від пептидної сполуки з рівня техніки полягає в тому, що пептидна сполука з рівня техніки має (b-(і-нафтил)аланін (І-Nal), тоді як (2-Nal) знаходиться на ТРО Сполуці №1. Фіг.2 показує і порівнює активність ПЕГільованої ТРО Сполуки №1 з ПЕГільованою пептидною сполукою з рівня техніки. Фіг.3 показує і порівнює зміну in vivo кількості тромбоцитів у пацюка, демонструючи відносну ефективність ПЕГільованої ТРО Сполуки №1 у порівнянні з ПЕГільованою пептидною сполукою з рівня техніки. Фіг.4 та 5 показують і порівнюють кількість та об'єм циркулюючих тромбоцитів у залежний від дози спосіб, відповідно, при застосуванні ПЕГільованої пептидної сполуки з рівня техніки та ПЕГільованої ТРО Сполуки №1. ВИЗНАЧЕННЯ ТА ЗАГАЛЬНІ ПАРАМЕТРИ Нижченаведені визначення наведені для ілюстрації та визначення значень та обсягу різних термінів, які використовуються для опису винаходу. 82710 12 „Агоніст” стосується біологічно активного ліганду, який зв'язується з його комплементарно біологічно активним рецептором та активує останній для виникнення біологічної відповіді у рецепторі або для підсилення біологічної активності рецептора, яка в ньому була. „Пептидна сполука” стосується молекули, яка гідролізується в амінокислоти і/або похідні амінокислот і/або замісники амінокислот. „Фармацевтично прийнятні солі” стосуються нетоксичних солей лужних металів, лужноземельних металів, та амонію, які використовуються у фармацевтичній промисловості, включаючи солі натрію, калію, літію, кальцію, магнію, барію, амонію та протамін цинку, одержані відомими у галузі способами. Термін також охоплює нетоксичні кислотні адитивні солі, які загалом одержують реакцією сполук даного винаходу з придатною органічною чи неорганічною кислотою. Представниками таких солей є гідрохлорид, гідробромід, сульфат, бісульфат, ацетат, оксалат, валерат, олеат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, напсилат, тощо. „Фармацевтично прийнятна адитивна сіль” стосується тих солей, які зберігають біологічну ефективність та властивості вільних основ і які не є біологічно чи яким-небудь іншим чином небажаними, і утворені з неорганічними кислотами, такими як соляна кислота, бромисто-воднева кислота, сірчана кислота, азотна кислота, фосфорна кислота, тощо, та органічними кислотами, такі як оцтова кислота, пропіоноа кислота, гліколева кислота, піровиноградна кислота, щавлева кислота, яблучна кислота, малонова кислота, сукцинова кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, мигдальна кислота, метансульфонова кислота, етансульфонова кислота, ртолуолсульфонова кислота, саліцилова кислота, тощо. Для опису фармацевтично прийнятних адитивних кислот як проліків [див. Bundgaard, H.] далі. „Фармацевтично прийнятний естер” стосується тих естерів, які зберігають при гідролізі естерного зв'язку біологічну ефективність та властивості карбонової кислоти або спирту і які не є біологічно чи яким-небудь іншим чином небажаними. Для опису фармацевтично прийнятних естерів як проліків [див. Bundgaard, H., ed., Design of Prodrugs, Elsevier Science Publishers, Amsterdam (1985)]. Ці естери зазвичай утворюються з відповідної карбонової кислоти та спирту. Загалом утворення естеру можна досягти за допомогою звичайних методів синтезу [Див., напр., March, Advanced Organic Chemistry, 4th Ed., John Wiley & Sons, New York (1992), 393-396 та наведені там посилання, та Mark et al., Encyclopedia of Chemical Technology, John Wiley & Sons, New York (1980)]. Спиртовий компонент естеру буде загалом містити (і) С2-С12 аліфатичний спирт, який може або не може включати один або більше подвійних зв'язків та може або не може включати розгалужені вуглеці або (іі) С7-С12 ароматичні чи гетероароматичні спирти. Даний винахід також передбачає застосування тих композицій, які є як естерами, описаними вище, 13 так і в той же час фармацевтично прийнятними кислотними адитивними солями. „Фармацевтично прийнятний амід” стосується тих амідів, які зберігають при гідролізі амідного зв'язку біологічну ефективність та властивості карбонової кислоти або аміну і які не є біологічно чи яким-небудь іншим чином небажаними. Для опису фармацевтично прийнятних амідів як проліків [див. Bundgaard, H., ed., Design of Prodrugs, Elsevier Science Piblishers, Amsterdam (1985)]. Ці аміди зазвичай утворюються з відповідної карбонової кислоти та аміну. Загалом утворення аміду можна досягти за допомогою звичайних методів синтезу. [Див., напр., March, Advanced Organic Chemistry, 4th Ed., John Wiley & Sons, New York (1992), c. 393 та Mark, et al., Encyclopedia of Chemical Technology, John Wiley & Sons, New York (1980]. Даний винахід також передбачає застосування тих композицій, які є як амідами, описаними вище, так в той же час фармацевтично прийнятними кислотними адитивними солями. „Фармацевтично або терапевтично прийнятний носій” стосується середовища носія, яке не впливає на ефективність біологічної активності активних інгредієнтів і які не є токсичними для хазяїна або пацієнта. „Стереоізомер” стосується хімічної сполуки, що має таку ж саму молекулярну масу, хімічний склад, та будову як і інша, але з атомами згрупованими по-іншому. Це означає, що деякі ідентичні хімічні групи розташовані в різних орієнтаціях у просторі і, таким чином, мають можливість обертати площину поляризованого світла. Однак, деякі чисті стереоізомери можуть мати оптичне обертання, яке є настільки слабким, що його неможливо виявити за допомогою сучасних приладів. Сполуки даного винаходу можуть мати один чи більше асиметричних атомів вуглецю і, таким чином, включають різні стереоізомери. Всі стереоізомери знаходяться в межах винаходу. „Терапевтично або фармацевтично ефективна кількість” стосовно композицій даного винаходу стосується кількості композиції, яка є достатньою для створення бажаного біологічного результату. Таким результатом може бути послаблення проявів, симптомів або причин хвороби, або будь-яка інша бажана зміна біологічної системи. У даному винаході результат буде звичайно включати зменшення імунологічних і/або запальних відповідей на інфекцію чи ушкодження тканини. Скороченнями амінокислотних послідовностей є такі: феніланілін - Phe або F; лейцин - Leu або L; ізолейцин - Не або І; метіонін - Met або М; валін Val або V; серин - Ser або S; пролін - Pro або Р; треонін - Thr або Т; аланін - Ala або А; тирозин Туг або Y; гістидин His або Н; Глутамін - Gin або Q; аспарагін - Asn або N; лізин - Lys або К; аспарагінова кислота - Asp або D; глютамінова кислота Glu або Е; цистеїн - Cys або S; триптофан - Тгр або W; аргінін - Arg або R; гліцин - Gly або G. Додатково, t -Buo - це трет-булилокси, Bzl -це бензил, СНА - це циклогексиламін, Ас - це ацетил, Me - це метил, Pen - це пинициламін, Aib - це аміноізомасляна кислота, ТМ - це тієнілаланін, ОВп - це Обензил та hyp -гідроксипролін, 82710 14 Пептидні аналоги зазвичай використовується у фармацевтичній промисловості як не-пептидні ліки з властивостями, аналогічними властивостям тимчасового пептиду. Ці типи не-пептидних сполук називають „пептидміметики” або „пептидні міметики” або „пептидоміметики” [Luthman, et al., A Textbook of Drug Design and Developmnt. 14:386406, 2nd Ed., Harwood Academic Publisshers (1996); Joachim Grante, Angew. Chem. Int. Ed. Engl, 33:1699-1720 (1994); Fauchere, J., Adv.m Drag. Res., 15-29 (1986); Veber and Freidinger TINS, c. 392 (1985); and Evans, et al., J. Med. Chem. 30-1229 (1987)], де вказані джерела включені шляхом посилання). Пептидні міметики структурно схожі на терапевтично придатні пептиди, які можуть бути використані для одержання еквівалентного або підсиленого терапевтичного чи профілактичного ефекту. Загалом пептидоміметики структурно схожі на парадигмовий поліпептид (тобто поліпептид, що має біологічну чи фармакологічну активність), такий як поліпептид природного походження, який є рецептор-зв'язувальним поліпептидом, але який включає один чи більше пептидних зв'язків необов'язково заміщених альтернативним зв'язків, таких як CH2NH-, -CH2S тощо способами, відомими в даній галузі і які описані в нижченаведених джерелах: [Spatola, A. F. в Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, B. Weinstein, eds., Marcel Dekker, New York, c. 267 (1983); Spatola, A, F., Vega Data (March 1983), Vol. 1, Issue 3, Peptide Backbone Modifications (general review); Morley, Trends Pharm. Sci. pp. 463-468 (1980), (general review); Hudson, et. al, Int. J. Pept. Prot. Res., 14:177-185 (1979); Spatola, et. al., Life Sci., 38:1243-1249 (1986); Harm, J. Chem. Soc. Perkin Trans. I. 307-314 (1982); Almquist, et al., J. Med. Chem., 23:1392-1398. (1980); Jennings-White, et al., Tetrahedron Lett. 23:2533 (1982); Szelke, et al., European Appln. EP 45665 (1982); Holladay, et al., Tetrahedron Let., 24:4401-4404 (1983); та Hruby, Life Sci., 31:189-199 (1982)]; де кожне з вказаних джерел включено шляхом посилання. Кращим непептидним зв'язком є CH2NH-. Такі пептидні міметики мають ряд серйозних переваг над використанням поліпептидів, включаючи, наприклад: більш економічне одержання, більшу хімічну стабільність, кращі фармакологічні властивості (період напіврозпаду, поглинання, потенція, ефективність тощо), видозмінену специфічність (наприклад, широкий спектр біологічної активності), знижену антигенність та інші. Маркування пептидоміметиків звичайно передбачає ковалентне зв'язування однієї чи більше міток напряму або за допомогою спейсера (наприклад, амідної групи) до позиції(ій) на пепдидоміметику, яка(і) не викликає перешкод, причому ці місця можна визначити за допомогою кількісних даних структурної активності і/або молекулярного моделювання. Такі позиції, які не завдають перешкод, загалом є позиціями, які не утворюють прямих контактів з макромолекулою(ми) (наприклад, молекулами імуноглобулінової суперсім'ї), з якою(ми) пептидоміметик зв'язується для одержання терапевтичного ефекту. Дериватизація (наприклад, мічення пептидоміметиків не повинна мати значено впливу на бажану 15 біологічну або фармакологічну активність пептидоміметика. Загалом пептидоміметики рецепторзв'язувальних пептидів зв'язуються з рецептором з високим степенем спорідненості та мають біологічну активність, яку можна визначити (тобто, є агоністами чи антагоністами до однієї або більше фенотипових змін, опосередкованих рецептором). Систематична заміна однієї чи більше амінокислот консенсусної послідовності D-амінокислотою того ж типу (напр., D-лізином замість L-лізину) може бути використано для одержання більш стабільних пептидів. На додаток, обмежені пептиди, що містять консенсусну послідовність або в основному ідентичну варіацію консенсусної послідовності можна одержати за допомогою відомих в даній галузі способів [Rizo, et al., Ann. Rev. Biochem., 61:387 (1992)], де вказане джерело включено шляхом посилання); наприклад, шляхом додавання внутрішніх цистеїнових залишків, здатних утворювати міжмолекулярні дисульфідні містки, які циклізують пептид. „Здатна до визначення мітка” стосується матеріалів, які при ковалентному зв'язуванні з пептидними сполуками даного винаходу дозволяють виявлення пептидних сполук in vivo у пацієнта, якому ця пептидна сполука була введена. Здатні до визначення мітки є добре відомими в даній галузі і включають, між іншими, радіоізотопи, флуоресцентні мітки (наприклад, флуоресцин), тощо. Конкретна здатна до визначення мітка не є критичною і її вибирають, приймаючи до уваги кількість мітки, яку будуть використовувати, а також токсичність мітки на кількість використаної мітки. Вибір мітки стосовно вказаних факторів є добре відомим в даній галузі. Ковалентне зв'язування здатної до визначення мітки з пептидною сполукою досягають звичайними методами, які добре відомі в галузі. Наприклад, коли використовують радіоізотоп 125І в якості здатної до визначення мітки, ковалентне зв'язування 125 І з пептидною сполукою можна досягти шляхом включення амінокислоти тирозину в пептидну сполуку з наступним йодуванням пептидної сполуки (див., напр., Weaner, et al., Synthesis and Applications of Isotopically Labelled Compounds, c. 137-140 (1994). Введення тирозину в N чи С- кінцеву частину пептидної сполуки можна досягти відомими у хімії способами. Подібним чином можна на пептидну сполуку ввести 32Р у якості фосфатної групи через, наприклад, гідроксильну групу на пепдидній сполуці за допомогою звичайних методів, відомих у хімії. II. Огляд Даний винахід пропонує пептидні сполуки, які зв'язуються з та активують TPO-R або, інакше, поводять себе як агоніст ТРО. Ці пептидні сполуки включають „основні” пептидні сполуки та „похідні” пептидні сполуки, сконструйовані таким чином, що вини мають схожу чи подібну молекулярну структуру або форму як у основної пептидної сполуки, але які відрізняються від основної пептидної сполуки сприйнятливістю до гідролізу або протеолізу і/або іншими біологічними властивостями, такими як підвищеною спорідненістю до рецептора. Даний винахід також пропонує композиції, які включають 82710 16 ефективну кількість пептидної сполуки та, більш конкретно, пептидної сполуки, яку можна використати для лікування гематологічних розладів і, зокрема, тромбоцитопенії, пов'язаної з хіміотерапією, радіаційної терапією, або трансфузіями кісткового мозку. Було виявлено, що ядро з пептидної сполуки може включати послідовність амінокислот (SEQ ID NО.2): Х9 X8 G Х1 X2 X3 X4 X5 Х6 Х7, де Х6 може являти собою b-(2-нафтил)аланін і де Х9 являє собою А, С, Е, G, I, L, M, P, R, Q, S, Т, чи V; а Х8 являє собою А, С, D, E, K, L, Q, R, S, Т, чи V. Краще, коли Х9 являє собою А або І; і X8 являє собою D, Е або К. Крім того, Х1 являє собою С, L, М, Р, Q, V; Х2 являє собою F, K, L, N, Q, R, S, Т або V; Х3 являє собою С, F, I, L, M, R, S, V або W; Х4 являє собою будь-яку з 20 генетично кодованих Lамінокислот; Х5 являє собою A, D, Е, G, К, М, Q, R, S, Т, V або Y; і Х7 являє собою С, G, I, K, L, M, N, R, aбo V. Однак, як описано далі, було виявлено, що при заміні Х6 b-(2-нафтил)аланіном сполука показує інші властивості, ніж сполука, яка включає (b-(інафтил)аланін. Подібним чином, краще, коли пептид включає амінокислотну послідовність (SEQ ID NO.7): IEGPTLRQ (2-Nal) L A A R (Sar). В іншому варіанті втілення пептидні сполуки даного винаходу являються переважно димеризованими чи олігомеризованими для підвищення спорідненості і/або активності сполук. Приклад кращої димеризованої пептидної сполуки включає, але без обмеження: Де Х10 являє собою саркозин або b-аланіновий залишок (SEQ ID NО:7). Слід відзначити, що один Х10 може являти собою саркозин, а інший залишок може бути b-аланін. Вищевказану структуру можна представити такою структурою: (H-IEGPTLRQ(2Nal)LAARX10)2K-NH2. Кращим варіантом пептидної сполуки є: де (2-Nal) являє собою b-(2-нафтил)аланін і (Sar) являє собою саркозин (SEQ ID NО:7). Ця пептидна сполука далі вживається під назвою „ТРО Сполука №1”. Пептидні сполуки, які мають ІС50 вище ніж приблизно 100mМ характеризуються недостатнім ступенем зв'язування, щоб їх можна було використовувати в діагностичних або терапевтичних аспектах даного винаходу. Краще, коли для діагностичних цілей пептидна сполука має ІС50 приблизно 2mM або менше, а для фармацевтичних цілей – пептидна сполука має ІС50 приблизно 100mM або менше. Фіг.1 порівнює активність трьох різних зразків ТРО Сполуки №1 з одним зразком пептидної сполуки з рівня техніки за допомогою методики стандартних відносних люмінесцентних одиниць. В 17 досліді використовували клітини мишей, інженеровані для стабільної експресії рецептора ТРО людини та конструкцію репортера луциферази, що управлязться fos-промотером. Різниція між ТРО Сполукою №1 та пептидною сполукою з рівня техніки полягала в тому, що пептидна сполука з рівня техніки містила (b-(1-нафтил)аланін (І-Nal), тоді як (2-Nal) був присутній на ТРО Сполуці №1. На Фіг.1 ТРО Сполуки №1 позначена як 2-Nal, а пептидна сполука з рівня техніки позначена як 1-Nal (Рівень Техніки). Як видно на Фіг.1 активність є схожою для кожної сполуки. Фіг.2 порівнює активність кількох різних зразків ПЕГільованої ТРО Сполуки №1 (пегілювання сполук даного винаходу докладно описано далі) з кількома ПЕГільованими зразками пептидної сполуки з рівня техніки. Обидва зразки ПЕГільованої пептидної сполуки з рівня техніки показують високу активність із загалом тим же рівнем активності, що і не ПЕГільована пептидна сполука з рівня техніки. Лінії, що залишились, показують активність різних зразків ПЕГільованої ТРО Сполуки №1. Як видно на Фіг.2 на цій моделі, останні показують меншу активність відносно ПЕГільованих сполук з рівня техніки. На Фіг.2 ПЕГільована ТРО Сполука №1 позначена як PEG-2-Nal, а ПЕГільована пептидна сполука з рівня техніки позначена як PEG-ІNal (Рівень Техніки). Фіг.3 показує відносно потенцію ПЕГільованої пептидної сполуки з рівня техніки та ПЕГільованої ТРО Сполуки №1. На моделі пацюка Фіг.3 показує in-vivo зміну кількості тромбоцитів після введення ПЕГільованої пептидної сполуки з рівня техніки та ПЕГільованої ТРО Сполуки №1. Як видно на Фіг.3, найвища доза ПЕГільованої ТРО Сполуки №1 має ту ж активність, що і найнижча доза ПЕГільованої пептидної сполуки з рівня техніки. Сполука з меншою потенцією може бути менш сильним подразником для цільової клітини, що може знизити ризик побічних ефектів, викликаних надмірним подразненням цільової клітини, таким як загострена тромбоцитопенія після циклу хіміотерапії. На Фіг.3 ПЕГільована ТРО Сполука №1 позначена як PEG-2-Nal, а ПЕГільована пептидна сполука з рівня техніки позначена як PEG-І-Nal (Рівень Техніки). Фіг.4 і 5 показують результати дослідження впритул дозової відповіді ПЕГільованої пептидної сполуки з рівня техніки та ПЕГільованої ТРО Сполуки №1 у звичайних мишей. На Фіг. 4 і 5 ПЕГільована ТРО Сполука No. 1 позначена як PEG-2-Nal, а ПЕГільована пептидна сполука з рівня техніки позначена як PEG-І-Nal (Рівень Техніки). Фіг.4 показує ріст рівня тромбоцитів і Фіг.5 показує середній об'єм тромбоцитів через шість (6) днів після лікування. Доза складала від 10 до 3000ug/kg. Обидві пептидні сполуки збільшували кількість циркулюючих тромбоцитів у залежний від дози спосіб, а збільшення відносно контрольної групи спостерігалось при таких малих дозах як 30ug/kg для обох сполук. При максимальній відповіді ці пептидні сполуки збільшували рівні тромбоцитів до рівнів, які були в 4 рази вищі за контрольні значення. Криві дози-відповіді для цих сполук були дуже схожі, що вказує на те, що в цій моделі між теста 82710 18 ми, які базуються на цих відправних точках, не було значної різниці. IV. Приготування пептидних сполук. А. Синтез у твердій фазі Пептидні сполуки винаходу можна одержати за допомогою класичних способів, відомих у галузі, наприклад, з використанням стандартної методики у твердій фазі. Стандартні способи включають синтез виключно у твердій фазі, методи часткового синтезу у твердій фазі, фрагментну конденсацію, класичний синтез у розчині, та навіть технологію рекомбінантної ДНК. [Див., напр., Merrifield, J.Am.Chem. Soc, 85:2149 (1963)], де вказане джерело включено шляхом посилання. У твердій фазі синтез зазвичай починається від Скінцевої частини пептиду з використанням альфааміно захисної смоли. Придатний вихідний матеріал можна, наприклад, одержати шляхом приєднання альфа-аміно кислоти до хлорметильованої смоли, гідроксиметильної смоли, або бензгідриламінової смоли. Одна з таких хлорметильованих смол є доступною під товарним знаком BIOBEADS SX-1 від компанії Bio Rad Laboratories, Richmond, CA, а приготування гідроксиметильної смоли описали Bodonszky, et al., Chem. Ind. (London), 38:1597 (1966). Бензгідриламінова смола (ВНА) була описана Pietta and Marshall, Chem. Commn., 650 (1970) і вона є комерційно доступною від Beckman Instruments, Inc., Paolo Alto, Calif., у формі гідрохлориду. Таким чином, пептидні сполуки винаходу можуть бути одержані шляхом приєднання альфааміно захисної амінокислоти до хлорметильованої смоли за допомогою, наприклад, каталізатору на основі бікарбонату цезію у відповідності зі способом, описаним Gisin, Helv. Chem. Acta., 56:1467 (1973). Після первісного сполучення альфа-аміно захисну групу вилучають за допомогою ряду реагентів, включаючи розчини трифтороцтової кислоти (TFA) або соляної кислоти (НС1) в органічних розчинниках при кімнатній температурі. Альфааміно захисні групи є групами, відомими для використання у галузі постадійного синтезу пептидів. Вони включають захисні групи ацильного типу (напр., формільну, трифторацетильну, ацетилену), захисні групи типу ароматичного уретану (напр., бензилоксикарбоільні (Cbz) та заміщені Cbz), аліфатичні уретанові захисні групи (напр., tбутилоксикарбонільні (Вос), ізопрпілоксикарбонільні, циклогексилоксикарбонільні) та захисні групи алкільного типу (напр., бензильні, трифенілметильні). Кращими захисними групами є Вос та Fmoc. Захисні групи бічного ланцюга залишаються неушкодженими в процесі приєднання та не відщеплюються під час депротекції кінцевої аміно-групи або під час приєднання. Захисна група на бічному ланцюгу повинна бути здатною до вилучення при завершенні синтезу кінцевого пептиду та в умовах реакції, які не матимуть впливу на цільовий пептид. Захисні групи бічного ланцюга для Туг включають тетрагідропіранільні, трет-бутильні, тритильні, бензильні, Cbz, Z-Br-Cbz та 2,5дихлорибензильні. Захисні групи бічного ланцюга для Asp включають 2,6-дихлорибензильні, метил 19 ьні, етильні та циклогексильні. Захисні групи бічного ланцюга для Thr та Ser включають ацетилені, бензоільні, тритильні, тетрагідропіранільні, бензильні, 2, дихлорбензильні та Cbz. Захисна група бічного ланцюга для Thr та Ser є бензольною. Захисні групи бічного ланцюга для Arg включають нітро, тозильні (Tos), Cbz, адамантилоксикарбоніл мезитоілсульфонільні (Mts) або Вос. Захисні групи бічного ланцюга для Lys включають 2хлорбензилоксикарбонільні (2-Сl-Cbz), 2бромбензилоксикарбонільні (2-BrCbz), Tos або Вос. Після вилучення альфа-аміно захисної групи амінокислоти, що залишились, групують постадійно у бажаному порядку. Надлишок кожної захищеної амінокислоти в основному використовують з придатним активатором карбоксильної групи, таким як дициклогексилкабодіімід (DCC) у розчині, наприклад, у сумішах метиленхлориду (СН2СІ2), диметилформаміду (DMF). Після завершення бажаної амінокислотної послідовності бажаний пептид відщеплюють від смоли-носія шляхом обробки реагентом, таким як трифтороцтова кислота чи фтористий водень (HF), який не тільки відщеплює пептид від смоли, але також відщеплює всі захисні групи бічного ланцюга, що залишились. Коли використовують хлорметильовану смолу, обробка фтористим воднем приводить до одержання вільних пептидних кислот. Коли використовують бенгідриламінову смолу, обробка фтористим воднем приводить до одержання вільного пептидного аміду. Альтернативно, коли використовують хлорметильовану смолу, захисну групу бічного ланцюга можна відщепити за допомогою обробки пептидної смоли аміаком з одержанням бажаного захищеного аміду бічного ланцюга або алкіламіном з одержанням бажаного захищеного алкіламіду чи диалкіламіду бічного ланцюга. Захист бічного ланцюга потім вилучають звичайним способом шляхом обробки фтористим водне з одержанням вільних амідів, алкіламідів або диалкіламідів. Ці способи синтезу пептидів добре відомі у галузі та [описані John Morrow Stewart and Janis Dillaha Young, Solid Phase Peptide Syntheses (2nd Ed., Pierce Chemical Company, 984)]. B. Синтетичні амінокислоти Ці методики також можуть біти використані для синтезу пептидів, у яких амінокислоти, що є іншими, ніж 20, звичайно присутніх, генетично кодованих амінокислот, є заміщеними в позиціях одна, дві чи більше будь-яких сполук даного винаходу. Можна замістити природні бічні ланцюги 20 генетично кодованих амінокислот (або D амінокислот) іншими бічними ланцюгами, наприклад групами, такими як алкіл, нижчий алкіл, циклічний 4-, 5-, 6-, 7-членний алкіл, амід, амід нижчий алкіл, амід ди(нижчий алкіл), нижчий алкокси, гідрокси, карбокси та похідні нижчого естеру та 4-, 5-, 6-, 7членними гетероциклами. Зокрема можна використати аналоги проліну, у якому розмір кільця проліну є зміненим з 5 членів на 4, 6 або 7 члени. Циклічні групи можуть бути насиченими чи ненасиченими і, якщо ненасичені, вони можуть бути ароматичними або неароматичними. Гетеро 82710 20 циклічні групи переважно містять один або більше гетероатомів азоту, кисню і/або сірки. Приклади таких груп включають фуразиніл, фурил, імідазолідиніл, імідазоліл, імідазолініл, ізотіазоліл, ізоксазоліл, морфолініл (наприклад, морфоліно), оксазоліл, піперазиніл (наприклад, 1-піперазиніл), піпериділ (наприклад, 1-піпериділ, піперидіно), піраніл, піразиніл, піразолідиніл, піразолініл, піразоліл, піридазиніл, піриділ, піримідиніл, піролідиніл (наприклад, 1-піролідиніл), піролініл, піроліл, тіадіазоліл, тіазоліл, тієніл, тіоморфолініл (наприклад, тіоморфоліно) та тріазоліл. Ці гетероциклічні групи можуть бути насиченими чи ненасиченими. Коли група є заміщеною, замісник може являти собою алкіл, алкокси, галоген, кисень, або заміщенні чи незаміщений феніл. Пептиди даного винаходу можна легко модифікувати шляхом фосфорилювання [див. напр., W. Bannwarth, et al., Biorganic and Medicinal Chemistry Letters, 6(17):2141-2146 (1996)] та інші способи одержання пептидних похідних сполук даного винаходу [описані в Hruby, et al., Biochem. J., 268(2):249-262 (1990)]. Таким чином, пептидні сполуки винаходу також слугують як основа для одержання пептидних міметиків зі схожою біологічною активністю. C. Модифікації кінцевої групи Фахівці в даній галузі знають, що багато методик можуть бути використані для конструювання пептидних сполук з тією ж чи схожою біологічною активністю, що і відповідна пептидна сполука, але з кращою активність, ніж пептидна сполука, відносно розчинності, стабільності та сприйнятливості до гідролізу та протеолізу. [Див., напр., Morgan, et al., Ann. Rep. Med. Chem., 24:243:252 (1989)]. Далі описуються способи одержання пептидних сполук, модифікованих в N-кінцевій аміногрупі, С-кінцевій карбоксильній групі і/або зміною одного або більше амідних зв'язків в пептиді на не амідний зв'язок. Слід розуміти, що дві чи більше таких модифікацій можуть бути сполучені в структурі однієї пептидної сполуки (наприклад, модифікація на Скінцевій карбоксильній групі та включення –СН2карбаматного зв'язку між двома амінокислотами в пептидній сполуці). 1. Модифікації N-кінцевої групи Звичайно пептидні сполуки синтезують у формі вільної кислоти, але, як зазначено вище, вони можуть бути прямо одержані як амід чи естер. Можна також модифікувати аміно і/або карбокси кінцеву групу пептидних сполук винаходу для одержання інших сполук згідно з винаходом. Модифікації аміно-кінцевої групи включають метилування, ацетилування, додавання бензилоксикарбонільної групи, або блокування аміно-кінцевої групи будь-якою блокуючою групою, яка містить карбоксилатну функціональну групу, позначену як RCOO--, де R вибраний з групи, яка включає нафтил, акридиніл, стероідил та схожі групи. Модифікації карбокси-кінцевої групи включають заміну вільної кислоти групою карбоксаміду чи утворення циклічного лактаму на карбокси-кінцевій групі для введення структурних обмежувачів. Модифікації аміно-кінцевої групи, яка вказано вище, включають алкілування, ацетилування, до 21 давання карбобензоільної групи, утворення сукцинімідної групи, тощо. [Див. Murray, et al., Burger's Medicinal Chemistry and Drug Discovery. 5th ed., Vol. 1, Manfred E. Wolf, ed., John Wiley and Sons, Inc. (1995)]. Більш конкретно N-кінцева груп може брати участь у реакції наступним чином: (a) для утворення амідної групи формули RC(O)NH-, де R визначено вище, шляхом реакції з кислотним галоїдом чи симетричним ангідридом. Звичайно реакцію можна проводити шляхом контактування приблизно еквімолярної або надлишкової кількості (напр., приблизно 5 еквівалентів) кислотного галоїду до пептиду у інертному розчиннику (напр., дихлорметані), який містить надлишок (напр., приблизно 10 еквівалентів) третинного аміну, такого як диізопропілетиламін для вилучення кислоти, що утворюється під час реакції. Умови реакції є звичайними (напр., при кімнатній температурі протягом 30 хвилин). Алкілування кінцевого аміну для N-заміщення нижчим алкілом з наступною реакцією с кислотним галоїдом, яка описано вище, приводить до утворення Nалкіламідної групи формули RC(O)NR-; (b) для утворення сукцинімідної групи шляхом реакції з бурштиновим ангідридом. Як вказано вище, можна використати приблизно еквімолярну кількість або надлишок бурштинового ангідриду (напр., приблизно 5 еквівалентів) і аміногрупу перетворюють в сукцинімід відомими у галузі способами, включаючи використання надлишку (напр., приблизно десять еквівалентів) третинного аміну, такого як диізопропілетиламін у придатному інертному розчиннику (напр., дихлорметані). [Див., напр., Wollenberg, et al., US Pat. No. 4612132], який включено шляхом посилання. Зрозуміло, що сукцинова група може бути заміщена, наприклад, алкілом або -SR замісниками, які можна одержати у звичайний спосіб, для одержання заміщеного сукциіміду на N-кінцевій групі пептиду. Такі алкільні замісники одержують реакцією нижчого олефіну з малеїновим ангідридом у спосіб, описаний Wollenberg, et al., вище, a -SR замісники можна одержати реакцією RSH з малеїновим ангідридом, де R визначено вище; (c) для утворення бензилоксикарбонілої-NHабо заміщеної бензилоксикарбонілої-NH- групи шляхом реакції з приблизно еквівалентною кількістю або надлишком CBZ-СІ (тобто бензилоксикарбоніл хлоридом), або заміщеним CBZ-СІ у придатному інертному розчиннику (напр., дихлорметані), який переважно містить третинний амін для вилучення кислоти, яка утворюється в ході реакції; (d) для утворення сульфонамідної групи шляхом реакції з еквівалентною кількістю або надлишком (наприклад, 5 еквівалентів) R-S(O)2Cl у придатному інертному розчиннику (напр., дихлорметані) для перетворення кінцевого аміну у сульфонамід, де R визначено вище. Краще, коли інертний розчинник містить третинний амін (напр., десять еквівалентів), такий як диізопропілетиламін, для вилучення кислоти, яка утворюється в ході реакції. Умови реакції є звичайними (напр., при кімнатній температурі протягом 30 хвилин); (є) для утворення карбаматної групи шляхом реакції з еквівалентною кількістю або надлишком 82710 22 (напр., 5 еквівалентів) R-ОС(О)2Сl або RОС(О)ОС6Н4 -pNO2 у придатному інертному розчиннику (напр., дихлорметані) для перетворення кінцевого аміну у карбамат, де R визначено вище. Краще, коли інертний розчинник містить третинний амін (напр., приблизно 10 еквівалентів), такий як диізопропілетиламін, для вилучення кислоти, яка утворюється в ході реакції. Умови реакції є звичайними (напр., при кімнатній температурі протягом 30 хвилин); (f) для утворення сечовинної групи шляхом реакції з еквівалентною кількістю або надлишком (напр., 5 еквівалентів) R-N =С = у придатному О інертному розчиннику (напр., дихлорметані) для перетворення кінцевого аміну у сечовинну (напр., RNHC(O)NH-) групу, де R визначено вище. Краще, коли інертний розчинник містить третинний амін (приблизно 10 еквівалентів), такий як диізопропілетиламін, для вилучення кислоти, яка утворюється в ході реакції. Умови реакції є звичайними (напр., при кімнатній температурі протягом 30 хвилин). 2. Модифікації С-кінцевої групи В одержанні пептидних сполук, де С-кінцеву групу заміщують естером (таким як -C(O)OR, де R визначено вище), використовують смоли, використані для одержання пептидних кислот і пептид, захищений бічним ланцюгом, розщеплюють основою та придатним спиртом, наприклад, метанолом. Захисні групи бічного ланцюга потім вилучають у звичайний спосіб обробкою фтористим воднем для одержання бажаного естеру. В одержанні пептидних сполук, де С-кінцеву карбоксильну групу заміщують амідом -C(O)NR3R4 в якості твердого носія для синтезу пептиду використовують бензгідриламінову смолу. Після закінчення синтезу обробка фтористим воднем для вивільнення пептиду з носія приводить безпосередньо до одержання вільного пептидного аміду (тобто С-кінцева група є -C(O)NH2). Альтернативно, використання хлорметильованої смоли у синтезіпептиду в поєднанні з реакцією з аміаком для відщеплення пептиду, захищеного бічним ланцюгом, від носія приводить до одержання вільного пептидного аміду і реакція з алкіламіном або диалкіламіном дає алкіламід або диалкіламід, захищений бічним ланцюгом (тобто С-кінцева група являє собою C(O)NRR1, де R та R1 визначені вище. Бічний ланцюговий захист потім вилучають у звичайний спосіб шляхом обробки фтористим воднем для одержання вільних амідів, алкіламідів або диалкіламідів. Можна також циклізувати пептидні сполуки даного винаходу, або включити залишок дезаміноабо дезкарбокси- залишок у кінцеві групи пептидної сполуки, таким чином, що не стане кінцевої аміно чи карбоксильної групи, що знижує сприйнятливість до протеаз або обмежує конформацію пептидної сполуки. С-кінцеві функціональні групи пептидних сполук даного винаходу включають амід, нижчий алкіл, амід ди(нижчий алкіл), нижчий алкокси, гідрокси, та корбокси і їх похідні нижчого естеру та їх фармацевтично прийнятні солі. На додаток до вищевказаних модифікацій С-кінцевих та N-кінцевих груп пептидні сполуки даного вина 23 ходу, включаючи пептидоміметики, можна краще модифікувати одним чи більше різноманітними гідрофільними полімерами або ковалентно зв'язувати з ними. Виявлено, що пептидні сполуки дериватизуються гідрофільним полімером, їх розчинність та періоди циркуляційного напіврозпаду збільшуються та їх імуногенність маскується. Вищевказане можна досягти за рахунок невеликого, якщо воно і буде, послаблення зв'язувальної активності. Небілкові полімери, придатні для застосування у відповідності з даним винаходом, включають, але це обмежуючись, поліалкілетери, прикладами яких є поліетиленгліколь та поліпропіленгліколь, полімолочна кислота, полігліколева кислота, поліоксиалкени, полівініловий спирт, полівінілпіролідон, целюлоза та похідні целюлози, декстран та похідні декстрану, тощо. Загалом такі гідрофільні полімери мають середню молекулярну масу від приблизно 500 до приблизно 100000 дальтон, краще - від приблизно 2000 до приблизно 40000 дальтон, ще краще від приблизно 5000 до приблизно 20000 дальтон. В переважних варіантах втілення такі гідрофільні полімери мають середню молекулярну масу приблизно 5000 дальтон, 10000 дальтон і 20000 дальтон. Пептидні сполуки винаходу можуть бути дериватизовані чи сполучені з такими полімерами, використовуючи способи, які [описали Zallipsky, S., Bioconjugate Chem., 6:150-165 (1995); Monfardini, C. et al., Bioconjugate Chem., 6:62-69 (1995); US Pat. No. 4640835; US Pat. No. 4496689; US Pat. No. 4301144; US Pat. No. 4670417; US Pat. No. 4791192; US Pat. No. 4179337 або WO 95/34326], де всі вказані джерела наведені шляхом посилання. У переважному варіанті втілення пептидні сполуки даного винаходу дериватизують поліетиленгліколем (PEG). PEG являє собою лінійний водорозчинний полімер з ланками оксиду етилену, що повторюються, та з двома кінцевими гідроксильними групами. Полімери PEG класифікують за їх молекулярною масою, яка зазвичай варіює від приблизно 500 дальтон до приблизно 40000 дальтон. У кращому варіанті втілення використовують полімери PEG з молекулярною масою, яка варіює від приблизно 5000 дальтон до приблизно 20000 дальтон. Полімери PEG, які сполучають з пептидними сполуками даного винаходу можуть бути розгалуженими та нерозгалуженими [Див., напр., Monfardini, C. et al., Bioconjugate Chem., 6:62-69 (1995)]. Полімери PEG можна одержати від Shearwater Polymers, Inc. (Huntsville, Ala.) (зараз частина Nektar Therapeutics (San Paolo, CA), Sigma Chemical Co. та інших компаній. Такі полімери PEG включають, але без обмеження, монометоксипо ліетил енгліколь (MePEG-OH), монометоксиполіетиленгліко ль-сукцинат (MePEG-S), монометоксипо ліетил енгліко ль-сукцинімідилсукцинат (MePEG-SNHS), монометоксиполіетиленглікольамін (MePEG-NH2), монометоксиполіетиленглікольтрезилат (MePEG-TRES) та монометоксиполіетиленглікольімідізазоліл-карбоніл (MePEG-IM). Стисло, в одному варіанті втілення гідрофільний полімер, який використовують, наприклад, PEG, переважно містить на одному кінці привиту 82710 24 нереакційноздатну групу, таку як метокси-чи етокси-групу. Після цього полімер активується на іншому кінці шляхом реакції з придатним активуючим агентом, таким як галоїдціани (наприклад, ціанхлорид, бромід чи фторид), діімадозол, ангідридний реагент (наприклад, дигалосукциновий ангідрид, такий як дибромсукциновий ангідрид), ацилазид, р-діазоніумбензиловий етер, 3-(рдіазоніумфенокси)-2-гідроксипропіловий етер), тощо. Активований полімер потім вступає в реакцію з пептидною сполукою даного винаходу для одержання пептидної сполуки, дериватизованої полімером. Альтернативно, функціональна група в пептидних сполуках винаходу може бути активована для реакції з полімером, або дві групи можуть бути приєднані в узгодженій реакції сполучення з використання відомих способів зв'язування. Високо оцінюється, що пептидні сполуки даного винаходу можна дериватизувати PEG, використовуючи міріади інших реакційних схем, які відомі та використовуються фахівцями в даній галузі. Коли пептидні сполуки дериватизують гідрофільним полімером, їх розчинність та періоди циркуляційного напіврозпаду збільшуються, а їх імуногенність зменшується. Вищенаведене може бути досягнуте при невеликій, якщо вона і буде, втраті біологічної активності. У переважних варіантах втілення дериватизовані пептиди мають активність, яка становить 0,1-0,01-кратну активність від активності немодифікованих пептидів. В переважних варіантах дериватизовані пептиди мають активність, яка становить 0,1-1-кратну активність від активності немодифікованих пептидів. В ще кращих варіантах втілення дериватизовані пептиди мають активність, яка перевищує активність не модифікованих пептидів. D. Модифікації основного ланцюга Інші способи одержання пептидних похідних сполук даного винаходу [описані в Hruby, et al., Biochem J., 268(2):249-262 (1990)], де вказане джерело наводиться шляхом посилання. Таким чином, пептидні сполуки винаходу також слугують як структурні моделі для непептидних сполук зі схожою біологічною активністю. Фахівці у галузі знають, що для конструювання пептидів з такою ж чи схожою бажаною біологічною активністю, що і основна пептидна сполука, стосовно розчинності, стабільності та сприйнятливості щодо гідролізу та протеолізу, існує широкий спектр методик. [Див. Morgan, et al., Ann. Rep. Med. Chem., 24:243-252 (1989)], де вказане джерело включено шляхом посилання. Ці методики включають заміну пептидного основного ланцюга основним ланцюгом, що складається з фосфонатів, амідатів, карбаматів, сульфонамідів, вторинних амідів та Nметиламінових кислот. Придатні реагенти включають, наприклад, амінокислотні аналоги, де карбоксильна група амінокислоти була заміщена групою, придатною для утворення одного з вищевказаних зв'язків. Подібно заміна амідо-зв'язку в пептиді фосфонатним зв'язком може бути здійснена згідно зі способом, [описаним в US Pat. Nos. 5359115 та 5420328], де обидва джерела включені шляхом посилання на їх зміст. 25 E. Утворення дисульфідного зв'язку Сполуки даного винаходу можуть існувати у циклізованій формі з міжмолекулярним дисульфідним зв'язком між тіоловими групами введених цистеїнів, якщо присутні. Альтернативно, міжмолекулярний дисульфідний зв'язок між тіоловими групами цистеїнів можна одержати для виходу димерної (чи високо олігомерної) сполуки. Один чи більше цистеїнових залишків може бути заміщений гомоцистеїном. V. Придатність Пептидні сполуки винаходу придатні in vitro як унікальні інструменти для розуміння біологічної ролі ТРО, включаючи оцінку багатьох факторів, які, як гадають, впливають на процес продукування ТРО та процес зв'язування рецептора та піддаються впливу. Дані пептидні сполуки також корисні у розвитку інших сполук, які зв'язуються з та активують TPO-R, оскільки дані пептидні сполуки надають важливу інформацію про відношення між структурою та активністю, яке буде прискорювати такий розвиток. Пептидні сполуки також корисні як конкурентні зв'язуючі в дослідах по скринінгу нових агоністів рецептора ТРО. У таких дослідах пептидні сполуки даного винаходу можуть бути використані різними способами; наприклад, шляхом мічення, такого як ковалентне чи не ковалентне приєднання групи, яка прямо чи непрямо надає здатний до визначення сигнал. У будь-якому з цих дослідів матеріал може бути міченим прямо або непрямо. Можливості для прямого мічення включають мічені групи, такі як: радіомітки, такі як 1 І, ферменти (US Pat. No. 3645090), такі як пероксидаза та лужна фосфатаза, та флуоресцентні мітки (US Pat. No. 3940475), які здатні проводити моніторинг флуоресцентної інтенсивності, зсуву довжини хвилі або флуоресцентної поляризації. Можливості для непрямого мічення включають біотінулування одного компонента з наступним зв'язуванням з авідином, сполученим з однією групою вищевказаної мітки. Пептидні сполуки можуть такою включати спейсери чи лінкери у випадках, коли пептидні сполуки необхідно з'єднати з твердим носієм. Більш того, на основі своєї здатності зв'язуватись з ТРО рецептором пептидні сполуки даного винаходу можуть бути використані як реагенти для визначення ТРО рецепторів на живих клітинах, фіксованих клітинах, у біологічних рідинах, у тканинних гомогенатах, в очищених, природних біологічних матеріалах, тощо. Наприклад, шляхом мічення таких пептидних сполук можна ідентифікувати клітини, які містять TPO-R на своїй поверхні. Додатково, на основі своєї здатності зв'язуватись з ТРО рецептором пептидні сполуки даного винаходу можуть бути використані в in situ забарвленні, FASC (флуоресцентно-активованому клітинному сортуванні), вестерн-блоттингу, ELISA, тощо. На додаток, на основі своєї здатності зв'язуватись з ТРО рецептором пептидні сполуки даного винаходу можуть бути використані в очищенні рецептора, або в очищенні клітин, які експресують ТРО рецептори на поверхні клітини (чи всередині, здатних до проникнення, клітин) 82710 26 Пептидні сполуки даного винаходу також можуть бути використані як комерційні реагенти для різноманітних медичних дослідницьких та діагностичних цілей. Такі застосування включають, але без обмеження: (1) застосування як калібрувального стандарту для кількісного визначення кандидату агоністів ТРО в різноманітних функціональних дослідах; (2) застосування для підтримання проліферації та росту ТРО-залежних клітинних ліній; (3) застосування у структурному аналізі ТРО-рецептора через спільну кристалізацію; (4) застосування для дослідження механізму сигналу трансдукції/активації рецептора; (5) інші дослідницькі та діагностичні застосування, де ТРО-рецептор є переважно активованим або така активація є зручно калібрована відносно відомої кількості ТРО агоніста, тощо. Пептидні сполуки даного винаходу можуть використовуватись для in vitro експансії мегакаріоцитів та їх комітованих прогеніторів, обидва в сполучені з додатковими цитокінами або на їх самих. [Див., напр., DiGuisto, et al, публікація РСТ 95/05843], де вказане джерело наведено шляхом посилання. Хіміотерапія та радіаційна терапія викликають тромбоцитопенію знищенням більш зрілої популяції мегакаріоцитів, які швидко розмножуються. Однак, такі методи терапевтичного лікування можуть також зменшити число та життєву здатність незрілих, менш мітотично активних мегакаріоцитних клітин-попередників. Таким чином, послаблення тромбоцитопенії ТРО чи пептидними сполуками даного винаходу може бути прискорено у пацієнтів після хіміотерапії чи радіаційної терапії популяцією його чи її власних клітин, збагачених мегакаріоцитами та незрілими попередниками, використовуючи in vivo культуру. Пептидні сполуки винаходу можуть також вводитись теплокровним тваринам, включаючи людей, для активації TPO-R in vivo. Таким чином, даний винахід охоплює методи терапевтичного лікування захворювань, пов'язаних з ТРО, які включають введення пептидної сполуки згідно з винаходом в кількостях, достатніх для імітації ефекту ТРО на TPO-R in vivo. Наприклад, пептидні сполуки даного винаходу можуть вводитись для лікування різноманітних гематологічних розладів, включаючи, але без обмеження тромбоцитні розлади та тромбоцитопенію, зокрема пов'язану з трансфузіями кісткового мозку, радіаційною терапією та хіміотерапією. У деяких втіленнях винаходу переважними є антагоністи ТРО, які спершу вводять пацієнтам, яких піддавали радіаційній терапії або хіміотерапії, з наступним введенням агоністів ТРО згідно з винаходом. Активність пептидних сполук даного винаходу можна розрахувати як in vitro, так і in vivo в одній в багатьох моделей, [описаних McDonald, Am. J. of Pediatric Hematology/Oncology, 14:8-21 (1992)], де вказане джерело наведено шляхом посилання. Згідно з одним варіантом втілення, композиції даного винаходу корисні для лікування тромбоцитопенії, пов'язаної з трансфузіями кісткового мозку, радіаційною терапією або хіміотерапією. Пептидні сполуки зазвичай будуть вводитись з профілактичною методою до хіміотерапії, радіа 27 ційної терапії чи трансплантації кісткового мозку або після такого лікування. Відповідно, даний винахід також пропонує фармацевтичні композиції, які включають як активний інгредієнт принаймні одну з пептидних сполук винаходу в поєднанні з фармацевтичним носієм чи розріджувачем. Пептидні сполуки даного винаходу можуть вводитись орально, пульмонарно, парентерально (шляхом внутрішньом'язової, внутрішньочеревинної, внутрішньовенної (IV), чи підшкірної ін'єкції), шляхом інгаляції (за допомогою порошкоподібних композицій), трансдермальним, назальним, вагінальним, ректальним або сублінгвальним шляхом введення і можуть комбінуватись у дозованих формах для кожного способу введення. Див, напр. Bernstein, et al., [патентна публікація РСТ No. WO/25221; Pitt, et al., патентна публікація РСТ No. WO/17784; та Pitt, et al.], заявка на видачу Європейського патенту 613683, де кожне джерело включено шляхом посилання. Тверді дозовані форми для орального введення включають капсули, таблетки, пігулки, порошки та гранули. У твердих дозованих формах активну пептидну сполуку змішують з принаймні одним фармацевтично прийнятним носієм, таким як цукроза, лактоза, чи крохмаль. Такі дозовані форми можуть також містити, оскільки це є нормальною практикою, додаткові речовини, інші, ніж інертні розчинники, напр., змащувальні агенти, такі як стеарат магнію. У випадку капсул, таблеток та пігулок дозовані форми можуть такою містити буферні агенти. Таблетки та пігулки можуть бути приготовані з додатковим ентеросолюбільним покриттям. Рідкі дозовані форми для орального введення включають фармацевтично прийнятні емульсії, розчини, суспензії, сиропи з еліксирами, що містять інертні розчинники, які звичайно використовують у галузі, такі як вода. Окрім таких інертних розчинників, композиції можуть також включати ад'юванти, такі як змочувальні агенти, емульгувальні та суспедуючі агенти та підсолоджувачі, ароматизатори та агенти для покращення запаху. Композиції згідно з винаходом для парентерального введення включають стерильні водні чи неводні розчини, суспензії або емульсії. Прикладами неводних розчинників або носіїв є пропіленгліколь, поліетиленгліколь, рослині олії, такі як оливкова олія та кукурудзяна олія, желатин, та придатні для ін'єкції органічні естери, такі як етиловий олеат. Такі дозовані форми можуть також містити ад'юванти, такі як консерванти, змочувальні агенти, емульгувальні та диспергуючі агенти. Вони також можуть бути стерилізовані, наприклад, фільтрацією крізь фільтр, який затримує бактерії, шляхом введення у композиції стерилізуючих агентів, шляхом опромінення композицій, або нагріванням композицій. Вони також можуть приготовані, використовуючи стерильну воду або деякі інші стерильні середовища, придатні для ін'єкцій безпосередньо перед використанням. Композиції для ректального або вагінального введення переважео являють собою супозиторії, які можуть включати на додаток до активної сполуки ексціпієнти, такі як кокосове масло або супозиторний віск. Композиції для назального чи сублінгвального введення також одержу 82710 28 ють зі стандартними ексціпієнтами, які добре відомі у галузі. Композиції, що містять пептидні сполуки, можуть вводитись для профілактичного і/або терапевтичного лікувань. У терапевтичному застосуванні композиції вводять пацієнту, який страждає на вищеописане захворювання, у кількості достатній для лікування або принаймні часткового пригнічення симптомів захворювання та його ускладнень. Кількість, яка є адекватною для досягнення цього, позначається як „терапевтично ефективна доза”. Кількості, які є ефективними для такого застосування, будуть залежати від складності захворювання та ваги і загального стану пацієнта. Композиції винаходу також можуть бути мікрокапсульовані, наприклад, за способом Тісе та Bibi [в Treatise on Controlled Drug Delivery, ed. A. Kydonieus, Marcel Dekker, New York (1992), c.315339]. Для профілактичних використань композиції, що містять пептидні сполуки винаходу, вводять пацієнту, який є сприйнятливим до, або іншим чином має ризик захворіти на таке захворювання. Така кількість є „профілактично ефективною дозою”. У такому використанні точні кількості знову залежать від стану здоров'я пацієнта та ваги. Кількості пептидної сполуки, необхідні для ефективної терапії будуть залежати від різних факторів, включаючи способи введення, цільове місце, фізіологічний стан пацієнта, та інші медикаменти, які вводять пацієнту. Таким чином лікувальні дози повинні бути титровані для оптимізації безпеки та ефективності. Зазвичай дози, які використовують in vitro, можуть бути використані для створення корисного довідника стосовно тих кількостей, які є корисними для in situ введення цих реагентів. Тестування на тваринах ефективних доз для лікування певних захворювань надасть подальшу передбачувану вказівку на дозу для людини. Різноманітні підходи описані, напр. в Gilman, et al., (eds.), Goodman and Gilman's: The Pharmacological Basis of Therapeutics, 8th ed., Pergamon Press (1990); та Remington's Pharmaceutical Sciences, 7th Ed., Mack Publishing Co., Easton, Pa (1985); де кожне з вказаних джерел наведено шляхом посилання. Пептидні сполуки даного винаходу, ефективні для лікування станів, опосередкованих ТРО, коли вони вводяться в дозі від приблизно 0,001 до приблизно 10 мг/кг ваги тіла. Конкретна доза регулюється конкретним станом, який піддають лікуванню, способу введення, а також висновком лікуючого лікаря, зробленого на основі таких факторів як важкість захворювання, вік та загальний стан пацієнта, тощо. Приклад 1 Синтез у твердій фазі Пептидні сполуки даного винаходу можуть бути синтезовані, наприклад, використовуючи методику синтезу Мерріфілда (Merrifield) у твердій фазі (див. Steward and Young, Solid Phase Peptide Synthesis, 2d. edition, Pierce Chemical, Rockford, III. (1984) and Merrified, J. A. Chem. Soc, 85:2149 (1963)) або пептидний синтезатор Applied Biosystems Inc. Model 431А або 433А. Пептидні 29 сполуки можуть бути складені, використовуючи стандартні протоколи Applied Biosystems Inc. Synth Assist™ 1.0.0 або Synth Assist™ 2.0.2. Кожне з'язування може бути здійснено для 2-х 30хв. з HBTU (2-(1H-бензотріазол-1-іл)-1,1,3,3тетраметилуронійгексафторфосфатом) та HOBt (1-гідроксибензотріазолом). Використана смола являла собою смолу НМР (ргідроксиметилфеноксиметил)полістирольну смолу або PAL (Milligen/Bioserch), яка являла собою полістирольну смолу, зшиту 5-(4'-Fmос-амінометил3,5'-диметоксифенокси)валеріановою кислотою як лінкером. Застосування смоли PAL приводить до одержання аміду з карбоксильною кінцевою групою з функціональністю при відщепленні пептиду від смоли. При відщепленні смола НМР утворює групу карбонової кислоти на С-кінцевій групі кінцевого продукту. Більшість реагентів, смоли та захищені амінокислоти (вільні або на смолі) можна одержати від МШіроге або Applied Biosystems Inc. Група Fmoc може бути використана для захисту аміногрупи в процесі приєднання. Захист первинної аміногрупи на амінокислотах можна досягти за допомогою групи Fmoc та захисних груп бічного ланцюга, таких як t-бутилової для серину, тирозину, глютамінової кислоти та треоніну; тритилової для глютаміну; РМС(2,2,5,7,8-пентаметилхроман6-сульфонільної) для аргініну; N-tбутоксикарбонільної для триптофану; Nтритильної для гістидину та S-тритильної для цистеїну. Вилучення пептидних сполук зі смоли та одночасну депротекцію функціональних груп бічного ланцюга можна досягти шляхом обробки реагентом К чи незначними її модифікаціями. Альтернативно, в синтезі цих пептидів з амідованою карбоксильною групою повністю сконструйований пептид можна розщепити сумішшю 90% трифтороцтової кислоти, 5% етандітіолу та 5% води, спочатку при 4°С, а потім з поступовим підвищенням температури до кімнатної. Пептидні сполуки після депротеції можна осаджувати за допомогою діетилового етеру. Очищення може бути препаративним, з використанням зворотної фази, за допомогою високоефективної рідинної хроматографії на С18 зв'язаній силікагелевій колонці з градієнтом ацетонітрил/вода в 0,1% трифтороцтовій кислоті. 82710 30 Гомогенні пептидні сполуки можуть бути охарактеризовані за допомогою мас-спектрометрії бомбардування швидкими атомами або масспектрометрії електророзсіювання та амінокислотного аналізу, де він прийнятний. У кращому варіанті втілення пептидні сполуки даного винаходу є димеризованими із застосуванням стандартних синтетичних методик, які відомі та використовуються у галузі. За цими синтетичними схемами фахівці у даній галузі можуть без труднощів одержати димерні пептидні сполуки згідно з даним винаходом. Додатково, для фахівців у галузі зрозуміло, що димерні субодиниці можуть бути сполучені за допомогою відомих методик та лінкерів. Приклад 2 Пегілювання пептидних сполук Пегілювання пептидної сполуки даного винаходу можна здійснити за допомогою відомих методик. Наприклад, пептидну сполуку згідно з винаходом можна розчинити в 100mМ біцину рН 8,0 у концентрації 10мг/мл, який додають до 1,25 кратного молярного надлишку порошкоподібного PEG2 (комерційно доступного від Shearwater Polymers, Inc. (Huntsville, Ala.)), та перемішувати при кімнатній температурі до завершення реакції, що звичайно складає 1-2 години. За реакцією здійснюють моніторинг за допомогою зворотної фази HPLC (високоефективної рідинної хроматографії), використовуючи 40-65% аценонітрильний градієнт з колонкою YMC ODS AQ. Після завершення реакції розчин додають до другого порошкоподібного PEG2 з 1,25 молярним надлишком і процес повторюють 4 рази, застосовуючи 5 молів PEG2 на кожний моль поліпептиду. Розчин розводять 2кратним PBS для зниження в'язкості та завантажують у колонку Superdex 200 (Pharmacia), заздалегідь урівноважену та елюйовану PBS. Фракції, що містять ди-РЕО-пептидну сполуку, яка елюює спочатку до будь-якої моно-PEG-пептидної сполуки, можна об'єднати та зберігати при 5°С або ліофілізувати. Хоча докладно були описані лише кращі варіанти втілення винаходу, цілком зрозуміло, що можливі модифікації та варіації винаходу, не виходячи за суть та обсяг даного винаходу. 31 Комп’ютерна верстка Н. Лисенко 82710 Підписне 32 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Автори англійськоюMACDONALD BRIAN R, WEIS JEFFERY KENNETH, YURKOW EDWARD JOHN
Автори російськоюМакДональд Брайен Ар, Вейс Джеффри Кеннет, Юрков Эдвард Джон
МПК / Мітки
МПК: A61K 38/03, C07K 7/00, A61P 7/00
Мітки: рецептором, пептид, зв'язується, лікування, спосіб, варіанти, тромбопоетиновим, тромбоцитопенії
Код посилання
<a href="https://ua.patents.su/16-82710-peptid-shho-zvyazuehtsya-z-trombopoetinovim-receptorom-varianti-ta-sposib-likuvannya-trombocitopeni-varianti.html" target="_blank" rel="follow" title="База патентів України">Пептид, що зв’язується з тромбопоетиновим рецептором (варіанти), та спосіб лікування тромбоцитопенії (варіанти)</a>