Заміщені 2-карбоніламіно-6-піперидинамінопіридини та заміщені 1-карбоніламіно-3-піперидинамінобензоли як агоністи 5-ht1f
Номер патенту: 82711
Опубліковано: 12.05.2008
Автори: Ксу Яо-Ченг, Бланко-Пілладо Марія-Джізус, Гудзяк Кевін Джон, Віктор Франтц, Чжан Деї, Філла Сандра Енн, Бенеш Дейна Рей, Матез Брайан Майкл, Колмен Деніел Тімоти, Захерл ДіАнна П'ятт, Коуен Майкл Філіп, Їнь Бей-Пінь
Формула / Реферат
1. Сполука формули І:
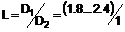 I
I
або фармацевтично прийнятна сіль такої сполуки з кислотою, де:
X є -C(R3c)= або -N=;
R1 є С2-С6-алкіл, заміщений С2-С6-алкіл, С3-С7-циклоалкіл, заміщений С3-С7-циклоалкіл, феніл, заміщений феніл, гетероцикл або заміщений гетероцикл;
R2 є водень, н-С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3-алкіл або група формули II
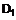 II,
II,
за умови, що, коли R1 є С2-С6-алкіл або заміщений С2-С6-алкіл, R2 є водень або метил;
R3a, R3b і, якщо X є -C(R3c)=, R3c незалежно один від одного є водень, фтор або метил, за умови, що не більше ніж один із замісників R3a, R3b та R3c може бути відмінним від водню;
R4 є водень або С1-С3-алкіл;
R5 є водень, С1-С3-алкіл або С3-С6-циклоалкілкарбоніл, за умови, що, коли R3a є відмінним від водню, R5 є водень;
R6 є водень або С1-С6-алкіл; і
n є ціле число від 1 до 6 включно.
2. Сполука за п. 1, де R4 є водень.
3. Сполука за п. 1 або п. 2, де R3a, R3b і, якщо X є -C(R3c)=, R3c незалежно один від одного є водень або фтор, за умови, що не більше ніж один із замісників R3a, R3b та R3c може бути відмінним від водню.
4. Сполука за будь-яким із пп. 1-3, де R5 є водень або метил.
5. Сполука за будь-яким із пп. 1-4, де R2 є водень або метил.
6. Сполука за будь-яким із пп. 1-5, де R1 є феніл, заміщений феніл, гетероцикл або заміщений гетероцикл.
7. Сполука за будь-яким із пп. 1-5, де R1 є феніл, заміщений феніл, гетероцикл або заміщений гетероцикл, причому гетероцикл вибраний з групи, яку складають фураніл, тіофеніл, піроліл, піролідиніл, піридиніл, N-метилпіроліл, оксазоліл, ізоксазоліл, піразоліл, імідазоліл, триазоліл, оксадіазоліл, тіадіазоліл, тіазоліл, тіазолідиніл, N-ацетилтіазолідиніл, піримідиніл, піразиніл, піридазиніл, ізохінолініл, бензоксазоліл, бензодіоксоліл, бензотіазоліл, хінолініл, бензофураніл, бензотіофеніл та індоліл; і
причому "заміщений феніл" та "заміщений гетероцикл" означають, що згаданий циклічний фрагмент:
(і) заміщений галогенами в кількості від одного до трьох; або
(іі) заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, яку складають галоген, С1-С4-алкіл, С1-С4-алкоксигрупа, С1-С4-алкілтіогрупа, ціаногрупа та нітрогрупа, причому кожний алкіл, алкоксигрупа та алкілтіогрупа можуть бути додатково заміщені незалежно С1-С4-алкоксигрупою або 1-5 атомами галогенів, вибраних із групи, яку складають фтор та хлор; або
(iiі) заміщений одним замісником, вибраним з групи, яку складають фенілоксигрупа, бензилоксигрупа, фенілтіогрупа, бензилтіогрупа та піримідинілоксигрупа, причому ці фенілоксигрупа, бензилоксигрупа, фенілтіогрупа, бензилтіогрупа або піримідинілоксигрупа можуть бути додатково заміщені одним або двома замісниками, вибраними з групи, яку складають галоген, С1-С2-алкіл та С1-С2-алкоксигрупа, де кожний алкіл та алкоксигрупа можуть бути додатково заміщені 1-3 атомами фтору; або
(iv) заміщений одним замісником, вибраним з групи, яку складають С1-С4-ацил та С1-С4-алкоксикарбоніл, і факультативно додатково заміщений одним замісником, вибраним із групи, яку складають галоген, С1-С4-алкіл, С1-С4-алкоксигрупа та С1-С4-алкілтіогрупа, причому кожний алкіл, алкоксигрупа та алкілтіогрупа можуть бути додатково заміщені 1-3 атомами фтору.
8. Сполука за п. 7, де R1 є феніл, заміщений феніл, гетероцикл або заміщений гетероцикл, де гетероцикл вибраний з групи, яку складают фураніл, тіофеніл, піроліл, піридиніл, N-метилпіроліл, піримідиніл, піразиніл, індоліл, бензофураніл, бензотіофеніл, бензодіоксоліл та тіазолідиніл; і
термін "заміщений" означає, що згаданий циклічний фрагмент:
(і) заміщений галогенами в кількості від 1 до 3; або
(іі) заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, яку складають галоген, С1-С4-алкіл, С1-С4-алкокси-, С1-С4-алкілтіо-, ціано- та нітрогрупа, причому кожний алкіл, алкокси- та алкілтіогрупа можуть бути додатково заміщені 1-5 атомами фтору.
9. Сполука за п. 7, де R1 є феніл, заміщений феніл, гетероцикл або заміщений гетероцикл, де гетероцикл вибраний з групи, яку складають піридиніл, тіофеніл та фураніл; і
термін "заміщений феніл" означає, що згаданий циклічний фрагмент:
(і) заміщений галогенами в кількості від 1 до 3; або
(іі) заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, яку складають галоген, метил, метоксигрупа, трифторметил, трифторметоксигрупа та ціаногрупа; і
термін "заміщений гетероцикл" означає, що згаданий циклічний фрагмент заміщений одним атомом галогену.
10. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-9 та фармацевтичний носій, розріджувач або наповнювач.
11. Спосіб активації рецепторів 5-НТ1F в організмі ссавця, який включає введення в організм ссавця, що потребує такої активації, ефективної кількості сполуки формули І:
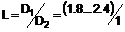 I
I
або фармацевтично прийнятної солі такої сполуки з кислотою, де:
X є -C(R3c)= або -N=;
R1 є С2-С6-алкіл, заміщений С2-С6-алкіл, С3-С7-циклоалкіл, заміщений С3-С7-циклоалкіл, феніл, заміщений феніл, гетероцикл або заміщений гетероцикл;
R2 є водень, н-С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3-алкіл або група формули II
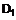 II,
II,
за умови, що, коли R1 є С2-С6-алкіл або заміщений С2-С6-алкіл, R2 є водень або метил;
R3a, R3b і, якщо X є -C(R3c)=, R3c незалежно один від одного є водень, фтор або метил, за умови, що не більше ніж один із замісників R3a, R3b та R3c може бути відмінним від водню;
R4 є водень або С1-С3-алкіл;
R5 є водень, С1-С3-алкіл або С3-С6-циклоалкілкарбоніл, за умови, що, коли R3a є відмінним від водню, R5 є водень;
R6 є водень або С1-С6-алкіл; і
n є ціле число від 1 до 6 включно.
12. Спосіб за п. 11, де згаданим ссавцем є людина.
13. Спосіб інгібування транссудації нейронних протеїнів в організмі ссавця, який включає введення в організм ссавця, що потребує такого інгібування, ефективної кількості сполуки формули І:
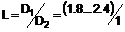 I
I
або фармацевтично прийнятної солі такої сполуки з кислотою, де:
X є -C(R3c)= або -N=;
R1 є С2-С6-алкіл, заміщений С2-С6-алкіл, С3-С7-циклоалкіл, заміщений С3-С7-циклоалкіл, феніл, заміщений феніл, гетероцикл або заміщений гетероцикл;
R2 є водень, н-С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3-алкіл або група формули II
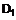 II,
II,
за умови, що, коли R1 є С2-С6-алкіл або заміщений С2-С6-алкіл, R2 є водень або метил;
R3a, R3b і, якщо X є -C(R3c)=, R3c незалежно один від одного є водень, фтор або метил, за умови, що не більше ніж один із замісників R3a, R3b та R3c може бути відмінним від водню;
R4 є водень або С1-С3-алкіл;
R5 є водень, С1-С3-алкіл або С3-С6-циклоалкілкарбоніл, за умови, що, коли R3a є відмінним від водню, R5 є водень;
R6 є водень або С1-С6-алкіл; і
n є ціле число від 1 до 6 включно.
14. Спосіб за п. 13, де згаданим ссавцем є людина.
15. Спосіб лікування або профілактики мігрені у ссавця, який включає введення в організм ссавця, що потребує такого лікування або профілактики, ефективної кількості сполуки формули І:
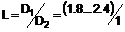 I
I
або фармацевтично прийнятної солі такої сполуки з кислотою, де:
X є -C(R3c)= або -N=;
R1 є С2-С6-алкіл, заміщений С2-С6-алкіл, С3-С7-циклоалкіл, заміщений С3-С7-циклоалкіл, феніл, заміщений феніл, гетероцикл або заміщений гетероцикл;
R2 є водень, н-С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3-алкіл або група формули II
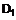 II,
II,
за умови, що, коли R1 є С2-С6-алкіл або заміщений С2-С6-алкіл, R2 є водень або метил;
R3a, R3b і, якщо X є -C(R3c)=, R3c незалежно один від одного є водень, фтор або метил, за умови, що не більше ніж один із замісників R3a, R3b та R3c може бути відмінним від водню;
R4 є водень або С1-С3-алкіл;
R5 є водень, С1-С3-алкіл або С3-С6-циклоалкілкарбоніл, за умови, що, коли R3a є відмінним від водню, R5 є водень;
R6 є водень або С1-С6-алкіл; і
n є ціле число від 1 до 6 включно.
16. Спосіб за п. 15, де згаданим ссавцем є людина.
17. Сполука за будь-яким із пп. 1-9 для застосування як фармацевтичний засіб.
18. Сполука за будь-яким із пп. 1-9 для застосування при активації рецепторів 5-НТ1F в організмі ссавця.
19. Сполука за будь-яким із пп. 1-9 для застосування при інгібуванні транссудації нейронних протеїнів в організмі ссавця.
20. Сполука за будь-яким із пп. 1-9 для застосування при лікуванні або профілактиці мігрені у ссавця.
21. Сполука за будь-яким із пп. 18-20, де згаданим ссавцем є людина.
22. Застосування сполуки за будь-яким із пп. 1-9 при виготовленні лікарського засобу для активації рецепторів 5-НТ1F в організмі ссавця.
23. Застосування сполуки за будь-яким із пп. 1-9 при виготовленні лікарського засобу для інгібування транссудації нейронних протеїнів в організмі ссавця.
24. Застосування сполуки за будь-яким із пп. 1-9 при виготовленні лікарського засобу для лікування або профілактики мігрені у ссавця.
25. Застосування сполуки за будь-яким із пп. 1-9 при виготовленні лікарського засобу для лікування розладу, пов'язаного з дисфункцією рецепторів 5-НТ1F у ссавця.
26. Застосування за п. 25, де згаданим розладом, пов'язаним із рецепторами 5-НТ1F, є транссудація нейронних протеїнів.
27. Застосування за п. 25, де згаданим розладом, пов'язаним із рецепторами 5-НТ1F, є мігрень.
28. Застосування за будь-яким із пп. 22-27, де згаданим ссавцем є людина.
29. Фармацевтична композиція, пристосована для лікування або профілактики мігрені, яка містить сполуку за будь-яким із пп. 1-9 у комбінації з одним або кількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами для цієї сполуки.
Текст
1. Сполука формули І: 3 7. Сполука за будь-яким із пп. 1-5, де R1 є феніл, заміщений феніл, гетероцикл або заміщений гетероцикл, причому гетероцикл вибраний з групи, яку складають фураніл, тіофеніл, піроліл, піролідиніл, піридиніл, N-метилпіроліл, оксазоліл, ізоксазоліл, піразоліл, імідазоліл, триазоліл, оксадіазоліл, тіадіазоліл, тіазоліл, тіазолідиніл, Nацетилтіазолідиніл, піримідиніл, піразиніл, піридазиніл, ізохінолініл, бензоксазоліл, бензодіоксоліл, бензотіазоліл, хінолініл, бензофураніл, бензотіофеніл та індоліл; і причому "заміщений феніл" та "заміщений гетероцикл" означають, що згаданий циклічний фрагмент: (і) заміщений галогенами в кількості від одного до трьох; або (іі) заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, яку складають галоген, С1-С4-алкіл, С1-С4алкоксигрупа, С1-С4-алкілтіогрупа, ціаногрупа та нітрогрупа, причому кожний алкіл, алкоксигрупа та алкілтіогрупа можуть бути додатково заміщені незалежно С1-С4-алкоксигрупою або 1-5 атомами галогенів, вибраних із групи, яку складають фтор та хлор; або (iiі) заміщений одним замісником, вибраним з групи, яку складають фенілоксигрупа, бензилоксигрупа, фенілтіогрупа, бензилтіогрупа та піримідинілоксигрупа, причому ці фенілоксигрупа, бензилоксигрупа, фенілтіогрупа, бензилтіогрупа або піримідинілоксигрупа можуть бути додатково заміщені одним або двома замісниками, вибраними з групи, яку складають галоген, С1-С2-алкіл та С1-С2-алкоксигрупа, де кожний алкіл та алкоксигрупа можуть бути додатково заміщені 1-3 атомами фтору; або (iv) заміщений одним замісником, вибраним з групи, яку складають С1-С4-ацил та С1-С4алкоксикарбоніл, і факультативно додатково заміщений одним замісником, вибраним із групи, яку складають галоген, С1-С4-алкіл, С1-С4алкоксигрупа та С1-С4-алкілтіогрупа, причому кожний алкіл, алкоксигрупа та алкілтіогрупа можуть бути додатково заміщені 1-3 атомами фтору. 8. Сполука за п. 7, де R1 є феніл, заміщений феніл, гетероцикл або заміщений гетероцикл, де гетероцикл вибраний з групи, яку складают фураніл, тіофеніл, піроліл, піридиніл, N-метилпіроліл, піримідиніл, піразиніл, індоліл, бензофураніл, бензотіофеніл, бензодіоксоліл та тіазолідиніл; і термін "заміщений" означає, що згаданий циклічний фрагмент: (і) заміщений галогенами в кількості від 1 до 3; або (іі) заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, яку складають галоген, С1-С4-алкіл, С1-С4-алкокси-, С1С4-алкілтіо-, ціано- та нітрогрупа, причому кожний алкіл, алкокси- та алкілтіогрупа можуть бути додатково заміщені 1-5 атомами фтору. 9. Сполука за п. 7, де R1 є феніл, заміщений феніл, гетероцикл або заміщений гетероцикл, де гетероцикл вибраний з групи, яку складають піридиніл, тіофеніл та фураніл; і 82711 4 термін "заміщений феніл" означає, що згаданий циклічний фрагмент: (і) заміщений галогенами в кількості від 1 до 3; або (іі) заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, яку складають галоген, метил, метоксигрупа, трифторметил, трифторметоксигрупа та ціаногрупа; і термін "заміщений гетероцикл" означає, що згаданий циклічний фрагмент заміщений одним атомом галогену. 10. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-9 та фармацевтичний носій, розріджувач або наповнювач. 11. Спосіб активації рецепторів 5-НТ1F в організмі ссавця, який включає введення в організм ссавця, що потребує такої активації, ефективної кількості сполуки формули І: R5 H R1 N R4 N X O N R3a R2 R3b I або фармацевтично прийнятної солі такої сполуки з кислотою, де: X є -C(R3c)= або -N=; R1 є С2-С6-алкіл, заміщений С2-С6-алкіл, С3-С7циклоалкіл, заміщений С3-С7-циклоалкіл, феніл, заміщений феніл, гетероцикл або заміщений гетероцикл; R2 є водень, н-С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3алкіл або група формули II CH2 n N N R6 II, за умови, що, коли R є С2-С6-алкіл або заміщений С2-С6-алкіл, R2 є водень або метил; R3a, R3b і, якщо X є -C(R3c)=, R3c незалежно один від одного є водень, фтор або метил, за умови, що не більше ніж один із замісників R3a, R3b та R3c може бути відмінним від водню; R4 є водень або С1-С3-алкіл; R5 є водень, С1-С3-алкіл або С3-С6циклоалкілкарбоніл, за умови, що, коли R3a є відмінним від водню, R5 є водень; R6 є водень або С1-С6-алкіл; і n є ціле число від 1 до 6 включно. 1 12. Спосіб за п. 11, де згаданим ссавцем є людина. 13. Спосіб інгібування транссудації нейронних протеїнів в організмі ссавця, який включає введення в організм ссавця, що потребує такого інгібування, ефективної кількості сполуки формули І: 5 N R4 N X O R2 R3a R3b I або фармацевтично прийнятної солі такої сполуки з кислотою, де: X є -C(R3c)=або -N=; R1 є С2-С6-алкіл, заміщений С2-С6-алкіл, С3-С7циклоалкіл, заміщений С3-С7-циклоалкіл, феніл, заміщений феніл, гетероцикл або заміщений гетероцикл; R2 є водень, н-С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3алкіл або група формули II n CH2 n N N N CH2 6 алкіл або група формули II R5 H R1 82711 N R6 II, за умови, що, коли R є С2-С6-алкіл або заміщений С2-С6-алкіл, R2 є водень або метил; R3a, R3b і, якщо X є -C(R3c)=, R3c незалежно один від одного є водень, фтор або метил, за умови, що не більше ніж один із замісників R3a, R3b та R3c може бути відмінним від водню; R4 є водень або С1-С3-алкіл; R5 є водень, С1-С3-алкіл або С3-С6циклоалкілкарбоніл, за умови, що, коли R3a є відмінним від водню, R5 є водень; R6 є водень або С1-С6-алкіл; і n є ціле число від 1 до 6 включно. 1 16. Спосіб за п. 15, де згаданим ссавцем є людина. N R6 17. Сполука за будь-яким із пп. 1-9 для застосування як фармацевтичний засіб. II, за умови, що, коли R1 є С2-С6-алкіл або заміщений С2-С6-алкіл, R2 є водень або метил; R3a, R3b і, якщо X є -C(R3c)=, R3c незалежно один від одного є водень, фтор або метил, за умови, що не більше ніж один із замісників R3a, R3b та R3c може бути відмінним від водню; R4 є водень або С1-С3-алкіл; R5 є водень, С1-С3-алкіл або С3-С6циклоалкілкарбоніл, за умови, що, коли R3a є відмінним від водню, R5 є водень; R6 є водень або С1-С6-алкіл; і n є ціле число від 1 до 6 включно. 20. Сполука за будь-яким із пп. 1-9 для застосування при лікуванні або профілактиці мігрені у ссавця. 14. Спосіб за п. 13, де згаданим ссавцем є людина. 21. Сполука за будь-яким із пп. 18-20, де згаданим ссавцем є людина. 15. Спосіб лікування або профілактики мігрені у ссавця, який включає введення в організм ссавця, що потребує такого лікування або профілактики, ефективної кількості сполуки формули І: 22. Застосування сполуки за будь-яким із пп. 1-9 при виготовленні лікарського засобу для активації рецепторів 5-НТ1F в організмі ссавця. R1 N X R4 N O R2 24. Застосування сполуки за будь-яким із пп. 1-9 при виготовленні лікарського засобу для лікування або профілактики мігрені у ссавця. N R3a R3b 19. Сполука за будь-яким із пп. 1-9 для застосування при інгібуванні транссудації нейронних протеїнів в організмі ссавця. 23. Застосування сполуки за будь-яким із пп. 1-9 при виготовленні лікарського засобу для інгібування транссудації нейронних протеїнів в організмі ссавця. R5 H 18. Сполука за будь-яким із пп. 1-9 для застосування при активації рецепторів 5-НТ1F в організмі ссавця. I або фармацевтично прийнятної солі такої сполуки з кислотою, де: X є -C(R3c)= або -N=; R1 є С2-С6-алкіл, заміщений С2-С6-алкіл, С3-С7циклоалкіл, заміщений С3-С7-циклоалкіл, феніл, заміщений феніл, гетероцикл або заміщений гетероцикл; R2 є водень, н-С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3 25. Застосування сполуки за будь-яким із пп. 1-9 при виготовленні лікарського засобу для лікування розладу, пов'язаного з дисфункцією рецепторів 5НТ1F у ссавця. 26. Застосування за п. 25, де згаданим розладом, пов'язаним із рецепторами 5-НТ1F, є транссудація нейронних протеїнів. 27. Застосування за п. 25, де згаданим розладом, пов'язаним із рецепторами 5-НТ1F, є мігрень. 7 82711 8 29. Фармацевтична композиція, пристосована для лікування або профілактики мігрені, яка містить сполуку за будь-яким із пп. 1-9 у комбінації з одним або кількома фармацевтично прийнятними наповнювачами, носіями або розріджувачами для цієї сполуки. До останнього часу серед теорій, що розглядають патофізіологію мігрені, з 1938 р. чільне місце займала робота Грехема та Вольфа [Graham and Wolff, Arch. Neurol. Psychiatry, 39:737-3, 1938]. Вони припускали, що причиною головного болю при мігрені є розширення позачерепних судин. Ця точка зору підтверджувалася інформацією про те, що алкалоїди ріжків та суматриптан (гідрофільний агоніст 5-HT1, який не перетинає гематоенцефалічний бар'єр) спричиняють звуження гладких м'язів черепних судин і є ефективними при лікуванні мігрені [Хамфрі та ін. - Humphrey, et al, Ann. NY Acad. Sci., 600:587-600, 1990]. Недавня робота Московіца, однак, показала, що явище головного болю при мігрені не залежить від змін діаметра судин [Moskowitz, Cephalalgia, 12:5-7, 1992]. Московіц припустив, що невідомі на цей час збудники болю стимулюють ганглії трійчастого нерва, які іннервують судинну сітку у тканині черепа, спричиняючи вивільнення вазоактивних нейропептидів з аксонів цієї судинної сітки. Ці вивільнені нейропептиди потім активують послідовність подій, наслідком якої є біль. Це нейрогенне запалення блокується суматриптаном та алкалоїдами ріжків за механізмами, які включають рецептори 5-НТ, які вважаються близько зв'язаними з підтипом 5HT1D, локалізованими на трійчасто-судинних волокнах [Neurology, 43 (suppl. 3): S16-S20 1993]. Дійсно, суматриптан має високу спорідненість до рецепторів 5-HT1В та 5-НТ1D (Ki відповідно 10,3нМ та 5,1нМ), активність яких може вказувати на судинозвужувальну дію. Добір суматриптану та аналогічних сполук, які пропонувалися раніше для лікування мігрені, базувався, насамперед, на основі цієї судинозвужувальної дії, виходячи з відомих моделей мігрені. Серотонін (5-НТ) викликає різноманітні фізіологічні ефекти, опосередковані щонайменше сімома класами рецепторів, найбільш гетерогенним з яких виявляється 5-HT1. Ген людини, який експресує один зі згаданих підтипів рецепторів 5-HT1 названий 5-HT1F, був виділений Као та ін. [Као and coworkers, Proc. Natl. Acad. ScL USA, 90:408-412, 1993]. Цей рецептор 5-HT1F має фармакологічний профіль, відмінний від профілів будь-яких серотонегрічних рецепторів, описаних на даний час. Було виявлено, що суматриптан, на додаток до вищезгаданої високої спорідненості до рецепторів 5HT1B та 5-HT1D, має спорідненість до підтипу рецептора 5-HT1F з показником Ki приблизно 23нМ. Це свідчить про можливу роль рецептора 5-HT1F при мігрені. Були розроблені різноманітні агоністи рецептора 5-HT1F, які виявляли відносну селективність до підкласу рецептора 5-HT1F, і показано, що така селективність, як правило, знижує судинозвужува льну активність, характерну для інших сполук, які пропонувалися як потенціальні засоби для лікування мігрені та пов'язаних із нею розладів. До цих агоністів рецептора 5-HT1F належать, зокрема, сполуки, розкриті в нижчезазначених документах: патенти США №5,708,187 та №5,814,653, де описано групу 6-заміщених 3-аміно(алкіл)тетрагідрокарбазолів та 7-заміщених 4аміно(алкіл)-циклогепта[7,6b]індолів; патенти США №5,521,196, №5,721,252, №5,521,197 та міжнародна заявка WO 96/29075, де описано різноманітні групи 5-заміщених піперидин-3-іл-індолів та 5-заміщених 1,2,3,6тетрагідропіридин-3-іл-індолів; міжнародна заявка WO 97/13512, де описано групу 5-заміщених 3-аміноетиліндолів; міжнародна заявка WO 98/46570, де описано групу 5-заміщених індолів, піроло[3,2-b]піридинів, бензофуранів та бензотіофенів, які мають у положенні 3 такі замісники: октагідроіндолізиніл, октагідро-2Н-хінолізиніл, декагідропіридо[1,2-а]азепініл, 1,2,3,5,8,8а-гексагідроіндолізиніл, 1,3,4,6,9,9агексагідро-2Н-хінолізиніл або 1,4,6,7,8,9,10,10аоктагідропіридо[1,2-а]азепініл; міжнародні заявки WO 98/20875 та WO 99/25348, де описано дві групи 5-заміщених піперидин-3-іл-азаіндолів та 5-заміщених 1,2,3,6тетрагідропіридин-3-іл-азаіндолів; міжнародна заявка WO 00/00487, де описано групу 5-заміщених (піперидин-3-іл- або 1,2,3,6тетрагідропіридин-3-іл-)індолів, азаіндолів, бензофуранів та бензотіофенів; міжнародна заявка WO 98/08502, де описано групу 8-заміщених 1,2,3,4-тетрагідро-2дибензофуранамінів та 9-заміщених 2аміноциклогепта[b]-бензофуранів; міжнародна заявка WO 98/55115, де описано групу 3-аміно-1,2,3,4-тетрагідро-9Н-карбазол-6карбоксамідів та 4-аміно-10Н-циклогепта[7,6b]індол-7-карбоксамідів; міжнародна заявка WO 98/15545, де описано певну групу 3,5-дизаміщених індолів та бензофуранів; міжнародна заявка WO 00/00490, де описано групу 5-алілзаміщених (піперидин-3-іл- або 1,2,3,6тетрагідропіридин-3-іл-)індолів, азаіндолів, бензофуранів та бензотіофенів; міжнародна заявка WO 00/47559, де описано групу 4-(3-заміщений бензоїл)піперидинів; міжнародна заявка WO 00/50426, де описано групу 3,5-дизаміщених азобензофуранів; і міжнародна заявка WO 00/34266, де описано групу 3-гетероарил-5-(2-(арил або гетероарил)-2оксоетил)індолів. При подальших дослідженнях несподівано 28. Застосування за будь-яким із пп. 22-27, де згаданим ссавцем є людина. 9 віднайдено новий та несподіваний клас нових селективних агоністів 5-HT1F, які мають відмінні від інших класів хімічні властивості та характеристики зв'язування з рецепторами, котрі інгібують транссудацію пептидів і при цьому не мають значної судинозвужувальної активності, і, отже, є корисними для лікування мігрені та інших розладів, пов'язаних із діяльністю рецепторів 5-HT1F. Короткий опис винаходу Цей винахід стосується заміщених 2карбоніламіно-6-піперидин-амінопіридинів та заміщених 1-карбоніламіно-Зпіперидинамінобензолів загальної формули І: або фармацевтично прийнятних солей цих сполук із кислотами, де: X є -C(R3c)= або -N=; R1 є С2-С6-алкіл, заміщений С2-С6-алкіл, С3-С7циклоалкіл, заміщений С3-С7-циклоалкіл, феніл, заміщений феніл, гетероцикл або заміщений гетероцикл; R2 є водень, н-С1-С3-алкіл, С3-С6-циклоалкілС1-С3-алкіл або група формули II за умови, що коли R1 є С2-С6-алкіл або заміщений С2-С6-алкіл, R2 є водень або метил; R3a, R3b і, якщо X є -C(R30)=, R3c незалежно один від одного є водень, фтор або метил, за умови, що не більше ніж один із замісників R3a, R3b та R3c може бути відмінним від водню; R4 є водень або С1-С3-алкіл; R5 є водень, С1-С3-алкіл або С3-С6циклоалкілкарбоніл, за умови, що коли R3a є відмінним від водню, R5 є водень; R6 є водень або С1-С6-алкіл; і n є ціле число від 1 до 6 включно. Цей винахід стосується також фармацевтичних композицій, які включають сполуку формули І або фармацевтично прийнятну сіль такої сполуки з кислотою та фармацевтично прийнятний носій, розріджувач або наповнювач. Відповідно до іншого варіанта здійснення, цей винахід стосується фармацевтичних композицій, придатних для активації рецепторів 5-HT1F, для інгібування транссудації нейронних протеїнів та/або для лікування або профілактики мігрені у ссавців, зокрема, у людей, причому згадані композиції включають сполуку формули І або фармацевтично прийнятну сіль 82711 10 такої сполуки з кислотою та фармацевтично прийнятний носій, розріджувач або наповнювач. Крім того, цей винахід стосується способу активації рецепторів 5-HT1F в організмах ссавців, зокрема, людей, який включає введення в організм ссавця, що потребує такої активації, ефективної кількості сполуки формули І або фармацевтично прийнятної солі такої сполуки з кислотою. Крім того, цей винахід стосується способу інгібування транссудації нейронних протеїнів в організмах ссавців, зокрема, людей, який включає введення в організм ссавця, що потребує такого інгібування, ефективної кількості сполуки формули І або фармацевтично прийнятної солі такої сполуки з кислотою. Крім того, цей винахід стосується способу лікування або профілактики мігрені у ссавців, зокрема, у людей, який включає введення в організм ссавця, що потребує такого лікування або профілактики, ефективної кількості сполуки формули І або фармацевтично прийнятної солі такої сполуки з кислотою. В іншому аспекті цей винахід стосується застосування сполуки формули І як лікарський засіб, зокрема, як лікарський засіб, придатний для активації рецепторів 5-HT1F, для інгібування транссудації нейронних протеїнів та/або для лікування або профілактики мігрені у ссавців, зокрема, у людей. Інакше кажучи, цей винахід стосується застосування сполуки формули 1 для активації рецепторів 5-HT1F, для інгібування транссудації нейронних протеїнів та/або для лікування або профілактики мігрені у ссавців, зокрема, у людей. Крім того, цей винахід стосується застосування однієї або кількох сполук формули 1 при виготовленні лікарського засобу для активації рецепторів 5-HT1F, для інгібування транссудації нейронних протеїнів та/або для лікування або профілактики мігрені у ссавців, зокрема, у людей. Крім того, цей винахід пропонує способи лікування та/або профілактики розладів, опосередкованих 5-HT1F, який включає введення в організм ссавця, зокрема, людини, що потребує такого лікування або профілактики, ефективної кількості сполуки формули І або фармацевтично прийнятної солі такої сполуки з кислотою. У варіантах, яким віддається перевага, розладом, опосередкованим 5-HT1F, є транссудація нейронних протеїнів та/або мігрень. Детальний опис винаходу Поданий нижче детальний опис пропонується з метою допомоги фахівцям у реалізації цього винаходу. Навіть з урахуванням цього, поданий нижче опис не слід розглядати як такий, що надмірно обмежує винахід, оскільки пересічний фахівець може внести у варіанти здійснення, які розглядаються в описі, модифікації та зміни без відходу від суті та обсягу винаходу. Мається на увазі, що такі модифікації та зміни охоплюються обсягом винаходу. Одним із варіантів здійснення цього винаходу є спосіб посилення активації рецепторів 5-HT1F при одночасному уникненні судинозвужувальної дії для лікування різноманітних розладів, пов'язаних із послабленою нейротрансмісією серотоніну у 11 ссавців. До таких розладів належать, зокрема, мігрень, болі загального характеру, невралгія трійчастого нерва, зубний біль або біль при дисфункції скронево-нижньощелепного суглоба, неспокій, страх або тривога, генералізований тривожний розлад, панічний розлад, депресія, порушення сну, синдром хронічної втоми, пременструальний синдром або синдром пізньої лютеальної фази, посттравматичний синдром, втрата пам'яті, деменція, в тому числі вікова деменція, соціальні фобії, аутизм, дефіцит уваги з гіперактивністю, розлади поведінки, розлади контролю імпульсів, розлади, суміжні з порушенням особистості, обсесивний компульсивний розлад, передчасна еякуляція, еректильна дисфункція, булімія, нервова анорексія, алкоголізм, нікотинізм, мутизм та трихотиломанія. Сполуки цього винаходу корисні також при профілактиці мігрені. У всіх цих способах застосовують сполуки формули І. У варіантах, яким віддається перевага, ссавцем, що підлягає лікуванню шляхом введення сполук формули І, є людина. У випадках, коли розлади, які можна лікувати агоністами серотоніну, є відомими у рамках встановлених та загальноприйнятих класифікаційних систем, їх класифікацію можна знайти в різних джерелах. Наприклад, на даний час діагностичний підхід для ідентифікації багатьох описаних в цьому документі розладів забезпечує четверте видання Діагностично-статистичного довідника з психічних розладів (Diagnostic and Statistical Manual of Mental Disorders (DSM-IV™) (1994, American Psychiatric Association, Washington, D.C.). Довідник "Міжнародна класифікація захворювань", 10-те переглянуте та доповнене видання (International Classification of Diseases, Tenth Revision (ICD-10), також пропонує класифікацію багатьох згаданих розладів. Для фахівця ясно, що існують альтернативні номенклатури, нозологічні характеристики та класифікації описаних у цьому документі розладів, в тому числі описаних у DSM-IV та ICD-10, і що системи термінології та класифікації розвиваються в процесі розвитку наукової медицини. Варіанти здійснення цього винаходу охоплюють застосування сполук формули І для активації рецепторів 5-HT1F, для інгібування транссудації нейронних протеїнів взагалі або, зокрема, внаслідок стимуляції гангліїв трійчастого нерва, та/або для лікування будь-якого з описаних вище розладів. За одним із варіантів, яким віддається перевага, цей винахід пропонує спосіб лікування мігрені у ссавця, наприклад, у людини, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки формули І. Відповідно до іншого варіанта, якому віддається перевага, цей винахід пропонує спосіб профілактики мігрені у ссавця, наприклад, у людини, який включає введення в організм ссавця, що потребує такого втручання, фармацевтично ефективної кількості сполуки формули І. Аналогічно, варіанти здійснення цього винаходу охоплюють застосування сполуки формули І або комбінації кількох сполук формули І у виготовленні лікарського засобу для активації рецепторів 5-HT1F. Для інгібування транссудації нейронних протеїнів взагалі або, зокрема, внаслідок стимуля 82711 12 ції гангліїв трійчастого нерва, та/або для лікування будь-якого з описаних вище розладів. Хімічні терміни загального характеру вживаються в цьому описі у їхніх звичайних значеннях. Наприклад, термін "алкіл" означає розгалужену або нерозгалужену насичену вуглеводневу групу. Термін "н-алкіл" означає нерозгалужений алкіл. Як необмежувальний ілюстративний приклад мається на увазі, що термін "С1-С2-алкіл" означає метил та етил. Термін "С1-С3-н-алкіл" означає метил, етил та н-пропіл. Термін "С1-С3-алкіл" означає метил, етил, н-пропіл та ізопропіл. Термін "С1-С4-алкіл" означає метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил та трет-бутил. Термін "С1-С6алкіл" охоплює усі розгалужені та нерозгалужені алкіли, що містять від 1 атому до 6 атомів вуглецю. Термін "С2-С6-алкіл" охоплює усі розгалужені та нерозгалужені алкіли, що містять від 2 до 6 атомів вуглецю. Термін "С3-С6-циклоалкіл" означає циклопропіл, циклобутан, циклопентан та циклогексил. Термін "С3-С7-циклоалкіл" охоплює також циклогептил. Термін "циклоалкілалкіл" означає циклоалкіл, приєднаний до решти молекули через н-алкільний ланцюг, як, наприклад, термін "С3-С6циклоалкіл-С1-С3-алкіл," що означає С3-С6циклоалкіл, приєднаний до решти молекули через н-алкільний ланцюг, який містить від 1 атому до 3 атомів вуглецю. Кожний алкіл, циклоалкіл та циклоалкілалкіл може бути факультативно заміщеним згідно з відповідними вказівками цього опису. Серед сполук, де R1 є циклоалкіл, сполукам, де X є N=, віддається перевага перед сполуками, де X є C(R3C)=. Терміни "алкокси(група)", "фенілокси(група)", "бензилокси(група)" та "піримідинілокси(група)" означають відповідно алкіл, феніл, бензил або піримідиніл, кожний з яких може бути факультативно заміщений відповідно до вказівок цього опису, приєднаний до решти молекули через атом кисню. Терміни "алкілтіо", "фенілтіо" та "бензилтіо" означають відповідно алкіл, феніл або бензил, кожний з яких може бути факультативно заміщений відповідно до вказівок цього опису, приєднаний до решти молекули через атом сірки. Термін "С1-С4-ацил" означає форміл або C1С3-алкіл, приєднаний до решти молекули через карбоніл. Термін "С1-С4-алкоксикарбоніл" означає С1-С4-алкоксигрупу, приєднану до решти молекули через карбоніл. Термін "С3-С6-циклоалкілкарбоніл" означає С3-С6-циклоалкіл, приєднаний до решти молекули через карбоніл. Термін "галоген" означає фтор, хлор, бром або йод. Перевага серед галогенів віддається фтору, хлору та брому. Більша перевага віддається фтору та хлору. Термін "гетероцикл" означає насичений або ненасичений 5- або 6-членний цикл, який містить від 1 до 3 гетероатомів, вибраних з групи, яку складають азот, кисень та сірка, причому згаданий цикл може бути факультативно конденсований з бензольним циклом. Для цілей цього винаходу прикладами гетероциклів є фураніл, тіофеніл, піроліл, піролідиніл, піридиніл, N-метилпіроліл, оксазоліл, ізоксазоліл, піразоліл, імідазоліл, триазоліл, оксадіазоліл, тіадіазоліл, тіазоліл, тіазолідиніл, 13 N-ацетилтіазолідиніл, піримідиніл, піразиніл, піридазиніл тощо. Прикладами конденсованих із бензольним циклом гетероциклів для цілей цього винаходу є ізохінолініл, бензоксазоліл, бензодіоксоліл, бензотіазоліл, хінолініл, бензофураніл, бензотіофеніл, індоліл тощо, причому кожний з них може бути факультативно заміщеним, в тому числі факультативно заміщеним при бензольному циклі, якщо гетероцикл конденсований з бензольним циклом. Відповідно до одного з варіантів, перевага серед гетероциклів віддається переліченим нижче: фураніл, тіофеніл, піроліл, піридиніл, Nметилпіроліл, піримідиніл, піразиніл, індоліл, бензофураніл, бензотіофеніл, бензодіоксоліл та тіазолідиніл, причому кожний з них може бути факультативно заміщеним. Відповідно до ще одного варіанта, до гетероциклів, яким віддається перевага, належать піридиніл, тіофеніл та фураніл, причому кожний з них може бути факультативно заміщеним. Термін "заміщений" (стосовно до алкілу, циклоалкілу, циклоалкілалкілу, алкокси- або алкілтіогрупи), означає відповідно алкіл, циклоалкіл, циклоалкілалкіл, алкоксиабо алкілтіогрупу, заміщений (заміщену) одним або кількома незалежними один від одного замісниками, вибраними з групи, яку складають галоген, гідроксил та С1-С3алкоксигрупа. Замісники при циклоалкілалкілах можуть бути приєднані до циклічної частини або до місточкового алкілу, або до обох цих частин. До варіантів заміщення, яким віддається перевага, належать заміщення 1-5 атомами галогенів, кожний з яких вибраний незалежно від інших, або заміщення 1-3 атомами галогенів та 1-2 групами, вибраними незалежно від інших з групи, яку складають гідроксил та С1-С3-алкоксигрупа, або заміщення 1-3 групами, вибраними незалежно одна від одної з групи, яку складають гідроксил та С1С3-алкоксигрупа, за умови, що до одного й того самого атома вуглецю може бути приєднаний щонайбільше один гідроксильний та/або алкоксильний замісник. Терміни "заміщений феніл" та "заміщений гетероцикл" означають, що циклічний фрагмент заміщений одним або кількома галогенами, відповідно до варіанта, якому віддається перевага, від 1 до 5, відповідно до варіанта, якому віддається більша перевага, від 1 до 3, вибраними незалежно один від одного; або заміщений одним або кількома, відповідно до варіанта, якому віддається перевага, від 1 до 2, замісниками, вибраними незалежно одна від одного з групи, яку складають галоген, С1-С4-алкіл, C1-С4-алкоксигрупа, C1-C4алкілтіогрупа, ціаногрупа та нітрогрупа, причому кожний алкіл, алкоксигрупа та алкілтіогрупа можуть бути додатково заміщені незалежно С1-С2алкоксигрупою або 1-5 атомами галогенів, вибраних з групи, яку складають фтор та хлор; або заміщений одним замісником, вибраним із групи, яку складають фенілоксигрупа, бензилоксигрупа, фенілтіогрупа, бензилтіогрупа та піримідинілоксигрупа, причому ці фенілоксигрупа, бензилоксигрупа, фенілтіогрупа, бензилтіогрупа та піримідинілоксигрупа можуть бути додатково заміщені одним або 82711 14 двома замісниками, вибраними з групи, яку складають галоген, С1-С2-алкіл та С1-С2-алкоксигрупа, де кожний алкіл та алкоксигрупа можуть бути додатково заміщені 1-3 атомами фтору; або заміщений одним замісником, вибраним з групи, яку складають C1-С4-ацил та C1-C4-алкоксикарбоніл, і додатково заміщений 0-1 замісником, вибраним з групи, яку складають галоген, С1-С4-алкіл, С1-С4алкоксигрупа та C1-C4-алкілтіогрупа. Якщо замісником є галоген, то перевагу серед галогенів віддають фтору, хлору та брому. Відповідно до іншого варіанта здійснення, до варіантів заміщення у "заміщеному фенілі" та "заміщеному гетероциклі", яким віддається перевага, належать заміщення одним або кількома галогенами, відповідно до варіанта, якому віддається перевага, від 1 до 5, відповідно до варіанта, якому віддається більша перевага, від 1 до 3, вибраними незалежно один від одного; або заміщення одним або кількома, відповідно до варіанта, якому віддається перевага, від 1 до 2, замісниками, вибраними незалежно один від одного з групи, яку складають галоген, С1-С4-алкіл, С1-С4-алкоксигрупа, ціаногрупа та нітрогрупа, причому кожний алкільний та алкоксильний замісник може бути додатково заміщений незалежно 1-5 атомами галогенів, вибраних із групи, яку складають фтор та хлор. За ще одним варіантом, до варіантів заміщення у "заміщеному фенілі", яким віддається перевага, належать заміщення 1-3 галогенами, вибраними незалежно одна від одного; або заміщення 1-2 замісниками, вибраними незалежно один від одного з групи, яку складають галоген, метил, метоксигрупа, трифторметил, трифторметоксигрупа та ціаногрупа. Абревіатури, вжиті в цьому описі, мають такі значення: BINAP означає 2,2'-біс(дифенілфосфіно)-1,1’бінафтил. DMF означає N,N-диметилформамід. DMSO означає диметилсульфоксид. Pd2(dba)3 означає трис(дибензиліденацетон)дипаладій(0). Pd(OAc)2 означає діацетат паладію. THF означає тетрагідрофуран. Термін "група захисту аміну" у значенні, вживаному в цьому описі, означає замісник, який звичайно вживається для блокування або захисту амінної функціональної групи при проведенні реакції з іншими функціональними групами певної сполуки. Прикладами таких груп захисту аміну є форміл, тритил, фталімідогрупа, ацетил, трихлорацетил, хлорацетил, бромацетил та йодацетил, блокувальні групи типу уретанів, наприклад, бензилоксикарбоніл, 9-флуоренілметоксикарбоніл ("FMOC"), трет-бутоксикарбоніл (t-ВОС) і т.ін.; та аналогічні групи захисту аміну. Тип застосованої групи захисту аміну не має вирішального значення за умови, що дериватизована аміногрупа зберігає стабільність в умовах подальших реакцій, які проходять по інших позиціях молекули, і може бути видалена у відповідний момент без руйнування решти молекули. Добір та застосування (приєднання та подальше відщеплення) груп захисту аміну добре відомі пересічному фахівцю в галузі. 15 Подальші приклади груп, які охоплюються поданим вище терміном, описані в монографії Гріні та Вутса "Групи захисту в органічному синтезі" [T.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", 3rd edition, John Wiley and Sons, New York, NY, 1999, розділ 7], яка позначається нижче як "Greene". Термін "фармацевтичний" або "фармацевтично прийнятний" при застосуванні як прикметник означає "практично нетоксичний та практично нешкідливий" для реципієнта. При вживанні терміну "фармацевтична композиція" додатково мається на увазі, що носій, розчинник, наповнювачі та солі мають бути сумісними з активним інгредієнтом композиції (наприклад, зі сполукою формули І). Для пересічного фахівця в галузі зрозуміло, що терміни "фармацевтична форма" та "фармацевтична композиція", як правило, є взаємозамінними і для цілей цього опису обидва терміни вживаються з урахуванням цієї обставини. Термін "сіль із кислотою" означає сіль сполуки, одержану шляхом проведення реакції цієї сполуки з неорганічною або органічною кислотою. Сполуки цього винаходу утворюють фармацевтично прийнятні солі з різноманітними органічними та неорганічними кислотами, в тому числі фізіологічно прийнятні солі, часто застосовувані в галузі фармацевтичної хімії. Такі солі також є варіантами здійснення цього винаходу. "Фармацевтично прийнятну сіль (з кислотою)" одержують із фармацевтично прийнятної кислоти, як добре відомо в галузі. До таких солей належать фармацевтично прийнятні солі, приклади яких подано в роботі Бержа та ін. [Berge S.M, Bighley L.D., and Monkhouse D.C., J. Pharm. Sci., 66:1, 1977], та які добре відомі фахівцям. До неорганічних кислот, які звичайно застосовують для одержання таких солей, належать хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, фосфорна кислота тощо. До органічних кислот, які звичайно застосовують для одержання таких солей, належать n-толуолсульфонова кислота, метансульфонова кислота, щавлева кислота, pбромфенілсульфонова кислота, вугільна кислота, бурштинова кислота, лимонна кислота, бензойна кислота, оцтова кислота тощо. Таким чином, прикладами таких фармацевтично прийнятних солей є сульфат, піросульфат, бісульфат, сульфіт, бісульфіт, фосфат, моногідрофосфат, дигідрофосфат, метафосфат, пірофосфат, хлорид, бромід, йодид, ацетат, пропіонат, деканоат, каприлат, акрилат, форміат, ізобутират, капроат, гептаноат, пропіолат, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, бутин-1,4-діоат, гексин-1,6діоат, бензоат, хлорбензоат, метилбензоат, динітробензоат, гідроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенілацетат, фенілпропіонат, фенілбутират, цитрат, лактат, bгідроксибутират, гліколят, тартрат, метансульфонат, пропансульфонат, нафталін-1-сульфонат, нафталін-2-сульфонат, манделат тощо. Відомо, що такі сполуки можуть утворювати солі в різних молярних співвідношеннях із кислотами, наприклад, гемікислотні, монокислотні, диксилотні солі 82711 16 тощо. Термін "ефективна кількість" означає кількість сполуки формули І, здатну активувати рецептори 5-HT1F та/або інгібувати транссудацію нейронних протеїнів. Термін "придатний розчинник" означає будьякий розчинник або суміш розчинників, інертний відносно здійснюваної реакції, який достатньою мірою розчиняє реагенти для забезпечення середовища, в якому здійснюється бажана реакція. Мається на увазі, що сполуки цього винаходу можуть існувати у формі стереоізомерів. У таких випадках винахід охоплює усі енантіомери, діастереомери та їхні суміші. При ідентифікації в цій заявці конкретних стереохімічних конфігурацій для позначення конкретних ізомерів та відносних стереохімічних конфігурацій застосовуються позначення (R)- та (S)- за Каном-Прелогом-Інгольдом (Cahn-Prelog-Ingold) та позначення відносних конфігурацій "цис" і "транс". Хоча мається на увазі, що винахід охоплює усі енантіомери, діастереомери та їхні суміші, перевага віддається індивідуальним енантіомерам та індивідуальним діастереомерам. Хоча як агоністи 5-НТ1F корисними є усі сполуки цього винаходу, але певним класам сполук віддається перевага, наприклад, сполукам, які включають будь-який з перелічених нижче сукупностей замісників. Сполуки, де 1) R1 є феніл, заміщений феніл, гетероцикл або заміщений гетероцикл; 2) R1 є заміщений феніл; 3) R1 є моно- або дизаміщений феніл, де замісники вибрані незалежно один від одного з групи, яку складають галоген, C1-C4-алкіл, С1-С4алкоксигрупа, трифторметил, трифторметоксигрупа, трифторетоксигрупа, фенілоксигрупа, бензилоксигрупа, ціаногрупа та нітрогрупа; 4) R1 є моно- або дизаміщений феніл, де замісники вибрані незалежно один від одного з групи, яку складають галоген, С1-С2-алкоксигрупа, трифторметил, трифторметоксигрупа та трифторетоксигрупа; 5) R1 є моно- або дизаміщений феніл, де замісники вибрані незалежно один від одного з групи, яку складають галоген, трифторметил та трифторметоксигрупа; 6) R1 є моно-, ди- або тризаміщений галогенами феніл; 7) R1 є гетероцикл або заміщений гетероцикл; 8) R1 є гетероцикл або заміщений гетероцикл, де гетероцикл вибраний з групи, яку складають фураніл, тіофеніл, піроліл, піролідиніл, піридиніл, N-метилпіроліл, оксазоліл, ізоксазоліл, піразоліл, імідазоліл, триазоліл, оксадіазоліл, тіадіазоліл, тіазоліл, тіазолідиніл, N-ацетилтіазолідиніл, піримідиніл, піразиніл, піридазиніл, ізохінолініл, бензоксазоліл, бензодіоксоліл, бензотіазоліл, хінолініл, бензофураніл, бензотіофеніл та індоліл; 9) R1 є заміщений або незаміщений гетероцикл, де гетероцикл вибраний з групи, яку складають піридиніл, індоліл, фураніл, бензофураніл, тіофеніл, бензодіоксоліл та тіазолідиніл; 10) R1 є заміщений або незаміщений гетероцикл, де гетероцикл вибраний з групи, яку складають піридиніл, тіофеніл та фураніл; 17 11) R1 є моно-, ди- або тризаміщений галогенами гетероцикл, де кожний галоген вибраний незалежно від інших; 12) R1 є моно- або дизаміщений гетероцикл, де один із замісників вибраний з групи, яку складають С1-С2-алкоксигрупа, феноксигрупа та фенілтіогрупа; 13) R1 є монозаміщений гетероцикл, де замісником є галоген або нітрогрупа; 14) R1 є монозаміщений галогеном гетероцикл; 15) R1 є незаміщений гетероцикл; 16) R1 є С2-С6-алкіл; 17) R1 є С2-С6-алкіл, заміщений галогенами в кількості від 1 до 5; 18) R1 є С3-С7-циклоалкіл; 19) R1 є С3-С7-циклоалкіл та X є -N=; 20) R1 є циклопропіл; 21) R2 є водень або С1-С3-н-алкіл; 22) R2 є водень або метил; 23) R2 є піразолілалкіл або N-заміщений піразолілалкіл; 24) R2 є піразол-4-іл-етил; 25) R2 є 1-(С1-С3-алкіл)піразол-4-іл-етил; 26) R2 є циклопропілметил; 27) кожний з R3a, R3b та R3c, в разі його присутності, є водень; 28) один із R3b або R3c, в разі його присутності, є фтор; 29) R4 є водень; 30) якщо X є -C(R3с)=, R4 є метил; 31) R5 є водень; 32) R5 є метил; 33) R3a, R3b та R3c, в разі його присутності, є водень або фтор, за умови, що тільки один із замісників R3a, R3b та R3c може бути відмінним від водню; 34) R3a, R3b та R3c, в разі його присутності, є водень або фтор, за умови, що тільки один із замісників R3a, R3b та R3c може бути відмінним від водню, та R4 є водень; 35) R3a, R3b та R3c, в разі його присутності, є водень або фтор, за умови, що тільки один із замісників R3a, R3b та R3c може бути відмінним від водню, R4 є водень та R5 є водень або метил; 36) R3b та R3c, в разі його присутності, є водень або фтор, за умови, що тільки один із замісників R3b та R3c може бути відмінним від водню, R4 є водень та R5 є водень або метил; 37) R2 є водень або метил, кожний з R3a, R3b та R3c, в разі його присутності, є водень або фтор, за умови, що тільки один із замісників R3a, R3b та R3c може бути відмінним від водню, R4 є водень та R5 є водень або метил; 38) R1 є моно-, ди- або тризаміщений феніл, де замісники незалежно один від одного вибрані з групи, яку складають галоген, C1-C2-алкоксигрупа, трифторметил, трифторметоксигрупа та трифторетоксигрупа, R2 є водень або метил, кожний з R3a, R3b та R3c, в разі його присутності, є водень або 82711 18 фтор, за умови, що тільки один із замісників R3a, R3b та R3c може бути відмінним від водню, R4 є водень та R5 є водень або метил; 39) R1 є моно-, ди- або тризаміщений феніл, де замісники незалежно один від одного вибрані з групи, яку складають галогени, R2 є водень або метил, кожний з R3a, R3b та R3c, в разі його присутності, є водень або фтор, за умови, що тільки один із замісників R3a, R3b та R3c може бути відмінним від водню, R4 є водень та R5 є водень або метил; 40) R1 є заміщений або незаміщений гетероцикл, вибраний з групи, яку складають піридиніл, індоліл, бензофураніл, фураніл, тіофеніл, бензодіоксоліл та тіазолідиніл, R2 є водень або метил, кожний з R3a, R3b та R3c, в разі його присутності, є водень або фтор, за умови, що тільки один із замісників R3a, R3b та R3c може бути відмінним від водню, R4 є водень та R5 є водень або метил; 41) R1 є заміщений або незаміщений гетероцикл, вибраний з групи, яку складають піридиніл, тіофеніл та фураніл, R2 є водень або метил, кожний з R3a, R3b та R3c, в разі його присутності, є водень або фтор, за умови, що тільки один із замісників R3a, R3b та R3c може бути відмінним від водню, R4 є водень та R5 є водень або метил. Слід мати на увазі, що вищезгадані класи можна комбінувати з утворенням додаткових класів сполук, яким віддається перевага, наприклад, комбінації двох або більше сукупностей замісників, яким віддається перевага. Ілюстративними прикладами комбінацій класів, яким віддається перевага, з утворенням додаткових класів сполук, яким віддається перевага, є перелічені нижче. 42) Комбінація будь-якого з класів 1)-20) включно з будь-яким із класів 21)-26) включно; 43) Комбінація будь-якого з класів 42) з класом 27) або 28); 44) Комбінація будь-якого з класів 42) або 43) з класом 29) або 30); 45) Комбінація будь-якого з класів 42), 43) або 44) з класом 31) або 32). Сполуки цього винаходу можна синтезувати численними альтернативними шляхами. Схеми 17 стосуються синтезу сполук, де X є -C(R3c)=. Схеми 8 та 9 стосуються синтезу сполук, де X є -N=. Відповідні умови проведення реакцій за стадіями цих схем добре відомі в галузі, для відповідних замін розчинників та допоміжних реагентів є достатньою кваліфікація пересічного фахівця. Аналогічно, для фахівця ясно, що синтетичні проміжні продукти в разі потреби або при бажанні можна виділити та/або очистити різноманітними відомими способами, і що часто можливо застосовувати різноманітні проміжні сполуки на подальших стадіях синтезу після незначного очищення або без очищення. Усі замісники, якщо не вказано інше, відповідають поданим вище визначенням, усі реагенти добре відомі в галузі. 19 Сполуки цього винаходу, де X є -CH=, можна синтезувати способами, показаними вище на Схемі 1, де R7 є С1-С3-н-алкіл, С3-С6-циклоалкіл-С1-С3алкіл або група вищезгаданої формули І, або придатна група захисту азоту. Схема включає відновлювальне амінування факультативно заміщеного R3 3-амінонітробензолу придатним піперидин-4оном із подальшим відновленням нітрогрупи та подальшим ацилюванням первинного аміну придатним R1-ацилхлоридом. Факультативно потім можна виконати ще одне відновлювальне амінування для одержання сполук, де R5 є відмінним від водню. У випадку, коли R7 є групою захисту, сполуки цього винаходу, де R2 є водень, одержують шляхом видалення цієї групи. Потім можна безпосередньо одержати подальші сполуки, де R2 є відмінним від водню, шляхом алкілування азоту піперидинільного фрагменту. Відновлювальне амінування 3амінонітробензолу придатним піперидин-4-оном можна виконувати у інертному розчиннику, наприклад, у дихлорметані, THF, толуолі тощо, як правило, при температурі від 0°С до 40°С у присутності боргідриду, наприклад, боргідриду натрію, триацетоксиборгідриду натрію, ціаноборгідриду натрію тощо. Перевага віддається проведенню цієї реакції у дихлорметані при температурі навколишнього середовища у присутності триацетоксиборгідриду натрію. Відновлення нітрогрупи шляхом каталітичного гідрування у присутності Pd/C виконують у придатному розчиннику, наприклад, у метанолі, етанолі, ізопропанолі тощо, як правило, 82711 20 при температурі від приблизно 20°С до 40°C. Перевага віддається проведенню гідрування в метанолі при температурі навколишнього середовища. Нарешті, ацилювання первинного аміну виконують із застосуванням надлишку хлорангідриду карбонової кислоти, як правило, від приблизно 1,1 до 1,3 екв, у присутності органічної основи, наприклад, триетиламіну, основи Х'юніга (Hunig) тощо, у придатному розчиннику, наприклад, THF, CH2Cl2, діетиловому простому ефірі, діізопропіловому простому ефірі, метил-трет-бутиловому простому ефірі, діоксані, DMF, толуолі, етилацетаті, ацетоні тощо, як правило, при температурі від приблизно 0°С до 40°C. Перевага віддається проведенню ацилювання у THF, ацетоні або етилацетаті із застосуванням 1,1 екв. хлорангідриду кислоти при кімнатній температурі у присутності 2,2 екв. триетиламіну. Сполуки, де R5 є С1-С3-алкіл, можна одержати шляхом відновлювального амінування придатним альдегідом у присутності органічної кислоти та придатного боргідриду. Перевага віддається проведенню цього другого амінування у метанолі у присутності оцтової кислоти та ціаноборгідриду натрію при температурі навколишнього середовища. Сполуки, де R5 є С3-С6-циклоалкілкарбоніл, можна одержати шляхом проведення реакції з придатним хлорангідридом циклоалкілкарбонової кислоти в умовах ацилювання, аналогічних описаним вище. 21 В альтернативному варіанті сполуки цього винаходу, де X є -CH=, можна синтезувати за способами, показаними вище на Схемі 2, де спочатку виконують конденсацію факультативно заміщеного R3 3-амінонітробензолу з придатним R1ацилхлоридом із подальшим відновленням нітрогрупи та відновлювальним амінуванням придатним піперидин-4-оном. Аналогічно Схемі 1, сполуки, де R5 є відмінним від водню, можна одержати шляхом ще одного відновлювального амінування по місточковому атому азоту. Також аналогічно Схемі 1, у випадку, коли R7 є групою захисту, сполуки цього винаходу, де R2 є водень, одержують шляхом відщеплення цієї групи. Потім можна безпосередньо одержати подальші сполуки, де R2 є відмінним від водню, шляхом алкілування азоту піперидинільного фрагменту. У типових випадках факультативно заміщений R3 3-амінонітробензол поєднують із придатним розчинником, наприклад, із діоксаном, піридином, THF, N,N-диметилацетамідом тощо. Одержану суміш обробляють придатним хлорангідридом кислоти (1,0-2,0 екв). Реакційну суміш перемішують протягом від приблизно 2 год до 48 год при температурі від приблизно 0°C до 40°C, наприклад, при кімнатній температурі протягом приблизно 16 год. Переносять реакційну суміш в етилацетат або в інший придатний розчинник і промивають послідовно водним розчином HCl (1н.), водним розчином NaOH (1-н.), і насиченим водним розчином NaCl. Після звичайних процедур переробки органічного шару одержують проміжний бензамід. Цей проміжний бензамід додають до підігріто 82711 22 го (від приблизно 35°С до 70°C, наприклад, приблизно 55°C) розчину SnCl2×2H2O в етанолі. Додають концентровану HCl, після чого витримують суміш при перемішуванні при температурі від приблизно 50°C до 65°С, наприклад, приблизно при 60°C, протягом часу від приблизно 20хв до 60хв, наприклад, приблизно 30хв. Охолоджують реакційну суміш, після чого підлуговують її приблизно до рН 14 водним розчином NaOH. Продукт екстрагують придатним розчинником, наприклад, етилацетатом тощо. Після звичайних процедур переробки об'єднаних органічних шарів одержують проміжний амінобензамід. Суміш проміжного амінобензаміду, захищеного при N 4-піперидону та порошкоподібного молекулярного сита (4Å) у придатному розчиннику, наприклад, у THF, дихлоретані, дихлорметані тощо, перемішують в інертній атмосфері. Додають льодяну оцтову кислоту. Через приблизно 1-8 год, наприклад, через приблизно 1 год, додають NaВН(ОС(О)СН3)3. Витримують суміш для проведення реакції протягом приблизно 8-24 год при приблизно 0°С-40°С, наприклад, приблизно при кімнатній температурі. Виливають реакційну суміш у придатний розчинник, наприклад, у дихлорметан, етилацетат тощо, і промивають водним розчином NaOH. Після звичайних процедур переробки органічного шару одержують бажаний піперидинілбензамід. Як і в Схемі 1, містечковий атом азоту можна за бажанням факультативно замістити з одержанням сполук, де R5 відрізняється від водню. 23 Сполуки цього винаходу, де X є -CH=, можна синтезувати за способами, показаними вище на Схемі 3, який включає забезпечення захисту однієї з аміногруп 1,3-діамінобензолу, відновлювальне амінування придатним піперидин-4-оном, відщеплення групи захисту та подальше ацилювання Сполуки цього винаходу, де R3c є фтор, можна синтезувати, як показано на Схемі 4. Після початкового відновлювального амінування 3-аміно-1хлор-2-фторбензолу відповідно заміщеним 4піперидоном перетворюють хлор в аміногрупу з подальшою конденсацією з відповідним R1 82711 24 первинного аміну придатним R1-ацилхлоридом. Умови проведення реакцій аналогічні вказаним вище для Схеми 1 та Схеми 2. Слід також зазначити, що заміщення при місточковому атомі азоту можна за бажанням виконувати перед стадією ацилювання або після неї. ацилгалогенідом. Умови проведення реакцій аналогічні вказаним вище для Схем 1-3. Слід також зазначити, що заміщення при місточковому атомі азоту можна за бажанням виконувати перед стадією ацилювання або після неї. 25 82711 26 Сполуки, де R3c є фтор, a R5 є С1-С3-алкіл, можна синтезувати, як показано на Схемі 5, де за приклад взято R5 = метил. Після початкової конденсації 1-бром-2-фторбензолу з відповідним за міщеним 4-амінопіперидином виконують галогенування бензильного циклу, перетворення галогену в аміногрупу та подальшу конденсацію з відповідним R1-ацилгалогенідом. Сполуки цього винаходу, де R3b є фтор та R5 є С1-С3-алкіл, можна синтезувати, як показано на Схемі 6, де за приклад взято R5 = метил. Після початкової конденсації 1,3-дибром-5-фторбензолу з придатним заміщеним 4-амінопіперидином виконують перетворення залишкового атома брому в аміногрупу та подальшу конденсацію з відповідним R1-ацилгалогенідом. В альтернативному варіанті, 1,3-дифтор-5-нітробензол можна застосувати для початкової конденсації з відповідним заміщеним 4-амінопіперидином із подальшим відновленням нітрогрупи до аміногрупи та подальшою кон денсацію з відповідним R1-ацилгалогенідом. У типових випадках 1,3-дибром-5-фторбензол, розчинений у придатному розчиннику, наприклад, у толуолі, бензолі тощо, змішують із метил-(1метилпіперидин-4-іл)аміном, трет-бутилатом натрію, Pd2dba3 та BINAP і нагрівають до температури від 50°С до 100°С, наприклад, приблизно до 80°C, протягом часу від 1 год до 3 год, наприклад, приблизно 2 год. Реакційну суміш гасять, наприклад, доданням води або іншим відповідним способом. Одержаний проміжний (3-бром-5фторфеніл)-метил-(1-метилпіперидин-4-іл)-амін 27 82711 28 можна переробити із застосуванням загальновідомих процедур, наприклад, видалення розчинника, екстракції та/або додаткового очищення хроматографією тощо. Цей проміжний (3-бром-5-фторфеніл)-метил(1-метилпіперидин-4-іл)-амін потім амінують у положення 3-бензольного циклу, наприклад, шляхом проведення реакції цього продукту з BINAP, Pd2dba3, бензгідриліденаміном та трет-бутилатом натрію, у придатному розчиннику, наприклад, у толуолі тощо, в інертній атмосфері протягом 1-3 год, наприклад, приблизно 2 год, при температурі від 50°C до 100°C, наприклад, приблизно 80°С. Одержаний проміжний продукт обробляють 1M HCl або аналогічним реагентом у придатному розчиннику, наприклад, у THF при температурі від 0°С до температури навколишнього середовища, відповідно до варіанта, якому віддається перевага, при температурі навколишнього середовища, протягом 1-2 год, наприклад, приблизно 1 год. Одержаний проміжний продукт, 5-фтор-N-метил-N-(1метилпіперидин-4-іл)бензол-1,3-діамін, можна потім виділити та очистити із застосуванням загальновідомих процедур, необмежувальними прикладами яких є видалення розчинника, екстракція та/або хроматографія тощо. Потім можна синтезувати кінцеві сполуки шляхом конденсації з R1-ацилхлоридом. У типових випадках проміжний 5-фторамінобензол вводять у реакцію з придатним R1-ацилхлоридом у придатному розчиннику, наприклад, у діоксані, піридині, DMF тощо, при температурі від. кімнатної до при близно 100°C, відповідно до варіанта, якому віддається перевага, від приблизно 50°C до 100°C, до завершення реакції, наприклад, протягом 1-4 год, наприклад, приблизно 2 год. Потім реакцію гасять доданням води, і кінцевий продукт очищають із застосуванням загальновідомих процедур. За альтернативним варіантом, проміжний 5фтор-N-метил-N-(1-метилпіперидин-4-іл)бензол1,3-діамін можна одержати шляхом проведення реакції 1,3-дифтор-5-нітробензолу з метил-(1метилпіперидин-4-іл)аміном у присутності ацетату натрію у придатному розчиннику, наприклад, в етанолі тощо, протягом приблизно 8-16 год, наприклад, приблизно 12 год, при 80-120°С, наприклад, при приблизно 100°С, у закритій трубці. Потім реакцію гасять додаванням води або аналогічним способом, і проміжний (3-фтор-5нітрофеніл)-метил-(1-метилпіперидин-4-іл)амін очищають із застосуванням загальновідомих процедур. Нітрогрупу потім відновлюють до аміногрупи, наприклад, шляхом оброблення залізом та 1M HCl у відповідному розчиннику, наприклад, у метанолі тощо, протягом часу від приблизно 8 год до наступного ранку, наприклад, приблизно 16 год, при температурі від 80°С до 100°C, наприклад, приблизно 100°C. Одержаний проміжний 5-фторN-метил-N-метилпіперидин-4-іл)бензол-1,3-діамін потім можна виділити та очистити із застосуванням загальновідомих процедур. Сполуки цього винаходу, де R3b є фтор і R5 є водень, можна синтезувати, як показано на Схемі 7, де 1,3-дибром-5-фторбензол перетворюють у 1,3-діаміносполуку та конденсують із придатним R1-ацилгалогенідом, після чого піддають відновлювальному амінуванню придатним заміщеним 4амінопіперидином. У типових випадках змішують 1,3-дибром-5фторбензол, бензофенонімін, Рd2(dba)3, BINAP та трет-бутилат натрію у придатному розчиннику, наприклад, у толуолі, ксилолі, 1,4-діоксані тощо і нагрівають, наприклад, до 60-130°C, протягом 8-20 год, наприклад, приблизно 15 год. Реакційну суміш гасять насиченим розчином NaHCO3, екстрагують кілька разів органічним розчинником, наприклад, етилацетатом, дихлорметаном тощо. Органічні шари об'єднують, і розчинник видаляють. Залишок розчиняють у придатному розчиннику, наприклад, у THF, діетиловому ефірі, метанолі тощо, і додають водний розчин HCl, наприклад, 1-6 н. HCl, наприклад, приблизно 5-н. HCl. Реакційну суміш перемішують протягом приблизно 1-3 год при температурі 0-60°C, наприклад, при температурі навколишнього середовища. Потім реакційну суміш розбавляють розбавленим водним розчином HCl і екстрагують системою розчинників етилацетат/гексан або еквівалентною. Органічний шар промивають розбавленим водним розчином HCl, після чого водний шар підлуговують NaOH і екстрагують органічним розчинником, наприклад, дихлорметаном тощо. Екстракт сушать, фільтрують, концентрують і додатково очищають хроматографією, одержуючи проміжну діаміносполуку. Суміш проміжної діаміносполуки та бажаного 29 82711 30 R1-ацилхлориду у придатному розчиннику, наприклад, у діоксані, піридині, THF або DMF, з придатним третинним аміном, наприклад, триетиламіном, N-метилморфоліном або діізопропілетиламіном, перемішують при температурі приблизно 0-40°C до завершення реакції, наприклад, протягом 2-20 год, наприклад, приблизно 12 год. Потім реакцію гасять доданням розбавленого водного розчину NaOH. Після відомих процедур перероблення та очищення одержують проміжний амід. До суміші цього аміду, відповідного 1-заміщеного або Nзахищеного 4-піперидону, оцтової кислоти та молекулярного сита (як правило, 4Å), у придатному розчиннику, наприклад, у THF, дихлоретані, дихлорметані тощо, потім додають триацетоксиборгідрид натрію. Реакційну суміш перемішують протя гом приблизно 8-20 год, наприклад, приблизно 12 год, при температурі 0-40°C, наприклад, при температурі навколишнього середовища. Потім реакцію гасять доданням розбавленого водного розчину NaOH, екстрагують придатним органічним розчинником, наприклад, дихлорметаном, етилацетатом тощо. Органічний шар сушать, фільтрують, концентрують і додатково очищають, наприклад, хроматографією, одержуючи бажаний продукт. Якщо R7 є групою захисту, можна застосувати придатний спосіб видалення групи захисту і одержати сполуки, де R2 є водень. При бажанні незаміщений піперидинільний фрагмент можна потім алкілувати відомими способами відновлювального алкілування і одержати сполуки, де R2 відрізняється від водню. 2,6-дигалогенпіридин (X = Cl або Br) алкілують відповідно заміщеним 4-(метиламіно)піперидином у присутності основи, наприклад, карбонату калію, н-бутиллітію, гідриду натрію тощо, у DMF, ацетонітрилі, THF або аналогічному розчиннику. За альтернативним варіантом 2,6-дигалогенпіридин можна обробити BINAP (або іншим прийнятним лігандом), Pd(OAc)2, піперидином та третбутилатом натрію (або іншою придатною основою) у толуолі (або аналогічному розчиннику) і одержати проміжний 1-метил-4-(N-(6-галогенпіридиніл)метиламінопіперидин. Цей галогенпіридин потім обробляють BINAP (або іншим прийнятним ліган дом), Pd(OAc)2, бензофеноніміном (або іншим еквівалентом аміну) та трет-бутилатом натрію (або іншою придатною основою) у толуолі (або аналогічному розчиннику) і одержують проміжний заміщений 4-(N-(6-амінопіридиніл)-метиламінопіперидин. Цей амін потім ацилюють різноманітними хлорангідридами кислот у піридині, THF, 1,4-діоксані або аналогічних розчинниках і одержують кінцевий продукт. Аналогічно, сполуки, де R5 є етил або пропіл, можна одержати із застосуванням придатного 4-(етиламіно)піперидину або 4(пропіламіно)піперидину. 31 У типових випадках суміш R1-ацилхлориду та 2,6-діамінопіридину у придатному розчиннику, наприклад, у діоксані, THF, DMF тощо, перемішують при температурі від температури навколишнього середовища до приблизно 100°С протягом 2-20 год, наприклад, приблизно 12 год. Після звичайних процедур оброблення, наприклад, екстракції, фільтрування та/або хроматографії, одержують проміжний N-(6-амінопіридин-2-іл)амід. Потімдо суміші вищезгаданого проміжного продукту, придатного 1-заміщеного 4-піперидону, оцтової кислоти та молекулярного сита у придатному розчиннику, наприклад, у THF, дихлоретані, дихлорметані тощо, додають триацетоксиборгідрид натрію. Реакційну суміш перемішують при температурі 0-40°C, наприклад, при температурі навколишнього середовища, протягом приблизно 820 год, наприклад, приблизно 12 год. У типових випадках додають ще раз аліквотні кількості піперидону та триацетоксиборгідриду натрію, і продовжують реакцію із залишковим проміжним N-(6 82711 32 амінопіридин-2-іл)амідом. Потім реакцію гасять доданням розбавленого водного розчину NaOH. Після звичайних процедур перероблення та очищення одержують N-(5-піперидин-4-іламіно)амід. Якщо R7 є бажаним замісником R2, то після остаточного очищення звичайним способом одержують кінцевий продукт. Якщо R7 є групою захисту, можна застосувати придатний спосіб відщеплення групи захисту і одержати сполуки, де R2 є водень. Ці сполуки при бажанні можна піддати додатковому алкілуванню добре відомими способами і одержати кінцеві продукти, де R2 відрізняється від водню. Подані нижче описи підготовчих синтезів та приклади наведено з метою кращого пояснення практики здійснення цього винаходу, і вони не повинні розглядатися як такі, що обмежують його обсяг. Підготовчі синтези Підготовчий синтез 1. N-(3-амінофеніл)-2хлор-4-фторбензамід 33 Змішують 3-нітроанілін (3,0г, 21,7ммоль), дихлорметан (100мл), піридин (2,11мл, 26,0ммоль) та 2-хлор-4-фторбензоїлхлорид (3,07мл, 23,9ммоль). Перемішують при кімнатній температурі протягом ночі. Відфільтровують білий осад, промивають діетиловим ефіром (2x10мл) і сушать у вакуумі, одержуючи 2-хлор-4-фтор-N-(3нітрофеніл)бензамід (4,92г, 77%). Змішують 2хлор-4-фтор-N-(3-нітрофеніл)бензамід (4,92г, 16,7ммоль) з етанолом (150мл), SnCl2×H2O (18,9г, 83,6ммоль) та концентрованою хлористоводневою кислотою (8,24мл, 83,6ммоль). Перемішують при нагріванні зі зворотним холодильником в атмосфері азоту протягом 2 год. Нейтралізують суміш гідроксидом амонію (15мл). Фільтрують через шар целіту, промивають дихлорметаном (2x15мл), розділяють фільтрат, екстрагують дихлорметаном (2x80мл), і сушать об'єднані органічні шари над сульфатом магнію. Фільтрують і концентрують досуха, одержуючи проміжний продукт у вигляді злегка забарвленої твердої речовини (3,04г, 69%). Мас-спектр (іонне розпилення): m/z=265,0 (М+1); 1H ЯМР (DMSO-d6): 10,16 (bs, N-H), 7,60 (dd, J=6,2Гц, 8,6Гц, 1H), 7,54 (dd, J=2,5Гц, 9,0Гц, 1H), 7,30 (td, J=2,5Гц, 8,5Гц, 1H), 7,04 (t, J=2,0Гц, 1H), 6,93 (t, J=8,0Гц, 1H), 6,74 (bd, J=7,9Гц, 1H), 6,29 (dd, J=2,2Гц, 7,9Гц, 1H), 5,10 (bs, 2H). Підготовчий синтез 2. N-(3-амінофеніл)-2хлор-6-фторбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 1, з використанням 2-хлор-6фторбензоїлхлориду (1,0г, 3,39ммоль), одержують вказаний у заголовку проміжний продукт (820мг, 91%). Мас-спектр (іонне розпилення): m/z=265,1 (M+1); 1H ЯМР (DMSO-d6): 10,42 (bs, N-H), 7,50 (td, J=6,2Гц, 8,2Гц, 1H), 7,40 (d, J=8,0Гц, 1H), 7,34 (t, J=8,7Гц, 1H), 7,03 (t, J=2,1Гц, 1H), 6,94 (t, J=8,0Гц, 1H), 6,71 (dd, J=2,1Гц, 8,0Гц, 1H), 6,31 (dd, J=2,1Гц, 8,0Гц, 1H), 5,13 (bs, 2H). Підготовчий синтез 3. N-(3-амінофеніл)-2,6дифторбензамід му Застосовуючи спосіб, аналогічний Підготовчосинтезу 1, з використанням 2,6 82711 34 дифторбензоїлхлориду (1,0г, 3,59ммоль), одержують вказаний у заголовку проміжний продукт (723мг, 81%). Мас-спектр (іонне розпилення): m/z=248,9 (М+1); 1H ЯМР (DMSO-d6): 10,44 (bs, NH), 7,58-7,50 (m, 1H), 7,24-7,17 (m, 2H), 7,02 (t, J=2,0Гц, 1H), 6,94 (t, J=8,0Гц, 1H), 6,72 (bd, J=8,0Гц, 1H), 6,31 (dd, J=2,1Гц, 8,0Гц, 1H), 5,14 (bs, 2H). Підготовчий синтез 4. N-(3-амінофеніл)-2,4дифторбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 1, з використанням 2,6дифторбензоїлхлориду (1,0г, 3,59ммоль), одержують вказаний у заголовку проміжний продукт (664мг, 74%). Мас-спектр (іонне розпилення): m/z=248,9 (M+1); 1H ЯМР (DMSO-d6): 10,08 (bs, NH), 7,68 (dd, J=8,1Гц, 15,1Гц, 1H), 7,38 (td, J=2,5Гц, 10,2Гц, 1H), 7,18 (td, J=2,5Гц, 8,5Гц, 1H), 7,01 (bs, 1H), 6,93 (t, J=7,8Гц, 1H), 6,76 (bd, J=7,8Гц, 1H), 6,29 (dd, J=1,9Гц, 8,0Гц, 1H), 5,10 (bs, 2H). Підготовчий синтез 5. N-(3-амінофеніл)-2,4,6трифторбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 1, із використанням 2,4,6трифторбензоїлхлориду (1,0г, 3,37ммоль), одержують вказану в заголовку сполуку (485мг, 54%). Мас-спектр (іонне розпилення): m/z=266,9 (М+1); 1 H ЯМР (DMSO-d6): 10,43 (bs, N-H), 7,34 (t, J=8,5Гц, 2Н), 6,99 (d, J=1,5Гц, 1H), 6,94 (t, J=7,9Гц, 1H), 6,70 (d, J=8,2Гц, 1H), 6,31 (d, J=8,2Гц, 1H), 5,15 (bs, 2H). Підготовчий синтез 6. N-(3-амінофеніл)-2бромбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 1, із використанням 2бромбензоїлхлориду (1,0г, 3,11ммоль), одержують вказаний у заголовку проміжний продукт (744мг, 82%). Мас-спектр (іонне розпилення): m/z=293,0 (М+1); 1H ЯМР (DMSO-d6): 10,14 (bs, N-H), 7,68 (d, J=8,0Гц, 1H), 7,50-7,43 (m, 2H), 7,37 (td, J=2,5Гц, 7,3Гц, 1H), 7,07 (bs, 1H), 6,92 (t, J=7,8Гц, 1H), 6,74 (bd, J=8,0Гц, 1H), 6,29 (bd, J=8,0Гц, 1H), 5,10 (bs, 2H). 35 Підготовчий хлорбензамід синтез 82711 7. N-(3-амінофеніл)-2 Застосовуючи спосіб, аналогічний Підготовчому синтезу 1, із використанням 2хлорбензоїлхлориду (4,0г, 14,5ммоль), одержують вказаний у заголовку проміжний продукт (2,8г, 78%). Мас-спектр (іонне розпилення): m/z=247,0 (М+1); 1H ЯМР (DMSO-d6): 10,16 (bs, N-H), 7,547,39 (m, 4H), 7,06 (bs, 1H), 6,92 (t, J=8,0Гц, 1H), 6,74 (bd, J=8,0Гц, 1H), 6,28 (bd, J=8,3Гц, 1H), 5,10 (bs, 2H). Підготовчий синтез 8. N-(3-амінофеніл)-2трифторметоксибензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 1, з використанням 2трифторметоксибензоїлхлориду (300мг, 1,01ммоль), одержують вказаний у заголовку проміжний продукт (274мг, 69%) у вигляді білої піни. Мас-спектр (іонне розпилення): m/z=394,2 (M+1); 1 H ЯМР (CDCl3): 8,18 (bs, N-H), 8,07 (d, J=7,5Гц, 1H), 7,55 (t, J=7,7Гц, 1H), 7,45 (t, J=7,5Гц, 1H), 7,34 (d, J=8,0Гц, 1H), 7,21 (s, 1H), 7,13 (t, J=8,0Гц, 1H), 6,68 (d, J=7,7Гц, 1H), 6,41 (d, J=8,0Гц, 1H), 3,703,63 (bm, 1H), 3,38-3,28 (bm, 1H), 3,85-3,77 (bm, 2H), 2,30 (s, 3H), 2,21-2,04 (bm, 4H), 1,57-1,46 (bm, 2H). Підготовчий синтез 9. Трет-бутиловий складний ефір (3-(1-метилпіперидин-4іламіно)феніл)карбамінової кислоти Розчин ди-трет-бутилдикарбонату (5,04г, 23,11ммоль) у хлороформі (100мл + 100мл для ополіскування) додають до розчину 1,3фенілендіаміну (5,0г, 46,23ммоль) у хлороформі (100мл). Перемішують при кімнатній температурі протягом ночі. Промивають водним розчином гідроксиду натрію (1-н., 200мл), і відділяють органічний шар. Очищають флеш-хроматографією (етилацетаm/zексан, від 1/4 до 1/1), і одержують третбутиловий складний ефір (3-аміно-феніл)карбамінової кислоти (4,17г, 87%). Змішують трет-бутиловий складний ефір (3амінофеніл)карбамінової кислоти (0,156г, 0,756ммоль), 1-метилпіперидин-4-он (0,093мл, 36 0,756ммоль), триацетоксиборгідрид натрію (208мг, 0,982ммоль), оцтову кислоту (0,043мл, 0,756ммоль) та дихлорметан (8мл). Перемішують при кімнатній температурі протягом ночі. Розбавляють суміш дихлорметаном (5мл) і двічі промивають водним розчином гідроксиду натрію (10мл, 1-н.). Об'єднують органічні шари і промивають насиченим водним розчином NaCl (10мл). Сушать над сульфатом магнію, фільтрують під зниженим тиском і концентрують досуха. Очищають флешхроматографією на картриджі Biotage® з діоксидом кремнію, елююючи сумішшю (20/1) дихлорметану та 2-н. розчину аміаку у метанолі, і одержують вказану у заголовку сполуку у формі вільної основи. Розчиняють залишок у діетиловому ефірі і обробляють ефірним розчином хлороводню. Одержану гумоподібну масу розтирають з діетиловим ефіром, і одержують вказану в заголовку сполуку у вигляді білої твердої речовини. Т.пл. 124-5°С; масспектр (іонне розпилення): m/z=306,2 (M+1), 1H ЯМР (CDCl3): 7,06 (t, J=8,0Гц, 1H), 6,86 (bs, 1H), 6,51-6,48 (m, 1H), 6,42 (bs, 1H), 6,30-6,27 (m, 1H), 3,60 (bs, 1H), 3,30 (bs, 1H), 2,80 (bd, J=11,8Гц, 2Н), 2,31 (s, 3H), 2,19-2,02 (m, 4H), 1,89 (bs, 2H), 1,52 (s, 9 H). Підготовчий синтез 10. Трет-бутиловий складний ефір (3-(метил-(1-метилпіперидин-4іл)аміно)феніл) карбамінової кислоти Змішують трет-бутиловий складний ефір (3-(1метилпіперидин-4-іламіно)феніл)карбамінової кислоти (Підготовчий синтез 9, 1,15г, 3,77ммоль), метанол (15мл) та формальдегід (37% водний розчин, 0,92мл, 11,3ммоль). Перемішують при кімнатній температурі протягом 45хв. Охолоджують до 0°C. Додають оцтову кислоту (0,22мл, 3,77ммоль) та ціаноборгідрид натрію (414мг, 6,59ммоль). Перемішують при кімнатній температурі протягом ночі. Концентрують досуха. Розчиняють залишок у суміші етилацетату з гексаном (2/1, 20мл) промивають водним розчином гідроксиду натрію (1-н., 2x20мл). Органічний шар відділяють і сушать над сульфатом магнію. Фільтрують і концентрують під зниженим тиском. Очищають флеш-хроматографією при елююванні сумішшю дихлорметану з елююванням 2-н. розчином аміаку в метанолі (20/1), і одержують вказану в заголовку сполуку (990мг, 82%). Мас-спектр (іонне розпилення): m/z=320,3 (M+1). Підготовчий синтез 11. Тригідрохлорид 1метил-4-(N-(3-амінофеніл)-Nметиламіно)піперидину Змішують ацетилхлорид (5мл) зі зневодненим 37 метанолом (10мл) при 0°C в атмосфері азоту. Перемішують протягом 1 год при 0°C. Додають розчин трет-бутилового складного ефіру (3-(метил-(1метилпіперидин-4-іл)аміно)феніл)-карбамінової кислоти (Підготовчий синтез 10, 990мг, 3,1ммоль) у метанолі (2мл). Перемішують протягом ночі. Концентрують під зниженим тиском. Розтирають із діетиловим ефіром (1мл), і одержують вказаний в заголовку проміжний продукт (671мг, 66%). Масспектр (вільна основа, іонне розпилення): m/z=220,3 (M+1). Елементний аналіз: обчислено для C13H24Cl3N3Cl3: C, 47,50; H, 7,36; N, 12,78. Знайдено: C, 47,28; H, 7,28; N, 12,46. Підготовчий синтез 12. 4-(2-гідроксіетил)-1ізопропіл-1Н-піразол Змішують 2,3-дигідрофуран (25мл, 0,33 моль) та триетилортоформіат (93,3мл, 0,56моль), а потім повільно додають діетилетерат трифториду бору (2,0мл, 0,017 моль) при інтенсивному перемішуванні. Витримують для проходження реакції протягом 18 год. Дистилюють реакційну суміш при 60°C під залишковим тиском 8мМ рт.ст. для видалення надлишку 2,3-дигідрофурану та триетилортоформіату. Частину одержаного залишку (10г, 45ммоль) нагрівають зі зворотним холодильником в 1-н. HCl з ізопропіл-гідразином (3,4г, 45ммоль). Через 2 год температуру знижують до 80°C, і реакційну суміш перемішують протягом 18 год. Після охолодження до кімнатної температури суміш підлуговують 1-н. NaOH до рН>12 і розбавляють CH2Cl2. Відділяють водний шар і двічі екстрагують його CH2Cl2, об'єднують органічні шари, сушать над MgSO4 і концентрують. Після хроматографії на силікагелі при градієнтному елююванні 0-10% (2M NH3 у метанолі) в CH2Cl2 одержують вказаний в заголовку проміжний продукт у вигляді коричневої твердої речовини (3,6г, 52%). Мас-спектр (іонне розпилення): m/z= 155,2 (M+1); 1Н ЯМР (DMSO, млн-1) 7,52 (s, 1H), 7,24 (s, 1H), 4,59 (t, J=5,5Гц, 10,6Гц, 1H), 4,39 (m, 1H), 3,51 (m, 2H), 2,51 (m, 2H), 1,38 (s, 3H), 1,35 (s, 3H). Підготовчий синтез 13. 2-хлор-4-фтор-N-(4фтор-3-нітрофеніл)бензамід Змішують 4-фтор-3-нітроанілін (1,0г, 6,4ммоль) з діоксаном (20мл). Додають до суміші 2-хлор-4фторбензоїлхлорид (1,6г, 8,3ммоль). Перемішують реакційну суміш протягом ночі при кімнатній тем 82711 38 пературі. Переливають суміш в етилацетат (220мл), після чого промивають послідовно водним розчином HCl (1-н., 50мл), водним розчином NaOH (1-н., 50мл), насиченим водним розчином NaCl (50мл). Органічний шар сушать над безводним сульфатом натрію, після чого випарюють розчинник під зниженим тиском. Залишок додатково очищають хроматографією на силікагелі при градієнтному елююванні 10-30% етилацетату в гексані, і одержують вказаний в заголовку проміжний продукт (1,7г, вихід 85%). Мас-спектр (іонне розпилення): m/z=313,0 (M+1). Підготовчий синтез 14. N-(3-аміно-4фторфеніл)-2-хлор-4-фторбензамід 2-хлор-4-фтор-N-(4-фтор-3нітрофеніл)бензамід (Підготовчий синтез 11, 1г, 3,2ммоль) додають до підігрітого (55°С) розчину SnCI2×2H2O (3,6г, 16ммоль) в етанолі (25мл). Додають концентровану HCl (25мл). Перемішують і нагрівають суміш при 60°С протягом 30хв. Охолоджують суміш, після чого підлуговують її водним розчином NaOH до рН 14. Екстрагують продукт тричі етилацетатом (3x150мл). Об'єднують органічні шари і сушать над безводним сульфатом натрію. Випарюють розчинник під зниженим тиском. Залишок додатково очищають хроматографією на силікагелі при градієнтному елююванні 10-50% етилацетату в гексані, і одержують вказаний в заголовку проміжний продукт (800мг, вихід 89%). Мас-спектр (іонне розпилення): m/z=283,0 (M+1). Підготовчий синтез 15. 2,4-дифтор-N-(4-фтор3-нітрофеніл)бензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 13, з використанням 4-фтор-3нітроаніліну (1,0г, 6,4ммоль), діоксану (20мл) та 2,4-дифторбензоїлхлориду (1,46г, 8,3ммоль) одержують вказаний в заголовку проміжний продукт (1,6г, вихід 84%). Мас-спектр (іонне розпилення): m/z=297,0 (M+1). Підготовчий синтез 16. 2,4-дифтор-N-(3-аміно4-фторфеніл)бензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 14, із використанням 2,4-дифтор-N-(4 39 фтор-3-нітрофеніл)бензаміду (Підготовчий синтез 13) (1,0г, 3,38ммоль), SnCl2×2H2O (3,8г, 16,9ммоль), етанолу (25мл) та концентрованої HCl (25мл), одержують вказаний в заголовку проміжний продукт (803мг, вихід 89%). Мас-спектр (іонне розпилення): m/z=267,0 (M+1). Підготовчий синтез 17. 1-метил-4-(3нітрофеніламіно)піперидин Змішують 3-нітроанілін (25,0г, 180,0ммоль), 1метил-4-піперидон (40,9мл, 360,0ммоль) та оцтову кислоту (21,7мл, 360,0ммоль) у 350мл дихлоретану. Перемішують при кімнатній температурі протягом 0,5 год. Додають кількома порціями триацетоксиборгідрид натрію (76,4г, 360,0ммоль), і перемішують реакційну суміш при кімнатній температурі протягом 2 днів. Гасять реакційну суміш доданням насиченого водного розчину NaHCO3 і розподіляють між CH2Cl2 та водою. Встановлюють рН водної фази приблизно 8, і екстрагують її тричі CH2Cl2. Змішують органічні фази і промивають насиченим водним розчином NaCl, сушать над MgSO4 і концентрують. Після додаткового очищення хроматографією на силікагелі при градієнтному елююванні 1-10% метанолу в етилацетаті одержують вказаний в заголовку проміжний продукт (23,8г, вихід 56%). Мас-спектр (іонне розпилення): m/z=236,2 (M+1). Елементний аналіз: обчислено для C12H17N3O2×0,3H2O: C, 59,88; H, 7,37; N, 17,45. Знайдено: C, 60,07; H, 7,18; N, 17,09. В альтернативному варіанті, до розчину 3нітроаніліну (360г, 2,6 моль) в дихлорметані (7,2л) додають частинами в атмосфері азоту триацетоксиборгідрид натрію (1,38кг, 6,5моль) на протязі 1 год. Потім додають оцтову кислоту (370мл, 6,5моль) із такою швидкістю, щоб температура реакційної суміші не перевищувала 25°С, після чого додають 1-метил-4-піперидон (450г, 3,98моль) протягом 150хв, підтримуючи температуру нижче 25°С. Перемішують суміш при кімнатній температурі протягом 3 год. Додають додаткові кількості триацетоксиборгідриду натрію (280г, 1,32моль), оцтової кислоти (74мл, 1,29моль) та 1метил 4-піперидону (90г, 0,8моль), і перемішують суміш протягом ночі при кімнатній температурі. Гасять реакційну суміш доданням води (4л), і встановлюють рН в межах 8-9, додаючи 30% розчин гідроксиду натрію. Екстрагують органічний шар дихлорметаном, і промивають водний шар дихлорметаном (2л). Промивають об'єднані органічні шари водою (1л), сушать над MgSO4 (100г) і концентрують (до половинного об'єму). Фільтрують одержану суспензію, промивають дихлорметаном (500мл) і концентрують фільтрати під зниженим тиском (40°С), одержуючи неочищений 1-метил-4(3-нітрофеніламіно)піперидин у вигляді твердої речовини оранжевого кольору (620г). Суспендують неочищений 1-метил-4-(3нітрофеніламіно)піперидин (590г) у суміші води (5,9л) та ізопропанолу (590мл). Перемішують су 82711 40 міш при кімнатній температурі протягом 5 год. Відділяють фільтруванням одержані жовті кристали, промивають сумішшю води (600мл) та ізопропанолу (60мл), сушать під зниженим тиском при кімнатній температурі протягом ночі, одержуючи 1метил-4-(3-нітрофеніламіно)піперидин (524г, вихід 94%). Підготовчий синтез 18. Триацетат 1-метил-4(3-амінофеніламіно)піперидину Змішують 1-метил-4-(3нітрофеніламіно)піперидин (Підготовчий синтез 17) (8,2г, 34,8ммоль), оцтову кислоту (6,3г, 110ммоль) та паладій на вугіллі (10%, 2,1г) у 300мл етанолу. Вакуумують реакційну посудину, заповнюють її газоподібним Н2 (під атмосферним тиском), і перемішують при кімнатній температурі протягом 18 год. Фільтрують через шар целіту, промивають етилацетатом і концентрують, одержуючи 13,1г вказаного в заголовку проміжного продукту, який, як правило, використовують у подальших реакціях без додаткового очищення. Невелику кількість вільної основи аміну було додатково очищено шляхом розчинення триацетату в метанолі, завантаження у колонку з 1г SCX (mega bond elut®, фірма Varian) і промивання метанолом, елюювання 2M розчином NH3 у метанолі і концентрування у вакуумі. Мас-спектр (іонне розпилення): m/z=206,2 (M+1); 1H ЯМР d (CDCl3,млн-1) 6,93 (t, J=7,9, 15,8Гц, 1H), 6,03 (d, J=7,9Гц, 2Н), 5,94 (s, 1H), 3,46 (bs, 3H), 3,24 (bs, 1H), 2,79 (m, 2H), 2,28 (s, 3H), 2,10 (m, 4H), 1,40 (m, 2H). В альтернативному варіанті, у посудину Парра місткістю 2л завантажують 1-метил-4-(3нітрофеніламіно)піперидин (100г; 0,425 моль), 10% Pd/C (5г) та метанол (1л). Струшують суміш протягом ночі під початковим тиском водню 4атм, підтримуючи температуру нижче 35°С. Відділяють каталізатор фільтруванням, і промивають його метанолом (100мл). Концентрують фільтрати під зниженим тиском, і одержують 1-метил-4-(3амінофеніламіно)піперидин у вигляді червоного масла (95,7г, вихід 100%), яке кристалізується при стоянні при кімнатній температурі. Підготовчий синтез 19. 1-метил-4-(3-хлор-2фторфеніламіно)піперидин Змішують З-хлор-2-фторанілін (4,37г, 30ммоль), 1-метилпіперидин-4-он (3,39г, 30ммоль), триацетоксиборгідрид натрію (5,26г, 33ммоль) та оцтову кислоту (5,4г, 90ммоль) і перемішують при кімнатній температурі протягом 41 ночі. Розподіляють реакційну суміш між дихлорметаном та насиченим водним розчином NaCl, який містить NH4OH, сушать над безводним сульфатом натрію, випарюють і очищають на колонці із силікагелем (110г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують 2,34г вказаної в заголовку сполуки (вихід 32%). Мас-спектр (іонне розпилення): m/z=243 (M+1); 1H ЯМР (CDCl3): 6,88 (ddd, 1H), 6,63 (ddd, 1H), 6,56 (dd, 1H), 3,85 (br d, 1H), 3,28 (m, 1H), 2,80 (m, 2Н), 2,30 (s, 3H), 2,13 (m, 2Н), 2,04 (m, 1H), 1,53 (m, 2Н). (файл: mn4-b6к-284-2). Підготовчий синтез 20. 2-фтор-N-(1метилпіперидин-4-іл)бензол-1,3-діамін Змішують 1-метил-4-(3-хлор-2фторфеніламіно)піперидин (Підготовчий синтез 19) (0,439г, 1,8ммоль), бензофенонімін (0,393г), Pd2(dba)3 (4,1мг), 2(дициклогексилфосфіно)біфеніл (4,7мг) та третбутилат натрію (0,242г) із толуолом (5мл) і нагрівають зі зворотним холодильником протягом ночі. Розчиняють реакційну суміш у метанолі і фільтрують через колонку з SCX (10г), промивають метанолом, елююють продукт 2M NH3 у метанолі, випарюють розчинник і додатково очищають продукт на колонці із силікагелем (35г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують неочищений 1-метил4-(3-бензгідриліденаміно-2фторфеніламіно)піперидин (0,372г). До розчину проміжного похідного бензгідриліденілу у THF (10мл) додають 1-н. HCl (2мл) і перемішують при кімнатній температурі протягом 30хв. Підлуговують NH4OH, екстрагують етилацетатом, сушать над безводним сульфатом натрію, випарюють і очищають на колонці із силікагелем (110г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують вказаний у заголовку проміжний продукт (0,08г). Мас-спектр (іонне розпилення): m/z=224 (М+1); 1H ЯМР (CDCl3): 6,75 (ddd, 1H), 6,12 (m, 2Н), 3,70 (br d, 1H), 3,62 (br s, 2H), 3,25 (m, 1H), 2,80 (m, 2H), 2,29 (s, 3H), 2,10 (m, 4H), 1,53 (m, 2H). Підготовчий синтез 21. 1-метил-4-N-(3-хлор-2фторфеніл)метиламіно)-піперидин Змішують 1-метил-4-(3-хлор-2фторфеніламіно)піперидин (Підготовчий синтез 19) (0,961г), формальдегід (37%) (0,973г), ціаноборгідрид натрію (0,917г) та оцтову кислоту (1,66г) у метанолі (50мл) і перемішують при кімнатній температурі протягом ночі. Додають формальдегід (37%) (0,973г), ціаноборгідрид натрію (0,917г) та 82711 42 оцтову кислоту (2мл) і перемішують при кімнатній температурі протягом ночі. Розподіляють реакційну суміш між дихлорметаном та насиченим водним розчином NaCl, сушать над безводним сульфатом натрію, випарюють і очищають на колонці із силікагелем (110г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують 1,06г вказаного в заголовку проміжного продукту. Підготовчий синтез 22. 1-метил-4-(N-(3-аміно2-фторфеніл)метиламіно)-піперидин Суміш 1-метил-4-(N-(3-хлор-2фторфеніл)метиламіно)піперидину (Підготовчий синтез 21) (0,77г), бензофеноніміну (0,652г), Рd2(dba)3 (6,9мг), рацемічного BINAP (7,9мг) та трет-бутилату натрію (0,404г) у толуолі (10мл) нагрівають протягом 44 год. Розбавляють реакційну суміш метанолом, завантажують у колонку із SCX (10г), промивають метанолом, елююють продукт 2M NH3 у метанолі, випарюють розчинник і очищають на колонці із силікагелем (110г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують 0,21г 1метил-4-(N-(3-бензгідриліденіламіно-2фторфеніл)метиламіно)піперидину. До розчину цього діаміну (0,21г) додають 2мл 1-н. HCl і перемішують протягом 30 хв, підлуговують NH4OH, екстрагують етилацетатом, сушать над безводним сульфатом натрію, випарюють і очищають на колонці із силікагелем (10г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують 44мг вказаного в заголовку проміжного продукту. Підготовчий синтез 23. 1-метил-4-(N-(2фторфеніл)метиламіно)-піперидин Змішують 1-бром-2-фторбензол (3,50г), 1метил-4-(метиламіно)-піперидин (2,56г), Pd2(dba)3 (0,366мг), рацемічний BINAP (0,498г) та третбутилат натрію (2,70г) у толуолі (40мл) і нагрівають зі зворотним холодильником протягом 2 днів. Фільтрують через шар целіту, розподіляють між дихлорметаном та насиченим водним розчином NaCl, сушать над безводним сульфатом натрію, випарюють і очищають на колонці із силікагелем (350г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують 1,1г вказаного в заголовку проміжного продукту. Підготовчий синтез 24. 1-метил-4-N-(2-фтор-3бромфеніл)метиламіно)-піперидин 43 До розчину 2,2,6,6-тетраметил-піперидину (0,97г) у THF (10мл) додають при -78°С нбутиллітій (1,6M у гексані, 4,3мл) і перемішують протягом 30 хв. Додають частинами розчин 1метил-4-(N-(2-фторфеніл)-метиламіно)піперидину (Підготовчий синтез 23, 1,02г) у THF (10мл) і перемішують протягом 10 хв. Додають краплями 1,2дибром-1,1,2,2-тетрахлоретан (1,50г) у THF (10мл) і перемішують протягом 1 год. Відстороняють охолоджувальну баню, і перемішують суміш протягом 30 хв. Розподіляють реакційну суміш між дихлорметаном та насиченим водним розчином NaCl, сушать над безводним сульфатом натрію, випарюють і очищають на колонці із силікагелем (110г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують 0,49г вказаного в заголовку проміжного продукту. Підготовчий синтез 25. 1-метил-4-(N-(2-фтор3-амінофеніл)метиламіно)-піперидин Змішують 1-метил-4-(N-(2-фтор-3бромфеніл)металаміно)піперидин (Підготовчий синтез 24, 0,42г), бензофенонімін (0,303г), Pd2(dba)3 (25мг), рацемічний BINAP (35мг) та третбутилат натрію (0,187г) у толуолі (10мл) і нагрівають зі зворотним холодильником протягом 3 год. Розбавляють реакційну суміш метанолом (5мл), завантажують у колонку із SCX (10г), промивають метанолом, елююють продукт 2M NH3 у метанолі, випарюють розчинник і додатково очищають на колонці із силікагелем (10г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують 0,44г вказаного в заголовку проміжного продукту. Підготовчий синтез 26. 1-метил-4-(N-(2-фтор3-хлорфеніл)етиламіно)-піперидин До розчину 1-метил-4-(3-хлор-2фторфеніламіно)піперидину (Підготовчий синтез 19) (0,45г), ціаноборгідриду натрію (0,123г) та трифтороцтової кислоти (0,633г) у метанолі (20мл) додають ацетальдегід (0,817г) і нагрівають при 80°C у герметично закритій трубці протягом 3 днів. Завантажують реакційну суміш у колонку із SCX (10г), промивають метанолом, елююють продукт 2M NH3 у метанолі, випарюють розчинник і додатково очищають на колонці із силікагелем (35г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у 82711 44 метанолі, і одержують 0,50г вказаного в заголовку проміжного продукту у вигляді безбарвного масла. Мас-спектр (іонне розпилення): m/z=271 (M+1); 1H ЯМР (CDCl3): 6,94 (m, 3H), 3,14 (q, J=7,0Гц, 2Н), 3,06 (m, 1H), 2,84 (br d, 2H), 2,22 (s, 3H), 1,93 (m, 2H), 1,74 (m, 4H), 0,95 (t, J=7,0Гц, 3Н). Підготовчий синтез 27. 1-метил-4-(N-(2-фтор3-амінофеніл)етиламіно)-піперидин Змішують 1-метил-4-(N-(2-фтор-3хлорфеніл)етиламіно)піперидин (Підготовчий синтез 26) (0,367г), бензофенонімін (0,295г), Рd2((dba)3 (50мг), 2-(ди-трет-бутилфосфіно)біфеніл (32мг) та трет-буптат натрію (0,182г) у толуолі (10мл) і нагрівають зі зворотним холодильником протягом 3 днів. Розбавляють реакційну суміш метанолом (5мл), через 30хв після додання 2мл 5н. HCl завантажують у колонку із SCX (10г), промивають метанолом, елююють продукт 2M NH3 у метанолі, випарюють розчинник і додатково очищають на колонці із силікагелем (35г), застосовуючи градієнтне елюювання сумішами дихлорметан-2M NH3 у метанолі, і одержують 39мг вказаної в заголовку сполуки. Мас-спектр (електророзпилення): m/z=252 (М+1). Підготовчий синтез 28. 1-метил-4-(N-(3-нітро5-фторфеніл)метиламіно)-піперидин Змішують 1,3-дифтор-5-нітро-бензол (1,78мл, 15,7ммоль), 1-метил-4-(метиламіно)піперидин (2,74мл, 18,85ммоль), ацетат натрію (2,45г, 29,8ммоль) та абсолютний етанол (10мл) у герметично закритій трубці. Нагрівають при 100°С та перемішують протягом 16 год. Охолоджують реакційну суміш до температури навколишнього середовища і виливають у воду (100мл). Екстрагують етилацетатом (2x100мл). Об'єднані органічні шари промивають насиченим водним розчином NaCl (100мл), сушать над сульфатом натрію, фільтрують і концентрують. Залишок очищають флешхроматографією на силікагелі з елююванням 10% (2M NH3 у метанолі) у CH2Cl2, і одержують 0,06г (1,4%) вказаного в заголовку проміжного продукту. 1 H ЯМР (CDCl3): 7,3 (m, 1H), 7,2 (m, 1H), 6,7 (m, 1H), 3,6 (m, 1H), 3,0 (m, 2Н), 2,8 (s, 3H), 2,3 (s, 3H), 2,2 (m, 2H), 1,9 (m, 2Н), 1,7 (m, 2Н). Підготовчий синтез 29. 1-метил-4-(N-(3-аміно5-фторфеніл)метиламіно)-піперидин 45 82711 Змішують 1-метил-4-(N-(3-нітро-5фторфеніл)метиламіно)піперидин (Підготовчий синтез 28) (0,06г, 0,22ммоль), порошкоподібне залізо (0,06г, 1,12ммоль), метанол (5мл) та 1M HCl (0,22мл, 0,22ммоль), перемішують і нагрівають зі зворотним холодильником протягом 18 год. Охолоджують реакційну суміш до кімнатної температури, розбавляють етилацетатом (50мл) і додають 1-н. розчин гідроксиду натрію до лужної реакції (рН=9). Відділяють органічний шар, промивають насиченим водним розчином NaCl, сушать над сульфатом натрію, фільтрують і концентрують, одержуючи 0,036г (69%) вказаного в заголовку проміжного продукту. 1H ЯМР (CDCl3): 5,9 (m, 1H), 5,7 (m, 2Н), 3,6 (bs, 2H), 3,4 (m, 1H), 2,9 (m, 2Н), 2,7 (s, 3H), 2,3 (s, 3H), 2,0 (m, 2Н), 1,8 (m, 2Н), 1,7 (m, 2Н). Підготовчий синтез 30. 1-метил-4-(N-(3-бром5-фторфеніл)метиламіно)-піперидин Змішують 1,3-дибром-5-фторбензол (5,0г, 19,7ммоль), 1-метил-4-(метиламіно)піперидин (2,58мл, 17,7ммоль), 2,2'-біс(дифенілфосфіно)1,1’-динафтил (0,49г, 0,79ммоль), трет-бутилат натрію (2,57г, 27,58ммоль) та толуол (100мл), перемішують і нагрівають при 80°C. Через 10хв додають Рd2((dba)3 (0,49г, 0,79ммоль). Після 3 год витримування при 80°С охолоджують суміш до температури навколишнього середовища. Розбавляють суміш етилацетатом (100мл) і промивають водою (50мл). Органічний шар сушать над сульфатом натрію, фільтрують і концентрують, одержуючи масло. Цей залишок очищають флешхроматографією на силікагелі з елююванням 10% (2M NH3 у метанолі) у CH2Cl2, і одержують 2,95г (55%) вказаного в заголовку проміжного продукту. 1 H ЯМР (CDCl3): 6,6 (s, 1H), 6,5 (m, 1H), 6,3 (m, 1H), 3,5 (m, 1H), 2,9 (m, 2H), 2,7 (s, 3H), 2,3 (s, 3H), 2,0 (m, 2H), 1,8 (m, 2H), 1,7 (m, 2H). Підготовчий синтез 31. 1-метил-4-(N-(3-аміно5-фторфеніл)метиламіно)-піперидин Змішують 1-метил-4-(N-(3-бром-5 46 фторфеніл)метиламіно)піперидин (Підготовчий синтез 30, 2,90г, 9,63ммоль), бензофенонімін (1,94мл, 11,55ммоль), 2,2'-біс(дифенілфосфіно)1,1’-бінафтил (0,24г, 0,39ммоль), трет-бутилат натрію (1,26г, 13,48ммоль), та толуол (60мл), перемішують і нагрівають до 80°C. Через 10 хв додають Рd2((dba)3 (0,17г, 0,19ммоль). Після витримування протягом 3 год при 80°С охолоджують до температури навколишнього середовища. Розбавляють суміш етилацетатом (100мл) і промивають водою (50мл). Відділяють органічний шар, сушать над сульфатом натрію, фільтрують і концентрують. Одержаний матеріал розчиняють у тетрагідрофурані (120мл) і обробляють 1M водним розчином хлористоводневої кислоти (40мл). Після перемішування при кімнатній температурі протягом 1 год додають 2M розчин гідроксиду натрію до лужної реакції (21мл). Екстрагують етилацетатом (2x100мл). Органічний шар промивають насиченим водним розчином NaCl (75мл), сушать над сульфатом натрію, фільтрують і концентрують, одержуючи масло. Цей залишок очищають флешхроматографією на силікагелі з елююванням 10% (2M NH3 у метанолі) у CH2Cl2, і одержують 1,96г (86%) вказаної в заголовку сполуки. Підготовчий синтез 32. 1,3-діаміно-5фторбензол Додають 1,3-дибром-5-фторбензол (5,078г, 20ммоль), бензофенонімін (8,700г, 48ммоль), Pd2(dba)3 (366мг, 0,4ммоль), BINAP (747мг, 1,2ммоль) та трет-бутилат натрію (4,998г, 52ммоль) до толуолу (100мл). Нагрівають реакційну суміш при 80°C протягом 15 год. Гасять реакцію насиченим розчином NaHCO3. Екстрагують суміш етилацетатом тричі. Об'єднані органічні шари промивають насиченим водним розчином NaCl, сушать над Na2SO4, фільтрують і концентрують, одержуючи залишок. Цей залишок розчиняють у THF (80мл), додають 5-н. HCl (14мл) і перемішують протягом 2 год. Розбавляють реакційну суміш 0,1н. HCl і екстрагують сумішшю етилацетаm/zексан (1:2) двічі. Об'єднані органічні шари промивають один раз 0,1-н. HCl, змішують водні шари, доводять до рН>11 за допомогою 5-н. NaOH. Каламутну суміш екстрагують CH2Cl2 тричі. Змішують органічні шари, сушать над Na2SO4, фільтрують і концентрують, одержуючи масло оранжевого кольору. Це масло очищають флешхроматографією на силікагелі з елююванням 3060% етилацетату в гексані, і одержують вказаний у заголовку проміжний продукт у вигляді жовтого масла (1,955г, вихід 77%). Мас-спектр (іонне розпилення): m/z=127,1 (M+1); 1H ЯМР (CDCl3,млн.-1): 5,82 (m, 3H), 3,67 (s, br, 2H). Підготовчий синтез 33. 1-метил-4-(N-(6бромпіридиніл)-метиламінопіперидин 47 82711 48 Мас-спектр (іонне розпилення): m/z =221,2 (M+1). Елементний аналіз: обчислено для C12H20N4×0,1CH2Cl2: C, 63,51; H, 8,90; N, 24,49. Знайдено: C, 63,42; H, 8,56; N, 24,25. Підготовчий синтез 35. 1-метил-4-(N-(6хлорпіридин-2-іл)метиламіно)-піперидин Розчиняють 2,6-дибромпіридин (5,0г, 21,1ммоль), (±)-BINAP (1,09г, 1,76ммоль) та Pd2(dba)3 (805мг, 0,88ммоль) у толуолі (50мл). Перемішують і додають 1-метил-4(метиламіно)піперидин (2,56мл, 17,6ммоль), а потім трет-бутилат натрію (2,37г, 24,6ммоль). Нагрівають реакційну суміш при 80°C протягом 40 год. Охолоджують реакційну суміш до кімнатної температури і розподіляють між етилацетатом та водою. Відділяють органічний шар, і екстрагують водний шар дихлорметаном (2x50мл). Змішують органічні екстракти, сушать над MgSO4, фільтрують і концентрують у вакуумі. Залишок завантажують у колонку із SCX і промивають метанолом. Елююють 2M розчином аміаку в метанолі, і концентрують елюат у вакуумі. Продукт додатково очищають хроматографією на колонці із силікагелем, застосовуючи градієнтне елюювання сумішами 2-10% (2М NH3 у метанолі) з CH2Cl2, і одержують вказаний у заголовку проміжний продукт (632мг, вихід 13%). Масспектр (іонне розпилення): m/z 286,0 (М+1); 1H ЯМР: d (CDCl3,млн.-1) 7,25 (m, 1H), 6,65 (d, J=8,0Гц, 1H), 6,35 (d, J=8,4Гц, 1H), 4,37 (m, 1H), 2,94 (m, 2H), 2,85 (s, 3H), 2,30 (s, 3H), 2,13 (m, 2H), 1,85 (m, 2H), 1,68 (m, 2H). Підготовчий синтез 34. 1-метил-4-(N-(6амінопіридиніл)-метиламінопіперидин Змішують 1-метил-4-(N-(6бромпіридиніл)метиламінопіперидин (1,02г, 3,59ммоль) (Підготовчий синтез 33), (±)-BINAP (224мг, 0,36ммоль) та Рd2((dba)3 (164мг, 0,18ммоль) у толуолі (20мл). Додають до реакційної суміші бензофенонімін (723мкл, 4,31ммоль) та трет-бутилат натрію (483мг, 5,03ммоль) і нагрівають при 80°С протягом 19 год. Охолоджують реакційну суміш до кімнатної температури і розподіляють між етилацетатом та водою. Відділяють органічний шар, і екстрагують водний шар дихлорметаном (2x50мл). Змішують органічні екстракти, сушать над MgSO4, фільтрують і концентрують у вакуумі. Залишок розчиняють у 50мл суміші THF/H2O (1:1) і обробляють 50мл 1-н. водного розчину HCl протягом 2 год. Завантажують розчин у колонку із SCX і промивають послідовно сумішшю THF/H2O (1:1), метанолом і 2M розчином аміаку в метанолі. Промивний розчин з лужною реакцією концентрують у вакуумі, і залишок очищають хроматографією на колонці із силікагелем, застосовуючи градієнтне елюювання сумішами 2-10% (2М NH3 у метанолі) з CH2Cl2, і одержують вказаний у заголовку проміжний продукт (459мг, вихід 58%). Розчиняють 1-метил-4-(метиламіно)піперидин (10мл, 68,8ммоль) у тетрагідрофурані (50мл) і охолоджують до -78°С. Повільно додають до реакційної суміші н-бутиллітій (1,6-н. розчин у гексані, 43мл, 68,8ммоль) і перемішують при -78°С протягом 30хв. Підігрівають реакційну суміш до кімнатної температури і перемішують протягом 30хв. Потім знов охолоджують реакційну суміш до -78°С, і додають 2,6-дихлорпіридин (11,2г, 75,7ммоль) у тетрагідрофурані (50мл). Перемішують реакційну суміш при -78°С протягом 15хв, підігрівають до кімнатної температури, а потім нагрівають при 60°C протягом 19 год. Охолоджують реакційну суміш до кімнатної температури і розподіляють між етилацетатом та водою. Відділяють органічний шар, і екстрагують водний шар дихлорметаном (2x50мл). Змішують органічні екстракти, сушать над MgSO4, фільтрують і концентрують у вакуумі. Залишок очищають хроматографією на колонці із силікагелем, застосовуючи градієнтне елюювання сумішами 2-10% (2М NH3 у метанолі) з CH2Cl2, і одержують вказаний у заголовку проміжний продукт (11,91г, 72%). Мас-спектр (іонне розпилення): m/z=240,1 (М+1); 1H ЯМР: d (CDCl3,млн.-1) 7,34 (t, J=7,6, 16,0Гц, 1H), 6,50 (d, J=8,0Гц, 1H), 6,33 (d, J=8,8Гц, 1H), 4,41 (m, 1H), 2,94 (m, 2H), 2,86 (s, 3H), 2,32 (s, 3H), 2,15 (m, 2H), 1,84 (m, 2H), 1,68 (m, 2H). Підготовчий синтез 36. 1-метил-4-(N-(6амінопіридин)метиламіно)-піперидин Змішують 1-метил-4-(N-(6-хлорпіридин-2іл)метиламіно)піперидин (Підготовчий синтез 35, 1,62г, 6,76ммоль), (±)-BINAP (420мг, 0,68ммоль) та Pd2(dba)3 (310мг, 0,34ммоль) у толуолі (15мл). Додають до реакційної суміші бензофенонімін (1,36мл, 8,11ммоль) та трет-бутилат натрію (910мг, 9,46ммоль) і нагрівають при 80°C протягом 20 год. Охолоджують реакційну суміш до кімнатної температури і розподіляють між етилацетатом та водою. Відділяють органічний шар, і екстрагують водний шар дихлорметаном (2x50мл). Змішують органічні екстракти, сушать над MgSO4, фільтрують і концентрують у вакуумі. Залишок завантажують у колонку із SCX, промивають метанолом, 49 елююють 2M розчином аміаку в метанолі і концентрують у вакуумі. Залишок розчиняють у 50мл суміші THF/H2O (1:1) і обробляють 50мл 1-н. водного розчину HCl протягом 2 год. Завантажують розчин у колонку із SCX і промивають послідовно сумішшю THF/H2O (1:1), метанолом і 2M розчином аміаку в метанолі. Промивний розчин із лужною реакцією концентрують у вакуумі, і залишок очищають хроматографією на колонці із силікагелем, застосовуючи градієнтне елюювання сумішами 2-10% (2M NH3 у метанолі) з CH2Cl2, і одержують вказаний у заголовку проміжний продукт (1,38г, 93%). Мас-спектр (іонне розпилення): m/z =221,1 (М+1); 1 H ЯМР: d (CDCl3, млн-1) 7,23 (t, J=9,2Гц, 17,2Гц, 1H), 5,86 (d, J=8,0Гц, 1H), 5,78 (d, J=7,2Гц, 1H), 4,46 (m, 1H), 4,13 (bs, 2H), 2,94 (m, 2H), 2,81 (s, 3H), 2,31 (s, 3H), 2,11 (m, 2H), 1,84 (m, 2H), 1,65 (m, 2H). Підготовчий синтез 37. N-(6-амінопіридин-2іл)-4-фторбензамід Змішують триетиламін (15,8мл, 111,0ммоль) та 2,6-діамінопіридин (6,5г, 59,6ммоль) у діоксані (200мл). Додають невеликими порціями 4фторбензоїлхлорид (5,46мл, 44,7ммоль). Після завершення додавання суміш перемішують при кімнатній температурі протягом 18 год. Виливають суміш у воду і розбавляють етилацетатом та водою. Розділяють шари, водний шар двічі екстрагують CH2Cl2, змішують органічні фази, сушать над MgSO4 і концентрують. Після хроматографії на силікагелі з градієнтним елююванням 0-10% (2M NH3 у метанолі) в CH2Cl2 одержують вказаний у заголовку проміжний продукт (8,91г, 86,3%). Масспектр (іонне розпилення): m/z=232,3 (М+1). Елементний аналіз: обчислено для C12H10N3OF×0,1Н2О: C, 61,85; H, 4,41; N, 18,03. Знайдено: C, 61,75; H, 4,08; N, 17,66. Підготовчий синтез 38. N-(6-амінопіридин-2іл)-2-хлор-4-фторбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 37, з використанням 2-хлор-4фторбензоїлхлориду, одержують вказаний у заголовку проміжний продукт у вигляді жовтуватокоричневої твердої речовини. Мас-спектр (іонне розпилення): m/z=266,2 (М+1). Елементний аналіз: обчислено для C12H9N3OClF: C, 54,25; H, 3,41; N, 15,82. Знайдено: C, 53,98; H, 3,23; N, 15,54. Підготовчий синтез 39. Трет-бутиловий складний ефір 4-(6-(4-фторбензоїламіно)-піридин-2іламіно)піперидин-1-карбонової кислоти 82711 50 Змішують N-(6-амінопіридин-2-іл)-4фторбензамід (Підготовчий синтез 37) (2г, 8,3ммоль) та 1-BOC-4-піперидон (15,0г, 83ммоль) в 1,2-дихлоретані (20мл). Перемішують протягом 1 год, після чого додають триацетоксиборгідрид натрію (4,38г, 20,8ммоль). Після перемішування протягом 36 год гасять реакційну суміш 1-н. NaOH і розбавляють CH2Cl2. Розділяють шари, водний шар двічі екстрагують CH2Cl2, змішують органічні фази, сушать над MgSO4 і концентрують. Залишок розчиняють у CH2Cl2, завантажують у дві колонки з 10г SCX. Колонки послідовно промивають CH2Cl2, а потім метанолом. Елююють продукт 2M NH3 у метанолі. Концентрують елюат і хроматографують на силікагелі, застосовуючи градієнтне елюювання 0-10% (2M NH3 у метанолі) у CH2Cl2, і одержують вказаний у заголовку проміжний продукт (3,11г, 90%). Мас-спектр (іонне розпилення): m/z 415,4 (М+1); т.пл. 82,7°С. Підготовчий синтез 40. Трет-бутиловий складний ефір 4-(6-(2-хлор-4-фторбензоїламіно)піридин-2-іламіно)піперидин-1-карбонової кислоти Застосовуючи спосіб, аналогічний Підготовчому синтезу 39, з використанням N-(6-амінопіридин2-іл)-2-хлор-4-фторбензаміду (Підготовчий синтез 38, 2,0г, 7,5ммоль), одержують вказаний у заголовку проміжний продукт. Мас-спектр (іонне розпилення): m/z=449,4 (М+1); т.пл. 82,0°C. Підготовчий синтез 41. Трет-бутиловий складний ефір 4-((6-(4-фторбензоїламіно)-піридин-2іламіно)метиламіно)піперидин-1-карбонової кислоти Змішують трет-бутиловий складний ефір 4-(6(4-фторбензоїламіно)-піридин-2-іламіно)піперидин1-карбонової кислоти (Підготовчий синтез 39) (3,1г, 7,4ммоль) та формальдегід (37% водний розчин) (6,1мл, 74ммоль) у метанолі (10мл) і перемішують протягом 36 год. Додають ціаноборгідрид натрію (2,3г, 37,0ммоль) і перемішують протя 51 гом 2 год. Гасять реакційну суміш 1-н. NaOH і розбавляють CH2Cl2. Розділяють шари, водний шар двічі екстрагують CH2Cl2 та один раз сумішшю СНСІ3:ізопропанол (3:1). Змішують органічні фази, сушать над MgSO4 і концентрують. Хроматографують на силікагелі, застосовуючи градієнтне елюювання 0-10% (2M NH3 у метанолі) у CH2Cl2, і одержують вказаний у заголовку проміжний продукт (0,97г, 30,6%). Мас-спектр (іонне розпилення): m/z=429,4 (М+1); т.пл. 77,7°С. Підготовчий синтез 42. Трет-бутиловий складний ефір 4-((6-(2-хлор-4-фторбензоїламіно)піридин-2-іл)метиламіно)піперидин-1карбонової кислоти Застосовуючи спосіб, аналогічний Підготовчому синтезу 41, із використанням трет-бутилового складного ефіру 4-(6-(2-хлор-4-фторбензоїламіно)піридин-2-іламіно)піперидин-1-карбонової кислоти (Підготовчий синтез 40, 2,11г, 4,6ммоль), одержують вказаний у заголовку проміжний продукт у вигляді білої твердої речовини. Мас-спектр (іонне розпилення): m/z=463,3 (М+1); т.пл. 79,1°С. Підготовчий синтез 43. N-(6-амінопіридин-2іл)-2,4,6-трифторбензамід Змішують 2,4,6-трифторбензоїлхлорид (3,891г, 20ммоль), 2,6-діамінопіридин (6,548г, 60ммоль) та діоксан (25мл) і перемішують протягом 1 год при кімнатній температурі, після чого нагрівають при 40°С протягом ночі. Розбавляють реакційну суміш CH2Cl2 (100мл) і промивають 0,1-н. розчином NaOH. Водний шар тричі екстрагують CH2Cl2. Змішують органічні шари, сушать над Na2SO4, фільтрують і концентрують, одержуючи залишок. Після хроматографії на силікагелі з градієнтним елююванням 40-50% етилацетату в гексані одержують вказаний у заголовку проміжний продукт (3,95г, 74%). Мас-спектр (іонне розпилення): m/z=267,9 (М+1); 1H ЯМР (CDCl3, млн.-1): 8,28 (s, br, 1H), 7,66 (d, 1H), 7,52 (t, 1H), 6,78 (m, 2H), 6,31 (d, 1H), 4,36 (s, br, 2H). Підготовчий синтез 44. N-(6-амінопіридин-2іл)ацетамід Розчиняють 2,6-діамінопіридин (9,822г, 90ммоль) у діоксані (100мл) і охолоджують до 0°C. 82711 52 Повільно додають ацетилхлорид (2,355г, 2,1мл, 30ммоль) і перемішують протягом 1 год при 0°С. Відстороняють льодяну баню, і перемішують суміш при кімнатній температурі протягом ночі. Гасять реакційну суміш насиченим розчином NaHCO3 і тричі екстрагують етилацетатом. Змішують органічні шари, сушать над Na2SO4, фільтрують і концентрують, одержуючи тверду речовину. Після хроматографії на силікагелі з градієнтним елююванням 60-70% етилацетату в гексані одержують вказаний у заголовку проміжний продукт (3,45г, 76%). Мас-спектр (іонне розпилення): m/z=152,1 (М+1); 1H ЯМР (CDCl3,млн.-1): 7,49 (m, 3H), 6,28 (d, 1H), 4,31 (s, br, 2H), 2,19 (s, 3H). Підготовчий синтез 45. N-(6-амінопіридин-2іл)-2-хлорбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 44, з використанням 2хлорбензоїлхлориду (875мг, 5,0ммоль), одержують вказаний у заголовку проміжний продукт у вигляді білої твердої речовини (1,172г, 95%). Масспектр (іонне розпилення) m/z=247,9 (М+1); 1H ЯМР (CDCl3,млн.-1): 8,37 (s, 1H), 7,72 (m, 2H), 7,44 (m, 4Н), 6,31 (d, 1H), 4,36 (s, br, 2H). Підготовчий синтез 46. N-(6-амінопіридин-2іл)-2-бромбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 44, з використанням 2бромбензоїлхлориду (1,097г, 5,0ммоль), одержують вказаний у заголовку проміжний продукт у вигляді білої твердої речовини (1,445г, 99%). Масспектр (іонне розпилення): m/z=291,9 (М+1); 1H ЯMP (CDCl3,млн.-1): 8,27 (s, br, 1H), 7,65 (m, 4H), 7,34 (m, 2H), 6,29 (d, 1H), 4,36 (s, br, 2H). Підготовчий синтез 47. (6-амінопіридин-2іл)амід циклогексанкарбонової кислоти Застосовуючи спосіб, аналогічний Підготовчому синтезу 44, з використанням циклогексанкарбонілхлориду (733мг, 5,0ммоль), одержують вказаний у заголовку проміжний продукт у вигляді білої твердої речовини (1,137г, 100%). Мас-спектр (іонне розпилення): m/z=242,0 (M+Na); 1H ЯМР (CDCl3,млн.-1): 7,97 (s, 1H), 7,56 (d, 1H), 7,43 (dd, 1H), 6,23 (dd, 1H), 4,40 (s, br, 2H), 2,18 (m, 1H), 1,81 (m, 4H), 1,66 (1H), 1,46 (2Н), 1,20 (m, 3H). Підготовчий синтез 48. N-(6-амінопіридин-2 53 іл)-2-хлор-6-фторбензамід Розчиняють 2,6-діамінопіридин (1,3г, 12ммоль) у діоксані (30мл). Додають 2-хлор-6фторбензоїлхлорид (768мг, 4ммоль). Перемішують в атмосфері азоту (40°C, 64 год). Виливають реакційну суміш в етилацетат (150мл). Промивають насиченим розчином бікарбонату натрію (80мл). Сушать над безводним сульфатом натрію. Видаляють розчинник під зниженим тиском, і очищають залишок хроматографією (силікагель, елюент 10% етилацетату в гексані), одержуючи вказаний у заголовку проміжний продукт (820мг, вихід 78%). Мас-спектр (іонне розпилення): m/z=266,0 (M+1). Підготовчий синтез 49. N-(6-амінопіридин-2іл)-3-хлор-2,6-дифтор-бензамід 82711 54 63%). Мас-спектр (іонне розпилення): m/z=250,0 (М+1). Підготовчий синтез 52. N-(6-амінопіридин-2іл)-2,6-дихлорбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 48, із використанням 2,6діамінопіридину (2,6г, 24ммоль), діоксану (75мл) та 2,6-дихлорбензоїлхлориду (1,68г, 8ммоль) (перемішування при 25°С протягом 16 год), одержують вказаний у заголовку проміжний продукт (1,5г, вихід 66%). Мас-спектр (іонне розпилення): m/z=282,0 (M+1). Підготовчий синтез 53. N-(6-амінопіридин-2іл)-2,6-дифторбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 48, з використанням 3-хлор-2,6дифторбензоїлхлориду (840мг, 4ммоль), одержують вказаний у заголовку проміжний продукт (761мг, вихід 67%). Мас-спектр (іонне розпилення): m/z=284,0 (M+1). Підготовчий синтез 50. N-(6-амінопіридин-2іл)-2,6-дифтор-3-метилбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 48, з використанням 2,6діамінопіридину (2,6г, 24ммоль), діоксану (75мл) та 2,6-дифторбензоїлхлориду (1,4г, 8ммоль) (перемішування при 25°С протягом 16 год), одержують вказаний у заголовку проміжний продукт (1,5г, вихід 75%). Мас-спектр (іонне розпилення): m/z=250,1 (M+1). Підготовчий синтез 54. N-(6-амінопіридин-2іл)-2,4-дихлорбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 48, з використанням 2,6-дифтор-3метилбензоїлхлориду (760мг, 4ммоль), одержують вказаний у заголовку проміжний продукт (669мг, вихід 64%). Мас-спектр (іонне розпилення): m/z=264,l (M+1). Підготовчий синтез 51. N-(6-амінопіридин-2іл)-2,4-дифторбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 48, із використанням 2,4дихлорбензоїлхлориду (838мг, 4ммоль) (перемішування при 0-25°C протягом 16 год), одержують вказаний у заголовку проміжний продукт (621мг, вихід 56%). Мас-спектр (іонне розпилення): m/z=282,0 (М+1). Підготовчий синтез55. N-(6-амінопіридин-2-іл)2,4,6-трихлорбензамід Застосовуючи спосіб, аналогічний Підготовчому синтезу 48, із використанням 2,4дифторбензоїлхлориду (704мг, 4ммоль, перемішування при 25°С протягом 16 год), одержують вказаний у заголовку проміжний продукт (625мг, вихід Застосовуючи спосіб, аналогічний Підготовчому синтезу 48, з використанням 2,6діамінопіридину (2,6г, 12ммоль), діоксану (80мл) та 2,4,6-трихлорбензоїлхлориду (1,95г, 8ммоль) 55 (перемішування при 0-25°C протягом 16 год), одержують вказаний у заголовку проміжний продукт (1,0г, вихід 39%). Мас-спектр (іонне розпилення): m/z=316,0 (M+1). Приклади Приклад 1. Дигідрохлорид 2-хлор-4-фтор-N-(3(1-метилпіперидин-4-іламіно)феніл)бензаміду Змішують 2-хлор-4-фтор-N-(3амінофеніл)бензамід (Підготовчий синтез 1, 200мг, 0,756ммоль), 1-метилпіперидин-4-он (0,093мл, 0,756ммоль), триацетоксиборгідрид натрію (208мг, 0,982ммоль), оцтову кислоту (0,043мл, 0,756ммоль) та дихлорметан (8мл). Перемішують при кімнатній температурі протягом ночі. Розбавляють дихлорметаном (5мл) і промивають двічі водним розчином гідроксиду натрію (10мл, 1-н.). Об'єднують органічні шари і промивають насиченим водним розчином NaCl (10мл). Сушать над сульфатом магнію, фільтрують під зниженим тиском і концентрують досуха. Очищають флешхроматографією на картриджі Biotage® з діоксидом кремнію при елююванні сумішшю 20/1 дихлорметану з 2-н. розчином аміаку в метанолі, і одержують вільну основу вказаної в заголовку сполуки (239мг, 87%). Розчиняють залишок у діетиловому ефірі і обробляють ефірним розчином хлороводню. Розтирають одержану гумоподібну масу з діетиловим ефіром, і одержують вказану в заголовку сполуку у вигляді білої твердої речовини. (31мг): т.пл. 180°С; мас-спектр (вільна основа, іонне розпилення): m/z=362,1 (M+1), 1H ЯМР (вільна основа, CDCl3): 7,80-7,75 (m, 2H), 7,23 (bs, 1H), 7,19 (dd, J=2,4Гц, 8,3Гц, 1H), 7,13 (t, J=8,2Гц, 1H), 7,08 (dd, J=2,4Гц, 8,3Гц, 1H), 6,67 (d, J=7,8Гц, 1H), 6,41 (dd, J=2,0Гц, 8,3Гц, 1H), 3,68 (bd, J=7,9Гц, 1H), 3,36 (bs, 1H), 2,92-2,81 (bm, 2H), 2,35 (s, 3H), 2,82-2,17 (bm, 2H), 2,10 (bd, J=13,0Гц, 2H), 1,64-1,51 (bm, 2H). Елементний аналіз: обчислено для C19H23Cl3FN3O: С, 51,95; H, 5,39; N, 9,57. Знайдено: С, 52,03; H, 5,46; N, 9,17. В альтернативному варіанті, до розчину 1метил-4-(3-амінофеніламіно)піперидину (92г, 17ммоль) та триетиламіну (156мл, 39ммоль) у безводному THF (1л) додають краплями в атмосфері азоту протягом 1 год 2-хлор-4фторбензоїлхлорид (3,6г, 18,6ммоль), підтримуючи температуру суміші в межах від 20°C до 26°C. Перемішують суспензію при кімнатній температурі протягом 1 год. Гасять реакційну суміш водою (100мл) та 30% NaOH (40мл), і одержують двофазний розчин (рН~8-9). Екстрагують метил-третбутиловим ефіром (500мл), промивають органічний шар водою (100мл), сушать над MgSO4 і концентрують під зниженим тиском, одержуючи 2хлор-4-фтор-N-(3-(1-метилпіперидин-4іламіно)феніл)бензамід у вигляді аморфної твердої речовини. Цю речовину суспендують із метил 82711 56 трет-бутиловим ефіром (400мл) і нагрівають суміш зі зворотним холодильником протягом 2 год. Охолоджують суміш до кімнатної температури, додають циклогексан (100мл) та метил-трет-бутиловий ефір (250мл). Фільтрують одержані кристали, промивають метил-трет-бутиловим ефіром (160мл) і сушать під зниженим тиском при 50°C протягом ночі, одержуючи 2-хлор-4-фтор-N-(3-(1метилпіперидин-4-іламіно)феніл)бензамід у вигляді білого порошку (123г, вихід 76%). Приклад 1A. Фумарат 2-хлор-4-фтор-N-(3-(1метилпіперидин-4-іламіно)феніл)-бензаміду До суспензії 2-хлор-4-фтор-N-(3-(1метилпіперидин-4-іламіно)феніл)бензаміду (вільна основа Прикладу 1, 500мг, 1,38ммоль) в ізопропанолі (5мл) додають при кімнатній температурі фумарову кислоту (170мг; 1,46ммоль). Суспензію нагрівають зі зворотним холодильником протягом 1 год, охолоджують до кімнатної температури і додатково перемішують протягом 2 год. Одержані кристали відділяють фільтруванням, промивають ізопропанолом (2x0,5мл) і сушать під зниженим тиском при 40°С, одержуючи білу тверду речовину (665мг, вихід 100%). Ці кристали (100мг; 0,21ммоль) повторно суспендують у воді (1мл) і перемішують при кімнатній температурі. Після 5хв перемішування суспензія перетворюється у гомогенний розчин оранжевого кольору (приблизно через 5хв), а потім з'являються дрібні кристали (приблизно через 10хв). Одержану суміш додатково перемішують протягом ночі. Потім суспензію фільтрують, твердий продукт промивають водою (0,1мл) і сушать під зниженим тиском, одержуючи вказану в заголовку сполуку у вигляді чистої білої твердої речовини (76мг, вихід 76%). Приклад 2. Гідрохлорид 2-хлор-4-фтор-N-(3-Nциклопропілкарбоніл-N-(1-метилпіперидин-4іл)аміно)феніл)бензаміду Змішують 2-хлор-4-фтор-N-(3-(1метилпіперидин-4-іламіно)феніл)-бензаміду дигідрохлорид (Приклад 1, 48мг, 0,134ммоль), діоксан (1мл) та циклопропілкарбонілхлорид (0,013мл, 0,148ммоль). Струшують і нагрівають (106°C) у приладі J-Kem® Reaction Block протягом 2 год. Завантажують у колонку із SCX (Varian) і елююють 2M розчином аміаку в метанолі, одержуючи вільну основу вказаної в заголовку сполуки (54мг, 93%). За методикою одержання солі, аналогічною описаній у Прикладі 1, одержують вказану в заголовку сполуку у вигляді білої твердої речовини (47мг): т.пл. 133-136°С; мас-спектр (вільна основа, іонне розпилення): m/z=430,1 (М+1), 1H ЯМР (вільна основа, CDCl3): 8,31 (bs, N-H), 7,76 (dd, J=6,0Гц, 8,6Гц, 1H), 7,61-7,56 (m, 2H), 7,38 (t, J=8,0Гц, 1H), 7,19 (dd, J=2,4Гц, 8,3Гц, 1H), 7,09 (td, J=2,4Гц, 8,2Гц, 1H), 6,96 (d, J=8,2Гц, 1H), 4,62-4,53 (m, 1H), 2,80 (bd, J=11,5Гц, 2H), 2,20 (s, 3H), 2,05 (td, J=2,2Гц, 12,1Гц, 2H), 1,83-1,69 (bm, 2H), 1,59-1,37 57 (bm, 2H), 1,21-1,13 (m, 1H), 0,99-0,89 (bm, 2H), 0,56 (bd, J=7,4Гц, 2H). Елементний аналіз: обчислено для C23H26Cl2FN3O2×0,8H2O: С, 57,46; H, 5,79; N, 8,74. Знайдено: С, 57,16; H, 5,73; N, 8,70. Приклад 3. Гідрохлорид 2-хлор-4-фтор-N-(3-Nциклобутанкарбоніл-N-(1-метилпіперидин-4іл))аміно)феніл)бензаміду Застосовуючи спосіб, аналогічний описаному у Прикладі 2, із використанням циклобутилкарбонілхлориду (0,017мл, 0,148ммоль) одержують вказану в заголовку сполуку у вигляді білої твердої речовини (вільна основа, 46мг, 78%; гідрохлорид, 30мг). Мас-спектр (вільна основа, іонне розпилення): m/z=444,2 (М+1), 1H ЯМР (вільна основа, CDCl3): 8,29 (bs, N-H), 7,77 (dd, J=6,0Гц, 8,8Гц, 1H), 7,54 (d, J=8,2Гц, 1H), 7,50-7,48 (bs, 1H), 7,34 (t, J=8,0Гц, 1H), 7,19 (dd, J=2,4Гц, 8,5Гц, 1H), 7,09 (td, J=2,3Гц, 8,2Гц, 1H), 4,56 (tt, J=4,2Гц, 12,1Гц, 1H), 2,89-2,76 (m, 3H), 2,32-2,18 (m, 5H), 2,06 (td, J=2,1Гц, 12,1Гц, 2H), 1,82-1,64 (bm, 6H), 1,54-1,32 (bm, 2H). Елементний аналіз: обчислено для C24H28Cl2FN3O2×1,0H2O: C, 57,83; H, 6,07; N, 8,43. Знайдено: С, 57,77; H, 5,97; N, 8,36. Приклад 4. Дигідрохлорид 2-хлор-6-фтор-N-(3(1-метилпіперидин-4-іламіно)феніл)бензаміду Застосовуючи спосіб, аналогічний описаному у Прикладі 1, із використанням 2-хлор-6-фтор-N-(3амінофеніл)бензаміду (Підготовчий синтез 2, 300мг, 1,133ммоль) одержують вказану в заголовку сполуку у вигляді білої твердої речовини (вільна основа 358мг, 87%; дигідрохлорид 415мг): т.пл. 192-194°C; мас-спектр (вільна основа, іонне розпилення): m/z=362,0 (M+1), 1H ЯМР (вільна основа, CDCl3): 7,41 (bs, N-H), 7,38-7,32 (m, 1H), 7,24 (bs, 1H), 7,13 (t, J=8,2Гц, 1H), 7,08 (td, J=0,9Гц, 8,5Гц, 1H), 6,66 (dd, J=2,0Гц, 8,0Гц, 1H), 6,41 (dd, J=2,1Гц, 8,0Гц, 1H), 3,69 (bd, J=7,9Гц, 1H), 3,35 (bs, N-H), 2,88-2,80 (bm, 2H), 2,33 (s, 3H), 2,19 (bt, J=11,2Гц, 2H), 2,12-2,05 (bm, 2H), 1,61-1,50 (bm, 2H). Елементний аналіз: обчислено для C19H23Cl3FN3O: C, 52,49; H, 5,33; N, 9,66. Знайдено: C, 52,24; H, 5,43; N, 9,27. Приклад 5. Дигідрохлорид 2,6-дифтор-N-(3-(1метилпіперидин-4-іламіно)феніл)бензаміду Застосовуючи спосіб, аналогічний описаному у 82711 58 Прикладі 1, з використанням 2,6-дифтор-N-(3амінофеніл)бензаміду (Підготовчий синтез З, 300мг, 1,208ммоль) одержують вказану в заголовку сполуку у вигляді білої твердої речовини (вільна основа 355мг, 85%; дигідрохлорид 411мг): т.пл. 198°С (з розкладом); мас-спектр (вільна основа, іонне розпилення): m/z=346,0 (М+1), 1H ЯМР (вільна основа, CDCl3): 7,55 (bs, N-H), 7,45-7,36 (m, 1H), 7,24 (t, J=1,9Гц, 1H), 7,12 (t, J=8,0Гц, 1H), 6,99 (t, J=8,1Гц, 2Н), 6,66 (dd, J=1,4Гц, 7,8Гц, 1H), 6,40 (dd, J=2,0Гц, 8,0Гц, 1H), 3,67 (bd, J=8,1Гц, 1H), 3,34 (bs, N-H), 2,83 (bd, J=11,0Гц, 2H), 2,32 (s, 3H), 2,18 (bt, J=11,6Гц, 2H), 2,08 (bd, J=12,7Гц, 2H), 1,59-1,48 (m, 2H). Елементний аналіз: обчислено для C19H23Cl2F2N3O: С, 54,55; H, 5,54; N, 10,04. Знайдено: С, 54,78; H, 5,69; N, 9,78. Приклад 6. Дигідрохлорид 2,4-дифтор-N-(3-(1метилпіперидин-4-іламіно)феніл)бензаміду Застосовуючи спосіб, аналогічний описаному у Прикладі 1, з використанням 2,4-дифтор-N-(3амінофеніл)бензаміду (Підготовчий синтез 4, 307мг, 1,236ммоль) одержують вказану в заголовку сполуку у вигляді білої твердої речовини (вільна основа 394мг, 92%; дигідрохлорид 394мг): т.пл. 262°С (із розкладом); мас-спектр (вільна основа, іонне розпилення): m/z=346,0 (M+1), 1H ЯМР (вільна основа, CDCl3): 8,20-8,02 (m, 2H), 7,14 (t, J=1,9Гц, 1H), 7,05 (t, J=8,0Гц, 1H), 7,00-6,93 (m, 1H), 6,92-6,80 (m, 1H), 6,63 (dd, J=1,3Гц, 7,9Гц, 1H), 6,33 (dd, J=1,9Гц, 7,9Гц, 1H), 3,58 (bd, J=8,1Гц, 1H), 3,27 (bs, N-H), 2,73 (bd, J=11,8Гц, 2H), 2,22 (s, 3H), 2,07 (bt, J=11,1Гц, 2H), 2,01 (bd, J=12,9Гц, 2H), 1,50-1,35 (m, 2H). Приклад 7. Дигідрохлорид 2,4,6-трифтор-N-(3(1-метилпіперидин-4-іламіно)феніл)бензаміду Застосовуючи спосіб, аналогічний описаному у Прикладі 1, із використанням 2,4,6-трифтор-N-(3амінофеніл)бензаміду (Підготовчий синтез 5, 290мг, 1,089ммоль) одержують вказану в заголовку сполуку у вигляді білої твердої речовини (вільна основа 355мг, 90%; дигідрохлорид 355мг): т.пл. 257°С (із розкладом); мас-спектр (вільна основа, іонне розпилення): m/z=364,0 (M+1), 1H ЯМР (вільна основа, CDCl3): 7,43 (bs, N-H), 7,13 (t, J=2,0Гц, 1H), 7,05 (t, J=8,0Гц, 1H), 6,69 (t, J=8,2Гц, 2Н), 6,57 (dd, J=1,4Гц, 7,8Гц, 1H), 6,33 (dd, J=1,9Гц, 8,1Гц, 1H), 3,59 (bd, J=8,0Гц, 1H), 3,25 (bs, N-H), 2,72 (bd, J=11,8Гц, 2H), 2,22 (s, 3H), 2,06 (bt, J=11,2Гц, 2H), 2,00 (bd, J=11,7Гц, 2H), 1,50-1,35 (m, 2H). Приклад 8. Дигідрохлорид 2-бром-N-(3-(1метилпіперидин-4-іламіно)феніл)бензаміду 59 Застосовуючи спосіб, аналогічний описаному у Прикладі 1, із використанням 2-бром-N-(3амінофеніл)бензаміду (Підготовчий синтез 6, 304мг, 1,044ммоль) одержують вказану в заголовку сполуку у вигляді білої твердої речовини (вільна основа 377мг, 93%; дигідрохлорид 395мг): т.пл. 192-193°С; мас-спектр (вільна основа, іонне розпилення): m/z=388,1 (М+1), 1H ЯМР (вільна основа, CDCl3): 7,65-7,60 (m, 2H), 7,57 (bs, N-H), 7,40 (td, J=1,1Гц, 7,5Гц, 1H), 7,31 (td, J=1,7Гц, 7,8Гц, 1H), 7,24 (bt, J=2,1Гц, 1H), 7,13 (t, J=8,0Гц, 1H), 6,67 (dd, J=1,5Гц, 7,9Гц, 1H), 6,40 (dd, J=2,0Гц, 8,1Гц, 1H), 3,68 (bd, J=7,9Гц, 1H), 3,38-3,29 (bm, 1H), 2,82 (bd, J=11,2Гц, 2H), 2,31 (s, 3H), 2,17 (bt, J=11,2Гц, 2H), 2,08 (bd, J=12,9Гц, 2H), 1,58-1,47 (m, 2H). Елементний аналіз: обчислено для C19H24BrCl2N3O×0,25H2O: С, 49,00; H, 5,30; N, 9,02. Знайдено: С, 49,11; H, 5,36; N, 8,69. Приклад 9. Дигідрохлорид 2-хлор-N-(3-(1метилпіперидин-4-іламіно)феніл)бензаміду Застосовуючи спосіб, аналогічний описаному у Прикладі 1, із використанням 2-хлор-N-(3амінофеніл)бензаміду (Підготовчий синтез 7, 300мг, 1,216ммоль) одержують вказану в заголовку сполуку у вигляді білої твердої речовини (вільна основа 331мг, 79%; дигідрохлорид 333мг): т.пл. 206-8°С; мас-спектр (вільна основа, іонне розпилення): m/z=344,0 (М+1), 1H ЯМР (вільна основа, CDCl3): 7,75 (bs, N-H), 7,73 (dd, J=2,0Гц, 7,3Гц, 1H), 7,46-7,34 (m, 3H), 7,25 (bt, J=2,1Гц, 1H), 7,13 (t, J=8,1Гц, 1H), 6,68 (dd, J=1,3Гц, 7,9Гц, 1H), 6,40 (dd, J=2,0Гц, 8,2Гц, 1H), 3,67 (bd, J=7,7Гц, 1H), 3,393,29 (bm, 1H), 2,83 (bd, J=11,0Гц, 2H), 2,32 (s, 3H), 2,18 (bt, J=11,5Гц, 2H), 2,09 (bd, J=12,5Гц, 2H), 1,59-1,48 (bm, 2H). Елементний аналіз: обчислено для C19H24Cl3N3O×0,5H2O: С, 53,60; H, 5,92; N, 9,87. Знайдено: С, 53,94; H, 5,91; N, 9,70. Приклад 10. Дигідрохлорид 2-трифторметоксиN-(3-(1-метилпіперидин-4-іламіно)феніл)бензаміду Застосовуючи спосіб, аналогічний описаному у Прикладі 1, із використанням 2-трифторметокси-N(3-амінофеніл)бензаміду (Підготовчий синтез 8, 82711 60 300мг, 1,013ммоль) одержують вказану в заголовку сполуку у вигляді білої твердої речовини (вільна основа 274мг, 69%; дигідрохлорид 325мг): т.пл. 159-162°С; мас-спектр (вільна основа, іонне розпилення): m/z=394,2 (М+1), 1H ЯМР (вільна основа, CDCl3): 8,18 (bs, N-H), 8,07 (d, J=7,5Гц, 1H), 7,55 (t, J=7,5Гц, 1H), 7,45 (t, J=7,5Гц, 1H), 7,34 (d, J=8,0Гц, 1H), 7,21 (bs, 1H), 7,13 (t, J=8,0Гц, 1H), 6,68 (d, J=7,5Гц, 1H), 6,41 (d, J=7,5Гц, 1H), 3,67 (bd, J=7,1Гц, 1H), 3,38-3,28 (bm, 1H), 2,81 (bd, J=9,5Гц, 2H), 2,30 (s, 3H), 2,22-2,04 (bm, 4H), 1,58-1,46 (bm, 2H). Приклад 11. Дигідрохлорид 2,6-дифтор-N-(3(N-метил-N-(1-метилпіперидин-4іл)аміно)феніл)бензаміду Змішують 1-метил-4-(N-(3-амінофеніл)-Nметиламіно)піперидин (Підготовчий синтез 11, 101мг, 0,307ммоль), дихлорметан (6мл) та піридин (0,125мл, 1,535ммоль) при 0°C. Додають 2,6дифторбензоїлхлорид (0,048мл, 0,384ммоль) у нерозбавленому вигляді і продовжують перемішування протягом 1 год. Розбавляють суміш дихлорметаном (5мл) і промивають водним розчином гідроксиду натрію (1-н. 2x8мл). Об'єднують органічні шари, сушать над сульфатом магнію, фільтрують під зниженим тиском і концентрують досуха. Очищають залишок флеш-хроматографією при елююванні сумішшю (20/1) дихлорметан/(2-н. розчин аміаку в метанолі), і одержують вільну основу вказаної в заголовку сполуки (88мг, 80%). За методикою одержання солі, аналогічною описаній у Прикладі 1, одержують вказану в заголовку сполуку у вигляді жовтої твердої речовини (89мг). Масспектр (вільна основа, іонне розпилення): m/z=360,1 (М+1), 1H ЯМР (вільна основа, CDCl3): 7,56 (bs, 1H), 7,44-7,34 (m, 2H), 7,20 (t, J=8,2Гц, 1H), 7,00 (t, J=8,2Гц, 2H), 6,78 (d, J=8,0Гц, 1H), 6,59 (dd, J=2,2Гц, 8,2Гц, 1H), 3,71-3,63 (bm, 1H), 3,143,04 (bm, 2H), 2,82 (s, 3H), 2,41 (bs, 3H), 2,11-1,97 (bm, 2H), 1,79 (bd, J=13Гц, 2H). Приклад 12. Дигідрохлорид 2-хлор-4-фтор-N(3-(N-метил-N-(1-метилпіперидин-4-іл)аміно)феніл)бензаміду Застосовуючи спосіб, аналогічний описаному у Прикладі 11, із використанням 2-хлор-4фторбензоїлхлориду (0,049мл, 0,384ммоль) одержують вказану в заголовку сполуку (вільна основа 102мг, 89%; дигідрохлорид 67мг, біла тверда речовина): т.пл. 172°С; мас-спектр (вільна основа, іонне розпилення): m/z=376,1 (M+1), 1H ЯМР (вільна основа, CDCl3): 7,80-7,76 (m, 2H), 7,30 (bs, N-H),
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted 2-carbonylamino-6-piperidinaminopyridines and substituted 1-carbonylamino-3-piperidinaminobenzenes as 5-ht1f agonists
Автори англійськоюBlanco-Pillado Maria-Jesus, Cohen Michael Philip, Filla Sandra Ann, Hudziak Kevin John, Kohlman Daniel Timothy, Benesh Dana Rae, Victor Frantz, Xu Yao-Chang, Ying Bai-Ping, Zacherl Deanna Piatt, Zhang Deyi, Mathes Brian Michael
Назва патенту російськоюЗамещенные 2-карбониламино-6-пиперидинаминопиридины и замещенные 1-карбониламино-3-пиперидинаминобензолы как агонисты 5-ht1f
Автори російськоюБланко-Пилладо Мария-Джизус, Коуэн Майкл Филип, Филла Сандра Энн, Гудзяк Кевин Джон, Колмен Дениел Тимоти, Бенеш Дейна Рей, Виктор Франтц, Ксу Яо-Ченг, Инь Бей-Пинь, Захерл ДиАнна Пьятт, Чжан Деи, Матез Брайан Майкл
МПК / Мітки
МПК: C07D 401/12, A61K 31/4409, A61K 31/4439, A61K 31/444, C07D 401/06, C07D 401/14, C07D 211/58, A61K 31/4436
Мітки: 5-ht1f, 1-карбоніламіно-3-піперидинамінобензоли, заміщені, агоністи, 2-карбоніламіно-6-піперидинамінопіридини
Код посилання
<a href="https://ua.patents.su/57-82711-zamishheni-2-karbonilamino-6-piperidinaminopiridini-ta-zamishheni-1-karbonilamino-3-piperidinaminobenzoli-yak-agonisti-5-ht1f.html" target="_blank" rel="follow" title="База патентів України">Заміщені 2-карбоніламіно-6-піперидинамінопіридини та заміщені 1-карбоніламіно-3-піперидинамінобензоли як агоністи 5-ht1f</a>
Попередній патент: Пептид, що зв’язується з тромбопоетиновим рецептором (варіанти), та спосіб лікування тромбоцитопенії (варіанти)
Наступний патент: Спосіб та пристрій передачі користувацьких даних з використанням інформаційного каналу
Випадковий патент: Спосіб лікування хворих на пневмонію і постпневмонічний пневмосклероз












