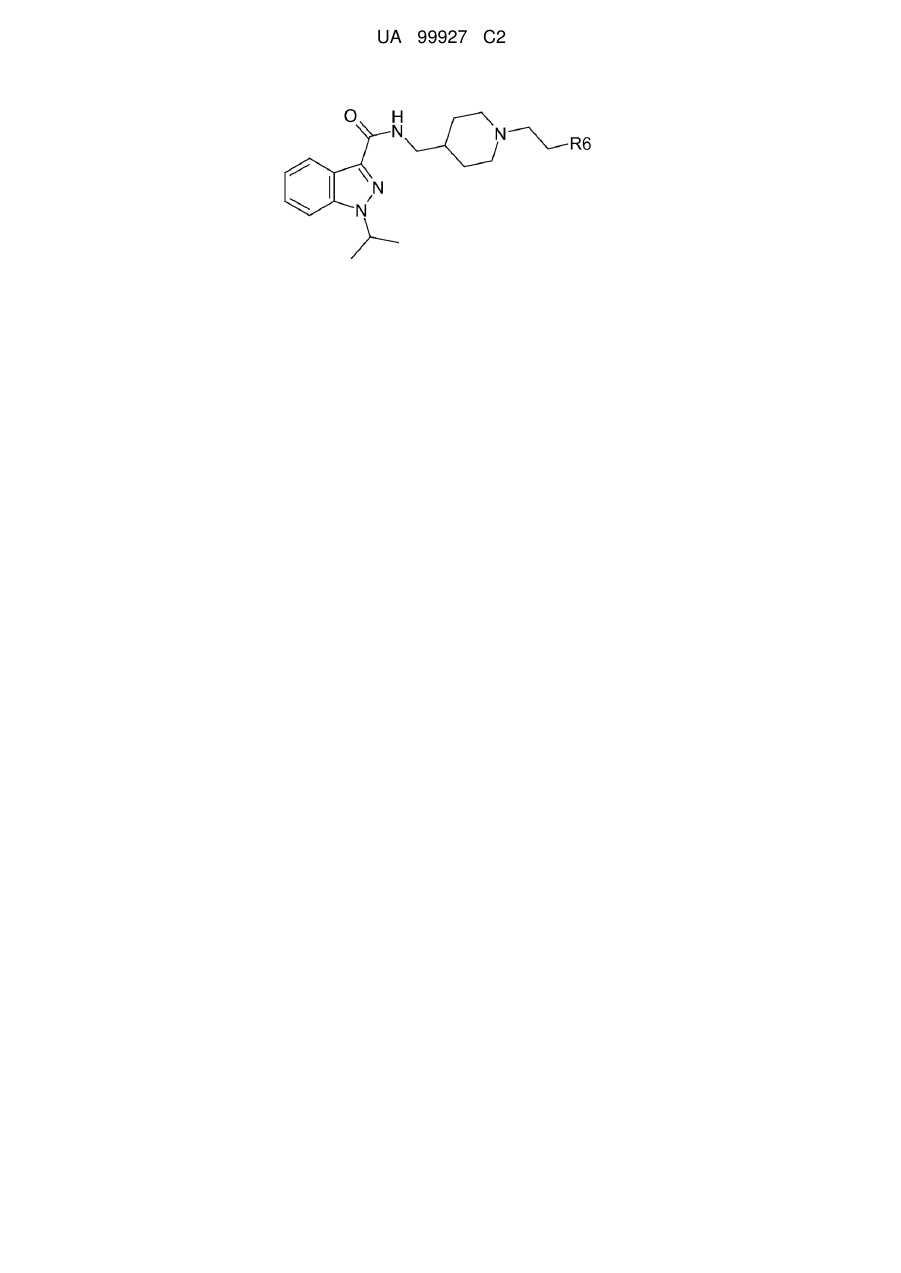
Медикамент, який є активним при невропатичному болі
Номер патенту: 99927
Опубліковано: 25.10.2012
Автори: Алісі Марія Алессандра, Гугліелмотті Анджело, Поленцані Лоренцо, Каццолла Нікола, Фурлотті Гвідо
Формула / Реферат
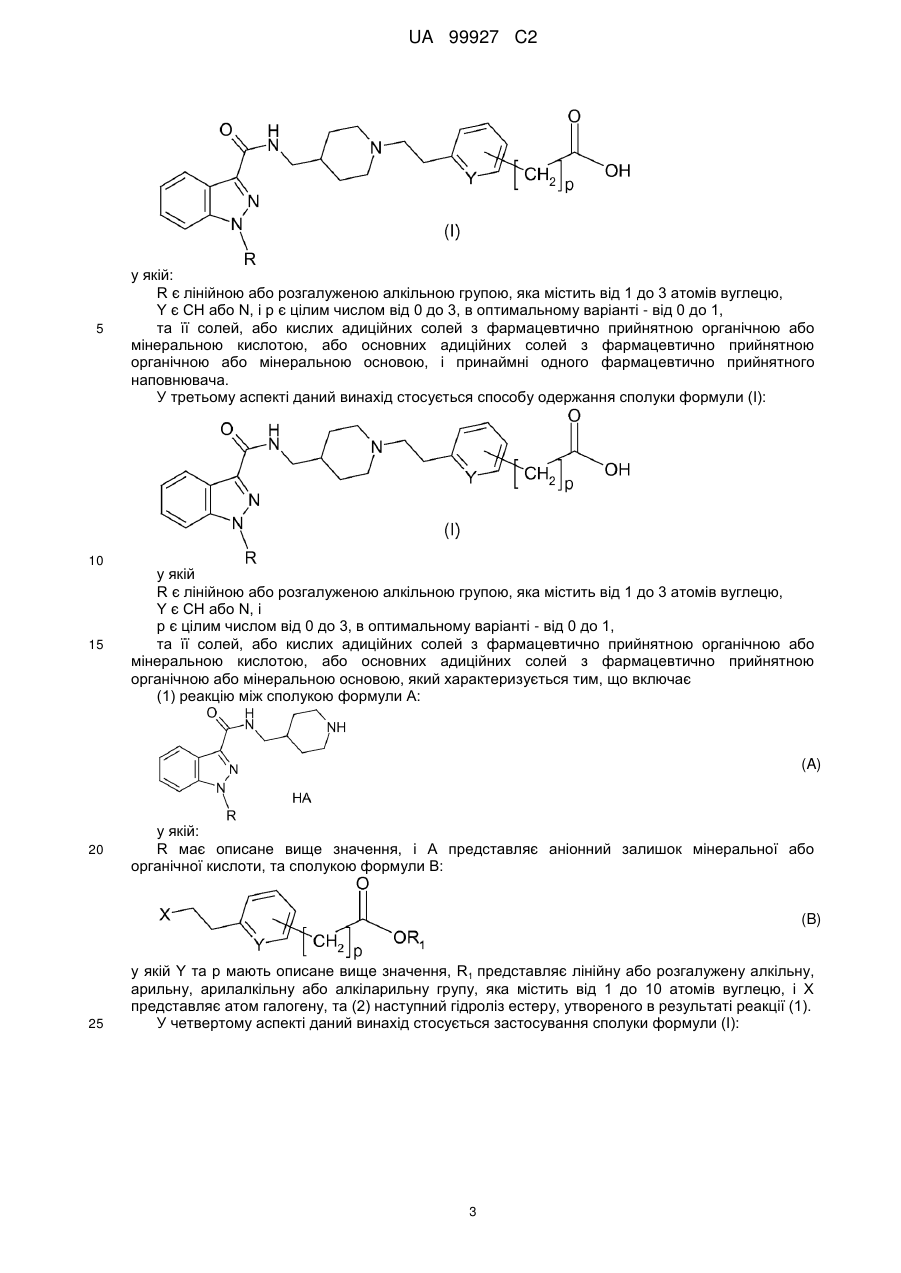
1. Сполука формули (І):
 ,
,
у якій:
R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю,
Y є СН або N, і
р є цілим числом від 0 до 3,
та її солі, або кислі адитивні солі з фармацевтично прийнятною органічною або мінеральною кислотою, або основні адитивні солі з фармацевтично прийнятною органічною або мінеральною основою.
2. Сполука за п. 1, яка відрізняється тим, що R є лінійною або розгалуженою алкільною групою, яка містить від 2 до 3 атомів вуглецю.
3. Сполука за п. 1, яка відрізняється тим, що Y є СН.
4. Сполука за п. 1, яка відрізняється тим, що р є цілим числом від 0 до 1.
5. Сполука за п. 1, яка відрізняється тим, що R, Y, р та позиція групи
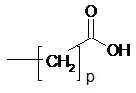
є представленими нижче у таблиці:
Сполука
R
X
Р
Позиція
1
Ізопропіл
СН
0
Пара
2
Ізопропіл
СН
1
Пара
3
Ізопропіл
СН
2
Пара
4
Ізопропіл
СН
3
Пара
5
Етил
СН
0
Пара
6
Метил
СН
0
Пара
7
Ізопропіл
N
0
Пара
8
Ізопропіл
N
1
Пара
9
Ізопропіл
N
3
Пара
10
Етил
N
0
Пара
11
Метил
N
0
Пара
12
Етил
N
1
Пара
13
Ізопропіл
СН
0
Мета
14
Ізопропіл
СН
0
Орто
6. Сполука за будь-яким з попередніх пп., яка відрізняється тим, що вищезгадану фармацевтично прийнятну органічну або мінеральну кислоту вибирають із групи, до якої належать щавлева кислота, малеїнова кислота, метансульфонова кислота, пара-толуолсульфонова кислота, бурштинова кислота, лимонна кислота, винна кислота, молочна кислота, хлористоводнева кислота, фосфорна кислота, сірчана кислота, аспарагінова кислота та глутамінова кислота.
7. Сполука за будь-яким з пп. з 1 по 5, яка відрізняється тим, що вищезгадану фармацевтично прийнятну органічну або мінеральну основу вибирають із групи, до якої належать метиламін, диметиламін, триметиламін, етиламін, діетиламін, триетиламін, пропіламін, дипропіламін, трипропіламін, етилендіамін, моноетаноламін, діетаноламін, триетаноламін, гуанідин, морфолін, піперидин, піролідин, піперазин, 1-бутилпіперидин, 1-етил-2-метилпіперидин, N-метил-піперазин, 1,4-диметилпіперазин, N-бензилфенілетиламін, N-метилглюкозамін, трис(гідроксиметил) амінометан, аргінін, лізин, аміак, гідроксид натрію, гідроксид кальцію, гідроксид калію, гідроксид алюмінію, гідроксид заліза, гідроксид магнію та гідроксид цинку.
8. Фармацевтична композиція, яка містить ефективну кількість сполуки формули (І):
 , (I)
, (I)
у якій:
R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів
вуглецю,
Y є СН або N, і
р є цілим числом від 0 до 3,
та її солі, або кислі адитивні солі з фармацевтично прийнятною органічною або мінеральною кислотою, або основні адитивні солі з фармацевтично прийнятною органічною або мінеральною основою, та
принаймні один фармацевтично прийнятний наповнювач.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що вищезгаданий принаймні один фармацевтично прийнятний наповнювач вибирають із групи, до якої належать регулятори швидкості вивільнення, зв'язувальні речовини, дезінтегратори, заповнювачі, розріджувачі, барвники, флюїдизатори, суперпластифікатори, мастила, консерванти, стабілізатори, зволожувачі, абсорбенти, поверхнево-активні речовини, буфери, солі для регулювання осмотичного тиску, емульгатори, ароматизатори та підсолоджувачі.
10. Фармацевтична композиція за п. 8, яка відрізняється тим, що сполука формули (І) визначається за будь-яким з пп. з 1 по 7.
11. Фармацевтична композиція за будь-яким з пп. з 8 по 10, яка відрізняється тим, що фармацевтичну композицію вибирають із групи, до якої належать таблетки, капсули, вкриті оболонкою таблетки, гранули, розчини та сиропи для перорального введення, антисептичні пластирі, розчини, пасти, креми та мазі для черезшкірного введення, супозиторії для ректального введення, стерильні розчини для ін'єкцій або аерозольного введення, у формі негайного вивільнення або уповільненого вивільнення.
12. Фармацевтична композиція за будь-яким з пп. з 8 по 11, яка відрізняється тим, що вищезгадана фармацевтична композиція містить кількість сполуки формули (І) або її кислої адитивної солі або основної адитивної солі для забезпечення рівня введення від 0,001 до 100 мг/кг/день сполуки формули (І) у формі чистої основи.
13. Фармацевтична композиція за п. 12, яка відрізняється тим, що вищезгадана кількість забезпечує рівень введення від 0,05 до 50 мг/кг/день.
14. Фармацевтична композиція за п. 12, яка відрізняється тим, що вищезгадана кількість забезпечує рівень введення від 0,1 до 10 мг/кг/день.
15. Спосіб одержання сполуки формули (І):
 , (I)
, (I)
у якій
R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю,
Y є СН або N, і
р є цілим числом від 0 до 3,
та її солей, або кислих адитивних солей з фармацевтично прийнятною органічною або мінеральною кислотою, або основних адитивних солей з фармацевтично прийнятною органічною або мінеральною основою,
який характеризується тим, що здійснюють
(1) реакцію між сполукою формули А:
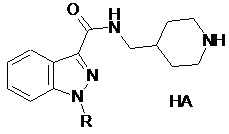 ,(A)
,(A)
у якій:
R має описане вище значення, і А представляє аніонний залишок мінеральної або органічної кислоти,
та сполукою формули В:
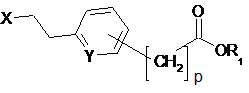 , (В)
, (В)
у якій Y та р мають описане вище значення, R1 представляє лінійну або розгалужену алкільну, арильну, арилалкільну або алкіларильну групу, яка містить від 1 до 10 атомів вуглецю, і X представляє атом галогену, та
(2) наступний гідроліз естеру, утвореного в результаті реакції (1).
16. Спосіб одержання за п. 15, який відрізняється тим, що вищезгаданий залишок А вибирають із групи, до якої належать галогенід, фосфат, сульфат, нітрат та органічний карбоксилат.
17. Спосіб одержання за п. 16, який відрізняється тим, що вищезгаданий залишок А вибирають із групи, до якої належать хлорид, бромід та йодид.
18. Спосіб одержання за п. 15, який відрізняється тим, що вищезгаданий залишок X вибирають із групи, до якої належать хлорид, бромід та йодид.
19. Спосіб одержання за п. 15, який відрізняється тим, що вищезгадану групу R1 вибирають із групи, до якої належать лінійний або розгалужений алкіл, який містить 1-6 атомів вуглецю, арил, арилалкіл та алкіларил, який містить 7-8 атомів вуглецю.
20. Спосіб одержання за будь-яким з пп. з 15 по 19, який відрізняється тим,
що вищезгадану реакцію (1) здійснюють в органічному розчиннику, вибраному з групи, до якої належать полярні апротонні розчинники.
21. Спосіб одержання за п. 20, який відрізняється тим, що вищезгаданий органічний розчинник вибирають із групи, до якої належать ацетон, метилетилкетон, тетрагідрофуран, диметилформамід, диметилсульфоксид, діоксан та ацетонітрил.
22. Спосіб одержання за будь-яким з пп. з 15 по 21, який відрізняється тим, що вищезгадану реакцію (1) здійснюють у присутності основної органічної або мінеральної сполуки.
23. Спосіб одержання за будь-яким з пп. з 15 по 22, який відрізняється тим, що вищезгадану реакцію (1) здійснюють у присутності активуючого агента, вибраного з групи, до якої належать йодид калію, йодид цезію, йодид тетрабутиламонію та йодид триметилфеніламонію.
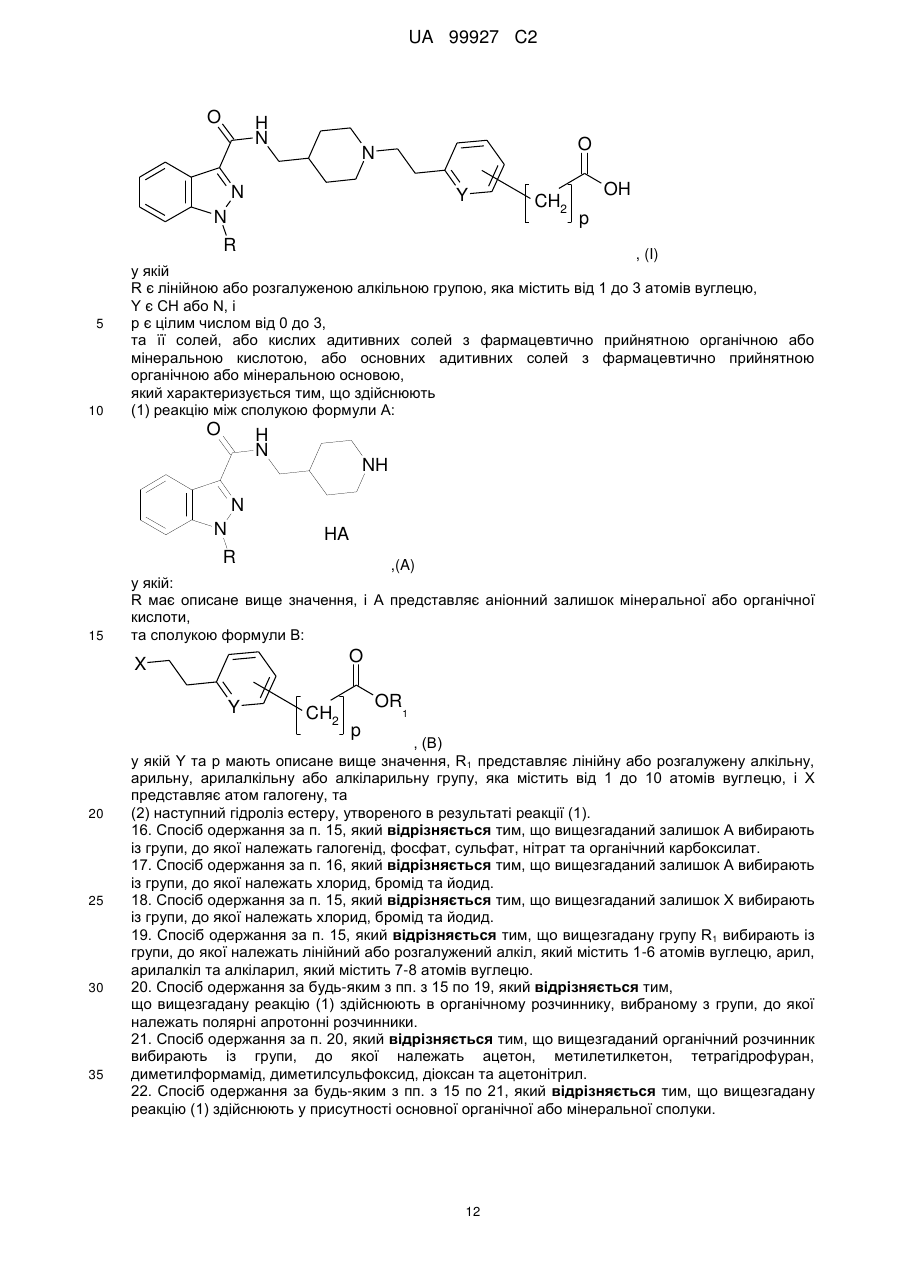
24. Застосування сполуки формули (І):
 , (I)
, (I)
у якій:
R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю,
Y є СН або N, і
р є цілим числом від 0 до З,
та її солей, або кислих адитивних солей з фармацевтично прийнятною органічною або мінеральною кислотою, або основних адитивних солей з фармацевтично прийнятною органічною або мінеральною основою для виготовлення фармацевтичної композиції для лікування від невропатичного болю.
25. Застосування сполуки за п. 24 для виготовлення фармацевтичної композиції для лікування від невропатичного болю, викликаного діабетом, раком, імунодефіцитом, травмою, ішемією, розсіяним склерозом, ішіасом, тригемінальною невралгією та постгерпетичним синдромом.
Текст
Реферат: Даний винахід стосується сполуки формули (І), у якій R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю, Y є СН або N, і р є цілим числом від 0 до 3, в оптимальному варіанті - від 0 до 1, та її солей, або кислих адиційних солей з фармацевтично прийнятною органічною або мінеральною кислотою, або основних адиційних солей з фармацевтично прийнятною органічною або мінеральною основою. Винахід також стосується способу одержання сполуки формули (І) та фармацевтичної композиції, яка її включає. Винахід також стосується застосування індазолу для виготовлення фармацевтичної композиції, яка є активною при лікуванні від невропатичного болю. UA 99927 C2 (12) UA 99927 C2 UA 99927 C2 5 10 15 20 25 30 Галузь винаходу Даний винахід стосується нового індазолу, способу його одержання та фармацевтичної композиції, яка його включає. Винахід також стосується застосування індазолу для одержання фармацевтичної композиції, яка є активною при лікуванні від невропатичного болю. Рівень техніки Хронічний біль являє собою низку патологій, від яких страждає у середньому близько 1020 % дорослого населення. Хронічний біль, як правило, є пов'язаним з клінічними станами, які характеризуються хронічними та/або дегенеративними ураженнями. Хронічний біль відрізняється від гострого болю насамперед тривалістю. Гострий біль має тривалість кілька днів або тижнів і корелюється з відновленням після події, яка спричинила цей біль (травми, опіків, інтенсивних фізичних зусиль, хірургічного або стоматологічного втручання і т. ін.). З іншого боку, хронічний біль триває протягом місяців і навіть років, викликаючи м'язове напруження, обмежену рухливість, втому, втрату апетиту та апатію. Типовими прикладами патологій, які характеризуються хронічним болем, є ревматоїдний артрит, остеоартрит, фіброміалгія, невропатія та ін. [Ashbum MA, Staats PS. Management of chronic pain. Lancet 1999; 353: 1865-69]. Хронічний біль, зокрема, невропатичний біль, часто є виснажуючим і стає причиною втрати працездатності та погіршення якості життя. Також наслідками є економічні та соціальні збитки. До анальгетичних медикаментів, які нині застосовуються для лікування від невропатичного болю, належать нестероїдні протизапальні засоби (NSAID), антидепресанти, опіоїдні анальгетики та протисудомні засоби [Woolf CJ, Mannion RJ, Neuropathic pain: aetiology, symptoms, mechanism, and management. Lancet 1999; 353: 1959-1964]. Однак, як відомо, хронічний біль, зокрема, невропатичний біль, важко виліковується наявними на даний час медикаментами. Отже, розробка нових медикаментів завжди була однією з головних цілей фармацевтичної промисловості. Крім того, незважаючи на численні зусилля дослідників, спрямовані на розпізнавання прийнятної анальгетичної сполуки, існує значна кількість пацієнтів, больовий стан яких і досі не має прийнятного лікування [Scholz J, Woolf CJ. Can we conquer pain? Nat Neusci. 2002; 5: 106276]. Деякі медикаменти, які діють на серотонінергічну систему, розглядались як засоби боротьби з хронічним болем, зокрема, з невропатичним болем. Патентні заявки EP-A-0 975 623 та WO 98/46589 стосуються численних сполук формули 1: (1) 35 40 включаючи ті, в яких R6 представлено арилом, необов'язково заміщеним гідроксильною або галогеновою групою. Згідно з вищезгаданими документами, сполуки формули (A) мають афінність до рецепторів 5HT4 і діють як частковий агоніст або антагоніст серотоніну, і було запропоновано застосовувати їх для лікування від порушень моторики шлунково-кишкового тракту, нетримання сечі, серцевої аритмії та порушень центральної нервової системи, таких, як порушення пам'яті та страх. Патентні заявки WO 2005/013989 та EP 1 646 387 стосуються застосування похідних індазолу для виготовлення фармацевтичної композиція, яка є активною при лікуванні від невропатичного болю, і ці похідні індазол є представленими нижчезазначеною формулою 2: (2) 45 де X може бути N або CH, і якщо X є N, R є воднем, і якщо X є CH, R є атомом водню, гідроксильною групою, алкілом з лінійним або розгалуженим ланцюгом, який містить від 1 до 3 атомів вуглецю, алкокси з лінійним або розгалуженим ланцюгом, який містить від 1 до 3 атомів вуглецю, або атомом галогену. 1 UA 99927 C2 Патентна заявка WO2004/101548 стосується застосування деяких похідних індазолу для виготовлення фармацевтичної композиції, яка є активною при лікуванні від хронічного болю. Деякі з похідних індазолу, які розкриваються у WO2004/101548, є представленими нижчезазначеною формулою 3: (3) 5 10 15 20 25 30 35 40 де Ra є H, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, лінійним або розгалуженим C1-C3 алкілом, лінійним або розгалуженим C1-C3 алкокси або галогеном; Rb є H, лінійним або розгалуженим C 1C6 алкілом; арил-(C1-C3)алкілом, необов'язково заміщеним 1 або 2 атомами галогену, C 1-C3 алкільною групою або C1-C3 алкокси-групою; Rc є гідрокси, аміно, ди-(C1-C3)алкіламіно, три-(C1C3)алкіл-амоніометилом, нітро, трифторометилом, нітрилом, CH3C(O)NH, CH3SO2NH, CH3SO2, R’R’’NSO2, де R' та R" є H, або лінійним або розгалуженим C 1-C6 алкілом, Rd є H, гідрокси, аміно, ди-(C1-C3)алкіламіно, три-(C1-C3)алкіл-амоніометилом, нітро, трифторометилом, нітрилом, CH3C(O)NH, CH3SO2NH, CH3SO2, R’R’’NSO2, де R' та R" мають вищезазначені значення, за умови, що у разі, коли Ra та Rd обидва є H, і Rb є ізопропілом, то Rc не є гідрокси. На жаль, застосовувані на даний час медикаменти, які діють на серотонінергічну систему, мають побічні й несприятливі ефекти, зумовлені низькою селективністю щодо інших серотонінергічних рецепторів, що часто змушує припиняти лікування або уникати лікування у разі певних типів пацієнтів, у яких, крім наявності хронічного болю, є присутніми супутні патологічні стани у конкретних системах, таких, як серцево-судинна система. По суті, взаємодія з серотонінергічною системою, зокрема, з конкретними субрецепторами, такими, як 5HT1B або 5HT2A, може викликати несприятливий вплив на серцево-судинну систему, включаючи вплив на серцевий ритм. Крім того, спостерігалася взаємодія з іонним каналом hERG, яка може зумовлювати несприятливі побічні ефекти у серцево-судинній системі. Опис винаходу Несподівано було виявлено, що у разі, коли група R формули 2 є представленою карбоксильною або алкенілкарбоксильною групою, сполуки формули (B) зберігають свою дію при невропатичному болі з підвищеною афінністю щодо серотонінергічного рецептора 5HT 4 та підвищеною селективністю по відношенню до інших серотонінергічних рецепторів і по відношенню до каналу hERG. Таким чином, даний винахід стосується сполуки формули (I): у якій: R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю, Y є CH або N, і p є цілим числом від 0 до 3, в оптимальному варіанті - від 0 до 1, та її солей, або кислих адиційних солей з фармацевтично прийнятною органічною або мінеральною кислотою, або основних адиційних солей з фармацевтично прийнятною органічною або мінеральною основою. У другому аспекті даний винахід стосується фармацевтичної композиції, яка включає ефективну кількість сполуки формули (I): 2 UA 99927 C2 5 10 15 у якій: R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю, Y є CH або N, і p є цілим числом від 0 до 3, в оптимальному варіанті - від 0 до 1, та її солей, або кислих адиційних солей з фармацевтично прийнятною органічною або мінеральною кислотою, або основних адиційних солей з фармацевтично прийнятною органічною або мінеральною основою, і принаймні одного фармацевтично прийнятного наповнювача. У третьому аспекті даний винахід стосується способу одержання сполуки формули (I): у якій R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю, Y є CH або N, і p є цілим числом від 0 до 3, в оптимальному варіанті - від 0 до 1, та її солей, або кислих адиційних солей з фармацевтично прийнятною органічною або мінеральною кислотою, або основних адиційних солей з фармацевтично прийнятною органічною або мінеральною основою, який характеризується тим, що включає (1) реакцію між сполукою формули A: (A) 20 у якій: R має описане вище значення, і A представляє аніонний залишок мінеральної або органічної кислоти, та сполукою формули B: (B) 25 у якій Y та p мають описане вище значення, R1 представляє лінійну або розгалужену алкільну, арильну, арилалкільну або алкіларильну групу, яка містить від 1 до 10 атомів вуглецю, і X представляє атом галогену, та (2) наступний гідроліз естеру, утвореного в результаті реакції (1). У четвертому аспекті даний винахід стосується застосування сполуки формули (I): 3 UA 99927 C2 5 10 у якій: R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю, Y є CH або N, і p є цілим числом від 0 до 3, в оптимальному варіанті - від 0 до 1, та її солей, або кислих адиційних солей з фармацевтично прийнятною органічною або мінеральною кислотою, або основних адиційних солей з фармацевтично прийнятною органічною або мінеральною основою, для виготовлення фармацевтичної композиції, яка є активною при лікуванні від невропатичного болю. Типові приклади сполук, представлених вищезгаданою формулою (I), показано нижче у Таблиці 1. У колонці "Позиція" вказується позиція карбоксильної або алкенілкарбоксильної групи на арилі відносно атома вуглецю, зв'язаного з N-етилпіперидино-групою. Таблиця 1 Сполука 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 20 25 30 R Ізопропіл Ізопропіл Ізопропіл Ізопропіл Етил Метил Ізопропіл Ізопропіл Ізопропіл Етил Метил Етил Ізопропіл Ізопропіл X CH CH CH CH CH CH N N N N N N CH CH P 0 1 2 3 0 0 0 1 3 0 0 1 0 0 Позиція Пара Пара Пара Пара Пара Пара Пара Пара Пара Пара Пара Пара Мета Орто Типовими прикладами фармацевтично прийнятних органічних та мінеральних кислот є: щавлева кислота, малеїнова кислота, метансульфонова кислота, пара-толуолсульфонова кислота, бурштинова кислота, лимонна кислота, винна кислота, молочна кислота, хлористоводнева кислота, фосфорна кислота, сірчана кислота. Амінокислоти, такі, як аспарагінова кислота та глутамінова кислота, також можуть застосовуватись як органічні кислоти. Типовими прикладами фармацевтично прийнятних органічних та мінеральних основ є: моно-, ди- та триалкіламіни, наприклад, метиламін, диметиламін, триметиламін, етиламін, діетиламін, триетиламін, пропіламін, дипропіламін, трипропіламін, етилендіамін, моно-, ди- та триалканоламіни, наприклад, моноетаноламін, діетаноламін та триетаноламін; гуанідин, морфолін, піперидин, піролідин, піперазин, 1-бутилпіперидин, 1-етил-2-метил-піперидин, Nметилпіперазин, 1,4-диметилпіперазин, N-бензилфеніл-етиламін, N-метилглюкозамін, трис(гідроксиметил)амінометан, аміак, гідроксид натрію, гідроксид кальцію, гідроксид калію, гідроксид алюмінію, гідроксид заліза, гідроксид магнію та гідроксид цинку. Амінокислоти, такі, як аргінін та лізин також можуть застосовуватись як органічні основи. Типовими прикладами патологій, які характеризуються невропатичним болем, є діабет, рак, імунодефіцит, травма, ішемія, розсіяний склероз, ішіас, тригемінальна невралгія та постгерпетичний синдром. В оптимальному варіанті фармацевтичні композиції згідно з даним винаходом виготовляють у формі прийнятних дозованих форм, які включають ефективну дозу принаймні однієї сполуки 4 UA 99927 C2 5 10 15 20 25 30 35 40 45 50 55 60 (I) або її солі, або кислої адиційної солі з фармацевтично прийнятною органічною або мінеральною кислотою, або основної адиційної солі з фармацевтично прийнятними органічними та мінеральними основами, та принаймні один фармацевтично прийнятний наповнювач. Термін "фармацевтично прийнятний наповнювач" означає, без будь-яких конкретних обмежень, матеріал, який є прийнятним для виготовлення фармацевтичної композиції, призначеної для введення живій істоті. До цих матеріалів, відомих спеціалістам у даній галузі, належать, наприклад, регулятори швидкості вивільнення, зв'язувальні речовини, дезінтегратори, заповнювачі, розріджувачі, барвники, флюїдизатори, суперпластифікатори, мастила, консерванти, стабілізатори, зволожувачі, абсорбенти, поверхнево-активні речовини, буфери, солі для регулювання осмотичного тиску, емульгатори, ароматизатори та підсолоджувачі. Прикладами придатних для застосування фармацевтично прийнятних наповнювачів є цукри, такі, як лактоза, глюкоза або цукроза, крохмалі, такі, як кукурудзяний крохмаль та картопляний крохмаль, целюлоза та її похідні, такі, як натрій карбоксиметилцелюлоза, етилцелюлоза та ацетат целюлози, трагакантова камедь, солод, желатин, тальк, масло какао, воски, олії, такі, як арахісова олія, бавовняна олія, сафлорова олія, кунжутна олія, оливкова олія, кукурудзяна олія та соєва олія, гліколі, такі, як пропіленгліколь, поліоли, такі, як гліцерин, сорбіт, маніт та поліетиленгліколь, естери, такі, як етилолеат та етиллаурат, агар агар, буфери, такі, як гідроксид магнію та гідроксид алюмінію, альгінова кислота, вода, ізотонічні розчини, етанол, буферні розчини, поліестери, полікарбонати, поліангідриди і т. ін. Прикладами прийнятних дозованих форм є таблетки, капсули, вкриті оболонкою таблетки, гранули, розчини та сиропи для перорального введення; антисептичні пластирі, розчини, пасти, креми та мазі для крізьшкірного введення; супозиторії для ректального введення та стерильні розчини для ін'єкцій або аерозольного введення. Іншими придатними дозованими формами є форми з уповільненим вивільненням або форми на основі ліпосом, для введення пероральним або ін'єкційним шляхом. Призначена для конкретних типів терапії фармацевтична композиція згідно з даним винаходом може містити інші фармакологічно активні інгредієнти, які мають вводитись одночасно. Кількість сполуки (I) або її кислої адиційної солі або основної адиційної солі у фармацевтичній композиції згідно з даним винаходом може бути різною у широких межах, залежно від відомих чинників, наприклад, типу патології, з якою пов'язаний невропатичний біль, який підлягає лікуванню, тяжкості хвороби, маси тіла пацієнта, дозованої форми, вибраного шляху введення, кількості введень на день та ефективності вибраної сполуки формули (I). Однак оптимальна кількість може бути легко і у звичний спосіб визначена спеціалістом у даній галузі. Як правило, кількість сполуки (I) або її кислої адиційної солі або основної адиційної солі у фармацевтичній композиції згідно з даним винаходом має бути такою, щоб забезпечувалося введення на рівні від 0,001 до 100 мг/кг/день сполуки (I), як чистої основи. В оптимальному варіанті рівень введення становить від 0,05 до 50 мг/кг/день, у ще кращому варіанті - від 0,1 до 10 мг/кг/день. Дозовані форми фармацевтичної композиції згідно з даним винаходом виготовляють згідно з технологіями, загальновідомими серед спеціалістів у галузі фармацевтики, включаючи змішування, гранулювання, пресування, розчинення, стерилізацію і т. ін. У процесі виробництва згідно з даним винаходом залишок A в оптимальному варіанті являє собою галогенід (такий, як хлорид, бромід або йодид), фосфат (такий, як пірофосфат, монофосфат, дифосфат або трифосфат), сульфат, нітрат або органічний карбоксилат (такий, як ацетат, бензоат, лактат і т. ін.). У ще кращому варіанті залишок A являє собою галогенід, зокрема, хлорид. У процесі виробництва згідно з даним винаходом залишок X в оптимальному варіанті являє собою галогенід, у ще кращому варіанті - хлорид, бромід або йодид. Оптимальним залишком X є бромід. У процесі виробництва згідно з даним винаходом група, представлена R 1, в оптимальному варіанті являє собою лінійний або розгалужений алкіл, який містить 1-6 атомів вуглецю, арил, арилалкіл або алкіларил, який містить 7-8 атомів вуглецю. Група R1 також може включати традиційні органічні замісники, такі, як галогенід, нітро, гідрокси і т. ін… Група R 1 в оптимальному варіанті є вибраною з-поміж метилу, етилу, ізопропілу, фенілу та бензилу. Реакцію (1) у процесі виробництва згідно з даним винаходом в оптимальному варіанті здійснюють в органічному розчиннику. Типовими прикладами органічних розчинників, які можуть застосовуватись у процесі виробництва згідно з даним винаходом, в оптимальному варіанті є 5 UA 99927 C2 5 10 15 20 25 30 35 40 45 50 55 60 полярні апротонні розчинники, такі, як кетони (наприклад, ацетон або метилетилкетон), тетрагідрофуран, диметилформамід, диметилсульфоксид, діоксан, ацетонітрил і т. ін. Реакцію (1) у процесі виробництва згідно з даним винаходом здійснюють в умовах високої температури, в оптимальному варіанті - при температурі точки кипіння реакційного розчину. Реакцію (1) у процесі виробництва згідно з даним винаходом в оптимальному варіанті здійснюють у присутності основної органічної або мінеральної сполуки. Прикладами придатних основних органічних речовин є аліфатичні або ароматичні аміни, такі, як моно-, ди- або триалкіламіни, моно-, ди- або триалканоламіни, бензиламін, N-метилбензиламін і т. ін. Прикладами придатних мінеральних основ є сильні основи, такі, як NaOH або KOH, або слабкі основи, такі, як NH4OH, Na2CO3 і т. ін. Реакцію (1) у процесі виробництва згідно з даним винаходом в оптимальному варіанті здійснюють у присутності активуючого агента, наприклад, йодиду калію, йодиду цезію, йодиду тетрабутиламонію або йодиду триметилфеніламонію. Гідроліз (2) естеру, утвореного в результаті реакції (1) у процесі виробництва згідно з даним винаходом здійснюють способами, відомими спеціалістам у даній галузі. В оптимальному варіанті гідроліз здійснюють у полярних протонних органічних розчинниках, наприклад, метанолі, етанолі, пропанолі, ізопропанолі, бутанолі і т. ін., або апротонних органічних розчинниках, таких, як метилетилкетон, тетрагідрофуран, диметилформамід, диметилсульфоксид, діоксан, ацетонітрил і т. ін., і у присутності основи, такої, як NaOH або KOH. Виготовлення сполук формули (A) може здійснюватися згідно зі способом, описаним у патенті EP 0 975 623 B1. Виготовлення сполук формули (B) може здійснюватися, як описано у журналі Journal of the American Chemical Society (1940), 62 1435-8. Анальгетичну активність сполуки (I) було продемонстровано за допомогою експериментальної моделі на щурах, представленої алодинією, викликаною лігатурою сідничного нерва. Як відомо спеціалістам у даній галузі, вищезгадана експериментальна модель може розглядатись як прогнозуюча щодо активності в організмі людини. Експериментальна модель лігатури сідничного нерва у щурів представляє невропатію, яка відтворює низку реакцій, подібних до тих, які спостерігаються у людини при численних травматичних та патологічних станах, пов'язаних з невропатичним болем. Причина полягає в тому, що лігатура сідничного нерва здатна викликати синдром, який є пов'язаним з активацією конкретних систем, призначених для контролювання відчуття болю, і характеризується виникненням алодинії, гіпералгезії та спонтанного болю. Відомо, що ця модель являє собою дієвий засіб дослідження медикаментів, призначених для лікування від невропатичного болю у людей, зокрема, для контролювання таких станів, як алодинія та гіпералгезія. Типовими прикладами людських патологій, які характеризуються дисфункціями, описаними для вищезгаданої експериментальної моделі, і характеризуються наявністю невропатичного болю, є діабет, рак, імунодефіцит, травма, ішемія, розсіяний склероз, ішіас, тригемінальна невралгія та постгерпетичний синдром. Підтвердження зв'язування з серотонінергічними рецепторами здійснювали за допомогою біохімічного випробування на очищених мембранах з рекомбінантних людських клітин, які стійко експресують специфічні рецептори, або з тваринних тканин, відібраних, як описано для кожного конкретного типу серотонінергічного рецептора у публікаціях: Martin G.R. and Humphrey P.P.A. Neuropharmacol. 1994, 33:261; Hoyer D. Eur. J. Pharmacol. 1985, 118:1; Bonhaus DW et al. Br. J. Pharmacol. 1995, 115:622; Wolf WA et al. J. Neurochem. 1997, 69:1449; Boess FG et al. Neuropharmacol. 1997, 36:637; Mialet J et al. Br. J. Pharmacol. 2000; 129:771; Rees S et al. FEBS Lett. 1994, 355:242; Monsma F.J. et al. Mol. Pharmacol. 1993, 43:320; Roth BL et al. J. Pharmacol. Exp. Ther. 1994, 268: 1403; та Shearman LP et al. Am. J. Physiol. 1998, 275: C1621. Як відомо спеціалістам у даній галузі, це випробування являє собою прогнозуючу модель молекулярної взаємодії та селективності з відібраними рецепторами. Підтвердження взаємодії з калієвими каналами здійснювали за допомогою функціонального випробування клітин (фіксація потенціалу), у якому застосовували рекомбінантні людські клітини HEK-293, які стійко експресують іонний канал hERG, як описано у публікації Zhou Z. et al. Biophys. J. 1998; 74:230. Як відомо спеціалістам у даній галузі, це випробування являє собою прогнозуючу модель викликання змін у функціональності серця, зокрема, впливу на серцевий ритм після змін у Qtчасі. Випробування 6 UA 99927 C2 5 10 15 20 25 1. Алодинія, викликана лігатурою сідничного нерва у щурів Використовували самців щурів CD, які при доставленні мали масу 200-250 г. Алодинію викликали лігатурою сідничного нерва лівої задньої кінцівки під анестезією [Seltzer Z, Dubner R, Shir Y. A novel behavioral model of neuropathic pain disorders produced in rats by partial sciatic nerve injury. Pain 1990; 43: 205-218; Bennet GJ, Xie YK. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain 1988; 33: 87-107]. Принаймні через два тижні після лігатури сідничного нерва відбирали щурів, які демонстрували зниження принаймні на 50 % порогу реакції, який записували до втручання. Больовий поріг вимірювали за допомогою пристрою фон Фрея, що дозволяє через застосування поступового зростання тиску на подушечку лівої задньої кінцівки щура записувати ноцицептичну реакцію, виражену у грамах, яка відповідає моментові, у який тварина відсмикує лапу. Через 30 хвилин, 1, 2 та 4 години експерименту, больовий поріг, виміряний у контрольних тварин, порівнювали з показником, виміряним у тварин, яким вводили випробуваний продукт (сполука 1 з Таблиці 1). Контрольним тваринам вводили такий самий носій (метилцелюлозу), як той, що застосовують для введення випробуваного продукту. Результати показано на Фігурі 1. 2. Зв'язування з серотонінергічними рецепторами Підтвердження зв'язування з серотонінергічними рецепторами здійснювали з застосуванням очищених мембран з відібраних тваринних тканин або з рекомбінантних людських клітин, які стійко експресують специфічні рецептори, як описано у публікаціях: Martin G.R. and Humphrey P.P.A. Neuropharmacol. 1994, 33:261; Hoyer D. Eur. J. Pharmacol. 1985, 118:1; Bonhaus DW et al. Br. J. Pharmacol. 1995, 115:622; Wolf WA et al. J. Neurochem. 1997, 69:1449; Boess FG et al. Neuropharmacol. 1997, 36:637; Mialet J et al. Br. J. Pharmacol. 2000, 129:771; Rees S et al. FEBS Lett. 1994, 355:242; Monsma F.J. et al. Mol. Pharmacol. 1993, 43:320; Roth BL et al. J. Pharmacol. Exp. Ther. 1994, 268: 1403; та Shearman LP et al. Am. J. Physiol. 1998, 275: C1621. У застосованих експериментальних умовах сполука 1 з Таблиці 1 демонструвала вибіркове інгібування зв'язування з рецептором 5-HT4. Отримані результати показано у Таблиці 2. Таблиця 2 Рецептор 5-HT1A 5-HT1B 5-HT2A 5-HT2B 5-HT2C 5-HT3 5-HT4 5-HT5A 5-HT6 5-HT7 5-HT транспортер - SERT 30 35 IC50 (нM) >10 000 >10 000 >10 000 >10 000 >10 000 >10 000 0,8 >10 000 >10 000 >10 000 >10 000 3. Взаємодія з калієвими каналами (hERG) Підтвердження взаємодії з калієвими каналами здійснювали з застосуванням випробування з фіксацією потенціалу, яке описується у публікації Zhou Z. et al. Biophys. J. 1998; 74:230, з використанням лінії рекомбінантних людських клітин HEK-293, які стійко експресують іонний канал hERG. У застосованих експериментальних умовах сполука 1 з Таблиці 1 демонструвала IC50 >50 мкM. Отримані результати показано у Таблиці 3. Таблиця 3 мкM 0,01 0,10 1,00 10,00 50,00 % інгібування 0,0 0,0 0,9 6,5 18,8 7 UA 99927 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади Приклад 1 Одержання сполуки 1 з Таблиці 1 4-{2-[4-({[(1-ізопропіл-1H-індазол-3-іл)карбоніл]аміно}метил)-піперидин-1-іл]етил}бензойна кислота 1a) 1-[4-(2-Бромоетил)феніл]етанон Розчин, який містив ацетилхлорид (85 мл; 0,85 моль) та бромоетилбензол (82 мл; 0,60 моль) додавали при 0 °C до суміші, яка містила безводний трихлорид алюмінію (72 г; 0,54 моль), дихлорометан (300 мл) та ацетилхлорид (42,5 мл; 0,6 моль). Суміш перемішували у прохолодних умовах протягом 3 годин, а потім додавали до холодного розчину 6N HCl (600 мл). Одержану в результаті суміш перемішували при кімнатній температурі протягом доби. Дві фази, утворені після відстоювання при кімнатній температурі протягом кількох хвилин, розділяли. Кислотну фазу двічі екстрагували 300 мл дихлорометану. Комбіновані органічні фази тричі промивали 100 мл води і один раз 100 мл насиченого розчину NaCl, а потім висушували безводним Na2SO4. Розчинник після цього випарювали під зниженим тиском для утворення 138 г необробленого продукту, і цей продукт потім очищали шляхом фракційної перегонки під зниженим тиском. Таким чином, одержували 79,0 г (0,35 моль) 1 -[4-(2-бромоетил)феніл]етанону (T=120 °C; P=7 мм рт. ст.). 1 H ЯМР ( ppm, CDCI3, 300 MГц): 2.59 (s, 3 H) 3,23 (t, J=7,31 Гц, 2 H) 3,59 (t, J=7,31 Гц, 2 H) 7,31 (d, J=7,89 Гц, 2 H) 7,92 (d, J=8,18 Гц, 2 H). 2a) 4-(2-Бромоетил)бензойна кислота Розчин, який містив 1-[4-(2-бромоетил)феніл]етанон (38,2 г; 0,17 моль) у діоксані (100 мл) повільно додавали до розчину, який містив бром (80,6 г; 0,50 моль), гідроксид натрію (55,4 г; 1,39 моль), воду (470 мл) та діоксан (340 мл) і який перемішували при 0 °C. Суміш перемішували при такій самій температурі протягом 3 годин з наступним додаванням, коли вона ще перебувала у холодному стані, 120 мл концентрованої HCl. Утворену в результаті суміш перемішували при кімнатній температурі протягом доби. Тверду речовину з суміші відфільтровували і промивали на фільтрі 1N HCl (200 мл). Таким чином, одержували 20,3 г 4-(2-бромоетил)бензойної кислоти (0,09 моль), яку застосовували для наступної реакції без подальшого очищення. 1 H ЯМР ( ppm, 300 MГц, DMSO-d6): 3,21 (t, J=6,95 Гц, 2 H) 3,77 (t, J=7,14 Гц, 2 H) 7,40 (d, J=8,42 Гц, 2 H) 7,89 (d, J=8,05 Гц, 2 H) 12,83 (s, 1 H). 3a) Етил 4-(2-бромоетил)бензоат Суміш, яка містила 4-(2-бромоетил)бензойну кислоту (10 г; 43,7 ммоль), 9,5 N розчин хлористоводневої кислоти в етанолі (50 мл; 475 ммоль) та абсолютний етанол (50 мл), перемішували при дефлегмації протягом 4 годин. Після цього суміш охолоджували до кімнатної температури і розчинник випарювали під зниженим тиском. Залишок поглинали насиченим розчином Na2CO3 (100 мл), а потім екстрагували етилацетатом (3 × 100 мл). Комбіновані органічні фази промивали спочатку водою (50 мл), а потім насиченим розчином NaCl (30 мл). Потім розчин висушували безводним Na2SO4. І нарешті, розчинник випарювали під зниженим тиском, таким чином, одержуючи 10,8 г етил 4-(2-бромоетил)-бензоату (42 ммоль), який застосовували для наступної реакції без подальшого очищення. 1 H ЯМР ( ppm, 300 MГц, CDCI3) 1,39 (t, J=6,87 Гц, 3 H) 3,22 (t, J=7,45 Гц, 2 H) 3,58 (t, J=7,45 Гц, 2 H) 4,37 (q, J=6,90 Гц, 2 H) 7,28 (d, J=8,15 Гц, 2 H) 8,00 (d, J=8,18 Гц, 2 H) 4a) Етил 4-{2-[4-({[(1-ізопропіл-1H-індазол-3-іл)карбоніл]аміно)-метил)піперидин-1іл]етил}бензоат Суміш, яка містила гідрохлорид 1-ізопропіл-N-(піперидин-4-ілметил)-1H-індазол-3карбокспміду (45,9 г, 136 ммоль), одержану, як описано у публікації EP 0 975 623, етил 4-(2бромоетил)бензоат (37 г; 144 ммоль), 2-бутанон (1600 мл) та триетиламін (18,9 мл; 136 ммоль) перемішували при дефлегмації. Після реакції протягом 1,5 годин додавали другу аліквотну кількість триетиламіну (9,5 мл; 68 ммоль) при підтриманні дефлегмації. Після реакції протягом додаткових 1,5 години додавали третю аліквотну кількість триетиламіну (9,5 мл; 68 ммоль) при підтриманні дефлегмації. Після додаткових 1,5 години до реакційної суміші додавали йодид калію (6,2 г; 37,3 ммоль) суміш, так само при дефлегмації. І нарешті суміш перемішували при дефлегмації протягом доби. Після цього утворену в результаті суміш охолоджували до кімнатної температури і виливали у воду (2 л). Дві фази розділяли і водну фазу екстрагували 2-бутаноном (2 × 400 мл). Комбіновані органічні фази після цього промивали водою (50 мл) та насиченим розчином NaCl (50 мл). Розчин висушували безводним Na2SO4 і розчинник після цього випарювали під 8 UA 99927 C2 5 10 15 20 25 зниженим тиском. Одержували 58,9 г необробленого продукту, і цей продукт очищали шляхом гравітаційної хроматографії на нейтральному глиноземі (1400 г), застосовуючи 8/2 суміші хлороформу та гексану як елюент. Таким чином, одержували 14,2 г етил 4-{2-[4-({[(1-ізопропіл-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]етил}бензоату (29,8 ммоль). 1 H ЯМР ( ppm, 300 MГц, CDCI3): 1,32-1,51 (m, 2 H) 1,38 (t, J=7,16 Гц, 3 H) 1,61 (d, J=6,72 Гц, 6 H) 1,64-1,91 (m, 3 H) 2,05 (td, J=11,55, 2,34 Гц, 2 H) 2,54-2,66 (m, 2 H) 2,81-2,91 (m, 2 H) 3,02 (d, J=11,69 Гц, 2 H) 3,42(t, J=6,43 Гц, 2 H) 4,36 (q, 2 H) 4,87 (spt, 1 H) 7,15 (t, J=6,28 Гц, 1 H) 7,227,31 (m, 3 H) 7,35-7,49 (m, 2 H) 7,96 (d, 2 H) 8,39 (dt, J=8,18, 1,02 Гц, 1 H). 5a) 4-{2-[4-({[(1-ізопропіл-1H-індазол-3-іл)карбоніл]аміно}метил)-піперидин-1іл]етил}бензойна кислота Розчин, який містив етил 4-{2-[4-({[(1-ізопропіл-1H-індазол-3-іл)карбоніл]аміно}метил)піперидин-1-іл]етил}бензоат (6,2 г; 13 ммоль), тетрагідрофуран (30 мл), абсолютний етанол (30 мл) та 1N гідроксид натрію (28,5 мл; 28,5 ммоль), перемішували при кімнатній температурі протягом 3 днів. Утворену в результаті суміш нейтралізували до pH 7 шляхом додавання кристалічної оцтової кислоти (приблизно 1,7 мл), а потім перемішували при кімнатній температурі протягом доби. Утворену таким чином тверду речовину відфільтровували, коли вона ще перебувала у холодному стані, а потім промивали на фільтрі 1/1 сумішшю тетрагідрофурану та абсолютного етанолу. Тверду речовину кілька разів кристалізували з 4/3 суміші етилацетату та етанолу. Таким чином, одержували 3,7 г 4-{2-[4-({[(1-ізопропіл-1H-індазол-3іл)карбоніл]аміно}метил)піперидин-1-іл]етил}бензойної кислоти (8,3 ммоль). 1 H ЯМР ( ppm, 300 MГц, DMSO-d6) 1,23 (d, J=11,34 Гц, 2 H) 1,53 (d, J=6,59 Гц, 6 H) 1,57-1,77 (m, 3 H) 2,01 (t, J=10,79 Гц, 2 H) 2,57 (t, J=8,00 Гц, 2 H) 2,81 (t, J=7,68 Гц, 2 H) 2,96 (d, J=10,98 Гц, 2 H) 3,21 (t, J=6,22 Гц, 2 H) 5,06 (spt, J=6,62 Гц, 1 H) 7,21-7,28 (m, 1 H) 7,31 (d, J=8,05 Гц, 2 H) 7,42 (ddd, J=8,51, 7,04, 1,28 Гц, 1 H) 7,76 (d, J=8,42 Гц, 1 H) 7,84 (d, J=8,05 Гц, 2 H) 8,12-8,24 (m, 2H) 10,78 (br. s., 1 H). + Т. пл. = 179-181 °C; MS показала основний пік 449 (MH ); Елементний аналіз для C26H32N4O3 30 % виявлено %розраховано C 69,37 69,62 H 7,23 7,19 N 12,25 12,49 Приклад 2 Таблетка, яка містила як активну складову Сполуку 1 згідно з даним винаходом, має такий склад: 35 Активна складова Моногідрат лактози Дикальційортофосфат зневоднений Мікрокристалічна целюлоза Кукурудзяний крохмаль Натрійкарбоксиметилкрохмаль Повідон Стеарат магнію 50 мг 161 мг 161 мг 95 мг 30 мг 24 мг 11 мг 3 мг Приклад 3 Вміст флакона, який містив як активну складову Сполуку 1 згідно з даним винаходом, має такий склад: 40 Активна складова Сорбіт Вода 25 мг qs - ізоосмотичний розчин qs - 100 мл Приклад 4 Фармацевтична композиція у формі гранул, яка містила як активну складову Сполуку 1 згідно з даним винаходом, має такий склад: 9 UA 99927 C2 Активна складова Мальтит Маніт Цукроза Лимонна кислота Аспартам Ароматизатори 50 мг 1300 мг 2700 мг 1000 мг 20 мг 20 мг 200 мг ФОРМУЛА ВИНАХОДУ 5 1. Сполука формули (І): O H N O N N Y CH2 N OH p R 10 15 , у якій: R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю, Y є СН або N, і р є цілим числом від 0 до 3, та її солі, або кислі адитивні солі з фармацевтично прийнятною органічною або мінеральною кислотою, або основні адитивні солі з фармацевтично прийнятною органічною або мінеральною основою. 2. Сполука за п. 1, яка відрізняється тим, що R є лінійною або розгалуженою алкільною групою, яка містить від 2 до 3 атомів вуглецю. 3. Сполука за п. 1, яка відрізняється тим, що Y є СН. 4. Сполука за п. 1, яка відрізняється тим, що р є цілим числом від 0 до 1. 5. Сполука за п. 1, яка відрізняється тим, що R, Y, р та позиція групи O CH2 20 p є представленими нижче у таблиці: Сполука 1 2 3 4 5 6 7 8 9 10 11 12 13 14 25 OH R Ізопропіл Ізопропіл Ізопропіл Ізопропіл Етил Метил Ізопропіл Ізопропіл Ізопропіл Етил Метил Етил Ізопропіл Ізопропіл X СН СН СН СН СН СН N N N N N N СН СН Р 0 1 2 3 0 0 0 1 3 0 0 1 0 0 Позиція Пара Пара Пара Пара Пара Пара Пара Пара Пара Пара Пара Пара Мета Орто 6. Сполука за будь-яким з попередніх пп., яка відрізняється тим, що вищезгадану фармацевтично прийнятну органічну або мінеральну кислоту вибирають із групи, до якої 10 UA 99927 C2 5 10 належать щавлева кислота, малеїнова кислота, метансульфонова кислота, паратолуолсульфонова кислота, бурштинова кислота, лимонна кислота, винна кислота, молочна кислота, хлористоводнева кислота, фосфорна кислота, сірчана кислота, аспарагінова кислота та глутамінова кислота. 7. Сполука за будь-яким з пп. з 1 по 5, яка відрізняється тим, що вищезгадану фармацевтично прийнятну органічну або мінеральну основу вибирають із групи, до якої належать метиламін, диметиламін, триметиламін, етиламін, діетиламін, триетиламін, пропіламін, дипропіламін, трипропіламін, етилендіамін, моноетаноламін, діетаноламін, триетаноламін, гуанідин, морфолін, піперидин, піролідин, піперазин, 1-бутилпіперидин, 1-етил-2-метилпіперидин, Nметилпіперазин, 1,4-диметилпіперазин, N-бензилфенілетиламін, N-метилглюкозамін, трис(гідроксиметил)амінометан, аргінін, лізин, аміак, гідроксид натрію, гідроксид кальцію, гідроксид калію, гідроксид алюмінію, гідроксид заліза, гідроксид магнію та гідроксид цинку. 8. Фармацевтична композиція, яка містить ефективну кількість сполуки формули (І): O H N N O N Y N R 15 20 25 30 35 40 45 CH2 OH p , (I) у якій: R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю, Y є СН або N, і р є цілим числом від 0 до 3, та її солі, або кислі адитивні солі з фармацевтично прийнятною органічною або мінеральною кислотою, або основні адитивні солі з фармацевтично прийнятною органічною або мінеральною основою, та принаймні один фармацевтично прийнятний наповнювач. 9. Фармацевтична композиція за п. 8, яка відрізняється тим, що вищезгаданий принаймні один фармацевтично прийнятний наповнювач вибирають із групи, до якої належать регулятори швидкості вивільнення, зв'язувальні речовини, дезінтегратори, заповнювачі, розріджувачі, барвники, флюїдизатори, суперпластифікатори, мастила, консерванти, стабілізатори, зволожувачі, абсорбенти, поверхнево-активні речовини, буфери, солі для регулювання осмотичного тиску, емульгатори, ароматизатори та підсолоджувачі. 10. Фармацевтична композиція за п. 8, яка відрізняється тим, що сполука формули (І) визначається за будь-яким з пп. з 1 по 7. 11. Фармацевтична композиція за будь-яким з пп. з 8 по 10, яка відрізняється тим, що фармацевтичну композицію вибирають із групи, до якої належать таблетки, капсули, вкриті оболонкою таблетки, гранули, розчини та сиропи для перорального введення, антисептичні пластирі, розчини, пасти, креми та мазі для черезшкірного введення, супозиторії для ректального введення, стерильні розчини для ін'єкцій або аерозольного введення, у формі негайного вивільнення або уповільненого вивільнення. 12. Фармацевтична композиція за будь-яким з пп. з 8 по 11, яка відрізняється тим, що вищезгадана фармацевтична композиція містить кількість сполуки формули (І) або її кислої адитивної солі або основної адитивної солі для забезпечення рівня введення від 0,001 до 100 мг/кг/день сполуки формули (І) у формі чистої основи. 13. Фармацевтична композиція за п. 12, яка відрізняється тим, що вищезгадана кількість забезпечує рівень введення від 0,05 до 50 мг/кг/день. 14. Фармацевтична композиція за п. 12, яка відрізняється тим, що вищезгадана кількість забезпечує рівень введення від 0,1 до 10 мг/кг/день. 15. Спосіб одержання сполуки формули (І): 11 UA 99927 C2 O H N O N N Y N CH2 OH p R 5 10 , (I) у якій R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю, Y є СН або N, і р є цілим числом від 0 до 3, та її солей, або кислих адитивних солей з фармацевтично прийнятною органічною або мінеральною кислотою, або основних адитивних солей з фармацевтично прийнятною органічною або мінеральною основою, який характеризується тим, що здійснюють (1) реакцію між сполукою формули А: O H N NH N N HA R 15 ,(A) у якій: R має описане вище значення, і А представляє аніонний залишок мінеральної або органічної кислоти, та сполукою формули В: O X Y 20 25 30 35 CH2 OR 1 p , (В) у якій Y та р мають описане вище значення, R1 представляє лінійну або розгалужену алкільну, арильну, арилалкільну або алкіларильну групу, яка містить від 1 до 10 атомів вуглецю, і X представляє атом галогену, та (2) наступний гідроліз естеру, утвореного в результаті реакції (1). 16. Спосіб одержання за п. 15, який відрізняється тим, що вищезгаданий залишок А вибирають із групи, до якої належать галогенід, фосфат, сульфат, нітрат та органічний карбоксилат. 17. Спосіб одержання за п. 16, який відрізняється тим, що вищезгаданий залишок А вибирають із групи, до якої належать хлорид, бромід та йодид. 18. Спосіб одержання за п. 15, який відрізняється тим, що вищезгаданий залишок X вибирають із групи, до якої належать хлорид, бромід та йодид. 19. Спосіб одержання за п. 15, який відрізняється тим, що вищезгадану групу R1 вибирають із групи, до якої належать лінійний або розгалужений алкіл, який містить 1-6 атомів вуглецю, арил, арилалкіл та алкіларил, який містить 7-8 атомів вуглецю. 20. Спосіб одержання за будь-яким з пп. з 15 по 19, який відрізняється тим, що вищезгадану реакцію (1) здійснюють в органічному розчиннику, вибраному з групи, до якої належать полярні апротонні розчинники. 21. Спосіб одержання за п. 20, який відрізняється тим, що вищезгаданий органічний розчинник вибирають із групи, до якої належать ацетон, метилетилкетон, тетрагідрофуран, диметилформамід, диметилсульфоксид, діоксан та ацетонітрил. 22. Спосіб одержання за будь-яким з пп. з 15 по 21, який відрізняється тим, що вищезгадану реакцію (1) здійснюють у присутності основної органічної або мінеральної сполуки. 12 UA 99927 C2 23. Спосіб одержання за будь-яким з пп. з 15 по 22, який відрізняється тим, що вищезгадану реакцію (1) здійснюють у присутності активуючого агента, вибраного з групи, до якої належать йодид калію, йодид цезію, йодид тетрабутиламонію та йодид триметилфеніламонію. 24. Застосування сполуки формули (І): O H N N O N Y N 5 10 15 R CH2 OH p , (I) у якій: R є лінійною або розгалуженою алкільною групою, яка містить від 1 до 3 атомів вуглецю, Y є СН або N, і р є цілим числом від 0 до З, та її солей, або кислих адитивних солей з фармацевтично прийнятною органічною або мінеральною кислотою, або основних адитивних солей з фармацевтично прийнятною органічною або мінеральною основою для виготовлення фармацевтичної композиції для лікування від невропатичного болю. 25. Застосування сполуки за п. 24 для виготовлення фармацевтичної композиції для лікування від невропатичного болю, викликаного діабетом, раком, імунодефіцитом, травмою, ішемією, розсіяним склерозом, ішіасом, тригемінальною невралгією та постгерпетичним синдромом. 13 UA 99927 C2 Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition that is active in the treatment of neuropathic pain
Автори англійськоюAlisi, Maria, Alessandra, Cazzolla, Nicola, Furlotti, Guido, Guglielmotti, Angelo, Polenzani, Lorenzo
Назва патенту російськоюМедикамент, который является активным при невропатической боли
Автори російськоюАлиси Мария Алессандра, Каццолла Никола, Фурлотти Гвидо, Гуглиелмотти Анджело, Гуглиэлмотти Анджело, Поленцани Лоренцо
МПК / Мітки
МПК: C07D 401/14, A61P 29/00, C07D 401/12, A61K 31/4545
Мітки: невропатичному, медикамент, активним, болі
Код посилання
<a href="https://ua.patents.su/16-99927-medikament-yakijj-eh-aktivnim-pri-nevropatichnomu-boli.html" target="_blank" rel="follow" title="База патентів України">Медикамент, який є активним при невропатичному болі</a>
Попередній патент: Сходинка для есклатора та ескалатор з такою сходинкою
Наступний патент: Спосіб корекції алкогольних пошкоджень печінки
Випадковий патент: Спосіб одержання води з атмосферного повітря