Налмефену гідрохлориду дигідрат
Номер патенту: 102128
Опубліковано: 10.06.2013
Автори: Де Фавері Карла, Лопес де Дієґо Хейді, Хубер Флоріан Антон Мартин
Формула / Реферат
1. Сполука, представлена формулою
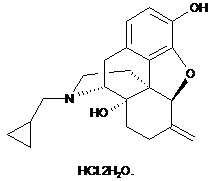
2. Сполука за п. 1, де сполука знаходиться в кристалічній формі.
3. Сполука за п. 2, де сполука в кристалічній формі характеризується спектром рентгенівської порошкової дифракції із застосуванням Сu Kα1-випромінювання у величинах кута 2θ, який має пік при 8,99.
4. Сполука за п. 3, де сполука в кристалічній формі далі характеризується спектром рентгенівської порошкової дифракції із застосуванням Сu Kα1-випромінювання у величинах кута 2θ, який має пік при одному або декількох з 10,63, 15,24, 16,55 і/або 17,20.
5. Сполука за будь-яким з попередніх пунктів, що є негігроскопічною і, таким чином, поглинає менше 1 %, переважно менше 0,5 %, переважно менше 0,3 % (маса/маса), вологи при відносній вологості 95 % при 25 °C.
6. Сполука за будь-яким з попередніх пунктів, де вміст води складає від приблизно 8 % до приблизно 9 % в інтервалі відносної вологості від приблизно 10 % до приблизно 95 %.
7. Спосіб одержання сполуки у відповідності з будь-яким з пп. 1-6, який включає етапи:
(1) змішування налмефену гідрохлориду (17-(циклопропілметил)-4,5-α-епокси-6-метиленморфінан-3,14-діолу гідрохлориду) і водного розчину, такого як вода,
(2) необов'язково нагрівання суміші,
(3) необов'язково дистиляції суміші,
(4) перемішування суміші до завершення перетворення і
(5) виділення утвореної твердої речовини.
8. Спосіб за п. 7, де суміш на етапі (4) перемішують протягом не менше 1 години.
9. Спосіб за будь-яким з пп. 7 і 8, де співвідношення водного розчину, такого як вода, використовуваного на етапі (1), знаходиться в інтервалі від приблизно 0,9 мл до приблизно 4 мл водного розчину/налмефену гідрохлориду (г), переважно від приблизно 1 мл до приблизно 2 мл водного розчину/налмефену гідрохлориду (г), більш переважно 1,5 мл водного розчину/налмефену гідрохлориду (г).
10. Спосіб за будь-яким з пп. 7-9, де налмефену гідрохлорид, використовуваний на етапі (1), знаходиться в гідратованій формі, такій як моногідратна форма.
11. Спосіб за будь-яким з пп. 7-9, де налмефену гідрохлорид, використовуваний на етапі (1), знаходиться в сольватованій формі або суміші гідратованої і сольватованої форм.
12. Спосіб за будь-яким з пп. 7-11, де на етапі (2) і/або (3) здійснюють перемішування.
13. Спосіб за будь-яким з пп. 7-12, де перемішування на етапі (4) проводять при температурі від приблизно 0 °C до приблизно 45 °C, переважно від 20 °C до приблизно 40 °C.
14. Спосіб за будь-яким з пп. 7-13, де утворену на етапі (5) тверду речовину виділяють при температурі від приблизно 0 °C до приблизно 20 °C, переважно від приблизно 0 °C до приблизно 5 °C.
15. Спосіб одержання сполуки у відповідності з будь-яким з пп. 1-6, який включає етапи:
(a) змішування налмефену гідрохлориду (17-(циклопропілметил)-4,5-α-епокси-6-метиленморфінан-3,14-діолу гідрохлориду) і водного розчину, такого як вода,
(b) нагрівання суміші для одержання по суті гомогенного розчину,
(c) необов'язково дистиляції суміші, отриманої на етапі (b),
(d) охолоджування розчину, отриманого на етапі (b) або (с), з подальшим внесенням затравки налмефену гідрохлориду, і
(e) виділення утвореної твердої речовини.
16. Спосіб за п. 15, де кількість водного розчину, такого як вода, використовуваного на етапі (а), знаходиться в інтервалі від 0,9 мл до приблизно 4 мл водного розчину/налмефену гідрохлориду (г), переважно від приблизно 1 мл до приблизно 2 мл водного розчину/налмефену гідрохлориду (г), або приблизно 1,5 мл водного розчину/налмефену гідрохлориду (г).
17. Спосіб за будь-яким з пп. 15, 16, де нагрівання на етапі (b) проводять до досягнення температури від приблизно 50 °C до приблизно 100 °C, переважно від приблизно 50 °C до приблизно 90 °C або від приблизно 70 °C до приблизно 85 °C.
18. Спосіб за будь-яким з пп. 15-17, де розчин на етапі (d) охолоджують до температури між 40 і 50 °C і при цій температурі проводять внесення затравки.
19. Спосіб за будь-яким з пп. 15-18, де кількість кристалічної затравки, що додається на етапі (d), складає від приблизно 1/2000 (маса/маса) кристалічної затравки налмефену гідрохлориду/налмефену гідрохлориду, доданого на етапі (а), переважно від приблизно 1/1000 (маса/маса) кристалічної затравки або 1/200 кристалічної затравки налмефену гідрохлориду/налмефену гідрохлориду, доданого на етапі (а).
20. Спосіб за будь-яким з пп. 15-19, де налмефен, використовуваний для внесення затравки, являє собою налмефену гідрохлориду дигідрат.
21. Спосіб за будь-яким з пп. 15-20, де кристалічну затравку, що додають на етапі (d), отримують за способом у відповідності з будь-яким з пп. 7-14.
22. Спосіб за будь-яким з пп. 15-21, де суміш, отриману на етапі (d), що містить кристал(и) затравки, далі піддають:
(d') подальшому охолоджуванню суміші до температури приблизно 0-5 °C протягом періоду часу приблизно 45 хвилин або більше і
(d") подальшому витримуванню суміші при температурі приблизно 0-5 °C протягом приблизно 45 хвилин або більше, перед виділенням утвореної твердої речовини згідно з етапом (e) п. 15.
23. Спосіб за будь-яким з пп. 15-22, де утворену тверду речовину виділяють при температурі приблизно 0-5 °C на етапі (e) п. 15.
24. Спосіб за будь-яким з пп. 15-23, де отримана сполука має наступний розподіл частинок за розміром: D90, рівний або менше 400 мкм, D50, рівний або менше 200 мкм, D10, рівний або менше 50 мкм, і співвідношення D90/D50, рівне або менше 2,5; як виміряно за умов, викладених в даному описі.
25. Спосіб за будь-яким з пп. 7-14 та 15-24 для одержання сполуки, визначеної за будь-яким з пп. 1-6, для використання у фармацевтичній композиції.
26. Спосіб за будь-яким з пп. 7-25, який далі включає етапи:
(і) необов'язково дистиляції маточного розчину, отриманого згідно зі способом за п. 7 або 15,
(іі) підлуговування маточного розчину, отриманого на етапі (і) або згідно зі способом за п. 7 або 15,
(ііі) екстракції суміші відповідним органічним розчинником,
(iv) додавання хлористого водню і
(ν) виділення утвореної твердої речовини.
27. Спосіб за п. 26, де підлуговування на етапі (іі) здійснюють до одержання рН в інтервалі 8-10.
28. Спосіб за п. 27, де підлуговування на етапі (іі) здійснюють до одержання рН в інтервалі 8-9.
29. Спосіб за будь-яким з пп. 27, 28, де підлуговування на етапі (іі) здійснюють за допомогою гідроксиду амонію.
30. Спосіб за будь-яким з пп. 27-29, де розчинники, використовувані на етапі екстракції (ііі), вибрані з групи, що включає галогеновані вуглеводні, етери, естери, кетони, більш переважно дихлорметан, 2-метилтетрагідрофуран, етилацетат, 2-бутанон і, більш переважно, дихлорметан.
31. Спосіб за будь-яким з пп. 7-14, 15-25 та 26-30, де отримана сполука має хімічну чистоту не менше 98 %, переважно хімічну чистоту не менше 99 % або хімічну чистоту не менше 99,5 %.
32. Фармацевтична композиція, яка містить сполуку, визначену в будь-якому з пп. 1-6.
33. Фармацевтична композиція за п. 32, де налмефену гідрохлориду дигідрат складає не менше 5 % (маса/маса), переважно не менше 10 % (маса/маса), не менше 30 %, не менше 50 % (маса/маса), не менше 70 % (маса/маса), не менше 90 % (маса/маса), не менше 95 % (маса/маса), не менше 99 % (маса/маса) або 100 % від фармацевтичної лікарської форми.
34. Фармацевтична композиція за п. 32 або 33, яка далі містить один або декілька фармацевтично прийнятних носіїв.
35. Фармацевтична композиція за будь-яким з пп. 32-34 в твердій лікарській формі для перорального введення, такій як пігулка.
36. Фармацевтична композиція за будь-яким з пп. 32-35, яка містить сполуку за будь-яким з пп. 1-6 в терапевтично ефективній кількості.
37. Фармацевтична композиція за будь-яким з пп. 32-36, яка містить сполуку за будь-яким з пп. 1-6 в кількості від приблизно 10 мг до приблизно 100 мг, переважно від приблизно 10 мг до приблизно 60 мг, від приблизно 10 мг до приблизно 40 мг або приблизно 20 мг.
38. Спосіб одержання фармацевтичної композиції за будь-яким з пп. 32-37, який включає спосіб за будь-яким з пп. 8-14 або 15-31.
39. Сполука за будь-яким з пп. 1-6, де сполука призначена для застосування в медицині, переважно для застосування в лікуванні алкогольної залежності.
40. Фармацевтична композиція за будь-яким з пп. 32-37, де композиція призначена для застосування в лікуванні алкогольної залежності.
Текст
Реферат: Цей винахід належить до налмефену гідрохлориду дигідрату формули І, способів виробництва налмефену гідрохлориду дигідрату, до фармацевтичної композиції, яка містить налмефену гідрохлориду дигідрат, і до способів лікування, які включають введення налмефену гідрохлориду дигідрату. UA 102128 C2 (12) UA 102128 C2 OH O N HO .HCl.2H2O (І) UA 102128 C2 5 10 15 20 25 30 35 40 Цей винахід відноситься до нової негігроскопічної форми налмефену гідрохлориду, а саме налмефену гідрохлориду дигідрату, особливо до лікарських форм для перорального введення, і до способів його одержання. Рівень техніки Налмефен (Nalmefen) є відомим антагоністом опіоїдного рецептора, який здатний інгібувати фармакологічні ефекти як опіоїдних агоністів, що вводяться, так і ендогенних агоністів, вироблюваних опіоїдною системою. Клінічне значення як антагоніста налмефен придбав завдяки своїй здатності швидко (і вибірково) змінювати на зворотне ефекти цих опіоїдних агоністів, включаючи часто спостережувані депресії центральної нервової системи і дихальної системи. Спочатку налмефен був розроблений для застосування при лікуванні алкогольної залежності, де продемонстрував позитивний ефект в дозах від 10 до 40 мг при завчасному прийомі до очікуваного вживання алкоголю (приблизно за 1-2 години до прийому алкоголю) (Karhuvaara et al, Alcohol. Clin. Exp. Res., (2007), Vol. 31 № 7. pp 1179-1187). Крім того, налмефен також досліджувався стосовно лікування інших залежностей, таких як патологічна пристрасть до азартних ігор і пристрасть до шопінгу. У цих експериментальних програмах і тестуваннях налмефен використовувався, наприклад, у вигляді парентерального розчину (Revex™). Налмефен є опіатним похідним, схожим за структурою з опіоїдним антагоністом налтрексоном (Naltrexone). Переваги налмефену по відношенню до налтрексону включають триваліший період напіврозпаду, більшу біодоступність при пероральному введенні і відсутність спостережуваної залежної від дози гепатотоксичності. Налмефен відрізняється від налтрексона заміною кетонової групи у положенні б налтрексону на метиленову групу (СН2), яка значно підвищує афінність зв'язування з μопіоїдним рецептором. Також налмефен має високу афінність до інших опіоїдних рецепторів (κ і δ рецепторів) і, завдяки своїй здатності блокувати усі ці три рецептори, відомий як "універсальний антагоніст". Налмефен може бути отриманий за способом, описаним Hanh зі співавторами (J Med Chem., 18, 259-262(1975), Mallinckrodt (патент США № 4751307) і Meltzner зі співавторами (патент США№ 4535157). Використовуючи вищезгадані способи, отримують вільну основу налмефену, яка далі може бути перетворена в хлористоводневу сіль із застосуванням стандартних методів. Згідно з Brittain (Analytical Profiles of Drug Substances and Excipients (1996), Vol 24, pp. 351395) налмефену гідрохлорид може бути перекристалізований з води, з виходом чистої активної речовини, яка обов'язково складається з моногідратної кристалічної форми. У тому ж огляді моногідратна кристалічна форма налмефену гідрохлориду описана як по суті негігроскопічна, оскільки може сорбувати тільки до 1 % додаткової вологи. Автори цього винаходу встановили, що, всупереч опублікованим даним, налмефену гідрохлорид у формі моногідрату є гігроскопічним. Отже, необхідна розробка нової, стабільної і негігроскопічної форми гідрату налмефену і способів її одержання. Суть винаходу Цей винахід відноситься до налмефену гідрохлориду дигідрату, представленому формулою OH O N HO 45 HCl.2H2O. переважно, в кристалічній формі. Вказаний налмефену гідрохлориду дигідрат є негігроскопічним. Винахід далі відноситься до двох способів одержання налмефену гідрохлориду дигідрату: 1 UA 102128 C2 5 10 15 20 25 30 35 40 45 50 55 Спосіб (І): перетворення налмефену гідрохлориду в налмефену гідрохлориду дигідрат шляхом ресуспендування у водному розчині, такому як вода, така як чиста вода, і Спосіб (II): перекристалізація налмефену гідрохлориду у водному розчині, такому як вода, така як чиста вода. Спосіб ресуспендування (Спосіб І) включає етапи: (1) змішування налмефену гідрохлориду (17-(циклопропілметил)-4,5-а-епокси-6метиленморфінан-3,14-діолу гідрохлориду) і водного розчину, такого як вода, така як чиста вода, (2) необов'язково нагрівання суміші, (3) необов'язково дистиляції суміші, (4) перемішування суміші до закінчення перетворення, наприклад, менше 1 години, наприклад, близько 1 години, наприклад, принаймні 1 годину, і (5) виділення утвореної твердої речовини. Спосіб перекристалізації (Спосіб II) включає етапи: (a) змішування налмефену гідрохлориду (17-(циклопропілметил)-4,5-а-епокси-6метиленморфінан-3,14-діолу гідрохлориду) іводного розчину, такого як вода, така як чиста вода, (b) нагрівання суміші для одержання по суті гомогенного розчину, (c) необов'язково дистиляції суміші, отриманої в (b), (d) охолоджування розчину, отриманого на етапі (b) або (с), з подальшим внесенням затравки налмефену гідрохлориду, і (e) виділення утвореної твердої речовини. Наступним аспектом (Спосіб III) цього винаходу є спосіб утилізації невикористаного налмефену із способів І і II, що складається з етапів: (і) необов'язково дистиляції маточного розчину, отриманого від способу (І) або (II), (іі) підлуговування маточного розчину, отриманого на етапі (і) або від способу (І) або (II), (ііі) екстракції суміші відповідним органічним розчинником, (iv) додавання хлористого водню і (v) виділення отриманої твердої речовини. Далі, винахід відноситься до фармацевтичних композицій, що містять налмефену гідрохлориду дигідрат, до застосування налмефену гідрохлориду дигідрату в медицині і, особливо, до застосування налмефену гідрохлориду дигідрату для лікування алкогольної залежності. Стислий опис ілюстративних матеріалів Фігура 1 показує термограму термогравіметричного аналізу налмефену гідрохлориду дигідрату. По осі "у" відкладені долі маси у відсотках, а по осі "X" значення температури (°С). Фігура 2 показує результати експерименту з вимірювання динаміки сорбції пари, проведеного при 40 °C для налмефену гідрохлориду дигідрату (графік залежності сухої маси). Перша вісь "у" (ліворуч) показує зміну маси відносно безводної речовини (%), а інша вісь "у" (праворуч) показує цільову відносну вологість (RH) (%), тоді як по осі "х" відкладений час в хвилинах. Тонкою лінією показані зміни у цільовій відносній вологості, а товстою - зміни щодо маси. Фігура 3 показує порошкову рентгенівську дифрактограму для налмефену гідрохлориду дигідрату. Вісь "у" показує інтенсивність (імпульси), а вісь "х" показує величину кута 2тета (°). Фігура 4 показує термограму термогравіметричного аналізу налмефену гідрохлориду моногідрату. По осі "у" відкладені долі маси у відсотках, а по осі "х" значення температури (°С). Фігура 5 показує результати експерименту з вимірювання динаміки сорбції пари, проведеного при 40 °C для налмефену гідрохлориду моногідрату (графік залежності сухої маси). Перша вісь "у" (ліворуч) показує зміну маси відносно безводної речовини (%), а інша вісь "у" (праворуч) показує цільову відносну вологість (RH) (%), тоді як по осі "х" відкладений час в хвилинах. Тонкою лінією показані зміни у відносній вологості, а товстою - зміни щодо маси. Фігура 6 показує порошкову рентгенівську дифрактограму для налмефену гідрохлориду моногідрату. Вісь "у" показує інтенсивність (імпульси), а вісь "х" показує величину кута 2тета (°). Докладний опис винаходу Цей винахід відноситься до налмефену гідрохлориду дигідрату, представленому нижченаведеною формулою 2 UA 102128 C2 OH O N HO HCl.2H2O. 5 10 15 20 25 30 35 40 45 50 Дигідратна форма налмефену гідрохлориду особливо переважна, оскільки є негігроскопічною. Завдяки цій властивості негігроскопічності, фізичні властивості препарату легко регулювати. Це має важливе значення при приготуванні твердих лікарських форм, таких як форми, що призначаються для перорального введення, включаючи тверді стандартні лікарські форми, наприклад, пігулки або жувальні пігулки і капсули. Як добре відомо у фармацевтичній промисловості, переробка гігроскопічних продуктів вимагає використання камер з регульованою вологістю як під час зберігання, так і в процесі переробки. Більш того, готовий гігроскопічний продукт обов'язково має бути упакований в герметичні блістери, щоб уникнути проблем із стабільністю внаслідок вологості навколишнього середовища. Цих недоліків можна уникнути, застосовуючи налмефену гідрохлорид у формі негігроскопічного дигідрату. Налмефену гідрохлориду дигідрат характеризується як негігроскопічна і стабільна речовина в сенсі вмісту води. Це сполука не поглинає і не втрачає воду за умов відносної вологості від 10 % до 95 %. Як показано в Прикладі 1 цього винаходу, експерименти з вимірювання динаміки сорбції пари (DVS) були проведені при 25 °C і при 40 °C. Результати показують, що налмефену гідрохлориду дигідрат не поглинав воду навіть при відносній вологості 95 %. На відміну від цього, як показано в Прикладі 2, налмефену гідрохлорид у формі моногідрату поглинав близько 2,5 % води в умовах відносної вологості 95 % і 40 °C. Крім того, результат з Прикладу 2 показав, що, в протилежність дигідратній формі, моногідратна форма змінює власний вміст води залежно від зміни вологості навколишнього середовища, а при відносній вологості понад 50 % моногідратна форма трансформувалася в нову структуру з вищим вмістом води. Отже, важливою властивістю налмефену гідрохлориду дигідрату є його негігроскопічність, як визначено вище. Таким чином, цей винахід відноситься до налмефену гідрохлориду дигідрату, що є негігроскопічним, що означає, що при відносній вологості 95 % при 25 °C поглинається менше 1 %, наприклад, менше 0,5 %, наприклад, менше 0,3 % вологи. Налмефену гідрохлориду дигідрат являє собою тверду кристалічну речовину, що характеризується відбиттям рентгенівського випромінювання при кутах 8,99, 10,63, 15,24, 16,55 і 17,20°2θ (±0,1°2θ), як отримано із застосуванням Сu, Кα1-випромінювання, і вмістом води від приблизно 8 до приблизно 9 %, приблизно 8,7 %, тоді як моногідратна форма налмефену гідрохлориду являє собою тверду кристалічну речовину, що характеризується відбиттям рентгенівського випромінювання при кутах 7,39, 11,33, 11,52, 17,70 і 24,27°2θ (±0,1°2θ) і вмістом води 4-7 %, залежно від відносної вологості навколишнього середовища. Також, цей винахід відноситься до застосування налмефену гідрохлориду дигідрату у виробництві лікарських препаратів. Зокрема цей винахід відноситься до застосування налмефену гідрохлориду дигідрату у виробництві лікарського препарату, де налмефену гідрохлориду дигідрат складає не менше 5 % (маса/маса), наприклад, не менше 10 % (маса/маса), не менше 30 %, не менше 50 % (маса/маса), наприклад, не менше 70 % (маса/маса), не менше 90 % (маса/маса), не менше 95 % (маса/маса), не менше 99 % (маса/маса), або 100 % від фармацевтичної лікарської форми, особливо лікарської форми для перорального введення, наприклад, стандартної твердої лікарської форми, такої як пігулка. Застосування налмефену гідрохлориду дигідрату особливо актуально у виробництві лікарського препарату для лікування алкогольної залежності. У наступному варіанті здійснення цей винахід відноситься до способу лікування алкогольної залежності, який включає введення терапевтично ефективної кількості налмефену гідрохлориду дигідрату, наприклад, у складі фармацевтичної композиції (такої як тверда лікарська форма, наприклад, пігулка для перорального введення), пацієнтові, що потребує цього. 3 UA 102128 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "терапевтично ефективна кількість" відноситься до кількості/дози сполуки або фармацевтичної композиції, яка достатня для одержання ефективної відповіді (тобто, одержання дослідником, ветеринаром, лікарем, який здійснює лікування, або клініцистом біологічної або терапевтичної відповіді тканини, системи, досліджуваної тварини або людини) при введенні пацієнтові. "Терапевтично ефективна кількість" варіюватиметься залежно від, зокрема, типу захворювання і ступеня тяжкості, віку, маси, фізичного стану і сприйнятливості пацієнта, що проходить лікування. Крім того, "терапевтично ефективна кількість" може варіюватися, якщо сполука винаходу комбінується з однією або декількома сполуками; у такому разі кількість введеної сполуки може бути меншою, такою як субефективна кількість. Термін "дистилювати" відноситься до способу розділення компонентів сумішей на основі відмінностей в летючості речовин в киплячій рідкій суміші. Використання вакууму, наприклад, часткового вакууму, є прикладом такого способу розділення. Термін "хімічна чистота" має своє звичайне значення в рамках даної галузі техніки і, таким чином, відноситься до ступеня, до якого отримана сполука забруднена домішками. Відповідно, отримана сполука з хімічною чистотою не менше 98 % містить не більше 2 % домішок. Хімічна чистота може бути виміряна, наприклад, методом ВЕРХ. Термін "зразок" відноситься до ефективного вмісту необхідної речовини, вираженого як відсоток за масою (маса/маса %). Термін "екстракція" відноситься до екстракції рідини рідиною, при якій налмефен у вигляді вільної основи переноситься з водної фази в органічну фазу. Термін "ресуспендування" відноситься до процедури, при якій кристалічна речовина суспендується в розчиннику або суміші розчинників при відповідній температурі, завдяки чому кристалічна речовина частково розчиняється і частково кристалізується знов, таким чином забезпечується можливість її перетворення в необхідну форму і/або її очищення. KF означає "титрування за методом Карла Фішера". TGA означає "термогравіметричний аналіз". DVS означає вимірювання "динаміки сорбції пари". У цьому винаході термін "по суті гомогенний розчин" означає рідку суміш без видимої нерозчиненої речовини. У цьому винаході термін "внесення затравки" означає, додавання малої кількості кристалів для ініціювання осадження продукту. У контексті цього винаходу термін "негігроскопічний" означає, що менше 1 %, наприклад, менше 0,5 %, наприклад, менше 0,3 % (маса/маса) вологи поглинається в умовах відносної вологості 95 % при 25 °C. У контексті цього винаходу розміри частинок визначені за методом лазерної дифракції із застосуванням приладу Malvern Mastersizer S, як детально описано на початку експериментального розділу. Переважна кількість налмефену гідрохлориду дигідрату у фармацевтичній композиції знаходиться в кількості від приблизно 10 мг до приблизно 100 мг, наприклад, від приблизно 10 мг до приблизно 60 мг, від приблизно 10 мг до приблизно 40 мг, або приблизно 20 мг. Термін "алкогольна залежність" є загальновідомим терміном для фахівців в даній галузі, який у виправленій 4-й редакції Діагностичного і Статистичного Керівництва по Психічних Розладах (DSM-IVTR) (Diagnostic and Statistical Manual of Mental Disorders, 4th edition text revision, American Psychiatric Publishing, 2000) визначений як пов'язані з алкоголем порушення в трьох або більше з семи сфер життя за той же період в 12 місяців. Ці порушення включають толерантність, факт абстинентного синдрому при припиненні або зменшенні прийому алкоголю, можливе втручання в життєве функціонування, пов'язане з проведенням великої кількості часу, вживаючи алкоголь, і повернення до вживання, не дивлячись на наявність фізичних або психологічних проблем. Фармацевтична композиція, яка містить налмефену гідрохлориду дигідрат далі може містити один або декілька фармацевтично прийнятних носіїв. Способи одержання твердих фармацевтичних препаратів добре відомі в даній галузі техніки. Див., наприклад, Remington: The Science and Practice of Pharmacy, 21st ed., Lippincott Williams & Wilkins (2005). Тверді препарати, такі як пігулки, можуть бути отримані шляхом змішування активних інгредієнтів із звичайним носієм, таким як ад'ювант і/або розріджувач, і подальшого пресування суміші в таблетувальній машині. Необмежувальні приклади ад'ювантів і/або розріджувачів включають: кукурудзяний крохмаль, лактозу, тальк, стеарат магнію, желатин, лактозу, камедь і подібні. Також можуть знайти застосування будь-які інші ад'юванти або добавки, такі як барвники, ароматизатори і консерванти, за умови, що вони сумісні з активними інгредієнтами. Таким чином, фармацевтичні 4 UA 102128 C2 5 10 15 20 25 30 35 40 45 50 55 композиції винаходу зазвичай містять ефективну кількість налмефену гідрохлориду дигідрату і один або декілька фармацевтично прийнятних носіїв. Згідно з цим винаходом передбачено, що налмефену гідрохлориду дигідрат може бути введений будь-яким відповідним способом, наприклад, перорально або парентерально, і може бути представлений для такого введення в будь-якій відповідній формі, наприклад, у формі пігулок, капсул, порошків, сиропів або розчинів або дисперсій для ін'єкцій. У одному варіанті здійснення налмефену гідрохлориду дигідрат переважно вводиться у формі твердої фармацевтичної одиниці, зручно у вигляді пігулки або капсули. Наступний аспект цього винаходу відноситься до способів одержання налмефену гідрохлориду дигідрату. Налмефену гідрохлориду дигідрат може бути отриманий будь-яким із способів (І) і (II), як буде викладено нижче. Спосіб (І): перетворення налмефену гідрохлориду на налмефену гідрохлориду дигідрат шляхом ресуспендування у водному розчині, такому як вода, така як чиста вода, і Спосіб (II): перекристалізація налмефену гідрохлориду у водному розчині, такому як вода, така як чиста вода. Згідно з одним аспектом винаходу, спосіб ресуспендування (Спосіб І) включає етапи: (1) змішування налмефену гідрохлориду (17-(циклопропілметил)-4,5-а-епокси-6метиленморфінан-3,14-діолу гідрохлориду) і водного розчину, такого як вода, така як чиста вода, (2) необов'язково нагрівання суміші, (3) необов'язково дистиляції суміші, (4) перемішування суміші і (5) виділення утвореної твердої речовини. У одному варіанті здійснення винаходу за способом (І) налмефену гідрохлорид перетворюють на налмефену гідрохлориду дигідрат шляхом ресуспендування у водному розчині. У іншому варіанті здійснення винаходу налмефену гідрохлорид перетворюють на налмефену гідрохлориду дигідрат шляхом ресуспендування у воді. У ще одному варіанті здійснення налмефену гідрохлорид перетворюють на налмефену гідрохлориду дигідрат шляхом ресуспендування в чистій воді. Співвідношення водного розчину, такого як вода, наприклад, чиста вода, використовуване на етапі (1) може знаходитися в інтервалі від 0,5 мл до приблизно 4 мл водного розчину/налмефену гідрохлориду (г), наприклад, від приблизно 1 мл до приблизно 2 мл водного розчину/налмефену гідрохлориду (г), більш переважно 1,5 мл водного розчину/налмефену гідрохлориду (г). Використовуваний налмефену гідрохлорид може бути вибраний з будь-якої гідратованої або сольватованої форми налмефену або сумішей гідратованої і/або сольватованої форм з розчинниками або без них. У одному варіанті здійснення використовують налмефену гідрохлорид у моногідратній формі. У іншому варіанті здійснення Способу (І) використовують налмефену гідрохлорид в гідратованій формі. У іншому варіанті здійснення використовують налмефену гідрохлорид в сольватованій формі. У ще одному варіанті здійснення використовують налмефену гідрохлорид як суміш гідратованої і сольватованої форм. У варіанті здійснення Способу (І), розчинники, що містяться у вказаних гідратованій і/або сольватованій формах, вибрані з групи, що складається з ацетону, n-пропанолу, ізопропанолу, дихлорметану і води. У одному варіанті здійснення вказаний розчинник являє собою ацетон. У іншому варіанті здійснення вказаний розчинник являє собою n-пропанол. У ще одному варіанті здійснення вказаний розчинник являє собою ізопропанол. У ще одному варіанті здійснення вказаний розчинник являє собою дихлорметан. У ще одному варіанті здійснення вказаний розчинник являє собою воду. Нагрівання на етапі (2) виконується необов'язково і може бути корисне за деяких умов для підвищення швидкості розчинення суміші, отриманої на етапі (b). Температура нагрівання може залежати від обставин. При певних обставинах змішування ефективно здійснюватиметься при кімнатній температурі (20-25 °C). Передбачається, що в одному варіанті здійснення нагрівання на етапі (2) проводять до приблизно 50 °C. У іншому варіанті здійснення нагрівання на етапі (2) проводять до 50 °C або менше. У іншому варіанті здійснення нагрівання на етапі (2) проводять до температури від приблизно 20 °C до приблизно 40 °C. У ще одному варіанті здійснення нагрівання на етапі (2) проводять до приблизно 30 °C. Етап (2) і етап (3) можна здійснювати з перемішуванням або без нього. Дистиляція на етапі (3) може бути проведена з метою видалення органічних розчинників, якщо вони присутні в суміші. Дистиляція може проводитися із застосуванням вакууму. 5 UA 102128 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перемішування на етапі (4) може здійснюватися при температурі від приблизно 0 °C до приблизно 50 °C, наприклад, при 45 °C, наприклад, від 20 °C до приблизно 40 °C. У одному варіанті здійснення суміш перемішують менше однієї години. У іншому варіанті здійснення суміш перемішують приблизно протягом однієї години. У ще одному варіанті здійснення суміш перемішують не менше однієї години. Тверда речовина може бути виділена при температурі в інтервалі приблизно 0-25 °C, наприклад, 0-20 °C і, більш переважно, в інтервалі 0-5 °C, для зниження розчинності продукту, наприклад, у воді, і для підвищення виходу. Тверда речовина може бути виділена шляхом фільтрації і промита відповідним розчинником. Розчинники для промивок включають воду і суміші вода/органічні розчинники або чисті органічні розчинники. Переважно використовують воду, а в наступному варіанті здійснення винаходу переважно використовують заздалегідь охолоджену воду. У разі застосування органічних розчинників, переважними є розчинники класу 2 або 3 (керівництво Міжнародної Конференції з Гармонізації (ІСН Q3C(R4))). У одному варіанті здійснення застосовують такі розчинники класу 3, як ацетон і етилацетат. У одному варіанті здійснення використовують ацетон. У іншому варіанті здійснення використовують етилацетат. Продукт може бути висушений під вакуумом при температурі нижче 40 °C, а більш переважно при температурі в інтервалі 25-35 °C. Передбачається, що отримана сполука має хімічну чистоту не менше 98 %, наприклад, хімічну чистоту не менше 99 % або хімічну чистоту не менше 99,5 %. Згідно з одним аспектом винаходу, спосіб перекристалізації (Спосіб (ІI)) включає етапи: (a) змішування налмефену гідрохлориду (17-(циклопропілметил)-4,5-α-епокси-6метиленморфінан-3,14-діолу гідрохлориду) і водного розчину, такого як вода, така як чиста вода, (b) нагрівання суміші для одержання по суті гомогенного розчину, (c) необов'язково дистиляції суміші, отриманої на етапі (b), (d) охолоджування розчину, отриманого на етапі (b) або (с), з подальшим внесенням затравки налмефену гідрохлориду, і (e) виділення утвореної твердої речовини. У одному варіанті здійснення Способу (II) налмефену гідрохлорид перетворюють на налмефену гідрохлориду дигідрат шляхом перекристалізації у водному розчині. У іншому варіанті здійснення налмефену гідрохлорид перетворюють на налмефену гідрохлориду дигідрат шляхом ресуспендування у воді. У ще одному варіанті здійснення налмефену гідрохлорид перетворюють на налмефену гідрохлориду дигідрат шляхом ресуспендування в чистій воді. Кількість водного розчину, такого як вода, така як чиста вода, що використовується на етапі (а), може знаходитися в інтервалі від приблизно 0,9 мл до приблизно 4 мл водного розчину/налмефену гідрохлориду (г), наприклад, від приблизно 1 мл до приблизно 2 мл водного розчину/налмефену гідрохлориду (г), або приблизно 1,5 мл водного розчину/налмефену гідрохлориду (г). Використовуваний налмефену гідрохлорид може бути вибраний з будь-якої гідратованої або сольватованої форми налмефену або сумішей гідратованої і/або сольватованої форм з розчинниками або без них. У одному варіанті здійснення Способу (II) використовують налмефену гідрохлорид в гідратованій формі. У іншому варіанті здійснення використовують налмефену гідрохлорид в сольватованій формі. У ще одному варіанті здійснення використовують налмефену гідрохлорид як суміш гідратованої і сольватованої форм. У варіанті здійснення Способу (II), розчинники, що входять до складу вказаних гідратованої і/або сольватованої форм, вибрані з групи, що складається з ацетону, n-пропанолу, ізопропанолу, дихлорметану і води. У одному варіанті здійснення вказаний розчинник являє собою ацетон. У іншому варіанті здійснення вказаний розчинник являє собою n-пропанол. У ще одному варіанті здійснення вказаний розчинник являє собою ізопропанол. У ще одному варіанті здійснення вказаний розчинник являє собою дихлорметан. У ще одному варіанті здійснення вказаний розчинник являє собою воду. Суспензія може піддаватися нагріванню до одержання по суті гомогенного розчину, тобто розчину. Нагрівання на етапі (b) може проводитися до досягнення температури від приблизно 50 °C до приблизно 100 °C, наприклад, від 50 °C до приблизно 90 °C або від приблизно 70 °C до приблизно 85 °C. Потім, для видалення слідових кількостей летких органічних сполук, якщо вони присутні, може використовуватися частковий вакуум на етапі (с). Необов'язково розчин, отриманий на етапі (b) або етапі (с), може бути профільтрований (наприклад, через 0,65 мкм фільтр) для видалення чужорідних домішок перед тим, як приступити до етапу (d). 6 UA 102128 C2 5 10 15 20 25 30 35 40 45 50 55 60 На етапі (d) розчин може бути охолоджений до температури між 40 °C і приблизно 50 °C і в нього може бути внесена затравка. У одному варіанті здійснення винаходу внесення затравки проводять при температурі між 40 °C і 50 °C. Внесення затравки проводять із застосуванням кристалів налмефену гідрохлориду дигідрату. У одному варіанті здійснення винаходу матеріал затравки налмефену може бути отриманий способом ресуспендування (І), описаним вище. Кількість внесеної кристалічної затравки, що додається на етапі (d), може складати від приблизно 1/2000 (маса/маса) кристалічної затравки налмефену гідрохлориду/налмефену гідрохлориду, доданого на етапі (а), наприклад, від приблизно 1/1000 (маса/маса) кристалічної затравки або 1/200 кристалічної затравки налмефену гідрохлориду/налмефену гідрохлориду, доданого на етапі (а). Відповідний діапазон температур охолоджування, наприклад, швидке охолоджування, і відповідне перемішування, таке як інтенсивне перемішування, перешкоджають подальшому зростанню вже сформованих кристалів і сприяють отриманню продукту з відносно малим розміром частинок, який добре визначений і знаходиться у вузькому інтервалі. Охолоджування від температури, при якій починається введення затравки, до температури, при якій продукт буде виділений, може проходити протягом декількох годин, а більш переважно в межах 1 години. Таким чином, суміш з внесеною затравкою, отримана на етапі (d), далі може піддаватися охолоджуванню, такому як швидке охолоджування, яке включає етапи: (d') подальшого охолоджування суміші до температури приблизно 0-5 °C, наприклад, протягом періоду часу приблизно 45 хвилин або більше, і (d") після цього суміш може витримуватися при температурі приблизно 0-5 °C протягом, наприклад, приблизно 45 хвилин або більше, перед виділенням утвореної твердої речовини на етапі (є). Утворена тверда речовина може бути виділена на етапі (є). Тверда речовина може бути виділена при температурі в інтервалі приблизно 0-20 °C, а більш переважно в інтервалі 0-5 °C для зменшення розчинності продукту у воді і, таким чином, підвищення виходу. Тверда речовина може бути виділена за допомогою фільтрації і промита придатним розчинником. Розчинники для промивки включають воду і суміші вода/органічні розчинники або чисті органічні розчинники. У одному варіанті здійснення розчинники для промивки вибрані з групи, що складається з ацетону і води. У одному варіанті здійснення використовують ацетон. У іншому варіанті здійснення використовують суміш ацетону і води. У ще одному варіанті здійснення використовують воду. У наступному варіанті здійснення використовувана вода є заздалегідь охолодженою водою. У разі, коли для промивки застосовують органічні розчинники, переважними є розчинники класу 2 або 3 (керівництво Міжнародної Конференції з Гармонізації ІСН Q3C(R4)), більш переважними є розчинники класу 3, такі як ацетон і етилацетат. У одному варіанті здійснення використовують етилацетат. Продукт може бути висушений під вакуумом при температурі нижче 40 °C, а більш переважно при температурі в інтервалі 25-35 °C. Передбачається, що отримана сполука має хімічну чистоту не менше 98 %, наприклад, хімічну чистоту не менше 99 % або хімічну чистоту не менше 99,5 %. Далі передбачено, що налмефену гідрохлориду дигідрат, отриманий вищеописаним Способом (II), має наступний розподіл частинок за розміром: D90, рівний або менше 400 мкм, і D50, рівний або менше 200 мкм, і D10, рівний або менше 50 мкм, і співвідношення D90/D50, рівне або нижче 2,5, де D"XX" (XX являє собою 10, 50 або 90) визначається як величина, для якої "відсоток XX" (узятий за об'ємом) частинок має діаметр, менший ніж вказане значення. Таким чином, для D10, 10 відсотків частинок (за об'ємом) мають діаметр, рівний 50 мкм або менше. Утилізація налмефену гідрохлориду із маточного розчину (Спосіб III) Налмефену гідрохлорид має високу розчинність у водних розчинах, таких як вода, така як чиста вода, і, отже, частина цієї речовини втрачається в залишках маточного розчину. Для одержання деякої кількості налмефену гідрохлориду, невикористаного у Способах І або II, викладених вище, був розроблений спосіб утилізації, який включає: (і) необов'язково дистиляцію маточних розчинів, отриманих від способу (І) або (II), (іі) підлуговування маточних розчинів, отриманих на етапі (і) або від способу (І) або (II), (ііі) екстракцію суміші відповідним органічним розчинником, (iv) додавання хлористого водню і (v) виділення отриманої твердої речовини. Підлуговування на етапі (іі) проводять для приведення рН в інтервал 8-10, такий як 8-9, із застосуванням органічної або неорганічної основи. У варіанті здійснення Способу (III) підлуговування на етапі (іі) проводять гідроксидом амонію. 7 UA 102128 C2 5 10 15 20 25 30 На етапі екстракції (ііі) органічний розчинник може бути вибраний з групи, що містить галогеновані вуглеводні, етери, естери, кетони і, переважно, дихлорметан, 2метилтетрагідрофуран, етилацетат, 2-бутанон, навіть більш переважно дихлорметан. У одному варіанті здійснення органічний розчинник являє собою галогеновані вуглеводні. У іншому варіанті здійснення органічний розчинник являє собою етери. У іншому варіанті здійснення органічний розчинник вибраний з групи естерів. У іншому варіанті здійснення органічний розчинник вибраний з групи кетонів. У іншому варіанті здійснення органічний розчинник являє собою дихлорметан. У іншому варіанті здійснення органічний розчинник являє собою 2метилтетрагідрофуран. У іншому варіанті здійснення органічний розчинник являє собою етилацетат. У іншому варіанті здійснення органічний розчинник являє собою 2-бутанон. Розчин основи налмефену в органічному розчиннику, отриманий на етапі (ііі), обробляють хлористим воднем для преципітації налмефену гідрохлориду. Кількість хлористого водню, що додають на етапі (iv), залежить від різних чинників, таких як використовувана кількість налмефену в маточних розчинах, і буде очевидною для фахівця в даній галузі техніки. Після додавання до суміші хлористоводневої кислоти на етапі (iv) продукту дається можливість випасти в осад. Осаджена тверда речовина може бути виділена, як описано для Способів І і II. Передбачається, що отримана сполука має хімічну чистоту не менше 98 %, наприклад, хімічну чистоту не менше 99 % або хімічну чистоту не менше 99,5 %. Приклади У цьому контексті хімічна чистота виміряна за методом ВЕРХ з використанням наступних умов: Умови хроматографії: Колонка: YMC Basic B-O3-5, 5 мкм, 250 × 4,6 мм або еквівалентна. Рухома фаза А: буфер. Рухома фаза В: метанол. Буфер: розчинити 1,1 г октансульфонату натрію (мол. маса 216,28) в 1 л води. Довести рН до 3,8 розбавленою Н3РО4. Температура колонки: 35 °C Детектор: УФ при 230 нм Витрата потоку: 1,5 мл/хв. Об'єм введеного зразка: 20 мкл Термін аналізу: 50 хвилин Термін (хв.) 0 10 25 40 50 Рухома фаза А 90 70 50 20 20 Рухома фаза В 10 30 50 80 80 35 40 45 50 У цьому контексті, розміри частинок визначені за допомогою лазерної дифракції із застосуванням приладу Malvern Mastersizer S, укомплектованого лазерним передавачем (гелійнеоновий лазер, довжина хвилі 632 нм), оптичною системою (300 F лінза, інтервал 0,5-900 мкм), вимірювальною коміркою для суспензії (довжина шляху променю 2,4 мм) і фотодіодним детектором. Зразок аналізувався із застосуванням мінеральної оливи (CAS 8042-47) як диспергенту. Приклад 1 1.1а Одержання дигідрату Дигідрат був отриманий таким чином. 20 г необробленого налмефену гідрохлориду (хімічна чистота 99,26 %, зразок 92,9 %) суспендували в 24 мл води. Суміш нагрівали, і тверда речовина повністю розчинилася при 6065 °C. Розчин нагрівали до 70 °C і таку температуру підтримували протягом 15 хвилин. Розчин охолодили з 70 °C до 20 °C протягом 3 годин з лінійним зменшенням температури. При 50 °C налмефену гідрохлорид був доданий як затравка. Затравка не розчинялася, і налмефен почав кристалізуватися. Після закінчення лінійного зниження температури суспензію перемішували і її температуру підтримували на рівні 20 °C протягом 2,5 доби. Тверду речовину відфідьтрували і промили ацетоном (50 мл). Вологий продукт протягом ночі висушували під вакуумом при 40 °C з виходом 13,2 г налмефену гідрохлориду дигідрату (хімічна чистота 99,74 %, вміст води 8,54 % (маса/маса), як виміряно титруванням за методом Карла Фішера). 8 UA 102128 C2 5 10 15 20 25 30 35 40 45 50 55 1.1b Одержання дигідрату 20 г необробленого налмефену гідрохлориду (хімічна чистота 97,2 %, зразок 82,6 %) суспендували в 30 мл води. Суміш нагрівали, і тверда речовина повністю розчинилася при 80 °C. Леткі органічні сполуки були видалені дистиляцією під вакуумом. Розчин охолодили до 50 °C. При 50 °C налмефену гідрохлориду дигідрат був доданий як затравка. Температуру суміші підтримували на рівні 50 °C протягом 3 годин, а потім суміші дозволили охолодитися до 20 °C. Суспензію перемішували при 20 °C протягом приблизно 2,5 доби. Тверду речовину відфільтрували і промили ацетоном (20 мл). Вологий продукт протягом ночі висушували під вакуумом при 30 °C з виходом 11,5 г налмефену гідрохлориду дигідрату (хімічна чистота 99,78 %, вміст води 8,78 % (маса/маса), як виміряно титруванням за методом Карла Фішера). 1.2 Властивості дигідрату У термогравіметричному аналізі (фігура 1) приблизно 10 мг зразка нагрівали із швидкістю 10°/хв. у відкритій судині під струмом азоту. Термограма показує втрату ваги приблизно у 8,5 % починаючи з 0, кімнатна температура, і закінчуючи при 125-150 °C. Експерименти з вимірювання динаміки сорбції пари проводилися при 25 °C і при 40 °C. Форма кривих була однакова при цих двох температурах; крива, отримана при 40 °C, наведена на Фігурі 2. Дигідратна форма підтримувалася при відносній вологості 10-95 %. Адсорбція на поверхні при високій відносній вологості становила менше ніж 0,2 %. Десорбція кристалічної води відбувається поволі при відносній вологості нижче 10 %. Проте крива динаміки сорбції пари показує повне відновлення вологовмісту після висушування при відносній вологості 0 %, отже, при такій обробці просторова кристалічна решітка зберігається. Рентгенівська порошкова дифрактограма для налмефену гідрохлориду дигідрату, отримана із застосуванням Cu Кα1-випромінювання, показана на Фігурі 3. Дифрактограма одержана в режимі роботи у відбитому випромінюванні в інтервалі 5-40°2θ. Вона характеризується кутами відбиття при рентгенівській порошковій дифракції 8,99, 10,63, 15,24, 16,55 і 17,20°2θ (±0,1°2θ). Приклад 2 2.1а Одержання моногідрату 25 г налмефену гідрохлориду (хімічна чистота 99,24, зразок 84,1) суспендували в 32 мл води. Суміш нагрівали до 80 °C. Для дистиляції низькокиплячих органічних розчинників застосовували вакуум. Розчин охолоджували до 20 °C лінійним чином протягом однієї години. Суспензію перемішували протягом двох годин і потім піддавали подальшому охолоджуванню до 4 °C протягом однієї години і перемішували при цій температурі додатково ще одну годину. Тверду речовину відфільтрували і промили 25 мл ацетону. Вологу тверду речовину висушували протягом ночі під вакуумом при 30 °C з виходом 13,5 г налмефену гідрохлориду моногідрату (вміст води 4,74 % (маса/маса), як виміряно титруванням за методом Карла Фішера, вихід 61 %). 2.1b Одержання моногідрату У реактор з сорочкою були завантажені налмефену гідрохлорид (72,3 г) і вода (100 мл). Суспензію нагрівали до 85 °C для одержання розчину. Застосовували струм азоту. Розчин охолоджували до 60 °C протягом приблизно 50 хвилин і потім витримували при цій температурі ще 10 хвилин. Продукт починав випадати в осад при 60 °C. Потім суспензію охолоджували до 55 °C і витримували при 55 °C протягом 10 хвилин. Суспензію охолоджували до 8 °C протягом приблизно однієї години і витримували при цій температурі протягом 30 хвилин перед виділенням. Тверду речовину відфільтрували і промили 83 мл ацетону. Тверду речовину висушили з виходом 48,6 г налмефену гідрохлориду моногідрату. 2.2 Властивості моногідрату У термогравіметричному аналізі (фігура 4) приблизно 5 мг зразка нагрівали із швидкістю 10°/хв. у відкритій судині під струмом азоту. Термограма показала втрату маси приблизно 4 %, починаючи від кімнатної температури і закінчуючи при 100-110 °C. Експерименти з вимірювання динаміки сорбції пари проводилися при 25 °C і при 40 °C. Форма кривих була однакова, і наведена тільки крива, отримана при 40 °C (Фігура 5). Більша частина води при гідратації (4 %) була поглинена при 10 % відносній вологості. Наступне ступінчасте збільшення маси відбувалося до значення вологості 4,3 % при 50 % відносній вологості, але при 60 % відносній вологості воно раптово збільшилося до 6,9 % і потім знов ступінчасто підвищилося до 7,3 % при 95 % відносній вологості. Кількості узяті як % збільшення маси відносно сухої речовини, таким чином, приріст маси, відповідний моногідрату, був 4,8 %, а 1,5 гідрат відповідає приросту 7,2 %. Отже, крива показує, що вміст води в моногідраті не був постійним, а змінювався разом з відносною вологістю. 9 UA 102128 C2 5 10 15 20 Рентгенівська порошкова дифрактограма (Фігура 6) для налмефену гідрохлориду моногідрату, отримана із застосуванням Cu Кα1-випромінювання, показана на Фігурі 6. Дифрактограма одержана в режимі роботи у відбитому випромінюванні в інтервалі 5-40°2θ. Вона характеризується кутами відбиття при рентгенівській порошковій дифракції 7,39, 11,33, 11,52, 17,70 і 24,27°20 (±0,1°2θ). Приклад 3 Одержання налмефену гідрохлориду дигідрату Необроблений налмефену гідрохлорид (7,67 кг, зразок 93,9 %) і вода (8,6 л) були завантажені у відповідний реактор. Суспензію нагрівали до 80 °C, поки субстрат не розчинився повністю. Потім для видалення органічних розчинників застосовувався вакуум. Отриманий розчин профільтрували через 0,65 мкм фільтр і потім розбавили водою (2,1 літра), використаною для обполіскування реактора і трубок. Розчин охолодили до 50 °C і як матеріал затравки додавали 7 г налмефену гідрохлориду дигідрату. Суміш охолоджували до 0-5 °C протягом однієї години при ефективному перемішуванні, а потім перемішували ще одну додаткову годину. Тверду речовину відфільтрували і промили ацетоном. Вологий продукт висушували під вакуумом при 25 °C до одержання налмефену гідрохлориду дигідрату (5,4 кг; вихід 73 %) з хімічною чистотою 99,89 % (дані ВЕРХ). Розмір частинок отриманого налмефену гідрохлориду дигідрату був визначений лазерною дифракцією з використанням приладу Malvern Mastersizer S. Розподіл частинок за розміром наведений в таблиці нижче: D10 14 мкм 25 30 35 40 D50 122 мкм D90 287 мкм Приклад 4 Утилізація налмефену гідрохлориду Маточні розчини, отримані в Прикладі 3, концентрували під вакуумом. Для доведення рН до 8-9 був доданий гідроксид амонію. Суміш екстрагували дихлорметаном при температурі 3035 °C. Органічну фазу відділили і охолодили до 25 °C. Додавали концентровану соляну кислоту і продукту дозволили випасти в осад. Тверду речовину відфільтрували і промили дихлорметаном, з виходом 1,35 кг налмефену НСl з хімічною чистотою 98,9 %, який може бути перетворений в дигідрат із застосуванням процедури, описаної в Прикладі 3. Приклад 5 Перетворення налмефену НСl в налмефену НСl дигідрат шляхом ресуспендування 50 г налмефену НСl (суміш моногідрату, ацетонового сольвату і дигідрату) суспендували в 50 мл води при кімнатній температурі. Для видалення ацетону застосовували вакуум протягом однієї години. Далі, суспензію перемішували при кімнатній температурі протягом двох годин. Тверду речовину відфільтрували і висушили під вакуумом при 30 °C з одержанням 39,9 г чистого налмефену НСl дигідрату (вміст води 8,76 % (маса/маса), як виміряно титруванням за методом Карла Фішера). Приклад 6 Перетворення налмефену НСl в налмефену НСІ дигідрат шляхом ресуспендування 3,6 г налмефену НСІ моногідрату суспендували при кімнатній температурі в 5 мл води. Суспензію перемішували при кімнатній температурі. Перетворення в дигідрат завершувалося через 1,5 години. 10 UA 102128 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука, представлена формулою OH O N HO 5 10 15 20 25 30 35 40 45 50 HCl.2H2O. 2. Сполука за п. 1, де сполука знаходиться в кристалічній формі. 3. Сполука за п. 2, де сполука в кристалічній формі характеризується спектром рентгенівської порошкової дифракції із застосуванням Сu Kα1-випромінювання у величинах кута 2θ, який має пік при 8,99. 4. Сполука за п. 3, де сполука в кристалічній формі далі характеризується спектром рентгенівської порошкової дифракції із застосуванням Сu K α1-випромінювання у величинах кута 2θ, який має пік при одному або декількох з 10,63, 15,24, 16,55 і/або 17,20. 5. Сполука за будь-яким з попередніх пунктів, що є негігроскопічною і, таким чином, поглинає менше 1 %, переважно менше 0,5 %, переважно менше 0,3 % (маса/маса), вологи при відносній вологості 95 % при 25 °C. 6. Сполука за будь-яким з попередніх пунктів, де вміст води складає від приблизно 8 % до приблизно 9 % в інтервалі відносної вологості від приблизно 10 % до приблизно 95 %. 7. Спосіб одержання сполуки у відповідності з будь-яким з пп. 1-6, який включає етапи: (1) змішування налмефену гідрохлориду (17-(циклопропілметил)-4,5-α-епокси-6метиленморфінан-3,14-діолу гідрохлориду) і водного розчину, такого як вода, (2) необов'язково нагрівання суміші, (3) необов'язково дистиляції суміші, (4) перемішування суміші до завершення перетворення і (5) виділення утвореної твердої речовини. 8. Спосіб за п. 7, де суміш на етапі (4) перемішують протягом не менше 1 години. 9. Спосіб за будь-яким з пп. 7 і 8, де співвідношення водного розчину, такого як вода, використовуваного на етапі (1), знаходиться в інтервалі від приблизно 0,9 мл до приблизно 4 мл водного розчину/налмефену гідрохлориду (г), переважно від приблизно 1 мл до приблизно 2 мл водного розчину/налмефену гідрохлориду (г), більш переважно 1,5 мл водного розчину/налмефену гідрохлориду (г). 10. Спосіб за будь-яким з пп. 7-9, де налмефену гідрохлорид, використовуваний на етапі (1), знаходиться в гідратованій формі, такій як моногідратна форма. 11. Спосіб за будь-яким з пп. 7-9, де налмефену гідрохлорид, використовуваний на етапі (1), знаходиться в сольватованій формі або суміші гідратованої і сольватованої форм. 12. Спосіб за будь-яким з пп. 7-11, де на етапі (2) і/або (3) здійснюють перемішування. 13. Спосіб за будь-яким з пп. 7-12, де перемішування на етапі (4) проводять при температурі від приблизно 0 °C до приблизно 45 °C, переважно від 20 °C до приблизно 40 °C. 14. Спосіб за будь-яким з пп. 7-13, де утворену на етапі (5) тверду речовину виділяють при температурі від приблизно 0 °C до приблизно 20 °C, переважно від приблизно 0 °C до приблизно 5 °C. 15. Спосіб одержання сполуки у відповідності з будь-яким з пп. 1-6, який включає етапи: (a) змішування налмефену гідрохлориду (17-(циклопропілметил)-4,5-α-епокси-6метиленморфінан-3,14-діолу гідрохлориду) і водного розчину, такого як вода, (b) нагрівання суміші для одержання по суті гомогенного розчину, (c) необов'язково дистиляції суміші, отриманої на етапі (b), (d) охолоджування розчину, отриманого на етапі (b) або (с), з подальшим внесенням затравки налмефену гідрохлориду, і (e) виділення утвореної твердої речовини. 16. Спосіб за п. 15, де кількість водного розчину, такого як вода, використовуваного на етапі (а), знаходиться в інтервалі від 0,9 мл до приблизно 4 мл водного розчину/налмефену гідрохлориду 11 UA 102128 C2 5 10 15 20 25 30 35 40 45 50 55 (г), переважно від приблизно 1 мл до приблизно 2 мл водного розчину/налмефену гідрохлориду (г), або приблизно 1,5 мл водного розчину/налмефену гідрохлориду (г). 17. Спосіб за будь-яким з пп. 15, 16, де нагрівання на етапі (b) проводять до досягнення температури від приблизно 50 °C до приблизно 100 °C, переважно від приблизно 50 °C до приблизно 90 °C або від приблизно 70 °C до приблизно 85 °C. 18. Спосіб за будь-яким з пп. 15-17, де розчин на етапі (d) охолоджують до температури між 40 і 50 °C і при цій температурі проводять внесення затравки. 19. Спосіб за будь-яким з пп. 15-18, де кількість кристалічної затравки, що додається на етапі (d), складає від приблизно 1/2000 (маса/маса) кристалічної затравки налмефену гідрохлориду/налмефену гідрохлориду, доданого на етапі (а), переважно від приблизно 1/1000 (маса/маса) кристалічної затравки або 1/200 кристалічної затравки налмефену гідрохлориду/налмефену гідрохлориду, доданого на етапі (а). 20. Спосіб за будь-яким з пп. 15-19, де налмефен, використовуваний для внесення затравки, являє собою налмефену гідрохлориду дигідрат. 21. Спосіб за будь-яким з пп. 15-20, де кристалічну затравку, що додають на етапі (d), отримують за способом у відповідності з будь-яким з пп. 7-14. 22. Спосіб за будь-яким з пп. 15-21, де суміш, отриману на етапі (d), що містить кристал(и) затравки, далі піддають: (d') подальшому охолоджуванню суміші до температури приблизно 0-5 °C протягом періоду часу приблизно 45 хвилин або більше і (d") подальшому витримуванню суміші при температурі приблизно 0-5 °C протягом приблизно 45 хвилин або більше, перед виділенням утвореної твердої речовини згідно з етапом (e) п. 15. 23. Спосіб за будь-яким з пп. 15-22, де утворену тверду речовину виділяють при температурі приблизно 0-5 °C на етапі (e) п. 15. 24. Спосіб за будь-яким з пп. 15-23, де отримана сполука має наступний розподіл частинок за розміром: D90, рівний або менше 400 мкм, D50, рівний або менше 200 мкм, D10, рівний або менше 50 мкм, і співвідношення D90/D50, рівне або менше 2,5; як виміряно за умов, викладених в даному описі. 25. Спосіб за будь-яким з пп. 7-14 та 15-24 для одержання сполуки, визначеної за будь-яким з пп. 1-6, для використання у фармацевтичній композиції. 26. Спосіб за будь-яким з пп. 7-25, який далі включає етапи: (і) необов'язково дистиляції маточного розчину, отриманого згідно зі способом за п. 7 або 15, (іі) підлуговування маточного розчину, отриманого на етапі (і) або згідно зі способом за п. 7 або 15, (ііі) екстракції суміші відповідним органічним розчинником, (iv) додавання хлористого водню і (ν) виділення утвореної твердої речовини. 27. Спосіб за п. 26, де підлуговування на етапі (іі) здійснюють до одержання рН в інтервалі 8-10. 28. Спосіб за п. 27, де підлуговування на етапі (іі) здійснюють до одержання рН в інтервалі 8-9. 29. Спосіб за будь-яким з пп. 27, 28, де підлуговування на етапі (іі) здійснюють за допомогою гідроксиду амонію. 30. Спосіб за будь-яким з пп. 27-29, де розчинники, використовувані на етапі екстракції (ііі), вибрані з групи, що включає галогеновані вуглеводні, етери, естери, кетони, більш переважно дихлорметан, 2-метилтетрагідрофуран, етилацетат, 2-бутанон і, більш переважно, дихлорметан. 31. Спосіб за будь-яким з пп. 7-14, 15-25 та 26-30, де отримана сполука має хімічну чистоту не менше 98 %, переважно хімічну чистоту не менше 99 % або хімічну чистоту не менше 99,5 %. 32. Фармацевтична композиція, яка містить сполуку, визначену в будь-якому з пп. 1-6. 33. Фармацевтична композиція за п. 32, де налмефену гідрохлориду дигідрат складає не менше 5 % (маса/маса), переважно не менше 10 % (маса/маса), не менше 30 %, не менше 50 % (маса/маса), не менше 70 % (маса/маса), не менше 90 % (маса/маса), не менше 95 % (маса/маса), не менше 99 % (маса/маса) або 100 % від фармацевтичної лікарської форми. 34. Фармацевтична композиція за п. 32 або 33, яка далі містить один або декілька фармацевтично прийнятних носіїв. 35. Фармацевтична композиція за будь-яким з пп. 32-34 в твердій лікарській формі для перорального введення, такій як пігулка. 36. Фармацевтична композиція за будь-яким з пп. 32-35, яка містить сполуку за будь-яким з пп. 1-6 в терапевтично ефективній кількості. 12 UA 102128 C2 5 37. Фармацевтична композиція за будь-яким з пп. 32-36, яка містить сполуку за будь-яким з пп. 1-6 в кількості від приблизно 10 мг до приблизно 100 мг, переважно від приблизно 10 мг до приблизно 60 мг, від приблизно 10 мг до приблизно 40 мг або приблизно 20 мг. 38. Спосіб одержання фармацевтичної композиції за будь-яким з пп. 32-37, який включає спосіб за будь-яким з пп. 8-14 або 15-31. 39. Сполука за будь-яким з пп. 1-6, де сполука призначена для застосування в медицині, переважно для застосування в лікуванні алкогольної залежності. 40. Фармацевтична композиція за будь-яким з пп. 32-37, де композиція призначена для застосування в лікуванні алкогольної залежності. 13 UA 102128 C2 14 UA 102128 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюNalmefene hydrochloride dihydrate
Автори англійськоюLopez de Diego, Heidi, De Faveri, Carla, Huber, Florian, Anton, Martin
Назва патенту російськоюНалмефена гидрохлорида дигидрат
Автори російськоюЛопес де Диего Хейди, Де Фавери Карла, Хубер Флориан Антон Мартин
МПК / Мітки
МПК: A61K 31/485, C07D 489/00, A61P 25/30
Мітки: гідрохлориду, налмефену, дигідрат
Код посилання
<a href="https://ua.patents.su/17-102128-nalmefenu-gidrokhloridu-digidrat.html" target="_blank" rel="follow" title="База патентів України">Налмефену гідрохлориду дигідрат</a>
Попередній патент: Виріб, що містить магнітно орієнтовані чорнила на ґрунтувальному шарі, та спосіб його виробництва
Наступний патент: Вимірювальна система для дослідження дрібномасштабної турбулентності в приповерхневому шарі моря
Випадковий патент: Декоративний матеріал












