5-b-похідні 14-b-андростану для лікування протеїнурії, гломерулосклерозу і ниркової недостатності
Номер патенту: 103664
Опубліковано: 11.11.2013
Автори: Феррарі Патріція, Бьянкі Джузеппе, Ферранді Мара
Формула / Реферат
1. Застосування сполуки формули (І)
 , (І)
, (І)
де:
символ ![]() являє собою одинарний або подвійний зв'язок;
являє собою одинарний або подвійний зв'язок;
Y являє собою OR4 і може мати альфа- або бета-конфігурацію;
R являє собою незаміщений або заміщений 3-фурил;
R1 являє собою водень, метил, етил або н-пропіл, заміщений ОН або NR5R6;
R2 являє собою водень;
R3 являє собою водень;
R4 являє собою водень; метил; С2-С6алкіл або С2-С6ацил, ці алкільні і ацильні групи є незаміщеними або заміщеними групою четвертинного амонію або одним або більше OR7 і NR8R9;
R5 і R6 являє собою незалежно водень; метил; С2-С6алкіл, незаміщений, або R5 і R6 разом з атомом азоту утворюють незаміщене, насичене або ненасичене пента- або гекса-моногетороциклічне кільце;
R7 є воднем, метилом або С2-С6алкілом;
R8, R9 незалежно являють собою водень; метил; С2-С6алкіл, або R8 і R9 разом з атомом азоту утворюють незаміщене, насичене або ненасичене пента- або гекса-моногетороциклічне кільце,
як антипротеїнуричного засобу.
2. Застосування сполуки формули (І) за п. 1 як антигломерулосклеротичного засобу.
3. Застосування сполуки формули (І) за п. 1 як засобу проти ниркової недостатності.
4. Застосування сполуки формули (І) за п. 1, вибраної з групи, яка складається з:
17-β-(3-фурил)-5-β-андростан-3-β,14-β,17-α-тріолу;
3-β-(2-гідроксіетокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
3-β-(2-аміноетокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
3-β-(3-амінопропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
3-β-(2-метиламіноетокси)-17-β-(3-фурил)-5-β-андростан-14-β, 17-α-діолу;
3-β-(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
3-β-(3-(1-піролідиніл)пропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
3-β-(2-(1-імідазоліл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
3-β-(2-(2-імідазолін-2-іл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
3-β-(2-(2-(1-піролідиніл)етоксі)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
3-β-(3-аміно-2-гідроксипропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
3-β-(2,3-діамінопропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу;
17-β-(3-фурил)-17-α-метоксі-5-β-андростан-3-β,14-β-діолу;
17-β-(3-фурил)-17-α-(2-(1-піролідиніл)етокси)-5-β-андростан-3-β,14-β-діолу;
3-β-(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-17-α-метоксі-5-β-андростан-14-β-олу;
3-β,17-α-біс(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β-олу;
3-β,17-α-біс(3-амінопропокси)-17-β-(3-фурил)-5-β-андростан-14-β-олу;
і 3-α-похідних вказаних вище 3-β-похідних.
5. Застосування сполуки формули (І) за п. 1 для виготовлення лікарського засобу для запобігання і/або лікування протеїнурії, гломерулосклерозу і ниркової недостатності.
6. Застосування за п. 5, де переважною сполукою є 17-β-(3-фурил)-5-β-андростан-3-β,14-β,17-α-тріол.
7. Застосування за п. 5, де сполука вводиться в дозі від 0,05 мг до 20 мг на день.
8. Застосування за п. 7, де сполука вводиться в дозі від 0,5 мг до 15 мг.
9. Застосування за п. 8, де сполука вводиться в дозі від 5 мг до 10 мг.
10. Застосування за пп. 7-9, де сполука вводиться за схемою одиничної дози.
11. Застосування за пп. 7-9, де сполука вводиться за схемою множинної дози.
12. Застосування за п. 5, де лікарський засіб призначений для орального, внутрішньовенного, внутрішньом'язового, внутрішньоартеріального, інтрамедулярного, інтратекального, інтравентрикулярного, трансдермального, черезшкріного, підшкірного, внутрішньоочеревинного, інтраназального, ентерального, місцевого, сублінгвального або ректального введення.
Текст
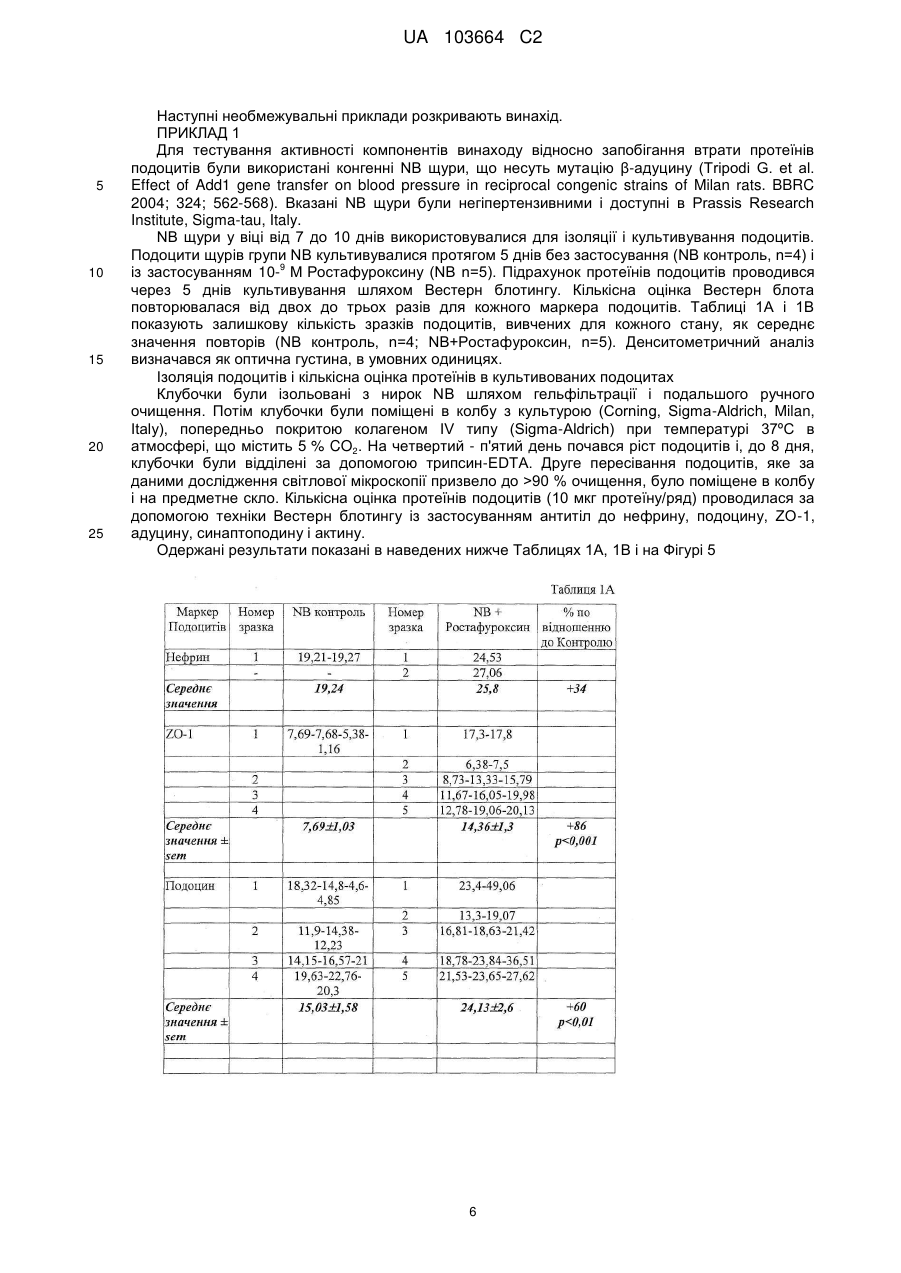
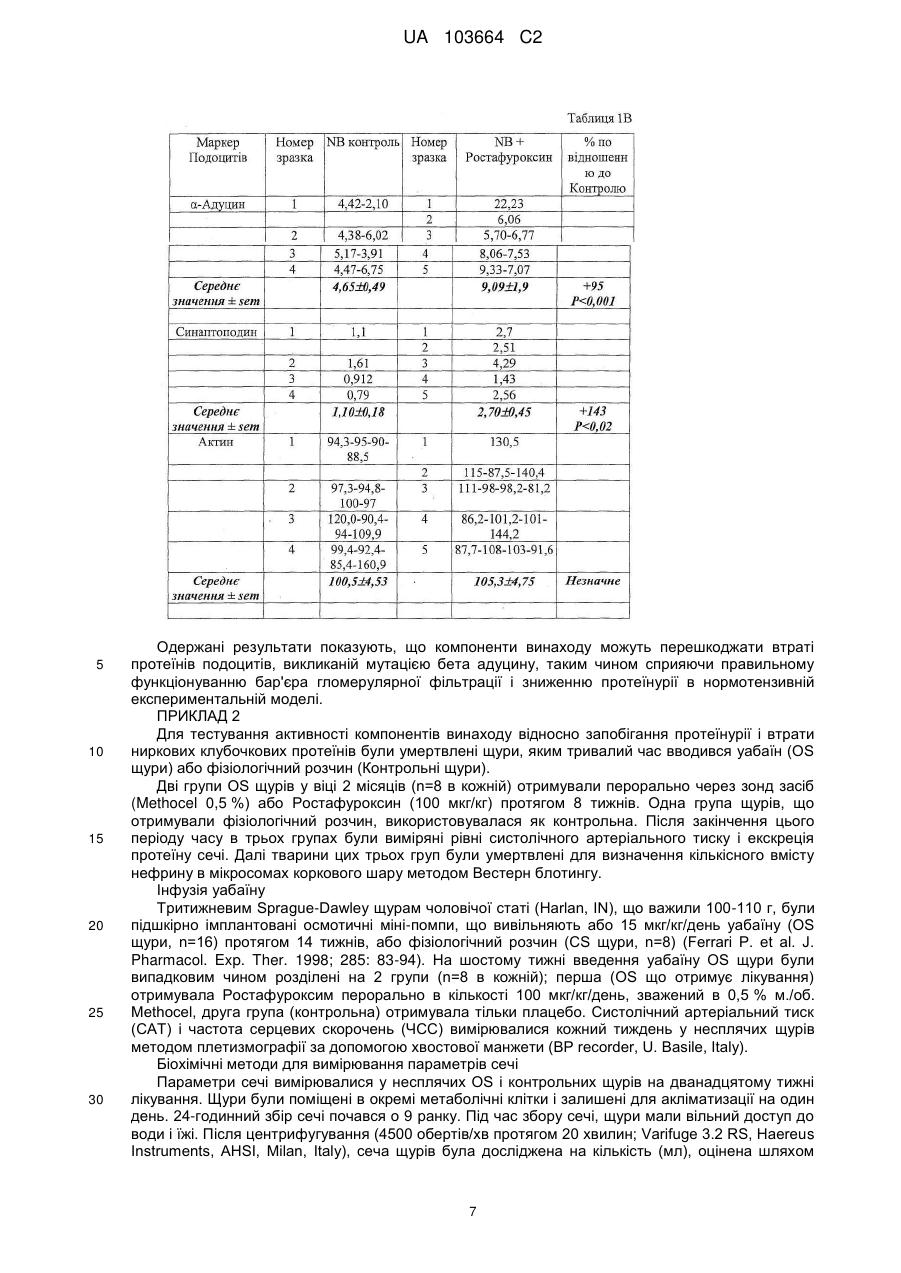
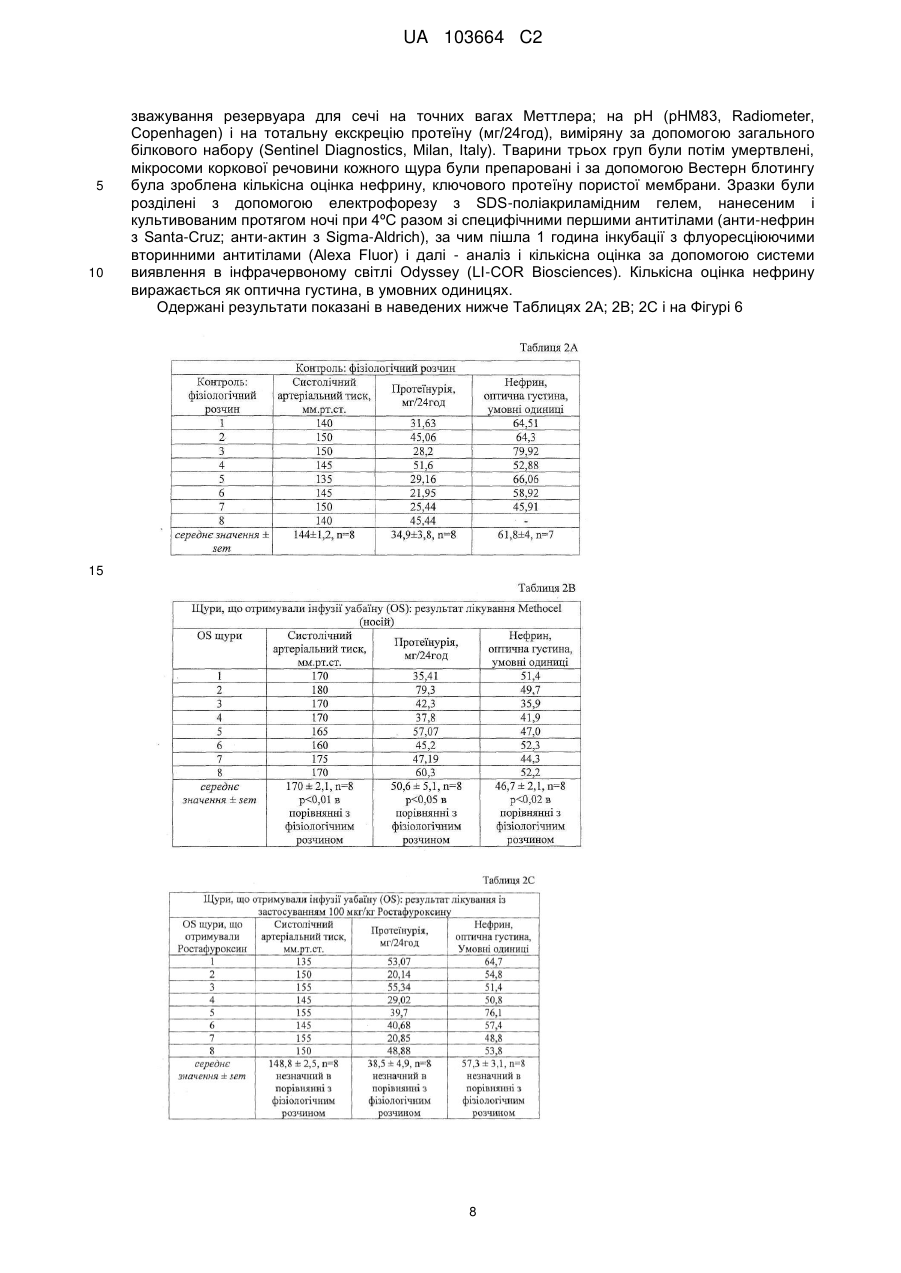
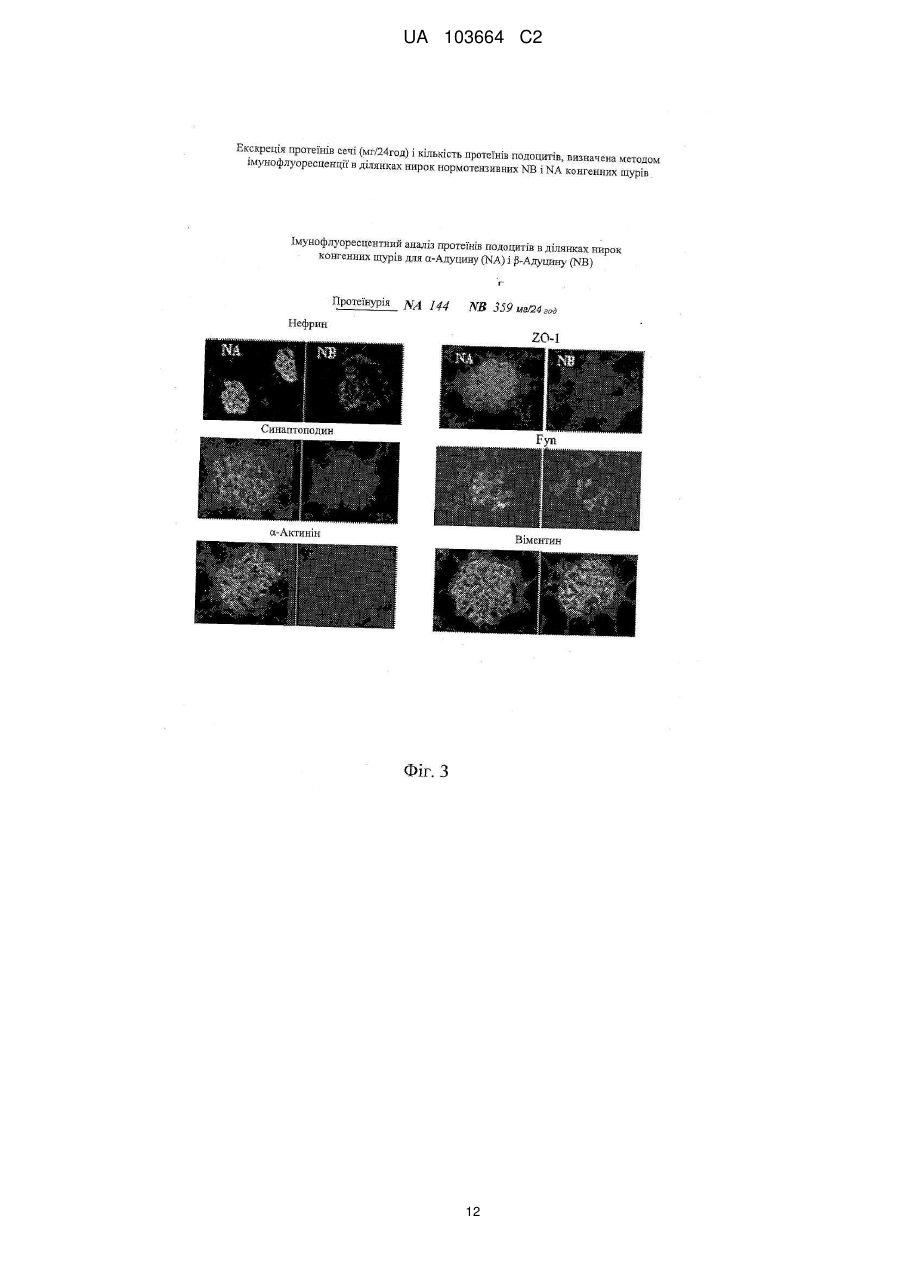
Реферат: Винахід стосується застосування сполуки формули (І) UA 103664 C2 (12) UA 103664 C2 R OR Y 2 OR R 1 3 H , (I) для якої значення символів розкрито в тексті; як антипротеїнуричного антигломерулосклеротичного засобу або як засобу проти ниркової недостатності. засобу, UA 103664 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід належить до 17-β-(3-фурил) і (4-піридазиніл)-5-β, похідних 14-β-андростану, які є корисними засобами для виготовлення лікарського засобу для запобігання і лікування протеїнурії, гломерулосклерозу і ниркової недостатності. РІВЕНЬ ТЕХНІКИ Термін протеїнурія є похідним від слів "протеїн" і "сеча", і означає наявність надлишку протеїнів сироватки в сечі. Протеїнурія може бути ознакою пошкодження нирок, оскільки протеїни сироватки повністю реабсорбуються з сечі, а наявність надмірного протеїну в ній вказує або на недостатність абсорбції, або на порушення фільтрації. Протеїнурія може бути ознакою наступних станів: нефротичні синдроми (наприклад, власна ниркова недостатність); токсичні пошкодження нирок; колагенози (наприклад, системний червоний вовчак); захворювання клубочків, такі, як мембранозний гломерулонефрит, фокальний сегментарний гломерулонефрит; інтенсивне фізичне навантаження; стрес, цукровий діабет; лікарські засоби (наприклад, НПЗС, нікотин, пеніциламін, золото і інші важкі метали, інгібітори АПФ, антибіотики, опіати, особливо героїн), інфекції (наприклад, ВІЛ, сифіліс, гепатит, постстрептококова інфекція); аміноацидурія; гіпертонічний нефросклероз; інтерстиційний нефрит і гломерулосклероз. Гломерулосклероз є спільним терміном для опису рубцювання крихітних кровоносних судин нирок, капілярних клубочків, які є функціональними одиницями нирок і здійснюють фільтрацію сечі з крові. Стан багатьох пацієнтів з гломерулосклерозом поступово погіршується доти, поки нирки повністю не перестають функціонувати. Цей стан називається термінальною стадією ниркової недостатності або ESRD. Пацієнтам з ESRD повинен проводитися діаліз (гемодіаліз або перитонеальний діаліз) для очищення крові або пересадки нової нирки за допомогою трансплантації. Клубочок нирки являє собою високоспеціалізовану структуру, яка контролює ультрафільтрацію протеїнів плазми. Специфічною клітинною одиницею, яка забезпечує даний контроль, є подоцит, дисфункція якого призводить до масивної втрати протеїнів сечі (протеїнурія). Добре відомо, що функція подоциту суворо контролюється специфічними протеїнами, що модулюють актиновий цитоскелет. Відомо, що мутації в генах, які кодують такі протеїни подоцитів, пов'язані зі зміною бар'єра гломерулярної мембрани і, отже, з масивною протеїнурією і пошкодженням нирок. Серед цих протеїнів подоцитів нефрин є фундаментальним компонентом щілинної пористої мембрани і регулює зв'язки цитоскелета шляхом активації шляху сигнальної трансдукції, регульованої тирозинкіназою Fyn, яка належить до сімейства Src кіназ (Trends Mol Med. 2007; 13: 396-403). Адуцин являє собою протеїн цитоскелета, що бере участь в процесі регуляції зв'язків між актином і спектрином у всіх клітинах. Був встановлений зв'язок поліморфізму генів адуцину з гіпертензією і прогресуванням ниркової недостатності. Дані експериментів показали, що α і β адуцин експресуються в клубочку, і їх поліморфізм спричиняє зміну експресії деяких протеїнів подоцитів, протеїнурію і прогресування пошкодження нирок у моделей тварин незалежно від їх артеріального тиску (J Hypertension 2003, 21 (Suppl. 4), abs 4C.4). Більш детально, у мишей, нокаутованих по мутантному β адуцину і таких, що мають нормальний артеріальний тиск, була зареєстрована підвищена експресія протеїнів подоцитів, таких як нефрин, синаптоподин, α-актинін, Fyn і ZO-1, а також зниження протеїнів сечі (Фіг. 1) в порівнянні з контрольною групою мишей, що визначає можливу роль β адуцину в зміні гломерулярної проникності незалежно від контролю артеріального тиску. У конгенних NB щурів з нормальним рівнем артеріального тиску, яким мутантний β адуцин ген від батьківської гіпертензивної MHS лінії (Q529R) вводився в нормотензивний MNS фон (BBRC 2004; 324: 562-568), експресія деяких протеїнів подоциту (нефрин, α-актинін, подоцин і ZO-1), виміряна в культурі подоцитів, виявилася зниженою (див. Фіг. 2) і пов'язаною з масивною протеїнурією і пошкодженням нирок, як показали дані імунофлюоресценції (див. Фіг. 3) у дорослих щурів в порівнянні з нормотензивною конгенною NA лінією, що несе варіант дикого типу β адуцину разом з мутованим α з лінії MHS. Внаслідок цього, ці одержані результати наводять на думки про патологічну роль мутантного β адуцину в функціонуванні нирок, що не залежить від артеріального тиску і регулюється α мутантним варіантом. Значущість експериментальних даних, одержаних на моделях тварин, для захворювань людини підтверджується останніми клінічними дослідженнями, які показали, що у пацієнтів з IgA нефропатією спостерігається більш швидке прогресування до термінальної стадії ниркової недостатності при носінні мутації β адуцину (CT+TT) у взаємодії з мутантним варіантом α адуцину (Trp) (див. Фіг. 4). 1 UA 103664 C2 5 10 15 20 25 30 35 40 45 50 Ендогенний Уабаїн (EO) широко відомий як новий гормон, здатний контролювати артеріальний тиск за допомогою різних механізмів, в основному через регуляцію обміну натрію в нирках. Був встановлений зв'язок між високими циркулюючими рівнями EO і високим артеріальним тиском. 17-(3-фурил) і (4-піридазиніл)-5-β, похідні 14-β-андростану, є відомими сполуками. EP0583578B1 описує похідні бета-андростану, заявлені в даній заявці, спосіб їх одержання і їх застосування для лікування серцево-судинних порушень, таких як серцева недостатність і гіпертензія. EP0590271B1 описує 17-арил і 17-гетероцикліл-5-альфа, похідні 14-β-андростану, андростену і андростадієну, спосіб їх одержання і їх застосування для лікування кардіоваскулярних розладів, таких як серцева недостатність і гіпертензія. EP0590272B1 описує 17-арил і 17-гетероцикліл-5-β, похідні 14-β-андростану і їх застосування для лікування кардіоваскулярних розладів, таких як серцева недостатність і гіпертензія. WO2008148812 описує 17-β-(3-фурил) і (4-піридазиніл)-5-бета, похідні 14-бета-андростану і їх застосування для лікування рестенозу після ангіопластики або ендоартеректомії, а також захворювань, зумовлених фіброзом органу. Жодна з відмічених вище публікацій не розкриває застосування 5бета, похідних 14бетаандростану для запобігання і/або лікування протеїнурії, гломерулосклерозу і ниркової недостатності. Було виявлено, що 17-β-(3-фурил) і (4-піридазиніл)-5-β, похідні 14-β-андростану, відповідно до даного винаходу є корисними засобами для запобігання і лікування протеїнурії, гломерулосклерозу і ниркової недостатності. ОПИС ВИНАХОДУ Виходячи з вищевикладеного, об'єктом даного винаходу є сполука формули (I), , де: символ --- являє собою одинарний або подвійний зв'язок; Y являє собою кисень або гуанідиноімін, коли --- в позиції 3 являє собою подвійний зв'язок; 4 4 Y являє собою гідрокси, OR або SR , коли --- в положенні 3 являє собою одинарний зв'язок і може мати альфа або бета конфігурацію; R являє собою незаміщену або заміщену 3-фурил або 4-піридазиніл групу; 1 5 6 R являє собою водень, метил, етил або н-пропіл, заміщений OH або NR R ; 2 3 R являє собою водень або разом з R є зв'язком оксиранового циклу; 3 2 R являє собою водень або разом з R є зв'язком оксиранового циклу; 4 R являє собою водень; метил; С2-С6 алкіл або С3-С6 алкеніл або С2-С6 ацил, ці алкільні, алкенільні і ацильні групи, незаміщені або заміщені групою четвертинного амонію або одним 7 8 9 8 9 або більше OR , NR R , формілом, амідино, гуанідиноіміно або NR R і гідрокси; 5 6 R і R являє собою незалежно водень; метил; С2-С6 алкіл, незаміщений або заміщений 10 11 10 11 5 6 одним NR R або NR R і гідрокси, або R і R разом з атомом азоту утворюють незаміщене або заміщене, насичене або ненасичене пента- або гекса-моногетороциклічне кільце, що додатково містить інший гетероатом, вибраний з кисню, сірки або азоту; 7 R є воднем, метилом або С2-С4 алкілом, цей алкіл є незаміщеним або заміщеним одним 10 11 10 11 або більше NR R або NR R і гідрокси; 8 9 R , R являє собою незалежно водень; метил; С2-С6 алкіл або С3-С6 алкеніл, ці алкільні і 10 11 10 11 алкенільні групи, незаміщені або заміщені одним або більше NR R або NR R і гідрокси, або 8 9 R і R разом з атомом азоту утворюють незаміщене або заміщене, насичене або ненасичене пента- або гекса-моногетороциклічне кільце, що додатково містить інший гетероатом, вибраний 8 9 8 9 з кисню, сірки або азоту, або R являє собою водень і R являє собою амідин; або NR R представляє пропаргіламін; 2 UA 103664 C2 10 5 10 15 20 25 30 35 40 45 50 55 60 11 10 11 R і R являє собою незалежно водень; С1-С6 алкіл або R і R , взяті разом з атомом азоту, утворюють насичене або ненасичене пента- або гекса-моногетороциклічне кільце; Також в даний винахід включені фармацевтично прийнятні солі (I), які зберігають біологічну активність субстрату і є похідними таких відомих фармацевтично прийнятних кислот, як соляна, сірчана, ортофосфорна, оксибурштинова, винна, малеїнова, лимонна, метансульфонова або бензойна; Алкільна або алкенільна групи можуть бути розгалуженими або групами з прямим ланцюгом; С1-С6 алкільна група, переважно, є С1-С4 алкільною групою, наприклад, метильною, етильною, н-пропільной, ізопропільною, н-бутильною, втор-бутильною; С2-С6 алкільна група, переважно, є С2-С4 алкільною групою, наприклад, етильною, нпропільною, ізопропільною, н-бутильною, втор-бутильною; С3-С6 алкенільна група, переважно, являє собою С3-С4 алкенільну групу, наприклад, 2пропеніл, 2-бутеніл; С2-С6 ацил, переважно, являє собою С2-С4 ацильну групу, наприклад, ацетил, пропіоніл, бутирил; Група четвертинного амонію, переважно, являє собою групу триметиламоній- або Nметилпіролідиній- або N-метилпіперидиній; 7 Група OR переважно являє собою гідрокси, 1-аміноетокси, 3-амінопропокси, 2диметиламіноетокси, 2-діетиламіноетокси, 3-диметиламінопропокси, 3-аміно-2гідроксипропокси, 2,3-діамінопропокси, 2-(1-піролідиніл)етокси, 3-(1-піролідиніл)пропокси; 5 6 Група NR R переважно являє собою аміно-, метиламіно-, етиламіно-, н-пропіламіно-, диметиламіно, діетиламіно, піролідиніл, морфоліно, піперазиніл, 1-імідазоліл, 2-аміноетиламіно, 3-амінопропіламіно. 8 9 Група NR R переважно є аміно-, метиламіно-, етиламіно-, н-пропіламіно-, ізо-пропіламіно-, аліламіно-, пропаргіламіно-, диметиламіно-, діетиламіно-, піролідиніл-, морфоліно-, піперазиніл, 1-імідазоліл-, 1-гуанідино-, 2-аміноетиламіно-, 3-амінопропіламіно-, 2-(1-піролідиніл)етиламіно-, 3-(1-піролідиніл)пропіламіно-, 3-аміно-2-гідроксипропіламіно-, 3-(1-піролідиніл)2гідроксипропіламіно-, 2,3-діамінопропіламіно-, (2-(1-піролідиніл)етил)метиламіно-групами; Переважними прикладами специфічних сполук відповідно до даного винаходу є: 17-β-(3-фурил)-5-β-андростан-3-β,14-β,17-α-триол; 3-β-(2-гідроксіетокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2-аміноетокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(3-амінопропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2-метиламіноетокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2-(3-(1-піролідиніл)пропоксі)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(3-(1-піролідиніл)пропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2-(1-імідазоліл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2-(2-імідазолін-2-іл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2-(2-амідино)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2-(2-(1-піролідиніл)етоксі)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2-гуанідиноетокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(3-гуанідинопропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(3-аміно-2-гідроксипропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 3-β-(2,3-діамінопропокси)-17-β-(3-фурил)5-β-андростан-14-β,17-α-діол; 17-β-(3-фурил)-17-α-метоксі-5-β-андростан-3-β,14-β-діол; 17-β-(3-фурил)-17-α-(2-(1-піролідиніл)етоксі)-5-β-андростан-3-β,14-β-діол; 17-β-(3-фурил)-17-α-(3-амінопропоксі)-5-β-андростан-3-β,14-β-діол; 3-β-(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-17-α-метоксі-5-β-андростан-14-β-ол; 3-β,17-α-біс(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β-ол; 3-β,17-α-біс(3-амінопропокси)-17-β-(3-фурил)-5-β-андростан-14-β-ол; 14-β,17-α-дигідрокси-17-β-(3-фурил)-5-β-андростан-3-он; 3-гуанідиноіміно-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діол; 17-β-(4-піридазиніл)-5-β-андростан-3-β,14-β,17-α-триол; 3-β-(2-гідроксіетокси)-17-β-(4-піридазиніл)5-β-андростан-14-β,17-α-діол; 3-β-(3-амінопропокси)-17-β-(4-піридазиніл)-5-β-андростан-14-β,17-α-діол; 3-β-(2-(1-піролідиніл)етокси)-17-β-(4-піридазиніл)-5-β-андростан-14-β,17-α-діол; 3-β-(3-(1-піролідиніл)пропокси)-17-β-(4-піридазиніл)-5-β-андростан-14-β,17-α-діол; 17-β-(4-піридазиніл)-17-α-(3-амінопропоксі)-5-β-андростан-3-β,14-β-діол; 3 UA 103664 C2 5 10 15 20 25 30 35 40 45 50 55 3-β-(2-(1-піролідиніл)етокси)-17-β-(4-піридазиніл)-17-α-метоксі-5-β-андростан-14-β-ол; 3-β-(2-(1-піролідиніл)етокси)-17-β-(4-піридазиніл)-17-α-(3-аміно-пропоксі)-5-β-андростан-14β-ол; 14-β,17-α-дигідрокси-17-β-(4-піридазиніл)-5-β-андростан-3-он; 3-гуанідиноіміно-17-β-(4-піридазиніл)-5-β-андростан-14-β,17-α-діол; 14-β,15-β-епокси-17-β-(3-фурил)-5-β-андростан-3-β,17-α-діол; 3-β-(2-гідроксіетоксі)-14-β,15-β-епокси-17-β-(3-фурил)-5-β-андростан-17-α-ол; 3-β-(3-амінопропоксі)-14-β,15-β-епокси-17-β-(3-фурил)-5-β-андростан-17-α-ол; 3-β-(2-(1-піролідиніл)етоксі)-14-β,15-β-епокси-17-β-(3-фурил)-5-β-андростан-17-α-ол; 3-β-(3-(1-піролідиніл)пропоксі)-14-β,15-β-епокси-17-β-(3-фурил)-5-β-андростан-17-α-ол; 3-β-(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-17-α-метоксі-14-β,15-β-епоксі-5-β-андростан; 17-α-гідрокси-17-β-(3-фурил)-14-β,15-β-епоксі-5-β-андростан-3-он; 3-гуанідиноіміно-17-β-(3-фурил)-14-β,15-β-епоксі-5-β-андростан-17-α-ол; 14-β,15-β-епокси-17-β-(4-піридазиніл)-5-β-андростан-3-β,17-α-діол; і 3 альфа похідні вказаних вище 3-β похідних, а також відповідні 3 альфа і 3-β тіопохідні, де Y=S; для застосування як антипротеїнуричного засобу. Найбільш переважним прикладом специфічної сполуки відповідно до даного винаходу є 17β-(3-фурил)-5-β-андростан-3-β,14-β,17-α-триол, що далі іменується як "ростафуроксин" або "PST 2238". Додатковим об'єктом даного винаходу є застосування даної сполуки формули (I) як антигломерулосклеротичної речовини. Додатковим об'єктом є застосування даної сполуки формули (I) як засобу проти ниркової недостатності. Додатковим об'єктом даного винаходу є застосування компонента формули (I) для виготовлення лікарського засобу для запобігання або лікуванню протеїнурії, гломерулосклерозу і ниркової недостатності. Додатковим об'єктом даного винаходу є спосіб лікування ссавців, страждаючих на протеїнурію, гломерулосклероз або ниркову недостатність, що включає введення терапевтично ефективної кількості компонента формули (I). Термін "терапевтично ефективна кількість" застосовується в даному документі як такий, що належить до кількості терапевтичного засобу, необхідної для лікування, поліпшення конкретного захворювання або стану або для демонстрації терапевтичного ефекту, що виявляється. Для будь-якої сполуки терапевтично ефективна доза може бути встановлена спочатку як в зразках клітинної культури, так і на модельних тваринах, зазвичай мишах, кроликах, собаках або свинях. Тваринна модель також може використовуватися для визначення відповідного діапазону концентрацій і шляху введення. Така інформація може використовуватися для визначення придатних доз і шляхів введення для людей. Точна ефективна кількість для людини буде залежати від тяжкості плину захворювання, загального стану здоров'я суб'єкта, віку, ваги і статі, дієти, часу і частоти введення, комбінації(й) лікарських засобів, чутливості реакції і стійкості/сприйнятливості до терапії. Ця кількість може бути визначена шляхом проведення звичайних експериментів і знаходиться в межах компетенції клініциста. Загалом ефективна щоденна доза буде від 0,05 мг до 20 мг, переважно, діапазон від 0,5 мг до 15 мг, найбільш переважно, від 5 мг до 10 мг. Лікувальне дозування може бути представлене схемою введення одиничної дози або схемою введення множинної дози, відповідно до рішення клініциста. Композиції можуть вводитися пацієнту окремо або в поєднанні з іншими засобами, лікарськими засобами або гормонами. Лікарський засіб також може містити фармацевтично прийнятний носій для введення терапевтичного засобу. Такі носії включають в себе антитіла і інші поліпептиди, гени і інші терапевтичні засоби, такі як ліпосоми, при цьому носій не може індукувати вироблення антитіл, шкідливих для організму, що приймає композицію, і може вводитися без викликання надмірної токсичності. Придатні носії можуть бути великими повільно метаболізованими макромолекулами, такими як протеїни, полісахариди, полімолочні кислоти, полігліколеві кислоти, полімерні амінокислоти, поліпептиди і неактивні вірусні частинки. Докладне обговорення фармацевтично прийнятних носіїв доступне в Remington's Pharmaceutical Sciences (Mack Pub. Co., N. J. 1991). 4 UA 103664 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтично прийнятні носії в терапевтичних композиціях можуть додатково містити рідини, такі як вода, фізіологічний розчин, гліцерин і етанол. Додатково в таких композиціях можуть бути присутніми допоміжний матеріал, наприклад, змочувальні і емульгувальні речовини, речовини, що буферують pH, і їм подібні. Такі носії дозволяють виготовляти фармацевтичні композиції у вигляді таблеток, пілюль, драже, желатинових капсул, рідин, гелів, сиропів, в'язких суспензій, суспензій і т.п. для прийому всередину пацієнтом. Після виготовлення композиція винаходу може вводитися напряму суб'єкту. Такими суб'єктами, що одержують лікування, можуть бути тварини; зокрема лікування можуть одержувати люди. Лікарський засіб даного винаходу може вводитися будь-яким способом, включаючи крім іншого, оральний, внутрішньовенний, внутрішньом'язовий, внутрішньоартеріальний, інтрамедулярний, інтратекальний, інтравентрикулярний, трансдермальний шлях або черезшкірні аплікації, підшкірний, внутрішньочеревинний, інтраназальний, ентеральний, місцевий, сублінгвальний, ректальний шляхи або місцеве застосування на уражені тканини після хірургічної операції. Композиція винаходу може також вводитися (як покриття) на стент навіть будучи включеною в контролюючий вивільнення матрикс. Опис фігур Фігура 1 представляє рівень екскреції протеїну сечі (мг/6год) у мишей, нокаутованих (KO) за бета адуцином в порівнянні з групою контролю дикого типу (WT). Вік мишей чоловічої статі становив 11 місяців, а рівень екскреції протеїну вимірювався в сечі, зібраній за 6 годин від кожної миші, що міститься в метаболічній клітці. Дані виражені як середнє ± стандартна помилка середньої (sem) для 15 WT і 19 KO мишей. Статистичний аналіз проводився за допомогою t тесту Ст'юдента. Фігура демонструє суттєве (приблизно 30 %) зниження екскреції протеїну за 6годинний період у KO мишей за бета адуцином в порівнянні з WT контролем. Фігура 2 представляє кількість протеїнів подоцитів (нефрин, α-актинін, ZO-1, подоцин, αадуцин і актин), експресованих в культурі подоцитів, одержаних від неонатальних (віком менше 10 днів) щурів з конгенних NB і NA ліній. Кількість протеїнів подоциту була виміряна у витримці подоцитів за допомогою Вестерн-блотингу з прийнятними антитілами (дивіться зразки слідів над стовпчиками). Дані - середні ± sem з декількох експериментів в інтервалі від 4 до 24 для кожної лінії. Статистичний аналіз проводився за допомогою t тесту Ст'юдента. На фігурі показано, що кількість Нефрину, α-Актиніну, ZO-1, Подоцину і α-Адуцину значно знижені в подоцитах групи NB нормотензивних щурів, що мають мутантний β-адуцин, в порівнянні з контролем NA, що несе варіант дикого типу, в той час як рівень протеїну актину домашнього хазяйства приблизно однаковий. Фігура 3 представляє експресію деяких протеїнів подоциту (Нефрин, α-Актинін, ZO-1, Fyn і Віментин), як таких, що визначаються за допомогою методу імунофлюоресценції в гломерулах нирок в групі NB нормотензивних щурів з мутантним β-адуцином, в порівнянні з контролем NA, що несе варіант дикого типу. Фігура показує суттєве зниження експресії цих протеїнів в групі NB щурів в порівнянні з NA групою, в той час як Віментин, мікрофіламент, локалізований в тілі клітини подоциту, має нормальний рівень експресії в обох лініях. Фігура 4 показує прогресування ниркової недостатності, що оцінюється як зниження рівня -1 -1 гломерулярної фільтрації (GFR) з плином часу (мл.хв .рік ) у пацієнтів з IgA нефропатією, в 4 групах відповідно до генотипів α-адуцину (ADD1, Gly460Tyr) і β-адуцину (ADD2, C399T). Роль взаємодії між двома генами в різкому зниженні була визначена як значна. Фігура 5 представляє кількість протеїнів подоцитів (нефрин, ZO-1, подоцин, α-адуцин, синаптоподин і актин), експресовану в культурі подоцитів, одержаних від неонатальних (вік менше 10 днів) щурів від конгенних NB ліній, інкубованих протягом 5 днів в присутності або без 9 Ростафуроксину 10- М. Підрахунок протеїнів подоциту проводився з витримування подоцитів методом Вестерн-блотингу з відповідними антитілами. Дані відомі як середні±sem з декількох експериментів. Статистичний аналіз проводився за допомогою t тесту Ст'юдента. Фігури показують підвищення в культурі подоцитів кількості Нефрину, ZO-1, Подоцину, α-Адуцину і 9 Синаптоподину за винятком Актину в присутності 10- Ростафуроксину. Фігура 6 представляє рівні систолічного артеріального тиску (САТ), екскреції протеїну сечі і кількість Нефрину з коркового шару нирок щурів, яким тривало вводився уабаїн (OS) і які лікувалися за допомогою носія в порівнянні з групою щурів, яким вводився фізіологічний розчин або з OS щурами, що отримували протягом 8 тижнів Ростафуроксин в дозуванні 100мкг/кг/день. Дані відомі як середні±sem для 8 щурів з кожної групи. Статистичний аналіз проводився за допомогою t тесту Ст'юдента. Фігура показує, що Ростафуроксин суттєво знижує САТ і екскрецію протеїну сечі, в той час як він збільшує експресії Нефрину у OS групи щурів, і таким чином спостерігаються антагоністичні ниркові ефекти уабаїну. 5 UA 103664 C2 5 10 15 20 25 Наступні необмежувальні приклади розкривають винахід. ПРИКЛАД 1 Для тестування активності компонентів винаходу відносно запобігання втрати протеїнів подоцитів були використані конгенні NB щури, що несуть мутацію β-адуцину (Tripodi G. et al. Effect of Add1 gene transfer on blood pressure in reciprocal congenic strains of Milan rats. BBRC 2004; 324; 562-568). Вказані NB щури були негіпертензивними і доступні в Prassis Research Institute, Sigma-tau, Italy. NB щури у віці від 7 до 10 днів використовувалися для ізоляції і культивування подоцитів. Подоцити щурів групи NB культивувалися протягом 5 днів без застосування (NB контроль, n=4) і 9 із застосуванням 10- М Ростафуроксину (NB n=5). Підрахунок протеїнів подоцитів проводився через 5 днів культивування шляхом Вестерн блотингу. Кількісна оцінка Вестерн блота повторювалася від двох до трьох разів для кожного маркера подоцитів. Таблиці 1А і 1В показують залишкову кількість зразків подоцитів, вивчених для кожного стану, як середнє значення повторів (NB контроль, n=4; NB+Ростафуроксин, n=5). Денситометричний аналіз визначався як оптична густина, в умовних одиницях. Ізоляція подоцитів і кількісна оцінка протеїнів в культивованих подоцитах Клубочки були ізольовані з нирок NB шляхом гельфільтрації і подальшого ручного очищення. Потім клубочки були поміщені в колбу з культурою (Corning, Sigma-Aldrich, Milan, Italy), попередньо покритою колагеном IV типу (Sigma-Aldrich) при температурі 37ºC в атмосфері, що містить 5 % CO2. На четвертий - п'ятий день почався ріст подоцитів і, до 8 дня, клубочки були відділені за допомогою трипсин-EDTA. Друге пересівання подоцитів, яке за даними дослідження світлової мікроскопії призвело до >90 % очищення, було поміщене в колбу і на предметне скло. Кількісна оцінка протеїнів подоцитів (10 мкг протеїну/ряд) проводилася за допомогою техніки Вестерн блотингу із застосуванням антитіл до нефрину, подоцину, ZO-1, адуцину, синаптоподину і актину. Одержані результати показані в наведених нижче Таблицях 1А, 1В і на Фігурі 5 6 UA 103664 C2 5 10 15 20 25 30 Одержані результати показують, що компоненти винаходу можуть перешкоджати втраті протеїнів подоцитів, викликаній мутацією бета адуцину, таким чином сприяючи правильному функціонуванню бар'єра гломерулярної фільтрації і зниженню протеїнурії в нормотензивній експериментальній моделі. ПРИКЛАД 2 Для тестування активності компонентів винаходу відносно запобігання протеїнурії і втрати ниркових клубочкових протеїнів були умертвлені щури, яким тривалий час вводився уабаїн (OS щури) або фізіологічний розчин (Контрольні щури). Дві групи OS щурів у віці 2 місяців (n=8 в кожній) отримували перорально через зонд засіб (Methocel 0,5 %) або Ростафуроксин (100 мкг/кг) протягом 8 тижнів. Одна група щурів, що отримували фізіологічний розчин, використовувалася як контрольна. Після закінчення цього періоду часу в трьох групах були виміряні рівні систолічного артеріального тиску і екскреція протеїну сечі. Далі тварини цих трьох груп були умертвлені для визначення кількісного вмісту нефрину в мікросомах коркового шару методом Вестерн блотингу. Інфузія уабаїну Тритижневим Sprague-Dawley щурам чоловічої статі (Harlan, IN), що важили 100-110 г, були підшкірно імплантовані осмотичні міні-помпи, що вивільняють або 15 мкг/кг/день уабаїну (OS щури, n=16) протягом 14 тижнів, або фізіологічний розчин (CS щури, n=8) (Ferrari P. еt al. J. Pharmacol. Exp. Ther. 1998; 285: 83-94). На шостому тижні введення уабаїну OS щури були випадковим чином розділені на 2 групи (n=8 в кожній); перша (OS що отримує лікування) отримувала Ростафуроксим перорально в кількості 100 мкг/кг/день, зважений в 0,5 % м./об. Methocel, друга група (контрольна) отримувала тільки плацебо. Систолічний артеріальний тиск (САТ) і частота серцевих скорочень (ЧСС) вимірювалися кожний тиждень у несплячих щурів методом плетизмографії за допомогою хвостової манжети (BP recorder, U. Basile, Italy). Біохімічні методи для вимірювання параметрів сечі Параметри сечі вимірювалися у несплячих OS і контрольних щурів на дванадцятому тижні лікування. Щури були поміщені в окремі метаболічні клітки і залишені для акліматизації на один день. 24-годинний збір сечі почався о 9 ранку. Під час збору сечі, щури мали вільний доступ до води і їжі. Після центрифугування (4500 обертів/хв протягом 20 хвилин; Varifuge 3.2 RS, Haereus Instruments, AHSI, Milan, Italy), сеча щурів була досліджена на кількість (мл), оцінена шляхом 7 UA 103664 C2 5 10 зважування резервуара для сечі на точних вагах Меттлера; на pH (pHM83, Radiometer, Copenhagen) і на тотальну екскрецію протеїну (мг/24год), виміряну за допомогою загального білкового набору (Sentinel Diagnostics, Milan, Italy). Тварини трьох груп були потім умертвлені, мікросоми коркової речовини кожного щура були препаровані і за допомогою Вестерн блотингу була зроблена кількісна оцінка нефрину, ключового протеїну пористої мембрани. Зразки були розділені з допомогою електрофорезу з SDS-поліакриламідним гелем, нанесеним і культивованим протягом ночі при 4ºС разом зі специфічними першими антитілами (анти-нефрин з Santa-Cruz; анти-актин з Sigma-Aldrich), за чим пішла 1 година інкубації з флуоресціюючими вторинними антитілами (Alexa Fluor) і далі - аналіз і кількісна оцінка за допомогою системи виявлення в інфрачервоному світлі Odyssey (LI-COR Biosciences). Кількісна оцінка нефрину виражається як оптична густина, в умовних одиницях. Одержані результати показані в наведених нижче Таблицях 2А; 2В; 2С і на Фігурі 6 15 8 UA 103664 C2 Одержані результати показують, що компоненти винаходу можуть протистояти патологічній дії уабаїну на артеріальний тиск, екскрецію протеїнів сечі і гломерулярну втрату протеїнів і таким чином знижують артеріальний тиск, відновлюють експресію нефринів клубочків і знижують протеїнурію. 5 ФОРМУЛА ВИНАХОДУ 1. Застосування сполуки формули (І) R OR Y 10 15 20 25 30 35 40 45 50 H 2 OR R 1 3 , (І) де: символ являє собою одинарний або подвійний зв'язок; 4 Y являє собою OR і може мати альфа- або бета-конфігурацію; R являє собою незаміщений або заміщений 3-фурил; 1 5 6 R являє собою водень, метил, етил або н-пропіл, заміщений ОН або NR R ; 2 R являє собою водень; 3 R являє собою водень; 4 R являє собою водень; метил; С2-С6алкіл або С2-С6ацил, ці алкільні і ацильні групи є 7 незаміщеними або заміщеними групою четвертинного амонію або одним або більше OR і 8 9 NR R ; 5 6 5 6 R і R являє собою незалежно водень; метил; С2-С6алкіл, незаміщений, або R і R разом з атомом азоту утворюють незаміщене, насичене або ненасичене пента- або гексамоногетороциклічне кільце; 7 R є воднем, метилом або С2-С6алкілом; 8 9 8 9 R , R незалежно являють собою водень; метил; С2-С6алкіл, або R і R разом з атомом азоту утворюють незаміщене, насичене або ненасичене пента- або гекса-моногетороциклічне кільце, як антипротеїнуричного засобу. 2. Застосування сполуки формули (І) за п. 1 як антигломерулосклеротичного засобу. 3. Застосування сполуки формули (І) за п. 1 як засобу проти ниркової недостатності. 4. Застосування сполуки формули (І) за п. 1, вибраної з групи, яка складається з: 17-β-(3-фурил)-5-β-андростан-3-β,14-β,17-α-тріолу; 3-β-(2-гідроксіетокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(2-аміноетокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(3-амінопропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(2-метиламіноетокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(3-(1-піролідиніл)пропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(2-(1-імідазоліл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(2-(2-імідазолін-2-іл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(2-(2-(1-піролідиніл)етоксі)етокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(3-аміно-2-гідроксипропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 3-β-(2,3-діамінопропокси)-17-β-(3-фурил)-5-β-андростан-14-β,17-α-діолу; 17-β-(3-фурил)-17-α-метоксі-5-β-андростан-3-β,14-β-діолу; 17-β-(3-фурил)-17-α-(2-(1-піролідиніл)етоксі)-5-β-андростан-3-β,14-β-діолу; 3-β-(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-17-α-метоксі-5-β-андростан-14-β-олу; 3-β,17-α-біс(2-(1-піролідиніл)етокси)-17-β-(3-фурил)-5-β-андростан-14-β-олу; 3-β,17-α-біс(3-амінопропокси)-17-β-(3-фурил)-5-β-андростан-14-β-олу; і 3-α-похідних вказаних вище 3-β-похідних. 5. Застосування сполуки формули (І) за п. 1 для виготовлення лікарського засобу для запобігання і/або лікування протеїнурії, гломерулосклерозу і ниркової недостатності. 6. Застосування за п. 5, де переважною сполукою є 17-β-(3-фурил)-5-β-андростан-3-β,14-β,17-αтріол. 9 UA 103664 C2 5 7. Застосування за п. 5, де сполука вводиться в дозі від 0,05 мг до 20 мг на день. 8. Застосування за п. 7, де сполука вводиться в дозі від 0,5 мг до 15 мг. 9. Застосування за п. 8, де сполука вводиться в дозі від 5 мг до 10 мг. 10. Застосування за пп. 7-9, де сполука вводиться за схемою одиничної дози. 11. Застосування за пп. 7-9, де сполука вводиться за схемою множинної дози. 12. Застосування за п. 5, де лікарський засіб призначений для орального, внутрішньовенного, внутрішньом'язового, внутрішньоартеріального, інтрамедулярного, інтратекального, інтравентрикулярного, трансдермального, черезшкріного, підшкірного, внутрішньоочеревинного, інтраназального, ентерального, місцевого, сублінгвального або ректального введення. 10 10 UA 103664 C2 11 UA 103664 C2 12 UA 103664 C2 13 UA 103664 C2 14 UA 103664 C2 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійською5-b,14-b-androstane derivatives useful for the treatment of proteinuria, glomerulosclerosis and renal failure
Автори англійськоюFerrari, Patrizia, Bianchi, Giuseppe, Ferrandi, Mara
Автори російськоюФеррари Патриция, Бьянки Джузеппе, Ферранди Мара
МПК / Мітки
МПК: A61P 13/12, A61K 31/58
Мітки: недостатності, лікування, гломерулосклерозу, протеїнурії, 14-b-андростану, ниркової, 5-b-похідні
Код посилання
<a href="https://ua.patents.su/17-103664-5-b-pokhidni-14-b-androstanu-dlya-likuvannya-protenuri-glomerulosklerozu-i-nirkovo-nedostatnosti.html" target="_blank" rel="follow" title="База патентів України">5-b-похідні 14-b-андростану для лікування протеїнурії, гломерулосклерозу і ниркової недостатності</a>
Попередній патент: Спосіб та пристрій для виготовлення частково кристалізованого полімерного матеріалу
Наступний патент: Лікування фарингіту, у тому числі фарингомікозу та атрофічного фарингіту методом лазеротерапії
Випадковий патент: Спосіб пренатальної діагностики хромосомної патології ультразвуковими маркерами