Спосіб одержання 4-аміно-3-хлор-5-фтор-6-(заміщених)піколінатів
Номер патенту: 105610
Опубліковано: 26.05.2014
Автори: Ренга Джеймс М., Арндт Кім Е., Фроуес Роберт Д., Чжу Юаньмін, Уайтекер Грегорі Т.
Формула / Реферат
1. Спосіб одержання 4-аміно-3-хлор-5-фтор-6-(заміщеного)піколінату формули І
 , I
, I
в якій
R являє собою (С1-С4)алкіл, циклопропіл, (С2-С4)алкеніл або феніл, що містить від 1 до 4 замісників, які незалежно вибирають з галогену, (С1-С4)алкілу, (С1-С4)галоалкілу, (С1-С4)алкокси або (С1-С4)галоалкокси; і
R1 являє собою (С1-С12)алкіл або незаміщений або заміщений (С7-С11)арилалкіл;
який включає наступні стадії:
а) фторування 3,4,5,6-тетрахлорпіколінонітрилу (формула А)
 A
A
джерелом фторид-іонів для одержання 3-хлор-4,5,6-трифторпіколінонітрилу (формула В)
 , В
, В
b) амінування 3-хлор-4,5,6-трифтор-2-піколінонітрилу (формула В) аміаком для одержання 4-аміно-3-хлор-5,6-дифторпіколінонітрилу (формула С)
 , C
, C
с) реакцію фторзамісника в положенні 6 4-аміно-3-хлор-5,6-дифторпіколінонітрилу (формула С) з гідразином для одержання 4-аміно-3-хлор-5-фтор-6-гідразинопіколінонітрилу (формула D)
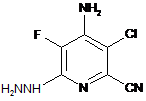 , D
, D
d) галогенування 4-аміно-3-хлор-5-фтор-6-гідразинопіколінонітрилу (формула D) джерелом хлору, брому або йоду для одержання 4-аміно-3-хлор-5-фтор-6-галогенпіколінонітрилу формули Е
 , E
, E
в якій L являє собою Вr, Сl або І;
e) гідроліз і етерифікацію 4-аміно-3-хлор-5-фтор-6-галогенпіколінонітрилу формули Е сильною кислотою і спиртом (R1OH) для одержання 4-аміно-3-хлор-5-фтор-6-галогенпіколінату формули F
 , F
, F
в якій L і R1 є такими, як визначено вище; і
f) поєднання 4-аміно-3-хлор-5-фтор-6-галогенпіколінату формули F з арил-, алкіл- або алкенілметалоорганічною сполукою формули G
![]() , G
, G
в якій R є таким, як визначено вище, і Met являє собою Zn-галогенід, Zn-R, три-((С1-С4)алкіл)олово, мідь, або B(OR2)(OR3), де R2 і R3 незалежно один від одного являють собою водень або (С1-С4)алкіл або спільно утворюють етиленову або пропіленову групу, в присутності каталізатора, що містить перехідний метал, для одержання 4-аміно-3-хлор-5-фтор-6-(заміщеного)піколінату формули І.
2. Спосіб за п. 1, в якому поєднання, як на стадії (f), здійснюють перед гідролізом і етерифікацією стадії (e).
3. Вдосконалений спосіб збільшення кількості 3-хлор-4,5,6-трифторпіколінонітрилу, що виділяється (формула В)
 , В
, В
одержаного фторуванням 3,4,5,6-тетрахлорпіколінонітрилу (формула А)
 A
A
джерелом фторид-іонів, де удосконалення включає наступні стадії:
і) виділення повністю фторованого 3,4,5,6-тетрафторпіколінонітрилу (формула Н)
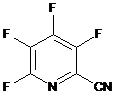 , H
, H
як побічного продукту фторування 3,4,5,6-тетрахлорпіколінонітрилу;
іі) реакція виділеного 3,4,5,6-тетрафторпіколінонітрилу (Н) (а) з хлоридом літію (LiCl), (b) з 3,4,5,6-тетрахлорпіколінонітрилом (формула А) в присутності каталізатора міжфазного перенесення або (с) з комбінацією LiCl і 3,4,5,6-тетрахлорпіколінонітрилу для одержання суміші, яку складають переважно 3,4,5,6-тетрахлорпіколінонітрил, монофтортрихлорпіколінонітрил і дифтордихлорпіколінонітрил; і
ііі) повернення суміші, яку складають переважно 3,4,5,6-тетрахлорпіколінонітрил, монофтортрихлорпіколінонітрил і дифтордихлорпіколінонітрили в реакцію фторування для одержання 3-хлор-4,5,6-трифторпіколінонітрилу (формула В).
4. Сполука формули
 .
.
Текст
Реферат: 4-Аміно-3-хлор-5-фтор-6-(заміщені)піколінати зручно одержувати з 3,4,5,6тетрахлорпіколінонітрилу, використовуючи ряд стадій, що включають фторидне заміщення, амінування, реакцію з гідразином, галогенування, гідроліз і етерифікацію, а також каталізоване перехідними металами поєднання. UA 105610 C2 (12) UA 105610 C2 UA 105610 C2 5 10 15 20 25 Даний винахід стосується способу отримання 4-аміно-3-хлор-5-фтор-6(заміщених)піколінатів. Більш конкретно, даний винахід стосується способу отримання 4-аміно3-хлор-5-фтор-6-(заміщених)піколінатів, в яких 5-фторзамісник вводять шляхом галогенідного заміщення на ранній стадії в схемі способу. Патент США № 6297197 B1 описує, крім іншого, певні 4-аміно-3-хлор-5-фтор-6-(алкокси або арилокси)піколінатні сполуки і їх використання як гербіциди. Патенти США №№ 6784137 B2 і 7314849 B2 описують, крім іншого, певні 4-аміно-3-хлор-5-фтор-6-(арил)піколінатні сполуки і їх використання як гербіциди. Патент США № 7432227 B2 описує, крім іншого, певні 4-аміно-3хлор-5-фтор-6-(алкіл)піколінатні сполуки і їх використання як гербіциди. Кожний з цих патентів описує отримання 4-аміно-3-хлор-5-фтор-пиколінатних вихідних матеріалів шляхом фторування відповідних 5-(незаміщених)піколінатів, використовуючи 1-(хлорметил)-4-фтор-1,4діазоніабіцикло[2.2.2]октану біс(тетрафторборат). Було б вигідно отримувати 4-аміно-3-хлор-5фтор-6-(заміщені)піколінати, не застосовуючи безпосередню фторування піколінату в положенні 5 фторуючим реагентом, що дорого коштує, таким як 1-(хлорметил)-4-фтор-1,4діазоніабіцикло[2.2.2]октану біс(тетрафторборат). Даний винахід стосується способу отримання 4-аміно-3-хлор-5-фтор-6(заміщених)піколінатів з 3,4,5,6-тетрахлорпіколінонітрилу. Більш конкретно, даний винахід стосується способу отримання 4-аміно-3-хлор-5-фтор-6-(заміщеного)піколінату формули I в якій R являє собою (C1-C4)алкіл, циклопропіл, (C2-C4)алкеніл або феніл, що містить від 1 до 4 замісників, як такі незалежно вибирають галоген, (C1-C4)алкіл, (C1-C4)галогеналкіл, (C1C4)алкокси або (C1-C4)галогеналкокси; і 1 R являє собою (C1-C12)алкіл або незаміщений або заміщений (C7-C11)арилалкіл; який включає наступні стадії: a) фторування 3,4,5,6-тетрахлорпіколінонітрилу (формула А) джерелом фторид-іону для отримання 3-хлор-4,5,6-трифторпіколінонітрилу (формула В) 30 b) амінування 3-хлор-4,5,6-трифторпіколінонітрилу (формула В) аміаком для отримання 4аміно-3-хлор-5,6-дифторпіколінонітрилу (формула С) c) реакцію фторзамісника в положенні 6 4-аміно-3-хлор-5,6-дифторпіколінонітрилу (формула С) з гідразином для отримання 4-аміно-3-хлор-5-фтор-6-гідразинопіколінонітрилу (формула D) 35 1 UA 105610 C2 d) галогенування 4-аміно-3-хлор-5-фтор-6-гідразинопіколінонітрилу (формула D) джерелом хлору, брому або йоду для отримання 4-аміно-3-хлор-5-фтор-6-галогенпіколінонітрилу формули Е 5 в якій L являє собою Br, Cl або I; e) гідроліз і етерифікацію 4-аміно-3-хлор-5-фтор-6-галогенпіколінонітрилу формули Е 1 сильною кислотою і спиртом (R OH) для отримання 4-аміно-3-хлор-5-фтор-6-галогенпіколінату формули F 10 в якій L і R є такими, як визначено вище; і f) поєднання 4-аміно-3-хлор-5-фтор-6-галогенпіколінату формули F з арил-, алкіл- або алкенілметалоорганічною сполукою формули G 15 20 25 1 в якій R є таким, як визначено вище, і Met являє собою Zn-галогенід, Zn-R, три-((C12 3 2 3 C4)алкіл)олово, мідь, або В(OR )(OR ), де R і R незалежно один від одного являють собою водень або (C1-C4)алкіл, або спільно утворюють етиленову або пропіленову групу в присутності каталізатора, що містить перехідний метал, для отримання 4-аміно-3-хлор-5-фтор-6(заміщеного)піколінату формули I. Стадії (a)-(f) можна здійснювати в послідовності, представленій на схемі I, або деякі з стадій можна міняти місцями, отримуючи інші послідовності, наскільки це допускає сумісність хімічних реагентів. Наприклад, стадію (f) можна здійснювати перед гідролізом і етерифікацією стадії (е). Схема I Додатковий аспект даного винаходу стосується вдосконаленого способу збільшення кількості 3-хлор-4,5,6-трифторпіколінонітрилу (формула В), що виділяється 2 UA 105610 C2 отриманого фторуванням 3,4,5,6-тетрахлорпіколінонітрилу (формула А) джерелом фторид-іонів, де удосконалення включає наступні стадії: i) виділення повністю фторованого 3,4,5,6-тетрафторпіколінонітрилу (формула Н) 5 10 15 20 25 30 35 40 45 як побічний продукт фторування 3,4,5,6-тетрахлорпіколінонітрилу; ii) реакція виділеного 3,4,5,6-тетрафторпіколінонітрилу (Н) (a) з хлоридом літію (LiCl), (b) з 3,4,5,6-тетрахлорпіколінонітрилом (формула А) в присутності каталізатора міжфазного перенесення або (с) з поєднанням LiCl і 3,4,5,6-тетрахлорпіколінонітрилу для отримання суміші, яку складають переважно 3,4,5,6-тетрахлорпіколінонітрил, монофтортрихлорпіколінонітрил і дифтордихлорпіколінонітрил; і iii) повернення суміші, яку складають переважно 3,4,5,6-тетрахлорпіколінонітрил, монофтортрихлорпіколінонітрил і дифтордихлорпіколінонітрили в реакцію фторування для отримання 3-хлор-4,5,6-трифторпіколінонітрилу (формула В). Наступний аспект даного винаходу являє собою новий проміжний продукт, отриманий при використанні даного способу, а саме, сполуку: Докладний опис винаходу Терміни «алкіл», «алкеніл» і «алкініл», а також похідні терміни, такі як «алкокси», «ацил», «алкілтіо» і «алкілсульфоніл» при використанні в цьому документі включають в межах свого об'єму вміщуючі лінійні ланцюги, розгалужені ланцюги і циклічні радикали. Якщо визначено не встановлені інші умови, кожний з них може бути незаміщеним або містити один або більше замісників, як такі вибирають, не обмежуючись цим, галоген, гідрокси, алкокси, алкілтіо, (C1C6)ацил, форміл, ціано, арилокси або арил, при тій умові, що замісники є стерично сумісними, і виконуються правила хімічного зв'язку і енергії деформації. Терміни «алкеніл» і «алкініл» призначені для включення одного або декількох ненасичених зв'язків. Термін «арилалкіл» при використанні в цьому документі означає феніл, заміщений алкільною групою, що містить всього від 7 до 11 атомів вуглецю, такою як бензильна (-CH2C6H5), 2-метилнафтильна (-CH2C10H7) і 1-або 2-фенетильна (-CH2CH2C6H5 або -CH(CH3)C6H5). Сама фенільна група може бути незаміщеною або містити один або декілька замісників, як такі незалежно вибирають галоген, нітрогрупу, ціаногрупу, (C1-C6)алкіл, (C1-C6)алкокси, галогенований (C1-C6)алкіл, галогенований (C1-C6)алкокси, (C1-C6)алкілтіо, C(O)O(C1-C6)алкіл, або два сусідніх замісники спільно утворюють групу -O(CH2)nO-, в якій n становить 1 або 2, при тій умові, що замісники є стерично сумісними, і виконуються правила хімічного зв'язку і енергії деформації. Якщо визначено не встановлені інші обмеження, термін «галоген», а також похідні терміни, такі як «гало», означають фтор, хлор, бром і йод. Фенільні групи, що містять від 1 до 4 замісників, як такі незалежно вибирають галоген, (C1C4)алкіл, (C1-C4)галогеналкіл, (C1-C4)алкокси або (C1-C4)галогеналкокси, можуть мати будь-яку орієнтацію, але переважними є 4-заміщений фенільний, 2,4-дизаміщений фенільний, 2,3,4тризаміщений фенільний, 2,4,5-тризаміщений фенільний, і 2,3,4,6-тетразаміщений фенільний ізомери. 4-аміно-3-хлор-5-фтор-6-(заміщені)піколінати отримують з 3,4,5,6-тетрахлорпіколінонітрилів, використовуючи послідовність стадій, що включають фторидне заміщення, амінування, реакцію з гідразином, галогенування, гідроліз, етерифікацію і каталізовану перехідними металами комбінацію. Окремі стадії можна здійснювати, використовуючи інші послідовності. 3,4,5,6-тетрахлорпіколінонітрил як вихідний матеріал являє собою відому сполуку, яка є в продажу. 3 UA 105610 C2 У реакції фторидного заміщення фторований піколінонітрил отримують, коли відповідний хлорований піколінонітрил реагує приблизно з одним еквівалентом джерела фторид-іонів на кожний підлягаючій обміну хлоридний замісник в кільці. 5 10 15 20 25 30 35 40 45 50 Типові джерела фторид-іонів являють собою фториди лужних металів, які включають фторид натрію (NaF), фторид калію (KF) і фторид цезію (CsF), причому переважними є KF і CsF. Фторид четвертинного алкіл- або ариламонію або фосфонію можна також використати як джерело фторид-іонів або як добавку. Переважно реакцію здійснюють, використовуючи полярний апротонний розчинник або реакційне середовище, таке як диметилсульфоксид (DMSO), N-метилпіролідон (NMP), N,N-диметилформамід (DMF), гексаметилфосфорамід (HMPA) або сульфолан. Температура, при якій проводять реакцію, не має вирішального значення, але звичайно вона складає від 60°С до 180°С і переважно від 70°С до 80°С. У залежності від того, який розчинник використовують в конкретній реакції, оптимальна температура буде змінюватися. Взагалі кажучи, чим нижче температура, тим повільніше буде проходити реакція. Дану реакцію проводять, як правило, при перемішуванні з досить високою інтенсивністю, щоб підтримувати практично однорідно дисперговану суміш реагентів. При проведенні реакції фторування не має вирішального значення ні швидкість, ні послідовність введення реагентів. Як правило, розчинник і фторид лужного металу змішують перед тим, як хлорований піколінонітрил додають в реакційну суміш. Для типової реакції потрібно, як правило, від 2 до 100 годин, переважно від 3 до 6 годин, і її звичайно проводять при атмосферному тиску навколишнього середовища. Хоча точна кількість реагентів не має вирішального значення, виявляється переважним використання кількості фториду лужного металу, яка забезпечує, щонайменше, еквімолярну кількість атомів фтору по відношенню до числа підлягаючих обміну атомів хлору у вихідному матеріалі, тобто щонайменше еквімолярну кількість фториду лужного металу. Після завершення реакції бажаний продукт виділяють, використовуючи стандартні технології розділення і очищення речовин, такі як дистиляція, кристалізація і хроматографія. У типовій реакції фторидного заміщення отримують суміш продуктів, що включає значну кількість повністю фторованого побічного продукту, а саме 3,4,5,6-тетрафторпіколінонітрилу (формула Н). Кінцевий вихід бажаного 3-хлор-4,5,6-трифторпіколінонітрилу можна підвищувати, виділяючи повністю фторований побічний продукт 3,4,5,6-тетрафторпіколінонітрил і повертаючи його для отримання проміжних продуктів, які можна вводити в реакцію фторидного заміщення. Це можна здійснювати декількома способами. Реакція 3,4,5,6-тетрафторпіколінонітрилу з LiCl або реакція 3,4,5,6-тетрафторпіколінонітрилу з надлишком 3,4,5,6-тетрахлорпіколінонітрилу або поєднання обох реакцій, з використанням або без використання розчинників, приводить до утворення сумішей хлорфторпіколінонітрилів, де 3-хлор ізомери можна використати як вихідний матеріал для отримання бажаного продукту. Таким чином, 3,4,5,6-тетрафторпіколінонітрил можна нагрівати з надлишком LiCl для отримання суміші, що містить переважно 3,4,5-трихлор6-фторпіколінонітрил і тетрахлорпіколінонітрил. Згідно з іншою методикою, в реакції виділеного 3,4,5,6-тетрафторпіколінонітрилу з надлишком 3,4,5,6-тетрахлорпіколінонітрилу в присутності каталізатора міжфазного перенесення отримують суміш, яку складають переважно монофтортрихлорпіколінонітрили і дифтордихлорпіколінонітрили. Нарешті, еквівалентні суміші виділеного 3,4,5,6-тетрафторпіколінонітрилу і 3,4,5,6-тетрахлорпіколінонітрилу в присутності каталізатора міжфазного перенесення і від 1 до 3 еквівалентів LiCl утворюють суміш, що містить переважно 3,4,5-трихлор-6-фторпіколінонітрил і 3,4,5,6-тетрахлорпіколінонітрил. Ці суміші, які складають переважно монофтортрихлорпіколінонітрили і/або дифтордихлорпіколінонітрили, можна використати в реакції фторування, застосовуючи фторид лужного металу, щоб отримати 3-хлор-4,5,6-трифторпіколінонітрил з 3,4,5,6-тетрафторпіколінонітрилу. 4 UA 105610 C2 5 10 15 20 25 У зворотній реакції галогенідного заміщення нагрівають 3,4,5,6-тетрафторпіколінонітрил і від 5 до 10 еквівалентів, переважно 6 еквівалентів LiCl, щоб отримати суміш, яка містить 4,5дихлор-3,6-дифторпіколінонітрил (3,6-F2-PN), 6-фтор-3,4,5-трихлорпіколінонітрил (6-F-PN) і 3,4,5,6-тетрахлорпіколінонітрил (Cl4-PN). Дану реакцію можна здійснювати без розчинника або в полярному апротонному розчиннику або реакційному середовищі, такому як, DMSO, NMP, DMF, HMPA або сульфолан. Часто виявляється зручним проведення реакції в розчиннику. Температура, при якій проводять реакцію, не має вирішального значення, але ця температура складає звичайно від 80°С до 200°С і переважно від 100°С до 150°С. Можна використати 90% або більшу частину суміші для отримання 3-хлор-4,5,6трифторпіколінонітрилу шляхом рециркуляції суміші через реакцію фторидного заміщення. У реакції заміщення, в якій заміняються групи фтору і хлору, реагують 3,4,5,6тетрафторпіколінонітрил і від 1 до 3 еквівалентів 3,4,5,6-тетрахлорпіколінонітрилу, переважно 2 еквіваленти 3,4,5,6-тетрахлорпіколінонітрилу. Дану реакцію можна здійснювати без розчинника або в полярному апротонному розчиннику або реакційному середовищі, такому як, DMSO, NMP, DMF, HMPA або сульфолан. Часто виявляється зручним проведення реакції без розчинника. Реакцію заміщення проводять в присутності добавки. Добавки включають (a) солі четвертинного фосфонію, що містять 10 або більше атомів вуглецю і (b) макроциклічні прості поліефіри, загальновідомі як краун-ефіри. Придатні як каталізатори краун-ефіри включають, але не обмежуються цим, 18-краун-6; дициклогексано-18-краун-6; дибензо-18-краун-6; 15- краун-5. Придатні солі четвертинного фосфонію включають солі тетра-н-алкілфосфонію, які є особливо переважними. Температура, при якій проводять реакцію, не має вирішального значення, але ця температура звичайно складає від 80°С до 200°С і переважно від 150°С до 180°С. У типовій реакції заміщення, наприклад, в якій реагують 1 еквівалент 3,4,5,6тетрафторпіколінонітрилу і 2 еквіваленти 3,4,5,6-тетрахлорпіколінонітрилу, можна отримати наступну суміш ізомерів: 3,4,5,6-тетра-хлорпіколінонітрил (C14-PN), 3,5-дихлор-4,6дифторпіколінонітрил (4,6-F2-PN), 3,4-дихлор-5,6-дифторпіколінонітрил (5,6-F2-PN), 4,5-дихлор3,6-дифторпіколінонітрил (3,6-F2-PN), 6-фтор-3,4,5-трихлорпіколінонітрил (6-F-PN) і 4-фтор3,5,6-трихлорпіколінонітрил (4-F-PN). 30 5 UA 105610 C2 5 10 15 Можна використати 80% цієї суміші для отримання 3-хлор-4,5,6-трифторпіколінонітрилу шляхом рециркуляції суміші через реакцію фторидного заміщення. У комбінації зворотної реакції галогенідного заміщення і реакцій заміщення реагують 3,4,5,6тетрафторпіколінонітрил і від 1 до 3 еквівалентів 3,4,5,6-тетрахлорпіколінонітрилу, переважно 1 еквівалент 3,4,5,6-тетрахлорпіколінонітрилу і від 1 до 4 еквівалентів, переважно від 1,5 до 2,5 еквівалентів LiCl. Дану реакцію можна здійснювати без розчинника або в полярному апротонному розчиннику або реакційному середовищі, такому як, DMSO, NMP, DMF, HMPA або сульфолан. Часто виявляється зручним проведення реакції без розчинника. Реакцію заміщення проводять в присутності добавки. Добавки включають (a) солі четвертинного фосфонію, що містять 10 або більше атомів вуглецю і (b) макроциклічні прості поліефіри, загальновідомі як краун-ефіри. Придатні як каталізатори краун-ефіри включають, але не обмежуються цим, 18краун-6; дициклогексано-18-краун-6; дибензо-18-краун-6; 15- краун-5. Придатні солі четвертинного фосфонію включають солі тетра-н-алкілфосфонію, які є особливо переважними. Температура, при якій проводять реакцію, не має вирішального значення, але ця температура звичайно складає від 80°С до 200°С і переважно від 150°С до 180°С. У типовому поєднанні реакцій галогенідного заміщення і реакцій заміщення, реагують, наприклад, 1 еквівалент 3,4,5,6-тетрафторпіколінонітрилу, 1 еквівалент 3,4,5,6тетрахлорпіколінонітрилу і 1,5 еквіваленти LiCl, і можна отримати наступну суміш ізомерів: 20 Можна використати 92% цієї суміші для отримання 3-хлор-4,5,6-трифторпіколінонітрилу шляхом рециркуляції суміші через реакцію фторидного заміщення. У реакції амінування 4-фторпіколінонітрил реагує з аміаком для заміщення атома фтору аміногрупою. 25 Хоча потрібна тільки стехіометрична кількість аміаку, часто виявляється зручним використання великого надлишку аміаку. Часто виявляється зручним використання аміаку, діючого одночасно як реагент і основа, щоб нейтралізувати фтороводень (HF), що утворюється в реакції. Як альтернатива, аміак може бути присутнім в формі розчину, такого як водний розчин гідроксиду амонію. Реакцію здійснюють без розчинника або в інертному розчиннику. Якщо використовують розчинник, то інертні розчинники включають, але не обмежуються цим, спирти, прості ефіри, складні ефіри, кетони, DMSO і ароматичні розчинники. Температура, при якій проводять реакцію, не має вирішального значення, але ця температура складає звичайно від 0°С до 45°С і переважно від 10°С до 30°С. Для типової реакції потрібно, як правило, від 0,5 до 5 годин, і її звичайно проводять при атмосферному тиску навколишнього середовища. Бажаний продукт виділяють, використовуючи стандартні методики розділення і очищення. У реакції з гідразином 6-фторпіколінонітрил реагує з гідразином, заміняючи атом фтору гідразиновою групою. 30 35 40 45 Хоча потрібна тільки стехіометрична кількість гідразину, часто виявляється зручним використання надлишку гідразину, діючого одночасно як реагент і як основа для нейтралізації фтороводню, що виділяється в реакції. Гідразин переважно являє собою моногідрат. Реакцію здійснюють в інертному полярному розчиннику, такому як DMSO, DMF, NMP, ацетонітрил, хлорований розчинник, простий ефір, тетрагідрофуран (THF) або спирт. Переважною є суміш DMSO і THF. Температура, при якій проводять реакцію, не має вирішального значення, але 6 UA 105610 C2 5 10 15 20 25 30 35 40 45 вона складає звичайно від температури навколишнього середовища до 150°С і переважно від 35°С до 70°С. При проведенні реакції з гідразином гідразин розчиняють в розчиннику, і 6фторпіколінонітрил додають в реакційну суміш. Для типової реакції потрібно, як правило, від 0,5 до 5 годин, і її звичайно проводять при атмосферному тиску. Бажаний продукт виділяють, використовуючи стандартні методики розділення і очищення. Сполуки можна легко виділяти, розбавляючи реакційну суміш ацетонітрилом, після чого йде фільтрування. У реакції галогенування 6-галопіколінонітрил отримують за допомогою взаємодії відповідного 6-гідразинопіколінонітрилу і, щонайменше, одного еквівалента бромуючого, хлоруючого або йодуючого реагенту. Відповідні йодуючі, хлоруючі і бромуючі реагенти включають, але не обмежуються цим, йод, монохлорид йоду, хлор, бром, сульфурилхлорид і сульфурилбромід. Хоча потрібна тільки стехіометрична кількість галогенуючого реагенту, часто виявляється зручним використання надлишку галогенуючого реагенту. Реакцію здійснюють в інертному апротонному розчиннику. Можна використати різноманітні розчинники, такі як хлоровані розчинники, ацетонітрил, DMSO, діоксан, DMF і вода. Часто виявляється переважним використання хлорованого розчинника. Температура, при якій проводять реакцію, не має вирішального значення, але вона складає звичайно від температури навколишнього середовища до 100°С і переважно від температури навколишнього середовища до 50°С. При проведенні реакції галогенування 6-гідразинопіколінонітрил розчиняють або суспендують в розчиннику, і галогенуючий реагент додають в реакційну суміш. Для типової реакції потрібно, як правило, від 0,5 до 24 годин. Бажаний продукт виділяють, використовуючи стандартні методики розділення і очищення. 1 У реакціях гідролізу і етерифікації піколінонітрил реагує зі спиртом (R OH) в присутності кислоти Бренстеда (Bronsted) або кислоти Льюїса (Lewis). Кислоти Бренстеда включають, але не обмежуються цим, такі кислоти, як хлористоводнева кислота, сірчана кислота і фосфорна кислота. Кислоти Льюїса включають трифторид бору, тетрагалогеніди титана, тетраалкоксиди титана, галогеніди цинку, галогенід олова, а також пентафториди фосфору і сурми. Кислоти, такі як сірчана кислота або фосфорна кислота, як правило, використовують в стехіометричних кількостях. Реакцію здійснюють в (C1C12)алкіловому спирті або незаміщеному або заміщеному (C7-C11)арилалкіловому спирті, відповідному бажаному складному ефіру. Реакцію можна зручно провести в герметичному реакторі, якщо температура реакції знаходиться вище температури кипіння спиртового розчинника. При проведенні етерифікації піколінонітрил або проміжний продукт гідролізу піколінаміду додають до суміші спирту і кислоти. Хоча температура реакції не має вирішального значення, часто здійснюють нагрівання при температурі від 80°С до 140°С протягом від 2 до 24 годин, переважно при температурі від 100°С до 120°С протягом від 6 до 8 годин. Бажаний продукт виділяють, використовуючи стандартні методики розділення і очищення. У реакції поєднання 6-галопіколінат реагує з арил-, алкіл- або алкенілметалоорганічною сполукою, де метал являє собою Zn-галогенід, Zn-R, три-(C1-C4алкіл)олово, мідь, або 2 3 2 3 В(OR )(OR ), де R і R незалежно один від одного являють собою водень, (C1-C4)алкіл або спільно утворюють етиленову або пропіленову групу в присутності каталізатора, що містить перехідний метал. 7 UA 105610 C2 5 10 15 20 25 30 35 40 45 50 Термін «каталізатор» означає каталізатор, що містить перехідний метал, зокрема, паладієвий каталізатор, такий як діацетат паладію(II) або дихлорбіс(трифенілфосфін)паладій(II), або нікелевий каталізатор, такий як ацетилацетонат нікелю(II) або дихлорбіс(трифенілфосфін)нікель(II). Крім того, каталізатори можна отримувати на місці застосування in situ, використовуючи солі металів і ліганди, такі як ацетат паладію(II) і трифенілфосфін або хлорид нікелю(II) і трифенілфосфін. Дані каталізатори, що отримуються на місці застосування, можна отримувати за допомогою попередньої реакції солі металу і ліганду, після чого йде введення в реакційну суміш, або за допомогою роздільного введення солі металу і ліганду безпосередньо в реакційну суміш. Як правило, реакції поєднання здійснюють за відсутності кисню, використовуючи інертний газ, такий як азот або аргон. Методики, що використовуються для виключення кисню з реакційних сумішей в реакціях поєднання, такі як витіснення інертним газом, добре відомі фахівцям в даній галузі техніки. Приклади таких методик описує книга «Поводження з чутливими до повітря сполуками», друге видання під редакцією D. F. Shriver і M.A. Drezdzon, видавництво Wiley-Interscience, 1986 р. Каталізатор використовують в субстехіометричних кількостях, що складають, як правило, від 0,0001 еквівалента до 0,1 еквівалента. Можна необов'язково вводити додаткові кількості ліганду для підвищення стійкості і активності каталізатора. Крім того, в реакцію поєднання, як правило, вводять добавки, такі як карбонат натрію, карбонат калію, фторид калію, фторид цезію і фторид натрію. Для реакції поєднання потрібно, як правило, від 1 до 5 еквівалентів, переважно від 1 до 2 еквівалентів такої добавки. Воду можна необов'язково вводити в реакцію поєднання для підвищення розчинності цих добавок. Для реакції поєднання потрібно, як правило, від 1 до 3 еквівалентів, переважно від 1 до 1,5 еквівалентів арил-, алкіл- або алкенілметалоорганічної сполуки. Реакцію здійснюють в інертному розчиннику, такому як толуол, THF, діоксан або ацетонітрил. Температура, при якій проводять реакцію, не має вирішального значення, але ця температура складає звичайно від 25°С до 150°С і переважно від 50°С до 125°С. Для типової реакції потрібно, як правило, від 0,5 до 24 годин. Жодний визначений порядок введення реагентів, як правило, не потрібний. Часто виявляється технологічно більш простоєм об'єднання всіх реагентів, за винятком каталізатора, і подальше видалення кисню з реакційного розчину. Після видалення кисню каталізатор можна вводити для початку реакції поєднання. Коли металоорганічна частина арил-, алкіл- або алкенілметалоорганічної сполуки являє собою Zn-галогенід, Zn-R або мідь, може виявитися необхідною захист реакційноздатних функціональних груп. Наприклад, якщо присутній амінний замісник (-NHR або -NH2), може бути потрібен захист цих реакційноздатних груп. У техніці відомі різноманітні групи для захисту аміногруп від реакції з металоорганічними реагентами. Приклади таких захисних груп описує книга «Захисні групи в органічному синтезі», третє видання під редакцією T. W. Greene і P.G.M. Wuts, видавництво Wiley-Interscience, 1999 р. На вибір металу для використання в металоорганічній сполуці R-Met впливає множина чинників, таких як вартість, стійкість, реакційна здатність і необхідність захисту реакційноздатних функціональних груп. Продукти, отримані будь-яким з цих способів, можна виділяти традиційними засобами, такими як випарювання або екстракція, і їх можна очищати стандартними процедурами, такими як перекристалізація або хроматографія. Наступні приклади представлені, щоб проілюструвати даний винахід. Приклади Фторидне заміщення Приклад 1a 3-Хлор-4,5,6-трифторпіколінонітрил У п’ятилітрову колбу з механічною мішалкою в атмосфері азоту завантажували DMSO (3820 мл), порошкоподібний карбонат калію K2CO3 (42 г) і тонкоподрібнений фторид цезію CsF (1510 8 UA 105610 C2 5 10 15 20 25 30 35 40 45 г). DMSO (приблизно 1 л) видаляли шляхом дистиляції при 75-80°С і 3,5 мм рт. ст. (0,46 кПа). Суспензію охолоджували до 55°С в атмосфері азоту перед введенням тонкоподрібненого 3,4,5,6-тетрахлорпіколінонітрилу (685 г). Введення здійснювали протягом 15-хвилинного періоду при охолоджуванні для підтримки температури реакційної суміші нижче 74°С. Температуру витримували на рівні від 65 до 70°С при повільному потоку азоту протягом 4 годин. Реакційну суміш охолоджували до 40-50°С і виливали в суміш крижаної води H2O (15 л) і діетилового ефіру Et2O (3 л). Після відділення органічної фази водну фазу екстрагували Et 2O (2×2 л). Органічні екстракти об'єднували, сушили над сульфатом магнію (MgSO 4), фільтрували і концентрували шляхом дистиляції при атмосферному тиску, отримуючи суміш неочищених продуктів (469 г) в формі ясно-коричневого масла. Це масло об'єднували з додатковим матеріалом, отриманим аналогічним чином, отримуючи в сумі 1669 г неочищеного продукту. Це масло дистилювали у вакуумі, використовуючи 30-тарілкову колонку Олдершоу (Oldershaw) в температурному інтервалі від 80 до 90°С, збираючи фракції при 63, 13 і 2 мм рт. ст. (8,4, 1,7 і 0,27 кПа). З матеріалу, зібраного при 13 мм рт. ст. (1,7 кПа), отримували 457 г (вихід 22%) твердої речовини, яка являла собою суміш двох хлортрифторпіколінонітрилів в співвідношенні 93/7. Цю тверду речовину перекристалізовували при 5°С з суміші гексану (420 г) і Et 2O, отримуючи 3-хлор-4,5,6-трифторпіколінонітрил (354 г, чистота 98%) в формі тонких білих голчатих кристалів. Невеликий зразок перекристалізовували другий раз, отримуючи чистоту 99,7% згідно з газовою хроматографією (GC); температура плавлення 41,5-43°С; спектр ЯМР 19 F (376 МГц, CDCl3) δ -78,1 (т, JF-F=23,1 Гц, F6), -114,2 (дд, JF-F=18,5, 22,5 Гц, F4), -149,3 (дд, JF13 1 C { Н} (101 МГц, CDCl3) δ 154,5 (ддд, JF-C=270, 11, 7 Гц, C4), F=18,2, 22,6 Гц, F5); спектр ЯМР 151,3 (ддд, JF-C=247, 13, 5 Гц, C6), 138,0 (ддд, JF-C=279, 31, 13 Гц, C5), 124,7 (ддд, JF-C=16, 6, 2 Гц, C3), 124,4 (ддд, JF-C=16, 7, 2 Гц, C2), 112,2 (c, CN); електронно-стимульована мас+ спектрометрія (EIMS) m/z 192 [M]( ). Елементний аналіз. Обчислено для C6ClF3N2 (%): C, 37,43; N, 14,55. Знайдено (%): С, 36,91; N, 14,25. З другої фракції при дистиляції (63 мм рт. ст., 8,4 кПа) отримували чистий 3,4,5,619 тетрафторпіколінонітрил (525 г, 24%) в формі безбарвного масла; спектр ЯМР F (376 МГц, CDCl3) δ -77,6 (т, JF-F=23,8 Гц, F6), -133,7 (кв., JF-F=18,8 Гц, F4), -134,2 (ддд, JF-F=24,2, 18,6, 10,1 13 1 Гц, F3), -145,3 (ддд, JF-F=24,1, 18,2, 10,2 Гц, F5); спектр ЯМР C { Н} (101 МГц, CDCl3) δ 150,4 (дм, JF-C=272 Гц, C3), 148,5 (ддд, JF-C=245, 12, 4 Гц, C6), 147,3 (дм, JF-C=270 Гц, C4), 138,6 (ддд, JF-C=280, 33, 11 Гц, C5), 113,4 (м, C2), 110,20 (c, CN). З третьої фракції при дистиляції (2 мм рт. ст., 0,27 кПа) отримували 3,5-дихлор-4,6дифторпіколінонітрил (48 г, чистота 98%) в формі білої твердої речовини; температура 19 плавлення 78-79°С; спектр ЯМР F (376 МГц, CDCl3) δ -63,65 (д, JF-F=18,7 Гц, F6), -92,52 (д, JF13 1 C { Н} (101 МГц, CDCl3) δ 162,6 (дд, JF-C=269, 6 Гц, C4), 157,8 (дд, F=18,5 Гц, F4); спектр ЯМР JF-C=245, 5 Гц, C6), 127,6 (дд, JF-C=17, 3 Гц, C3), 123,5 (дд, JF-C=18, 6 Гц, C2), 112,4 (дд, JF-C=36, 21 Гц, C5), 112,3 (CN). Приклад 1b Зворотна реакція галогенідного заміщення 3,4,5,6-тетрафторпіколінонітрилу з хлоридом літію Суміш 3,4,5,6-тетрафторпіколінонітрилу (17 г, 0,1 моль) і сухий LiCl (25,4 г, 0,6 моль) нагрівали в сухому DMSO (200 мл). За реакцією спостерігали, проводячи аналіз методом газової хроматографії аліквот, екстрагованих Et2O з H2O. Спочатку реакційну суміш нагрівали до 120°С, і весь LiCl розчинявся. Протягом п’ятихвилинного витримування при 120°С весь вихідний матеріал і ізомери хлортрифторпіколінонітрилу реагували, утворюючи суміш 3,6-F2-PN (83%) і 6F-PN (14%). Температуру реакційної суміші підвищували до 135°С, і через 75 хвилин після початку реакції проводили аналіз методом газової хроматографії. Визначали, що суміш являла собою 3,6-F2-PN/6-F-PN/Cl4-PN суміш в співвідношенні 8:80:12. Приклад 1ca Обмін 3,4,5,6-тетрафторпіколінонітрилу 9 UA 105610 C2 5 10 15 20 25 30 Суміш 3,4,5,6-тетрахлорпіколінонітрилу (16,1 г, 66 ммоль) і 3,4,5,6-тетрафторпіколінонітрилу (5,9 г, 33 ммоль) нагрівали до 160°С в атмосфері азоту, отримуючи розчин. У даний розчин при перемішуванні вводили хлорид тетрабутилфосфонію Bu4PCl (0,36 г, 1,2 ммоль), і розчин витримували при 160°С протягом 1 години. Аліквоту розчиняли в метиленхлориді (CH 2Cl2) і пропускали через тонкий шар силікагелю перед аналізом методом газової хроматографії. Галогеновані піколінонітрили мали наступний склад: 11,2% CI4-PN; 11,3% 4,6-F2-PN; 2,3% 5,6-F2PN; 19% 3,6-F2-PN; 52,6% 6-F-PN і 3,6% 4-F-PN. Можна використати 80% даної суміші в реакції галогенідного заміщення, щоб отримувати 3-хлор-4,5,6-трифторпіколінонітрил. Приклад 1cb Виділення після обміну 3,4,5,6-тетрафторпіколінонітрилу У реакційну колбу, забезпечену коротким дефлегматором, завантажували тонкоподрібнений CsF (35,1 г, 0,23 моль) і сухий DMSO (175 мл). Реакційну суміш перемішували і нагрівали до 7075°С у вакуумі (0,1 мм рт. ст., 13,33 Па) доти, поки DMSO (75 мл) не був видалений шляхом дистиляції. Дану суспензію охолоджували до 50°С в атмосфері азоту, і вводили отриману раніше розплавлену реакційну суміш (21,7 г). Реакційну суміш нагрівали при 70°С протягом 2,5 год. при інтенсивному перемішуванні. Екстракт діетилового ефіру вводили у воду і аналізували методом газової хроматографії, виявляючи, що вона містила: 61% 3,4,5,6тетрафторпіколінонітрилу; 31% 3-хлор-4,5,6-трифторпіколінонітрилу; 3,4% 5-хлор-3,5,6трифторпіколінонітрилу і 4,8% 3,5-дихлор-4,6-дифторпіколінонітрилу. Цей результат був сприятливим в порівнянні з типовою чистотою від 38 до 42%, отриманою методом газової хроматографії для неочищеного зразка, коли аналогічну реакцію проводили, використовуючи як вихідний матеріал чистий 3,4,5,6-тетрахлорпіколінонітрил. Приклад 1d Обмін 3,4,5,6-тетрафторпіколінонітрилу під дією LiCl Суміш 3,4,5,6-тетрахлорпіколінонітрилу (12,2 г, 50 ммоль) і 3,4,5,6-тетрафторпіколінонітрил (8,8 г, 50 ммоль) нагрівали до 160°С в атмосфері азоту, отримуючи прозорий розчин. У нього вводили Bu4PCl (0,36 г, 1,2 ммоль). Реакційний розчин витримували при 160°С протягом 15 хвилин перед введенням сухого LiCl (4,2 г, 0,1 моль). Через 60 хвилин вводили додаткову кількість LiCl (2,2 г, 50 ммоль), і реакційну суміш перемішували протягом 11 годин. Газохроматографічний аналіз ефірного екстракту з води визначив суміш 3,6-F2-PN/6-F-PN/C14PN в співвідношенні 8:75:17. Амінування Приклад 2 4-Аміно-3-хлор-5,6-дифторпіколінонітрил 10 UA 105610 C2 5 10 15 20 25 30 35 40 45 Розчин 3-хлор-4,5,6-трифторпіколінонітрилу (200 г) в етилацетаті (EtOAc) (3 л) охолоджували до 10°С. У цей розчин повільно вводили 14% водний розчин гідроксиду амонію (NH4OH) (1296 г), витримуючи температуру в інтервалі від 18 до 23°С. Водний розчин відділяли від органічного розчину. Органічну фазу промивали, використовуючи послідовно розбавлений вдвічі (50/50) насичений водний розчин NaCl і воду (500 мл) і насичений водний розчин NaCl (250 мл). Органічну фазу концентрували у вакуумі при 50°С до об'єму 500 мл для кристалізації продукту. До даної суспензії додавали гептан (1 л), і EtOAc, що залишився, видаляли у вакуумі, отримуючи кінцеву суспензію. Тверду речовину відділяли шляхом фільтрування. Дану тверду речовину промивали пентаном і сушили у вакуумі, отримуючи 4-аміно-3-хлор-5,6дифторпіколінонітрил (173,8 г, 90%, чистота 99,6%) в формі білої кристалічної твердої 13 l речовини; температура плавлення 190-191,5°С; спектр ЯМР C { Н} (101 МГц, DMSO-d6) δ 150,03 (дд, J=232,4, 12,5 Гц, C6), 144,29 (дд, J=11,4, 6,9 Гц, C4), 133,72 (дд, J=257,9, 30,8 Гц, 19 C5), 122,14 (дд, J=19,6, 4,9 Гц, C2), 119,31 (c, C3), 114,25 (c, CN); спектр ЯМР F (376 МГц, DMSO-d6) δ -91,24 (д, J=24,2 Гц), -154,97 (д, J=24,2 Гц); електронно-стимульована мас+ спектрометрія (EIMS) m/z 189 [M]( ). Елементний аналіз. Обчислено для C6H2ClF2N3 (%): C, 38,02; H, 1,06; N, 22,17. Знайдено (%): С, 37,91; Н, 1,00; N, 22,02. Реакція з гідразином Приклад 3 4-Аміно-3-хлор-5-фтор-6-гідразинопіколінонітрил У розчин гідрату гідразину (3,9 г, 78 ммоль) в THF (15 мл) і DMSO (10 мл) вводили 4-аміно-3хлор-5,6-дифторпіколінонітрил (5 г, 26 ммоль) в формі розчину в DMSO (5 мл). Отриманий розчин нагрівали при 65°С протягом 45 хвилин, охолоджували і розбавляли ацетонітрилом (30 мл), осаджуючи продукт в формі світлої жовто-коричневої твердої речовини. Дану тверду речовину сушили у вакуумі при 40°С протягом 3 годин, отримуючи 4-аміно-3-хлор-5-фтор-6гідразинопіколінонітрил (5,1 г, 98%); температура плавлення 215-220°С (розкладання); спектр 13 1 ЯМР C { H} (101 МГц, DMSO-d6) δ 149,34 (д, J=10,5 Гц, C6), 138,28 (д, J=11,6 Гц, C4), 133,81 (д, 19 J=251,6 Гц, C5), 123,74 (д, J=5,3 Гц, C2), 115,87 (c, C3), 112,57 (c, CN); спектр ЯМР F (376 МГц, + DMSO-d6) δ -154,6; електронно-стимульована мас-спектрометрія (EIMS) m/z 203 ([M+Н] ). Елементний аналіз. Обчислено для C6H5ClFN5 (%): C, 35,75; H, 2,50; N, 34,74. Знайдено (%): С, 35,97; Н, 2,70: N, 35,01. Галогенування Приклад 4 4-Аміно-3,6-дихлор-5-фторпіколінонітрил У суспензію 4-аміно-3-хлор-5-фтор-6-гідразинілпіколінонітрилу (9,04 г, 44,8 ммоль) в CH 2Cl2 (150 мл) вводили сульфурилхлорид (7,20 мл, 89 ммоль). Суміш перемішували при кімнатній температурі протягом 40 годин. Розчинник видаляли при зниженому тиску, і залишок розбавляли насиченим водним розчином бікарбонату натрію (NaHCO 3) і EtOAc. Органічну фазу відділяли, сушили над Na2SO4 і фільтрували. Розчин концентрували, і залишок очищали методом хроматографії з силікагелем, отримуючи продукт (7,01 г, 76%) в формі білуватої 1 13 твердої речовини; спектр ЯМР H (300 МГц, DMSO-d6) δ 7,55 (c, 2H); спектр ЯМР C (101 МГц, DMSO-d6) δ 143,26 (д, J=259,2 Гц, C5), 142,69 (д, J=14,0 Гц, C4), 135,53 (д, J=17,6 Гц. C6), 126,07 19 6 (д, J=4,4 Гц, C2), 120,14 (д, J=4,3 Гц, C3), 114,36 (c, CN); спектр ЯМР F (376 МГц, DMSO-d ) δ + 132,30 (с); електронно-стимульована мас-спектрометрія (ESIMS) m/z 203 ([M+Н] ), 206. Гідроліз і етерифікація Приклад 5 Метил-4-аміно-3,6-дихлор-5-фторпіколінат 11 UA 105610 C2 5 10 15 20 25 30 35 40 Концентровану сірчану кислоту (2,0 мл, 37,5 ммоль) повільно вводили в метиловий спирт (8 мл) при охолоджуванні. Потім в розчин вводили 4-аміно-3,6-дихлор-5-фторпіколінонітрил (0,20 г, 0,97 ммоль), і суміш перемішували із зворотним холодильником протягом 29 годин. Розчинник видаляли у вакуумі, залишок виливали на лід і перемішували протягом 15 хвилин. Продукт екстрагували EtOAc (3 рази). Органічні екстракти об'єднували, промивали концентрованим розчином NaCl, сушили над MgSO4, фільтрували і очищали на колонці з силікагелем, отримуючи метил-4-аміно-3,6-дихлор-5-фторпіколінат (0,085 г, 37%) в формі білої твердої 1 13 речовини: спектр ЯМР H (400 МГц, CDCl3) δ 5,08 (c, 2H), 3,97 (c, 3H); спектр ЯМР C (101 МГц, CDCl3) δ 163,57 (c, C=0), 143,29 (д, J=258,1 Гц, C5), 141,73 (д, J=5,1 Гц, C2), 141,05 (д, J=12,7 Гц, 19 C4), 135,32 (д, J=16,8 Гц, C6), 116,26 (c, C3), 53,24 (c, OMe); спектр ЯМР F (376 МГц, CDCl3) δ 135,63 (с). Поєднання Приклад 6a Метил-4-аміно-3-хлор-5-фтор-6-(4-хлор-2-фтор-3-метокси-феніл)піколінат У трьохгорлу колбу об'ємом 250 мл, забезпечену зворотним холодильником, впусканням азоту і термопарою, завантажували метил-4-аміно-3,6-дихлор-5-фторпіколінат (9,965 г, 41,7 ммоль), 2-(4-хлор-2-фтор-3-метоксифеніл)-1,3,2-діоксаборинан (12,74 г, 52,1 ммоль) і KF (4,84 г, 83 ммоль). Додавали ацетонітрил (78 мл) і воду (26 мл). Реакційну суміш продували азотом. Вводили дихлорбіс(трифенілфосфін)паладій(II) Pd(PPh3)2Cl2 (1,477 г, 2,10 ммоль, 5 мол.%), і розчин нагрівали при 70°С в атмосфері азоту протягом 2 годин. Після охолоджування до кімнатної температури осад, що утворився, відфільтровували і промивали водою. Осад розчиняли в EtOAc (приблизно 500 мл) і промивали водою і потім концентрованим розчином NaCl. Органічний шар сушили над MgSO4, і розчинник видаляли за допомогою роторного випарника, отримуючи оранжеву тверду речовину, яку сушили у вакуумній печі при 50°С (11,46 1 г, 76% вихід); температура плавлення 169-170,5°С; спектр ЯМР H (400 МГц, DMSO-d6) δ 7,48 13 (д, J=8,4 Гц, 1H), 7,32 (т, J=7,7 Гц, 1H), 7,15 (c, 2H), 3,96 (c, 3H), 3,90 (c, 3H); спектр ЯМР C 1 { Н}(101 МГц, DMSO-d6) δ 164,85 (с), 153,11 (д, J=252,5 Гц), 146,29 (с), 144,52 (д, J=4,3 Гц), 143,74 (с), 142,75 (дд, J=227,1, 14,0 Гц), 136,38 (д, J=13,4 Гц), 128,58 (д, J=3,2 Гц), 125,87 (с), 125,54 (д, J=3,5 Гц), 122,89 (дд, J=13,8, 4,0 Гц), 113,01 (д, J=3,0 Гц), 61,61 (д, J=4,2 Гц), 52,70 (с); + електронно-стимульована мас-спектрометрія (ESIMS) m/z 364 ([M+Н] ). Елементний аналіз. Обчислено для C14H10Cl2F2N2O3 (%): C, 46,30; H, 2,78; N, 7,71. Знайдено (%): С, 46,60; Н, 2,68; N, 7,51. Приклад 6b 4-Аміно-3-хлор-5-фтор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінонітрил Суміш 4-аміно-3,6-дихлор-5-фторпіколінонітрилу (0,37 г, 1,80 ммоль), 2-(4-хлор-2-фтор-3метоксифеніл)-1,3,2-діоксаборинану (0,549 г, 2,24 ммоль) і KF (0,209 г, 3,59 ммоль) вводили в ацетонітрил (6,75 мл) і воду (2,25 мл). Суміш перемішували і продували азотом. Вводили Pd(PPh3)2Cl2 (63 мг, 0,1 ммоль) і суміш знов продували азотом. Потім розчин нагрівали при 75°С в атмосфері азоту протягом 2 годин. Після охолоджування утворювався осад, який виділяли 12 UA 105610 C2 5 10 шляхом фільтрування, промивали водою і сушили у вакуумі, отримуючи продукт (0,34 г) в формі білуватої твердої речовини. Водну фазу екстрагували EtOAc (3 рази), і об'єднані органічні екстракти промивали концентрованим розчином NaCl, сушили і концентрували. Методом хроматографічного очищення з силікагелем отримували додатковий продукт (0,12 г) в формі 1 білої твердої речовини. Сумарний вихід 78%. Спектр ЯМР H (400 МГц, DMSO-d6) δ 7,50 (дд, 13 1 J=8,5, 1,4 Гц, 1H), 7,45 (c, 2H), 7,33 (дд, J=8,5, 7,2 Гц, 1H), 3,94 (c, 3H); спектр ЯМР C { H} (101 МГц, DMSO-d6) δ 152,97 (д, J=253,2 Гц), 145,73 (д, J=260,8 Гц), 143,82 (д, J=13,7 Гц), 141,83 (д, J=14,7 Гц), 138,45 (д, J=14,8 Гц), 133,93-132,79 (м), 128,93 (д, J=3,3 Гц), 127,74 (с), 126,37-125,10 19 (м), 122,08 (дд, J=13,6, 3,9 Гц), 119,34 (д, J=4,5 Гц), 114,99 (с), 61,61 (с); спектр ЯМР F (376 МГц, DMSO-d6) δ -129,00 (дд, J=28,2, 7,0 Гц, 1F), -133,76 (д, J=28,2 Гц, 1F); електронно+ стимульована мас-спектрометрія (ESIMS) m/z 330,1 ([M+Н] ). ФОРМУЛА ВИНАХОДУ 15 1. Спосіб одержання 4-аміно-3-хлор-5-фтор-6-(заміщеного)піколінату формули І NH2 Cl F OR1 R N O 20 ,I в якій R являє собою (С1-С4)алкіл, циклопропіл, (С2-С4)алкеніл або феніл, що містить від 1 до 4 замісників, які незалежно вибирають з галогену, (С1-С4)алкілу, (С1-С4)галоалкілу, (С1-С4)алкокси або (С1-С4)галоалкокси; і 1 R являє собою (С1-С12)алкіл або незаміщений або заміщений (С7-С11)арилалкіл; який включає наступні стадії: а) фторування 3,4,5,6-тетрахлорпіколінонітрилу (формула А) Cl Cl Cl Cl 25 N CN A джерелом фторид-іонів для одержання 3-хлор-4,5,6-трифторпіколінонітрилу (формула В) F Cl F F N CN , В b) амінування 3-хлор-4,5,6-трифтор-2-піколінонітрилу (формула В) аміаком для одержання 4аміно-3-хлор-5,6-дифторпіколінонітрилу (формула С) NH2 Cl F F 30 N CN , C с) реакцію фторзамісника в положенні 6 4-аміно-3-хлор-5,6-дифторпіколінонітрилу (формула С) з гідразином для одержання 4-аміно-3-хлор-5-фтор-6-гідразинопіколінонітрилу (формула D) 13 UA 105610 C2 NH2 Cl F N H2NNH CN ,D d) галогенування 4-аміно-3-хлор-5-фтор-6-гідразинопіколінонітрилу (формула D) джерелом хлору, брому або йоду для одержання 4-аміно-3-хлор-5-фтор-6-галогенпіколінонітрилу формули Е NH2 Cl F 5 L N CN , E в якій L являє собою Вr, Сl або І; e) гідроліз і етерифікацію 4-аміно-3-хлор-5-фтор-6-галогенпіколінонітрилу формули Е сильною 1 кислотою і спиртом (R OH) для одержання 4-аміно-3-хлор-5-фтор-6-галогенпіколінату формули F NH2 Cl F OR1 L 10 O ,F в якій L і R є такими, як визначено вище; і f) поєднання 4-аміно-3-хлор-5-фтор-6-галогенпіколінату формули F з арил-, алкіл- або алкенілметалоорганічною сполукою формули G 1 R 15 20 N Met , G в якій R є таким, як визначено вище, і Met являє собою Zn-галогенід, Zn-R, три-((С12 3 2 3 С4)алкіл)олово, мідь, або B(OR )(OR ), де R і R незалежно один від одного являють собою водень або (С1-С4)алкіл або спільно утворюють етиленову або пропіленову групу, в присутності каталізатора, що містить перехідний метал, для одержання 4-аміно-3-хлор-5-фтор-6(заміщеного)піколінату формули І. 2. Спосіб за п. 1, в якому поєднання, як на стадії (f), здійснюють перед гідролізом і етерифікацією стадії (e). 3. Вдосконалений спосіб збільшення кількості 3-хлор-4,5,6-трифторпіколінонітрилу, що виділяється (формула В) F Cl F F 25 N CN , В одержаного фторуванням 3,4,5,6-тетрахлорпіколінонітрилу (формула А) Cl Cl Cl Cl N CN A джерелом фторид-іонів, де удосконалення включає наступні стадії: і) виділення повністю фторованого 3,4,5,6-тетрафторпіколінонітрилу (формула Н) 14 UA 105610 C2 F F F F 5 10 N CN H як побічного продукту фторування 3,4,5,6-тетрахлорпіколінонітрилу; іі) реакція виділеного 3,4,5,6-тетрафторпіколінонітрилу (Н) (а) з хлоридом літію (LiCl), (b) з 3,4,5,6-тетрахлорпіколінонітрилом (формула А) в присутності каталізатора міжфазного перенесення або (с) з комбінацією LiCl і 3,4,5,6-тетрахлорпіколінонітрилу для одержання суміші, яку складають переважно 3,4,5,6-тетрахлорпіколінонітрил, монофтортрихлорпіколінонітрил і дифтордихлорпіколінонітрил; і ііі) повернення суміші, яку складають переважно 3,4,5,6-тетрахлорпіколінонітрил, монофтортрихлорпіколінонітрил і дифтордихлорпіколінонітрили в реакцію фторування для одержання 3-хлор-4,5,6-трифторпіколінонітрилу (формула В). 4. Сполука формули NH2 Cl F H2NNH N CN . Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 4-amino-3-chloro-5-fluoro-6-(substituted)picolinates
Автори англійськоюZhu, Yuanming, Whiteker, Gregory, T., Arndt, Kim, E., Renga, James, M., Froese, Robert D.
Автори російськоюЧжу Юаньмин, Уайтекер Грегори Т., Арндт Ким Э., Ренга Джэймс М., Фроуес Роберт Д.
МПК / Мітки
МПК: A61K 31/435, A01N 43/40
Мітки: спосіб, одержання, 4-аміно-3-хлор-5-фтор-6-(заміщених)піколінатів
Код посилання
<a href="https://ua.patents.su/17-105610-sposib-oderzhannya-4-amino-3-khlor-5-ftor-6-zamishhenikhpikolinativ.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 4-аміно-3-хлор-5-фтор-6-(заміщених)піколінатів</a>
Попередній патент: Спосіб одержання аплікаційних срібловмісних композитів на основі волокнистих вуглецевих сорбентів
Наступний патент: Спосіб вимірювання розподілу акустичного тиску на поверхні ультразвукового перетворювача
Випадковий патент: Спосіб роботи машини об'ємного витиснення












