Спосіб одержання 7-хлор-1-алкіл-6-фтор-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової кислоти
Формула / Реферат
1. Спосіб одержання похідної 1,8-нафтиридин-3-карбонової кислоти, який включає у себе:
першу стадію а) проводять реакцію сполуки за наведеною нижче формулою (1)
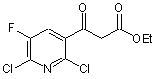 (1)
(1)
з диметилформаміддіалкілацеталем за формулою Me2NCH(OR)2, де R є нерозгалужений, розгалужений або циклічний алкіл, що має від 1 до 9 атомів вуглецю, або є бензил, у розчиннику при наявності кислотного каталізатора, отримуючи сполуку за наведеною нижче формулою (2)
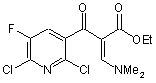 (2);
(2);
другу стадію b) проводять реакцію утвореної сполуки за наведеною нижче формулою (2)
 (2)
(2)
з аміном за формулою YNH2, отримуючи сполуку за наведеною нижче формулою (3)
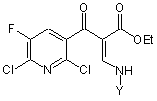 , (3)
, (3)
де Y є нерозгалужений, розгалужений або циклічний алкіл, що має від 1 до 5 атомів вуглецю, і є незаміщеним або заміщеним на галоген, або є феніл, незаміщений чи заміщений галогеном;
третю стадію с) отриману сполуку за наведеною нижче формулою (3)
 , (3)
, (3)
де Y є таким, як визначено вище, піддають циклізації при наявності солі четвертинного амонію та основи, отримуючи естер 1,8-нафтиридин-3-карбонової кислоти за наведеною нижче формулою (4)
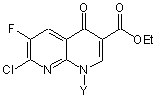 , (4)
, (4)
де Y є таким, як визначено вище; і
четверту стадію d) утворену сполуку за наведеною нижче формулою (4)
 , (4)
, (4)
де Y є таким, як визначено вище, піддають гідролізу при наявності кислоти, отримуючи в результаті похідну 1,8-нафтиридин-3-карбонової кислоти за наведеною нижче формулою (5)
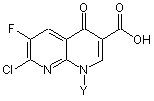 , (5)
, (5)
де Y є таким, як визначено вище,
який відрізняється тим, що зазначені вище стадії проводять методом одного реактора при використанні одного розчинника і без виділення проміжних продуктів.
2. Спосіб за п. 1, який відрізняється тим, що R є метил.
3. Спосіб за п. 1, який відрізняється тим, що як розчинник використовують толуол.
4. Спосіб за п. 1, який відрізняється тим, що диметилформаміддіалкілацеталь за формулою [Ме2NСН(OR)2] використовують у кількості від 1,05 до 1,15 молярних еквівалентів на моль сполуки за формулою (1).
5. Спосіб за п. 1, який відрізняється тим, що на стадії а) як кислотний каталізатор використовують оцтову кислоту в кількості від 0,2 до 0,3 молярних еквівалентів на моль сполуки за формулою (1).
6. Спосіб за п. 1, який відрізняється тим, що аміном за формулою YNH2 є циклопропіламін.
7. Спосіб за п. 1, який відрізняється тим, що амін за формулою YNH2 використовують у кількості від 1,1 до 1,2 молярних еквіваленти на моль сполуки за формулою (1).
8. Спосіб за п. 1, який відрізняється тим, що реакційний розчин після стадії b) додатково промивають водним розчином лимонної кислоти.
9. Спосіб за п. 1, який відрізняється тим, що на стадії с) як основу використовують водний розчин гідроксиду тетрабутиламонію.
10. Спосіб за п. 1, який відрізняється тим, що на стадії d) реакційний розчин гріють зі зворотним холодильником при використанні концентрованого водного розчину соляної кислоти.
Текст
1. Спосіб одержання похідної 1,8-нафтиридин3-карбонової кислоти, який включає у себе: першу стадію а) проводять реакцію сполуки за наведеною нижче формулою (1) O O 3 O F Cl 82127 O OEt N N Y , (4) де Y є таким, як визначено вище, піддають гідролізу при наявності кислоти, отримуючи в результаті похідну 1,8-нафтиридин-3-карбонової кислоти за наведеною нижче формулою (5) O O F Cl OH N N Y , (5) де Y є таким, як визначено вище, який відрізняється тим, що зазначені вище стадії проводять методом одного реактора при використанні одного розчинника і без виділення проміжних продуктів. 2. Спосіб за п. 1, який відрізняється тим, що R є метил. Галузь техніки, до якої належить винахід Даний винахід стосується нового процесу виготовлення 7-хлор-1-циклопропіл-6-фтор-4-оксо1,4-дигідро-1,8-нафтиридин-3-карбонової кислоти. Процес дозволяє шляхом ! проведення низки реакцій згідно зі Схемою 1 так званим „методом одного реактора" одержувати із сировинного етил-3-(2,6-дихлор-5-фторпіридин3-іл)-3-оксопропаноату (1) 7-хлор-1-циклопропїл-6фтор-4-оксо-1,4-дигідро-1,8-нафтиридин-Зкарбонову кислоту (5) високої чистоти. де Υ є нерозгалужений, розгалужений або циклічний алкіл, що має від 1 до 5 атомів вуглецю і є незаміщеним або заміщеним на галоген, або є феніл, незаміщений або заміщений на галоген. Ефективне виготовлення сполуки (5) згідно з наведеною вище Схемою 1 є головною передумовою для економічного виготовлення фторхінолонових антибіотиків, призначених для боротьби з мікробною інфекцією. Відомий раніше процес, описаний у викладеній заявці на патент Японії [JP Laid-Open Hei 3-74231], дозволяє отримувати сполуку (5) за три стадії. На стадії 1 цього процесу проводять реакцію етилового естеру 3-(2,6-дихлор-5-фторпіридин-3іл)-3-оксопропанової кислоти з триетилортоформатом і оцтовим ангідридом, продуктом якої є етиловий естер 2-[(2,6-дихлор-5фторпіридин-3-іл)карбоніл]-3-етоксіакрилової кислоти. 4 3. Спосіб за п. 1, який відрізняється тим, що як розчинник використовують толуол. 4. Спосіб за п. 1, який відрізняється тим, що диметилформаміддіалкілацеталь за формулою [Ме2NСН(OR)2] використовують у кількості від 1,05 до 1,15 молярних еквівалентів на моль сполуки за формулою (1). 5. Спосіб за п. 1, який відрізняється тим, що на стадії а) як кислотний каталізатор використовують оцтову кислоту в кількості від 0,2 до 0,3 молярних еквівалентів на моль сполуки за формулою (1). 6. Спосіб за п. 1, який відрізняється тим, що аміном за формулою YNH2 є циклопропіламін. 7. Спосіб за п. 1, який відрізняється тим, що амін за формулою YNH2 використовують у кількості від 1,1 до 1,2 молярних еквіваленти на моль сполуки за формулою (1). 8. Спосіб за п. 1, який відрізняється тим, що реакційний розчин після стадії b) додатково промивають водним розчином лимонної кислоти. 9. Спосіб за п. 1, який відрізняється тим, що на стадії с) як основу використовують водний розчин гідроксиду тетрабутиламонію. 10. Спосіб за п. 1, який відрізняється тим, що на стадії d) реакційний розчин гріють зі зворотним холодильником при використанні концентрованого водного розчину соляної кислоти. На стадії 2 проводять реакцію вищезазначеного продукту стадії 1 з циклопропіламіном. На стадії 3 утворений на стадії 2 циклопропіленамін піддають циклізації гідридом натрію, отримуючи нафтиридиновий естер. Недоліком цього процесу було те, що на кожній з його стадій доводилося відділяти проміжні продукти реакцій, що значно його ускладнювало і знижувало вихід корисного продукту. Інший процес одержання сполуки (5) був описаний у викладеній заявці на патент Японії [JP Laid-Open 2002-155081]. Цей процес був більш досконалим, ніж описаний вище процес згідно з викладеною заявкою на патент Японії [JP LaidOpen Неі 3-74231], і на всіх його трьох стадіях проводився з одним і тим самим розчинником без операцій відділяння проміжного продукту. Більш докладно, стадії його проводилися таким чином. Стадія 1. Проводили реакцію сполуки (1) з триетилортоформатом під нагрівом при наявності ангідриду оцтової кислоти з одночасним видаленням побічних продуктів етанолу й оцтової кислоти. По завершенні реакції триетилортоформатний залишок треба було повністю відганяти під зниженим тиском для запобігання утворенню побічного продукту на наступній стадії. Стадія 2. Отриманий описаним вище шляхом залишок охолоджували і розчиняли в толуолі. До цього розчину по краплях додавали циклопропіламін і в результаті отримували енамінову сполуку. 5 Стадія 3. До розчину енамінової сполуки додавали каталітичну кількість тетрабутиламонійброміду і після цього для циклізації - водний розчин гідроксиду натрію. Кристалізований естер нафтиридин-3-карбонової кислоти фільтрували, промивали сушили і піддавали гідролізу. У результаті отримували сполуку (5) із загальним виходом приблизно 85%. Цей процес мав ту перевагу, що при виготовленні нафтаридинового естеру він не потребував відділяння проміжних продуктів. Але при цьому він також мав недолік, який полягав в такому. Реакція Стадії 1 є добре відомою із ряду публікацій і широко застосовується як загальний метод, див. [WO 89/06649, ЕР 0 160 578 А]. Але у промисловому виробництві на цій стадії виникає дві проблеми. По-перше, по завершенні реакції, триетилортоформат повинен ретельно видалятися шляхом відгонки під зниженим тиском. Ця операція потребує багато часу. По-друге, якщо триетилортоформат не видалений повністю, то решта його, що залишилася, реагує з продуктом наступної стадії, циклопропіламіном, утворюючи побічний продукт, видалити який дуже важко. У результаті досліджень, проведених авторами даного винаходу щодо вирішення проблем цитованої вище викладеної заявки на патент Японії [JP Laid-Open 2002-155081], було знайдено, що предмет даного винаходу, похідна 1,8-нафтиридин-З-карбонової кислоти, може бути виготовлена з високим виходом і чистотою за короткий період часу за допомогою простого процесу, який не потребує проведення складних операцій і в якому на першій стадії замість триетилортоформату використовується диметилформамід-діалкілацеталь. У відповідності з цим процесом, виготовлення проміжних продуктів (2), (3) і (4) проводять в одному реакторі, використовуючи один і той самий розчинник і не застосовуючи операцій відділяння проміжних продуктів. Нижче суть винаходу поясняється більш докладно з ілюстрацією на прикладах його практичного здійснення. Кращий варіант здійснення винаходу Даний винахід стосується процесу виготовлення похідної 1,8-нафтиридин-3карбонової кислоти, що описується формулою (5), методом одного реактора з одним розчинником і без відділяння проміжних продуктів. a) На першій стадії цього процесу проводять реакцію сполуки за формулою (1) 82127 6 наявності кислотного каталізатора, отримуючи сполуку за формулою (2): b) На другій стадії процесу за даним винаходом проводять реакцію отриманої сполуки за формулою (2) з аміном за формулою YNH2, одержуючи сполуку за формулою (3) де Υ є нерозгалужений, розгалужений або циклічний алкіл, що має від 1 до 5 атомів вуглецю і є незаміщеним або заміщеним на галоген, або є феніл, незаміщений або заміщений на галоген. c) На третій стадії процесу за даним винаходом отриману сполуку за формулою (3) де Υ є таким, як визначено вище, піддають циклізації при наявності солі четвертинного амонію й основи, в результаті чого одержують естер 1,8-нафтиридин-З-карбонової кислоти за формулою (4), де Υ є таким, як визначено вище. з диметилформамід-діалкілацеталем за формулою Me2NCH(OR)2 (де R є нерозгалужений, розгалужений або циклічний алкіл, що має від 1 до 9 атомів вуглецю, або бензил) у розчиннику при 7 82127 d) На четвертій стадії процесу за даним винаходом одержану сполуку за формулою (4) де Υ є таким, як визначено вище, піддають гідролізу при наявності кислоти, одержуючи в результаті похідну 1,8-нафтиридин-3-карбонової кислоти, що описується формулою де Υ є таким, як визначено вище. Далі кожна із вищеописаних проілюстрована більш докладно. 8 молярного еквівалента, ще краще - від 0,2 до 0,3 молярного еквівалента на моль сполуки (1). На стадії а) сполука (1), диметилформаміддіалкілацеталь, кислотний каталізатор і розчинник можуть об'єднуватися між собою в будь-якому порядку, вигідному для даного процесу, оскільки порядок їх об'єднання не впливає на реакцію. Температура реакції на цій стадії лежить у межах від 0 до 50 °С, краще - від 10 °С до 40 °С і ще краще - від 20 °С до ЗО °С. У найкращому варіанті на стадії а) згідно з даним винаходом проводять реакцію сполуки (1) з 1,05-1,15 молярним еквівалентом диметилформамід-диметилацеталю і 0,2-0,3 молярного еквівалента оцтової кислоти у 6 шестикратній кількості (об./мас.) толуолу відносно кількості сполуки (1) при температурі від 20 °С до 30 °С . Енамінова структура, показана у сполуки (2), утвореної на стадії а), може мати змішану Ε/Ζ форму, причому даним винаходом охоплюються обидві ці форми. стадій acid catalyst - кислотний каталізатор По-перше, розчинник, що використовується на стадіях від а) до d), є галогенізованим алканом або ароматичним вуглеводнем. Галогенізованими алкановими розчинниками можуть бути, наприклад, хлористий метилен, 1,2-дихлоретан та інші. Розчинниками із ароматичних вуглеводнів можуть бути, наприклад, бензол, хлорбензол, 1,2дихлорбензол, толуол, ксилол та інші, кращими серед яких є 1,2-дихлорбензол і толуол. Розчинник використовують у кількості, що відповідає співвідношенню від 3 до 15 (об./мас), краще - від 4 до 10 (об./мас.) і ще краще - 6 (об./мас.) відносно кількості сполуки (1). Компонентом R у диметилформаміддіалкілацеталі [Me2NCH(OR)2], що є одним із реагентів, можуть бути, наприклад, метил, етил, пропіл, ізопропіл, бутил, t-бутил, неопентил, бензил, циклогексил і т.д, кращими серед яких є метил, етил, ізопропіл і т.д., а ще кращим ε метил. Диметилформамід-діалкілацеталь використовується в кількості від 1 до 3 молярних еквівалентів, краще - від 1 до 1,5 молярного еквівалента, і ще краще - від 1,05 до 1,15 молярного еквівалента на моль сполуки (1) Підходящими для ролі кислотного каталізатора карбоновими кислотами можуть бути, наприклад, оцтова, пропіонова, бутанова кислоти та інші, кращою серед яких є оцтова кислота. При цьому, наприклад, оцтова кислота використовується в кількості від 0,05 до 0,6 молярного еквівалента, краще - від 0,1 до 0,4 До сирої реакційної суміші сполуки (2), одержаної на стадії а), додають амін за формулою ΥΝΗ2. У цій формулі аміну компонентом Υ є заміщений або незаміщений алкіл, наприклад, метил, етил, пропіл, ізопропіл, бутил, втор-бутил, трет-бутил, пентил та інші. Серед них кращими є алкіли з нерозгалуженим або розгалуженим ланцюгом із 1 - 4 атомів вуглецю і, зокрема, метил, етил і пропіл. У випадку галоїд-заміщених алкільних груп, галоїдним компонентом можуть служити фтор, хлор, бром, йод та ін., серед яких кращими є фтор і хлор. Зокрема, галогензаміщеними алкільними групами можуть бути хлорметил, 2-хлоретил, фторметил, 1-фторетил, 2-фторетил і т.д., серед яких кращими є фторметил і 2-фторетил. Серед циклічних алкілів можуть використовуватися циклопропіл, циклобутил, циклопентил, циклогексил і т.д. При цьому циклічні алкіли можуть бути заміщеними на галоген, наприклад, фтор, хлор, бром або йод, серед яких кращими в будь-якому положенні є хлор і фтор. Серед кращих циклічних алкілів можна назвати, наприклад, 2-фторциклопропіл, 2,2-дифторциклопропіл, 2-хлор-2-фторциклопропіл і т.д., а серед більш кращих циклічних алкілів можна назвати, наприклад, циклопропіл або 2хлор-2-фторциклопропіл та інші. Крім того, серед незаміщених або заміщених на галоген фенілів підходящими можна назвати феніл і 2,4дифторфеніл, серед яких кращим є 2,4дифторфеніл. Для застосування в даному винаході найкращим є циклопропіл. При виготовленні сполуки за формулою (3) із зазначеного вище аміну, амін за формулою YNH2 використовують у кількостях від 0,9 до 2 молярних еквівалентів, у кращому варіанті - від 1,0 до 1,5 молярного еквівалента, ще краще - від 1,1 до 1,3 9 молярних еквівалента, а в найкращому - від 1,1 до 1,2 молярного еквівалента на моль сполуки (1). У цій реакції для вигідності змішування шляхом перемішування певна кількість розчинника може додаватися до реакційного розчину протягом усіх стадій, а кількість розчинника - відповідати співвідношенню 0:1 - 5:1 (об./мас.) відносно кількості сполуки (1), але з погляду на швидкість реакції і реакційний об'єм розчинник все ж додавати не є бажаним. При цьому температура реакції лежить у межах від 0 до 50 °С, краще - від 10°С до 40°С, і ще краще - від 20°С до 30°С . Розчин, що містить сполуку за формулою (3), отриману за допомогою описаної вище реакції, містить спирт, утворений як побічний продукт, непрореагований YNH2 і вивільнений зі сполуки за формулою (2) диметиламін. Таким чином, бажано ці побічні продукти і непрореаговані речовини видаляти. З погляду на це, для виведення видалених амінових похідних та їх солей у водний шар застосовують промивання розбавленим водним розчином кислоти. Використовуваний при цьому водний розчин кислоти може бути приготований із неорганічної кислоти, наприклад, розбавленої сірчаної кислоти, розбавленої соляної кислоти, розбавленої фосфорної кислоти або гідросульфату калію і т.д., або ж із органічної кислоти, наприклад, винної або лимонної. Величина рН при промиванні лежить у межах від 1 до 6, краще - від 2 до 5, і ще краще - від 3 до 4. Більш прийнятною для промивання є органічна кислота, наприклад, винна, лимонна або інша органічна кислота. При цьому найкращою серед них є лимона кислота. При використанні лимонної кислоти концентрація її у водному розчині складає від 3 до 30%, краще - від 5 до 20% і ще краще - від 10 до 15%. Температура при промиванні лежить у межах від 10°С до 50°С, краще - від 25°С до 45°С, і ще краще - від 30°С до 40°С. Промивання можна проводити один або декілька разів, а якщо використовується зазначена вище бажана концентрація лимонної кислоти при відповідній температурі, то достатнім є однократне промивання. Після розділяння шарів розчину відділений органічний шар може в разі необхідності промиватися більше одного разу нейтральною водою. Стадія с) Сиру сполуку (3) у відділеному органічному шарі, отриманому на стадії Ь), піддають циклізації при наявності солі четвертинного амонію та основи, отримуючи сполуку за формулою (4). Компонент R у формулі солі четвертинного амонію (R4NX), використовуваній на даній стадії, являє собою нерозгалужений або розгалужений алкіл, що має від 1 до 18 атомів вуглецю, або бензил, та ін.; чотири компоненти R можуть бути однаковими або різними; Χ ε галоген, HSO4 або радикал гідроксилу, де галогеном є хлор, бром, йод і т.д. Як сіль четвертинного амонію на стадії с) 82127 10 згідно з даним винаходом у загальному випадку можуть використовуватися сіль бензилтриалкіламонію, сіль тетраметиламонію, сіль тетраетиламонію, сіль тетрабутиламонію, або продукти під марками "Aliquat 336," "Adogen 464," і т.д. У кращому варіанті використовують хлорид, бромід чи йодид бензилтриетиламонію, або хлорид, бромід чи йодид тетраетиламонію, або хлорид, бромід чи йодид тетрабутиламонію. У більш кращому варіанті використовується бромід тетрабутиламонію. Проте, в разі потреби використовуватися може будь-який із перелічених вище видів солей четвертинного амонію. Сіль четвертинного амонію може використовуватися у твердій формі або у формі водного розчину в кількостях від 0,001 до 1 молярного еквівалента, краще - від 0,01 до 0,1 молярного еквівалента, і ще краще - від 0,03 до 0,05 молярного еквівалента на моль сполуки (1). Якщо компонентом X у використовуваній тут солі четвертинного амонію (R4NX) є галоген або HSO4, то дуже важливо використовувати основу, а якщо X є гідроксил, то як основа діє сама сіль четвертинного амонію, і використовувати в такому випадку надлишкову основу не обов'язково. Підходящими для застосування видами основ є водні розчини гідроксиду літію, гідроксиду натрію, гідроксиду калію, карбонату літію, карбонату натрію, гідрокарбонату натрію, гідрокарбонату калію, гідроксиду четвертинного амонію і т.д. Кращими серед них є гідроксид натрію і гідроксид калію, а найкращим є гідроксид натрію. Використовувана на цій стадії кількість основи складає від 0,9 до 1,5 молярного еквівалента, краще - від 1,0 до 1,3 молярного еквівалента, ще краще - від 1,1 до 1,2 молярного еквівалента на моль сполуки (1) З іншого боку, водний розчин гідроксиду четвертинного амонію може використовуватися замість суміші солі четвертинного амонію й основи. У цьому випадку, кількість водного розчину гідроксиду четвертинного амонію може складати від 0,9 до 1,5 молярних еквівалентів, краще - від 1,0 до 1,3 молярних еквівалентів, і ще краще - від 1,05 до 1,15 молярних еквівалентів на моль сполуки (1). Температура реакції при цьому лежить в інтервалі від 10 до 60°С , краще - від 20 до 50°С , і ще краще - від 25 до 35°С . І нарешті, циклізація проміжного продукту (3) на (4) проводиться за короткий період часу при навколишній температурі і забезпечує більші продуктивність і чистоту продукту порівняно з відомими процесами. До реакційної суміші, що містить сполуку (4), одержану на Стадії с), додають водний розчин кислоти, і суміш гріють для проведення гідролізу естерної групи, а утворену кристалічну речовину відфільтровують, отримуючи таким чином сполуку (5). 11 Для гідролізу використовують соляну або сірчану кислоту, серед яких кращою є концентрована соляна кислота. Кількість кислоти при цьому складає від 1,5 до 9 молярних еквівалентів, у кращому варіанті - від 3 до 6 молярних еквівалентів, і в ще кращому - від 4 до 5 молярних еквівалентів на моль сполуки (1). Зокрема, у випадку використання соляної кислоти концентрація її водного розчину може лежати в межах від 10 до 35%. У кращому варіанті використовують 35% водний розчин соляної кислоти. Дана реакція може проводитися при температурі від кімнатної до 120°С, у кращому варіанті - від 60°С до 120°С, і в ще кращому - від 110°С до 120°С. По завершенні реакції, реакційний розчин охолоджують, а утворену тверду речовину відфільтровують, промивають водою та органічним розчинником. Утворений у результаті корж фільтрату просушують і отримують сполуку (5) високої чистоти. Загальний вихід чотирьох стадій цього процесу звичайно складає не менше 90%. Я показано вище, даний винахід має такі переваги: всі стадії запропонованого процесу проводяться в одному реакторі без відділяння проміжних продуктів, утворюваних на кожній стадії, і без заміни або додавання розчинника. Оскільки такі операції, як відділяння, заміна розчинника, заміна реактора, промивання реактора і т.д., тут виконувати не потребується, даний винахід дозволяє виготовляти сполуку (5) високоефективним і простим шляхом з точки зору часового циклу процесу, а також виходу і якості продукту. Нижче наведено приклади, що ілюструють подальші варіанти здійснення винаходу. При цьому слід зауважити, що дані приклади лише ілюструють винахід, жодним чином не обмежуючи його об'єму. Приклад 1 Приготування 7-хлор-1 -циклопропіл-б-фтор-4оксо-і ,4-дигідро-1,8-нафтиридин-3-карбонової кислоти (при використанні гідроксиду тетрабутиламонію) До перемішуваного розчину етилового естеру 3-(2,6-дихлор-5-фторпіридин-3-іл)-3оксопропанової кислоти (сполука (1): 10,0г, 35,7ммоль) у толуолі (60 мл) при кімнатній температурі додали диметилформаміддиметилацеталь (4,68г, 39,3ммоль) і оцтову кислоту (0,53г, 8,9ммоль). Суміш перемішали при кімнатній температурі протягом 30 хвилин. Після того, як етиловий естер 3-(2,6-дихлор-5фторпіридин-3-іл)-3-оксопропанової кислоти (сполука (1)) повністю зник (моніторинг за допомогою рідинної хроматографії високої розрізнювальної спроможності (HPL.C)), додали циклопропіламін (2,24г, 39,3ммоль), і суміш перемішали протягом 30 хвилин. Після повного зникнення сполуки (2) (HPLC моніторинг), реакційну суміш промили 10% водним розчином лимонної кислоти. Після розділяння шарів відділений органічний шар промили дистильованою водою і до розчину додали 25% 82127 12 водний розчин гідроксиду тетрабутиламонію (40г, 39,3ммоль). Розчин перемішали протягом 1 години. Після того, як сполука (3) повністю зникла (HPLC моніторинг), до реакційного розчину додали концентровану соляну кислоту (14,7мл, 146ммоль), і суміш гріли зі зворотним холодильником протягом 10 годин. Реакційний розчин охолодили, профільтрували, промили ізопропанолом, дистільованою водою, знов ізопропанолом і просушили, одержавши зазначену в заголовку сполуку (5) (9,4г) у вигляді білих кристалів. Загальний вихід: 93,1% Чистота (HPLC): 98,6%. Приклад 2 Виготовлення 7-хлор-1 -циклопропіл-б-фтор-4оксо-і ,4-дигідро-1,8-нафтиридин-3-карбонової кислоти [використовуючи гідрохлорид тетрабутиламонію і гідроксид натрію] Використовуючи як вихідний матеріал етиловий естер 3-(2,6-дихлор-5-фторпіридин-3-іл)3-оксопропанової кислоти (сполука (1): 100г, 35,7ммоль) у толуолі (70 мл) і дотримуючись процесу, описаного у Прикладі 1, була одержана сполука (3). До приготованого розчину сполуки (3) в толуолі додали дистільовану воду (10мл), а потім 40% водного розчину гідроксиду тетрабутиламонію (2,32г, 3,57ммоль) і для циклізації реакційного розчину - 10N розчин гідроксиду натрію (3,93мл, 39,3ммоль). Через 1,3 години до реакційного розчину додали концентровану соляну кислоту (16,7мл), і суміш гріли зі зворотним холодильником протягом 8 годин для гідролізу суміші. Реакційний розчин охолодили, а утворений твердий продукт відфільтрували, промили за такою самою процедурою, як у Прикладі 1, і просушили, одержавши зазначену в заголовку сполуку (5) (9,3г) у вигляді білих кристалів. Загальний вихід: 92,1% Чистота (HPLC): 99,9%. Приклад 3 Виготовлення 7-хлор-1 -циклопропіл-б-фтор-4оксо-і ,4-дигідро-1,8-нафтиридин-3-карбонової кислоти До перемішуваного розчину етилового естеру 3-(2,6-дихлор-5-фторпіридин-3-іл)-3оксопропанової кислоти (сполука (1): 85,0кг, 303моль) у толуолі додали (808кг) Me2NCH(OMe) (40,8кг) і оцтову кислоту (4,56кг). Суміш перемішали при кімнатній температурі протягом 50 хвилин. До реакційної суміші додали циклопропіламін (22,53 кг) і суміш перемішали при температурі 25-35°С протягом 50 хвилин. Далі реакційну суміш промили 10% водним розчином лимонної кислоти, а потім водою. Після розділяння шарів, водний шар видалили, а до відділеного органічного шару додали бромід тетрабутиламонію (4,88кг) і 25% водний розчин гідроксиду натрію (53кг). Утворену таким чином суміш перемішували протягом 2 годин. Додали до неї 35% водний розчин соляної кислоти (142кг), і утворену суміш гріли зі зворотним холодильником. Приблизно через 8 годин реакційну суміш охолодили, і до неї додали воду (приблизно 50кг). 13 Після цього водний шар відділили. Реакційний розчин промили водою, а наявну у відділеному органічному шарі тверду сполуку відфільтрували і промили ізопропанолом, водою і знов ізопропанолом. Після висушування цього твердого продукту під вакуумом одержали зазначену в заголовку сполуку (77кг) у вигляді білих кристалів. Загальний вихід: 90% Чистота (HPLC): 99,9%. 82127 14
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing 7-chloro-1-cyclopropyl-6-fluoro-4-oxo-1,4-dihydro-1,8-naphthyridine-3-carboxylic acid
Автори англійськоюShin Hyun-Ik, Chang Jay-Hyok, Lee Kyu-Woong
Назва патенту російськоюСпособ получения 7-хлор-1-алкил-6-фтор-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоновой кислоты
Автори російськоюШин Хьюн-Ик, Чанг Джай-Хьок, Ли Кью-Воонг
МПК / Мітки
МПК: C07D 471/04
Мітки: спосіб, одержання, кислоти, 7-хлор-1-алкіл-6-фтор-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової
Код посилання
<a href="https://ua.patents.su/7-82127-sposib-oderzhannya-7-khlor-1-alkil-6-ftor-4-okso-14-digidro-18-naftiridin-3-karbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 7-хлор-1-алкіл-6-фтор-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової кислоти</a>
Попередній патент: Спосіб змащування підшипникових вузлів та пристрій для централізованого змащування
Наступний патент: Високоміцна опалубка для бетонування стін
Випадковий патент: Фурма для обробки рідкого розплаву металу