Дималеат 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(n,n-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((s)-тетрагідрофуран-3-ілокси)хіназоліну, спосіб його одержання та застосування
Номер патенту: 91401
Опубліковано: 26.07.2010
Автори: Кулінна Крістіан, Зігер Петер, Зойка Райнер, Ралль Вернер, Шнаубельт Юрген
Формула / Реферат
1. Спосіб одержання дималеату 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3-ілокси)хіназоліну, який включає наступні стадії:
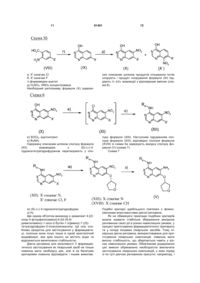
а) сполуку загальної формули (V)
 (V)
(V)
піддають у відповідних розчинниках після відповідної активації взаємодії з ді-(С1-С4алкіл)фосфонооцтовою кислотою та
б) одержану таким шляхом сполуку загальної формули (VI)
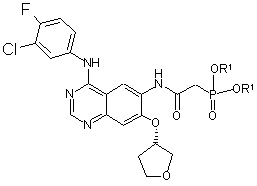 , (VI)
, (VI)
у якій R1 означає прямоланцюжкову або розгалужену С1-С4алкільну групу, піддають взаємодії з альдегідом формули
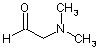
або з відповідним еквівалентом альдегіду з використанням придатних для цих цілей органічних або неорганічних основ,
в) одержаний таким шляхом 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3-ілокси)хіназолін переводять взаємодією, що проводять при нагріванні, з малеїнової кислотою у відповідному розчиннику в дималеат.
2. Спосіб за п. 1, який відрізняється тим, що як розчинник використовують етанол або ізопропанол, необов'язково при додаванні води.
3. Спосіб за п. 1 або 2, який відрізняється тим, що використовують щонайменше 2 еквіваленти малеїнової кислоти.
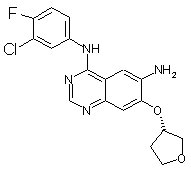
4. Дималеат 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3-ілокси)хіназоліну.
5. Лікарський засіб, який містить дималеат 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3-ілокси)хіназоліну та необов'язково один або декілька інертних носіїв і/або розріджувачів.
6. Застосування дималеату 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3-ілокси)хіназоліну для одержання лікарського засобу, призначеного для лікування доброякісних і злоякісних пухлин, для попередження та лікування захворювань дихальних шляхів і легенів, а також для лікування захворювань шлунково-кишкового тракту, жовчних шляхів і жовчного міхура.
Текст
1. Спосіб одержання дималеату 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3ілокси)хіназоліну, який включає наступні стадії: а) сполуку загальної формули (V) 3 91401 4 джувачів. 6. Застосування дималеату 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3ілокси)хіназоліну для одержання лікарського засо бу, призначеного для лікування доброякісних і злоякісних пухлин, для попередження та лікування захворювань дихальних шляхів і легенів, а також для лікування захворювань шлунково-кишкового тракту, жовчних шляхів і жовчного міхура. Даний винахід стосується вдосконаленого способу одержання амінокротонільних сполук, таких, наприклад, як 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3ілокси)хіназолін, і їх фізіологічно сумісних солей, насамперед дималеату 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(N,N[-диметиламіно)-1оксо-2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3 ілокси)хіназоліну, а також дималеату 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3ілокси)хіназоліну та його застосування для одержання лікарських засобів. 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,Nдиметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((5)тетрагідрофуран-3-ілокси)хіназолін має наступну структурну формулу і вже відомий з заявки WO 02/50043, де описуються сполуки з цінними фармакологічними властивостями, до яких насамперед належать інгібуюча дія на опосередковувану тирозинкіназами трансдукцію сигналів та інгібуюча дія на опосередковувану рецептором епідермального фактора росту (EGF-R) трансдукцію сигналів. Тому сполуки такого типу придатні для лікування певних захворювань, насамперед для лікування онкологічних захворювань, захворювань легень і дихальних шляхів, так само як і захворювань шлунковокишкового тракту, а також жовчних шляхів і жовч ного міхура. У заявці WO 02/50043 пропонується спосіб одержання амінокротонільних сполук (IV), таких, наприклад, як 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4(N,N[-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7((5)-тетрагідрофуран-3-ілокси)хіназолін, який полягає у тому, що зазначені сполуки одержують за реакцією, яку проводять у одному апараті, з відповідного анілінового структурного фрагмента (II), бромкротонової кислоти (III), оксалілхлориду та вторинного аміну (див. схему 1) 5 Цей спосіб забезпечував максимум 50%-вий вихід продукту. Крім того, передбачалося, як правило, очищення за допомогою колоночної хроматографії. Тому можливість реалізації даного способу одержання 4-[(3-хлор-4-фторфеніл)аміно]-6{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}7-((S)-тетрагідрофуран-3-ілокси)хіназоліну в промисловому масштабі виключалася. Ще один недолік запропонованого підходу полягав у тому, що необхідна для його здійснення бромкротонова кислота не поставляється на ринок у великих кількостях, а відповідний метиловий ефір бромкротонової кислоти доступний лише з 80%-вим ступенем чистоти. Ці фактори також не дозволяють застосовувати спосіб одержання 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3ілокси)хіназоліну в промисловому масштабі. З урахуванням вищеописаних недоліків відомого способу в основу даного винаходу було покладене завдання запропонувати спосіб, що забезпечував би одержання амінокротонілариламідів, насамперед 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7((S)-тетрагідрофуран-3-ілокси)хіназоліну, з використанням легкодоступних вихідних речовин, з високим ступенем чистоти та без значних виробничих витрат. Таким чином, новий спосіб призначається для здійснення синтезу в промисловому масштабі та тим самим для одержання комерційно доступних продуктів. Зазначене завдання вирішується за допомогою пропонованого у винаході способу одержання 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(N,Nдиметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((S)тетрагідрофуран-3-ілокси)хіназоліну та інших амінокротонільних сполук. Поряд із промисловою 91401 6 застосовністю пропонованого у винаході синтезу, що забезпечує високий вихід, до його інших переваг варто віднести винятково високу хімічну чистоту одержуваних продуктів і низький вміст цисізомерів, що становить менше 0,1%. Відповідно до пропонованого у винаході способу відповідну аміноарильну сполуку формули (V) піддають взаємодії з ді-(C1С4алкіл)фосфонооцтовою кислотою, переважно з діетилфосфонооцтовою кислотою, у придатних для цих цілей розчинниках, після відповідної активації, краще 1,1-карбонілдіімідазолом, 1,1карбонілдитриазолом або ангідридом пропанфосфонової кислоти, особливо бажано 1,1карбонілдіімідазолом, як це показано на схемі 2. Як розчинники можуть використовуватися, наприклад, тетрагідрофуран (ТГФ), диметилформамід (ДМФ) та етилацетат. Активацію можна проводити з використанням всіх звичайних методів амідного приєднання, тобто, наприклад, за допомогою 1,1карбонілдіімідазолу, 1,1-карбонілдитриазолу, ДЦК (N,N-дициклогексилкарбодііміду), ДЕК (N'(диметиламінопропіл)-N-етилкарбодііміду), ТБТУ (тетрафторборату O-(бензотриазол-1-іл)-N,N,N',N'тетраметилуронію)), тіазолідин-2-тіону або переведенням у відповідний хлорангідрид кислоти, наприклад, за допомогою тіонілхлориду. За певних умов активацію проводять з використанням органічних основ, таких як триетиламін або піридин, при цьому додатково можна додавати ДМАП (диметиламінопіридин). Як розчинники в цих випадках прийнятні ДМФ, ТГФ, етилацетат, толуол, хлоровані вуглеводні або їх суміші. У наведені нижче формулах замісники мають наступні значення: X означає метанову групу або атом азоту, 7 91401 8 Rа означає бензильну, 1-фенілетильну або 3хлор-4-фторфенільну групу та R1 означає С1-С4алкільну групу з прямим або розгалуженим ланцюгом. Пропонований у винаході спосіб краще вико ристовувати для одержання сполук, у яких X означає атом азоту, Ra означає 3-хлор-4-фторфенільну групу та R1 означає етильну групу. а) Ді-(С1-С4алкіл)фосфонооцтова кислота, активатор Одержаний описаним шляхом з високим виходом і високим ступенем чистоти ариламід формули (VI) піддають за реакцією Віттига-ХорнераЕммонса взаємодії з 2-аміноацетальдегідом з використанням відповідних органічних або неорганічних основ (схема 3). Цю реакцію можна проводити безпосередньо після одержання сполуки формули (VI) або після її виділення, наприклад шляхом осадження додаванням, наприклад, третбутилметилового ефіру. До придатних для зазначеної мети основ належать серед інших ДБН (1,5діазабіцикло[4.3.0]нон-5-ен), гідроксид натрію та гідроксид калію, кращими з яких є гідроксид натрію та гідроксид калію, особливо кращий гідроксид калію. Замість альдегіду можна використовувати також відповідний еквівалент, наприклад гідрат або ацеталь, з якого альдегід вивільняють (попередньо або in situ). б) Альдегід, основа, ТГФ/вода Як ацеталі можуть використовуватися, наприклад, сполуки наступної загальної формули: ілокси)хіназолін формули (І), можна потім за відомою методикою переводити в його солі, насамперед у його фізіологічно сумісні солі. Краще переведення у фумарати, тартрати або малеати. Особливо кращим є дималеат 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3ілокси)хіназоліну структурної формули (Ia) і відповідно переведення 4-[(3-хлор-4-фторфеніл)аміно]6-{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1іл]аміно}-7-((S)-тетрагідрофуран-3ілокси)хіназоліну в його дималеат, як це показано на схемі 4. Із цією метою сполука формули (І) розчиняють у відповідному розчиннику, такому, наприклад, як метанол, ізопропанол, н-бутанол або етанол, необов'язково з додаванням води, краще у етанолі, і при нагріванні змішують із кристалічною малеїновою кислотою або з розчином малеїнової кислоти. При використанні як розчинник етанолу краще працювати при температурі в інтервалі від 60 до 75 C з використанням розчину малеїнової у якій кожний з R2-R5 означає прямоланцюжкову або розгалужену С1-С4алкільну групу, при цьому такі залишки можуть бути ідентичними або різними. У кращому варіанті кожний з R3 та R4 означає метальну групу, а кожний з R2 та R5 означає етильну групу. Одержаний описаним шляхом амінокротонілариламід формули (VII), наприклад, 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-N,N-диметиламіно)-1-оксо2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3 9 91401 10 кислоти в етанолі. Умови реакції доцільно вибирати з таким розрахунком, щоб забезпечити максимально швидке викристалізування необхідної солі. Краще використовувати приблизно 2 еквіваленти малеїнової кислоти. Після початку кристалізації суміш охолоджують до кімнатної температури, перемішують та відокремлюють кристалізат, що утворився, який являє собою сполуку формули (Ia) Схема 4 в) Малеїнова кислота, етанол Вихідну сполуку формули (V) можна одержувати, наприклад, відповідно до наступних методів, відомих з літератури. Хінолінові структурні фрагменти формули (V), у якій X означає CH, можна одержувати виходячи з доступного як комерційний продукт 3-фтору-6нітрофенолу формули (XIV) шляхом алкілування, обміну атома фтору на аміногрупу та взаємодією з ефірами етоксіакрилової кислоти, ефірами етоксиметиленціаноцтової кислоти або ефірами етоксиметиленмалонової кислоти (схема 5а). Потім одержану описаним шляхом сполуку формули (XVII) переводять у сполуку формули (XVIII), як це показано на схемі 6 на прикладі аналога хіназоліну. При одержанні сполуки формули (V), де X означає N, працюють у такий спосіб: Виходячи з доступної як комерційний продукт 4-хлорантранілової кислоти (формула VIII, X означає Cl), взаємодією з формамідин-ацетатом одер жують хіназолінон формули (IX), який потім нітрують з використанням сірчаної кислоти та концентрованої азотної кислоти (схема 5б). В іншому варіанті можна виходити з 4-фторантранілової кислоти. 11 91401 12 а: X' означає Cl б: X' означає F г) формамідин-ацетат д) H2SO4, HNO3 концентрована Необхідний регіоізомер формули (X) одержа них описаним шляхом продуктів нітрування потім хлорують і продукт хлорування формули (XI) піддають in situ взаємодії з відповідним аміном (схема 6). е) SOCl2, ацетонітрил є) R3NH2 Одержану описаним шляхом сполуку формули (XII) взаємодією з (S)-(+)-3гідрокситетрагідрофураном перетворюють у спо луку формули (XIII). Наступним гідруванням сполуки формули (XIII), відповідно сполуки формули (XVIII) зі схеми 5а одержують вихідну сполуку формули (V) (схема 7). Схема 7 ж) (S)-(+)-3-гідрокситетрагідрофуран з) H2 Ще одним об'єктом винаходу є дималеат 4-[(3хлор-4-фторфеніл)аміно]-6-{[4-(N,Nдиметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((S)тетрагідрофуран-3-ілокси)хіназоліну. Ця сіль особливо придатна для застосування у фармацевтиці, оскільки вона існує лише в одній кристалічній модифікації, яка крім іншого не містить води та відрізняється винятковою стабільністю. Діюча речовина для можливості її фармацевтичного застосування як лікарський засіб не тільки повинна мати необхідну дію, але й за багатьма критеріями повинна відповідати і іншим вимогам. Подібні критерії здебільшого пов'язані з фізикохімічними властивостями діючої речовини. Як не обмежуючі приклади подібних критеріїв можна назвати стабільне збереження вихідною речовиною своєї дії в різних навколишніх умовах, у процесі приготування фармацевтичного препарату та у складі кінцевих лікарських засобів. Тому лікарська діюча речовина, використовувана для приготування лікарських композицій, повинна мати високу стабільність, що зберігається навіть у різних навколишніх умовах. Обов'язкове додержання цієї вимоги обумовлено необхідністю виключити застосування лікарських композицій, у яких поряд із по суті діючою речовиною присутні, наприклад, і 13 продукти її розкладу. У такому разі вміст діючої речовини у фармацевтичних препаратах може виявитися меншим зазначеного виробником. У результаті абсорбції вологи вміст лікарської діючої речовини зменшується через обумовлене поглинанням вологи збільшення її маси. Тому лікарські засоби, що проявляють схильність до поглинання вологи, необхідно на час зберігання захищати від вологи, наприклад, за рахунок додавання прийнятних осушувачів або зберігання лікарського засобу в умовах, у яких він захищений від контакту з вологою. Крім цього поглинання вологи може привести до зменшення змісту лікарського діючої речовини в процесі виготовлення фармацевтичного препарату, якщо лікарська діюча речовина не захищена від контакту з вологою та безпосередньо піддається впливу факторів навколишнього середовища. Із цієї причини лікарська діюча речовина бажано повинна мати лише мінімально можливу гігроскопічність. Оскільки для одержання лікарської форми з постійно відтворюваним вмістом у ній діючої речовини важливе значення має її кристалічна модифікація, спочатку необхідно одержувати максимально повну інформацію про будь-який можливий поліморфізм діючої речовини, представленої в кристалічній формі. Якщо діюча речовина може існувати в різних поліморфних модифікаціях, то необхідно впевнитися в тому, що певна кристалічна модифікація діючої речовини не зазнає ніяких змін у виготовленому пізніше на її основі лікарському препараті. У іншому випадку подібні поліморфні перетворення можуть негативно вплинути на ефективність медикаменту та його відтворюваності. З урахуванням сказаного вище кращі діючі речовини, що характеризуються лише мінімальною схильністю до поліморфних перетворень. 91401 14 Іншим критерієм, що за певних умов може мати особливо важливе значення залежно від вибраної лікарської форми або вибраної технології її приготування, є розчинність діючої речовини. Так, наприклад, при приготуванні лікарських форм у вигляді розчинів (наприклад, для інфузій) обов'язковою умовою є наявність у діючої речовини достатньої розчинності у фізіологічно сумісних розчинниках. Особливо важливе значення має й достатня розчинність діючої речовини, яка включається до складу лікарських засобів, які вводять в організм перорально. Відповідно до цього ще одне покладене в основу даного винаходу завдання полягало у одержанні лікарської діючої речовини, яка мала б не тільки високу фармакологічну ефективність, але й, крім того, у максимально можливому ступені задовольняла б за своїми фізико-хімічними властивостями розглянутим вище вимогам. Зазначене завдання вирішується за допомогою дималеату 4-[(3-хлор-4-фторфеніл)аміно]-6{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно }7-((S)-тетрагідрофуран-3-ілокси)хіназоліну. Температура плавлення дималеату 4-[(3-хлор4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1оксо-2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3ілокси)хіназоліну дорівнює 178 C (див. представлені на фіг. 2 у графічному вигляді результати термоаналізу). Кристалічний дималеат 4-[(3-хлор4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1оксо-2-бутен-1-іл]аміно}-7-((S)-тетрагідрофуран-3ілокси)хіназоліну більш детально аналізували за допомогою рентгенівської порошкової дифрактометрії. Отримана дифрактограма представлена на фіг. 1. У нижченаведеній таблиці наведені результати цього аналізу. Таблиця Дифракційні максимуми (рефлекси) та їх інтенсивність (відносна), виявлені при аналізі дималеату 4-[(3хлор-4-фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((5)-тетрагідрофуран-3ілокси)хіназоліну рентгенівською порошковою дифрактометрією 2 [°] 4,91 6,42 7,47 8,13 10,37 11,69 12,91 13,46 13,66 14,94 16,58 17,19 17,87 19,43 19,91 20,84 21,33 21,58 Значення dhkl [Å] 18,0 13,8 11,8 10,9 8,53 7,56 6,85 6,58 6,48 5,93 5,34 5,15 4,96 4,57 4,46 4,26 4,16 4,12 Відносна інтенсивність l/Io [%] 47 33 27 30 зо 2 20 3 2 11 12 36 5 38 100 13 21 12 15 91401 16 Продовження таблиці 2 [°] 22,25 22,94 23,67 24,82 25,56 26,71 27,46 28,37 30,71 29,31 29,57 31,32 32,31 33,10 33,90 34,84 35,71 36,38 36,96 37,99 39,94 Значення dhkl [Å] 3,992 3,873 3,756 3,584 3,482 3,335 3,245 3,143 2,909 3,045 3,019 2,854 2,769 2,705 2,643 2,573 2,512 2,467 2,430 2,367 2,255 Відносна інтенсивність l/Io [%] 15 32 9 7 37 9 4 8 3 4 4 10 4 5 1 2 1 1 1 2 5 У наведеній вище таблиці величина "2 [°]" означає кут дифракції в градусах, а величина "dhkl [Å]" означає визначені міжплощинні відстані в ангстремах [Å]. Для одержання рентгенівської порошкової дифрактограми пропонованої у винаході сполуки використовували дифрактометр Bruker D8 Advanced, оснащений позиційно-чутливим детектором (детектором оптичного випромінювання) і мідним анодом як джерело рентгенівського випро мінювання (К -випромінювання міді, =1,5418Å, 40кВ, 40мА). Нижче винахід більш докладно пояснюється на прикладах. Приклади Приклад 1 Діетиловий ефір {[4-(3-хлор-4фторфеніламіно)-7-((S)-тетрагідрофуран-3ілокси)хіназолін-6-ілкарбамоїл]метил}фосфонової кислоти 3,58кг 1,1-карбонілдіімідазолу (22,16моль) додають в 12,8л тетрагідрофурану та при 40 C змішують із розчином 4,52кг (22,16моль) діетилфосфонооцтової кислоти в 6,5л тетрагідрофурану. Потім протягом 30хв перемішують при 40 C. Одержаний таким шляхом розчин позначають далі як розчин А. 4 6,39кг (17,05моль) N -(3-хлор-4-фторфеніл)-7(тетрагідрофуран-3-ілокси)хіназолін-4,6-діаміну додають в 26,5 л тетрагідрофурану та при 40 C змішують із розчином А з наступним перемішуванням протягом 2 год при 30 C. До суспензії, що утворилася, додають 64л трет-бутилметилового ефіру та після охолодження до 20 C осад відокре млюють центрифугуванням. На завершення спочатку промивають сумішшю з 16л тетрагідрофурану та 16л трет-бутилметилового ефіру, а потім 32л води і сушать при 50°С. Вихід: 6,58кг (69,8%) білих кристалів, чистота згідно з даними PXBP (рідинна хроматографія високого розділення): 99,1%, що припадає на площу поверхні під піком. Приклад 2 [4-(3-хлор-4-фторфеніламіно)-7-((S)тетрагідрофуран-3-ілокси)хіназолін-6-іл]амід (Е)-4диметиламінобут-2-енової кислоти 19 До 4,4л води додають 5,6л 30%-вий розчин соляної кислоти (53,17моль). Потім при 30 C продовж 20хв по краплях додають 4,28кг 95%-вого (диметиламіно)ацетальдегіддіетилацеталю (26,59моль). Реакційну суміш перемішують протягом 8 год при 35°С, охолоджують до 5°С и в наступному зберігають в атмосфері аргону. Цей розчин означають далі як розчин Б. 4,55кг (68,06моль) гідроксиду калію розчиняють в 23,5л води та охолоджують до -5 C. Цей розчин позначають далі як розчин В. 5,88кг (10,63моль) діетилового ефіру ((4-(3хлор-4-фторфеніламіно)-7-(тетрагідрофуран-3ілокси)хіназолін-6-ілкарбамоїл)метил)фосфонової кислоти та 0,45кг хлориду літію (10,63моль) додають в 23,5л тетрагідрофурану та охолоджують до 7°С. Далі протягом 10хв додають холодний розчин В. Потім при -7°С у продовж 1 год додають розчин Б. Після 1-годинного перемішування при -5°С реакційну суміш нагрівають до 20 C та змішують із 15л води. Після охолодження до 3°С суспензію піддають вакуум-фільтрації та залишок промивають водою й сушать. Вихід: 5,21кг (100%) сирого продукту, вологовміст: 6,7%. Кристалізацію сирого продукту здійснюють із використанням бутилацетату/метилциклогексану. Вихід: 78%, чистота згідно з даним РХВР: 91401 20 99,4%, що припадає на площу поверхні під піком, вологовміст: 5,4%. Приклад 3 Дималеат [4-(3-хлор-4-фторфеніламіно)-7-((S)тетрагідрофуран-3-ілокси)хіназолін-6-іл]аміду (Е)4-диметиламінобут-2-енової кислоти 6,0кг (12,35моль) [4-(3-хлор-4фторфеніламіно)-7-((5)-тетрагідрофуран-3ілокси)хіназолін-6-іл]аміду (Е)-4-диметиламінобут2-енової кислоти додають в 84л етанолу, нагрівають до 70 C та змішують із розчином 2,94кг (25,31моль) малеїнової кислоти в 36л етанолу. Після початку кристалізації суміш спочатку охолоджують до 20 C і перемішують протягом 2 год, а потім протягом 3 год при 0°С. Осад відокремлюють вакуум-фільтрацією, промивають 19л етанолу та сушать у вакуумі при 40 C. Вихід: 8,11кг (91,5%), t пл 178°С. 1 Н-ЯМР (CD3OD): = 2,47 + 2,27 (m+m, 2Н), 2,96 (s, 6Н), 4,03 (m, 2Н), 4,07 + 3,92 (m+m, 2Н), 4,18 + 4,03 (m+m, 2Н), 5,32 (m, 1H), 6,26 (s, 4Н), 6,80 (m, 1Н), 6,99 (m, 1Н), 7,27 (s, 1H), 7,30 (t, 1Н), 7,66 (m, 1H), 7,96 (dd, 1Н), 8,62 (s, 1H), 9,07 (s, 1H) част./млн. 21 91401 22 23 Комп’ютерна верстка А. Крулевський 91401 Підписне 24 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-[(3-chloro-4-fluorophenyl)amino]-6-{[4-(n,n-dimethylamino)-1-oxo-2-butene-1-yl]amino}-7-((s)-tetrahydrofurane-3-yloxy)-quinazoline maleate, production method and uses thereof
Автори англійськоюRall Werner, Soyka Rainer, Kulinna Christian, Schnaubelt Juergen, Sieger Peter
Назва патенту російськоюДималеат 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(n,n-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((s)-тетрагидрофуран-3-илокси)хиназолина, способ его получения и применения
Автори російськоюРалль Вернер, Зойка Райнер, Кулинна Кристиан, Шнаубельт Юрген, Зигер Петер
МПК / Мітки
МПК: A61K 31/505, A61P 35/00, C07D 405/12
Мітки: одержання, 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(n,n-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((s)-тетрагідрофуран-3-ілокси)хіназоліну, спосіб, застосування, дималеат
Код посилання
<a href="https://ua.patents.su/12-91401-dimaleat-4-3-khlor-4-ftorfenilamino-6-4-nn-dimetilamino-1-okso-2-buten-1-ilamino-7-s-tetragidrofuran-3-iloksikhinazolinu-sposib-jjogo-oderzhannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Дималеат 4-[(3-хлор-4-фторфеніл)аміно]-6-{[4-(n,n-диметиламіно)-1-оксо-2-бутен-1-іл]аміно}-7-((s)-тетрагідрофуран-3-ілокси)хіназоліну, спосіб його одержання та застосування</a>
Попередній патент: Багатошарова ламінована плівка
Наступний патент: Скріплення рейкове проміжне для кривих ділянок колії
Випадковий патент: В'яжуче