Спосіб отримання інтерлейкіну-7 людини за допомогою рекомбінантної молекули, рекомбінантна молекула, що містить кднкову копію структурної частини сплайсованого кднк гена інтерлейкіну-7 людини та експресійного в
Номер патенту: 112442
Опубліковано: 12.09.2016
Автор: ТОВАРИСТВО З ОБМЕЖЕНОЮ ВІДПОВІДАЛЬНІСТЮ "УНІВЕРСАЛЬНЕ АГЕНТСТВО "ПРО-ФАРМА"
Формула / Реферат
1. Спосіб отримання біологічно активної форми інтерлейкіну-7 людини за допомогою рекомбінантної молекули, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкіну-7 людини та необхідні службові послідовності, причому рекомбінантну молекулу вбудовують в плазміду pACYC_IL7s, яка позначена на Фіг. 2, і вводять в бактерію E. coli BL21(DE3), де ДНК-послідовність кДНКової копії на 100 % співпадає з відповідними нуклеотидними послідовностями екзонів гена, що кодує повноцінний людський інтерлейкін-7, та де рекомбінантний інтерлейкін-7 продукують в живильному середовищі складу, який забезпечує аутоіндукцію і далі переводять в біологічно активну форму та очищують.
2. Рекомбінантна молекула, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкіну-7 людини та необхідні службові послідовності, яка відрізняється тим, що її вбудовують в плазміду pACYC_IL7s, позначену на Фіг. 2, і вводять в бактерію E. coli BL21(DE3), причому ДНК-послідовність кДНКової копії на 100 % співпадає з відповідними нуклеотидними послідовностями екзонів гена, що кодує повноцінний людський інтерлейкін-7.
3. Рекомбінантна молекула за п. 2, службові послідовності якої наступні:

 .
.
4. Рекомбінантна молекула ДНК за пп. 2-3, де нуклеотидна послідовність, що представляє інтерес, включає кодуючу послідовність.
5. Рекомбінантна молекула ДНК за п. 4, де кодуюча послідовність кодує відповідну білкову послідовність, яка після вводиться в організм та викликає потрібну фенотипічну ознаку.
6. Рекомбінантна молекула ДНК за пп. 1-5, яка крім кодуючої трансльованої послідовності включає нетрансльовану.
7. Вектор експресії ДНК, який включає рекомбінантну молекулу ДНК за будь-яким з пп. 1-6.
8. Вектор експресії ДНК за п. 7, який є мультикопійним.
9. Вектор експресії ДНК за пп. 1-8, що не містить сайтів, що призводять до втрати цільового гена.
Текст
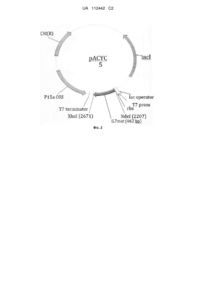
Реферат: Винахід належить до способу отримання біологічно активної форми інтерлейкіну-7 людини за допомогою рекомбінантної молекули, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкіну-7 людини та необхідні службові послідовності, вбудовані в плазміду pACYC_IL7s, яка позначена на Фіг. 2 і введена в бактерію E. coli BL21(DE3). UA 112442 C2 (12) UA 112442 C2 UA 112442 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід належить до способів отримання інтерлейкіну-7 людини за допомогою рекомбінантної молекули, рекомбінантної молекули, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкіну-7 людини та експресійного вектора ДНК. Інтерлейкін-7 належить до обширної групи природних біологічно активних білків інтерлейкінів. Інтерлейкіни є сигнальними молекулами білкової природи, що забезпечують функціонування імунної системи людини і тварин. Відома велика кількість різних інтерлейкінів (їх визначають по білковій послідовності, кодуючих їх генах, рецепторах, з якими вони взаємодіють, і функціях). Інтерлейкін-7 (далі IL7) був відкритий і описаний в 1988 році мишачий [1], а в 1989 р. людський [2]. У людини його ген розміщений на восьмій хромосомі в ділянці q 12-13 (sq 12-13). Послідовність гена IL7 визначена в 33 тисячі пар нуклеотидів (т.п.н.) і складається з 6 екзонів, що кодують глікозилований білок молекулярної маси в 25 кДа. Унікальною особливістю IL7 є його повна незамінність в регуляції Т-клітинної ланки імунітету. Він забезпечує і регулює гомеостаз Т-клітин, їх збереження, мультиплікацію, різноманітність рецепторів, що розпізнають чужі антигени. Фундаментальною особливістю IL7 є те, що його дія на людину не залежить від віку. Рецепція IL7 здійснюється мембранним рецептором, що складається з двох різних субодиниць. Одна з них специфічна тільки для IL7. Ця α-субодиниця, що ідентифікується на поверхні клітини, як CD 127. Друга субодиниця бере участь в складі ряду інших субодиниць, для рецепції обширної групи інших цитокінів. Це γ субодиниця, що ідентифікується на поверхні клітини, як CD 132 [3]. Регуляція інтерлейкіном-7, після з'єднання з рецептором іде в основному через підвищення рівня Всl-2, Bcl-XL і McL-1; індукцію янус-кіназ і активацію JAK/STAT-mainly JAK 1, JAK 3 і STAT 5, а також через включення Рі3К/АКТ сигналінгу [4]. Вивчення біологічно і потенційно терапевтичних властивостей IL7 показали перспективність його використання як лікарського засобу. кДНК IL7 людини була клонована в 1989 році (фактично відразу після відкриття IL7). Така кДНК кодує білок, що складається з 25 амінокислот сигнального пептиду (для напрацювання в Е. соlі він не потрібен) і кодуючої активної частини (те, що і розуміють, коли пишуть або говорять "IL7"), що складається з 177 амінокислот, масою 17,4 кДа. Цей же білок, що продукується в еукаріотичних клітинах, за рахунок глікозилування має масу в 25 кДа. Обидві форми в організмі мають практично однакові властивості. У зв'язку з високою гідрофобністю IL7 напрацьовується в клітинах Е. соlі у вигляді тіл включення. Даний винахід стосується інтерлейкіну-7 людини, способу отримання з біологічного матеріалу кДНК, що містить кодони, відповідні екзонам природного інтерлекійкіну-7 людини, рекомбінантної молекули, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкіну-7 людини, експресійного вектора ДНК, способу напрацювання в Е. cоli рекомбінантного білка IL7 та його переводу в біологічно активну форму. Згідно з винаходом запропоновано спосіб отримання інтерлейкіну-7 людини за допомогою рекомбінантної молекули, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкіну-7 людини та необхідні службові послідовності, причому рекомбінантна молекула вбудована в плазміду pACYC_IL7s, яка позначена на Фіг. 2 і введена в бактерію E. coli BL21(DE3), а ДНК-послідовність кДНКової копії на 100 % співпадає з відповідними нуклеотидними послідовностями екзонів гена, що кодує повноцінний людський інтерлейкін у інтерлейкін-7, що продукується у необхідній кількості в живильному середовищі складу, який забезпечується аутоіндукцією. Джерелом інформаційної РНК для отримання кДНК гена інтерлейкіну-7 (iL7) був кістковий мозок людини. Poly A+ РНК була виділена з кісткового мозку людини через набір реактивів фірми GE Healthcare (27-9255-01), Великобританія. Також запропоновано рекомбінантну молекулу, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкін-7 людини та необхідні службові послідовності, яка згідно з винахідницьким задумом вбудована в плазміду pACYC_IL7, яка позначена на Фіг. 2 і введена в бактерію E. coli BL21(DE3), причому ДНК-послідовність кДНКової копії на 100 % співпадає з відповідними нуклеотидними послідовностями екзонів гена, що кодує повноцінний людський інтерлейкін. В окремих варіантах рекомбінантна молекула може містити наступні службові послідовності: 1 UA 112442 C2 5 10 15 20 . В одному з аспектів винаходу нуклеотидна послідовність рекомбінантної молекули ДНК, що представляє інтерес, включає кодуючу послідовність. В іншому аспекті кодуюча послідовність рекомбінантної молекули кодує потрібну фенотипічну ознаку. Ще в одному аспекті винаходу кодуюча ділянка рекомбінантної молекули ДНК є нетрансльованою. Також, запропоновано вектор експресії ДНК, який включає рекомбінантну молекулу ДНК, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкін-7 людини та необхідні службові послідовності, яка згідно з винахідницьким задумом вбудована в плазміду pACYC_IL7s, яка позначена на Фіг. 2 і введена в бактерію E. coli BL21(DE3), причому ДНКпослідовність кДНКової копії на 100 % співпадає з відповідними нуклеотидними послідовностями екзонів гена, що кодує повноцінний людський інтерлейкін-7. В одному з аспектів винаходу експресійник вектор ДНК є мультикопійним. Ще в одному варіанті експресійний вектор ДНК не містить сайтів, що призводять до втрати цільового гена. Відповідно до винахідницького задуму синтез кДНК з праймером oligo-dT і подальший синтез гена IL7, здійснювали ферментами: зворотною транскриптазою і Pfu-полімеразою компанії Fermentas. Олігонуклеотиди, потрібні для конструювання гена IL7 синтезували у фірмі ЗАТ "Синтол", Москва. Схема клонування (Етапи отримання гена IL7 з кісткового мозку людини) представлена на Фіг. 1. Рестрикцію і лігування проводили ферментами фірми Fermentas, Литва. Аналіз первинної нуклеотидної послідовності проводили за допомогою секвенатора АВІ Prism3130. Отримана нуклеотидна послідовність і відповідна амінокислотна послідовність представлені нижче. 2 UA 112442 C2 5 10 . Аналіз визначеної первинної послідовності показав повну відповідність аналогічної послідовності, опублікованої в банку NCBI. У нашому випадку лідерний пептид, що відповідає за вихід білка з еукаріотичних клітин, не використовується. Лідерний пептид нативного гена Зрілий пептид. . Показано повну відповідність синтезованого гена літературним даним, для отримання продуцента рекомбінантного IL7. Синтезований фрагмент ДНК, розміром 462 п.н. був заклонований в плазміду pACYC по сайтах Nde1 і Xho1 (Фіг. 2). pACYC-iL7 5263 bp CM(R) lacI iL7mat (462bp) lac operator T7 prom rbs P15aORI T7 terminator Ndel (2207) Xho XhoI (2671) 3 UA 112442 C2 5 10 15 20 25 30 35 40 Отриману і охарактеризовану рекомбінантну плазмідну ДНК переносили в експресійний штам E. coli BL21(DE3), що містить ген РНК-полімерази фага Т7. Використовуючи метод порівняння індуційованної або неіндуційованної культури, був показний біосинтез цільового білкового продукту в клітинах E. coli (Фіг. 3), де показана елекрофореграма в 12 % поліакримідному гелі: 1 - індуційовані клітини; 2 - маркер мол. ваги; 3 - клітини без індукції експресії. Синтезований білок масою 17,4 кДа, відповідає розмірам IL7 людини. Для біосинтезу використовується живильне середовище, яке містить мінеральні солі, гідролізат білків, цукру і мікродобавки, що забезпечують біосинтез цільового продукту зростаючої культурою продуцента. Вирощування проводиться в режимі хорошої атрації і перемішування при температурі в діапазоні 34-39 °C протягом 10-36 годин, залежно від щільності посіву і конкретного режиму культивування. Після закінчення культивування відокремлюють клітинну біомасу від рідкої фази. Клітини отриманої біомаси руйнують і з гомогенату ізолюють фракцію, що містить тіла включення, які містять цільовий білок. Вміст цієї фракції розчиняють у відповідному складі з'єднань, які забезпечують переведення матеріалу тіл включення в розчинну (у цьому складі) форму. Така розчинна форма знаходиться в розгорнуто-хаотичній конформації. Наступний етап полягає в переведенні розгорнуто-хаотичної конформації в біологічно-активну тривимірну структуру і одночасній зміни розчинників. Вже правильно зібраний білок інтерлейкіну-7 передається на очистку. Очищення проводиться іонообмінною хроматографією. Одержуваний таким шляхом чистий матеріал є субстанцією для приготування лікарської форми. Винахід проілюстрований шляхом посилання на нижченаведені приклади. Проте ці приклади не призначені для обмеження об'єму формули винаходу яким-небудь шляхом. Фахівцям в даній області техніки очевидно, що можна практикувати безліч модифікацій, як матеріалів, так і способів, не відхиляючись від завдання і цілей даного винаходу. ПРИКЛАДИ Приклад 1. Біосинтез IL7 в Е.соli. Відібраний клон Е. соlі з окремої колонії, яка вирощена в чашці Петрі на середовищі LB Agar, що містить 1 % глюкози і 10 мкг/мл хлорамфеніколу інокулюють бактеріологічною петлею в пробірку з 2 мл середовища 2YT, що містить 1 % глюкози і 10 мкг/мл хлорамфеніколу. Інкубують при температурі 37 °C на шейкері при 250 об/хв. протягом 3-4 год. до досягнення культуральної рідини щільності 0,6-1,0 OD. Приблизно за 30 хв. до закінчення інкубації готують середовище для індукції. Отримане середовище заливають в колбу для культивування, об'єм якої перевищує об'єм середовища в 10 разів. Після інкубації отриману культуральну рідину в співвідношенні 1/1000 інокулюють в підготовлене середовище. Інкубують при тих же умовах 1618 годин до досягнення культурою щільності 14-16 OD. Клітини осаджують центрифугуванням при 4000 об/хв. протягом 15 хв. На Фіг. 4 показана елекрофореграма індукції (13 % поліакриламідний гель), де 1, 2, 3, 4-40, 20, 10 і 4 мкл відповідно; клітини без індукції експресії; 5, 6, 7, 8-40, 20, 10 і 4 мкл відповідно; індуковані клітини; 9 - маркер мол. ваги. Надосад злити. Живильні середовища: 45 • LB • LB Agar • 2YT 50 Ha 1 л 20 таблеток LB BROTH TABLETS (SIGMA, США) 35 гp. LB AGAR (GE Healthcare, США) 17 гp. Bacto™ Proteose Peptone (Becton, Dickinson and Company Sparks, Франція), 10 гp. Yeast Extract (Helicon, Росія), 5 гp. NaCl Кількісний аналіз проводили за допомогою програми TotalLab. Приклад 2. Виділення та очищення тілець-включень, в яких знаходиться hIL-7 з клітин Е. соlі Для етапу виділення і очищення тілець-включень використовували такі буферні розчини: Буфер A: 50 mM TRIS-HCl, рН 8,0, 5 mМ EDTA, 100 mМ NaCl, 1 мг/мл лізоцим (лізоцим додається в розчин безпосередньо перед використанням); Буфер В: 20 mM TRIS -НСl, рН 7,0, 1 mM EDTA, 0,1 % Triton X-100; Буфер С: 20 mM TRIS -НСl, рН 8,0, 0,14М NaCl; 4 UA 112442 C2 5 10 15 20 25 30 35 40 45 50 55 Буфер D: 20 mM TRIS -НСl, рН 8,0, 0,3 % дезоксихолат Na. Клітини ресуспендують в буфері А в об'ємному співвідношенні буфер/вихідна культура 1/5. Інкубують на льоду 30 хв. (до появи в'язкості в розчині). Потім додають MgSO4 до кінцевої концентрації 20 мм і ДНКазу до кінцевої концентрації 1 мг/л, добре розмішують і інкубують при кімнатній температурі ~ 20 хв. до повного зникнення в'язкості лізату. Після цього об'єм лізату доводять буфером Б до об'єму вихідної культури, добре розмішують і інкубують протягом ночі при 4 °C. Після інкубації лізат розмішують і розливають по 2 мл в пластикові пробірки типу Eppendorf і 3 відцентрифугірують 15 хв. при 13 тис. об./хв. (15,7 - 10 g) (центрифуга Eppendorf 5415D). Надосад зливають (Фіг. 5). Наявність центрифуги з великим об'ємом склянок значно полегшить цей процес. На Фіг. 5 представлена елекрофореграма виділення тілець-включень з клітин Е. соlі. Де: 1 і 2-5 і 2,5 мкл вихідної культури клітин Е. соlі; 3 і 4-5 і 2,5 мкл клітин ресуспендованих в буферах А і В; 5 і 6-5 і 2,5 мкл надосаду після осадження тілець-включень; 7 і 8-5 і 2,5 мкл тілець-включень, ресуспендованих в буфері С; 9, 10 і 11-0,5, 1 і 2 мкг відповідно білка-маркера FGF (мол. вага 17,0 кДа). До осаду в кожній пробірці додають по 1 мл буфера С і ресуспендують в ньому осад за допомогою ультразвукового дезінтегратора (MSE, США). Параметри роботи дезінтегратора (за шкалою приладу): потужність - high, режим - 6, амплітуда - 20 мікронів. Щоб уникнути нагріву при обробці ультразвуком пробірки інкубують на льоду в перервах між актами обробки (один акт 3-4 сек, 2-3 акти до повного ресуспендування осаду). Після ресуспендування об'єм отриманих суспензій доводять до об'єму вихідної культури і інкубують протягом 1 години. Приклад, одержаного на цьому етапі матеріалу представлений на Фіг. 6. Далі матеріал осаджують в тих же умовах і послідовно провадять всі маніпуляції з буфером D і деіонізованною водою (у випадку з водою, інкубація протягом години не потрібно) (Фіг. 7 та 8). На Фіг. 6 представлена елекрофореграма промивання тілець-включень буфером D. Де: 1 і 2-5 і 2,5 мкл тілець-включень, ресуспендований в буфері D; 3 і 4-5 і 2,5 мкл надосаду після осадження; 5 і 6-5 і 2,5 мкл тілець-включень, ресуспендований в diH2O; 7, 8 і 9-0,5, 1 і 2 мкг відповідно білка-маркера FGF (мол. вага 17,0 кДа). На Фіг. 7 представлена елекрофореграма промивання тілець-включень diH2O. Де: 1 і 2-5 і 2,5 мкл тілець-включень, ресуспендований в diH2O; 3 і 4-5 і 2,5 мкл надосаду після осадження; 5, 6 і 7-0,5, 1 і 2 мкг відповідно білка-маркера FGF (мол. вага 17,0 кДа); 7, 8 і 9-5 і 2,5 мкл (у перерахунку на вихідну культуру) очищених тілець-включень. На Фіг. 8 елекрофореграма виділення і очищення тілець - включень. Де: 1 і 2-5 і 2,5 мкл вихідної культури клітин Е.соlі; 3 і 4-5 і 2,5 мкл клітин ресуспендований в буферах А і В; 5 і 6-5 і 2,5 мкл надосаду після осадження тілець - включень; 7 і 8-5 і 2,5 мкл тілець-включень, ресуспендований в буфері С; 9 і 10-5 і 2,5 мкл надосаду після осадження; 11 і 12-5 і 2,5 мкл тілець-включень, ресуспендований в буфері D; 13 і 14-5 і 2,5 мкл надосаду після осадження; 15 і 16-5 і 2,5 мкл тілець-включень, ресуспендований в diH2O; 17 і 18-5 і 2,5 мкл надосаду після осадження; 19, 20 і 21-0,5, 1 і 2 мкг відповідно білка-маркера FGF (мол. вага 17,0 кДа); 22, 23 і 24-5 і 2,5 мкл (у перерахунку на вихідну культуру) очищених тілець - включень. Приклад 3. Солюбілізація тілець включення Тільця включення, що містять IL7, нерозчинні у воді, сечовині в прийнятних детергентах їх перехід в розчинну форму можливий тільки в досить жорстких системах. За розробленою технологією тільця включення, що містять IL7, розчиняють в буфері наступного складу: Семимолярний (7М) гуанідин гідрохлорид (кваліфікації Biotechnology grade "Applichem" або "Amresco"); 0.1 М Дитіотріетол (ДТТ) (Fermentas), 0.1 % Tween-80, 20 mМ Tpic-HCl pH 8,0. (буферний розчин готується безпосередньо перед вживанням). 5 UA 112442 C2 5 10 15 20 25 30 35 40 45 50 55 Розчинення проводиться виходячи зі співвідношення: на 1,2-1,5 мг інтерлейкіну-7-2 мл буферного розчину (вміст білка в отриманій партії тілець включення визначається до солюбілізації шляхом денситометрування SDS- РА гелів). У такому складі тільця включення ресуспендують і проводять інкубацію при 22 °C протягом 1-1,5 години на вертушці (2 об/хв.). По завершенні інкубації отриманий розчин центрифугують при 13,2 тис об./хв., 15 хв. У присутності гуанідинхлориду електрофорез в гелі провести не можна. Тому на даному етапі солюбілізуючий матеріал передається на наступну процедуру без аналізу. Отриманий супернатант використовують для подальшої ренатурації цільового білка. Приклад 4. Ренатурація рекомбінантного інтерлейкіну-7 зміна буфера за допомогою гельфільтрації Отриманий після солюбілізації тілець включення супернатант наносили на колонку ХК16/20 (GE Healthcare), запаковану Sephadex G-25 fine (25-30 мл сорбенту). Сорбент попередньо врівноважували 5 об'ємами розчину Кларка-Лабса (50 мл 0,1м KН2РО4 (3,6 г/л) + 13,9 мл 0,1м NaOH, pH 6,0), що містить 0,1 М L-аргінін гідрохлориду та 0,1 % Tween-80. На колонку наносили 2 мл супернатанта попереднього етапу солюбілізації, що містить 1,21,5 мг цільового білка. Об'єм елюату варіював в діапазоні від 4,5 до 5,1 мл. Отриманий елюат центрифугували при 13,2 тис. об./хв. протягом 15 хвилин, осад видалявся. Після центрифугування супернатант з центрифугальних пробірок об'єднувався і передавався для подальшого очищення. Цим закінчувався один цикл фолдирування. Приклад 5. Очищення рекомбінантного IL7 після його ренатурації з бактеріальних тілець включення Очищення рекомбінантного IL7 проводили у дві стадії з використанням DEAE сефарози (слабкий аніонообменнік) - перша стадія, і SP сефарози (сильний катіонообмінник) - друга стадія. На першій стадії для проведення очистки рекомбінантного IL7 в колонку упаковували 5 мл DEAE сефарози ("Sigma"), під'єднували до автоматизованої хроматографічної системі FPLC ("Pharmacia") і послідовно промивали наступними розчинами: 1. 5 об'ємами колонки (25 мл) деіонізованої води; 2. 5 об'ємами колонки (25 мл) буфера KH2PO4/NaOH рН 6,0, 0,1 М L-аргініну, 0,1 % Твін 80, 1 М NaCl; 3. потім колонку врівноважували пропусканням через неї 5-10 об'ємами колонки (25-50 мл) буфера KH2PO4/NaOH рН 6,0, 0,1 М L-аргініну, 0,1 % Твін 80. Після промивання і врівноваження, на колонку наносили ренатурований рекомбінантний IL7, попередньо профільтрований через 0,45 мкм PVDF мембранний фільтр ("Millipore"). Для збереження дисульфідних зв'язків у ренатуровану суміш додавали окислювально-відновну пару глутатіону (окислений/відновлений) до кінцевої концентрації в розчині 1 мМ, інкубували 30 хв. при +4 °C. Розчини, які використовували для хроматографічного очищення рекомбінантного IL7, фільтрували через 0,22 мкм мембранний фільтр ("Millipore") і дегазували з використанням вакуумного насосу. Фракцію рекомбінантного IL7, яку пропускали через DEAE сефарозу, використовували для подальшого очищення на SP сефарозі. Для проведення другої стадії очистки в колонку упаковували 5 мл SP сефарози GE Healthcare, під'єднували до автоматизованої хроматографічної FPLC системі (Pharmacia) і промивали наступними розчинами: 1. 5 об'ємами колонки деіонізованої води; 2. 5 об'ємами колонки KH2PO4/NaOH рН 5,0, 0,1 М L-аргініну, 0,1 % Твін 80 1 М NaCl; 3. колонку врівноважували KH2PO4/NaOH рН 6,0, 0,1 М L-аргініну, 0,1 % Твін 80. Після промивань і врівноваження колонки на неї наносили фракцію рекомбінантного IL7, яка перед цим (перша стадія) була пропущена через DEAE сефарозу. Елюцію рекомбінантного IL7 проводили ступінчастим градієнтом NaCl: 1. KH2PO4/NaOH рН 6,0, 0,1 М L-аргініну, 0,1 % Твін 80 0,1 М NaCl. 2. KH2PO4/NaOH рН 6,0, 0,1 M L-аргініну, 0,1 % Твін 80 0,2 М NaCl. 3. KH2PO4/NaOH рН 6,0, 0,1 M L-аргініну, 0,1 % Твін 80 0,3 М NaCl, 4. KH2PO4/NaOH рН 6,0, 0,1 M L-аргініну, 0,1 % Твін 80 0,4 М NaCl. 5. KH2PO4/NaOH рН 6,0, 0,7 M L-аргініну, 0,1 % Твін 80 0,4 М NaCl. 6. KH2PO4/NaOH рН 6,0, 2,0 M L-аргініну, 0,1 % Твін 80 0,4 М NaCl. 6 UA 112442 C2 5 10 15 20 25 30 35 40 45 50 55 60 Всі фракції отримані в результаті хроматографічного очищення рекомбінантного IL7 збирали і аналізували в 12 % поліакриламідному гелі (SDS-PAG) і з використанням спектрофотометра NanoDrop. У подальшу роботу відбиралася основна частина піку, а його плечі відкидалися. Підготовку сорбенту і розчинів для хроматографії проводили, як описано для DEAE сефарози. Швидкість нанесення білка на колонку становила 0,5 мл/хв., швидкість при промиванні і зрівноважуванні колонки становила 1,0 мл/хв. На Фіг. 9 наведено приклад одного з одержуваного по двохстадійному очищенню препарату IL7 (Фото робочого матеріалу). Де: 1 - фракція 1L 7 після ренатурації; 2 - фракція IL 7 після очищення на DEAE і SP сефарозі; 3 - білки маркери молекулярної маси (250, 130, 100, 70, 55, 25, 15 кДа). Подальше очищення можна проводити на гепарин-сефарозі, а якщо буде потрібно оберненофазовій хроматографією. Приклад 6. Тестування біологічної активності рекомбінантного IL-7 у стандартній проліферативній пробі з Т-лімфоцитами, стимульований фітогемаглютиніном (ФГА) А. Виділення мононуклеарів периферичної крові (МНПК) людини 1. Зразки крові (20 мл) відбираються в пробірки з ЕДТА як антикоагулянт. 2. Кров розводиться 1:1 стерильним фізіологічним розчином у стерильній пробірці на 50 мл для культивування. 3. У 4 пробірки на 15 мл додають по 3 мл Ficoll-PaqueTM PLUS (щільність 1,077 г/л) і нашаровується по 8 мл розведеної крові. Пробірки центрифугують 30 хв. при 1500 об/хв. при кімнатній температурі в центрифузі з baket-ротором. 4. МНПК відбираються за допомогою стерильної піпетки на 10 мл в одну пробірку; розводяться в 2 рази фізіологічним розчином. 5. Пробірка центрифугується 10 хв. при 1500 об/хв. при кімнатній температурі; супернатант відкидається. 6. Клітини ресуспендують за допомогою стерильної піпетки в 10 мл стерильного фізіологічного розчину; і повторно центрифугують 8 хв. при 1500 об/хв. 7. Повторити кроки 5 і 6, але ресуспендувати клітини в 10 мл середовища RPMI. 8. Ресуспендувати фінальний клітинний осад у 5 мл Blast-середовища (Blast-середовище: RPMI з 10 % інактивованої ембріональної сироватки великої рогатої худоби, пеніцилін/стрептоміцин, 50 мкМ 2-меркаптоетанол.) 9. Кількість життєздатних клітин оцінюється в камері Горяєва при розведенні в 0,4 % розчину трипанового синього. 6 10. Кількість клітин у пробірці доводиться за допомогою Blast-середовища до 4×10 клітин/мл. Б. Престимуляція МНПК 6 1. Для стимуляції МНПК в концентрації 1-4×10 клітин/мл додають ФГА (РНА Sigma L 8754) до кінцевої концентрації 10 мкг/мл і культивуються протягом 5 днів в пластикових матрацах (10 мл/матрац) при 37 °C в 5 % СO2 в інкубаторі. 2. По закінченні культивування суспензія клітин переноситься в пробірки на 15 мл і відмиваються 3 рази при 1500 об/хв. по 10 хвилин в середовищі RPMI з остаточним 6 розведенням в Blast-середовищі в кількості 4×10 клітин/мл. Після останнього відмивання осад клітин ресуспендуєтся в Blast-середовищі (RPMI, ETC 10 %, 50 мкМ 2-меркаптоетанол). Підрахунок клітин проводиться з фарбуванням трипановим синім. С. Стимуляція Т- клітинних бластів (Т cell blasts) IL7 5 1. Клітини культивуються в 96-лункових планшетах по 1×10 клітин на лунку з серійним розведенням рекомбінантного IL7 в діапазоні від 2 нг/мл до 200 нг/мл. Як позитивний контроль використовується людський рекомбінантний IL-7 будь-якої фірми. Кожне розведення повинно бути в 3 повторах, включаючи повтори з негативним контролем (додається буферний розчин без рекомбінантного білка). 2. Планшети інкубуються протягом 72 годин при 37 °C в інкубаторі з 5 % СО2. 3. Після чого додають 15 мкл розчину МТТ (5мг/мл) у кожну лунку і інкубують 4:00 при 37 °C в інкубаторі з 5 % СО2. 4. Зчитувати OD при 540 нм після розчинення кристалів формазану в ДМСО (яке додається по 200 мкл в лунку). 5. Після закінчення роботи клітини, посуд і використані реагенти піддаються дезобробці і викиданню в спеціальні контейнери. 7 UA 112442 C2 5 10 15 20 25 Обчислення результатів 1. Побудова графіка OD проти логарифма концентрації IL7 має давати сигмоїдальну криву. 2. ED50 (ефективна доза) обчислюється з лінійної частини графіка і представляє 50 % проліферативну відповідь щодо максимального проліферативної відповіді, отриманого в лінійній частині графіка. Приклад аналізу та розрахунок результатів представлений на Фіг. 10. Проліферація стимульованих ФГА клітин периферичної крові людини (після 5 діб) при збільшується концентрації рекомбінантного hIL-7. Концентрації hIL-7: 2, 5, 10, 15, 25, 30, 50, 100, 200 нг/мл. Вісь X - логарифм концентрації hIL-7, вісь У - відношення ODx до OD контролю. ED50 отриманого препарату 20нг/мл. Хоча справжній винахід був описаний з посиланням на наведені вище приклади, слід розуміти, що модифікації й зміни охоплюються в межах суті й обсягу винаходу. Відповідно, винахід обмежений тільки нижченаведеною формулою винаходу. ДЖЕРЕЛА ІНФОРМАЦІЇ: 1. А.Е. Namen, S. Lupton, К. Hjerrild, J. Wignall, D.Y. Mochizuki, A. Schmierer, B. Mosley, C.J. March, D. Urdal, S. Gillis Stimulation of B-cell progenitors by cloned murine interleukin-7 // Nature. 1988. - V. 333, N 6173. - P. 571-3. 2. R.G. Goodwin, S. Lupton, A. Schmierer, K.J. Hjerrild, R. Jerzy, W. Clevenger, S. Gillis, D. Cosman, A.E. Namen Human interleukin-7: molecular cloning and growth factor activity on human and murine B-lineage cells // Proc. Natl. Acad. Sci. USA. - 1989. - V 86, N 1. - P. 302-6. 3. Q. Jiang, W.Q. Li, F.B. Aiello, R. Mazzucchelli, B. Asefa, A.R. Khaled, S.K. Durum Cell biology of IL-7, a key lymphotrophin // Cytokine Growth Factor Rev. - 2005. - V.I 6, N 4-5. - P. 513-33. 4. R. Hofmeister, A.R. Khaled, N. Benbernou, .E Rajnavolgyi, K. Muegge, S.K. Durum Interleukin7: physiological roles and mechanisms of action // Cytokine Growth Factor Rev. - 1999. - V. 10, N 1. P. 41-60. ФОРМУЛА ВИНАХОДУ 30 35 40 1. Спосіб отримання біологічно активної форми інтерлейкіну-7 людини за допомогою рекомбінантної молекули, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкіну-7 людини та необхідні службові послідовності, причому рекомбінантну молекулу вбудовують в плазміду pACYC_IL7s, яка позначена на Фіг. 2, і вводять в бактерію E. coli BL21(DE3), де ДНК-послідовність кДНКової копії на 100 % співпадає з відповідними нуклеотидними послідовностями екзонів гена, що кодує повноцінний людський інтерлейкін-7, та де рекомбінантний інтерлейкін-7 продукують в живильному середовищі складу, який забезпечує аутоіндукцію і далі переводять в біологічно активну форму та очищують. 2. Рекомбінантна молекула, що містить кДНКову копію структурної частини сплайсованого кДНК гена інтерлейкіну-7 людини та необхідні службові послідовності, яка відрізняється тим, що її вбудовують в плазміду pACYC_IL7s, позначену на Фіг. 2, і вводять в бактерію E. coli BL21(DE3), причому ДНК-послідовність кДНКової копії на 100 % співпадає з відповідними нуклеотидними послідовностями екзонів гена, що кодує повноцінний людський інтерлейкін-7. 3. Рекомбінантна молекула за п. 2, службові послідовності якої наступні: 8 UA 112442 C2 5 10 . 4. Рекомбінантна молекула ДНК за пп. 2-3, де нуклеотидна послідовність, що представляє інтерес, включає кодуючу послідовність. 5. Рекомбінантна молекула ДНК за п. 4, де кодуюча послідовність кодує відповідну білкову послідовність, яка після вводиться в організм та викликає потрібну фенотипічну ознаку. 6. Рекомбінантна молекула ДНК за пп. 1-5, яка крім кодуючої трансльованої послідовності включає нетрансльовану. 7. Вектор експресії ДНК, який включає рекомбінантну молекулу ДНК за будь-яким з пп. 1-6. 8. Вектор експресії ДНК за п. 7, який є мультикопійним. 9. Вектор експресії ДНК за пп. 1-8, що не містить сайтів, що призводять до втрати цільового гена. 9 UA 112442 C2 10 UA 112442 C2 11 UA 112442 C2 12 UA 112442 C2 13 UA 112442 C2 14 UA 112442 C2 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Автори англійськоюPROFARMA UNIVERSAL AGENCY, LIMITED LIABILITY COMPANY
Автори російськоюОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ "УНИВЕРСАЛЬНОЕ АГЕНТСТВО "ПРО-ФАРМА"
МПК / Мітки
МПК: C12N 1/21, C12N 15/24, C07K 14/54, C07K 17/02, C12R 1/19
Мітки: рекомбінантної, допомогою, містить, кднкову, гена, сплайсованого, інтерлейкіну-7, частини, експресійного, молекула, молекули, копію, спосіб, отримання, кднк, структурної, людини, рекомбінантна
Код посилання
<a href="https://ua.patents.su/17-112442-sposib-otrimannya-interlejjkinu-7-lyudini-za-dopomogoyu-rekombinantno-molekuli-rekombinantna-molekula-shho-mistit-kdnkovu-kopiyu-strukturno-chastini-splajjsovanogo-kdnk-gena-interl.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання інтерлейкіну-7 людини за допомогою рекомбінантної молекули, рекомбінантна молекула, що містить кднкову копію структурної частини сплайсованого кднк гена інтерлейкіну-7 людини та експресійного в</a>
Попередній патент: Квазіоптичний багатокутовий терагерцевий еліпсометр
Наступний патент: Кондиціювання біомаси для поліпшеного вивільнення цукрів с5/с6 перед ферментацією
Випадковий патент: Спосіб визначення мутагенного ефекту важких металів