Спосіб визначення нуклеїнових кислот методом полімеразно-ланцюгової реакції в режимі реального часу і пристрій для його здійснення
Номер патенту: 101848
Опубліковано: 13.05.2013
Автори: Строганов Алєксандр Анатольєвіч, Сляднєв Максім Ніколаєвіч
Формула / Реферат
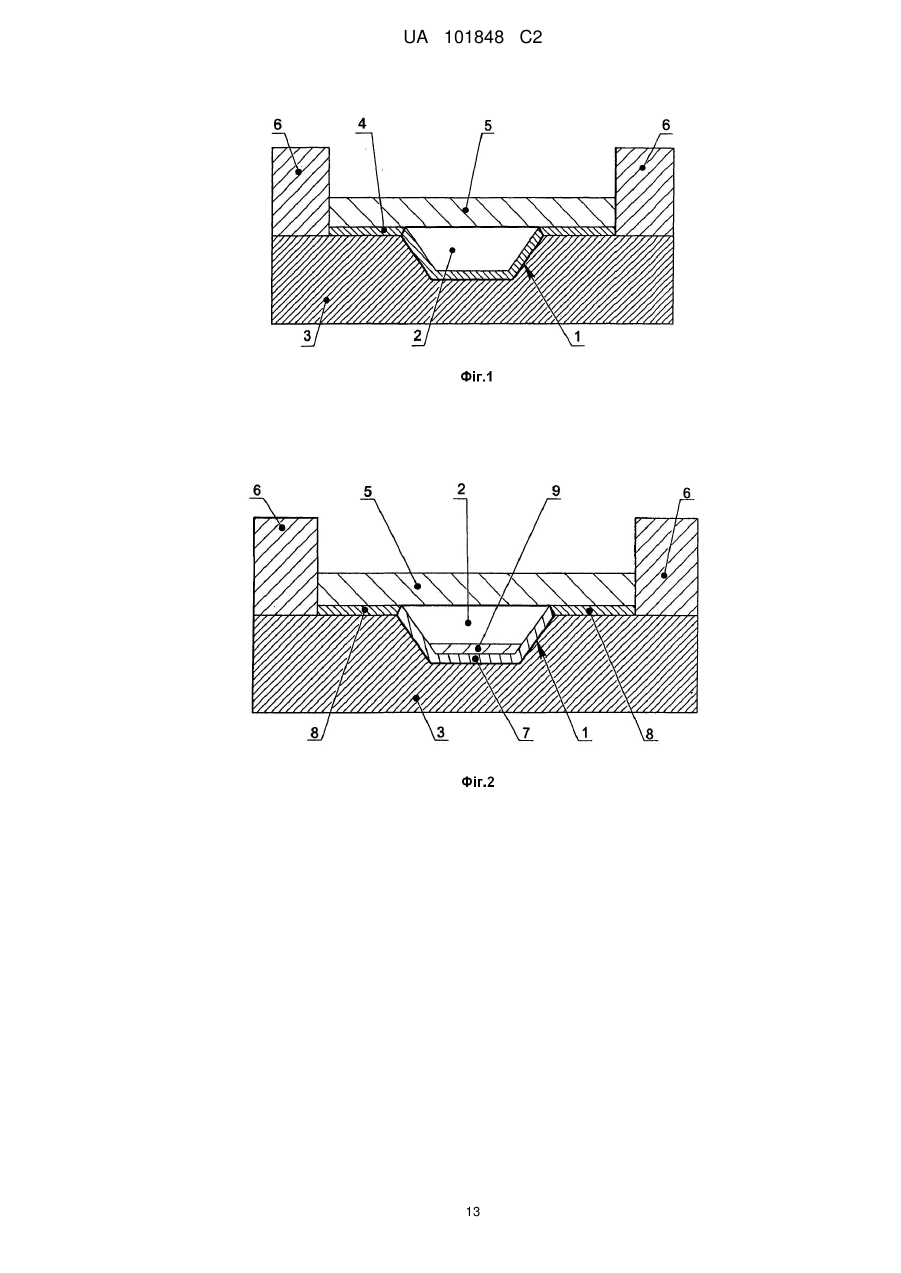
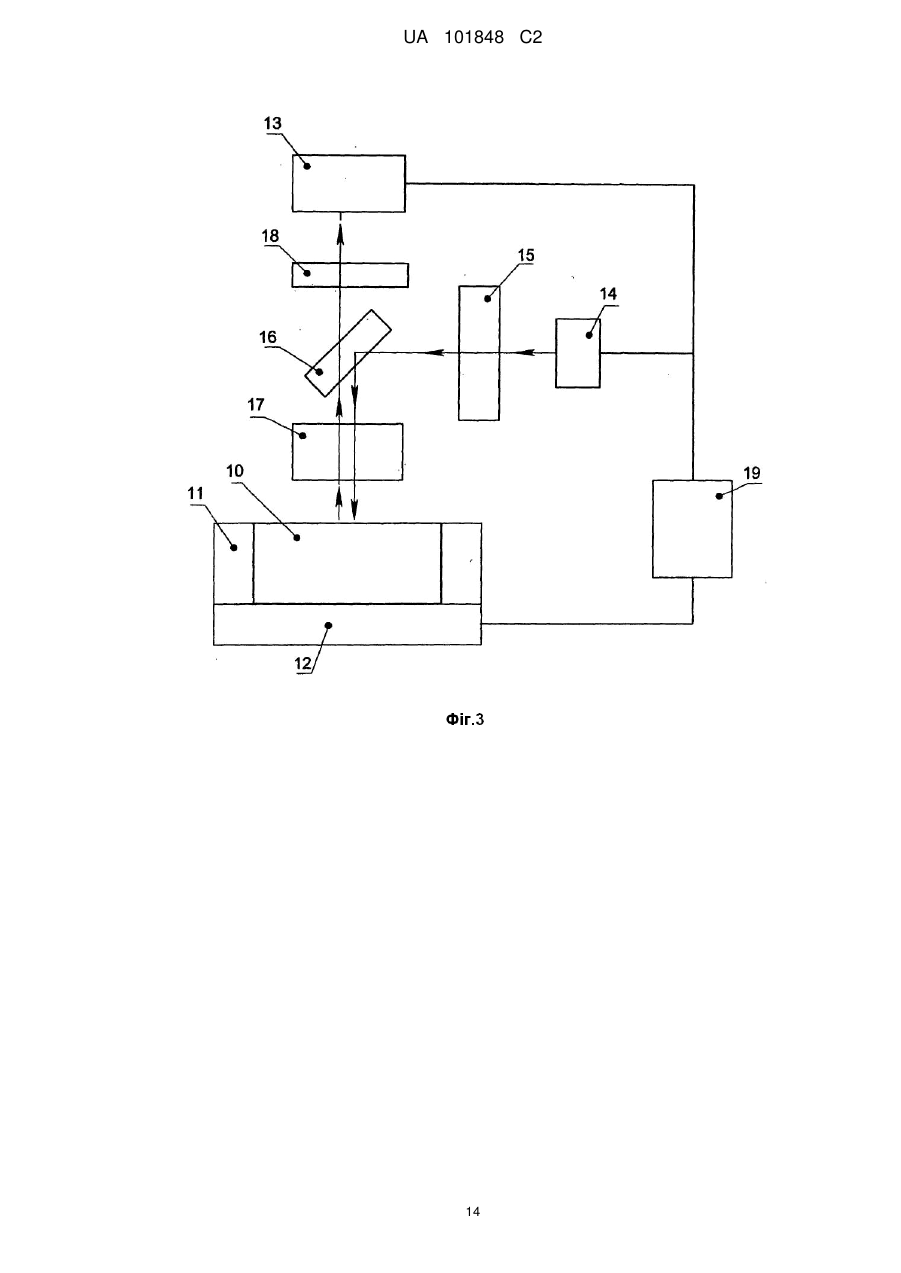
1. Спосіб визначення нуклеїнових кислот методом полімеразно-ланцюгової реакції в режимі реального часу, що включає введення рідких проб, що містять нуклеїнову кислоту, в реакційні зони на верхній поверхні теплопровідної підкладки мікрочипа; ізолювання введених проб від атмосфери; взаємодію нуклеїнової кислоти проби з компонентами полімеразно-ланцюгової реакції при термоциклуванні проб з відведенням тепла через зовнішню поверхню мікрочипа; флуоресцентне визначення зміни кількості продуктів полімеразно-ланцюгової реакції в процесі термоциклування; визначення кількості початкової нуклеїнової кислоти в пробах за динамікою зростання флуоресцентного сигналу, який відрізняється тим, що використовують мікрочип з теплопровідної підкладкою з теплопровідного матеріалу з коефіцієнтом теплопровідності понад 1 Вт/см•K і з коефіцієнтом теплової дифузії понад 0,6 см2/с, при цьому реакційні зони на поверхні мікрочипа відокремлюють від теплопровідної підкладки шаром пасивуючого матеріалу, який ковалентно зв'язаний з поверхнею теплопровідного матеріалу, а ізолювання введених проб виконують шляхом відділення їх від атмосфери шаром не змішуваної з водою рідини, яку утримують на верхній поверхні теплопровідної підкладки за допомогою периферійного бар'єра, причому відношення сумарної термічної маси мікрочипа з введеними пробами і шаром не змішуваної з водою рідини і теплової провідності підкладки мікрочипа не перевищує 0,04 секунди.
2. Спосіб за п. 1, який відрізняється тим, що флуоресцентне визначення зміни кількості продуктів полімеразно-ланцюгової реакції в пробах у процесі термоциклування виконують шляхом опромінювання проб вибраним діапазоном довжин хвиль з інтервалу 350-700 нм і реєстрації сигналу флуоресценції у вибраному діапазоні довжин хвиль з інтервалу 450-1000 нм.
3. Спосіб за п. 1, який відрізняється тим, що як теплопровідний матеріал використовують кремній.
4. Спосіб за п. 1, який відрізняється тим, що як теплопровідний матеріал використовують метал.
5. Спосіб за п. 4, який відрізняється тим, що як метал використовують алюміній або мідь.
6. Спосіб за п. 1, який відрізняється тим, що як пасивуючий матеріал використовують оксид кремнію або оксид металу, або поліметилметоксисилоксан або 3-гліцидоксипропілтриметоксисилан з етиленглікольдигліциловим ефіром.
7. Спосіб за п. 1, який відрізняється тим, що введення рідких проб в реакційні зони здійснюють крізь шар не змішуваної з водою рідини.
8. Спосіб за п. 1, який відрізняється тим, що як пасивуючий матеріал на поверхні мікрочипа в реакційних зонах використовують гідрофільний матеріал, а як пасивуючий матеріал на поверхні мікрочипа між реакційними зонами використовують гідрофобний матеріал.
9. Спосіб за п. 8, який відрізняється тим, що як пасивуючий матеріал на поверхні мікрочипа в реакційних зонах використовують 3-гліцидоксипропілтриметоксисилан з етиленглікольдигліциловим ефіром, а як пасивуючий матеріал на поверхні мікрочипа між реакційними зонами використовують поліметилметоксисилоксан.
10. Спосіб за п. 1, який відрізняється тим, що використовують шар не змішуваної з водою рідини, пропускання якого у вибраному спектральному діапазоні опромінювання і у вибраному спектральному діапазоні флуоресценції не менше 10 %.
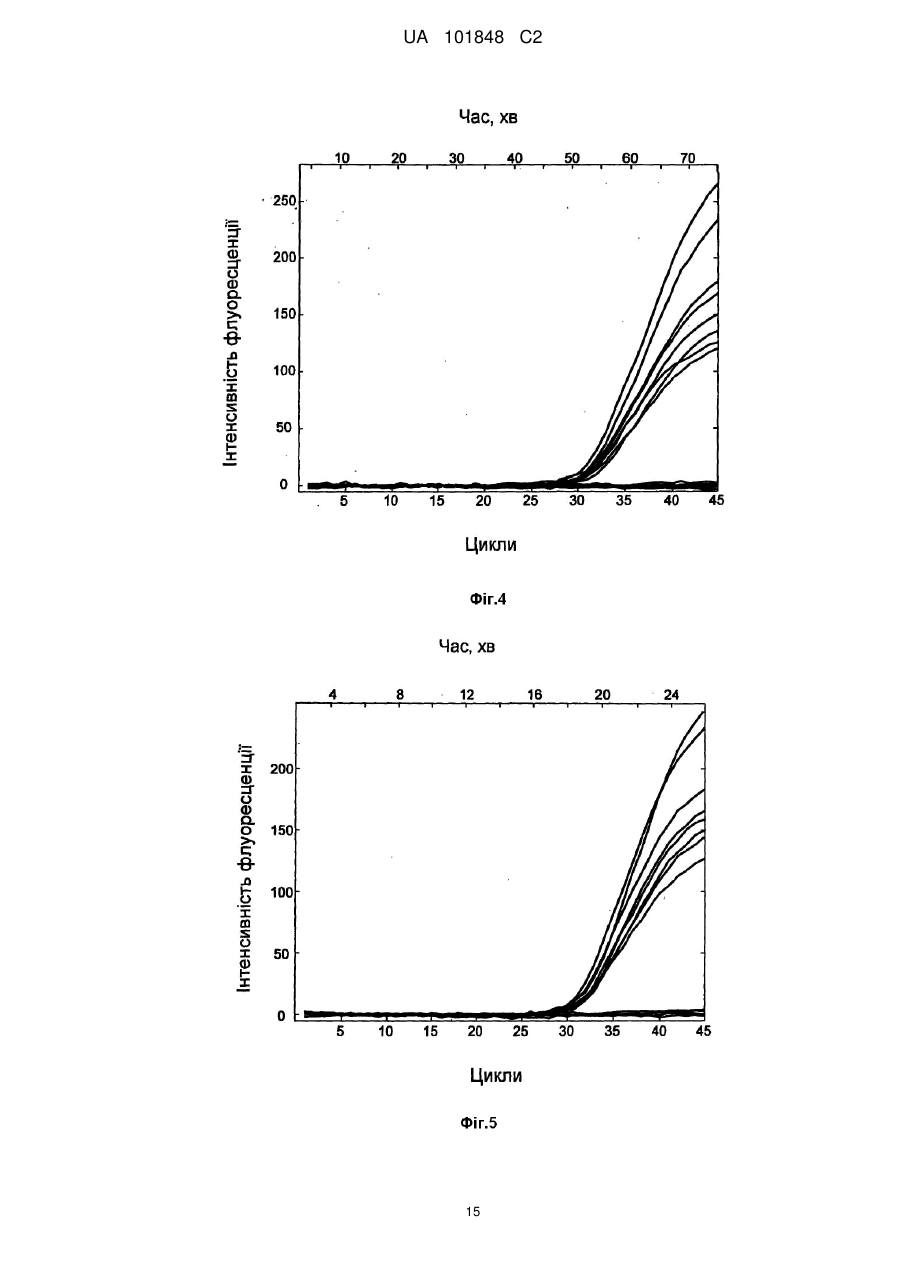
11. Спосіб за п. 1, який відрізняється тим, що використовують шар не змішуваної з водою рідини, сигнал флуоресценції від якої не перевищує 10 % від сигналу, що створюється пробами, поміщеними в реакційні зони.
12. Спосіб за п. 1, який відрізняється тим, що як не змішувану з водою рідину використовують поліметилсилоксанову рідину, густота якої менша, ніж густота води.
13. Спосіб за п. 1, який відрізняється тим, що в реакційні зони на поверхні мікрочипа на шар пасивуючого матеріалу наносять один або декілька компонентів полімеразно-ланцюгової реакції у вигляді водного розчину і висушують вказаний розчин.
14. Спосіб за п. 13, який відрізняється тим, що водний розчин, що містить один або декілька компонентів полімеразно-ланцюгової реакції, висушують шляхом ліофільного висушування.
15. Пристрій для визначення нуклеїнових кислот методом полімеразно-ланцюгової реакції в режимі реального часу, що містить мікрочип щонайменше з однією реакційною зоною на його поверхні, який механічно зв'язаний з утримувачем мікрочипа і оптично зв'язаний з детектором флуоресцентного випромінювання через блок фільтрації випромінювання каналу реєстрації, що включає щонайменше одне джерело випромінювання, оптично зв'язане з блоком фільтрації випромінювання каналу освітлення і мікрочипом, а також систему керування, електрично зв'язану з блоком термоциклування, який термічно зв'язаний з мікрочипом і виконаний з можливістю нагрівання, охолодження і підтримки температури мікрочипа, який відрізняється тим, що мікрочип містить термічно зв'язану з блоком термоциклування теплопровідну підкладку, виконану з матеріалу з коефіцієнтом теплопровідності понад 1 Вт/см•K і з коефіцієнтом теплової дифузії понад 0,6 см2/с, а кожна з реакційних зон відокремлена від теплопровідної підкладки шаром пасивуючого матеріалу, ковалентно зв'язаного з поверхнею теплопровідної підкладки, причому на верхній поверхні мікрочипа виконаний периферійний бар'єр з можливістю утримання заданої кількості не змішуваної з водою рідини на верхній поверхні мікрочипа, причому відношення сумарної термічної маси мікрочипа з введеними пробами і шаром не змішуваної з водою рідини до теплової провідності підкладки мікрочипа не перевищує 0,04 секунди.
16. Пристрій за п. 15, який відрізняється тим, що як джерело випромінювання містить принаймні один світлодіод.
17. Пристрій за п. 15, який відрізняється тим, що як джерело випромінювання містить матрицю світлодіодів.
18. Пристрій за п. 15, який відрізняється тим, що система керування виконана з можливістю перемикання джерел випромінювання між одним джерелом випромінювання та іншим джерелом випромінювання.
19. Пристрій за п. 15, який відрізняється тим, що система керування виконана з можливістю зміни спектрального діапазону блока (або блоків) фільтрації випромінювання.
20. Пристрій за п. 15, який відрізняється тим, що як детектор флуоресцентного випромінювання містить матричний детектор.
21. Пристрій за п. 17, який відрізняється тим, що як детектор флуоресцентного випромінювання містить фотоелектронний помножувач.
22. Пристрій за п. 17, який відрізняється тим, що як детектор флуоресцентного випромінювання містить фотодіод.
23. Пристрій за п. 15, який відрізняється тим, що блок термоциклування містить елемент Пельтьє.
24. Пристрій за п. 15, який відрізняється тим, що мікрочип виконано таким чином, що поверхня мікрочипа в реакційних зонах покрита шаром гідрофільного пасивуючого матеріалу, а поверхня мікрочипа між реакційними зонами покрита гідрофобним пасивуючим матеріалом.
25. Пристрій за п. 15, який відрізняється тим, що мікрочип виконано таким чином, що реакційні зони на поверхні мікрочипа зверху шару пасивуючого матеріалу містять один або декілька компонентів полімеразно-ланцюгової реакції у висушеному вигляді.
26. Пристрій за п. 15, який відрізняється тим, що периферійний бар'єр виконано з можливістю ізоляції реакційних зон від атмосфери за допомогою клейової плівки.
27. Пристрій за п. 15, який відрізняється тим, що система керування виконана з можливістю автоматичного перемикання джерел випромінювання і блоків фільтрації світлового випромінювання і синхронізованого з цими перемиканнями збору сигналів від детектора випромінювання.
Текст
Реферат: Винахід належить до області молекулярної біології, медицини, біотехнології і стосується способу проведення полімеразної ланцюгової реакції і пристрою для його здійснення з реєстрацією накопичення продуктів реакції в режимі реального часу, що включає введення рідких проб, що містять нуклеїнову кислоту, в реакційні зони на верхній поверхні теплопровідної підкладки мікрочипа; ізолювання введених проб від атмосфери; взаємодію нуклеїнової кислоти проби з компонентами полімеразно-ланцюгової реакції при термоциклуванні проб з відведенням тепла через зовнішню поверхню мікрочипа; флуоресцентне визначення зміни кількості продуктів полімеразно-ланцюгової реакції в процесі термоциклування; визначення кількості початкової нуклеїнової кислоти в пробах за динамікою зростання флуоресцентного сигналу. Згідно з винаходом використовують мікрочип з теплопровідною підкладкою із теплопровідного матеріалу з коефіцієнтом теплопровідності понад 1 Вт/см•K і з коефіцієнтом 2 теплової дифузії понад 0,6 см /с, при цьому реакційні зони на поверхні мікрочипа відокремлюють від теплопровідної підкладки шаром пасивуючого матеріалу, який ковалентно зв'язаний з поверхнею теплопровідного матеріалу, а ізолювання проб, що вводяться, виконують шляхом відділення їх від атмосфери шаром не змішуваної з водою рідини, яку утримують на верхній поверхні теплопровідної підкладки за допомогою периферійного бар'єра, причому відношення сумарної термічної маси мікрочипа з введеними пробами і шаром не змішуваної з водою рідини, до теплової провідності підкладки мікрочипа не перевищує 0,04 секунди. Технічний результат полягає у скороченні часу аналізу, підвищенні надійності, достовірності, продуктивності і економічності аналізу. UA 101848 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область техніки, до якої належить винахід Винахід належить до області молекулярної біології, медицини, біотехнології і стосується способу проведення полімеразної ланцюгової реакції (ПЛР) і пристрою для його здійснення з реєстрацією накопичення продуктів реакції в режимі реального часу (ПЛР в реальному часі, ПЛР РВ). Запропонований спосіб і пристрій можуть бути використані в медицині, ветеринарії, харчовій промисловості, при дослідженні навколишнього середовища та в інших областях, пов'язаних з виявленням, ідентифікацією та кількісною оцінкою нуклеїнових кислот в досліджуваних зразках. ПЛР представляє багаторазово повторювані цикли синтезу певної області ДНК (ампліфікацію), які викликані циклічною зміною температури реакційної суміші, і приводять до експоненціального збільшення кількості фрагмента ДНК, обмеженого двома олігонуклеотидними праймерами. При циклічній зміні температури реакційної суміші, відомій фахівцям в даній області як термоциклування, послідовно відбуваються такі стадії: денатурація дволанцюгової молекули ДНК мішені (плавлення), приєднання олігонуклеотидних праймерів до комплементарних ділянок утворених одноланцюгових молекул ДНК мішені (відпал), і добудова праймерів за допомогою термостабільної полімерази до утворення протяжних фрагментів комплементарних ДНК молекул (елонгація). Умови, за яких виконуються вказані стадії, добре відомі фахівцям в даній області. ПЛР застосовується для ампліфікації нуклеїнових кислот і дозволяє виявити і ідентифікувати присутність, а також визначити кількість нуклеїнової кислоти з шуканою послідовністю нуклеотидів в ДНК- або РНК-зразку. Для проведення ПЛР готують реакційну суміш в буферному розчині, що містить, як правило, термостабільну полімеразу, дезоксинуклеозид-трифосфати (дНТФ), прямий і зворотний олігонуклеотидні праймери, іони магнію, в яку додають аналізовану нуклеїнову кислоту для її ампліфікації, з подальшою реєстрацією ампліфікованих нуклеотидних послідовностей. Для реєстрації результатів реакції в режимі реального часу реакцію проводять в термоциклері, оснащеному флуоресцентним детектором у присутності або флуоресцентних інтеркалюючих фарбників, або флуоресцентно-мічених олігонуклеотидних праймерів чи зондів. Терміни і визначення: Термічна маса об'єкту (Дж/К), що дорівнює теплоємності матеріалу, з якого він виготовлений, помноженій на його масу, характеризує здатність об'єкту змінювати свою температуру при підведенні або відведенні теплової енергії. Повна термічна маса складеного об'єкту, що містить декілька частин з різних матеріалів, дорівнює сумі термічних мас всіх його частин. Коефіцієнт теплопровідності матеріалу (Вт/м*К) характеризує здатність матеріалу проводити теплову енергію. Теплова провідність об'єкту (Вт/К), що дорівнює добутку коефіцієнта теплопровідності матеріалу, з якого він зроблений, на площу поверхні теплообміну, поділеному на товщину матеріалу, характеризує здатність об'єкту проводити теплову енергію через поверхню теплообміну. 2 Коефіцієнт теплової дифузії (м /с), що дорівнює відношенню теплопровідності матеріалу до добутку його теплоємності на його густину, характеризує здатність матеріалу до теплового обміну з навколишнім середовищем по відношенню до процесу накопичення тепла в самому матеріалі. Для системи, що містить два об'єкти: перший, нагріваний або охолоджуваний, і другий, через який відбувається теплообмін, справедлива така характеристика. Відношення термічної маси першого об'єкту до теплової провідності другого об'єкту, виражене в секундах, характеризує здатність системи швидко підводити тепло до і відводити тепло від першого об'єкту через другий. Рівень техніки Існуючі методи проведення ПЛР з використанням комерційно доступного устаткування, як правило, базуються на застосуванні полімерних пробірок, які встановлюються в металеві нагрівальні блоки. Висока термічна маса стандартних нагрівальних блоків зі встановленими в них пробірками і зразками, невисока теплопровідність матеріалу стінок пробірок обмежує швидкість нагрівання та охолодження зразка, а також може призводити до високої неоднорідності температурного поля в зразку, що перебуває в пробірці. При використанні звичайних лабораторних приладів, призначених для виконання ПЛР в полімерних пробірках або планшетах, рекомендований час підтримки температури в термоциклі, становить 2 або більше хвилин. Наприклад, Ausubel et at., eds. (1996) Current Protocols in Molecular Biology, Current Protocols, Greene Publishing Associates, Inc. and John Wiley 1 UA 101848 C2 5 10 15 20 25 30 35 40 45 50 55 60 & Sons, Inc., рекомендують використовувати 5 хвилин на цикл, без урахування часу, який витрачається на переходи між температурними рівнями. В результаті ПЛР процес з 40 циклів із використанням звичайного устаткування при об'ємі проби 20-50 мкл може зайняти 3 або більше годин. Останніми роками для скорочення часу, що витрачається на один цикл, було запропоновано багато методів проведення ПЛР в мініатюрних реакційних контейнерах. Для прискорення часу, потрібного на перехід між температурними рівнями, в подібних пристроях істотно зменшена маса нагрівального елементу, маса контейнерів і об'єм зразків, що дозволило скоротити термічну масу, застосовуються матеріали з високими коефіцієнтами теплопровідності і підвищується співвідношення площі поверхні зразка до його об'єму, а також для нагрівання використовуються способи безконтактного підведення тепла до зразків. Наприклад, прилад RapidCycler, (Idaho Technologies, Inc., США) дозволяє відносно швидко змінювати температуру ПЛР-суміші при переході між температурними рівнями і забезпечує відносно ефективне перенесення тепла від нагрівача до зразків. У цьому пристрої 30 циклів ПЛР РВ можуть бути завершені за 10 хвилин. Відомі також методи, реалізовані в мікрофлюїдних пристроях, що дозволяють скоротити час, потрібний на один цикл. Наприклад, Kорр et al. (1998) Science, 280:1046, описує пристрій, в якому ПЛР-суміш послідовно протікає по мікроканалу у вигляді меандру, виконаному в мікрофлюїдному чіпі, через три температурні зони, що приводить до циклічної зміни температури ПЛР-суміші протягом 20 термоциклів. Оскільки поперечний переріз мікроканалу відносний малий, то температура розчину всередині мікроканалу встановлюється достатньо швидко. Час, протягом якого суміш знаходиться при певній температурі, в цьому випадку регулюється за допомогою швидкості потоку. Авторами показана можливість виконання ПЛР в описаному пристрої при часі циклу, рівному 6,6 сек. Таким чином, застосування мікрочіпових технологій дозволяє істотно скоротити час циклу ПЛР, і відповідно скоротити час ПЛР-аналізу та збільшити продуктивність. Проте, реалізація ПЛР РВ у подібних мікрофлюїдних пристроях стикається з певними труднощами. Збільшення співвідношення площі поверхні між мікрореактором і зразком до об'єму викликає зниження активності і навіть необоротну дезактивацію ферменту полімерази. На поверхнях таких матеріалів як кремній, метали, кварц, скло, спостерігається необоротна сорбція ДНК і ферменту, інших компонентів реакції. Для усунення вказаних обмежень потрібне додавання до реакційної суміші додаткових речовин, що запобігають сорбції та дезактивації компонентів ПЛР, наприклад введення амінокислот, білків і поверхнево-активних речовин [патент США 6,660,517 "Mesoscale polynucleotide amplification devices"]. У цьому ж патенті розкриваються також способи, що дозволяють створювати захисне покриття поверхонь мікрореакторів, в яких проводиться ПЛР. Подібні покриття запобігають адсорбції та інгібуванню компонентів ПЛР, що дозволяє досягти високої чутливості ПЛР-аналізу. Однією з відомих для фахівців проблем при проведенні ПЛР є випаровування зразків при термоциклуванні. Оскільки температура денатурації ДНК близька до температури кипіння водних розчинів, інтенсивне випаровування ПЛР-суміші під час реакції може перешкоджати протіканню ПЛР, що в стандартних пристроях, як правило, усувається або шляхом ізолювання водної поверхні суміші від атмосфери за допомогою рідини, що не змішується з водою, наприклад, мінерального масла, або шляхом герметизації реакційних посудин за допомогою нагріваної кришки. У закритих каналах мікрофлюїдних чіпів можливо герметизувати мікрореактори за допомогою клапанів у мікроканалі [патент США 7,118,910 "Microfluidic device and methods of using same"]. Реалізація подібного способу герметизації технічно складна, і збільшує вартість аналізу з використанням такого мікрочіпа. Для мікрочіпів, що містять відкриті реакційні лунки, відомі способи ізоляції реакційної суміші від атмосфери, що полягають у нанесенні на поверхню водного розчину реакційної суміші рідини, що не змішується з водою, наприклад мінерального або силіконового масла [патент США 6,664,044 "Method for conducting PCR protected from evaporation"] для запобігання випаровуванню зразків при термоциклуванні. Проте в описаному пристрої для введення робочої ПЛР-суміші і зразків багаторазово задіяна система струменевого друку, що може привести до неконтрольованої деградації ПЛР-реактивів і взаємного забруднення зразків у процесі нанесення. Відомий спосіб і пристрій [патентна заявка США 20070196237 "Apparatus for regulating the temperature of a biological and/or chemical sample and method of using the same"], в якому використовується мікрочіп з нанесеними на поверхню підкладки реакційними об'ємами, що є краплею рідини, що не змішується з водою, в яку поміщена ПЛР-суміш. Проте в цьому 2 UA 101848 C2 5 10 15 20 25 30 35 40 45 50 55 способі реакційна суміш відокремлена від поверхні нагріваної підкладки шаром не змішуваної з водою рідини і, як правило, має невисоку теплопровідність, що уповільнює процес нагрівання і охолодження. Крім того, в цьому способі реакційні об'єми можуть неконтрольовано переміщатися, оскільки вся поверхня теплопровідної підкладки ізотропна, що потенційно може приводити до просторового незбігу нагріваної зони і нагріваного зразка в процесі введення проби і термоциклування, що призведе до недостовірних результатів ПЛР-аналізу. Ще одним недоліком, загальним для відомих мікрофлюїдних пристроїв, є підвищена трудомісткість змішування зразків з компонентами ПЛР-суміші до введення в мікрочіп. Крім того, ця процедура вимагає витрат на додаткові витратні матеріали (пластикові наконечники, пробірки) і практично не реалізовується в звичайних пробірках при об'ємі рідин менше одного мікролітра через підвищену вірогідність випаровування реактивів і зразків під час змішування. Відомі способи, що дозволяють іммобілізувати в мікрореакторі один або декілька компонентів реакційної суміші, необхідні для проведення ПЛР, для того, щоб потім заповнити мікрореактор водним розчином, що містить нуклеїнові кислоти і бракуючі компоненти ПЛР-суміші [патент США 7,118,910 "Microfluidic device and methods of using same"]. Проте, вказаний спосіб трудомісткий і нелегко піддається контролю при проведенні, оскільки вимагає нанесення біологічних реагентів безпосередньо в процесі виготовлення мікрочіпа, що підвищує небезпеку негативної дії подальших технологічних процесів на нанесені реактиви (дія підвищеної температури, хімічних сполук, випромінювання). Відомі способи ліофільного висушування підготовленої ПЛР-суміші, що містить всі або майже всі компоненти реакції, а також додаткові стабілізатори, в пробірках [патент РФ 2259401 "Сухая смесь реагентов для полимеразной цепной реакции и способ проведения ПЦР-анализа", патент США 6,153,412 "Lyophilized reagent for polymerase chain reaction"]. Цей метод може бути реалізований практично в будь-якій мікрореакторній системі з відкритими реакторами. Не зважаючи на наявність великого числа способів і пристроїв реалізації ПЛР РВ в мікрофлюїдному і мікрочіповому форматах, потреба в розробці нових, досконаліших способів і пристроїв зберігається. У даній області техніки існує потреба в економічно ефективному способі експресного кількісного визначення нуклеїнових кислот множини зразків, що має високу чутливість і не вимагає великих трудовитрат при підготовці до аналізу, а також потреба в пристрої для його здійснення. Найбільш близьким аналогом даного винаходу може служити спосіб і пристрій, описані в заявці на винахід США 20070196237 "Apparatus for regulating the temperature of a biological and/or chemical sample and method of using the same". У заявці розкритий спосіб здійснення біохімічних реакцій, зокрема ПЛР РВ, що містить стадії термоциклування і детектування флуоресцентного сигналу, з використанням модуля терморегулювання, що складається з нагрівача і датчика температури; на вказаний модуль поміщається підкладка з теплопровідного матеріалу, а на вказану підкладку наноситься біологічний зразок, наприклад суміш, що містить всі компоненти для проведення ПЛР РВ, яка ізолюється від атмосфери шляхом внесення до віртуального реакційної лунки, утвореної не змішуваною з водою рідиною, наприклад мінеральним маслом. Основними недоліками прототипу є: невисокі реальні швидкості нагрівання та охолодження зразка, технічна складність модуля терморегулювання з інтегрованим мікронагрівачем і термодатчиком, що призводить до подорожчання і знижує комерційну привабливість пристрою. Ще одним недоліком аналога є неконтрольоване зниження чутливості при можливому контакті зразка з поверхнею теплопровідного матеріалу. Крім того, розкриті в описі аналога спосіб і пристрій потребують попереднього приготування розчинів ПЛР компонентів, змішування ПЛР компонентів з пробою і введення утвореної суміші в реакційні зони, що призводить до додаткових трудовитрат, підвищує ризик помилки оператора, і призводить до подорожчання аналізу через зростаючу кількість витратних матеріалів (пробірки, наконечники для дозатора, реактиви). Ще одним недоліком аналога є можливість просторового незбігу нагріваної зони і нагріваного зразка в процесі введення проби і термоциклування, що приведе до недостовірних результатів ПЛР-аналізу. Суть винаходу Задачею даного винаходу є розробка способу і пристрою для його здійснення, які б дозволили: 1. скоротити час аналізу і підвищити продуктивність аналізу; 2. збільшити чутливість, достовірність і надійність аналізу; 3. скоротити трудовитрати на проведення визначення нуклеїнових кислот методом ПЛР РВ; 4. знизити вартість проведення ПЛР-аналізу. 3 UA 101848 C2 5 10 15 20 25 30 35 40 45 50 55 60 Поставлена задача вирішується використанням описаного в даному винаході способу визначення нуклеїнових кислот за допомогою полімеразно-ланцюгової реакції в режимі реального часу і пристрою для виконання ПЛР РВ аналізу, що містить мікрочіп. Пропонується спосіб визначення нуклеїнових кислот за допомогою полімеразно-ланцюгової реакції в режимі реального часу, що включає такі стадії: - введення рідких проб, що містять нуклеїнову кислоту, в реакційні зони на верхній поверхні теплопровідної підкладки мікрочіпа, та ізолювання введених проб від атмосфери; - взаємодія нуклеїнової кислоти проби з компонентами полімеразно-ланцюгової реакції при термоциклуванні проб з відведенням тепла через зовнішню поверхню мікрочіпа; - флуоресцентне визначення зміни кількості продуктів полімеразно-ланцюгової реакції в процесі термоциклування; - визначення кількості початкової нуклеїнової кислоти в пробах за динамікою зростання флуоресцентного сигналу. При цьому мікрочіп виконують з теплопровідною підкладкою із теплопровідного матеріалу з коефіцієнтом теплопровідності понад 1 Вт/смК і з коефіцієнтом теплової дифузії понад 0,6 2 см /с; реакційні зони на поверхні мікрочіпа відокремлюють від теплопровідної підкладки шаром пасивуючого матеріалу, який ковалентно зв'язаний з поверхнею теплопровідного матеріалу, а ізолювання проб, що вводяться, виконують шляхом відділення їх від атмосфери шаром не змішуваної з водою рідини, яку утримують на верхній поверхні теплопровідної підкладки за допомогою периферійного бар'єру, причому відношення сумарної термічної маси мікрочіпа з введеними пробами і шаром не змішуваної з водою рідини до теплової провідності підкладки мікрочіпа не перевищує 0,04 секунди. Пристрій для здійснення вказаного способу містить мікрочіп щонайменше з однією реакційною зоною на його поверхні, який механічно зв'язаний з утримувачем мікрочіпа, термічно зв'язаний з блоком термоциклування і оптично зв'язаний з детектором флуоресцентного випромінювання; пристрій також містить щонайменше одне джерело випромінювання, оптично зв'язане з блоком фільтрації випромінювання каналу освітлення і мікрочіпом, вказаний детектор флуоресцентного випромінювання оптично зв'язаний з мікрочіпом через блок фільтрації випромінювання каналу реєстрації, а вказаний блок термоциклування виконаний з можливістю нагрівання, охолодження і підтримки температури мікрочіпа, крім того пристрій містить систему керування, електрично зв'язану з указаним детектором, джерелом випромінювання і блоком термоциклування. При цьому вказаний мікрочіп містить теплопровідну підкладку, виконану з матеріалу з коефіцієнтом теплопровідності понад 1 Вт/смК і з коефіцієнтом теплової дифузії понад 0,6 2 см /с, кожна з реакційних зон на поверхні вказаного мікрочіпа відокремлена від теплопровідної підкладки шаром пасивуючого матеріалу, ковалентно зв'язаного з поверхнею теплопровідної підкладки; на верхній поверхні вказаного мікрочіпа виконаний периферійний бар'єр з можливістю утримання заданої кількості не змішуваної з водою рідини на верхній поверхні мікрочіпа, при цьому відношення сумарної термічної маси мікрочіпа з введеними пробами і шаром не змішуваної з водою рідини до теплової провідності підкладки мікрочіпа не перевищує 0,04 секунди. Наведена сукупність ознак пропонованого винаходу за рахунок 1) збільшення швидкості термоциклування; 2) усунення інгібування реакції за допомогою захисного покриття поверхні реакційних зон; 3) усунення неконтрольованого переміщення проби відносно реакційної зони; 4) створення мікрочіпа, що містить висушені ПЛР-реагенти, необхідні для визначення заданих нуклеїнових кислот; 5) скорочення витрати реагентів і витратних матеріалів та скорочення трудомісткості аналізу дозволяє вирішити поставлену задачу. У пропонованому винаході використовується мікрочіп, підкладка якого виконана з матеріалів з високою теплопровідністю і тепловою дифузією, при цьому поверхня реакційних зон на верхній поверхні мікрочіпа покрита пасивуючим шаром, причому випаровування ПЛР-суміші усунуте за допомогою шару ізолюючої рідини, а мікрочіп також може містити в реакційних зонах один або декілька компонентів ПЛРсуміші. Можливі різні схеми виконання способу, описаного в даному винаході. Способи здійснення взаємодії нуклеїнової кислоти проби з компонентами ПЛР можуть виконуватися в різних варіантах. Наприклад, проба, що містить нуклеїнову кислоту, перед проведенням аналізу заздалегідь змішується з одним або декількома компонентами ПЛРсуміші. Можливе змішування проби з розчином, що містить всі компоненти, необхідні для проведення ПЛР. Також можливе змішування проби з буферним розчином, що містить один 4 UA 101848 C2 2+ 5 10 15 20 25 30 35 40 45 50 55 2+ компонент, наприклад іони магнію Мg , або декілька компонентів, наприклад, іони магнію Мg і 2+ полімеразу, або наприклад, іони магнію Мg , олігонуклеотидні праймери і флуоресцентномічені зонди. У подібних випадках додавання бракуючих компонентів ПЛР може бути здійснене шляхом введення в реакційні зони рідких розчинів, що містять ці компоненти, до або після введення проб будь-яким з відомих способів. Доцільно, щоб бракуючі компоненти ПЛР були внесені до реакційних зон до введення проб. Ще більш доцільно, щоб до введення проб компоненти ПЛР були внесені до реакційних зон у висушеному вигляді. Для цього в реакційні зони на поверхні мікрочіпа на шар пасивуючого матеріалу доцільно нанести один або декілька компонентів ПЛР у вигляді водного розчину і висушити вказаний розчин. Спосіб припускає, що в реакційні зони можуть бути внесені і висушені ПЛР компоненти, такі як дезоксинуклеозидтрифосфати (дНТФ), прямий і зворотний олігонуклеотидні праймери, флуоресцентно-мічені зонди. Ще більш доцільно нанести в реакційні зони і висушити дезоксинуклеозидтрифосфати (дНТФ), прямий і зворотний олігонуклеотидні праймери, флуоресцентно-мічені зонди, термостабільну полімеразу і стабілізатори. Стабілізатори можуть бути вибрані з ряду речовин, таких як поліцукри (манітол, глюкоза, сахароза). Спосіб передбачає, що флуоресцентне визначення зміни кількості продуктів полімеразноланцюгової реакції в пробах у процесі термоциклування може бути виконане шляхом опромінювання проб вибраним діапазоном довжин хвиль і реєстрації сигналу флуоресценції у вибраному діапазоні довжин хвиль. Переважно, опромінювання проб повинне проводитися в інтервалі 350-700 нм, а флуоресценція повинна реєструватися в інтервалі 450-1000 нм. Далі, спосіб передбачає, що мікрочіп може бути виконаний з різних матеріалів, що переважно мають високі коефіцієнти теплопровідності (понад 1 Вт/смК) і теплової дифузії 2 (понад 0,6 см /с). Таким матеріалом можуть служити метали, наприклад алюміній, мідь, або діелектрики, такі як кремній або кераміка. Найбільш переважними матеріалами є кремній і алюміній. Геометричні розміри мікрочіпа і його маса мають бути невеликі, щоб його термічна маса була малою. Доцільно, щоб товщина підкладки була менше 1 мм, щоб забезпечити її високу теплову провідність. Спосіб передбачає, що шар пасивуючого матеріалу виконаний з речовин, що запобігають необоротній сорбції компонентів ПЛР та інгібуванню реакції. Переважно шар має бути нанесений шляхом ковалентного зв'язування пасивуючої речовини з матеріалом теплопровідної підкладки мікрочіпа, щоб підвищити стійкість пасивуючого шару до тривалого зберігання і до термоциклування під час проведення реакції. Такі речовини можуть бути вибрані з ряду: оксид алюмінію, оксид кремнію, органічні молекули, що утворюють моношари або полімерні покриття. Органічні молекули можуть бути вибрані з ряду: полідиметилсилоксан, поліметилметоксисилоксан, 3-гліцидоксипропілтриметоксисилан, етиленглікольдигліциловий ефір. Ще більш переважно, щоб шар пасивуючого матеріалу в реакційних зонах мав гідрофільні властивості, щоб забезпечити хорошу розтічність розчину при введенні ПЛР-суміші в реакційну зону. При цьому переважно, щоб шар пасивуючого матеріалу поза областю реакційних зон мав гідрофобні властивості для запобігання розтіканню водного розчину за межі реакційної зони. Найдоцільніше, щоб пасивуючий матеріал в реакційних зонах був утворений в результаті реакції шару 3-гліцидоксипропілтриметоксисилану з етиленгліколь-дигліциловим ефіром. Також доцільно, щоб пасивуючий матеріал поза областю реакційних зон був утворений із полімерного шару поліметилметоксисилоксану. Ізолювання від атмосфери проб, введених в реакційні зони, може здійснюватися шляхом нанесення шару ізолюючої рідини на реакційні зони. Як ізолюючу рідину переважно використовувати рідини, що не змішуються з водою, мають меншу густину, ніж вода, і переважно мають температуру кипіння вище 100 °C при атмосферному тиску. Ізолюючі рідини можуть бути вибрані з ряду: мінеральне масло, силіконові рідини різної в'язкості, та їх суміші. Спосіб припускає, що ізолююча рідина оптично прозора в діапазоні довжин хвиль, в якому ведеться збудження і реєстрація люмінесценції флуоресцентних фарбників, що використовуються для детектування продуктів ПЛР РВ. Оптичне пропускання шару ізолюючої рідини у вказаному діапазоні довжин хвиль має бути переважно не менше 10 %. Ще більш переважно, щоб в діапазоні реєстрації люмінесценції фарбників шар ізолюючої рідини створював сигнал флуоресценції не вище 10 % від сигналу, що створюється пробами, поміщеними в реакційні зони. Спосіб припускає, що можливо наносити шар ізолюючої рідини як одноразово (до або після введення проб), так і в два етапи: спочатку шар ізолюючої рідини наносити на незаповнені 5 UA 101848 C2 5 10 15 20 25 30 35 40 45 50 55 60 реакційні зони, потім проводити введення рідких проб крізь вказаний шар ізолюючої рідини, а потім додатково додавати ізолюючу рідину. Можливі різні конструктивні і компонувальні вирішення відповідного винаходові пристрою. Мікрочіп із кремнію зі щонайменше однією реакційною зоною на його поверхні може бути виготовлений методом фотолітографії з подальшим рідинним анізотропним або ізотропним травленням, добре відомим фахівцям в області мікроелектромеханічних систем. Мікрочіп із металу, кераміки або пластика може бути виготовлений методами точного штампування, гарячого литва, лазерної абляції, рідинного ізотропного травлення, плазмового травлення, добре відомими фахівцям в даній області. Лінійні розміри реакційної зони вибираються з 1 4 1 3 діапазону 10 -10 мкм в довжину і ширину, і 10 -10 мкм в глибину. Лінійні розміри реакційної 2 3 2 2 зони вибираються переважно з діапазону 5×10 - 5×10 мкм в довжину і ширину, і 2×10 - 5×10 мкм в глибину. Габаритні розміри мікрочіпа мають бути вибрані такими, щоб термічна маса мікрочіпа була малою, а товщина теплопровідної підкладки має бути мінімальною при збереженні достатньої міцності конструкції. Доцільно, щоб відношення термічної маси мікрочіпа з введеними пробами і шаром не змішуваної з водою рідини до теплової провідності підкладки мікрочіпа не перевищувало 0,04 секунд. Наприклад, цим умовам задовольняє мікрочіп з підкладкою, виконаною з кремнію з розмірами (Д × Ш × В) 28 × 25 × 0,6 мм, з 16 реакційними зонами розміром (Д × Ш × Г) 2 × 2 × 0,4 мм кожна, з периферійним бар'єром, виконаним з поліакриламіду у вигляді прямокутної рамки з габаритними розмірами (Д × Ш × В) 28 × 25 х 3 мм і шириною бортів 4 мм. Периферійний бар'єр може бути виконаний за допомогою конструктивного елементу, що вивищується над верхньою поверхнею мікрочіпа і утворює замкнутий контур так, щоб ізолююча рідина перебувала в цьому контурі в процесі проведення ПЛР. Можливо, щоб периферійний бар'єр був виготовлений з матеріалу теплопровідної підкладки мікрочіпа. Матеріал для виготовлення периферійного бар'єру має бути переважно з невисоким коефіцієнтом теплопровідності і малою теплоємністю. Периферійним бар'єром може служити шар матеріалу з олеофобними властивостями, нанесений на поверхню мікрочіпа навколо реакційних зон. Матеріалом з олеофобними властивостями є переважно алкілсилани з насиченими фторвуглеводневими ланцюгами. Можливо, що периферійний бар'єр виконується у вигляді комбінації конструктивного елементу і шару олеофобного матеріалу. Периферійний бар'єр був виготовлений переважно з можливістю ізолювання реакційних зон від атмосфери шляхом нанесення на нього клейкої плівки. Шар пасивуючого матеріалу, ковалентно зв'язаний з поверхнею мікрочіпа, може бути виконаний шляхом проведення хімічних реакцій на поверхні мікрочіпа. Можливо проводити вказані реакції шляхом взаємодії компонентів з газової фази з поверхнею мікрочіпа, наприклад термохімічне окислення кремнію з утворенням шару оксиду кремнію. Переважно, щоб вказані реакції виконувалися при взаємодії компонентів з рідкої фази з поверхнею мікрочіпа. Переважно роздільно нанести шар пасивуючого матеріалу на поверхню мікрочіпа в областях поза реакційними зонами і шар пасивуючого матеріалу в області реакційних зон. Ще більш переважно нанести на поверхню мікрочіпа в областях поза реакційними зонами шар поліметилметоксисилану, що має гідрофобні властивості, шляхом контактного змочування вказаних областей розчином не полімеризованого поліметилметоксисилану і подальшої термічної полімеризації. При цьому шар пасивуючого матеріалу в області реакційних зон нанести шляхом проведення послідовних хімічних реакцій в реакційних зонах, наприклад шляхом послідовної інкубації в реакційних зонах рідкого 3-гліцидоксипропілтриметоксисилану, а потім рідкого етиленглікольдигліцилового ефіру. Нанесення одного або декількох компонентів полімеразно-ланцюгової реакції в реакційні зони на поверхні мікрочіпа слід переважно виконувати шляхом висушування водного розчину вказаних компонентів ПЛР-суміші. При цьому розчини, що містять необхідні компоненти, мають бути внесені до реакційних зон і висушені в ламінарній шафі при кімнатній температурі. Ще більш переважно, щоб висушування вказаних розчинів проводилося в режимі ліофілізації, при знижених температурах і тиску, наприклад при температурі в діапазоні від мінус 20 °C до мінус 50 °C і тиску в діапазоні від 0,01 до 10 мм рт.ст. Детектор флуоресцентного випромінювання може включати блок фільтрації випромінювання, виконаний з використанням світлофільтрів абсорбції та інтерференційних, а також дихроїчних дзеркал. Джерелом випромінювання може служити світлодіод, оптично зв'язаний з блоком фільтрації випромінювання і мікрочіпом за допомогою оптичних елементів, наприклад лінз і дзеркал. У пристрої згідно з винаходом для детектування декількох продуктів ПЛР в одному мікрореакторі можливо виконати детектор, що містить декілька джерел 6 UA 101848 C2 5 10 15 20 25 30 35 40 45 50 55 60 випромінювання і декілька блоків фільтрації випромінювання, виконаних з можливістю перемикання між одним та іншим джерелом і блоком фільтрації випромінювання. Такий багатоканальний детектор може бути побудований з використанням декількох світлодіодів, світлофільтрів і дихроїчних дзеркал, що відрізняються своїми спектральними характеристиками. Переважно, щоб джерела випромінювання і блоки фільтрації випромінювання створювали світловий потік у вибраному діапазоні довжин хвиль збудження флуоресценції в інтервалі 350700 нм і дозволяли реєструвати сигнал флуоресценції у вибраному діапазоні довжин хвиль в інтервалі 450-1000 нм. Діапазони довжин хвиль збудження і реєстрації флуоресценції вибираються так, щоб детектувати флуоресцентні фарбники, використовувані в практиці ПЛР РВ, які добре знайомі фахівцям в даній області. Прикладами фарбників є, карбоксифлуоресцеїн (FAM), 6-карбокси-2',4,4',5',7,7'-гексахлорфлуоресцеїн (HEX), 6-карбоксиродамін (R6G), карбокси-Х-родамін (ROX), тетраметилкарбоксиродамін (TAMRA), 6-карбокси-4',5'-дихлор-2',7'диметоксифлуоресцеїн (6-JOE), карбоксиродамін (R110). Детектором флуоресцентного випромінювання може служити матричний детектор, фотоелектронний помножувач або фотодіод. У пристрої згідно з винаходом переважно, щоб як детектор випромінювання використовувався матричний детектор, наприклад ПЗЗ-матриця (ПЗЗ - прилад із зарядовим зв'язком) або КМОН-матриця (КМОН-комплементарний метал - оксид напівпровідник). В цьому випадку переважно, щоб на матричному детекторі формувалося зображення мікрочіпа за допомогою оптичних елементів, наприклад, за допомогою лінзового, дзеркально-лінзового або дзеркального об'єктиву. Переважно, щоб матричний детектор дозволяв реєструвати сигнал флуоресценції у всьому діапазоні довжин хвиль в інтервалі 4501000 нм. Блок термоциклування, який термічно зв'язаний з мікрочіпом, може бути виконаний з можливістю нагрівання, охолодження і підтримки температури мікрочіпа з використанням резистивних нагрівачів, напівпровідникових термоелектричних модулів (елементів Пельтьє), індукційних нагрівачів, нагрівачів, що використовують перенесення енергії у вигляді випромінювання, нагрівачів, що використовують перенесення теплової енергії за допомогою потоку рідини або газу, зокрема з використанням конденсації і випаровування. У пристрої згідно з винаходом блок термоциклування виконаний переважно з використанням елемента Пельтьє, оскільки в цьому випадку здійснюється і активне нагрівання, і активне охолодження мікрочіпа. Перелік креслень. Винахід пояснюється кресленнями, на яких представлені: Фіг. 1 Конструкція мікрочіпа для здійснення способу аналізу нуклеїнових кислот методом ПЛР РВ; Фіг. 2 Варіант структури мікрочіпа для здійснення способу аналізу нуклеїнових кислот методом ПЛР РВ з компонентами полімеразно-ланцюгової реакції у висушеному вигляді; Фіг. 3 Приклад функціональної схеми пристрою мікрочіпового ПЛР-аналізатора; Фіг. 4 Результат визначення ДНК методом ПЛР РВ з використанням пристрою згідно з винаходом при використанні температурного режиму, рекомендованого виробником реактивів; Фіг. 5 Результат визначення ДНК методом ПЛР РВ з використанням пристрою згідно з винаходом при використанні температурного режиму зі скороченою тривалістю стадій ПЛР. Докладне розкриття винаходу Приклад виконання мікрочіпа для здійснення способу аналізу нуклеїнових кислот методом ПЛР РВ відповідно до даного винаходу зображений на фіг. 1 і фіг. 2. У реакційній зоні 1, розташованій на верхній поверхні мікрочіпа, знаходиться проба 2. Мікрочіп містить теплопровідну підкладку 3, виконану з теплопровідного матеріалу, коефіцієнт теплопровідності 2 якого становить понад 1 Вт/смК, а коефіцієнт теплової дифузії понад 0,6 см /с. Згідно варіантом виконання, зображеним на фіг. 1, реакційна зона 1 відокремлена від теплопровідної підкладки 3 шаром 4 пасивуючого матеріалу, який ковалентно зв'язаний з поверхнею теплопровідного матеріалу. У іншому варіанті виконання, зображеному на фіг. 2, реакційна зона 1 на поверхні мікрочіпа відокремлена від теплопровідної підкладки 3 шаром 7 пасивуючого матеріалу, який має гідрофільні властивості і ковалентно зв'язаний з поверхнею теплопровідного матеріалу. В області поза реакційною зоною 1 поверхня теплопровідної підкладки 3 покрита шаром 8 пасивуючого матеріалу, який має гідрофобні властивості і ковалентно зв'язаний з поверхнею теплопровідного матеріалу. У реакційній зоні 1 на шарі 8 пасивуючого матеріалу розміщений шар 9, що містить один або декілька компонентів полімеразно-ланцюгової реакції у висушеному вигляді. Згідно з варіантами виконання, зображеними на фіг. 1 і фіг. 2, шар 5 ізолюючої рідини відокремлює введену пробу 2 від атмосфери. Периферійний бар'єр 6 утримує шар 5 ізолюючої 7 UA 101848 C2 5 10 15 20 25 30 35 40 45 50 55 60 рідини на верхній поверхні теплопровідної підкладки 3. Для здійснення способу згідно з винаходом введення проби 2, що містить нуклеїнову кислоту, в реакційну зону 1 здійснюють крізь шар 5 ізолюючої рідини. Нагрівання і охолодження проби 2, поміщеної в реакційну зону 1, здійснюють з боку нижньої поверхні теплопровідної підкладки 3. Флуоресцентне визначення кількості продуктів полімеразно-ланцюгової реакції в пробі 2, поміщеній в реакційну зону 1, в процесі термоциклування виконують з боку верхньої поверхні теплопровідної підкладки 3, крізь шар 5 ізолюючої рідини. Приклад функціональної схеми відповідного винаходові пристрою зображений на фіг. 3. Пристрій містить щонайменше одну реакційну зону на поверхні мікрочіпа 10, який механічно зв'язаний з утримувачем 11 мікрочіпа, термічно зв'язаний з блоком 12 термоциклування і оптично зв'язаний з детектором 13 флуоресцентного випромінювання. Пристрій містить щонайменше одне джерело 14 випромінювання, оптично зв'язане з блоком 15 фільтрації випромінювання каналу освітлення, дихроїчним дзеркалом 16, об'єктивом 17 і мікрочіпом 10. Детектор 13 флуоресцентного випромінювання оптично зв'язаний з мікрочіпом 10 через об'єктив 17, дихроїчне дзеркало 16 і блок 18 фільтрації випромінювання каналу реєстрації. Блок 12 термоциклування виконаний з можливістю нагрівання, охолодження і підтримки температури мікрочіпа 10. Пристрій містить також систему 19 керування, електрично зв'язану з детектором 13 випромінювання, принаймні з одним джерелом 14 випромінювання і блоком 12 термоциклування. Система 19 керування виконана з можливістю перемикання джерел 14 випромінювання між одним джерелом випромінювання та іншим джерелом випромінювання (якщо джерел більше одного), а також з можливістю зміни спектрального діапазону блоку (або блоків) фільтрації випромінювання. Пристрій працює таким чином. Мікрочіп 10 вставляється в утримувач 11 мікрочіпа. На верхню поверхню мікрочіпа 10 наноситься шар 5 ізолюючої рідини і крізь нього здійснюється введення проби 2 в реакційну зону 1. Утримувач 11 мікрочіпа із спорядженим мікрочіпом 10 потім встановлюється в блок 12 термоциклування. Випромінювання від джерела 14 випромінювання прямує в блок 15 фільтрації випромінювання каналу освітлення, потім відбивається від дихроїчного дзеркала 16, потрапляє в об'єктив 17 і потрапляє на пробу 2, розташовану в реакційній зоні 1 мікрочіпа крізь шар 5 ізолюючої рідини. Флуоресцентне випромінювання від проби крізь шар 5 ізолюючої рідини збирається об'єктивом 17 і прямує через дихроїчне дзеркало 16 і блок 18 фільтрації випромінювання каналу реєстрації на детектор 13 флуоресцентного випромінювання. Блок 12 термоциклування, який термічно зв'язаний з мікрочіпом 10, здійснює підведення і відведення тепла для здійснення нагрівання, охолодження і підтримки температури мікрочіпа 10. Високі швидкості нагрівання і охолодження досягаються завдяки малій сумарній термічній масі мікрочіпа з введеними пробами і шаром не змішуваної з водою рідини (у діапазоні від 0,5 до 4 Дж/К), виконаного з використанням теплопровідної підкладки з високою тепловою провідністю (у діапазоні від 100 до 500 Вт/К), що приводить в результаті до малого відношення сумарної термічної маси мікрочіпа до теплової провідності підкладки мікрочіпа (у діапазоні від 0,001 до 0,04 с). Керування температурним режимом блоку 12 термоциклування, вибір і вмикання джерела 14 випромінювання, а також збір і обробку сигналів флуоресцентного детектора 13 під час термоциклування проби, здійснює система 19 керування, електрично зв'язана з блоками 12, 13 і 14. Відомості, що підтверджують можливість здійснення винаходу Винахід ілюструють наведені нижче приклади. Опис даних прикладів не має бути використаний для обмеження домагань даного патенту, він лише ілюструє можливість для фахівців в даній області здійснити винахід. Приклад 1 Мікрочіп, що містить 16 реакційних зон на його поверхні, був виготовлений з полірованих кристалічних кремнієвих пластин завтовшки 0,6 мм методом фотолітографії з наступним анізотропним рідинним хімічним травленням. Розмір теплопровідної підкладки складав 25 × 28 × 0,6 мм. Реакційні зони були розташовані на поверхні мікрочіпа у вигляді матриці 4 × 4, кожна реакційна зона мала форму зрізаної піраміди з розмірами верхньої основи 2 × 2 мм, нижньої основи 1,7 × 1,7 мм і завглибшки 0,4 мм. На кремнієву підкладку по всій поверхні був нанесений шар оксиду кремнію SiO2 методом термохімічного окислення. Кремнієва підкладка з нанесеним шаром SiO2 була очищена в суміші концентрованої сірчаної кислоти і пероксиду водню (3:1) протягом 20 хвилин. Після ретельного промивання дистильованою і деіонізованою водою і висушування поверхні кремнієвої підкладки в області поза реакційними зонами була оброблена поліметилметоксисилоксаном "Пента-111" (Пента-Север, Росія). Після полімеризації при термічній обробці поверхня реакційних зон була оброблена спочатку 3-гліцидоксипропіл 8 UA 101848 C2 5 10 15 20 25 30 35 40 45 50 55 триметоксисиланом (Sigma, США) протягом 60 хв, а потім етиленгліколь-дигліциловим ефіром (Sigma, США) протягом 60 хв. Потім підготовлена таким чином підкладка приєднувалася за допомогою клею до периферійного бар'єру, виконаного з поліакриламіду завтовшки 3 мм. Згідно з проведеними розрахунками, повна термічна маса мікрочіпа із введеними в реакційні зони пробами та ізолюючою рідиною склала 3,35 Дж/К. Теплова провідність кремнієвої підкладки склала 175 Вт/К. При цьому відношення повної термічної маси мікрочіпа до теплової провідності підкладки мікрочіпа не перевищує 0,02 секунди. Виготовлений мікрочіп проходив обробку УФ випромінюванням протягом 5 хв, а потім на верхню поверхню периферійного бар'єру наносилася захисна полімерна плівка для запобігання забрудненню поверхні реакційних зон при зберіганні і при обходженні з мікрочіпом. У такому вигляді мікрочіп міг зберігатися при кімнатній температурі протягом декількох місяців. У пристрої згідно з винаходом як джерела випромінювання були використані світлодіоди XL9030 (Сrее, США), як детектор - ПЗЗ камера MultiBlue (Perkin-Elmer Optoelectronics, США), а в блоці фільтрації випромінювання використовувався набір інтерференційних світлофільтрів XF52 (Omega Optical, США). У блоці термоциклування був використаний елемент Пельтьє (40 Вт, Кріотерм, Росія), а як система керування використовувався персональний комп'ютер зі встановленим програмним забезпеченням. Для проведення ПЛР РВ були приготовані такі розчини: 1) ампліфікаційна суміш, що містить: 80 мМ TRIS-HCI (рН=8,0), 0,1 % Triton X-100, 5 % гліцерин (Sigma, США), 5 мМ МgСІ2, 24 мМ (NH4)2SO4, 0,5 мМ EDTA, дезоксинуклеозидтрифосфати dATP, dTTP, dGTP, dCTP по 500 мкМ кожного, OligoTaq ДНК-полімераза 0,1 U/μl (Promega, США); прямий і зворотний олігонуклеотидні праймери в концентрації 0,5 мкМ, флуоресцентно-мічений олігонуклеотидний зонд в концентрації 0,2 мкМ для визначення Escherichia coli, штам С600, фрагмент гена 16S рРНК, стерильна деіонізована вода. 2) розчин зразка, що містить 104 ДНК копій Escherichia coli в 1 мкл, штам С600, в стерильній деіонізованій воді (зразок К+). Як зразок, що не містить специфічну ДНК, використовувалася стерильна деіонізована вода (зразок К-). Розчини готувалися безпосередньо перед проведенням аналізу, змішувалися між собою в співвідношенні 1:1, перемішувалися шляхом вортексування і піпетувания, а потім центрифугувались. Отриману робочу суміш ПЛР використовували для введення в реакційні зони мікрочіпа. На верхню поверхню мікрочіпа, обмежену периферійним бар'єром, за допомогою мікродозатора вносилося 100 мкл силіконової рідини ПМС-200 (Пента-Север, Росія), яка служила ізолюючою рідиною. Введення робочої ПЛР-суміші об'ємом 2 мкл здійснювалося за допомогою мікродозатора крізь шар ізолюючої рідини. Завдяки тому, що поверхня реакційних зон мала гідрофільні властивості, а поверхня поза областю реакційних зон мала гідрофобні властивості, розчин легко розтікався по реакційних зонах і при цьому утримувався в них, не розтікаючись по поверхні підкладки і запобігаючи таким чином взаємній контамінації. Термоциклування здійснювалося за температурним режимом, рекомендованим виробником реактивів, а саме: активація полімерази 94 °C протягом 180 с (1 цикл), денатурація ДНК 94 °C протягом 20 с, відпал праймерів 58 °C протягом 40 с, елонгація ампліконів і зчитування сигналу флуоресценції 72 °C протягом 20 с (45 циклів). Результат ПЛР РВ наведений на фіг. 4. Для ПЛР РВ кривих характерно те, що на початкових циклах інтенсивність флюоресценції мала і практично не змінюється. Цей рівень флюоресценції називається базовим. Показником накопичення продукту реакції є так званий "пороговий цикл" (Ct, threshold cycle), тобто цикл, на якому інтенсивність флюоресценції починає перевищувати базовий поріг. З фіг. 4 видно, що в пробах, що містять шукану ДНК, спостерігається збільшення сигналу флуоресценції, а в пробах, що не містять ДНК, сигнал флуоресценції залишається на базовому рівні. Порівняння середньої величини порогових циклів (Ct), отриманих для описаних в цьому прикладі розчинів з використанням пристрою згідно з винаходом (Ct=31,3), і порогових циклів, отриманих на комерційно доступному устаткуванні SmartCycler II (Cepheid, США) з використання повністю аналогічного режиму термоциклування (Ct=31,0), показує, що аналітичні характеристики пристрою згідно з винаходом і комерційного устаткування порівнянні. При цьому максимальні швидкості нагрівання і охолодження для пристрою згідно з винаходом склали 16,5 і 14,3 °C/с, відповідно, що в 4 і 8 разів вище, ніж аналогічні параметри у звичайного лабораторного устаткування, а також в 2 і 5 разів вище, ніж у найбільш швидких зразків комерційно доступного устаткування. 9 UA 101848 C2 5 10 15 20 25 30 35 40 45 50 55 Час, що витрачається в цьому прикладі на досягнення порогового циклу при використанні пристрою згідно винаходу, склав 53,1 хв. Приклад 2 Використовувався мікрочіп і пристрій згідно з винаходом, аналогічні описаним в прикладі 1. Для проведення ПЛР РВ були приготовані розчини, аналогічні прикладу 1. Приготування робочої ПЛР-суміші та її введення в реакційні зони мікрочіпа здійснювалося аналогічно прикладу 1. Термоциклування здійснювалося за температурним режимом, в якому була скорочена тривалість стадій денатурації, відпалу праймерів і елонгації, а саме: активація полімерази 94 °C протягом 120 с (1 цикл), денатурація ДНК 94 °C протягом 3 с, відпал праймерів 58 °C протягом 3 с, елонгація ампліконів і зчитування сигналу флуоресценції 72 °C протягом 8 с (45 циклів). Результат ПЛР РВ наведений на фіг. 5. З фігури видно, що в пробах, що містять шукану ДНК, спостерігається збільшення сигналу флуоресценції, а в пробах, що не містять ДНК, збільшення сигналу флуоресценції не відбувається. Порівняння порогових циклів (Ct), отриманих з використанням пристрою згідно з винаходом при температурному режимі, рекомендованому виробником тест-систем Ct=31,3, і при температурному режимі, в якому була скорочена тривалість стадій ПЛР Ct=31,9, показує, що ефективність ПЛР реакції при використанні скороченого температурного режиму змінилася незначною мірою. При цьому час, що витрачається в цьому прикладі на досягнення порогового циклу, при використанні пристрою згідно з винаходом склав 18,0 хв, що більш ніж в 3 рази швидше, ніж при використанні одного з найшвидших комерційно доступних ПЛР-аналізаторів Smart Cycler II (54,7 хв). Приклад 3 Використовувався мікрочіп і пристрій згідно з винаходом, аналогічні описаним в прикладі 1. Для проведення ПЛР РВ були приготовані такі розчини: 1) ампліфікаційна суміш, що містить: 80 мМ TRIS-HCI (рН=8,0), 0,1 % Triton X-100, 24 мМ (NH4)2SO4, 0,5 мМ EDTA, дезоксинуклеозидтрифосфати dATP, dTTP, dGTP, dCTP по 500 мкМ кожного, 0,16 % D-глюкоза, 1,6 % інулін, 8 % D-манітол (Sigma, США), OligoTaq ДНК-полімераза 0,1 U/μl (Promega, США); прямий і зворотний праймери в концентрації 0,5 мкМ, флуоресцентномічений олігонуклеотидний зонд в концентрації 0,2 мкМ для визначення ДНК Escherichia coli, штам С600, фрагмент гена 16S рРНК, стерильна деіонізована вода. 2) розчин зразка, що містить: 104 ДНК копій в 1 мкл Escherichia coli, штам С600, в стерильній деіонізованій воді (зразок К+) або стерильна деіонізована вода (зразок К-), розчинені в розчині, що містить 5 мМ МgСІ2, 10 мМ TRIS-HCI (рН=8,0), 0,1 % Triton X-100, 5 % гліцерин (Sigma, CШA) і стерильну деіонізовану воду. У кожну з 16 реакційних зон мікрочіпа вносилося по 1 мкл ампліфікаційної суміші, приготовленої згідно з п. 1 цього прикладу. Суміш висушувалася в ламінарній шафі при кімнатній температурі протягом 2-3 годин до утворення щільного шару, що міцно утримується в реакційних зонах. На верхню поверхню периферійного бар'єру наносилася захисна плівка з клейовим шаром, що ізолює реакційні зони від атмосфери, для запобігання забрудненню поверхні реакційних зон при зберіганні і при обходженні з мікрочіпом. У такому вигляді мікрочіп міг зберігатися при кімнатній температурі протягом декількох тижнів. Для проведення ПЛР-аналізу введення розчину зразка згідно п. 2 цього прикладу, здійснювалося в реакційні зони мікрочіпа аналогічно прикладу 1. Термоциклування здійснювалося за температурним режимом, рекомендованим виробником реактивів, а саме: активація полімерази 94 °C протягом 180 с (1 цикл), денатурація ДНК 94 °C протягом 20 с, відпал праймерів 58 °C протягом 40 с, елонгація ампліконів і зчитування сигналу флуоресценції 72 °C протягом 20 с (45 циклів). В результаті були отримані ПЛР РВ криві (дані не наведені), з яких було видно, що в пробах, що містять шукану ДНК, спостерігається збільшення сигналу флуоресценції, а в пробах, що не містять ДНК, збільшення сигналу флуоресценції не відбувається. У експерименті було встановлено, що кількість витратних матеріалів, трудовитрат і часу, що витрачаються на виконання підготовчих операцій з приготування зразків і введення отриманих сумішей в реакційні зони, значно скорочується при використанні способу і пристрою згідно з винаходом у порівнянні із звичайним устаткуванням. Наприклад, кількість ПЛР реагентів скоротилася в 12 разів, кількість наконечників для дозатора скоротилася в 6 разів, кількість стадій піпетування скоротилася в 2 рази, час, потрібний на проведення підготовчих операцій, скоротився в 4 рази. До важливих достоїнств даного винаходу, що приводять до досягнення поставленого завдання, можна віднести: 10 UA 101848 C2 5 10 1. збільшення швидкості термоциклування зразка за рахунок використання матеріалів з високою теплопровідністю, а також за рахунок забезпечення контакту зразка з поверхнею реакційної зони; 2. усунення інгібування ПЛР за допомогою пасивуючого покриття поверхні реакційних зон, що збільшує чутливість, достовірність і надійність аналізу; 3. скорочення трудовитрат і вартості проведення ПЛР-аналізу за рахунок використання мікрочіпа, що містить висушені реагенти ПЛР. Вище наведені переважні приклади здійснення винаходу, що не обмежують суті та обсягу винаходу, а лише ілюструють його. Фахівці в даній області без утруднень зможуть знайти різні зміни і удосконалення запропонованого винаходу, які теж підпадають під його обсяг, відображений у формулі винаходу. ФОРМУЛА ВИНАХОДУ 15 20 25 30 35 40 45 50 55 60 1. Спосіб визначення нуклеїнових кислот методом полімеразно-ланцюгової реакції в режимі реального часу, що включає введення рідких проб, що містять нуклеїнову кислоту, в реакційні зони на верхній поверхні теплопровідної підкладки мікрочипа; ізолювання введених проб від атмосфери; взаємодію нуклеїнової кислоти проби з компонентами полімеразно-ланцюгової реакції при термоциклуванні проб з відведенням тепла через зовнішню поверхню мікрочипа; флуоресцентне визначення зміни кількості продуктів полімеразно-ланцюгової реакції в процесі термоциклування; визначення кількості початкової нуклеїнової кислоти в пробах за динамікою зростання флуоресцентного сигналу, який відрізняється тим, що використовують мікрочип з теплопровідної підкладкою з теплопровідного матеріалу з коефіцієнтом теплопровідності понад 2 1 Вт/см•K і з коефіцієнтом теплової дифузії понад 0,6 см /с, при цьому реакційні зони на поверхні мікрочипа відокремлюють від теплопровідної підкладки шаром пасивуючого матеріалу, який ковалентно зв'язаний з поверхнею теплопровідного матеріалу, а ізолювання введених проб виконують шляхом відділення їх від атмосфери шаром не змішуваної з водою рідини, яку утримують на верхній поверхні теплопровідної підкладки за допомогою периферійного бар'єра, причому відношення сумарної термічної маси мікрочипа з введеними пробами і шаром не змішуваної з водою рідини і теплової провідності підкладки мікрочипа не перевищує 0,04 секунди. 2. Спосіб за п. 1, який відрізняється тим, що флуоресцентне визначення зміни кількості продуктів полімеразно-ланцюгової реакції в пробах у процесі термоциклування виконують шляхом опромінювання проб вибраним діапазоном довжин хвиль з інтервалу 350-700 нм і реєстрації сигналу флуоресценції у вибраному діапазоні довжин хвиль з інтервалу 450-1000 нм. 3. Спосіб за п. 1, який відрізняється тим, що як теплопровідний матеріал використовують кремній. 4. Спосіб за п. 1, який відрізняється тим, що як теплопровідний матеріал використовують метал. 5. Спосіб за п. 4, який відрізняється тим, що як метал використовують алюміній або мідь. 6. Спосіб за п. 1, який відрізняється тим, що як пасивуючий матеріал використовують оксид кремнію або оксид металу, або поліметилметоксисилоксан або 3гліцидоксипропілтриметоксисилан з етиленглікольдигліциловим ефіром. 7. Спосіб за п. 1, який відрізняється тим, що введення рідких проб в реакційні зони здійснюють крізь шар не змішуваної з водою рідини. 8. Спосіб за п. 1, який відрізняється тим, що як пасивуючий матеріал на поверхні мікрочипа в реакційних зонах використовують гідрофільний матеріал, а як пасивуючий матеріал на поверхні мікрочипа між реакційними зонами використовують гідрофобний матеріал. 9. Спосіб за п. 8, який відрізняється тим, що як пасивуючий матеріал на поверхні мікрочипа в реакційних зонах використовують 3-гліцидоксипропілтриметоксисилан з етиленглікольдигліциловим ефіром, а як пасивуючий матеріал на поверхні мікрочипа між реакційними зонами використовують поліметилметоксисилоксан. 10. Спосіб за п. 1, який відрізняється тим, що використовують шар не змішуваної з водою рідини, пропускання якого у вибраному спектральному діапазоні опромінювання і у вибраному спектральному діапазоні флуоресценції не менше 10 %. 11. Спосіб за п. 1, який відрізняється тим, що використовують шар не змішуваної з водою рідини, сигнал флуоресценції від якої не перевищує 10 % від сигналу, що створюється пробами, поміщеними в реакційні зони. 12. Спосіб за п. 1, який відрізняється тим, що як не змішувану з водою рідину використовують поліметилсилоксанову рідину, густота якої менша, ніж густота води. 11 UA 101848 C2 5 10 15 20 25 30 35 40 45 50 13. Спосіб за п. 1, який відрізняється тим, що в реакційні зони на поверхні мікрочипа на шар пасивуючого матеріалу наносять один або декілька компонентів полімеразно-ланцюгової реакції у вигляді водного розчину і висушують вказаний розчин. 14. Спосіб за п. 13, який відрізняється тим, що водний розчин, що містить один або декілька компонентів полімеразно-ланцюгової реакції, висушують шляхом ліофільного висушування. 15. Пристрій для визначення нуклеїнових кислот методом полімеразно-ланцюгової реакції в режимі реального часу, що містить мікрочип щонайменше з однією реакційною зоною на його поверхні, який механічно зв'язаний з утримувачем мікрочипа і оптично зв'язаний з детектором флуоресцентного випромінювання через блок фільтрації випромінювання каналу реєстрації, що включає щонайменше одне джерело випромінювання, оптично зв'язане з блоком фільтрації випромінювання каналу освітлення і мікрочипом, а також систему керування, електрично зв'язану з блоком термоциклування, який термічно зв'язаний з мікрочипом і виконаний з можливістю нагрівання, охолодження і підтримки температури мікрочипа, який відрізняється тим, що мікрочип містить термічно зв'язану з блоком термоциклування теплопровідну підкладку, виконану з матеріалу з коефіцієнтом теплопровідності понад 1 Вт/см•K і з коефіцієнтом теплової 2 дифузії понад 0,6 см /с, а кожна з реакційних зон відокремлена від теплопровідної підкладки шаром пасивуючого матеріалу, ковалентно зв'язаного з поверхнею теплопровідної підкладки, причому на верхній поверхні мікрочипа виконаний периферійний бар'єр з можливістю утримання заданої кількості не змішуваної з водою рідини на верхній поверхні мікрочипа, причому відношення сумарної термічної маси мікрочипа з введеними пробами і шаром не змішуваної з водою рідини до теплової провідності підкладки мікрочипа не перевищує 0,04 секунди. 16. Пристрій за п. 15, який відрізняється тим, що як джерело випромінювання містить принаймні один світлодіод. 17. Пристрій за п. 15, який відрізняється тим, що як джерело випромінювання містить матрицю світлодіодів. 18. Пристрій за п. 15, який відрізняється тим, що система керування виконана з можливістю перемикання джерел випромінювання між одним джерелом випромінювання та іншим джерелом випромінювання. 19. Пристрій за п. 15, який відрізняється тим, що система керування виконана з можливістю зміни спектрального діапазону блока (або блоків) фільтрації випромінювання. 20. Пристрій за п. 15, який відрізняється тим, що як детектор флуоресцентного випромінювання містить матричний детектор. 21. Пристрій за п. 17, який відрізняється тим, що як детектор флуоресцентного випромінювання містить фотоелектронний помножувач. 22. Пристрій за п. 17, який відрізняється тим, що як детектор флуоресцентного випромінювання містить фотодіод. 23. Пристрій за п. 15, який відрізняється тим, що блок термоциклування містить елемент Пельтьє. 24. Пристрій за п. 15, який відрізняється тим, що мікрочип виконано таким чином, що поверхня мікрочипа в реакційних зонах покрита шаром гідрофільного пасивуючого матеріалу, а поверхня мікрочипа між реакційними зонами покрита гідрофобним пасивуючим матеріалом. 25. Пристрій за п. 15, який відрізняється тим, що мікрочип виконано таким чином, що реакційні зони на поверхні мікрочипа зверху шару пасивуючого матеріалу містять один або декілька компонентів полімеразно-ланцюгової реакції у висушеному вигляді. 26. Пристрій за п. 15, який відрізняється тим, що периферійний бар'єр виконано з можливістю ізоляції реакційних зон від атмосфери за допомогою клейової плівки. 27. Пристрій за п. 15, який відрізняється тим, що система керування виконана з можливістю автоматичного перемикання джерел випромінювання і блоків фільтрації світлового випромінювання і синхронізованого з цими перемиканнями збору сигналів від детектора випромінювання. 12 UA 101848 C2 13 UA 101848 C2 14 UA 101848 C2 15 UA 101848 C2 Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod and a device for determination of nucleic acids by real-time polymerase chain reaction
Автори англійськоюStroganov, Alexander Anatolyevich, Slyadnev, Maxim Nikolaevich
Назва патенту російськоюСпособ определения нуклеиновых кислот методом полимеразно-цепной реакции в режиме реального времени и устройство для его осуществления
Автори російськоюСтроганов Александр Анатольевич, Сляднев Максим Николаевич
МПК / Мітки
МПК: C12P 19/34, C12Q 1/68, C12Q 1/25
Мітки: реакції, здійснення, полімеразно-ланцюгової, часу, спосіб, режимі, методом, кислот, реального, визначення, пристрій, нуклеїнових
Код посилання
<a href="https://ua.patents.su/18-101848-sposib-viznachennya-nuklenovikh-kislot-metodom-polimerazno-lancyugovo-reakci-v-rezhimi-realnogo-chasu-i-pristrijj-dlya-jjogo-zdijjsnennya.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення нуклеїнових кислот методом полімеразно-ланцюгової реакції в режимі реального часу і пристрій для його здійснення</a>