Композиція для перорального введення
Номер патенту: 102403
Опубліковано: 10.07.2013
Автори: Ольсен Христина Курре, Хертель Клаус Петер, Бруун Лоне, Віллумсен Біргітте, Холм Рене, Кау Христине, Сьобю Карина Крьоєр
Формула / Реферат
1. Пероральна фармацевтична композиціядля лікування захворювань центральної нервової системи, яка містить як активне начало 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазин формули (І)
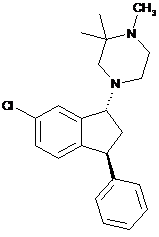 , (І)
, (І)
у формі сукцинатної або малонатної солі, яка відрізняється тим, що містить вказане активне начало у кількості 4-14 мг в розрахунку на вільну основу, при цьому вказана композиція призначена для введення один раз на день.
2. Композиція за п. 1, яка відрізняється тим, що вона являє собою лікарську форму у вигляді пігулки або капсули для перорального введення.
3. Композиція за п. 1 або 2, яка відрізняється тим, що кількість активного начала становить 4-12 мг, 5-14 мг, 4-6 мг, 6-8 мг, 8-10 мг, 10-12 мг, 12-14 мг, 5-7 мг, 7-9 мг, 9-11 мг, 11-13 мг, 5 мг, 7 мг, 10 мг або 14 мг в розрахунку на вільну основу.
4. Композиція за будь-яким з пп. 1-3, яка відрізняється тим, що захворювання центральної нервової системи вибране з групи, яка складається з когнітивної дисфункції, шизофренії, шизофреноформного розладу, шизоафективного розладу, маревного розладу, короткочасного психотичного розладу, спільного (розділеного) психотичного розладу, манії при біполярному розладі, тривожних розладів, депресії, підтримки біполярних розладів, порушень сну, мігрені, паркінсонізму, що індукується нейролептичними лікарськими засобами, або кокаїнової залежності, нікотинової залежності або алкогольної залежності.
Текст
Реферат: Винахід стосується пероральної фармацевтичної композиції для лікування захворювань центральної нервової системи, яка містить як активне начало 4-((1R,3S)-6-хлор-3-феніліндан-1іл)-1,2,2-триметилпіперазин у кількості 4-14 мг в розрахунку на вільну основу. UA 102403 C2 (12) UA 102403 C2 UA 102403 C2 5 10 15 20 25 30 35 40 45 Даний винахід відноситься до фармацевтичної композиції, призначеної для перорального введення, яка містить низькі дози 4-((1R, 3S)-6-хлор-3-феніліндан-1-іл)-1,2,2триметилпіперазину. Окрім цього, винахід відноситься до покращеного зв'язувального агента в композиції, яка містить 4-((1R, 3S)-6-хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазин. Попередній рівень техніки Сполука, яка є об'єктом цього винаходу, 4-((1R, 3S)-6-хлор-3-феніліндан-1-іл)-1,2,2триметилпіперазин, має формулу (I) . Міжнародна патентна публікація WO 2005/016900 описує сполуку формули I (сполуку I) як вільну основу і відповідні їй солі сукцинат і малонат. Повідомляється, що сполука має високу афінність по відношенню до дофамінових рецепторів D1 і D2 (антагоніст), по відношенню до рецептора 5-НТ2 (антагоніст) і по відношенню до α1-адренорецепторів. У WO 2005/016900 припускають, що ця сполука є придатною для лікування декількох захворювань центральної нервової системи, включаючи психоз, зокрема, шизофренію (позитивні, негативні і/або депресивні симптоми), або інші захворювання, що мають психотичні симптоми, такі як, наприклад, шизофренія, шизофреноформний розлад, шизоафективний розлад, маревний розлад, короткочасний психотичний розлад, спільний (розділений) психотичний розлад, а також інші психотичні розлади або захворювання, пов'язані з психотичними симптомами, наприклад, манії при біполярному розладі. WO 2005/016900 також пропонує застосування сполуки формули I для лікування тривожних розладів, афективних розладів, включаючи депресію, для лікування біполярних розладів, порушень сну, мігрені, паркінсонізму, що індукується нейролептичними лікарськими засобами, а також кокаїнової залежності, нікотинової залежності, алкогольної залежності і інших розладів, пов'язаних із зловживаннями різними агентами. Інші публікації, що описують сполуку формули I і споріднені сполуки, що мають описаний вище фармакологічний профіль, - це ЕР 638073; Bøgesø K.P. et al., J. Med. Chem., 1995, 38, стор. 4380-4392, і Bøgesø K.P. "Drug Hunting, the Medicinal Chemistry of 1-Piperazino-3-phenylindanes and Related Compounds", 1998, ISBN 8788085-10-4 (див., наприклад, сполуку 69 в таблиці 3, стор. 47 і в таблиці 9А, стор. 101). Опис винаходу Сполука формули I являє собою припустиму антипсихотичну сполуку з афінністю по відношенню до дофамінових рецепторів D1 і D2. Доклінічні експерименти на щурах з використанням моделі умовної реакції уникнення (CAR) (експериментальної процедури, описаної раніше в Hertel P., Olsen C.K., Arnt J. Repeated administration of the neurotensin analogue NT69L induces tolerance to its supрressant effect on conditioned avoidance behaviour. Eur. J. Pharmacol. 2002; 439(1-3):107-11) показали, що сполука формули I має антипсихотичну активність при дуже низьких рівнях зайнятості рецепторів D2. В ході дослідження за допомогою позитрон-емісійної томографії (РЕТ) на здорових суб'єктах 11 з використанням 11C-SCH23390 і С-раклоприду як ізотопних індикаторів рецепторів D1 і D2 було встановлено, що сполука формули I індукує зайнятість рецепторів D2 від 11 до 43 % в шкаралупі (putamen) при зростанні дози від 2 до 10 мг на день, яку вводили щодня протягом 18 днів. Вказаний рівень зайнятості рецепторів D2 є низьким в порівнянні з тим же показником для антипсихотичних лікарських засобів, що використовуються в даний час, які зазвичай вимагають зайнятості рецепторів D2 біля або вище 50 % для своєї терапевтичної ефективності (Stone J.M., Davis J.M., Leucht S., Pilowsky L.S. Cortical Dopamine D2/D3 Receptors Are а Common Site of Action for Antipsychotic Drugs; An Original Patient data Meta-analysis of the SPECT and PET In Vivo, Schizophr. Bull. 2008, Feb. 26. [електронна публікація перед виданням]). У тому ж дослідженні РЕТ було встановлено, що сполука формули I індукує зростання зайнятості рецепторів D1 від 32 до 69 % в шкаралупі при зростанні дози від 2 до 10 мг на день, яку вводили щодня протягом 1 UA 102403 C2 5 10 15 20 25 30 35 40 45 18 днів. Вказаний високий рівень зайнятості D1 зазвичай не спостерігається для антипсихотичних лікарських засобів, що використовуються в даний час (Farde L., Nordström A.L., Weisel F.A., Pauli S., Halldin C., Sedvall G. Positron emission tomographic analisys of central D1 and D2 dopamine receptor occupancy in patients treated with classical neuroleptics and clozapine. Relation to extrapyramidal side effects. Arch. Gen. Psychiatry 1992; 49(7):538-44). Таким чином, сполука формули I демонструє унікальне співвідношення зайнятості рецепторів D1:D2 при низьких щоденних дозах. На підставі вищезгаданого очікується, що сполука формули I має клінічно значущі терапевтичні ефекти у пацієнтів з шизофренією в дозах (від 4 мг на день до 14 мг на день), які індукують лише низький рівень зайнятості рецепторів D2. Це цілком може бути наслідком високої зайнятості рецепторів D1 і унікального співвідношення зайнятості рецепторів D1 і D2, які демонструє сполука формули I. Низька зайнятість рецепторів D2 при використанні терапевтично ефективних доз буде сприятливою з точки зору зменшення тенденції виникнення проблемних побічних ефектів, що опосередковуються блокадою рецепторів D2, включаючи екстрапірамідні побічні ефекти і гіперпролактинемію. Сполука формули I в терапевтично ефективній кількості 4-14 мг в розрахунку на вільну основу вводиться перорально і може бути представлена в будь-якій формі, відповідній для вказаного введення, наприклад, у формі пігулок, капсул, порошків, сиропів або розчинів. У одному варіанті здійснення цього винаходу сіль сполуки формули I вводять у вигляді твердої фармацевтичної форми, наприклад, у вигляді пігулки або капсули. Способи виготовлення твердих фармацевтичних композицій або препаратів добре відомі фахівцям. Так, пігулки можна виготовляти змішуванням активного інгредієнта із звичайними ад'ювантами, наповнювачами і розріджувачами і подальшим пресуванням суміші з використанням відповідної таблетувальної машини. Приклади ад'ювантів, наповнювачів і розріджувачів включають кукурудзяний крохмаль, лактозу, тальк, стеарат магнію, желатин, камедь і тому подібне. Типові наповнювачі вибирають з лактози, маніту, сорбіту, целюлози і мікрокристалічної целюлози. Будь-які інші ад'юванти або добавки, такі як барвники, ароматизатори, консерванти і тому подібне, також можна використовувати за умови, що вони сумісні з активним інгредієнтом. Як вже вказувалося, сполука 4-((1R, 3S)-6-хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазин має загальну формулу (I) , та згадується в цьому описі як "сполука формули I", що позначає будь-яку форму сполуки, таку як вільна основа, її фармацевтично прийнятні солі, наприклад, фармацевтично прийнятні кислотно-адитивні солі, такі як солі сукцинат і малонат, гідрати або сольвати вільної основи або їх солей, а також безводні форми, аморфні форми або кристалічні форми. Сполука формули I, призначена для включення в композицію за цим винаходом, також включає її солі, зазвичай фармацевтично прийнятні солі. Вказані солі включають фармацевтично прийнятні кислотно-адитивні солі. Кислотно-адитивні солі включають солі неорганічних кислот, а також органічних кислот. Репрезентативні приклади відповідних неорганічних кислот включають хлористоводневу, бромистоводневу, йодистоводневу, фосфорну, сірчану, сульфамінову, азотну кислоти і тому подібні. Репрезентативні приклади відповідних органічних кислот включають мурашину, оцтову, трихлороцтову, трифтороцтову, пропіонову, бензойну, коричну, лимонну, фумарову, гліколеву, ітаконову, молочну, метансульфонову, малеїнову, яблучну, малонову, мигдалеву, щавлеву, пікринову, піровиноградну, саліцилову, бурштинову, метансульфонову, етансульфонову, винну, аскорбінову, памову, бісметиленсаліцилову, етандисульфонову, глюконову, цитраконову, аспарагінову, стеаринову, пальмітинову, EDTA, гліколеву, п-амінобензойну, глутамінову, 2 UA 102403 C2 5 10 15 20 25 30 35 40 45 бензолсульфонову, п-толуолсульфонову кислоти, теофіліноцтові кислоти, а також 8галогентеофіліни, наприклад, 8-бромтеофілін, і тому подібне. Крім того, сполука формули I може існувати в несольватованій формі, а також в сольватованих формах з фармацевтично прийнятними розчинниками, такими як вода, етанол і тому подібне. Взагалі, сольватовані форми розглядаються як еквівалентні несольватованим формам для цілей цього винаходу. Цей винахід відноситься до фармацевтичної композиції, яка включає сполуку формули I у терапевтично ефективній кількості у 4-14 мг в розрахунку на вільну основу. У ще одному варіанті здійснення цього винаходу композиція, яка включає сполуку формули I, призначена для лікування когнітивної дисфункції, шизофренії, шизофреноформного розладу, шизоафективного розладу, маревного розладу, короткочасного психотичного розладу, спільного (розділеного) психотичного розладу, манії при біполярному розладі, тривожних розладів, депресії, підтримки біполярних розладів, порушень сну, мігрені, паркінсонізму, що індукується нейролептичними лікарськими засобами, або кокаїнової залежності, нікотинової залежності або алкогольної залежності. Типовим використанням композиції за цим винаходом є лікування шизофренії, наприклад позитивних симптомів шизофренії, або когнітивної дисфункції при шизофренії. У ще одному аспекті цей винахідвідноситься до застосування сполуки формули (I) для виготовлення лікарського засобу для лікування когнітивної дисфункції, шизофренії, шизофреноформного розладу, шизоафективного розладу, маревного розладу, короткочасного психотичного розладу, спільного (розділеного) психотичного розладу, манії при біполярному розладі, тривожних розладів, депресії, підтримки біполярних розладів, порушень сну, мігрені, паркінсонізму, що індукується нейролептичними лікарськими засобами, або кокаїнової залежності, нікотинової залежності або алкогольної залежності, де сполука формули I представлена в терапевтично ефективній кількості у 4-14 мг в розрахунку на вільну основу. У ще одному аспекті цей винахід відноситься також до способу лікування когнітивної дисфункції, шизофренії, шизофреноформного розладу, шизоафективного розладу, маревного розладу, короткочасного психотичного розладу, спільного (розділеного) психотичного розладу, манії при біполярному розладі, тривожних розладів, депресії, підтримки біполярних розладів, порушень сну, мігрені, паркінсонізму, що індукується нейролептичними лікарськими засобами, або кокаїнової залежності, нікотинової залежності або алкогольної залежності, який включає введення терапевтично ефективної кількості у 4-14 мг в розрахунку на вільну основу сполуки формули I, у пацієнта, який потребує цього. У варіанті здійснення композиції, застосування або способу лікування за цим винаходом сполука формули I виготовляється у формі для перорального введення, такій як пігулка або капсула, зазвичай пігулка. Композицію, таку як пігулка, зазвичай вводять перорально один раз на день. У ще одному варіанті здійснення композиції, застосування або способу лікування сполука формули I виготовляється у формі сукцинату або малонату. Зазвичай, у формі сукцинату. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 4-12 мг. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 5-14 мг. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 4-6 мг, наприклад, 5 мг. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 6-8 мг, наприклад, 7 мг. 3 UA 102403 C2 5 10 15 20 25 30 35 40 45 У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 8-10 мг. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 10-12 мг. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 12-14 мг, наприклад 14 мг. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 5-7 мг. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 7-9 мг. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 9-11 мг, наприклад, 10 мг. У інших варіантах здійснення композиції, застосування або способу лікування кількість сполуки формули I складає 11-13 мг. У разі, коли винахід відноситься до застосування або до способу лікування, то доза понад 414 мг, наприклад, 5 мг, 7 мг, 10 мг або 14 мг, приводиться на щоденній основі. У ще одному варіанті здійснення композиції, застосування або способу лікування композиція додатково включає повідон, такий як Kollidone 30 (CAS-№ 94800-10-9), або коповідон, такий як Kollidone VA64 (CAS-№ 25086-89-9), як зв'язувальний агент. Цей зв'язувальний агент зазвичай присутній в концентрації, що знаходиться в діапазоні 2-10 % (мас./мас.), наприклад, 2-4 %, 46 %, 6-8 %, 8-10 %, 2-8 %, 4-8 %, 4-10 % або 6-10 % (мас./мас.). У ще одному аспекті цей винахід відноситься також до фармацевтичної композиції, яка включає сполуку формули I і повідон або коповідон як зв'язувальний агент. Зв'язувальним агентом є Kollidone VA64. У одному варіанті здійснення цього винаходу зв'язувальний агент присутній в концентрації, що знаходиться в діапазоні 2-10 % (мас./мас.). Зазвичай, в концентрації, що знаходиться в діапазоні 2-4 %, 4-6 %, 6-8 % або 8-10 % (мас./мас.). У випадках, коли зв'язувальним агентом є повідон або коповідон, типові наповнювачі вибрані з гідрофосфату кальцію, лактози, маніту, сорбіту, целюлози і мікрокристалічної целюлози, і, переважно, лактози, маніту, сорбіту, целюлози і мікрокристалічної целюлози, наприклад, лактози. У одному варіанті здійснення цього винаходу наповнювач, такий як будь-який з перелічених вище, присутній в концентрації, що знаходиться в діапазоні 15-50 % (мас./мас.). Зазвичай наповнювач, такий як будь-який з лактози, маніту, сорбіту, целюлози і мікрокристалічної целюлози, присутній в концентрації, що знаходиться в діапазоні 15-25 %, 20-50 %, 30-45 % (мас./мас.). У ще одному варіанті здійснення композиції сполука формули (I) знаходиться у формі сукцинатної солі. Експериментальний розділ Безпека і ефективність сполуки формули I для пацієнта з шизофренією будуть досліджені з використанням стандартних способів визначення ефективності (включаючи шкалу позитивних і негативних синдромів [PANSS] і шкалу глобального клінічного враження [CGI]) і безпеки. Після періоду скринінгу відповідні пацієнти будуть рандомізовані в співвідношенні 2:1 для сліпого лікування сполукою формули I (наприклад, в дозах 5, 7, 10 і 14 мг на день) або плацебо протягом 8 тижнів. Дослідження включає 5 частин із зростаючими дозами сполуки формули I, а прийняття рішення про початок наступного рівня дози ґрунтуватиметься на оцінці безпеки і здатності до переносності, здійсненої на основі попередньої частини дослідження. Ефективність і безпека сполуки формули I оцінюватимуться порівняно з об'єднаною зі всіх частин дослідження групою плацебо. 4 UA 102403 C2 5 10 15 20 25 30 Ефективність відносно когнітивних порушень при шизофренії Було показано, що сполука формули I має властивості посилення когнітивності на доклінічних моделях когнітивних дисфункцій. Вважають, що афінність сполуки I по відношенню до рецепторів 5-НТ6 бере участь в прокогнітивних ефектах сполуки. Крім того, вважають, що вказаний прокогнітивний ефект сполуки формули I буде очевидним при низькому рівні зайнятості рецепторів D2, що є сприятливим з точки зору профілю побічних ефектів. Вплив сполуки формули I на когнітивні порушення у пацієнтів з шизофренією оцінюватиметься в ході клінічних випробувань, в яких відповідні пацієнти будуть рандомізовані в співвідношенні 1:1 щодо сліпого лікування гнучкими дозами сполуки формули I (від 5 до 7 мг на день) або оланзапіну (від 10 до 15 мг на день) протягом 12 тижнів. Вплив сполуки формули I на когнітивні симптоми оцінюватиметься з використанням шкали стислої оцінки когнітивності при шизофренії (BACS) (Keefe R.S., Goldberg T.E., Harvey P.D., Gold J.M., Рої M.P., Coughenour L. The Brief Assessment of Cognition in Schizophrenia: reliability, sensitivity, and comparison with а standard neurocognitive battery. Schizophr. Res. 2004; 68 (2-3):283-97.i. Schizophr. Res. 2004; 68 (2-3):283-97.). Приклад 1. Виготовлення пігулки з негайним вивільненням, покритої плівковим покриттям, призначеної для перорального введення І Фармацевтична розробка Дослідження сумісності ексципієнтів і сполуки формули I показало, що компоненти, використані в композиції пігулок, були сумісні із сполукою. На даній основі був розроблений традиційний процес вологого гранулювання, таблетування і нанесення плівкового покриття з використанням стандартних способів і ексципієнтів. Опис лікарського продукту Сполуку формули I виготовляють у формі пігулки з негайним вивільненням, покритої плівковим покриттям, призначеної для перорального введення. Пігулки, що містять сполуку формули I, в даному прикладі виготовляють з різним вмістом активного інгредієнта, 5 і 7 мг. Продукт, що містить сполуку формули I, є пігулкою білого кольору з плівковим покриттям, поміщеною в коричнево-червону тверду капсулу. Пігулки з іншим вмістом активного інгредієнта, таким як 4, 6, 8, 9, 10, 11, 12, 13 або 14 мг, можна виготовляти за таким же способом. Композиція Композиції пігулок 5 мг і 7 мг представлено нижче в таблиці 1. Таблиця 1. Композиція пігулок 5 мг і 7 мг Найменування інгредієнта Кількість на одиницю 5 мг Лікарська субстанція Сукцинат сполуки формули I Відповідає сполуці формули I Ексципієнти Ядро пігулки: Гідрофосфат кальцію, безводний Кукурудзяний крохмаль 2 Целюлоза, мікрокристалічна Кроскармелоза натрію Тальк 5 мг 7 мг 37,990 мг Активний інгредієнт Внутрішній 36,213 мг Наповнювач Ph. Eur. 18,995 мг 18,106 мг 3,35 мг q.s. q.s. Наповнювач Зв'язувальний агент Рідина для гранулювання Ph. Eur. 3,35 мг Коповідон Вода, очищена 9,331 мг Посилання на 1 стандарт 7 мг 6,665 мг Функція 25 мг 25 мг Наповнювач Ph. Eur. 3 мг 3 мг Ph. Eur. 4 мг 4 мг Розпушувач Змащувальна речовина 5 Ph. Eur. Ph. Eur. Ph. Eur. UA 102403 C2 Продовження таблиці 1 Стеарат магнію 1 мг 1 мг Маса ядра кожної пігулки Плівкове покриття Opadry Y-1-7000 білий, що складається з: Гіпромелоза (5 мПуаз) 100 мг 1,563 мг Найменування інгредієнта Кількість на одиницю Ph. Eur. 100 мг 1,563 мг Змащувальна речовина Макрогол 400 Діоксид титану (Е171) 2 Вода, очищена Маса кожної пігулки з покриттям Стеарат магнію 1 2 5 мг 0,156 мг 0,781 мг q.s. 7 мг 0,156 мг 0,781 мг q.s. 102,5 мг q.s. Посилання на 1 стандарт Функція 102,5 мг q.s. Плівкоутворю-вач Ph. Eur. Пластифікатор Пігмент Розчинник Ph. Eur. Ph. Eur. Ph. Eur. Змащувальна речовина Ph. Eur. використовується сучасна фармакопея; непостійний матеріал Композиції для репрезентативного розміру партії у 10000 пігулок представлені в таблиці 2. 5 Таблиця 2. Композиція партії для пігулок з плівковим покриттям (розмір партії 10000 пігулок) Вміст активного інгредієнта Інгредієнти Ядро пігулки: Сукцинат сполуки формули I Гідрофосфат кальцію, безводний Кукурудзяний крохмаль Коповідон 1 Вода, очищена Целюлоза, мікрокристалічна Кроскармелоза натрію Тальк Стеарат магнію Маса ядра пігулки Вміст активного інгредієнта Плівкове покриття: Opadry Y-1-7000 білий 1 Вода, очищена Маса пігулки з плівковим покриттям 10 5 мг 7 мг Кількість (г) % мас. (на ядро пігулки) Кількість (г) % мас. (на ядро пігулки) 66,65 6,665 93,31 9,331 379,90 37,990 362,13 36,213 189,95 33,5 q.s. 250 30 40 10 18,995 3,35 25 3 4 1 181,06 33,5 q.s. 250 30 40 10 18,106 3,35 25 3 4 1 100 мг 100 мг 5 мг 7 мг 25 q.s. 2,5 102,5 мг 25 q.s. 2,5 102,5 мг Опис процесу виготовлення і контролю процесу Способом гранулювання є традиційний процес вологого гранулювання з використанням коповідону (Kollidone VA64) як сухого зв'язувального агента і води як рідини для гранулювання. У 10-літровій мішалці РМА 1, що забезпечує високе зусилля зсуву, процес для 2 кг партії здійснюють таким чином: 6 UA 102403 C2 5 10 15 Змішують сукцинат сполуки формули I, безводний гідрофосфат кальцію, кукурудзяний крохмаль і коповідон протягом 2 хвилин при 500 об/хв. Додають очищену воду для ініціації агломерації. Гранулюють при 800 об/хв. протягом приблизно 4 хвилин до досягнення відповідного розміру гранул. Просівають вологі гранули. Сушать гранули в лотковій сушарці при 50 °C до придбання продуктом відносної вологості (RH) 25-55 % RH. Просівають висушені гранули. Змішують гранули з мікрокристалічною целюлозою, кроскармелозою натрію і тальком в мішалці. Додають стеарат магнію в мішалку і змішують. Пресують гранулят в пігулки на таблетувальній машині. Наносять плівкове покриття на ядра пігулок в пристрої для нанесення плівкового покриття, з використанням параметрів процесу, представлених в таблиці 3. Таблиця 3. Устаткування і умови процесу нанесення покриття Устаткування Compu Lab 15’’ 20 Завантаження (г) Швидкість розпилювання (г/хв.) 1360-1500 10 Потік вхідного повітря 3 (м /год.) 500 Темпер. вхідного повітря (°С) Темпер. повітря, що виходить (°С) 60 58 Схема процесу виготовлення і контролювання процесу показані на фіг. 1. Несподівані ефекти зв'язувального агента в композиції пігулок З метою оптимізації процесу агломерації були виготовлені дві різні композиції пігулок, і оцінювався їх вплив на хімічну стабільність сполуки формули I. Композиція вказаних пігулок представлена в таблиці 4, а процес виготовлення був схожий з процесом, описаним вище. Таблиця 4. Композиції партії пігулок з плівковим покриттям з 2 різними зв'язувальними агентами (розмір партії 10000 пігулок) Вміст активного інгредієнта Інгредієнти Ядро пігулки: Сукцинат сполуки формули I Гідрофосфат кальцію, безводний Кукурудзяний крохмаль Коповідон Мальтодекстрин 1 Вода, очищена Целюлоза, мікрокристалічна Кроскармелоза натрію Тальк Стеарат магнію Маса ядра пігулки 25 2,5 мг % мас. (на ядро пігулки) % мас. (на ядро пігулки) 2,67 2,67 40,66 40,66 20,33 3,3 0,00 26,0 3,0 3,0 1,0 20,33 0,0 3,35 26,0 3,0 3,0 1,0 125 мг Використання коповідону як зв'язувального агента надає пігулкам кращі фармацевтичні технічні властивості, наприклад, можливість виготовляти твердіші пігулки з низькими втратами на лом, без погіршення часу дезінтеграції, як показано в таблиці 5. 7 UA 102403 C2 Таблиця 5. Порівняння фармацевтичних технічних даних для пігулок, що містять сукцинат сполуки формули I, з композицією, представленою в таблиці 4 Коповідон Прикладена сила пресування (Н) 86 108 120 130 Мальтодекстрин Крихкість (% мас.) Час дезінтеграції 0,14 0,16 0,18 0,22 Прикладена сила пресування (Н) 36 47 51 59 44 сек. 1 хв. 14 сек. 1 хв. 52 сек. 2 хв. 09 сек. Крихкість (% мас.) Час дезінтеграції 0,69 0,51 0,43 0,23 43 сек. 1 хв. 13 сек. 1 хв. 42 сек. 1 хв. 59 сек. Крім того, різні зв'язувальні агенти приводять до несподіваної різниці в стабільності, як показано в таблиці 6. 5 Таблиця 6. Розкладання сукцинату сполуки формули I в композиціях, в яких як зв'язувальний агент використовувався мальтодекстрин і коповідон; композиція пігулок представлена в таблиці 4. Дія Початковий аналіз Після автоклавування 80 °C протягом 48 годин 80 °C протягом 120 годин 40 °C/75 % RH протягом 3 тижнів 60 °C протягом 3 тижнів 10 15 20 Загальне розкладання (%) сполуки формули I Коповідон Мальтодекстрин
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition intended for oral administration
Автори англійськоюHolm, Rene, Kau, Christine, Willumsen, Birgitte, Hertel, Klaus Peter, Olsen, Christina Kurre, Bruun, Lone, Soby, Karina Krojer
Назва патенту російськоюКомпозиция для перорального введения
Автори російськоюХолм Рене, Кау Христине, Виллумсен Биргитте, Хертель Клаус Петер, Ольсен Христина Курре, Бруун Лоне, Сьобю Карина Крьоер
МПК / Мітки
МПК: A61K 31/495, A61P 25/00
Мітки: введення, перорального, композиція
Код посилання
<a href="https://ua.patents.su/18-102403-kompoziciya-dlya-peroralnogo-vvedennya.html" target="_blank" rel="follow" title="База патентів України">Композиція для перорального введення</a>
Попередній патент: Пристрій для утримання плазми
Наступний патент: Багатошаровий вміщуючий лігноцелюлозу формований виріб із низькою емісією формальдегіду (варіанти)
Випадковий патент: Герметичне різьбове з`єднання












