Таблетка для орального введення, що включає тамсулозин і соліфенацин
Номер патенту: 102885
Опубліковано: 27.08.2013
Автори: Сугіхара Акіо, Йосіно Хіроюкі, Сако Казухіро, Ясудзі Такехіко, Кавахама Сууя, Кіносіта Норіюкі
Формула / Реферат
1. Таблетка для орального введення, що включає
(1) шар, який містить частину з модифікованим вивільненням, яка включає тамсулозин або його фармацевтично прийнятну сіль, і полімер, який утворює гідрогель, і
(2) шар, який включає частину з негайним вивільненням, яка включає соліфенацин або його фармацевтично прийнятну сіль, і гідрофільну речовину, де 70 % або більше соліфенацину розчиняються протягом 15 хв.
2. Таблетка для орального введення за п. 1, де частина з негайним вивільненням розпадається і/або розчиняється раніше, ніж частина з модифікованим вивільненням утворить гель.
3. Таблетка для орального введення за п. 1 або 2, де 85 % або більше соліфенацину розчиняється протягом 15 хв.
4. Таблетка для орального введення за п. 3, де 90 % або більше соліфенацину розчиняється протягом 60 хв.
5. Таблетка для орального введення за п. 4, де 70 % або більше соліфенацину розчиняється протягом 15 хв. і 90 % або більше соліфенацину розчиняється протягом 60 хв.
6. Таблетка для орального введення за п. 5, де 85 % або більше соліфенацину розчиняється протягом 30 хв. і 90 % або більше соліфенацину розчиняється протягом 60 хв.
7. Таблетка для орального введення за будь-яким з пп. 1-6, де гідрофільна речовина являє собою одну сполуку або дві або більше сполук, вибраних з групи, що складається з поліетиленгліколю, мальтози, полівінілпіролідону і маніту.
8. Таблетка для орального введення за будь-яким з пп. 1-7, де гідрофільна речовина складає від 5 % мас. до 99 % мас.
9. Таблетка для орального введення за будь-яким з пп. 1-8, де гідрофільну речовину або дві або більше гідрофільних речовин, вибраних з групи, що складається з поліетиленгліколю, мальтози, полівінілпіролідону і маніту, використовують як зв'язувальну речовину.
10. Таблетка для орального введення за будь-яким з пп. 1-9, де маніт як гідрофільну речовину використовують як наповнювач.
11. Таблетка для орального введення за будь-яким з пп. 1-10, де полімер, що утворює гідрогель, має в'язкість 4000 мПа·с або більше в 1 %-ному водному розчині (25 °С).
12. Таблетка для орального введення за п. 11, де полімер, що утворює гідрогель, являє собою один полімер або два або декілька полімерів, вибраних з групи, що складається з поліетиленоксиду, гідроксипропілметилцелюлози, натрійкарбоксиметилцелюлози і карбоксивінілового полімеру.
13. Таблетка для орального введення за п. 12, де полімером, що утворює гідрогель, є поліетиленоксид.
14. Таблетка для орального введення за п. 13, де середньов'язкісна молекулярна маса поліетиленоксиду становить 5000000 або більше.
15. Таблетка для орального введення за будь-яким з пп. 1-14, де полімер, що утворює гідрогель, складає від 5 % мас. до 95 % мас.
16. Таблетка для орального введення за будь-яким з пп. 1-15, де частина з модифікованим вивільненням додатково включає добавку, яка дозволяє воді проникати в препаративну форму.
17. Таблетка для орального введення за п. 16, де добавка, яка дозволяє воді проникати в препаративну форму, має таку розчинність, що кількість води, необхідна для розчинення 1 г вказаної добавки, становить 5 мл або менше.
18. Таблетка для орального введення за п. 17, де добавка, яка дозволяє воді проникати в препаративну форму, складає від 3 % мас. до 80 % мас.
19. Таблетка для орального введення за будь-яким з пп. 1-18, для лікування симптомів з боку нижніх сечовивідних шляхів, пов'язаних з доброякісною гіперплазією передміхурової залози.
20. Таблетка для орального введення за будь-яким з пп. 1-19, яка є багатошаровою таблеткою.
Текст
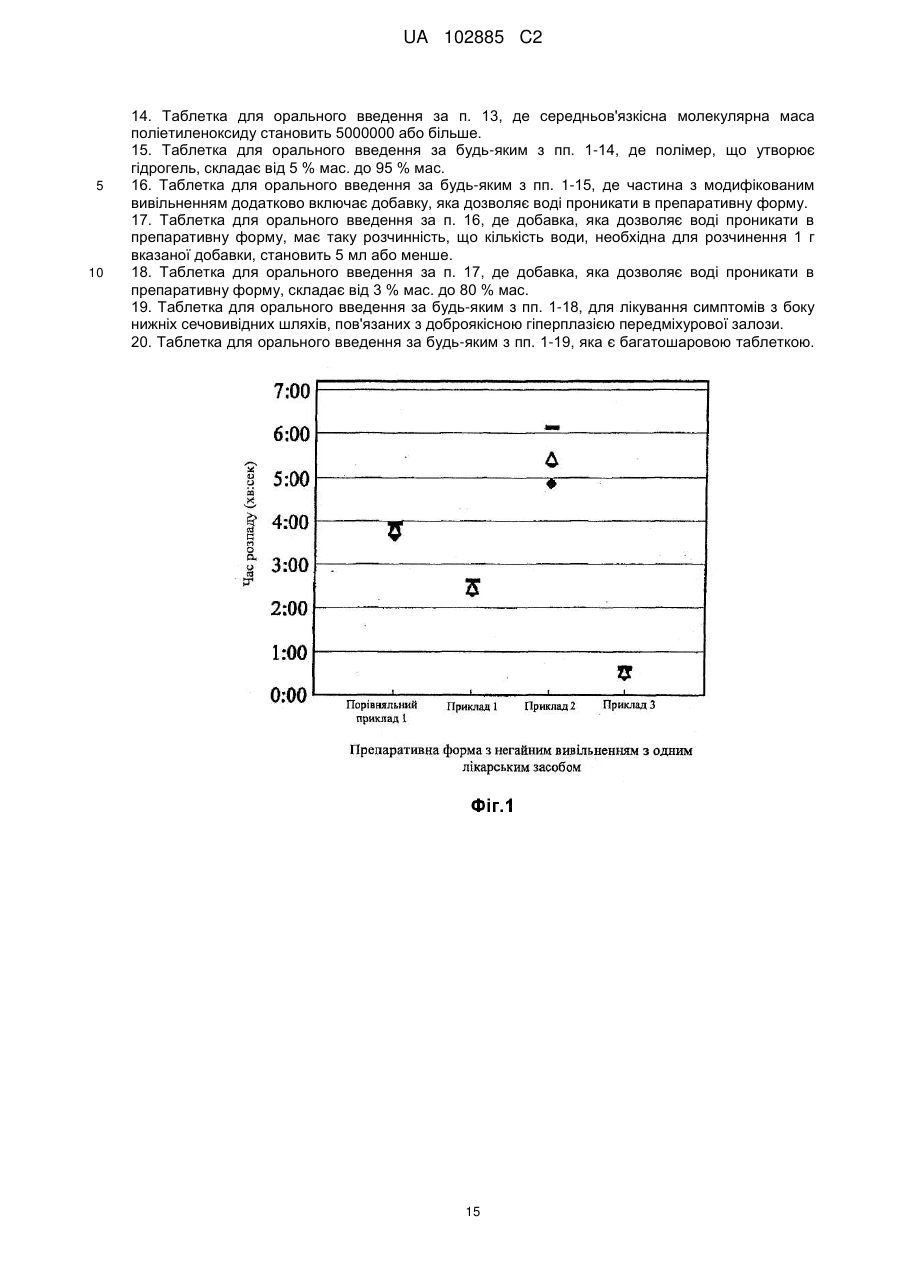
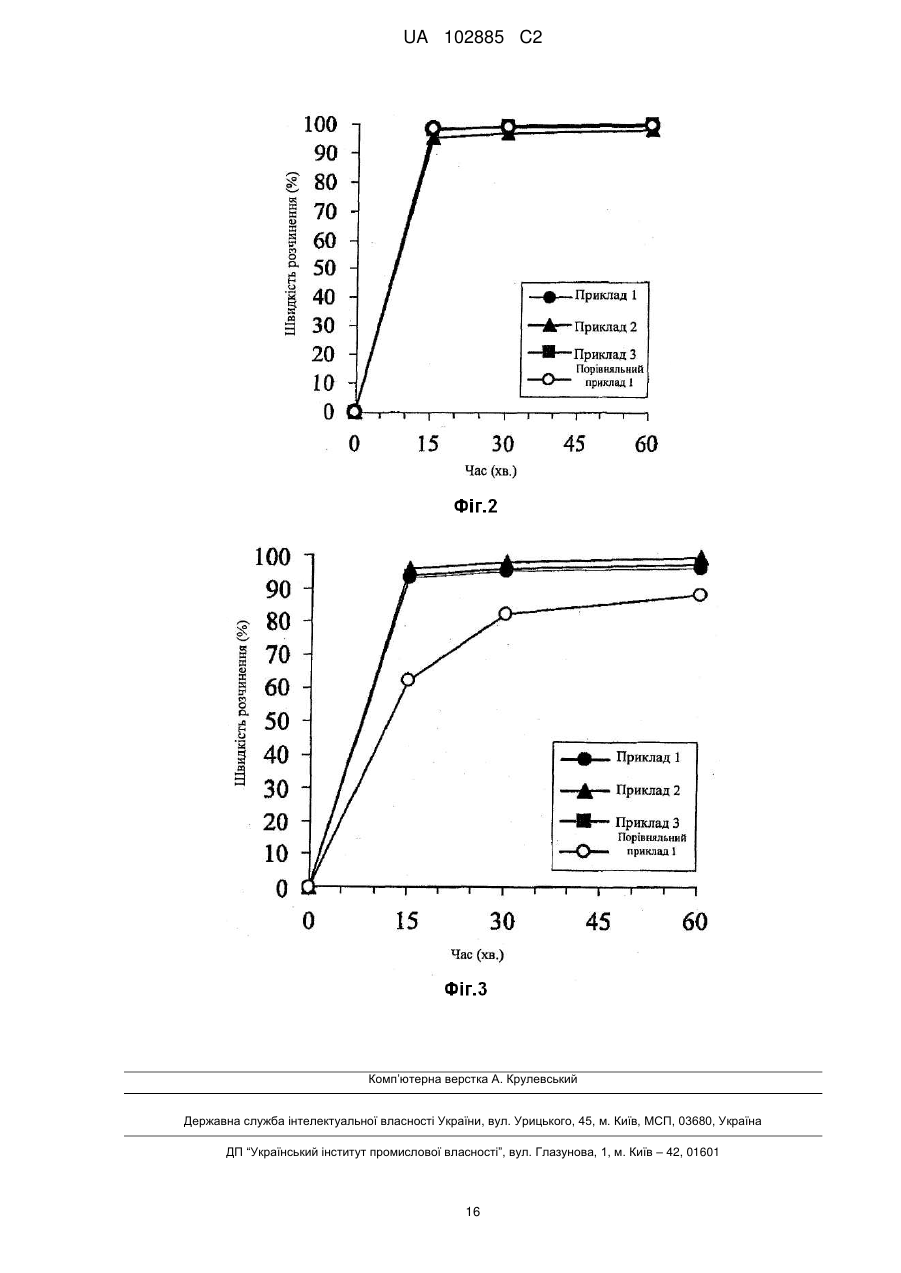
Реферат: Винахід стосується таблетки для орального введення, що включає: (1) шар, який містить частину з модифікованим вивільненням, яка включає тамсулозин або його фармацевтично прийнятну сіль, і полімер, який утворює гідрогель, і (2) шар, який включає частину з негайним вивільненням, яка включає соліфенацин або його фармацевтично прийнятну сіль, і гідрофільну речовину, де 70 % або більше соліфенацину розчиняються протягом 15 хв. UA 102885 C2 (12) UA 102885 C2 UA 102885 C2 5 10 15 20 25 30 35 40 Галузь техніки, до якої належить винахід Даний винахід стосується фармацевтичної композиції для орального введення, яка включає частину з модифікованим вивільненням, здатну регулювати вивільнення тамсулозину, і частину з негайним вивільненням, здатну швидко вивільняти соліфенацин. Зокрема, даний винахід стосується фармацевтичної композиції для орального введення, яка в одній препаративній формі включає частину з модифікованим вивільненням, що містить тамсулозин, полімер, що утворює гідрогель, і гідрофільну основу і частину з негайним вивільненням, що містить соліфенацин і гідрофільну речовину. Передумови до створення винаходу Тамсулозин являє собою (R)-5-(2-{[2-(2-етоксифеноксі)етил]аміно}пропіл)-2-метоксибензол1-сульфонамід, що має наступну структурну формулу. Вказана сполука, а також її фармацевтично прийнятні солі раніше розкриті в патентній літературі 1. Відомо, що тамсулозин або його солі мають здатність блокувати адренергічний рецептор 1А. Зокрема, гідрохлорид тамсулозину активний при блокуванні рецепторів 1 в сечовипускному каналі і передміхуровій залозі і широко використовується як засіб для лікування дизурії, пов'язаної з доброякісної гіперплазією передміхурової залози, яка знижує тиск в передміхуровій залозі в профілі тиску в сечовивідному каналі. Клінічні дослідження підтверджують, що гідрохлорид тамсулозину ефективний при лікуванні симптомів з боку нижніх сечовивідних шляхів і, таким чином, гідрохлорид тамсулозину є надзвичайно корисним лікарським засобом для використання в клінічних умовах. Тамсулозин постачається на ринок як Harnal (зареєстрований товарний знак) в Японії, Flomax (зареєстрований товарний знак) в Сполучених Штатах і Omnic (зареєстрований товарний знак) в Європі. Соліфенацин представлений наступною хімічною формулою і має хімічну назву (ІІ)хінуклідин-3-іл (S)-1-феніл-1,2,3,4-тетрагідроізохінолін-2-карбоксилат. Відомо, що соліфенацин або його солі проявляють прекрасну селективну антагоністичну активність проти мускаринових рецепторів М 3 і придатні як засіб для запобігання або лікування захворювань сечовивідної системи, таких як нетримання сечі і полакіурія при неврогенній полакіурії, нейрогенному сечовому міхурі, нічному нетриманні сечі, слабкому сечовому міхурі, цитоспазмі і хронічному циститі; захворювань дихальних шляхів, таких як хронічні обструктивні захворювання легень, хронічний бронхіт, астма і риніт; і захворювань травної системи, таких як синдром подразненого кишечника, спастичний коліт і дивертикуліт (див. патентний документ 2). Зокрема, соліфенацин має високу селективність до рецепторів М3, розташованих в гладеньких м'язах, тканинах залоз і т. д., в порівнянні з рецепторами М 2, розташованими в серці і т. д., і придатний як антагоніст рецептора М3, що чинить менший побічний вплив на серце і т. д., зокрема, придатний як засіб для запобігання або лікування нетримання сечі і полакіурії, хронічних обструктивних захворювань легень, хронічного бронхіту, астми, риніту і т. п. Як засіб для лікування невідкладних позивів до сечовипускання, частоти сечовипускання і нетримання сечі при гіперактивності сечового міхура соліфенацин постачається на ринок як Vesicare (зареєстрований товарний знак) в Японії, VESIcare (зареєстрований товарний знак) в Сполучених Штатах і Vesicare (зареєстрований товарний знак) в Європі. 1 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 Препаративна форма з модифікованим вивільненням, що містить тамсулозин або його фармацевтично прийнятну сіль, відома (наприклад, з патентних документів 3 і 4) і постачається на ринок як Omnic OCAS (зареєстрований товарний знак). У даному винаході пропонується препаративна форма з модифікованим вивільненням, з профілем концентрації в крові, що показує менше відношення пікового значення до мінімального значення, ніж у звичайній препаративній формі з модифікованим вивільненням. Препаративна форма з модифікованим вивільненням не тільки зменшує імовірність виникнення побічних ефектів, таких як ортостатична анемія, але і, як очікується, буде збільшувати дозу або підтримувати ефективність протягом тривалого періоду часу. Крім того, можна уникнути впливу їжі на концентрацію лікарського засобу в крові і, як очікується, буде досягнутий високий профіль безпеки з точки зору дотримання пацієнтом режимів дозування лікарського засобу (патентний документ 5). Для лікування симптомів з боку нижніх сечовивідних шляхів, пов'язаних з доброякісною гіперплазією передміхурової залози, розкривається фармацевтична композиція, що містить тамсулозин або його фармацевтично прийнятну сіль і соліфенацин або його фармацевтично прийнятну сіль, зокрема, фармацевтична композиція для лікування симптомів з боку нижніх сечовивідних шляхів, пов'язаних з доброякісною гіперплазією передміхурової залози, і даний винахід стосується комбінованого використання обох лікарських засобів (патентний документ 6). Тамсулозин або його фармацевтично прийнятна сіль ефективні при лікуванні симптомів випорожнення, навпаки, соліфенацин або його фармацевтично прийнятна сіль ефективні при лікуванні симптомів наповнення і, таким чином, обидві сполуки чинять протилежну дію. Однак комбіноване використання обох лікарських засобів несподівано привело до подальшого зниження інтенсивності симптомів наповнення і не вплинуло на зниження інтенсивності симптомів випорожнення, в порівнянні з введенням кожного лікарського засобу по окремості. Оскільки було підтверджено, що комбінована терапія з використанням тамсулозину або його фармацевтично прийнятної солі або соліфенацину або його фармацевтично прийнятної солі клінічно ефективна при лікуванні симптомів з боку нижніх сечовивідних шляхів, пов'язаних з доброякісною гіперплазією передміхурової залози, то бажано розробити для даної галузі медицини комбіновану препаративну форму (тобто одну препаративну форму), що містить обидва лікарських засобів, з метою поліпшення дотримання пацієнтом режимів дозування лікарського засобу. Як варіант комбінованої препаративної форми за даним винаходом, з метою забезпечити ефективний вплив, який виявляється при комбінованому використанні, втримуючи при цьому на низькому рівні можливі побічні ефекти, і протягом тривалого часу підтримувати ефективність впливу, може бути запропонована комбінована препаративна форма з модифікованим вивільненням, що містить тамсулозин, разом із звичайною препаративною формою (препаративною формою з негайним вивільненням), що містить соліфенацин. Однак оскільки швидкості розчинення лікарського засобу в обох препаративних формах відрізняються один від одного, то навіть в тому випадку, коли з обох препаративних форм готують єдину препаративну форму (тобто комбіновану препаративну форму), бажано, щоб швидкість вивільнення лікарського засобу в кожній препаративній формі, що міститься в єдиній препаративній формі, не сильно змінилася. Список літератури Патентна література: [патентний документ 1] Заявка на патент Японії, що не пройшла експертизу (Кокаі) № 56110665 [патентний документ 2] Патент США № 6017927 (відповідає міжнародній публікації WO 96/20194) [патентний документ 3] Міжнародна публікація WO 94/06414 [патентний документ 4] Міжнародна публікація WO 2004/078212 [патентний документ 5] Опублікована заявка на патент США 2005-0100603 [патентний документ 6] Міжнародна публікація WO 2009/013846 Суть винаходу Технічна задача Автори даного винаходу використовують ті ж самі компоненти лікарських форм, що розглядаються, тобто Vesicare (назва лікарської форми) з великою швидкістю вивільнення лікарського засобу (85% протягом 30 хв.) і препаративну форму з модифікованим вивільненням лікарського засобу Omnic OCAS (назва лікарської форми), для приготування єдиної препаративної форми (тобто комбінованої препаративної форми) (наведений нижче порівняльний приклад 1). 2 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 Зокрема, виготовляють двошарові таблетки, що складаються з частини з модифікованим вивільненням, яка містить тамсулозин, поліетиленоксид, поліетиленгліколь і стеарат магнію, і частини з негайним вивільненням, яка містить соліфенацин, лактозу, кукурудзяний крохмаль, гідроксипропілметилцелюлозу і стеарат магнію. Було проведене дослідження розчинності з використанням отриманих двошарових таблеток, і несподівано було виявлено: [1] швидкість розчинення соліфенацину знижується і складає менше ніж 85% протягом 30 хв., і [2] максимальний процент розчинення соліфенацину складає менше ніж 90%. Коли швидкість розчинення або максимальний процент розчинення соліфенацину знижується, це викликає заклопотаність, що це приводить до зменшення його доступності в організмі, тобто біодоступності, а в результаті фармакологічні ефекти, еквівалентні тим, які виявляються при комбінованому використанні відомих препаративних форм (варіанти препаративних форм з одним лікарським засобом), не можуть бути отримані. Метою даного винаходу є розробка для даної галузі медицини єдиної препаративної форми (комбінованої препаративної форми), яка включає частину з модифікованим вивільненням, що містить тамсулозин, і частину з негайним вивільненням, що містить соліфенацин, зокрема, (1) розробка єдиної препаративної форми (комбінованої препаративної форми), в якій швидкості розчинення обох лікарських засобів (зокрема, швидкість розчинення соліфенацину в частині з негайним вивільненням) аналогічні швидкостям розчинення відомих препаративних форм з одним лікарським засобом, і (2) розробка єдиної препаративної форми (комбінованої препаративної форми), що має максимальний процент розчинення обох лікарських засобів (зокрема, максимальний процент розчинення соліфенацину в частині з негайним вивільненням), що дорівнює 90% або більше, біодоступність якої еквівалентна біодоступності відомих препаративних форм з одним лікарським засобом. Вирішення задачі Вищезгадані результати, тобто сповільнення швидкості розчинення соліфенацину з двошарової таблетки і зменшення максимального проценту розчинення соліфенацину були вкрай несподіваними для авторів даного винаходу, оскільки розчинність соліфенацину у воді становить 610 мг/мл, і таким чином, соліфенацин вважається водорозчинною сполукою відповідно до рівняння розчинності, наведеного в Фармакопеї Японії, і, крім того, відома препаративна форма [Vesicare (зареєстрований товарний знак)] розроблена як препаративна форма з негайним вивільненням. Внаслідок різної поведінки в середовищі живого організму введеної двошарової таблетки і кожної введеної окремо препаративної форми (препаративної форми з одним лікарським засобом) потрібно указати, що частина з модифікованим вивільненням розташовується поруч з частиною з негайним вивільненням і, таким чином, соліфенацин, що розчинився з частини з негайним вивільненням, знаходиться поблизу частини з модифікованим вивільненням, що містить інший лікарський засіб. Зокрема, несподіваним є те, що з'являється можливість для "розчинного" у воді соліфенацину розчинятися і включатися в препаративну форму частини з модифікованим вивільненням, що містить полімер, що утворює гідрогель. Часи розпаду препаративних форм, що негайно вивільняються з одним лікарським засобом, які приготовані з тих же самих компонентів, що і препаративні форми з суміші порошків для частини з негайним вивільненням, які готують, відповідно, в розглянутих нижче прикладах 1-3 і порівняльному прикладі 1, наведені на Фіг. 1, а часи вивільнення лікарського засобу з препаративних форм, що негайно вивільняються з одним лікарським засобом, наведені на Фіг. 2. Коли використовують ті ж самі компоненти (соліфенацин, лактозу, кукурудзяний крохмаль, гідроксипропілметилцелюлозу і стеарат магнію), що і у відомій препаративній формі, які наведені на вказаних фігурах у вигляді суміші порошків для частини з негайним вивільненням, описаної в порівняльному прикладі 1, то вказана препаративна форма показує швидкий розпад і швидке вивільнення лікарського засобу. Цей результат відрізняється від результату для єдиної препаративної форми (комбінованої препаративної форми) і, таким чином, результат для двошарової таблетки як єдиної препаративної форми (комбінованої препаративної форми) був вкрай несподіваним. У даних обставинах автори даного винаходу зосередили увагу на збільшенні швидкості вивільнення соліфенацину і підвищенні максимального проценту розчинення соліфенацину і провели відповідні інтенсивні дослідження; таким чином був здійснений даний винахід. У даному винаході пропонується: 3 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 60 [1] фармацевтична композиція для орального введення, що включає (1) частину з модифікованим вивільненням, яка включає тамсулозин або його фармацевтично прийнятну сіль, і (2) частину з негайним вивільненням, яка включає соліфенацин або його фармацевтично прийнятну сіль, і гідрофільну речовину; [2] фармацевтична композиція для орального введення за п. [1], де частина з негайним вивільненням розпадається і/або розчиняється раніше, ніж частина з модифікованим вивільненням утворює гель; [3] фармацевтична композиція для орального введення за п. [1] або [2], де 70% або більше соліфенацину розчиняється протягом 15 хв.; [4] фармацевтична композиція для орального введення за п. [3], де 90% або більше соліфенацину розчиняється протягом 60 хв.; [5] фармацевтична композиція для орального введення за п. [4], де 70% або більше соліфенацину розчиняється протягом 15 хв. і 90% або більше соліфенацину розчиняється протягом 60 хв.; [6] фармацевтична композиція для орального введення за п. [5], де 85% або більше соліфенацину розчиняється протягом 30 хв. і 90% або більше соліфенацину розчиняється протягом 60 хв.; [7] фармацевтична композиція для орального введення за будь-яким з пп. [1]-[6], де гідрофільна речовина являє собою одну сполуку або дві або декілька сполук, вибраних з групи, що складається з поліетиленгліколю, мальтози, полівінілпіролідону і маніту; [8] фармацевтична композиція для орального введення за будь-яким з пп. [1]-[7], де гідрофільна речовина складає від 5% мас. до 99% мас. [9] фармацевтична композиція для орального введення за будь-яким з пп. [1]-[8], де гідрофільну речовину або дві або декілька гідрофільних речовин, вибраних з групи, що складається з поліетиленгліколю, мальтози, полівінілпіролідону і маніту, використовують як зв'язувальну речовину; [10] фармацевтична композиція для орального введення за будь-яким з пп. [1]-[9], де маніт як гідрофільну речовину використовують як наповнювач; [11] фармацевтична композиція для орального введення за будь-яким з пп. [1]-[10], де частина з модифікованим вивільненням містить полімер, що утворює гідрогель; [12] фармацевтична композиція для орального введення за п. [11], де полімер, що утворює гідрогель, має в'язкість 4000 мПас або більше в 1%-ному водному розчині (25°С); [13] фармацевтична композиція для орального введення за п. [12], де полімер, що утворює гідрогель, являє собою один полімер або два або декілька полімерів, вибраних з групи, що складається з поліетиленоксиду, гідроксипропілметилцелюлози, натрій карбоксиметилцелюлози і карбоксивінілового полімеру; [14] фармацевтична композиція для орального введення за п. [13], де полімером, що утворює гідрогель, є поліетиленоксид; [15] фармацевтична композиція для орального введення за п. [14], де середньов'язкісна молекулярна маса поліетиленоксиду становить 5000000 або більше; [16] фармацевтична композиція для орального введення за будь-яким з пп. [11]-[15], де полімер, що утворює гідрогель, складає від 5% мас. до 95% мас. [17] фармацевтична композиція для орального введення за будь-яким з пп. [1]-[16], де частина з модифікованим вивільненням додатково включає добавку, яка дозволяє воді проникати в препаративну форму; [18] фармацевтична композиція для орального введення за п. [17], де добавка, яка дозволяє воді проникати в препаративну форму, має таку розчинність, що кількість води, необхідна для розчинення 1 г вказаної добавки, становить 5 мл або менше; [19] фармацевтична композиція для орального введення за п. [18], де добавка, яка дозволяє воді проникати в препаративну форму, складає від 3% мас. до 80% мас. [20] фармацевтична композиція для орального введення за будь-яким з пп. [1]-[19], яка являє собою фармацевтичну композицію для лікування симптомів з боку нижніх сечовивідних шляхів, пов'язаних з доброякісною гіперплазією передміхурової залози; і [21] фармацевтична композиція для орального введення за будь-яким з пп. [1]-[20], де фармацевтична композиція є таблеткою. Переваги винаходу У даному винаході пропонується фармацевтична композиція для орального введення, що включає частину з модифікованим вивільненням, яка включає тамсулозин або його фармацевтично прийнятну сіль, і частину з негайним вивільненням, яка включає соліфенацин або його фармацевтично прийнятну сіль, і гідрофільну речовину. Фармацевтична композиція за 4 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 60 даним винаходом здатна вивільняти лікарський засіб аналогічно кожній з препаративних форм з одним лікарським засобом і, таким чином, єдина препаративна форма (комбінована препаративна форма) здатна чинити фармакологічну дію, еквівалентну фармакологічній дії, яку можуть надати препаративні форми з одним лікарським засобом. Крім того, очікується, що вона поліпшить дотримання пацієнтом режимів дозування лікарського засобу, оскільки кількість препаративних форм, які необхідно приймати, зменшується. Короткий опис креслень [Фіг. 1] Фігура 1 являє собою діаграму, яка показує часи розпаду препаративних форм з негайним вивільненням, що містять один лікарський засіб, які приготовані з тих же компонентів, що і змішані порошки для частини з негайним вивільненням, отриманої в прикладах 1-3 за даним винаходом і порівняльному прикладі 1, відповідно. [Фіг. 2] Фігура 2 являє собою графік, який показує профілі вивільнення для препаративних форм з негайним вивільненням, що містять один лікарський засіб, які приготовані з тих же компонентів, що і змішані порошки для частини з негайним вивільненням, отриманої в прикладах 1-3 за даним винаходом і порівняльному прикладі 1, відповідно. [Фіг. 3] Фігура 3 являє собою графік, який показує профілі розчинення фармацевтичних композицій, отриманих в прикладах 1-3 за даним винаходом і порівняльному прикладі 1, відповідно. Що стосується часу розпаду кожної препаративної форми з негайним вивільненням, що містить один лікарський засіб, який вказаний на фігурі 1, і вивільнення лікарського засобу з кожної препаративної форми з негайним вивільненням, що містить один лікарський засіб, який вказаний на фігурі 2, то препаративна форма з негайним вивільненням, що містить один лікарський засіб, яка приготована з тих же компонентів, що і змішані порошки для частини з негайним вивільненням, отриманої в порівняльному прикладі 1, демонструє швидкий розпад і швидке вивільнення лікарського засобу, де розчинення завершується протягом 15 хв., так само як і препаративні форми з негайним вивільненням, що містять один лікарський засіб, які приготовані з тих же компонентів, що і змішані порошки для частини з негайним вивільненням, приготованої в прикладах 1-3, відповідно. Що стосується єдиних препаративних форм (комбінованих препаративних форм), як показано на фігурі 3, то хоча препаративні форми з негайним вивільненням, що містять один лікарський засіб, демонструють такий же швидкий розпад і таке ж швидке розчинення, в фармацевтичній препаративній формі, отриманій в порівняльному прикладі 1, водорозчинний соліфенацин розчиняється і включається в частину з модифікованим вивільненням, що містить полімер, що утворює гідрогель, і несподівано ступінь вивільнення лікарського засобу не досягає 90%, і повне вивільнення лікарського засобу не спостерігається. Опис переважних варіантів здійснення даного винаходу Нижче роз'яснюються переважні варіанти здійснення даного винаходу. Термін "препаративна форма, що містить один лікарський засіб" в даному описі означає варіант здійснення препаративної форми, що містить лікарський засіб. Термін "комбінована препаративна форма" в даному описі також позначають як "єдина препаративна форма", і він означає варіант здійснення препаративної форми, що містить два або більше лікарських засобів. Термін "комбінована препаративна форма" включає препаративну форму, яка містить функціонально різні препаративні форми, такі як частина з модифікованим вивільненням і частина з негайним вивільненням за даним винаходом. Термін "частина з модифікованим вивільненням" в даному описі означає варіант втілення даного винаходу, який міститься в єдиній препаративній формі, і частина, яка контролює вивільнення лікарського засобу. Термін "частина з негайним вивільненням" в даному описі означає варіант втілення даного винаходу, який міститься в єдиній препаративній формі, і частина, яка швидко вивільняє лікарський засіб з фармацевтичної композиції (у випадку "розчинного" лікарського засобу термін "вивільнення" має практично те ж саме значення, що і "розчинення"). Термін "максимальний процент розчинення" в даному описі означає такий процент розчинення, коли ступінь розчинення лікарського засобу з фармацевтичної композиції досягає плато у випробуванні на розчинність в заданих умовах. Далі пояснюється фармацевтична композиція для орального введення за даним винаходом. Тамсулозин або його фармацевтично прийнятну сіль, які можуть застосовуватися за даним винаходом, легко отримують відповідно до способів, наведених в JP 56-110665 і JP 62-114952, або відповідно до модифікованих варіантів вказаних способів. Тамсулозин може утворювати фармацевтично прийнятні солі з різними неорганічними і органічними кислотами. Вказані фармацевтично прийнятні солі можуть використовуватися в 5 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 60 даному винаході. Приклади солей включають солі з неорганічними кислотами, такими як хлористоводнева кислота, сірчана кислота і фосфорна кислота; солі з органічними кислотами, такими як фумарова кислота, яблучна кислота, лимонна кислота і янтарна кислота; солі з лужними металами, такими як натрій і калій; і солі з лужноземельними металами, такими як кальцій і магній. Гідрохлорид тамсулозину може використовуватися в іншому варіанті здійснення даного винаходу. Вказані солі можуть бути отримані звичайними способами. Дозу тамсулозину або його фармацевтично прийнятної солі можна відповідним чином визначити для кожного пацієнта в залежності, наприклад, від шляху введення, симптомів захворювання, віку і статі пацієнта, лікування якого проводять, і т. п. Коли гідрохлорид тамсулозину призначають дорослому орально, то денна доза активного інгредієнта складає від приблизно 0,1 мг до 1,6 мг, і його вводять орально раз на день. Соліфенацин або його фармацевтично прийнятну сіль, які можуть застосовуватися за даним винаходом, легко отримують відповідно до способу, наведеного в WO 96/20194, або відповідно до модифікованих варіантів вказаних способів. Соліфенацин може утворювати фармацевтично прийнятні солі з різними неорганічними і органічними кислотами. Вказані фармацевтично прийнятні солі можуть використовуватися в даному винаході. Приклади солей включають кислотно-адитивні солі з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, азотна кислота і фосфорна кислота; і кислотно-адитивні солі з органічними кислотами, такими як мурашина кислота, оцтова кислота, пропіонова кислота, щавлева кислота, малонова кислота, янтарна кислота, фумарова кислота, малеїнова кислота, молочна кислота, яблучна кислота, лимонна кислота, винна кислота, вугільна кислота, пікринова кислота, метансульфонова кислота, етансульфонова кислота і глутамінова кислота. Сукцинат соліфенацину може використовуватися в іншому варіанті здійснення даного винаходу. Вказані солі можуть бути отримані звичайним способом. Дозу соліфенацину або його фармацевтично прийнятної солі можна відповідним чином визначити для кожного пацієнта в залежності, наприклад, від шляху введення, симптомів захворювання, віку і статі пацієнта, лікування якого проводять, і т. п. Коли сукцинат соліфенацину призначають дорослому орально, то денна доза активного інгредієнта складає від приблизно від 0,01 мг/кг до 100 мг/кг, і його вводять один раз на день або ділять на окремі дози від двох до чотирьох доз на день. Як альтернатива, коли дозу вводять, дорослому внутрішньовенно, кількість лікарського засобу складає від 0,01 мг/кг на дозу до 10 мг/кг на дозу, і вказану дозу вводять один раз на день або декілька разів на день. Вміст кожного лікарського засобу спеціально не обмежується, при умові, що він являє собою кількість, ефективну для лікування або запобігання захворювання. Вміст лікарського засобу в препаративній формі, наприклад, становить 85% мас. або менше, 80% мас. або менше в іншому варіанті здійснення даного винаходу, 50% мас. або менше в іншому варіанті здійснення даного винаходу, і 10% мас. або менше ще в одному варіанті здійснення даного винаходу. "Частина з модифікованим вивільненням" за даним винаходом включає тамсулозин або його фармацевтично прийнятну сіль, полімер, що утворює гідрогель, (в даному описі іноді називають полімером, який утворює гідрогель) і гідрофільну основу (в даному описі іноді називають добавкою, яка дозволяє воді проникати в препаративну форму). "Частину з модифікованим вивільненням" визначають в даному описі як частину, для якої точка, що відповідає розчиненню 50% лікарського засобу з фармацевтичної композиції, складає від 3 годин до 15 годин з моменту початку проведення випробувань розчинності, коли випробування розчинності проводять відповідно до тесту на розчинність, спосіб 2 (спосіб з використанням лопатевої мішалки, швидкість обертання від 50 об./хв. до 200 об./хв.), який описаний в Фармакопеї Японії, або коли випробування розчинності проводять відповідно до тесту на розчинність, спосіб 1 (спосіб в барабані, швидкість обертання від 50 об./хв. до 200 об./хв.), який описаний в Фармакопеї Японії. Полімер, що утворює гідрогель, який може використовуватися за даним винаходом, спеціально не обмежується, при умові, що він має такі властивості як в'язкість і т. п. під час гелеутворення, що зберігають певною мірою форму препаративної форми, що майже повністю перетворилася в гель від впливу скорочень в травному тракті, які супроводжують перетравлення їжі і переміщують препаративну форму, що перетворилася в гель, до товстого кишечника в нижній частині травного тракту. Як полімер, що утворює гідрогель, може використовуватися полімер, що має високу в'язкість під час гелеутворення, такий як полімер з в'язкістю 4000 мПас або більше в 1%-ному водному розчині при 25°С. Властивості полімеру залежать від його молекулярної маси, і як полімер, що утворює гідрогель, який може використовуватися за даним винаходом, переважний полімер з більш 6 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 високою молекулярною масою. Приклади полімеру з більш високою молекулярною масою включають поліетиленоксид із середньою молекулярною масою 5000000 або більше, із середньою молекулярною масою 7000000 або більше в іншому варіанті здійснення даного винаходу, із середньою молекулярною масою від 5000000 до 8000000 в іншому варіанті здійснення даного винаходу, і з середньою молекулярною масою від 7000000 до 8000000 в ще одному варіанті здійснення даного винаходу. Приклади полімерів включають: поліетиленоксид (РЕО) [наприклад, продукти з назвами Polyox WSR-308 (середня молекулярна маса: 8000000, в'язкість: 10000-15000 мПас (1%-ний водний розчин при 25°С)), Polyox WSR-303 (середня молекулярна маса: 7000000, в'язкість: 7500-10000 мПас (1%-ний водний розчин при 25°С)), Polyox WSR Coagulant (середня молекулярна маса: 5000000, в'язкість: 5500-7500 мПас (так само, як указано вище)), які всі виготовляє компанія Dow]; гідроксипропілметилцелюлозу (НРМС) [наприклад, продукти з назвами Metolose 90SH100000 (в'язкість: 4100-5600 мПас (1%-ний водний розчин при 20°С)) і Metolose 90SH30000 (в'язкість: 25000-35000 мПас (2%-ний водний розчин при 20°С)), які всі виготовляє компанія Shin-Etsu Chemical Co., Ltd.]; натрій карбоксиметилцелюлози (CMC-Na) [наприклад, продукти з назвами Sunrose F1000MC (середня молекулярна маса: 420,000, в'язкість: 8000-12000 мПас (так само, як указано вище)) і НЕС DAICEL SE900 (середня молекулярна маса: 1560000, в'язкість: 4000-5000 мПас (так само, як указано вище)), які виготовляє компанія Daicel chemical Industries, Ltd.]; і карбоксивінілові полімери [наприклад, Carbopol 940 (середня молекулярна маса: приблизно 2500000), виготовляє компанія]. В іншому варіанті здійснення даного винаходу може застосовуватися поліетиленоксид. Вказані полімери, що утворюють гідрогель, можуть використовуватися індивідуально або у вигляді прийнятної комбінації з двох або декількох полімерів, що утворюють гідрогель. Коли змішують два або більшу кількість полімерів, в'язкість або середня молекулярна маса яких виходить за межі вищезгаданих конкретних діапазонів, а отримана суміш має властивості, що відповідають вищезгаданим конкретним діапазонам, то суміш полімерів включають в полімери, що утворюють гідрогель, які можуть застосовуватися за даним винаходом. Для того, щоб вивільнити лікарський засіб в товстому кишечнику людини, переважно, частина препаративної форми, що утворила гель, зберігається в товстому кишечнику після, принаймні, від 6 до 8 годин, більш переважно, після 12 годин або більше після введення препаративної форми. Приготування препаративної форми, що утворює гідрогель, що має вказані властивості, змінюється в залежності від розміру препаративної форми, типу полімерів, властивостей лікарського засобу і добавки, яка дозволяє воді проникати в препаративну форму, вмісту полімеру і т. п. Для препаративної форми, що становить 600 мг або менше на таблетку, вміст полімеру, що утворює гідрогель, по відношенню до маси препаративної форми складає, наприклад, від 5% мас. до 95% мас. і, переважно, складає від 10% мас. до 90% мас. в іншому варіанті здійснення даного винаходу, а вміст полімеру, що утворює гідрогель, по відношенню до маси частини з модифікованим вивільненням, складає, наприклад, від 10% мас. до 95% мас. і, переважно, складає від 15% мас. до 90% мас. в іншому варіанті здійснення даного винаходу. Кількість на одну препаративну форму, переважно, становить 40 мг або більше, і 60 мг або більше в іншому варіанті здійснення даного винаходу. Коли вміст нижче, ніж вказані значення, то виникає імовірність того, що достатнє пролонговане вивільнення протягом тривалого часу не досягається внаслідок ерозії в травному тракті. Добавка, що дозволяє воді проникати в препаративну форму (її також позначають як "гідрофільна основа"), яка може використовуватися за даним винаходом, спеціально не обмежується, при умові, що вона являє собою речовину, здатну надавати препаративній формі властивостей, що забезпечують проникнення води в препаративну форму. Приклади гідрофільної основи включають речовину, що має таку розчинність, що кількість води, необхідна для розчинення 1 г гідрофільної основи при 20±5°С становить 5 мл або менше і 4 мл або менше в іншому варіанті здійснення даного винаходу. Коли гідрофільна основа має велику розчинність у воді, то ефект, який дозволяє воді проникати в препаративну форму, посилюється. Приклади гідрофільної основи включають: водорозчинний полімер, такий як поліетиленгліколь [PEG: наприклад, продукти з назвами PEG 400, PEG 1500, PEG 4000, PEG 6000 і PEG 20000 (виготовляються компанією NOF Corporation)] і полівінілпіролідон [PVP: наприклад, продукт з назвою PVP K30 (виготовляється компанією BASF)]; цукрові спирти, такі як D-сорбіт і ксиліт; 7 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 60 сахариди, такі як сахароза, безводна мальтоза, D-фруктоза, декстран (наприклад, Dextran 40) і глюкоза; поверхнево-активні речовини, такі як поліоксіетиленполіокиспропіленгліколь [наприклад, Pluronic F68 (виготовляється компанією Asahi Denka і т. д.)]; солі, такі як хлорид натрію і хлорид магнію; органічні кислоти, такі як лимонна кислота і винна кислота; амінокислоти, такі як гліцин, -аланін і гідрохлорид лізину; і аміносахариди, такі як меглумін. В іншому варіанті здійснення даного винаходу можуть застосовуватися PEG6000, полірінілпіролідон, D-сорбіт і т. п. Вказані гідрофільні основи можуть використовуватися окремо або у вигляді комбінації з двох або більшої кількості гідрофільних основ. Вміст гідрофільної основи може змінюватися в залежності від різних чинників, таких як властивості (розчинність, терапевтичний ефект і т. п.) і вміст лікарського засобу, розчинність гідрофільної основи, властивості полімеру, що утворює гідрогель, стан суб'єкта, якому буде вводитися композиція, і т. п., однак переважною є кількість, при якій гелеутворення майже повністю досягається під час утримування препаративної форми у верхній частині травного тракту. Час утримування лікарського засобу у верхній частині травного тракту змінюється в залежності від хімічних речовин і індивідуумів, однак час утримування після введення собакам і людям складає приблизно 2 години і приблизно від 4 до 5 годин, відповідно [Br. J. Clin. Pharmac, (1988) 26, 435-443]. У людей вміст гідрофільної основи, переважно, являє собою кількість, при якій гелеутворення препаративної форми майже повністю досягається через 4-5 годин після її введення. Вміст складає, наприклад, від приблизно 3% мас. до 80% мас. (від приблизно 3% мас. до 60% мас. в іншому варіанті здійснення даного винаходу) від маси препаративної форми, і наприклад, від приблизно 5% мас. до 80% мас. (від приблизно 5% мас. до 60% мас. в іншому варіанті здійснення даного винаходу) від маси частини з модифікованим вивільненням. Гідрофільна речовина, що утворює "частину з негайним вивільненням", яку використовують в даному винаході, спеціально не обмежується, при умові, що частина з негайним вивільненням може розпадатися і/або розчинятися. В іншому варіанті здійснення даного винаходу гідрофільна речовина спеціально не обмежується, при умові, що частина з негайним вивільненням може практично повністю розпастися раніше, ніж частина з модифікованим вивільненням утворить гель. Стан "майже повністю" можна визначити або оцінити по моменту, коли гідрофільна речовина, яка утворює матрицю частини з негайним вивільненням, візуально майже повністю розпадається в умовах проведення тесту на розчинність. Стан "майже повністю" можна визначити або оцінити на основі результатів випробування на розчинність, коли 70% або більше лікарського засобу (85% або більше в іншому варіанті здійснення даного винаходу і 90% або більше в ще одному варіанті здійснення даного винаходу) розчиняється протягом 15 хв., або коли 85% або більше лікарського засобу (90% або більше в іншому варіанті здійснення даного винаходу) розчиняється протягом 30 хв., або коли 90% або більше лікарського засобу розчиняється протягом 60 хв. Максимальний процент розчинення частини з негайним вивільненням визначають, встановивши процент розчинення лікарського засобу з фармацевтичної композиції через 60 хв. в умовах, коли випробування розчинності проводять відповідно до тесту на розчинність, спосіб 2 (спосіб з використанням лопатевої мішалки, швидкість обертання від 50 об./хв. до 200 об./хв.), який описаний в Фармакопеї Японії, або коли випробування розчинності проводять відповідно до тесту на розчинність, спосіб 1 (спосіб в барабані, швидкість обертання від 50 об./хв. до 200 об./хв.), який описаний в Фармакопеї Японії. Приклади гідрофільної речовини включають D-маніт, мальтозу, поліетиленгліколь і полівінілпіролідон. Частина з негайним вивільненням містить соліфенацин або його фармацевтично прийнятну сіль і гідрофільну речовину. Гідрофільна речовина може виконувати функції наповнювача і/або зв'язувального. Як наповнювач можуть використовуватися D-маніт, мальтоза, поліетиленгліколь або полівінілпіролідон. Як зв'язувальний можуть використовуватися мальтоза, поліетиленгліколь або полівінілпіролідон. Приклади поліетиленгліколю (PEG) включають PEG 400, PEG 1500, PEG 4000, PEG 6000 і PEG 20000 (торгова назва, кожна з них виготовляється компанією NOF Corporation). Приклади полівінілпіролідону (PVP) включають Kollidon K25 і Kollidon K90 (торгові назви, кожна з них виготовляється компанією BASF). Що стосується стану гідрофільної речовини, яка знаходиться в частині з негайним вивільненням, то даний винахід включає варіант втілення, в якому гідрофільна речовина рівномірно розподілена в частині з негайним вивільненням, і варіант втілення, в якому гідрофільна речовина рівномірно розташовується на межі частини з негайним вивільненням. 8 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 60 Гідрофільні речовини можуть використовуватися окремо або у вигляді відповідної комбінації двох або більшої кількості гідрофільних речовин. Вміст гідрофільної речовини складає, наприклад, від 2% мас. до 40% мас. (від 4% мас. до 35% мас. в іншому варіанті здійснення даного винаходу) по відношенню до препаративної форми, і від 5% мас. до 95% мас. (від 10% мас. до 90% мас. в іншому варіанті здійснення даного винаходу і від 20% мас. до 80% мас. в ще одному варіанті здійснення даного винаходу) по відношенню до частини з негайним вивільненням. Різні фармацевтичні добавки, якщо необхідно, можуть відповідним чином використовуватися при отриманні фармацевтичної композиції за даним винаходом, і вони спеціально не обмежуються при умові, що вони фармацевтично і фармакологічно прийнятні. Приклади фармацевтичної добавки включають зв'язувальне, стабілізатор, розрихлювач, підкислювач, шипучий засіб, штучний підсолоджувач, віддушку, лубрикант, барвник, буферну добавку, антиоксидант і поверхнево-активну речовину. Приклади зв'язувального включають гуміарабік, гідроксипропілметилцелюлозу, гідроксипропілцелюлозу і гідроксіетилцелюлозу. Приклади стабілізатора включають жовтий оксид заліза(ІІІ), червоний оксид заліза(ІІІ) і чорний оксид заліза. Як стабілізатор для поліетиленоксиду фармацевтична композиція для орального введення за даним винаходом, переважно, містить жовтий оксид заліза(ІІІ) і/або червоний оксид заліза(ІІІ). Коли стабілізатор додають в матрицю шляхом фізичного змішування, вміст стабілізатора складає, наприклад, від 1% мас. до 20% мас. (від 3% мас. до 15% мас. в іншому варіанті здійснення даного винаходу) по відношенню до маси препаративної форми. Наприклад, вміст червоного оксиду заліза(ІІІ) складає, наприклад, від 5% мас. до 20% мас. (від 10% мас. до 15% мас. в іншому варіанті здійснення даного винаходу) по відношенню до маси препаративної форми. Вміст жовтого оксиду заліза(ІІІ) складає, наприклад, від 1% мас. до 20% мас. (від 3% мас. до 10% мас. в іншому варіанті здійснення даного винаходу). Коли на стабілізатор наносять плівкове покриття, то його вміст складає, наприклад, від 0,3% мас. до 2% мас. (від 0,5% мас. до 1,5% мас. в іншому варіанті здійснення даного винаходу) по відношенню до маси таблетки. У цьому випадку концентрація жовтого оксиду заліза(ІІІ) або червоного оксиду заліза(ІІІ), що містився в плівці, складає, наприклад, від 5% мас. до 50% мас. (від 10% мас. до 20% мас. в іншому варіанті здійснення даного винаходу). Термін "шляхом фізичного змішування з матрицею" в даному описі означає, наприклад, спосіб, при якому лікарський засіб, поліетиленоксид і оксид(и) заліза(ІІІ) дисперговані рівномірно і в результаті лікарський засіб і оксид заліза(ІІІ), рівномірно дисперговані в поліетиленоксиді, як головній основі препаративної форми. Термін "плівкове покриття" в даному описі означає, наприклад, спосіб, в якому оксид(и) заліза(ІІІ) розчинені або суспендовані в розчині водорозчинного полімеру, такому як гідроксипропілметилцелюлоза, а заздалегідь приготовані таблетки покривають вказаним розчином або суспензією, щоб сформувати тонкий шар. Жовтий оксид заліза(ІІІ) і/або червоний оксид заліза(ІІІ), які можуть використовуватися за даним винаходом, можуть знаходитися в будь-якому місці препаративної форми. Оксид(и) заліза(ІІІ) можуть, наприклад, попасти в плівку при нанесенні плівкового покриття і т. п., в гранули при гранулюванні і т. п., в матрицю (наприклад, розташовуватися навколо поліетиленоксиду) і т. п. Приклади розрихлювача включають кукурудзяний крохмаль, картопляний крохмаль, кальцієве похідне кармелози, натрієве похідне кармелози і гідроксипропілцелюлозу з низьким ступенем заміщення. Приклади підкислювача включають лимонну кислоту, винну кислоту і яблучну кислоту. Приклади шипучої речовини включають бікарбонат натрію. Приклади штучного підсолоджувача включають натрієве похідне сахарину, динатрій гліциринат, аспартам, стевію і тауматин. Приклади віддушки включають лимон, лимон-лайм, апельсин і ментол. Приклади лубриканту включають стеарат магнію, стеарат кальцію, складний ефір сахарози з жирними кислотами, поліетиленгліколь, тальк і стеаринову кислоту. Приклади барвника включають харчовий барвник жовтий №4, харчовий барвник жовтий №5, харчовий барвник червоний №3, харчовий барвник червоний №102 і харчовий барвник синій №3. Приклади буферної добавки включають лимонну кислоту, янтарну кислоту, фумарову кислоту, винну кислоту, аскорбінову кислоту і їх солі; глутамінову кислоту, глутамін, гліцин, аспарагінову кислоту, аланін, аргінін і їх солі; і оксид магнію, оксид цинку, гідроксид магнію, фосфорну кислоту, борну кислоту і їх солі. Приклади антиоксиданту включають аскорбінову кислоту, дибутилгідрокситолуол і пропілгалат. 9 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади поверхнево-активної речовини включають полісорбат 80, лаурилсульфат натрію і поліоксіетильовану гідровану касторову олію. Вказані фармацевтичні добавки можуть відповідним чином додаватися індивідуально або ж у вигляді комбінації двох або більшої кількості фармацевтичних добавок у відповідній кількості. Кожна фармацевтична добавка може міститися в такій кількості, щоб досягалася необхідна дія композиції за даним винаходом. Приклади фармацевтичної композиції (препаративної форми) за даним винаходом включають таблетки, які готують відомим способом, наприклад, багатошарові таблетки, такі як двошарова таблетка, в якій частина з модифікованим вивільненням і частина з негайним вивільненням являють собою тонкі шари, багатошарову таблетку, в якій ламінуванню піддають Множину частин з модифікованим вивільненням і частин з негайним вивільненням, і тришарову таблетку, в якій шар гідрофільної речовини, що не містить лікарського засобу і/або нерозчинної у воді речовини, розташовується в сандвіч-структурі між частиною з модифікованим вивільненням і частиною з негайним вивільненням; таблетка, покрита оболонкою сухим способом, в якій серцевину таблетки утворює частину з модифікованим вивільненням, а частина з негайним вивільненням виконує роль зовнішнього покриття; і таблетка з плівковим покриттям, в якій частина з модифікованим вивільненням як серцевина покрита частиною з негайним вивільненням шляхом нанесення плівкового покриття. Нижче детально пояснюється спосіб приготування фармацевтичної композиції за даним винаходом. (1) Стадії подрібнення і змішування Пристрій і спосіб, які використовують на стадії подрібнення, спеціально не обмежуються, при умові, що лікарські засоби і відповідні добавки можна фармацевтично подрібнити. Приклади пристрою включають молотковий млин, кульовий млин, вихровий млин і колоїдний млин. Умови подрібнення можна вибрати відповідним чином, і вони спеціально не обмежуються. Пристрій і спосіб, які використовують на стадії змішування після проведення стадії подрібнення, спеціально не обмежуються, при умові, що компоненти можуть бути однорідно змішані фармацевтично. (2) Частина з модифікованим вивільненням: стадія гранулювання Пристрій і спосіб, які використовують на даній стадії, спеціально не обмежуються, при умові, що полімер, що утворює гідрогель, може бути гранульований з використанням рідини, що розпилюється. Приклади гранулювання включають спосіб гранулювання при швидкому перемішуванні, спосіб гранулювання подрібненням, спосіб гранулювання в псевдозрідженому шарі, екструзійний спосіб гранулювання, спосіб гранулювання в барабані і спосіб гранулювання розпиленням; і пристрої, які використовують у вказаних способах. В іншому варіанті здійснення даного винаходу може застосовуватися спосіб гранулювання в псевдозрідженому шарі і відповідний пристрій, а в ще одному варіанті здійснення даного винаходу може застосовуватися спосіб гранулювання в псевдозрідженому шарі в барабані і відповідний пристрій. Отриманий гранульований продукт можна висушити. Спосіб сушіння спеціально не обмежується, при умові, що гранульований продукт можна висушити фармацевтично. (3) Частина з негайним вивільненням: стадія гранулювання Пристрій і спосіб, які використовують на даній стадії, спеціально не обмежуються, при умові, що лікарський засіб може бути гранульований з використанням рідини, що розпилюється. Приклади гранулювання включають спосіб гранулювання в псевдозрідженому шарі, спосіб гранулювання в розплаві, спосіб гранулювання при швидкому перемішуванні, спосіб гранулювання подрібненням, екструзійний спосіб гранулювання, спосіб гранулювання в барабані, спосіб гранулювання розпиленням і сухий спосіб гранулювання; і пристрої, які використовують у вказаних способах. В іншому варіанті здійснення даного винаходу може застосовуватися спосіб гранулювання в псевдозрідженому шарі. Як зв'язувальна речовина, що застосовується при вологому гранулюванні, переважною є гідрофільна речовина, і може використовуватися, наприклад, поліетиленгліколь, мальтоза або полівінілпіролідон. Вказані зв'язувальні сполуки можуть використовуватися індивідуально або у вигляді відповідної комбінації двох або більшої кількості зв'язувальних. Умови для приготування рідини, що використовується при розпиленні можна вибрати відповідним чином, і вони спеціально не обмежуються. Отриманий гранульований продукт можна висушити. Спосіб сушіння спеціально не обмежується, при умові, що гранульований продукт можна висушити фармацевтично. (4) Стадія формування Пристрій і спосіб, які використовують на даній стадії, спеціально не обмежуються, при умові, що фармацевтичну композицію за даним винаходом можна формувати. 10 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади способу включають: спосіб, при якому лікарські засоби і відповідні добавки змішують без гранулювання і сушіння; і пресують в форму, отримуючи таблетки; спосіб, при якому проводять стадію гранулювання, до отриманого гранульованого продукту додають лубрикант і отриману суміш пресують в форму, отримуючи таблетки; спосіб отримання двошарових таблеток шляхом прокачування тонких шарів з частини з модифікованим вивільненням і частини з негайним вивільненням; спосіб отримання багатошарових таблеток шляхом прокачування тонких шарів з множини частин з модифікованим вивільненням і частин з негайним вивільненням; спосіб отримання багатошарових таблеток шляхом розміщення шару, що не містить лікарського засобу, між частиною з модифікованим вивільненням і частиною з негайним вивільненням; і спосіб отримання таблеток, покритих оболонкою сухим способом, у яких серцевину таблетки утворює частина з модифікованим вивільненням, а частина з негайним вивільненням виконує роль зовнішнього покриття. В іншому варіанті здійснення даного винаходу можна використати спосіб отримання двошарових таблеток. Приклади таблеткової машини включають багатошарову роторну таблеткову машину і масляний прес. Умови для таблетування, такі як тиск при таблетуванні, спеціально не обмежуються, при умові, що можуть бути отримані двошарові таблетки і багатошарові таблетки. При приготуванні двошарових таблеток гранульовану речовину для першого шару і іншу гранульовану речовину для другого шару прокочують у вигляді тонких шарів і стискають в таблетковій машині під тиском від приблизно 2 кН приблизно до 20 кН з тим, щоб отримати двошарові таблетки. В іншому варіанті здійснення даного винаходу гранульовану речовину для першого шару стискають в таблетковій машині під тиском від приблизно 0,1 кН до приблизно 10 кН, а іншу гранульовану речовину для другого шару наносять на перший шар і стискають в таблетковій машині під тиском від приблизно 2 кН до приблизно 20 кН з тим, щоб отримати двошарові таблетки. При виготовленні багатошарових таблеток тиск в таблетковій машині можна, відповідно, регулювати таким чином, щоб здійснити стиснення. Твердість отриманої таблетки спеціально не обмежується, при умові, що таблетка не ушкоджується в процесі її виготовлення і подальшого переміщення. Твердість може складати, наприклад, від 2 до 20 Н. (5) Нанесення плівкового покриття Після таблетування на отримані таблетки може бути нанесене покриття. Спосіб нанесення плівкового покриття спеціально не обмежується, при умові, що на таблетки можна нанести покриття фармацевтично. Приклади покриття включають покриття, яке наносять в установці барабанного типу, і покриття, яке наносять методом занурення. Речовини для нанесення покриття можна додавати окремо або у вигляді поєднання відповідної кількості двох або декількох речовин. Ступінь покриття спеціально не обмежується, при умові, що плівка може бути утворена. Ступінь покриття складає, наприклад, від 1% до 10%. Коли на серцевину у вигляді частини з модифікованим вивільненням наносять покриття з частини з негайним вивільненням, з метою отримання таблеток з оболонкою, то рідина для розпилення, яку готують, розчиняючи або диспергуючи компоненти частини з негайним вивільненням в розчиннику, такому як вода, можна нанести на серцевину шляхом розпилення і отримати таблетки з покриттям. Ступінь покриття спеціально не обмежується, при умові, що може бути утворена плівка з частини з негайним вивільненням. Ступінь покриття складає, наприклад, від 1% до 20%. Після нанесення плівкового покриття таблетки з оболонкою можуть бути висушені. Спосіб сушіння спеціально не обмежується, при умові, що покриті оболонкою таблетки можуть бути фармацевтично висушені. Умови сушіння спеціально не обмежуються, при умові, що вони вибрані відповідним чином з урахуванням, наприклад, стабільності препаративної форми. Початковий вміст води після нанесення плівкового покриття, переважно, складає від 0,1% до 2% відповідно, наприклад, до стійкості. Фармацевтична композиція для орального введення за даним винаходом може використовуватися як фармацевтична композиція для лікування симптомів з боку нижніх сечовивідних шляхів, пов'язаних з доброякісної гіперплазією передміхурової залози. Спосіб виготовлення фармацевтичної композиції за даним винаходом спеціально не обмежується, при умові, що необхідна фармацевтична препаративна форма може бути отримана шляхом відповідного комбінування вищезгаданих способів або відомих способів. ПРИКЛАДИ 11 UA 102885 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід далі пояснюється наступними прикладами, порівняльними прикладами і експериментальними прикладами, які ні в якому разі його не обмежують. Приклад 1 (1) Отримання змішаного порошку для частини з модифікованим вивільненням Рідину для розпилення отримують, розчиняючи 1,2 частини макроголю 8000 в 4,8 частинах води при перемішуванні і суспендуючи 0,1 частини заздалегідь подрібненого гідрохлориду тамсулозину у вказаному розчині. У реактор для гранулювання в псевдозрідженому шарі вміщують 8,8 частин макроголю 8000 і 50 частин поліетиленоксиду [POLYOX (зареєстрована торгова марка) WSR-303, виробник - компанія Dow] і проводять гранулювання шляхом розпилення рідини, що використовується при розпиленні. Отриманий внаслідок гранулювання продукт сушать і 60,1 частини висушеного гранульованого продукту змішують з 0,3 частинами стеарату магнію, отримуючи змішаний порошок для частини з модифікованим вивільненням. (2) Отримання змішаного порошку для частини з негайним вивільненням Рідину для розпилення отримують, розчиняючи 1 частину мальтози в 4 частинах води при перемішуванні. Потім змішують 0,6 частин соліфенацину і 2,4 частин маніту і подрібнюють, а отриману подрібнену суміш і 5,9 частин маніту вміщують в реактор для гранулювання в псевдозрідженому шарі і проводять гранулювання шляхом розпилення рідини, що використовується при розпиленні. Отриманий внаслідок гранулювання продукт сушать і 9,9 частини висушеного гранульованого продукту змішують з 0,1 частинами стеарату магнію, отримуючи змішаний порошок для частини з негайним вивільненням. (3) Виготовлення таблеток і нанесення покриття Отриманий змішаний порошок для частини з модифікованим вивільненням і отриманий змішаний порошок для частини з негайним вивільненням формують у вигляді таблеток за допомогою багатошарової роторної таблеткової машини і отримують препаративну форму (двошарові таблетки) за даним винаходом. На отримані двошарові таблетки наносять покриття способом розпилення за допомогою раніше приготованої рідини для розпилення, яку отримують шляхом розчинення і диспергування 5,04 частин гідроксипропілметилцелюлози, 0,95 частин макроголю 6000 і 1,26 частини жовтого оксиду заліза(ІІІ), і отримують фармацевтичну композицію (таблетки з плівковим покриттям) за даним винаходом. Експериментальний приклад 1 Фармацевтичну композицію, отриману в Прикладі 1, піддають випробуванню на розчинність, яке проводять відповідно до тесту на розчинність, метод 2 (спосіб з використанням лопатевої мішалки, 50 об./хв.), описаного в Фармакопеї Японії. Об'єм, що використовується при проведенні випробування рідини становить 900 мл. Проценти розчинення соліфенацину після 15 хв., 30 хв. і 60 хв. з початку випробування наведені в таблиці 1. Приклад 2 (1) Отримання змішаного порошку для частини з модифікованим вивільненням Рідину для розпилення отримують, розчиняючи 1,2 частини макроголю 8000 в 4,8 частинах води при перемішуванні і суспендуючи 0,1 частини заздалегідь подрібненого гідрохлориду тамсулозину у вказаному розчині. У реактор для гранулювання в псевдозрідженому шарі вміщують 8,8 частин макроголю 8000 і 50 частин поліетиленоксиду [POLYOX (зареєстрована торгова марка) WSR-303, виробник - компанія Dow] і проводять гранулювання шляхом розпилення рідини, що використовується при розпиленні. Отриманий внаслідок гранулювання продукт сушать і 60,1 частини висушеного гранульованого продукту змішують з 0,3 частинами стеарату магнію, отримуючи змішаний порошок для частини з модифікованим вивільненням. (2) Отримання змішаного порошку для частини з негайним вивільненням Після того як змішують і подрібнюють 0,6 частин соліфенацину і 2,4 частин маніту, отриману подрібнену суміш, 5,9 частин маніту, 1 частину PEG 8000 і 0,1 частину стеарату магнію змішують і отримують змішаний порошок для частини з негайним вивільненням. (3) Виготовлення таблеток Отриманий змішаний порошок для частини з модифікованим вивільненням і отриманий змішаний порошок для частини з негайним вивільненням формують у вигляді таблеток за допомогою масляного преса і отримують фармацевтичну композицію (двошарові таблетки) за даним винаходом. Приклад 3 (1) Отримання змішаного порошку для частини з модифікованим вивільненням Рідину для розпилення отримують, розчиняючи 1,2 частини макроголю 8000 в 4,8 частинах води при перемішуванні і суспендуючи 0,1 частини заздалегідь подрібненого гідрохлориду тамсулозину у вказаному розчині. У реактор для гранулювання в псевдозрідженому шарі вміщують 8,8 частин макроголю 8000 і 50 частин поліетиленоксиду [POLYOX (зареєстрована 12 UA 102885 C2 5 10 15 20 25 30 35 40 45 торгова марка) WSR-303, виробник - компанія Dow] і проводять гранулювання шляхом розпилення рідини, що використовується при розпиленні. Отриманий внаслідок гранулювання продукт сушать і 60,1 частини висушеного гранульованого продукту змішують з 0,3 частинами стеарату магнію, отримуючи змішаний порошок для частини з модифікованим вивільненням. (2) Отримання змішаного порошку для частини з негайним вивільненням Рідину для розпилення отримують, розчиняючи 0,5 частин полівінілпіролідону (PVP K90) в 4 частинах води при перемішуванні. Потім змішують 0,6 частин соліфенацину і 2,4 частин маніту, подрібнюють і отриману подрібнену суміш і 6,4 частин маніту вміщують в реактор для гранулювання в псевдозрідженому шарі і проводять гранулювання шляхом розпилення рідини, що використовується при розпиленні. Отриманий внаслідок гранулювання продукт сушать і 9,9 частин висушеного гранульованого продукту змішують з 0,1 частинами стеарату магнію, отримуючи змішаний порошок для частини з негайним вивільненням. (3) Виготовлення таблеток Отриманий змішаний порошок для частини з модифікованим вивільненням і отриманий змішаний порошок для частини з негайним вивільненням формують у вигляді таблеток за допомогою багатошарової роторної таблеткової машини і отримують фармацевтичну композицію (двошарові таблетки) за даним винаходом. Порівняльний приклад 1 (1) Отримання змішаного порошку для частини з модифікованим вивільненням Рідину для розпилення отримують, розчиняючи 1,2 частини макроголю 8000 в 4,8 частинах води при перемішуванні і суспендуючи 0,1 частини заздалегідь подрібненого гідрохлориду тамсулозину у вказаному розчині. У реактор для гранулювання в псевдозрідженому шарі вміщують 8,8 частин макроголю 8000 і 50 частин поліетиленоксиду [POLYOX (зареєстрована торгова марка) WSR-303, виробник - компанія Dow] і проводять гранулювання шляхом розпилення рідини, що використовується при розпиленні. Отриманий внаслідок гранулювання продукт сушать і 60,1 частини висушеного гранульованого продукту змішують з 0,3 частинами стеарату магнію, отримуючи змішаний порошок для частини з модифікованим вивільненням. (2) Отримання змішаного порошку для частини з негайним вивільненням Рідину для розпилення отримують, розчиняючи 204 частини гідроксипропілметилцелюлози 2919 в 1836 частинах води при перемішуванні. Потім змішують 340 частин сукцинату соліфенацину і 1360 частин лактози, подрібнюють і отриману подрібнену суміш, 2125 частин лактози і 1020 частин кукурудзяного крохмалю вміщують в реактор для гранулювання в псевдозрідженому шарі і проводять гранулювання шляхом розпилення рідини, що - використовується при розпиленні. Отриманий в результаті гранулювання продукт сушать і 1188 частин висушеного гранульованого продукту, змішують з 12 частинами стеарату магнію, отримуючи змішаний порошок для частини з негайним вивільненням. (3) Виготовлення таблеток Отриманий змішаний порошок для частини з модифікованим вивільненням і отриманий змішаний порошок для частини з негайним вивільненням формують у вигляді таблеток за допомогою масляного преса і отримують фармацевтичну композицію (двошарові таблетки) для порівняння. Експериментальний приклад 2 Фармацевтичну композицію, отриману в прикладах 1-3 і порівняльному прикладі 1, піддають випробуванню на розчинність, яке проводять відповідно до тесту на розчинність, метод 1 (барабанний спосіб, 100 об./хв.), описаного в Фармакопеї Японії. Об'єм, що використовується при проведенні випробування рідини, становить 900 мл. Ступінь розчинення соліфенацину після 15 хв., 30 хв. і 60 хв. з початку проведення випробування наведені в таблиці 2. Таблиця 1 Приклад 1 15 хв. 71% 50 13 30 хв. 85% 60 хв. 94% UA 102885 C2 Таблиця 2 Приклад 1 Приклад 2 Приклад 3 Порівняльний приклад 1 5 10 15 15 хв. 93% 96% 94% 62% 30 хв. 95% 98% 96% 82% 60 хв. 96% 99% 97% 88% Застосовність в промисловості У даному винаході пропонується фармацевтична композиція для орального введення, яка включає частину з модифікованим вивільненням, що містить тамсулозин або його фармацевтично прийнятну сіль, і частину з негайним вивільненням, що містить соліфенацин або його фармацевтично прийнятну сіль. Фармацевтична композиція за даним винаходом демонструє ступінь вивільнення, аналогічний ступеню вивільнення відомих препаративних форм, що містять один лікарський засіб, і, таким чином, може застосовуватися як спосіб приготування препаративної форми, який дозволяє отримати єдину препаративну форму (тобто об'єднану препаративну форму), здатну чинити фармакологічну дію, еквівалентну фармакологічній дії відомих препаративних форм, які містять один лікарський засіб. Як указано вище, даний винахід пояснюється з посиланням на конкретні варіанти його здійснення, однак модифікації і поліпшення, очевидні фахівцям з галузі техніки, входять в об'єм даного винаходу. ФОРМУЛА ВИНАХОДУ 20 25 30 35 40 45 50 1. Таблетка для орального введення, що включає (1) шар, який містить частину з модифікованим вивільненням, яка включає тамсулозин або його фармацевтично прийнятну сіль, і полімер, який утворює гідрогель, і (2) шар, який включає частину з негайним вивільненням, яка включає соліфенацин або його фармацевтично прийнятну сіль, і гідрофільну речовину, де 70 % або більше соліфенацину розчиняються протягом 15 хв. 2. Таблетка для орального введення за п. 1, де частина з негайним вивільненням розпадається і/або розчиняється раніше, ніж частина з модифікованим вивільненням утворить гель. 3. Таблетка для орального введення за п. 1 або 2, де 85 % або більше соліфенацину розчиняється протягом 15 хв. 4. Таблетка для орального введення за п. 3, де 90 % або більше соліфенацину розчиняється протягом 60 хв. 5. Таблетка для орального введення за п. 4, де 70 % або більше соліфенацину розчиняється протягом 15 хв. і 90 % або більше соліфенацину розчиняється протягом 60 хв. 6. Таблетка для орального введення за п. 5, де 85 % або більше соліфенацину розчиняється протягом 30 хв. і 90 % або більше соліфенацину розчиняється протягом 60 хв. 7. Таблетка для орального введення за будь-яким з пп. 1-6, де гідрофільна речовина являє собою одну сполуку або дві або більше сполук, вибраних з групи, що складається з поліетиленгліколю, мальтози, полівінілпіролідону і маніту. 8. Таблетка для орального введення за будь-яким з пп. 1-7, де гідрофільна речовина складає від 5 % мас. до 99 % мас. 9. Таблетка для орального введення за будь-яким з пп. 1-8, де гідрофільну речовину або дві або більше гідрофільних речовин, вибраних з групи, що складається з поліетиленгліколю, мальтози, полівінілпіролідону і маніту, використовують як зв'язувальну речовину. 10. Таблетка для орального введення за будь-яким з пп. 1-9, де маніт як гідрофільну речовину використовують як наповнювач. 11. Таблетка для орального введення за будь-яким з пп. 1-10, де полімер, що утворює гідрогель, має в'язкість 4000 мПа·с або більше в 1 %-ному водному розчині (25 °С). 12. Таблетка для орального введення за п. 11, де полімер, що утворює гідрогель, являє собою один полімер або два або декілька полімерів, вибраних з групи, що складається з поліетиленоксиду, гідроксипропілметилцелюлози, натрійкарбоксиметилцелюлози і карбоксивінілового полімеру. 13. Таблетка для орального введення за п. 12, де полімером, що утворює гідрогель, є поліетиленоксид. 14 UA 102885 C2 5 10 14. Таблетка для орального введення за п. 13, де середньов'язкісна молекулярна маса поліетиленоксиду становить 5000000 або більше. 15. Таблетка для орального введення за будь-яким з пп. 1-14, де полімер, що утворює гідрогель, складає від 5 % мас. до 95 % мас. 16. Таблетка для орального введення за будь-яким з пп. 1-15, де частина з модифікованим вивільненням додатково включає добавку, яка дозволяє воді проникати в препаративну форму. 17. Таблетка для орального введення за п. 16, де добавка, яка дозволяє воді проникати в препаративну форму, має таку розчинність, що кількість води, необхідна для розчинення 1 г вказаної добавки, становить 5 мл або менше. 18. Таблетка для орального введення за п. 17, де добавка, яка дозволяє воді проникати в препаративну форму, складає від 3 % мас. до 80 % мас. 19. Таблетка для орального введення за будь-яким з пп. 1-18, для лікування симптомів з боку нижніх сечовивідних шляхів, пов'язаних з доброякісною гіперплазією передміхурової залози. 20. Таблетка для орального введення за будь-яким з пп. 1-19, яка є багатошаровою таблеткою. 15 UA 102885 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition for oral administration
Автори англійськоюYasuji, Takehiko, Kinoshita Noriyuki, Yoshino Hiroyuki, Kawahama Shuuya, Sako, Kazuhiro, Sugihara Akio
Назва патенту російськоюТаблетка для орального введения, которая содержит тамсулозин и солифенацин
Автори російськоюЯсудзи Такехико, Киносита Нориюки, Йосино Хироюки, Кавахама Сууя, Сако Казухиро, Сугихара Акио
МПК / Мітки
МПК: A61K 31/439, A61K 47/38, A61P 13/08, A61K 47/10, A61K 47/32, A61P 13/02, A61K 31/18, A61K 47/26
Мітки: орального, включає, введення, тамсулозин, соліфенацин, таблетка
Код посилання
<a href="https://ua.patents.su/18-102885-tabletka-dlya-oralnogo-vvedennya-shho-vklyuchaeh-tamsulozin-i-solifenacin.html" target="_blank" rel="follow" title="База патентів України">Таблетка для орального введення, що включає тамсулозин і соліфенацин</a>
Попередній патент: Спосіб одержання алкалоїдів з рослинної сировини
Наступний патент: Спосіб регенерації відпрацьованих нафтових мастил
Випадковий патент: Спосіб діагностики хламідіозу і мікоплазмозу у хворих на ранній сифіліс