Спосіб синтезу агомелатину
Формула / Реферат
1. Спосіб промислового синтезу сполуки формули (І):
 , (I)
, (I)
який відрізняється тим, що 1-(4-метоксифеніл)-4-пентен-1-он формули (II):
 (II)
(II)
піддають реакції у присутності вільнорадикального ініціатора зі сполукою формули (III):
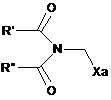 , (III)
, (III)
де R′ і R", які можуть бути однаковими або різними, причому кожен являє собою лінійну або розгалужену (С1-С6)алкільну групу, або R′ і R" разом утворюють (С2-С3)алкіленовий ланцюг, причому кільце, утворене таким чином, може бути злитим з фенільною групою, а Ха є групою -S-C(S)-OR, в якій R являє собою лінійну або розгалужену (С1-С6)алкільну групу,
з одержанням продукту приєднання формули (IV):
 , (IV)
, (IV)
де R, R′ і R" є такими, як визначено вище,
при цьому існує можливість необов'язкового виділення сполуки формули (IV), з амінної функції якої необов'язково може бути знятий захист, і вона може бути перетворена на ацетамідну функцію, яку піддають реакції циклізації за присутності вільнорадикального ініціатора, щоб утворити сполуку формули (V):
 , (V)
, (V)
є зрозумілим, що група ![]() вказує на захищену амінну функцію, визначену як наступні:
вказує на захищену амінну функцію, визначену як наступні:
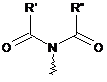 ,
,
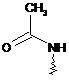 ,
,
де R′ і R" є такими, як визначено вище,
амінна функція цієї сполуки формули (V) необов'язково може бути зі знятим захистом,
зазначену сполуку формули (V) або піддають відновленню-етерифікації з наступною дегідратацією, або перетворюють на вінілгалід з одержанням сполуки формули (VI):
 , (VI)
, (VI)
де Y являє собою атом галогену або атом водню, група ![]() є такою, як визначено вище,
є такою, як визначено вище,
захищену амінну функцію цієї сполуки формули (VI) перетворюють на ацетамідну функцію, де це застосовано, тобто якщо це перетворення не було здійснене раніше, з одержанням сполуки формули (VI′):
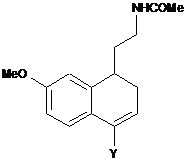 , (VI’)
, (VI’)
де Y є таким, як визначено вище,
яку, зрештою, піддають реакції ароматизації з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини.
2. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули (III) вибирають із:
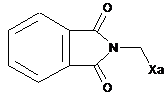 ,
, 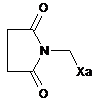 ,
, 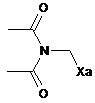 ,
,
де Ха=-S-C(S)-OR є таким, як визначено в п. 1.
3. Спосіб синтезу сполуки формули (І) за будь-яким з п. 1 або п. 2, який відрізняється тим, що група Ха=-S-C(S)-OC2H5.
4. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що вільнорадикальні реакції ініціюють термічними способами за температури від 50 до 140 °C.
5. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що етап додавання сполуки формули (II) до сполуки формули (III) ініціюють за присутності дилауроїлу пероксиду.
6. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що реакцію циклізації продукту приєднання формули (IV) здійснюють за присутності дилауроїлу пероксиду, необов'язково з пероксидом дибензоїлу.
7. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що етап додавання сполуки формули (II) до сполуки формули (III) і етап циклізації продукту приєднання формули (IV) здійснюють в етилацетаті.
8. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули (V), де R′ і R" разом утворюють етиленовий ланцюг, кільце, утворене таким чином, є злитим з фенільною групою, піддають реакції зняття захисту з аміну, а потім реакції з оцтовим ангідридом, щоб утворити сполуку формули (VII):
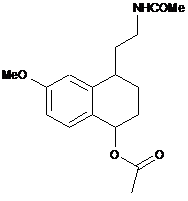 , (VII)
, (VII)
цю сполуку формули (VII) потім гідролізують, а потім дегідратують, перш ніж піддати реакції ароматизації з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини.
9. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули (V), де R′ і R" разом утворюють етиленовий ланцюг, кільце утворене таким чином, є злитим з фенільною групою, піддають реакції галогенування з одержанням сполуки формули (VI"), окремого випадку сполук формули (VI):
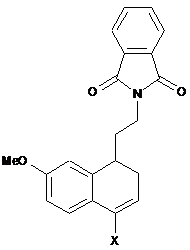 , (VI")
, (VI")
де X являє собою атом галогену (переважно Сl або Вr),
зазначену сполуку формули (VI") потім піддають реакції зняття захисту з аміну, а потім - реакції з оцтовим ангідридом, щоб утворити сполуку формули (VIter), окремий випадок сполук формули (VI):
 , (VIter)
, (VIter)
де X є таким, як визначено вище,
зазначену сполуку формули (VIter), зрештою, ароматизують в основному середовищі з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини.
10. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що реакцію зняття захисту з амінної функції сполуки формули (V), коли амінна функція захищена фталімідною групою, здійснюють у присутності боргідриду натрію або речовини типу гідразину.
11. Спосіб синтезу сполуки формули (І) за п. 8, який відрізняється тим, що етап ароматизації сполуки формули (VII) здійснюють, використовуючи бензохінон, такий як 2,3-дихлор-5,6-диціано-1,4-бензохінон (ДДХ).
12. Спосіб синтезу сполуки формули (І) за п. 9, який відрізняється тим, що ароматизацію сполуки формули (VIter) здійснюють у присутності сильної ненуклеофільної основи.
13. Спосіб синтезу сполуки формули (І) за п. 9, який відрізняється тим, що ароматизацію сполуки формули (VIter) здійснюють у присутності пари алкоголят/спирт.
14. Спосіб синтезу сполуки формули (І) за п. 13, який відрізняється тим, що ароматизацію сполуки формули (VIter) здійснюють у присутності пари калію трет-бутилат/трет-бутанол або пари калію 3-метил-3-пентилат/3-метил-3-пентанол.
15. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що додавання сполуки формули (II) до сполуки формули (III), де R' і R" кожен являє собою метилову групу, здійснюють з одержанням продукту приєднання формули (IV'):
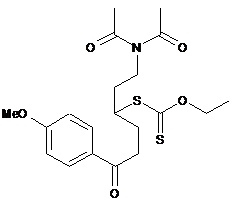 , (IV')
, (IV')
яку піддають реакції зняття захисту у присутності основи (такої як триетиламін) з одержанням сполуки формули (IV"), яку, необов'язково, виділяють:
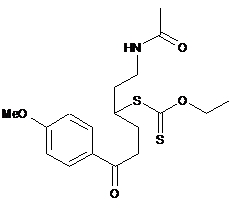 , (IV")
, (IV")
зазначену сполуку формули (IV") потім піддають реакції циклізації у присутності вільнорадикального ініціатора з одержанням сполуки формули (V'), окремий випадок сполук формули (V):
 , (V')
, (V')
яку перетворюють на вінілгалід, а потім піддають реакції ароматизації з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини.
16. Сполука формули (V) за п. 1 для використання як проміжної сполуки в синтезі агомелатину формули (І).
17. Сполука формули (V) за п. 16, яку вибирають з наступних сполук:
- 2-[2-(7-метокси-4-оксо-1,2,3,4-тетрагідро-1-нафтил)етил]-1Н-ізоіндол-1,3(2Н)-діон,
- N-[2-(7-метокси-4-оксо-1,2,3,4-тетрагідро-1-нафтил)етил]ацетамід.
18. Застосування сполуки формули (V) за будь-яким з п. 16 або п. 17 в синтезі агомелатину формули (І).
19. Сполука формули (VI) за п. 1 для використання як проміжної сполуки в синтезі агомелатину формули (І).
20. Сполука формули (VI) за п. 19, вибрана з наступних сполук:
- 2-[2-(4-хлор-7-метокси-1,2-дигідро-1-нафтил)етил]-1Н-ізоіндол-1,3(2Н)-діон,
- 2-[2-(4-бром-7-метокси-1,2-дигідро-1-нафтил)етил]-1Н-ізоіндол-1,3(2Н)-діон,
- N-[2-(4-хлор-7-метокси-1,2-дигідро-1-нафтил)етил]ацетамід,
- N-[2-(4-бром-7-метокси-1,2-дигідро-1-нафтил)етил]ацетамід,
- N-[2-(7-метокси-1,2-дигідро-1-нафтил)етил]ацетамід.
21. Застосування сполуки формули (VI) за будь-яким з п. 19 або п. 20 в синтезі агомелатину формули (І).
22. Сполука формули (VII) за п. 8 для використання як проміжної сполуки в синтезі агомелатину формули (І).
23. Застосування сполуки формули (VII) за п. 22 в синтезі агомелатину формули (І).
24. Спосіб синтезу агомелатину за п. 1, починаючи зі сполуки формули (V), який відрізняється тим, що сполуку формули (V) одержують відповідно до способу синтезу згідно з будь-яким одним із пп. від 1 до 7.
25. Спосіб синтезу агомелатину за п. 1, починаючи зі сполуки формули (VI), який відрізняється тим, що сполуку формули (VI) одержують відповідно до способу синтезу згідно з будь-яким одним із пп. від 1 до 7 або 9.
26. Спосіб синтезу агомелатину за п. 1, починаючи зі сполуки формули (VII), який відрізняється тим, що сполуку формули (VII) одержують відповідно до способу синтезу згідно з п. 8 або 11.
Текст
Реферат: Спосіб промислового синтезу сполуки формули (І) NHCOMe MeO (I). (72) Винахідник(и): Зард Самір (FR), Сіре Беатріс (FR), Бумедьєн Мехді (FR) (73) Власник(и): ЛЕ ЛАБОРАТУАР СЕРВЬЄ, 35, rue de Verdun, F-92284 Suresnes Cedex, France (FR) (74) Представник: Петошевіч Діна Анатоліївна, реєстр. №284 (56) Перелік документів, взятих до уваги експертизою: EP 1564202 A, 17.08.2005 EP 0447285 A1, 18.09.1991 EP 2151428 A1, 10.02.2010 Fourmaintraux E. et al. Tetrahydronaphthalenic derivatives as new agonist and antagonist ligands for melatonin receptors // Bioorganic and Medicinal Chemistry. - 1998 - Vol. 6, No. 1. - P. 9-13 UA 104123 C2 (12) UA 104123 C2 UA 104123 C2 Даний винахід стосується нового способу промислового синтезу агомелатину, або N-[2-(7метокси-1-нафтил)етил]ацетаміду, формули (І): 5 10 15 20 25 30 35 40 Агомелатин, або N-[2-(7-метокси-1-нафтил)етил]ацетамід, має цінними фармакологічними властивостями. Фактично він має подвійні характеристики, з одного боку, агоніста рецепторів мелатонінергічної системи і, з іншого боку, антагоніста, рецепторів мелатонінергічної системи і, з іншого боку, антагоніста рецептора 5-НТ2С. Зазначені властивості забезпечують його активність у центральній нервовій системі і, зокрема, у лікуванні значної депресії, сезонних афективних розладів, порушень сну, серцево-судинних захворювань, захворювань системи травлення, безсоння і втоми, викликаних зміною часових поясів, порушень апетиту і ожиріння. Агомелатин, його приготування і терапевтичне застосування були описані в Європейських патентних специфікаціях ЕР 0447285 і ЕР 1564202. Беручи до уваги фармацевтичну цінність цієї сполуки, дуже важливою є можливість виробляти її, використовуючи ефективний промисловий спосіб синтезу, який може бути легко перенесений у промисловий масштаб і який забезпечить одержання агомелатину з гарним виходом і відмінною чистотою. У Європейському патенті ЕР 0447285 описується виробництво агомелатину за вісім етапів, починаючи з 7-метоксі-1-тетралону. У Європейському патенті ЕР 1564202 Заявник розробив новий шлях синтезу, який є набагато ефективнішим, який може застосовуватись у промисловості, складається тільки з чотирьох етапів, починаючи з 7-метокси-1-тетралону, і дає можливість одержати агомелатин за способом з високою відтворюваністю в чітко визначеній кристалічній формі. Проте, на даний час ще є актуальним пошук нових шляхів синтезу, зокрема тих, які розпочинаються з початкових матеріалів, які є дешевшими за 7-метокси-1 -тетралон. Заявник продовжував свої дослідження і розробив новий спосіб синтезу агомелатину, починаючи з 1-(4-метоксифеніл)-4-пентен-1-ону і сполуки ксантогенату: ці нові початкові матеріали мають перевагу в тому, що вони прості і їх легко одержувати у великих кількостях з меншими витратами. Цей шлях синтезу оснований на проведенні вільно-радикальних реакцій, які не дуже широко використовуються, але, однак, є дуже ефективними. Конвертування цих реакцій у промисловий масштаб з використанням потокових реакторів є перспективним, оскільки контролювати поширення ланцюгової реакції стає простіше. Більше того, цей новий спосіб робить можливим одержання агомелатину відтворюваним способом і не вимагає трудомісткого очищення, з чистотою, сумісною з його застосуванням як фармацевтично активного інгредієнта. Дійсно, агомелатин може, відповідно, бути синтезованим за 6 етапів, під час яких виділяють тільки одну із проміжних речовин. Зокрема, даний винахід стосується способу промислового синтезу сполуки формули (І): причому спосіб відрізняється тим, що 1-(4-метоксифеніл)-4-пентен-1-он формули (II): 45 1 UA 104123 C2 вступає в реакцію, за присутності вільно-радикального ініціатора, зі сполукою формули (III): 5 10 15 де R' і R", які можуть бути однаковими або різними, кожен являє собою лінійну або розгалужену (С1-С6)алкільну групу, або R' і R" разом утворюють (С 2-С3)алкіленовий ланцюг, причому кільце, утворене таким чином, може бути злитим з фенільною групою, а Ха є групою S-C(S)-OR, в якій R являє собою лінійну або розгалужену (С1-С6)алкільну групу, з одержанням продукту приєднання формули (IV): де R, R' і R" є такими, як визначено вище, причому існує можливість необов'язкового виділення сполуки формули (IV), з амінної функції якої може, необов'язково, бути знятий захист, і вона може бути перетворена на ацетамідну функцію, яку піддають реакції циклізації за присутності вільно-радикального ініціатора, щоб утворити сполуку формули (V): 20 є зрозумілим, що група вказує на захищену амінну функцію, визначену як наступні: 2 UA 104123 C2 5 10 де R' і R" є такими, як визначено вище, амінна функція цієї сполуки формули (V) може, необов'язково, бути зі знятим захистом, зазначену сполуку формули (V) або піддають відновленню-етерифікації з наступною дегідратацією, або перетворюють на вінілгалід з одержанням сполуки формули (VI): де Y являє собою атом галогену (який нижче називають X) або атом водню, група є такою, як визначено вище, захищену амінну функцію цієї сполуки формули (VI) перетворюють на ацетамідну функцію, де це застосовно, тобто якщо це перетворення не було здійснене раніше, з одержанням сполуки формули (VI): 15 20 де Y є таким, як визначено вище, яку, зрештою, піддають реакції ароматизації з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини. Сполука формули (II) є доступною фахівцям у даній галузі техніки за допомогою звичайних хімічних реакцій і/або хімічних реакцій, описаних в літературі (Pattisson, V.A. etal., J. Am. Chem. Soc. 1962, 84, 4295). Переважними сполуками формули (III) є: 25 3 UA 104123 C2 5 10 15 20 25 де Ха = -S-C(S)-OR є таким, як визначено вище. В переважній Ха групі R являє собою етилову групу. У способі згідно з винаходом ініціацію вільно-радикальних реакцій здійснюють термічними способами. Переважно реакційну суміш нагрівають до температури від 50 °C до 140 °C. Пероксиди є вільно-радикальними ініціаторами, які є особливо придатними для проведення етапу додавання сполуки формули (II) до сполуки формули (III) або для виконання циклізації сполуки формули (IV) з утворенням сполуки формули (V). Як приклад, можна назвати, зокрема, діізобутирил пероксид, куміл пероксинеодеканоат, тpeт-аміл пероксинеодеканоат, ди(2етилгексил) пероксидикарбонат, трет-бутил пероксинеодеканоат, дибутил пероксидикарбонат, дицетил пероксидикарбонат, диміристил пероксидикарбонат, трет-бутил пероксинеогептаноат, тpeт-аміл пероксипівалат, дидеканоїл пероксид, тpeт-аміл перокси-2-етилгексаноат, трет-бутил пероксиізобутират, 1,4-ди(трет-бутилпероксикарбо)циклогексан, трет-бутил пероксиацетат, трет-бутил пероксибензоат, ди-трет-аміл пероксид, трет-бутил куміл пероксид, біс(трет-бутил) пероксид, дикуміл пероксид, дилауроїл пероксид (ДЛП), дибензоїл пероксид або ди(4-третбутилциклогексил) пероксидикарбонат. Переважно реакцію ініціюють за присутності дилауроїлу пероксиду. В переважному варіанті втілення винаходу реакцію циклізації продукту приєднання формули (IV) здійснюють за присутності дилауроїлу пероксиду, необов'язково - з пероксидом дибензоїлу. Реакції приєднання і/або циклізації проводять у розчиннику, який зазвичай використовується в хімії вільних радикалів, такому як 1,2-дихлоретан, дихлорметан, бензол, толуол, трифторметилбензол, хлорбензол, гексан, циклогексан, гептан, октан, етилацетат, тpeтбутиловий спирт та їх суміші. Перевагу у способі згідно з винаходом віддають використанню етилацетату. Коли амінна функція сполуки формули (V) захищена фталімідною групою (тобто R' і R" разом утворюють етиленовий ланцюг, кільце, утворене таким чином, є злитим з фенільною групою): - сполуку формули (V) переважно піддають реакції зняття захисту з аміну, а потім реакції з оцтовим ангідридом, щоб утворити сполуку формули (VII): 30 35 цю сполуку формули (VII) потім гідролізують, а потім дегідратують, перш ніж піддати реакції ароматизації, з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини, - необов'язково сполуку формули (V) можуть піддавати реакції галогенування з одержанням сполуки формули (VI"), окремого випадку сполук формули (VI): 4 UA 104123 C2 5 10 15 20 де X являє собою атом галогену (переважно СІ або Вr), зазначену сполуку формули (VI") потім піддають реакції зняття захисту з аміну, а потім - реакції з оцтовим ангідридом, щоб ter утворити сполуку формули (Vl ), окремий випадок сполук формули (VI): де X є таким, як визначено вище, ter цю сполуку формули (Vl ), зрештою, ароматизують в основному середовищі з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини. В переважному варіанті втілення винаходу реакцію зняття захисту з аміну, коли амінна функція захищена фталімідною групою, здійснюють за присутності відновлювача, такого як борогідрид натрію. Також можна використовувати речовини типу гідразину. Переважно етап ароматизації сполуки формули (VII) може бути проведений з використанням бензохінону, такого як 2,3-дихлор-5,6-диціано-1,4-бензохінон (ДДХ), тоді як ter ароматизацію сполуки формули (Vl ) переважно здійснюють за присутності сильної ненуклеофільної основи. Зазначену останню реакцію здійснюють в полярному протонному ter середовищі. В переважному варіанті втілення винаходу ароматизацію сполуки формули (Vl ) здійснюють за присутності пари алкоголят/спирт, і навіть більш переважно - за присутності пари калію трет-бутилат/трет-бутанол або пари калію 3-метил-3-пентилат/3-метил-3-пентанол. В іншому варіанті винаходу додавання сполуки формули (II) до сполуки формули (III), де R' і R", кожен, являє собою метилову групу, здійснюють з одержанням продукту приєднання формули (IV): 25 5 UA 104123 C2 яку піддають реакції зняття захисту за присутності основи (такої як триетиламін) з одержанням сполуки формули (IV"), яку, необов'язково, виділяють: 5 зазначену сполуку формули (IV") потім піддають реакції циклізації за присутності вільнорадикального ініціатора з одержанням сполуки формули (V'), окремий випадок сполук формули (V): 10 15 20 25 30 35 яку перетворюють на вінілгалід, а потім піддають реакції ароматизації з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини. Цей спосіб є особливо цінним з наступних причин: - він дозволяє одержати сполуку формули (І) у промисловому масштабі з хорошим виходом, починаючи з простого дешевого початкового матеріалу; - тільки проміжна речовина формули (V) потребує етапу очищення і виділення. Сполуки з формулами (V), (VI) і (VII), одержані згідно зі способом за винаходом, є новими і придатними як проміжні сполуки у синтезі агомелатину. Переважними сполуками формули (V) є наступні: - 2-[2-(7-метоксі-4-оксо-1,2,3,4-тетрагідро-1-нафтил) етил]-1 Н-ізоіндол-1,3(2Н)-діон, - N-[2-(7-метоксі-4-оксо-1,2,3,4-тетрагідро-1-нафтил) етил]ацетамід. Переважними сполуками формули (VI) є наступні: - 2-[2-(4-хлор-7-метоксі-1,2-дигідро-1-нафтил) етил]-1Н-ізоіндол-1,3(2Н)-діон, - 2-[2-(4-бром-7-метоксі-1,2-дигідро-1-нафтил) етил]-1Н-ізоіндол-1,3(2H)-діон, - N-[2-(4-хлор-7-метоксі-1,2-дигідро-1-нафтил) етил]ацетамід, - N-[2-(4-бром-7-метоксі-1,2-дигідро-1-нафтил) етил]ацетамід, - N-[2-(7-метоксі-1,2-дигідро-1-нафтил) етил]ацетамід. Приклади, наведені нижче, ілюструють винахід, жодним чином не обмежуючи його. З метою затвердження шляху реакції проміжні речовини синтезу, систематично виділяли і характеризували. Однак, можна значно оптимізувати процедури шляхом обмеження кількості виділених проміжних речовин. Відповідно, Приклад 5, наведений нижче, відповідає тому ж самому шляху реакції, який використовується у Прикладі 4, але з тією різницею, що виділяють тільки N-[2-(7-метоксі-4-оксо-1,2,3,4-тетрагідро-1-нафтил)етил]ацетамід. Приклад 1:N-[2-(7-Метокси-1-нафтил)етил1ацетамід Етап A: S-{(1,3-діоксо-1,3-дигідро-2Н-ізоіндол-2-іл)метил]-О-етил дитіокарбонат До холодного (0 °C) розчину N-(хлорметил)фталіміду (40,0 г, 205,0 ммоль) в ацетоні (400 мл) додають послідовними частинами калію О-етилксантогенат (36,1г, 225,0 ммоль). Реакційну 6 UA 104123 C2 5 10 15 20 25 30 35 40 45 50 55 60 суміш перемішують за температури 0 °C протягом 30 хвилин, а потім розчинник випаровують. Залишок, одержаний таким чином, переносять у воду. Водну фазу екстрагують дихлорметаном, в той час як органічні фази висушують над MgSO4 і концентрують під зниженим тиском. Одержаний таким чином залишок перекристалізовують із суміші етилацетату і петролейного ефіру з одержанням зазначеного в заголовку продукту з виходом 74 %. 1 Н ЯМР (, част/млн) 7,90-7,84 (м, 2Н, СН-2), 7,77-7,72 (м, 2Н, СН-1), 5,33 (CDCI3 400 МГц) (с, 2Н, СН2-5), 4,68 (к, 2Н, J=7,1 Гц, СН2-7), 1,46 (т, 3Н, J=7,1 Гц, СН3-8). 13 С ЯМР (, част/млн) 210,2 (CS), 166,6 (NCO), 134,4 (СН-7), 131,8 (С-3), (CDCI3, 100 МГц) 123,6 (СН-2), 70,5 (СН2-7), 41,2 (СН2-5), 13,7 (СН3-8). Етап Б: S-[1-[2-(1,3-діоксо-1,3-дигідро-2Н-ізоіндол-2-іл)етил]-4-(4-метоксифеніл)-4оксобутил]-О-етил дитіокарбонат 1 Суміш 1-(4-метоксифеніл)-4-пентен-1-ону (11,0 г, 57,6 ммоль) і ксантогенату, одержану на Етапі А (19,4 г, 69,2 ммоль), в етилацетаті (580 мл) нагрівають до кипіння в атмосфері азоту протягом 15 хвилин. Потім кожні 1,5 години додають 10 моль% дилауроїлу пероксиду. Після додавання 4 × 10 моль% і 1 × 5 моль% дилауроїлу пероксиду розчинник, зрештою, випаровують і одержаний залишок очищають за допомогою колонкової флеш-хроматографії (петролейний ефір-етилацетат: 80-20) з одержанням зазначеної в заголовку сполуки у вигляді масла з виходом 78 %. MCBP (El, м/з) Розрах. для C24H25NO5S2: 471,1174; знайдено: 471,1172. Етап В: 2-[2-(7-Метоксі-4-оксо-1,2,3,4-тетрагідро-1-нафтил)етил]-1Н-ізоіндол-1,3(2Н)-діон Розчин продукту, одержаного на Етапі Б (20,6 г, 43,7 ммоль), в хлорбензолі (660 мл) кип'ятять в атмосфері азоту протягом 15 хвилин. Потім кожні 15 хвилин додають 10 моль% дилауроїлу пероксиду доти, доки всі початкові реагенти не споживаються повністю. Суміш охолоджують до температури навколишнього середовища і концентрують під зниженим тиском. Потім вводять ацетонітрил, щоб викликати осадження значної частини сполук ділауроїлу пероксиду. Суміш потім фільтрують, концентрують під зниженим тиском і очищають за допомогою колонкової флеш-хроматографії (петролейний ефір-етилацетат: 90-10, потім 70-30) з одержанням зазначеного в заголовку продукту у вигляді твердої речовини з виходом 39 %. МСВР (ЕІ, м/з) Розрах. для C21H19NO4: 349,1314; знайдено: 349,1316. Етап Г: 4-[2-(Ацетиламіно)етил]-6-метоксі-1,2,3,4-тетрагідро-1-нафтил ацетат До розчину тетралону, одержаного на Етапі В (350 мг, 1,0 ммоль), в ізопропанолі (10 мл) за температури навколишнього середовища додають борогідрид натрію (190 мг, 5,0 ммоль). Суміш перемішують за кипіння протягом ночі, а потім додають по краплях розчин гідроксиду натрію (80 мг, 2,0 ммоль) у воді (2,0 мл). Підтримують кипіння суміші протягом 30 хвилин, а потім додають ацетон (1,5мл). Через 10 хвилин суміш охолоджують до температури навколишнього середовища, перед тим як концентрувати під зниженим тиском. Одержане в такий спосіб масло розчиняють в дихлорметані (10 мл). Потім додають диметиламінопіридин (270 мг, 2,2 ммоль), з наступним додаванням по краплях оцтового ангідриду (210 мкл, 2,2 ммоль). Розчин перемішують за температури навколишнього середовища протягом 1 години, а потім додають воду. Рівень рН розчину коригують до 8-9 шляхом додавання насиченого розчину гідрокарбонату натрію. Водну фазу екстрагують дихлорметаном і органічні фази промивають насиченим розчином NaCI, висушують над сульфатом магнію, фільтрують і випаровують. Зазначену в заголовку сполуку одержують після очищення за допомогою колонкової флешхроматографії (етилацетат-петролейний ефір: 90-10, потім етилацетат-метанол: 90-10) у вигляді масла з виходом 79 %. МСВР (ЕІ, м/з) Розрах. для C17H23NO4: 305,1627; знайдено: 305,1630. Етап Д: N-[2-(7-Meтoкci-1,2-дигідро-1-нафтил)етил]ацетамід До розчину сполуки, одержаної на Етапі Г (261 мг, 0,86 ммоль), в суміші метанол/вода (2/0,2 мл) за температури навколишнього середовища додають гідроксид натрію (86 мг, 2,14 ммоль). Суміш перемішують протягом 1 години під час кипіння, а потім розчин охолоджують. Додають соляну кислоту (2,6 мл, 2,6 ммоль, 1N) і суміш перемішують протягом ночі. Водну фазу екстрагують дихлорметаном, а органічні фази промивають насиченим розчином NaCI, висушують над сульфатом магнію, фільтрують і випаровують. Зазначену в заголовку сполуку одержують після очищення за допомогою колонкової флеш-хроматографії (етилацетатпетролейний ефір: 90-10, потім етилацетат-метанол: 90-10) у вигляді масла з виходом 61 %. МСВР (ЕІ, м/з) Розрах. для C15H19NO2: 245,1416; знайдено: 245,1413. Етап Е: N-[2-(7-Meтокси-1-нафтил)етил]ацетамід До розчину сполуки, одержаної на Етапі Д (100 мг, 0,41 ммоль), в дихлорметані (4 мл) додають за температури навколишнього середовища ДДХ (111 мг, 0,49 ммоль). Реакційну суміш перемішують протягом 2 діб, а потім промивають насиченим розчином NaHCO 3. Водну 7 UA 104123 C2 5 10 15 20 25 30 35 40 45 50 55 60 фазу екстрагують етилацетатом, а органічні фази збирають, а потім висушують з використанням розсолу, а потім над MgSO4. Після фільтрування розчинники випаровують під зниженим тиском і одержану неочищену реакційну суміш очищають за допомогою хроматографії на колонці з силікагелем (елюант: етилацетат/петролейний ефір 90/10, потім етилацетат/метанол 90/10) з одержанням зазначеного в заголовку продукту з виходом 48 %. Приклад 2: N-[2-(7-Метокси-1-нафтил)етил]ацетамід Етап А: 2-[2-(7-Метоксі-4-оксо-1,2,3,4-тетрагідро-1-нафтил)етил]-1 Н-ізоіндол-1,3(2Н)-діон Сполуку одержують згідно з процедурою, описаною для Етапів від А до В Прикладу 1. Етап Б: 2-[2-(4-Хлор-7-метоксі-1,2-дигідро-1-нафтил) етил]-1Н-ізоіндол-1,3(2Н)-діон До розчину ДМФ (190 мкл, 2,4 ммоль) в 1,0 мл дихлорметану за температури 0 °C додають 2 по краплях РОСІ3 (190 мл, 2,0 ммоль) . Через 30 хвилин одержаний на Етапі А тетралон (0,70 г, 2,0 ммоль), розчинений в дихлорметані (2,0 мл), додають по краплях до реагенту Вільсмейера. Температурі реакційної суміші дозволяють повернутися до температури навколишнього середовища. Суміш перемішують доти, доки реагенти не зникають повністю (контролюють за допомогою ТШХ). Потім додають насичений розчин ацетату натрію, а потім розчин екстрагують дихлорметаном. Органічну фазу промивають насиченим розчином NaCI і водою, а потім висушують над MgSO4, фільтрують і випаровують. Зазначену в заголовку сполуку одержують за допомогою колонкової флеш-хроматографії (петролейний ефір-етилацетат: 80-20) у вигляді твердої речовини з виходом 75 %. MCBP (El, м/з) Розрах. для C21H18CINO3: 367,0975; знайдено: 367,0975. Етап В: N-[2-(4'Хлор-7-метоксі-1,2-дигідро-1-нафтил)етил]ацетамід До розчину одержаної на Етапі Б сполуки (370 мг, 1,0 ммоль) в ізопропанолі (10 мл) за температури навколишнього середовища додають борогідрид натрію (190 мг, 5,0 ммоль). Суміш перемішують протягом 3 годин під час кипіння, а потім додають по краплях розчин гідроксиду натрію (80 мг, 2,0 ммоль) у воді (2,0 мл). Підтримують кипіння суміші протягом 30 хвилин, а потім додають ацетон (1,5 мл). Через 10 хвилин суміш охолоджують до температури навколишнього середовища, перед тим як концентрувати під зниженим тиском. Одержане в такий спосіб масло розчиняють в дихлорметані (10 мл). Потім додають диметиламінопіридин (270 мг, 2,2 ммоль), з наступним додаванням по краплях оцтового ангідриду (210 мкл, 2,2 ммоль). Розчин перемішують за температури навколишнього середовища протягом 1 години, а потім додають воду. Також додають декілька крапель соляної кислоти (1N), щоб одержати кислий рівень рН. Водну фазу екстрагують дихлорметаном, а органічні фази промивають насиченим розчином NaCI, висушують над сульфатом магнію, фільтрують і випаровують. Зазначену в заголовку сполуку одержують після очищення за допомогою колонкової флешхроматографії (етилацетат-петролейний ефір: 90-10, потім етилацетат-метанол: 90-10) у вигляді масла з виходом 71 %. МСВР (ЕІ, м/з) Розрах. для C15H18CINO2: 279,1026; знайдено: 279,1030. Етап Г: N-[2-(7-Meтoкcи-1-нафтил )етил]ацетамід До розчину сполуки, одержаної на Етапі В (125 мг, 0,45 ммоль), в трет-бутанолі (1 мл) за кипіння додають калію /трет-бутилат (200 мг, 1,8 ммоль). Суміш перемішують протягом 3 годин під час кипіння, а потім додають соляну кислоту (1N). Водну фазу екстрагують дихлорметаном, а органічні фази промивають насиченим розчином NaCI, висушують над сульфатом магнію, фільтрують і випаровують. Зазначену в заголовку сполуку одержують після очищення за допомогою колонкової флеш-хроматографії (етилацетатпетролейний ефір: 90-10, потім етилацетат-метанол: 90-10) у вигляді твердої речовини з виходом 68 %. МСВР (ЕІ, м/з) Розрах. для C15H19NO3: 261,1365; знайдено: 261,1369. Приклад 3: N-[2-(7-Метокси-1-нафтил)етил]ацетамід Етап А: 2-[2-(7-Метоксі-4-оксо-1,2,3,4-тетрагідро-1-нафтил)етил]-1Н-ізоіндол-1,3(2Н)-діон Сполуку одержують згідно з процедурою, описаною для Етапів від А до В Прикладу 1. Етап Б: 2-[2-(4-Бром-7-метоксі-1,2-дигідро-1-нафтил)етил]-1Н-ізоіндол- 1,3(2Н)-діон До холодного розчину трифеніл фосфіту (290 мкл, 1,1 ммоль) в дихлорметані (3,5 мл), який підтримують за температури -78 °C в атмосфері азоту, додають по краплях бром (60 мкл, 1,2 3 ммоль) . До розчину додають триетиламін (180 мкл, 1,3 ммоль) і одержаний на Етапі А тетралон (350 мг, 1,0 ммоль). Реакційну суміш перемішують протягом 18 годин, поки її температура не повернеться до температури навколишнього середовища. Потім суміш нагрівають до кипіння протягом однієї години, перед тим як концентрувати, і очищають за допомогою колонкової флеш-хроматографії (петролейний ефір-етилацетат: 80-20). Зазначену в заголовку сполуку одержують у вигляді масла з виходом 95 %. MCBP (El, м/з) Розрах. для C21H18BrNO3: 411,0470; знайдено: 411,0470. 8 UA 104123 C2 5 10 15 20 25 30 35 40 45 50 55 60 Етап В: N-[2-(4-Бpoм-7-метоксі-1,2-дигідро-1-нафтил)етил]ацетамід До розчину одержаної на Етапі Б сполуки (390 мг, 0,95 ммоль) в ізопропанолі (10 мл) за температури навколишнього середовища додають борогідрид натрію (179 мг, 4,7 ммоль). Суміш перемішують протягом 3 годин під час кипіння, а потім додають по краплях розчин гідроксиду натрію (76 мг, 1,9 ммоль) у воді (2,0 мл). Підтримують кипіння суміші протягом 30 хвилин, а потім додають ацетон (1,5мл). Через 10 хвилин суміш охолоджують до температури навколишнього середовища, перед тим як концентрувати під зниженим тиском. Одержане таким чином масло розчиняють в дихлорметані (10 мл). Потім додають диметиламінопіридин (255 мг, 2,1 ммоль), з наступним додаванням по краплях оцтового ангідриду (200 мкл, 2,1 ммоль). Розчин перемішують за температури навколишнього середовища протягом 1 години, а потім додають воду. Також додають декілька крапель соляної кислоти (1N), щоб одержати кислий рівень рН. Водну фазу екстрагують дихлорметаном, а органічні фази промивають насиченим розчином NaCI, висушують над сульфатом магнію, фільтрують і випаровують. Зазначену в заголовку сполуку одержують після очищення за допомогою колонкової флеш-хроматографії (етилацетат-петролейний ефір: 90-10, потім етилацетат-метанол: 90-10) у вигляді масла з виходом 64 %. МСВР (ЕІ, м/з) Розрах. для C15H18BrNO2: 323,0521; знайдено: 323,0517. Етап Г: N-[2-(7-Метокси-1-нафтил) етил]ацетамід Сполуку одержують згідно з процедурою, описаною для Етапу Г Прикладу 2. Приклад 4: N-[2-(7-Метокси-1-нафтил)етил]ацетамід Етап А: S-[(Ацетиламіно)метил]-О-етил дитіокарбонат Ацетамід (29,5 г, 0,50 моль) і параформальдегід (18,0 г, 0,6 моль) розчиняють в оцтовому ангідриді (250 мл) і оцтовій кислоті (50 мл). Розчин нагрівають за температури 80 °C протягом 5 годин, охолоджують і випаровують. 20 % за масою одержаного в результаті масла потім розчиняють в етанолі (200 мл) і охолоджують до температури 0 °C перед додаванням калію Оетилксантогенату (19,2 г, 0,12 моль). Реакційну суміш перемішують за температури навколишнього середовища протягом 6 годин, а потім додають воду і велику частину етанолу видаляють із суміші під зниженим тиском. Суспензію тримають за температури 0 °C протягом 20 хвилин і фільтрують. Після розчинення залишку в дихлорметані органічну фазу висушують над сульфатом магнію, фільтрують і випаровують з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини з виходом 57 %. МСВР (ЕІ, м/з) Розрах. для C6H11NO2S2: 193,0231; знайдено: 193,0230. Етап Б: S-[(Диацетиламіно)метил]-О-етил дитіокарбонат Розчин ксантогенату, одержаного на Етапі А (5,93 г, 30,7 ммоль) в ізопренілацетаті (45 мл) кип'ятять протягом ночі за присутності декількох кристалів р-толуолсульфонової кислоти, а потім охолоджують і концентрують під зниженим тиском. Зазначену в заголовку сполуку одержують у вигляді масла після очищення за допомогою колонкової флеш-хроматографії (етилацетат-петролейний ефір: 80-20) у кількісному виході. МСВР (ЕІ, м/з) Розрах. для C8H13NO3S2: 235,0337; знайдено: 235,0338. Етап В: S-[1-[2-Диацетиламіно)етил]-4-(4-метоксифеніл)-4-оксобутил]-О-етил дитіокарбонат Сполуку з Етапу Б використовують безпосередньо без очищення. Масло, одержане на вищезазначеному Етапі (25 % за масою), додають до розчину 1-(4-метоксифеніл)-4-пентен-1ону (2,92 г, 15,3 ммоль) в етилацетаті (8 мл) і кип'ятять в атмосфері азоту протягом 15 хвилин. Потім кожні 1,5 години додають 10 моль% дилауроїлу пероксиду (305 мг). Після додавання 2 × 10 моль% і 1 × 5 моль% дилауроїлу пероксиду розчинник випаровують. Зазначену в заголовку сполуку одержують після очищення за допомогою колонкової флеш-хроматографії (етилацетатпетролейний ефір: 90-10, потім чистий етилацетат) у вигляді масла з виходом 72 %. МСВР (ЕІ, м/з) Розрах. для C20H27NO5S2: 425,1331; знайдено: 425,1331. Етап Г: N-[2-(7-метоксі-4-оксо-1,2,3,4-тетрагідро-1-нафтил)втил]ацетамід Розчин одержаної на Етапі В сполуки (1,10 г, 2,59 ммоль) в етилацетаті (52 мл) кип'ятять в атмосфері азоту протягом 15 хвилин, а потім кожні 1,5 години додають дибензоїлу пероксид (940 мг, 3,88 ммоль) і 20 моль% дилауроїлу пероксиду (206 мг), поки реагенти не зникають повністю. Суміш потім охолоджують до температури навколишнього середовища і концентрують під зниженим тиском. Одержане таким чином масло розчиняють в метанолі (5 мл) за присутності триетиламіну (3,6 мл), а потім кип'ятять протягом 1 години. Суміш концентрують під зниженим тиском і очищають за допомогою колонкової флеш-хроматографії (етилацетатпетролейний ефір: 90-10, потім етилацетат-метанол: 80-20) з одержанням зазначеної в заголовку сполуки у вигляді масла з виходом 56 %. МСВР (ЕІ, м/з) Розрах. для C15H19NO3: 261,1365; знайдено: 261,1369. Етап Д: N-[2-(7-Метокси-1-нафтил)етил]ацетамід 9 UA 104123 C2 5 10 15 20 25 30 35 40 До розчину ДМФ (93 мкл, 1,2 ммоль) в 0,5 мл дихлорметану за температури 0 °C додають по краплях РОСІ3 (92 мл, 1,0 ммоль). Через 30 хвилин одержаний на Етапі Г тетралон (261 мг, 1,0 ммоль), розчинений в дихлорметані (1 мл), додають по краплях до реагенту Вільсмейера. Температурі реакційної суміші дозволяють повернутися до температури навколишнього середовища, перемішуючи протягом ночі. Потім додають насичений розчин ацетату натрію (NaOAc), а потім розчин екстрагують дихлорметаном. Органічну фазу промивають, використовуючи насичений розчин NaCI і воду, а потім висушують над MgSO4, фільтрують і випаровують. Залишок розчиняють в тpeт-бутанолі (2 мл) і кип'ятять. Додають калію третбутилат (450 мг, 4,0 ммоль) і підтримують кипіння суміші протягом 3 годин. Після охолодження до температури навколишнього середовища додають соляну кислоту (1N). Водну фазу екстрагують дихлорметаном, а органічну фазу промивають насиченим розчином NaCI, a потім висушують над MgSO4, фільтрують і випаровують. Зазначену в заголовку сполуку одержують після очищення за допомогою колонкової флеш-хроматографії (етилацетат-петролейний ефір: 90-10, потім етилацетат-метанол: 90-10) у вигляді твердої речовини з виходом 53 %. МСВР (ЕІ, м/з) Розрах. для С15Н19NО3: 261,1365; знайдено: 261,1369. Приклад 5: N-[2-(7-Метокси-1-нафтил)етил]ацетамід Етап А: S-[(Ацетиламіно)метил]-О-етил дитіокарбонат Зазначену в заголовку сполуку одержують згідно з експериментальною методикою, описаною для Прикладу 4. Етап Б: N-[2-(7-Meтoкci-4-oкco-1,2,3,4-тетрагідро-1-нафтил)етил]ацетамід Розчин ксантогенату, одержаний на Етапі А (9,34 г, 48,3 ммоль), в ізопренілацетаті (75 мл) кип'ятять протягом 3 годин за присутності декількох кристалів р-толуолсульфонової кислоти, а потім випаровують з одержанням 5-[(диацетиламіно)метил]-О-етил дитіокарбонату. Зразок одержаного таким чином неочищеного продукту (1,0 г) додають до розчину 1-(4-метоксифеніл)4-пентен-1-ону (800 мг, 4,20 ммоль) в етилацетаті (4 мл) і кип'ятять в атмосфері азоту протягом 15 хвилин. Потім кожні 1,5 години додають 10 моль% дилауроїлу пероксиду (170 мг). Після додавання 4 × 10 моль% і 1× 5 моль% дилауроїлу пероксиду розчинник випаровують з одержанням S-[1-[2-(диацетиламіно)етил]-4-(4-метоксифеніл)-4-оксобутил]-О-етил дитіокарбонату. Неочищений продукт, одержаний таким чином, розчиняють в етилацетаті (85 мл). Розчин кип'ятять в атмосфері азоту протягом 15 хвилин, а потім кожні 1,5 години додають дибензоїл пероксид (1,53 г, 6,30 ммоль) і 20 моль% дилауроїлу пероксиду (335 мг), поки реагенти не зникають повністю. Суміш потім охолоджують до температури навколишнього середовища і концентрують під зниженим тиском. Одержане таким чином масло розчиняють в метанолі (8,5 мл) за присутності триетиламіну (5,9 мл), а потім кип'ятять протягом 1 години. Суміш концентрують під зниженим тиском і очищають за допомогою колонкової флешхроматографії (етилацетат-петролейний ефір: 90-10, потім етилацетат-метанол: 80-20) з одержанням зазначеної в заголовку сполуки у вигляді масла з виходом 44 %. МСВР (ЕІ, м/з) Розрах. для C15H19NO3: 261,1365; знайдено: 261,1369. Етап В: N-[2-(7-Метокси-1-нафтил)етил]ацетамід Зазначену в заголовку сполуку одержують згідно з методикою, описаною для Етапу Д Прикладу 4. MCBP (El, м/з) Розрах. для C15H19NO3: 261,1365; знайдено: 261,1369. ФОРМУЛА ВИНАХОДУ 45 1. Спосіб промислового синтезу сполуки формули (І): NHCOMe MeO , (I) який відрізняється тим, що 1-(4-метоксифеніл)-4-пентен-1-он формули (II): 10 UA 104123 C2 O O (II) піддають реакції у присутності вільнорадикального ініціатора зі сполукою формули (III): O R' N R" Xa O 5 10 , (III) де R′ і R", які можуть бути однаковими або різними, причому кожен являє собою лінійну або розгалужену (С1-С6)алкільну групу, або R′ і R" разом утворюють (С 2С3)алкіленовий ланцюг, причому кільце, утворене таким чином, може бути злитим з фенільною групою, а Ха є групою -S-C(S)-OR, в якій R являє собою лінійну або розгалужену (С1-С6)алкільну групу, з одержанням продукту приєднання формули (IV): R" R' O N O S OR MeO S O 15 , (IV) де R, R′ і R" є такими, як визначено вище, при цьому існує можливість необов'язкового виділення сполуки формули (IV), з амінної функції якої необов'язково може бути знятий захист, і вона може бути перетворена на ацетамідну функцію, яку піддають реакції циклізації за присутності вільнорадикального ініціатора, щоб утворити сполуку формули (V): N MeO O , (V) N є зрозумілим, що група як наступні: вказує на захищену амінну функцію, визначену 11 UA 104123 C2 R" R' N O O , CH3 O 5 NH , де R′ і R" є такими, як визначено вище, амінна функція цієї сполуки формули (V) необов'язково може бути зі знятим захистом, зазначену сполуку формули (V) або піддають відновленню-етерифікації з наступною дегідратацією, або перетворюють на вінілгалід з одержанням сполуки формули (VI): N MeO Y , (VI) N 10 де Y являє собою атом галогену або атом водню, група є такою, як визначено вище, захищену амінну функцію цієї сполуки формули (VI) перетворюють на ацетамідну функцію, де це застосовано, тобто якщо це перетворення не було здійснене раніше, з одержанням сполуки формули (VI′): NHCOMe MeO Y 15 , (VI’) де Y є таким, як визначено вище, яку, зрештою, піддають реакції ароматизації з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини. 2. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули (III) вибирають із: O N Xa 20 O N O N Xa O O , , де Ха=-S-C(S)-OR є таким, як визначено в п. 1. 12 Xa O , UA 104123 C2 5 10 15 3. Спосіб синтезу сполуки формули (І) за будь-яким з п. 1 або п. 2, який відрізняється тим, що група Ха=-S-C(S)-OC2H5. 4. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що вільнорадикальні реакції ініціюють термічними способами за температури від 50 до 140 °C. 5. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що етап додавання сполуки формули (II) до сполуки формули (III) ініціюють за присутності дилауроїлу пероксиду. 6. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що реакцію циклізації продукту приєднання формули (IV) здійснюють за присутності дилауроїлу пероксиду, необов'язково з пероксидом дибензоїлу. 7. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що етап додавання сполуки формули (II) до сполуки формули (III) і етап циклізації продукту приєднання формули (IV) здійснюють в етилацетаті. 8. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули (V), де R′ і R" разом утворюють етиленовий ланцюг, кільце, утворене таким чином, є злитим з фенільною групою, піддають реакції зняття захисту з аміну, а потім реакції з оцтовим ангідридом, щоб утворити сполуку формули (VII): NHCOMe MeO O O 20 25 , (VII) цю сполуку формули (VII) потім гідролізують, а потім дегідратують, перш ніж піддати реакції ароматизації з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини. 9. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули (V), де R′ і R" разом утворюють етиленовий ланцюг, кільце, утворене таким чином, є злитим з фенільною групою, піддають реакції галогенування з одержанням сполуки формули (VI"), окремого випадку сполук формули (VI): O N O MeO X 30 , (VI") де X являє собою атом галогену (переважно Сl або Вr), зазначену сполуку формули (VI") потім піддають реакції зняття захисту з аміну, а ter потім - реакції з оцтовим ангідридом, щоб утворити сполуку формули (VI ), окремий випадок сполук формули (VI): 13 UA 104123 C2 O HN MeO X 5 10 15 20 ter , (VI ) де X є таким, як визначено вище, ter зазначену сполуку формули (VI ), зрештою, ароматизують в основному середовищі з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини. 10. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що реакцію зняття захисту з амінної функції сполуки формули (V), коли амінна функція захищена фталімідною групою, здійснюють у присутності боргідриду натрію або речовини типу гідразину. 11. Спосіб синтезу сполуки формули (І) за п. 8, який відрізняється тим, що етап ароматизації сполуки формули (VII) здійснюють, використовуючи бензохінон, такий як 2,3-дихлор-5,6-диціано-1,4-бензохінон (ДДХ). 12. Спосіб синтезу сполуки формули (І) за п. 9, який відрізняється тим, що ter ароматизацію сполуки формули (VI ) здійснюють у присутності сильної ненуклеофільної основи. 13. Спосіб синтезу сполуки формули (І) за п. 9, який відрізняється тим, що ter ароматизацію сполуки формули (VI ) здійснюють у присутності пари алкоголят/спирт. 14. Спосіб синтезу сполуки формули (І) за п. 13, який відрізняється тим, що ter ароматизацію сполуки формули (VI ) здійснюють у присутності пари калію третбутилат/трет-бутанол або пари калію 3-метил-3-пентилат/3-метил-3-пентанол. 15. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що додавання сполуки формули (II) до сполуки формули (III), де R' і R" кожен являє собою метилову групу, здійснюють з одержанням продукту приєднання формули (IV'): O N O S O MeO S O 25 , (IV') яку піддають реакції зняття захисту у присутності основи (такої як триетиламін) з одержанням сполуки формули (IV"), яку, необов'язково, виділяють: 14 UA 104123 C2 HN O S O MeO S O , (IV") зазначену сполуку формули (IV") потім піддають реакції циклізації у присутності вільнорадикального ініціатора з одержанням сполуки формули (V'), окремий випадок сполук формули (V): HN O MeO 5 10 15 20 25 30 35 O , (V') яку перетворюють на вінілгалід, а потім піддають реакції ароматизації з одержанням сполуки формули (І), яку виділяють у вигляді твердої речовини. 16. Сполука формули (V) за п. 1 для використання як проміжної сполуки в синтезі агомелатину формули (І). 17. Сполука формули (V) за п. 16, яку вибирають з наступних сполук: - 2-[2-(7-метоксі-4-оксо-1,2,3,4-тетрагідро-1-нафтил)етил]-1Н-ізоіндол-1,3(2Н)-діон, - N-[2-(7-метоксі-4-оксо-1,2,3,4-тетрагідро-1-нафтил)етил]ацетамід. 18. Застосування сполуки формули (V) за будь-яким з п. 16 або п. 17 в синтезі агомелатину формули (І). 19. Сполука формули (VI) за п. 1 для використання як проміжної сполуки в синтезі агомелатину формули (І). 20. Сполука формули (VI) за п. 19, вибрана з наступних сполук: - 2-[2-(4-хлор-7-метокси-1,2-дигідро-1-нафтил)етил]-1Н-ізоіндол-1,3(2Н)-діон, - 2-[2-(4-бром-7-метокси-1,2-дигідро-1-нафтил)етил]-1Н-ізоіндол-1,3(2Н)-діон, - N-[2-(4-хлор-7-метокси-1,2-дигідро-1-нафтил)етил]ацетамід, - N-[2-(4-бром-7-метокси-1,2-дигідро-1-нафтил)етил]ацетамід, - N-[2-(7-метокси-1,2-дигідро-1-нафтил)етил]ацетамід. 21. Застосування сполуки формули (VI) за будь-яким з п. 19 або п. 20 в синтезі агомелатину формули (І). 22. Сполука формули (VII) за п. 8 для використання як проміжної сполуки в синтезі агомелатину формули (І). 23. Застосування сполуки формули (VII) за п. 22 в синтезі агомелатину формули (І). 24. Спосіб синтезу агомелатину за п. 1, починаючи зі сполуки формули (V), який відрізняється тим, що сполуку формули (V) одержують відповідно до способу синтезу згідно з будь-яким одним із пп. від 1 до 7. 25. Спосіб синтезу агомелатину за п. 1, починаючи зі сполуки формули (VI), який відрізняється тим, що сполуку формули (VI) одержують відповідно до способу синтезу згідно з будь-яким одним із пп. від 1 до 7 або 9. 26. Спосіб синтезу агомелатину за п. 1, починаючи зі сполуки формули (VII), який відрізняється тим, що сполуку формули (VII) одержують відповідно до способу синтезу згідно з п. 8 або 11. 15 UA 104123 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel process for synthesizing agomelatine
Автори англійськоюZard, Samir, Sire, Beatrice, Boumediene, Mehdi
Автори російськоюЗард Самир, Сире Беатрис, Бумедьен Мехди
МПК / Мітки
МПК: C07D 209/48, C07C 233/18, C07C 231/14, C07C 233/31
Мітки: спосіб, агомелатину, синтезу
Код посилання
<a href="https://ua.patents.su/18-104123-sposib-sintezu-agomelatinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу агомелатину</a>
Попередній патент: Спосіб синтезу агомелатину
Наступний патент: Пристрій для визначення віброзахисних властивостей спеціального взуття
Випадковий патент: Піднімальний пристрій для проведення аварійно-рятувальних робіт












