Спосіб синтезу агомелатину, кристалічна форма агомелатину і фармацевтична композиція, яка його містить
Номер патенту: 78825
Опубліковано: 25.04.2007
Автори: Сувьє Жан-Клод, Гонсалез Бланко Ісаак, Томіно Жиль, Орват Стефан, Шапюі Женевьєв, Дам'єн Жерар
Формула / Реферат
1. Спосіб промислового синтезу сполуки формули (І)
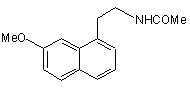 , (I)
, (I)
який відрізняється тим, що 7-метокси-1-тетралон формули (III):
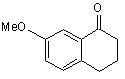 (ІІІ)
(ІІІ)
піддають реакції з ціанооцтовою кислотою формули (IV):
![]() (IV)
(IV)
в умовах, коли воду, що утворилась, видаляють, у присутності каталітичної кількості сполуки формули (V):
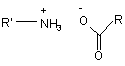 , (V)
, (V)
де R і R', які можуть бути однаковими або відрізнятись, кожний являє собою лінійну або розгалужену (С3-С10)алкільну групу, незаміщену або заміщену арильну групу, або незаміщену або заміщену лінійну або розгалужену арил(С1-С6)алкільну групу,
з одержанням, після фільтрування і промивання основним розчином, (7-метокси-3,4-дигідро-1-нафталеніл)ацетонітрилу формули (VI):
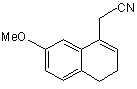 , (VI)
, (VI)
яку піддають реакції гідрогенізації з використанням каталізатора у присутності сполуки алілу, з одержанням сполуки формули (VII):
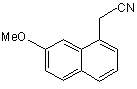 , (VII)
, (VII)
яку потім піддають відновленню воднем у присутності нікелю Ренея в аміачному етанольному середовищі і потім перетворюють в сіль, використовуючи хлористоводневу кислоту, з одержанням сполуки формули (VIII):
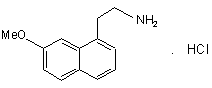 , (VIII)
, (VIII)
яку піддають послідовно дії ацетату натрію і потім оцтового ангідриду з одержанням сполуки формули (І), яку виділяють у формі твердої речовини,
де:
- арил, як повинно розумітись, означає фенільну, нафтильну або біфенільну групу,
- термін "заміщений", що визначає терміни "арил" і "арилалкіл", означає, що ароматична частина цих груп може бути заміщена від 1 до 3 однаковими або різними групами, вибираними з лінійного або розгалуженого (С1-С6)алкілу, гідрокси і лінійного або розгалуженого (С1-С6)алкокси,
- "сполука алілу", як повинно розумітись, являє собою будь-яку молекулу, яка містить від 3 до 10 атомів вуглецю, що можуть містити в доповнення від 1 до 5 атомів кисню, і містить щонайменше одну –СН2-СН=СН2 групу.
2. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що перетворення сполуки формули (III) у сполуку формули (VI) проводять при нагріванні зі зворотним холодильником толуолу.
3. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що R являє собою гексильну групу.
4. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що R' являє собою бензильну групу.
5. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що каталізатор, який залучений у перетворення сполуки формули (III) у сполуку формули (VI), являє собою каталізатор формули (Va):
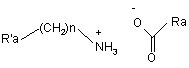 , (Va)
, (Va)
де R'a являє собою фенільну групу, незаміщену або заміщену однією або більше лінійними або розгалуженими (С1-С6)алкільними групами, n являє собою 0 або 1, і Ra являє собою лінійну (С3-С10)алкільну групу.
6. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що каталізатор, використаний для перетворення сполуки формули (III) у сполуку формули (VI), являє собою гептаноат бензиламонію формули (IX):
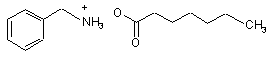 (IX).
(IX).
7. Сполука формули (VI), яка являє собою (7-метокси-3,4-дигідро-1-нафталеніл)ацетонітрил для застосування як проміжної сполуки у синтезі агомелатину.
8. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що перетворення сполуки формули (VI) у сполуку формули (VII) проводять при нагріванні зі зворотним холодильником толуолу.
9. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що каталізатор гідрогенізації, використаний у перетворенні сполуки формули (VI) у сполуку формули (VII), являє собою паладій.
10. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що каталізатор гідрогенізації, використаний у перетворенні сполуки формули (VI) у сполуку формули (VII), являє собою 5% паладій-на-вуглеці.
11. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що кількість каталізатора гідрогенізації, використаного у перетворенні сполуки формули (VI) у сполуку формули (VII), складає 5% за вагою каталізатора відносно ваги субстрату.
12. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що перетворення сполуки формули (VII) у сполуку формули (VIII) проводять при 40°С.
13. Спосіб синтезу сполуки формули (І) за п. 1, який відрізняється тим, що перетворення сполуки формули (VIII) у сполуку формули (І) проводять в етанолі.
14. Спосіб синтезу агомелатину, починаючи зі сполуки формули (VI), який відрізняється тим, що сполуку формули (VI) одержують способом синтезу за будь-яким з пп. 1-6 і піддають ароматизації з наступним відновленням і потім піддають зв'язуванню з оцтовим ангідридом.
15. Спосіб синтезу агомелатину, починаючи зі сполуки формули (VII), який відрізняється тим, що сполуку формули (VII) одержують способом синтезу за будь-яким з пп. 1-6 і 8-11 і піддають відновленню і потім зв'язуванню з оцтовим ангідридом.
16. Спосіб синтезу агомелатину, починаючи зі сполуки формули (VIII), який відрізняється тим, що сполуку формули (VIII) одержують способом синтезу за будь-яким з пп. 1-6 і 8-12 і піддають зв'язуванню з оцтовим ангідридом.
17. Кристалічна II форма агомелатину формули (І):
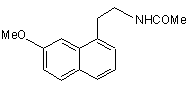 , (I)
, (I)
яка характеризується наступними параметрами:
- моноклінна кришталева решітка,
- параметри решітки: а=20,0903 ![]() , b=9,3194
, b=9,3194 ![]() , с=15,4796
, с=15,4796 ![]() ,
, ![]() =108,667°,
=108,667°,
- просторова група: Р21/n,
- кількість молекул в елементарному осередку: 8,
- об'єм елементарного осередку: Vелементарний осередок=2746,742 ![]() 3,
3,
- щільність: d=1,13г/см3.
18. Фармацевтична композиція, яка містить як активний інгредієнт кристалічну II форму агомелатину за п. 17 у поєднанні з одним або більше фармацевтичнo прийнятними, інертними, нетоксичними носіями.
19. Фармацевтична композиція за п. 18 для застосування у виробництві ліків для лікування розладів мелатонінергічної системи.
20. Фармацевтична композиція за п. 18 для застосування у виробництві ліків для лікування розладів сну, стресу, тривоги, сезонних емоційних розладів або суворої депресії, серцево-судинних патологій, патологій травного тракту, безсоння і втоми через порушення добового ритму організму, шизофренії, нападів паніки, меланхолії, розладів апетиту, ожиріння, безсоння, психотичних розладів, епілепсії, діабету, хвороби Паркінсона, старечого недоумства, різних розладів, пов'язаних з нормальним або патологічним старінням, мігренню, втратою пам'яті, хворобою Альцгеймера, розладами мозкового кровообігу, а також сексуальної дисфункції, як інгібітори овуляції, імуномодулятори, і у лікуванні раків.
Текст
Даний винахід відноситься до способу промислового синтезу агомелатину, або N-[2-(7-метокси-1нафтил)етил]ацетаміду, формули (І): (І) Даний винахід відноситься також до кристалічної форми II агомелатину способу її одержання і фармацевтичних композицій, які її містять. Агомелатин, або N-[2-(7-метокси-1-нафтил)етил]ацетамід, має цінні фармакологічні властивості. Дійсно, він має подвійну особливість існування, з одного боку, він є агоністом рецепторів мелатонінергічної системи і, з іншого боку, антагоністом 5-НТ2C рецептора. Такі властивості надають активність в центральній нервовій системі і, більш конкретно, у лікуванні суворої депресії, сезонних емоційних розладів, розладів сну, серцево-судинних патологій, патологій травного тракту, безсоння і втоми, яка виникає через порушення добового ритму організму, розладів апетиту і ожиріння. Агомелатин, його одержання і терапевтичне застосування були розкриті в [Описі Європейської патентної заявки ЕР 0 447 285]. Беручи до уваги фармацевтичне значення цієї сполуки, важливим було спромогтись одержати її ефективним промисловим способом синтезу, який є легко транспонованим на промислові ваги і дає агомелатин з хорошим виходом і відмінною чистотою. Також було важливим спромогтись одержати агомелатин з добре визначеною кристалічною формою, відмінно відтворюваною, який в результаті виявляє цінні характеристики в показниках фільтрування і легкості формулювання. Опис патентної заявки ЕР 0 447 285 розкриває одержання агомелатину за вісім стадій, починаючи з 7метокси-1-тетралону, даючи середній вихід менше ніж 30%. Цей спосіб включає дію етил бромацетату, з наступними ароматизацією і омиленням, для одержання відповідної кислоти, яку потім перетворюють в ацетамід і згодом дегідрують для одержання (7-метокси-1нафтил)ацетонітрилу, з наступним відновленням, а потім конденсацією ацетил хлориду. Зокрема, одержання (7-метокси-1-нафтил)ацетонітрилу включає шість стадій реакції і, транспонований на промислові ваги, швидко демонстрував труднощі здійснення способу, що викликаються, головним чином, проблемами відтворюваності першої стадії, що складає дію етил бромацетату на 7-метокси-1-тетралон відповідно до реакції Реформатські, даючи етил (7-метокси-3,4-дигідро-1(2Н)-нафталеніліден)етаноат. Крім того, наступна стадія ароматизації етил (7-метокси-3,4-дигідро-1(2Н)-нафталеніліден)етаноату часто була незавершеною і в результаті давала, після омилення, суміші продуктів, які важко очищувати. Література описує одержання (7-метокси-1-нафтил)ацетонітрилу в трьох стадіях, починаючи з 7-метокси1-тетралону, дією LiCH2CN, з наступною дегідрогенізацією з DDQ (2,3-дихлор-5,6-диціано-1,4-бензохінон) і нарешті дегідруванням в кислотному середовищі (Synthetic Communication, 2001, 31(4), 621-629). Повний вихід є середнім (76%), однак, і зокрема DDQ, використаний в реакції дегідрогенізації і нагріванні бензолу зі зворотним холодильником, необхідним на третій стадії, не відповідають промисловим вимогам стосовно вартості і навколишнього середовища. Заявник в даний момент розробив новий спосіб промислового синтезу, який в результаті дає, відтворюваним чином і без необхідності важкого очищення, агомелатин чистоти, сумісної з його використанням як фармацевтично активного інгредієнта. Альтернатива до складностей, які зустрічаються у способі, розкритому в [описі патентної заявки ЕР 0 447 285], була одержана безпосереднім конденсуванням ціано сполуки з 7-метокси-1-тетралоном. Крім того необхідним було, щоб одержана конденсована сполука могла бути легко піддана ароматизації для одержання (7-метокси-1-нафтил)ацетонітрилу без необхідності в сильнодіючих умовах, і щоб могли бути використаними реактиви, сумісні з промисловими вимогами щодо вартості і навколишнього середовища. Очевидно, що (7-метокси-3,4-дигідро-1-нафталеніл)ацетонітрил буде являти собою ідеальну проміжну сполуку синтезу, що відповідає вимогам для прямого синтезу з 7-метокси-1-тетралону, і буде відмінним субстратом для стадії ароматизації. Реакції для прямої конденсації тетралонів з ацетонітрилу або сполук ацетонітрилу описані в літературі. Зокрема, [опис патентної заявки US 3 992 403] розкриває конденсацію ціанометил фосфонату з 6-фтор-1тетралоном, і [опис патентної заявки US 3 931 188] розкриває конденсацію ацетонітрилу з тетралоном, який веде до проміжної ціано сполуки, яка безпосередньо залучена у наступній реакції. Застосована до 7-метокси-1-тетралону, конденсація ацетонітрилу дає суміш ізомерів, в яких "екзо" складає більшу частину і "ендо" - незначну частину, відповідно до Фігури 1: таку суміш, що потребує наступних сильнодіючих умов ароматизації, які не сумісні з промисловими вимогами з метою проведення синтезу агомелатину. Заявник в даний момент розробив новий спосіб промислового синтезу, який дозволяє одержати (7метокси-1-нафтил)ацетонітрил з 7-метокси-тетралону, з можливістю відтворення і без необхідності у важкому очищенні, тільки за дві стадії за допомогою використання як проміжної сполуки синтезу (7-метокси-3,4-дигідро 1-нафталеніл)ацетонітрилу, вільного від "екзо" домішки, формули (II): (IІ) домішка якого не може бути піддана наступній ароматизації в робочих умовах, які сумісні з промисловими вимогами з метою проведення синтезу агомелатину. Більш конкретно, даний винахід відноситься до способу промислового синтезу сполуки формули (І): (І) який відрізняється тим, що 7-метокси-1-тетралон формули (III): (IIІ) піддають реакції з ціанооцтовою кислотою формули (IV): (ІV) в умовах, коли воду, що утворилась, видаляють, у присутності каталітичної кількості сполуки формули (V): (V) де R і R', які можуть бути однаковими або відрізнятись, кожний являє собою лінійну або розгалужену (С3С10)алкільну групу, незаміщену або заміщену арильну груну, або незаміщену або заміщену лінійну або розгалужену арил (С1-С6)алкільну групу, для одержання, після фільтрування і промивання основним розчином, (7-метокси-3,4-дигідро-1нафталеніл)ацетонітрилу формули (VI): (VІ) сполуку формули (VI) якої піддають реакції з каталізатором гідрогенізації у присутності сполуки алілу, для одержання сполуки формули (VII): (VIІ) яку потім піддають відновленню воднем у присутності нікелю Ренея в аміачному етанольному середовищі і потім перетворюють в сіль, використовуючи хлористоводневу кислоту, для одержання сполуки формули (VIII): (VIIІ) яку піддають послідовно дії ацетату натрію і потім оцтового ангідриду, для одержання сполуки формули (І), яку виділяють у формі твердої речовини, де: - арил, як повинно розумітись, означає фенільну, нафтильну або біфенільну групу, - термін "заміщений", що визначає терміни "арил" і "арилалкіл", означає, що ароматична частина цих груп може бути заміщена від 1 до 3 однаковими або різними групами, вибираними з лінійного або розгалуженого (С1-С6)алкілу, гідрокси і лінійного або розгалуженого (С1-С6)алкокси, - "сполука алілу", як повинно розумітись, являє собою будь-яку молекулу, яка містить від 3 до 10 атомів вуглецю, що можуть містити в доповнення від 1 до 5 атомів кисню, і містить щонайменше одну -СН2-СН=СН2 груну. Більш конкретно, в реакції перетворення сполуки формули (III) в сполуку формули (VI), воду, яка утворюється, видаляють дистиляцією. Переважно використовують реакційний розчинник, що має температуру кипіння вище або яка дорівнює температурі кипіння води, і навіть більш переважно той, що утворює азеотроп з водою, такий як, наприклад, ксилол, толуол, анізол, етилбензол, тетрахлоретилен, циклогексен або мезитилен. Переважно, перетворення сполуки формули (III) у сполуку формули (VI) проводять при нагріванні зі зворотним холодильником толуолу або ксилолу і, більш конкретно, при нагріванні зі зворотним холодильником толуолу. У реакції перетворення сполуки формули (III) у сполуку формули (VI), переважно одна з груп R або R' залученого каталізатора являє собою лінійну або розгалужену (С3-С10)алкільну групу, а інша являє собою арильну або арилалкільну групу. Більш конкретно, переважним каталізатором є каталізатор формули (Va): (Va) де R'a являє собою фенільну групу, незаміщену або заміщену однією або більше лінійною або розгалуженою (С1-С6)алкільними групами, η являє собою 0 або 1, і Ra являє собою лінійну (С3-С10)алкільну групу. Переважно, R'a являє собою незаміщену або заміщену фенільну групу, більш конкретно незаміщену фенільну групу. Переважна група Ra являє собою гексильну групу. Переважним значенням n є 1. Переважним каталізатором, який використовується у перетворенні сполуки формули (III) у сполуку формули (VI) відповідно до способу даного винаходу, є бензиламоній гептаноат формули (IX): (ІX) Переважно, сполуку формули (VI) одержують після фільтрування і промивання мінеральним або органічним основним розчином, таким як NaOH, KОН, Са(ОН)2, Sr(OH)2 або NH4OH, і більш конкретно розчином гідроксиду натрію. Переважно, перетворення сполуки формули (VI) у сполуку формули (VII) проводять при нагріванні зі зворотним холодильником толуолу або ксилолу, більш переважно при нагріванні зі зворотним холодильником толуолу. Каталізатор, який переважно використовують у перетворенні сполуки формули (VI) у сполуку формули (VII), являє собою каталізатор або у формі оксиду або підтримуваний як, наприклад, паладій, платина, нікель, Аl2О3 і, більш конкретно, паладій. Переважно, буде використано від 1 до 20% паладію-на-вуглеці, і більш конкретно від 5% або 10% паладію-на-вуглеці. Переважно, паладій-на-вуглеці буде використаний у кількості від 1 до 10% за вагою каталізатора відносно ваги субстрату, і більш конкретно 5%. Водневий акцептор, переважно використаний в реакції перетворення сполуки формули (VI) у сполуку формули (VII), являє собою сполуку алілу і, більш конкретно, аліл акрилат або ефір аліл гліцидилу. Переважний аліл акрилат способу відповідно до даного винаходу являє собою аліл метакрилат. Переважно, перетворення сполуки формули (VII) у сполуку формули (VIII) відповідно до способу даного винаходу проводиться при від 20 до 40°С, більш конкретно при від 30 і 40°С, і навіть більш переважно при 40°С. Переважно, перетворення сполуки формули (VIII) у сполуку формули (І) проводять в спиртовому середовищі і більш конкретно в етанольному середовищі. Цей спосіб представляє конкретний інтерес з наступних причин: - він дозволяє одержати "ендо" сполуку формули (VI), виключно, на промислових вагах. Цей результат зовсім дивує, зважаючи на літературу, яка має відношення до такого тину реакції, яка найбільш часто повідомляє про одержання "екзо"/"ендо" суміші [Tetrahedron, 1966, 22, 3021-3026]. Результат є таким завдяки використанню сполуки формули (V) як каталізатора реакції замість амоній ацетатів, які в даний момент використовуються в таких реакціях [Bull. Soc. Chim. Fr., 1949, 884-890], - ступінь перетворення сполуки формули (III) у сполуку формули (VI) є дуже високою, перевищуючи 97%, на відміну від того, що могло б спостерігатись при використанні оцтової кислоти, для якої ступінь не перевищує 75%, - використання каталізатора гідрогенізації у присутності сполуки алілу для перетворення сполуки формули (VI) у сполуку формули (VII) є цілком сумісним з промисловими вимогами щодо вартості і навколишнього середовища, на відміну від хінонів, які в даний момент використовуються, - до того ж, він дозволяє сполуку формули (VII), виключно, зокрема вільну від відповідного продукту відновлення формули (X): (x) одержати на промислових вагах, - нарешті, ступені перетворення сполуки формули (VI) у сполуку формули (VII), що спостерігаються, є високими, перевищуючи 90%, - гідрогенізація сполуки формули (VII) у присутності нікелю Ренея в аміачному етанольному середовищі була описана [J. Med. Chem., 1994, 37(20), 3231-3239], але вимагає умов, які є важкими для застосування на промислових вагах: реакцію проводять при 60°С і протягом 15 годин, і кінцевий вихід є менше ніж 90%. До того ж, головною перешкодою цієї реакції є супутнє утворення "біс" сполуки формули (XI): (xІ) і складність контролювання ступеню перетворення цієї домішки. Спосіб, розроблений Заявником, дозволяє одержати сполуку формули (VIII) з рівнем домішки навіть нижче 4% в експериментальних умовах, які є сумісними з промисловими вимогами, оскільки реакцію проводять при від 30 до 40°С, для одержання виходу, який перевищує 90%, і хімічної чистоти, яка перевищує 99,5%. - стадія амідування, яку проводять у спиртовому середовищі і більш конкретно етанольному середовищі, дозволяє дуже легко виділити сполуку формули (І) в кількісному виході, результат чого цілком дивує, оскільки реакція такого типу не дуже сумісна з тим розчинником, для якого очікувалось би конкурентне споживання оцтового ангідриду. Сполука формули (VI), одержана відповідно до способу даного винаходу, є новою і корисною як проміжна сполука в синтезі агомелатину, в якому її піддають ароматизації, з наступним відновленням і потім піддають зв'язуванню з оцтовим ангідридом. Винахід відноситься також до кристалічної II форми агомелатину, одержаного відповідно до способу, описаного вище. Це є, фактично, важливим, для можливості одержати добре визначену і відмінно відтворювану кристалічну форму. Прототип [ЕР 0 447 285 і Yous et al. Journal of Medicinal Chemistry, 1992, 35 (8), 1484-1486] дозволяє одержати агомелатин у кристалічній формі, яка була [описана в Tinant et al. Acta Cryst., 1994, C50, 907-910]. Заявник в даний момент розробив спосіб одержання агомелатину в чіткій, відмінно відтворюваній, кристалічній формі і який, в результаті, виявляє цінні властивості щодо фільтрування і легкості формулювання. Більш конкретно, даний винахід відноситься до кристалічної II форми агомелатину, яка відрізняється наступними параметрами, отриманими з порошкової рентгенограми, отриманої з використанням дифрактометра високого розділення Bruker AXS D8, що має 2q кутовий діапазон 3°-90°, крок 0,01° і 30с за крок: - моноклінна кришталева решітка - параметри решітки: а=20,0903 Å, b=9,3194 Å, с=15,4796 Å, β=108,667° - просторова група: P21/n - кількість молекул в елементарному осередку: 8 - об'єм елементарного осередку; Vелементарний осередок=2746,742 Å3 - щільність: d=1,13г/см3. Перевага одержання такої кристалічної форми полягає в тому, що вона робить можливим особливо швидке і ефективне фільтрування, а також одержання фармацевтичних складів, які мають стійку і відтворювану композицію, яка є особливо переважною, коли склади призначені для введення оральним шляхом. Форма, одержана таким чином, є достатньо стійкою для забезпечення можливості тривалого зберігання без спеціальних умов щодо температури, легкої вологості або рівнів кисню. Фармакологічні дослідження форми, одержаної таким чином, продемонстрували, що вона має суттєву активність у відношенні центральної нервової системи і у відношенні мікроциркуляції, що дає можливості встановити, що кристалічна II форма агомелатину є корисною у лікуванні стресу, розладів сну, тривоги, суворої депресії, сезонних емоційних розладів, серцево-судинних патологій, патологій травного тракту, безсоння і втоми через порушення добового ритму організму, шизофренії, нападів паніки, меланхолії, розладів апетиту, ожиріння, безсоння, болю, психотичних розладів, епілепсії, діабету, хвороби Паркінсона, старечого недоумства, різних розладів, пов'язаних з нормальним або патологічним старінням, мігренню, втратою пам'яті, хворобою Альцгеймера, і розладів мозкового кровообігу. В іншому полі активності, виявляється, що кристалічна II форма агомелатину може бути використана при лікуванні сексуальної дисфункції, що вона має овуляція-інгібуючі та імуномодулюючі властивості і що вона застосовується у лікуванні раків. Кристалічна II форма агомелатину переважно буде використовуватись у лікуванні суворої депресії, сезонних емоційних розладів, розладів сну, серцево-судинних патологій, безсоння і втоми через порушення добового ритму організму, розладів апетиту і ожиріння. Винахід також відноситься до фармацевтичних композицій, які містять як активний інгредієнт кристалічну II форму агомелатину разом з одним або більше відповідним інертним, нетоксичним ексципієнтом. Серед фармацевтичних композицій відповідно до даного винаходу можуть бути згадані, більш конкретно, ті, які придатні для орального, парентерального (внутрішньовенного або підшкірного) або назального введення, таблеток або драже, гранул, під'язикових таблеток, желатинових капсул, коржиків, супозиторіїв, кремів, мазей, шкірних гелів, ін'єктованих приготувань, придатних для пиття суспензій і дезінтегрованих мазей. Корисне дозування може бути пристосоване відповідно до природи і тяжкості розладу, шляху введення, віку і ваги пацієнта. Дозування змінюється від 0,1 мг до 1 г за день за одне або більше введень. Приклади, вказані нижче, ілюструють винахід, але не обмежують його жодним чином. Приклад 1: N-[2-(7-Метокси-1-нафтил)етил]ацетамід Стадія А: (7-Метокси-3,4-дигідро-1-нафталеніл)ацетонітрил В 670-літровий реактор вміщують 85,0кг 7-метокси-1-тетралону, 60,3кг ціанооцтової кислоти і 15,6кг гептанової кислоти в толуолі у присутності 12,7кг бензиламіну. Суміш нагрівають зі зворотним холодильником. Коли весь вихідний субстрат зникає, розчин охолоджують і фільтрують. Одержаний осад промивають толуолом і потім одержаний фільтрат промивають 2N розчином гідроксиду натрію і потім водою до нейтрального стану. Після видалення розчинника випаровуванням, одержану тверду речовину перекристалізовують з суміші етанол/вода (80/20), для одержання вказаного у заголовку продукту з виходом 90% і хімічною чистотою, яка перевищує 99%. Точка плавлення: 48-50°С. Стадія В: (7-Метокси-1-нафтил)ацетонітрил В 670-літровий реактор вміщують 12,6кг 5% паладію-на-вуглеці в толуолі, який нагрівають зі зворотним холодильником; потім 96,1кг (7-метокси-3,4-дигідро-1-нафталеніл)ацетонітрилу, який розчиняють в толуолі, додають також як і 63,7кг аліл метакрилату. Реакцію продовжують при нагріванні зі зворотним холодильником з наступною парофазною хроматографією. Коли весь початковий субстрат зникає, реакційну суміш охолоджують до температури навколишнього середовища і потім фільтрують. Після видалення толуолу випаровуванням, одержаний твердий залишок перекристалізовують з суміші етанол/вода (80/20), для одержання вказаного у заголовку продукту і виходом 91% і хімічною чистотою, яка перевищує 99%. Точка плавлення: 83°С. Стадія С: 2-(7-Метокси-1-нафтил)етанамін гідрохлорид В 1100-літровий реактор вміщують 80,0кг сполуки, одержаної на Стадії В, 24,0кг нікелю Ренея в етанолі і 170л гідроксиду амонію. Суміш перемішують під тиском водню в 30 бар, потім доводять до 40°С. Коли весь початковий субстрат зникає, розчинник випаровують, одержаний залишок повторно розчиняють в етилацетаті і додають 41,5л 11N розчину хлористоводневої кислоти. Після фільтрування, одержаний осад промивають етилацетатом і потім висушують в сушильній печі, для одержання вказаного у заголовку продукту з виходом 95,3% і хімічною чистотою, яка перевищує 99,5%. Точка плавлення: 243°С. Стадія D: N-[2-(7-Метокси-1-нафтил)етил]ацетамід 173 кг сполуки, одержаної на Стадії С, і 66кг ацетату натрію в етанолі вміщують в 1600-літровий реактор. Суміш перемішують і потім додають 79кг оцтового ангідриду; реакційну суміш нагрівають зі зворотним холодильником і додають 600л води. Реакційній суміші дають повернутись до температури навколишнього середовища і одержаний осад відфільтровують і промивають 35/65 сумішшю етанол/вода, для одержання вказаного у заголовку продукту з виходом 92,5% і хімічною чистотою, яка перевищує 99%. Точка плавлення: 108°С. Приклад 2: N-[2-(7-Метокси-1-нафтил)етил]ацетамід Стадія А: (7-Метокси-3,4-дигідро-1-нафталеніл)ацетонітрил В 670-літровий реактор вміщують 85,0кг 7-метокси-1-тетралону, 60,3кг ціанооцтової кислоти і 15,6кг гепатнової кислоти в толуолі у присутності 11,0кг аніліну. Суміш нагрівають зі зворотним холодильником. Коли весь початковий субстрат зникає, розчин охолоджують і фільтрують. Одержаний осад промивають толуолом і потім одержаний фільтрат промивають 2N розчином гідроксиду натрію і потім водою до нейтрального стану. Після видалення розчинника випаровуванням, одержану тверду речовину перекристалізовують з суміші етанол/вода (80/20), для одержання вказаного у заголовку продукту з виходом 87% і хімічною чистотою, яка перевищує 99%. Точка плавлення: 48-50°С. Стадія В: (7-Метокси-1-нафтил)ацетонітрил Методика є такою ж, як і на Стадії В Прикладу 1. Точка плавлення: 83°С. Стадія С: 2-(7-Метокси-1-нафтил)енатнамін гідрохлорид Методика є такою ж, як і на Стадії С Прикладу 1. Точка плавлення: 243°С. Стадія D: N-[2-(7-Метокси-1-нафтил)етил]ацетамід Методика є такою ж, як і на Стадії D Прикладу 1. Точка плавлення: 108°С. Приклад 3: Кристалічна II форма N-(7-метокси-1-нафтил)етил]ацетамід Запис даних проводили з використанням дифрактометра високого розділення Bruker AXS D8 з наступними параметрами: 2q кутовий діапазон 3°-90°, крок 0,01° і 30 с за крок. Порошок N-[2-(7-метокси-1нафтиил)етил]ацетаміду, одержаний у Прикладі 1, кладуть на опору передачі. Джерелом рентгенівського випромінювання є мідна труба (lСuKa1=1,54056 Å). Опора включає передній монохроматор (Ge(111) кришталь) і твердотільний детектор з розділенням по енергії (MXP-D1, Moxtec-SEPH). Сполука є добре кристалізованою: ширина променя при напіввисоті дорівнює приблизно 0,07° (20). Таким чином, були визначені наступні параметри: - моноклінна кришталева решітка - параметри решітки: а=20,0903 Å, b=9,3194 Å, с=15,4796 Å, b=108,667° - просторова група: Р21/n - кількість молекул в елементарному осередку: 8 - об'єм елементарного осередку: Vелементарний осередок=2746,742 Å3 - щільність: d=1,13г/см3. Приклад 4: Фармацевтична композиція Склад для приготування 1000 таблеток, кожна з яких містить дозу 25мг: сполука Прикладу 3 25г моногідрат лактози 62г стеарат магнію 1,3г маїсовий крохмаль 26г мальтодекстрини 9г кремнезем, колоїдний безводний 0,3г гліколят крохмалю натрію типу А 4г стеаринова кислота 2,6г Приклад 5: Фармацевтична композиція Склад для приготування 1000 таблеток, кожна з яких містить дозу 25мг: 25г сполука Прикладу 3 моногідрат лактози 62г стеарат магнію 1,3г повідон 9г кремнезем, колоїдний безводний 0,3г гліколят целюлози натрію 30г стеаринова кислота 2,6г
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for agomelatine synthesis, crystalline form of agomelatine, and pharmaceutical composition
Автори англійськоюSouvie Jean-Claude, Isaac GONZALES BLANKO, Horvath Sthephane, Damien Gerard
Назва патенту російськоюСпособ синтеза агомелатина, кристаллическая форма агомелатина и содержащая его фармацевтическая композиция
Автори російськоюСувье Жан-Клод, Орват Стефан, Дамьен Жерар
МПК / Мітки
МПК: C07C 233/17, C07C 15/24, A61K 31/165, C07C 233/73, C07C 231/00, A61P 25/00, C07C 233/22, C07C 233/60
Мітки: містить, яка, спосіб, композиція, агомелатину, синтезу, форма, фармацевтична, кристалічна
Код посилання
<a href="https://ua.patents.su/5-78825-sposib-sintezu-agomelatinu-kristalichna-forma-agomelatinu-i-farmacevtichna-kompoziciya-yaka-jjogo-mistit.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу агомелатину, кристалічна форма агомелатину і фармацевтична композиція, яка його містить</a>
Попередній патент: Система для проведення масових розваг
Наступний патент: Фіточай “загальнозміцнюючий”
Випадковий патент: Спосіб виробництва сечовини зі сміття будь-якого складу переважно побутових відходів









