Спосіб розділення дезамідованої та недезамідованої людських днказ, очищена дезамідована людська днказа, очищена недезамідована людська днказа, фармацевтична композиція (варіанти), спосіб зберігання людської днк
Номер патенту: 46693
Опубліковано: 17.06.2002
Автори: Френз Джон, Шайє Стівен Джей, Слівковскі Мері Б.
Формула / Реферат
1. Способ разделения дезамидированной и недезамидированной человеческой ДНКазы из их смеси, заключающийся в том, что смесь разделяют с помощью триптической или тентаклической хроматографии с использованием синтетических смол.
2. Способ по п. 1, отличающийся тем, что используют тентаклическую катионообменную смолу.
3. Способ по п. 1, отличающийся тем, что используют иммобилизованную гепариновую смолу.
4. Способ по п. 1, отличающийся тем, что используют негидролизируемую ДНК-аналоговую смолу.
5. Очищенная дезамидированная человеческая ДНКаза, предназначенная для лечения больных с накоплением гнойного материала.
6. Очищенная недезамидированная человеческая ДНКаза, предназначенная для лечения больных с накоплением гнойного материала.
7. Фармацевтическая композиция, содержащая в качестве основного компонента дезамидированную человеческую ДНКазу, которая в основном свободна от недезамидированной человеческой ДНКазы, предназначенная для лечения больных с накоплением гнойного материала.
8. Фармацевтическая композиция по п. 7, отличающаяся тем, что она помещена в контейнер, изготовленный не из стекла.
9. Фармацевтическая композиция по п. 7, отличающаяся тем, что она помещена в контейнер, изготовленный из пластика.
10. Фармацевтическая композиция, содержащая в качестве основного компонента недезамидированную человеческую ДНКазу, которая в основном свободна от дезамидированной человеческой ДНКазы, предназначенная для лечения больных с накоплением гнойного материала.
11. Фармацевтическая композиция по п. 10, отличающаяся тем, что в нее включен фармацевтически приемлемый эксцепиент.
12. Фармацевтическая композиция по п. 11, отличающаяся тем, что в качестве эксцепиента использована стерильная вода.
13. Фармацевтическая композиция по п. 11, отличающаяся тем, что в качестве эксцепиента использован стерильный небуферный раствор с рН 4,5-6,8.
14. Фармацевтическая композиция по п. 10, отличающаяся тем, что она помещена в аэрозольную упаковку.
15. Фармацевтическая композиция по п. 10, отличающаяся тем, что она помещена в контейнер, изготовленный не из стекла.
16. Фармацевтическая композиция по п. 16, отличающаяся тем, что она помещена в контейнер, изготовленный из пластика.
17. Фармацевтическая композиция по п. 10, отличающаяся тем, что она в основном свободна от дезамидированной человеческой ДНКазы.
18. Способ сохранения человеческой ДНКазы, предусматривающий приготовление водного раствора недезамидированной человеческой ДНКазы с рН от 4,5 до 6,8.
19. Способ лечения пациентов, имеющих накопление гнойного материала, предусматривающий использование очищенной недезамидированной человеческой ДНКазы в количестве, терапевтически эффективном для уменьшения вязкости гнойного материала.
20. Способ по п. 19, отличающийся тем, что недезамидированная человеческая ДНКаза в значительной степени свободна от протеаз.
21. Способ лечения больных кистозным фиброзом легких, предусматривающий использование терапевтически эффективного количества очищенной недезамидированной человеческой ДНКазы.
Текст
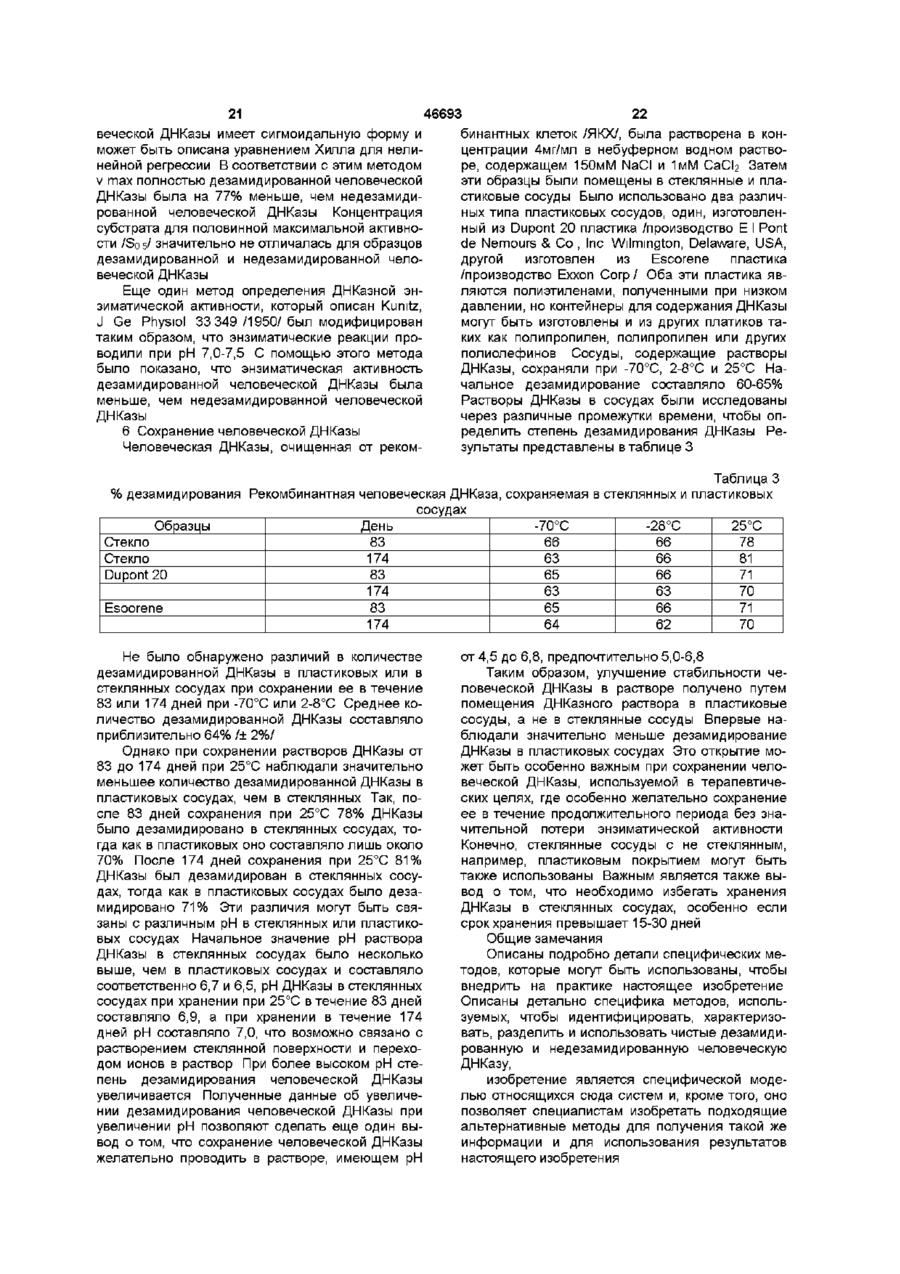
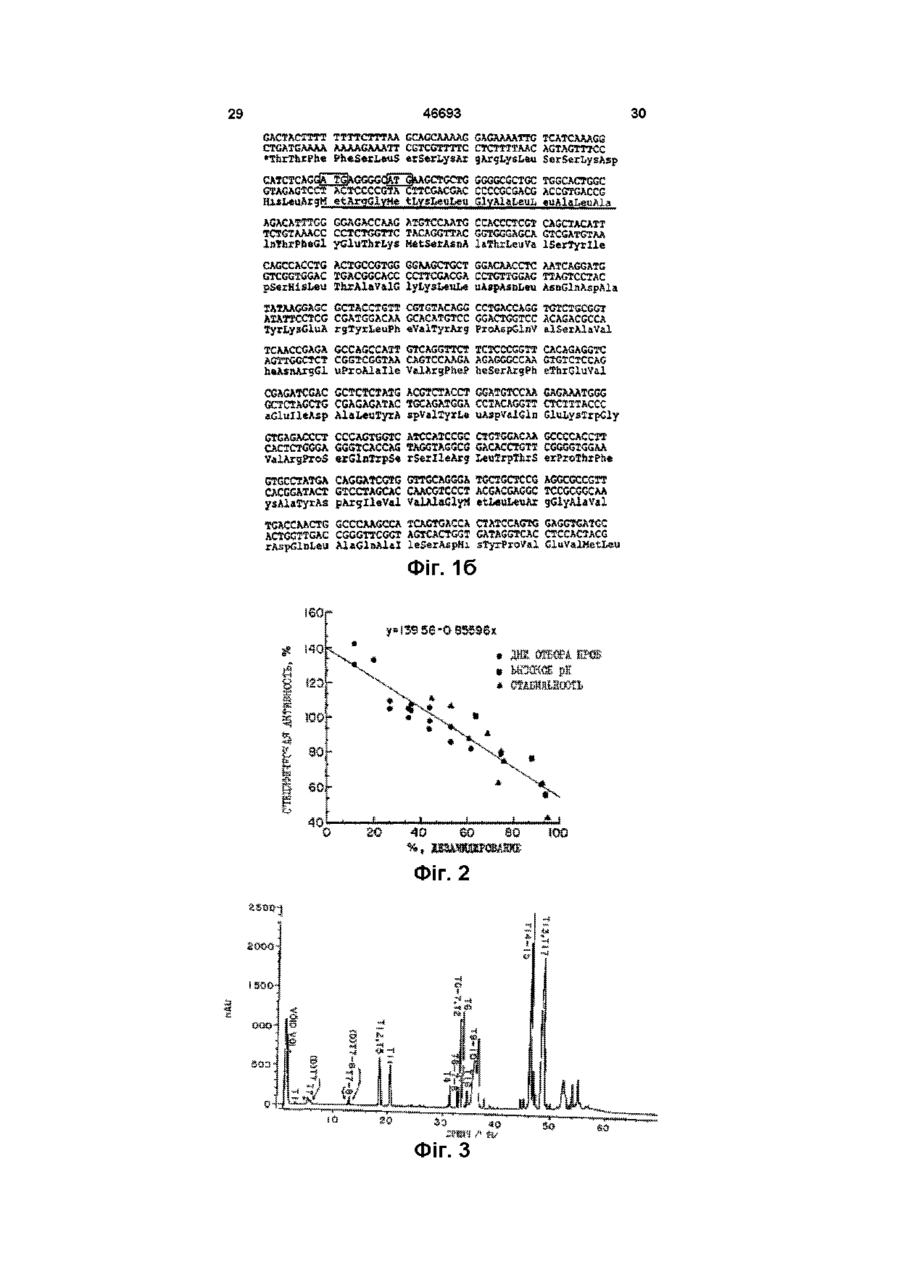
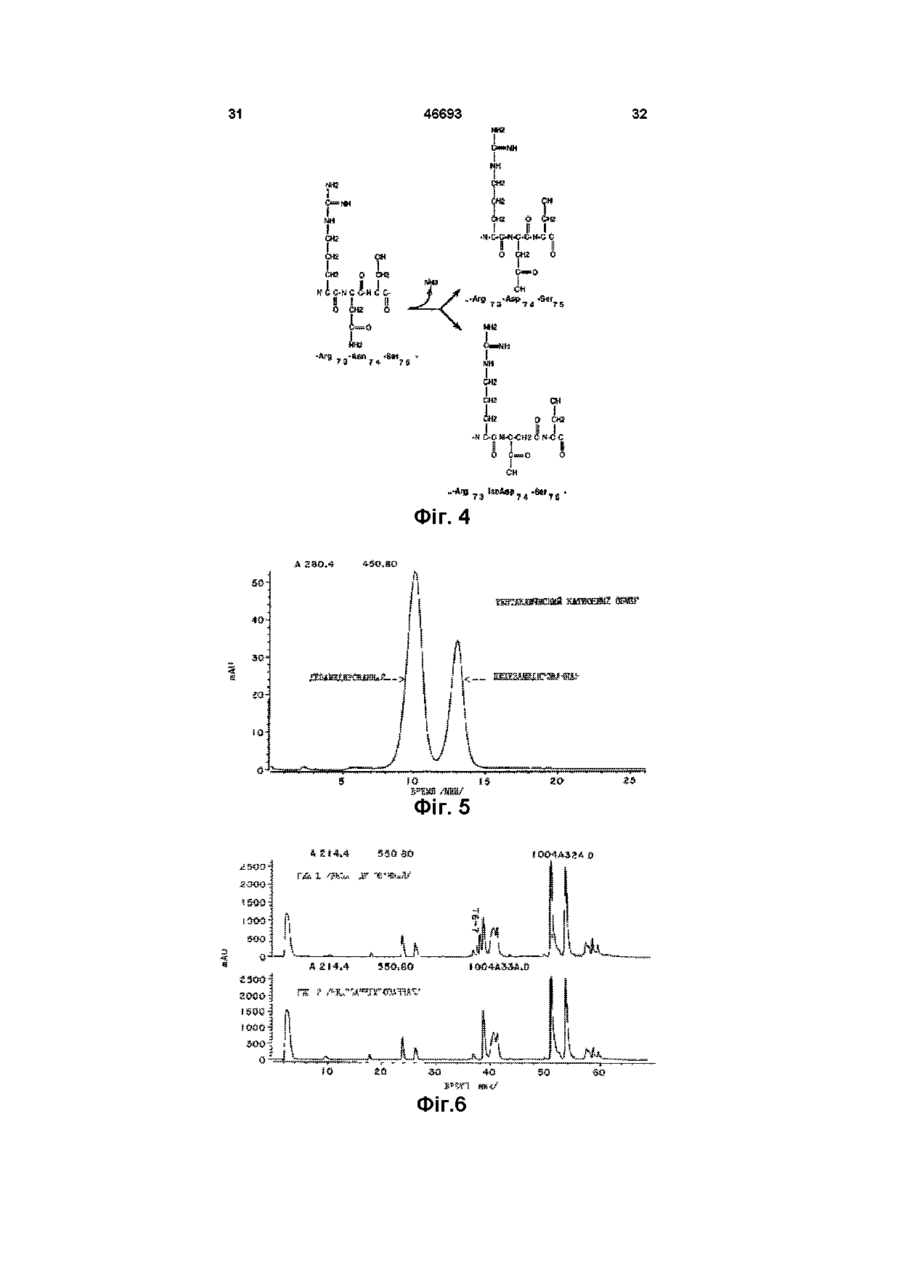
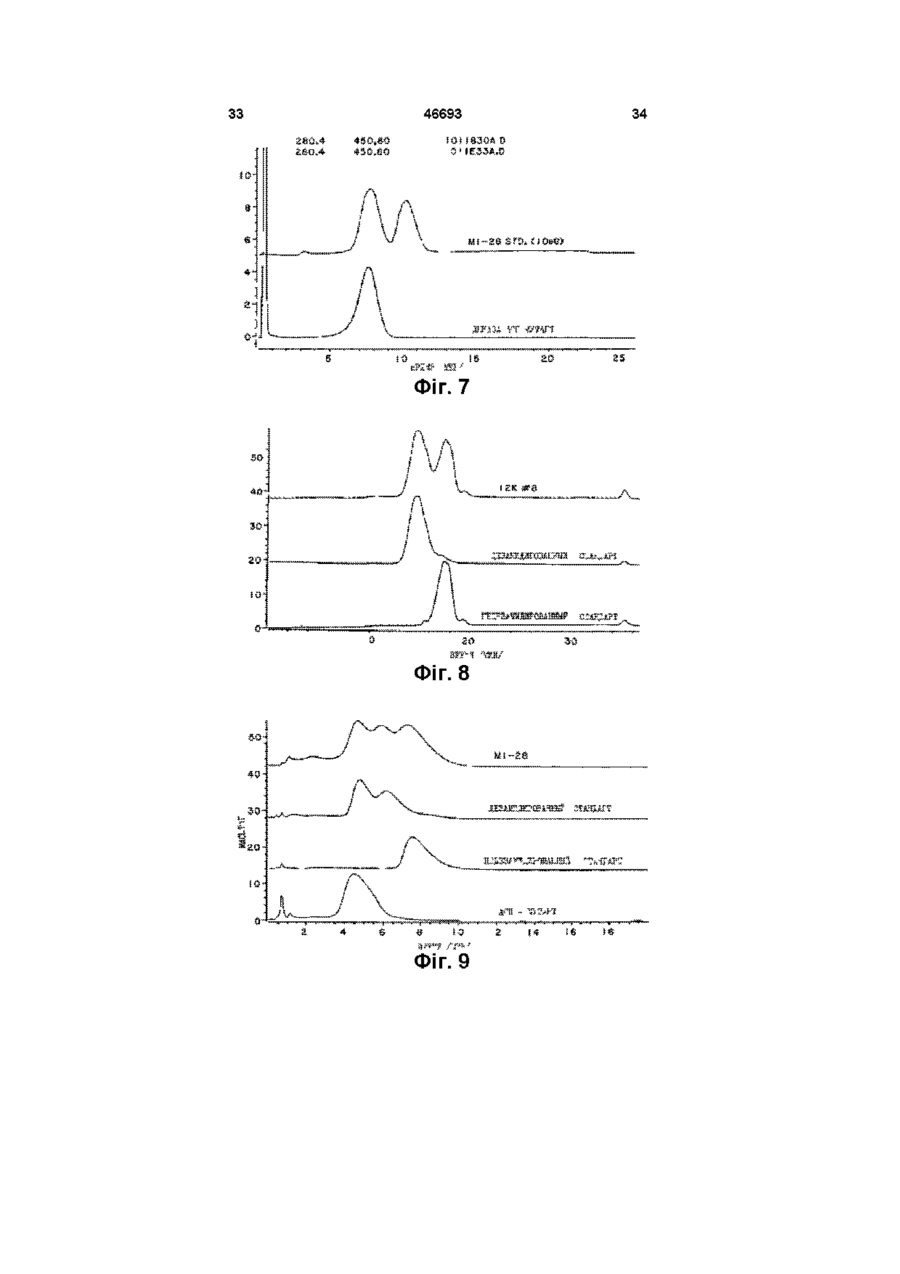
1 Способ разделения дезамидированной и недезамидированной человеческой ДНКазы из их смеси, заключающийся в том, что смесь разделяют с помощью триптической или тентаклической хроматографии с использованием синтетических смол 2 Способ по п 1, отличающийся тем, что используют тентаклическую катионообменную смолу 3 Способ по п 1, отличающийся тем, что используют иммобилизованную гепариновую смолу 4 Способ по п 1, отличающийся тем, что используют негидролизируемую ДНК-аналоговую смолу 5 Очищенная дезамидированная человеческая ДНКаза, предназначенная для лечения больных с накоплением гнойного материала 6 Очищенная недезамидированная человече ская ДНКаза, предназначенная для лечения больных с накоплением гнойного материала 7 Фармацевтическая композиция, содержащая в качестве основного компонента дезамидированную человеческую ДНКазу, которая в основном свободна от недезамидированной человеческой ДНКазы, предназначенная для лечения больных с накоплением гнойного материала 8 Фармацевтическая композиция по п 7, отличающаяся тем, что она помещена в контейнер, изготовленный не из стекла 9 Фармацевтическая композиция по п 7, отличающаяся тем, что она помещена в контейнер, изготовленный из пластика 10 Фармацевтическая композиция, содержащая в качестве основного компонента недезамидированную человеческую ДНКазу, которая в основном свободна от дезамидированной человеческой ДНКазы, предназначенная для лечения больных с накоплением гнойного материала 11 Фармацевтическая композиция по п 10, отличающаяся тем, что в нее включен фармацевтически приемлемый эксцепиент 12 Фармацевтическая композиция по п 11, отличающаяся тем, что в качестве эксцепиента использована стерильная вода 13 Фармацевтическая композиция по п 11, отличающаяся тем, что в качестве эксцепиента использован стерильный небуферный раствор с рН 4,5-6,8 14 Фармацевтическая композиция по п 10, отличающаяся тем, что она помещена в аэрозольную упаковку 15 Фармацевтическая композиция по п 10, отличающаяся тем, что она помещена в контейнер, изготовленный не из стекла 16 Фармацевтическая композиция по п 16, отличающаяся тем, что она помещена в контейнер, изготовленный из пластика 17 Фармацевтическая композиция по п 10, отличающаяся тем, что она в основном свободна от дезамидированной человеческой ДНКазы 18 Способ сохранения человеческой ДНКазы, предусматривающий приготовление водного рас О го (О (О твора недезамидированной человеческой ДНКазы с рН от 4,5 до 6,8 19 Способ лечения пациентов, имеющих накопление гнойного материала, предусматривающий использование очищенной недезамидированной человеческой ДНКазы в количестве, терапевтически эффективном для уменьшения вязкости гнойного материала Настоящее изобретение относится к исследованию дезоксирибонуклеазы /ДНКазы/ - фосфодиэстеразы, которая может гидролизовать полидезоксирибонуклеиновую кислоту Изобретение относится к методам разделения различных форм упомянутой ДНКазы, к формам ДНКазы, которые непосредственно относяться к фармацевтическим составам и к способам их клинического применения Предпосылки изобретения ДНКаза - это фосфодиэстераза, способная к гидролизу полидезоксирибонуклеиновой кислоты ДНКаза различных видов ыюкет быть очищена до различной степени Полная аминокислотная последовательность для ДНКазы млекопитающих была установлена в 1973г см Си Liao et al , J Biol Chem , 248 1489 (1973) Известны различные способы использования ДНКазы в терапевтических целях Ее главное 'терапевтическое использование связано с уменьшением вязкости логичных выделений при таких заболеваниях как пневмония, кистозный фиброз, что способствует очистке дыхательных путей Lourenco et al , Arch Intern, Med 142 2299 (1982) Shak et al , Proc Nat Acad Sei 87 9188 (1990), Hubbard et al , NewEngl J Mad 326 812(1992) ДНК, кодирующая человеческую ДНКазу I, была выделена и затем была установлена возможность ее получения в коммерчески достаточных количествах в рекомбинантных клетках хозяина Shak et al , Proc Nat, Acad Sci87 91889192 (1990) Затем была установлена возможность клинического использования рекомбинантной человеческой ДНКазы /рчДНКазы/ особенно после того, как появилась возможность получения очищенных форм ДНКазы, свободных от протеаз и других протеинов, с которыми она обычно связана в природе Hubbard et al , New Engl J.Med 326 812 (1992) Средства и методы, с помощью которых человеческая ДНКаза может быть получена в фармацевтически эффективной форме, описаны в заявке на патент, указанной выше В настоящее время известны различные специфические методы для очистки ДНКазы Knou et al , U S Patent №4 065 355 /опубл 27 декабря 1977г /, Markey, FEBS, Letters 167 155 (19S4), Nefsky et al , Eur J Biochem , 175 215 (1989) Хотя это не было оценено в указанных выше заявках на патенты, ДНКазы, полученные из ре 46693 4 20 Способ по п 19, отличающийся тем, что недезамидированная человеческая ДНКаза в значительной степени свободна от протеаз 21 Способ лечения больных кистозным фиброзом легких, предусматривающий использование терапевтически эффективного количества очищенной недезамидированной человеческой ДНКазы комбинантных клеток хозяина, содержат смесь дезамидированных и недезамидированных форм ДНКазы Существование дезамидированных форм ДНКазы оставалось неоцененным , несмотря на то, что феномен дезамидирования аспарагинового и глютаминового остатков в протеинах был известен Eipper et al, Ann Rev, Physiol 50 333 (1988), Kossiakoff, Science 240 191 (1988), Bradbury et al , Trends in Biochem Sei 16, 112 (1991), Wright, Protein Engineering 4 283 (1991) Настоящее изобретение основывается на ранее неоцененном факте, что рекомбинантная человеческая ДНКаза монет существовать как смесь дезамидированных и недезамидированных форм Используя методы, описанные в настоящей изобретении, было установлено, что дезамидированная человеческая ДНКаза менее активна энзиматически, чем недезамидированная человеческая ДНКаза Таким образом, присутствие дезамидированной и недезамидированной форм ДНКазы вместе и возможность дальнейшего дезамидирования, как это было обнаружено при сохранении препаратов человеческой ДНКазы in vitro, может усложнять усилия по обеспечению однородности препарата для применения его в клинических целях Таким образом, до настоящем изобретения не были известны существование и характеристики дезамидированных форм ДНКазы, таи же как методы идентификации и выделения их из препаратов ДНКазы Резюме Настоящее изобретение относится к процессу выделения дезамидированной и недезамидированной форм человеческой ДНКазы ив их смеси Этот процесс включает хроматографию смеси путем применения смолы или других компонентов, имеющих катионные полимеры, такие как гепарин или аналог не гидролизуемой дезоксирибонуклеиновой кислоты /ДНК/, или хроматографию, используя так называемые тентаклитические катионнообменные смолы Настоящее изобретение включает при проведении хроматографии возможность использование бычьей, а не человеческой ДНКазы, Настоящее изобретение относится также к методам получения дезамидированной человеческой ДНКзу, как очищенного продукта, в значительной мере свободного от недезамидированной человеческой ДНКазы Настоящее изобретение направлено также на то, чтобы получить чистую недезамидированную человеческую ДНКазу, очищенную от деза 46693 мидированной человеческой ДНКазы Как было показана в проведенных здесь исследованиях, недезамидированная ДНКаза энзиматически более активна чем дезамидированная человеческая ДНКаза Настоящее изобретение направлено также но то, чтобы получить фармацевтический продукт, содержащий очищенные дезамидированную или недезамидированную человеческие ДНКазы, как активные формы, факультативно вместе с фармацевтически приемлемым эксципиентом Настоящее изобретение направлено также на то, чтобы определить терапевтически аффективные количества очищенных дезамидированной и недезамидированной человеческих ДНКаз для лечения способных накапливаться вязких ДНК-содержащих материалов Наилучший эффект при применении таких очищенных ДНКаз имеет место при прямой ингаляции в легкие Настоящее изобретение особенно пригодно при лечении больных, имеющих такие легочные заболевания как хронические бронхиты, кистозные фиброзы или эмфизему легких путем введения терапевтически эффективных количеств очищенной надезамидированной человеческой ДНКазы пряно в воздушные пути Настоящее изобретение направлено на то, чтобы получить фармацевтические препараты, включающие недезамидированную человеческую ДНКазу, помещенную в пластиковидный сосуд, факультативно в присутствии фармацевтически приемлемого эксципиента Краткое описание рисунков На фиг 1 показаны аминокислотная / № I/ и ДНК последовательности /№2/ человеческой ДНКазы I Природная кодовая последовательность подчеркнута, потенциальные первичные кодоны обведеш кружков, а зрелая последовательность заключена в скобки На фиг 2 показана зависимость между энзинатической активностью й степенью дезамидирования образцов человеческой ДНКазы, Специфическую активность определяли о помощью метилового зеленого /МЗ/ /в единицах концентрации но отношению к стандартной кривой/, где концентрация ДНКазы измерялась энзимосвязующей, иммуноабсорбентной пробой (ELISA) Процент дезамидирования определил с помощью хроматографии триптической ДНКазы /ДНКазы, полученной при обработке ДНКазы трипсином/ "В день жатвы" образцы человеческой ДНКазы были очищены от культуры рекомбинантных клеток яичников китайские хомяков /ЯКХ/ акспрессионной ДНК, кодирующей человеческую ДНКазу Такие образцы были исследованы на 3,5,7,9,11 и 13 и 20 дик после качала культивирования Высокая рН образцов очищенной ДНКазы на 13 день была обнаружена в - образцах, которые культивировали in vitro в течение 2-х дней при рН 8 при 37°С, "Стабильность" образцов очищенной ДНКазы, взятых на 13-ый день, сохранялась in vitro при 5°, 25° или 37°С в течение различного периода времени На фиг 3 представлены пример хроматограммы триптической ДНКазы, используемой для определения степени дезамидирования Образец, приведенный здесь, является 65% дезамидированной ДНКазой "mAU" доказывает количество мили-абсорбируемых единиц при 214 нм На фиг 4 схематически представлено дезами дирование остатка аспарагиновой аминокислоты в положении 74/Аси-74/ человеческой ДНКазы, Дезамидирование ведет к образованию остатка аспартиковой /Асп/ или изо-аспартиковой кислоты /изо-Асп/ Каждая из этих трех форм, получаемых при расщеплении ДНКазы трипсином, образует пару пептидов, что указывает на их идентичность ДНКазе На фиг 5 показана хроматограмма образца человеческой ДНКазы фракционированного на тентаклической катионнообменной /ТКХ/ колонке Приведенный образец является 67% дезамидированной ДНКазой На фиг 7 показаны хроматограммы нескольких образцов человеческих ДНКаз, факционированных на ТКХ колонке Образец, обозначенный как "ML-28 STD" является препаратом человеческой ДНКазы, полученной в культуре клеток яичника китайского хомяка /ЯКХ/, трансформированных ДНК, кодирующей природную человеческую ДНКазу I Образец, обозначенный как "ДНКаза Асп Мутант" является ДНКазой, имеющей остаток аспартиковой /скорее, чем аспарагиновой аминокислоты в положении 74, и который таким образом имеет такую же последовательность аминокислот, как Асп форма дезамидированной ДНКазы показанной на фиг 4 ДНКаза Асп Мутант был получен из культур клеток, трансформированных ДНК, кодирующей эту форму мутанта человеческой ДНКазы ДНК, кодирующая ДНКазу Асп Мутанта, была получена путем мутагенеза ДНК, кодирующее природную человеческую ДНКазу Сравнение хроматограм показывает, что одна из форм человеческой ДНКазы в "ML-28 STD" элюирует из ТКХ колонки с того же положения, что и ДНКаза Асп Мутант На фиг 8 показаны хроматограммы и нескольких образцов человеческих ДНКаз, фракционированных на ТСК- Гепариновой колонке (Toso Haas, Montgomeryville, Pennsylvania) Образец, обозначенный как 12 К 18 является препаратом человеческое ДНКазы, полученной из культуры клеток яичников китайского хомяка /ЯКХ/ трансформированных ДНК, кодирующей природную человеческую ДНКазу I Образец, обозначенный как "Дезамидированный стандарт" является очищенной дезамидированной человеческой ДНКазой Образец, обозначенный как "Недезамидированный стандарт" относится к очищенной недезамидированной человеческой ДНКазе Очищенная дезамидированная человеческая ДНКаза и очищенная недезамидированная человеческая ДНКаза были получены с помощью ТКХ хроматографии На фиг 9 показаны хроматограммы нескольких образцов человеческой ДНКазы, фракционированных на иммобилизованной ДНК аналоговой 8 46693 ловеческой ДНКазы, полученные путем рекомбинантной экспрессии, содержит от 50 до 80 и более процентов дезамидированной человеческой ДНКазы Термин "очищенная дезамидированная человеческая ДНКаза", используемый здесь обозначает дезамидированную человеческую ДНКазу, которая свободна от недезамидированной человеческой ДНКазы Другими словами недезамидированвая человеческая ДНКаза будет составлять менее 10%, желательно около 5% и наиболее желательно менее 1% от общего веса дезамидированной человеческой ДНКазы Тернии "очищенная недезамидированная человеческая ДНКаза", используемый здесь, обозначает дезамидированную человеческую ДНКаДетальное описание зу, свободную от дезамидированной челоА Определения веческой ДНКазы Другими словами, дезамидиТермин "человеческая ДНКаза" приведенный рованная человеческая ДНКаза будет составлять здесь, обозначает полипептид, имеющий аминоменее 25%, желательно менее 5% и наиболее кислотную последовательность человеческой желательно менее 1% от общего веса очищенной зрелой ДНКазы I /показан на фигура I/, также как недезамидированной человеческой ДНКазы варианты аминокислотной последовательности /включая аллельные варианты/, которые энзинаТермин "эксципиент" обозначает фармацевтически активны при гидролизе ДНК Таким обратически приемлемый материал, который может зом, термин "человеческая ДНКаза" используется быть использован вместе с ДНКазой для праздесь также для обозначения материалов, выяввильного и успешного введения ДНКазы пациенленных в заявках на патенты, описанных выше там Благоприятные эксципиенты хорошо известны и описаны, например в Physicians Desk ReferТермин "человеческая ДНКаза" включает ence, the Marks Index and Remingtio's Pharприродную зрелую человеческую ДНКазу, имеюmaceutical Sciences щую остаток аспарагиновой /Аси/ аминокислоты в положении 74 полипептида Аспарагиновая Предпочтительные растворителем для челокислота в этом случае чувствительна к дезамивеческой ДНКазы являются буферное а не будированию и при дезамидировании образуется ферные водные растворы, предпочтительном явсмесь дезамидированных и недезамидированных ляется соловой изотонический раствор в 150мМ форм человеческой ДНКазы Кроме остатка асхлорида натрия, содержащий 1,0мМ хлорида парагиновой кислоты в положении 74 дазамидикальция при рН 7 Эти растворы особенно прированная ДНКаза имеет остаток аспартиковой годны для использования в коммерческих раскислоты /Асп/ или остаток йзо-аспартиковой китворителях, включая распыляющиеся раствослоты /Изо-Асп/ /см фиг 4/ рители и ультрасонические растворители, используемые, например для введения прямо в Термин дезамидированная человеческая воздушные пути или легкие больных Что касаДНКаза", используется здесь, также для обознается указанных выше заявок на патенты, их дечения человеческой ДНКазы, которая дезамидитальный анализ может позводить более эффекрованная при аспарагиновом остатке, который тивно использовать человеческую ДНКазу находится в положении 74 в аминокислотном последовательности природной человеческой Торбин "терапевтически эффективное колиДНКазы Было обнаружено, что дезамидированчество в данном случае обозначает дозы от 1мг ная человеческая ДНКаза может появится в продо 100мг человеческой ДНКазы на килограмм цессе образования человеческой ДНКазы путем веса тела пациента, в зависимости от фармацеврекомбинации и может быть обнаружена в препатического состава описанного препарата Тераратах человеческой ДНКазы, полученных из репевтически эффективное количество человечекомбинантных клеток хозяина Кроме того, дезаской ДНКазы зависит, например от терапевтичемидированная человеческая ДНКаза может обраских свойств, способа введення и состояния пазовываться при хранении незамидированной чециента Поэтому, если это необходимо с тераловеческой ДНКазы певтической точки зрання, то может быть изменена доза, способ введения препарата для того, Хотя остаток аспарагиновой аминокислоты в чтобы получить оптимальный терапевтический положении 7 в аминокислотной последовательэффект С точки зрения различий между энзиманости природной человеческой ДНКазы, также тической активностью дезамидированной и недеможет быть дазамидирован /кроме остатка аспазамидированной ДНКазами, описанными здесь, рагиновой аминокислоты в положении 74/, такая вероятно, количество очищенной недезамидиродвойная дезамидированная ДНКаза может быть ванной ДНКазы, необходимой для достижения энзиматически неактивна терапевтического эффекта, будет меньше, чем Термин "смесь", используемый здесь, отноколичество очищенной дезамидированной челосится к препаратам из человеческой ДНКазы, где веческой ДНКазы, или смеси двух форм, чтобы присутствуют обе дезамидированная и недезапри тех же условиях достичь такого же эффекта ми дированная формы человеческой ДНКазы Было обнаружено что, например, препараты чеОчищенные ДНКазы, особенно их недезамиколонке Образец, обозначенный как "М-28" является препаратом человеческой ДНКазы, полученной из клеток яичников китайского хомяка /ЯКХ/ трансформированных ДНК, кодирующей природную человеческую ДНКазу I Образец, обозначенный "Недезамидированный стандарт" относится к очищенной недезамидированной человеческой ДНКазе Очищенная дезамидированная человеческая ДНКаза и очищенная недезанидированная человеческая ДНКаза были приготовлена путем ТЕХ хроматографии Образец, обозначенный как "ДНКаза Асп Мутант" является ДНКазой, имеющей остаток аспарагиновой кислоты /скорее, чем остаток аспарагиновой кислоты/ в положении аминокислоты 74 46693 10 522 77 (1990), Hearn et al , J Chromatography 548 117 (1991) He вдаваясь в механизмы или теорию процесса, было выяснено, что остаток аспарагиновой аминокислоты в положении 74 у человеческой ДНКазы более чувствительный к дезамидированнию, локализован внутри ДНК связующей цепочки энзима, по аналогии с известной кристаллической структурой бычьей ДНКазы ДНКсвязующая цепочка содержат основные аминокислотные остатки /для того, чтобы связывать ДНК/ при этом цепочка очевидно, доступна к лигандам из тентаклитической катионнообменной смолы, на не к более коротким лигандам из обычных катионнообменных смол Вероятно лиганды из тентаклической катионнобмменой смолы имеют сходные структуры с природной нуклеиновой кислотой Таким образов можно предБ Примеры применения положить, что тентаклическая катионнообменная После успешного клонирования и экспрессии хроматография может быть использована для человеческой ДНКазы в рекомбинантных клетках очистки других нуклеаз, таких как рибонуклеазы хозяина и дальнейшего детального исследова/РНК/ или рестрикционных эндонуклеаз, так же ния было выявлено, что ДНКазный продукт, покак ДНК связующих протеиназ лученный, способом рекомбинантной экспрессии дированная форма, используется для энзиматического изменения вязкости секрета слизистых Такие очищенные человеческие ДНКазы особенно пригодны для лечения больных с легочными заболеваниями, у которых отмечается выделение вязких гнойных секретов при таких заболеваниях как острые или хронические бронхиально-легочные заболевания включая инфекционную пневмонию, бронхиты и трахеобронхиты, бронихиоэктазы, кистозные фиброзы, астму, туберкулез и грибные инфекции Для лечения таких больных раствор или полностью разделенный и высушенный препарат, очищенной дезамидированной человеческой ДНКазы или очищенной недезамидированной человеческой ДНКазы вводится определенный образом, например, в виде аэрозоля в бронхи представляет собой, как правило, смесь ДНКаз, а также других не идентифицированных В частности, изоэлектрические фокусионные анализы /ИФА/ человеческой ДНКазы, очищенной от культур рекомбинантных клеток яичников китайского хомяка, выявили комплекс различных видов ДНКазы Было определено, что различные образцы ДНКазы являются результатом некоторых посттрансляционных модификаций, включая дезамидирование Были проведены наследования для выяснения наличия и степени дезамидирования ДНКазы в таких препаратах Один из методов включал триптическое расщепление начальных препаратов ДНКазы и анализ полученной путем реверсии фазы пептидов С помощью этого метода было определено количество дезамидированной ДНКазы в начальном препарате, состоящее из шести триптической пептидов Другим методом определения начальных препаратов ДНКаза является хроматография на тентаклической катионообменной колонке /ТКХ/ Проведение хроматографии на ТКХ-колонке позволяет разделять дезамидированную и недезамидированную форму ДНКазы и получать их очищенные формы Таким образом определяли количество дезамидированной и недезамидированной ДНКаз в начальное препарате путем измерения на хроматограммах зон пиков, относящихся к разным формам ДНКаз Хотя оба эти метода, достаточно эффективны для определения дезамидированной ДНКазы, ТКХ метод является более эффективным т к требует меньше времени и специалистов, чем другой метод Более того, ТКХ-хроматография обеспечивает возможность разделения дезамидированной и недезамидированной форм ДНКазы, тогда как обычные катионообменные смолы и различные другий обменные смолы не обеспечивают такого разделения Общие принципы ТКХ-хроматографии описаны например Миллером J Chromatography 510 133 (1990), Janzen at al , J Chromatography Альтернативно, разделение дезамидированных и недезамидированных форм ДНКазы может быть выполнено с помощью хроматографии, используя смолу или другие матричные материала, содержащие катионы полимеры такие как гепарин или синтетический негидролизованный ДНКаналог Для -этих целей коммерчески пригодны иммобилизованные гепариновые хроматографические колонки /например/ Tose Haas Co , Montgomeryville, Pennsylvania) Негидролизованные ДНК-аналоги описаны, например у Spitzer et al , Nuc Acid Res 16 11691 (1988) Иммобилизованная негидролизованная ДНКаналоговая колонка может быть наготовлена путем синтеза ДНК-аналога с аминокислотной группой З-end на одном или обоих ее комплиментарных нитях Аминогруппа пригодна для соединения ее с эпоксиактивированной колонкой, как описано у Raimn Biochemical LC Products (Woburn, Massachusetts) Успешное разделение дезамидированной и недезамидированной человеческой ДНКазы с помощью способов, описанных в настоящем изобретении, позволило определить, что энзиматическая активность дезамидированной ДНКазы меньше энзиматической активности дезамидированной ДНКазы, что было определенно с помощью пробы на метиловый зеленый /МЗ/ Kurmck , Arch Biochem 29 4 (1950) Было установлено, что энзиматическая активность дезамидированной ДНКазы составляет несколько больше половины энзиматической активности дезамидированной ДНКазы Таким образов, путем комбинирования очищенной дезамидированной ДНКазы и очищенной недезамидированной ДНКазы в различных пропорциях возможно получение фармацевтических препаратов человеческой ДНКазы, имеющих желаемую специфическую активность в пределах между активностями компонентов, что бывает необходимый при некоторых случаях заболеваний 11 46693 12 Следующие примеры, иллюстрируют некотостандартных пиковых зонах (D)T7, (D)T7-8 и Т6-7 в рые случай и не ограничивает использование сравнении с общими стандартизованными пикоизобретения другим образом выми зонами шести пептидов С Примеры Один миллиграмм ДНКазы в объеме 250мкл I Триптическая хроматография требовался для того, чтобы тщательно выполнить метод триптической хроматографии для опредеПроцедура, используемая для получения ления дезамидированной ДНКазы в соответствии триптической хроматограммы заключается в слес процедурой, описанной выше Следовательно, дующем начальный образец препарата для этого способа Этап 1 Берут I мг образца ДНКазы и доводят требует или концентрации или разбавления обее концентрацию на Амикон-Центрикон-10 или разца для того, чтобы достичь нужного резульпутей разбавления с эксципиентом до 4 мг/мл тата ДНКаза в присутствии кальция очень устойОкончательный объем 250мкл чива к протеиназам, включая трипсин Поэтому Этап 2 Добавляют к образцу 250мкл предобследующий шаг в процедуре - это частичное ударабатывающего буфера /40мМ БисТрис, ЮмМ ление ионов кальция путем обработки с этилен ЭГРА, рН 6,0/ Инкубируют I час при 37°С бис/оксиэтиленэнитрило/ тетрауксусной кислотой Этап 3 Буфер в образце заменяют на расще/ЭГТА/ Чрезмерная обработка ЭГТА может денапляющий буфер /ЮОмМ Трис, рН 8/, используя турировать и агрегировать ДНКазу, поэтому должPharmacia NAP5 колонку Окончательный объем ны быть приняты меры, чтобы предотвратить это 1мл ЭГТА-обработанный образец в объеме 0,5мл заЭтап 4 Добавляют Юмкл раствора трипсина теи помещали в I -мл расцепляющего буфера, Трипсин 1ик/кл, 1мМ HCI к образцу и инкубируют добавляли трипсин и образец инкубировали при 2 часа при 37°С 37°С в течение двух часов Затем добавляли втоЭтап 5 Добавляют вторые Юмкл водного рое кратное количество трипсина и образец инкураствора трипсина к образцу и инкубируют 2 часа бировали дополнительно два часа Расщепление при 37°С прекращали путем ацидификации, после чего обЭтап 6 Останавливают расщепления добавразец или сохраняли для дальнейших анализов ления к образцу бмкл трифторуксусной кислоты или проводили анализ сразу па HPLC колонке /ТФК/ Образцы до начала хромотрграфии сохраняют при температуре ниже 5°С 250кл /250мкг/ смеси пептида, полученного в результате триптического расщепления HPLC Этап 7 Разделяют пептидную смесь с поразделяли на противоположный фазе HPLC комощьюНРІС при следующих условиях лонки в соответствии с условиями, описаний выКолонках Nucleosil C18, 5мкм, 100 А, 2,0х150мм ше (ALLtech, Co , Deerfield, Illinois) Температура колонки - 40°С Типичная триптическая хроматограмма человеческой ДННКазы показана на фиг 3 HPLC была ЭлюантА 0,12% ТФК в воде выполнена на Hewlett-Packard модели 1090М Элюант Б 0,10% ТФК в ацетонитриле HPLC Коломочный эфлюэкт контролировали одновременно при 214 и 180нм путем диодного деГрадиентный профиль тектора, что является характеристикой этого приВремя %А %Б бора Так как ранняя порция пептида на хромото0 100 0 грамме является критической, в отношении коли5 100 0 чества дезамидированной ДНКазы, как описано 65 40 60 ниже, использование для этого анализа других 69 5 95 приборов с большим градиентом задержки боль70 5 95 шими объемами не возможно Каждый анализ в Скорость 0,25мл/мин Объем наносимого образца 250мкл Постфракционное реуравновешивающее время при 100% элюанта А, 20мин Температуры внутри камеры с образцом 5°С Обнаружение абсорбция при 214 и 280нм Этап 8 Идентификация Т7, (D)T7,T7-8, (D)T7-8 , 16-7-8 и Т6-7 триптических пептидов путем сравнения времени удержания со стандартов Этап 9 Интегральная хроматограмма получена при 280нм Оценка качества интеграции проведена путем сравнения со стандартной линией компактна эльютируемых пиков Особое внимание должно быть обращено на раноэльютируемые пептиды 17 и (D)T7, которые недостаточно хорошо растворяются Этап 10 Стандартизация пиковых зон шести пептидов к тирозин-содержащим Пептиды Т7, (D)T7, T-7-8 и (D)T7-8, каждый из которых содержит один остаток тирозина, в то время как Т6-7-8 и Т6-7 содержат три остатка тирозина Оценка пропорции дезамидированных видов, основана на этой процедуре требует 70 минут для градиентного фракционирования и 20 минут для реуравновешиния колонки Таким образом общее время анализа на HPLC колонке составляет 90 минут Обоснование и процедура определения степени дезамидирования ДНКазы в образце описана ниже Дезамидирование человеческой ДНКазы происходит, как правило, в месте расположения аспарагинового остатка в положении аминокислоты 74 /Асн-74/ в природной зрелой человеческой ДНКазе Асн-74 после расщепления ДНКазы с помощью трипсина расположена после остатка аргининовой аминокислоты в положении 73 /Apr -73/ и расположена на ц-концевой стороне, как показано в списке пептидов, выявленных при расщеплении трипсином природной человеческой ДНКазы, приведенных в таблице 1 Кроме остатка аспарагиновой /Асн/ аминокислоты, находящейся в положении 74 у природной недезамидированной человеческой ДНКазы ТАБЛИЦА I. Пептиды, выявленные при расщепленик трипсином природной человеческой ДНКазы № Последовательность аминокислот в пептидах Остатки 1-2 3-і 5 /псл>з/ 16-31 32-4І /псл а J64/ YffiCAbVQBTR 42-50 Тб /псло /ПСЛО * 6 / 51-73 74-77 №/ BMR /ПСЛ. №7/ 2ШЖ / п с л о №8/ 78-79 «9 80-111 112-117 /пел. Л9/ BPAIVE /псл в JKEQ/ Т11 118-121 Ї12 122-126 ПЗ 127-157 BFAITPLHAAPaBATAjanAlYDVYbDVQM П4 158-185 WGI^DraHJaiJMfAGCSyVHPSQWSSIR П5 186-213 3OTSPTPQWUPD5AOTIA«MHOAyDR / ПСЛ» Я 5 / Т16 214-222 I7VAGMLLR / п с л 0 ЖЕб/ Т17 £23-260 /пел. №11/ /псл о Щ2/ /пел. М З / /псЛ. Ж 4 / /ПОЛ. Ж 7 / Примечание; пел - последовательность дезамидированная человеческая ДНКаза имеет или Асп или изо-Асп остаток, как показано на фиг.4. Изо-Асп является изометрической бетааминокислотной формой аспартиковой кислоты. Пептид, расположенный между Арг-73 и изо-Асп кислотой, устойчив к расщеплению трипсином, поэтому дезамидированной человеческая ДНКаза характеризуется наличной триптического пептида, содержащего остатки 51-77 и называемого Т6-7, следовательно, это ость соединенные пептиды 16 н Т7. При получении триптической хромаграммы Арг-73-Асп-74 пептид, связанный в недезамидированной человеческой ДНКазы и Арг-73-Асп-74 пептид, связанный в Асп-форме дезамидированной человеческой ДНКазы, расщепляются трипсином. Следовательно, недезамидированной ДНКа за, показанная на триптической хроматограме, содержит Т7 пептид, указанный, в таблице 1, в то время как Асп-74 форма человеческой дезамидированной ДНКазы, приведенная на триптической хроматограмме, содержит дезамидированной Т7 пептид, называемый (D)T7. Эти три пептида отмечены на фиг.З. К сожалению, трипсин только частично расщепляет пептид, расположенный па Сконцевой стороне Т7, между остатками 77 и 78, так что каждый из указанных пептидов Т7, (D)T7 и Т6-7 имеют, соответственно, Т8 конфигурацию, Т7-8, (D(T7-8 и Т6-7-8. Эти шесть указанных пептидов, следовательно, должны быть учтены для количественного определения дезамидированной человеческой ДНКазы, определяемой с помощью метода триптического хроматографирования. 15 46693 16 Таким образом, (D)T7, (DJT7-8, Т6-7 и 16-7-8 и недезамидированной пептидов позволяет оцепептиды представляют дезамидированной челонить содержащие дезамидированной ДНКазы в веческую ДНКазу, а Т7 и Т7-8 пептиды представобразце ляют недезамидированной человеческую ДНКазу, 2 Тентаклическая катионнообменная хромаи знание относительной пропорции этих пептидов тография позволяет сделать вывод о степени дезамидироТентаклическая катионнообменные /ТИХ/ ванной препарата ДНКазы Для того, чтобы подсмолы непохожи на обычние катионнообменные, считать фракции образца дезамидированной они имеют полиионные лиганды, направленные к ДНКазы требуется знание молярного соотношения силикагелевой поверхности В этом эксперименте дезамидированных и недезамидированной образиспользованы лиганды из LiChrospher 1000 SO3 цов колонка (ЕМ Separations, Gib-bstown, New Jersey), Имеются две дополнительные проблемы в которая содержит от 25 до 50 сульфопропиловых процедуре триптической хроматографии одна групп вдоль полиэтиленового стержня и присоехроматографическая, а вторая проблема, связандиненных одним концом к силикагеновой поверхная с выявлением Хроматографическая проности блема состоит в том, что пептид 12 коэльютирует ТКХ хроматограмма образца рекомбинантной с 16-7, и таким образом, препятствует точному человеческой ДНКазы, полученной на LiChrospher определению зоны пика этого показывающего степень дезамидированной пептида Эта про1000 SO3 колонке показана на фиг 5 Рекомбиблема может быть разрешена путем интеграции нантная человеческая ДНКаза была очищена из хроматограмм, полученных при 280им, т к все культур клеток яичника китайского хомяка, трансшесть, имеющихся здесь пептидов, содержат на формированных ДНК, кодирующей человеческую конце один остаток тирозина /Тир/ и, таким обраДНКазу Shak, et al, Proc Nat Acad Sei 87 9188зом, хорошо абсорбируются при 280нм, в то время 9192 (1990), Shaketal , International Patent Applicaкак Т2 не содержит остатков Тир или триптофана tion Publication No WO 90/07572 (1990) /Трп/ и таким абсорбируется незначительно при Были отобраны образцы из двух пиковых зон это длине волны Проблема выявления состоит в и исследованы несколькими способами для того, том, что каждый из Т6-7 и Т6-7-8 пептидов содерчтобы идентифицировать их как формы ДНКаз, жит три остатка Тир, в то время как каждый из чеотличающиеся только остатком аминокислоты в тырех других пептидов содержит только один положении 74 На фиг 6 приведены триптические Такт образом, Тб-содержащиепнптиды имеют бохроматограммы дезамидированной и не дезамилее высокую молярную абсорбируемость, чем дированной форм человеческое ДНКазы Триптипептиды, содержащие только Т7,н сравнение пическая хроматография виявила, что обе формы ковых зон образцов ведет к завышенной оценке дезамидированной ДНКазы, имеющие Асп или содержания дезамидированных форм в образце изо-Асп, остаток аминокислоты в положении 74 Эта проблема решается путем стандартизапредставлены в I- пике Таблица 2 показывает ции пиковых зон шести пептидов путем стандарспецифические активности двух пиков, подтвертизации количества терозиновых остатков в пепждающие связь между дезамидированнием и спетиде Таким образом, подразумевается, что все цифической активностью и подтверждающие вытирозиновые остатки в каждом из шести пептидов воды, представленные на фиг 2 и, кроме того, эквивалентны химическому окружению которое, подтверждающие ТХК-фракций Активность фраквероятно, хорошо принимает на себя относиций ДНКазы в пробах была определена с помотельно небольшие пептиды, такие как здесь полущью метилового зеленого /МЗ/ чены При стандартизации сравнение скорректированных 1 ых пиковых зон для дезамидированных Таблица 2 Активность фракции, собранных па ТКХ-колонке /данные, представленные в таблице, являются средними из двух образцов/ Образец Начальный препарат из рекокбинантной человеческой ДНКазы ТКХ Пик 1/ дезамидированной / ТКХ Пик 2 /не дезамидированной/ Мутантная форма человеческой ДНКазы, имеющая Асп остаток аминокислоты в положении 74, была получена мутагенезом ДНК кодирующей природной зрелой человеческом ДНКазы Этот мутант коэльютирует с 1-й пиком, полученным с помощью хроматографии, как показано на фиг 7 Следующим этапом является процедура ис Мк/мл 8315 85,3 149,2 Специфическая активность 7828 119,7 99,4 1,06 0,71 1,50 пользования LiChrospher 1000 SO3 тентаклической катионнобменной смолы Кроме нее, другая тентаклитическая катионнобменная была использована для разделения дезамидированных и не дезамидированных форм человеческой ДНКазы ДНКазы - это Fractogel тентаклическая катионнообменная (ЕМ Separations, Gibbstown, New Jer 17 46693 18 sey) LiChrospher и Fractogel - это зарегистриро4,5, содержащих ионы кальция, вводят образец и ванные товарные знаки, владельцев ЕМ Industries, затех колонку элыэ-тнруют солевых градисптох Inc , Hawthorne, NY или Е Merck, Darmstadt West Следующая процедура может быть использована Germany при небольшой шкале для разделения дезамидированной и не дезамидированной форм челове"Сильные" формы тентаклических катионных ческой ДНКазы Пропорции пиковых зон па полуобменных смол /или LiChrospher или Fractogel/, ченных хроматограммы адекватны пропорция деимеющие SO3 - Функциональную группу были замидированной и недезамидированной ДНКазы в использованы, так как они позволяют получать образце наилучшей результат Этап 1 Загрузка образца, содержащего 3 HPLC Колоночная загрузочная процедура 150мМ NaCI при рН до 9, в чашку для образца, для получения культур клеток жидких образцов для LiChrospher 1000 SO3 смола требуется рН до 4,5 и центрифигурование, чтобы а Материалы и оборудование удалить протеины, что невозможно в буферном 1 Приготовление стеклянного картриджа растворе, используемом в этой процедуре 1,0см х 5,0см Этап 2 Разделение двух форм ДНКазы с по2 Загрузочный буфер ЮмМ уксусного намощью HPLC при следующих условиях трия, 1мМ рН доводили до 4,5 с помощью уксусной кислоты колонка ТЕХ LiChrospher 1000 SO3 перегружали Фильтрацию проводили через фильтр 0,2мк в стальную колонку Разборы колонки 4,6х50мм и 3 Колоночный загрузочный резервуар объе4,6x150мм мом 20мл /Alltech part 9501 пли эквивалент/ Температура колонки температура окружаю4 Пустая колонка 4,6x5,0мм из нержавеющей щей среды Элюант А ЮмМ ацетата натрия, 1мМ стали с 0,5мк отсеченными фритами CaCI2 рН 4,5 Элюант В 1 М NaCI в буфере А 5 HPLC помпа, способная поддерживать обГрадиент профильный ратное давление /Водная недель 510 или эквивалент/ Время /мин / %А %В 6 Загрузочная процедура 0 100 8 1 Подготовка смолы 4 100 0 а/ распаковывание 1,0см х 5,см приготовлен30 30 70 ной стеклянной колонки /объем=3,93мл смолы/ 30,1 5 95 Ресуспензирование смолы до 20mls в чистом 37 5 95 стеклянном закрытом сосуде в уравновешивающем буфере Достигают жидкой однородной сусСкорость 0,8мл/мин/ 50мм колонка/, пензии, которая разделяется в кратности 2x10мл 0,5мл/мин/150 мм колонка/ Добавляют 10 mis загрузочного колоночного буОбъем вводимого образца до 250мкл фера к каждой части, чтобы достичь приблизиПостфракционное рекалибровочное время тельно 1,95mls смолы в 20mls загрузочного бупри 100% элюанта А 20 мин фера, Температура в камере для образца 5° б/ растворяют до достижения однородной сусОбнаружение абсорбция при 280нм пензии Суспензирование проводят в течение двух Этап 3 Интегральная хроматограмма Опречасов, пока твердые частицы не осядут на дно деление пропорции дезамидированных образцов, сосуда Тщательно сливают супернатант, содероснованное на определении пиковой зоны образжащий определенные частицы цов, более раннего эльюировання по сравнению с в/ добавляют 20mls загрузочного буфера к общей пиковой зоной обоих форм смоле и повторяют этап б/ Эта процедура повтоТентаклическая катионнообменная хроматоряется по крайній мере до четырех раз, чтобы гаграфия также обеспечивает возможность для разрантированно удалить все лишние частицы смоделения при большей шкале дезамидированной и лы недезамидированной форм человеческой ДНКа2 Загрузка колонки зы Большая шкала чаще применяется для фрака/ соединяют 4,6х5мм пустую HTLC колопку с ционирования, используя при этом более простые загрузочным резервуаром Растворяют смолу в условия эльюации, чем описано выше для не20mls загрузочного буфера, большой шкалы аналитического разделения двух б/ добавляют растворенную смолу в резерформ ДНКазы Так, большая шкала была испольвуар и быстро ее закрывают Давление загрузочзована с применением Fractogel - поддерного буфера не превышает 2000 psi Скорость живающего тентаклического катионнообменника, течения тока, что уравновешивающее давление используя следующую рН-эльюирующую процеподдерживается /около 2000 psi/ и буфер подаДУРУ ется в течение 15 минут после стабилизации давЭтап 1 Загрузка 31,6 колонки /1,6см х 15,7см ления Удаляют колонку и присоединяют верхний конец Колонка может быть использована неповысоты/ с Fractogel EMD SO3 -650 М тентакличесредственно или сохраняться в 0,02% растворе ской смолы (ЕМ Separations, Gibbstown, New Jerазида натрия sey) Для большинства образцов, включая ДНКазу, Этап 2 Диафильтрация загрузочной ДНКазы помещенную в 150мМ NaCI, образец препарата не уравновешивающим буфером /ЗОмМ ацетат натребует предварительного введения в колонку трия /NaAc /, 1мМ хлорида кальция /СаСЬ/ 50мМ Колонку уравновешивают ацетатных буферах с рН 20 19 46693 хлорида натрия /NaCI/ pH 5 Концентрат с ультраформу и присоединена к Ramin Hydropora-EP кофильтрацией к объему от 355mls и концентрация лонке Ramin Co, Woburn, Massachusetts) На 2,5м г/мл фиг 9 показаны хроматограммы проанализирована на этой колонке образцов, содержащих Этап 3 Промывка колонки 2,5 колоночными смесь дезамидированных и недезамидированных объемами /КО/ 2% гидроксида натрия /NaOH/ форм человеческой ДНКазы, очищенной недезаЭтап 4 Промывка колонки 2,5 КО предуравномидированнои человеческой ДНКазы, очищенной вешивающим буфером /ЗООмМ NaAc, 1 М NaCI, недезамидированнои человеческой ДНКазы, или рН5/ очищенного мутанта человеческой ДНКазы, Этап 5 Промывка колонки 2,5 КО уравновеимеющего остаток аспаративной шивающего буфера Этап 6 Загрузка колонки 1-1,Зг диафильтро/предпочтительнее чем остаток аспарагиновой ванной /ультрафильтрованной ДНКазы /получена кислоты в положении аминокислоты 74 Для па 4 этапе Начало сбора фракций колоночного проведения анализов на колонке использовали эфльюэнта с момента загрузки ДНКазы буфер, содержащий 1 мМ хлористого кальция, 5мМ MES при рН около 6 и эльюировали с линейЭтап 7 Промывка колонки 5 КО уравновешиным градиентом концентрации хлористого натрия вающего буфера до 1 М в течение 20 минут со скоростью 1 мл/мин Этап 8 Промывка колонки 5 КО при рН проКак показано на фиг 9 при этих условиях дезамирывающего буфера 5,3/25мМ сукцината, 1мМ Садированная и недезамидированная формы ДНКаС12, РН 5,3/ зы частично отделились одна от другой Кроме, Этап 9 Промывка колонки 10 КО прорываютого, две изомерные формы дезамидированной щего буфера с рН 5,4/25мМ сукцината, 1мМ СаСЬ ДНКазы, которые отличались положением аминоРН 5,4/ кислоты в положении 74 ДНКазной последоваЭтап 10 Промывка колонки 10 КО прорываютельности, имеющей в указанном положении асщего буфера с рН 6.0/25MES, 1мМ CaCI2 рН 6,0/ партиковую или изо-аспартиковую кислоту также Этап 11 Смешивание фракций, отобранных могли быть разделены на этой колонке Таким на этапах 6-8, для того, чтобы получить смесь, образом добавочным преимуществом этого хропреимущественно содержащую дезамидированматограф и чес кго метода является то, что он поную ДНКазу Смешивание фракции, собранной на зволяет разделить два изомера, что часто необэтапе 10, чтобы получить недезамидированнои ходимо при дезамидированнии человеческой ДНКазу Фракции, собранные на 9 этапе, содержат ДНКазы смесь двух ДНКаз и могут быть рецитированы 5 Эзиматическая активность дезамидированМетодика, описанная выше, является призеной человеческой ДНКазы и недезамидированнои ром использования тентаклической катионнообчеловеческой ДНКазы ненной смолы для получения препаратов очищенных 2-х форм рекомбинантной человеческой Несколько аналитических методов било исДНКазы такни образом, что использование больпользовано, чтобы исследовать влияние дезамишой шкалы позволяет обнаруживать очищенную дированния на энзиматическую активность челодезавуированную и очищенную недезамидировеческой ДНКазы Очищенная дезамидированная ванную ДНКазу человеческая ДНКаза и очищенная недезамидированная человеческая ДНКаза были получены Гепариновая и иммобилизованная ДНКазная путем хроматографии на ТКХ колонке, как описано аналоговая хроматография выше На фиг 8 представлены хроматограммы анализов, полученных на TSK - гепариновой колонке В одном опыте для определения ДНКазной (Tose Haas, Montgomeryville, Pennsylvania) из обэнзиматической активности была использована разцов, содержащих смесь дезамидированных и синтезированная двух нитчатая свернутая ДНК, в недезамидированных форм человеческой ДНКакоторой 25 пар основаній в последовательности зы, очищенной недезамидированнои челобыли маркированы денитрофенолом /ДНФ/ на веческой ДНКазы Фракционирование па TSR одном конце и биотином - на другом конце Стегепариновой колонке проводили при таких же успень гидролиза субстрата ДНКазой определяли ловиях, как описано для фракционирования на оценкой продуктов реакции на микротитровочном ТКХ-колонке Представленная хроматограмма кювете, стенки которое содержали антитела к свидетельствует о том, что колонка с иммобилиДНФ и определяли количество интактной пробы с зованным гепарином позволяет разделить дезастрептовиридин-лошадиной перексидазой Спемидированные и недезамидированные формы цифическая активность стабильности образцов ДНКазы коррелировала (г2=0,613, п=5) со степенью дезамидированния ДНКазы /пределы 27-93%/ Как описано выше, другие сродства разделения дезамидированных и недезамидированных Экстраполяция наименьших квадратов линейформ ДНКазы использованы в колонке, содержаного уравнения свидетельствуют, что специфичещей иммобилизованную аналоговую ДНК, что ская активность дезамидированной человеческой обеспечивает устойчивость к гидролизу ДНКазой ДНКазы была приблизительно па 77% меньше, Один из призеров использования иммобилизованчем недезамидированнои человеческой ДНКазы ной ДНК аналоговой колонии включал синтез Другой опыт определения ДНКазной энзимафосфоротиоата олигонуклеотида 5'тической активности включал гидролиз хромогенного субстрата П-нитрофенил фенилфосфоват GCGCGCGCGCGCGCGCGCGCGC-NH3-3', Эта /ПНФФ/ как описано Liao et al , Biochem J , 255, самокомплементарная последовательность может 781-787 /1988/ Кинетика ПНФФ гидролиза челобыть энниэлирована в двух нитчатую свернутую 22 21 46693 веческой ДНКазы имеет сигмоидальную форму и бинантных клеток /ЯКХ/, была растворена в конможет быть описана уравнением Хилла для нелицентрации 4мг/мл в небуферном водном раствонейной регрессии В соответствии с этим методом ре, содержащем 150мМ NaCI и 1мМ СаСЬ Затем v max полностью дезамидированнои человеческой эти образцы были помещены в стеклянные и плаДНКазы была на 77% меньше, чем недезамидистиковые сосуды Было использовано два различрованной человеческой ДНКазы Концентрация ных типа пластиковых сосудов, один, изготовленсубстрата для половинной максимальной активноный из Dupont 20 пластика /производство Е I Pont сти /So 5/ значительно не отличалась для образцов de Nemours & Со , Inc Wilmington, Delaware, USA, дезамидированнои и недезамидированной челодругой изготовлен из Escorene пластика веческой ДНКазы /производство Exxon Corp/ Оба эти пластика являются полиэтиленами, полученными при низком Еще один метод определения ДНКазной эндавлении, но контейнеры для содержания ДНКазы зиматической активности, который описан Kumtz, могут быть изготовлены и из других платиков таJ Ge Physiol 33 349 /1950/ был модифицирован ких как полипропилен, полипропилен или других таким образом, что энзиматические реакции прополиолефинов Сосуды, содержащие растворы водили при рН 7,0-7,5 С помощью этого метода ДНКазы, сохраняли при -70°С, 2-8°С и 25°С Набыло показано, что энзиматическая активность чальное дезамидирование составляло 60-65% дезамидированнои человеческой ДНКазы была Растворы ДНКазы в сосудах были исследованы меньше, чем недезамидированной человеческой через различные промежутки времени, чтобы опДНКазы ределить степень дезамидирования ДНКазы Ре6 Сохранение человеческой ДНКазы зультаты представлены в таблице 3 Человеческая ДНКазы, очищенная от рекомТаблица 3 % дезамидирования Рекомбинантная человеческая ДНКаза, сохраняемая в стеклянных и пластиковых сосудах Образцы День -70°С -28°С 25°С Стекло 83 66 66 78 Стекло 174 63 66 81 Dupont 20 83 65 66 71 174 63 63 70 Esoorene 83 65 66 71 174 64 62 70 Не было обнаружено различий в количестве дезамидированнои ДНКазы в пластиковых или в стеклянных сосудах при сохранении ее в течение 83 или 174 дней при -70°С или 2-8°С Среднее количество дезамидированнои ДНКазы составляло приблизительно 64% /± 2%/ Однако при сохранении растворов ДНКазы от 83 до 174 дней при 25°С наблюдали значительно меньшее количество дезамидированнои ДНКазы в пластиковых сосудах, чем в стеклянных Так, после 83 дней сохранения при 25°С 78% ДНКазы было дезамидировано в стеклянных сосудах, тогда как в пластиковых оно составляло лишь около 70% После 174 дней сохранения при 25°С 8 1 % ДНКазы был дезамидирован в стеклянных сосудах, тогда как в пластиковых сосудах было дезамидировано 7 1 % Эти различия могут быть связаны с различным рН в стеклянных или пластиковых сосудах Начальное значение рН раствора ДНКазы в стеклянных сосудах было несколько выше, чем в пластиковых сосудах и составляло соответственно 6,7 и 6,5, рН ДНКазы в стеклянных сосудах при хранении при 25°С в течение 83 дней составляло 6,9, а при хранении в течение 174 дней рН составляло 7,0, что возможно связано с растворением стеклянной поверхности и переходом ионов в раствор При более высоком рН степень дезамидирования человеческой ДНКазы увеличивается Полученные данные об увеличении дезамидирования человеческой ДНКазы при увеличении рН позволяют сделать еще один вывод о том, что сохранение человеческой ДНКазы желательно проводить в растворе, имеющем рН от 4,5 до 6,8, предпочтительно 5,0-6,8 Таким образом, улучшение стабильности человеческой ДНКазы в растворе получено путем помещения ДНКазного раствора в пластиковые сосуды, а не в стеклянные сосуды Впервые наблюдали значительно меньше дезамидирование ДНКазы в пластиковых сосудах Это открытие может быть особенно важным при сохранении человеческой ДНКазы, используемой в терапевтических целях, где особенно желательно сохранение ее в течение продолжительного периода без значительной потери энзиматической активности Конечно, стеклянные сосуды с не стеклянным, например, пластиковым покрытием могут быть также использованы Важным является также вывод о том, что необходимо избегать хранения ДНКазы в стеклянных сосудах, особенно если срок хранения превышает 15-30 дней Общие замечания Описаны подробно детали специфических методов, которые могут быть использованы, чтобы внедрить на практике настоящее изобретение Описаны детально специфика методов, используемых, чтобы идентифицировать, характеризовать, разделить и использовать чистые дезамидированную и недезамидированную человеческую ДНКазу, изобретение является специфической моделью относящихся сюда систем и, кроме того, оно позволяет специалистам изобретать подходящие альтернативные методы для получения такой же информации и для использования результатов настоящего изобретения 24 23 46693 Тем но немее, однако, такое подробное опиSer Сув I b r Gly Ser Ala Lea Lye Cys Phe Phe сание, которое приведено в тексте, не должно Arg Aap leu Ssr Ser Zaa Ї Ь г ttr Pbe Phe Ser быть лимитирующим фактором, скорее цель наl e u Ser Ser Lys Arg Arg Lye Leu Ser Ser стоящего изобретения - определить только законные рамки дополнительных требований Aep H e Pro Aep Ser Zaa Gin His Ser Arg Перечень последовательностей leu Жаа Gly His His His His Leu Arg Met /I/Общая информация SJy Met Lys Leu leu Gly Ale Leu Leu Ala lieu /і/Заявитель Генентех, Инк /и/ Название изобретения Очищенные формы Ala Ala leu Leu Sin Gly Ala Val Ser Leu ДНКазы lie Ala Ala Phe Ава Не 01и 3?Ь* й е Gly /ш/Количество последовательностей 17 ЗЙЇГ Lye Met Ser Asa Als ЇЬг Leu Val Ser /іу/ Адрес для переписки He Val Gin lie Leu Ser Arg їуг Asp lie /А/Адрес Генентех, Инк /Б/ Улица 460 Пойнт Сан Бруно Блвд Leu Val Gin Glu Val Arg Aep Ser His Leu /В/ Город Саус Сан Франциске Ala Val Gly Lys Leu Leu Asp Asn Leu Aan tan /Г/ Штат/ Калифорния Asp Ser Ala Его Аир Thr ї у г His Tyr Val Val /Д/Страна США Glu Pro Leu Gly Arg A эй, Ser Tyr Lys Gly Arg /Е/ ИНД 94080 Тут Leu Pile Val fyr A rg Pro Aep S i n Val S e r /У/ Требования к минимальной конфигурации компьютера Ala Asp Ser Tyr Eyr Asp Asp Gly Vel /А/ Тип 5,25 дюйма, 360 Кб, флоппи диск /Б/ Компьютер IBM PC совместимый Aap Thr Phe Asn Cys Oltt Pro Cys Glu Asn /В/Операционная система PC-DOS/MS-Dos Glu Pro Ala lie Val Arg Phe Phe S e r Arg /Г/ Программное обеспечение / патин /Генентех/ Arg Phe 1!kr Glu Val Arg Qlu Phe Ala lie /yi/ Сведения о заявке Ala Ala Val l e u His Pya S l y Asp Ala Г» /А/ Номер заявки Val Ala Slu H e Asp A l s Ыи Tyr Asp Val /Б/Дата подачи /В/ Классификация lieu Asp S i n Glu Lys Trp Gly Lsu Syr Val /ум/ Сведения о приоритетной заявке Glu Aep Val Met lieu Met Sly Aap Fhe Asn /А/ Номер заявки /В/Дата подачи Ala Gly Cys S e r Ч?г Val Arg Pro S e r Gin /уш/ Сведения о патентном агенте Trp S s r Ser l i e Arg Leu Ї Ї Р Thr S e r Pro /А/ Фамилия Джонстон Син А Gin /В/Регистрационный номер 35,910 Thr Trp Leu l i e Pro Asp S e r Ala И» /В/ Номер дела 747 Asp tor fh.r Ala Shx Pro His Cys Ala /їх/ Телекоммуникационная информация Tyr Asp Arg He Tel Tal Ala Gil Met Leu /А/ Телефон 415/225-3562 /Б/Телефакс 415/952-9881 Leu Arg Gly Ala Val Val Pro Авр S e r Ala /В/Телекс 910/371-7168 Leu Pro Phe Asn Fbe Gin Ala Ala Tyr Gly 121 Информация для последовательности №1 /і/ Характеристики последовательности Leu S e r Asp Gin Leu Ala Gin Ala He Ser /А/ Длина 346 аминокислот Aep Жів «Cyr Pro Val Qlu Val Btot Leu bys /Б/Тип аминокислота 2 a a Ala Ala Pro Pro His T&r Ser Xaa /В/Топология линейная /хі/ Перечень последовательностей ПоследоAla вательность №1 /2/ Информация для последовательности №2 /і/ Хараісгеристики последовательности /А/Длина 1039 оснований /Б/ Тип нуклеиновая кислота /В/Топология линейная /Г/Структура однонитчатая /хі/ Перечень последовательностей Последовательность №2 25 46693 TCCTGCACAG GCAGTGCCTT GAAGTGCTTC TTCAGAGACC ТТТСТТСЙТА so GftCraerrri' ТТТТСТТГЙА GCAGCAAAAS С Ж Ш А Й Т Г С TCATCAAAGG ATATTCCAGA TTCTTGACAG CATTCTCGTC ATCTCTGAGG АСЙТСйССАТ CATCTCAGGA TGRGSGGCAT GAAGCTSCTG LO O 150 GGGGCGCTGC TGGCACTGGC GGCCCTACTG CAGGGGGCCS ТОТСССТОЙЛ GATCGCAGCC ГГСААСАТСС !SD AGACATTTGG GGAGACCASG ATGTCCAATG CCACCCTCGT CAGCTACAT? GTGCAGATCC TGAGCCGCTA TGACATCGCC CTGGTCCASQ ДООТШЇАЄА CftGCCACCTG ftCTGCCGTGG GOAAGCTGCT GGACAACCTC зов 350 AATCAGGATG CACCAGACAC CTATCACTAC GTGGTCAGTG AGCCACTGGG ACGGAACAGC 450 TATAftGGAGC GCTACCTGTT CGTGTACAGG CCTGACCAGG TGTCTGCGGT £00 GGACAGCTAC TACTACGbTG ATGGCTGCGA GCCCTGCGCSG AACGACACCT S50 TCAACCGAGA GCCAGCCATT GTCAGGTTCT i r T C C C G G T T CACAGRGGTC 600 JBGGAGTTTG С С А Т Т а і Т Г С CCTGCATGCG GCCCCGGGGG ACGCAGTAGC 6S0 CGAGATCGAC 700 GCICFCTATS ACGTCTACCT GGATGTCCAA GAGAAATGGG GCT7GGAGGA CGTCSTGTTG ATGGGCSACT TCAATGCGGG CTGCAGCTUT 7Б0 QT43AGACCCT CiXAGTGGTC ATCCATCCGC CTaTOGACAA GCCCCftCCIT B00 CCAGTGGCTG ATCCCCGACA CACW3CTACA CCCftCGCACT 850 5TGCCTATGA САСКЗАТСЭКЗ GTTGCMOGA TGCTGCTCCG A G 3 C S C C « 3 T 500 SOSCTGACaC GTTCCCGACT CGECTCTTCC С И Т А Д С Т Г С CMGCTGCCT ATGGCCTGAG ЭЁО TGACCAACTG GCCCAAC3CCA ТОМЗТЕАССЬ CTATCCAGTG GAGGTGA-reC талАкгадос AGCCCCTCCC CACACC>T GARCTCCAG ЮЗЭ /2/ Информация для последовательности №3 /і/ Хараісгеристики последовательности /А/Длина 13 аминокислот /Б/ Тип аминокислота /В/Топология Линейная /хі/ Перечень последовательностей Последовательность №3 he Ala Ala Phe Asn he Gin Thr PheGlyGluThrLys 121 Информация для последовательности №4 /і/ Характеристики последовательности /А/ Длина 16 аминокислот /Б/ Тип аминокислота /В/ Топология линейная /J,XI/ Перечень последовательностей '^Последовательность №4 Met Ser Asn Ala Thr Leu Val Ser Тут he Val Gin he Leu Ser Arg 121 Информация для последовательности №5 /і/ Характеристики последовательности /А/Длина 16 аминокислот /Б/Тип аминокислота /В/Топология линейная /хі/ Перечень последовательностей Последовательность №5 Туг Asp he Ala Leu Val Gin Glu Val Arg 121 Информация для последовательности №6 /і/ Характеристики последовательности /А/ Длина 9 аминокислот /Б/ Тип аминокислота /В/ Топология линейная /хі/ Перечень последовательностей Последо 1000 26 вательность №6 Asp Ser His Leu Thr Ala Val Gly Lys 121 Информация для последовательности №7 /і/ Характеристики последовательности /А/ Длина 23 аминокислоты /Б/ Тип аминокислота /В/ Топология линейная /хі/ Перечень последовательностей Последовательность №7 Leu Leu Asp Asn Leu Asa Gin Asp Ala Pro Asp , Thr Tyr His Тут Val Val Ser Glu Pro Leu Gly Arg 121 Информация для последовательности № 8 /і/ Характеристики последовательности /А/ Д л и н а 4 аминокислоты /Б/ Тип аминокислота /В/ Топология линейная /хі/ Перечень последовательностей Последовательность № 8 Asn Ser Тут Lys 121 Информация для последовательности № 9 /і/ Характеристики последовательности /А/ Д л и н а 3 2 аминокислоты /Б/ Тип аминокислота /В/ Топология линейная /хі/ Перечень последовательностей Последовательность № 9 Туг Leu Phe Val Туг Arg Pro Asp Gin Val Ser Ala Val Asp Ser Туг Туг Туг Asp Asp Gly Cys Glu Pro Cys Gly Asn Asp Thr Phe Asn, Arg 121 Информация для последовательности № 1 0 /і/ Характеристики последовательности /А/ Д л и н а 6 аминокислот /Б/ Тип аминокислота /В/ Топология линейная /хі/ Перечень последовательностей Последовательность № 1 0 Glu Pro Ala he Val Arg 121 Информация для последовательности №11 /і/ Характеристики последовательности /А/ Д л и н а 4 аминокислоты /Б/Тип, аминокислота /В/ Топология линейная /хі/ Перечень последовательностей Последовательность №11 Phe Phe Ser Arg 121 Информация для последовательности № 1 2 /і/ Характеристики последовательности /А/ Д л и н а 5 аминокислот /Б/ Тип аминокислота /В/ Топология линейная /хі/ Перечень последовательностей Последовательность №12 P h e T h r Glu Val Arg 121 Информация для последовательности № 1 3 /і/ Характеристики последовательности /А/Длина 31 аминокислота /Б/ Тип аминокислота /В/ Топология линейная /хі/ Перечень последовательностей Последовательность № 1 3 Glu Phe Ala he Val Pro Leu His Ala Ala Pro Gly Asp Ala Val Ala Glu he Asp Ala Leu Tyr Asp Val Tyr Lau Asp Val Gin Glu Lys 121 Информация для последовательности № 1 4 /і/ Характеристики последовательности /А/ Д л и н а 28 аминокислот /Б/ Тип аминокислота /В/ Топология линейная /хі/ Перечень последовательностей последова 27 46693 28 /Б/ Тип аминокислота /В/ Топология линейтельность №14 ная Trp Gly Leu Glu Asp Val Met Leu Met Gly Asp Phe Asn Ala Gly Cys Ser Тут Val Arg Pro Ser Gin Trp /хі/ Перечень последовательностей последоваSer Ser he Arg тельность № 1 6 he Val Val Ala Gly Met Leu Leu Arg 121 Информация для последовательности №15 /і/ Хараісгеристики последовательности 121 Информация для последовательности № 17 /і/ Характеристики последовательности /А/ Длина 28 аминокислот IN Длина 38 аминокислот /Б/ Тип аминокислота /Б/ Тип аминокислота /В/ Топология линейная /хі/ Перечень последовательностей Последо/В/ Топология линейная вательность №15 Leu Trp Thr Ser Pro Thr Phe /xi/ Перечень последовательностей ПоследоGin Trp Leu Це Pro Asp Ser Ala Asp Thr Thr Ala вательность № 1 7 Gly Ala Val Val Pro Asp Ser Ala Thr Pro Thr His Cys Ala Tyr Asp Arg Leu Pro Phe Asn Phe Gin Ala Ala Tyr Gly Leu Ser 121 Информация для последовательности №16 Asp Gin Leu Ala Gin Ala he Ser Asp His Tyr Pro Val /і/ Характеристики последовательности Glu Val Met Leu Lys /А/ Длина 9 аминокислот 1 TCCTGCACAG GCAGTGCCTT GAAGTGCTTC ITTCAGAGACC ТТТСГГГСАТА AGCACGTGTC CGTCACGGAA CTTCACGAAG AAGTCTCTGG AAAGAAGTAt 1 SerCyslhrG iySerAlaLe uLysCysPhe PheArgAspL euSerSexAM 101 ATAfTCCAGA TTCTTGACAG CATTCTCGTC AtCTCTGAGG ACATCACCAT TATAAGGTCT AAGAACTGTC GTAAGAGCAG TAGAGACTCC TGTAGTGGTA 35 IleProAs pSerOP*GIs HisSerArgH isLeuOP*Gl yHisHisHis 201 GGCCCTACTG CAGGGGGCCG TGTCCCTGAA GATCGCAGCC TTCAACATCC CCGGGATGAC GTCCCCCGGC ACAGGGACTT CTAGCGTCGG AAGTTGTAGG 68 AlabeuLeu GlnGlyAlaV alSerbeuLy sIleAlaAla PheAsnlleG 301 GTGCAGATCC TGAGCCGCTA TGACATCGCC CTGGTCCAGG AGG1CAGAGA CACGTCTAGG ACTCGGCGAT ACTGTAGCGG GACCAGGTCC TCCAGTCTCT 101 VailGlnlleb euSerArgTy rAspIleAla LeuValGlnG XuValArgAs 401 CACCAGACAC CTATCACTAC GTGGTCAGTG AGCCACTGGG ACGGAACAGC GIGGTCTGTG GAtAGtGAfG CACCAGTCAC TCGGTGACCC TGCCTTGTCG 135 ProAspTh rTyrHisTyr VaiValSerG luProbeuGl yArgAsnSer 501 GGACAGCtAC TACTACGATG ATGGCTCCGA GCCCTGCGGG AACGACACCT CCTGTCGATG ATGATGCTAC TACCGACGCT CGGGACGCCC TTGCTGTGGA 168 AspSerTfr TyrTytAspA spGlyCysGl uProCysGly AsnAspThrP AGGGAGTTTG CCATTGTTCC CCTGCATGCG GCCCCGGGGG ACCGAGTAGC TCCCTCAAAC GGTAACAAGG GGACGTACGC CGGGGCCCCC TGGOTCATCG 201 ArgGiuPheA lalleValPr oLeuHisAla AlaProGlyA spArgValAl 701 GCTTGGAGGA CGTCAfGTTG ATGGGCGACT SCAATGCGGC CTGCAGCTAT CGAACCTCCT GCAGTACAAC TACCCGCTGA AGT3ACGCCC GACGTCGATA 235 LeuGluAs pVaiMetLeu HetGlyAspP heAsnAlaGl yCysSerTyr 801 CCAGTGGCfG ATCCCCGACA GCGCTGACAC CACAGCTACA CCCACGCACT GGTCACCGAC 2AGGGGCTGT CGCGACTGTG GTGTCGATGT GGGTGCGTGA 268. GlnTrpLeu IlePxoAspS erAlaAspIh rThrAlaThr ProfhrHisC 901 GTTCCCGACT CGGCTCTTCC CTTTAACTTC CAGGCTGCCT ATGGCCTGAG CAAGGGCTGA GCCGAGAAGG GAAATTGAAG GTCCGACGGA i;ACCGGACTC 301 YalProAspS erAlaLeuPr oPheAsnPhe GlnAlaAlaT yrGlyLeuSe 1001 TGAACbGAGC AGCCCCTCCC CACACCAGTT GAACTGCAG ACXTCftOTCG TCGGGGAGGG GTGTGGTCAA CTTGACGTC 335 Ьуфр*А1 aAlaProPro HisThrSerO P*ThrAla Фіг. 1а 29 46693 GACTACTTTT TTTTCTTTAA GCAGCAAAAG GAGAAAATTG TCATCAAAGG CTGATGAAAA AAAAGAAATT CGTCGTTTTC СЇСЇЇЇЇААС AGTAGTTTCC «ТЬгТЬгРЬе P h e S e r L e u S e r S e r L y s A r gArgLysLeu S e r S e r L y s A s p CATCTCACGJA"" TGJftGGGGdAT~G>AGCTGCTG GGGGCGCTGC TGGCACTGGC GTAGAGTCCS ACTCCCCGTA CTTCGACGAC CCCCGCGACG ACCGTGACCG HisLeuArgW etArgGlyMe AGACATTTGG GGAGACCAAG ATGTCCAATG CCACCCTCGt CAGCIACATT TCTGTAMCC CCTCTGGTTC TACAGGTTAC GGTGGGAGCA GTCGATGTAA lnlhrPheGl yGlulhrLys HetserAsnA laThrieuVs lSerTyrlle CAGCCACCTG ACIGCCGTGG GGAAGCTGCT GGACAACCTC AATCAGGATG GTCGGTGGAC TGACGGCACC CCTTCGACGA CCTGTfGGAG rTAGTCCTAC pSerHisLeu ThrAlayalG ayiysbeiiLe uAspAsnLeu AsnGlnAspAia TATAACGAGC GCTACCTGTT CGTGTACAGG CCTGACCAGG TGtCTGCGGT A2ATTCCTCG CGA1GGACAA GCACATGTCC GGACTGGTCC ACAGACGCCA TyrLysGluA rgTyrLeuPh eValTyrArg ProAspGlnV alSerAlaVal TCAACCGAGS GCCAGCCATT G^CAGGDTCT TCTCCCGGTT CACAGAGGTC AG1TGGCTCT CGGTCGGTAA CAGTCCAAGA AGAGCGCCAA GXGTCTCCAG heAsnArgGl uProAlalle ValArgPhe? heSerArgPh eThrGluVai CGAGATCGAC GCTCTCTATG ACGTCTACCT GGATGTCCAA GAGAAATGGG GCTCTAGCTG CGAGAGATAC TGCAGATGGA CCTACAGGTT CTC1TTACCC sCluUeAsp AlaLeuTyrA spVaXTyrLe uAspValGln GXuLysTrpGly GTGAGACCCT CCCAGTGGTC ATCCATCCGC CTGTGGACAA GCCCCACCfT CACTCTGGGA GGGICACCAG TAGGTAGGCG GACACCTGTT CGGGGTGGAA valArgProS erGIflTrpSe rSerlleArj LeuTrpThxS erProThrPhe GTGCCTATGA CAGGATCGTG GTTGCAGGGA TGCTGCTCCG AGGCGCCGTT CACGGATACT GTCCTAGCAC CAACGTCCCT ACGACGAGGC TCCGCGGCAA pArglleVal ValAlaGly^I etbeuLeuAx gGXyAlaVal TGACCAACTG GCCCAAGCCA TCAGTGACCA CTATCCAGTG GAGGTGATGC ACtCGTTGAC CGGGTTCGGT AGTCACTGGT GATAGGTCAC CTCCACTACG r A s p G l n L e u A l a G l n A l a l l e S e r A s p H i s T y r P r o V a l GluValMetLeu ФІГ. 16 Фіг. 2 Фіг. З 30 31 32 46693 ЄНІ 1 СИ It L '•Ц-G-C-N-C-C-M-G С r KCC-NCC-MC G \ I О CHZ < О L. _ -ftSfi -Зй-і ТЭ re75 NH I снг снг сн I I снг о снг •к с-с м-с-снг с N-* с О Фіг. 4 Фіг. 5 ФІГ.6 СштО О 33 46693 Фіг. 7 Фіг. 8 Фіг. 9 34 35 46693 36 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044) 456 - 20 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 15/09, A61P 11/00, C07K 14/47, C07K 1/22, C12N 9/16, C12N 9/22, C07K 1/18, A61K 38/45
Мітки: недезамідована, днказ, днк, людська, фармацевтична, днказа, варіанти, дезамідована, людських, розділення, дезамідованої, людської, композиція, зберігання, недезамідованої, спосіб, очищена
Код посилання
<a href="https://ua.patents.su/18-46693-sposib-rozdilennya-dezamidovano-ta-nedezamidovano-lyudskikh-dnkaz-ochishhena-dezamidovana-lyudska-dnkaza-ochishhena-nedezamidovana-lyudska-dnkaza-farmacevtichna-kompoziciya-variant.html" target="_blank" rel="follow" title="База патентів України">Спосіб розділення дезамідованої та недезамідованої людських днказ, очищена дезамідована людська днказа, очищена недезамідована людська днказа, фармацевтична композиція (варіанти), спосіб зберігання людської днк</a>
Попередній патент: Спосіб керування доступом станції даних до мобільних носіїв даних, мобільний носій даних, станція даних і система для здійснення способу
Наступний патент: Кон’югат між суперантигеном дикого типу, який був модифікований, та частиною молекули, що відшукує мішень
Випадковий патент: Автономна дістанційно керована транспортна модульна платформа супроводження повітряного десанту