Заміщені імідазопіридини
Формула / Реферат
1. Сполука формули (І)
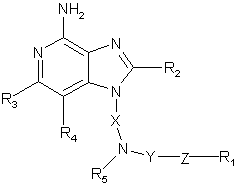 ,(I)
,(I)
де Х означає алкілен або алкенілен;
Y означає -CO-, -CS- або -SO2-;
Z означає зв'язок, -O-, -S- або -NR5-;
R1 означає арил, гетероарил, гетероцикліл, С1-20-алкіл або С2-20-алкеніл, кожний з яких може бути незаміщеним або заміщеним одним або декількома замісниками, незалежно вибраними з групи, яка складається з:
алкілу;
алкенілу;
арилу;
гетероарилу;
гетероциклілу;
заміщеного циклоалкілу;
-O-алкілу;
-O-(алкіл)0-1-арилу;
-O-(алкіл)0-1-гетероарилу;
-O-(алкіл)0-1-гетероциклілу;
-СООН;
-СО-O-алкілу;
-СО-алкілу;
-S(O)0-2-алкілу;
-S(O)0-2-(алкіл)0-1-арилу;
-S(O)0-2-(алкіл)0-1-гетероарилу;
-S(О)0-2-(алкіл)0-1-гетероциклілу;
(алкіл)0-1-N(R5)2;
(алкіл)0-1-NR5-СО-О-алкілу;
(алкіл)0-1-NR5-СО-алкілу;
(алкіл)0-1-NR5-СО-арилу;
(алкіл)0-1-R5-СО-гетероарилу;
-N3;
галогену;
галоалкілу;
галоалкокси;
-СО-галоалкілу;
-СО-галоалкокси;
-NO2;
-CN;
-ОН;
-SH; і у випадку алкілу, алкенілу та гетероциклілу, оксо;
R2 вибраний з групи, яка складається з:
водню;
алкілу;
алкенілу;
алкіл-O-алкілу;
алкіл-S-алкілу;
алкіл-O-арилу;
алкіл-S-арилу;
алкіл-O-алкенілу;
алкіл-S-алкенілу і
алкілу або алкенілу, заміщених одним або декількома замісниками, вибраними з групи, яка складається з:
-ОН;
галогену;
-N(R5)2;
-CO-N(R5)2;
-CS-N(R5)2;
-SO2-N(R5)2;
-NR5-CO-C1-10-алкілу;
-NR5-CS-C1-10-алкілу;
-NR5-SO2-C1-10-алкілу;
-СО-С1-10-алкілу;
-CO-O-C1-10-алкілу;
-N3;
арилу;
гетероарилу;
гетероциклілу;
-СО-арилу та
-СО-гетероарилу;
R3 та R4 незалежно вибрані з групи, яка складається з алкілу, алкенілу, галогену, алкокси, аміно, алкіламіно, діалкіламіно та алкілтіо; і
кожний R5 означає незалежно Н або С1-10-алкіл;
або їх фармацевтично прийнятна сіль.
2. Сполука або сіль за п. 1, в якій Y означає -СО-.
3. Сполука або сіль за п. 1, в якій Y означає -CO- і Z є зв'язком.
4. Сполука або сіль за п. 3, в якій R1 означає алкіл, арил або заміщений арил.
5. Сполука або сіль за п. 1, в якій Y означає -CS-.
6. Сполука або сіль за п. 1, в якій Y означає -CS-, а Z означає -NR5-.
7. Сполука або сіль за п. 6, в якій R5 означає Н і R1 означає арил або заміщений арил.
8. Сполука або сіль за п. 1, в якій Y означає -SO2-.
9. Сполука або сіль за п. 1, в якій Y означає -SO2- і Z є зв'язком.
10. Сполука або сіль за п. 9, в якій R1 означає алкіл, арил або заміщений арил.
11. Сполука або сіль за п. 10, в якій R1 означає алкіл.
12. Сполука або сіль за п. 1, в якій Y означає -SO2-, і Z означає -NR5-.
13. Сполука або сіль за п. 12, в якій R5 означає алкіл і R1 означає алкіл.
14. Сполука або сіль за п. 1, в якій R2 означає Н, алкіл або алкіл-O-алкіл.
15. Сполука або сіль за п. 1, в якій Х означає -(СН2)2-4-.
16. Сполука або сіль за п. 1, в якій R3 та R4 означають незалежно Н або алкіл.
17. Сполука згідно з пунктом 1, вибрана з групи, до складу якої входять:
N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5-с]піридин-1-іл)бутил]бензамід;
N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5-с]піридин-1-іл)бутил]метансульфонамід;
N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5-с]піридин-1-іл)бутил]фторбензолсульфонаміду моногідрат;
N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5-с]піридин-1-іл)бутил]-N'-фенілтіосечовини моногідрат;
N'-[4-(4-aмiнo-2-бyтил-6,7-димeтил-1H-iмiдaзo[4,5-c]пipидин-1-iл)бyтил]-N,N-диметилсульфамід;
N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5-с]піридин-1-іл)бутил]-N'-фенілсечовина;
N-[4-(4-аміно-2,6,7-триметил-1H-імідазо[4,5-с]піридин-1-іл)бутил]метансульфонамід;
N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5-с]піридин-1-іл)бутил]-4-[[2-(диметиламіно)етокси](феніл)метил]бензамід і
N-{4-[4-аміно-2-(етоксиметил)-6,7-диметил-1Н-імідазо[4,5-с]піридин-1-іл]бутил}метансульфонамід;
або її фармацевтично прийнятна сіль.
18. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за п. 1 в комбінації зфармацевтично прийнятним носієм.
19. Фармацевтична композиція за пунктом 18, яка містить терапевтично ефективну кількість сполуки за п. 9 в комбінації з фармацевтично прийнятним носієм.
20. Фармацевтична композиція за пунктом 18, яка містить терапевтично ефективну кількість сполуки за п. 17 в комбінації з фармацевтично прийнятним носієм.
21. Спосіб індукування біосинтезу цитокіну у тварини, що полягає у введенні тварині терапевтично ефективної кількості сполуки згідно з пунктом 1.
22. Спосіб індукування біосинтезу цитокіну у тварини за пунктом 21, що полягає у введенні тварині терапевтично ефективної кількості сполуки згідно з пунктом 9.
23. Спосіб індукування біосинтезу цитокіну у тварини за пунктом 21, що полягає у введенні тварині терапевтично ефективної кількості сполуки згідно з пунктом 17.
24. Спосіб лікування вірусного захворювання у тварини, що полягає у введенні тварині терапевтично ефективної кількості сполуки згідно з пунктом 1.
25. Спосіб лікування вірусного захворювання у тварини за пунктом 24, що полягає у введенні тварині терапевтично ефективної кількості сполуки згідно з пунктом 9.
26. Спосіб лікування вірусного захворювання у тварини за пунктом 24, що полягає у введенні тварині терапевтично ефективної кількості сполуки згідно з пунктом 17.
27. Спосіб лікування неопластичного захворювання у тварини, що полягає у введенні тварині терапевтично ефективної кількості сполуки згідно з пунктом 1.
28. Спосіб лікування неопластичного захворювання у тварини за пунктом 27, що полягає у введенні тварині терапевтично ефективної кількості сполуки згідно з пунктом 9.
29. Спосіб лікування неопластичного захворювання у тварини за пунктом 27, що полягає у введенні тварині терапевтично ефективної кількості сполуки згідно з пунктом 17.
30. Сполука формули (II):
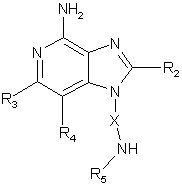 ,(II)
,(II)
в якій: Х означає алкілен або алкенілен;
R2 вибраний з групи, яка складається з:
водню;
алкілу;
алкенілу;
алкіл-O-алкілу;
алкіл-S-алкілу;
алкіл-O-арилу;
алкіл-S-арилу;
алкіл-O- алкенілу;
алкіл-S- алкенілу та
алкілу або алкенілу, заміщених одним або декількома замісниками, вибраними з групи, яка складається з:
-ОН;
галогену;
-N(R5)2;
-CO-N(R5)2;
-CS-N(R5)2;
-SO2-N(R5)2;
-NR5-CO-C1-10-алкілу;
-NR5-CS-C1-10-алкілу;
-NR5-SO2-C1-10-алкілу;
-СО-С1-10-алкілу;
-СО-O-С1-10-алкілу;
-N3;
арилу;
гетероарилу;
гетероциклілу;
-СО-арилу та
-СО-гетероарилу;
R3 та R4 незалежно вибрані з групи, яка складається з алкілу, алкенілу, галогену, алкокси, аміно, алкіламіно, діалкіламіно та алкілтіо; і
кожний R5 означає незалежно Н або С1-10-алкіл;
або її фармацевтично прийнятна сіль.
Текст
1. Сполука формули (І) NH2 C2 2 (19) 1 3 74593 4 алкілу або алкенілу, заміщених одним або декільN-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5кома замісниками, вибраними з групи, яка складас]піридин-1-іл)бутил]-N'-фенілсечовина; ється з: N-[4-(4-аміно-2,6,7-триметил-1H-імідазо[4,5-ОН; с]піридин-1-іл)бутил]метансульфонамід; галогену; N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5-N(R5)2; с]піридин-1-іл)бутил]-4-[[2-CO-N(R5)2; (диметиламіно)етокси](феніл)метил]бензамід і -CS-N(R5)2; N-{4-[4-аміно-2-(етоксиметил)-6,7-диметил-1Н-SO2-N(R5)2; імідазо[4,5-с]піридин-1-NR5-CO-C1-10-алкілу; іл]бутил}метансульфонамід; -NR5-CS-C1-10-алкілу; або її фармацевтично прийнятна сіль. -NR5-SO2-C1-10-алкілу; 18. Фармацевтична композиція, яка містить тера-СО-С1-10-алкілу; певтично ефективну кількість сполуки за п. 1 в -CO-O-C1-10-алкілу; комбінації з фармацевтично прийнятним носієм. -N3; 19. Фармацевтична композиція за пунктом 18, яка арилу; містить терапевтично ефективну кількість сполуки гетероарилу; за п. 9 в комбінації з фармацевтично прийнятним гетероциклілу; носієм. -СО-арилу та 20. Фармацевтична композиція за пунктом 18, яка -СО-гетероарилу; містить терапевтично ефективну кількість сполуки R3 та R4 незалежно вибрані з групи, яка складаза п. 17 в комбінації з фармацевтично прийнятним ється з алкілу, алкенілу, галогену, алкокси, аміно, носієм. алкіламіно, діалкіламіно та алкілтіо; і 21. Спосіб індукування біосинтезу цитокіну у твакожний R5 означає незалежно Н або С1-10-алкіл; рини, що полягає у введенні тварині терапевтично або їх фармацевтично прийнятна сіль. ефективної кількості сполуки згідно з пунктом 1. 2. Сполука або сіль за п. 1, в якій Y означає -СО-. 22. Спосіб індукування біосинтезу цитокіну у тва3. Сполука або сіль за п. 1, в якій Y означає -CO- і рини за пунктом 21, що полягає у введенні тварині Z є зв'язком. терапевтично ефективної кількості сполуки згідно з 4. Сполука або сіль за п. 3, в якій R1 означає алкіл, пунктом 9. арил або заміщений арил. 23. Спосіб індукування біосинтезу цитокіну у тва5. Сполука або сіль за п. 1, в якій Y означає -CS-. рини за пунктом 21, що полягає у введенні тварині 6. Сполука або сіль за п. 1, в якій Y означає -CS-, а терапевтично ефективної кількості сполуки згідно з Z означає -NR5-. пунктом 17. 7. Сполука або сіль за п. 6, в якій R5 означає Н і R1 24. Спосіб лікування вірусного захворювання у означає арил або заміщений арил. тварини, що полягає у введенні тварині терапев8. Сполука або сіль за п. 1, в якій Y означає -SO2-. тично ефективної кількості сполуки згідно з пунк9. Сполука або сіль за п. 1, в якій Y означає -SO2- і том 1. Z є зв'язком. 25. Спосіб лікування вірусного захворювання у 10. Сполука або сіль за п. 9, в якій R1 означає алтварини за пунктом 24, що полягає у введенні твакіл, арил або заміщений арил. рині терапевтично ефективної кількості сполуки 11. Сполука або сіль за п. 10, в якій R1 означає згідно з пунктом 9. алкіл. 26. Спосіб лікування вірусного захворювання у 12. Сполука або сіль за п. 1, в якій Y означає -SO2тварини за пунктом 24, що полягає у введенні тва, і Z означає -NR5-. рині терапевтично ефективної кількості сполуки 13. Сполука або сіль за п. 12, в якій R5 означає згідно з пунктом 17. алкіл і R1 означає алкіл. 27. Спосіб лікування неопластичного захворюван14. Сполука або сіль за п. 1, в якій R2 означає Н, ня у тварини, що полягає у введенні тварині тераалкіл або алкіл-O-алкіл. певтично ефективної кількості сполуки згідно з 15. Сполука або сіль за п. 1, в якій Х означає пунктом 1. (СН2)2-4-. 28. Спосіб лікування неопластичного захворюван16. Сполука або сіль за п. 1, в якій R3 та R4 ознаня у тварини за пунктом 27, що полягає у введенні чають незалежно Н або алкіл. тварині терапевтично ефективної кількості сполуки 17. Сполука згідно з пунктом 1, вибрана з групи, до згідно з пунктом 9. складу якої входять: 29. Спосіб лікування неопластичного захворюванN-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5ня у тварини за пунктом 27, що полягає у введенні с]піридин-1-іл)бутил]бензамід; тварині терапевтично ефективної кількості сполуки N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5згідно з пунктом 17. с]піридин-1-іл)бутил]метансульфонамід; 30. Сполука формули (II): N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5с]піридин-1-іл)бутил]фторбензолсульфонаміду моногідрат; N-[4-(4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5с]піридин-1-іл)бутил]-N'-фенілтіосечовини моногідрат; N'-[4-(4-aмiнo-2-бyтил-6,7-димeтил-1H-iмiдaзo[4,5c]пipидин-1-iл)бyтил]-N,N-диметилсульфамід; 5 NH2 N N R2 N R3 X R4 NH R5 ,(II) в якій: Х означає алкілен або алкенілен; R2 вибраний з групи, яка складається з: водню; алкілу; алкенілу; алкіл-O-алкілу; алкіл-S-алкілу; алкіл-O-арилу; алкіл-S-арилу; алкіл-O- алкенілу; алкіл-S- алкенілу та алкілу або алкенілу, заміщених одним або декількома замісниками, вибраними з групи, яка складається з: -ОН; Цей винахід стосується імідазопіридинових сполук, що мають заміщену аміногрупу в положенні 1, та фармацевтичних композицій, що містять такі сполуки. Додатковий аспект цього винаходу стосується використання цих сполук як імуномодуляторів для індукції синтезу цитокінів у тварин, та при лікуванні захворювань, включаючи вірусні та неопластичні захворювання.. Перший достовірний звіт стосовно 1Німідазо[4,5-с]хінолінової кільцевої системи, Backman et al., J.Org.Chem. 15, 1278-1284 (1950) описує синтез 1-(6-метокси-8-хінолініл)-2-метил1Н-імідазо[4,5-с]хіноліну для можливого застосування як антималярійного агенту. Згідно з цим, були описані синтези різноманітних заміщених 1Німідазо[4,5-с]хінолінів. Наприклад, Jain et al., J. Med. Chem. 11, pp. 87-92 (1968) синтезували 1-[-2(4-піперидил)етил]-1Н-імідазо[4,5-с]хінолін як можливий протисудомній та кардіоваскулярний агент. Також, Baranov et al., Chem.Abs. 85, 94362 (1976) повідомили про декілька 2-оксоімідазо[4,5с]хінолінів, а Berenyi et al., J. Heterocyclic. Chem. 18, 1537-1540 (1981) повідомили про декілька окремих 2-оксоімідазо[4,5-с]хінолінів. Пізніше були знайдені деякі 1Н-імідазо[4,5с]хінолін-4-аміни та 1- та 2-заміщені похідні, що є корисними як антивіруси) агенти, бронходилатори та імуномодулятори. Вони описані в, infer аliа, в патентах США №4,689,338; 4,698,348; 4,929,624; 5,037,986; 5,268,376; 5,346,905; 5,389,640, всі з яких включені сюди як посилання. Сполуки заміщеного 1H-імідазопіридин-4аміну, що є придатними як модифікатори імунної відповіді, описані в патентах US №№.5,446,153; 5,494,916 та 5,644,063. Сполуки, описані в цих 74593 6 галогену; -N(R5)2; -CO-N(R5)2; -CS-N(R5)2; -SO2-N(R5)2; -NR5-CO-C1-10-алкілу; -NR5-CS-C1-10-алкілу; -NR5-SO2-C1-10-алкілу; -СО-С1-10-алкілу; -СО-O-С1-10-алкілу; -N3; арилу; гетероарилу; гетероциклілу; -СО-арилу та -СО-гетероарилу; R3 та R4 незалежно вибрані з групи, яка складається з алкілу, алкенілу, галогену, алкокси, аміно, алкіламіно, діалкіламіно та алкілтіо; і кожний R5 означає незалежно Н або С1-10-алкіл; або її фармацевтично прийнятна сіль. патентах, не мають в 1-ому положенні замісника, що містить аміногрупу. Певні 1H-імідазо[4,5с]хінолін-4-аміни, що містять амідні, сульфонамідна та сечовинні групи в 1-ому положенні, описані в РСТ заявках з номерами публікації WO 00/76505, WO 00/76518 і WO 00/76519. Не зважаючи на недавнішнє одержання сполук, що є корисними як модифікатори імунної відповіді, все ще існує потреба у сполуках, що мають здатність модулювати імунну відповідь, шляхом індукції біосинтезу цитокінів або інших механізмів. Нами було виявлено новий клас сполук, що є корисними для індукції біосинтезу цитокінів у тварин. Відповідно, цей винахід забезпечує сполуки імідазопіридин-4-аміну, що мають заміщену аміногрупу у положенні 1. Сполуки, які, як було виявлено, є корисними індукторами біосинтезу цитокінів, визначаються Формулою (l), яка більш детально описується нижче. Формула (l) представлена як наступна: 7 де X, Y, Z, R1, R2, R3, R4 та R5 є такими, як визначено тут. Сполуки Формули (l) є корисними як модифікатори імунної відповіді завдяки своїй здатності індукувати біосинтез цитокінів і, таким чином, модулювати імунну відповідь при введенні тваринам. Це робить ці сполуки корисними при лікуванні різних станів, таких, як вірусні захворювання та пухлини, що є чутливими до таких змін в імунній відповіді. Винахід також охоплює фармацевтичні композиції, що містять сполуки, що модифікують імунну відповідь, та способи індукції біосинтезу цитокінів у тварини, лікування вірусної інфекції у тварини і/або лікування неопластичного захворювання у тварини шляхом введення сполуки Формули (l) тварині. Крім того, винахід охоплює способи синтезу сполук згідно з винаходом та проміжні сполуки, що є корисними у синтезі вищезгаданих сполук. Як згадувалося раніше, нами було виявлено, що певні сполуки викликають біосинтез цитокінів та модифікують імунну відповідь у тварин. Такі сполуки представлені нижче формулою (l): де X означає алкілен або алкенілен; Υ означає -CO-, -CS- або -SO2-; Ζ означає зв'язок, -О-, -S- або –NR5-; R1 означає арил, гетероарил, гетероцикліл, С120 алкіл або С2-20 алкеніл, кожний з яких може бути незаміщеним або заміщеним одним або декількома замісниками, незалежно вибраними з групи, яка складається з: -алкілу; -алкенілу; -арилу; -гетероарилу; 74593 8 -гетероциклілу; -заміщеного циклоалкілу; -О-алкіл; -O-(алкіл)0-1-арилу; -O-(алкіл)0-1-гетероарилу; -O-(алкіл)0-1-гетероциклілу; -СООН; -СО-О-алкілу; -СО-алкілу; -S(O)0-2-алкілу; -S(O)0-2-(алкіл)0-1-арилу; -S(O)0-2-(алкіл)0-1-гетероарилу; -S(O)0-2-(алкіл)0-1-гетероциклілу; -(алкіл)0-1-N(R5)2; -(алкіл)0-1-NR5-СО-О-алкілу; -(алкіл)0-1-NR5-CO-aлкілу; -(алкіл)0-1-NR5-CO-арилу; -(алкіл)0-1-NR5-СО-гетероарилу; -N3; -галогену; -галоалкілу; -галоалкокси; -СО-галоалкілу; -СО-галоалкокси; -NO2,-CN; -ОН; -SH; і у випадку алкілу, алкенілу та гетероциклілу, оксо; R2 вибраний з групи, яка складається з: -водню; алкілу; -алкенілу; -алкіл-О-алкілу; -алкіл-S-алкілу; -алкіл-О-арилу; -алкіл-S-арилу; -алкіл-О-алкенілу; -алкіл-S-алкенілу; і -алкілу або алкенілу, заміщених одним або декількома замісниками, вибраними з групи, яка складається з: -ОН; -галогену; -N(R5)2; -CO-N(R5)2; -CS-N(R2)2; -SO2-N(R5)2; -NR5-CO-C1-10 алкілу; -NR5-CS-C1-10 алкілу; -NR5-SO2-C1-10 алкілу; -СО-С1-10 алкілу; -СО-О-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; -СО-арил; та -СО-гетероарилу; N3 та R4 незалежно вибрані з групи, яка складається з алкілу, алкенілу, галогену, алкокси, аміно, алкіламіно, діалкіламіно та алкілтіо; і кожний R5 означає незалежно Η або С1-10 алкіл; або їх фармацевтично прийнятна сіль. Одержання сполук Сполуки згідно з винаходом можуть бути оде 9 74593 10 ржані відповідно до Реакційної схеми l, в якій R1, во може застосовуватись каталізатор, такий як, R2, R3, R4, R5, Χ, Υ та Ζ є такими, як визначено випіридингідрохлоид. ще, Вn означає бензил і R' означає алкіл, що має Альтернативно сполука формули XV може бувід одного до чотирьох атомів вуглецю, перфторати одержана у дві стадії (а) взаємодією діаміну лкіл з кількістю вуглецевих атомів від одного до формули Хlll з галоїдангідридами формули чотирьох, феніл або феніл, заміщений галогеном R2C(O)Cl або R2C(O)Br з одержанням сполуки фоабо алкілом, що має від одного до чотирьох атомів рмули XlV і наступною (b) циклизацією. На стадії вуглецю. (4а) галоїдангідрид додають до розчину діаміну в На стадії (1) Реакційної схеми l 3-нітропіридинінертному розчиннику, такому як, ацетонітрил, пі2,4-дисульфонат формули X реагує з аміном форридин або дихлорметан. Реакція може бути промули R1-Z-Y-N(R5)-X-NH2 з одержанням 3-нітро-4ведена при температурі оточуючого середовища. амінопіридин-2-сульфонату формули Xl. Внаслідок На стадії (4b) продукт стадії (4а) нагрівають в присутності двох сульфонатних груп, які, в принспиртовому розчиннику в присутності основи. Пеципі, можуть бути замінені, в результаті реакції реважно продукт стадії (4а) кип'ятять у метанолі в може утворюватися суміш продуктів, які можуть присутності надлишку триетиламіну або нагрівабути легко розділені з використанням стандартних ють з метанольним розчином аміаку. Альтернатиметодик, таких як, колонкова хроматографія. вно стадія (4b) може бути проведена нагріванням Реакцію переважно проводять додаванням продукту стадії (4а) у піридині. Якщо стадію (4а) аміну до розчину сполуки формули X в придатнобуло проведено у піридині, стадія (4b) може бути му розчиннику, такому як, дихлорметан в присутпроведена нагріванням реакційної суміші після ності третинного аміну, такого як, триетиламін. того, як аналіз показує, що стадія (4а) завершена. Оскільки сульфонатна група є групою, що відносно На стадії (5) Реакційної схеми l 4легко відходить, реакція може відбуватися при дибензиламіно-1H-імідазо[4,5-с]піридин формули низькій температурі (0°С) для того, щоб зменшити XV піддають гідрогенолізу з одержанням 4-амінокількість небажаних 2-амінованого та 2,41H-імідазо[4,5-с]піридину формули l. Переважно діамінованого побічного продуктів. 3-Нітропіридинсполуку формули XV нагрівають в мурашиній кис2,4-дисульфонати відомі і можуть бути легко оделоті в присутності гідроксиду паладію на вугіллі. ржані, використовуючи відомі методи синтезу, Продукт або його фармацевтично прийнятна сіль див., наприклад, Lindstom та ін, патент U.S. Νο.можуть бути виділені з використанням загальноп5,446,153 та джерела інформації, що цитуються рийнятих методів. там. На стадії (2) Реакційної схеми l 3-нітро-4амінопіридин-2-сульфонат формули Χl піддають взаємодії з дибензиламіном з одержанням 2дибензиламіно-3-нітроу-4-амін формули Хll. Реакцію проводять шляхом змішуванням сполуки формули Xl, дибензиламіну та третинного аміну, такого як, триетиламін, в інертному розчиннику, такому як, бензол, толуол або ксилол, та нагрівання отриманої суміші. На стадії (3) Реакційної схеми l нітрогрупа 2дибензиламіно-3-нітропіридин-4-аміну формули Хll відновлюють до аміногрупи. Відновлення переважно проводять, використовуючи NiB2, який утворюється in situ з борогідриду натрію та гідрату хлориду нікелю в метанолі. Реакція переважно проводять при температурі оточуючого середовища. На стадії (4) Реакційної схеми l 2дибензиламінопіридин-3,4-діамін формули Хlll піддають реакції з карбоновою кислотою або її еквівалентом з одержанням 4-дибензиламіно-1Hімідазо[4,5-с]піридин формули XV. Придатні еквіваленти карбонової кислоти включають ортоестери та 1,1-діалкоксиалкілалканоати. Карбонову кислоту або еквівалент вибирають таким чином, щоб вони забезпечували необхідний замісник R2 в сполуці формули XV. Наприклад, триетилортоформіат буде забезпечувати одержання сполуки, в якій R2 є воднем, а триетилортоацетат буде забезпечувати одержання сполуки, в якій R2 є метилом. Реакція може відбуватися у відсутності розчинника або в інертному розчиннику, такому як толуол. Реакція відбувається при достатньому нагріванні, щоб видалити будь-які спирт або воду, що утворюються як побічний продукт реакції. Необов'язко 11 Сполуки винаходу можуть бути одержані згідно з Реакційною схемою ll, в якій R1, R2, R3, R4, R5 та X є таким, як визначено вище, Вn означає бензил, ВОС означає трет-бутоксикарбоніл і W означає О або S. На стадії (1) Реакційної схеми ll амінозахисні групи 1Н-імідазо[4,5-с]піридину формули XVl видаляють, одержуючи 1Н-імідазо[4,5-с]піридин формули ll. Переважно розчин сполуки формули XVl в придатному розчиннику, такому як дихлорметан, обробляють трифторметилсульфоновою кислотою при температурі оточуючого середовища. Сполуки формули XVl можуть бути одержані з використанням методів синтезу, описаних на Реакційній схемі l. На стадії (1) 2,4-дисульфонат формули X піддають взаємодії з аміном формули BOC-NR5-X-NH2. Стадії 2-4 потім проводять як описано вище, отримуючи сполуку формули XVl, яка є підродом формули XV. На стадії (2а) Реакційної схеми ll, 1Hімідазо[4,5-с]піридин формули ll піддають взаємодії з хлорангідридом кислоти формули R1-C(O)Cl або з ангідридом кислоти формули R1-C(O)OC(O)R1 3 одержанням 1H-імідазо[4,5-с]піридин-1іламіду формули XVll, який є підродом формули l. Реакцію переважно проводять додаванням хлорангідриду кислоти або ангідриду кислоти до розчину сполуки формули Η в придатному розчиннику, такому як, дихлорметан або ацетонітрил, в прису 74593 12 тності основи, такої як, триетиламін. Реакція може відбуватися при зниженій температурі (0°С) або при температурі оточуючого середовища. Продукт або його фармацевтично прийнятна сіль можуть бути виділені з використанням загальноприйнятих методів. На стадії (2b) Реакційної схеми ll, 1Німідазо[4,5-с]піридин формули ll піддають взаємодії з ізоціанатом формули R1-N=C=O або з ізотіоціанатом формули R1-N=C=S, отримуючи 1Німідазо[4,5-с]піридин-1-іл сечовину або тіосечовину формули XVlll, яка є підродом формули l. Реакцію переважно проводять додаванням ізоціанату або ізотіоціанату до розчину сполуки формули ll в придатному розчиннику, такому як, дихлорметан, при зниженій температурі (0°С). Продукт або його фармацевтично прийнятна сіль можуть бути виділені з використанням загальноприйнятих методів. На стадії (2с) Реакційної схеми ll, 1Німідазо[4,5-с]піридин формули ll піддають взаємодії з сульфонілхлоридом формули R1-S(O)2Cl або сульфоновим ангідридом формули R 1S(O)2OS(O)2-R1 з одержанням 1Н-імідазо[4,5с]піридин-1-ілсульфонаміду формули ХlХ, який є підродом формули l. Реакцію переважно проводять додаванням сульфонілхлориду або сульфонового ангідриду до розчину сполуки формули ll в придатному розчиннику, такому як, дихлорметан, в присутності основи, такої як, триетиламін. Реакція може відбуватися при зниженій температурі (0°С) або при температурі оточуючого середовища. Продукт або його фармацевтично прийнятна сіль можуть бути виділені з використанням загальноприйнятих методів. Сполуки винаходу можуть бути одержані відповідно до Реакційної схеми lll, де R1, R2, R3, R4, R5 та X є такими, як визначено вище. На стадії (1) Реакційної схеми lll 1Hімідазо[4,5-с]піридин формули ll піддають взаємодії з сульфамоїлхлоридом формули R 1N(R5)S(O)2Cl, одержуючи 1Н-імідазо[4,5-с]піридин1-ілсульфамід формули XXl, який є підродом формули l. Переважно сульфамоїлхлорид додають до розчину сполуки формули ll в придатному розчиннику, такому як, 1,2-дихлоретан, в присутності основи, такої як, триетиламін. Реакція може відбу 13 74593 14 ватися при підвищеній температурі. Продукт або та джерела інформації, що цитуються в ньому. його фармацевтично прийнятна сіль можуть бути На стадії (2) Реакційної схеми lV 2,4-дихлор-3виділені з використанням загальноприйнятих менітропіридин формули ΧΧlll піддають взаємодії з тодів. аміном формули BOC-NR5-X-NH2, одержуючи 2Альтернативно сульфамід формули XXl може хлор-3-нітропіридин формули XXlV. Реакцію перебути одержаний у дві стадії (а) взаємодією 1Hважно проводять додаванням аміну до розчину імідазо[4,5-с]піридину формули ll з сульфурилхлосполуки формули ΧΧίΗ в придатному розчиннику, ридом з утворенням in situ сульфамоїлхлориду такому як, Ν,Ν-диметилформамід, в присутності формули XX та наступною (b) взаємодією сультретинного аміну, такого як, триетиламін. фамоїлхлориду з аміном формули R1-N(R5)H. На На стадії (3) Реакційної схеми lV 2-хлор-3стадії (la) реакція може бути проведена шляхом нітропіридин формули XXlV піддають взаємодії з додавання розчину сульфурилхлориду в дихлорфенолом, отримуючи 3-нітро-2-феноксипіридин метані до розчину сполуки формули і) в присутноформули XXV. Фенол піддають взаємодії з гідристі 1 еквіваленту 4-(диметиламіно)піридину. Реакдом натрію в придатному розчиннику, такому як, цію переважно проводять при зниженій диглім, з утворенням феноксиду. Потім феноксид температурі (-78°С). Необов'язково після того, як піддають взаємодії при підвищеній температурі зі додавання закінчено, реакційну суміш залишають сполукою формули XXlV. нагріватися до температури оточуючого середоНа стадії (4) Реакційної схеми lV 3-нітро-2вища. На стадії (lb) розчин, який містить 2 еквівафеноксипіридин формули XXV відновлюють з ленти R1-N(R5)H та 2 еквіваленти триетиламіну в одержанням 3-аміно-2-феноксипіридину формули дихлорметані, додають до реакційної суміші зі XXVl. Відновлення переважно проводять з використадії (lа). Реакцію переважно проводять при знистанням загальноприйнятого каталізатора гетероженій температурі (-78°С). Продукт або його фаргенного гідрування, такого як, платина на вугіллі мацевтично прийнятна сіль можуть бути виділені з або паладій на вугіллі. Реакція може бути зручним використанням загальноприйнятих методів. чином проведена на апараті Раrr'а в придатному розчиннику, такому як, ізопропіловий спирт або толуол. На стадії (5) Реакційної схеми lV 3-аміно-2феноксипіридин формули XXVl піддають взаємодії з карбоновою кислотою або її еквівалентом з одерданням 4-фенокси-1H-імідазо[4,5-с]хіноліну формули lV. Придатні еквіваленти карбонової кислоти включають ортоестери та 1,1діалкоксиалкілалканоати. Карбонову кислоту або еквівалент вибирають таким чином, щоб вони забезпечували необхідний замісник R2 в сполуці формули lV. Наприклад, триетилортоформіат буде забезпечувати одержання сполуки, в якій R2 є воднем, а триметилортовалерат буде забезпечувати одержання сполуки, в якій R2 є бутилом. Реакція може відбуватися у відсутності розчинника або в інертному розчиннику, такому як, толуол. Реакція відбувається при достатньому нагріванні для того, щоб видалити будь-які спирт або воду, що утворюються як побічні продукти реакції. Необов'язково може використовуватися каталізатор, такий як, піридингідрохлорид. Альтернативно, стадію (5) можна проводити (і) взаємодією сполуки формули XXVl з ацилгалоїдом формули R2C(O)Cl або R2C(O)Br і потім (іі) циклізацією. В частині (і) ацилгалоїд додають до розчину сполуки формули XXV в інертному розчиннику, Сполуки винаходу можуть бути одержані відтакому як, ацетонітрил, піридин або дихлорметан. повідно до Реакційної схеми lV, де R1, R2, R3, R4, Реакцію можна проводити при температурі оточуR5 та X є такими, як визначено вище і ВОС ознаючого середовища. В чакстині (іі) продукт частини чає трет-бутоксикарбоніл. (і) нагрівають в піридині. На стадії (1) Реакційної схеми lV 2,4На стадії (6) Реакційної схеми lV ВОС-групу дигідрокси-3-нітропіридин формули ХХll, хлоровавидаляють зі сполуки формули lV з одержанням 4ній з використанням загальноприйнятих хлоруюфенокси-1H-імідазо[4,5-с]хіноліну формули V. Печих агентів, одержуючи 2,4-дихлор-3-нітропіридин реважно розчин сполуки формули lV в придатному формули ХХlll. Переважно сполуку формули ХХll розчиннику, такому як, дихлорметан, обробляють об'єднують з оксихлоридом фосфору і нагрівають. трифтороцтовою кислотою або соляною кислотою Багато 2,4-дигідрокси-3-нітропіридинів формули при зниженій температурі. ХХН відомі, а інші можуть бути легко одержані з На стадії (7) Реакційної схеми lV 4-феноксивикористанням відомих методів синтезу, див. на1H-імідазо[4,5-с]хінолін формули V перетворюють приклад, Lindstom та ін., патент U.S. №.5,446,153 у 4-фенокси-1H-імідазо[4,5-с]хінолін-1 15 74593 16 ілсульфонамід формули Vl, використовуючи етод -алкіл-О-алкенілу; стадії (2с) Реакційної схеми ll. -алкіл-S-алкенілу; та На стадії (8) Реакційної схеми lV 4-фенокси-алкілу або алкенілу, заміщених одним або де1H-імідазо[4,5-с]хінолін-1-ілсульфонамід формули кількома замісниками, вибраними з групи, яка Vl амінують з одержанням 4-аміно-1Н-імідазо[4,5складається з: с]хінолін-1-ілсульфонаміду формули XlX, який є -ОН; підродом формули l. Реакція може бути проведена -галогену; комбінуванням сполуки формули Vl з ацетатом -N(R5)2; амонію в запаяній трубці і нагріванням (-150°С). -CO-N(R5)2; Продукт або його фармацевтично прийнятна сіль -CS-N(R5)2; можуть бути виділені з використанням загальноп-SO2-N(R5)2; рийнятих методів -NR5-CO-C1-10 алкілу; -NR5-CS-C1-10 алкілу; -NR5-SO2-C1-10 алкілу; -СО-С1-10 алкілу; -СО-О-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; -СО-арилу; та -СО-гетероарилу; R3 та R4 незалежно вибрані з групи, яка складається з алкілу, алкенілу, галогену, алкокси, аміно, алкіламіно, діалкіламіно та алкілтіо; і кожний R5 означає незалежно Η або С1-10 алкіл; або їх фармацевтично прийнятна сіль. інший клас проміжних сполук має формулу lll: Винахід також охоплює нові сполуки: корисні як проміжні сполуки в синтезі сполук формули l. Такі проміжні сполуки мають структурні формули (ll) - (Vl): описані більш детально нижче. Один клас проміжних сполук має формулу (ll) де: X означає алкілен або алкенілен; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -алкіл-О-алкілу; -алкіл-S-алкілу; -алкіл-О-арилу; -алкіл-S-арилу; де: Q означає ΝΟ2 або ΝΗ2; X означає алкілен або алкенілен; R3 та R4 незалежно вибрані з групи, яка складається з алкілу, алкенілу, галогену, алкокси, аміно, алкіламіно, діалкіламіно та алкілтіо; і кожний R5 означає незалежно Η або С1-10 алкіл; або їх фармацевтично прийнятна сіль. Інший клас проміжних сполук має формулу (lV): 17 де: X означає алкілен або алкенілен; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -алкіл-О-алкілу; -алкіл-S-алкілу; -алкіл-О-арилу; -алкіл-S-арилу; -алкіл-О-алкенілу; -алкіл-S-алкенілу; та -алкілу або алкенілу, заміщених одним або декількома замісниками, вибраними з групи, яка складається з: -ОН; -галогену; -N(R5)2,-CO-N(R5)2; -CS-N(R5)2; -SO2-N(R5)2; -NR5-CO-C1-10 алкілу; -NR5-CS-C1-10 алкіл; -NR5-SO2-C1-10 алкілу; -СО-С1-10 алкілу; -СО-О-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; -СО-арилу; та -СО-гетероарилу; R3 та R4 незалежно вибрані з групи, яка складається з алкілу, алкенілу, галогену, алкокси, аміно, алкіламіно, діалкіламіно та алкілтіо; і кожний R5 незалежно означає Η або С1-10 алкіл; або їх фармацевтично прийнятна сіль. інший клас проміжних сполук має формулу (V): 74593 18 де: X означає алкілен або алкенілен; R2 вибраний з групи, яка складається з: -водню; -алкілу; -алкенілу; -алкіл-О-алкілу; -алкіл-S-алкілу; -алкіл-О-арилу; -алкіл-S-арилу; -алкіл-О-алкенілу; -алкіл-S-алкенілу; і -алкілу або алкенілу, заміщених одним або декількома замісниками, вибраними з групи, яка складається з: -ОН; -галогену; -N(R5)2; -CO-N(R5)2; -CS-N(R5)2; -SO2-N(R5)2; -NR5-CO-C1-10 алкілу; -NR5-CS-C1-10 алкілу; -NR5-SO2-C1-10 алкілу; -СО-С1-10 алкілу; -СО-О-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; -СО-арилу; і -СО-гетероарилу; R3 та R4 незалежно вибрані з групи, яка складається з алкілу, алкенілу, галогену, алкокси, аміно, алкіламіно, діалкіламіно та алкілтіо; і кожний R5 означає незалежно Η або С1-10 алкіл; або їх фармацевтично прийнятна сіль. Iнший клас проміжних сполук має формулу (Vl) 19 74593 20 кількома замісниками, вибраними з групи, яка складається з: -ОН; -галогену; -N(R5)2; -CO-N(R5)2; -CS-N(R5)2; -SO2-N(R5)2; -NR5-CO-C1-10 алкілу; -NR5-CS-C1-10 алкілу; -NR5-SO2-C1-10 алкілу; -СО-С1-10 алкілу; -СО-О-С1-10 алкілу; -N3; -арилу; -гетероарилу; -гетероциклілу; в якій: X означає алкілен або алкенілен; -СО-арилу; та R1 означає арил, гетероарил, гетероцикліл, С1-СО-гетероарилу; 20 алкіл або С2-20 алкеніл, кожний з яких може бути R3 and R4 незалежно вибрані з групи, яка незаміщеним або заміщеним одним або декількоскладається з алкілу, алкенілу, галогену, алкокси, ма замісниками, незалежно вибраними з групи, яка аміно, алкіламіно, діалкіламіно та алкілтіо; і складається з: кожний R5 означає незалежно Η або С1-10 ал-алкілу; кіл; -алкенілу; або їх фармацевтично прийнятна сіль. -арилу; В даному контексті терміни "алкіл", "алкеніл" і -гетероарилу; префікс "алк-" включають як нерозгалужені, так і -гетероциклілу; розгалужені ланцюгові групи і циклічні групи, тобто -заміщеного циклоалкілу; циклоалкільні і циклоалкенільні. Якщо не вказано -О-алкілу; інше, ці групи містять від 1 до 20 атомів вуглецю, -O-(алкіл)0-1-арилу; причому алкенільні групи містять від 2 до 20 ато-О-(алкіл)0-1-гетероарилу; мів вуглецю. Переважні групи взагалі мають до 10 -O-(алкіл)0-1-гетероциклілу; атомів вуглецю. Циклічні групи можуть бути моно-СООН; циклічними або поліциклічними і переважно мають -СО-О-алкілу; від 3 до 10 атомів вуглецю в кільці. Прикладами -СО-алкілу; циклічних груп є циклопропіл, циклопентил, цикло-S(O)0-2-алкілу; гексил, циклопропілметил і адамантил. -S(O)0-2-(алкіл)0-1-арилу; Термін "галоалкіл" включає групи, що є замі-S(O)0-2-(алкіл)0-1-гетероарилу; щеними одним або більшою кількістю атомів гало-S(O)0-2-(алкіл)0-1-гетероциклілу; гену, включно з перфторованими групами. Це та-(aлкіл)0-1-N(R5)2; кож стосується груп, які містять префікс "гало-". -(алкіл)0-1-NR5-CO-О-алкілу; Прикладами придатних галоалкільних груп є хло-(алкіл)0-1-NR5-CO-aлкілу; рметил, трифторметил і т.ін. -(алкіл)0-1-NR5-CO-арилу; Термін "арил", як тут використовується, вклю-(алкіл)0-1-NR5-CO-гетероарилу; чає карбоциклічні ароматичні кільця або циклічні -N3; системи. Прикладами арильних груп є феніл, наф-галогену; тил, біфеніл, флуореніл і інденіл. Термін "гетероа-галоалкілу; рил" включає ароматичні кільця або циклічні сис-галоалкокси; теми, що містять, принаймні, один гетероатом в -СО-галоалкілу; кільці (наприклад, О, S, N). Придатними гетероа-СО-галоалкокси; рильними групами є фурил, тієніл, піридил, хінолі-NO2; ніл, ізохінолініл, індоліл, ізоіндоліл, триазоліл, пі-CN; роліл, тетразоліл, імідазоліл, піразоліл, оксазоліл, -ОН; тіазоліл, бензофураніл, бензотіофеніл, карбазоліл, -SH; і у випадку алкілу, алкенілу та гетероцикбензоксазоліл, піримідиніл, хіноксалініл, бензоімілілу, оксо; дазоліл, бензотіазоліл, нафтиридиніл, ізоксазоліл, R2 вибраний з групи, яка складається з: ізотіазоліл, пуриніл, хінозолініл і так далі. -водню; "Гетероцикліл" включає неароматичні кільця -алкілу; або циклічні системи, які містять принаймні один -алкенілу; гетероатом в кільці (наприклад, О, S, N) і включа-алкіл-О-алкілу; ють всі повністю насичені і частково ненасичені -алкіл-S-алкілу; похідні згаданих вище гетероарильних груп. Прик-алкіл-О-арилу; ладами гетероциклічних груп є піролідиніл, тетра-алкіл-S-арилу; гідрофураніл, морфолініл, тіоморфолініл, піпери-алкіл-О-алкенілу; диніл, піперазиніл, тіазолідиніл, імідазолідиніл, -алкіл-S-алкенілу; та ізотіазолідиніл. -алкілу або алкенілу, заміщених одним або де 21 74593 22 Арильні, гетероарильні і гетероциклільні групи цевтичній композиції згідно з винаходом, буде зміможуть бути незаміщеними або заміщеними одним нюватись в залежності від факторів, що відомі або більшою кількістю замісників, що незалежно спеціалісту у цій галузі, такі як фізична та хімічна вибирають з групи, яка містить алкіл, алкокси, алприрода сполуки, природа носія, прописаний рекілтіо, галоалкіл, галоалкокси, галоалкілтіо, галожим дозування, передбачається, що композиції ген, нітро, гідрокси, меркапто, ціано, карбокси, фозгідно з винаходом будуть містити достатню кільрміл, арил, арилокси, арилтіо, арилалкокси, кість активного інгредієнту для забезпечення дози арилалкілтіо, гетероарил, гетероарилокси, гетеровід приблизно 100нг/кг до приблизно 50мг/кг, пеарилтіо, гетероарилалкокси, гетероарилалкілтіо, реважно від приблизно 10мкг/кг до приблизно аміно, алкіламіно, діалкіламіно, гетероцикліл, ге5мг/кг сполуки для суб'єкта. Можуть використовутероциклоалкіл, алкілкарбоніл, алкенілкарбоніл, ватися будь-які традиційні дозовані форми, такі як алкоксикарбоніл, галоалкілкарбоніл, галоалкокситаблетки, лозенги, парентеральні композиції, сикарбоніл, алкілтіокарбоніл, арилкарбоніл, гетероаропи, креми, мазі, аерозольні композиції, трансдерилкарбоніл, арилоксикарбоніл, гетероарилоксирмальні пластирі, трансмукозальні пластирі, тощо. карбоніл, арилтіокарбоніл, гетероарилтіокарбоніл, Сполуки згідно з винаходом можуть вводитися алканоїлокси, алканоїлтіо, арилкарбонілокси, арияк окремий терапевтичний агент в режимі лікуванлкарбонілтіо, арилкарбоніламіно, алкіламіносульня, або сполуки згідно з винаходом можуть вводифоніл, алкілсульфоніл, арилсульфоніл, гетероатися у комбінації ще з одним іншим або з іншими рилсульфоніл, арилдіазиніл, алкілсульфоніламіно, активними агентами, включаючи додаткові модиарилсульфоніламіно, арилалкілсульфоніламіно, фікатори імунної відповіді, антивірусні агенти, аналкілкарбоніламіно, алкенілкарбоніламіно, арилтибіотики, тощо. карбоніламіно, арилалкілкарбоніламіно, гетероаПоказано, що сполуки згідно з винаходом індурилкарбоніламіно, гетероарилалкілкарбоніламіно, кують продукування певних цитокінів в експеримеалкілсульфоніламіно, алкенілсульфоніламіно, нтах, проведених згідно з набором тестів, що арилсульфоніламіно, арилалкілсульфоніламіно, представлені нижче. Ці результати показують, що гетероарилсульфоніламіно, гетероарилалкілсульсполуки є корисними як модифікатори імунної відфоніламіно, алкіламінокарбоніламіно, алкеніламіповіді, які модулюють імунну відповідь багатьма нокарбоніламіно, ариламінокарбоніламіно, ариларізними шляхами, і це робить їх корисними при лкіламіиокарбоніламіно, лікуванні цілого ряду розладів. гетероариламінокарбоніламіно, гетероарилалкілЦитокіни, продукування яких може індукуватикарбоніламіно і, у випадку гетероциклілу, оксо. ся шляхом введення сполук згідно з винаходом, в Якщо для будь-яких інших груп вказано, що є "зазагальному випадку включають інтерферон- (lFNміщеними" або "необов'язково заміщеними", тоді ) і/або фактор некрозу пухлин- (TNF- ), а також ці групи також можуть бути заміщені одним або деякі інтерлейкіни (tL). Цитокіни, біосинтез яких більшою кількістю згаданих вище замісників. може індукуватися сполуками з винаходом, вклюДеякі замісники є особливо переважними. Начають lFN- , TNF- , lL-1, tL-6, tL-10 та lL-12, та приклад, переважними Υ групами є - CO - та -SO2-; різноманітність інших цитокінів. Серед інших вплиΖ переважно означає зв'язок або - NR5 -; і R1 перевів ці та інші цитокіни можуть інгубувати продукуважно є алкілом, арилом або заміщеним арилом. вання вірусу та ріст клітин пухлини, що робить ці Переважні R2 групи включають алкільні групи, що сполуки корисними при лікуванні вірусних захвомають від 1 до 4 атомів вуглецю (тобто, метил, рювань та пухлин. Відповідно, винахід забезпечує етил, пропіл, ізопропіл, м-бутил, втор-бутил, ізобуспосіб індукції біосинтезу цитокінів у тварин, що тил та трет-бутил), метоксиетил, етоксиметил та передбачає введення тварині ефективної кількості циклопропілметил. R3 та R4 переважно є метилом. сполуки або композиції за винаходом. Один або більша кількість цих переважних замісБуло встановлено, що деякі сполуки винаходу ників, в разі присутності, можуть бути присутніми у переважно індукують експресію lFN- в популяції сполуках згідно з винаходом у будь-якій комбінації. гематопоетичних клітин, таких, як РВМС (мононукВинахід включає сполуки, описані тут, у будьлеарні клітини периферійної крові), що містять якій їх фармацевтично прийнятній формі, включаpDC2 клітини (попередники дендритних клітин тиючи ізомери, такі як, діастереомери та енантіомепу 2) без супутнього продукування значних рівнів ри, солі, сольвати, поліморфні форми, тощо. Зокцитокінів запалення. рема, якщо сполука є оптично активною, винахід У доповнення до здатності індукувати продуособливо включає кожний з енантіомерів сполуки, кування цитокінів сполуки згідно з винаходом виа також рацемічні суміші енантіомерів. кликають інші аспекти природженої імунної відпоФармацевтичні композиції та біологічна активвіді. Наприклад, може бути стимульована ність активність природних клітин-кілерів, ефект, яка Фармацевтичні композиції згідно з винаходом може виникати завдяки індукуванню цитокінів. містять терапевтично ефективну кількість сполуки Сполуки також можуть активувати макрофаги, які в винаходу, як описано вище, у комбінації з фармасвою чергу стимулюють секрецію оксиду азоту і цевтично прийнятним носієм. продукування додаткових цитокінів. Крім того, Термін „терапевтично ефективна кількість" сполуки можуть викликати проліферацію та дифеозначає кількість сполуки, достатню для викликанренціацію В-лімфоцитів. ня терапевтичного ефекту, такого як індукція цитоСполуки винаходу також можуть мати вплив кінів, протипухлинна активність і/або антивірусна на набуту імунну відповідь. Наприклад, незважаюактивність. Незважаючи на те, що точна кількість чи на те, що не передбачається існування будьактивної сполуки, яка використовується у фармаякого безпосереднього впливу на Т-клітини або 23 74593 24 безпосередню індукцію цитокінів Т-клітин, продутин, таких як моноцити, макрофаги, дентритичні клітини і B-клітини, продукувати таку кількість одкування цитокіну lFN- Т-хелперами типу 1 (Тh1) ного або декількох цитокінів, таких як, наприклад, індукується опосередковано і продукування цитокінів lL-4, lL-5 та lL-13 хелперами типу 2 (Th2) інгіlFN- , TNF- , lL-1, lL-6, lL-10 та lL-12, яка перевибується при введенні сполук згідно з винаходом. щує фоновий рівень. Точна кількість буде варіюваЦя активність означає, що сполуки є корисними тися в залежності від факторів, що відомі у цій при лікуванні захворювань, при яких є бажаним галузі, але очікується, що це буде доза від прибпідвищення Тh1 відповіді та/або зниження Th2 лизно 100нг/кг до приблизно 50мг/кг, переважно відповіді. З огляду на здатність сполук винаходу від приблизно 10мкг/кг до приблизно 5мг/кг. Винаінгібувати Th2 імунну відповідь, сполуки, як очікухід також охоплює спосіб лікування вірусної інфекється, будуть корисними при лікуванні атопічних ції у тварини та спосіб лікування неопластичного захворювань, наприклад, атопічного дерматиту, захворювання у тварин, що передбачає введення астми, алергії, алергічного риніту; системної еритварині ефективної кількості сполуки або композитематозної вовчанки; як вакцинний ад'ювант для ції винаходу. Кількістю, що є ефективною для лікуімунітету, опосередкованого клітинами; та можливі вання або інгібування вірусної інфекції, є кількість, як засіб для лікування рецидивуючих грибкових яка буде спричиняти зменшення одного або більзахворювань та хламідій. шої кількості проявів вірусної інфекції, таких як Модифікуючий вплив сполук на імунну відповірусні ушкодження, вірусне навантаження, швидвідь робить їх корисними при лікуванні широкого кість продукування вірусу та смертність у порівпереліку станів. Завдяки їх здатності індукувати нянні з необробленими контрольними тваринами. Точна кількість буде варіюватись в залежності від продукування цитокінів, таких як lFN- та TNF- , факторів, що відомі у цій галузі техніки, але очікусполуки є особливо корисними при лікуванні вірусється, що доза становить від приблизно 100нг/кг них захворювань та раку. Ця імуномодулююча до приблизно 50мг/кг, бажано від приблизно активність передбачає, що сполуки згідно з вина10мкг/кг до приблизно 5мг/кг. Кількістю сполуки, ходом є корисними при лікуванні захворювань, які ефективною для лікування неопластичного стану, включають, але не обмежуються ними, вірусні зає кількість, що буде спричиняти зменшення розміхворювання, включаючи генітальні бородавки, ру пухлини або кількості пухлинних локусів. З інзвичайні бородавки, підошвенні бородавки, гепашого боку, точна кількість буде варіюватись в затит В, гепатит С, вірус звичайного герпесу типу 1 лежності від факторів, що відомі у даній галузі, але та типу 2, контагіозний молюск, віспа, особливо очікується, що доза буде складати від приблизно віспа голови, ВlЧ, ЦМВ, VZV, риновірус, аденові100нг/кг до приблизно 50мг/кг, переважно від прирус, коронавірус; вірус грипу та парагрипу, інтраеблизно 10мкг/кг до приблизно 5мг/кг. пітеліальні неоплазії, такі, як цервікальна інтраепіВинахід також описується наступними приклателіальна неоплазія, папіломавірус людини (HPV) дами, які призначені тільки для ілюстрації і не прита асоційовані неоплазії, грибкові захворювання, значені для обмеження винаходу будь-яким чинаприклад, кандидоз, аспергільоз та криптококоном. вий менінгіт, неопластичні захворювання, наприПриклад 1 клад, карцинома базальних клітин, лейкемія ворN-[4-(4-Аміно-2-бутил-6,7-диметил-1Hсинчатих клітин, саркома Капоші, карцинома імідазо[4,5-с]піридин-1-іл)бутил]бензамід ниркових клітин, карцинома лускатих клітин, мієлогенна лейкемія, множинна мієлома, лімфома неХоджкіна, шкірна Т-клітинна лімфома, та інші види раку, паразитарні захворювання, наприклад, пневмоцистіс карнії, криптоспорідіоз, гістоплазмоз, токсоплазмоз, трипаносомна інфекція та лешманіоз, бактеріальні інфекції, наприклад, туберкульоз та мікобактеріум авіум. Додатковими захворюваннями або станами, які можуть лікуватися при використанні сполук винаходу є актинічний кератоз, екзема, еозинофілія, есенціальна тромбоцитемія, проказа, розсіяний склероз, синдром Оммена, дисковидна вовчанка, захворювання Бовена, бовеноїЧастина А дний папульоз, алопеція ареата, інгібування утвоТриетиламін (16.8мл, 123.8ммоль) додавали рення келоїдів після хірургічного втручання та до суспензії 4-гідрокси-5,6-диметил-3-нітро-2(1Н)інших типів шрамів після хірургічного втручання. піридону (7.6г, 41.2ммоль) в дихлорметані (200мл). Крім того, ці сполуки можуть покращувати або Одержану суміш охолоджували в льодяній бастимулювати загоєння ран, включаючи хронічні ні. Додавали трифторметансульфоновий ангідрид рани. Сполуки можуть бути корисними при ліку(13.7мл, 82.5ммоль) і реакційну суміш перемішуванні опортуністичних інфекцій та пухлин, що вивали протягом 30 хвилин. Додавали однією порціникають після пригнічення імунітету, опосередкоєю моно-трет-бутоксикарбоніл-1,4-бутилдіамін ваного клітинами у, наприклад, пацієнтів, яким (7.6г, 41.2ммоль) і реакційну суміш залишали навживлюють трансплантат, ракових хворих та пацігріватися до температури оточуючого середовища. єнтів, хворих на ВlЧ. Через 1 годину реакційну суміш промивали водКількістю сполуки, ефективною для індукції біним 1% розчином карбонату натрію (2 100мл), осинтезу цитокінів є кількість, що достатня для висушували над сульфатом магнію і потім концентого, щоб примусити один або декілька типів клі 25 74593 26 трували при зниженому тиску з одержанням сиродавали гідроксид амонію (50мл) і воду (100мл) і го продукту. Цю речовину розчиняли в дихлормеодержану суміш перемішували протягом 30 хвитані і завантажували на шар силікагелю. Силікалин. Шари розділяли і водну фракцію екстрагували гель елюювали спочатку дихлорметаном для дихлорметаном (100мл). Органічні фракції об'єдвидалення деяких домішок і потім 2-5% етилаценували, промивали 1% водним розчином карбонататом в дихлорметані для одержання цільового ту натрію, промивали насиченим розчином солі і продукту. Фракції, що містили продукт, об'єднуваконцентрували при зниженому тиску. Залишок ли і потім концентрували при зниженому тиску з об'єднували з метанолом (30мл), перемішували одержанням 12г 4-({4-[(третпротягом 30 хвилин і фільтрували. Фільтрат конбутоксикарбоніл)аміно]бутил}аміно)-5,6-диметилцентрували при зниженому тиску і одержаний за3-нітропіридин-2-іл трифторметансульфонату у лишок об'єднували з 1% водним розчином карбовигляді світло-жовтого масла. нату натрію і перемішували. Суміш екстрагували Частина В гексаном для видалення органічних домішок. ВодРечовину з Частини А об'єднували з триетиний шар містив нерозчинне масло, яке екстрагуваламіном (2.5г, 24.7ммоль), дибензиламіном (4.8г, ли дихлорметаном. Органічний шар об'єднували з 24.7ммоль) та толуолом (150мл), і потім і потім сульфатом магнію, перемішували протягом 5 хвинагрівали при кипіння протягом 4 годин. Реакційну лин і фільтрували. Фільтрат концентрували при суміш промивали водним 1% розчином карбонату зниженому тиску з одержанням твердої речовини, натрію і потім концентрували при зниженому тиску яку перекристалізовували з толуолу з одержанням з одержанням сирого продукту. Цей продукт роз1г 1-(4-амінобутил)-2-бутил-6,7-диметил-1Нчиняли в дихлорметані і завантажували на силікаімідазо[4,5-с]піридин-4-аміну. гель. Силікагель елюювали 2-20% етилацетатом в Частина F дихлорметані. Фракції, що містили продукт, об'єдТриетиламін (0.07мл, 0.5ммоль) додавали до нували і потім концентрували при зниженому тиску розчину 1-(4-амінобутил)-2-бутил-6,7-диметил-1Німідазо[4,5-с]піридин-4-аміну (150мг, 0.5ммоль) в з одержанням 13г трет-бутил 4-{[2дихлорметані (150мл). Реакційну суміш охолоджу(дибензиламіно)-5,6-диметил-3-нітропіридин-4вали в льодяній бані. Додавали бензоїлхлорид іл]аміно}бутилкарбамату. (0.07мл, 0.5ммоль) і реакційну суміш видаляли з Частина С льодяної бані. Реакційну суміш промивали двічі Борогідрид натрію (1.4г, 36ммоль) повільно водою і потім концентрували при зниженому тиску. додавали до розчину гідрату хлориду нікелю (2.9г, Одержаний залишок очищали флеш12.3ммоль) в метанолі і одержану суміш переміхроматографією, елююючи 10% метанолом в дихшували протягом 30 хвилин. Додавали однією лорметані з одержанням маслоподібної речовини порцією розчин речовини з Частини В в метанолі. коричневого кольору. Цю речовину розчиняли в Повільно додавали борогідрид натрію доти, поки мінімальній кількості ізопропанолу і потім додаваутворювана піна не стала безбарвною. Реакційну ли при перемішуванні етансульфонову кислоту суміш фільтрували. Фільтрат концентрували при (55мг, 0.5ммоль). Реакційну суміш перемішували зниженому тиску. Одержаний залишок об'єднувапри температурі оточуючого середовища протягом ли з дихлорметаном і суміш фільтрували для видалення солей. Фільтрат концентрували при зни1 години і потім короткочасно нагрівали у піщаній бані поки вона не ставала гомогенною. Розчин женому тиску з одержанням 12г трет-бутил 4-{[3залишали охолоджуватися до температури оточуаміно-2-(дибензиламіно)-5,6-диметилпіридин-4ючого середовища і потім охолоджували в льодяіл]аміно}бутилкарбамату. ній бані. Одержаний осад виділяли фільтрацією з Частина D одержанням 111мг N-[4-(4-аміно-2-бутил-6,7Валерилхлорид (3мл, 24.7ммоль) додавали до диметил-1H-імідазо[4,5-с]піридин-1розчину речовини з Частини С в ацетонітрилі іл)бутил]бензаміду у вигляді кристалічної твердої (200мл). Реакційну суміш перемішували при темречовини, т.пл. 127.8-128.8°С. пературі оточуючого середовища. Реакційну суміш Аналіз: Розраховано для C23H31N5O: %С, концентрували при зниженому тиску. Залишок 70.20; %Н, 7.94; %N, 17.80; об'єднували з етанолом та триетиламіном (5г, Одержано: %С, 69.82; %Н, 7.70; %N, 17.68. 49ммоль.). Реакційну суміш нагрівали при кипінні Приклад 2 протягом ночі і потім концентрували при зниженоN-[4-(4-Aмінo-2-бyтил-6,7-димeтил-1Нму тиску. Одержаний залишок розподіляли між імідaзo[4,5-c]піpидин-1-іл)бyтил]мeтaнcyльфoнaмiд дихлорметаном та водою. Дихлорметановий шар відокремлювали і потім завантажували в колонку з силікагелем. Колонку елюювали сумішшю 9:90:1 етилацетат:дихлорметан:метанол. Фракції, що містили продукт, об'єднували і потім концентрували при зниженому тиску з одержанням 6.5г третбутил 4-[2-бутил-4-(дибензиламіно)-6,7-диметил1Н-імідазо[4,5-с]піридин-1-іл]бутилкабамату у вигляді масла. Частина Е Трифторметансульфонову кислоту (16г, 107ммоль) додавали до розчину речовини з ЧасТриетиламін (0.07мл, 0.5ммоль) додавали до тини D (6.5г, 11.4ммоль) в дихлорметані (250мл). розчину 1-(4-амінобутил)-2-бутил-6,7-диметил-1НОдержану суміш перемішували протягом ночі. Доімідазо[4,5-с]піридин-4-аміну (150мг, 0.5ммоль) в 27 74593 28 дихлорметані (160мл). Реакційну суміш охолоджували в льодяній бані. Додавали метансульфоновий ангідрид (90мг,0.5ммоль) і реакційну суміш видаляли з льодяної бані. Реакційну суміш перемішували протягом 35 хвилин. Реакційну суміш промивали тричі водою, концентрували при зниженому тиску і розтирали з мінімальним об'ємом метилацетату. Одержану тверду кристалічну речовину відокремлювали фільтрацією і потім сушили в сушильному апараті Abderhatden з одержанням 94мг N-[4-(4-аміно-2-бутил-6,7-диметил-1Німідазо[4,5-с]піридин-1іл)бутил]метансульфонаміду, т.пл. 130-130.5°С Фенілізоціанат (0.056мл, 0.5ммоль) додавали Аналіз: Розраховано для C17H29N5O2S: %С, до охолодженого розчину 1-(4-амінобутил)-255.56; %Н, 7.95; %N, 19.06; бутил-6,7-диметил-1Н-імідазо[4,5-с]піридин-4Одержано: %С, 55.37; %Н, 7.89; %N, 18.03. аміну (150мг, 0.5ммоль) в дихлорметані (150мл). Приклад 3 Льодяну баню прибирали. Через 5 хвилин утворюN-[4-(4-Аміно-2-бутил-6,7-диметил-1Hвався осад білого кольору. Реакційну суміш залиімідазо[4,5-с]піридин-1-іл)бутил]-4шали перемішуватися протягом 30 хвилин і потім її фторбензолсульфонаміду гідрат концентрували при зниженому тиску з одержанням кристалічної речовини білуватого кольору. Цю речовину відокремлювали фільтрацією, використовуючи невелику кількість діетилового етеру для переносу речовини на фільтр і потім сушили і сушильному апараті Abderhalden з одержанням 185мг N-[4-(4-аміно-2-бутил-6,7-диметил-1Hімідазо[4,5-с]піридин-1-іл)бутил]-N-фенілсечовини, т.пл. 195.8-196.8°С. Аналіз: Розраховано для C23H32N6O: %С, 67.62; %Н, 7.89; %N, 20.57; Одержано: %С, 66.84; %Н, 7.71; %N, 20.54. Приклад 5 N-[4-(4-Аміно-2-бутил-6,7-диметил-1НТриетиламін (0.07мл, 0.5ммоль) додавали до імідазо[4,5-с]піридин-1-іл)бутил]-Nрозчину 1-(4-амінобутил)-2-бутил-6,7-диметил-1Нфенілтіосечовини гідрат імідазо[4,5-с]піридин-4-аміну (150мг, 0.5ммоль) в дихлорметані (150мл). Реакційну суміш охолоджували в льодяній бані. Додавали 4фторбензолсульфонілхлорид (113мг, 0.5ммоль) і реакційну суміш видаляли з льодяної бані. Реакційну суміш перемішували при температурі оточуючого середовища протягом 48 годин. Реакційну суміш промивали водою (2 150мл) і потім концентрували при зниженому тиску. Одержаний залишок перекристалізовували з метилацетату і потім сушили в сушильному апараті Abderhalden з одержанням 50мг гідрату N-[4-(4-ам)но-2-бутил-6,7диметил-1H-імідазо[4,5-с]піридин-1-іл)бутил]-4З використанням методики Прикладу 4 1-(4фторбензолсульфонаміду у вигляді твердої крисамінобутил)-2-бутил-6,7-диметил-1Н-імідазо[4,5талічної речовини білого кольору, т.пл. 133.1с]піридин-4-амін (100мг, 0.35ммоль) піддавали 133.7°С. взаємодії з фенілізотіоціанатом (0.041мл, Аналіз: Розраховано для C22H30FN5O2S Н2О: 0.35ммоль) з отриманням 97мг гідрату N-[4-(4%С, 56.75; %Н, 6.93; %N, 15.04; аміно-2-бутил-6,7-диметил-1H-імідазо[4,5Одержано. %С, 56.99; %Н, 6.58; %N, 15.24. с]піридин-1-іл)бутил]-N-фенілтіосечовини у вигляді Приклад 4 кристалічної твердої речовини білого кольору, N-[4-(4-Аміно-2-бутил-6,7-диметил-1Hт.пл. 160.0-160.8°С. імідазо[4,5-с]піридин-1-іл)бутил]-N-фенілсечовина Аналіз: Розраховано для C23H32N6S Н2О: %С, 62.41; %Н, 7.74; %N, 18.99; Одержано: %С, 62.39; %Н, 7.47; %N, 18.52. Приклад 6 N-[4-(4-Аміно-2-бутил-6,7-диметил-1Hімідазо[4,5-с]піридин-1-іл)бутил]-N,Nдиметилсульфамід 29 74593 30 юванням 60/40 етилацетат/гексан), одержуючи 55г 2,4-дихлор-5,6-диметил-3-нітропіридину. Частина В трет-Бутил 4-амінобутилкарбамат (60г, 339ммоль) повільно додавали до суміші 2,4дихлор-5,6-диметил-3-нітропіридину (50г, 226ммоль), безводного Ν,Ν-диметилформаміду (500мл) та триетиламіну (50мл, 339ммоль). Реакційну суміш залишали перемішуватися протягом ночі і потім концентрували її при зниженому тиску з одержанням масла. Масло розчиняли в етилацетаті і потім промивали водою. Органічний шар висушували над сульфатом магнію і потім концентТриетиламін (0.031мл, 0.23ммоль) додавали рували при зниженому тиску з одержанням до розчину 1-(4-амінобутил)-2-бутил-6,7-диметилтемного масла. Цю речовину очищали колонковою 1H-імідазо[4,5-с]піридин-4-аміну (67мг, 0.23ммоль) хроматографією (силікагель з елююванням 40/60 в дихлорметані (45мл). Реакційну суміш охолоетилацетат/гексан), одержуючи 64.5г трет-бутил 4джували в льодяній бані. Додавали диметилсуль(2-хлор-5,6-диметил-3-нітропіридин-4фамоїлхлорид (0.025мл, 0.23ммоль). Реакційну іл)бутилкарбамату у вигляді масла яскраво орансуміш видаляли з льодяної бані і залишали пережевого кольору, яке тверділо при стоянні. мішуватися при температурі навколишнього сереЧастина С довища протягом 113 годин. Аналіз за допомогою Розчин фенолу (18.50г, 196ммоль) в диглімі HPLC показав, що реакція не закінчилася. Дихло(50мл) повільно додавали по краплинам до охолорметан видаляли при зниженому тиску. Додавали дженої (0°С) суспензії гідриду натрію (8.28г 60% в 1,2-дихлоретан (50мл) і реакційну суміш нагрівали мінеральному маслі, 207ммоль) в диглімі (50мл). до 60°С. Через 3 години додавали більше диметиЧерез 1 годину утворення газу припинялося. Розлсульфамоїлхлориду (2.5мкл) і нагрівання продочин трет-бутил 4-(2-хлор-5,6-диметил-3вжували. Через 22 години температуру реакції нітропіридин-4-іл)бутилкарбамату (68.95г, піднімали до кипіння і реакційну суміш кип'ятили 185ммоль) в диглімі (200мл) повільно додавали по протягом 100 годин. Реакційну суміш двічі екстракраплям реакційної суміші. Після того, як додавангували водою. Водні фракції об'єднували та коння закінчували, реакційну суміш нагрівали при кицентрували при зниженому тиску. Одержаний запінні протягом 4 годин. Реакційну суміш концентлишок перекристалізовували з метилацетату з рували при зниженому тиску з одержанням одержанням 10мг N -[4-(4-аміно-2-бутил-6,7темного масла. Масло розчиняли в етилацетаті і диметил-1H -імідазо[4,5-с]піридин-1-іл)бутил]-N,Nпотім екстрагували 1N розчині гідроксиду натрію диметилсульфаміду у вигляді кристалічної твердої для того, щоб видалити надлишки фенолу. Оргаречовини білуватого кольору, т.пл 129.5-1ЗТС. M/Z нічний шар висушували над сульфатом магнію і = 397.1 (М+Н)+. потім концентрували при зниженому тиску. ЗалиПриклад 7 шок очищали хроматографією (силікагель з елююN-[4-(4-Аміно-2,6,7-триметил-1N-імідазо[4,5ванням сумішшю 30/70 етилацетат/гексан) з одерс]піридин-1-іл)бутил]метансульфонамід жанням 40.67г трет-бутил 4-[(2,3-диметил-5-нітро6-феноксипіридин-4-іл)аміно]бутилкарбамату у вигляді масла оранжевого кольору. Частина D трет-Бутил 4-[(2,3-диметил-5-нітро-6феноксипіридин-4-іл)аміно]бутилкарбамат (9.17г, 21.3ммоль), толуол (50мл), ізопропанол (5мл) та 5% платину на вугіллі (7.0г) змішували і підтримували суміш під тиском водню (50 psi, 3.5кг/см2) на апараті Parr протягом ночі. Каталізатор видаляли фільтрацією і фільтрат концентрували при зниженому тиску. Одержане темне масло сушили у виЧастина А сокому вакуумі з одержанням 7.47г трет-бутил 4Суміш 5,6-диметил-3-нітропіридин-2,4[(3-аміно-5,6-диметил-2-феноксипіридин-4діолу (60.0г, 326ммоль) та оксихлориду фосфору іл)аміно]бутилкарбамату. (600мл) нагрівали при кипінні протягом 2 годин. Частина Ε Реакційну суміш концентрували при зниженому Суміш продукту з Частини D, триетилортоацетиску. Одержаний залишок об'єднували з етилацетату (3.59мл, 19.58ммоль), безводного толуолу татом (300мл) і потім фільтрували. Фільтрат про(75мл) та гідрохлориду піридину (0.75г) нагрівали мивали водним розчином бікарбонату натрію. Шапри кипінні протягом 1 години і потім концентрувари відокремлювали і водний шар двічі ли при зниженому тиску з одержанням масла коекстрагували етилацетатом. Органічні шари об'єдричневого кольору. Масло розчиняли в етилацетанували, висушували над сульфатом магнію і потім ті і потім промивали водою (Х2), насиченим концентрували при зниженому тиску з одержанням розчином солі, висушували над сульфатом магнію твердої речовини коричневого кольору. Цю речоі потім концентрували при зниженому тиску, одервину очищали хроматографією (силікагель з елюжуючи 6.74г трет-бутил 4-(2,6,7-триметил-4 31 74593 32 фенокси-1Н-імідазо[4,5-с]піридин-1етером і потім сушили у вакуумі при температурі іл)бутилкарбамату у вигляді масла коричневого близько 80°С, отримуючи 2.00г N-[4-(4-аміно-2,6,7кольору. триметил-1Н-імідазо[4,5-с]піридин-1Частина F іл)бутил]метансульфонаміду, т.пл. 228-230°С. Розчин трет-бутил 4-(2,6,7-триметил-4Аналіз: Розраховано для C14H23N5O2S: %С, фенокси-1Н-імідазо[4,5-с]піридин-151.67; %Н, 7.12; %Ν, 21.52; іл)бутилкарбамату (6.70г, 15.8ммоль) в дихлормеОдержано: %С, 51.48; %Н, 6.95; %Ν, 21.51. тані (50мл) повільно додавали до охолодженої Приклад 8 (0°С) суміші трифтороцтової кислоти (60мл) та N-{4-[4-аміно-2-(етоксиметил)-6,7-диметил-1Hдихлорметану (100мл). Реакційну суміш залишали імідазо[4,5-с]піридин-1-іл]бутил}метансульфонамід нагріватися до температури оточуючого середовища і потім залишали на ніч. Реакційну суміш концентрували при зниженому тиску з одержанням масла коричневого кольору. Масло розчиняли в дихлорметані і розчин підлужували (pH 14) за допомогою 5% водного розчину гідроксиду натрію. Шари відокремлювали і водний шар екстрагували дихлорметаном. Органічні шари об'єднували, висушували над сульфатом магнію і потім концентрували при зниженому тиску, отримуючи 4.50г 4(2,6,7-триметил-4-фенокси-1Н-імідазо[4,5с]піридин-1-іл)бутиламіну у вигляді масла коричЧастина А невого кольору. Триетиламін (3.3мл, 23.7ммоль) додавали до Частина G охолодженої (0°С) суміші трет-бутил 4-[(3-аміноСуміш продукту з Частини F, триетиламіну 5,6-диметил-2-феноксипіридин-4(2.0мл, 14.6ммоль) та безводного ацетонітрилу іл)аміно]бутилкарбамату (8,60г, 21.5ммоль) та (450мл) нагрівали до отримання гомогенного розбезводного дихлорметану (200мл). Додавали еточину. Повільно додавали до реакційної суміші анксиацетилхлорид (2.76г, 22.5ммоль). Через 1 гогідрид метансульфонової кислоти (2.54г, дину реакційну суміш залишали нагріватися до 14.6ммоль). Реакцію вважали закінченою через 10 температури оточуючого середовища і перемішухвилин. Реакційну суміш концентрували при знивали протягом 2 годин. Реакційну суміш концентженому тиску з одержанням масла коричневого рували при зниженому тиску з одержанням треткольору. Масло розчиняли в дихлорметані і пробутил 4-({3-[(етоксиацетил)аміно]-5,6-диметил-2мивали 5% водним розчином гідроксиду натрію. феноксипіридин-4-іл}аміно)бутилкарбамату у виВодний шар відокремлювали і потім екстрагували гляді масла коричневого кольору. Масло об'єднудихлорметаном. Органічні шари об'єднували, вивали з піридином (130мл) і кип'ятили протягом сушували над сульфатом магнію і потім концентночі. Реакційну суміш концентрували при знижерували при зниженому тиску з одержанням тверному тиску з одержанням масла коричневого кодої речовини коричневого кольору. Цей продукт льору. Масло розчиняли в дихлорметані і промиочищали колонковою хроматографією (силікагель вали водою. Органічний шар висушували над з елююванням сумішшю 95/5 дихлормесульфатом магнію і потім концентрували при знитан/метанол), одержуючи 4.49г N-[4-(2,6,7женому тиску. Залишок розчиняли в діетиловому триметил-4-фенокси-1H-імідазо[4,5-с]піридин-1етері і потім концентрували при зниженому тиску, іл)бутил]метансульфонаміду у вигляді твердої отримуючи 8.21г трет-бутил 4-[2-(етоксиметил)речовини світло-коричневого кольору. 6,7-диметил-4-фенокси-1Н-імідазо[4,5-с]піридин-1Частина Н іл]бутил-карбамату. N-[4-(2,6,7-Триметил-4-фенокси-1HЧастина В імідазо[4,5-с]піридин-1-іл)бутил]метанЗ використанням методики Частини F Прикласульфонамід (4.20г, 10.4ммоль) та ацетат амонію ду 7, матеріал з Частини А гідролізували з одер(42г) об'єднували ί потім нагрівали в запаяній тружанням 5.76г 4-[2-(етоксиметил)-6,7-диметил-4бці при 150°С протягом 36 годин. Реакційну суміш фенокси-1Н-імідазо[4,5-с]піридин-1-іл]бутан-1залишали охолоджуватися і потім н розчиняли в аміну у вигляді масла коричневого кольору. хлороформі. Розчин екстрагували 10% водним Частина С розчином гідроксиду натрію. Водний шар відокремлювали і потім екстрагували багато разів у хлороформі. Органічні шари об'єднували, висушували над сульфатом магнію і потім концентрували при зниженому тиску з одержанням масла жовтого З використанням методики Частини G Приккольору. Масло розчиняли в метанолі об'єднували ладу 7, 4-[2-(етоксиметил)-6,7-диметил-4-феноксиз 1М розчином хлористоводневої кислоти в діети1Н-імідазо[4,5-с]піридин-1-іл]бутан-1-аміну (5.52г, ловому етері (10.4мл). Одержаний осад білого 15.0ммоль) піддавали взаємодії з метансульфонокольору відокремлювали фільтрацією і висушувавим ангідридом (2.74г, 15.7ммоль), отримуючи ли. Тверду речовину розчиняли у воді і доводили 6.26г N-{4-[2-(етоксиметил)-6,7-диметил-4pH розчину до 10 за допомогою твердого карбонафенокси-1Н-імідазо4,5-с]піридин-1ту натрію. Одержаний осад білого кольору відоіл]бутил}метансульфонаміду у вигляді твердої кремлювали фільтрацією, промивали діетиловим речовини коричневого кольору. 33 74593 34 Частина D щено мішалку. Трубку запаювали і нагрівали при З використанням методики Частини Η Прикла150°С потягом 16 годин. Реакційну суміш охолоду 7, N-{4-[2-(етоксиметил)-6,7-диметил-4джували до кімнатної температури і розбавляли фенокси-1H-імідазо4,5-с]піридин-1водою. Одержану непрозору водну суміш підлужуіл]бутил}метансульфонамід (5.86г, 13.1ммоль) вали за допомогою 10% водного розчину гідроксиамінували з одержанням 1.58г N-{4-[4-аміно-2ду натрію та екстрагували хлороформом (3 (етоксиметил)-6,7-диметил-1H-імідазо4,525мл). Об'єднані органічні фракції промивали з с]піридин-1-іл]бутил}метансульфонамід у вигляді наступним промиванням насиченим розчином сотвердої речовини білого кольору, т.пл. 165-167°С. лі, висушували (Na2SО4), декантували і випарюваАналіз: Розраховано для C16H27N5O3S: %С, ли, отримуючи масло жовтого кольору. Очищен52.01; %Н, 7.37; %N, 18,95; ням флеш-колонковою хроматографією Одержано: %С, 51.83;%H,7.39;%N, 18.88. (силікагель, градієнтне елюювання від 95:5 дихлоПриклад 9 рметан/метанол до 9:1 дихлорметан/метанол і N-[4-(4-Aмінo-2-бyтил-6,7-димeтил-1Ннаприкінці 94:5:1 дихлормеімідaзo[4,5-c]піpидин-1-iл)бyтил]-4-[[2тан/метанол/триетиламін) одержували 14мг N-[4(диметиламіно)етокси](феніл)метил]бензамід (4-аміно-2-бутил-6,7-диметил-1H-імідазо[4,5с]піридин-1-іл)бутил]-4-[[2(диметиламіно)етокси](феніл)метил]бензамід у вигляді масла жовтого кольору. 1 H-ЯМР (500МГц, DMSO-d6) δ 8.41 (т, J = 5.5Гц, 1Н), 7.76.(д, J = 8.3Гц, 2Н); 7.43 (д, J = 8.3, 2Н), 7.37-7.31 (м, 4Н), 7.26-7.22 (м, 1Н), 5.84 (шс, 2Н), 5.52 (с, 1Н), 4.22 (т, J = 7.7Гц, 2Н), 3.49 (т, J = 5.8Гц, 2Н), 3.29 (дд, J = 6.4,12.4Гц, 2Н), 2.76 (т, J = 7.7Гц, 2Н), 2.58 (т, J = 5.7Гц, 2Н), 2.32 (с, 3Н), 2.27 (с, 3Н), 2.22 (с, 6Н), 1/73-1.65 (м, 4Н), 1.61-1.55 (м, 2Н), 1.35 (секстет, J = 7.4Гц, 2Н), 0.86 (т, J = 7.4Гц, 3Н); 13 С-ЯМР (125МГц, DMSO-d6) δ 165.9, 153.0, 148.1, 145.4, 142.0, 138.6, 133.5, 128.23, 127.4, 127.3, 127.1, 126.4, 126.1, 124.5, 103.0, 82.0, 66.3, 58.0, 45.2, 43.6, 38.4, 29.3, 28.8, 26.1,26.0,21.7,21.0,13.6,12.2. Частина А ВРМС (Cl) m/е 571.3763 (М+Н), (571.3761 розУ атмосфері азоту 4-(2-бутил-6,7-диметил-4раховано для C34H47N6O2, М+Н). фенокси-1Н-імідазо[4,5-с]піридин-1-іл)бутан-1-амін Індукування цитокіну в клітинах людини (122мг, 0.33ммоль) розчиняли в дихлорметані та Для визначення індукування цитокінів була витриетиламіні (0.093мл, 0.67ммоль). Розчин охолокористана система клітин крові людини in vitro. джували в бані з льодяною водою і 4-[[2Активність базується на вимірюванні інтерферону (диметиламіта фактору некрозу пухлини ( ) (lFN і TNF, відпоно)етокси](феніл)метил]бензоїлхлорид (106мг, відно), які секретуються в культуральному середо0.33ммоль) розчиняли/суспендували в дихлормевищі як описано у Testerman et. al. в "Cytokine тані та додавали по краплям. Льодяну баню приinduction by the lmmunomodulators imiquimod and Cбирали і реакцію перемішували протягом ще 16 27609", Journal of Leukocyte Biology, 58, 365-372 годин. Реакцію зупиняли додаванням 10% водного (September, 1995). розчину карбонату натрію. Фази відокремлювали і Одержання культури клітин крові водну фракцію екстрагували дихлорметаном. ОрВсю кров збирали шляхом пункції з вени в ганічні фракції об'єднували, промивали водою з пробірки вакуумного контейнера EDTA у здорових наступним промиванням насиченим розчином солюдей - донорів крові. Мононуклеарні клітини пелі, висушували (Na2SO4, декантували і випарювариферійної крові (РВМС) відділяли з усієї крові ли, отримуючи масло жовтого кольору. Очищеншляхом центрифугування за градієнтом густини ням флеш-колонковою хроматографією (силікагель, градієнтне елюювання від 92:8 дихловикористовуючи Histopaque -1077 (Sigma рметан/метанол до 95:5 дихлорметан/метанол) Chemicats, St. Louis, MO). РВМС суспендували до одержували 101мг N-[4-(2-бутил-6,7-диметил-43-4 106 клітини/мл в RPMl повний. Додавали суфенокси-1H-імідазо[4,5-с]піридин-1-іл)бутил]-4-[[2спензію РВМС до 48 луночних планшетів із плас(диметиламіно)етокси](феніл)метил]бензаміду у ким дном та з стерильною культурою тканини вигляді твердої речовини блідо-жовтого кольору. (Costar, Cambridge, MA або Becton Dickinson Чистота продукту, визначена за допомогою HPLC, Labware, Lincoln Park, NJ), які містили однаковий була 97+%. об'єм повних середовищ RPMl, які містили тестуєMS(Cl): 648 (М+Н). му сполуку. Частина В Приготування сполуки N-[4-(2-Бyτил-6,7-димeτил-4-фeнoкcи-1HСполуки розчиняли в диметилсульфокиді імідaзo[4,5-c]піpидин-1-iл)бyтил]-4-[[2(ДМСО). Концентрація ДМСО не повинна переви(диметиламіно)етокси](феніл)метил]бензамід щувати кінцеву концентрацію 1% для додавання в (101мг, 0.16ммоль) та ацетат амонію (1.1г) помілунок з культурою. Сполуки зазвичай досліджуващали в трубку під тиском, вздовж якої було розміли починаючи з концентрації в інтервалі від 0,12 35 74593 36 до 30мкМ. ферон- і на фактор некрозу пухлини ( ) за допоІнкубування могою ELlSA. Розчин сполуки, яку тестували, додавали до Аналіз на інтерферон ( ) та фактор некрозу першої лунки, яка містила повний RPMl, в кількості пухлин ( ) за допомогою EllSA 60мкМ і в лунках робили ряд 3-кратних розведень. Концентрація інтерферону ( ) визначалась за Суспензію ПКМК додавали до лунок в еквівалентдопомогою ELlSA використовуючи набір Human них кількостях, доводячи концентрації тестуємої Multi-Species від PBL Biomedicat Laboratories, New сполуки до бажаного рівня (0,12-30мкМ). Кінцевою Brunswick, NJ. Результати виражали в пг/мл. 6 концентрацією РВМС суспензії є 1,5-2 10 кліКонцентрація фактору некрозу пухлини ( ) тин/мл. Планшети накривали стерильними криш(TNF) визначалась за допомогою наборів ELlSA, ками з пластику, обережно перемішували, а потім які одержували від Genzyme, Cambridge, MA; R&D інкубували від 18 до 24 годин при 37°С в 5% атмоSystems, Minneapolis, MN; або Pharmingen, San сфері діоксиду вуглецю. Diego, CA. Результати виражали в пг/мл. Відокремлення Наведена нижче таблиця надає найнижчі конПісля інкубації, планшети центрифугували центрації, при яких індукується інтерферон, та протягом 5-10 хвилин при 1000об/хв. ( 200 g) найнижчі концентрації, при яких індукується факпри 4°С. Надосадкову рідину вільну від культуратор некрозу пухлини, для кожної сполуки. Позначльних клітин виділяли стерильною поліпропіленока "*" вказує на те, що не виявлено індукції при вою піпеткою і переносили до стерильних поліпроконцентраціях, які проходили тестування. піленових пробірок. Зразки зберігали при -30 до 70°С до аналізу. Зразки аналізувалися на інтерТаблиця Приклад № 1 2 3 4 5 6 7 8 Індукування цитокіну в клітинах людини Найнижча ефективна концентрація (мкМ) інтерферон Фактор некрозу пухлини 0,12 1,11 0,0046 0,01 0,01 0,37 0,12 0,37 0,01 0,12 0,01 0,01 0,37 * 0,04 10 Даний винахід описаний з посиланням на деякі його втілення. Вищенаведений детальний опис та приклади надані лише з метою його розуміння, і не повинні розумітися як його обмеження. Фахівцеві буде зрозумілим, що багато змін може бути зроблено до описаних варіантів реалізації без зміни Комп’ютерна верстка Л. Купенко суті та об'єму винаходу. Таким чином, об'єм винаходу не повинен бути обмежений конкретними деталізаціями композицій та структур, описаних тут, а скоріше може тлумачитися як форма викладнення формули винаходу, наведеної далі. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted imidazopyridines
Назва патенту російськоюЗамещенные имидазопиридины
МПК / Мітки
МПК: A61P 31/12, A61P 43/00, C07D 213/74, A61K 31/437, A61P 35/00, C07D 471/04
Мітки: імідазопіридини, заміщені
Код посилання
<a href="https://ua.patents.su/18-74593-zamishheni-imidazopiridini.html" target="_blank" rel="follow" title="База патентів України">Заміщені імідазопіридини</a>
Попередній патент: 4-галогеновані 17-метиленстероїди, спосіб їх одержання та фармацевтична композиція, яка містить ці сполуки
Наступний патент: Низькотемпературне пластичне мастило
Випадковий патент: Модель підземного сховища газу












