Фармацевтична композиція, що містить амлодипін та аторвастатин, спосіб її одержання та комплект
Номер патенту: 79750
Опубліковано: 25.07.2007
Автори: Хан Садат Улла, Мухаммад Нуман Абдул-Хуссейн, Алані Ламан, Макніл Томас Майкл
Формула / Реферат
1. Фармацевтична композиція, яка складається з двох компонентів:
(а) одного компонента, що містить гранулят аторвастатину або його фармацевтично прийнятні солі, носій та засіб підлужування, який створює рН більше 5; та
(б) другого компонента у сухій порошкоподібній формі, що містить амлодипін або його фармацевтично прийнятну сіль та носій, причому співвідношення аторвастатину або його фармацевтично прийнятної солі і згаданого підлужувального агента в компоненті (а) складає від приблизно 1 : 1 до приблизно 1 : 4 (за вагою), і обидва компоненти скомбіновано з утворенням кінцевої композиції у вигляді твердої лікарської форми.
2. Фармацевтична композиція за п. 1, в якій засіб підлужування у компоненті (а) вибрано з групи, що складається з кальцій карбонату, дикальцій фосфату та трикальцій фосфату.
3. Фармацевтична композиція за п. 1, що містить приблизно 0,25-10 % амлодипіну або його фармацевтично прийнятної солі та приблизно 2,5-20 % аторвастатину або його фармацевтично прийнятної солі.
4. Фармацевтична композиція за п. 1, що містить приблизно 0,5-20 мг амлодипіну або його фармацевтично прийнятної солі та приблизно 0,5-160 мг аторвастатину або його фармацевтично прийнятної солі.
5. Фармацевтична композиція за п. 1, що містить амлодипін-безилат та кальцій-аторвастатин.
6. Фармацевтична композиція за п. 1, що містить комбінацію, вибрану з групи, яка складається з
кальцій-аторвастатину, 5 мг, та амлодипін-безилату, 2,5 мг;
кальцій-аторвастатину, 10 мг, та амлодипін-безилату, 2,5 мг;
кальцій-аторвастатину, 20 мг, та амлодипін-безилату, 2,5 мг;
кальцій-аторвастатину, 40 мг, та амлодипін-безилату, 2,5 мг;
кальцій-аторвастатину, 80 мг, та амлодипін-безилату, 2,5 мг;
кальцій-аторвастатину, 5 мг, та амлодипін-безилату, 5 мг;
кальцій-аторвастатину, 10 мг, та амлодипін-безилату, 5 мг;
кальцій-аторвастатину, 20 мг, та амлодипін-безилату, 5 мг;
кальцій-аторвастатину, 40 мг, та амлодипін-безилату, 5 мг;
кальцій-аторвастатину, 80 мг, та амлодипін-безилату, 5 мг;
кальцій-аторвастатину, 5 мг, та амлодипін-безилату, 10 мг;
кальцій-аторвастатину, 10 мг, та амлодипін-безилату, 10 мг;
кальцій-аторвастатину, 20 мг, та амлодипін-безилату, 10 мг;
кальцій-аторвастатину, 40 мг, та амлодипін-безилату, 10 мг; та
кальцій-аторвастатину, 80 мг, та амлодипін-безилату, 10 мг.
7. Спосіб отримання фармацевтичної композиції за будь-яким з пп. 1-6, який полягає в тому, що
[A] аторвастатин гранулюють,
(1) розчиняючи поверхнево-активний засіб у воді та додаючи і гідратуючи зв'язуючий засіб,(2) змішуючи кальцій-аторвастатин, засіб підлужування, що створює рН більше 5, наповнювач-розріджувач, наповнювач-розріджувач-дезінтегратор та дезінтегратор у гранулювальному апараті,
(3) утворюючи гранули порошкової суміші з операції (2) у розчині з операції (1) у гранулювальному апараті, та
(4) висушуючи гранулят у сушильному апараті;
[B] отримують готовий продукт,
(1) додаючи амлодипін-безилат, наповнювач-розріджувач, дезінтегратор та речовину, що поліпшує плинність гранулята до гранулята аторвастатину,
(2) пропускаючи порошкову суміш через подрібнювач, та
(3) змішуючи подрібнену суміш та змащувальний засіб у змішувачі для отримання однорідної змішаної фармацевтичної композиції для твердої лікарської форми.
8. Фармацевтична композиція за будь-яким з пп. 1-6, яка містить не більше 2 % загальних забруднень та/або продуктів розкладання аторвастатину, та не більше 2 % загальних забруднень та/або продуктів розкладання амлодипіну після зберігання при 25 °С та 60 % відносної вологості протягом 24 місяців.
9. Фармацевтична композиція за будь-яким з пп. 1-6, яка містить не більше 0,5 % сполуки, вибраної з групи, що складається з
5-(4-флуорфеніл)-2,3-дигідро-β,δ-дигідрокси-3-(1-метилетил)-2-оксо-4-феніл-3-[(феніламіно)карбоніл]-1Н-пірол-1-гептанової кислоти,
(2R-транс)-5-(4-флуорфеніл)-2-(1-метилетил)-N,4-дифеніл-1-[2-(тетрагідро-4-гідрокси-6-оксо-2Н-піран-2-іл)етил]-1Н-пірол-3-карбоксаміду та
3-[(4-флуорфеніл)карбоніл]-2-(2-метил-1-оксопропіл)-N,3-дифеніл-2-оксиранкарбоксаміду, після зберігання при 25 °С та 60 % відносної вологості протягом 24 місяців.
10. Фармацевтична композиція за будь-яким з пп. 1-6, яка містить не більше 1,0 % сполуки, вибраної з групи, що складається з
2-(2-аміноетоксиметил)-4-(2-хлорфеніл)-6-метилпіридин-3,5-дикарбонової кислоти 3-етилового естеру 5-метилового естеру та
6-(2-хлорфеніл)-8-метил-3,4,6,7-тетрагідро-2Н-1,4-бензоксазин-5,7-дикарбонової кислоти 5-етилового естеру 7-метилового естеру, після зберігання при 25°С та 60 % відносної вологості протягом 24 місяців.
11. Фармацевтична композиція за будь-яким з пп. 1-6 та 8-10 для лікування суб'єкта, що страждає на стенокардію, атеросклероз, комбіновану гіпертензію та гіперліпідемію та/або гіперхолестеринемію, та для лікування суб'єкта з симптомами серцевого ризику.
12. Комплект для отримання терапевтичного ефекту під час лікування суб'єкта, що страждає на стенокардію, атеросклероз, комбіновану гіпертензію та гіперліпідемію та/або гіперхолестеринемію, та для лікування суб'єкта з симптомами серцевого ризику, який містить фармацевтичну композицію за будь-яким з пп. 1-6 та 8-11 у вигляді лікарської форми та контейнер для зберігання зазначеної лікарської форми, яка містить не більше ніж 2 % загальних забруднень та/або продуктів розкладання аторвастатину та не більше ніж 2 % загальних забруднень та/або продуктів розкладання амлодипіну після зберігання при 25 °С та 60 % відносної вологості протягом 24 місяців.
Текст
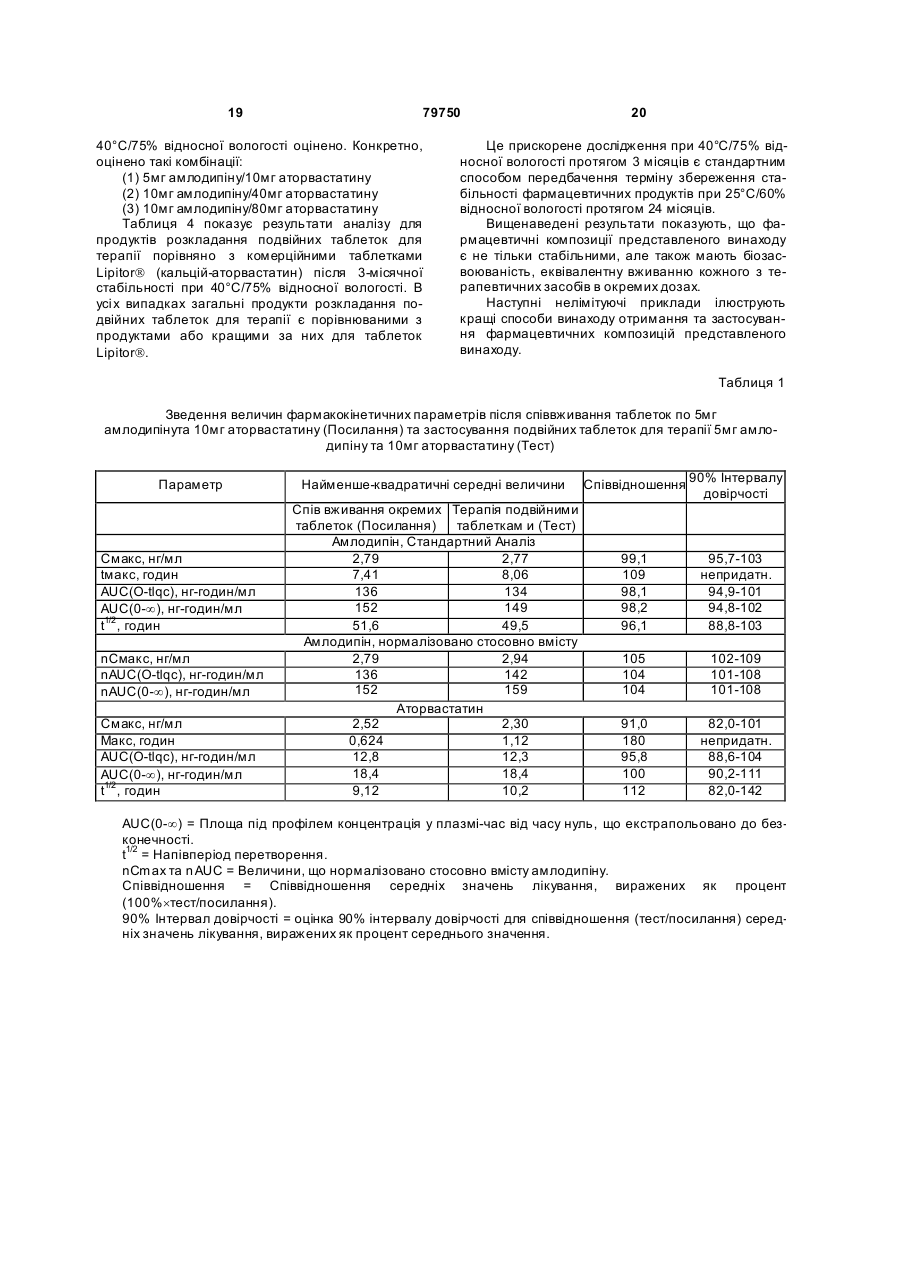
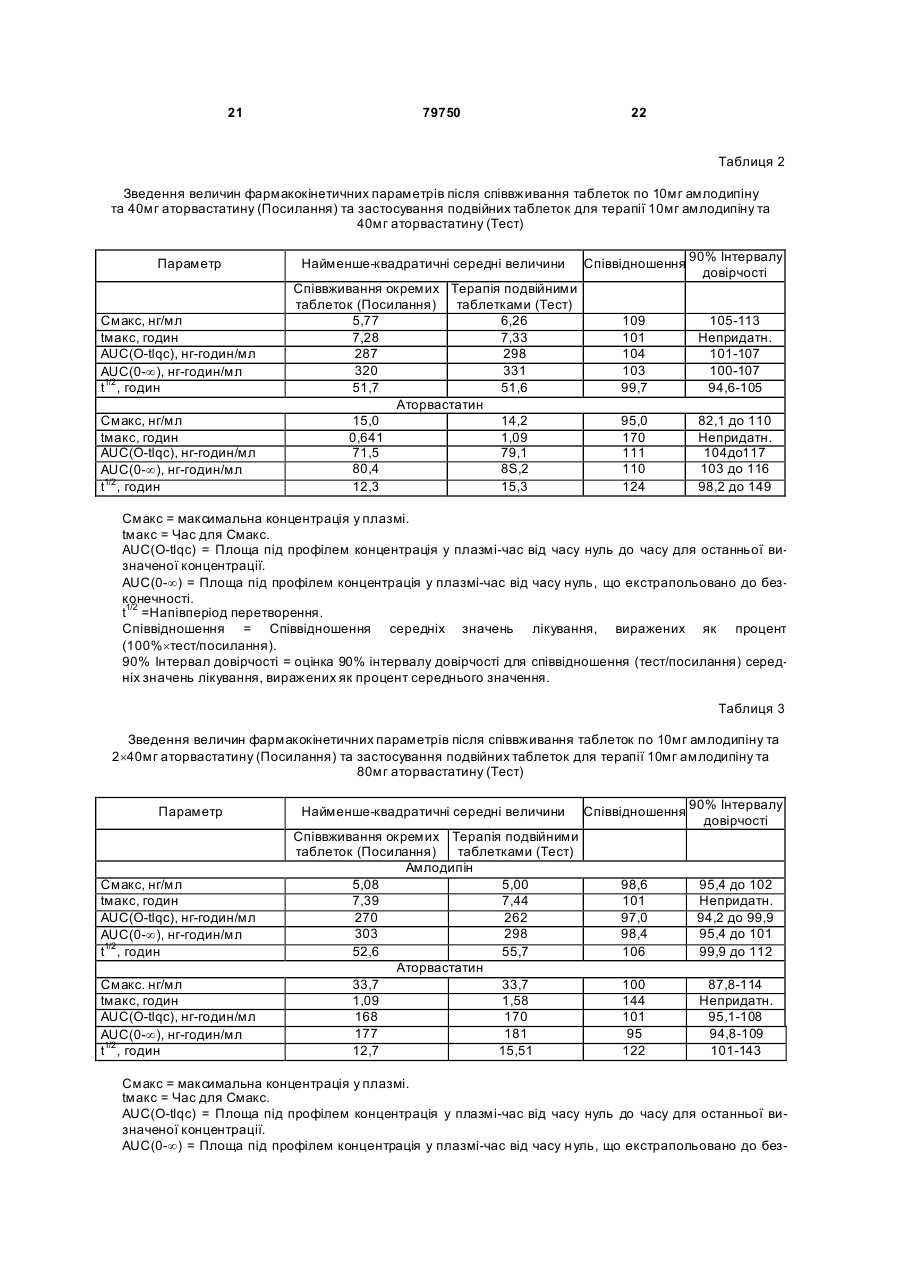
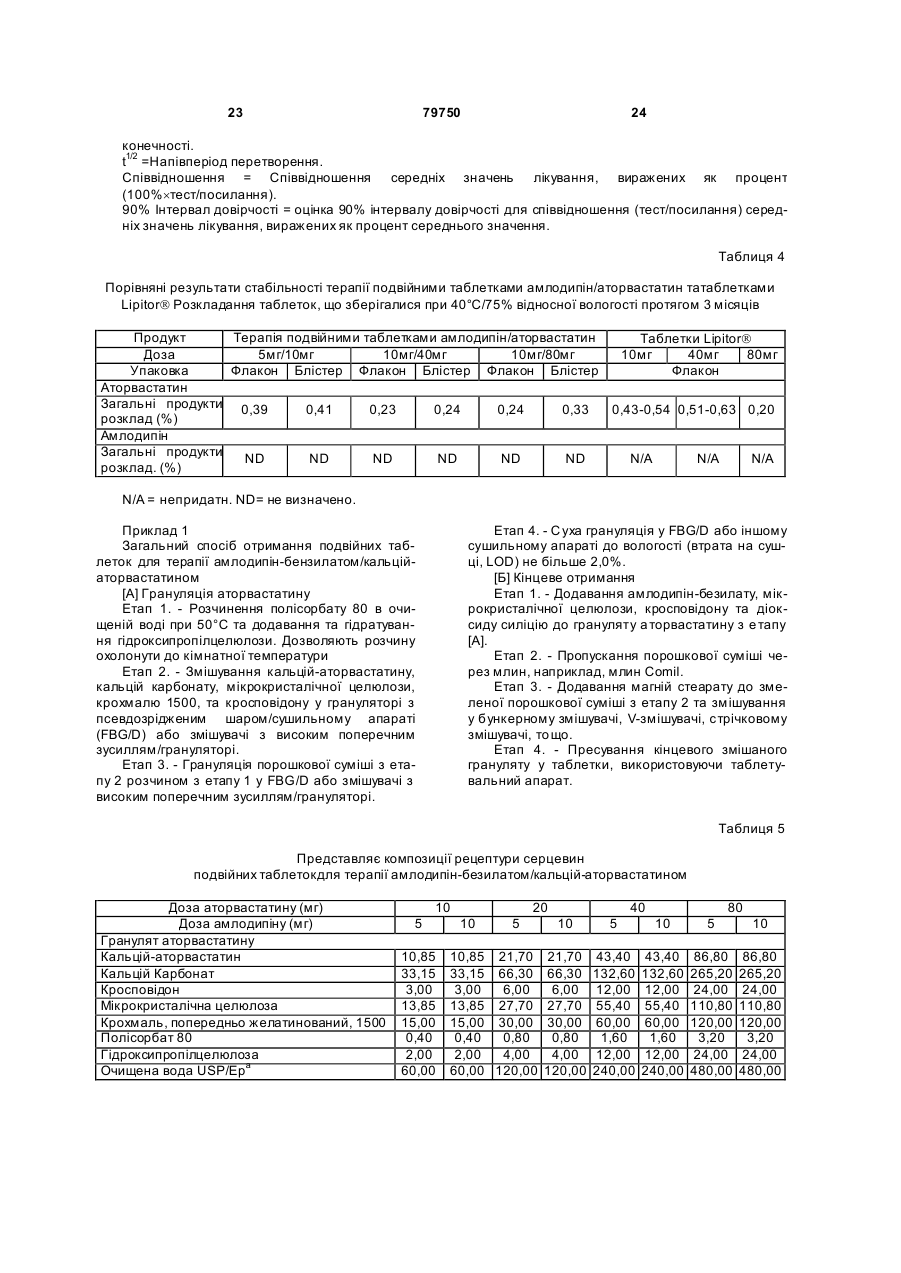
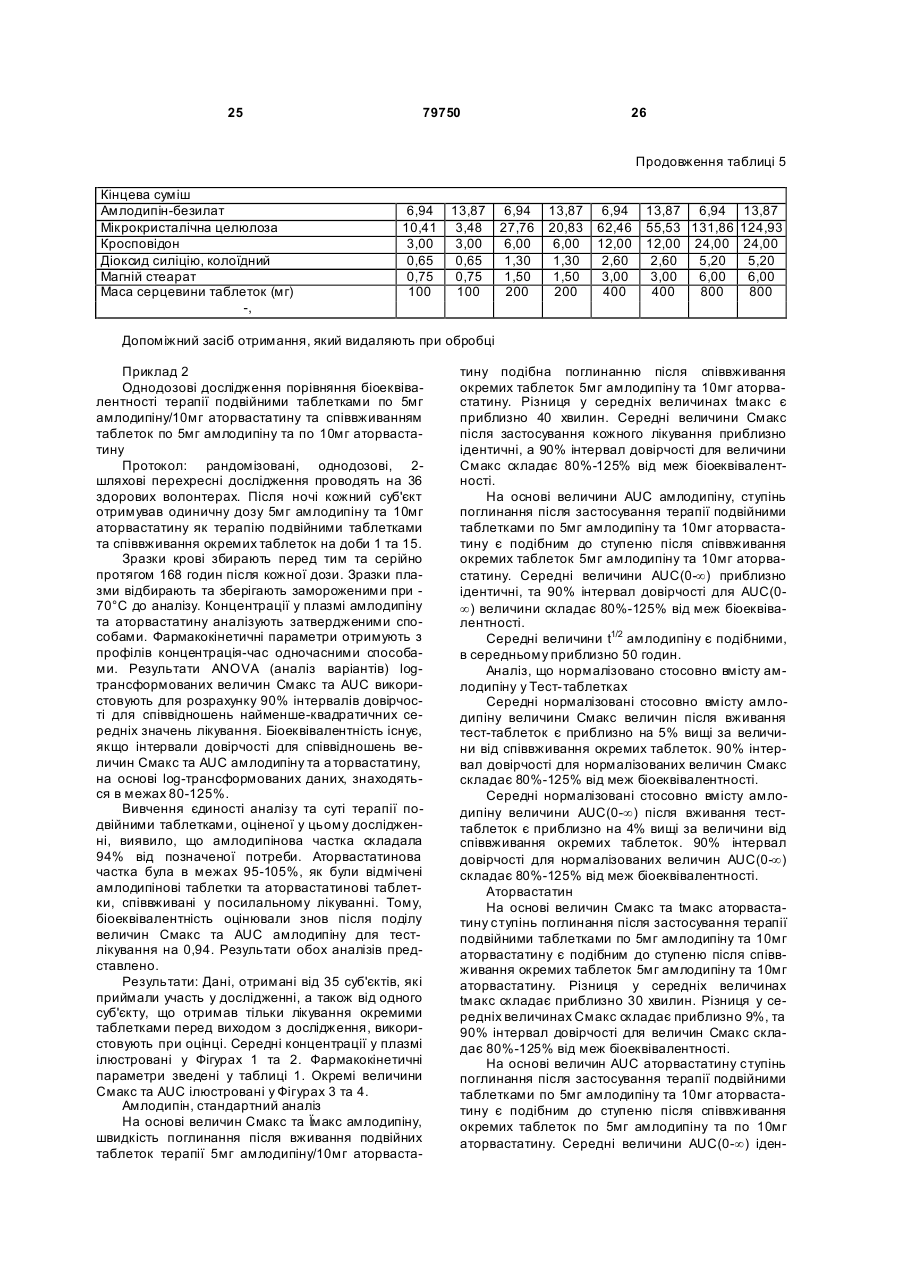
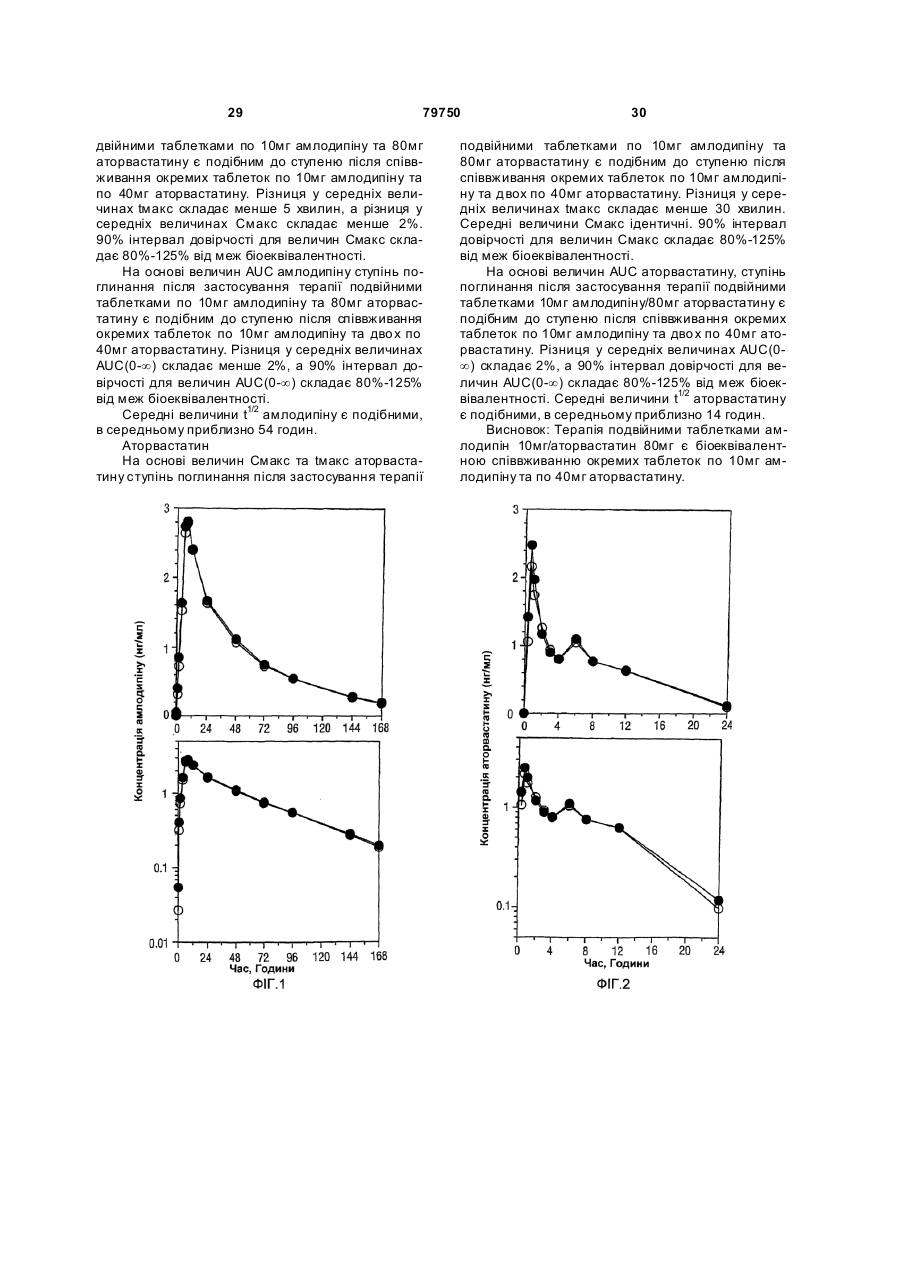
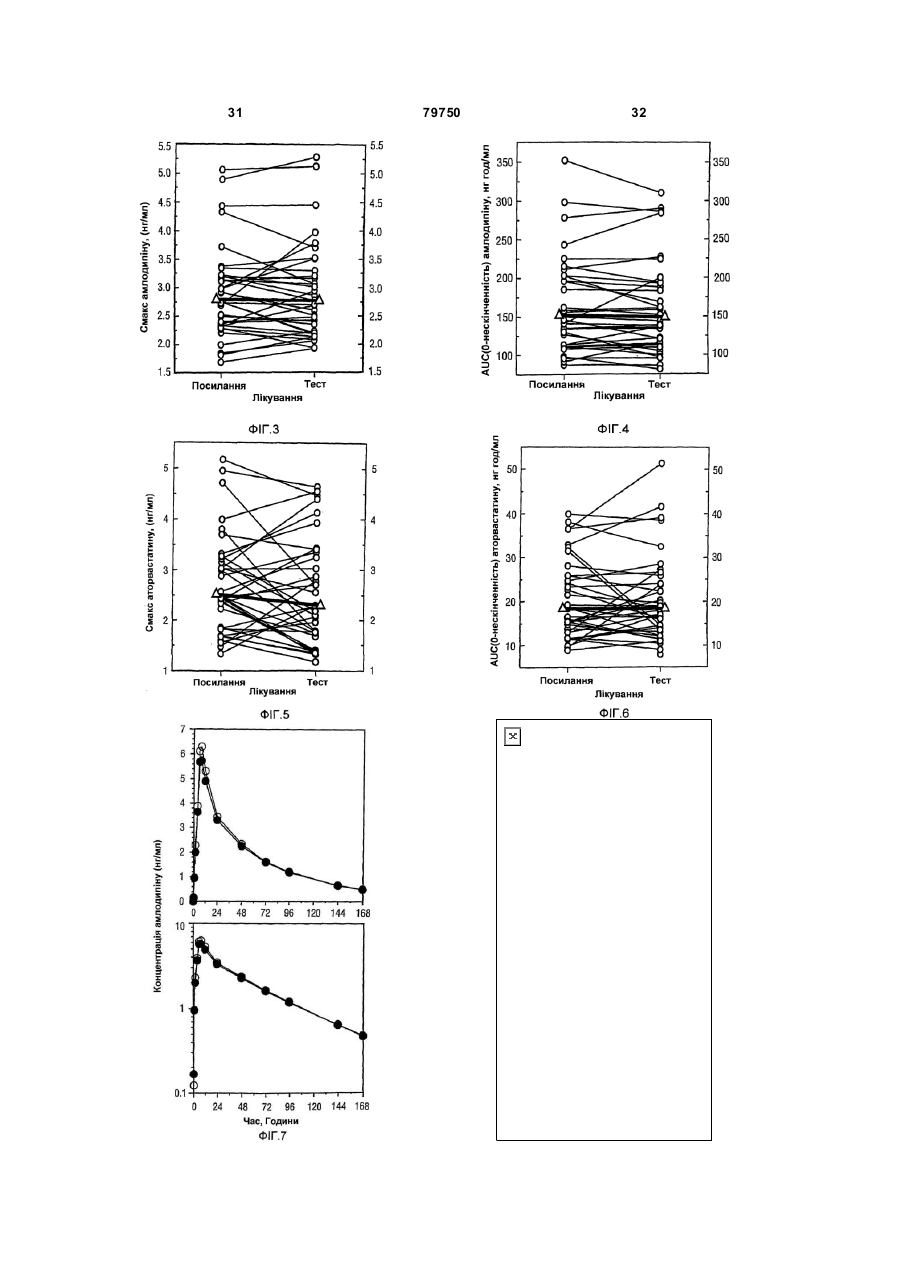
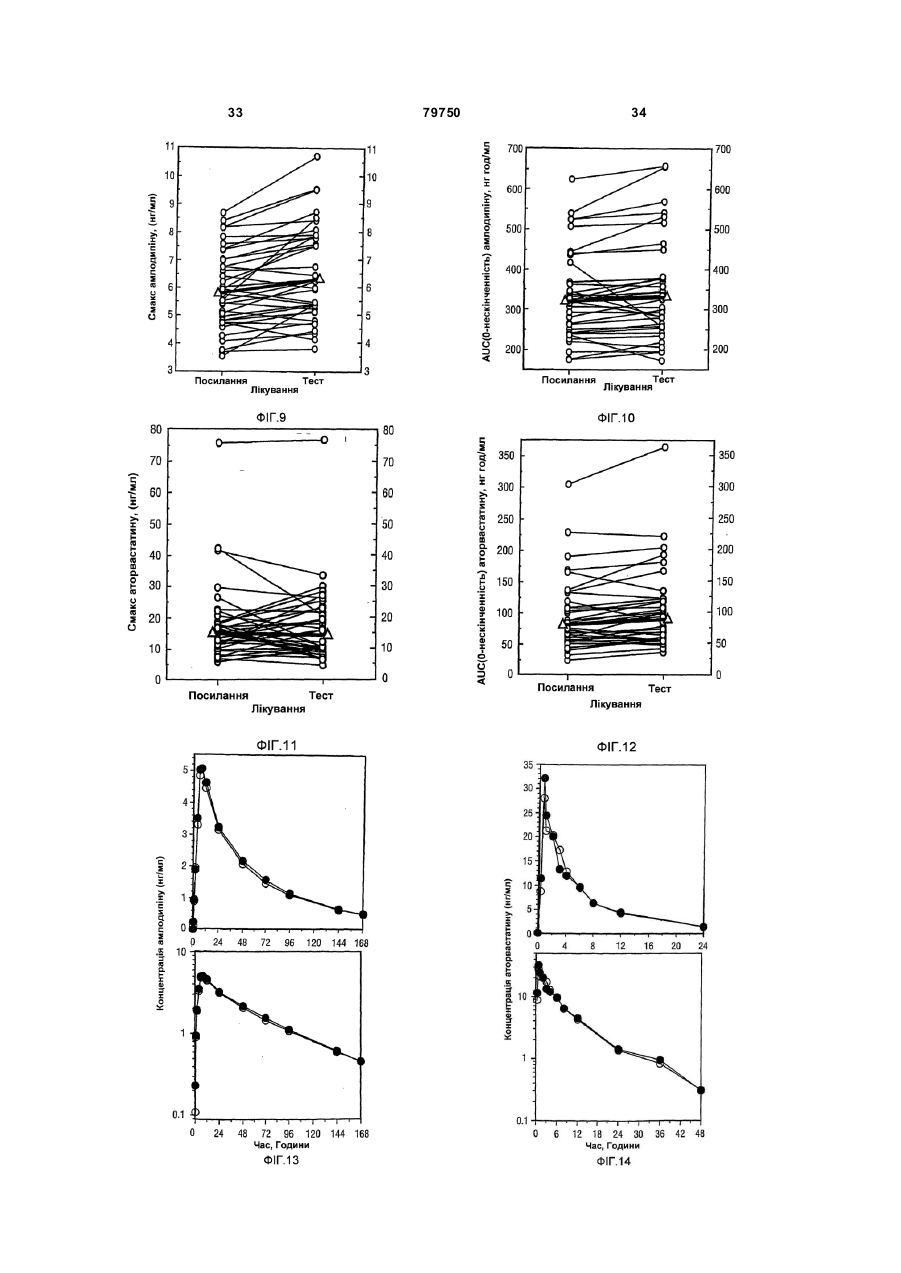
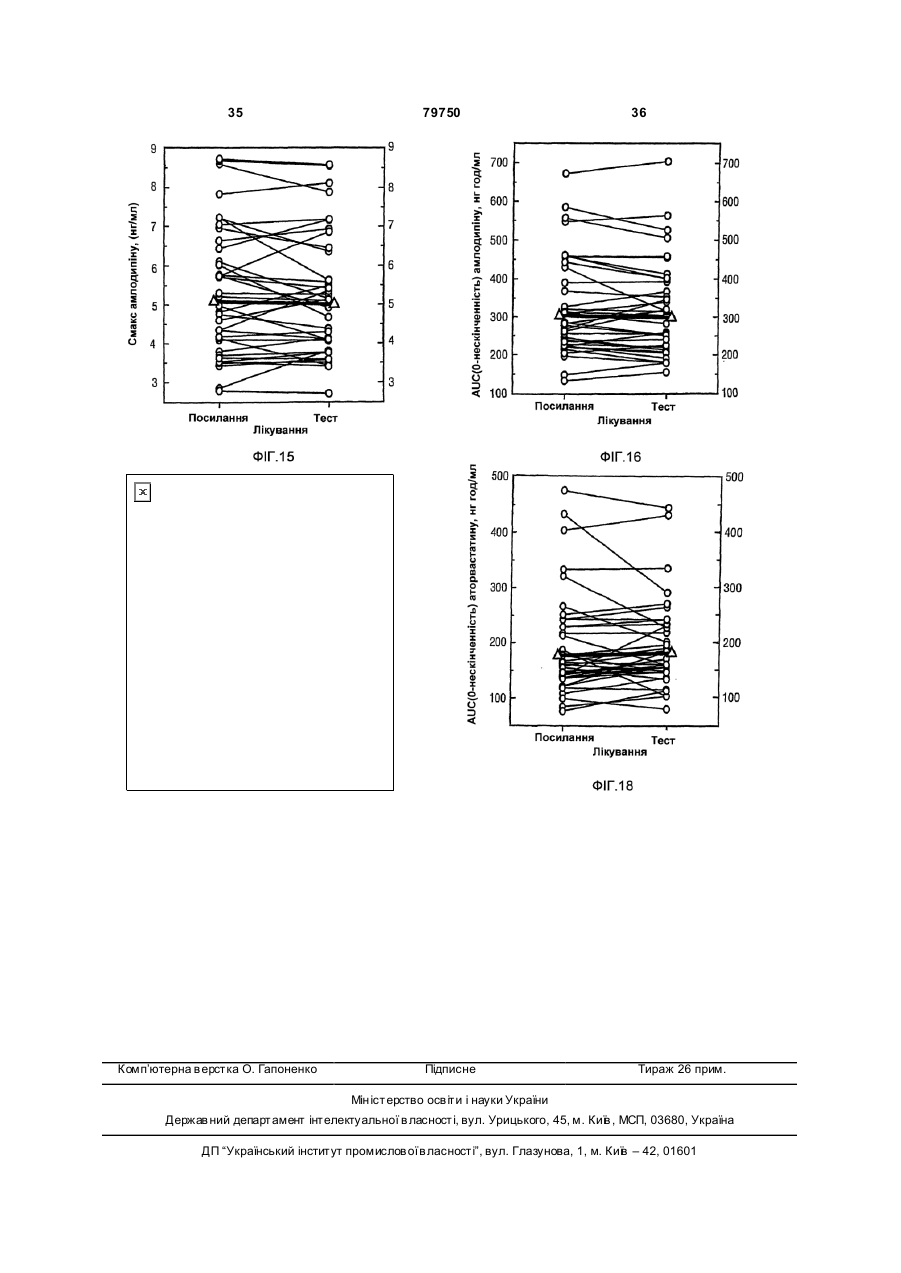
1. Фармацевтична композиція, яка складається з двох компонентів: (а) одного компонента, що містить гранулят аторвастатину або його фармацевтично прийнятні солі, носій та засіб підлужування, який створює рН більше 5; та (б) другого компонента у сухій порошкоподібній формі, що містить амлодипін або його фармацевтично прийнятну сіль та носій, причому співвідношення аторвастатину або його фармацевтично прийнятної солі і згаданого підлужувального агента в компоненті (а) складає від приблизно 1 : 1 до приблизно 1 : 4 (за вагою), і обидва компоненти скомбіновано з утворенням кінцевої композиції у вигляді твердої лікарської форми. 2. Фармацевтична композиція за п. 1, в якій засіб підлужування у компоненті (а) вибрано з групи, що складається з кальцій карбонату, дикальцій фосфату та трикальцій фосфату. 3. Фармацевтична композиція за п. 1, що містить приблизно 0,25-10 % амлодипіну або його фармацевтично прийнятної солі та приблизно 2,5-20 % аторвастатину або його фармацевтично прийнятної солі. 4. Фармацевтична композиція за п. 1, що містить приблизно 0,5-20 мг амлодипіну або його фарма 2 (19) 1 3 79750 4 (1) розчиняючи поверхнево-активний засіб у воді та додаючи і гідратуючи зв'язуючий засіб,(2) змішуючи кальцій-аторвастатин, засіб підлужування, що створює рН більше 5, наповнювачрозріджувач, наповнювач-розріджувачдезінтегратор та дезінтегратор у гранулювальному апараті, (3) утворюючи гранули порошкової суміші з операції (2) у розчині з операції (1) у гранулювальному апараті, та (4) висушуючи гранулят у сушильному апараті; [B] отримують гото вий продукт, (1) додаючи амлодипін-безилат, наповнювачрозріджувач, дезінтегратор та речовину, що поліпшує плинність гранулята до гранулята аторвастатину, (2) пропускаючи порошкову суміш через подрібнювач, та (3) змішуючи подрібнену суміш та змащувальний засіб у змішувачі для отримання однорідної змішаної фармацевтичної композиції для твердої лікарської форми. 8. Фармацевтична композиція за будь-яким з пп. 16, яка містить не більше 2 % загальних забруднень та/або продуктів розкладання аторвастатину, та не більше 2 % загальних забруднень та/або продуктів розкладання амлодипіну після зберігання при 25 °С та 60 % відносної вологості протягом 24 місяців. 9. Фармацевтична композиція за будь-яким з пп. 16, яка містить не більше 0,5 % сполуки, вибраної з групи, що складається з 5-(4-флуорфеніл)-2,3-дигідро-β,δ-дигідрокси-3-(1метилетил)-2-оксо-4-феніл-3[(феніламіно)карбоніл]-1Н-пірол-1-гептанової кислоти, (2R-транс)-5-(4-флуорфеніл)-2-(1-метилетил)-N,4дифеніл-1-[2-(тетрагідро-4-гідрокси-6-оксо-2Нпіран-2-іл)етил]-1Н-пірол-3-карбоксаміду та 3-[(4-флуорфеніл)карбоніл]-2-(2-метил-1оксопропіл)-N,3-дифеніл-2-оксиранкарбоксаміду, після зберігання при 25 °С та 60 % відносної вологості протягом 24 місяців. 10. Фармацевтична композиція за будь-яким з пп. 1-6, яка містить не більше 1,0 % сполуки, вибраної з групи, що складається з 2-(2-аміноетоксиметил)-4-(2-хлорфеніл)-6метилпіридин-3,5-дикарбонової кислоти 3етилового естеру 5-метилового естеру та 6-(2-хлорфеніл)-8-метил-3,4,6,7-тетрагідро-2Н-1,4бензоксазин-5,7-дикарбонової кислоти 5-етилового естеру 7-метилового естеру, після зберігання при 25°С та 60 % відносної вологості протягом 24 місяців. 11. Фармацевтична композиція за будь-яким з пп. 1-6 та 8-10 для лікування суб'єкта, що страждає на стенокардію, атеросклероз, комбіновану гіпертензію та гіперліпідемію та/або гіперхолестеринемію, та для лікування суб'єкта з симптомами серцевого ризику. 12. Комплект для отримання терапевтичного ефекту під час лікування суб'єкта, що страждає на стенокардію, атеросклероз, комбіновану гіпертензію та гіперліпідемію та/або гіперхолестеринемію, та для лікування суб'єкта з симптомами серцевого ризику, який містить фармацевтичну композицію за будь-яким з пп. 1-6 та 8-11 у вигляді лікарської форми та контейнер для зберігання зазначеної лікарської форми, яка містить не більше ніж 2 % загальних забруднень та/або продуктів розкладання аторвастатину та не більше ніж 2 % загальних забруднень та/або продуктів розкладання амлодипіну після зберігання при 25 °С та 60 % відносної вологості протягом 24 місяців. Цей винахід стосується фармацевтичних композицій, що містять амлодипін і його фармацевтично прийнятні солі, та аторвастатин і його фармацевтично прийнятні солі, та спосіб їх отримання, комплекти, що містять так композиції, а також способи використання таких композицій для лікування суб'єктів, що потерпають від стенокардії, атеросклерозу, комбінованої гіпертензії та гіперліпідемії та/або гіперхолестеринемії, та для лікування суб'єктів з симптомами серцевого ризику, включаючи людей. Перетворення 3-гідрокси-3-метилглутарилкоферменту A (HMG-Co A) у мевалонат є початковою та лімітуючою швидкість стадією у біосинтетичному шля ху обміну холестерину Ця стадія каталізується ферментом HMG-CoA-редуктазою Статини інгібують HMG-CoA-редуктазу від каталізу цього перетворення. Як такі, статини є разом потужними ліпід-понижуючими засобами. Аторвастатин-кальцій, розкритий у [патенті США №5273995], який представлено як посилання, зараз продають як LipitorÒ, що має хімічну на зву тригідрат солі кальцію (2:1) [R-(R*,R*)]-2-(4флуорфеніл)-b,d-дигідрокси-5-(І-метилетил)-3феніл-4-[(феніламіно)карбоніл]-1Н-пірол-1гептанової кислоти та формулу Аторвастатин та його фармацевтично прийнятні солі є селективними, конкурентними інгібіторами HMG-CoA-редуктази. Як такий, кальційаторвастатин є потужною ліпід-понижуючою сполукою та є тому корисним як гіполіпідемічний 5 79750 та/або гіпохолестеринемічний засіб. [Патент США №4681893], який представлено як посилання, розкриває деякі транс-6-[2-(3- або 4карбоксамідо-заміщені-пірол-1-іл)алкіл]-4-гідроксипіран-2-они, включаючи транс (±)-5-(4флуорфеніл)-2-(І-метилетил)-N,4-дифеніл-1-[(2тетрагідро-4-гідрокси-6-оксо-2Н-піран-2-іл)етил]1Н-пірол-3-карбоксамід. [Патент США №5273995], який представлено як посилання, розкриває енантіомер, що має Rформу кислоти з відкритим кільцем транс-5-(4флуорфеніл )-2-(1-метилетил )-N,4-дифеніл-1-[(2тетрагідро-4-гідрокси-6-оксо-2Н-піран-2-іл)етил]1Н-пірол-3-карбоксаміду, тобто, [R-(R*,R*)]-2-(4флуорфеніл)-b,d-дигідрокси-5-(І-метилетил)-3феніл-4-[(феніламіно)-карбоніл]-1Н-пірол-1гептанової кислоти, якою є аторвастатин. [Патенти США №5003080; 5097045; 5103024; 5124482; 5149837; 5155251; 5216174; 5245047; 5248793; 5280126; 5397792; 5342952; 5298627; 5446054; 5470981; 5489690; 5489691; 5510488; 5998633; та 6087511], які представлені як посилання, розкривають різноманітні способи та ключові інтермедіати для отримання аторвастатину. Кристалічні форми кальцій-аторвастатину розкриті у [патентах США №s 5969156 та 6121461], які представлені як посилання. Стабільні пероральні композиції рецептур кальцій-аторвастатину розкриті у [патентах США №s 5686104 та 6126971]. Амлодипін та споріднені дигідропіридинові сполуки розкриті у [патенті США №4572909], який представлено як посилання, як потужні антиішемічні та антигіпертензивні засоби. [Патент США №4879303], який представлено як посилання, розкриває амлодипін бензолсульфонат (також під назвою амлодипін-безилат). Амлодипін та амлодипін-безилат є потужними та довгодіючими блокаторами кальцій-каналів. Як такий, амлодипін, амлодипін-безилат та інші фармацевтично прийнятні кислотно-адитивні солі амлодипіну мають корисність як антигіпертензивні засоби та як антиішемічні засоби. Амлодипін та його фармацевтично прийнятні кислотно-адитивні солі також розкриті у [патенті США №5155120] як такі, що мають корисність при лікуванні застійної серцевої нестачі. Амлодипін-безилат зараз продають як NorvascÒ. Амлодипін має формулу Атеросклероз є станом, що характеризується нерівномірно розподіленими ліпідними відкладеннями в інтимі артерій, включаючи коронарні, сонні та периферійні артерії. Атеросклеротична коронарна хвороба серця (далі під назвою "CHD"), як вважають, дає 53% усіх смертей від серцевосудинних інцидентів. CHD, як вважають, дає приблизно половину (приблизно $50-$60 більйонів) загальних витрат на о хорону здоров'я у США від 6 серцево-судинних захворювань та приблизно 6% загальних національних медичних витрат кожного року. Незважаючи на спроби пом'якшати вторинні фактори ризику, як-то, серед іншого, паління, ожиріння і нестача фізичних вправ, та лікування дисліпідемії зміною харчування та терапією ліками, CHD залишається найпоширенішою причиною смертей у США. Висок рівні холестерину та ліпідів у крові є умовами, залученими у початок атеросклерозу. Добре відомо, що інгібітори редуктази 3-гідрокси3-метилглутарил-коферменту (H MG-CoAредукгаза) є ефективними при пониженні рівня холестерину у плазмі крові, особливо ліпопротеїнів холестерину низької густин (LDL-C), у людини [Brown and Goldstein, New England Journal of Medicine, 1981;305(9):515-517]. Зараз виявлено, що пониження рівнів LDL-C захищає від коронарної хвороби серця [дивись, наприклад, Scandinavian Simvastatin Survival Study Group. Рандомізоване дослідження пониження холестерину у 4444 пацієнтів з коронарною хворобою серця: Scandinavian Simvastatin Survival Study (4S), Lancet, 1994;344:1383-1389; та Shepherd J. et aL Попередження коронарної хвороби серця правастатином у людини з гіперхолестеринемією. New England Journal of Medicine, 1995;333:1301-1307]. Стенокардія є суворим стискаючим болем у грудній клітині, що часто ірадіює від передсердя до лівого плеча та нижче у ліву рук у. Часто стенокардія обумовлена ішемією серця та звичайно викликанакоронарною хворобою. Зараз лікування симптоматичної стенокардії значно варіює від країни до країни. У США пацієнтів з симптоматичною стабільною стенокардією часто лікують хірургічно або підшкірною транслюмінальною коронарною ангіопластикою (РТСА). Пацієнти, яких лікують РТСА або іншими хірургічними способами лікування стенокардії, часто відчувають ускладнення, як-то рестеноз. Цей рестеноз може виражатися як коротко-термінова проліферативна реакція на індуковану ангіопластикою травмі або як довго-термінова прогресія атеросклеротичного процесу у трансплантованих судинах та ангіопластичних сегментах. Симптоматична терапія стенокардії включає застосування ряду ліків, часто як комбінацію двох або більше таких класів: бета-блокатори. нітрати та блокатори кальцій-каналу. Більшість, якщо не всі з цих пацієнтів потребують терапії засобом пониження ліпідів також. Національна програма холестеринової освіти (NCEP) виділяє пацієнтів з хворобою коронарних артерій як особливий клас, що потребує агресивної терапії підвищеного LDL-C. Амлодипін допомагає попереджувати міокардіальну ішемію у пацієнтів зі стенокардією напруги зменшенням загальної периферійної резистентності, або постнавантаження, яке зменшує продукування величини тиску та таким чином потребу міокарду у кисні при будь-якому певному рівні фізичних вправ. У пацієнтів з вазоспастичною стенокардією амлодипін продемонстрував блокування скорочення, відновлюючи таким чином міокардіальну подачу кисню. Крім того амлодипін, як 7 79750 показано, збільшує міокардіальну подачу кисню розширенням коронарних артерій. Гіпертензія часто співіснує з гіперліпідемією і їх вважають головними факторами ризику для розвитку серцевої хвороби, що в кінцевому рахунку призводить до несприятливих серцевих інцидентів. Ця кластеризація факторів ризику є потенційно обумовленою загальним механізмом. Крім того піддатливість пацієнта терапії гіпертензії є загалом кращою, ніж піддатливість пацієнта гіперліпідемії. Це може мати перевагу для пацієнтів, що отримують одиночну терапію, яка лікує обидва ці стани. Коронарна хвороба серця є багатофакторною хворобою, в якій інцидентність та суворість залежать від ліпідного профілю, наявності діабету та статі суб'єкту. Інцидентність також залежить від паління та гіпертрофії лівого шлуночка як є вторинної до гіпертензії. Для вираженого зменшення ризику коронарної хвороби серця важливо зважати на повний спектр ризику. Наприклад, дослідження впливу гіпертензії продемонстрували повну нормалізацію серцево-судинної смертності, обумовленої коронарною хворобою серця. Лікування інгібіторами синтезу холестерину у пацієнтів з коронарною артеріальною хворобою та без неї зменшує ризик серцево-судинної захворюваності та смертності. Дослідження серця Framingham Heart Study, де проводили перспективні дослідження дорослих чоловіків та жінок, показали, що деякі фактори ризику можна використовувати для передбачення розвитку коронарної хвороби серця [дивись Wilson et al., Am. J. Cardiol., 1987;59(14):91G-94G]. Ці фактори включають вік, стать, рівні загального холестерину, рівні ліпопротеїнів високої густини (HDL), систолічний тиск крові, паління сигарет, нестерпність до глюкози та серцеве розширення (гіпертрофія лівого шлуночка на електрокардіограмі, ехокардіограмі або збільшене серце на рентгенограмі грудної клітки). Калькулятори та комп'ютери можна легко програмувати, використовуючи багатомірну логістичну функцію, що дозволяє розрахувати умовну ймовірність серцево-судинних інцидентів. Ці дослідження, основані на вивченні 5209 чоловіків та жінок, що приймали участь у дослідженні Framingham, оцінюють ризик коронарної артеріальної хвороби протягом змінних періодів наступного спостереження. Модельовані значення інцидентності знаходяться в межах від менше 1% до більше 80% протягом довільно вибраного 6річного інтервалу. Однак, ці значення звичайно менше 10% та рідко перевищують 45% у чоловіків та 25% у жінок. [Kramsch et al., Journal of Human Hypertension, 1995;(Suppl. l):53-59], розкривають застосування блокаторів кальцій-каналів, включаючи амлодипін, для лікування атеросклерозу. Це посилання крім того свідчить, що атеросклероз можна лікувати комбінацією амлодипіну та засобу пониження ліпідів. Дослідження людини показали, що блокатори кальцій-каналів мають корисну дію при лікуванні ранніх атеросклеротичних уражень [дивись, наприклад, Lichtlen P.R. et al., Retardation of angiographic progression of coronary artery disease by nifedipine (Затримка ангіографічної прогресії 8 коронарної артеріальної хвороби ніфедипіном). Lancet, 1990;335:1109-1113; та Waters D. et al., A controlled clinical trial to assess the effect of a calcium channel blocker on the progression of coronary atherosclerosis (Контрольовані клінічні дослідження дії блокатору кальцій-каналів на прогресію коронарного атеросклерозу, Circulation, 1990;82.1940-1953)]. [Патент США №4681893] розкриває, що деякі статини, включаючи аторвастатин, є гіполіпідемічними засобами та як такі є корисними при лікуванні атеросклерозу. [Jukema et al.. Circulation. 1995; (Suppl. 1):1-197], розкривають, що є свідоцтва, що блокатори кальцій-каналів діють синергетично у комбінації з засобами пониження ліпідів (наприклад, інгібіторами HMG-CoAредуктази), конкретно правастатин. [Orekhov et al., Cardiovascular Drugs and Therapy, 1997; 11:350], розкривають застосування амлодипіну у комбінації з ловастатином для лікування атеросклерозу. Опублікована [міжнародна патентна заявка WO 99/11259розкриває терапевтичні комбінації, що містять амлодипін та аторвастатин. Таким чином, пацієнтам, що потребують дуальної терапії, бажано мати змогу вживати ці два фармацевтичні засоби. Крім того ще більш бажано мати змогу вживати обидва ці два фармацевтичні засоби у формі дозованої одиниці. Тому об'єктом представленого винаходу є стабільна форма дози, що має гарну біозасвоюваність. Крім того об'єктом представленого винаходу є стабільна композиція з низьким рівнем забруднень та/або продукти розкладання, що можуть з'являтися при отриманні та/або наступному зберіганні композиції. Ми несподівано виявили, що амлодипін та аторвастатин можна формувати у дозовані одиниці, що є стабільними, мають біозасвоюваність, еквівалентну застосуванню кожного терапевтичного засобу у окремій формі дози, та містять дуже низькі рівні забруднень та/або продуктів розкладання, незважаючи на відому несумісність між амлодипіном та аторвастатином. Відповідно, першим аспектом представленого винаходу є фармацевтична композиція, що містить два компоненти: (a) один компонент, що містить грануляційний аторвастатин або його фармацевтично прийнятні солі та носій, включаючи засіб підлужування, що утворює рН більше 5; та (b) другий компонент, що містить амлодипін або його фармацевтично прийнятні солі та носій за винятком засобу підлужування, що утворює рН більше 5. причому два компоненти комбінують для утворення кінцевої композиції твердої форми дози. Другим аспектом представленого винаходу є спосіб отримання фармацевтичної композиції, що включає: [A] Грануляцію аторвастатину, яка включає: Етап (1) розчинення поверхнево-активного засобу у воді та додавання та гідратування зв'язувального засобу; Етап (2) - змішування кальцій-аторвастатину, засобу підлужування, що утворює рН більше 5, наповнювачу/розріджувачу, наповнювачу/розріджувачу/дезинтегратору, та дезинтегратору у гранулювальному апараті; 9 79750 Етап (3) - грануляція порошкової суміші з етапу (2) розчином з етапу (1) у гранулювальному апараті: та Етап (4) - суха грануляція у сушильному апараті; [B] кінцеве формування, що включає: Етап (1) - додавання амлодипін-безилату. наповнювачу/розріджувачу, дезинтегратору та ковзного засобу до композиції аторвастатину: Етап (2) - пропускання порошкової суміші через млин; та Етап (3) - змішування змеленої порошкової суміші та змащувального засобу у змішувачі з утворенням однорідної змішаної фармацевтичної композиції для твердої дозованої форми. Третім аспектом представленого винаходу є фармацевтична композиція, що має низькі рівні продуктів розкладання та/або забруднень. Четвертим аспектом представленого винаходу є спосіб використання фармацевтичних композицій для лікування суб'єктів, що потерпають від стенокардії, атеросклерозу, комбінованої гіпертензії та гіперліпідемії та/або гіперхолестеринемії, та для лікування суб'єктів з симптомами серцевого ризику, включаючи людей. П'ятим аспектом представленого винаходу є терапевтична упаковка або комплект, придатний для продажу, що містить контейнер та фармацевтичну композицію, що має низькі рівні продуктів розкладання та/або забруднень. Винахід крім того описаний наступними нелімітуючими прикладами, які стосуються супутні х Фігури 1-18. короткі відомості про які надано нижче. Фігура 1 Середні профілі (концентрація у плазмі амлодипіну)-час після співвживання таблеток по 5мг амлодипіну та 10мг аторвастатину (закриті символи) та застосування терапії подвійними таблетками по 5мг амлодипіну та 10мг аторвастатину (відкриті символи). Верхні та нижчі табло представляють лінійні та напівлогарифмічні графіки, відповідно. Фігура 2 Середні профілі (концентрація у плазмі аторвастатину)-час після співвживання таблеток по 5мг амлодипіну та 10мг аторвастатину (закриті символи) та застосування терапії подвійними таблетками по 5мг амлодипіну та 10мг аторвастатину (відкриті символи). Верхні та нижчі табло представляють лінійні та напівлогарифмічні графіки, відповідно. Фігура 3 Величини Смакс для амлодипіну окремо після співвживання таблеток по 5мг амлодипіну та 10мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 5мг амлодипіну та 10мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фігура 4 Величини Смакс для амлодипіну AUC(0-¥) окремо після співвживання таблеток по 5мг амлодипіну та 10мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 5мг амлодипіну та 10мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фігура 5 Величини Смакс для аторвастатину окремо після співвживання таблеток по 5мг амло 10 дипіну та 10мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 5мг амлодипіну та 10мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фігура 6 Величини Смакс для аторвастатину AUC(0-¥) окремо після співвживання таблеток по 5мг амлодипіну та 10мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 5мг амлодипіну та 10мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фігура 7 Середні профілі (концентрація у плазмі амлодипіну)-час після співвживання таблеток по 10мг амлодипіну та 40мг аторвастатину (закриті символи) та застосування терапії подвійними таблетками по 10мг амлодипіну та 40мг аторвастатину (відкриті символи). Верхні та нижчі табло представляють лінійні та напівлогарифмічні графіки, відповідно. Фігура 8 Середні профілі (концентрація у плазмі аторвастатину)-час після співвживання таблеток по 10мг амлодипіну та 40мг аторвастатину (закриті символи) та застосування терапії подвійними таблетками по 10мг амлодипіну та 40мг аторвастатину (відкриті символи). Верхні та нижчі табло представляють лінійні та напівлогарифмічні графіки, відповідно. Фігура 9 Величини Смакс для амлодипіну окремо після співвживання таблеток по 10мг амлодипіну та 40мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 10мг амлодипіну та 40мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фігура 10 Величини Смакс для амлодипіну AUC(0-¥) окремо після співвживання таблеток по 10мг амлодипіну та 40мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 10мг амлодипіну та 40мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фігура 11 Величини Смакс для аторвастатину після співвживання окремих таблеток по 10мг амлодипіну та 40мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 10мг амлодипіну/40мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фігура 12 Величини Смакс для аторвастатину AUC(0-¥) окремо після співвживання таблеток по 10мг амлодипіну та 40мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 10мг амлодипіну та 40мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно/ Фігура 13 Середні профілі (концентрація у плазмі амлодипіну) - час після співвживання таблеток по 10мг амлодипіну та 2´40мг аторвастатину (закриті символи) та застосування терапії подвійними таблетками по 10мг амлодипіну та 80мг аторвастатину (відкриті символи). Верхні та нижчі табло представляють лінійні та напівлогарифмічні графіки, відповідно. Фігура 14 Середні профілі (концентрація у 11 79750 плазмі аторвастатину) - час після співвживання таблеток по 10мг амлодипіну та 2´40мг аторвастатину (закриті символи) та застосування терапії подвійними таблетками по 10мг амлодипіну та 80мг аторвастатину (відкриті символи). Верхні та нижчі табло представляють лінійні та напівлогарифмічні графіки, відповідно. Фігура 15 Величини Смакс для амлодипіну окремо після співвживання таблеток по 10мг амлодипіну та 2´40мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 10мг амлодипіну та 80мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фігура 16 Величини Смакс для амлодипіну AUC(0-¥) окремо після співвживання таблеток по 10мг амлодипіну та 2´40мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 10мг амлодипіну та 80мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фігура 17 Величини Смакс для аторвастатину окремо після співвживання таблеток по 10мг амлодипіну та 2´40мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 10мг амлодипіну та 80мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно Фігура 18 Величини Смакс для аторвастатину AUC(0-¥) окремо після співвживання таблеток по 10мг амлодипіну та 2´40мг аторвастатину (Посилання) та застосування терапії подвійними таблетками по 10мг амлодипіну та 80мг аторвастатину (Тест). Окремий об'єкт та середні величини представлені кружечками та трикутниками, відповідно. Фармацевтичні композиції представленого винаходу містять амлодипін або його фармацевтично прийнятну кислотно-адитивну сіль та аторвастатин або його фармацевтично прийнятну основно-адитивну сіль. Амлодипін можна легко отримати як описано у [патенті США №4572909] як представлено як посилання. Амлодипін-безилат, як є зараз продають як NorvascÒ, можна отримати як описано у [патенті США №4879303], який представлено як посилання. Амлодипін та амлодипін-безилат є потужними та довгодіючими блокаторами кальційканалів. Аторвастатин можна легко отримати як описано у [патентах США №s 5273995 та 5969156], які представлені як посилання. Напівкальцієву сіль аторвастатину зараз продають як LipitorÒ. Фармацевтично прийнятні кислотно-адитивні солі сполук представленого винаходу включають солі, похідні від нетоксичних неорганічних кислот, як-то гідрохлоридна, нітратна, фосфатна, сульфатна, гідробромідна, гідройодидна, гідрофлуоридна, фосфорна, тощо, а також солі, похідні від нетоксичних органічних кислот, як-то аліфатичні моно- та дикарбонова кислоти, феніл-заміщена алканові кислоти, гідроксіалканові кислоти, алкандіонові кислоти, ароматичні кислоти, аліфатичні та ароматичні сульфонові кислоти, тощо. Такі солі, таким чином, включають сульфат, піросульфат, гідросульфат, суль фіт, гідросульфі т, нітрат, фосфат, 12 моногідрофосфат, дигідрофосфат. метафосфат, пірофосфат, хлорид, бромід, йодид, ацетат, трифлуорацетат, пропіонат, каприлат. ізобутират, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, манделат, бензоат, хлорбензоат. метилбензоат, динітробензоат, фталат, бензолсульфонат, толуолсульфонат, фенілацетат, цитрат, лактат, малеат, тартрат, метансульфонат, тощо. Також включені солі амінокислот, як-то аргінат та подібні і глюконат, галактуронат [дивись, наприклад, Berge S.M. et al., "Pharmaceutical Salts" J. ofPharma. Sci, 1977;66:1]. Кислотно-адитивні солі вказаної основної сполуки отримують взаємодією вільної основи з достатньою кількістю потрібної кислоти для отримання солі звичайним способом. Вільну основу можна регенерувати взаємодією солі з основою та виділенням вільної основи звичайним способом. Вільні основи дещо відрізняються від своїх відповідних солей деякими фізичними властивостями, як-то розчинність у полярних розчинниках, але інакше солі еквіваленті їх відповідним вільним основам для мети представленого винаходу. Фармацевтично прийнятні основно-адитивні солі отримують з металами або амінами, як-то лужні та лужно-земельні метали або органічні аміни. Прикладами використовуваних як катіони металів є натрій, калій, магній, кальцій, тощо. Прикладами придатних амінів є Ν,Ν'дибензилетилендіамін, хлорпрокаїн, холін, діетаноламін, дициклогексиламін, етилендіамін, Νметилглюкамін та прокаїн [дивись, наприклад, Berge et al., вище., 1977]. Основно-адитивні солі вказаної кислотної сполуки отримують взаємодією вільної кислоти з достатньою кількістю потрібної основи для отримання солі звичайним способом. Вільну кислоту можна регенерувати взаємодією солі з кислотою та виділення вільної кислоти звичайним способом. Вільні кислоти дещо відрізняються від своїх відповідних солей деякими фізичними властивостями, як-то розчинність у полярних розчинниках, але інакше солі еквіваленті їх відповідним вільним кислотам для мети представленого винаходу. Крім того, сполуки представленого винаходу можуть існувати у несольватованій формі, а також сольватованій формі, включаючи гідратовані форми. Загалом, сольватовані форми, включаючи гідратовані форми, еквівалентні несольватованим формам та охоплені рамками представленого винаходу. Амлодипін є рацемічною сполукою, що обумовлено симетрією у позиці 4 дигідропіридинового кільця. R та S енантіомери можна отримати як описано [Arrowsmith et al., J. Med. Chem., 1986;29:1696]. Активність амлодипіну стосовно блокування кальцій-каналів по суті обмежена S(-) ізомером та рацемічною сумішшю, що містить R(+) та S(-) форми [дивись міжнародну патентну заявку № РСТ/ЕР94/02697 (WO 95/05822)]. R(+) ізомер має малу активність стосовно блокування кальційканалів, або не має її. Однак, R(+) ізомер є потужним інгібітором міграції клітин гладеньких м'язів. Таким чином, R(+) ізомер є корисним при лікуванні або попередження атеросклерозу [дивись міжна 13 79750 родну патентну заявку № РСТ/ЕР95/00847 (WO 95/25722)]. На основі вищенаведеного фахівець може вибрати R(+) ізомер, S(-) ізомер, або рацемічну суміш R(+) ізомеру та S(-) ізомеру для застосування у комбінації цього винаходу. Для отримання фармацевтичних композицій зі сполук представленого винаходу, фармацевтично прийнятні носії є твердими. Тверді форми препаратів включають порошки, таблетки, пілюлі, капсули, облатки, та супозиторії. Твердий носій може бути одною або більше речовинами, які можуть також діяти як розріджувачі, смакові засоби, солюбілізатори, ковзні засоби, суспендувальні засоби, зв'язувальні засоби, консерванти, дезинтегратори таблеток, або капсулювальний матеріал. Наприклад, аніонні ПАР включають натрійдокузат та натрій лаурилсульфат: зв'язувальні засоби включають камедь акації, карбомер, натрій-карбоксиметилцелюлозу, декстрин, етилцелюлозу, желатин, гуарову смолу, гідровану рослинну олію (тип 1), гідроксіетилцелюлозу, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, магній алюмосилікат, мальтодекстрин, метилцелюлозу, поліметакрилати, повідон, попередньо желатинований крохмаль, натрій алгінат, крохмаль, та зеїн; катіонні ПАР включають бензалконій хлорид, бензетоній хлорид, та цертримід; розріджувачі включають кальцій карбонат, кальцій сульфат, декстрати, декстрин, декстрозу, дигідрат двосновного кальцій фосфату, гліцерилпальмітостеарат, гідровану рослинну олію (тип 1), каолін, магній карбонат, магній оксид, мальтодекстрин. маніт, мікрокристалічну целюлозу, поліметакрилати, калій хлорид, порошкову целюлозу, попередньо желатинований крохмаль, натрій хлорид, сорбіт, крохмаль, тальк, та триосновний кальцій фосфа т; дезинтегратори включають кальційкарбоксиметилцелюлозу, натрійкарбоксиметилцелюлозу, колоїдний діоксид силіцію, кросповідон, кросповідон, гуарову смолу, магній алюмосилікат, метилцелюлозу, мікрокристалічну целюлозу, полакрилін-калій, порошкову целюлозу, попередньо желатинований крохмаль, натрій алгінат, натрій-гліколят крохмалю, та крохмаль: смакові засоби включають етилмальтол, етилванілін, мальтол, ментол, та ванілін; ковзні засоби включають колоїдний діоксид силіцію, магній трисилікат, порошкову целюлозу, крохмаль, тальк, та триосновний кальцій фосфат: засоби гранулювання включають камедь акації, декстрозу, желатин, повідон, крохмаль, та камедь трагаканту: ковзні засоби включають кальцій стеарат, гліцерилмоностеарат, гліцерилпальмітостеарат, гідровану рицинову олію, гідровану рослинну олію (тип 1). світле мінеральне масло, лубритаб, магній стерат, мінеральне масло, поліетиленгліколь, натрій бензоат, натрій лаурилсульфат, натрій стеарилфумарат, стеаринову кислоту, тальк та цинк стеарат; неіоногенні ПАР включають гліцерилмоноолеат, поліоксіетиленовані естери сорбіту та жирної кислоти, полівініловий спирт та естери сорбіту; консерванти включають спирт, бензалконій хлорид, бензетоній хлорид, бензиловий спирт, бронопол. бутилпарабен. цетримід, хлоргексидин, хлорбутанол, хлоркрезол, крезол, етилпарабен. 14 гліцерин, імідсечовину, метилпарабен, фенол, феноксіетанол, фенілетиловий спирт, фенілмеркурій ацетат, фенілмеркурій борат, фенілмеркурій нітрат, калій сорбат, пропіленгліколь, пропілпарабен, натрій бензоат, натрій пропіонат, та тимеросал; солюбілізатори включають бензалконій хлорид, бензетоній хлорид, бензилбензоат, циклодекстрини, гліцерилмоностеарат, лецитин, полоксамер, алкіл-поліоксіетиленові етери, похідні поліоксіетилену та рицинової олії, поліоксіетиленові естери сорбіту та жирної кислоти, поліоксіетиленстеарати, естери сорбіту та стеаринової кислоти; суспендувальні засоби включають камедь акації, бентоніт, карбомер, кальційкарбоксиметилцелюлозу, натрійкарбоксиметилцелюлозу, колоїдний діоксид силіцію, декстрин, желатин, гуарову смолу. гідроксіетилцелюлозу, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, каолін, магній алюмосилікат, розчин мальтітолу, метилцелюлозу, мікрокристалічну целюлозу, повідон, порошкову целюлозу, пропіленгліколь-алгінат, натрій алгінат, натрійгліколят крохмалю, крохмаль, камедь трагаканту, та ксантанову смолу. У порошках носієм є мілко подрібнений твердий матеріал у суміші з мілко подрібненим активним компонентом. У твердій формі дози активний компонент змішують з носієм, що має необхідні зв'язувальні властивості, у придатних співвідношеннях та пресують до потрібної форми та розміру. Порошки та таблетки переважно містять від 5% до приблизно 70% активної сполуки. Придатними носіями є магній карбонат, магній стеарат, тальк, пектин, декстрин, крохмаль, желатин, камедь трагаканту, метилцелюлоза, натрійкарбоксиметилцелюлоза, низькоплавкий віск, масло какао, тощо. Термін "препарат" включає композицію активної сполуки з капсулювальним матеріалом як носієм, що забезпечує капсулу, в якій активний компонент, з іншими носіями або без них, оточено носієм, який є таким чином в асоціації з ним. Подібно, включені облатки та коржі. Таблетки, порошки, капсули, пілюлі, облатки, та коржі можна використовувати як тверді форми доз, придатні для перорального вживання. Фармацевтичний препарат знаходиться переважно у формі одиничної дози, що містить прийнятні кількості активного компоненту, одинична форма дози можу бути упакованим препаратом, упаковки містять дискретні кількості препарату, якто упаковані таблетки, капсули, та порошки у склянках або ампулах. Також, одинична форма дози може бути капсулою, таблеткою, облаткою, або коржем самою по собі, або може бути прийнятним числом будь-чого з цього в упакованій формі. Конкретно, фармацевтичні композиції представленого винаходу отримують, використовуючи наступний загальний спосіб: [А] Гранулят аторвастатину отримують так: Етап (1) - поверхнево-активний засіб, як-то, наприклад, полісорбат 80, натрій лаурилсульфат, тощо розчиняють у воді та додають та гідратують зв'язувальний засіб, як-то, наприклад, гідроксипропілцелюлозу, повідон, гідроксипропілметилце 15 79750 люлозу (НРМС), крохмаль 1500, крохмаль, тощо; Етап (2) - кальцій-аторвастатин змішують із засобом підлужування, що дає рН більше 5, як-то, наприклад, кальцій карбонат, ди- та три-кальцій фосфа т то що, наповнювачем/розріджувачем, якто, наприклад, мікрокристалічна целюлоза, осилікована мікрокристалічна целюлоза, крохмаль, крохмаль 1551, сорбіт, маніт, тощо, наповнювач/розріджувач/дезинтегратор, як-то, наприклад, крохмаль 1551, крохмаль 1550, тощо, та дезинтегратором, як-то, наприклад, кросповідон, натрійгліколят крохмалю, поліплаздон, крохмаль, карбоксиметилцелюлоза (CMC) тощо, у гранулювальному апараті, як-то, наприклад, гранулятор з псевдозрідженим шаром/сушильний апарат, змішувач з високим поперечним зусиллям/гранулятор, змішувач зі спареним корпусом/гранулятор, стрічковий змішувач гранулятор, тощо; Етап (3) - суміш порошку з етапу (2) гранулюють з розчином з етапу (1) у гранулювальному апараті; та Етап (4) - гранулят сушать у сушильному апараті, як-то, наприклад, гранулятор з псевдозрідженим шаром/сушильний апарат, шафа, сушильний апарат з конвеєрною стрічкою, мікрохвильовий сушильний апарат, тощо; [В] кінцеву композицію рецептури отримують так: Етап (1) - амлодипін-безилат, наповнювач/розріджувач, як-то, наприклад, мікрокристалічна целюлоза, осилікована мікрокристалічна целюлоза, крохмаль, крохмаль 1551, тощо, дезинтегратор як-то, наприклад, кросповідон, натрій-гліколят крохмалю, поліплаздон, крохмаль, CMC тощо, та ковзні засоби, як-то, наприклад, діоксид силіцію, тальк, стеротекс, стеаринова кислота, силоїд тощо, додають до грануляту аторвастатину та змелюють пропусканням через млин, якто, наприклад, млин Соmil, млин Fritz, млин Oscillator, млин Ріn, тощо; Етап (2) - змелений матеріал змішують у змішувачі, як-то описаному вище, зі змащувальним засобом, як-то, наприклад, магній стеарат, кальцій стеарат, цинк стеарат, тальк, тощо; та Етап (3) - змішаний гранулят пресують у пресувальному апараті у таблетки. Переважно, грануляторний сушильний апарат, що використовують при отриманні фармацевтичних композицій, є грануляторним сушильним апаратом з псевдозрідженим шаром (FBGD). Таким чином, фармацевтичні композиції представленого винаходу містять на додаток до активних фармацевтичних засобів засіб підлужування, який використовують як "регулятор біозасвоюваності" для контролю розчинності та біозасвоюваності композиції рецептури та як "підсилювач стабільності". Термін "регулятор біозасвоюваності" означає речовину, використовуван у у композиції рецептури, що має вплив на розчинність активного фармацевтичного засобу, і таким чином її можна використовува ти для регуляції фармакокінетичних параметрів засобів. Термін "підсилювач стабільності" стосується застосування засобу підлужування для стабілізації аторвастатину або його фармацевтично прийнятної солі у представлених фарма 16 цевтичних композиціях. "Регулятори біозасвоюваності" можна використовувати у позитивному плані в тому, що їх наявність може підвищувати рівні композиції рецептури у крові, або їх можна використовувати у негативному плані, коли пригнічує рівні композиції рецептури у крові. Таким чином, використанням прийнятної кількості придатного регулятору біозасвоюваності можливо оптимізувати біозасвоюваності певної композиції рецептури. Як вказано, композиції представленого винаходу застосовують як регулятор біозасвоюваності засіб підлужування, як-то кальцій карбонат, дикальцій карбонат, трикальцій карбонат, тощо. У таблетках, отриманих згідно з винаходом, засіб підлужування поводить себе у позитивному плані для посилення біозасвоюваності аторвастатинового компоненту. Переважно, кальцій карбонат використовують у співвідношенні кальційаторвастатину до кальцій-карбонату приблизно 1:1-1:4 за масою. Найкращим є співвідношення кальцій-аторвастатину до кальцій-карбонату 1:3 за масою. Крім того, інші кращі носії включають мікрокристалічну целюлозу, крохмаль 1551, крохмаль 1500, кросповідон, полісорбат 8,0, гідроксипропілцелюлозу, діоксид силіцію та магній стеарат, що використовують у фармацевтичних композиціях представленого винаходу. Фармацевтичні композиції представленого винаходу містять приблизно 0,25%-10% амлодипіну або його фармацевтично прийнятної солі та приблизно 2,5%-20% аторвастатину або його фармацевтично прийнятної солі: переважно приблизно 0,5%-7% амлодипін-безилату та приблизно 10%20% кальцій-аторвастатину. Згідно з представленим винаходом наступне є кращими зафіксованими комбінаціями терапії парними дозами, використовуваних у фармацевтичних композиціях. Кальцій-аторвастатин Амлодипін-безилат (мг), (мг), як активна речовина як активна речовина D 10' 20 40 80 5 10 20 40 80 5 10 20 40 80 2,5 2,5 2,5 2,5 2,5 5 5 5 5 5 10 10 10 10 10 Представлений винахід стосується лікування у суб'єкту хвороб та станів, як-то стенокардії, атеросклерозу, комбінованої гіпертензії та гіперліпідемії та/або гіперхолестеринемії, та лікування суб'єктів з 17 79750 симптомами серцевого ризику комбінацією активних інгредієнтів, які описані вище, що можна вживати у формі твердої дози, що має низькі рівні продуктів розкладання та/або забруднень, знаходиться у терапевтичній упаковці або комплекті. Комплект включає дозу у твердій формі та контейнер. Звичайно, комплект включає інструкції для вживання форми дози. Контейнер може бути у будь-якій звичайній формі або формі, відомій у рівні техніки, наприклад, паперова коробка, скляний або пластиковий флакон, або блістерна упаковка з індивідуальними дозами для вичавлювання зі зворотного боку згідно з терапевтичним графіком. Фармацевтичні композиції та способи згідно з винаходом адаптовані для терапевтичного застосування як засоби при лікуванні стенокардії, атеросклерозу та стану, що характеризується наявністю як гіпертензії, так і гіперліпідемії у ссавців, особливо люди. Крім того оскільки ці хвороби та стани тісно споріднені з розвитком серцевої хвороби та несприятливих серцевих станів, ці комбінації та способи силою їх дії як засобів проти стенокардії, атеросклерозу, гіпертензії та гіперліпідемії є корисними у терапії серцевого ризику. При використанні тут термін "серцевий ризик" означає ймовірність, що суб'єкт у майбутньому матиме несприятливий серцевий інцидент як-то, наприклад, інфаркт міокарду, серцева зупинка, серцева нестача, серцева ішемія. Серцевий ризик розраховують, використовуючи стабілізацію ризику Framingham, яка пояснена вище. Термін "терапія серцевого ризику" означає, що ризик майбутніх несприятливих серцевих інцидентів є по суті зменшеним. Корисність сполук представленого винаходу як медичних засобів при лікуванні атеросклерозу у ссавців (наприклад, людини) демонструється активністю сполук винаходу у звичайних дослідженнях та клінічних протоколах, описаних у опублікованій [міжнародній патентній заявці № WO 99/11259], яку представлено як посилання. Наступні кількості доз та інші кількості доз дене-де в описі та у формулі винаходу розраховані на середню людину, що має масу приблизно 6570кг. Фахівець легко визначить кількості доз, потрібні для суб'єкту, що має масу за межами 6570кг, на основі історії хвороби суб'єкту та наявності хвороби, наприклад, діабету, у суб'єкта. Усі дози в описі та у формулі винаходу представляють добові дози. Загалом, згідно з цим винаходом, амлодипінбезилат як правило застосовують у дозах приблизно 0,5-20мг активного інгредієнту. Переважно, амлодипін-безилат застосовують у дозах приблизно 0,5-10мг активного інгредієнту. Фа хівці здогадаються, що можна використовувати у цьому винаході вільну основу або інші солі окрім амлодипін-безилату. Розрахунок кількості дози для цих інших форм або вільної основи або іншої солі окрім амлодипін-безилату легко зробити за допомогою простого співвідношення стосовно молекулярної маси залучених сполук. Загалом, згідно з цим винаходом, аторваста 18 тин вживають у дозі приблизно 0,5мг д-160мг активного інгредієнту. Переважно, аторвастатин вживають у дозі приблизно 10-80мг активного інгредієнту. Фахівець легко визначить, що можна використовува ти у цьому винаході вільну кислоту або інші солі окрім кальцій-аторвастатину. Розрахунок кількості доз для цих інших форм або вільної кислоти або іншої солі окрім кальційаторвастатину легко зробити за допомогою простого співвідношення стосовно молекулярної маси залучених сполук. Дослідження біоеквівалентності Однодозові дослідження біоеквівалентності проводять порівнянням терапії подвійними таблетками амлодипін-безилат/кальцій-аторвастатин зі співвживанням таблеток амлодипін-безилату та кальцій-аторвастатину. Конкретно, порівняння проводять між такими режимами дозування: (1) терапія подвійними таблетками по 5мг амлодипіну/10мг аторвастатину проти таблеток 5мг амлодипіну та - 10мг аторвастатину (2) терапія подвійними таблетками по 10мг амлодипіну/40мг аторвастатину проти таблеток по 10мг амлодипіну та 40мг аторвастатину (3) терапія подвійними таблетками по 10мг амлодипіну/80мг аторвастатину проти таблеток по 10мг амлодипіну та дві по 40мг аторвастатину В усі х випадках терапія подвійними таблетками є біоеквівалентною співвживанню окремих таблеток амлодипіну та аторвастатину. Детальні дослідження описані у прикладах 2-4 та Таблицях 13. Дослідження стабільності Загальні забруднення та/або продукти розкладання аторвастатину після зберігання фармацевтичної композиції при 25°С/60% відносної вологості протягом 24 місяців повинні бути не більше 2,0%. Крім того, таких конкретних забруднень та/або продуктів розкладання повинно бути не більше 0,5%: 5-(4-Флуорфеніл)-2,3-дигідро-р.5-дигідрокси-3(1-метилетил)-2-оксо-4-феніл-3[(феніламіно)карбоніл]-1Н-пірол-1-гептанова кислота; (2R-транс)-5-(4-Флуорфеніл)-2-(І-метилетил)N,4-дифеніл-1-[2-(тетрагідро-4-гідрокси-6-оксо-2Нпіран-2-іл)етил]-1Н-пірол-3-карбоксамід; та 3-[(4-Флуорфеніл)карбоніл]-2-(2-метил-1оксопропіл)-N,3-дифеніл-2-оксиранкарбоксамід. Загальні забруднення та/або продукти розкладання амлодипіну після зберігання фармацевтичної композиції при 25°С/60% відносної вологості протягом 24 місяців повинні бути не більше 2,0%. Крім того, таких конкретних забруднень та/або продуктів розкладання повинно бути не більше 1,0%: 2-(2-Аміно-етоксиметил)-4-(2-хлор-феніл)-6метил-піридин-3,5-дикарбонової кислоти 3етиловий естер 5-метил естер; та 6-(2-Хлор-феніл)-8-метил-3,4,6,7-тетрагідро2Н-1,4-бензоксазин-5,7-дикарбонов кислот 5-етил естер 7-метиловий естер. Стабільність подвійних таблеток для терапії амлодипіном/аторвастатином, що зберігалися при 19 79750 40°С/75% відносної вологості оцінено. Конкретно, оцінено такі комбінації: (1) 5мг амлодипіну/10мг аторвастатину (2) 10мг амлодипіну/40мг аторвастатину (3) 10мг амлодипіну/80мг аторвастатину Таблиця 4 показує результати аналізу для продуктів розкладання подвійних таблеток для терапії порівняно з комерційними таблетками LipitorÒ (кальцій-аторвастатин) після 3-місячної стабільності при 40°С/75% відносної вологості. В усі х випадках загальні продукти розкладання подвійних таблеток для терапії є порівнюваними з продуктами або кращими за них для таблеток LipitorÒ. 20 Це прискорене дослідження при 40°С/75% відносної вологості протягом 3 місяців є стандартним способом передбачення терміну збереження стабільності фармацевтичних продуктів при 25°С/60% відносної вологості протягом 24 місяців. Вищенаведені результати показують, що фармацевтичні композиції представленого винаходу є не тільки стабільними, але також мають біозасвоюваність, еквівалентну вживанню кожного з терапевтичних засобів в окремих дозах. Наступні нелімітуючі приклади ілюструють кращі способи винаходу отримання та застосування фармацевтичних композицій представленого винаходу. Таблиця 1 Зведення величин фармакокінетичних параметрів після співвживання таблеток по 5мг амлодипінута 10мг аторвастатину (Посилання) та застосування подвійних таблеток для терапії 5мг амлодипіну та 10мг аторвастатину (Тест) Параметр Смакс, нг/мл tмакс, годин AUC(O-tlqc), нг-годин/мл AUC(0-¥), нг-годин/мл t1/2 , годин nСмакс, нг/мл nAUC(O-tlqc), нг-годин/мл nAUC(0-¥), нг-годин/мл Смакс, нг/мл Макс, годин AUC(O-tlqc), нг-годин/мл AUC(0-¥), нг-годин/мл t1/2 , годин Найменше-квадратичні середні величини Спів вживання окремих Терапія подвійними таблеток (Посилання) таблеткам и (Тест) Амлодипін, Стандартний Аналіз 2,79 2,77 7,41 8,06 136 134 152 149 51,6 49,5 Амлодипін, нормалізовано стосовно вмісту 2,79 2,94 136 142 152 159 Аторвастатин 2,52 2,30 0,624 1,12 12,8 12,3 18,4 18,4 9,12 10,2 Співвідношення 90% Інтервалу довірчості 99,1 109 98,1 98,2 96,1 95,7-103 непридатн. 94,9-101 94,8-102 88,8-103 105 104 104 102-109 101-108 101-108 91,0 180 95,8 100 112 82,0-101 непридатн. 88,6-104 90,2-111 82,0-142 AUC(0-¥) = Площа під профілем концентрація у плазмі-час від часу нуль, що екстрапольовано до безконечності. t1/2 = Напівперіод перетворення. nСmах та n AUC = Величини, що нормалізовано стосовно вмісту амлодипіну. Співвідношення = Співвідношення середніх значень лікування, виражених як процент (100%´тест/посилання). 90% Інтервал довірчості = оцінка 90% інтервалу довірчості для співвідношення (тест/посилання) середніх значень лікування, виражених як процент середнього значення. 21 79750 22 Таблиця 2 Зведення величин фармакокінетичних параметрів після співвживання таблеток по 10мг амлодипіну та 40мг аторвастатину (Посилання) та застосування подвійних таблеток для терапії 10мг амлодипіну та 40мг аторвастатину (Тест) Параметр Смакс, нг/мл tмакс, годин AUC(O-tlqc), нг-годин/мл AUC(0-¥), нг-годин/мл t1/2 , годин Смакc, нг/мл tмакc, годин AUC(O-tlqc), нг-годин/мл AUC(0-¥), нг-годин/мл t1/2 , годин Найменше-квадратичні середні величини Співвживання окремих Терапія подвійними таблеток (Посилання) таблетками (Тест) 5,77 6,26 7,28 7,33 287 298 320 331 51,7 51,6 Аторвастатин 15,0 14,2 0,641 1,09 71,5 79,1 80,4 8S,2 12,3 15,3 Співвідношення 90% Інтервалу довірчості 109 101 104 103 99,7 105-113 Непридатн. 101-107 100-107 94,6-105 95,0 170 111 110 124 82,1 до 110 Непридатн. 104до117 103 до 116 98,2 до 149 Смакc = максимальна концентрація у плазмі. tмакс = Час для Смакc. AUC(O-tlqc) = Площа під профілем концентрація у плазмі-час від часу нуль до часу для останньої визначеної концентрації. AUC(0-¥) = Площа під профілем концентрація у плазмі-час від часу нуль, що екстрапольовано до безконечності. t1/2 =Напівперіод перетворення. Співвідношення = Співвідношення середніх значень лікування, виражених як процент (100%´тест/посилання). 90% Інтервал довірчості = оцінка 90% інтервалу довірчості для співвідношення (тест/посилання) середніх значень лікування, виражених як процент середнього значення. Таблиця 3 Зведення величин фармакокінетичних параметрів після співвживання таблеток по 10мг амлодипіну та 2´40мг аторвастатину (Посилання) та застосування подвійних таблеток для терапії 10мг амлодипіну та 80мг аторвастатину (Тест) Параметр Смакс, нг/мл tмакс, годин AUC(O-tlqc), нг-годин/мл AUC(0-¥), нг-годин/мл t1/2 , годин Смакс. нг/мл tмакс, годин AUC(O-tlqc), нг-годин/мл AUC(0-¥), нг-годин/мл t1/2 , годин Найменше-квадратичні середні величини Співвживання окремих Терапія подвійними таблеток (Посилання) таблетками (Тест) Амлодипін 5,08 5,00 7,39 7,44 270 262 303 298 52,6 55,7 Аторвастатин 33,7 33,7 1,09 1,58 168 170 177 181 12,7 15,51 Співвідношення 90% Інтервалу довірчості 98,6 101 97,0 98,4 106 95,4 до 102 Непридатн. 94,2 до 99,9 95,4 до 101 99,9 до 112 100 144 101 95 122 87,8-114 Непридатн. 95,1-108 94,8-109 101-143 Смакc = максимальна концентрація у плазмі. tмакс = Час для Смакc. AUC(O-tlqc) = Площа під профілем концентрація у плазмі-час від часу нуль до часу для останньої визначеної концентрації. AUC(0-¥) = Площа під профілем концентрація у плазмі-час від часу н уль, що екстрапольовано до без 23 79750 24 конечності. t1/2 =Напівперіод перетворення. Співвідношення = Співвідношення середніх значень лікування, виражених як процент (100%´тест/посилання). 90% Інтервал довірчості = оцінка 90% інтервалу довірчості для співвідношення (тест/посилання) середніх значень лікування, виражених як процент середнього значення. Таблиця 4 Порівняні результати стабільності терапії подвійними таблетками амлодипін/аторвастатин татаблетками LipitorÒ Розкладання таблеток, що зберігалися при 40°С/75% відносної вологості протягом 3 місяців Продукт Терапія подвійними таблетками амлодипін/аторвастатин Таблетки LipitorÒ Доза 5мг/10мг 10мг/40мг 10мг/80мг 10мг 40мг 80мг Упаковка Флакон Блістер Флакон Блістер Флакон Блістер Флакон Аторвастатин Загальні продукти 0,39 0,41 0,23 0,24 0,24 0,33 0,43-0,54 0,51-0,63 0,20 розклад (%) Амлодипін Загальні продукти ND ND ND ND ND ND N/A N/A N/A розклад. (%) N/A = непридатн. ND= не визначено. Приклад 1 Загальний спосіб отримання подвійних таблеток для терапії амлодипін-бензилатом/кальційаторвастатином [А] Грануляція аторвастатину Етап1. - Розчинення полісорбату 80 в очищеній воді при 50°С та додавання та гідратування гідроксипропілцелюлози. Дозволяють розчину охолонути до кімнатної температури Етап 2. - Змішування кальцій-аторвастатину, кальцій карбонату, мікрокристалічної целюлози, крохмалю 1500, та кросповідону у грануляторі з псевдозрідженим шаром/сушильному апараті (FBG/D) або змішувачі з високим поперечним зусиллям/грануляторі. Етап 3. - Грануляція порошкової суміші з етапу 2 розчином з етапу 1 у FBG/D або змішувачі з високим поперечним зусиллям/грануляторі. Етап 4. - С уха грануляція у FBG/D або іншому сушильному апараті до вологості (втрата на сушці, LOD) не більше 2,0%. [Б] Кінцеве отримання Етап 1. - Додавання амлодипін-безилату, мікрокристалічної целюлози, кросповідону та діоксиду силіцію до грануляту а торвастатину з е тапу [А]. Етап 2. - Пропускання порошкової суміші через млин, наприклад, млин Соmil. Етап 3. - Додавання магній стеарату до змеленої порошкової суміші з етапу 2 та змішування у бункерному змішувачі, V-змішувачі, стрічковому змішувачі, то що. Етап 4. - Пресування кінцевого змішаного грануляту у таблетки, використовуючи таблетувальний апарат. Таблиця 5 Представляє композиції рецептури серцевин подвійних таблетокдля терапії амлодипін-безилатом/кальцій-аторвастатином Доза аторвастатину (мг) Доза амлодипіну (мг) Гранулят аторвастатину Кальцій-аторвастатин Кальцій Карбонат Кросповідон Мікрокристалічна целюлоза Крохмаль, попередньо желатинований, 1500 Полісорбат 80 Гідроксипропілцелюлоза Очищена вода USP/Epa 10 5 10,85 33,15 3,00 13,85 15,00 0,40 2,00 60,00 20 10 5 10,85 21,70 33,15 66,30 3,00 6,00 13,85 27,70 15,00 30,00 0,40 0,80 2,00 4,00 60,00 120,00 40 80 10 5 10 5 10 21,70 66,30 6,00 27,70 30,00 0,80 4,00 120,00 43,40 132,60 12,00 55,40 60,00 1,60 12,00 240,00 43,40 132,60 12,00 55,40 60,00 1,60 12,00 240,00 86,80 265,20 24,00 110,80 120,00 3,20 24,00 480,00 86,80 265,20 24,00 110,80 120,00 3,20 24,00 480,00 25 79750 26 Продовження таблиці 5 Кінцева суміш Амлодипін-безилат Мікрокристалічна целюлоза Кросповідон Діоксид силіцію, колоїдний Магній стеарат Маса серцевини таблеток (мг) -, 6,94 10,41 3,00 0,65 0,75 100 13,87 3,48 3,00 0,65 0,75 100 6,94 27,76 6,00 1,30 1,50 200 13,87 20,83 6,00 1,30 1,50 200 6,94 62,46 12,00 2,60 3,00 400 13,87 6,94 13,87 55,53 131,86 124,93 12,00 24,00 24,00 2,60 5,20 5,20 3,00 6,00 6,00 400 800 800 Допоміжний засіб отримання, який видаляють при обробці Приклад 2 Однодозові дослідження порівняння біоеквівалентності терапії подвійними таблетками по 5мг амлодипіну/10мг аторвастатину та співвживанням таблеток по 5мг амлодипіну та по 10мг аторвастатину Протокол: рандомізовані, однодозові, 2шляхові перехресні дослідження проводять на 36 здорових волонтерах. Після ночі кожний суб'єкт отримував одиничну дозу 5мг амлодипіну та 10мг аторвастатину як терапію подвійними таблетками та співвживання окремих таблеток на доби 1 та 15. Зразки крові збирають перед тим та серійно протягом 168 годин після кожної дози. Зразки плазми відбирають та зберігають замороженими при 70°С до аналізу. Концентрації у плазмі амлодипіну та аторвастатину аналізують затвердженими способами. Фармакокінетичні параметри отримують з профілів концентрація-час одночасними способами. Результати ANOVA (аналіз варіантів) logтрансформованих величин Смакс та AUC використовують для розрахунку 90% інтервалів довірчості для співвідношень найменше-квадратичних середніх значень лікування. Біоеквівалентність існує, якщо інтервали довірчості для співвідношень величин Смакс та AUC амлодипіну та а торвастатину, на основі log-трансформованих даних, знаходяться в межах 80-125%. Вивчення єдиності аналізу та суті терапії подвійними таблетками, оціненої у цьому дослідженні, виявило, що амлодипінова частка складала 94% від позначеної потреби. Аторвастатинова частка була в межах 95-105%, як були відмічені амлодипінові таблетки та аторвастатинові таблетки, співвживані у посилальному лікуванні. Тому, біоеквівалентність оцінювали знов після поділу величин Смакс та AUC амлодипіну для тестлікування на 0,94. Результати обох аналізів представлено. Результати: Дані, отримані від 35 суб'єктів, які приймали участь у дослідженні, а також від одного суб'єкту, що отримав тільки лікування окремими таблетками перед виходом з дослідження, використовують при оцінці. Середні концентрації у плазмі ілюстровані у Фігурах 1 та 2. Фармакокінетичні параметри зведені у таблиці 1. Окремі величини Смакс та AUC ілюстровані у Фігурах 3 та 4. Амлодипін, стандартний аналіз На основі величин Смакс та Їмакс амлодипіну, швидкість поглинання після вживання подвійних таблеток терапії 5мг амлодипіну/10мг аторваста тину подібна поглинанню після співвживання окремих таблеток 5мг амлодипіну та 10мг аторвастатину. Різниця у середніх величинах tмакс є приблизно 40 хвилин. Середні величини Смакс після застосування кожного лікування приблизно ідентичні, а 90% інтервал довірчості для величини Смакс складає 80%-125% від меж біоеквівалентності. На основі величини AUC амлодипіну, ступінь поглинання після застосування терапії подвійними таблетками по 5мг амлодипіну та 10мг аторвастатину є подібним до ступеню після співвживання окремих таблеток 5мг амлодипіну та 10мг аторвастатину. Середні величини AUC(0-¥) приблизно ідентичні, та 90% інтервал довірчості для AUC(0¥) величини складає 80%-125% від меж біоеквівалентності. Середні величини t1/2 амлодипіну є подібними, в середньому приблизно 50 годин. Аналіз, що нормалізовано стосовно вмісту амлодипіну у Тест-таблетках Середні нормалізовані стосовно вмісту амлодипіну величини Смакс величин після вживання тест-таблеток є приблизно на 5% вищі за величини від співвживання окремих таблеток. 90% інтервал довірчості для нормалізованих величин Смакс складає 80%-125% від меж біоеквівалентності. Середні нормалізовані стосовно вмісту амлодипіну величини AUC(0-¥) після вживання тесттаблеток є приблизно на 4% вищі за величини від співвживання окремих таблеток. 90% інтервал довірчості для нормалізованих величин AUC(0-¥) складає 80%-125% від меж біоеквівалентності. Аторвастатин На основі величин Смакс та tмакс аторвастатину ступінь поглинання після застосування терапії подвійними таблетками по 5мг амлодипіну та 10мг аторвастатину є подібним до ступеню після співвживання окремих таблеток 5мг амлодипіну та 10мг аторвастатину. Різниця у середніх величинах tмакс складає приблизно 30 хвилин. Різниця у середніх величинах Смакс складає приблизно 9%, та 90% інтервал довірчості для величин Смакс складає 80%-125% від меж біоеквівалентності. На основі величин AUC аторвастатину ступінь поглинання після застосування терапії подвійними таблетками по 5мг амлодипіну та 10мг аторвастатину є подібним до ступеню після співвживання окремих таблеток по 5мг амлодипіну та по 10мг аторвастатину. Середні величини AUC(0-¥) іден 27 79750 тичні, а 90% інтервал довірчості для величин AUC(0-¥) складає 80%-125% від меж біоеквівалентності. Середні величини t1/2 аторвастатин у є подібними, в середньому приблизно 10 годин. Висновок: Терапія подвійними таблетками амлодипін 5мг/аторвастатин 10мг є біоеквівалентною співвживанню окремих таблеток по 5мг амлодипіну та по 10мг аторвастатину. Приклад 3 Однодозове дослідження порівняння біоеквівалентності терапії подвійними таблетками 10мг амлодипіну/40мг аторвастатину та співвживаня таблеток по 10мг амлодипіну та 40мг аторвастатину Протокол: рандомізовані, однодозові, 2шляхові перехресні дослідження проведено на 36 здорових волонтерах. Після ночі кожний суб'єкт отримував одиничну дозу 10мг амлодипіну та 40мг аторвастатину як терапію подвійними таблетками та співвживанням окремих таблеток на доби 1 та 15. Зразки крові збирають перед тим та серійно протягом 168 годин після кожної дози. Зразки плазми відбирають та зберігають замороженими при 70°С до аналізу. Концентрації у плазмі амлодипіну та аторвастатину аналізують затвердженими способами. Фармакокінетичні параметри величини оцінюють за профілями концентрація-час одночасними способами. Результати ANOVA logтрансформованих величин Смакс та AUC використовують для розрахунку 90% інтервалів довірчості для співвідношень найменше-квадратичних середніх значень лікування. Біоеквівалентність існує, якщо інтервали довірчості для співвідношень величин Смакс та AUC амлодипіну та аторвастатину на основі log-трансформованих даних, знаходяться в межах 80-125%. Результати: Дані, отримані від 36 суб'єктів, які завершили дослідження оцінені. Середні концентрації у плазмі ілюстровані у Фігура х 5 та 6. Фармакокінетичні параметри зведені у таблиці 2. Індивідуальні величини Смакс та AUC ілюстровані у Фігура х 7 та 8. Амлодипін На основі величин Смакс та tмакс амлодипіну ступінь поглинання після застосування терапії подвійними таблетками по 10мг амлодипіну та 40мг аторвастатину є подібним до ступеню після співвживання окремих таблеток по 10мг амлодипіну та по 40мг аторвастатину. Різниця у середніх величинах tмакс складає менше 10 хвилин, а різниця у середніх величинах Смакс складає 9%. 90% інтервал довірчості для величин Смакс складає 80%125% від меж біоеквівалентності. На основі величин AUC амлодипіну ступінь поглинання після застосування терапії подвійними таблетками по 10мг амлодипіну та 40мг аторвастатину є подібним до ступеню після співвживання окремих таблеток по 10мг амлодипіну та по 40мг аторвастатину. Різниця у середніх величинах AUC(0-¥) складає 3%, та 90% інтервал довірчості для AUC(0-¥) величини складає 80%-125% від меж біоеквівалентності. Середні величини t1/2 амлодипіну є подібними, 28 в середньому приблизно 51 годин. Аторвастатин На основі величин Смакс та tмакс аторвастатину ступінь поглинання після застосування терапії подвійними таблетками по 10мг амлодипіну та 40мг аторвастатину є подібним до ступеню після співвживання окремих таблеток по 10мг амлодипіну та по 40мг аторвастатину. Різниця у середніх величинах tмакс складає менше 30 хвилин. Різниця у середніх величинах Смакс складає 5%, а 90% інтервал довірчості для величин Смакс складає 80%-125% від меж біоеквівалентності. На основі величин AUC аторвастатину, ступінь поглинання після застосування терапії подвійними таблетками по 10мг амлодипіну та 40мг аторвастатину є подібним до ступеню після співвживання окремих таблеток по 10мг амлодипіну та по 40мг аторвастатину. Різниця у середніх величинах AUC(0-¥) складає 10%, а 90% інтервал довірчості для AUC(0-¥) величини складає 80%-125% від меж біоеквівалентності. Середні величини t1/2 аторвастатин у є подібними, в середньому приблизно 14 годин. Висновок: Терапія подвійними таблетками амлодипін 10мг/аторвастатин 40мг біоеквівалентна співвживанню окремих таблеток по 10мг амлодипіну та по 40мг аторвастатину. Приклад 4 Однодозове дослідження порівняння біоеквівалентності терапії подвійними таблетками 10мг амлодипіну/80мг аторвастатину та співвживаня таблеток по 10мг амлодипіну та 80мг аторвастатину Протокол: рандомізовані, однодозові 2шляхові перехресні дослідження проводять на 36 здорових волонтерах. Після ночі кожний суб'єкт отримував одиничну дозу 10мг амлодипіну та 80мг аторвастатину як терапію подвійними таблетками та співвживанням окремих таблеток на доби 1 та 15. Зразки крові збирають перед тим та серійно протягом 168 годин після кожної дози. Зразки плазми відбирають та зберігають замороженими при 70°С до аналізу. Концентрації у плазмі амлодипіну та аторвастатину аналізують затвердженими способами. Фармакокінетичні параметри оцінюють за профілем концентрація-час одночасними способами. Результати ANOVA log-трансформованих величин Смакс та AUC використовують для розрахунку 90% інтервалів довірчості для співвідношень найменше-квадратичних середніх значень лікування. Біоеквівалентність існує, якщо інтервали довірчості для співвідношень величин Смакс та AUC для амлодипіну та аторвастатину на основі log-трансформованих даних знаходяться в межах 80-125%. Результати: Дані, отримані від 36 суб'єктів, які завершили дослідження, оцінені. Середні концентрації у плазмі ілюстровані у Фігура х 9 та 10. Фармакокінетичні параметри зведені у таблиці 3. Індивідуальні величини Смакс та AUC ілюстровані у Фігура х 11 та 12. Амлодипін На основі величин Смакс та tмакс амлодипіну ступінь поглинання після застосування терапії по 29 79750 двійними таблетками по 10мг амлодипіну та 80мг аторвастатину є подібним до ступеню після співвживання окремих таблеток по 10мг амлодипіну та по 40мг аторвастатину. Різниця у середніх величинах tмакс складає менше 5 хвилин, а різниця у середніх величинах Смакс складає менше 2%. 90% інтервал довірчості для величин Смакс складає 80%-125% від меж біоеквівалентності. На основі величин AUC амлодипіну ступінь поглинання після застосування терапії подвійними таблетками по 10мг амлодипіну та 80мг аторвастатину є подібним до ступеню після співвживання окремих таблеток по 10мг амлодипіну та дво х по 40мг аторвастатину. Різниця у середніх величинах АUС(0-¥) складає менше 2%, а 90% інтервал довірчості для величин AUC(0-¥) складає 80%-125% від меж біоеквівалентності. Середні величини t1/2 амлодипіну є подібними, в середньому приблизно 54 годин. Аторвастатин На основі величин Смакс та tмакс аторвастатину ступінь поглинання після застосування терапії 30 подвійними таблетками по 10мг амлодипіну та 80мг аторвастатину є подібним до ступеню після співвживання окремих таблеток по 10мг амлодипіну та двох по 40мг аторвастатину. Різниця у середніх величинах tмакс складає менше 30 хвилин. Середні величини Смакс ідентичні. 90% інтервал довірчості для величин Смакс складає 80%-125% від меж біоеквівалентності. На основі величин AUC аторвастатину, ступінь поглинання після застосування терапії подвійними таблетками 10мг амлодипіну/80мг аторвастатину є подібним до ступеню після співвживання окремих таблеток по 10мг амлодипіну та дво х по 40мг аторвастатину. Різниця у середніх величинах AUC(0¥) складає 2%, а 90% інтервал довірчості для величин AUC(0-¥) складає 80%-125% від меж біоеквівалентності. Середні величини t1/2 аторвастатину є подібними, в середньому приблизно 14 годин. Висновок: Терапія подвійними таблетками амлодипін 10мг/аторвастатин 80мг є біоеквівалентною співвживанню окремих таблеток по 10мг амлодипіну та по 40мг аторвастатину. 31 79750 32 33 79750 34 35 Комп’ютерна в ерстка О. Гапоненко 79750 Підписне 36 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition of amlodipine and atorvastatin, process for the preparation thereof and kit
Автори англійськоюAlani Laman
Назва патенту російськоюФармацевтическая композиция, которая содержит амлодипин и аторвастатин, способ ее получения и комплект
Автори російськоюАлани Ламан
МПК / Мітки
МПК: A61P 9/08, A61P 9/10, A61P 9/12, A61P 9/00, A61P 9/14, A61K 31/40
Мітки: одержання, фармацевтична, композиція, аторвастатин, спосіб, комплект, амлодипін, містить
Код посилання
<a href="https://ua.patents.su/18-79750-farmacevtichna-kompoziciya-shho-mistit-amlodipin-ta-atorvastatin-sposib-oderzhannya-ta-komplekt.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить амлодипін та аторвастатин, спосіб її одержання та комплект</a>
Попередній патент: Інгібітори серин-протеаз, зокрема ns3 протеази вірусу гепатиту типу с
Наступний патент: Спосіб потокового приготування комбікормів
Випадковий патент: Спосіб гартування кілець підшипника кочення та підшипник кочення