Стабільна ліофілізована композиція на основі fgf-18
Формула / Реферат
1. Стабільна ліофілізована композиція, яка містить FGF-18, фосфатний буфер, який підтримує значення рН в діапазоні між 7,0 і 7,5, полоксамер 188 і цукрозу.
2. Стабільна ліофілізована композиція за п. 1, яка відрізняється тим, що фосфатний буфер підтримує значення рН на рівні 7,2 або приблизно 7,2.
3. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що концентрація буфера становить або приблизно становить від 5 мМ до 100 мМ.
4. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що концентрація полоксамеру 188 становить або приблизно становить від 0,1 мг/вмістище до 0,4 мг/вмістище.
5. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що концентрація цукрози становить або приблизно становить від 10 мг/вмістище до 60 мг/вмістище.
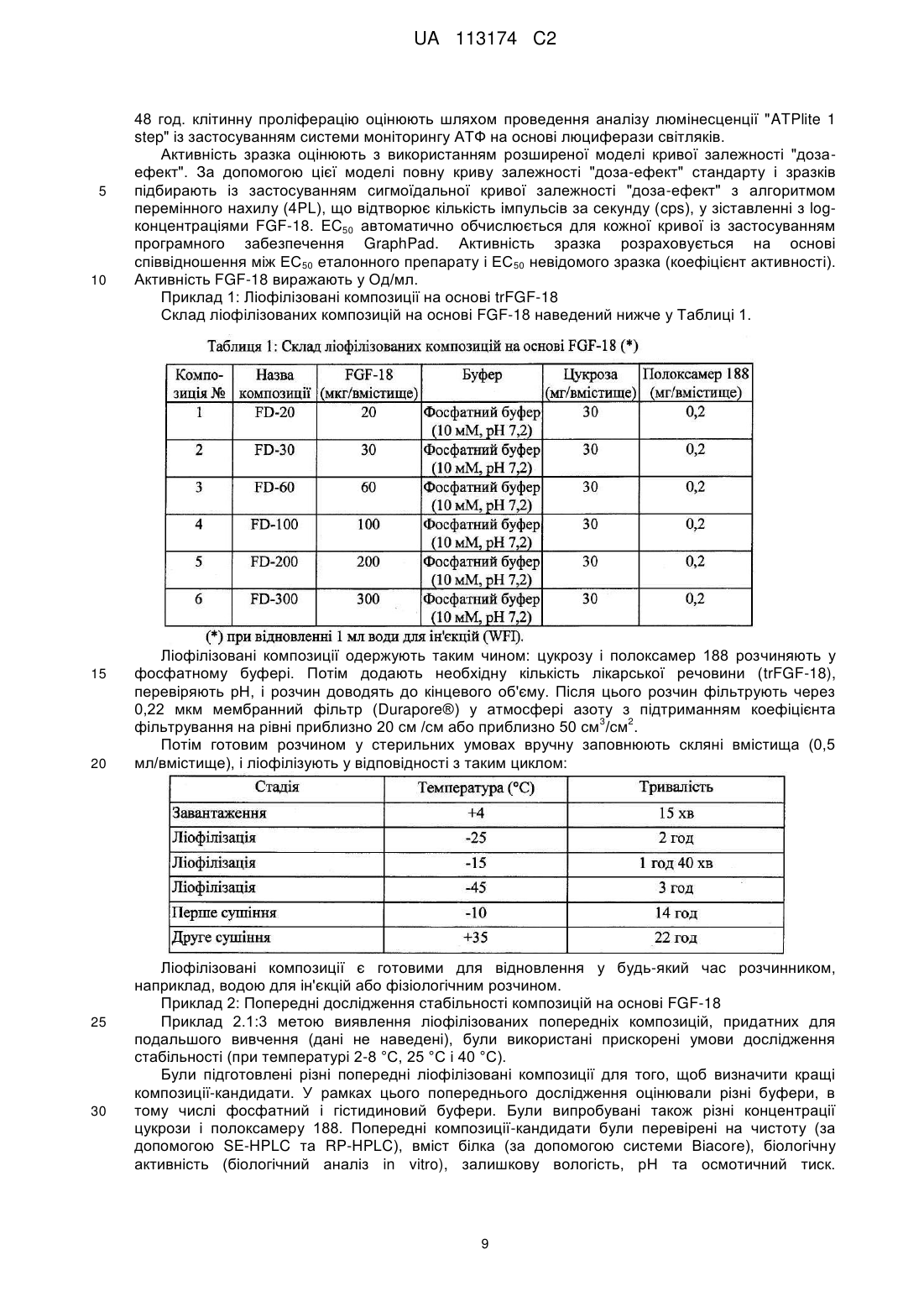
6. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що концентрація FGF-18 становить або приблизно становить від 20 мкг/вмістище до 300 мкг/вмістище.
7. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що композиція містить FGF-18 у кількості 20 мкг/вмістище, 30 мкг/вмістище, 60 мкг/вмістище, 100 мкг/вмістище, 200 мкг/вмістище або 300 мкг/вмістище, фосфатний буфер (10 мМ), який підтримує значення рН на рівні 7,2 або приблизно 7,2, цукрозу (30 мг/вмістище) і полоксамер 188 (0,2 мг/вмістище).
8. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що композиція додатково містить 5 % надлишок FGF-18.
9. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що FGF-18 вибраний з групи, яку складають:
а) поліпептид, який містить або складається з амінокислотні(-их) залишки(-ів) 28-207 послідовності SEQ ID NO:1,
b) поліпептид, який містить або складається з амінокислотні(-их) залишки(-ів) 28-196 послідовності SEQ ID NO:1, і
c) поліпептид, який містить або складається з послідовність(-ості) SEQ ID NO:2.
10. Спосіб одержання стабільної ліофілізованої композиції за будь-яким із попередніх пунктів, який включає стадії:
a) утворення суміші FGF-18 з фосфатним буфером, полоксамером 188 і цукрозою, і
b) піддавання згаданої суміші ліофілізації.
11. Готовий виріб, який включає в себе перше вмістище, яке вміщує стабільну ліофілізовану композицію за будь-яким із пп. 1-9, і друге вмістище, яке вміщує розчинник для відновлення.
12. Готовий виріб за п. 11, який відрізняється тим, що вмістище, яке вміщує стабільну ліофілізовану композицію, і вмістище, яке вміщує розчинник для відновлення, є двома відсіками двокамерної системи.
Текст
Реферат: Винахід стосується стабільної ліофілізованої композиції, яка містить фактор росту фібробластів FGF-18, полоксамер 188 і цукрозу; способу одержання такої композиції; виробу, який містить вказану композицію і розчинник, які знаходяться в різних відсіках двокамерної системи. UA 113174 C2 (12) UA 113174 C2 UA 113174 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Цей винахід стосується фармацевтичних композицій. Більш конкретно, цей винахід стосується ліофілізованих композицій на основі білка фактора росту фібробластів 18 (FGF-18) і способів одержання таких композицій. Ліофілізовані композиції за цим винаходом є стабільними при зберіганні при кімнатній температурі протягом відповідного періоду часу. Передумови створення винаходу Фактор росту фібробластів 18 (FGF-18) є членом родини білків фактора росту фібробластів (FGF), тісно спорідненим із FGF-8 і FGF-17. Члени родини FGF відрізняються гепаринзв'язувальними доменами. Такий передбачуваний гепарин-зв'язувальний домен був ідентифікований для FGF-18. Припускають, що рецептор-опосередковане передавання сигналів ініціюється при зв'язуванні ліганду FGF в комплексі з протеогліканом клітинної поверхні, сульфатом гепарину. Було показано, що FGF-18 являє собою проліферативний агент для хондроцитів і остеобластів (Ellsworth et al., 2002, Osteoarthritis and Cartilage, 10: 308-320; Shimoaka et al., 2002, J. Bio. Chem. 277(9):7493-7500). FGF-18 був запропонований для лікування хвороби хрящової тканини, такої як остеоартрит і пошкодження хрящів, як окрема лікарська речовина (WO2008/023063) або в поєднанні з гіалуроновою кислотою (WO2004/032849). Фармацевтичні композиції, які містять поліпептид FGF, є відомими. У WO00/21548 розкриті фармацевтичні композиції, які містять рекомбінантний FGF в комбінації з фармацевтично прийнятним носієм або розріджувачем. Прикладами відповідних носіїв або розріджувачів для ін'єкційних розчинів є вода або ізотонічні фізіологічні розчини. WO2008/121563 стосується фармацевтичних композицій, які містять FGF-21-вмісну сполуку, яка входить до складу дозованої ін'єкційної лікарської форми разом із фармацевтично прийнятним носієм. Прийнятним носієм може бути, зокрема, цукор, буфер та/або поверхневоактивна речовина. У WO92/01442 розкрита ліофілізована композиція, яка містить FGF, фармацевтично прийнятний наповнювач та або і) сіль лужного металу та целюлози, або іі) комбінацію складного ефіру поліоксіетиленсорбітану із цистеїном. Компоненти і) та іі) забезпечують можливість стабілізації композиції на основі FGF. У WO01/39788 описані фармацевтичні композиції, які містять FGF-18-вмісну сполуку разом із цитотоксином, в суміші із фармацевтично прийнятним носієм, наприклад, забуференим фосфатом фізіологічним розчином. У WO2008/023063 розкриті композиції, які містять FGF-18-вмісну сполуку разом із щонайменше одним фармацевтично прийнятним носієм, наповнювачами тощо. У цій заявці як приклад розкрита композиція для ін'єкцій, яка містить FGF-18 в носіях, таких як фізіологічний розчин, розчин декстрози, сироватковий альбумін і розчин Рінгера. При приготуванні фармацевтичної композиції, яка містить біологічно активний білок, згадану композицію необхідно виготовляти так, щоб активність білка зберігалась протягом заданого періоду часу. Втрата активності/стабільності білка може бути результатом хімічної або фізичної нестійкості білка, особливо унаслідок денатурації, агрегації або окиснення. Відповідно, одержані продукти можуть бути фармацевтично неприйнятними. Хоча використання наповнювача(-ів), як відомо, підвищує стабільність вихідного білка, стабілізувальна дія цих наповнювачів значною мірою залежать від природи наповнювачів і самого біологічно активного білка. Залишається потреба в композиціях, які містять FGF-18 як активний інгредієнт, які є стабільними протягом заданого періоду часу і які є придатними для використання для ін'єкції, за варіантом, якому віддається перевага, для внутрішньосуглобової ін'єкції. Згадані композиції можуть бути корисними для введення при лікуванні хвороби хрящової тканини у пацієнта, такої як остеоартрит або пошкодження хряща. Суть винаходу Метою цього винаходу є надання нової композиції, яка містить білок FGF-18. Конкретніше, згадана композиція являє собою стабільну одержану шляхом сублімаційного сушіння (або ліофілізовану) композицію, яка містить FGF-18. Цей винахід також пропонує способи одержання ліофілізованої композиції за цим винаходом. Ліофілізована композиція, опис якої наведений нижче, може бути корисною, після відновлення, для введення при лікуванні хвороб хрящової тканини. У першому аспекті цей винахід пропонує стабільну ліофілізовану композицію, яка містить або яку складають FGF-18, буфер, полоксамерна поверхнево-активна речовина і цукор як стабілізувальний агент. У варіанті здійснення цього винаходу, якому віддається перевага, згаданий буфер являє собою фосфатний буфер, згадана полоксамерна поверхнево-активна речовина являє собою полоксамер 188, і згаданий стабілізувальний агент являє собою цукрозу. 1 UA 113174 C2 5 10 15 20 25 30 35 40 45 50 55 60 У ще одному варіанті здійснення цього винаходу, якому віддається перевага, буфер підтримує значення рН на рівні від 6 до 8 або від приблизно 6 до приблизно 8, а більш конкретно, на рівні 7,2 або приблизно 7,2. У ще одному варіанті здійснення цього винаходу, якому віддається перевага, концентрація полоксамерної поверхнево-активної речовини дорівнює або приблизно дорівнює від 0,1 мг/вмістище до 0,4 мг/вмістище. За варіантом, якому віддається перевага, FGF18 вибраний з групи, яку складають: 1) поліпептид, який містить або складається зі зрілу(-ої) форму(-и) людського FGF-18, що відповідає послідовності, яка містить або складається з ділянку(-и) від залишку 28 (Glu) до залишку 207 (Ala) послідовності SEQ ID NO: 1, 2) поліпептид, який містить або складається зі скорочену(-ої) форму(-и) людського FGF-18, яка містить або складається з ділянку(-и) від залишку 28 (Glu) до залишку 196 (Lys) послідовності SEQ ID NO:1, і 3) поліпептид, який містить або складається з послідовність(-ості) SEQ ID NO:2. За варіантом, якому віддається більша перевага, FGF-18 являє собою trFGF-18, який відповідає визначенню, наведеному нижче. У другому аспекті цей винахід пропонує спосіб виготовлення стабільної ліофілізованої композиції на основі FGF-18, який включає стадії: 1) утворення суміші FGF-18, разом із буфером, поверхнево-активною речовиною і стабілізувальним агентом, і 2) піддавання згаданої суміші ліофілізації (сублімаційному сушінню), де згаданий буфер являє собою фосфатний буфер, згаданий стабілізувальний агент являє собою цукор, такий як цукроза, і згадана поверхнево-активна речовина являє собою полоксамерну поверхнево-активну речовину, таку як полоксамер 188. У варіанті здійснення цього винаходу, якому віддається перевага, буфер підтримує значення рН на рівні від 6 до 8 або від приблизно 6 до приблизно 8, й більш конкретно - на рівні 7,2 або приблизно 7,2. За варіантом, якому віддається перевага, FGF-18 вибирають з групи, яку складають: 1) поліпептид, який містить або складається зі зрілу(-ої) форму(-и) людського FGF-18, що відповідає послідовності, яка містить або складається з ділянку(-и) від залишку 28 (Glu) до залишку 207 (Ala) послідовності SEQ ID NO: 1, 2) поліпептид, який містить або складається зі скорочену(-ої) форму(-и) людського FGF-18, яка містить або складається з ділянку(-и) від залишку 28 (Glu) до залишку 196 (Lys) послідовності SEQ ID NO:1, і 3) поліпептид, який містить або складається з послідовність(-ості) SEQ ID NO:2. За варіантом, якому віддається більша перевага, FGF-18 являє собою trFGF-18, який відповідає визначенню, наведеному нижче. У третьому аспекті цей винахід пропонує готовий виріб для фармацевтичного або ветеринарного застосування, який включає в себе: 1) перше вмістище, яке вміщує стабільну ліофілізовану композицію, яка містить FGF-18, буфер, поверхнево-активну речовину і стабілізувальний агент, і 2) друге вмістище, яке вміщує розчинник для відновлення, причому згаданий буфер являє собою фосфатний буфер, згаданий стабілізувальний агент являє собою цукор, такий як цукроза, згадана поверхнево-активна речовина являє собою полоксамерну поверхнево-активну речовину, таку як полоксамер 188, і згаданий розчинник для відновлення являє собою воду або фізіологічний розчин (наприклад, 0,9 % (маса/об'єм) натрію хлорид для ін'єкцій). За варіантом, якому віддається перевага, FGF-18 вибраний з групи, яку складають: 1) поліпептид, який містить або складається зі зрілу(-ої) форму(-и) людського FGF18, що відповідає послідовності, яка містить або складається з ділянку(-и) від залишку 28 (Glu) до залишку 207 (Ala) послідовності SEQ ID NO:1, 2) поліпептид, який містить або складається зі скорочену(-ої) форму(-и) людського FGF-18, яка містить або складається з ділянку(-и) від залишку 28 (Glu) до залишку 196 (Lys) послідовності SEQ ID NO: 1, і 3) поліпептид, який містить або складається з послідовність(-ості) SEQ ID NO: 2. За варіантом, якому віддається більша перевага, FGF-18 являє собою trFGF-18, який відповідає визначенню, наведеному нижче. Визначення - Термін "білок FGF-18" або "FGF-18" у цьому описі означає білок, який зберігає щонайменше одну біологічну активність людського білка FGF-18. FGF-18 може бути нативним білком, у його зрілій формі або його скороченій формі. Біологічними активностями людського білка FGF-18, зокрема, є підвищення остеобластної активності (дивись W098/16644) або утворення хрящової тканини (дивись WO2008/023063). Нативний людський FGF-18, або людський FGF-18 дикого типу, являє собою білок, який експресується хондроцитами суглобового хряща. Людський FGF-18 вперше був позначений як zFGF-5 і повністю описаний у WO98/16644. Послідовність SEQ ID NO: 1 відповідає амінокислотній послідовності нативного людського FGF-18 із сигнальним пептидом, який складають амінокислотні залишки від 1 (Met) до 27 (Ala). Зріла форма людського FGF-18 відповідає амінокислотній послідовності від залишку 28 (Glu) до залишку 207 (Ala) послідовності 2 UA 113174 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO:1 (180 амінокислот). FGF-18 має специфічність до FGFR4 і "lllс" сплайсингових варіантів FGFR3 і FGFR2 (Ellsworth et al., 2002, Osteoarthritis and Cartilage, 10: 308-320). Зріла форма FGF-18 має середню масу 21,04 кДа. У цьому винаході FGF-18 можна продукувати із застосуванням рекомбінантного способу, наприклад, описаного у заявці WO2006/063362. Залежно від систем та умов експресії, FGF-18 у цьому винаході експресують в рекомбінантній клітині-хазяїні з вихідним метіоніном (залишок Met) або із сигнальною послідовністю для секреції. У разі експресії в прокаріотичному хазяїні, такому як Е.соlі, FGF-18 містить додатковий залишок Met у своїй N-кінцевій послідовності. Наприклад, амінокислотна послідовність людського FGF-18, у разі експресії в Е.соlі, починається із залишку Met в N-кінцевій послідовності (положення 1) з подальшими залишками від 28 (Glu) до залишку 207 (Ala) послідовності SEQ ID NO:1. - Термін "скорочена форма" FGF-18 у цьому описі означає білок, який містить або який складається із залишки(-ів) від 28 (Glu) до 196 (Lys) послідовності SEQ ID NO: 1. За варіантом, якому віддається перевага, скорочена форма білка FGF-18 являє собою поліпептид, позначений як "trFGF-18" (170 амінокислот), який починається із залишку Met (в N-кінцевій послідовності) з подальшими амінокислотними залишками 28 (Glu)-196 (Lys) людського FGF-18 дикого типу. Амінокислотна послідовність trFGF-18 представлена послідовністю SEQIDNO:2 (амінокислотні залишки від 2 до 170 послідовності SEQ ID NO: 2 відповідають амінокислотним залишкам від 28 до 196 послідовності SEQ ID NO:1). Скорочена форма білка FGF-18 (trFGF-18) являє собою рекомбінантну скорочену форму людського FGF-18, який продукується в Е.соlі (дивись WO2006/063362). Було показано, що trFGF-18 демонструє активності, подібні до активностей зрілого людського FGF-18, наприклад, він підвищує проліферацію хондроцитів і відкладення хряща, що призводить до репарації та відновлення різних хрящових тканин (дивись WO2008/023063). Скорочена форма білка FGF-18 (trFGF-18) має середню масу 19,83 кДа. - Термін "стабільність" у цьому описі означає фізичну, хімічну і конформаційну стабільність FGF-18 в композиціях за цим винаходом (включаючи підтримання біологічної активності). Нестабільність білкової композиції може бути спричинена хімічною деградацією або агрегацією білкових молекул з утворенням полімерів більш високого порядку, деглікозилюванням, модифікацією глікозилювання, окисненням або будь-якою іншою структурною модифікацією, яка послаблює щонайменше одну біологічну активність білка FGF-18 за цим винаходом. - Термін "стабільний" розчин або композиція у цьому описі означає розчин або композицію, ступінь деградації, модифікації, агрегації, втрати біологічної активності тощо, білків в якому(-ій) є прийнятно контрольованим і не підвищує рівня неприйнятності з перебігом часу. За варіантом, якому віддається перевага, композиція зберігає щонайменше більше ніж 80 % активності FGF18 протягом періоду часу щонайменше 12 місяців при кімнатній температурі. Стабілізована композиція за цим винаходом містить FGF-18, і за варіантом, якому віддається перевага, має термін придатності, тривалість якого становить щонайменше приблизно 12 місяців, 18 місяців, за варіантом, якому віддається більша перевага, щонайменше 20 місяців, за варіантом, якому віддається ще більша перевага, приблизно 24 місяці, при зберіганні при кімнатній температурі. Методи моніторингу стабільності композиції на основі FGF-18 за цим винаходом є застосовними в цій галузі і включають методи, описані в прикладах, наведених нижче. - Термін "буфер" у цьому описі означає розчини сполук, які, як відомо, є безпечними в композиціях для фармацевтичного або ветеринарного застосування та які мають здатність до підтримання або регулювання значень рН композиції в інтервалі рН, бажаному для згаданої композиції. До прийнятних буферів для регулювання значень рН від помірно кислих рН до помірно основних рН, належать, але без обмеження ними, трис-буфер, фосфатний, ацетатний, цитратний, аргініновий і гистидиновий буфери. Термін "трис-буфер" означає 2-аміно-2гідроксиметил-1,3-пропандіол, а також будь-яку його фармакологічно прийнятну сіль. За цим винаходом буферами, яким віддається перевага, є фосфатні буфери. - Термін "поверхнево-активна речовина" у цьому описі означає розчинну сполуку, яка може використовуватись, зокрема, для підвищення розчинності у воді гідрофобних, маслянистих речовин, або для підвищення іншим чином зміщуваності двох речовин із різними рівнями гідрофобності. З цієї причини, ці полімери широко використовуються в промисловості, косметичних і фармацевтичних засобах. Вони також використовуються як типові системи для доставки ліків, зокрема, для того, щоб модифікувати абсорбцію лікарського засобу або його доставку до тканин-мішеней. Добре відомими поверхнево-активними речовинами є полісорбати (похідні поліоксіетилену; Tween), а також полоксамери (тобто співполімери на основі оксиду етилену і оксиду пропілену, також відомі як Pluronics®). За цим винаходом поверхнево-активна речовина, якій віддається перевага, являє собою полоксамерну поверхнево-активну речовину, а за варіантом, якому віддається ще більша перевага, є полоксамером 188 (Pluronic® F68). 3 UA 113174 C2 5 10 15 20 25 30 35 40 45 50 55 60 - Термін "стабілізувальний агент", "стабілізатор" або "ізотонічний агент", у значенні, вживаному у цьому описі, означає сполуку, яка є фізіологічно прийнятною і надає композиції відповідну стабільність/ізотонічність. Він запобігає, зокрема, потоку води через клітинні мембрани, які контактують із композицією. Під час процесу сублімаційного сушіння (ліофілізації) згаданий стабілізатор також ефективний як кріопротектор. Для таких цілей зазвичай використовують такі сполуки як гліцерин. До інших прийнятних стабілізувальних агентів належать, але без обмеження ними, амінокислоти або білки (наприклад, гліцин або альбумін), солі (наприклад, хлорид натрію) і цукри (наприклад, декстроза, маніт, цукроза і лактоза). За цим винаходом стабілізувальним агентом, якому віддається перевага, є цукор, за варіантом, якому віддається ще більша перевага, цукроза. - Термін "вмістище" або "контейнер" у цьому описі означає, в широкому сенсі, резервуар, придатний для зберігання композиції на основі FGF-18 в ліофілізованої формі. Цей резервуар також вміщує розчинник для відновлення. Прикладами вмістища, яке можна використовувати за цим винаходом, є шприци, ампули, картриджі або інші такі резервуари, придатні для доставки композиції на основі FGF-18 пацієнту у вигляді ін'єкції, за варіантом, якому віддається перевага, шляхом внутрішньосуглобової ін'єкції. Альтернативно вмістище, яке вміщує композицію на основі FGF-18, і вмістище, яке вміщує розчинник для відновлення, можуть бути виконані як 2 відсіки двокамерної системи (наприклад, шприца або картриджа). Вмістища, придатні для пакування засобів для внутрішньосуглобового введення, добре відомі і широко використовуються в цій галузі. -Термін "розчинник" у цьому описі означає рідкий розчинник, водний або неводний. Вибір розчинника залежить насамперед від розчинності лікарської сполуки у згаданому розчиннику і від способу введення. Водний розчинник може складатись виключно з води, або може містити воду та один або декілька змішуваних розчинників, і може містити розчинені речовини, такі як цукри, буфери, солі або інші наповнювачі. Найчастіше використовуваними неводними розчинниками є коротколанцюгові органічні спирти, такі як метанол, етанол, пропанол, коротколанцюгові кетони, такі як ацетон, та поліспирти, такі як гліцерин. За цим винаходом розчинник, якому віддається перевага, являє собою водний розчинник, такий як вода або фізіологічний розчин. - Термін "хвороба хрящової тканини" у цьому описі означає розлади, які є результатом уражень унаслідок травматичного пошкодження або хондропатії. Прикладами хвороб хрящової тканини, які можна лікувати шляхом введення композиції на основі FGF-18, розкритої у цьому описі, є, але без обмеження ними, артрит, такий як остеоартрит або ревматоїдний артрит, і пошкодження хряща. - Термін "остеоартрит" вжитий для позначення найбільш поширеної форми артриту. Він може спричинюватись руйнуванням хряща. Шматочки хряща можуть відриватись і викликати біль і набряк в суглобі між кістками. З перебігом часом хрящ може стиратися повністю, і кістки будуть тертися одна об одну. Остеоартрит може уразити будь-який суглоб, але зазвичай стосується рук і навантажуваних суглобів, таких як стегна, коліна, стопи і хребет. У прикладі, якому віддається перевага, остеоартрит може бути остеоартритом колінного суглоба або остеоартритом стегнового суглоба. Фахівцям добре відома класифікація остеоартриту, яка вживається в цій галузі, зокрема, система оцінювання морфології хряща, запропонована OARSI (Міжнародна спілка вивчення остеоартриту) (дивись, наприклад, Custers et al., 2007). Остеоартрит є однією із хвороб хрящової тканини, яку доцільно лікувати шляхом введення композиції на основі FGF-18 за цим винаходом. - Термін "пошкодження хряща" у цьому описі означає хворобу хрящової тканини або пошкодження хряща, що є наслідком, зокрема, травми. Пошкодження хряща можуть виникнути в результаті травматичного механічного руйнування, зокрема, після аварії або хірургічного втручання. У межах цього визначення розглядається також пов'язане зі спортом пошкодження або пов'язане зі спортом виснаження тканин суглоба. Докладний опис винаходу Головною метою цього винаходу є надання стабільної ліофілізованої композиції, яка містить або яку складають білок FGF-18, буфер, полоксамерна поверхнево-активна речовина і цукор як стабілізувальний агент. У варіанті здійснення цього винаходу, якому віддається перевага, згаданий буфер являє собою фосфатний буфер, згадана полоксамерна поверхнево-активна речовина являє собою полоксамер 188, і згаданий стабілізувальний агент являє собою цукрозу. За варіантом, якому віддається перевага, білок FGF-18 вибраний з групи, яку складають: 1) поліпептид, який містить або складається зі зрілу(-ої) форму(-и) людського FGF-18, що відповідає послідовності, яка містить або складається з ділянку(-и) від залишку 28 (Glu) до залишку 207 (Ala) послідовності SEQ ID NO:1, 2) поліпептид, який містить або складається зі 4 UA 113174 C2 5 10 15 20 25 30 35 40 45 50 55 скорочену(-ої) форму(-и) людського FGF-18, яка містить або складається з ділянку(-и) від залишку 28 (Glu) до залишку 196 (Lys) послідовності SEQ ID NO: 1, і 3) поліпептид, який містить або складається з послідовність(-ості) SEQ ID NO:2. За варіантом, якому віддається більша перевага, FGF-18 являє собою trFGF-18. Концентрація FGF-18 у цьому винаході за варіантом, якому віддається перевага, дорівнює або приблизно дорівнює від 20 мкг/вмістище до 300 мкг/вмістище, за варіантом, якому віддається перевага, дорівнює або приблизно дорівнює 20 мкг/вмістище, 30 мкг/вмістище, 40 мкг/вмістище, 50 мкг/вмістище, 60 мкг/вмістище, 70 мкг/вмістище, 80 мкг/вмістище, 90 мкг/вмістище, 100 мкг/вмістище, 150 мкг/вмістище, 200 мкг/вмістище, 250 мкг/вмістище або 300 мкг/вмістище, за варіантом, якому віддається ще більша перевага, дорівнює або приблизно дорівнює 20 мкг/вмістище, 30 мкг/вмістище, 60 мкг/вмістище, 100 мкг/вмістище, 200 мкг/вмістище або 300 мкг/вмістище. FGF-18 може бути доданий із 5 % надлишком, щоб запобігти втратам білка, які можуть виникнути під час приготування композиції. Наприклад, при концентрації FGF-18 30 мкг/вмістище, згадана сполука може бути додана в кількості 31,5 мкг/вмістище. За варіантом, якому віддається перевага, композиції за цим винаходом протягом періоду часу тривалістю щонайменше 12 місяців (перед першим використанням) зберігають щонайменше 80 % від біологічної активності FGF-18 під час ліофілізації та/або пакування. Активність FGF-18 може бути визначена, як описано нижче в розділі "Приклади". Буферами, яким віддається перевага, за цим винаходом є фосфатні буфери, які підтримують значення рН в діапазоні між 6 і 8, за варіантом, якому віддається перевага, між 7 і 7,5 і за варіантом, якому віддається ще більша перевага, на рівні 7,2 або приблизно 7,2. Концентрація буфера в загальному розчині, за варіантом, якому віддається перевага, дорівнює або приблизно дорівнює від 5 мМ до 500 мМ. У варіанті здійснення цього винаходу, якому віддається перевага, концентрація буфера дорівнює або приблизно дорівнює від 10 мМ до 100 мМ. За варіантом, якому віддається перевага, концентрація буфера дорівнює або приблизно дорівнює 10 мМ. Стабілізувальний агент за цим винаходом, за варіантом, якому віддається перевага, являє собою цукор. Цукром, якому віддається перевага, є цукроза. За варіантом, якому віддається перевага, концентрація стабілізувального агента дорівнює або приблизно дорівнює від 0,5 мг/вмістище до 250 мг/вмістище, за варіантом, якому віддається більша перевага, дорівнює або приблизно дорівнює від 1 мг/вмістище до 100 мг/вмістище, конкретніше, дорівнює або приблизно дорівнює від 15 мг/вмістище до 60 мг/вмістище, за варіантом, якому віддається ще більша перевага, дорівнює або приблизно дорівнює 30 мг/вмістище. Поверхнево-активна речовина за цим винаходом, за варіантом, якому віддається перевага, являє собою полоксамерну поверхнево-активну речовину, і, зокрема, є полоксамером 188 (наприклад, Pluronic® F68). За варіантом, якому віддається перевага, концентрація поверхневоактивної речовини дорівнює або приблизно дорівнює від 0,01 мг/вмістище до 10 мг/вмістище, за варіантом, якому віддається більша перевага, дорівнює або приблизно дорівнює від 0,05 мг/вмістище до приблизно 5 мг/вмістище, конкретніше, дорівнює або приблизно дорівнює від 0,1 мг/вмістище до приблизно 1 мг/вмістище, за варіантом, якому віддають найбільшу перевагу, дорівнює або приблизно дорівнює 0,1 мг/вмістище, 0,2 мг/вмістище або 0,4 мг/вмістище, і зокрема дорівнює або приблизно дорівнює 0,2 мг/вмістище. У варіанті здійснення цього винаходу, якому віддається перевага, стабільна ліофілізована композиція за цим винаходом містить або її складають FGF-18 у кількості, яка дорівнює або приблизно дорівнює 20 мкг/вмістище, 30 мкг/вмістище, 60 мкг/вмістище, 100 мкг/вмістище, 200 мкг/вмістище або 300 мкг/вмістище, фосфатний буфер (10 мМ) при рН 7,2, цукроза (30 мг/вмістище) і полоксамер 188 (0,2 мг/вмістище). У разі включення 5 % надлишку, ліофілізована композиція за цим винаходом містить FGF-18 у кількості, яка дорівнює або приблизно дорівнює 21 мкг/вмістище, 31,5 мкг/вмістище, 63 мкг/вмістище, 105 мкг/вмістище, 210 мкг/вмістище або 315 мкг/вмістище. У іншому варіанті здійснення цей винахід пропонує стабільну ліофілізовану композицію, яка містить: 1) FGF-18:цукрозу зі співвідношенням концентрацій від або приблизно від 1:95000 до або приблизно до 1:6000, за варіантом, якому віддається перевага, на рівні або приблизно на рівні 1:92000, 1:61000,1:31000, 1:18450, 1:9200 або 1:6100, 2) FGF-18:полоксамер 188 зі співвідношенням концентрацій від або приблизно від 1:25 до або приблизно до 6:10, за варіантом, якому віддається перевага, на рівні або приблизно нарівні 1:25, 5:83, 5:42, 1:5, 2:5 або 6:10, 5 UA 113174 C2 5 10 15 20 25 30 35 40 45 50 55 3) FGF-18:фосфатний буфер при рН 7,2 з молярним співвідношенням від або приблизно від 1:10500 до або приблизно до 1:700, за варіантом, якому віддається перевага, на рівні або приблизно на рівні 1:10500,1:7000,1:3500,1:2100,1:1050 або 1:700, причому білок FGF-18, за варіантом, якому віддається перевага, вибраний з групи, яку складають: 1) поліпептид, який містить або складається з амінокислотні(-их) залишки(-ів) 28 (Glu)-207 (Ala) послідовності SEQ ID NO: 1, 2) поліпептид, який містить або складається з амінокислотні(-их) залишки(-ів) 28 (Glu)-196 (Lys) послідовності SEQ ID NO: 1, або 3) поліпептид, який містить або складається з послідовність(-ості) SEQ ID NO: 2. За варіантом, якому віддається більша перевага, FGF-18 містить або складається з амінокислотні(-их) залишки(-ів) 28 (Glu)-207 (Ala) послідовності SEQ ID NO: 1. У ще одному варіанті здійснення цей винахід пропонує стабільну ліофілізовану композицію, яка містить: 1) FGF-18:цукрозу з молярним співвідношенням від або приблизно від 1:90000 до або приблизно до 1:5000, за варіантом, якому віддається перевага, на рівні або приблизно нарівні 1:87000,1:58000,1:29000,1:17400,1:8700 або 1:5800, 2)FGF-18:полоксамер 188 з молярним співвідношенням від або приблизно від 5:120 до або приблизно до 5:8, за варіантом, якому віддається перевага, на рівні або приблизно нарівні 5:118, 5:79,10:79,10:47, 5:12 або 5:8, 3)FGF-18:фосфатний буфер при рН 7,2 з молярним співвідношенням від або приблизно від 1:10000 до або приблизно до 1:700, за варіантом, якому віддається перевага, на рівні або приблизно на рівні 1:10000,1:6600,1:3300,1:2000,1:1000 або 1:700, причому білок FGF-18, за варіантом, якому віддається перевага, вибраний з групи, яку складають: 1) поліпептид, який містить або складається з амінокислотні(-их) залишки(-ів) 28 (Glu)-207(Ala) послідовності SEQ ID NO: 1, 2)поліпептид, який містить або складається з амінокислотні(-их) залишки(-ів) 28 (Glu)-196 (Lys) послідовності SEQ ID NO: 1, або 3) поліпептид, який містить або складається з послідовність(-ості) SEQ ID NO: 2. За варіантом, якому віддається більша перевага, білок FGF-18 містить або складається з амінокислотні(-их) залишки(-ів) 28 (Glu)-196 (Lys) послідовності SEQ ID NO: 1. За варіантом, якому віддається ще більша перевага, білок FGF-18 містить або складається з послідовність(-ості) SEQ ID NO: 2. У конкретному варіанті здійснення цього винаходу білок FGF-18 являє собою trFGF-18. Цей винахід також пропонує спосіб виготовлення будь-якої з описаних вище стабільних ліофілізованих композицій на основі FGF-18, який включає стадії: 1) утворення суміші FGF-18 з буфером, полоксамерною поверхнево-активною речовиною і цукром як стабілізувальним агентом, і 2) піддавання згаданої суміші ліофілізації. Стадії 1 і 2 здійснюють з використанням традиційних процедур. Як приклад, з метою одержання прийнятної стабільної композиції, певну кількість FGF-18, такого як trFGF-18, змішують із фосфатним буфером, який підтримує рН на рівні 7,2 або приблизно 7,2, полоксамером 188 і цукрозою. Кожна із цих сполук (тобто FGF-18,буфер, поверхнево-активна речовина і стабілізувальний агент) може бути використана відповідно до описаних вище концентрацій, рН та/або співвідношень. Одержану суміш ліофілізують, після чого розподіляють у вмістища. Зміни цього процесу будуть зрозумілі фахівцю в цій галузі техніки. Цей винахід також пропонує готовий виріб для фармацевтичного або ветеринарного застосування, який включає в себе: 1) перше вмістище, яке вміщує будь-яку з описаних вище стабільних ліофілізованих композицій, яка містить або яку складають FGF-18, буфер, полоксамерна поверхнево-активна речовина, цукор як стабілізувальний агент, і 2) друге вмістище, яке вміщує розчинник для відновлення. Як приклад, перше вмістище вміщує стабільну ліофілізовану композицію, яка містить або яку складають певна кількість FGF-18, такого як trFGF-18, фосфатний буфер, який підтримує рН на рівні 7,2 або приблизно 7,2, полоксамер 188 і цукрозу(-а), а друге вмістище вміщує фізіологічний розчин (0,9 % (маса/об'єм) натрію хлорид для ін'єкцій). Кожна із цих сполук (тобто FGF-18, буфер, поверхнево-активна речовина і стабілізувальний агент) може бути використана відповідно до описаних вище концентрацій, рН та/або співвідношень. За варіантом, якому віддається перевага, вмістище, яке вміщує композицію на основі FGF-18, і вмістище, яке вміщує розчинник для відновлення, відповідають двом відсікам двокамерної системи (наприклад, шприца або картриджа). Описаний також пакувальний матеріал, на який нанесені інструкції з відновлення ліофілізованої композиції на основі FGF-18 (перше вмістище) в розчиннику (друге вмістище). 6 UA 113174 C2 5 10 15 20 25 30 35 40 45 50 55 Ліофілізовані композиції за цим винаходом можуть зберігатися протягом щонайменше від приблизно 12 місяців до приблизно 24 місяців. За умов зберігання, яким віддається перевага, перед першим використанням ці композиції зберігають без доступу яскравого світла (за варіантом, якому віддається перевага, в темряві), при кімнатній температурі (при 25 °C або при приблизно 25 °C). Стабільну ліофілізовану композицію за цим винаходом необхідно відновити, за варіантом, якому віддається перевага, в стерильних умовах, із використанням розчинника, такого як вода або фізіологічний розчин (наприклад, 0,9 % (маса/об'єм) натрію хлорид для ін'єкцій), перед використанням, тобто перед ін'єкцією. Після відновлення об'єм, призначений для ін'єкції, становить, за варіантом, якому віддається перевага, від 0,5 мл до 5 мл, за варіантом, якому віддається більша перевага, 0,5 мл, 1 мл або 2 мл. Композиція на основі FGF-18, за варіантом, якому віддається перевага, має бути введена протягом однієї години після відновлення. Цей винахід пропонує стабільні ліофілізовані композиції на основі FGF-18, зокрема, для разового застосування, придатні для фармацевтичного або ветеринарного застосування. Стабільну ліофілізовану композицію, яка містить FGF-18, за цим винаходом можна застосовувати, після відновлення, для введення з метою полегшення репарації хряща або для лікування хвороб хрящової тканини, таких як остеоартрит або пошкодження хряща. Ці стабільні ліофілізовані композиції, після відновлення, є придатними для використання в ін'єкційних та альтернативних системах доставки. У варіанті здійснення цього винаходу, якому віддається особлива перевага, композиції за цим винаходом призначені для внутрішньосуглобового введення. Вони можуть бути введені, після відновлення, шляхом прямої ін'єкції в синовіальну рідину суглоба або безпосередньо в пошкодження. У варіанті здійснення цього винаходу, якому віддається перевага, внутрішньосуглобове введення виконують в суглоб, вибраний з групи, яку складають тазостегновий суглоб, колінний суглоб, ліктьовий суглоб, суглоби зап'ястка, гомілковостопний суглоб, суглоби хребта, суглоби стопи, суглоби пальця руки, суглоби пальця ноги, суглоби кисті, плечовий суглоб, суглоби ребер, суглоби лопаток, стегнові суглоби, суглоби гомілок, суглоби п'ят і суглоби вздовж кісткових точок хребта. У ще одному варіанті здійснення цього винаходу, якому віддається перевага, внутрішньосуглобове введення здійснюють в стегновий або колінний суглоб. Композиції на основі FGF-18 за цим винаходом мають поліпшену стабільність, і їх можна легко зберігати при кімнатній температурі (при 25 °C або при приблизно 25 °C) або при температурі 2-8 °C (дивись наведені нижче приклади), за варіантом, якому віддається перевага, при кімнатній температурі. Дійсно, винахідники виявили, що ліофілізовані композиції, які містять FGF-18 (наприклад, trFGF-18), фосфатний буфер (10 мМ) при рН 7,2, цукрозу (30 мг/вмістище) і полоксамер 188 (0,2 мг/вмістище), є стабільними тривалий час, зокрема, при зберіганні при кімнатній температурі. Згадані композиції зводять до мінімального рівня втрати активного інгредієнта, тобто FGF-18 Крім того, було виявлено, що згадані композиції є більш стійкими до окиснення і утворення білкових агрегатів. Наведені нижче приклади призначені для пояснення одержання композицій за цим винаходом. Обсяг цього винаходу не слід розглядати як такий, що складається лише з наведених нижче прикладів. Опис фігури Фігура 1: Показує вплив поверхнево-активної речовини (полоксамер 188) на відновлення FGF-18 до процесу ліофілізації. Використовували попередні композиції, які містять 10 мг/мл (+5 % надлишку) FGF-18 у фосфатному буфері при рН 7,2, з одночасною зміною концентрації поверхнево-активної речовини (від 0 % до 0,2 %). Вміст білка визначали для кожної з попередніх композицій перед фільтруванням (BF) і після фільтрування (Т=0). Опис послідовностей SEQ ID NO: 1: Амінокислотна послідовність нативного людського FGF-18. SEQ ID NO: 2: Амінокислотна послідовність рекомбінантного скороченого FGF-18 (trFGF-18). Приклади Матеріал Рекомбінантний скорочений FGF-18 (trFGF-18) цих прикладів одержали шляхом експресії в E.colі, у відповідності з методикою, описаною в заявці WO2006/063362. У наведених нижче прикладах trFGF-18 і FGF-18 використовують взаємозамінно. У наведених нижче прикладах були використані такі речовини: - цукроза (1,07653, Merck; молекулярна маса: 342,30 г/моль); - натрію дигідрофосфату моногідрат (1,06345, Merck); - динатрію дигідрофосфату дигідрат (1,06586, Merck); 7 UA 113174 C2 5 10 15 20 25 30 35 40 45 50 55 60 - полоксамер 188 (Lutrol F68 DAC, USP/NF (Фармакопея США/Національний рецептурний довідник), BASF; молекулярна маса: 8400 г/моль); - вода для ін'єкцій; - фізіологічний розчин (0,9 % (маса/об'єм) натрію хлорид для ін'єкцій); - моноклональні антитіла анти-FGF-l 8, клон № F5A2, на вміст білка (надано RBM); - клітини BAF3-FGFR3c (Вашингтонський університет); - селективне середовище на основі RPMI1640 (Інститут імені Розуела Парка) (Invitrogen); - люмінесцентна аналітична система ATPIite I step (Perkin Elmer); - гепарин Н3149 (Sigma). Обладнання - фільтр AMICON ULTRA-4, смуга пропускання 10000 (UFC 8012024, Amicon); - система Biacore 2000 (Biacore); - СО2-інкубатор (Heraeus); - колонка TSK2000SWxl, 7,8 × 300 мм, 5 мкм (TosoHaas, код 08540); - передколонка TSKG2000 (Hichrom, код 8543); - системи рідинної хроматографії високої ефективності (HPLC) (Waters); - люмінометр (Perkin Elmer); - мембранні фільтри 0,22 мкм (Durapore, тип GWVP, Millipore); - програмне забезпечення Stabileo (версія 1.1; пакет Microsoft® Excel Visual Basic®); - програмне забезпечення GraphPad (Prism); - тримачі з нержавіючої сталі, ємність 22 мл і 220 мл (Sartorius); - колонка Zorbax 300SB-C18 (150 × 4,6 см); - скляні пробірки DIN2R (3 мл) (Nuova ОМРІ); - пробки з гумовим покриттям (S2F452, D777-1, В2-40, West Pharmaceutical); - гумові пробки (код 1779, W1816, сірий колір, Pharma-Gummi). Методи Різні дослідження композицій Стандартні методи були використані для: - гель-хроматографії за розміром молекул (SE-HPLC), - рідинної хроматографії високої ефективності з оберненою фазою (RP-HPLC), - вимірювання залишкової вологості, - вимірювання рН, - вимірювання осмоляльності (лише час 0), - електрофорезу в поліакриламідному гелі з додецилсульфатом натрію/забарвлення сріблом (SDS-PAGE/SS), і - пептидного картування/рідинної хроматографії надвисокої ефективності (UPLC) (окиснені форми). Вміст білка Кількісне визначення білка, тобто trFGF-18, в різних композиціях здійснюють із застосуванням мікрорідинної системи Biacore. Зразки (25 мкл), які містять trFGF-18 (відповідним чином розведені у присутності 10 мг/мл бичачого сироваткового альбуміну (BSA)), випробують шляхом пропускання (5 мкл/хв при температурі 25 °C) над поверхнею датчика, заздалегідь сенсибілізованою моноклональним антитілом анти-FGF-18, клон F5A2, з подальшим пропусканням гліцину (5 мкл, 10 мМ, рН2,0), використаного як регенераційний буфер. Еталон (IRS FGF-18 № 051230), в межах від 125 нг/мл до 2000нг/мл, пропускають в кожній аналітичній серії. Результати збирають у вигляді резонансних одиниць (RU), і рівень FGF-18 кожного зразка екстраполюють за стандартною кривою, яку підбирають із використанням квадратичного алгоритму з log-трансформованими даними. Біологічний аналіз Біологічну активність FGF-18 визначають як проліферативну активність за допомогою біологічного аналізу in vitro з використанням клітинної лінії BaF3, стабільно трансфікованої FGFрецептором 3с (FGFR3c). Клітини BaF3, які експресують FGFR3c, проліферують у разі стимулювання FGF-18. Клітини BaF3/FGFR3c культивують на селективному середовищі на основі RPMI 1640 у присутності r-hIL-3, використаного як фактор росту. З метою специфічної перевірки проліферативної дії FGF-18, клітини мають бути позбавлені IL-3. Таким чином, клітини культивують при температурі 37 °C, 5 % СО2 та за відсутності r-hIL-3 протягом 26 год. перед аналізом. Стандарт і зразки піддають 5-кратному послідовному розведенню у аналітичному середовищі в діапазоні концентрацій від 0,002 Од/мл до 177,5 Од/мл. Клітини BAF3/FGFR3c, позбавлені IL-3, у кількості 20000 клітин/лунка інкубують при температурі 37 °C, 5 % СО2 з FGF18 у присутності гепарину (1 мкг/мл) і 10 % сироватки новонародженого теляти, після чого через 8 UA 113174 C2 5 10 15 20 25 30 48 год. клітинну проліферацію оцінюють шляхом проведення аналізу люмінесценції "ATPlite 1 step" із застосуванням системи моніторингу АТФ на основі люциферази світляків. Активність зразка оцінюють з використанням розширеної моделі кривої залежності "дозаефект". За допомогою цієї моделі повну криву залежності "доза-ефект" стандарту і зразків підбирають із застосуванням сигмоїдальної кривої залежності "доза-ефект" з алгоритмом перемінного нахилу (4PL), що відтворює кількість імпульсів за секунду (cps), у зіставленні з logконцентраціями FGF-18. EC50 автоматично обчислюється для кожної кривої із застосуванням програмного забезпечення GraphPad. Активність зразка розраховується на основі співвідношення між ЕС50 еталонного препарату і ЕС50 невідомого зразка (коефіцієнт активності). Активність FGF-18 виражають у Од/мл. Приклад 1: Ліофілізовані композиції на основі trFGF-18 Склад ліофілізованих композицій на основі FGF-18 наведений нижче у Таблиці 1. Ліофілізовані композиції одержують таким чином: цукрозу і полоксамер 188 розчиняють у фосфатному буфері. Потім додають необхідну кількість лікарської речовини (trFGF-18), перевіряють рН, і розчин доводять до кінцевого об'єму. Після цього розчин фільтрують через 0,22 мкм мембранний фільтр (Durapore®) у атмосфері азоту з підтриманням коефіцієнта 3 2 фільтрування на рівні приблизно 20 см /см або приблизно 50 см /см . Потім готовим розчином у стерильних умовах вручну заповнюють скляні вмістища (0,5 мл/вмістище), і ліофілізують у відповідності з таким циклом: Ліофілізовані композиції є готовими для відновлення у будь-який час розчинником, наприклад, водою для ін'єкцій або фізіологічним розчином. Приклад 2: Попередні дослідження стабільності композицій на основі FGF-18 Приклад 2.1:3 метою виявлення ліофілізованих попередніх композицій, придатних для подальшого вивчення (дані не наведені), були використані прискорені умови дослідження стабільності (при температурі 2-8 °C, 25 °C і 40 °C). Були підготовлені різні попередні ліофілізовані композиції для того, щоб визначити кращі композиції-кандидати. У рамках цього попереднього дослідження оцінювали різні буфери, в тому числі фосфатний і гістидиновий буфери. Були випробувані також різні концентрації цукрози і полоксамеру 188. Попередні композиції-кандидати були перевірені на чистоту (за допомогою SE-HPLC та RP-HPLC), вміст білка (за допомогою системи Віасоrе), біологічну активність (біологічний аналіз in vitro), залишкову вологість, рН та осмотичний тиск. 9 UA 113174 C2 5 10 15 20 25 30 35 40 45 50 55 Підтверджувальні дані щодо стабільності були також одержані за допомогою SDS-PAGE/SS (чистота) і пептидного картування/UPLC (окиснені форми). Приклад 2.2 (Дані щодо стабільності попередніх композицій; дані не наведені): Згадані дані щодо стабільності, зібрані для попередніх ліофілізованих композицій за допомогою SE-HPLC протягом 3-4 тижнів зберігання, вказують на те, що перевагу слід віддати фосфатному буферу при рН 7,2, оскільки спостерігався значно вищий рівень чистоти (тобто вищий відсоток мономерів) в порівнянні з гістидиновим буфером при рН 6 (дивись Таблицю 2). Кількість цукрози (15 мкг/вмістище проти 30 мкг/вмістище) також відіграє роль у стабілізації FGF-18 проти агрегації, де загалом більш високе відновлення мономерів спостерігалось при кількості цукрози на рівні 30 мкг/вмістище (зберігання при температурі 25 °C і 5 °C). Крім того, після стадії фільтрування (перед процесом ліофілізаціі) спостерігалось більш високе відновлення білка у разі підвищення вмісту поверхнево-активної речовини (тобто полоксамеру 188), з кращими результатами при 0,2 мг/вмістище (Фігура 1). Виходячи з результатів цієї фази дослідження попередніх композицій, для проведення подальших досліджень приготували шість ліофілізованих композицій (композиції 1-6 з Таблиці 1; на них також посилаються як на композиції-кандидати). Приклад 3: Дослідження стабільності ліофілізованих композицій на основі FGF-18 Дані щодо стабільності ліофілізованих композицій-кандидатів Таблиці 1 збирали впродовж періоду часу тривалістю від двох тижнів до 24 місяців. Приклад 3.1 (чистота за даними SE-HPLC): Результати визначеної із застосуванням програмного забезпечення Stabileo статистичної оцінки даних щодо стабільності, одержаних за допомогою SE-HPLC, підсумовані в Таблиці 3: у жодної з ліофілізованих композицій-кандидатів при зберіганні при різних температурах (до 6 місяців при температурі 40 °C і до 24 місяців при температурі 25 °C) не було виявлено значної втрати чистоти (вміст мономера). Приклад 3.2 (чистота за даними SDS-PAGE/SS): Результати, одержані за допомогою SDSPAGE, підтвердили рівні чистоти, загалом вищі ніж 99 %, для всіх ліофілізованих композицій при зберіганні при всіх досліджених температурах (щонайменше 6 місяців при температурі 40 °C і до 18 місяців при температурі 25 °C). Результати наведені в Таблиці 4. Приклад 3.3 (чистота за даними RP-HPLC): Результати визначеної із застосуванням програмного забезпечення Stabileo статистичної оцінки даних, одержаних за допомогою RPHPLC, підсумовані в Таблиці 5: у жодної з ліофілізованих композицій-кандидатів при зберіганні при різних температурах (до 6 місяців при температурі 40 °C і до 18 місяців при температурі 25 °C) не було виявлено значної втрати чистоти (відсоток головного піка). Таким чином, одержання композиції на основі FGF-18 за цим винаходом не призводить до будь-якої втрати чистоти в порівнянні з вихідним матеріалом (чистим) FGF-18. Слід зазначити, що згаданий вихідний матеріал (до одержання композиції) не був повністю чистим (домішки не були повністю відділені за допомогою RP-HPLC), пік перед одержанням композиції не знаходився на рівні 100 %, але, наприклад, він дорівнював 77,5 % у разі FD-30, і 87,4 % - у разі FD-300, а пік при Т=0, наприклад, дорівнював 76,8 % у разі FD-30, і 87,7 % - у разі FD-300. Приклад 3.4 (аналіз вмісту білка): Результати визначення концентрації білка, одержані за допомогою системи Віасоrе, підсумовані в Таблиці 6 і Таблиці 7. При фільтруванні через 0,22 мкм мембранний фільтр не було виявлено ніяких значних втрат, тобто спостерігалось майже повне відновлення білка (дивись стовпчик "AF" в Таблиці 6). При відновленні ліофілізованого продукту із використанням 1 мл води для ін'єкцій (дивись стовпчики "Т0" в Таблиці 6) одержали нижчий рівень відновлення, що може пояснюватись адсорбцією білка на скляній пробірці (після завершення відновлення розчин білка у подальшому потрапляє на більшу поверхню). З точки зору стабільності, за допомогою системи Віасоrе не було виявлено втрати вмісту білка для всіх концентрацій при всіх випробуваних температурах, як показано в Таблиці 7 (до 6 місяців при температурі 40 °C і до 24 місяців при температурі 25 °C). Приклад 3.5 (біологічна активність): Результати визначення біологічної активності (виражені в Од/контейнер) для всіх ліофілізованих композицій-кандидатів при зберіганні наведені в Таблиці 8. Наприклад, біологічна активність, визначена для більш високої концентрації (300 мкг/вмістище trFGF-18) при зберіганні як при температурі 25 °C, так і при температурі 40 °C, була стабільною з перебігом часу. Більша мінливість спостерігалась у разі нижчої концентрації FD-20. Оскільки ніяких змін в стабільності продукту жодним з інших аналізів виявлено не було, згадане зниження, яке спостерігалось у разі FD-20, має бути підтверджене після 39 тижнів, 52 тижнів, 78 тижнів і 104 тижнів зберігання при температурі 25 °C. Приклад 3.6 (окиснені форми): Рівень окиснених форм, виявлений при всіх концентраціях у процесі зберігання, підсумовано в Таблиці 9: результати показують, що з-посеред залишків Met, 10 UA 113174 C2 5 10 які могли б зазнати окиснення, більш сприйнятливим до окиснення є Met 1, при всіх концентраціях і при будь-якій з оцінюваних температур. Приклад 3.7 (залишкова вологість): При зберіганні з усіма концентраціями значного збільшення залишкової вологості не відбулось; впродовж дослідження стабільності рівні залишкової вологості загалом були нижчими за або дорівнювали приблизно 1 % (дивись Таблицю 10) (до 6 місяців при температурі 40 °C і до 24 місяців при температурі 25 °C). Приклад 3.8 (коливання рН): При зберіганні при будь-якій з випробуваних температур для усіх концентрацій значного коливання рН не спостерігалось (дивись Таблицю 11) (до 6 місяців при температурі 40 °C і до 24 місяців при температурі 25 °C). Приклад 3.9 (коливання осмоляльності): При зберіганні при будь-якій з випробуваних температур для усіх концентрацій значного коливання осмоляльності не спостерігалось (дивись Таблицю 12) (до 6 місяців при температурі 40 °C і до 24 місяців при температурі 25 °C). Таблиці 15 11 UA 113174 C2 5 12 UA 113174 C2 13 UA 113174 C2 14 UA 113174 C2 5 15 UA 113174 C2 5 10 ПОСИЛАННЯ 1. Ellsworth et al., 2002, Osteoarthritis and Cartilage, 10: 308-320 2. Shimoaka et al., 2002, JBC 277(9):7493-7500 3. WO2008/023063 4. WO2004/032849 5.WO00/21548 6.WO2008/121563 7. WO92/01442 8. WO01/39788 9.WO98/16644 10.WO2006/063362 11. Custers et al., 2007, Osteoarthritis and Cartilage, 15:1241-1248 ФОРМУЛА ВИНАХОДУ 15 20 25 30 35 40 45 1. Стабільна ліофілізована композиція, яка містить FGF-18, фосфатний буфер, який підтримує значення рН в діапазоні між 7,0 і 7,5, полоксамер 188 і цукрозу. 2. Стабільна ліофілізована композиція за п. 1, яка відрізняється тим, що фосфатний буфер підтримує значення рН на рівні 7,2 або приблизно 7,2. 3. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що концентрація буфера становить або приблизно становить від 5 мМ до 100 мМ. 4. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що концентрація полоксамеру 188 становить або приблизно становить від 0,1 мг/вмістище до 0,4 мг/вмістище. 5. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що концентрація цукрози становить або приблизно становить від 10 мг/вмістище до 60 мг/вмістище. 6. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що концентрація FGF-18 становить або приблизно становить від 20 мкг/вмістище до 300 мкг/вмістище. 7. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що композиція містить FGF-18 у кількості 20 мкг/вмістище, 30 мкг/вмістище, 60 мкг/вмістище, 100 мкг/вмістище, 200 мкг/вмістище або 300 мкг/вмістище, фосфатний буфер (10 мМ), який підтримує значення рН на рівні 7,2 або приблизно 7,2, цукрозу (30 мг/вмістище) і полоксамер 188 (0,2 мг/вмістище). 8. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що композиція додатково містить 5 % надлишок FGF-18. 9. Стабільна ліофілізована композиція за будь-яким із попередніх пунктів, яка відрізняється тим, що FGF-18 вибраний з групи, яку складають: а) поліпептид, який містить або складається з амінокислотні(их) залишки(ів) 28-207 послідовності SEQ ID NO:1, b) поліпептид, який містить або складається з амінокислотні(их) залишки(ів) 28-196 послідовності SEQ ID NO:1, і c) поліпептид, який містить або складається з послідовності SEQ ID NO:2. 10. Спосіб одержання стабільної ліофілізованої композиції за будь-яким із попередніх пунктів, який включає стадії: 16 UA 113174 C2 5 a) утворення суміші FGF-18 з фосфатним буфером, полоксамером 188 і цукрозою, і b) піддавання згаданої суміші ліофілізації. 11. Готовий виріб, який включає в себе перше вмістище, яке вміщує стабільну ліофілізовану композицію за будь-яким із пп. 1-9, і друге вмістище, яке вміщує розчинник для відновлення. 12. Готовий виріб за п. 11, який відрізняється тим, що вмістище, яке вміщує стабільну ліофілізовану композицію, і вмістище, яке вміщує розчинник для відновлення, є двома відсіками двокамерної системи. Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 17
ДивитисяДодаткова інформація
Назва патенту англійськоюFreeze-dried formulations of fgf-18
Автори англійськоюCerreti, Alessandra, Del Rio, Alessandra
Автори російськоюЧеррети Алессандра, Дель Рио Алессандра
МПК / Мітки
МПК: A61K 38/18
Мітки: стабільна, композиція, fgf-18, ліофілізована, основі
Код посилання
<a href="https://ua.patents.su/19-113174-stabilna-liofilizovana-kompoziciya-na-osnovi-fgf-18.html" target="_blank" rel="follow" title="База патентів України">Стабільна ліофілізована композиція на основі fgf-18</a>
Попередній патент: Система та спосіб розпізнавання контенту програми мовлення
Наступний патент: Комплекс установок газоочистки
Випадковий патент: Спосіб регулювання товщини штаби у попередньо напруженій кліті листового прокатного стана і пристрій для його реалізації