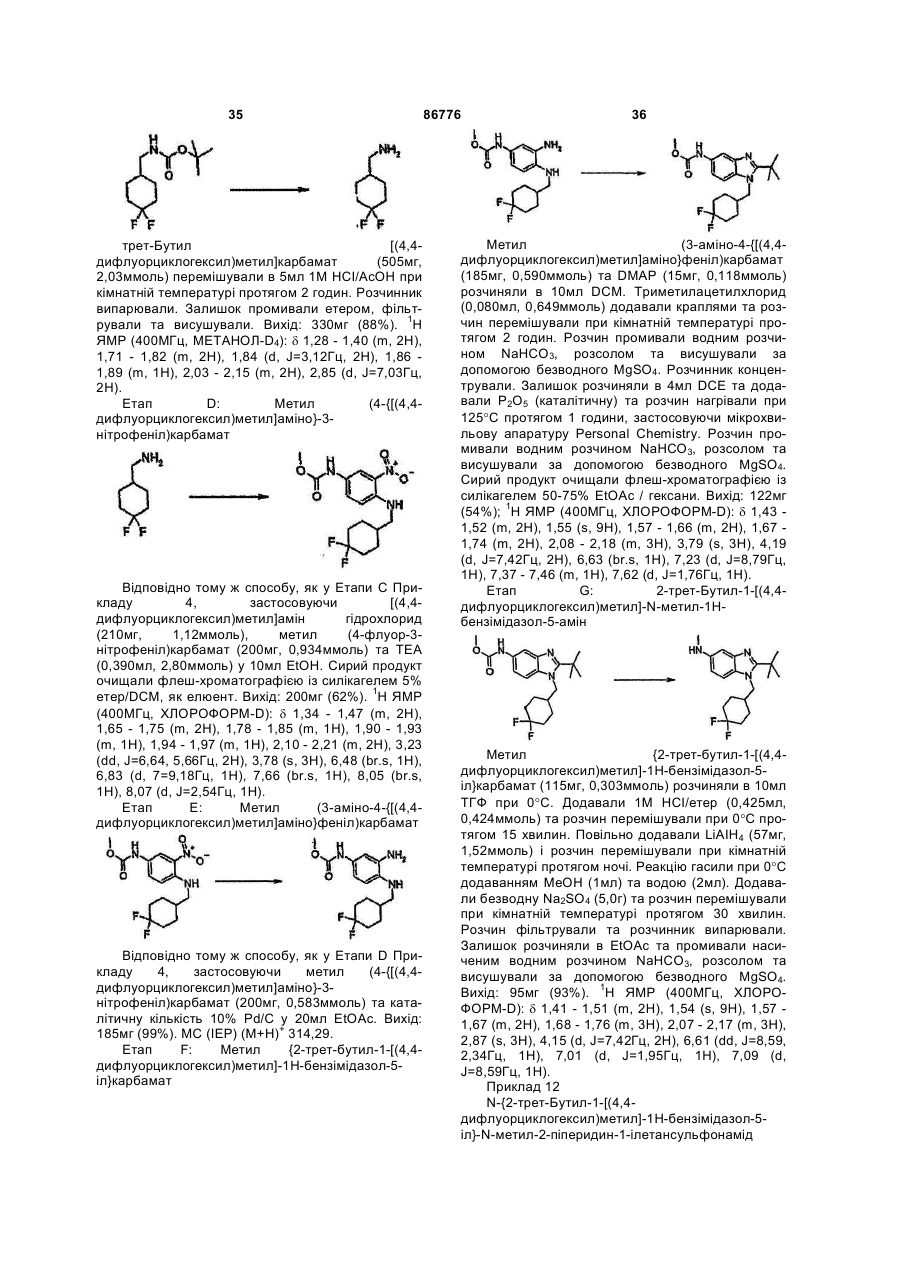
Похідні бензімідазолу, фармацевтична композиція, яка їх містить, спосіб їх отримання та застосування
Номер патенту: 86776
Опубліковано: 25.05.2009
Автори: Лю Зіпінґ, Янґ Хуа, Пеідж Деніел, Волпоул Крістофер
Формула / Реферат
1. Сполука формули І або її фармацевтично прийнятна сіль
 , I
, I
де
R1 вибрано із групи: С3-10циклоалкіл-С1-6алкіл, С3-6гетероцикліл-С1-6алкіл, що є необов'язково заміщеними одним або кількома атомами галогену;
R2 означає С1-10алкіл, необов'язково заміщений одною або кількома метиловими групами;
R3 вибрано із групи: С1-10алкіл, С2-10алкеніл, С3-6гетероциклоалкіл,
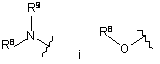 ,
,
де кожний з R8 та R9 є незалежно вибраним з -Н та С1-10алкілу, необов’язково заміщеного ОН;
R4 вибрано із групи: -Н, С1-10алкіл і С2-10алкеніл.
2 Сполука за п. 1, де
R1 вибрано із групи: С3-10циклоалкіл-С1-4алкіл, С3-6гетероцикліл-С1-4алкіл, що є необов'язково заміщеними одним або кількома атомами галогену,
R2 означає С1-6алкіл, необов'язково заміщений одною або кількома метильними групами;
R3 вибрано із групи: С1-6алкіл. С2-6алкеніл, С3-6гетероциклоалкіл,
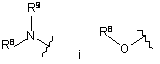 ,
,
де кожний з R8 та R9 є незалежно вибраним з -Н та С1-6алкілу, необов’язково заміщеного ОН;
R4 вибрано із групи: -Н та С1-3алкіл.
3. Сполука за п. 1, де
R1 вибрано із групи С3-10циклоалкіл-С1-4алкіл, С3-6гетероцикліл-С1-4алкіл, що є необов'язково заміщеними одним або кількома атомами галогену,
R2 означає С1-6алкіл, необов'язково заміщений одною або кількома метильними групами;
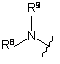 ,
,
R3 вибрано із групи: С2-6алкіл, С3-6гетероциклоалкіл, та
де кожний з R8 та R9 є незалежно вибраним з -Н та С1-6алкілу, необов'язково заміщеного ОН;
R4 вибрано із групи: -Н та С1-3алкіл.
4. Сполука за п. 1, де
R1 вибрано із групи: циклогексилметил, циклопентилметил, циклобутилметил, циклопропілметил, 4,4-дифлуорциклогексанметил, циклогексилетил, циклопентилетил, тетрагідропіранілметил, тетрагідрофуранілметил, 1-піперидинілетил та N-метил-2-піперидинілметил;
R2 вибрано із групи, т-бутил, н-бутил, 2-метил-2-бутил, ізопентил, 1-метилпропіл, 1,1-диметилпропіл, 1,1-диметил-3-бутен-1-іл, етил та 2-пропіл;
R3 - С2-5алкіл та R8R9N-, де R8 та R9 є незалежно вибраними з -Н та С1-3алкілу.
5. Сполука, яку вибрано із групи:
N-[2-трет-бутил-1-(циклогексилметил)-1Н-бензімідазол-5-іл]-N,N',N'-триметилсульфамід;
N-[2-тpeт-бyтил-1-(циклогексилметил)-1Н-бензімідазол-5-іл]-N',N'-діетил-N-метилсульфамід;
N-[1-(циклогексилметил)-2-(1,1-диметилпропіл)-1Н-бензімідазол-5-іл]-N,N-диметилсульфамід;
N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)-1Н-бензімідазол-5-іл]-N-метилбутан-1-сульфонамід;
N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)-1Н-бензімідазол-5-іл]-N-метил-2-піролідин-1-ілетансульфонамід;
N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)-1Н-бензімідазол-5-іл]-N-метил-2-морфолін-4-ілетансульфонамід;
N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)-1Н-бензімідазол-5-іл]-N-метил-2-піперидин-1-ілетансульфонамід;
N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)-1Н-бензімідазол-5-іл]-2-метокси-N-метилетансульфонамід;
N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)-1Н-бензімідазол-5-іл]-2-[(2-гідроксіетил)аміно]-N-метилетансульфонамід;
2-(2-аміноетокси)-N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)-1Н-бензімідазол-5-іл]-N-метилетансульфонамід;
N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)-1Н-бензімідазол-5-іл]-N-метилетиленсульфонамід;
N-{2-трет-бутил-1-[(4,4-дифлуорциклогексил)метил]-1Н-бензімідазол-5-1л}-N-метилбутан-1-сульфонамід;
N-{2-трет-бутил-1-[(4,4-дифлуорциклогексил)метил]-1Н-бензімідазол-5-іл}-N-метил-2-піперидин-1-ілетансульфонамід, та її фармацевтично прийнятні солі.
6. Сполука за будь-яким з пп. 1-5 для застосування як медикаменту.
7. Застосування сполуки за будь-яким з пп. 1-5 у виробництві медикаменту для лікування болю.
8. Застосування сполуки за будь-яким з пп. 1-5 у виробництві медикаменту для лікування розладів з компонентом тривоги.
9. Застосування сполуки за будь-яким з пп. 1-5 у виробництві медикаменту для лікування раку, розсіяного склерозу, хвороби Паркінсона, хореї Хантингтона, хвороби Альцгеймера, шлунково-кишкових розладів та серцево-судинних розладів.
10. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-5 та фармацевтично прийнятний носій.
11. Спосіб лікування болю у теплокровної тварини, в якому вводять зазначеній тварини, що потребує такого лікування, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-5.
12. Спосіб отримання сполуки формули І
 , І
, І
в якому здійснюють реакцію сполуки формули ІІ
 ІІ
ІІ
зі сполукою R2C(=O)X у присутності основи та, як варіант, реагенту сполучення і подальшу обробку кислотою;
де
X вибрано з Сl, Br, F та ОН;
R1 вибрано із групи: С3-10циклоалкіл-С1-6алкіл, С3-6гетероцикліл-С1-6алкіл, що є необов'язково заміщеними одним або кількома атомами галогену;
R2 означає С1-10алкіл, необов'язково заміщений одною або кількома метильними групами;
R3 вибрано із групи: С1-10алкіл, С2-10алкеніл, С3-6гетероциклоалкіл,
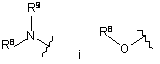 ,
,
де кожний з R8 та R9 є незалежно вибраним з -Н та С1-10алкілу, необов’язково заміщеного ОН;
R4 вибрано із групи: -Н, С1-10алкіл і С2-10алкеніл.
Текст
1. Сполука формули І або її фармацевтично прийнятна сіль 2 3 86776 4 N-[2-тpeт-бyтил-1-(циклогексилметил)-1Н10. Фармацевтична композиція, яка містить сполубензімідазол-5-іл]-N',N'-діетил-N-метилсульфамід; ку за будь-яким з пп. 1-5 та фармацевтично приN-[1-(циклогексилметил)-2-(1,1-диметилпропіл)йнятний носій. 1Н-бензімідазол-5-іл]-N,N-диметилсульфамід; 11. Спосіб лікування болю у теплокровної тварини, N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)в якому вводять зазначеній тварини, що потребує 1Н-бензімідазол-5-іл]-N-метилбутан-1такого лікування, терапевтично ефективну кільсульфонамід; кість сполуки за будь-яким з пп. 1-5. N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)12. Спосіб отримання сполуки формули І 1Н-бензімідазол-5-іл]-N-метил-2-піролідин-1R4 ілетансульфонамід; O N N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)N R3 S 1Н-бензімідазол-5-іл]-N-метил-2-морфолін-4R2 ілетансульфонамід; O N N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)1Н-бензімідазол-5-іл]-N-метил-2-піперидин-1R1 ,І ілетансульфонамід; в якому здійснюють реакцію сполуки формули ІІ N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)R4 1Н-бензімідазол-5-іл]-2-метокси-NO метилетансульфонамід; N N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)NH2 R3 S 1Н-бензімідазол-5-іл]-2-[(2-гідроксіетил)аміно]-NH O метилетансульфонамід; N 2-(2-аміноетокси)-N-[2-трет-бутил-1-(тетрагідро2Н-піран-4-ілметил)-1Н-бензімідазол-5-іл]-NR1 ІІ метилетансульфонамід; зі сполукою R2C(=O)X у присутності основи та, як N-[2-трет-бутил-1-(тетрагідро-2Н-піран-4-ілметил)варіант, реагенту сполучення і подальшу обробку 1Н-бензімідазол-5-іл]-N-метилетиленсульфонамід; кислотою; N-{2-трет-бутил-1-[(4,4де дифлуорциклогексил)метил]-1Н-бензімідазол-5X вибрано з Сl, Br, F та ОН; 1л}-N-метилбутан-1-сульфонамід; R1 вибрано із групи: С3-10циклоалкіл-С1-6алкіл, С3N-{2-трет-бутил-1-[(4,46гетероцикліл-С1-6алкіл, що є необов'язково замідифлуорциклогексил)метил]-1Н-бензімідазол-5щеними одним або кількома атомами галогену; іл}-N-метил-2-піперидин-1-ілетансульфонамід, та її R2 означає С1-10алкіл, необов'язково заміщений фармацевтично прийнятні солі. одною або кількома метильними групами; 6. Сполука за будь-яким з пп. 1-5 для застосуванR3 вибрано із групи: С1-10алкіл, С2-10алкеніл, С3ня як медикаменту. 6гетероциклоалкіл, 7. Застосування сполуки за будь-яким з пп. 1-5 у R9 виробництві медикаменту для лікування болю. 8. Застосування сполуки за будь-яким з пп. 1-5 у R8 N виробництві медикаменту для лікування розладів з R8 O компонентом тривоги. і , 9. Застосування сполуки за будь-яким з пп. 1-5 у 8 9 де кожний з R та R є незалежно вибраним з -Н та виробництві медикаменту для лікування раку, розС1-10алкілу, необов’язково заміщеного ОН; сіяного склерозу, хвороби Паркінсона, хореї ХанR4 вибрано із групи: -Н, С1-10алкіл і С2-10алкеніл. тингтона, хвороби Альцгеймера, шлунковокишкових розладів та серцево-судинних розладів. Винахід стосується терапевтичних сполук, фармацевтичних композицій, які містять ці сполуки, способів їх виготовлення та застосування. Конкретно, заявлений винахід стосується сполук, які можуть бути ефективними у лікуванні болю, раку, розсіяного склерозу, хвороби Паркінсона, хореї Хантингтона, хвороби Альцгеймера, розладів з компонентом тривоги, шлунково-кишкових розладів та/або серцево-судинних розладів. Терапія болю є важливою галуззю дослідження багато років. Добре відомо, що ліганди канабіноїдного рецептору (наприклад, рецептору СВ1, рецептору СВ2), що охоплюють агоністи, антагоністи та інверсні агоністи, полегшують біль в різноманітних моделях тварин взаємодією з рецепторами СВ1 та/або СВ2. Звичайно, рецептори СВ1 локалізовано, переважно, у центральній нервовій системі, тоді як рецептори СВ2 локалізовано в основному на периферії, а в основному обмежено клітинами та тканинами, похідними від імунної системи. Тоді як агоністи рецептору СВ1, як-то D9 - тетрагідроканабінол ( D9 -ТГК) та анадамід, є корисними у моделях анти-ноцицепції у тварин, вони мають тенденцію викликати небажану побічну дію на центральну нервову систему, наприклад, психотропну побічну дію, можливе зловживання ліками, залежність та толерантність до ліків, тощо. Відомо, що ці небажані побічні дії опосередковано рецепторами CB1, локалізованими у центральній нервовій системі. Однак, існує ряд свідчень, які 5 86776 6 наводять на думку, що агоністи CB1, які діють на ного вуглеводневого радикалу, який містить кільпериферійних ділянках або з обмеженим впливом це, і має принаймні один подвійний зв'язок карбонна центральну нервову систему, можуть утихомикарбон та містить принаймні 3-12 атомів карбону. рювати біль у людей або тварин зі значно поліп"Циклоалкеніл" охоплює моноциклічні та багатоцишеним повним профілем in vivo. Тому потрібні нові клічні структури вуглеводню. Структура багатоліганди рецептору CB1, як-то агоністи, які можуть циклічного вуглеводню охоплює неконденсовані, бути корисними в утихомиренні болю або лікуванні конденсовані та місткові кільця. інших пов'язаних з ним симптомів або хвороб, зі Термін "циклоалкініл", застосований окремо зниженою або мінімальною небажаною побічною або як суфікс чи префікс, стосується моновалентдією на центральну нервову систему. ного вуглеводневого радикалу, який містить кільЗгідно з заявленим винаходом запропоновано це, і має принаймні один потрійний зв'язок карбонліганди рецептору CB1, котрі можуть бути корискарбон та містить 7-12 атомів карбону. ними у лікуванні болю та/або інших, пов'язаних із Термін "арил", застосований окремо або як болем симптомів або хвороб. суфікс чи префікс, стосується вуглеводневого раЯкщо не сказано інше, номенклатура, застосодикалу, який має одне або більше ненасичених вана в цьому описі, звичайно, відповідає приклаполікарбонових кілець, що мають ароматичний дам та правилам, наведеним у Nomenclature of характер, (наприклад, 4n+2 делокалізованих елекOrganic Chemistry, Sections A, B, C, D, E, F, та Н, тронів) та містять 5-14 атомів карбону, де радикал Pergamon Press, Oxford, 1979, котрі тут охоплено локалізовано на карбоні ароматичного кільця. посиланнями стосовно назв типових хімічних струТермін "неароматична група" або "неароматиктур та правил їх найменування. чна", застосований окремо, як суфікс або як пре"Рецептори СВ1/СВ2" означають рецептори фікс, стосується хімічної групи, або радикалу, які СВ1 та/або СВ2. не містять кільця, яке має ароматичний характер Термін "Cm-n" або " Cm-n - група " застосований (наприклад, 4п + 2 делокалізованих електронів). окремо або як префікс, стосується будь-якої групи, Термін "арилен", застосований окремо або як що має від m до n атомів карбону. суфікс чи префікс, стосується двовалентного вугТермін "вуглеводень", застосований окремо леводневого радикалу, що має одне або більше або як суфікс чи префікс, стосується будь-якої поліненасичених карбонових кілець, які мають структури, що містить тільки атоми карбону та гідароматичний характер, (наприклад, 4n+2 делокарогену аж до 14 атомів карбону. Термін "вуглеводлізованих електронів) та містять 5-14 атомів карневий радикал" або "гідрокарбіл", застосований бону, котрі зв'язують дві структури разом. окремо або як суфікс чи префікс, стосується будьТермін "гетероцикл", застосований окремо або якої структури яка утворюється від видалення одяк суфікс чи префікс, стосується кільцевої структуного або більше гідрогенів від вуглеводню. ри, або молекули, яка має один, або більше багаТермін "алкіл", застосований окремо або як товалентних гетероатомів, незалежно вибраних з суфікс чи префікс, стосується моновалентних N, О, Р та S, як частки кільцевої структури та охопрямих або розгалужених ланцюжків вуглеводних плюють принаймні 3-20 атомів у кільці(ях). Гетерорадикалів, що містять 1-12 атомів карбону. Якщо цикл може бути насиченим або ненасиченим, охоне сказано інше, "алкіл" звичайно, охоплює як наплюючи один або більше подвійних зв'язків, та сичений алкіл, так і ненасичений алкіл. гетероцикл може містити більше ніж одне кільце. Термін "алкілен", застосований окремо або як Коли гетероцикл містить більше одного кільця, суфікс чи префікс, стосується двовалентних прявони можуть бути конденсовані або неконденсомих або розгалужених вуглеводневих радикалів, вані. Конденсовані кільця, звичайно, стосуються що містять 1-12 атомів карбону, котрі придатні для принаймні двох кілець із двома спільними атомазв'язування двох структур разом. ми. Гетероцикл може мати або не мати ароматичТермін "алкеніл", застосований окремо або як ного характеру. суфікс чи префікс, стосується моновалентного Термін "гетероалкіл", застосований окремо прямого, або розгалуженого ланцюжку вуглеводабо як суфікс чи префікс, стосується радикалу, невого радикалу, який має принаймні один подвійутвореного в результаті заміщення одного, або ний зв'язок карбон-карбон та містить принаймні 2більше атомів карбону алкілу одним, або більше 12 атомів карбону. гетероатомами, вибраними з N, О, Р та S. Термін "алкініл", застосований окремо або як Термін "гетероароматична", застосований суфікс чи префікс, стосується моно-валентного окремо або як суфікс чи префікс, стосується кільпрямого, або розгалуженого ланцюжку вуглеводцевої структури, або молекули, яка має один, або невого радикалу, який має принаймні один потрійбільше багатовалентних гетероатомів, незалежно ний зв'язок карбон-карбон та містить принаймні 2вибраних з N, О, Р та S, як частки кільцевої струк12 атомів карбону. Термін "циклоалкіл, ", застосотури та охоплює принаймні 3-20 атомів у кільці(ях), ваний окремо або як суфікс чи префікс, стосується де кільцева структура або молекула має ароматимоновалентного вуглеводневого радикалу, який чний характер (наприклад, 4n+2 делокалізованих містить кільце, і має принаймні 3-12 атомів карбоелектронів). ну. "Циклоалкіл" охоплює як моноциклічні, так і Термін "гетероциклічна група," "гетероциклічна багатоциклічні вуглеводеневі структури. Багатоцичастинка," "гетероциклічна," або "гетероцикло", клічна структура вуглеводню охоплює некондензастосований окремо або як суфікс чи префікс, совані, конденсовані та місткові кільця. стосується радикальної похідної гетероциклу, Термін "циклоалкеніл", застосований окремо отриманої видаленням звідти одного, або більше або як суфікс чи префікс, стосується моновалентгідрогенів. 7 86776 8 Термін "гетероцикліл", застосований окремо сил, хлор, та аміно можуть заміщувати будь-який або як суфікс чи префікс, стосується радикалу, придатний гідроген на кільце фенілу. утвореного з гетероциклу видаленням принаймні Термін "заміщений", застосований як суфікс одного гідрогену від карбонового кільця гетероципершої структури, молекули або групи, супровоклу. джуваний одною або більше назвами хімічних Термін "гетероциклілен", застосований окремо груп, стосується другої структури, молекули або або як суфікс чи префікс, стосується двовалентногрупи, котра є результатом заміщення одного або го радикалу, що зв'язує дві структури разом, утвобільше гідрогенів першої структури, молекули або реного з гетероциклу видаленням звідти двох гідгрупи одною або більше названими хімічними грурогенів. пами, наприклад, "феніл, заміщений нітро" стосуТермін "гетероарил", застосований окремо або ється нітрофенілу. як суфікс чи префікс, стосується гетероциклілу, Термін "як варіант заміщений" стосується обох який має ароматичний характер, де радикал гетегруп, структур, або молекул, які заміщено, та тароциклілу локалізовано на карбоні ароматичного ких, що не заміщено. кільця гетероциклілу. Гетероарил тут може містити Гетероцикл охоплює, наприклад, моноциклічні ароматичні та неароматичні кільця. Ці кільця могетероцикли як-то: азиридин, окси-ран, тііран, азежуть бути конденсованими або інакше пов'язані тидин, оксетан, тіетан, піролідин, піролін, імідазоразом. лідин, піразолідин, піра-золін, діоксолан, сульфоТермін "гетероциклоалкіл", застосований лан 2, 3-дигідрофуран, 2, 5-дигідрофуран окремо або як суфікс чи префікс, стосується гетететрагідрофуран, тіофан, піперидин, 1, 2, 3, 6роциклілу, що не має ароматичного характеру. тетрагідропіридин, піперазин, морфолін, тіоморТермін "гетероарилен", застосований окремо фолін, піран, тіопіран, 2, 3-дигідропіран, тетрагідабо як суфікс чи префікс, стосується гетероцикліропіран, 1, 4-дигідропіридин, 1, 4-діоксан, 1, 3лену, який має ароматичний характер. Термін "гедіоксан, діоксан, гомопіперидин, 2, 3, 4, 7тероциклоалкілен", застосований окремо або як тетрагідро-1Н-азепін гомопіперазин, 1, 3суфікс чи префікс, стосується гетероциклілену, що діоксепан, 4, 7-дигідро-1, 3-діоксепін та гексаметине має ароматичного характеру. леноксид. Термін "шестичленний", застосований як преОкрім того, гетероцикл охоплює ароматичні фікс, стосується групи, яка має кільце, яке містить гетероцикли, наприклад, піридин, пі-разин, піримішість атомів. дин, піридазин, тіоазин, фуран, фуразан, пірол, Термін "п'ятичленний", застосований як преімдазол, тіазол, оксазол, піразол, ізотіазол, ізоксафікс, стосується групи, яка має кільце яке містить зол, 1, 2, 3-триазол, тетразол, 1, 2, 3-тіадіазол, 1, п'ять атомів. 2, 3-оксадіазол, 1, 2, 4-триазол, 1, 2, 4-тіадіазол, 1, П'ятичленний кільцевий гетероарил є гетеро2, 4-оксадіазол, 1, 3, 4-триазол, 1,3,4-тіадіазол, та арилом із кільцем, яке має п'ять атомів, де 1, 2 або 1, 3, 4- оксадіазол. 3 атоми кільця незалежно вибрано з N, О та S. Додатково, гетероцикл охоплює поліциклічні Зразками п'ятичленних кільцевих гетероарилів гетероцикли, наприклад, індол, індо-лін, ізоіндолін, є тієніл, фурил, піроліл, імідазоліл, тіазоліл, оксахінолін, тетрагідрохінолін, ізохінолін, тетрагідроізоліл, піразоліл, ізотіазоліл, ізоксазоліл, 1, 2, 3зохінолін, 1, 4-бензодіоксан, кумарин, дигідрокутриазоліл, тетразоліл, 1, 2, 3-тіадіазоліл, 1, 2, 3марин, бензофуран, 2, 3-дигідробензофуран, ізооксадіазоліл, 1, 2, 4-триазоліл, 1, 2, 4-тіадіазоліл, бен-зофуран, хромен, хроман, ізохроман, ксантен, 1, 2, 4-оксадіазоліл, 1, 3, 4-триазоліл, 1, 3, 4феноксантіїн, тіантрен, індолізин, ізоін-дол, індатіадіазоліл, та 1, 3, 4-оксадіазоліл. зол, пурин, фталазин, нафтиридин, хіноксалін, Шестичленний кільцевий гетероарил є гетерохіназолін, цинолін, птеридин, фенантридин, периарилом із кільцем, яке має шість атомів, де 1, 2 мідин, фенантролін, феназин, фенотіазин, феноабо 3 атоми кільця незалежно вибрано з N, О та S. хазин, 1, 2-бензізоксазол, бензотіоазин, бензоксаЗразками шестичленних кільцевих гетероаризол, бензтіазол, бензімідазол, бензтриазол, тіолів є піридил, піразиніл, піримідиніл, триазиніл та ксантин, карбазол, карболін, акридин, піролізидин, піридазиніл. та хінолізидин. Термін "заміщений", застосований як префікс, На додаток до поліциклічних гетероциклів, стосується структури, молекули або групи, де описаних вище, гетероцикл охоплює поліциклічні один, або більше гідрогенів заміщено одним, або гетероцикли, де конденсація двох або більше кібільше С1-12-вуглеводневих груп, або одна або лець охоплює більше одного зв'язку, спільного для більше хімічних груп, які складаються з одного, двох кілець, та більше двох атомів, спільних для або більше гетероатомів, вибрано з N, О, S, F, СІ, двох кілець. Приклади місткових гетероциклів охоВг, І, та Р. Зразки хімічних груп, які складаються з плюють хінуклідин, діазабіцикло[2, 2, 1]гептан та 7одного або більше гетероатомів, охоплюють гетеоксабіцикло[2, 2,1]гептан. роцикліл, -NO2, -OR, -СІ, -Br, -I, -F, -CF3, -C(=O)R, Гетероцикліл охоплює, наприклад, моноцикліC(=O)OH, -NH2, -SH, -NHR, -NR2; -SR, -SO3H, чні гетероцикліли, як-то: азиридиніл, оксираніл, SO2R, -S(=O)R, - CN, -OH, -C(=O)OR, -C(=O)NR2, тіїраніл, азетидиніл, оксетаніл, тіетаніл, піролідиNRC(=O)R, оксо (=0), іміно (=NR), тіо (=S), та оксініл, піролініл, імідазолідиніл, піразолідиніл, піразоміно (=N-OR), де кожний "R" – С1-12гідрокарбіл. лініл, діоксоланіл, сульфоланіл, 2, 3Наприклад, заміщениий феніл може означати нітдигідрофураніл, 2, 5-дигідрофураніл, тетрагідророфеніл, піридилфеніл, метоксифеніл, хлорфеніл, фураніл, тіофаніл, піперидиніл, 1, 2, 3, 6амінофеніл, тощо, де групи нітро, піридил, метоктетрагідро-піридиніл, піперазиніл, морфолініл, тіоморфолініл, піраніл, тіопіраніл, 2, 3 9 86776 10 дигідропіраніл, тетрагідропіраніл, 1, 4Перша кільцева група, "конденсована" із друдигідропіридиніл, 1, 4-діоксаніл, 1, 3-діоксаніл, діогою кільцевою групою означає, що перше кільце та ксаніл, гомопіперидиніл, 2, 3, 4, 7-тетрагідро-1Ндруге кільце мають принаймні два спільних атома азепініл, гомопіперазиніл, 1, 3-діоксепаніл, 4, 7між ними. дигідро-1, 3-діоксепініл, та гексаметиленоксидил. "Зв'язок," "зв'язаний," або "зв'язуючий," якщо Окрім того, гетероцикліл охоплює ароматичні не сказано інше, означає ковалентно зв'язаний. гетероцикліли або гетероарил, наприклад, піридиКоли перша група, структура, або атом є "безніл, піразиніл, піримідиніл, піридазиніл, тієніл, фупосередно поєднаними" до другої групи, структури рил, фуразаніл, піроліл, імідазоліл, тіазоліл, оксаабо атома принаймні один атом першої групи, золіл, піразоліл, ізотіазоліл, ізоксазоліл, 1, 2, 3структури або атома утворюють хімічний зв'язок з триазоліл, тетразоліл, 1, 2, 3-тіадіазоліл, 1, 2, 3принаймні одним атомом другої групи, структури оксадіазоліл, 1, 2, 4-триазоліл, 1, 2, 4-тіадіазоліл, або атома. 1, 2, 4-оксадіазоліл, 1, 3, 4-триазоліл, 1, 3, 4"Насичений карбон" означає атом карбону у тіадіазоліл, та 1, 3, 4 оксадіазоліл. структурі, молекулі або групі, де всі зв'язки цього Додатково, гетероцикліл охоплює поліциклічні атома карбону є простими зв'язками. Інакше кажугетероцикліли (що охоплюють ароматичні або нечи, відсутній подвійний або потрійний зв'язки в ароматичні), наприклад, індоліл, індолініл, ізоіндоатому карбону, а цей атом карбону, звичайно, має лініл, хінолініл, тетрагі-дрохінолініл, ізохінолініл, sp3-гібридизацію атомних орбіталей. тетрагідроізохінолініл, 1, 4- бензодіоксаніл, кума"Ненасичений карбон" означає атом карбону риніл, дигідрокумариніл, бензофураніл, 2, 3структури, молекули або групи, де принаймні один дигідробензофураніл, ізобензофураніл, хроменіл, зв'язок атому карбону не є простим зв'язком. Інакхроманіл, ізохроманіл, ксантеніл, феноксантіїніл, ше кажучи, є принаймні один подвійний або потіантреніл, індолізиніл, ізоіндоліл, індазоліл, пуритрійний зв'язок атому карбону та цей атом карбоніл, фталазиніл, нафтиридиніл, хіноксалініл, хінану, звичайно, має sp або sр2-гібридизацію атомних золініл, цінолініл, птеридиніл, фенантридиніл, пеорбіталей. римідиніл, фенантролініл, феназиніл, В одному аспекті втілення винаходу запропофенотіазиніл, феноксазиніл, 1, 2-бензізоксазоліл, новано сполуку формули I, її фармацевтично прибензотіофеніл, бензоксазоліл, бензтіазоліл, бензійнятні солі, діастереоізомери, енантіомери або їх мідазоліл, бензтриазоліл, тіоксантиніл, карбазоліл, суміші: карболініл, акридиніл, піролізидиніл, та хінолізидиніл. На додаток до поліциклічних гетероциклілів, описаних вище, гетероцикліл охоплює поліциклічні гетероцикліли, де конденсація двох або більше кілець охоплює більше одного зв'язку, спільного для двох кілець, та більше двох атомів, спільних для двох кілець. Приклади таких місткових гетероциклілів охоплюють хінуклідиніл, діазабіцикло[2, 2, 1]гептил; та 7-оксабіцикло[2, 2, 1]гептил. Термін "алкокси", застосований окремо або як де суфікс або префікс, стосується радикалів загальR1 вибрано із групи: С1-10алкіл, С2-10алкеніл, С2ної формули -O-R, де -R вибрано із а вуглеводнеR5R6N-C1-6aлкiл, R5OC1-6алкіл, 10алкініл, 5 6 5 6 вого радикалу. Зразок алкоксил охоплює метокR C(=O)N(-R )-C1-6aлкiл, R R NS(=O)2-C1-6aлкiл, сил, етоксил, пропоксил, ізопропоксил, бутоксил, тR5CS{=O)2N(-R6)-C1-6aлкiл, R5R6NC(=O)N(-R7)-C1бутоксил, ізобутоксил, циклопропілметоксил, алі5 6 7 6aлкiл, R R NS(=O)2N(R )- C1-6aлкiл, C6-10арил-C1локсил, та пропаргілоксил. 6aлкiл, C6-10арил-С(=О)-C1-6aлкiл, C3-10циклоалкілТермін "арилокси", застосований окремо або C1-6aлкiл, C4-8циклоалкенілC1-6aлкiл, C3як суфікс чи префікс, стосується радикалів загальC3-6гетероцикліл-С(=О)6гетероцикліл-C1-6aлкiл, ної формули -О-Аr, де -Аr - арил. C1-6aлкiл, C1-10гідрокарбіламіно, R5R6N-, R5O-, Термін "гетероарилокси", застосований окреR5C(=O)N(-R6)-, R5R6NS(=O)2-, R5CS(=O)2N(-R6)-, мо або як суфікс чи префікс, стосується радикалів R5R6NC(=O)N(-R7)-, R5R6NS(=O)2N(R7)-, C6-10арил, загальної формули -0-Аr', де -Аr' - гетероарил. C6-10арил-С(=О)-, C3-10циклоалкіл, C4Термін "амін" або "аміно", застосований окреC3-6гетероцикліл та C38циклоалкеніл, мо або як суфікс чи префікс, стосується радикалів 6гетероцикліл-С(=0)-; де названі C1-10алкіл, C2загальної формули -NRR', де R та R' незалежно C2-10алкеніл, C6-10арил-C1-6алкіл, C610алкеніл, вибрано з гідрогену або вуглеводневого радикалу. 10арил-С(=О)- C1-6алкіл, C3-10циклоалкіл- C1-6алкіл, "Ацил", застосований окремо, як префікс або C4-8циклоалкеніл- C1-6алкіл, C3-6гетероцикліл-C1суфікс, означає -C(=O)-R, де -R -, як варіант, заміC3-6гетероцикліл-С(=О)- C1-6алкіл, C16алкіл, щений гідрокарбіл, гідроген, аміно або алкоксил. 10гідрокарбіламіно, C6-10арил, C6-10арил-С(=О)-, C3Ацилу охоплює, наприклад, ацетил, пропіоніл, 10циклоалкіл, С4-8циклоалкеніл, C3-6гетероцикліл бензоїл, фенілацетил, карбоетоксил, та диметилабо C3-6гетероцикліл-С(=О)-, застосовані у визнакарбамоїл. ченні R1, як варіант, є заміщеними одним або біГалоген охоплює флуор, хлор, бром та йод. льше замісниками, вибраними із групи: галоген, "Галогенований," застосований як префікс груціано, нітро, метоксил, етоксил, метил, етил, гідропи, означає, що один або більше гі-дрогенів на ксил та -NR5R6; групу є заміщеними одним або більше галогенами. 11 86776 12 R2 вибрано із групи: C1-10алкіл, C2-10алкеніл, C2C3-6гетероциклоалкіл-C16циклоалкеніл-C1-4алкіл, 5 6 C3-10циклоалкіл, C3-10циклоалкіл-C110алкініл, 4алкіл, C4-6циклоалкеніл, C3-5гетероарил, R R N- та C4-8циклоалкеніл-C1-6алкіл, C3феніл, де названі C1-6алкіл, C2-6алкеніл, C36алкіл, C4-8циклоалкеніл, C3-6циклоалкіл-C1-4алкіл, C46гетероциклоалкіл-C1-6алкіл, 6циклоалкіл, R5R6N-, С3-5гетероарил, С6-10арил та С36циклоалкеніл-C1-4алкіл, C3-6гетероцикліл-C1-4алкіл, де названі С1-10алкіл, С2C4-6циклоалкеніл, C3-5гетероарил, R5R6N- та феніл, 6гетероциклоалкіл, С2-10алкініл, С3-8циклоалкіл, С3застосовані у визначенні R2 є, як варіант, заміще10алкеніл, ними одним або більше замісниками, вибраними із 8циклоалкіл- С1-6алкіл, С4-8циклоалкеніл-С1-6алкіл, С3-6гетероциклоалкіл-С1-6алкіл, С4-8циклоалкеніл, групи: галоген, ціано, нітро, метоксил, етоксил, С3-5гетероарил, С6-10арил або С3метил, етил, гідроксил та -NR5R6 2 R3 вибрано із групи: -Н, C1-6алкіл, C2-6алкеніл, 6гетероциклоалкіл, застосовані у визначенні R , як варіант, є заміщеними одним або більше замісниC3-6циклоалкіл, C3ками, вибраними із групи: галоген, ціано, нітро, метоксил, етоксил, метил, етил, гідроксил тaNR5R6; де R5, R6 та R7 є незалежно вибраними з -Н, що як 6гетероциклоалкіл, С1-6алкілу, С2-6алкенілу, С2-6алкінілу та двовалентваріант, заміщено одним або більше замісної С1-6-групи, яка разом з іншими двовалентними никами, вибраними із C1-6алкілу та галогену; R5, R6 або R7 формує частину кільця; кожна з R8 та R9 є незалежно вибраною із груR3 вибрано із групи: -Н, С1-10алкіл, С2-10алкеніл, пи: -Н, C1-6алкіл, C2-6алкеніл, C3-6циклоалкіл, C3С2-10алкініл, С3-10циклоалкіл, С3-10циклоалкіл-С1C3-6гетероцикліл та C36циклоалкіл-C1-6алкіл, алкіл, С4-8циклоалкеніл-С1-6алкіл, С36 6гетероцикліл-C1-6алкіл, де названі C1-6алкіл, C26гетероциклоалкіл, 6алкеніл, C3-6циклоалкіл, C3-6циклоалкіл-C1-6алкіл, C3-6гетероцикліл, C3-6гетероцикліл-C1-6алкіл та двовалентна C1-6-група, яка разом з іншою двовалентною групою, вибраною із R8 та R9, формує частину кільця, де названі C1-6алкіл, C2-6алкеніл, C3-6циклоалкіл, C3-6циклоалкіл-C1-6алкіл, C3що, як варіант, заміщено одним або більше 6гетероцикліл та C3-6гетероцикліл-C1-6алкіл, або замісниками, вибраними із групи: C1-6алкіл, галодвовалентна C1-6-група є, як варіант, заміщеними ген, аміно та C1-6алкокси; одним або більше замісниками, вибраними із грукожний з R8 та R9 є незалежно вибраним із пи: галоген, ціано, нітро, метоксил, етоксил, метил, групи: -Н, C1-10алкіл, C2-10алкеніл, C3-10алкініл, C3етил, гідроксил та -NR5R6; та C3-10циклоалкіл-C1-6алкіл, C310циклоалкіл, R4, R5 та R6 є незалежно вибраними з -Н та C1C6-10арил, C3-6гетероцикліл-C16гетероцикліл, 3алкілу. 6алкіл, C6-10арил-C1-6алкіл та двовалентна C1-6Згідно з ще одним втіленням винаходу запрогрупа, яка разом з іншими двовалентними група8 9 поновано сполуки формули I, де R1 вибрано із груми, вибраними з R та R , формує частину кільця, пи: C1-6алкіл, C2-6алкеніл, феніл-C1-4алкіл, C3де названі C1-10алкіл, C2-10алкеніл, C2-10алкініл, C310циклоалкіл-C1-4алкіл, C4-6циклоалкеніл-C1-4алкіл, C3-10циклоалкіл C1-6алкіл, 10циклоалкіл, C3-6гетероциклоалкіл-C1-4алкіл, C6-10арил, C3C3-6гетероцикліл, C6-10арил, C3-6гетероцикліл-C110циклоалкіл та C4-6циклоалкеніл, де названі C16алкіл, C6-10арил-C1-6алкіл, або двовалентна C1-6C2-6алкеніл, феніл-C1-4алкіл, C36алкіл, група є, як варіант, заміщеними одним або більше 10циклоалкіл-C1-4алкіл, C4-6циклоалкеніл-C1-4алкіл, замісниками, вибраними із групи: галоген, ціано, C3-6гетероциклоалкіл-C1-4алкіл, C6-10арил, C3нітро, метоксил, етоксил, метил, етил, гідроксил та 10циклоалкіл та C4-6циклоалкеніл застосовані у -NR5R6; та визначенні R1 є, як варіант, заміщеними одним або R4 вибрано із групи: -Н, C1-10алкіл, C2-10алкеніл, більше замісниками, вибраними із групи: галоген, C2-10алкіл, C3-10циклоалкіл, C3-10циклоалкіл-C1метоксил, етоксил, метил, етил, гідроксил та 6алкіл, та C4-8циклоалкеніл-C1-6алкіл. NR5R6; Згідно з іншим втіленням винаходу запропоноR2 вибрано із групи: C1-6алкіл, C2-6алкеніл, C3вано сполуки формули I, де 1 циклоалкіл та C3-6циклоалкіл-C1-4алкіл, де названі 6 R вибрано із групи: C1-6алкіл, C2-6алкеніл, C2C1-6алкіл, C2-6алкеніл, C3-6циклоалкіл та C36алкініл, феніл-C1-4алкіл, C3-10циклоалкіл-C1-4алкіл, 2 6циклоалкіл-C1-4алкіл, застосовані у визначенні R C4-6циклоалкеніл-C1-4алкіл, C3-6гетероцикліл-C1є, як варіант, заміщеними одним або більше замі4алкіл, C6-10арил, C3-10циклоалкіл, C3-6гетероцикліл сниками, вибраними із групи: галоген, метоксил, та C4-6циклоалкеніл, де названі C1-6алкіл, C2етоксил, метил, етил, гідроксил та -NR5R6; C2-6алкініл, феніл-C1-4алкіл, C36алкеніл, R3 вибрано із групи: C2-5алкіл, C310циклоалкіл-C1-4алкіл, C4-6циклоалкеніл-C1-4алкіл, C6-10арил, C3-6гетероцикліл-C1-4алкіл, C310циклоалкіл, C3-6гетероцикліл та C4-8циклоалкеніл, застосовані у визначенні R1 є, як варіант, заміщеними одним або більше замісниками, вибраними із 6гетероциклоалкіл, групи: галоген, ціано, нітро, метоксил, етоксил, що як варіант, заміщено одним або більше C1метил, етил, гідроксил та -NR5R6; 6алкілом; де названий C3-6гетероциклоалкіл міс2 R вибрано із групи: C1-6алкіл, C2-6алкеніл, C3тить принаймні один кільцевий атом нітрогену, та C3-6циклоалкіл-C1-4алкіл, C46циклоалкіл, радикал C3-6гетероциклоалкіл є локалізованим на 13 86776 14 принаймні одному кільцевому атомі нітрогену, та кож можливо отримувати сіль відповідного лужнокожна з R8 та R9 є незалежно вибраною із групи: го металу (як-то натрію, калію, або літію) або лужН, C1-6алкіл, морфолініл-C1-3алкіл, піролідиніл-C1ноземельного металу (як-то кальцію) обробкою сполуки заявленого винаходу, яка має відповідний 3алкіл та піперидиніл-C1-3алкіл, де названі C1кислотний протон, як-то карбонова кислота або 6алкіл, морфолініл-C1-3алкіл, піролідиніл-C1-3алкіл та піперидиніл-C1-3алкіл є, як варіант, заміщеними фенол, одним еквівалентом гідроксиду, або алкокодним або більше замісниками, вибраними із грусиду лужного металу або лужноземельного метапи: галоген, метоксил, етоксил, метил, етил, гідролу (як-то етоксиду або метоксиду), або відповідксил та -NR5R6; та ним основним органічним аміном (як-то холіном R4, R5 та R6 є незалежно вибраними з -Н та C1або меглуміном) у водному середовищі з подальшим очищенням звичайними способами. 3алкілу. Згідно з ще одним втіленням винаходу запроВ одному втіленні вищевказану сполуку формули І можна перетворювати до фармацевтично поновано сполуки формули I, де прийнятної солі або її сольвату, конкретно, кислоR1 вибрано із групи: циклогексилметил, циклотно-адитивної солі, як-то хлориду, броміду, фоспентилметил, циклобутилметил, циклопропілмефату, ацетату, фумарату, малеату, тартрату, циттил, циклогексил, циклопентилетил, 4,4рату, метансу-льфонату або п-толуолсульфонату. дифлуорциклогексилметил, тетрагідропіранілмеМи виявили, що сполуки винаходу мають актил, тетрагідропіранілетил, тетрагідрофуранілметивність, як фармацевтичні, зокрема, як модулятил, 1-піперидинілетил, N-метил-2тори або ліганди, як-то агоністи, часткові агоністи, піперидинілметил; інверсний агоніст або антагоністи рецепторів СВ 1. R2 вибрано із групи: т-бутил, н-бутил, 2-метилБільш конкретно, сполуки винаходу демонструють 2-бутил, ізопентил, 2-метокси-2-пропіл, 2активність як агоністи рецепторів СВ1 та є корисгідроксил-пропіл, трифлуорметил, 1,1ними в терапії, конкретно, для полегшення різних дифлуоретил, 2, 2, 2-трифлуоретил, 1-метилбольових станів, як-то хронічного болю, невропапропіл, 1,1-диметил-пропіл, 1,1-диметил-3-бутентичного болю, гострого болю, болю при раку, бо1-іл, етил, та 2-пропіл; лю, спричиненого ревматоїдним артритом, мігрені, вісцерального болю тощо. Цей перелік, однак, не слід розуміти, як вичерпний. Додатково, сполуки заявленого винаходу є корисними в інших хворобливих станах, де є присутніми або охоплюються R3 – C3-6алкіл та , де R4, R8 та R9 вибдисфункції рецепторів СВ1 СВ1. Крім того, сполуки рано із групи: -Н та C1-3алкіл. винаходу можна застосовувати для лікування раЗрозуміло, що коли сполуки заявленого винаку, розсіяного склерозу, хвороби Паркінсона, хореї ходу містять один або більше хіраль-них центрів, Хантингтона, хвороби Альцгеймера, розладів з сполуки винаходу можуть існувати та бути отрикомпонентом тривоги, шлунково-кишкових розламаними як, енантіомерні або діастереоізомерні дів та серцево-судинних розладів. форми, або як рацемічні суміші. Заявлений винаСполуки винаходу є корисними як імуномодухід охоплює будь-які можливі енантіомери, діастелятори, конкретно, для аутоімунних хвороб, як-то реоізомери, рацемати або їх суміші сполуки форартриту, для трансплантатів шкіри, трансплантатів мули І. Оптично активні форми сполуки винаходу органів та подібних хірургічних потреб, для коламожна отримувати, наприклад, хіральним хромагену хвороб, різних алергій, для застосування як тографічним розділенням рацемату, синтезом із протипухлинні засоби та противірусні засоби. оптично активних вихідних матеріалів або асиметСполуки винаходу є корисними у хворобливих ричним синтезом, базованим на способах, описастанах, де є присутньою дегенерація або дисфунних далі. кція канабіноїдних рецепторів, або охоплених цією Також треба розуміти, що певні сполуки заявпарадигмою. Це може охоплювати застосування леного винаходу можуть існувати як геометричні мічених ізотопами варіантів сполук винаходу у ізомери, наприклад, ізомери E та Z алкенів. Заявдіагностиці та відтворюванні зображення як-то в лений винахід охоплює будь-який геометричний позитронній емісійній томографії (ПЕТ). ізомер сполуки формули І. Подалі треба розуміти, Сполуки винаходу є корисними для лікування що заявлений винахід охоплює таутомери сполук діареї, депресії, розладів з компонентом тривоги формули I. та пов'язаних зі стресом, як-то стресових розладів Також треба розуміти, що певні сполуки заявпісля травми, панічного розладу, генералізованого леного винаходу можуть існувати в сольватоварозладу з компонентом тривоги, соціальної фобії них, наприклад, гідратованих, а також несольватота нав'язливого маніакального розладу, нетриманваних формах. Подалі треба розуміти, що ня сечі, передчасної еякуляції, різних психічних заявлений винахід охоплює всі такі сольватовані хвороб, кашлю, набряку легенів, різних шлунковоформи сполуки формули I. кишкових розладів, наприклад, запору, функціонаУ рамках винаходу є також солі сполук форльних шлунково-кишкових розладів як-то синдрому мули I. Звичайно, фармацевтично прийнятні солі подразнення кишковика та функціональної диспесполук заявленого винаходу можна отримувати, псії, хвороби Паркінсона та інших моторних розлазастосовуючи стандартні способи, добре відомі в дів, травматичного ушкодження мозку, інсульту, рівні техніки, наприклад, реакцією достатньо оснокардіопротекції після інфаркту міокарду, ушковної сполуки, наприклад, алкіламіну із придатною дження спинного мозку та пристрасті до ліків, охокислотою, наприклад, НСІ або оцтовою кислотою, плюючи лікування зловживання спиртом, нікотищоб отримати фізіологічно прийнятний аніон. Та 15 86776 16 ном, опіоїдом та іншими ліками, та розладів симДля отримання фармацевтичних композицій зі патичної нервової системи, наприклад, гіпертензії. сполуки цього винаходу, інертні, фармацевтично Сполуки винаходу є корисними як аналгетик прийнятні носії може бути або твердими, або ріддля застосування протягом загальної анестезії та кими. Тверді форми препаратів охоплюють порошконтрольованому обслуговуванні анестезії. Часто ки, таблетки, дисперсні гранули, капсули, облатки застосовують комбінації засобів із відмінними влата супорзиторії. стивостями, щоб досягти балансу дії, потрібного Твердий носій може бути одною або більше для підтримування аналгетичного стану (наприсубстанціями, котрі також можуть діяти як розріклад, амнезії, аналгезії, релаксації та заспокоєння джувачі, ароматизуючі засоби, солюбілізатори, м'язів). Цією комбінацією охоплено дихальні анесзмащувачі, суспендувальні засоби, зв'язувачі або тетики, снодійні, анксіолітики, нервом'язові блокадезінтегрувальні засоби; Він також може бути каптори та опіоїди. сулювальним матеріалом. Також у рамках винаходу є застосування будьНосій у порошках є тонко подрібненою твердою речовиною, котру змішано з тонко подрібнеякої сполуки вищезазаначеноі формули I, для виною сполукою винаходу або активною складовою. робництва медикаменту для лікування будь-яких Активну складову в таблетках змішують з носієм, станів, розглянутих вище. який має необхідні зв'язувальні властивості, в Подальшим аспектом винаходу є спосіб лікупридатних співвідношеннях, та компонують до вання суб'єкта, що потерпає від будь-яких станів, бажаної форми та розміру. розглянутих вище, за допомогою ефективної кільДля отримання композицій супозиторіїв низькості сполуки згідно з вищезазначеною формулою коплавкий віск, як-то суміші гліцеридів жирних кисI, застосованої до пацієнта в разі потреби такого лот та масла какао спочатку розплавляють та дислікування. пергують активну складову, наприклад, Таким чином, згідно з винаходом запропоноперемішуванням. Тоді розплавлену гомогенну сувано сполуку формули I, або її фармацевтично міш заливають у форми відповідного розміру та прийнятну сіль або сольват, як вище визначено, охолоджують і стверджують. для застосування в терапії. Придатними носіями є магній карбонат, магній У подальшому аспекті згідно з заявленим вистеарат, тальк, лактоза, цукор, пектин, декстрин, находом запропоновано застосування сполуки крохмаль, трагакант, метилцелюлоза, натрійформули І або її фармацевтично прийнятної солі карбоксиметилцелюлоза, низькоплавкий віск, масабо сольвату, як вище визначено, у виробництві ло какао, та подібне. медикаменту для застосування в терапії. Термін композиція також охоплює композицію У контексті представленого опису термін "теактивної складової з капсулювальним матеріалом рапія" також охоплює "профілактику", якщо відсутяк носієм, забезпечуючи капсулу, у котрій активну ні особливі показники проти. Термін "терапевтичскладову (з іншими носіям або без них) оточено ний" та "терапевтично" застосовано відповідно. носієм, котрий, таким чином, є асоційованим із Термін "терапія" в контексті заявленого винаходу нею. Подібне містять облатки. подалі охоплює застосування ефективної кількості Таблетки, порошки, облатки, та капсули можна сполуки заявленого винаходу, для пом'якшення застосовувати як тверді форми дозування, придавже наявного хворобливого стану, гострого або тні для перорального застосування. хронічного, або зворотного стану. Це визначення Рідкі форми композицій охоплюють розчини, також охоплює профілактичну терапію для попесуспензії, та емульсії., наприклад, стерильна вода редження зворотних станів та подовженої терапії або водні пропіленгліколеві розчини активних спопри хронічних розладах. лук можуть бути рідкими препаратами, придатниСполуки заявленого винаходу є корисними в ми для парентерального застосування. Рідкі комтерапії, конкретно лікування різних больових стапозиції можна складати у розчині, у водному полі нів, що охоплюють (але не обмежуються): гострого етиленгліколі. болю, хронічного болю, невропатичного болю, Водні розчини для перорального застосування зворотного болю, болю при раку та вісцерального можна отримувати розчиненням активної складоболю. вої у воді та додаванням, за потребою, придатних У терапії теплокровної тварини, як-то людини барвників, ароматизуючих засобів, стабілізаторів сполуку винаходу можна застосовувати у формі та загущувальних засобів. Водні суспензії для пезвичайної фармацевтичної композиції будь-яким рорального застосування можна робити диспергуспособом: перорально, внутрішньом'язово, підшківанням тонко розділеної активної складової у воді рно, локально, інтраназально, інтраперитонеальразом із в'язкою речовиною, як-то натуральними но, інтраторакально, внутрішньовенно, епідуральсинтетичними смолам, смолами, метилцелюлоно, інтратекально, інтрацеребровенгтрикулярно та зою, натрій-карбоксиметилцелюлозою та іншими ін'єкцією в суглоби. суспендувальними засобами, відомими в рівні В одному втіленні винаходу, шлях застосувантехніки для фармацевтичного складу. ня може бути пероральним, внутрішньовенним або Залежно від способу застосування фармацеввнутрішньом'зовим. тична композиція переважно містить 0,05 Дозування залежатиме від шляху застосуван99мас% (масовий процент), переважніше 0, 10 ня, суворості хвороби, віку та маси пацієнта та 50мас%, сполуки винаходу, усі масові проценти інших факторів, що, звичайно, розглядає лікар, базовано на масі усієї композиції. коли визначає індивідуальний режим та рівень Терапевтично ефективну кількість для практидозування, найбільш придатний для конкретного чного застосування заявленого винаходу може пацієнта. 17 86776 18 визначити звичайний спеціаліст застосуванням як-то HATU, EDC, з подальшою обробкою кисловідомого критерія, що охоплює вік, масу та відгук тою, як-то АсОН, окремого пацієнта, та інтерпретувати в контексті де хвороби, котру лікують або попереджують. Рамки C вибрано із групи: СІ, Br, F та ОН; винаходу охоплюють застосування будь-якої споR1 вибрано із групи: C1-10алкіл, C2-10алкеніл, C2луки формули I, яку визначено вище, для виробR5R6N-C1-6алкіл, R5OC1-6алкіл, 10алкініл, 5 5 6 ництва медикаменту. R C(=O)N(-R6)-C1-6алкіл, R R NS(=O)2-C1-6алкіл, Також рамки винаходу охоплюють застосуванR5CS{=O)2N(-R6)-C1-6алкіл, R5R6NC(=O)N(-R7)-C15 6 7 ня будь-якої сполуки формули I для виробництва 6алкіл, R R NS(=O)2N(R )-C1-6алкіл, C6-10арил-C1медикаменту для лікування болю. 6алкіл, C6-10арил-С(=О)-C1-6алкіл, C3-10циклоалкілC1-6алкіл, C4-8циклоалкеніл-C1-6алкіл, C3Додатково запропоновано застосування будь6гетероцикліл-C1-6алкіл, C3-6гетероцикліл-С(=0)-C1якої сполуки формули I для виробництва медикаC1-10гідрокарбіламіно, R5R6N-, R50-, 6алкіл, менту для лікування різних больових станів, що 5 6 5 6 5 R C(=O)N(-R )-, R R NS(=O)2-, R CS(=O)2N(-R6)-, охоплюють (але не обмежують): гострий біль, хроR5R6NC(=O)N(-R7)-, R5R6NS(=O)2N(R7)-, C6-10арил, нічний біль, невропатичний біль, біль у спині, біль C6-10арил-С(=О)-, C3-10циклоалкіл, C4при раку та вісцеральний біль. C3-6гетероцикліл та C38циклоалкеніл, Подальшим аспектом винаходу є спосіб ліку6гетероцикліл-С(=0)-; де названі C1-10алкіл, C2вання суб'єкта, що потерпає від будь-яких станів, C2-10алкініл, C6-10арил-C1-6алкіл, C610алкеніл, розглянутих вище, за допомогою чого ефективну C3-10циклоалкіл-C1-6алкіл, 10арил-С(=О)-C1-6алкіл, кількість сполуки вищезазначеноі формули I заC4-8циклоалкеніл-C1-6алкіл, C3-6гетероциклоалкілстосовують до пацієнта, який потребує такого ліC1-6алкіл, C3-6гетероциклоалкіл-С(=О)-C1-6алкіл, C1кування. 10гідрокарбіламіно, C6-10арил, C6-10арил-С(=О)-, C3Додатково запропоновано фармацевтичну 10циклоалкіл, C4-8циклоалкеніл, C3-6гетероцикліл композицію, що містить сполуку формули I, або її або C3-6гетероцикліл-С(=О)-, застосовані у визнафармацевтично прийнятну сіль в асоціації з фарченні R1, як варіант, є заміщеними одним або бімацевтично прийнятним носієм. льше замісниками, вибраними із групи: галоген, Конкретно, запропоновано фармацевтичну ціано, нітро, метоксил, етоксил, метил, етил, гідрокомпозицію, що містить сполуку формули I або її ксил та -NR5R6; фармацевтично прийнятну сіль в асоціації з фарR2 вибрано із групи: C1-10алкіл, C2-10алкеніл, C2мацевтично прийнятним носієм для лікування, C3-10циклоалкіл, C3-10циклоалкіл-C110алкініл, більш конкретно - для лікування болю. C4-8циклоалкеніл-C1-6алкіл, C36алкіл, Подалі запропоновано фармацевтичну компоC4-8циклоалкеніл, 6гетероциклоалкіл-C1-6алкіл, зицію, що містить сполуку формули I, або її фарR5R6N-, C3-5гетероарил, C6-10арил та C3мацевтично прийнятну сіль, в асоціації з фармаде названі C1-10алкіл, C26гетероциклоалкіл, цевтично прийнятним носієм, корисну у будь-яких C2-10алкініл, C3-8циклоалкіл, C310алкеніл, станах, розглянутих вище. C4-8циклоалкеніл-C1-6алкіл, 8циклоалкіл-C1-6алкіл, Іншим аспектом винаходу є спосіб отримання C3-6гетероциклоалкіл-C1-6алкіл, C4-8циклоалкеніл, сполуки заявленого винаходу. C3-5гетероарил, C6-10арил або C3В одному втіленні способом винаходу є спосіб 2 6гетероциклоалкіл, застосовані у визначенні R , як отримання сполуки формули I, варіант, є заміщеними одним або більше замісниками, вибраними із групи: галоген, ціано, нітро, метоксил, етоксил, метил, етил, гідроксил тa NR5R6; де R5, R6 та R7 є незалежно вибраними з -Н, C1-6алкіл, C2-6алкеніл, C2-6алкініл та двовалентна C1-6-група, яка разом з іншими двовалентними R5, R6 або R7 формує частину кільця; R3 вибрано із групи: -Н, C1-10алкіл, C2-10алкеніл, C2-10алкініл, C3-10циклоалкіл, C3-10циклоалкіл-C1C4-8циклоалкеніл-C1-6алкіл, C36алкіл, 6гетероциклоалкіл, зі сполукою R2COX, у присутності основи, якто алкіламіну, та, як варіант, реагенту сполучення, що, як варіант, заміщено одним або більше замісниками, вибраними із групи: C1-6алкіл, галоген, аміно та C1-6алкокси; кожна з R8 та R9 є незалежно вибраною із групи: -Н, C1-10алкіл, C2-10алкеніл, C2-10алкініл, C3C3-10циклоалкіл-C1-6алкіл, C310циклоалкіл, C6-10арил, C3-6гетероцикліл-C16гетероцикліл, 6алкіл, C6-10арил-C1-6алкіл та двовалентна C1-6група, яка разом з іншими двовалентними група 19 86776 20 ми, вибраними з R8 та R9, формує частину кільця, сниками, вибраними із групи: галоген, метоксил, де названі C1-10алкіл, C2-10алкеніл, C2-10алкініл, C3етоксил, метил, етил, гідроксил та -NR5R6; C3-10циклоалкіл-C1-6алкіл, C3R3 вибрано із групи: -Н, C2-5алкіл, C310циклоалкіл, C6-10арил, C3-6гетероцикліл-C16гетероцикліл, 6алкіл, C6-10арил-C1-6алкіл, або двовалентна C1-6група є, як варіант, заміщеною одним або більше замісниками, вибраними із групи: галоген, ціано, 6гетероциклоалкіл, нітро, метоксил, етоксил, метил, етил, гідроксил та що, як варіант, заміщено одним або більше C1-NR5R6; та 6алкілом; де названий C3-6гетероциклоалкіл міс4 R вибрано із групи: -Н, C1-10алкіл, C2-10алкеніл, тить принаймні один кільцевий атом нітрогену, та C2-10алкіл, C3-10циклоалкіл, C3-10циклоалкіл-C1радикал C3-6гетероциклоалкіл є локалізованим на 6алкіл та C4-8циклоалкеніл-C1-6алкіл. принаймні одному кільцевому атомі нітрогену, та Конкретно, спосіб винаходу є способом отрикожна з R8 та R9 є незалежно вибраною із групи: мання сполуки формули I, де Н, C1-6алкіл, морфолініл-C1-3алкіл, піролідиніл-C1C вибрано із групи: СІ, Br, F та ОН; 3алкіл, та піперидиніл-C1-3алкіл, де названі C11 R вибрано із групи: C1-6алкіл, C2-6алкеніл, фе6алкіл, морфолініл-C1-3алкіл, піролідиніл-C1-3алкіл, ніл-C1-4алкіл, C3-10циклоалкіл-C1-4алкіл, C4та піперидиніл-C1-3алкіл є, як варіант, заміщеними C6-10арил, C36циклоалкеніл-C1-4алкіл, одним або більше замісниками, вибраними із груC3-10циклоалкіл та C46гетероцикліл-C1-4алкіл, пи: галоген, метоксил, етоксил, метил, етил, гідро6циклоалкеніл, де названі C1-6алкіл, C2-6алкеніл, ксил та -NR5R6; та феніл-C1-4алкіл, C3-10циклоалкіл-C1-4алкіл, C4R4, R5 та R6 є незалежно вибраними з -Н та C1C6-10арил, C36циклоалкеніл-C1-4алкіл, алкілу. 3 C3-10циклоалкіл та C46гетероцикліл-C1-4алкіл, Сполуки заявленого винаходу також можна 1 6циклоалкеніл застосовані у визначенні R є, як отримати згідно етапам синтезу, зображеним у варіант, заміщеними одним або більше замісникаСхемі 1. ми, вибраними із групи: галоген, метоксил, етокСхема 1. сил, метил, етил, гідроксил та -NR5R6; Відновник - redusing agent; відновлення 2 R вибрано із групи: C1-6алкіл, C2-6алкеніл, C3reduction; 2-дихлоретан 2-dichloretan; коли - when; 6циклоалкіл та C3-6циклоалкіл-C1-4алкіл, де названі засіб сполучення coupling agent; кислота - acid; C1-6алкіл, C2-6алкеніл, C3-6циклоалкіл та C3нагрівання у мікрохвильовій печі microwave oven 2 6циклоалкіл-C1-4алкіл, застосовані у визначенні R heating; наприклад - e.g.; основа - base; розчинник є, як варіант, заміщеними одним або більше замі- solvent R1, R2, R3 та R4 визначено в описі. Біологічна оцінка Зв'язування рецептору hСВ1 та hСВ2. Мембрани рецептору СВ1 людини від Receptor Biology (hСВ1)або рецептору СВ2 людини від BioSignal (hCB2) розморожували при 37°С, пропускали 3 рази через голку 25 калібру з тупим кінцем, розбавляли буфером для зв'язування канабіноїду (50ммоль TRis, 2,5ммоль ЕДТА, 5ммоль MgСІ2, та 0,5мг бичачого сироваточного альбуміну (БСА) без жирних кислот, рН 7,4) та аліквоти, яка містять прийнятну кількість білку розподіляли у 96коміркові планшети. КІ50 сполук винаходу для hCB1 та hCB2 визначали за 10-точковими кривими дозавідгук, зроблених з 3Н-СР553940 при 20000 25000імп/хв на комірку (0,17-0,21нм) у кінцевому об'ємі 300мкл. Загальне та неспецифічне зв'язу 21 86776 22 приблизно 0,7-3,5нм. ЕК50 відносно рецепторів СВ1 вання визначали у відсутності та присутності людини для найбільшої кількості сполук винаходу 0,2мкМ HU210, відповідно. Планшети перемішувавиміряні в діапазоні приблизно 24-84нм. Емакс. відли та інкубували протягом 60 хвилин при кімнатній носно рецепторів СВ1 людини для найбільшої кітемпературі, фільтрували через UnifilteR8 GF/B лькості сполук винаходу виміряні в діапазоні при(попередньо просочений у 0,1% поліетиленіміні) зі близно 105-116%. збирачем Tomtec або PackaRd J, застосовуючи ПРИКЛАДИ 3мл промивного буферу (50ммоль TRis, 5ммоль Винахід подалі описано більш детально наMgСІ2, 0, 5мг БСА рН 7,0). Фільтри висушували ступними прикладами, котрі описують способи протягом 1 години при 55°С. Радіоактивність отримання сполук заявленого, очищення, аналізу (імп/хв) обраховували в TopCount (PackaRd) після та біологічного тестування, але не обмежують видодавання 65мкл/комірку сцинтиляційної рідини нахід. MS-20. Приклад 1 Зв'язування hСВ1 та СВ2 GTPgS N-[2-трет-бутил-1-(циклогексилметил)-1НРецептор СВ1 людини від Receptor Biology бензімідазол-5-іл]-N, N', N'-триметилсульфамід (hСВ1) або мембрани з рецептором СВ2 людини від BioSignal (hCB2) розморожували при 37°С, пропускали 3 рази через голку 25 калібру з тупим кінцем та розбавляли буфером для зв'язування GTPgS (50ммоль Гепес, 20ммоль NaOH, 100ммоль NaCI, 1ммоль ЕДТА, 5ммоль MgСІ2, рН 7,4, 0,1% БСА). ЕК50 та ЕМакс. сполуки винаходу визначали за 10-точковими кривими доза-відгук, отриманими у 300мкл із придатною кількістю білку мембран та 100000-130000імп/хв GTPg35S на коміру (0,11 Етап А. N-[2-трет-Бутил-1-(циклогексилметил)0,14нм). Базове та максимальне стимульоване 1Н-бензімідазол-5-іл]- N, N', N'-триметилсульфамід зв'язування визначали у відсутності та присутності 1мкМ (hCB2) або 10мкМ (hCB1) Win 55,212-2, відповідно. Мембрани преінкубували протягом 5 хвилин з 56,25мкМ (hCB2) або 112,5мкМ (hCB1) GDP pRioR до розподілення в планшети (15мкМ (hCB2) або 30мкМ (hCB1) GDP кінцеве). Планшети перемішували та інкубували протягом 60 хвилин при 2-трет-Бутил-1-(циклогексилметил)-N-метилкімнатній температурі, фільтрували на UnifilteR8 1Н-бензімідазол-5-амін (40мг, 0,133ммоль) (для GF/B (попередньо просочений у воді) зі збирачем отримання див. наступні етапи В, С, D, Е та F) та Tomtec або PackaRd, застосовуючи 3мл промивнодиметилсульфамоїлхлорид (0,020мл, 0,173ммоль) го буферу (50ммоль TRis, 5ммоль MgСІ2, 50ммоль перемішували в 3мл дихлорметану, який містить NaCI, рН 7,0). Фільтри висушували протягом годикаталітичну кількість DMAP, протягом ночі при кімни при 55°С. Радіоактивність (імп/хв) обраховуванатній температурі. Розчинник випарювали. Проли в TopCount (PackaRd) після додавання дукт очищали реверсно-фазовою ВЕРХ, застосо65мкл/комірку сцинтиляційної рідини MS-20. Довуючи 20-80% CH3CN/H2O та тоді ліофілізували, слідження антагоністу інверсії зроблено тим же що дало названу сполуку як відповідну сіль трифшляхом за виключенням: (а) криву доза-відгук аголуороцтової кислоти. Вихід: 36мг (52%); 1Н ЯМР ністу зроблено в присутності постійної концентра(400МГц, МЕТАНОЛ-D4) d 1,22 (m, 5Н), 1,62 (m, ції антагоністу, або (b) криву доза-відгук антагоніс2Н), 1,65 (s, 9Н), 1,67 (m, 1Н), 1,75 (m, 2Н), 2,10 (m, ту зроблено в присутності постійної концентрації 1Н), 2,81 (s, 6H), 3,29 (s, ЗН), 4,44 (d, J = 7,62Гц, агоністу. 2Н), 7,64 (dd, J = 9,08, 2,05Гц, 1Н), 7,78 (d, J = Виходячи із вищенаведених аналізів, констан1,95Гц, 1Н), 7,90 (d, J = 8,98Гц, 1Н); МС (IEP) ту дисоціації (Кі) для конкретної сполуки винаходу (М+Н)+ 407,3; Анал.розрах. для C21H34O2S + 1,3 відносно конкретного рецептору визначали, застосовуючи наступне рівняння: TFA + 0,3 Н2О: С, 50, 60; Н, 6,46; N, 10, 00. Знайдено: С, 50, 64; Н, 6, 47; N, 10,15. Ki = KI50/(1[rad]/Kd), Етап В. Метил (4-флуор-3нітрофеніл)карбамат де КІ50 - концентрація сполуки винаходу, при котрій спостерігається 50% заміщення; [Rad] - стандартна або еталонна концентрація радіоактивного ліганду в цей момент Kd - константа дисоціації радіоактивного ліганду відносно конкретного рецептору. Застосовуючи вищенаведені аналізи, Кі відносно рецепторів СВ1 людини для найбільшої кількості сполук винаходу виміряні в діапазоні 5-25нм. Кі відносно рецепторів СВ2 людини для найбільшої кількості сполук винаходу виміряні в діапазоні Метилхлорформіат (13,2мл, 170,2ммоль) додавали краплями до холодного (0°С) розчину 4флуор-3-нітроанілін (24, 15г, 154,7ммоль) та DIPEA (35мл, 201ммоль) у дихлорметані (200мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Розчин тоді розріджували 200мл дихлорметану та промивали 2М НСІ, роз 23 86776 24 солом та висушували за допомогою безводного MgSO4. Розчинник концентрували та продукт безпосередно застосовували на наступних етапах без подальшого очищення. Вихід: 35,5г (99%); 1Н ЯМР (400МГц, ХЛОРОФОРМ-D) d 3,81 (s, 3Н), 7,02 (s, 1H), 7,23 (m, 1H), 7,72 (d, J = 8,59Гц, 1Н), 8,17 (dd, J = 6,35, 2,64Гц, 1Н). Етап С. Метил {4-[(циклогексилметил)аміно]-3Метил {3-аміно-4нітрофеніл}карбамат [(циклогексилметил)аміно]феніл}карбамат (950мг, 3,43ммоль) та DMAP (100мг, 0,858ммоль) розчиняли в 25мл дихлорметану. Додавали краплями триметилацетилхлорид (0,460мл, 3,77ммоль) та розчин перемішували при кімнатній температурі протягом 1 години. Розчинник концентрували. Залишок розподіляли на дві порції та кожну із них розчиняли в 3мл льодяної АсОН у герметичній тубі. Розчини нагрівали при 150°С, застосовуючи мікрохвильовий прилад Pesonal Chemistry Smith Synthesizer із трьома інтервалами по 30 хвилин (3 * 30 хвилин). Вміст двох туб поєднували, і розчинник випарювали. Залишок розчиняли в ЕtOАс та промивали насиченим розчином NaHCO3, розсолом та висушували за допомогою безводного MgSO4. Сирий продукт очищали флешМетил (4-флуор-3-нітрофеніл)карбамат (1,00г, хроматографією, застосовуючи 4,67ммоль) та циклогексилметиламін (0,730мл, 3:1/дихлорметан:діетиловий етер. Вихід: 656мг 5,60ммоль) перемішували в ЕtOН (20мл), який (56%); 1Н ЯМР (400МГц, ХЛОРОФОРМ-D) d 1,08 містить з TEA (1,0мл, 7,00 ммоль) при 75°С протя(m, 2H), 1,18 (m, ЗН), 1,54 (s, 9Н),) 1,65 (m, 1Н), гом 24 годин. Розчинник концентрували. Залишок 1,69(m, 2Н), 1,73 (dd, J = 5,96, 3,22Гц, 2Н), 2,02 (m, розчиняли в EtOAc та промивали 5% розчином 1Н), 3,78 (s, 3Н), 4,10 (d, J = 7,42Гц, 2Н), 6,64 (m, KHSO4, насиченим розчином NaHCO3, розсолом 1Н), 7,25 (d, J = 8,79Гц, 1Н), 7,39 (m, 1Н), 7,59 (d,J= та висушували за допомогою безводного MgSO4. 1,76Гц, 1Н). Сирий продукт очищали флеш-хроматографією, Етап F. Метил[2-трет-бутил-1застосовуючи 4:1/гексан: ЕtOАс на силікагелі. Ви(циклогексилметил)-1Н-бензімідазол-5-іл]карбамат хід: 1,05г (73%); 1Н ЯМР (400МГц, ХЛОРОФОРМD) d 1,04 (ddd, J = 24,02, 12,11, 2,93Гц, 2Н), 1,25 (m, 3Н), 1,69 (m, 2H), 1,76 (m, 1H), 1,79 (m, 1H), 1,83 (m, 1Н), 1,86 (m, 1Н), 3,14 (dd, J = 6,44, 5,66Гц, 2Н), 3,78 (s, 3Н), 6,46 (m, 1H), 6,84 (d, J = 9,37Гц, 1Н), 7,63 (m, 1Н), 8,05 (d, J = 2,54Гц, 1Н), 8,09 (m, 1H). Етап D. Метил {3-аміно-4Метил [2-трет-бутил-1-(циклогексилметил)-1Н[(циклогексилметил)аміно]феніл}карбамат бензімідазол-5-іл]карбамат (650мг, 1,89ммоль) розчиняли в 20мл ТГФ при 0°С під азотом. Додавали краплями 1М НСІ/етер (2,65мл, 2,65ммоль) та розчин перемішували при 0°С протягом 15 хвилин. Тоді повільно додавали LіАІН4 (360мг, 9,45ммоль) та розчин перемішували при кімнатній температурі протягом ночі. Реакційну суміші гасили при 0°С додаванням МеОН (5мл) а потім - води Метил {4-[(циклогексилметил)аміно]-3(10мл). Розчин розріджували ЕtOАс та промивали нітрофеніл}карбамат (1,05г, 3,42ммоль) розчиняли насиченим розчином NaHCO3, розсолом та висув 30мл ЕtOАс, який містить каталітичну кількість шували за допомогою безводного MgSO4. Розчин10% Pd/C. Розчин струшували в У апараті Парра ник випарювали та продукт застосовували безподля гідрогенізації в атмосфері Н2 (40фунт/кв.дюйм) середно для етапи А без подальшого очищення. при кімнатній температурі протягом ночі. Розчин Вихід: 544мг (96%). 1Н ЯМР (400МГц, ХЛОРОфільтрували через целіт та розчинник випарюваФОРМ-D) d 1,08 (s, 2Н), 1,17 (m, 3Н), 1,54 (s, 9Н), ли. Продукт безпосередно застосовували на на1,64 (m, 2Н), 1,67 (m, 2Н), 1,72 (m, 2Н), 2,02 (m, ступних етапах без подальшого очищення. Вихід: 1Н), 2, 87 (s, 3Н), 4,06 (d, J = 7,62Гц, 2Н), 6,60 (dd, 950мг (99%). МС (ІЕР) (М+Н)+277,9. J = 8,69, 2,25Гц, 1Н), 7,00 (d, J = 1,76Гц, 1Н), 7,12 Етап Е. Метил [2-трет-бутил-1(d, J = 8,59Гц, 1Н). (циклогексилметил)-1Н-бензімідазол-5-іл]карбамат Приклад 2 N-[2-трет-Бутил-1-(циклогексилметил)-1Нбензімідазол-5-іл]- N'N'-діетил-N-метилсульфамід 25 86776 26 очищали MPLC (гексани/ЕtOАс 1:1 як елюент на силікагелі), що дало названу сполуку як білу тверду речовину (56,2мг, 76%), котру перетворювали на білу тверду сіль трифлуороцтової кислоти. 1Н ЯМР (400МГц, CD3OD): d 0,84 (t, J=7,52Гц, 3Н), 1,24 (m, 5Н), 1,64 (m, 2Н), 1,66 (s, 6Н), 1,71 (m, 1Н), Розчин діетиламіну (0,103мл, 1,00ммоль) у 1,78 (m, 2Н), 2,01 (q, J=7,55Гц, 2H), 2,11 (m, 1Н), 1мл дихлорметану та TEA (0,140мл, 1,00ммоль) 2,82 (s, 6Н), 4,44 (d, J=7,81Гц, 2H), 7,37 (dd, J=8,98, 2,15Гц, 1H), 7,69 (d, J=2,15Гц, 1H), 7,84 (d, додавали послідовно до холодного (0°С) розчину SO2CI2 (0,160мл, 2,00ммоль) у дихлорметані (1мл) J=8,98Гц, 1H); МС (IEP) (М+Н)+: 407,3; під атмосферо нітрогену. Тоді розчин перемішуваАнал.розрах. для C21H34N4O2S + 1,0 TFA + 0,2 Н2О: ли при кімнатній температурі протягом 3 годин. С, 52,70; Н, 6,81; N, 10,69. Знайдено: С, 52,70; Н, Розчин 0 промивали 5% розчином KHSO4, розсо6,66; N, 10,45. лом та висушували за допомогою безводного Етап В. N-(4-флуор-3-нітрофенул)ацетамід MgSO4. Розчинник концентрували. Тоді залишок розчиняли в 1мл дихлорметану, до котрого краплями додавали розчин 2-трет-бутил-1(циклогексилметил)- N-метил-1Н-бензімідазол-5аміну (25мг, 0,0835ммоль) та DMAP (каталітичну) у 4-Флуор-3-нітро-анілін (45,0г, 288,2ммоль) до1мл дихлорметану. Розчин перемішували при кімдавали порціями до оцтового ангідриду (150мл) натній температурі протягом 24 годин. Продукт при кімнатній температурі. Реакційну суміш переочищали реверсно-фазовою ВЕРХ, застосовуючи мішували при кімнатній температурі протягом 2 30-80% CH3CN/H2O та ліофілзували, що дало нагодин. Білу тверду речовину збирали та висушузвану сполуку як відповідну сіль трифлуороцтової вали у вакуумі, що дало названу сполуку (42,0г, кислоти. Вихід: 15мг (33%); 1Н ЯМР (400МГц, 70%). 1Н ЯМР (400МГц, CDCI3): d 2,23 (s, 3Н), 7,26 METAHOЛ-D4) d 1, 13 (t, J = 7,13Гц, 6Н), 1,24 (m, (m, 1Н), 7,50 (s широк, 1Н), 7,87 (m, 1Н), 8,23 (dd, SH), 1,63 (m, 2H), 1,67 (s, 9H), 1,70 (m, 1H), 1,77 J=6,44, 2,73Гц, 1Н). (m, 2H), 2,12 (m, 1H), 3,26 (s, 3Н), 3,30 (m, 4Н), 4,46 Етап С. N-{4-[(циклогексилметил)аміно]-3(d, J = 7,62 Гц, 2Н), 7,61 (dd, J - 8,98, 2,15Гц, 1Н), нітрофеніл}ацетамід 7,78 (d, J = 1,95Гц, 1Н), 7,89 (d, J = 8,98Гц, 1Н); МС (IEP) (М+Н)+ 435,2; Анал.розрах. для C23H38N4O2S + 1,2 TFA + 0,8 Н2О: С, 52,07; Н, 7,02; N, 9,56. Знайдено: С, 52,00; Н, 7,01; N, 9,55. Приклад 3 N'-[1-(циклогексилметил)-2-(1,1диметилпропіл)-1Н-бензімідазол-5-iл]-N,Nдиметил-сульфамід. Циклогексилметиламін (2,86мл, 2,49г, 22,0ммоль) додавали до суміші Н-(4-флуор-3нітрофеніл)ацетаміду (3,96г, 20,0ммоль) та натрій карбонату (4,66г, 44ммоль) у ЕtOН (50мл) при кімнатній температурі. Реакційну суміш нагрівали протягом 48 годин при 60°С, та розріджували Н2О (800мл). Тверду жовтогарячу речовину осаджували та збирали, що давало бажаний продукт (6,60г, Етап А. N-[1-(циклогексилметил)-2-(1,1100%). МС (ІЕР) (М+Н)+: 292,32. диметилпропіл)-1Н-бензімідазол-5-іл]N,NЕтап D. N-{3-аміно-4диметилсульфамід [(циклогексилметил)аміно]феніл}ацетамід DMAP (80,1мг, 0,65ммоль) додавали до розчину 1-(циклогексилметил)-2-(1,1диметилпропіл)бензімідазол-5-амін (69,5мг, 0,18ммоль) (для отримання, див. наступні етапи В, С, D, Е та F) у ацетонітрилі (10мл) при 0 °С, а потім додавали диметилсульфамоїлхлорид (22мкл, 28,7мг, 0,20ммоль). Отриману суміші нагрівали з дефлегматором протягом 20 годин та тоді гасили МеОН (2мл). Після випарювання розчинника залишок розчиняли в EtOAc (100мл) та промивали водним розчином NaCI (10мл) та висушували над Na2SO4. Після фільтрації та випарювання залишок Вищезазначений сирий продукт N-{4[(циклогексилметил)аміно]-3-нітрофеніл}ацетамід (6,60г) гідрогенізували в етилацетаті (300мл) з каталізатором 10% Pd/C (0,5г) при 2030фунт/кв.дюйм Н2 у струшувачі Парра протягом 4,5 годин при кімнатній температурі. Після фільтрації через целіт та концентрування отримували 5,08г (97%) чистої твердої речовини, котру застосовували в наступному етапі без подальшого очищення. 1Н ЯМР (400МГц, CDCI3): d 1,00 (m, 2Н), 27 86776 28 1,24 (m, 3Н), 1,59 (m, 2Н), 1,72 (m, 2Н), 1,84 (m, N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-42Н), 2,13 (s, 3Н), 2,91 (d, /=6,64Гц, 2Н)5 3,37 (s шиілметил)-1Н-бензімідазол-5-іл]-N-метилбутан-1рок, 3Н), 6,56 (d, J=8,40Гц, 1Н), 6,69 (dd, J=8,30, сульфонамід 2,25Гц, 1Н), 6,98 (s, 1Н), 7,12 (d, J=2,34Гц, 1Н). МС (ІЕР) (М+Н)+: 262,31. Етап Е. N-[1 -(циклогексилметил)-2-(1,1диметилпропіл)-1Н-бензімідазол-5-іл]ацетамід DMAP (0,65г, 5,3ммоль) додавали до суспензії N-{3-aміно-4[(циклогексилметил)аміно]феніл}ацетаміду (2,09г, 8,0ммоль) у дихлорметані (40мл) при-10°С, а потім додавали 2,2-диметилбутирилхлорид (1,51г, 11,2ммоль). Отриману суміш перемішували протягом ночі при кімнатній температурі. Після випарювання розчинника отримували 4,14г коричневої твердої речовини, котра відповідала бажаному продукту сполучення А. МС (ІЕР) (М+Н)+ = 360,07. Розчиняли 308,1мг вищезгаданого сирого продукту А у 1,2-дихлоретані (5мл) у покритій тефлоном тестовій пробірці. Сосуд опромінювали мікрохвилями протягом 3 годин при 170°С. Після випарювання розчинника залишок розчиняли в EtOAc (100мл), промивали водним розчином 2N NaOH (10мл), насиченим водним розчином NaCI (10мл) та висушували над Na2SO4. Після фільтрації та випарювання залишок очищали ВЕРХ (гексани/ЕtOАс 1:1 як елюент на силікагелі), що дало названу сполуку як світло-жовту тверду речовину (111,0мг, 55%), котру перетворювали на білу тверду сіль трифлуороцтової кислоти. 1Н ЯМР (400МГц, CD3OD): d 0,84 (t, J=7,52Гц, 3Н), 1,25 (m, 5Н), 1,63 (m, 2Н), 1,66 (s, 6Н), 1,70 (m, 1Н), 1,77 (m, 2Н), 2,01 (q, J=7,42Гц, 2H), 2,10 (m, 1Н), 2,18 (s, 3Н), 4,44 (d, J=7,81Гц, 2Н), 7,50 (dd, J=8,98, 1,95Гц, 1Н), 7,84 (d, J=9,18Гц, 1Н), 8,44 (d, J=1,76Гц, 1Н). МС (IEP) (М+Н)+: 342,05. Етап F. 1-циклогексилметил-2-(диметилпропіл1Н-бензімідазол-5-амін N-[1-(циклогексилметил)-2-(1,1диметилпропіл)-1Н-бензімідазол-5-іл]ацетамід (110,0мг, 0,32ммоль) розчиняли у ЕtOН (3мл) та 2N НСІ (2мл) у покритій тефлоном тестовій пробірці. Сосуд опромінювали мікрохвилями протягом 45 хвилин, при 120°С після випарювання розчинника, названу сполуку отримували сіро-білу тверду речовину (117,8мг, 100%). 1Н ЯМР (400МГц, CD3OD): d 0,87 (t, J=7,52Гц, 3Н), 1,27 (m, 5Н), 1,66 (m, 3Н), 1,71 (s, 6H), 1,78 (m, 2H), 2,05 (q, J=7,42Гц, 2H), 2,13 (m, 1H), 4,53 (d, J=7,62Гц, 2H), 7,66 (dd, J=8,79, 1,56Гц, 1H), 7,97 (d, J=1,76Гц, 1H), 8,17 (d, J=8,79Гц, 1H); МС (ІЕР) (М+Н)+: 300,05. Приклад 4 Етап А: N-[2-трет-Бутил-1-тетрагідро-2Н-піран4-ілметил)-1Н-бензімідазол-5-іл]-N-метилбутан-1сульфонамід 2-трет-Бутил-N-метил-1-(тетрагідро-2Н-піран4-ілметил)-1Н-бензімідазол-5-амін (для отримання див. наступні етапи В, С, D, Е та F) (38мг, 0,126ммоль) та 1-бутансульфонілхлорид (0,025мл, 0,189ммоль) перемішували в 3мл DCM, який містить каталітичну кількість DMAP при кімнатній температурі протягом ночі. Розчинник випарювали та продукт очищали реверсно-фазовою ВЕРХ, застосовуючи 10-60% CH3CN/H2O та ліофілзували, що дало названу сполуку як відповідну сіль трифлуороцтової кислоти. Вихід: 39мг (58%). 1Н ЯМР (400МГц, МЕТАНОЛ-: d 0,88 - 0,94 (m, J=7,42, 7,42Гц, 3Н), 1,43 (dq, J=15,06, 7,41Гц, 2Н), 1,53 1,59 (m, 2Н,) 1,59 - 1,66 (m, 2Н), 1,69 (s, 9Н), 1,71 1,77 (m, 2Н), 2,35 - 2,42 (m, 1Н), 3,10 - 3,16 (m, Н), 3,35 (dt, JM11,52, 2,73Гц, 2Н), 3,40 (s, 3Н), 3,93 (d, J=3,12Гц, 1Н), 3,96 (d, J=3,71Гц, 1Н), 4,54 (d, J=7,42Гц, 2Н), 7,69 (dd, J=8,98, 2,15Гц, 1Н), 7,81 (d, J=1,56Гц, 1Н), 7,97 (d, J=8,98Гц, 1Н); МС (IEP) (М+Н)+ 422,2; Анал.розрах. для C22H35N3O3S + 1,3 TFA + 1,2 Н2О: С, 49,96; Н, 6,60; N, 7,10. Знайдено: С, 49,98; Н, 6,67; N, 6,83. Етап В: Метил (4-флуор-3нітрофеніл)карбамат Метилхлорформіат (13,2мл, 170,2ммоль) додавали краплями до холодного (0°С) розчину 4флуор-3-нітроаніліну (24,15г, 154,7ммоль) та DIPEA (35мл, 201ммоль) у дихлорметані (200мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Розчин тоді розріджували 200мл дихлорметану та промивали 2М НСІ, розсолом та висушували за допомогою безводного MgSO4. Розчинник концентрували та продукт безпосередньо застосовували на наступних етапах без подальшого очищення. Вихід: 35,5г (99%). 1Н ЯМР (400МГц, ХЛОРОФОРМ-D): d 3,81 (s, 3H), 7,02 (s, 1Н), 7,23 (m, 1Н), 7,72 (d, J = 8,59Гц, 1Н), 8,17 (dd, J = 6,35, 2,64Гц, 1Н). 29 86776 30 Етап С:Метил {3-нітро-4-[(тетрагідро-2Н-піранMgSO4. Залишок розчиняли в 25мл АсОН та нагрі4-ілметил)аміно]феніл}карбамат вали при 125°С протягом 1 години, застосовуючи мікрохвильову апаратуру Personal Chemistry. Розчинник випарювали. Залишок розчиняли в EtOAc та промивали водним розчином NaНСО3, розсолом та висушували за допомогою безводного MgSO4. Сирий продукт очищали флешхроматографією із силікагелем 4:3 / гексани:ацетон як елюент. Вихід: 1,81г (64%). 1Н ЯМР Метил (4-флуор-3-нітрофеніл)карбамат (2,0г, (400МГц, ХЛОРОФОРМ-D): d 1,48 - 1,54 (m, 4Н) 9,32ммоль) та 4-амінометилтетрагідропіран (1,28г, 1,56 (s, 9Н) 2,23 - 2,35 (m, 1Н) 3,27 - 3,35 (m, 2Н) 11,2ммоль) протягом 48 годин при 75°С перемішу3,78 (s, 3Н) 3,96 (t, J=2,93Гц, 1Н) 3,99 (t, J=3,03Гц, вали в 50мл ЕtOН, який містить TEA (2,0мл, 14,0ммоль). Розчинник випарювали. Залишок роз1Н) 4,18 (d, J=7,42Гц, 2Н) 6,63 (br.s, 1Н) 7,24 - 7,28 (m, 1Н) 7,41 (br.s, 1Н) 7,61 (d, J=1,95Гц, 1Н). чиняли в EtOAc та промивали водним 5% KHSO4, Етап F: 2-трет-Бутил-Н-метил-1-(тетрагідронасиченим водним розчином NaHCO3, розсолом 2Н-піран-4-ілметил)-1Н-бензімідазол-5-амін та висушували за допомогою безводного MgSO4. Сирий продукт очищали флеш-хроматографією із силікагелем 1:1 / гексани: EtOAc як елюент. Вихід: 2,53г (88%). 1Н ЯМР (400МГц, ХЛОРОФОРМ-D): d 1,42 (ddd, J=25,24, 12,06, 4,49Гц, 2Н), 1,73 (d, J=1,76Гц, 1H), 1,76 (d, J=1,95Гц, 1H), 1,88 - 2,01 (m, 1Н), 3,22 (dd, J=6,74, 5,57Гц, 2H), 3,42 (td, J=11,86, Метил [2-трет-бутил-1-(тетрагідро-2Н-піран-42,05Гц, 2H)3 3,78 (s, 3H), 4,01 (d, J=4,30Гц, 1Н), ілметил)-1Н-бензімідазол-5-іл]карбамат (1,80г, 4,04 (d, J=3,51Гц, 1Н), 6,48 (br.s, 1Н), 6,85 (d, 5,21ммоль) розчиняли в 75мл ТГФ при 0°С. 1М J=9,37Гц, 1Н), 7,65 (br.s, 1Н), 8,03 - 8,09 (m, 2Н). НСІ/етер (7,3мл, 7,29ммоль) додавали краплями Етап D: Метил {3-аміно-4-[(тетрагідро-2Нта розчин перемішували при 0°С протягом 15 хвипіран-4-ілметил)аміно]феніл}карбамат лин. LiAIH4 (988мг, 26,1ммоль) додавали повільно та розчин перемішували при кімнатній температурі протягом ночі. Реакцію гасили при 0°С додаванням МеОН (5мл) потім водою (10мл) та розчин залишали перемішуватися при кімнатній температурі для 30 хвилин. Додавали безводний Na2SO4 (10г) та розчин перемішували при кімнатній темМетил {3-нітро-4-[(тетрагідро-2Н-піран-4пературі ще 30 хвилин. Розчин фільтрували та ілметил)аміно]феніл}карбамат (2,53г, 8,18ммоль) розчинник випарювали. Залишок розчиняли в розчиняли в 50мл ЕtOАс, який містить каталітичну EtOAc та промивали водним розчином NaHCO3, кількість 10% Pd/C. Розчин струшували протягом розсолом та висушували за допомогою безводного ночі при кімнатній температурі в атмосфері Н2 MgSO4. Розчинник випарювали. Вихід: 1,54г (98%). 1 (40фунт/кв.дюйм), застосовуючи апарат Парра для Н ЯМР (400МГц, ХЛОРОФОРМ-D): d 1,49 - 1,53 гідрогенізації. Розчин фільтрували через целіт і (m, 4Н), 1,53 - 1,57 (m, 9Н), 2,22 - 2,32 (m, 1Н), 1 розчинник випарювали. Вихід: 2,29г (99%). Н ЯМР 2,87 (s, 3Н), 3,26 - 3,35 (m, 2Н), 3,95 (t, J=3,03Гц, (400МГц, ХЛОРОФОРМ-D): d 1,40 (ddd, J=25,09, 1Н), 3,97 - 4,00 (m, 1Н), 4,13 (d, J=7,42Гц, 2Н), 6,61 12,01, 4,49Гц, 2Н), 1,70 - 1,74 (m, 1Н), 1,74 - 1,77 (dd, J=8,59, 2,15Гц, 1H), 6,99 (d, J=1,95Гц, 1H), 7,11 (m, 1Н), 1,81 - 1,92 (m, 1Н), 2,99 (d, J=6,64Гц, 2H), (d, J=8,59Гц,1H). 3,34 (br.s, H), 3,41 (dt, J=11,81, 2,15Гц, 2H), 3,74 (s, Приклад 5: 3H), 3,99 (d, J=3,51Гц, 1Н), 4,02 J=3,51Гц, 1Н), 6,38 N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4(br.s, 1Н), 6,55 - 6,60 (m, 1Н), 6,62 - 6,68 (m, 1Н), ілметил)-1Н-бензімідазол-5-іл]-N-метил-26,95 (br.s, 1Н). піролідин-1-ілетансульфонамід Етап Е: Метил [2-трет-бутил-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензімідазол-5-іл]карбамат Метил {3-аміно-4-[(тетрагідро-2Н-піран-4ілметил)аміно]феніл}карбамат (2,29г, 8,20ммоль) та DMAP (0,20г, 1,64ммоль) розчиняли в 75мл DCM. Триметилацетилхлорид (1,10мл, 9,02 ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали водним розчином NaHCO3, розсолом та висушували за допомогою безводного 2-трет-Бутил-Н-метил-1-(тетрагідро-2Н-піран4-ілметил)-1Н-бензімідазол-5-амін (30мг, 0,0996ммоль) розчиняли в 2мл DCE, який містить піридин (0,012мл, 0,149ммоль). Додавали 2-хлор1-етансульфонілхлорид (0,012мл, 0,129ммоль) та розчин перемішували при кімнатній температурі протягом 3 години. Додавали піролідин (0,080мл, 0,996ммоль) та розчин перемішували при кімнатній температурі протягом 3 годин. Розчин промивали насиченим водним NaHCO3 розчином, роз 31 86776 32 солом та висушували за допомогою безводного - 1,68 (m, 2Н), 1,70 (s, 9Н), 1,73 - 1,84 (m, 3Н), 1,88 MgSO4. Продукт очищали реверсно-фазовою - 1,97 (m, 2Н), 2,34 - 2,42 (m, 1Н), 2,98 (t, ВЕРХ, застосовуючи 10-50% CH3CN/H2O та ліофіJ=11,72Гц, 2Н) 3,35 (td, J=11,57, 2,44Гц, 2Н) 3,45 лзували, що дало названу сполуку як відповідну (s, 3Н) 3,50 - 3,53 (m, 2Н), 3,54 - 3,59 (m, 2Н), 3,68 сіль трифлуороцтової кислоти. Вихід: 44мг (77%). - 3,74 (m, 2Н), 3,93 (d, J=3,12Гц, 1H), 3,96 (d, 1 Н ЯМР (400МГц, МЕТАНОЛ-: d 1,50 -1,56 (m, 2Н), J=2,15Гц, 1H), 4,56 (d, J=7,42Гц, 2H), 7,71 (dd, 1,56 - 1,64 (m, 2Н), 1,68 (s, 9Н), 2,00 - 2,08 (m, 2Н), J=8,98, 2,15Гц, 1H), 7,89 (d, J=1,765Гц, 1H), 8,00 (d, 2,09 - 2,20 (m, 2Н), 2,32 - 2,43 (m, 1Н), 3,06 - 3,21 J=8,98Гц, 1H); MC (ІЕР) (М+Н)+ 477,0; Анал.розрах. (m, 2Н), 3,35 (td, J=11,67, 2,25Гц, 2Н), 3,45 (s, 3Н), для C25H40N4O3S + 3,4 TFA + 0,9 Н2О: С, 43,38; Н, 3,63 - 3,77 (m, 6Н), 3,93 (d, J=3,12Гц, 1Н), 3,96 (d, 5,17; N, 6,36. Знайдено: С, 43,41; Н, 5,14; N, 6,36. J=3,12Гц, 1Н), 4,53 (d, J=7,62Гц, 2Н), 7,66 (dd, Приклад 8 J=8,98, 1,95Гц, 1Н), 7,84 (d, J=1,56Гц, 1Н), 7,95 (d, N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4J=8,98Гц, 1H);) MC(IEP)(M+H)+463,1. ілметил)-1Н-бензімідазол-5-іл]-2-метокси-NПриклад 6: метилетансульфонамід N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензімідазол-5-іл]-N-метил-2морфолін-4-ілетансульфонамід Способом з прикладу 5, застосовуючи 2-третбутил-N-метил-1-(тетрагідро-2Н-піран-4-ілметил)1Н-бензімідазол-5-амін (36мг, 0,119ммоль), 2хлор-1-етансульфонілхлорид (0,015мл, 0,143ммоль), піридин (0,015мл, 0,179ммоль) та морфолін (0,050мл, 0,595ммоль) у 3мл DCE. Продукт очищали реверсно-фазовою ВЕРХ, застосовуючи 10-50% CH3CN/H2O та ліофілзували, що дало названу сполуку як відповідну сіль трифлуороцтової кислоти. Вихід: 42мг (50%). 1Н ЯМР (400МГц, МЕТАНОЛ-: d 1,51 - 1,57 (m, 2Н), 1,58 1,66 (m, 2Н), 1,69 (s, 9Н), 2,33 - 2,42 (m, 1Н), 3,31 3,40 (m, 4Н), 3,45 (s, 3Н), 3,57 - 3,63 (m, 2Н), 3,68 3,75 (m, 2Н), 3,89 (br.s, 2Н), 3,93 (d, J=3,51Гц, 1Н), 3,96 (d, J=2,34Гц, 1Н), 4,55 (d, J=7,62Гц, 2Н), 7,70 (dd, J=8,98, 1,95Гц, 1Н), 7,86 (d, J=2,15Гц, 1Н), 7,99 (d, J=8,98Гц, 1Н); МС (IEP) (М+Н)+479,0; Анал.розрах. для C24H38N4O4S + 2,5 TFA + 1,0 Н2О: С, 44,56; Н, 5,48; N, 7,17. Знайдено: С, 44,53; Н, 5,38; N, 7,26. Приклад 7 N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензімідазол-5-іл]-N-метил-2піперидин-1-ілетансульфонамід Способом з прикладу 5, застосовуючи 2-третбутил-N-метил-1-(тетрагідро-2Н-піран-4-ілметил)1Н-бензімідазол-5-амін (130мг, 0,431ммоль), 2хлор-1-етансульфонілхлорид (0,054мл, 0,517ммоль), піридин (0,052мл, 0,647ммоль) та піперидин (0,213мл, 2,16ммоль) у 5мл DCE. Продукт очищали реверсно-фазовою ВЕРХ, застосовуючи 10-50% CH3CN/H2O та ліофілзували, що дало названу сполуку як відповідну сіль трифлуороцтової кислоти. Вихід: 52мг (20%). 1Н ЯМР (400МГц, МЕТАНОЛ-D4): d 1,52 - 1,58 (m, 2Н), 1,59 Способом з прикладу 5, застосовуючи 2-третбутил-N-метил-1-(тетрагідро-2Н-піран-4-ілметил)1Н-бензімідазол-5-амін (60мг, 0,199ммоль), 2хлор-1-етансульфонілхлорид (0,024мл, 0,299ммоль), піридин (0,024мл, 0,299ммоль) та 2М NaOMe/MeOH (0,5мл) у 3мл DCE. Розчинник випарювали. Залишок розчиняли в EtOAc та промивали насиченим водним NaHCO3 розчином, розсолом та висушували за допомогою безводного MgSO4. Продукт очищали реверсно-фазовою ВЕРХ, застосовуючи 10-50% CH3CN/H2O та ліофілзували, що дало названу сполуку як відповідну сіль трифлуороцтової кислоти. Вихід: 20мг (20%). 1Н ЯМР (400МГц, METAHOЛ-D4): d 1,52 - 1,57 (m, 2Н), 1,57 - 1,63 (m, 2Н), 1,67 (s, 9Н), 2,35 - 2,41 (m, 1Н), 3,32 - 3,35 (m, 4Н), 3,36 (s, 3Н), 3,38 (s, 3Н), 3,75 (t, J-5,57Гц, 2Н), 3,93 (d, J=3,51Гц, 1Н), 3,95 (d, J=3,71Гц, 1Н), 4,52 (d, J=7,62Гц, 2Н), 7,66 (dd, J=8,98, 2,15Гц, 1Н), 7,83 (d, J-1,95Гц, 1Н), 7,92 (d, J=9,18Гц, 1Н); MC (IEP) (М+Н)+ 424,0; Анал.розрах. для C21H33N3O4S + 1,2 TFA + 0,9 Н2О: С, 48,74; Н, 6,29; N, 7,29. Знайдено: С, 48,69; Н, 6,19; N, 7,50. Приклад 9 Продукт А: N-[2-трет-Бутил-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензімідазол-5-іл]-2-[(2гідроксиетил)аміно]-N-метилетансульфонамід Продукт В: 2-(2-Аміноетокси)-N-[2-трет-бутил1-(тетрагідро-2Н-піран-4-ілметил)-1Нбензімідазол-5-іл]-N-метилетансульфонамід Способом з прикладу 5, застосовуючи 2-третбутил-N-метил-1-(тетрагідро-2Н-піран-4-ілметил)1Н-бензімідазол-5-амін (33мг, 0,109ммоль), 2 33 86776 34 хлор-1-етансульфонілхлорид (0,014мл, 0,131ммоль), піридин (0,013мл, 0,164ммоль) та етаноламін (0,066мл, 1,09ммоль) у 3 мл DCE. Продукт очищали реверсно-фазовою ВЕРХ, застосовуючи 10-50% CH3CN/H2O та ліофілзували, що дало названі сполуки як відповідні солі TFA. Вихід: Продукт А: 37мг (60%); Продукт В: 14мг (23%). Продукт А: 1Н ЯМР (400МГц, МЕТАНОЛ-D4): d 1,51 - 1,57 (m, 2Н), 1,56 - 1,63 (m, 2Н), 1,68 (s, Етап А: N-{2-трет-Бутил-1-[(4,49Н), 2,33 - 2,42 (m, 1Н), 3,16 - 3,21 (m, 2Н), 3,35 (td, дифлуорциклогексил)метил]-1Н-бензімідазол-51=11,57, 2,44Гц, 2Н), 3,45 (s, 3Н), 3,49 - 3,55 (m, іл}-N-метилбутан-1-сульфонамід 2Н), 3,59 - 3,64 (m, 2Н), 3,75 - 3,80 (m, 2Н), 3,93 (d, J=3,12Гц, 1Н), З,96 (d, J=2,73Гц, 1Н), 4,54 (d, J=7,62Гц, 2Н), 7,68 (dd, 1=8,98, 1,95Гц, 1Н), 7,85 (d, J=1,56Гц, 1Н), 7,97 (d, J=8,79Гц, 1Н); МС (IEP) (М+Н)+453,0; Анал.розрах. для C22H36N4O4S + 2,6 TFA + 1,5 Н2О: С, 42,10; Н, 5,40; N, 7,22. Знайдено: С, 42,02; Н, 5,25; N, 7,41. Продукт В: 1Н ЯМР 2-трет-Бутил-1-[(4,4(400МГц, МЕТАНОЛ-D4): d 1,50 - 1,56 (m, 2Н), 1,55 дифлуорциклогексил)метил]-N-метил-1Н- 1,64 (m, 2Н), 1,66 (s, 9Н), 2,33 - 2,41 (m, 1Н), 3,07 бензімідазол-5-амін (для отримання див. наступні (s, 3Н), 3,18 (t, J=5,66Гц, 2Н), 3,31 - 3,40 (m, 4Н), етапи В, С, D, Е, F та г) (46мг, 0,137ммоль) та 13,62 (t, J=5,57Гц, 2Н), 3,90 - 3,97 (m, 4Н), 4,47 (d, бутансульфонілхлорид (0,063мл, 0,411ммоль) пеJ=7,62Гц, 2Н), 6,90 (d, J=2,34Гц, 1Н), 7,16 (dd, ремішували в 3мл DCM, який містить каталітичну J=9,37, 2,34Гц, 1Н), 7,75 (d, J=9,37Гц, 1Н); МС кількість DMAP при кімнатній температурі протя(IEP) (М+Н)+453,0; Анал.розрах. для C22H36N4O4S + гом 6 годин. Розчинник випарювали та продукт 1,5 TFA: С, 48,15; Н, 6,06; N, 8,97. Знайдено: С, очищали реверсно-фазовою ВЕРХ, застосовуючи 48,34; Н, 6,22; N, 8,57. 10-75% CH3CN/H2O та ліофілзували, що дало наПриклад 10 звану сполуку як відповідну сіль трифлуороцтової N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4кислоти. Вихід: 48мг (62%): 1Н ЯМР (400МГц, МЕілметил)-1Н-бензімідазол-5-іл]-NТАНОЛ-D4): d 0,92 (t, J=7,32Гц, 3H), 1,43 (td, метилетиленсульфонамід J=14,94, 7,42Гц, 2H), 1,52 - 1,63 (m, 2H), 1,69 (s, Способом з прикладу 5, застосовуючи 2-трет9H), 1,70 - 1,76 (m, 4H), 1,76-1,84 (m, 2H), 2,02-2,12 бутил-N-метил-1-(тетрагідро-2Н-піран-4-ілметил)(m, 2H), 2,22 - 2,31 (m, 1H), 3,10-3,17 (m, 2Н), 3,41 1Н-бензімідазол-5-амін (49мг, 0,163ммоль), 2(s, 3Н), 4,56 (d, J=7,62Гц, 2Н), 7,69 (dd, J=8,98, хлор-1-етансульфонілхлорид (0,022мл, 2,15Гц, 1H), 7,82 (d, J=1,76Гц, 1H), 7,96 (d, 0,212ммоль), піридин (0,020мл, 0,245ммоль) та 2М J=9,18Гц, 1H); МС (IEP) (М+Н)+456. амоній/ЕtOН (Q, 5мл) у 3мл DCE. Розчинник випаЕтап В: трет-Бутил [(4,4рювали. Залишок розчиняли в EtOAc та промивадифлуорциклогексил)метил]карбамат ли насиченим водним розчином NaHCO3, розсолом та висушували за допомогою безводного MgSO4. Продукт очищали реверсно-фазовою ВЕРХ, застосовуючи 10-60% CH3CN/H2O та ліофілзували, що дало названу сполуку як відповідну сіль трифлуороцтової кислоти. Вихід: 34мг (41%). 1 Н ЯМР (400МГц, МЕТАНОЛ-D4): d 1,52 - 1,58 (m, 2Н), 1,58 - 1,67 (m, 2Н), 1,69 (s, 9Н), 2,34 - 2,43 (m, 4-Н-Вос-амінометил циклогексанон (1.00г, 1Н), 3,32 (s, ЗН), 3,33 - 3,39 (m, 2Н), 3,93 (d, 4,4ммоль) розчиняли в 30мл DCM при 0°С. DAST J=3,12Гц, 1Н), 3,95 (d, J=3,52Гц, 1Н), 4,55 (d, (1,45мл, 11,0ммоль) додавали краплями та розчин J=7,42Гц, 2Н), 6,10 (d, J=8,79Гц, 1Н), 6,13 (d, перемішували при кімнатній температурі протягом J=2,15Гц, 1Н), 6,70 (dd, J=16,50, 10,06Гц, 1Н), 7,61 ночі. Розчин промивали 5% водним розчином (dd, J=8,98, 2,15Гц, 1Н), 7,76 (d, J=1,56Гц, 1Н), 7,96 KHSO4, насиченим водним розчином NaHCO3, + (d, J-8,98Гц, 1Н); МС (IEP) (М+Н) 392,0; розсолом та висушували за допомогою безводного Анал.розрах. для C20H29N3O3S + 1,3 TFA + 0,3 Н2О: MgSO4. Сирий продукт очищали флешС, 49,79; Н, 5,71; N, 7,71. Знайдено: С, 49,81; Н, хроматографією із силікагелем 3:1 / гексани: 5,77; N, 7,74. ЕtOАс, як елюент. Вихід: 508мг (46%). 1Н ЯМР Приклад 11 (400МГц, ХЛОРОФОРМ-D): d 1,19-1,36 (m, 2Н), N-{2-трет-Бутил-1-[(4,41,44 (s, 9Н), 1,51 -1,56 (m, 1Н), 1,59 - 1,75 (m, 2Н), дифлуорциклогексил)метил]-1Н-бензімідазол-51,75 - 1,84 (m, 2Н), 2,01 - 2,16 (m, 2Н), 3,03 (t, іл}-N-метилбутан-1-сульфонамід J=6,54Гц, 2Н), 4,62 (br.s, 1Н). Етап С: [(4,4-дифлуорциклогексил)метил]амін гідрохлорид 35 трет-Бутил [(4,4дифлуорциклогексил)метил]карбамат (505мг, 2,03ммоль) перемішували в 5мл 1М НСІ/АсОН при кімнатній температурі протягом 2 годин. Розчинник випарювали. Залишок промивали етером, фільтрували та висушували. Вихід: 330мг (88%). 1Н ЯМР (400МГц, МЕТАНОЛ-D4): d 1,28 - 1,40 (m, 2Н), 1,71 - 1,82 (m, 2Н), 1,84 (d, J=3,12Гц, 2Н), 1,86 1,89 (m, 1Н), 2,03 - 2,15 (m, 2Н), 2,85 (d, J=7,03Гц, 2Н). Етап D: Метил (4-{[(4,4дифлуорциклогексил)метил]аміно}-3нітрофеніл)карбамат Відповідно тому ж способу, як у Етапи С Прикладу 4, застосовуючи [(4,4дифлуорциклогексил)метил]амін гідрохлорид (210мг, 1,12ммоль), метил (4-флуор-3нітрофеніл)карбамат (200мг, 0,934ммоль) та TEA (0,390мл, 2,80ммоль) у 10мл ЕtOН. Сирий продукт очищали флеш-хроматографією із силікагелем 5% етер/DCM, як елюент. Вихід: 200мг (62%). 1Н ЯМР (400МГц, ХЛОРОФОРМ-D): d 1,34 - 1,47 (m, 2Н), 1,65 - 1,75 (m, 2Н), 1,78 - 1,85 (m, 1Н), 1,90 - 1,93 (m, 1Н), 1,94 - 1,97 (m, 1Н), 2,10 - 2,21 (m, 2Н), 3,23 (dd, J=6,64, 5,66Гц, 2Н), 3,78 (s, 3Н), 6,48 (br.s, 1Н), 6,83 (d, 7=9,18Гц, 1Н), 7,66 (br.s, 1Н), 8,05 (br.s, 1Н), 8,07 (d, J=2,54Гц, 1Н). Етап Е: Метил (3-аміно-4-{[(4,4дифлуорциклогексил)метил]аміно}феніл)карбамат Відповідно тому ж способу, як у Етапи D Прикладу 4, застосовуючи метил (4-{[(4,4дифлуорциклогексил)метил]аміно}-3нітрофеніл)карбамат (200мг, 0,583ммоль) та каталітичну кількість 10% Pd/C у 20мл ЕtOАс. Вихід: 185мг (99%). МС (ІЕР) (М+Н)+ 314,29. Етап F: Метил {2-трет-бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензімідазол-5іл}карбамат 86776 36 Метил (3-аміно-4-{[(4,4дифлуорциклогексил)метил]аміно}феніл)карбамат (185мг, 0,590ммоль) та DMAP (15мг, 0,118ммоль) розчиняли в 10мл DCM. Триметилацетилхлорид (0,080мл, 0,649ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали водним розчином NaHCO3, розсолом та висушували за допомогою безводного MgSO4. Розчинник концентрували. Залишок розчиняли в 4мл DCE та додавали Р2О5 (каталітичну) та розчин нагрівали при 125°С протягом 1 години, застосовуючи мікрохвильову апаратуру Personal Chemistry. Розчин промивали водним розчином NaHCO3, розсолом та висушували за допомогою безводного MgSO4. Сирий продукт очищали флеш-хроматографією із силікагелем 50-75% ЕtOАс / гексани. Вихід: 122мг (54%); 1Н ЯМР (400МГц, ХЛОРОФОРМ-D): d 1,43 1,52 (m, 2Н), 1,55 (s, 9Н), 1,57 - 1,66 (m, 2Н), 1,67 1,74 (m, 2Н), 2,08 - 2,18 (m, 3Н), 3,79 (s, 3Н), 4,19 (d, J=7,42Гц, 2Н), 6,63 (br.s, 1Н), 7,23 (d, J=8,79Гц, 1H), 7,37 - 7,46 (m, 1Н), 7,62 (d, J=1,76Гц, 1Н). Етап G: 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-N-метил-1Нбензімідазол-5-амін Метил {2-трет-бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензімідазол-5іл}карбамат (115мг, 0,303ммоль) розчиняли в 10мл ТГФ при 0°С. Додавали 1М НСІ/етер (0,425мл, 0,424ммоль) та розчин перемішували при 0°С протягом 15 хвилин. Повільно додавали LiAIH4 (57мг, 1,52ммоль) і розчин перемішували при кімнатній температурі протягом ночі. Реакцію гасили при 0°С додаванням МеОН (1мл) та водою (2мл). Додавали безводну Na2SO4 (5,0г) та розчин перемішували при кімнатній температурі протягом 30 хвилин. Розчин фільтрували та розчинник випарювали. Залишок розчиняли в ЕtOАс та промивали насиченим водним розчином NaHCO3, розсолом та висушували за допомогою безводного MgSO4. Вихід: 95мг (93%). 1Н ЯМР (400МГц, ХЛОРОФОРМ-D): d 1,41 - 1,51 (m, 2Н), 1,54 (s, 9Н), 1,57 1,67 (m, 2Н), 1,68 - 1,76 (m,3Н), 2,07 - 2,17 (m, 3Н), 2,87 (s, 3Н), 4,15 (d, J=7,42Гц, 2Н), 6,61 (dd, J=8,59, 2,34Гц, 1H), 7,01 (d, J=1,95Гц, 1H), 7,09 (d, J=8,59Гц, 1H). Приклад 12 N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензімідазол-5іл}-N-метил-2-піперидин-1-ілетансульфонамід 37 86776 38 промивали насиченим водним розчином NаНСО3, розсолом та висушували за допомогою безводного MgSO4. Продукт очищали реверсно-фазовою ВЕРХ, застосовуючи 10-50% CH3CN/H2O та ліофілзували, що дало названу сполуку як відповідну сіль трифлуороцтової кислоти. Вихід: 40мг (48%). 1 Н ЯМР (400МГц, МЕТАНОЛ-D4): d 1,53 - 1,63 (m, 3Н), 1,68 (s, 9Н), 1,71 - 1,77 (m, 4Н), 1,77 - 1,85 (m, 2-трет-Бутил-1-[(4,43Н), 1,90 - 1,97 (m, 2Н), 2,03 - 2,12 (m, 2Н), 2,20 дифлуорциклогексил)метил]-N-метил-1Н2,30 (m, 1Н), 2,94 - 3,04 (m, 2Н), 3,45 (s, 3Н), 3,51 бензімідазол-5-амін (45мг, 0,134ммоль) та піридин 3,59 (m, 4Н), 3,67 - 3,73 (m, 2Н), 4,55 (d, J=7,62Гц, (0,022мл, 0,268ммоль) розчиняли в 3мл DCE. До2Н), 7,68 (dd, J=8,98, 2,15Гц, 1H), 7,86 (d, J=1,95Гц, давали 2-Хлор-1-етансульфонілхлорид (0,021мл, 1H), 7,95 (d, J=8,98Гц, 1H); МС (IEP) (М+Н)+ 511,0; 0,201ммоль) та розчин перемішували при кімнатАнал.розрах. для, 5 C25H40N4O2SF2 + 2,7 TFA + 1,0 ній температурі протягом 2 годин. Додавали піпеН2О: С, 45,08; Н, 5,39; N, 6,70. Знайдено: С, 45,01; ридин (0,066мл, 0,670ммоль) та розчин перемішуН, 5,32; N, 7,00. вали при 75°С протягом 2 годин. Розчин Комп’ютерна верстка А. Крижанівський Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzimidazole derivatives, compositions containing them, preparation thereof and uses thereof
Автори англійськоюLiu Ziping, Page Daniel, Walpole Christopher, Yang Hua
Назва патенту російськоюПроизводные бензимидазола, фармацевтическая композиция, которая их содержит, способ их получения и применение
Автори російськоюЛю Зипинг, Пеидж Дениэл, Волпоул Кристофер, Янг Хуа
МПК / Мітки
МПК: A61K 31/4184, A61P 25/00, C07D 405/06, C07D 235/08
Мітки: бензимідазолу, фармацевтична, яка, композиція, застосування, спосіб, містить, отримання, похідні
Код посилання
<a href="https://ua.patents.su/19-86776-pokhidni-benzimidazolu-farmacevtichna-kompoziciya-yaka-kh-mistit-sposib-kh-otrimannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні бензімідазолу, фармацевтична композиція, яка їх містить, спосіб їх отримання та застосування</a>
Попередній патент: Спосіб очищення розчину альфа-1-антитрипсину
Наступний патент: 6-алкеніл- та 6-фенілалкілзаміщені 2-хінолінони та 2-хіноксалінони як інгібітори полі(адф-рибоза)полімерази
Випадковий патент: Пристрій для вимірювання параметрів вібрації машин