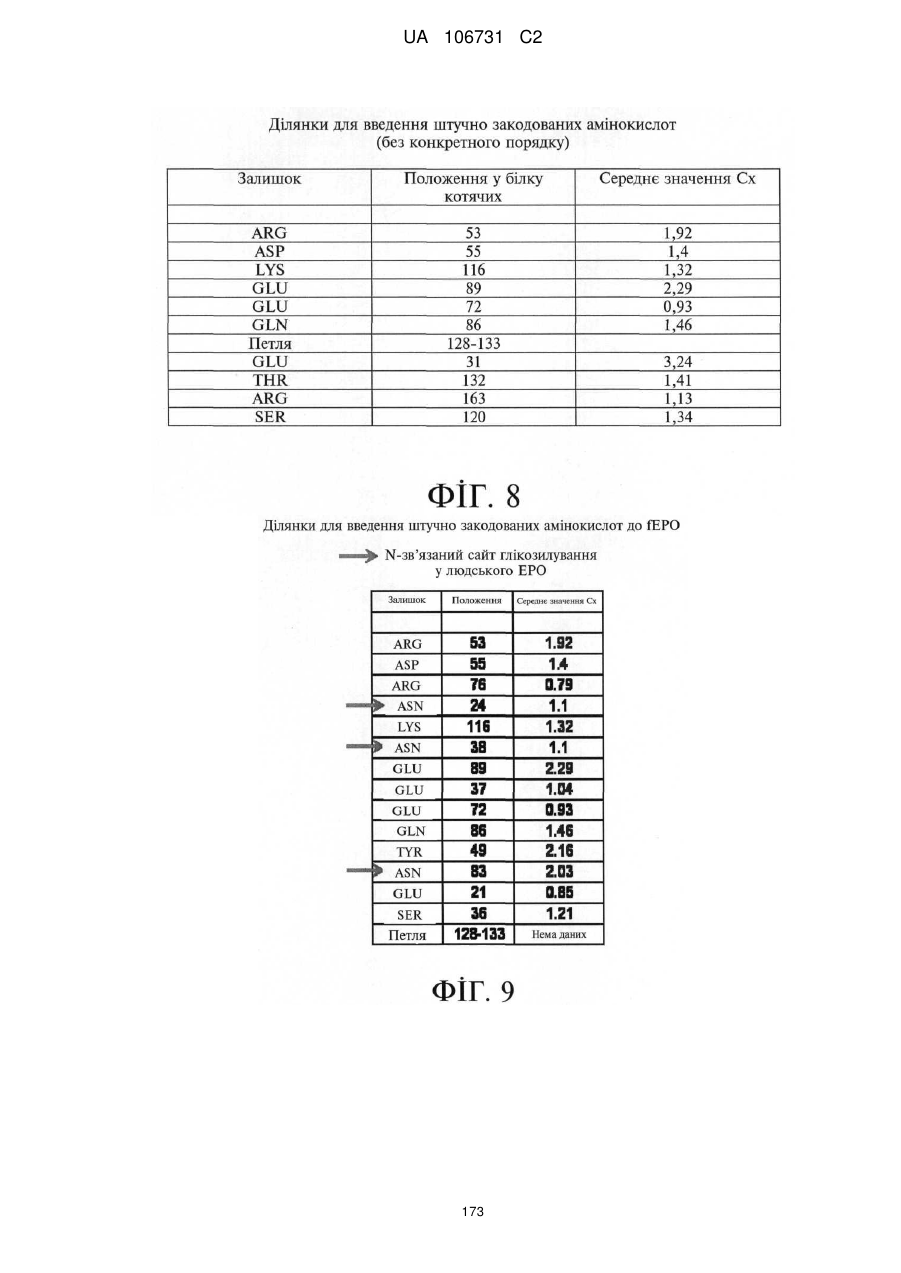
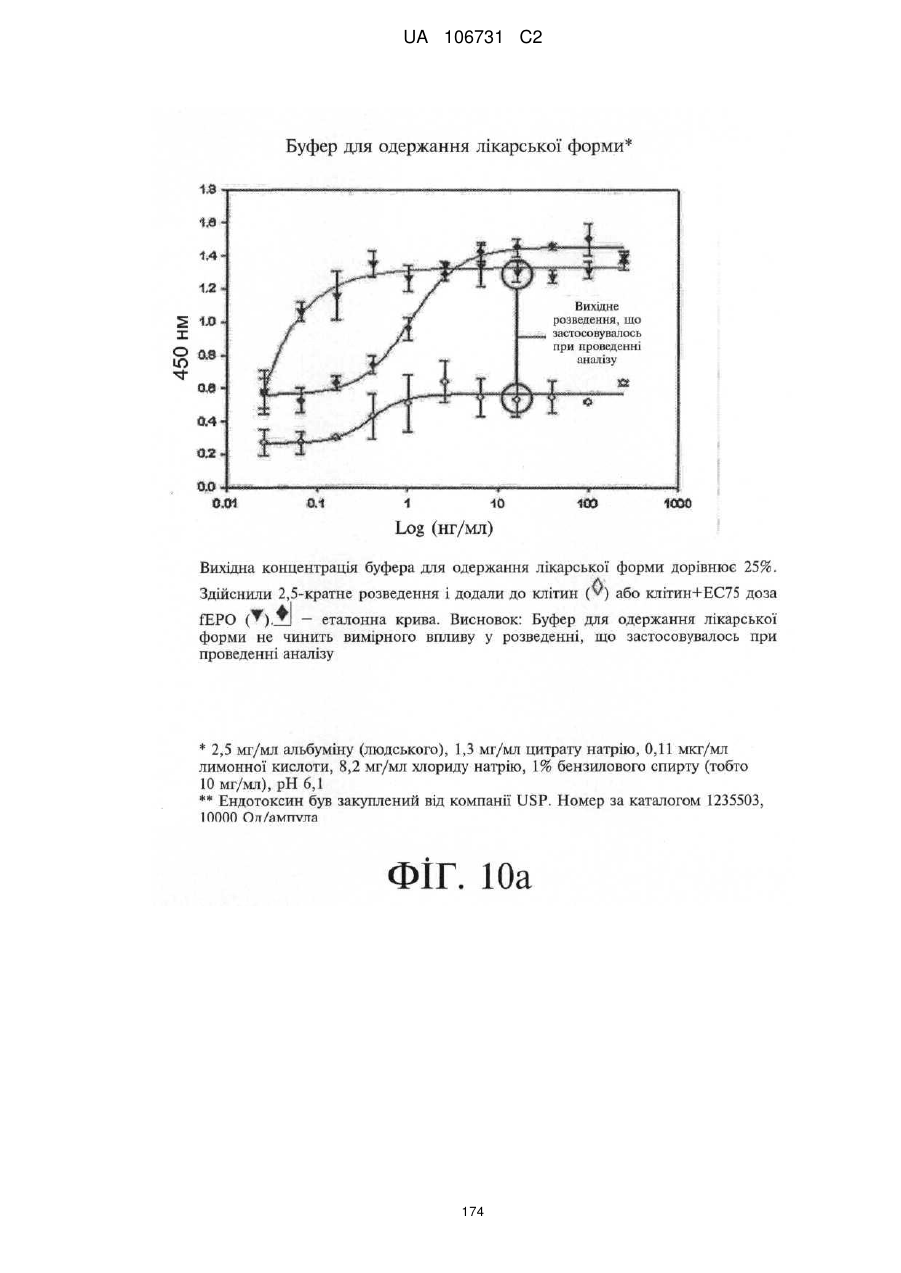
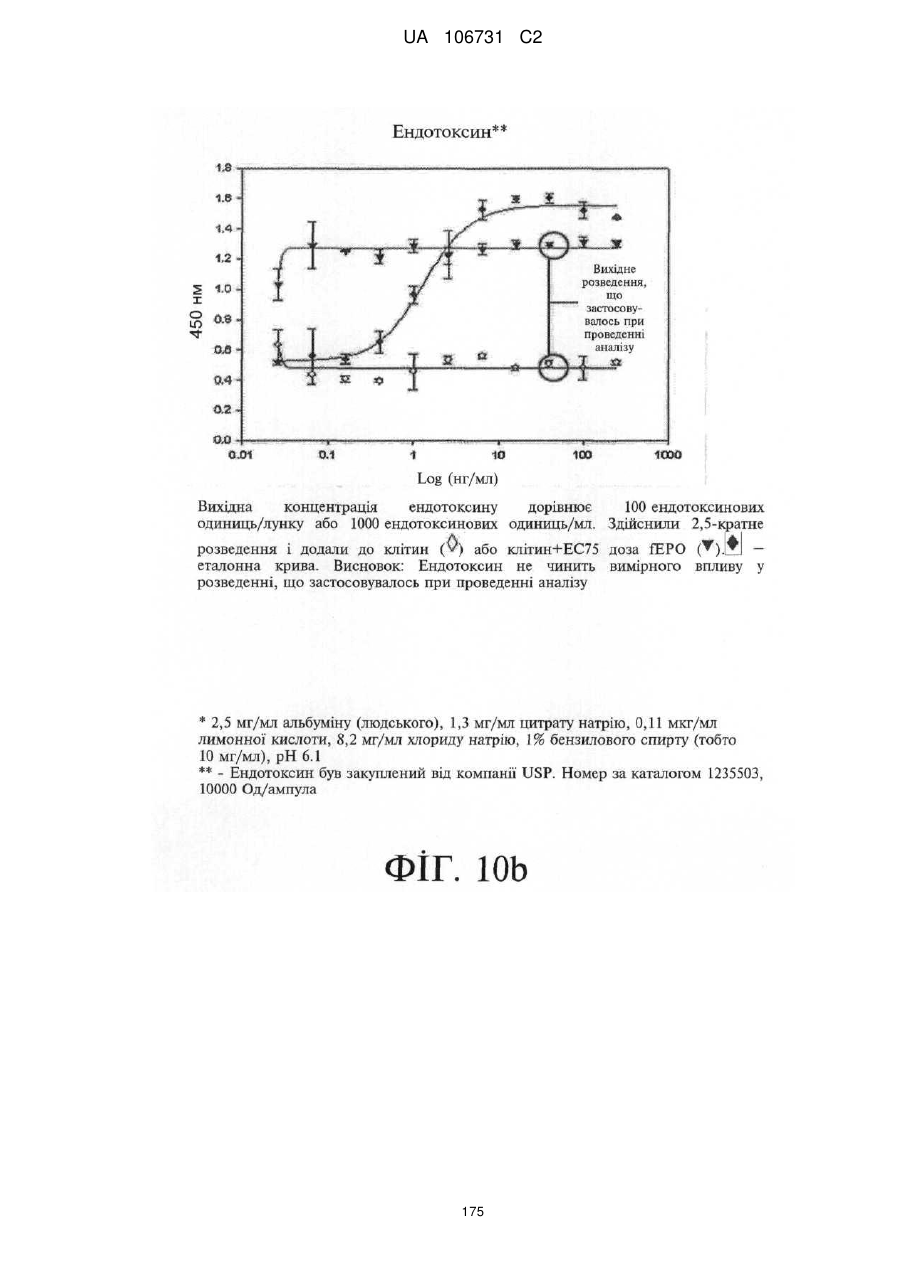
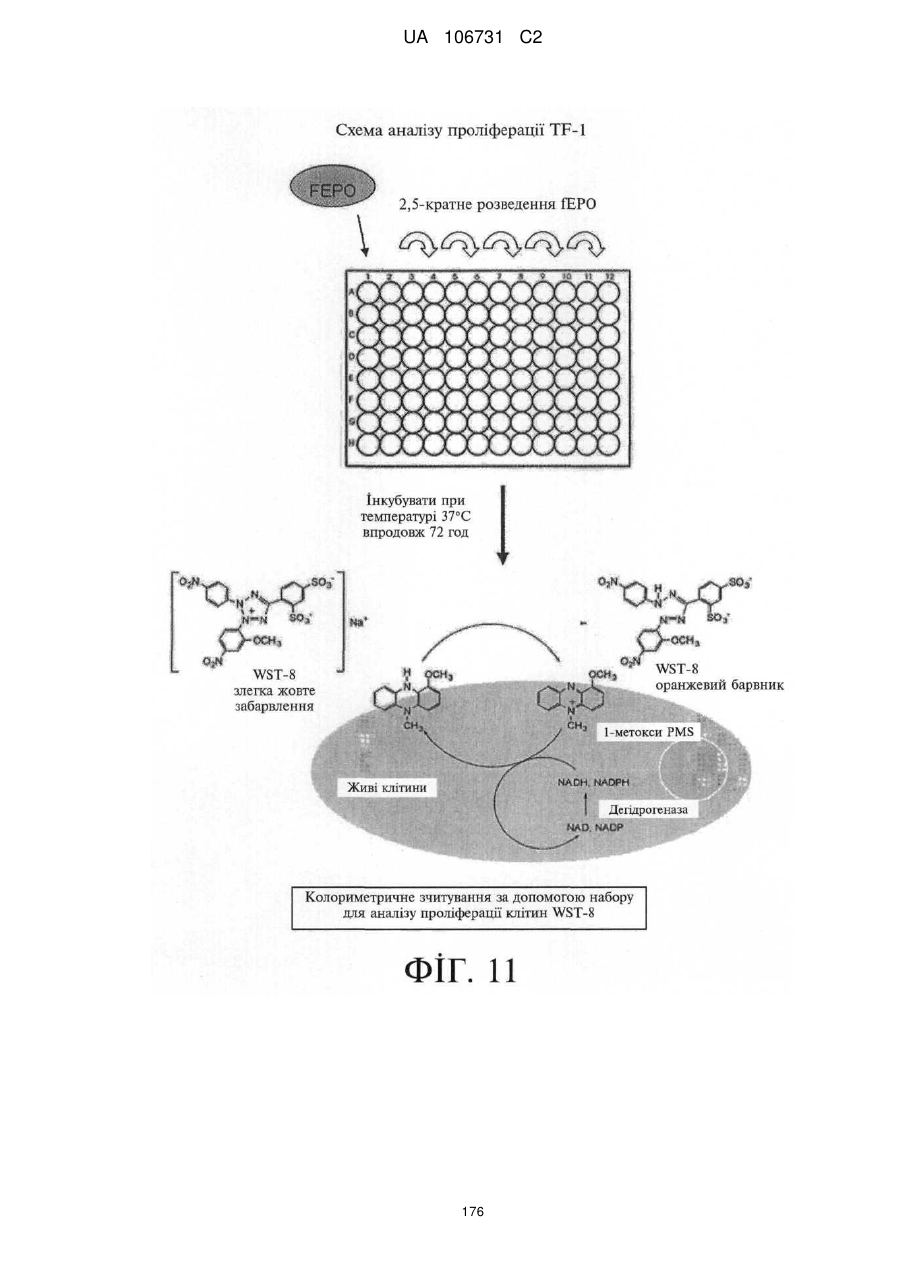
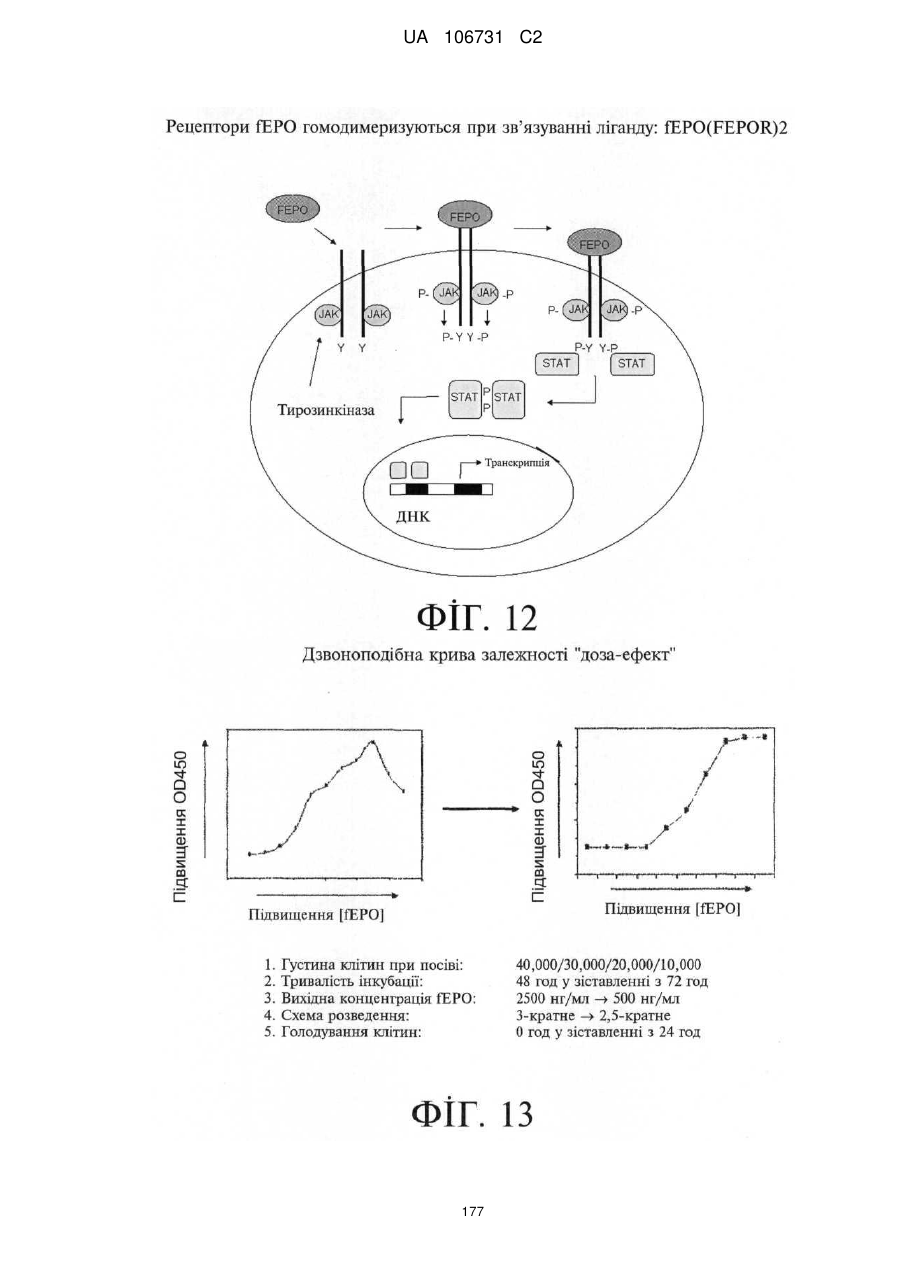
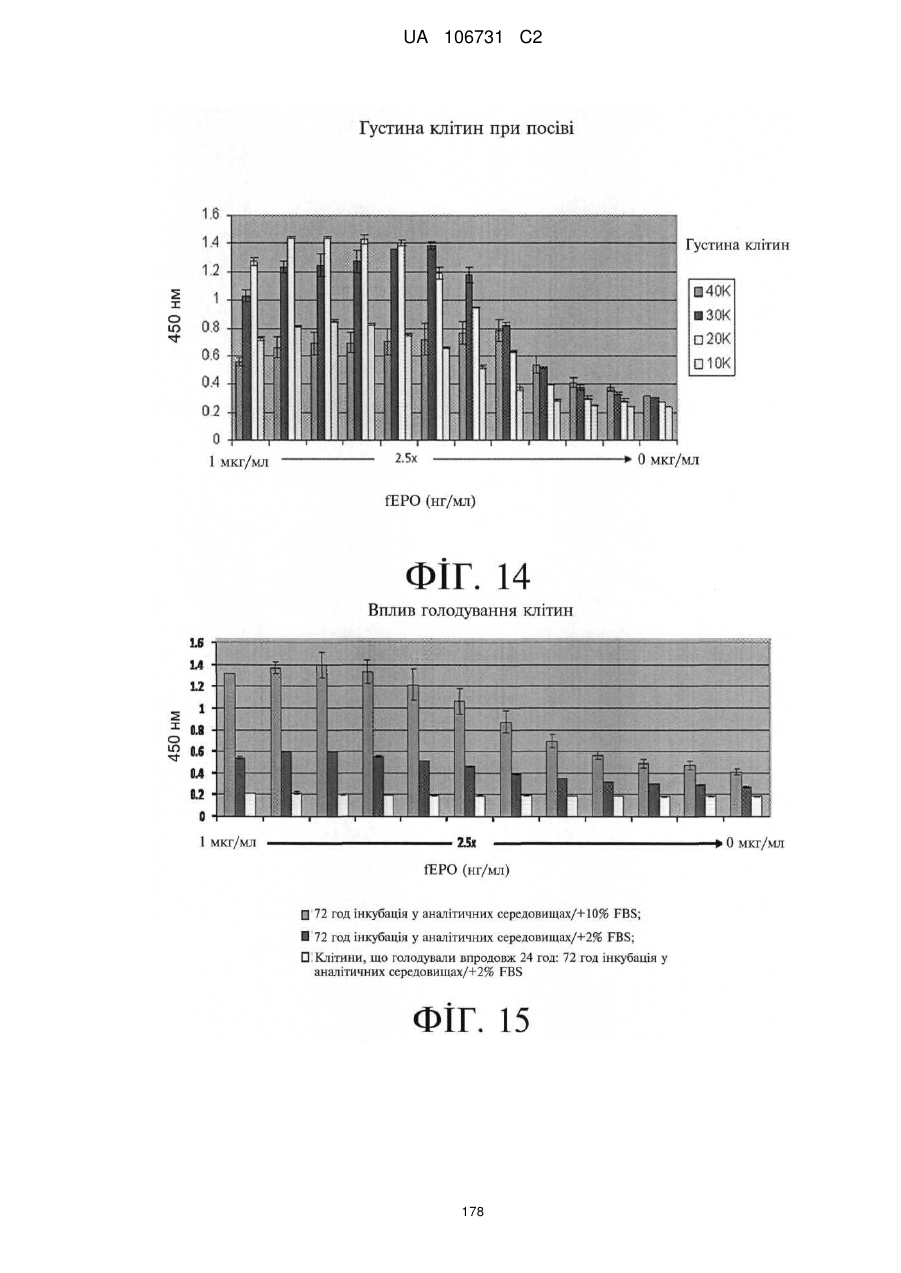
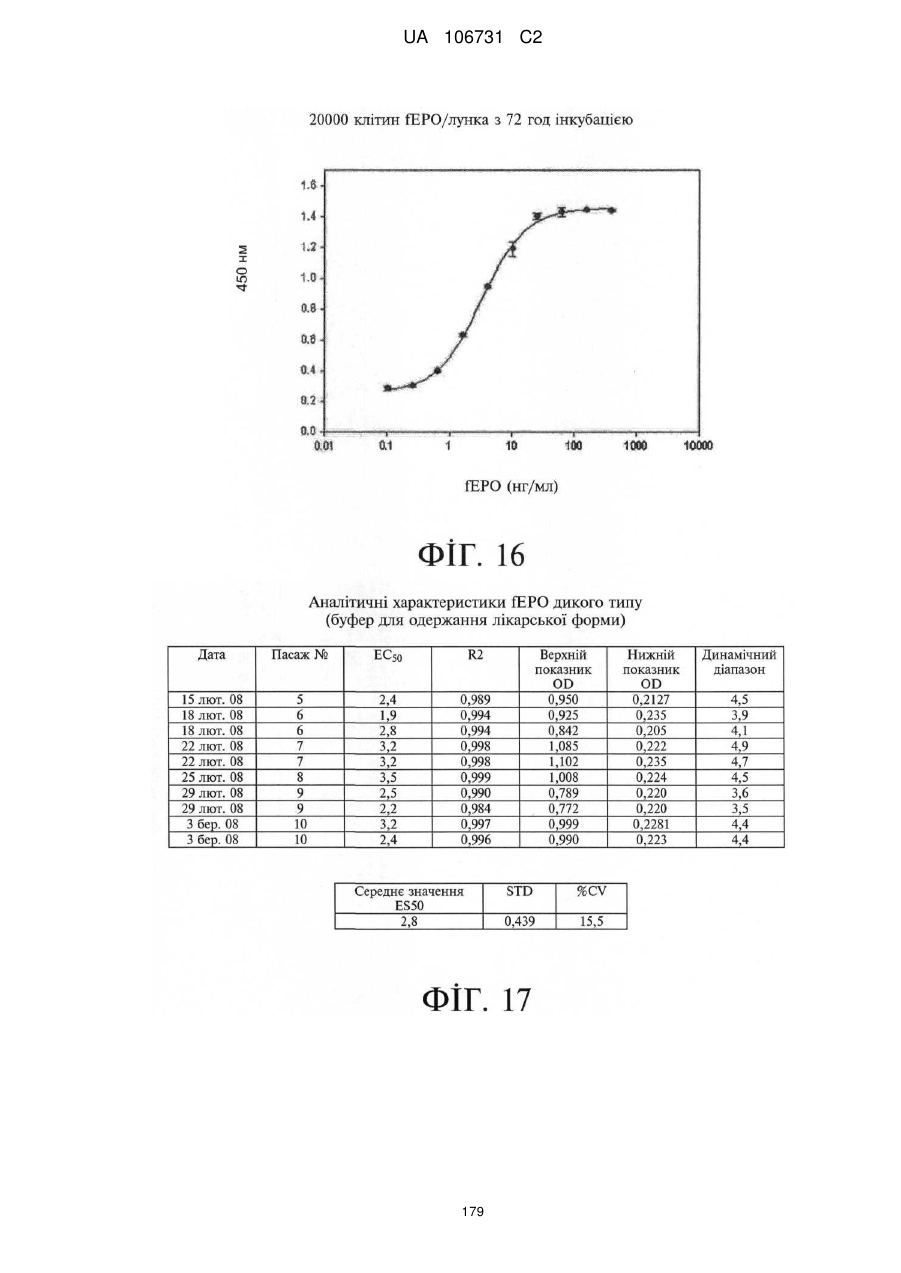
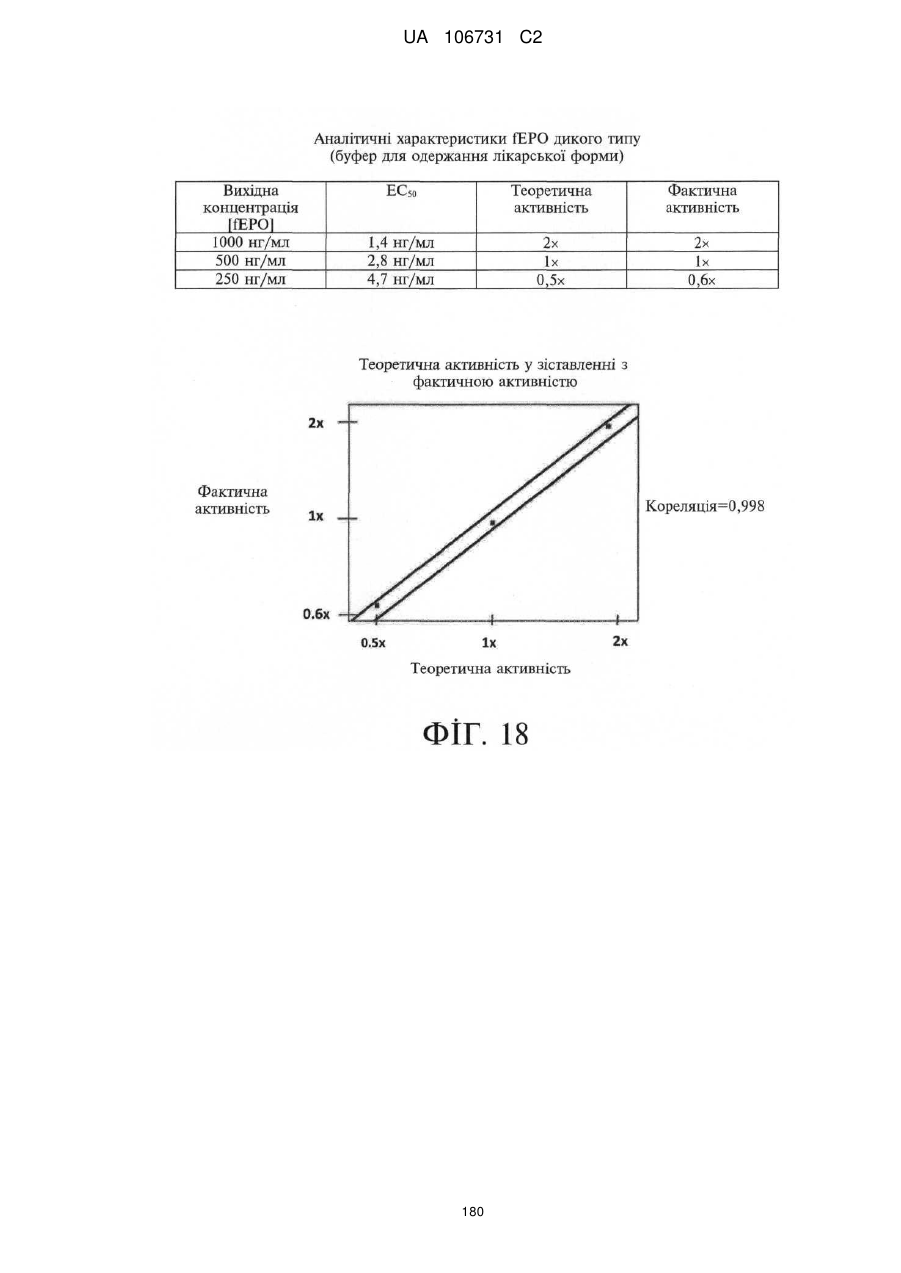
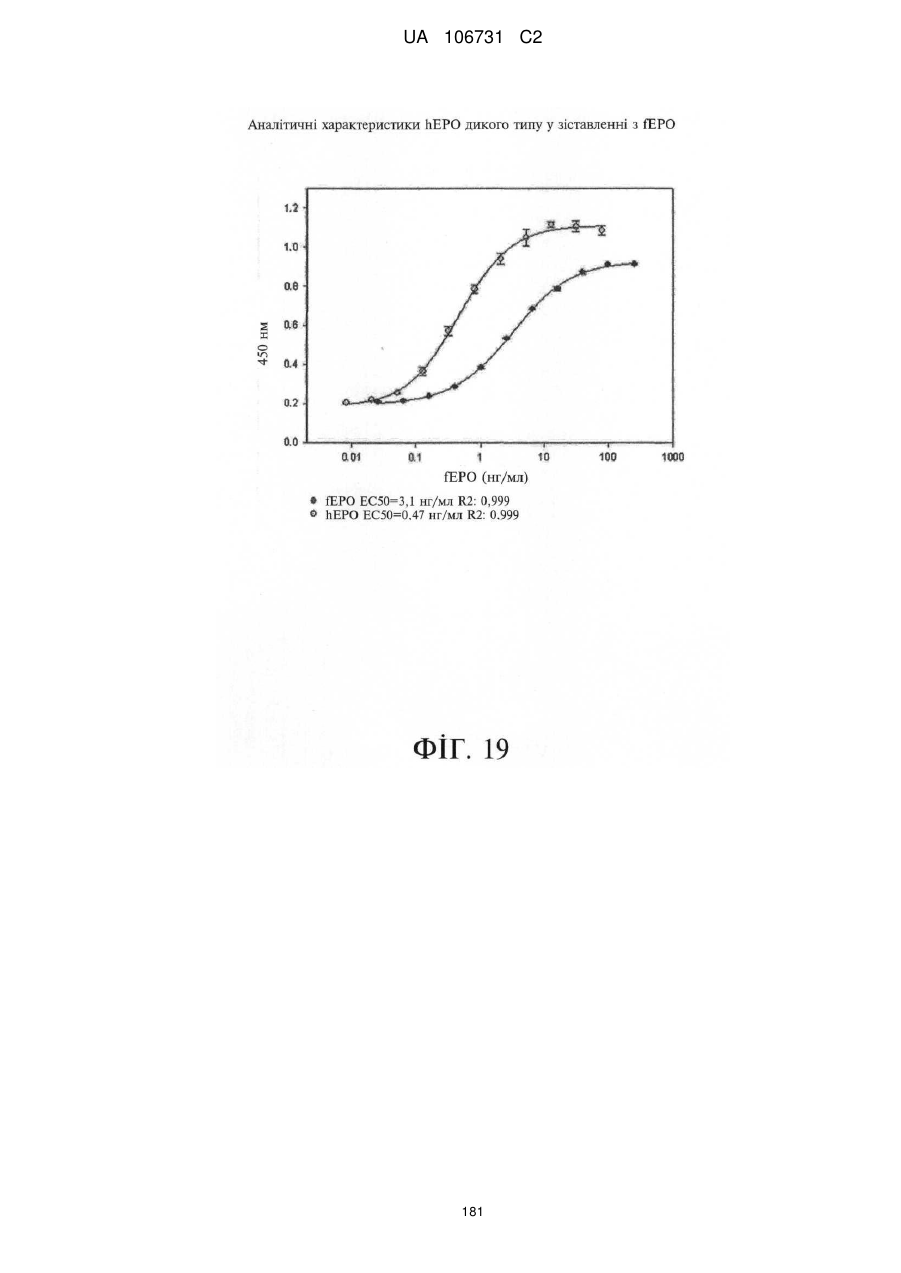
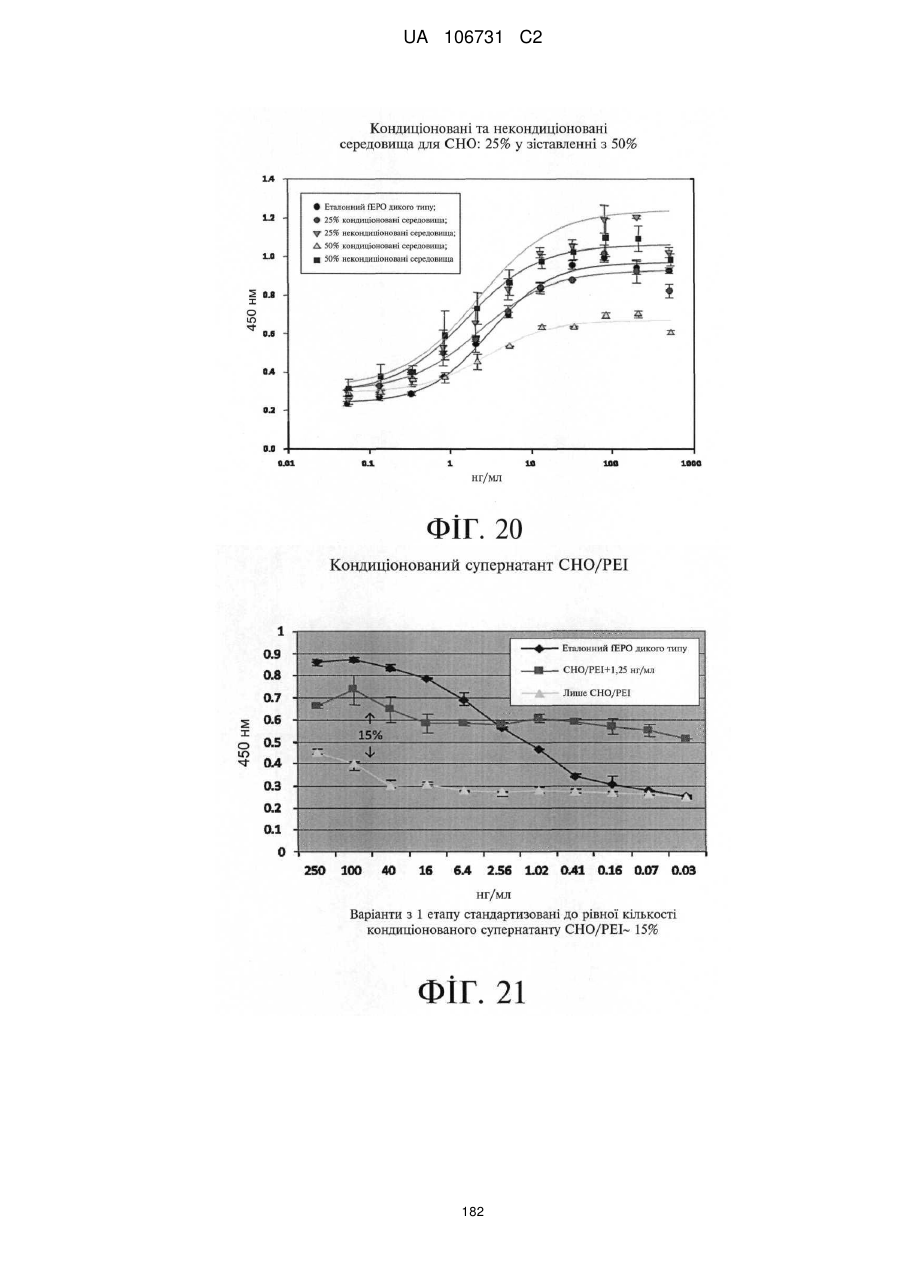
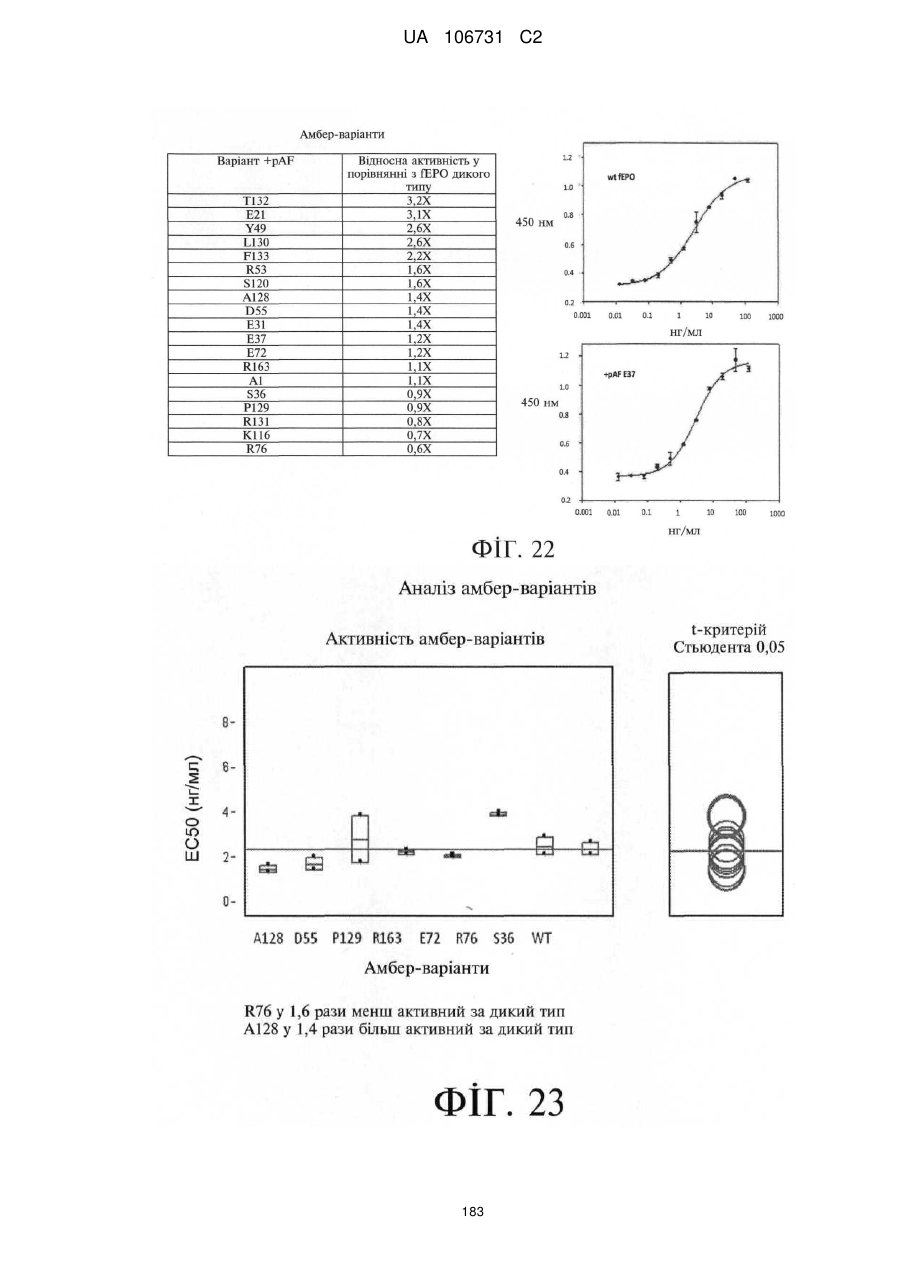
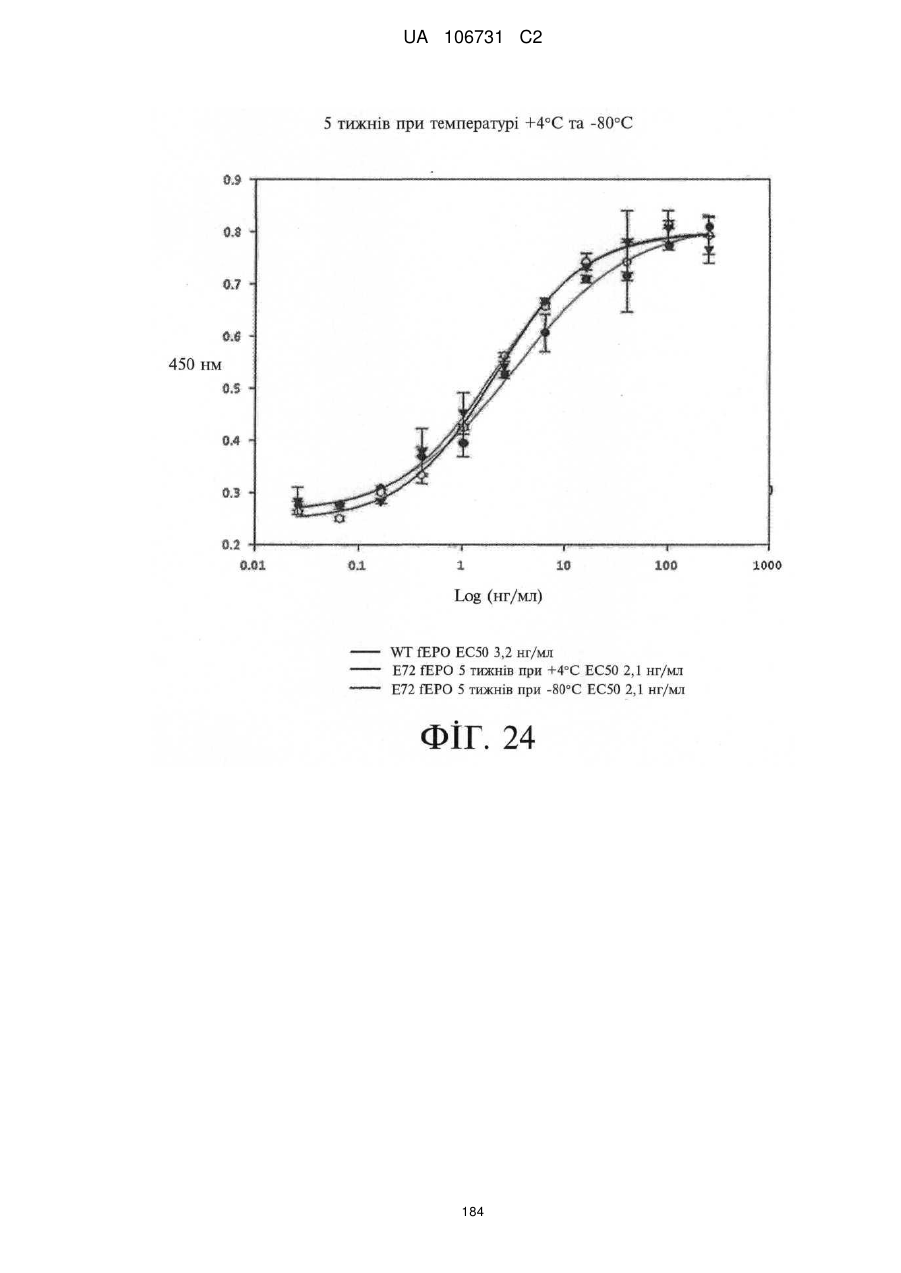
Модифіковані поліпептиди еритропоетину тварин та їх застосування
Номер патенту: 106731
Опубліковано: 10.10.2014
Автори: Шеффер Джозеф, Сон Френк, Аткінсон Кайл, Чу Стефані, Каннінг Пітер С., Тянь Фен, Сіладі Марк, Хейз Патман Анна-Марія А., Барнетт Річард С., Лі Дарін
Формула / Реферат
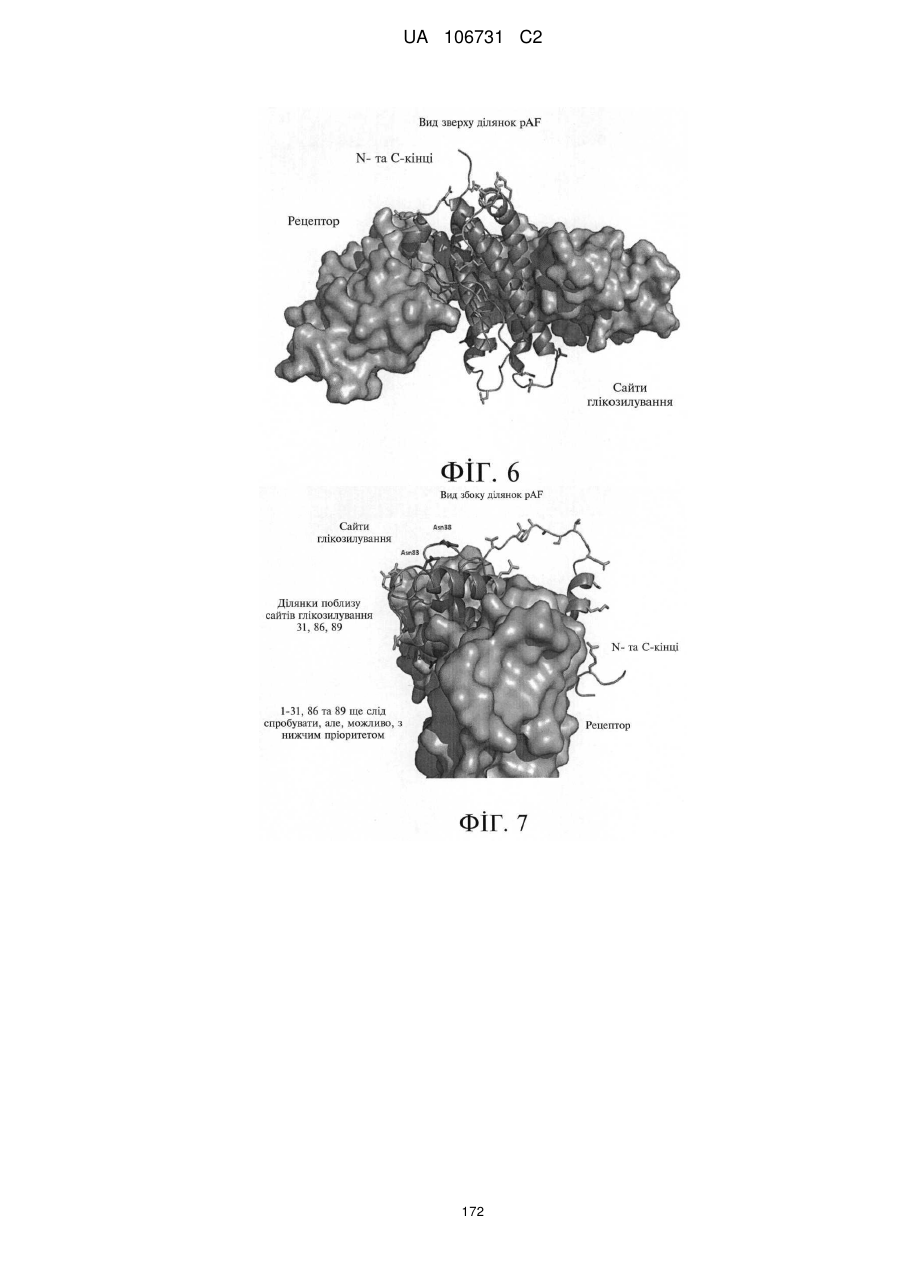
1. Поліпептид еритропоетину котячих (fEPO), який містить штучно закодовану амінокислоту, заміна якою здійснена у положенні, вибраному з групи, яку складають залишки 1, 21, 31, 36, 37, 49, 53, 55, 72, 76, 116, 120, 128, 129, 130, 131, 132, 133 та 163 з послідовності SEQ ID NО: 2,
причому штучно закодована амінокислота містить карбонільну групу, ацетильну групу, амінооксигрупу, гідразинову групу, гідразидну групу, семікарбазидну групу, азидну групу або алкінову групу, та
причому штучно закодована амінокислота сполучена з водорозчинним полімером, який містить полі(етиленгліколеву) складову.
2. Поліпептид fEPO за п. 1, який є сполученим із щонайменше одним додатковим поліпептидом fEPO.
3. Поліпептид fEPO за п. 1, де молекула полі(етиленгліколю) є біфункціональним полімером.
4. Поліпептид fEPO за п. 3, де біфункціональний полімер сполучений з другим поліпептидом.
5. Поліпептид fEPO за п. 4, де другим поліпептидом не є поліпептид fEPO.
6. Поліпептид fEPO за п. 1, який містить щонайменше дві амінокислоти, сполучені з водорозчинним полімером, який містить полі(етиленгліколеву) складову.
7. Поліпептид fEPO за п. 1, де заміна штучно закодованою амінокислотою здійснена у положенні 1 послідовності SEQ ID NО: 2.
8. Поліпептид fEPO за п. 1, який містить заміну, додання або делецію, що підвищує спорідненість поліпептиду fEPO до еритропоетинового рецептора.
9. Поліпептид fEPO за п. 1, який містить амінокислотну заміну, додання або делецію, що підвищує стабільність або розчинність поліпептиду fEPO.
10. Поліпептид fEPO за п. 8, який містить амінокислотну заміну, вибрану з групи, яка включає, але без обмеження ними, S9A, F48S, Y49S, A50S, Q59A, A73G, G101A, Т106А, L108A, Т132А, R139A, K140А, R143A, S146A, N147A, R150A та K154А і їхню комбінацію з послідовності SEQ ID NО: 2.
11. Поліпептид fEPO за п. 1, де штучно закодована амінокислота містить карбонільну групу та має структуру:
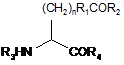 ,
,
де n - 0-10; R1 - алкіл, арил, заміщений алкіл або заміщений арил; R2 - Н, алкіл, арил, заміщений алкіл та заміщений арил; R3 - Н, амінокислота, поліпептид або амінокінцева група-модифікатор; та R4 - Н, амінокислота, поліпептид або карбоксикінцева група-модифікатор.
12. Поліпептид fEPO за п. 7 або п. 11, де штучно закодована амінокислота пара-ацетилфенілаланіном.
13. Поліпептид fEPO за п. 1, де штучно закодована амінокислота містить амінооксигрупу.
14. Поліпептид fЕРО за п. 1, де штучно закодована амінокислота містить гідразидну групу.
15. Поліпептид fEPO за п. 1, де штучно закодована амінокислота містить гідразинову групу.
16. Поліпептид fEPO за п. 1, де штучно закодований амінокислотний залишок містить семікарбазидну групу.
17. Поліпептид fEPO за п. 1, де штучно закодований амінокислотний залишок містить азидну групу.
18. Поліпептид fEPO за п. 17, де штучно закодована амінокислота має структуру:
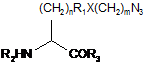 ,
,
де n - 0-10; R1 - алкіл, арил, заміщений алкіл, заміщений арил або відсутній; X - О, N, S або відсутній; m - 0-10; R2 - Н, амінокислота, поліпептид або амінокінцева група-модифікатор; і R3 - Н, амінокислота, поліпептид або карбоксикінцева група-модифікатор.
19. Поліпептид fEPO за п. 1, де штучно закодована амінокислота містить алкінову групу.
20. Поліпептид fEPO за п. 19, де штучно закодована амінокислота має структуру:
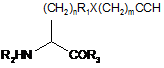 ,
,
де n - 0-10; R1 - алкіл, арил, заміщений алкіл або заміщений арил; X - О, N, S або відсутній; m - 0-10, R2 - Н, амінокислота, поліпептид або амінокінцева група-модифікатор, і R3 - Н, амінокислота, поліпептид або карбоксикінцева група-модифікатор.
21. Поліпептид fEPO за п. 1, де молекула полі(етиленгліколю) має молекулярну масу у межах від приблизно 1 кДа до приблизно 100 кДа.
22. Поліпептид fEPO за п. 21, де молекула полі(етиленгліколю) має молекулярну масу у межах від приблизно 1 кДа до 50 кДа.
23. Поліпептид fEPO за п. 1, який одержують шляхом реагування поліпептиду fEPO, який містить карбонілвмісну амінокислоту, з молекулою полі(етиленгліколю), що містить амінооксигрупу, гідроксиламінову, гідразинову, гідразидну або семікарбазидну групу.
24. Поліпептид fEPO за п. 23, де амінооксигрупа, гідроксиламінова, гідразинова, гідразидна або семікарбазидна група є сполученою з молекулою полі(етиленгліколю) за допомогою амідного зв'язку.
25. Поліпептид fEPO за п. 1, одержаний шляхом реагування молекули полі(етиленгліколю), що містить карбонільну групу, з поліпептидом, який містить штучно закодовану амінокислоту, яка містить амінооксигрупу, гідроксиламінову, гідразидну або семікарбазидну групу.
26. Поліпептид fEPO за п. 1, одержаний шляхом реагування поліпептиду fEPO, який містить алкінвмісну амінокислоту, з молекулою полі(етиленгліколю), що містить азидну складову.
27. Поліпептид fEPO за п. 1, одержаний шляхом реагування поліпептиду fEPO, який містить азидвмісну амінокислоту, з молекулою полі(етиленгліколю), що містить алкінову складову.
28. Поліпептид fEPO за п. 26 або п. 27, де азидна або алкінова група сполучена з молекулою полі(етиленгліколю) за допомогою амідного зв'язку.
29. Поліпептид fEPO за п. 1, де молекула полі(етиленгліколю) є розгалуженим або мультирозгалуженим полімером.
30. Поліпептид fEPO за п. 29, де кожне відгалуження розгалуженого полі(етиленгліколю) має молекулярну масу у межах від приблизно 5 кДа до 30 кДа.
31. Поліпептид fEPO за п. 1, де водорозчинний полімер сполучений з поліпептидом за допомогою сахаридної складової.
32. Спосіб одержання поліпептиду fEPO за п. 1, який включає контактування ізольованого поліпептиду fEPO, який містить штучно закодовану амінокислоту, заміна якою здійснена у положенні, вибраному з групи, яку складають залишки 1, 21, 31, 36, 37, 49, 53, 55, 72, 76, 116, 120, 128, 129, 130, 131, 132, 133 та 163 з послідовності SEQ ID NO: 2, з водорозчинним полімером, який містить складову, яка реагує зі штучно закодованою амінокислотою,
причому штучно закодований амінокислотний залишок містить карбонільну групу, амінооксигрупу, гідразидну групу, семікарбазидну групу, азидну групу або алкінову групу.
33. Спосіб за п. 32, який відрізняється тим, що водорозчинний полімер містить полі(етиленгліколеву) складову, яка має середню молекулярну масу у межах від приблизно 1 кДа до приблизно 100 кДа.
34. Спосіб за п. 32, який відрізняється тим, що штучно закодований амінокислотний залишок містить карбонільну складову, а водорозчинний полімер містить амінооксигрупу, гідроксиламінову, гідразидну або семікарбазидну складову.
35. Спосіб за п. 32, який відрізняється тим, що штучно закодований амінокислотний залишок містить алкінову складову, а водорозчинний полімер містить азидну складову.
36. Спосіб за п. 32, який відрізняється тим, що штучно закодований амінокислотний залишок містить азидну складову, а водорозчинний полімер містить алкінову складову.
37. Спосіб за п. 33, який відрізняється тим, що полі(етиленгліколева) складова має середню молекулярну масу у межах від 10 кДа до 40 кДа.
38. Спосіб за п. 36, який відрізняється тим, що полі(етиленгліколева) складова є розгалуженим або мультирозгалуженим полімером.
39. Композиція, яка містить поліпептид fEPO за будь-яким із пп. 1-31 і фармацевтично прийнятний носій.
40. Застосування композиції за п. 39 для виробництва лікарського засобу для лікування тварини, окрім людини, що має розлад, який модулюється fEPO.
41. Застосування за п. 40, причому хворобою є анемія.
42. Застосування за п. 41, причому анемією є нерегенеративна анемія.
43. Застосування за п. 40, причому твариною є кошачі.
44. Спосіб підвищення періоду напіввиведення fEPO із сироватки або часу знаходження fEPO у кровообігу, який включає заміну штучно закодованою амінокислотою у положенні, вибраному з групи, яку складають залишки 1, 21, 31, 36, 37, 49, 53, 55, 72, 76, 116, 120, 128, 129, 130, 131, 132, 133 та 163 послідовності SEQ ID NО: 2 й сполучення водорозчинного полімеру, який містить полі(етиленгліколеву) складову, зі штучно закодованою амінокислотою,
причому штучно закодований амінокислотний залишок містить карбонільну групу, амінооксигрупу, гідразидну групу, семікарбазидну групу, азидну групу або алкінову групу.
Текст
Реферат: Винахід стосується поліпептиду еритропоетину котячих (fEPO), який містить штучно закодовану амінокислоту, яка містить карбонільну групу, ацетильну групу, амінооксигрупу, гідразинову групу, гідразидну групу, семікарбазидну групу, азидну групу або алкінову групу, заміна якою здійснена у визначеному положенні, і штучно закодована амінокислота сполучена з водорозчинним полімером, який містить полі(етиленгліколеву) складову. Винахід також стосується способу одержання модифікованого fEPO, композицій та їхнього застосування. UA 106731 C2 (12) UA 106731 C2 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь, до якої належить винахід Цей винахід стосується поліпептидів еритропоетину котячих, собачих та конячих, модифікованих щонайменше однією штучно закодованою амінокислотою. Передумови створення винаходу [01] Родина супергенів гормону росту (GH) (Bazan F. Immunology Today 11: 350-354 (1991); Mott H.R. and Campbell I.D. Current Opinion in Structural Biology 5: 114-121 (1995); Silvennoinen O. and Ihle J.N. (1996) Signaling by the Hematopoietic Cytokine Receptors) представляє набір білків з подібними структурними характеристиками. Незважаючи на існування ще неідентифікованих членів цієї родини, прикладом деяких членів цієї родини є такі: гормон росту, пролактин, плацентарний лактоген, еритропоетин (EPO), тромбопоетин (TPO), інтерлейкін-2 (IL-2), IL-3, IL4, IL-5, IL-6, IL-7, IL-9, IL-10, IL-11, IL-12 (субодиниця p35), IL-13, IL-15, онкостатин M, ціліарний нейротропний фактор, фактор інгібування лейкозних клітин, інтерферон альфа, інтерферон бета, інтерферон гамма, інтерферон омега, інтерферон тау, інтерферон епсилон, гранулоцитарний колонієстимулювальний фактор (G-CSF), гранулоцитарно-макрофагальний колонієстимулювальний фактор (GM-CSF), макрофагальний колонієстимулювальний фактор (M-CSF) та кардіотропін-1 (CT-1) ("родина супергенів GH"). Члени родини супергенів GH мають подібні вторинні та третинні структури, незважаючи на те, що вони, як правило, мають обмежену ідентичність амінокислот або послідовностей ДНК. Спільні відмітні структурні ознаки забезпечують можливість легкої ідентифікації нових членів згаданої родини генів. [02] Одним з членів родини супергенів GH є еритропоетин котячих (fEPO). Природний еритропоетин (EPO) являє собою глікопротеїновий гормон з молекулярною масою 34 кілодальтони (кДа), що продукується у нирках та печінці ссавців. EPO є ключовим компонентом еритропоезу, що індукує проліферацію та диференціацію клітин-попередників еритроцитів. Активність EPO також пов'язується з активацією ряду еритроїд-специфічних генів, у тому числі глобіну та карбоангідрази. Дивись, наприклад, Bondurant et al., Mol. Cell Biol. 5:675-683 (1985); Koury et al., J. Cell. Physiol. 126: 259-265 (1986). [03] Рецептор еритропоетину (EpoR) є членом родини рецепторів гемопоетичних клітин/цитокінів/факторів росту, до складу якої входить декілька інших рецепторів факторів росту, такі як рецептори інтерлейкіну (IL)-3, (IL)-4 та (IL)-6, рецептор макрофагального колонієстимулювального фактора (M-CSF), а також рецептори пролактину та гормону росту. Дивись Bazan, Proc. Natl. Acad. Sci USA 87: 6934-6938 (1990). Члени родини рецепторів цитокінів містять чотири консервативні цистеїнові залишки та мотив триптофан-серин-Хтрипрофан-серин, що розміщується безпосередньо за межами трансмембранної ділянки. Вважають, що згадані консервативні послідовності є залученими до білок-білкових взаємодій. Дивись, наприклад, Chiba et al., Biochim. Biophys. Res. Comm. 184: 485-490 (1992). [04] Патенти США 5,441,868; 5,547,933; 5,618,698 та 5,621,080 описують послідовності ДНК, що кодують людський EPO і очищений та ізольований поліпептид, що має часткову або повну первинну структурну конформацію і біологічні властивості природного EPO. [05] Біологічні ефекти EPO є наслідком його взаємодії із специфічними клітинними рецепторами. Механізм взаємодії між EPO та екстрацелюлярним доменом його рецептора (EPObp) є добре вивченим. Дані рентгенівської кристалографії високої роздільної здатності показують, що EPO має два рецепторзв'язувальні сайти і послідовно зв'язує дві рецепторні молекули з використанням різних сайтів на згаданій молекулі. Два згадані рецепторзв'язувальні сайти позначають як Сайт I і Сайт II. Сайт I включає карбоксильний кінець спіралі D і частини спіралі A та петлі A-B, у той час як Сайт II охоплює амінокінцеву ділянку спіралі A та частину спіралі C. Зв'язування EPO з його рецептором відбувається послідовно, де першим зв'язується Сайт I. Після цього до взаємодії з другим рецептором EPO вступає Сайт II, наслідком чого є димеризація рецептора та активація внутрішньоклітинних шляхів передачі сигналів, наслідком чого є клітинні реакції на гормони. [06] Рекомбінантний людський EPO застосовують як терапевтичний засіб, який було схвалено для лікування людей. Наслідком дефіциту EPO, наприклад, є анемія, яка успішно лікується екзогенним введенням згаданого гормону. [07] Анемії, у широкому значенні, можуть підрозділятись на дві категорії: регенеративні та нерегенеративні. Регенеративні анемії спричинюються крововтратою або є наслідком руйнування еритроцитів імунною системою. До нерегенеративних анемій, з іншого боку, належать ті з них, на які кістковий мозок не реагує або не може реагувати. Поширеною причиною анемії є хронічна ниркова недостатність (CRF), у той час як більшість інших випадків обумовлюється інфікуванням вірусом лейкозу котячих (FeLV). Ці два розлади є причинами номер 1 (FeLV) та номер 2 (CRF) загибелі домашніх кішок. При лікуванні анемії котячих застосовують hEPO. На жаль, у разі застосування hEPO для лікування анемії котячих 1 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 виникають проблеми з імуногенністю і приблизно у 25 %-33 % кішок, яких лікують hEPO, спостерігався розвиток аплазії еритроцитів (RCA). Були проведені дослідження, у тому числі дослідження на 11 кішках та 6 собаках з CRF, яких лікували рекомбінантним hEPO. Незважаючи на те, що була продемонстрована деяка можливість підвищення кількості еритроцитів (RBC) та ретикулоцитів, у 5 з 11 кішок з'явились антитіла проти r-hEPO (L.D. Cowgill et al., J. Am. Vet. Med. Assoc. 1998 Feb 15;212(4):521-528). Дослідження безпечності та ефективності рекомбінантного еритропоетину котячих (rfEPO) провели на 26 експериментальних кішках і було встановлено, що, незважаючи на підвищення кількості еритроцитів (RBC) та ретикулоцитів, у вісьмох з 26 кішок (тобто більше ніж у 30 %) з'явились антитіла проти r-fEPO (J.E. Randolph et al., Am. J. Vet. Res. 2004 Oct;65(10):1355-1366). При проведенні іншого дослідження, експериментальній групі з 10 кішок вводили вектор на основі рекомбінантного аденоасоційованого вірусу серотипу 2 (rAAV2), що містив кДНК еритропоетину котячих. Встановили, що в усіх кішок, яким вводили згаданий вектор, були виявлені антитіла проти rAAV2, одна кішка страждала на чисту аплазію еритроцитів, а у кішок, яких обробляли меншими кількостями, ефекту не спостерігалось (M.C. Walker et al., Am. J. Vet. Res. 2005 Mar;66(3):450-456). [08] Ковалентне приєднання гідрофільного полімеру полі(етиленгліколю), скорочено PEG (ПЕГ), являє собою спосіб підвищення водорозчинності, біологічної доступності, підвищення періоду напіввиведення з плазми, підвищення періоду напіввиведення терапевтично ефективної кількості, модулювання імуногенності, модулювання біологічної активності або подовження періоду циркуляції багатьох біологічно активних молекул, у тому числі білків, пептидів і, зокрема, гідрофобних молекул. PEG широко застосовують у фармацевтичних препаратах, штучних імплантатах та за іншими варіантами застосування, де важливу роль відіграє біологічна сумісність, відсутність токсичності та відсутність імуногенності. З метою доведення необхідних властивостей PEG до максимального рівня, загальна молекулярна маса та гідратаційний стан полімеру PEG або полімерів, приєднаних до біологічно активної молекули, мають бути достатньо високими для наділення вигідними характеристиками, які, як правило, пов'язуються з приєднанням полімеру PEG, такими як підвищена водорозчинність та підвищений період напіввиведення з плазми, без справляння одночасного негативного впливу на біологічну активність вихідної молекули. [09] Похідні PEG часто зв'язуються з біологічно активними молекулами через реакційноздатні хімічні функціональні групи, такі як залишки лізину, цистеїну та гістидину, Nкінець та вуглеводні складові. Білки та інші молекули часто мають обмежену кількість реакційноздатних ділянок, доступних для приєднання полімеру. Часто ділянки, найбільш придатні для модифікування шляхом приєднання полімеру, відіграють суттєву роль у зв'язуванні рецептора і є необхідними для збереження біологічної активності молекули. Як наслідок, безладне приєднання полімерних ланцюгів до таких реакційноздатних ділянок на біологічно активній молекулі часто веде до значного зниження або навіть повної втрати біологічної активності модифікованої полімером молекули. R. Clark et al., (1996), J. Biol. Chem., 271:21969-21977. Для одержання кон'югатів з достатньою молекулярною масою полімеру для надання необхідних переваг молекулі-мішені, попередні відомі варіанти підходів залучали, як правило, неспецифічне приєднання численних відгалужень полімеру до молекули, з підвищенням, тим самим, ризику зменшення або навіть повної втрати біологічної активності вихідної молекули. [10] Реакційноздатні ділянки, що утворюють локуси для приєднання похідних PEG до білків, визначаються структурою білка. Білки, у тому числі ферменти, складаються з різних послідовностей альфа-амінокислот, які мають загальну структуру H2N-CHR-COOH. Альфааміноскладова (H2N-) однієї амінокислоти приєднується до карбоксильної складової (-COOH) прилеглої амінокислоти з утворенням амідних зв'язків, які можуть бути представлені як -(NHCHR-CO)n-, де нижній індекс "n" може дорівнювати сотням або тисячам. Фрагмент, представлений R, може містити реакційноздатні ділянки для біологічної активності білка і для приєднання похідних PEG. [11] Наприклад, у разі амінокислоти лізину, у епсилон-положенні, а також у альфа-положенні існує -NH2 складова. Епсилон -NH2 є вільною для реагування за умов основного значення pH. Більшість зусиль у галузі дериватизації білків PEG була спрямована на розробку похідних PEG для приєднання до епсилон -NH2 складової залишку лізину, присутнього у білках. "Polyethylene Glycol and Derivatives for Advanced PEGylation", Nektar Molecular Engineering Catalog, 2003, pp. 117. Усі ці похідні PEG, однак, мають спільне обмеження, яке полягає у тому, що вони не можуть вибірково розміщуватись серед часто численних залишків лізину, присутніх на поверхні білків. Це може бути суттєвим обмеженням у випадках, коли залишок лізину є важливим для активності білка і знаходиться, наприклад, на ферментативно-активній ділянці, або у випадках, 2 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 коли залишок лізину відіграє роль у опосередковуванні взаємодії білка з іншими біологічними молекулами, наприклад, як у разі рецептор-зв'язувальних ділянок. [12] Друге і однаково важливе ускладнення існуючих способів пегілування білків полягає у тому, що похідні PEG можуть вступити до небажаних побічних реакцій з іншими залишками, окрім необхідних. Гістидин містить реакційноздатну іміноскладову, структурно представлену як N(H)-, однак багато хімічно реакційноздатних різновидів, що реагують з епсилон -NH2, можуть також реагувати з -N(H)-. Подібним же чином, бічний ланцюг амінокислоти цистеїну несе вільну сульфгідрильну групу, структурно представлену як -SH. У деяких випадках, похідні PEG, спрямовані на епсилон -NH2 групу лізину, можуть також реагувати з цистеїновим, гістидиновим або іншими залишками. Це може привести до утворення складних гетерогенних сумішей PEGдериватизованих біологічно активних молекул і до небезпеки знищення активності біологічної молекули, яка виступає у ролі мішені. Бажано було б розробити похідні PEG, які дозволяли б введення хімічної функціональної групи на одній ділянці у межах білка, що у подальшому могло б забезпечити можливість вибіркового з'єднання одного або декількох полімерів PEG з біологічно активною молекулою на конкретних ділянках на поверхні білка, що є добре визначеними та прогнозованими. [13] На додаток до залишків лізину, значні зусилля у цій галузі були спрямовані на розробку активованих реактивів PEG, мішенню для яких служать інші бічні ланцюги амінокислот, у тому числі цистеїну, гістидину та N-кінця. Патент США 6,610,281. "Polyethylene Glycol and Derivatives for Advanced PEGylation", Nektar Molecular Engineering Catalog, 2003, pp. 1-17. Цистеїновий залишок може бути введеним до визначеного сайту у структурі білків шляхом сайтспрямованого мутагенезу та інших способів, відомих у цій галузі, і вільна сульфгідрильна складова, яка буде одержана, може реагувати з похідними PEG, що несуть тіол-реакційні функціональні групи. Цей підхід, однак, є складним у тому відношенні, що введення вільної сульфгідрильної групи може ускладнити експресію, погіршити укладання та стабільність білка, який буде одержано. Таким чином, бажано було б мати засіб введення хімічної функціональної групи до біологічно активних молекул, який забезпечував би селективне сполучення одного або декількох полімерів PEG з білком, з одночасною сумісністю (тобто невступленням до небажаних побічних реакцій з) з сульфгідрилами та іншими хімічними функціональними групами, які, як правило, входять до складу білків. [14] Як видно із зразків у цій галузі, багато з цих похідних, що були розроблені для приєднання до бічних ланцюгів білків, зокрема -NH2 складової бічного ланцюга амінокислоти лізину та -SH складової бічного ланцюга цистеїну, виявились проблематичними щодо синтезу та застосування. Деякі утворюють нестабільні зв'язки з білком, які зазнають гідролізу і, унаслідок цього, розкладаються, деградують або є по-іншому нестабільними у рідких середовищах, наприклад, у кров'яному руслі. Деякі утворюють більш стабільні зв'язки, однак зазнають гідролізу до утворення зв'язку, що означає, що реактивна група на похідній PEG може бути інактивованою до приєднання білка. Деякі мають певну токсичність і, унаслідок цього, є менш придатними для застосування in vivo. Деякі реагують занадто повільно, щоб бути практично придатними. Деякі спричинюють втрату активності білка унаслідок приєднання до ділянок, що несуть відповідальність за активність білка. Деякі не є специфічними на ділянках, до яких вони приєднаються, наслідком чого також може бути втрата бажаної активності та неможливість відтворення результатів. З метою подолання проблем, пов'язаних з модифікуванням білків полі(етиленгліколевими) складовими, були розроблені похідні PEG, що є більш стабільними (наприклад, патент США 6,602,498) або які селективно реагують із тіоловими складовими на молекулах та поверхнях (наприклад, патент США 6,610,281). Безсумнівно, у цій галузі існує потреба у похідних PEG, що є хімічно нейтральними у фізіологічному середовищі до виникнення необхідності вибіркового реагування для утворення стабільних хімічних зв'язків. [15] Нещодавно з'явилось повідомлення про абсолютно нову технологію у галузі наук про білок, яка обіцяє подолання більшості обмежень, пов'язаних з сайт-специфічними модифікаціями білків. Конкретно, до білкового біосинтетичного механізму клітин прокаріотів Escherichia coli (E. coli) (наприклад, L. Wang et al., (2001), Science 292:498-500) та клітин еукаріотів Sacchromyces cerevisiae (S. cerevisiae) (наприклад, J. Chin et al., Science 301:964-967 (2003)) були додані нові компоненти, які надали можливість введення негенетично закодованих амінокислот у білки in vivo. За допомогою цієї методики ряд нових амінокислот з новими хімічними, фізичними або біологічними властивостями, у тому числі фотоафінні мітки та амінокислоти, що зазнають фотоізомеризації, кетоамінокислоти та глікозиловані амінокислоти, були ефективно та з високою надійністю введені у білки E. coli та дріжджів у відповідь на амберкодон, TAG. Дивись, наприклад, J.W. Chin et al., (2002), Journal of the American Chemical Society 124:9026-9027; J.W. Chin, & P.G. Schultz, (2002), ChemBioChem 3(11):1135-1137; J.W. Chin et al., 3 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2002), PNAS United States of America 99:11020-11024; та L. Wang, & P.G. Schultz, (2002), Chem. Comm., 1-10. Ці дослідження продемонстрували можливість селективного та рутинного введення хімічних функціональних груп, наприклад, алкінових груп та азидних складових, яких немає у білках, які є хімічно нейтральними до усіх функціональних груп, що знаходяться у 20 звичайних генетично закодованих амінокислотах, і які можуть застосовуватись для ефективного та селективного реагування з утворенням стабільних ковалентних зв'язків. [16] Можливість введення у білки негенетично закодованих амінокислот надає можливість введення хімічних функціональних груп, які могли б являти собою цінні альтернативні варіанти природним функціональним групам, наприклад, епсилон -NH2 лізину, сульфгідрильній групі -SH цистеїну, іміногрупі гістидину тощо. Відомо, що певні хімічні функціональні групи є нейтральними до функціональних груп, що знаходяться у 20 звичайних генетично закодованих амінокислотах, проте чітко та ефективно реагують з утворенням стабільних зв'язків. У цій галузі відомо, наприклад, що азидні та ацетиленові групи вступають до реакції [3+2]-циклоприєднання Хьюсгена у водних умовах у присутності каталітичної кількості міді. Дивись, наприклад, Tornoe et al., (2002) Org. Chem. 67:3057-3064; та Rostovtsev et al., (2002) Angew. Chem. Int. Ed. 41:25962599. Шляхом введення азидної складової до структури білка, наприклад, можна ввести функціональну групу, що є хімічно нейтральною до амінів, сульфгідрилів, карбонових кислот, гідроксильних груп, що знаходяться у білках, але яка також чітко та ефективно реагує з ацетиленовою складовою з утворенням продукту циклоприєднання. Важливим є те, що за відсутності ацетиленової складової азид залишається хімічно нейтральним та інертним у присутності інших бічних ланцюгів білків та за фізіологічних умов. [17] Цей винахід спрямовується, разом з іншим, на проблеми, пов'язані з активністю та продукуванням EPO, а також спрямовується на одержання поліпептиду hEPO з поліпшеними біологічними або фармакологічними властивостями, наприклад, поліпшеним періодом напіввиведення його терапевтично ефективної кількості. Суть винаходу [18] Цей винахід пропонує поліпептиди fEPO, що містять штучно закодовану амінокислоту. [19] За деякими варіантами здійснення цього винаходу згаданий поліпетид fEPO є сполученим з другим поліпептидом fEPO. [20] За деякими варіантами здійснення цього винаходу штучно закодована амінокислота зв'язана з водорозчинним полімером. За деякими варіантами здійснення цього винаходу згаданий водорозчинний полімер містить полі(етиленгліколеву) складову. За деякими варіантами здійснення цього винаходу молекула полі(етиленгліколю) є біфункціональним полімером. За деякими варіантами здійснення цього винаходу біфункціональний полімер є сполученим з другим поліпептидом. За деякими варіантами здійснення цього винаходу згаданим другим поліпептидом є поліпептид fEPO. [21] За деякими варіантами здійснення цього винаходу поліпептид fEPO містить щонайменше дві амінокислоти, сполучені з водорозчинним полімером, що містить полі(етиленгліколеву) складову. За деякими варіантами здійснення цього винаходу щонайменше одна амінокислота є штучно закодованою амінокислотою. [22] За деякими варіантами здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до будь-якого положення на одній або декількох з наведених нижче ділянок, що відповідають вторинним структурам fEPO, наведеним нижче чином: 1-7 (Nкінець), 8-26 (спіраль A), 27-54 (ділянка між спіраллю A та спіраллю B) 55-83 (спіраль B), 84-89 (ділянка між спіраллю B та спіраллю C), 90-112 (спіраль C), 113-137 (ділянка між спіраллю C та спіраллю D), 138-161 (спіраль D), 162-166 (C-кінець), 39-41 (бета-складка 1), 133-135 (бетаскладка 2), 47-52 (мініпетля B), 114-121 (мініпетля C), 34-38 (петля між спіраллю A та антипаралельною бета-складкою 1), 51-57 (C-кінець спіралі B", петля між спіраллю B" та спіраллю B і N-кінець спіралі B), 82-92 (ділянка між спіраллю B та спіраллю C) і 120-133 (ділянка між спіраллю C" та антипаралельною бета-складкою 2). За деякими варіантами здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до одного з наведених нижче положень fEPO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165 та 166. За деякими варіантами здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до одного з наведених нижче положень 4 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 fEPO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165 and 166. За деякими варіантами здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до одного з наведених нижче положень fEPO: 1, 2, 3, 4, 5, 6, 17,21, 24, 27, 28, 30, 31, 32, 34, 35, 36, 37, 38, 40, 50, 51, 52, 53, 54, 55, 56, 57, 58, 68, 72, 76, 80, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 113, 116, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134,136, 162, 163, 164, 165 та 166. За деякими варіантами здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до одного з наведених нижче положень fEPO: 1, 2, 3, 4, 5, 6, 17, 18, 21, 24, 27, 28, 30, 31, 32, 34, 35, 36, 37, 38, 40, 50, 51, 52, 53, 54, 55, 56, 57, 58, 68, 72, 76, 80, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 113, 116, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134,136, 162, 163, 164, 165 та 166. За деякими варіантами здійснення цього винаходу поліпептиди fEPO за цим винаходом містять одну або декілька штучних амінокислот у одному або декількох з наведених нижче положень: 21, 24, 27, 28, 30, 31, 34, 36, 37, 38, 40, 55, 68, 72, 76, 83, 85, 86, 87, 89, 113, 116, 119, 120, 121, 123, 124, 125, 126, 127, 128, 129, 130,136 та 162. За деякими варіантами здійснення цього винаходу штучна амінокислота у цих або інших положеннях сполучається з водорозчинною молекулою, у тому числі, але без обмеження, у положеннях 21, 24, 38, 83, 85, 116 та 119. За деякими варіантами здійснення цього винаходу поліпептиди fEPO за цим винаходом містять одну або декілька штучних амінокислот у одному або декількох з наведених нижче положень: 18, 53, 58, 116, 121, 89, 94, 72, 77, 86, 91, 31, 36, 132, 137, 163, 168, 120, 125, 55 та 60. За деякими варіантами здійснення поліпептиди fEPO за цим винаходом містять одну або декілька штучних амінокислот у одному або декількох з наведених нижче положень: 53, 58, 116, 121, 89, 94, 72, 77, 86, 91, 31, 36, 132, 137, 163, 168, 120, 125, 55 та 60. За деякими варіантами здійснення поліпептиди fEPO за цим винаходом містять одну або декілька штучних амінокислот у одному або декількох з наведених нижче положень: 18, 53, 58, 116, 121, 89, 94, 72, 77, 86, 91, 31, 36, 132, 137, 163, 168, 120, 125, 55 та 60. За деякими варіантами здійснення цього винаходу штучна амінокислота у цих або інших положеннях сполучається з водорозчинною молекулою, у тому числі, але без обмеження, у положеннях 53, 58, 116, 121, 89, 94, 72, 77, 86, 91, 31, 36, 132, 137, 163, 168, 120, 125, 55 та 60. За деякими варіантами здійснення поліпептиди fEPO за цим винаходом містять одну або декілька штучних амінокислот у одному або декількох з наведених нижче положень: 123, 124, 125, 126, 127, 128, 129 та 130. За деякими варіантами здійснення цього винаходу штучна амінокислота у цих або інших положеннях сполучається з водорозчинною молекулою, у тому числі, але без обмеження, у положеннях 123, 124, 125, 126, 127, 128, 129 та 130. [23] За деякими варіантами здійснення цього винаходу поліпептид fEPO містить заміну, додання або делецію, що підвищує спорідненість поліпептиду fEPO до рецептора еритропоетину. За деякими варіантами здійснення цього винаходу поліпептид fEPO містить заміну, додання або делецію, що підвищує стабільність поліпептиду fEPO. За деякими варіантами здійснення цього винаходу поліпептид fEPO містить заміну, додання або делецію, що підвищує водорозчинність поліпептиду fEPO. За деякими варіантами здійснення цього винаходу поліпептид fEPO містить заміну, додання або делецію, що підвищує розчинність поліпептиду fEPO, продукованого клітиною-хазяїном. За деякими варіантами здійснення цього винаходу поліпептид fEPO містить заміну амінокислоти, вибраної з групи, до складу якої входять, але ними не обмежуються, N24, N36, N38, Q58, Q65, N83, Q86, G113, Q115 та S126 і їх комбінації у послідовності SEQ ID NO: 2. За деякими варіантами здійснення цього винаходу поліпептид fEPO містить заміну амінокислоти, вибраної з групи, до складу якої входять, але ними не обмежуються, N24, N36, N38, Q58, Q65, N83, Q86, G113, Q115 та S126 і їх комбінації у послідовності SEQ ID NO: 4. [24] За деякими варіантами здійснення цього винаходу амінокислотні заміни у поліпептиді fEPO можуть здійснюватись природними або штучними амінокислотами, за умови, що щонайменше одна заміна здійснюється штучно закодованою амінокислотою. [25] За деякими варіантами здійснення цього винаходу штучно закодована амінокислота містить карбонільну групу, ацетильну групу, амінооксигрупу, гідразинову групу, гідразидну групу, семікарбазидну групу, азидну групу або алкінову групу. [26] За деякими варіантами здійснення цього винаходу штучно закодована амінокислота 5 UA 106731 C2 містить карбонільну групу. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота має структуру: (CH2)nR1COR2 5 10 R3HN COR4 , де n – 0-10; R1 – алкіл, арил, заміщений алкіл або заміщений арил; R 2 – H, алкіл, арил, заміщений алкіл та заміщений арил; R 3 – H, амінокислота, поліпептид або амінокінцева групамодифікатор; і R4 – H, амінокислота, поліпептид або карбоксикінцева група-модифікатор. [27] За деякими варіантами здійснення цього винаходу штучно закодована амінокислота містить амінооксигрупу. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота містить гідразидну групу. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота містить гідразинову групу. За деякими варіантами здійснення цього винаходу залишок штучно закодованої амінокислоти містить семікарбазидну групу. [28] За деякими варіантами здійснення цього винаходу залишок штучно закодованої амінокислоти містить азидну групу. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота має структуру: (CH2)nR1X(CH2)mN3 15 20 R2HN COR3 , де n – 0-10; R1 – алкіл, арил, заміщений алкіл, заміщений арил або відсутній; X – O, N, S або відсутній; m – 0-10; R2 – H, амінокислота, поліпептид або амінокінцева група-модифікатор; і R3 – H, амінокислота, поліпептид або карбоксикінцева група-модифікатор. [29] За деякими варіантами здійснення цього винаходу штучно закодована амінокислота містить алкінову групу. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота має структуру: (CH2)nR1X(CH2)mCCH 25 30 35 40 45 50 R2HN COR3 , де n – 0-10; R1 – алкіл, арил, заміщений алкіл або заміщений арил; X – O, N, S або відсутній; m – 0-10, R2 – H, амінокислота, поліпептид або амінокінцева група-модифікатор, і R3 – H, амінокислота, поліпептид або карбоксикінцева група-модифікатор. [30] За деякими варіантами здійснення цього винаходу згаданий поліпептид є агоністом, частковим агоністом, антагоністом, частковим антагоністом або зворотним агоністом еритропоетину. За деякими варіантами здійснення цього винаходу агоніст, частковий агоніст, антагоніст, частковий антагоніст або зворотний агоніст еритропоетину містить штучно закодовану амінокислоту, сполучену з водорозчинним полімером. За деякими варіантами здійснення цього винаходу водорозчинний полімер містить полі(етиленгліколеву) складову. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота, сполучена з водорозчинним полімером, знаходиться у межах ділянки Сайту 2 (ділянка білка, що охоплюється поверхнею спірального пучка АС) fEPO. За деякими варіантами здійснення цього винаходу поліпептид fEPO, який містить штучно закодовану амінокислоту, сполучену з водорозчинним полімером, запобігає димеризації рецептора fEPO шляхом запобігання зв'язування антагоністу fEPO з другою молекулою рецептора fEPO. За деякими варіантами здійснення цього винаходу амінокислоту, окрім лейцину, замінюють на L108 у послідовності SEQ ID NO: 2. За деякими варіантами здійснення цього винаходу аргінін або лізин замінюють на L108 у послідовності SEQ ID NO: 2. За деякими варіантами здійснення цього винаходу штучно закодовану амінокислоту замінюють на L108 у послідовності SEQ ID NO: 2. [31] Цей винахід також пропонує ізольовані нуклеїнові кислоти, що містять полінуклеотид, що гібридизується за суворих умов з послідовністю SEQ ID NO: 24, 25, 26 або 27, де згаданий полінуклеотид містить щонайменше один селекторний кодон. За деякими варіантами здійснення цього винаходу селекторний кодон вибирають з групи, до складу якої входить амбер-кодон, охра-кодон, опал-кодон, унікальний кодон, рідкісний кодон та чотириосновний кодон. [32] Цей винахід також пропонує способи одержання поліпептиду fEPO, сполученого з водорозчинним полімером. За деякими варіантами здійснення цього винаходу спосіб включає контактування ізольованого поліпептиду fEPO, що містить штучно закодовану амінокислоту, з водорозчинним полімером, що містить складову, яка реагує з штучно закодованою амінокислотою. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота, що включена до складу fEPO, може реагувати з водорозчинним полімером, який, 6 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 за інших обставин, не реагує з жодною з 20 звичайних амінокислот. [33] За деякими варіантами здійснення цього винаходу поліпептид fEPO, сполучений з водорозчинним полімером, одержують шляхом реагування поліпептиду fEPO, що містить карбонілвмісну амінокислоту, з молекулою полі(етиленгліколю), що містить амінооксигрупу, гідроксиламіногрупу, гідразинову групу, гідразидну групу або семікарбазидну групу. За деякими варіантами здійснення цього винаходу амінооксигрупа, гідроксиламіногрупа, гідразинова група, гідразидна група або семікарбазидна група сполучена з молекулою полі(етиленгліколю) через амідний зв'язок. [34] За деякими варіантами здійснення цього винаходу поліпептид fEPO, сполучений з водорозчинним полімером, одержують шляхом реагування молекули полі(етиленгліколю), що містить карбонільну групу, з поліпептидом, що містить штучно закодовану амінокислоту, що містить гідроксиламіногрупу, гідразидну групу або семікарбазидну групу. [35] За деякими варіантами здійснення цього винаходу поліпептид fEPO, сполучений з водорозчинним полімером, одержують шляхом реагування поліпептиду fEPO, що містить алкінвмісну амінокислоту, з молекулою полі(етиленгліколю), що містить азидну складову. За деякими варіантами здійснення цього винаходу азидна група або алкінова група сполучена з молекулою полі(етиленгліколю) через амідний зв'язок. [36] За деякими варіантами здійснення цього винаходу поліпептид fEPO, сполучений з водорозчинним полімером, одержують шляхом реагування поліпептиду fEPO, що містить азидвмісну амінокислоту, з молекулою полі(етиленгліколю), що містить алкінову складову. За деякими варіантами здійснення цього винаходу азидна група або алкінова група сполучена з молекулою полі(етиленгліколю) через амідний зв'язок. [37] За деякими варіантами здійснення цього винаходу молекула полі(етиленгліколю) має молекулярну масу у межах від приблизно 1 кДа до приблизно 100 кДа. За деякими варіантами здійснення цього винаходу молекула полі(етиленгліколю) має молекулярну масу у межах від приблизно 1 кДа до приблизно 50 кДа. [38] За деякими варіантами здійснення цього винаходу молекула полі(етиленгліколю) є розгалуженим полімером. За деякими варіантами здійснення цього винаходу кожне розгалуження розгалуженого полімеру полі(етиленгліколю) має молекулярну масу у межах від приблизно 1 кДа до приблизно 100 кДа або від приблизно 1 кДа до приблизно 50 кДа. [39] За деякими варіантами здійснення цього винаходу водорозчинний полімер, сполученій з поліпептидом fEPO, містить поліалкіленгліколеву складову. За деякими варіантами здійснення цього винаходу залишок штучно закодованої амінокислоти, введений до складу fEPO, містить карбонільну групу, ацетильну групу, амінооксигрупу, гідразидну групу, семікарбазидну групу, азидну групу або алкінову групу. За деякими варіантами здійснення цього винаходу залишок штучно закодованої амінокислоти, введений до складу fEPO, містить карбонільну складову, а водорозчинний полімер містить амінооксигрупу, гідроксиламіногрупу, гідразидну групу або семікарбазидну складову. За деякими варіантами здійснення цього винаходу залишок штучно закодованої амінокислоти, введений до складу fEPO, містить алкінову складову, а водорозчинний полімер містить азидну складову. За деякими варіантами здійснення цього винаходу залишок штучно закодованої амінокислоти, введений до складу fEPO, містить азидну складову, а водорозчинний полімер містить алкінову складову. [40] Цей винахід також пропонує композиції, які містять поліпептид fEPO, який містить штучно закодовану амінокислоту, і фармацевтично прийнятний носій. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота сполучена з водорозчинним полімером. [41] Цей винахід також пропонує клітини, що містять полінуклеотид, що кодує поліпептид fEPO, який містить селекторний кодон. За деякими варіантами здійснення цього винаходу згадані клітини містять ортогональну РНК-синтетазу та/або ортогональну тРНК для введення штучно закодованої амінокислоти до поліпептиду fEPO. [42] Цей винахід також пропонує способи одержання поліпептиду fEPO, що містить штучно закодовану амінокислоту. За деякими варіантами здійснення цього винаходу згадані способи включають культивування клітин, що містять полінуклеотид або полінуклеотиди, що кодують поліпептид fEPO, ортогональну РНК-синтетазу та/або ортогональну тРНК, за умов, що дозволяють експресію поліпептиду fEPO; і очищення поліпептиду fEPO з клітин та/або культурального середовища. [43] Цей винахід також пропонує способи підвищення періоду напіввиведення терапевтично ефективної кількості fEPO, періоду напіввиведення fEPO з плазми або часу знаходження fEPO у кровообізі. За деякими варіантами здійснення цього винаходу згадані способи включають заміну будь-якої однієї або декількох амінокислот природного fEPO на штучно закодовану 7 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислоту та/або сполучення поліпептиду fEPO з водорозчинним полімером. [44] Цей винахід також пропонує способи лікування хворого, що потребує такого лікування, ефективною кількістю молекули fEPO за цим винаходом. За деякими варіантами здійснення цього винаходу згадані способи включають введення хворому терапевтично ефективної кількості фармацевтичної композиції, яка містить поліпептид fEPO, який містить штучно закодовану амінокислоту, та фармацевтично прийнятний носій. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота сполучена з водорозчинним полімером. [45] Цей винахід також пропонує поліпептиди fEPO, що містять послідовність, представлену послідовностями SEQ ID NO: 1, 2, 3 або 4, за виключенням того, що щонайменше одна амінокислота замінена штучно закодованою амінокислотою. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота сполучена з водорозчинним полімером. За деякими варіантами здійснення цього винаходу водорозчинний полімер містить полі(етиленгліколеву) складову. За деякими варіантами здійснення цього винаходу штучно закодовану амінокислоту вводять у положення, вибране з групи, що включає залишки (з включенням, але без обмеження) 1-6, 21-40, 68-89, 116-136, 162-166 послідовності SEQ ID NO: 2 або послідовності SEQ ID NO: 4, або положення відповідної амінокислоти послідовності SEQ ID NO:1 або послідовності SEQ ID NO: 3. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота містить карбонільну групу, амінооксигрупу, гідразидну групу, гідразинову групу, семікарбазидну групу, азидну групу або алкінову групу. [46] Цей винахід також пропонує фармацевтичні композиції, які містять фармацевтично прийнятний носій та поліпептид fEPO, який містить послідовність, представлену послідовністю SEQ ID NO: 1, 2, 3 або 4, де щонайменше одна амінокислота замінена штучно закодованою амінокислотою. Цей винахід також пропонує фармацевтичні композиції, які містять фармацевтично прийнятний носій та поліпептид fEPO, який містить послідовність, представлену послідовністю SEQ ID NO: 2 або 4, де щонайменше одна амінокислота замінена штучно закодованою амінокислотою. За деякими варіантами здійснення цього винаходу штучно закодована амінокислота містить сахаридну складову. За деякими варіантами здійснення цього винаходу водорозчинний полімер є сполученим з поліпептидом через сахаридну складову. Короткий опис фігур [47] Фіг. 1 – Схема вирівнювання послідовності еритропоетину людини та еритропоетину котячих. [48] Фіг. 2 – Схема, що пояснює різницю між двома послідовностями, депонованими у Genbank (депонування Genbank: U00685 і депонування Genbank: L10606), консенсусна послідовність. [49] Фіг. 3 – Показана схема загальної структури чотириспірального пучка білка еритропоетину (EPO) з високо- та низькоафінними рецепторами. [50] Фіг. 4 – Схема альтернативного виду загальної структури чотириспірального пучка білка еритропоетину (EPO) з високо- та низькоафінними рецепторами. [51] Фіг. 5 – Схема, що показує деякі вибрані ділянки для введення штучно закодованих амінокислот. [52] Фіг. 6 – Схема, на якій показано вид зверху деяких вибраних ділянок для введення штучно закодованих амінокислот. [53] Фіг. 7 – Схема, на якій показано вид збоку деяких вибраних ділянок для введення штучно закодованих амінокислот, та яка пояснює, які з цих ділянок знаходяться поблизу від сайтів глікозилування. [54] Фіг. 8 – Таблиця, у якій наведені деякі вибрані ділянки для введення штучно закодованих амінокислот, природна амінокислота та амінокислотне положення з послідовності SEQ ID NO: 2 та послідовності SEQ ID NO: 4, і середнє значення Cx для цих ділянок. [55] Фіг. 9 – Таблиця, у якій наведені деякі вибрані ділянки для введення штучно закодованих амінокислот, природна амінокислота та амінокислотне положення з послідовності SEQ ID NO: 2 та послідовності SEQ ID NO: 4, і середнє значення Cx для цих ділянок. [56] Фіг. 10a – Оптична густина при 450 нм у залежності від концентрації буфера для одержання лікарської форми. [57] Фіг. 10b – Оптична густина при 450 нм у залежності від концентрації ендотоксину. [58] Фіг. 11 – Схема аналізу проліферації ТF-1. [59] Фіг. 12 – Схема гомодимеризації рецепторів fEPO при зв'язуванні ліганду. [60] Фіг. 13 – При нанесенні показників оптичної густини при 450 нм у залежності від підвищених концентрацій fEPO, одержують дзвоноподібну криву залежності "доза-ефект". [61] Фіг. 14 – Показана різна густина клітин TF-1 при посіві. Цей графік показує, що, у разі, 8 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, шляху трансдукції сигналу JAK-STAT, співвідношення між fEPO та рецептором fEPO, для оптимальної активності у відповідь на fEPO, становить 1:2. [62] Фіг. 15 – Графік експериментальних результатів з визначення, чи буде голодування клітин синхронізувати поділ клітин та забезпечувати більший динамічний діапазон, – результати показали, що це не забезпечувало особливої переваги. [63] Фіг. 16 – Крива умов, що застосовувались при проведенні аналізу TF-1 при густині посіву 20000, 72 год. інкубації, вихідній концентрації fEPO 500 нг/мл та розведенні 2,5. [64] Фіг. 17 – Таблиця з визначенням стійкості аналізу, що надає дані стосовно кількості клітинних пасажів, EC50, показників оптичної густини та динамічних діапазонів. [65] Фіг. 18 – Таблиця і графік аналітичних характеристик TF-1 з fEPO дикого типу та буфером для одержання лікарської форми. [66] Фіг. 19 – Графік порівняння аналітичних характеристик людських та котячих EPO дикого типу. [67] Фіг. 20 – Крива визначених показників оптичної густини у залежності від змінних концентрацій кондиціонованих та некондиціонованих середовищ для CHO із застосуванням fEPO дикого типу у якості контролю. [68] Фіг. 21 – Криві порівняння fEPO дикого типу, CHO/PEI+1,25 нг/мл fEPO та лише CHO/PEI із зменшенням концентрації та їхні визначені показники оптичної густини. [69] Фіг. 22 – Таблиця і графіки відносної активності варіантів fEPO з введеною штучною амінокислотою, pAF, у порівнянні з fEPO дикого типу. [70] Фіг. 23 – Стовпчикова діаграма декількох варіантів fEPO з введеною pAF на визначених ділянках та кожен з їхніх показників ED50 у нг/мл. [71] Фіг. 24 – Крива варіанту fEPO E72, що зберігався при температурі чотири градуси та мінус вісімдесят градусів впродовж п'яти тижнів, у порівнянні з fEPO дикого типу та відповідні показники оптичної густини. [72] Фіг. 25 – Схематичне зображення вектора Lucy F та ділянок тРНК, транскрипційного елемента гена, який становить інтерес та тРНК-синтетази. [73] Фіг. 26 – Схематичне зображення вектора Irwin та ділянок тРНК, транскрипційного елемента гена, який становить інтерес та тРНК-синтетази. [74] Фіг. 27 – Схематичне зображення генно-інженерної конструкції супресованої експресії Nat L BB-Opti FEPO у векторі Lucy F для еритропоетину котячих. [75] Фіг. 28 – Схематичне зображення генно-інженерної конструкції супресованої експресії Nat L BB-Opti FEPO у векторі Irwin для еритропоетину котячих. [76] Фіг. 29 – Схематичне зображення генно-інженерної конструкції супресованої експресії за цим винаходом, що кодує характерне для даного виду антитіло з генами легкого і важкого ланцюгів. [77] Фіг. 30 – Стовпчикова діаграма, що показує рівні супресії варіантів fEPO у присутності pAF, визначені засобами ELISA (OD-50). [78] Фіг. 31 – Показує порівняння міграції пегільованого fEPO засобами SDS-PAGE (електрофорез в поліакриламідному гелі в присутності додецилсульфата натрію). Смуги 1-3: реакції 20 кДа PEG з fEPO R53 pAF варіантом. Смуга 1: R53, 8 мкг навантаження fEPO, без PEG. Смуга 2: пегілування R53, 2 мкг навантаження fEPO. Смуга 3: пегілування R53, 8 мкг навантаження fEPO. Смуги 4-6: реакції 30 кДа PEG з fEPO P129 pAF варіантом. Смуга 4: P129, 8 мкг навантаження fEPO, без PEG. Смуга 5: пегілування P129, 2 мкг навантаження fEPO. Смуга 6: пегілування P129, 8 мкг навантаження fEPO. Смуги 7-9: реакції 40 кДа PEG з fEPO Y49 pAF варіантом. Смуга 7: Y49, 8 мкг навантаження fEPO, без PEG. Смуга 9: пегілування Y49, 8 мкг навантаження fEPO. Смуга 9: пегілування Y49, 2 мкг навантаження fEPO. Горизонтальна стрілка на 38 кДа вказує місцезнаходження міграції непегільованого fEPO. Прямокутна рамка вказує ділянку міграції пегільованого fEPO. [79] Фіг. 32 – Гель SDS-PAGE, що показує реакції пегілування (30 кДа) pAF варіантів fEPO D55 та P129, де представлені ці два пегільовані варіанти. Смуга 1: D55, без PEG. Смуга 2: пегілування D55. Смуга 3: fEPO дикого типу, без інкубації. Смуга 4: P129, 8 мкг навантаження fEPO, без PEG. Смуга 5: пегілування P129, 2 мкг навантаження fEPO. Смуга 6: пегілування P129, 8 мкг навантаження fEPO. Горизонтальна стрілка на 38 кДа вказує місцезнаходження міграції непегільованого fEPO. Прямокутна рамка вказує ділянку міграції пегільованого fEPO. [80] Фіг. 33 – Гель SDS-PAGE, що показує успішну реакцію пегілування (30 кДа) pAF варіанту fEPO А1. Смуга 1 показує fEPO дикого типу, 8 мкг навантаження, без інкубації і смуга 2 показує пегільований A1. [81] Фіг. 34 – Порівняння амінокислотних послідовностей cEPO (послідовність SEQ ID NO: 31) та fEPO (послідовність SEQ ID NO: 4), що показує 94 % гомологію між двома згаданими 9 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовностями. [82] Фіг. 35 – Порівняння амінокислотних послідовностей еEPO (послідовність SEQ ID NO: 33) та fEPO (послідовність SEQ ID NO: 4), що показує 94 % гомологію між двома згаданими послідовностями. [83] Фіг. 36 – Графік, що показує вплив різних обробок на гематокрит та кількість еритроцитів (RBC) у експерименті, який було проведено у Прикладі 32. Визначення [84] Слід розуміти, що цей винахід не обмежується конкретною методологією, методами, лініями клітин, генно-інженерними конструкціями та реактивами, опис яких наведено, оскільки вони можуть змінюватись. Слід також розуміти, що термінологія, яка застосовується у цьому описі, призначена лише для опису конкретних прикладів здійснення і не призначена для обмеження обсягу цього винаходу, який обмежений лише формулою винаходу, що додається. [85] Форми однини, які вживають у цьому описі і формулі винаходу, яка додається, охоплюють і форми множини, якщо контекст явно не вказує на інше. Так, наприклад, посилання на "fEPO" є посиланням на один або декілька таких білків і включає їх еквіваленти, відомі фахівцям у цій галузі. [86] Якщо не вказується інше, усі технічні та наукові терміни, які вживаються у цьому описі, мають загальноприйняте значення, зрозуміле для фахівця у галузі, до якої належить цей винахід. Наведено опис способів, пристроїв та матеріалів, яким віддають перевагу, хоча при практичному здійсненні або випробуванні цього винаходу можуть бути застосовані будь-які способи, пристрої та матеріали, аналогічні або еквівалентні тим, які описані. [87] Усі публікації і патенти, які згадуються у цьому описі, включені до нього шляхом посилань з метою опису та розкриття, наприклад, генно-інженерних конструкцій та методів, які описують у публікаціях, що можуть застосовуватись у зв'язку з винаходом, опис якого наводиться. Публікації, що обговорюються у цьому описі, наведені виключно для їх розкриття раніше дати подання цієї заявки. Ніщо у цій заявці не повинно розглядатись як припущення того, що заявники не мають права датувати таке розкриття більш раннім числом унаслідок попереднього винаходу або з будь-якої іншої причини. [88] Термін "по суті очищений" означає fEPO, який може бути значною мірою або по суті вільним від компонентів, які, за нормальних обставин, супроводжують або взаємодіють з білком у його природному середовищі, тобто нативній клітині або клітині-хазяїні у разі рекомбінантно продукованого fEPO. fEPO, що може бути по суті вільним від клітинного матеріалу, включає препарати білка, що мають менше ніж приблизно 30 %, менше ніж приблизно 25 %, менше ніж приблизно 20 %, менше ніж приблизно 15 %, менше ніж приблизно 10 %, менше ніж приблизно 5 %, менше ніж приблизно 4 %, менше ніж приблизно 3 %, менше ніж приблизно 2 % або менше ніж приблизно 1 % (за сухою масою) контамінуючого білка. У разі, коли fEPO або його варіант продукується клітинами-хазяями рекомбінантним шляхом, згаданий білок може бути присутнім на рівні приблизно 30 %, приблизно 25 %, приблизно 20 %, приблизно 15 %, приблизно 10 %, приблизно 5 %, приблизно 4 %, приблизно 3 %, приблизно 2 % або приблизно 1 % чи менше від сухої маси клітин. У разі, коли fEPO або його варіант продукується клітинами-хазяями рекомбінантним шляхом, згаданий білок може бути присутнім у культуральному середовищі на рівні приблизно 5 г/л, приблизно 4 г/л, приблизно 3 г/л, приблизно 2 г/л, приблизно 1 г/л, приблизно 750 мг/л, приблизно 500 мг/л, приблизно 250 мг/л, приблизно 100 мг/л, приблизно 50 мг/л, приблизно 10 мг/л або приблизно 1 мг/л чи менше від сухої маси клітин. Таким чином, "по суті очищений" fEPO, у разі одержання за способами, які відповідають цьому винаходу, може мати рівень чистоти щонайменше приблизно 30 %, щонайменше приблизно 35 %, щонайменше приблизно 40 %, щонайменше приблизно 45 %, щонайменше приблизно 50 %, щонайменше приблизно 55 %, щонайменше приблизно 60 %, щонайменше приблизно 65 %, щонайменше приблизно 70 %, конкретно, рівень чистоти щонайменше приблизно 75 %, 80 %, 85 % і ще конкретніше, рівень чистоти щонайменше приблизно 90 %, рівень чистоти щонайменше приблизно 95 %, рівень чистоти щонайменше приблизно 99 % або більше, як визначається за допомогою відповідних методик, наприклад, аналізом SDS/PAGE, RP-HPLC, SEC та капілярним електрофорезом. [89] Термін "рекомбінантна клітина-хазяїн" або "клітина-хазяїн" означає клітину, яка містить екзогенний полінуклеотид, незалежно від способу, який застосували для введення, наприклад, такого способу як пряме захоплення, трансдукція, f-кон'югація або інші способи, відомі у цій галузі для одержання рекомбінантних клітин-хазяїв. Екзогенний полінуклеотид можна зберігати як неінтегрований вектор, наприклад, плазміду, або за альтернативним варіантом можна інтегрувати до генома клітини-хазяїна. [90] Термін "живильне середовище" або "живильні середовища", який вживають у цьому 10 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 описі, охоплює будь-яке культуральне середовище, розчин, тверду, напівтверду або жорстку основу, які можуть підтримувати або містити будь-яку клітину-хазяїна, у тому числі бактеріальні клітини-хазяї, дріжджові клітини-хазяї, клітини-хазяї комах, клітини-хазяї рослин, еукаріотні клітини-хазяї, клітини-хазяї ссавців, клітини CHO або E. coli та вміст клітин. Таким чином, цей термін може охоплювати живильне середовище, у якому була вирощена клітина-хазяїн, наприклад, середовище, до якого було секретовано fEPO, у тому числі середовище перед або після етапу проліферації. Цей термін може також охоплювати буфери або реактиви, що містять лізати клітин-хазяїв, наприклад, у разі, коли fEPO продукується усередині клітин і клітини-хазяї піддають лізису або руйнуванню для вивільнення fEPO. [91] Термін "IRES" або "ділянка внутрішньої посадки рибосоми", який вживають у цьому описі, є відомим фахівцям у цій галузі. IRES являє собою ділянку нуклеїновокислотної молекули, наприклад, молекули мРНК, яка надає можливість внутрішньої посадки/зв'язування рибосоми такою мірою, що є достатньою для ініціювання трансляції у аналізі кеп-незалежної трансляції, наприклад, у аналізі репортерів з біцистронними мРНК, опис якого наведено у патенті США 6,715,821. Присутність IRES у межах молекули мРНК надає можливість кепнезалежної трансляції сполученої білок-кодувальної послідовності, яка б у іншому разі не транслювалась. IRES вперше були ідентифіковані у пікорнавірусів і вважаються парадигмою кеп-незалежної трансляції. 5' UTR (ділянки, що не транслюються) усіх пікорнавірусів є довгими і опосередковують ініціацію трансляції шляхом прямого рекрутингу та зв'язування рибосом, з обходженням тим самим початкової стадії кеп-зв'язування. [92] IRES елементи часто знаходять у вірусних мРНК і рідко у невірусних мРНК. На сучасному етапі до невірусних мРНК, які містять функціональні IRES елементи у їхніх відповідних 5' UTR, належать мРНК, що кодують зв'язувальний білок важких ланцюгів імуноглобуліну (BIP) (Macejak D.J. et al., Nature 353:90-94 (1991)); Drosophila Antennapedia (Oh S.K. et al., Genes Dev. 6:1643-53 (1992)); та ультрабіторан (Ultrabithoran) (Ye X. et al., Mol. Cell. Biol. 17:1714-21 (1997)); фактор росту фібробластів 2 (Vagner et al., Mol. Cell. Biol. 15:35-47 (1915); фактор ініціації (Gan et al., J. Biol. Chem. 273:5006-12 (1992)); білок-онкоген c-myc (Nambru et al., J. Biol. Chem. 272:32061-6 (1995)); Stonely M. Oncogene 16:423-8 (1998)); фактор росту ендотелію судин (VEGF) (Stein J. et al., Mol. Cell. Biol. 18:3112-9 (1998)). Клітинні IRES елементи не мають очевидної подібності послідовності або структурної подібності з послідовностями IRES або між собою і, як наслідок, ідентифікуються за допомогою аналізів трансляції. Еншою відомою IRES є XIAP IRES, розкрита у патенті США 6,171,821, який у повному обсязі включено до цього опису шляхом посилання. [93] Термін "відновник", який вживають у цьому описі стосовно рефолдингу білків, визначається як будь-яка сполука або матеріал, який підтримує сульфгідрильні групи у відновленому стані та відновлює внутрішньомолекулярні та міжмолекулярні дисульфідні зв'язки. До прийнятних відновників належать, але ними не обмежуються, дитіотреітол (DTT), 2меркаптоетанол, дитіоеритритол, цистеїн, цистеамін (2-аміноетантіол) та відновлений глутатіон. Фахівцям у цій галузі зрозуміло, що для застосування у способах та композиціях за цим винаходом є прийнятними найрізноманітніші відновники. [94] Термін "окисник", який вживають у цьому описі стосовно рефолдингу білків, визначається як будь-яка сполука або матеріал, які є здатними до видалення електрону із сполуки, яку піддають окисненню. До прийнятних окисників належать, але ними не обмежуються, окиснений глутатіон, цистин, цистамін, окиснений дитіотреітол, окиснений еритреітол та кисень. Фахівцям у цій галузі зрозуміло, що для застосування у способах та композиціях за цим винаходом є прийнятними найрізноманітніші окисники. [95] Термін "денатуруюча речовина" або "денатурант", який вживають у цьому описі, визначається як будь-яка сполука або матеріал, що спричинює оборотне розгортання білкової молекули. Сила денатуруючої речовини або денатуранту буде визначатись як властивостями, так і концентрацією конкретної денатуруючої речовини або денатуранту. Відповідними денатуруючими речовинами або денатурантами можуть бути хаотропи, детергенти, органічні розчинники, водозмішувальні розчинники, фосфоліпіди або комбінація двох або декількох таких речовин. Відповідні хаотропи включають (але ними не обмежуються) сечовину, гуанідин та тіоціанат натрію. Придатні детергенти можуть включати (але ними не обмежуватись) сильні детергенти, наприклад, додецилсульфат натрію або прості ефіри поліоксіетилену (наприклад, такі детергенти, як твін або тритон), саркозил, м'які неіоногенні детергенти (наприклад, дигітонін), м'які катіоногенні детергенти, наприклад, N-›2,3-(діолеїлокси)-пропіл-N, N,Nтриметиламоній, м'які іоногенні детергенти (наприклад, холат натрію або дезоксихолат натрію) або цвіттеріонні детергенти, у тому числі, але без обмеження, сульфобетаїни (цвіттергент), 3-(3холамідопропіл)диметиламоніо-1-пропансульфат (CHAPS) та 3-(3 11 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 холамідопропіл)диметиламоніо-2-гідрокси-1-пропансульфонат (CHAPSO). Органічні водозмішувальні розчинники, наприклад, ацетонітрил, нижчі алканоли (зокрема, C 2-C4алканоли, наприклад, етанол або ізопропанол) або нижчі алкандіоли (зокрема, C 2-C4алкандіоли, наприклад, етиленгліколь) можуть застосовуватись як денатуранти. Фосфоліпіди, придатні для цього винаходу, можуть бути природними фосфоліпідами, наприклад, фосфатиділетаноламін, фосфатиділхолін, фосфатиділсерин та фосфатиділізонітол, або синтетичні похідні чи варіанти фосфоліпідів, наприклад, дигексаноїлфосфатиділхолін або дигептаноїлфосфатиділхолін. [96] Термін "рефолдинг", який вживають у цьому описі, описує будь-який процес, реакцію або метод, що трансформує поліпептиди, які містять дисульфідні зв'язки, з невідповідно укладеного або розгорнутого стану у нативну або відповідно вкладену конформацію відносно дисульфідних зв'язків. [97] Термін "сумісне вкладання", який вживають у цьому описі, стосується конкретно процесів, реакцій або методів рефолдингу, у яких застосовують щонайменше два поліпептиди, які взаємодіють між собою, результатом чого є трансформування неукладених або невідповідно укладених поліпептидів у нативні, відповідно укладені поліпептиди. [98] Термін "еритропоетин" або "EPO", який вживають у цьому описі, означає ті поліпептиди та білки, які мають щонайменше одну біологічну активність еритропоетину котячих (fEPO), а також аналоги еритропоетину, ізоформи еритропоетину (такі як сполуки, описані у патенті США 5,856,298, який включений до цього опису шляхом посилання), міметики еритропоетину (такі як сполуки, описані у патенті США 6,310,078, який включений до цього опису шляхом посилання), фрагменти еритропоетину, гібридні білки еритропоетину, гібридні олігомерні та мультимерні білки, гомологи, глікозиловані варіанти та мутеїни, незалежно від їхньої біологічної активності і, окрім того, незалежно від способу їхнього синтезування або одержання, у тому числі, але без обмеження, рекомбінантними (продукованими з кДНК або геномної ДНК), синтетичними, трансгенними методами та методами активації генів. Конкретні приклади еритропоетину включають (але ними не обмежуються) епоетин альфа (такі як сполуки, описані у патентах США 4,667,016; 4,703,008; 5,441,868; 5,547,933; 5,618,698; 5,621,080; 5,756,349 та 5,955,422, які включені до цього опису шляхом посилання), дарбепоетин альфа (наприклад, описаний у заявці ™TM на патент EP 640619), DYNEPO (епоетин дельта), аналог людського еритропоетину (такий як гібридні білки людського сироваткового альбуміну, опис яких наведений у міжнародній патентній заявці WO 99/66054 та патентах США 6,548,653 та 5,888,772, які включені до цього опису шляхом посилання), мутантні варіанти еритропоетину (опис яких наведений у міжнародній патентній заявці WO 99/38890 та патентах США 6,489,293; 5,888,772; 5,614,184 та 5,457,089, які включені до цього опису шляхом посилання), еритропоетин омега (який можна одержати з рестрикційного фрагменту Apa I гена людського еритропоетину, опис якого наведений у патентах США 5,688,679; 6,099,830; 6,316,254 та 6,682,910, які включені до цього опису шляхом посилання), змінений глікозилований людський еритропоетин (опис якого наведений у WO 99/11781 та EP 1064951) та PEG-кон'юговані аналоги еритропоетину (опис яких наведений, наприклад, у WO 9805363 та патентах США 5,643,575; 6,583,272; 6,340,742 та 6,586,398, які включені до цього опису шляхом посилання). Опис конкретних прикладів ліній клітин, модифікованих для експресії ендогенного людського еритропоетину, наведено у міжнародних патентних заявках WO 99/05268 та WO 94/12650 і патенті США 6,376,218, які включені до цього опису шляхом посилання). [99] Термін "еритропоетин котячих (fEPO)" або "поліпептид fEPO" означає еритропоетин або EPO, як описано вище, а також поліпептид, що зберігає щонайменше одну біологічну активність природного fEPO. Поліпептиди fEPO включають фармацевтично прийнятні солі та проліки, а також проліки, що являють собою солі, поліморфи, гідрати, сольвати, біологічно активні фрагменти, біологічно активні варіанти та стереоізомери природного еритропоетину котячих, а також агоністичні, міметичні та антагоністичні варіанти природного людського еритропоетину та його гібридні поліпептиди. Приклади поліпептидів та міметиків fEPO включають сполуки, описані у патентах США 6,310,078; 5,106,954; 6,703,480; 6,642,353; 5,986,047 та 5,712,370, які включені до цього опису шляхом посилання. Гібриди, що містять додаткові амінокислоти на амінокінці, карбоксильному кінці або на обох, охоплюються терміном "поліпептид fEPO". Зразкові гібриди включають (але ними не обмежуються), наприклад, метіоніл-еритропоетин, у якого метіонін є сполученим з N-кінцем fEPO, гібриди, призначені для очищення (у тому числі, але без обмеження, полігістидин або афінні антигенні детермінанти), гібриди з пептидами, що зв'язують сироватковий альбумін, та гібриди з сироватковими білками, наприклад, сироватковим альбуміном. Нуклеїнові кислоти природного fEPO та амінокислотні послідовності є відомими. Повна амінокислотна послідовність природного fEPO, а також амінокислотна послідовність 12 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 зрілої форми природного hEPO представлені наведеними у цьому описі послідовностями SEQ ID NO: 1 та SEQ ID NO: 2, відповідно. Повна консенсусна амінокислотна послідовність fEPO, а також консенсусна амінокислотна послідовність зрілої форми fEPO представлені наведеними у цьому описі послідовностями SEQ ID NO: 3 та SEQ ID NO: 4, відповідно. За деякими варіантами здійснення цього винаходу поліпептиди fEPO за цим винаходом є по суті ідентичними послідовностям SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 або SEQ ID NO: 4. Відомими також є нуклеїновокислотні молекули, що кодують мутантні форми fEPO та мутантні форми поліпептидів fEPO. До прикладів мутантних форм fEPO належать мутантні форми, розкриті у патентах США 6,489,293; 6,153,407; 6,048,971; 5,614,184 та 5,457,089, які включені до цього опису шляхом посилання. [100] Еритропоетин або fEPO має цілий ряд біологічних активностей, у тому числі, але без обмеження, зв'язування свого рецептора, спричинення димеризації свого рецептора, стимуляції продукування еритроцитів та стимуляції проліферації клітин. Приклади деяких біологічних активностей еритропоетину та hEPO описані у патентах США 6,676,947; 6,579,525; 6,531,121; 6,521,245; 6,489,293; 6,368,854; 6,316,254; 6,268,336; 6,239,109; 6,165,283; 5,986,047; 5,830,851 та 5,773,569, які включені до цього опису шляхом посилання. [101] Біологічно активні фрагменти/варіанти fEPO включають генний продукт, що складається із 192 амінокислот, перші 26 з яких розщеплюються під час секреції, а також видалення однієї або декількох з останніх чотирьох амінокислот під час утворення зрілої форми еритропоетину (послідовність SEQ ID NO: 1 і послідовність SEQ ID NO: 2). Термін "поліпептид fEPO" також охоплює глікозиловані форми з N-зв'язаними сайтами глікозилування у положеннях 24, 38 та 83 і O-зв'язаним сайтом глікозилування у положенні 126 (Takeuchi et al. (1988) JBC 263: 3657-3663; Saski et al. (1988) Biochemistry 27: 8618-8626). Варіанти, що містять однонуклеотидні заміни (тобто S104N та L105F, P122Q, E13Q, Q58→QQ, G113R), також вважаються біологічно активними варіантами hEPO (Jacobs et al., (1985) Nature 313: 806-810; Funakoshi et al., (1993) Biochem.Biophys.Res.Comm. 195: 717-722). Термін "поліпептид fEPO" також охоплює гетеродимери, гомодимери, гетеромультимери або гомомультимери fEPO або будь-який інший поліпептид, білок, вуглевод, полімер, дрібну молекулу, ліганд або іншу активну молекулу будь-якого типу, сполучену хімічними засобами або експресовану як гібридний білок (Sytkowski et al., (1998) Proc. Natl. Acad. Sci. USA 95(3):1184-1188; та Sytkowski et al. (1999) J. Biol. Chem. 274(35):24773-8, і патенти США 6,187,564; 6,703,480; 5,767,078, які включені до цього опису шляхом посилання), а також аналоги поліпептидів, які містять специфічні делеції, але зберігають біологічну активність (Boissel et al., (1993) JBC 268: 15983-15993; Wen et al., (1994) JBC 269: 22839-22846; Bittorf et al., (1993) FEBS 336: 133-136; і патент США 6,153,407, які включені до цього опису шляхом посилання). [102] Усі посилання на амінокислотні положення fEPO, опис яких наведено, робляться на основі положень послідовності SEQ ID NO: 2, якщо не вказується інше (тобто коли вказується, що порівняння робиться на основі послідовності SEQ ID NO: 3). Фахівцям у цій галузі буде зрозуміло, що амінокислотні положення, які відповідають положенням послідовності SEQ ID NO: 2, можуть бути легко ідентифіковані у гібридів, варіантів, фрагментів fEPO тощо. Наприклад, програми вирівнювання послідовностей, наприклад, BLAST, можуть застосовуватись для вирівнювання та ідентифікування конкретного положення у білка, що відповідає положенню послідовності SEQ ID NO: 2. Заміни, делеції або додання амінокислот, опис яких наведено відносно послідовності SEQ ID NO: 2, призначені також для посилання на заміни, делеції або додання у відповідних положеннях гібридів, варіантів, фрагменті fEPO тощо, опис яких наведено або які є відомими у цій галузі і явно охоплюються цим винаходом. [103] Термін "поліпептид fEPO" охоплює поліпептиди fEPO, які містять одну або декілька амінокислотних замін, додань або делецій. Були описані зразкові заміни різноманітних амінокислотних положень природного fEPO, у тому числі, але без обмеження, заміни, що підвищують агоністичну активність, підвищують розчинність поліпептиду, перетворюють поліпептид на антагоніста тощо і охоплюються терміном "поліпептид fEPO". [104] До антагоністів EPO котячих належать, але ними не обмежуються, антагоністи, що мають заміни у положеннях V11, R14, Y15, D96, K97, S100, R103, S104, T107, L108 та R110 (у тому числі, але без обмеження, V11S, R14Q, Y15I, S100E, R103A, S104I та L108K, дивись Elliot et al. 1993), які знаходяться на сайті зв'язування рецептора з низькою спорідненістю (сайт 2). За деякими варіантами здійснення цього винаходу антагоністи fEPO містять щонайменше одну заміну на ділянках 10-15 або 100-108, які примушують fEPO відігравати роль антагоніста. Дивись, наприклад, Elliot et al. 1993 та Cheetham et al. 1998. За деякими варіантами здійснення цього винаходу антагоніст fEPO містить штучно закодовану амінокислоту, сполучену з водорозчинним полімером, що знаходиться на ділянці зв'язування (Сайт 2) молекули hEPO. За 13 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 деякими варіантами здійснення цього винаходу поліпептид fEPO зазнає додаткових модифікацій шляхом введення наведених нижче замін: V11S, R14Q, Y15I, S100E, R103A, S104I та L108K. [105] За деякими варіантами здійснення цього винаходу поліпептиди fEPO додатково містять додання, заміну або делецію, що модулює біологічну активність fEPO. Наприклад, додання, заміни або делеції можуть модулювати спорідненість до рецептора fEPO, модулювати (з включенням, але без обмеження, підвищення або зменшення) димеризацію рецептора, стабілізувати димери рецепторів, модулювати час половини строку життя у кров'яному руслі, модулювати період напіввиведення терапевтично ефективної кількості, модулювати стабільність поліпептиду, модулювати дозу, модулювати виділення або біологічну доступність, полегшувати очищення або поліпшувати чи змінювати конкретний шлях введення. Подібним же чином, поліпептиди fEPO можуть містити послідовності розщеплення протеазами, реакційноздатні групи, антигензв'язувальні центри (у тому числі, але без обмеження, FLAG або полі-His, ) або інші послідовності на основі спорідненості (у тому числі, але без обмеження, FLAG, полі-His, GST тощо) чи сполучені молекули (у тому числі, але без обмеження, біотин), які поліпшують виявлення (у тому числі, але без обмеження, GFP), очищення або інші особливості поліпептиду. [106] Термін "поліпептид fEPO" також охоплює гомодимери, гетеродимери, гомомультимери та гетеромультимери fEPO, що є сполученими безпосередньо через бічні ланцюги штучно закодованих амінокислот з бічними ланцюгами тих же самих або іншихштучно закодованих амінокислот, з бічними ланцюгами природних амінокислот або опосередковано через сполучний агент. До прикладів сполучних агентів належать (але ними не обмежуються) водорозчинні полімери, такі як полі(етиленгліколь) або полідекстран, або поліпептид. [107] Термін "штучно закодована амінокислота" означає амінокислоту, що не є однією з 20 звичайних амінокислот або піролізином чи селеноцистеїном. Термін "штучно закодована амінокислота" охоплює (але ними не обмежується) амінокислоти, які одержують шляхом модифікування природної амінокислоти (у тому числі, але без обмеження, 20 звичайних амінокислот або піролізину чи селеноцистеїну), але які самі по собі не вводяться до збільшуваного трансляційним комплексом ланцюга поліпептиду. Приклади природних амінокислот, що не кодуються природним шляхом, включають (але ними не обмежуються) Nацетилглюкозамініл-L-серин, N-ацетилглюкозамініл-L-треонін та O-фосфотирозин. [108] Термін "амінокінцева група-модифікатор" означає будь-яку молекулу, що може приєднуватись до амінокінця поліпептиду. Подібним же чином, термін "карбоксикінцева групамодифікатор" означає будь-яку молекулу, що може приєднуватись до карбоксильного кінця поліпептиду. Кінцеві групи-модифікатори включають (але ними не обмежуються) різні водорозчинні полімери, пептиди або білки, наприклад, сироватковий альбумін або інші складові, що підвищують період напіввиведення пептидів з плазми. [109] Термін "функціональна група", "активна складова", "активуюча група", "відщеплювана група", "реакційно-активна ділянка", "хімічно-активна група" та "хімічно-активна складова" вживають у цій галузі та у цьому описі для посилання на певні ділянки або елементи молекули, які піддаються визначенню. Згадані терміни є до деякої міри синонімічними у галузі хімії і вживаються у цьому описі для визначення ділянок молекул, що здійснюють якусь функцію або активність і є реакційноактивними з іншими молекулами. [110] Термін "сполучення" або "сполучний агент" застосовують у цьому описі для посилання на агенти або зв'язки, які, за нормальних обставин, формуються як наслідок хімічної реакції і, як правило, є ковалентними зв'язками. Термін "гідролітично стабільні зв'язки" означає, що зв'язки є по суті стабільними у воді і не реагують з водою при застосовуваних значеннях рН, у тому числі, але без обмеження, за фізіологічних умов впродовж тривалого періоду часу, можливо, навіть безкінечно. Термін "гідролітично нестабільні або гідролітично розкладні зв'язки" означає, що зв'язки розпадаються у воді або у водних розчинах, у тому числі, наприклад, у крові. Термін "ферментативно нестабільні або ферментативно розкладні зв'язки" означає, що зв'язок може бути розкладеним одним або декількома ферментами. У цій галузі припускають, що полі(етиленгліколь) та споріднені полімери можуть мати розкладні зв'язки у каркасі полімеру або у сполучній групі між каркасом полімеру та однією або декількома кінцевим функціональними групами полімерної молекули. Наприклад, складноефірні зв'язки, утворені унаслідок реакції пегільованих карбонових кислот або PEG-активованих карбонових кислот із спиртовими групами біологічно активного агента зазвичай гідролізуються за фізіологічних умов з виділенням згаданого агента. Енші гідролітично розкладні зв'язки включають (але ними не обмежуються) карбонатні зв'язки; імінові зв'язки, що є наслідком реакції аміну та альдегіду; фосфатноефірні зв'язки, утворені шляхом реакції спирту з фосфатною групою; гідразонові 14 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язки, що є продуктом реакції гідразиду та альдегіду; ацеталеві зв'язки, що є продуктом реакції альдегіду та спирту; складні ортоефірні зв'язки, що є продуктом реакції форміату та спирту; пептидні зв'язки, що утворюються аміногрупою, у тому числі, але без обмеження, на кінці полімеру, наприклад, полі(етиленгліколю), та карбоксильною групою пептиду; та олігонуклеотидні зв'язки, що утворюються фосфорамідитною групою, у тому числі, але без обмеження, на кінці полімеру, та 5' гідроксильною групою олігонуклеотиду. [111] Термін "біологічно активна молекула", "біологічно активна складова" або "біологічно активний агент", у разі вживання у цьому описі, означає будь-яку речовину, яка може впливати на будь-які фізичні або біохімічні властивості біологічного мікроорганізму, у тому числі, але без обмеження, вірусів, бактерій, грибів, рослин, тварин та людей. Зокрема, як вживають у цьому описі, біологічно активні молекули включають (але ними не обмежуються) будь-яку речовину, призначену для діагностування, лікування, заспокоєння або запобігання хвороби у людей або інших тварин чи поліпшення іншим шляхом фізичного або психічного благополуччя людей або тварин. Приклади біологічно активних молекул включають (але ними не обмежуються) пептиди, білки, ферменти, дрібномолекулярні лікарські засоби, барвники, ліпіди, нуклеозиди, олігонуклеотиди, клітини, віруси, ліпосоми, мікрочастинки та міцели. Класи біологічно активних агентів, що є прийнятними для застосування з цим винаходом, включають (але ними не обмежуються) антибіотики, фунгіциди, противірусні агенти, протизапальні агенти, протипухлинні агенти, засоби для лікування серцево-судинних захворювань, антифобічні седативні засоби, гормони, фактори росту, стероїдні агенти тощо. [112] Термін "біфункціональний полімер" означає полімер, який містить дві окремі функціональні групи, що є здатними до реагування, зокрема, з іншими складовими (у тому числі, але без обмеження, бічними групами амінокислот) з утворенням ковалентних або нековалентних зв'язків. Біфункціональна сполучна група, що має одну функціональну групу, яка може реагувати з групою конкретної біологічно активної складової, та іншу групу, яка може реагувати з групою другої біологічної складової, може застосовуватись для утворення кон'югату, який містить першу біологічно активну складову, біфункціональну сполучну групу та другу біологічно активну складову. Відомо багато методів та сполучних молекул для приєднання різних сполук до пептидів. Дивись, наприклад, заявку EP 188,256; патенти США 4,671,958, 4,659,839, 4,414,148, 4,699,784; 4,680,338; 4,569,789 та 4,589,071, які включені до цього опису шляхом посилання. Термін "багатофункціональний полімер" означає полімер, що містить дві або декілька окремих функціональних груп, які є здатними до реагування, зокрема, з іншими складовими (у тому числі, але без обмеження ними, бічними групами амінокислот) з утворенням ковалентних або нековалентних зв'язків. [113] У тому разі, коли замінні групи визначаються традиційними хімічними формулами, записаними зліва-направо, вони також охоплюють хімічно ідентичні замісники, що є наслідком запису структури справа-наліво, наприклад, структура -CH2O- є еквівалентною структурі -OCH2-. [114] Термін "замісники" охоплює, але без обмеження ним, термін "нейтральні замісники". До числа "нейтральних замісників" належать групи, що формують стабільні сполуки. Відповідні нейтральні замісники або радикали включають (але ними не обмежуються) галоген, C1-C10алкіл, C2-C10-алкеніл, C2-C10-алкініл, C1-C10-алкоксигрупа, C1-C12-аралкіл, C1-C12-алкарил, C3-C12циклоалкіл, C3-C12-циклоалкеніл, феніл, заміщений феніл, толуоїл, ксиленіл, біфеніл, C 2-C12алкоксіалкіл, C2-C12-алкоксіарил, C7-C12-арилоксіалкіл, C7-C12-оксіарил, C1-C6-алкілсульфініл, C1C10-алкілсульфоніл, -(CH2)m-O- (C1-C10-алкіл), де m – від 1 до 8, арил, заміщений арил, заміщена алкоксигрупа, фторалкіл, гетероциклічний радикал, заміщений гетероциклічний радикал, нітроалкіл, -NO2, -CN, -NRC(O)-(C1-C10-алкіл), -C(O)-(C1-C10-алкіл), C2-C10-алкілтіоалкіл, -C(O)O(C1-C10-алкіл), -OH, -SO2, =S, -COOH, -NR2, карбоніл, -C(O)-(C1-C10-алкіл)-CF3, -C(O)-CF3, C(O)NR2, -(C1-C10-арил)-S-(C6-C10-арил), -C(O)-(C1-C10-арил), -(CH2)m-O-(CH2)m-O-(C1-C10-алкіл), де кожен m – від 1 до 8, -C(O)NR2, -C(S)NR2, -SO2NR2, -NRC(O)NR2, -NRC(S)NR2, їх солі і т.ін. Кожен R, як застосовується у цьому описі, являє собою H, алкіл або заміщений алкіл, арил або заміщений арил, аралкіл або алкарил. [115] Термін "галоген" включає фтор, хлор, йод та бром. [116] Термін "алкіл", сам по собі або як частина іншого замісника, означає, якщо не вказується інше, вуглеводневий радикал з прямим або розгалуженим ланцюгом чи циклічний вуглеводневий радикал або їх комбінацію, що може бути повністю насіченим, моно- або поліненасиченим і може включати бі- та полівалентні радикали, що мають вказану кількість атомів вуглецю (тобто C1-C10 означає від одного до десяти атомів вуглецю). Приклади насичених вуглеводневих радикалів включають (але ними не обмежуються) такі групи, як метил, етил, n-пропіл, ізопропіл, n-бутил, t-бутил, ізобутил, втор-бутил, циклогексил, циклогексилметил, циклопропілметил, гомологи та ізомери, наприклад, n-пентил, n-гексил, n 15 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 гептил, n-октил і т.ін. Ненасиченою алкільною групою є група, що має один або декілька подвійних зв'язків або потрійних зв'язків. Приклади ненасичених алкільних груп включають (але ними не обмежуються) вініл, 2-пропеніл, кротил, 2-ізопентеніл, 2-(бутадієніл), 2,4-пентадієніл, 3(1,4-пентадієніл), етиніл, 1- та 3-пропініл, 3-бутиніл і вищі гомологи та ізомери. Термін "алкіл", якщо не вказується інше, також включає похідні алкілу, які докладніше визначаються нижче, наприклад, "гетероалкіл". Алкільні групи, які є обмеженими вуглеводневими групами, позначаються як "гомоалкіл". [117] Термін "алкілен", сам по собі або як частина іншого замісника, означає бівалентний радикал, що є похідною алкану, зразковими (необмежувальними) прикладами якого є структури -CH2CH2- та -CH2CH2CH2CH2-, і який додатково означає групи, які описуються нижче як "гетероалкілен". За типовим варіантом алкільна (або алкіленова) група буде мати від 1 атому до 24 атомів вуглецю, причому перевагу за цим винаходом віддають тим групам, що мають 10 або менше атомів вуглецю. "Нижчим алкілом" або "нижчим алкіленом" є алкільна або алкіленова група з коротшим ланцюгом, який складається, як правило, з восьми або менше атомів вуглецю. [118] Терміни "алкоксигрупа", "алкіламіногрупа" та "алкілтіогрупа" (або тіоалкоксигрупа) застосовують у їх традиційному значенні і вони означають алкільні групи, приєднані до решти молекули через атом кисню, аміногрупу або атом сірки, відповідно. [119] Термін "гетероалкіл", сам по собі або у комбінації з іншим терміном, означає, якщо не вказується інше, стабільний вуглеводневий радикал з прямим або розгалуженим ланцюгом чи циклічний вуглеводневий радикал або їх комбінації, що можуть складатись з визначеної кількості атомів вуглецю і щонайменше одного гетероатому, який вибирають з групи, до складу якої входить O, N, Si та S, і де атоми азоту та сірки факультативно можуть бути окисненими, а гетероатом азоту факультативно може бути кватернізованим. Гетероатом(-и) O, N та S і Si може(-уть) розміщуватись у будь-якому внутрішньому положенні гетероалкільної групи або у положенні, у якому алкільна група приєднується до решти молекули. Приклади включають (але ними не обмежуються) -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2CH3, -CH2-CH2,-S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3 та CH=CH-N(CH3)-CH3. До двох гетероатомів можуть розміщуватись послідовно, наприклад, -CH2NH-OCH3 та -CH2-O-Si(CH3)3. Подібним же чином, термін "гетероалкілен", сам по собі або як частина іншого замісника, означає бівалентний радикал, що є похідною гетероалкілу, наприклад, але без обмеження ними, -CH2-CH2-S-CH2-CH2- та -CH2-S-CH2-CH2-NH-CH2-. В гетероалкіленових групах (у тому числі, але без обмеження ними, алкіленокси-, алкілендіокси-, алкіленаміно-, алкілендіаміногрупах, амінооксіалкілені тощо) однакові або різні гетероатоми можуть також займати будь-який або обидва кінці ланцюга. Окрім того, у разі алкіленових та гетероалкіленових сполучних груп, орієнтація сполучної групи не визначається напрямком, у якому записується формула сполучної групи. Наприклад, формула -C(O)2R'- означає як C(O)2R'-, так і -R'C(O)2-. [120] Терміни "циклоалкіл" та "гетероциклоалкіл", самі по собі або у комбінації з іншими термінами, означають, якщо не вказується інше, циклічні варіанти "алкілу" та "гетероалкілу", відповідно. Так, циклоалкіл або гетероциклоалкіл включає насичені та ненасичені кільцеві містки. Окрім того, у разі гетероциклоалкілу, гетероатом може займати положення, у якому гетероцикл приєднується до решти молекули. Приклади циклоалкілу охоплюють, але ними не обмежуються, циклопентил, циклогексил, 1-циклогексеніл, 3-циклогексеніл, циклогептил і т.ін. Приклади гетероциклоалкілу охоплюють, але ними не обмежуються, 1-(1,2,5,6тетрагідропіридил), 1-піперидиніл, 2-піперидиніл, 3-піперидиніл, 4-морфолініл, 3-морфолініл, тетрагідрофуран-2-іл, тетрагідрофуран-3-іл, тетрагідротієн-2-іл, тетрагідротієн-3-іл, 1піперазиніл, 2-піперазиніл і т.ін. [121] Термін "водорозчинний полімер", який вживають у цьому описі, означає будь-який полімер, що є розчинним у водних розчинниках. Наслідком сполучення водорозчинних полімерів з fEPO можуть бути зміни, у тому числі, але без обмеження, підвищення або модулювання періоду напіввиведення з плазми або підвищення чи модулювання періоду напіввиведення терапевтично ефективної кількості, у порівнянні з немодифікованою формою, модульована імуногенність, модульовані характеристики фізичних зв'язків, наприклад, агрегування та утворення мультимерів, змінене зв'язування з рецептором та змінена димеризація або мультимеризація рецепторів. Водорозчинний полімер може мати або може не мати своєї власної біологічної активності. Відповідні полімери включають (але ними не обмежуються) поліетиленгліколь, поліетиленглікольпропіоновий альдегід, їх моно C 1-C10алкокси- або арилокси- похідні (описані у патенті США 5,252,714, який включений до цього опису шляхом посилання), монометоксиполіетиленгліколь, полівінілпіролідон, полівініловий спирт, поліамінокислоти, співполімер дивінілового ефіру/малеїнового ангідриду, N-(2 16 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідроксипропіл)-метакриламід, декстран, похідні декстрану, у тому числі сульфат декстрану, поліпропіленгліколь, співполімер поліпропіленоксиду/етиленоксиду, поліоксіетилований поліол, гепарин, фрагменти гепарину, полісахариди, олігосахариди, глікани, целюлозу та похідні целюлози, у тому числі, але без обмеження ними, метилцелюлозу та карбоксиметилцелюлозу, крохмаль та похідні крохмалю, поліпептиди, поліалкіленгліколь та його похідні, співполімери поліалкіленгліколів та їх похідні, полівінілетилові ефіри та альфа-бета-полі[(2-гідроксіетил)-DLаспартамід і т.ін. або їх суміші. Приклади таких водорозчинних полімерів охоплюють (але ними не обмежуються) поліетиленгліколь та сироватковий альбумін. [122] Термін "поліалкіленгліколь", який вживають у цьому описі, означає поліетиленгліколь, поліпропіленгліколь, полібутиленгліколь та їх похідні. Термін "поліалкіленгліколь" охоплює як лінійні, так і розгалужені полімери із середньою молекулярною масою від 1 кДа до 100 кДа. Енші зразкові варіанти здійснення наведені, наприклад, у каталогах комерційних постачальників, наприклад, у каталозі компанії Shearwater Corporation "Polyethylene Glycol and Derivatives for Biomedical Applications" (2001). [123] Термін "арил" означає, якщо не вказується інше, поліненасичений, ароматичний вуглеводневий замісник, який може мати одне кільце або численні кільця (за варіантом, якому віддається перевага, від 1 кільця до 3 кілець), які конденсуються або зв'язуються між собою ковалентними зв'язками. Термін "гетероарил" означає арильні групи (або циклічні системи), що містять від одного до чотирьох гетероатомів, вибраних з групи, до складу якої входить N, O та S, де атоми азоту та сірки факультативно окиснені, а атом(-и) азоту факультативно кватернізований(-і). Гетероарильна група може приєднуватись до решти молекули через гетероатом. Необмежувальні приклади арильних та гетероарильних груп включають феніл, 1нафтил, 2-нафтил, 4-біфеніл, 1-піроліл, 2-піроліл, 3-піроліл, 3-піразоліл, 2-імідазоліл, 4імідазоліл, піразиніл, 2-оксазоліл, 4-оксазоліл, 2-феніл-4-оксазоліл, 5-оксазоліл, 3-ізоксазоліл, 4ізоксазоліл, 5-ізоксазоліл, 2-тіазоліл, 4-тіазоліл, 5-тіазоліл, 2-фурил, 3-фурил, 2-тієніл, 3-тієніл, 2-піридил, 3-піридил, 4-піридил, 2-піримідил, 4-піримідил, 5-бензотіазоліл, пуриніл, 2бензімідазоліл, 5-індоліл, 1-ізохіноліл, 5-ізохіноліл, 2-хіноксалініл, 5-хіноксалініл, 3-хіноліл та 6хіноліл. Замісники для кожної з вищезазначених арильних та гетероарильних циклічних систем вибирають з групи прийнятних замісників, опис яких наведено нижче. [124] Для стислості, термін "арил", у разі застосування у комбінації з іншими термінами (у тому числі, але без обмеження, арилокси, арилтіокси, арилалкіл), включає як арильні, так і гетероарильні кільця, як визначено вище. Таким чином, термін "арилалкіл" включає ті радикали, у яких арильна група приєднана до алкільної групи (у тому числі, але без обмеження, бензил, фенетил, піридилметил тощо), у тому числі ті алкільні групи, у яких атом вуглецю (у тому числі, але без обмеження нею, метиленова група) був замінений, наприклад, атомом кисню (у тому числі, але без обмеження ними, феноксиметил, 2-піридилоксиметил, 3-(1-нафтилокси)пропіл тощо). [125] Кожен з вищезгаданих термінів (у тому числі, але без обмеження ними, "алкіл", "гетероалкіл", "арил" та "гетероарил") включає як заміщені, так і незаміщені форми вказаного радикалу. Зразкові замісники для радикалів кожного типу наведені нижче. [126] Замісниками для алкільних та гетероалкільних радикалів (у тому числі для тих груп, які часто позначають як алкілен, алкеніл, гетероалкілен, гетероалкеніл, алкініл, циклоалкіл, гетероциклоалкіл, циклоалкеніл та гетероциклоалкеніл) можуть бути одна або декілька з цілого ряду груп, вибраних з-посеред наведених нижче (але без обмеження ними): -OR', =O, =NR', =NOR', -NR'R", -SR', -галоген, -SiR'R'R"', -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R", NR'C(O)R', -NR'-C(O)NR'R"', -NR'C(O)2R', -NR-C(NR'R'R'")=NR"", -NR-C(NR'R")=NR'", -S(O)R', S(O)2R', -S(O)2NR'R", -NRSO2R', -CN та -NO2 у кількості від нуля до (2m’+1), де m" – загальна кількість атомів вуглецю у такому радикалі. Кожен з R', R", R"' and R"", незалежно від інших, означає водень, заміщений або незаміщений гетероалкіл, заміщений або незаміщений арил, у тому числі, але без обмеження, арил, заміщений 1-3 атомами галогену, заміщений або незаміщений алкіл, алкоксильну або тіоалкоксильну групи чи арилалкільні групи. У разі, коли сполука за цим винаходом містить, наприклад, більше ніж одну R групу, кожна з R груп вибирається незалежно одна від одної, так само, як і кожна з R', R", R'" та R"" груп, у разі, коли присутньою є більше, ніж одна з цих груп. У разі, коли R' та R" приєднуються до того ж самого атому азоту, вони можуть комбінуватисьз атомом азоту з утворенням 5-, 6- або 7-членного кільця. Наприклад, -NR'R" включає (але не обмежується ними) 1-піролідиніл та 4-морфолініл. З вищенаведеного обговорення замісників, фахівцю у цій галузі буде зрозуміло, що термін "алкіл" включає групи, що містять атоми вуглецю, зв'язані з іншими групами, окрім гідроксильних груп, наприклад, з галогеналкільною (у тому числі, але без обмеження, -CF3 та -CH2CF3) та ацильною (у тому числі, але без обмеження, -C(O)CH3, -C(O)CF3, -C(O)CH2OCH3 тощо). 17 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 [127] Подібно до замісників, описаних для алкільного радикалу, існують різні замісники для арильних та гетероарильних груп, які вибирають з-посеред наведених нижче (але без обмеження ними): галоген, -OR', =O, =NR', =N-OR', -NR'R", -SR', -галоген, -SiR'R'R"', -OC(O)R', C(O)R', -CO2R', -CONR'R", -OC(O)NR'R", -NR'C(O)R', -NR'-C(O)NR'R"', -NR'C(O)2R', -NRC(NR'R'R'")=NR"", -NR-C(NR'R")=NR'", -S(O)R', -S(O)2R', -S(O)2NR'R", -NRSO2R', -CN та -NO2, -R', -N3, -CH(Ph)2, фтор(C1-C4)алкоксигрупа та фтор(C1-C4)алкіл у кількості від нуля до загального числа відкритих валентностей у ароматичній циклічній системі; і причому кожен з R', R", R"' та R"", незалежно від інших, вибирають з-посеред водню, алкілу, гетероалкілу, арилу та гетероарилу. У разі, коли сполука за цим винаходом містить, наприклад, більше ніж одну R групу, кожна з R груп вибирається незалежно одна від одної, так само, як і кожна з R', R", R'" та R"" груп, у разі, коли присутньою є більше, ніж одна з цих груп. [128] Термін "модульований період напіввиведення з плазми", який вживають у цьому описі, означає позитивну або негативну зміну часу знаходження модифікованої біологічно активної молекули у кровообізі, порівняно з її немодифікованою формою. Період напіввиведення з плазми визначають шляхом відбирання проб крові у різні часові точки після введення біологічно активної молекули і визначення концентрації цієї молекули у кожній пробі. Кореляція концентрації у сироватці та часу надає можливість обчислення періоду напіввиведення з плазми. Бажаним є щонайменше двократне підвищення періоду напіввиведення з плазми, але корисним може бути і менше підвищення, наприклад, у тому разі, коли воно забезпечує задовільну схему приймання лікарського засобу або дозволяє уникнути токсичного ефекту. За деякими варіантами здійснення цього винаходу підвищення є щонайменше приблизно трикратним, щонайменше приблизно п'ятикратним або щонайменше приблизно десятикратним. [129] Термін "модульований період напіввиведення терапевтично ефективної кількості", який вживають у цьому описі, означає позитивну або негативну зміну періоду напіввиведення терапевтично ефективної кількості модифікованої біологічно активної молекули, порівняно з її немодифікованою формою. Період напіввиведення терапевтично ефективної кількості визначають шляхом визначення фармакокінетичних та/або фармакодинамічних властивостей молекули у різні часові точки після введення. Підвищений період напіввиведення терапевтично ефективної кількості надає можливість розробки особливо благотворної схеми приймання лікарського засобу, особливо благотворної загальної дози та уникання небажаного ефекту. За деякими варіантами здійснення цього винаходу підвищений період напіввиведення терапевтично ефективної кількості є наслідком підвищеної активності, підвищеного або зниженого зв'язування модифікованої молекули з мішенню, або підвищення чи зменшення іншого параметру або механізму дії немодифікованої молекули. [130] Термін "ізольована(-ий)", у разі вживання щодо нуклеїнової кислоти або білка, означає те, що нуклеїнова кислота або білок є по суті вільною(-им) від інших клітинних компонентів, з якими вона(він) є пов'язаною(-им) у природному стані. Амінокислота(білок) може бути у однорідному стані. Езольовані речовини можуть бути у сухому або напівсухому стані чи у розчині, у тому числі, але без обмеження ним, у водному розчині. Чистота і однорідність, як правило, визначаються за допомогою методів аналітичної хімії, наприклад, за допомогою електрофорезу у поліакриламідному гелі або високоефективної рідинної хроматографії. Білок, який є переважним різновидом, присутнім у препараті, є по суті очищеним. Зокрема, ізольований ген відокремлюють від відкритих рамок зчитування, які фланкують ген та кодують білок, окрім гена, який становить інтерес. Термін "очищена(-ий)" означає, що нуклеїнова кислота або білок утворює по суті одну смугу у електрофоретичному гелі. Зокрема, цей термін може означати, що нуклеїнова кислота або білок має щонайменше 85 % чистоту, щонайменше 90 % чистоту, щонайменше 95 % чистоту, щонайменше 99 % або більшу чистоту. [131] Термін "нуклеїнова кислота" означає дезоксирибонуклеотиди або рибонуклеотиди та їх полімери у одно- чи двонитковій формі. У разі відсутності конкретного обмеження, згаданий термін охоплює нуклеїнові кислоти, які містять відомі аналоги природних нуклеотидів, які мають подібні зв'язувальні властивості, як і еталонна нуклеїнова кислота, і метаболізуються у спосіб, подібний до природних нуклеотидів. Якщо не вказується інше, послідовність конкретної нуклеїнової кислоти також беззастережно охоплює її консервативно модифіковані варіанти (у тому числі, але без обмеження, заміни вироджених кодонів) та комплементарні послідовності, а також послідовності, які прямо вказуються. Зокрема, заміни вироджених кодонів можна здійснювати шляхом одержання послідовностей, у яких третє положення одного або декількох вибраних (або усіх) кодонів замінюється залишками із змішаними основами та/або залишками дезоксиінозину (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); та Cassol et al. (1992); Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)). [132] Терміни "поліпептид", "пептид" та "білок" вживають у цьому описі взаємозамінно для 18 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 позначення полімеру залишків амінокислот. Згадані терміни вжиті до полімерів природних амінокислот, а також до полімерів амінокислот, у яких один або декілька амінокислотних залишків є штучно закодованою амінокислотою. Згадані терміни, які вживають у цьому описі, охоплюють амінокислотні ланцюги будь-якої довжини, у тому числі непроцесовані білки (тобто антигени), де залишки амінокислот є сполучені ковалентними пептидними зв'язками. [133] Антитіла являють собою білки, що демонструють специфічність зв'язування конкретного антигена. Нативні антитіла, як правило, являють собою гетеротетрамерні глікопротеїни масою приблизно 150000 Да (Дальтонів), що складаються з двох ідентичних легких (L) ланцюгів і двох ідентичних важких (H) ланцюгів. Кожен легкий ланцюг сполучається з важким ланцюгом одним ковалентним дисульфідним зв'язком, у той час як кількість дисульфідних зв'язків між важкими ланцюгами імуноглобулінів різних ізотипів є змінною. Кожен важкий і легкий ланцюг також має рівномірно розміщені міжланцюгові дисульфідні містки. Кожен важкий ланцюг на одному кінці має варіабельну ділянку (VH), за якою йде ряд константних ділянок. Кожен легкий ланцюг має варіабельну ділянку (VL) на одному кінці і константу ділянку на своєму другому кінці; константа ділянка легкого ланцюга розміщується на одній лінії з першою константною ділянкою важкого ланцюга, а варіабельна ділянка легкого ланцюга розміщується на одній лінії з варіабельною ділянкою важкого ланцюга. Вважають, що конкретні амінокислотні залишки утворюють поверхню розділу між варіабельними ділянками легкого і важкого ланцюгів. [134] Термін "варіабельний" означає те, що деякі частини варіабельних ділянок між антитілами значно різняться за послідовністю і несуть відповідальність за специфічність зв'язування кожного конкретного антитіла з відповідним конкретним антигеном. Однак варіабельність не є рівномірно розподіленою серед варіабельних ділянок антитіл. Вона концентрується у трьох сегментах, які називають гіперваріабельними ділянками (CDR) варіабельних ділянок як легких, так і важких ланцюгів. Більш висококонсервативні частини варіабельних ділянок називають каркасними ділянками (FR). Кожна з варіабельних ділянок нативних важких і легких ланцюгів містить чотири каркасні ділянки, які значною мірою набувають -складчасту конформацію, з'єднані трьома або чотирма CDR, які утворюють петлі, що з'єднують, а у деяких випадках і утворюють частину -складчастої конформації. CDR у кожному ланцюзі утримуються разом у безпосередній близькості каркасними ділянками і, з CDR іншого ланцюга, сприяють утворенню антигензв'язувального центру антитіл (дивись Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). [135] Константні ділянки не є безпосередньо залученими до зв'язування антитіла з антигеном, але проявляють різні ефекторні функції. У залежності від амінокислотної послідовності константної ділянки їхніх важких ланцюгів, антитіла або імуноглобуліни можуть бути розподілені на різні класи. Еснує п'ять головних класів імуноглобулінів: IgA, IgD, IgE, IgG та IgM, і декілька з них можуть додатково підрозділятись на підкласи (ізотипи), наприклад, IgG1, IgG2, IgG3 та IgG4; IgA1 та IgA2. Константні ділянки важкого ланцюга, що відповідають різним класам імуноглобулінів, називають α, δ, ε, γ та μ, відповідно. Відомо, що з-посеред різних класів людських імуноглобулінів, лише людські IgG1, IgG2, IgG3 та IgM активують комплемент. [136] "Визрівання афінності" антитіл in vivo стимулюється селекцією антигенами варіантів антитіл підвищеної афінності, які одержують, головним чином, шляхом соматичного гіпермутагенезу. Часто також відбувається "зсув репертуару", у разі якого спостерігається, що переважні гени ембріонального типу вторинної та третинної імунної відповіді відрізняються від відповідних генів первинної та вторинної імунної відповіді. [137] Процес "визрівання афінності" імунної системи може відтворюватись шляхом введення мутацій до генів антитіл in vitro та застосування процесу селекції афінності для ізоляції мутантів з поліпшеною афінністю. Такі антитіла-мутанти можуть проявлятись на поверхні нитчастого бактеріофагу або мікроорганізмів, наприклад, дріжджів, і згадані антитіла можуть відбиратись за їхньою спорідненістю до антигена або за їхньою кінетикою дисоціації з антигеном. Hawkins et al. J. Mol. Biol. 226:889-896 (1992). "Блукаючий" мутагенез CDR застосовували для "визрівання афінності" людських антитіл, що зв'язують людський оболонковий глікопротеїн gp120 вірусу імунодефіциту людини типу 1 (ВЕЛ-1) (Barbas III et al. PNAS (USA) 91: 3809-3813 (1994); та Yang et al. J. Mol. Biol. 254:392-403 (1995)); та анти-c-erbB-2 одноланцюговий Fv-фрагмент (Schier et al. J. Mol. Biol. 263:551567 (1996)). Переставляння ланцюгів антитіл та мутагенез CDR застосовували для "визрівання афінності" високоафінного людського антитіла, спрямованого проти третьої гіперваріабельної петлі ВЕЛ (Thompson et al. J. Mol. Biol. 256:77-88 (1996)). Balint and Larrick Gene 137:109-118 (1993) описують комп'ютеризований олігодезоксирибонуклеотидспрямований сканувальний мутагенез, у разі якого усі CDR гена варіабельних ділянок 19 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 одночасно і ретельно перевіряють на присутність поліпшених варіантів. v3-специфічне гуманізоване антитіло піддавали "визріванню афінності" за допомогою стратегії початкового обмеженого мутагенезу, у разі якого кожне положення усіх шести CDRs піддавали мутації з подальшою експресією та скринінгом комбінаторної бібліотеки, що містила мутанти з найвищою афінністю (Wu et al. PNAS (USA) 95: 6037-6-42 (1998)). Огляд антитіл фагового дисплею наведено у Chiswell and McCafferty TIBTECH 10:80-84 (1992); та Rader and Barbas III Current Opinion in Biotech. 8:503-508 (1997). У кожному випадку повідомлення у згаданих посиланнях про мутантні антитіла з поліпшеною афінністю, порівняно з вихідним антитілом, згадане мутантне антитіло мало амінокислотні заміни у CDR. [138] Термін "визрівання афінності" у цьому описі означає процес підвищення спорідненості антитіла до його антигена. Способи "визрівання афінності" включають (але ними не обмежуються) методи комп'ютерного скринінгу та експериментальні методи. [139] Термін "антитіло" у цьому описі означає білок, що складається з одного або декількох поліпептидів, які по суті кодуються усіма або частиною генів антитіл. До імуноглобулінових генів належать (але ними не обмежуються) гени константних ділянок каппа, лямбда, альфа, гамма (IgG1, IgG2, IgG3 та IgG4), дельта, епсілон і мю, а також велику кількість генів варіабельних ділянок імуноглобулінів. Термін "антитіло" у цьому описі означає непроцесовані антитіла та фрагменти антитіл і включає антитіла, які природно існують у будь-якому організмі або є створеними методами генної інженерії (наприклад, є варіантами). [140] Термін "фрагмент антитіла" означає будь-яку форму антитіла, окрім непроцесованої форми. Фрагменти антитіл, за цим описом, включають антитіла, що є меншими складовими частинами, які існують у межах непроцесованих антитіл, та антитіла, які були одержані методами генної інженерії. Фрагменти антитіл включають (але ними не обмежуються) Fv, Fc, Fab та (Fab')2, одноланцюгові Fv (scFv), діатіла, триатіла, тетратіла, біфункціональні гібридні антитіла, CDR1, CDR2, CDR3, комбінації CDR (гіперваріабельних ділянок), варіабельні ділянки, каркасні ділянки, константні ділянки тощо (Maynard & Georgiou, 2000, Annu. Rev. Biomed. Eng. 2:339-76; Hudson, 1998, Curr. Opin. Biotechnol. 9:395-402). [141] Термін "амінокислота" означає природні та штучні амінокислоти, а також аналоги амінокислот та міметики амінокислот, що функціонують у спосіб, подібний до природних амінокислот. Природними амінокислотами є 20 звичайних амінокислот (аланін, аргінін, аспарагін, аспарагінова кислота, цистеїн, глутамін, глутамінова кислота, гліцин, гістидин, ізолейцин, лейцин, лізин, метіонін, фенілаланін, пролін, серин, треонін, триптофан, тирозин та валін) та піролізин і селеноцистеїн. Термін "аналоги амінокислот" означає сполуки, які мають таку ж саму основну хімічну структуру, що і природна амінокислота, тобто α-вуглець, зв'язаний з воднем, карбоксильну групу, аміногрупу та R групу, такі як гомосерин, норлейцин, сульфоксид метіоніну, метіонінметилсульфоній. Такі аналоги мають модифіковані R групи (такі як норлейцин) або модифіковані пептидні каркаси, але зберігають ту саму основну хімічну структуру, що і природна амінокислота. [142] На амінокислоти у цьому описі можуть бути посилання за допомогою їх широковідомих трилітерних умовних позначень або за допомогою однолітерних умовних позначень, рекомендованих Комісією з біохімічної номенклатури ЕЮПАК (Міжнародна спілка з теоретичної та прикладної хімії) – ЕЮБ (Міжнародна спілка з біохімії). Подібним же чином, на нуклеотиди можна посилатись за допомогою їх загальноприйнятих однолітерних умовних позначень. [143] Термін "консервативно модифіковані варіанти" є застосовним як до амінокислот, так і до нуклеїновокислотних послідовностей. Стосовно конкретних нуклеїновокислотних послідовностей, термін "консервативно модифіковані варіанти" означає ті нуклеїнові кислоти, що кодують ідентичні або по суті ідентичні амінокислотні послідовності, або, у разі, коли нуклеїнова кислота не кодує амінокислотної послідовності, по суті ідентичні послідовності. З причини виродженості генетичного коду, велика кількість функціонально ідентичних нуклеїнових кислот кодує будь-який даний білок. Наприклад, усі кодони GCA, GCC, GCG та GCU кодують амінокислоту аланін. Таким чином, у кожному положенні, де аланін визначається кодоном, згаданий кодон може бути замінений на будь-який з відповідних описаних кодонів без зміни закодованого поліпептиду. Такі нуклеїновокислотні варіанти є "варіантами, які мовчать", що являють собою один із різновидів консервативно модифікованих варіантів. Кожна нуклеїновокислотна послідовність у цьому описі, яка кодує поліпептид, також описує кожний можливий варіант, який мовчить, нуклеїнової кислоти. Фахівцю буде зрозуміло, що кожен кодон у нуклеїновій кислоті (за виключенням AUG, який, як правило, є єдиним кодоном для метіоніну, та TGG, який, як правило, є єдиним кодоном для триптофану) може бути модифікованим з одержанням функціонально ідентичної молекули. Відповідним чином, кожен варіант, який мовчить, нуклеїнової кислоти, що кодує поліпептид, мають на увазі у кожній описаній 20 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності. [144] Щодо амінокислотних послідовностей, фахівцю буде зрозуміло, що індивідуальні заміни, делеції або додання до нуклеїнової кислоти, пептиду, поліпептиду або білкової послідовності, що змінюють, додають або видаляють одну амінокислоту або невеликий відсоток амінокислот у закодованій послідовності, являють собою "консервативно модифікований варіант", де наслідком зміни є заміна амінокислоти хімічно подібною амінокислотою. Таблиці консервативних замін, що пропонують функціонально подібні амінокислоти, є добре відомими у цій галузі. Такі консервативно модифіковані варіанти мають місце окрім інших варіантів і не виключають поліморфних варіантів, міжвидових гомологів та алелей за цим винаходом. [145] Кожна з наведених нижче восьми груп містить амінокислоти, що є консервативно взаємозамінними: 1) Аланін (A), Гліцин (G); 2) Аспарагінова кислота (D), Глутамінова кислота (E); 3) Аспарагін (N), Глутамін (Q); 4) Аргінін (R), Лізин (K); 5) Езолейцин (I), Лейцин (L), Метіонін (M), Валін (V); 6) Фенілаланін (F), Тирозин (Y), Триптофан (W); 7) Серин (S), Треонін (T); та 8) Цистеїн (C), Метіонін (M) (дивись, наприклад, Creighton, Proteins: Structures and Molecular Properties (W H Freeman & Co.; 2nd edition (December 1993). [146] Терміни "ідентична" або відсоткова "ідентичність", у контексті двох або декількох нуклеїнових кислот або поліпептидних послідовностей, означають дві або декілька послідовностей або субпослідовностей, що є однаковими. Послідовності є "по суті ідентичними", якщо вони мають відсоток однакових залишків амінокислот або нуклеотидів (тобто приблизно 60 % ідентичність, факультативно приблизно 65 % ідентичність, приблизно 70 % ідентичність, приблизно 75 % ідентичність, приблизно 80 % ідентичність, приблизно 85 % ідентичність, приблизно 90 % ідентичність або приблизно 95 % ідентичність на визначеній ділянці) у разі порівняння та вирівнювання для визначення максимальної відповідності у "вікні" порівняння або на визначеній ділянці, як визначається за допомогою одного з наведених нижче алгоритмів порівняння послідовностей або шляхом ручного вирівнювання та візуальної перевірки. Це визначення також має відношення до комплементу експериментальної послідовності. Едентичність може існувати на ділянці, яка має щонайменше приблизно 50 амінокислот або нуклеотидів у довжину або на ділянці, яка має 75-100 амінокислот або нуклеотидів у довжину, або, у разі відсутності визначення, на усій послідовності полінуклеотиду або поліпептиду. [147] У разі порівняння послідовностей, одна послідовність, як правило, відіграє роль еталонної послідовності, з якою порівнюють експериментальні послідовності. У разі застосування алгоритму порівняння послідовностей, експериментальну та еталонну послідовності вводять до комп'ютеру, задають координати послідовностей, у разі необхідності, та задають параметри програми алгоритму послідовностей. Можна застосовувати параметри програми за умовчанням або можна визначати альтернативні параметри. Після цього алгоритм порівняння послідовностей обчислює відсоткову ідентичність експериментальних послідовностей відносно еталонної послідовності, виходячи з параметрів програми. [148] Термін "вікно" порівняння, який вживають у цьому описі, означає посилання на сегмент будь-якого одного з ряду суміжних положень, вибраний з групи, яку складають від 20 положень до 600 положень, як правило, від приблизно 50 положень до приблизно 200 положень, частіше від приблизно 100 положень до приблизно 150 положень, на якому послідовність може порівнюватись з еталонною послідовністю, що має таку ж саму кількість суміжних положень, після оптимального вирівнювання двох послідовностей. Способи вирівнювання послідовностей для порівняння є добре відомими у цій галузі. Оптимальне вирівнювання послідовностей для порівняння може здійснюватись, у тому числі, але без обмеження, за алгоритмом локальної гомології Сміта-Уотермена (1970) Adv. Appl. Math. 2:482c, за алгоритмом вирівнювання для знаходження гомології Нідлмена-Вунша (1970) J. Mol. Biol. 48:443, за методом пошуку подібності Пірсона-Ліпмана (1988) Proc. Nat'l. Acad. Sci. USA 85:2444, шляхом комп'ютеризованого застосування цих алгоритмів (GAP, BESTFIT, FASTA та TFASTA у пакеті програм Wisconsin Genetics Software Package, компанія Genetics Computer Group, 575 Science Dr., Madison, штат Вісконсін) або шляхом ручного вирівнювання та візуальної перевірки (дивись, наприклад, Ausubel et al., Current Protocols in Molecular Biology (1995 supplement)). [149] Прикладом алгоритмів, що є прийнятними для визначення відсоткової ідентичності та подібності послідовностей, є алгоритми BLAST та BLAST 2.0, опис яких наведено у Altschul et al. 21 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 (1997) Nuc. Acids Res. 25:3389-3402, та Altschul et al. (1990) J. Mol. Biol. 215:403-410, відповідно. Пакет програм для проведення аналізу BLAST є загальнодоступним через Національний центр біотехнологічної інформації. Параметри W, T та X програми BLAST визначають чутливість та швидкість вирівнювання. Програма BLASTN (для нуклеотидних послідовностей) застосовує за умовчанням довжину слів (W) 11, очікування (E) 10, M=5, N=-4 та порівняння обох ниток. У разі амінокислотних послідовностей, програма BLASTP застосовує за умовчанням довжину слів 3, очікування (E) 10 і оцінювальну матрицю BLOSUM62 (дивись Henikoff and Henikoff (1989) Proc. Natl. Acad. Sci. USA 89:10915) з вирівнюванням (B) 50, очікуванням (E) 10, M=5, N=-4 та порівнянням обох ниток. Алгоритм BLAST, як правило, застосовують з відключеним фільтром "низької складності". [150] Алгоритм BLAST також здійснює статистичний аналіз подібності між двома послідовностями (дивись, наприклад, Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5787). Одним з критеріїв подібності, що надається алгоритмом BLAST, є ймовірність найменшої суми (P(N)), який надає показник ймовірності, за яким могла б трапитись випадкова сумісність двох нуклеотидних або амінокислотних послідовностей. Наприклад, нуклеїнова кислота вважається подібною до еталонної послідовності, якщо ймовірність найменшої суми при порівнянні експериментальної нуклеїнової кислоти з еталонною нуклеїновою кислотою є меншою за приблизно 0,2 або меншою за приблизно 0,01 чи меншою за приблизно 0,001. [151] Термін "селективно (або специфічно) гібридизується з" означає зв'язування, утворення дуплексу або гібридизацію молекули лише з конкретною нуклеотидною послідовністю за суворих умов гібридизації, коли ця послідовність є присутньою у складній суміші (з включенням (але без обмеження) загальної клітинної або бібліотечної ДНК або РНК). [152] Термін "суворі умови гібридизації" означає гібридизацію за умов низької іонної сили та високої температури, як відомо у цій галузі. За суворих умов зонд, як правило, буде гібридизуватись із своєю послідовністю-мішенню у складній суміші нуклеїнової кислоти (у тому числі, але без обмеження, загальної клітинної або бібліотечної ДНК або РНК), але не буде гібридизуватись з іншими послідовностями у складній суміші. Суворі умови залежать від послідовностей і будуть іншими за інших обставин. Довші послідовності гібридизуються, як правило, при більш високих температурах. Вичерпну інформацію стосовно гібридизації нуклеїнових кислот можна знайти у Tijssen, Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Probes, "Overview of principles of hybridization and the strategy of nucleic acid assays" (1993). Взагалі, температуру у разі суворих умов вибирають на приблизно 510C нижче від температури плавлення (T m) конкретної послідовності при визначеній іонній силі, pH. Tm означає температуру (при визначеній іонній силі, pH, та концентрації нуклеїнових кислот), при якій 50 % зондів, комплементарних до мішені, гібридизуються з послідовністюмішенню у стані рівноваги (оскільки послідовності-мішені є присутніми з надлишком, при T m, ступінь зайнятості зондів у стані рівноваги дорівнює 50 %). Суворими можуть бути умови, за яких концентрація солі є меншою за приблизно 1,0 М іонів натрію, як правило, концентрація іонів натрію (або інших солей) становить від приблизно 0,01 М до 1,0 М при значенні рН від 7,0 до 8,3 і температурі щонайменше приблизно 30C для коротких зондів (у тому числі, але без обмеження, від 10 нуклеотидів до 50 нуклеотидів) та щонайменше приблизно 60C для довгих зондів (у тому числі, але без обмеження, більших за 50 нуклеотидів). Суворі умови можуть бути забезпечені також у разі додання дестабілізуючих речовин, наприклад, формаміду. У разі селективної або специфічної гібридизації, позитивний сигнал може перевищувати фонову гібридизацію щонайменше удвічі, факультативно у десять разів. Зразкові умови гібридизації за суворих умов можуть виглядати таким чином: 50 % формаміду, 5SSC (стандартний цитратний фізіологічний розчин) та 1 % SDS (додецилсульфат натрію), інкубування при температурі 42C, або 5SSC, 1 % SDS, інкубування при температурі 65C, з промиванням у 0,2SSC та 0,1 % SDS при температурі 65C. Тривалість таких промивань може становити 5 хв, 15 хв, 30 хв, 60 хв, 120 або більше хвилин. [153] Термін "еукаріот", який вживають у цьому описі, означає організми, що належать до філогенетичного домену Eucarya, наприклад, тварини (у тому числі, але без обмеження, ссавці, комахи, плазуни, птахи тощо), війчасті, рослини (у тому числі, але без обмеження, однодольні, дводольні, водорості тощо), гриби, дріжджі, джгутиконосні, мікроспоридії, протисти тощо. [154] Термін "еукаріотна клітина" та "еукаріотні клітини" означають, наприклад, клітини ссавців, наприклад, CHO (культура клітин яєчника хом'ячка), лінію клітин мієломи, BHK (культура клітин нирок хом'ячка), імунокомпетентні клітини, клітини комах, клітини птахів, клітини амфібій, наприклад, овоцити жаб, клітини грибів та дріжджів. Дріжджі включають, наприклад, Saccharomyces, Schizosaccharomyces, Hansenula, Candida, Torulopsis, Yarrowia, Pichia тощо. Дріжджі для експресії, яким віддають особливу перевагу, включають штами 22 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 метилотрофних дріжджів, наприклад, Pichia pastoris, Hansenula polymorpha, Pichia guillermordii, Pichia methanolica, Pichia inositovera тощо. (Дивись, наприклад, патенти США 4,812,405, 4,818,700, 4,929,555, 5,736,383, 5,955,349, 5,888,768 та 6,258,559, кожен з яких включений до цього опису шляхом посилання для усіх цілей). Ці та інші патенти також описують промотори, термінатори, енхансери, сигнальні послідовності та інші регуляторні послідовності, придатні для полегшення експресії гетерологічних генів у дріжджах, наприклад, генів білків за цим винаходом. [155] Термін "трансформація", який вживають у цьому описі, слід вживати у широкому розумінні для посилання на будь-яке введення ДНК до реципієнтної клітини-хазяїна, що змінює генотип і у подальшому веде до зміни реципієнтної клітини. [156] Термін "нееукаріот", який вживають у цьому описі, означає нееукаріотні організми. Наприклад, нееукаріотні організми можуть належати до філогенетичного домену Eubacteria (у тому числі, але без обмеження, Escherichia coli, Thermus thermophilus, Bacillus stearothermophilus тощо) або до філогенетичного домену Archaea (у тому числі, але без обмеження, Methanococcus jannaschii, Methanobacterium thermoautotrophicum, Halobacterium, наприклад, Haloferax volcanii та Halobacterium spp NRC-1, Archaeoglobus fulgidus, Pyrococcus furiosus, Pyrococcus horikoshii, Aeuropyrum pernix тощо). [157] Термін "суб'єкт", який вживають у цьому описі, означає тварину, за варіантом, якому віддається перевага, ссавця, за варіантом, якому віддають найбільшу перевагу, людину, що є об'єктом лікування, спостереження або експерименту. Докладний опис [158] Фахівець у цій галузі зможе розробити та застосувати такі ж самі методи, що наводяться нижче, для композицій на основі еритропоетину котячих та споріднених методів, для композицій та методів, пов'язаних з еритропоетином собачих (cEPO) (зріла амінокислотна послідовність SEQ ID NO: 31, непроцесована амінокислотна послідовність SEQ ID NO: 30) та еритропоетином конячих (eEPO) (зріла амінокислотна послідовність SEQ ID NO: 33, непроцесована амінокислотна послідовність SEQ ID NO: 32), для cEPO та eEPO із штучною та/або штучно закодованою амінокислотою, введеною до поліпептидів cEPO та eEPO. Ці поліпептиди можуть також застосовуватись, як розкривається у цьому описі, для лікування кошачих або інших тварин, які потребують цього, або вони можуть застосовуватись для лікування собачих або конячих. На Фіг. 34 та Фіг. 35 представлені порівняння кожної із 166 амінокислотних послідовностей cEPO та eEPO з fEPO (166 амінокислот), що докладніше обговорюється у цьому описі, але у цьому описі наведена інформація щодо заміни, додання або делеції штучно закодованої кислоти у послідовностях SEQ ID NO: 31 та 33, cEPO та eEPO, відповідно. I. Введення [159] Цей винахід пропонує молекули EPO котячих, що містять щонайменше одну штучну амінокислоту. За певними варіантами здійснення цього винаходу, EPO із щонайменше однією штучною амінокислотою містить щонайменше одну посттрансляційну модифікацію. За одним з варіантів здійснення винаходу, згадана щонайменше одна посттрансляційна модифікація являє собою приєднання молекули (у тому числі, але без обмеження, барвника, полімеру, у тому числі, але без обмеження, похідної полі(етиленгліколю), фотозшивального агента, цитотоксичної сполуки, афінної мітки, похідної біотину, смоли, другого білка або поліпептиду, антитіла або фрагмента антитіла, хелатоутворювача, кофактора, жирної кислоти, вуглеводу, полінуклеотиду (у тому числі, але без обмеження, ДНК, РНК тощо), що містить другу реакційноздатну групу, до щонайменше однієї штучної амінокислоти, що містить першу реакційноздатну групу, за допомогою хімічних методів, відомих фахівцю у цій галузі як такі, що є прийнятними для конкретних реакційноздатних груп. Наприклад, першою реакційноздатною групою є алкінільна складова (у тому числі, але без обмеження, у штучній амінокислоті, ппропаргілоксифенілаланіні, де пропаргільну групу подеколи називають також ацетиленовою складовою), а другою реакційноздатною групою є азидна складова, і застосовують такий хімічний метод як реакція [3+2]-циклоприєднання. За іншим варіантом здійснення цього винаходу першою реакційноздатною групою є азидна складова (у тому числі, але без обмеження, у штучній амінокислоті, п-азидо-L-фенілаланіні), а другою реакційноздатною групою є алкінільна складова. За певними варіантами здійснення модифікованого fEPO за цим винаходом застосовують щонайменше одну штучну амінокислоту (у тому числі, але без обмеження, штучну амінокислоту, що містить функціональну кетогрупу), що містить щонайменше одну посттрансляційну модифікацію, де щонайменше одна посттрансляційна модифікація містить сахаридну складову. За певними варіантами здійснення цього винаходу посттрансляційну модифікацію здійснюють in vivo в еукаріотній або в нееукаріотній клітині. 23 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 [160] За певними варіантами здійснення цього винаходу білок містить щонайменше одну посттрансляційну модифікацію, яка здійснюється in vivo однією клітиною-хазяїном, де згадана посттрансляційна модифікація, як правило, клітиною-хазяїном іншого типу не здійснюється. За певними варіантами здійснення цього винаходу білок містить щонайменше одну посттрансляційну модифікацію, що здійснюється in vivo еукаріотною клітиною, де згадана посттрансляційна модифікація, як правило, нееукаріотною клітиною не здійснюється. Приклади посттрансляційних модифікацій включають, але ними не обмежуються, ацетилування, ацилування, ліпідну модифікацію, пальмітоїлування, приєднання пальмітату, фосфорилування, модифікацію шляхом зв'язування гліколіпідів тощо. За одним з варіантів здійснення цього винаходу посттрансляційна модифікація являє собою приєднання олігосахариду до аспарагіну за допомогою зв'язку GlcNAc-аспарагін (у тому числі, але без обмеження, коли олігосахарид містить (GlcNAc-Man)2-Man-GlcNAc-GlcNAc тощо). За іншим варіантом здійснення цього винаходу посттрансляційна модифікація являє собою приєднання олігосахариду (у тому числі, але без обмеження, Gal-GalNAc, Gal-GlcNAc тощо) до серину або треоніну за допомогою зв'язку GalNAc-серин, GalNAc-треонін, GlcNAc-серин або GlcNAc-треонін. За певними варіантами здійснення білок або поліпептид за цим винаходом може містити секреторну або локалізаційну послідовність, мітку антигенної детермінанти, мітку FLAG, полігістидинову мітку, гібрид GST та/або подібні елементи. [161] Білок або поліпептид, який становить інтерес, може містити щонайменше одну, щонайменше дві, щонайменше три, щонайменше чотири, щонайменше п'ять, щонайменше шість, щонайменше сім, щонайменше вісім, щонайменше дев'ять або десять чи більше штучних амінокислот. Згадані штучні амінокислоти можуть бути однаковими або різними, наприклад, білок може мати 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 або більше різних сайтів, що містять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 або більше різних штучних амінокислот. За певними варіантами здійснення цього винаходу щонайменше одну (але менше, ніж усі) конкретну амінокислоту, присутню у природному варіанті білка, замінюють на штучну амінокислоту. [162] Цей винахід пропонує способи та композиції на основі членів родини супергенів GH, зокрема fEPO, що містять щонайменше одну штучно закодовану амінокислоту. Введення щонайменше однієї штучно закодованої амінокислоти до складу члену родини супергенів GH, наприклад, fEPO, може здійснюватись за допомогою методів кон'югації, що залучають специфічні хімічні реакції, у тому числі, але без обмеження, з однією або декількома штучно закодованими амінокислотами, у той самий час, без реагування із 20 звичайними амінокислотами. За деякими варіантами здійснення цього винаходу член родини супергенів GH, наприклад, fEPO, що містить штучно закодовану амінокислоту, є зв'язаним з водорозчинним полімером, наприклад, поліетиленгліколем (PEG), через бічний ланцюг штучно закодованої амінокислоти. Цей винахід пропонує високоефективний метод селективної модифікації білків похідними PEG, що включає селективне введення негенетично закодованих амінокислот, у тому числі, але без обмеження, тих амінокислот, що містять функціональні групи або замісники, відсутні у 20 природним чином введених амінокислот, у тому числі, але без обмеження, азидну або ацетиленову складову, до складу білків у відповідь на селекторний кодон та подальшу модифікацію цих амінокислот відповідною реакційноздатною похідною PEG. Після введення, бічні ланцюги амінокислот можуть у подальшому модифікуватись за допомогою хімічних методів, відомих фахівцям у цій галузі як такі, що є прийнятними для конкретних функціональних груп або замісників, присутніх у штучно закодованій амінокислоті. Найрізноманітніші відомі хімічні методи є прийнятними для застосування за цим винаходом для введення водорозчинного полімеру до складу білка. Такі методи включають, але ними не обмежуються, реакцію [3+2]-циклоприєднання Хьюсгена (дивись, наприклад, Padwa, A. in Comprehensive Organic Synthesis, Vol. 4, (1991) Ed. Trost, B. M., Pergamon, Oxford, p. 1069-1109; та Huisgen, R. in 1,3-Dipolar Cycloaddition Chemistry, (1984) Ed. Padwa, A., Wiley, New York, p. 1176) з включенням, але без обмеження ними, ацетиленових або азидних похідних, відповідно. [163] Оскільки метод [3+2]-циклоприєднання Хьюсгена включає реакцію циклоприєднання, а не нуклеофільного заміщення, білки можуть модифікуватись з надзвичайно високою селективністю. Згадану реакцію можна здійснювати при кімнатній температурі у водних умовах з надзвичайно високою регіоселективністю (1,4>1,5) шляхом додання каталітичних кількостей солей Cu(I) до реакційної суміші. Дивись, наприклад, Tornoe et al., (2002) J. Org. Chem. 67:30573064; та Rostovtsev et al., (2002) Angew. Chem. Int. Ed. 41:2596-2599; та WO 03/101972. Молекула, що може буди приєднана до білка за цим винаходом шляхом реакції [3+2]циклоприєднання, включає фактично будь-яку молекулу з відповідною функціональною групою або замісником, у тому числі, але без обмеження, азидопохідну або ацетиленову похідну. Ці молекули можуть додаватись до штучної амінокислоти з ацетиленовою групою, у тому числі, 24 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 але без обмеження, п-пропаргілоксифенілаланіну, або азидною групою, у тому числі, але без обмеження, п-азидофенілаланіну, відповідно. [164] П'ятичленний цикл, одержаний в результаті реакції [3+2]-циклоприєднання Хьюсгена, як правило, не є оборотним у відновних середовищах і є стійким проти гідролізу у водних середовищах впродовж тривалих періодів часу. Унаслідок цього, за допомогою активних похідних полі(етиленгліколю) за цим винаходом, за необхідних водних умов можуть бути модифіковані фізичні та хімічні характеристики найрізноманітніших речовин. Ще більш важливим є те, що, оскільки азидні та ацетиленові складові є взаємоспецифічними (і не реагують, наприклад, з жодною з 20 звичайних генетично закодованих амінокислот), білки можуть модифікуватись на одному або декількох специфічних сайтах з надзвичайно високою селективністю. [165] Цей винахід пропонує також водорозчинні та гідролітично стабільні похідні похідних полі(етиленгліколю) та споріднених гідрофільних полімерів, які мають одну або декілька ацетиленових або азидних складових. Похідні полімеру полі(етиленгліколю), які містять ацетиленові складові, є високоселективними для сполучення з азидними складовими, що були селективно введені у білки у відповідь на селекторний кодон. Подібним же чином, похідні полімеру полі(етиленгліколю), що містять азидні складові, є високоселективними для сполучення з ацетиленовими складовими, які були селективно введені у білки у відповідь на селекторний кодон. [166] Конкретніше, азидні складові включають, але ними не обмежуються, алкілазиди, арилазиди та похідні цих азидів. Похідні алкіл- та арилазидів можуть включати інші замісники доти, доки зберігається ацетилен-специфічна реакційна здатність. Ацетиленові складові включають алкіл- та арилацетилени і похідні кожного з них. Похідні алкіл- та арилацетиленів можуть включати інші замісники доти, доки зберігається азид-специфічна реакційна здатність. [167] Цей винахід пропонує кон'югати речовин, які мають цілий ряд функціональних груп, замісників або складових, з іншими речовинами, у тому числі, але без обмеження, водорозчинними полімерами, наприклад, PEG, білками, лікарськими засобами, дрібними молекулами, біоматеріалами або будь-якою іншою необхідною сполукою або речовиною. Цей винахід також включає кон'югати речовин, що мають азидні або ацетиленові складові, з похідними полімеру PEG, що мають відповідні ацетиленові або азидні складові. Наприклад, полімер полі(етиленгліколю), який містить азидну складову, може сполучатись з біологічно активною молекулою у положенні білка, що містить негенетично закодовану амінокислоту, що несе ацетиленову функціональну групу. Зв'язок, за допомогою якого сполучаються полі(етиленгліколь) та біологічно активна молекула, містить (але не обмежується) продукт реакції [3+2]-циклоприєднання Хьюсгена. [168] У цій галузі точно встановлено, що полі(етиленгліколь) може застосовуватись для модифікування поверхонь біоматеріалів (дивись, наприклад, патент США 6,610,281; Mehvar R., J. Pharmaceut. Sci., 3(1):125-136 (2000), які включено до цього опису шляхом посилання). Цей винахід також включає біоматеріали, які мають поверхню, на якій знаходиться одна або декілька реакційноздатних азидних або ацетиленових ділянок та один або декілька азид- або ацетиленвмісних полімерів за цим винаходом, сполучених з поверхнею за допомогою зв'язку, який одержали унаслідок реакції [3+2]-циклоприєднання Хьюсгена. Біоматеріали та інші речовини можуть також зв'язуватись з азид- або ацетиленактивованими похідними полімеру за допомогою іншого зв'язку, аніж азидний або ацетиленовий зв'язок, наприклад, за допомогою зв'язку, що містить карбоксильну, аміно-, спиртову або тіолову групу, залишаючи азидну або ацетиленову складову доступною для подальших реакцій. [169] Цей винахід включає спосіб синтезування азид-або ацетиленвмісних полімерів за цим винаходом. У разі азидвмісної похідної полі(етиленгліколю), азид може зв'язуватись безпосередньо з атомом вуглецю згаданого полімеру. За альтернативним варіантом азидвмісну похідну полі(етиленгліколю) можна одержати шляхом приєднання сполучного агента, який має азидну складову на одному кінці, до традиційно активованого полімеру такими чином, що одержаний в результаті полімер має азидну складову на своєму кінці. У разі ацетиленвмісної похідної полі(етиленгліколю), ацетилен може зв'язуватись безпосередньо з атомом вуглецю згаданого полімеру. За альтернативним варіантом ацетиленвмісну похідну полі(етиленгліколю) можна одержати шляхом приєднання сполучного агента, який має ацетиленову складову на одному кінці, до традиційно активованого полімеру таким чином, що одержаний в результаті полімер має ацетиленову складову на своєму кінці. [170] Конкретніше, у разі азидвмісної похідної полі(етиленгліколю), водорозчинний полімер, який має щонайменше одну активну гідроксильну складову, зазнає реакції з одержанням заміщеного полімеру, який має у своєму складі більш реакційноздатну складову, наприклад, 25 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 мезилатну, трезилатну, тозилатну або галогенову відщеплювану групу. Фахівцям є відомими способи одержання та застосування похідних полі(етиленгліколю), які містять галогенангідриди сульфокислоти, атоми галогену та інші відщеплювані групи. У подальшому одержаний заміщений полімер піддають реакції із заміщення азидної складової на кінці полімеру на більш реакційноздатну складову. За альтернативним варіантом водорозчинний полімер, який має щонайменше одну активну нуклеофільну або електрофільну складову, зазнає реакції зі сполучним агентом, який має азид на одному кінці, завдяки чому між полімером полі(етиленгліколю) та сполучним агентом утворюється ковалентний зв'язок, і азидна складова розміщується на кінці полімеру. Фахівцям відомі нуклеофільні та електрофільні складові, у тому числі аміни, тіоли, гідразиди, гідразини, спирти, карбоксилати, альдегіди, кетони, складні тіоефіри тощо. [171] Конкретніше, у разі ацетиленвмісної похідної полі(етиленгліколю), водорозчинний полімер, який має щонайменше одну активну гідроксильну складову, зазнає реакції з заміщення галогену або іншої активованої відщеплюваної групи у попереднику, що містить ацетиленову складову. За альтернативним варіантом водорозчинний полімер, який має щонайменше одну активну нуклеофільну або електрофільну складову, зазнає реакції із сполучним агентом, який має ацетилен на одному кінці, завдяки чому між полімером полі(етиленгліколю) та сполучним агентом утворюється ковалентний зв'язок, і ацетиленова складова розміщується на кінці полімеру. Фахівцям у цій галузі добре відомо застосування галогенових складових, активованої відщеплюваної групи, нуклеофільних та електрофільних складових у контексті органічного синтезу та одержання і застосування похідних полі(етиленгліколю). [172] Цей винахід також пропонує спосіб селективної модифікації білків шляхом приєднання до модифікованого білка інших речовин, у тому числі, але без обмеження ними, водорозчинних полімерів, таких як полі(етиленгліколь) та похідні полі(етиленгліколю), які містять азидну або ацетиленову складову. Азид- та ацетиленвмісні похідні полі(етиленгліколю) можуть застосовуватись для модифікування властивостей поверхонь та молекул, де важливим фактором є біосумісність, стабільність, розчинність та відсутність імуногенності, з одночасним забезпеченням більш селективних засобів приєднання похідних полі(етиленгліколю) до білків, аніж ті, що були раніше відомі у цій галузі. II. Родина супергенів гормону росту [173] До числа наведених нижче білків входять білки, закодовані генами родини супергенів гормону росту (GH) (Bazan F. Immunology Today 11: 350-354 (1991); Bazan, J. F. Science 257: 410-411 (1992); Mott H.R. and Campbell I.D., Current Opinion in Structural Biology 5: 114-121 (1995); Silvennoinen O. and Ihle J.N., Signalling by the Hematopoietic Cytokine Receptors (1996)): гормон росту, пролактин, плацентарний лактоген, еритропоетин (EPO), тромбопоетин (TPO), інтерлейкін-2 (IL-2), IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-10, IL-11, IL-12 (субодиниця p35), IL-13, IL15, онкостатин M, ціліарний нейротропний фактор, фактор інгібування лейкозних клітин, інтерферон альфа, інтерферон бета, інтерферон гамма, інтерферон омега, інтерферон тау, гранулоцитарний колонієстимулювальний фактор (G-CSF), гранулоцитарно-макрофагальний колонієстимулювальний фактор (GM-CSF), макрофагальний колонієстимулювальний фактор (M-CSF) та кардіотропін-1 (CT-1) ("родина супергенів GH"). Вважають, що у майбутньому, завдяки клонуванню і секвенуванню генів, будуть ідентифіковані додаткові члени цієї родини генів. Члени родини супергенів GH мають подібні вторинні та третинні структури, незважаючи на те, що вони, як правило, мають обмежену ідентичність амінокислот або послідовностей ДНК. Спільні відмітні структурні ознаки забезпечують можливість легкої ідентифікації нових членів згаданої родини генів. Приймаючи до уваги рівень структурної гомології серед членів родини супергенів GH, за допомогою цього винаходу штучно закодовані амінокислоти можуть вводитись до складу будь-яких членів родини супергенів GH. [174] Структури ряду цитокінів, у тому числі G-CSF (Hill C.P., Proc. Natl. Acad. Sci. USA 90:5167-5171 (1993)), GM-CSF (Diederichs K. et al. Science 154: 1779-1782 (1991); Walter et al., J. Mol. Biol. 224:1075-1085 (1992)), IL-2 (Bazan J.F. Science 257: 410-411 (1992); McKay D.B. Science 257: 412 (1992)), IL-4 (Redfield et al., Biochemistry 30: 11029-11035 (1991); Powers et al., Science 256:1673-1677 (1992)), та IL-5 (Milburn et al., Nature 363: 172-176 (1993)) були визначені рентгенографічними та ЯМР-дослідженнями і продемонстрували вражаючу консервативність, порівняно із структурою GH, незважаючи на відсутність суттєвої гомології первинної структури. EPO вважають членом цієї родини, виходячи з результатів досліджень з моделювання та мутагенезу (Boissel et al., J. Biol. Chem. 268: 15983-15993 (1993); Wen et al., J. Biol. Chem. 269: 22839-22846 (1994)). До цієї родини належить велика кількість додаткових цитокінів та факторів росту, у тому числі ціліарний нейротропний фактор (CNTF), фактор інгібування лейкозних клітин (LIF), тромбопоетин (TPO), онкостатин M, макрофагальний колонієстимулювальний фактор (M 26 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 CSF), IL-3, IL-6, IL-7, IL-9, IL-12, IL-13, IL-15 та інтерферон альфа, бета, омега, тау та гамма (оглядова стаття Mott and Campbell, Current Opinion in Structural Biology 5: 114-121 (1995); Silvennoinen and Ihle (1996) Signalling by the Hematopoietic Cytokine Receptors). Зараз вважають, що усі вищезгадані цитокіни та фактори росту утворюють одну велику родину генів. [175] Окрім того, що члени цієї родини мають подібні вторинну та третинну структури, вони також мають спільну властивість, за якою вони мають олігомеризувати поверхневоклітинні рецептори для активації внутрішньоклітинних шляхів передачі сигналу. Деякі члени родини GH, у тому числі, але без обмеження ними, GH та EPO, зв'язують рецептор одного типу і примушують його утворювати гомодимери. Енші члени родини, у тому числі, але без обмеження, IL-2, IL4 та IL-6, зв'язують рецептори більше ніж одного типу і примушують ці рецептори утворювати гетеродимери або агрегати більш високого порядку (Davis et al., (1993) Science 260: 1805-1808; Paonessa et al., 1995) EMBO J. 14: 1942-1951; Mott and Campbell, Current Opinion in Structural Biology 5: 114-121 (1995)). Дослідження з мутагенезу показали, що, подібно до GH, згадані інші цитокіни та фактори росту містять численні рецепторзв'язувальні сайти, як правило, два, і зв'язують свої споріднені рецептори послідовно (Mott and Campbell, Current Opinion in Structural Biology 5: 114-121 (1995); Matthews et al., (1996) Proc. Natl. Acad. Sci. USA 93: 9471-9476). Подібно до GH, основні рецепторзв'язувальні сайти згаданих інших членів родини знаходяться, головним чином, на чотирьох альфа-спіралях та на петлі A-B. Конкретні амінокислоти у спіральних пучках, що приймають участь у зв'язуванні рецепторів, різняться серед члені родини. Більшість клітинноповерхневих рецепторів, що взаємодіють з членами родини супергенів GH, є структурно спорідненими і складають другу велику мультигенну родину. Дивись, наприклад, патент США 6,608,183. [176] Загальний висновок, якого дійшли на основі результатів мутаційних досліджень різних членів родини супергенів GH, полягає у тому, що петлі, які сполучають альфа-спіралі, як правило, не є залученими до участі у зв'язуванні рецепторів. Зокрема, коротка петля B-C, як видається, не є незамінною при зв'язуванні рецепторів у більшості, якщо не у всіх, членів родини. З цієї причини петлю B-C у членів родини супергенів GH можна замінити штучно закодованими амінокислотами, як описано у цій заявці. Петлю A-B, петлю C-D (і петлю D-E інтерферону/IL-10-подібних членів родини супергенів GH) також можна замінити штучною амінокислотою. Амінокислоти, проксимальні до спіралі А та дистальні до кінцевої спіралі, також не є схильними до залучення до процесу зв'язування рецептора, і також можуть бути ділянками для введення штучних амінокислот. За деякими варіантами здійснення цього винаходу штучно закодованою амінокислотою замінюють будь-яке положення у межах петлі, у тому числі, але без обмеження, перші 1, 2, 3, 4, 5, 6, 7 або більше амінокислот петлі A-B, петлі B-C, петлі C-D або петлі D-E. За деякими варіантами здійснення цього винаходу штучно закодованою амінокислотою замінюють останні 1, 2, 3, 4, 5, 6, 7 або більше амінокислот петлі A-B, петлі B-C, петлі C-D або петлі D-E. [177] Певні члени родини GH, у тому числі, але без обмеження, EPO, IL-2, IL-3, IL-4, IL-6, GCSF, GM-CSF, TPO, IL-10, IL-12 p35, IL-13, IL-15 та інтерферон бета, містять N-сполучені та Oсполучені цукри. Сайти глікозилування у білків знаходяться, майже виключно, на ділянках петель, а не у альфа-спіральних пучках. Оскільки ділянки петель, як правило, не є залученими до зв'язування рецепторів і оскільки вони є ділянками ковалентного приєднання цукрових груп, вони можуть бути придатними ділянками для введення штучних амінокислотних замін до згаданих білків. Амінокислоти, що складають N- та O-сполучені сайти глікозилування у згаданих білків, можуть бути ділянками для штучних амінокислотних замін, оскільки ці амінокислоти знаходяться на поверхні. Таким чином, природний білок може переносити об'ємні цукрові групи, приєднані до білків на цих ділянках, а сайти глікозилування мають схильність до розміщення на певній відстані від рецепторзв'язувальних сайтів. [178] Ймовірно, що у майбутньому будуть відкриті інші члени родини супергенів GH. Нові члени родини супергенів GH можуть ідентифікуватись за допомогою комп'ютерного аналізу вторинної та третинної структури прогнозованих білкових послідовностей. Члени родини супергенів GH, як правило, мають чотири або п'ять амфіпатичних спіралей, сполучених неспіральними амінокислотами (ділянки петель). Згадані білки можуть містити гідрофобну сигнальну послідовність на N-кінці для стимулювання секреції з клітини. Таким чином, до цього винаходу є включеними також члени родини супергенів GH, відкриті впродовж останнього часу. [179] У посиланні на поліпептиди fEPO у цій заявці, fEPO використовують як приклад члену родини супергенів GH. Таким чином, розуміється, що модифікації та хімічні способи, опис яких наведено у цій заявці відносно fEPO, можуть рівною мірою застосовуватись по відношенню до будь-яких інших членів родини супергенів GH, у тому числі до тих з них, які конкретно наведені у цьому описі. 27 UA 106731 C2 5 10 15 20 25 30 35 40 45 50 55 60 III. Експресійні системи, що продукують моно- або полігенні продукти, які становлять інтерес, за допомогою однієї експресійної генно-інженерної конструкції, що застосовуються за цим винаходом [180] У цій заявці описані нові експресійні системи для продукування моно- або полігенних продуктів, які становлять інтерес, за допомогою однієї експресійної генно-інженерної конструкції або за допомогою численних експресійних генно-інженерних конструкцій. За одним із варіантів здійснення цей винахід включає еукаріотну систему супресованої експресії, у якій супресовані білкові гени, які становлять інтерес, транскрибуються з одного вектора, що кодує усі елементи, необхідні для супресії з включенням штучної амінокислоти. Зокрема, згадана експресійна система містить вектор, що є здатним до експресії білків у еукаріотних клітинах-хазяях таким чином, що згаданий(-і) білок(-ки) містить(-ять) штучну амінокислоту. Згадана експресійна система містить вектор, що є здатним до експресії білків у еукаріотних клітинах-хазяях таким чином, що згаданий(-і) білок(-ки) містить(-ять) штучно закодовану амінокислоту. Згадана експресійна система містить вектор, що є здатним до експресії білків у еукаріотних клітинаххазяях таким чином, що згаданий(-і) білок(-ки) містить(-ять) штучно закодовану амінокислоту, наприклад, але без обмеження, п-ацетилфенілаланін (pAF). Згадані експресійні вектори можуть містити наведені нижче функціонально сполучені елементи: одну або численні копії супресорної тРНК, у тому числі промотори та термінатори транскрипції, що функціонують у еукаріотній клітині; промотор, сполучений з послідовністю ДНК, що кодує будь-який ген, який становить інтерес, для експресії (супресований); та промотор, сполучений з кодувальною ділянкою функціональної тРНК-синтетази ссавця. Варіантом здійснення цього винаходу є клітини ссавців, які містять вектор супресованої експресії, і спосіб одержання функціональних супресованих білків у клітинах ссавців, трансфікованих згаданим вектором супресованої експресії. [181] Цей винахід також стосується супресованої експресії функціональних білків з відповідними рівнями експресії за допомогою експресійної системи в еукаріотній клітині-хазяїні. За одним з варіантів здійснення цей винахід має відношення до супресованої експресії функціональних білків в еукаріотних клітинах, за варіантом, якому віддається перевага, клітинах ссавців, клітинах грибів або дріжджів, і, за варіантом, якому віддають ще більшу перевагу, клітинах CHO (яєчник китайського хом'ячка), за допомогою системи супресованої експресії. [182] Конкретніше, один з варіантів здійснення цього винаходу має відношення до супресованої експресії функціональних білків в еукаріотних клітинах, наприклад, клітинах ссавців, клітинах грибів або дріжджів, із застосуванням системи супресованої експресії, де усі супресійні елементи знаходяться у одному векторі. Один з варіантом здійснення цього винаходу має відношення до супресованої експресії функціональних білків у клітинах CHO (яєчник китайського хом'ячка) (клітини, депоновані у ATCC (американська колекція типових культур), а також відомі варіанти та клітини і/або клітини, які, як відомо фахівцям у цій галузі, можна застосовувати замість клітин CHO), із застосуванням системи супресованої експресії, де усі супресійні елементи знаходяться у одному векторі. За одним з аспектів цього варіанта здійснення винаходу супресована експресія функціональних білків у клітинах ссавців включає застосування системи супресованої експресії, що містить тРНК, тРНК синтетазу та транскрипційні/трансляційні елементи білка, який становить інтерес. [183] Енший варіант здійснення цього винаходу пропонує варіант включення однієї або численних тРНК з незалежною транскрипційною орієнтацією для ефективного модулювання рівнів внутрішньоклітинної експресії. За іншим варіантом здійснення цей винахід пропонує варіант включення однієї транскрипційної одиниці, яка кодує один білок, який становить інтерес, до якого має бути введена штучна амінокислота. Енший приклад здійснення цього винаходу пропонує варіант включення численних транскрипційних одиниць, що кодують численні білки, які становлять інтерес, або їхні субодиниці (наприклад, легкі та важкі ланцюги антитіл), до одного з яких або до усіх білків має бути введена штучна амінокислота. [184] Еншим варіантом здійснення цього винаходу є лінія еукаріотних клітин, таких як лінія клітин CHO, що секретує супресований білок, де експресія згаданого білка відбувається через систему супресованої експресії, опис якої наведено. За деякими варіантами здійснення цього винаходу згаданою еукаріотною клітиною є клітина CHO або клітина дріжджів, наприклад, Pichia. Еншим варіантом здійснення цього винаходу є культура клітин ссавців або дріжджів, що містить систему супресованої експресії, здатну до продукування функціональних супресованих білків. До згаданих клітин ссавців або дріжджів можуть вводитись вектори, які містять послідовності супресованої експресії за цим винаходом. Під час культивування клітин, необхідні послідовності екзогенної ДНК можуть бути введеними до цільових клітин ссавців або дріжджів, завдяки чому екзогенну ДНК вводять до генома клітин ссавців або дріжджів довільно або шляхом гомологічної рекомбінації. У залежності від застосованих послідовностей, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюModified animal erythropoietin polypeptides and their uses
Автори російськоюTian, Feng, Hays Putnam, Anna-Maria, A., Song, Frank, Chu, Stephanie, Sheffer, Joseph, Barnett, Richard, S., Siladi, Marc, Atkinson, Kyle, Lee, Darin, Canning, Peter, C.
МПК / Мітки
МПК: C12N 15/10, C12N 15/11, C12P 21/02, A61K 38/22, A61P 7/06, C07K 14/505, C12N 15/16
Мітки: еритропоетину, застосування, модифіковані, тварин, поліпептиди
Код посилання
<a href="https://ua.patents.su/195-106731-modifikovani-polipeptidi-eritropoetinu-tvarin-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Модифіковані поліпептиди еритропоетину тварин та їх застосування</a>
Попередній патент: Спосіб вимірювання видів електричної енергії
Наступний патент: Рідкі водні склади для захисту культурних рослин
Випадковий патент: Тримач стоматологічного штрипса