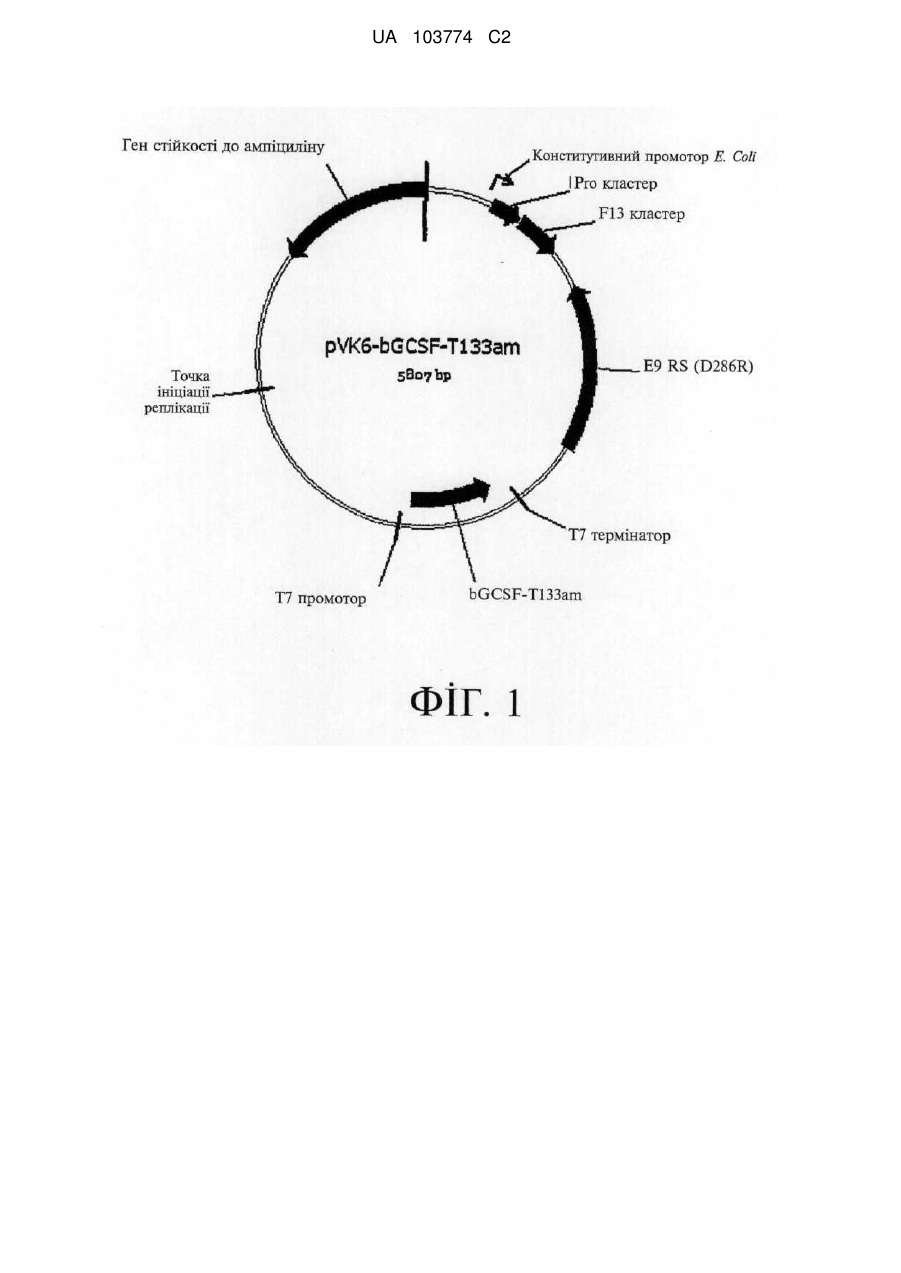
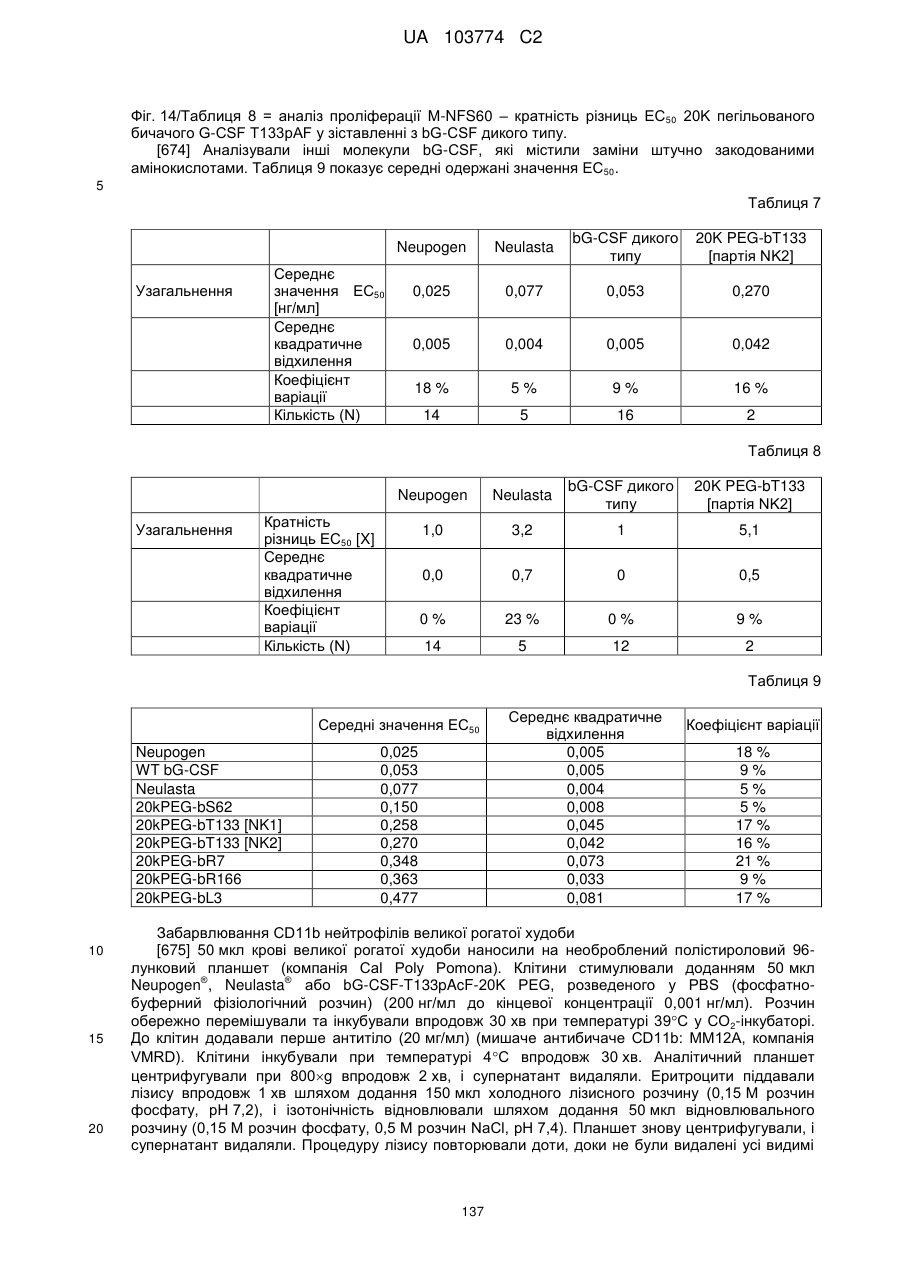
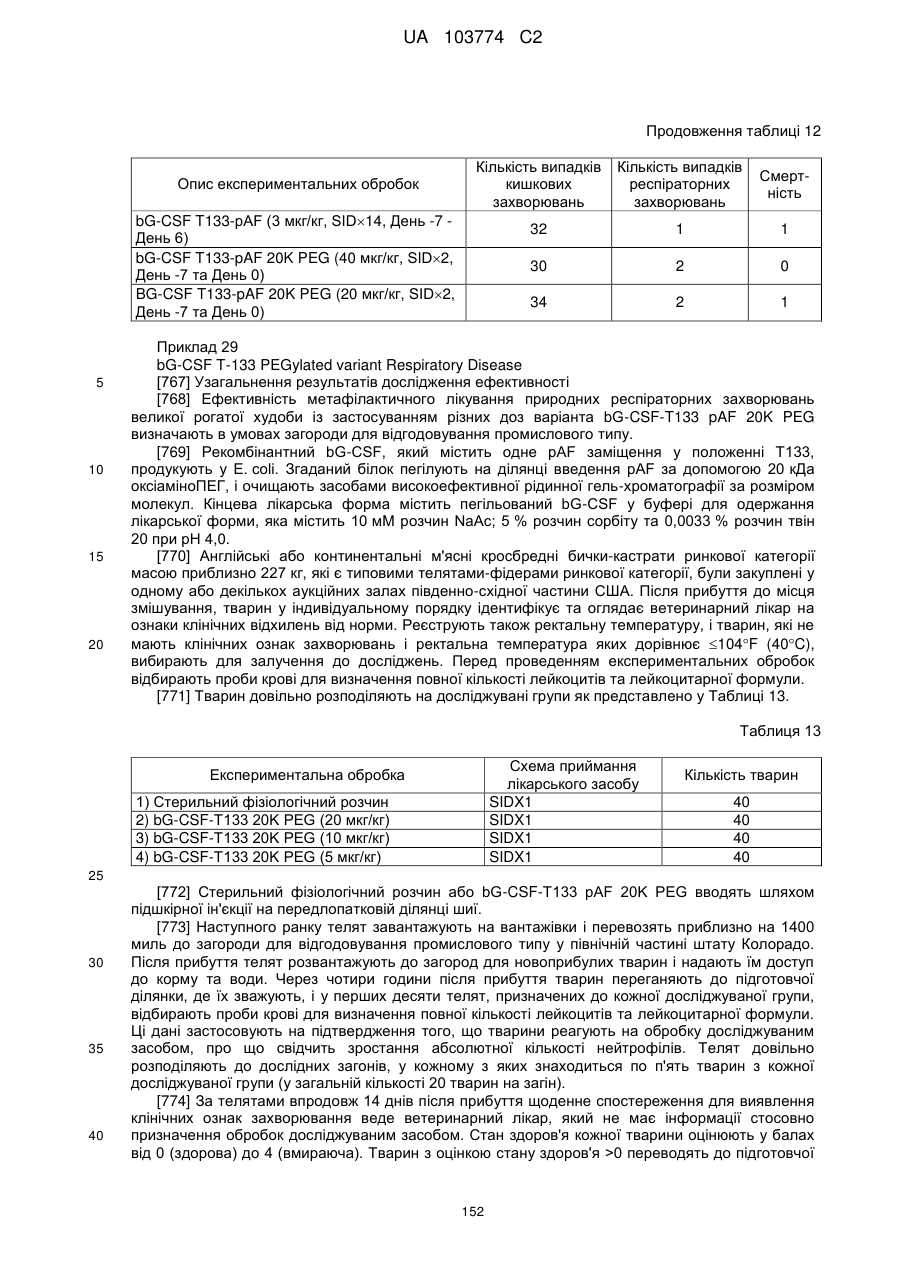
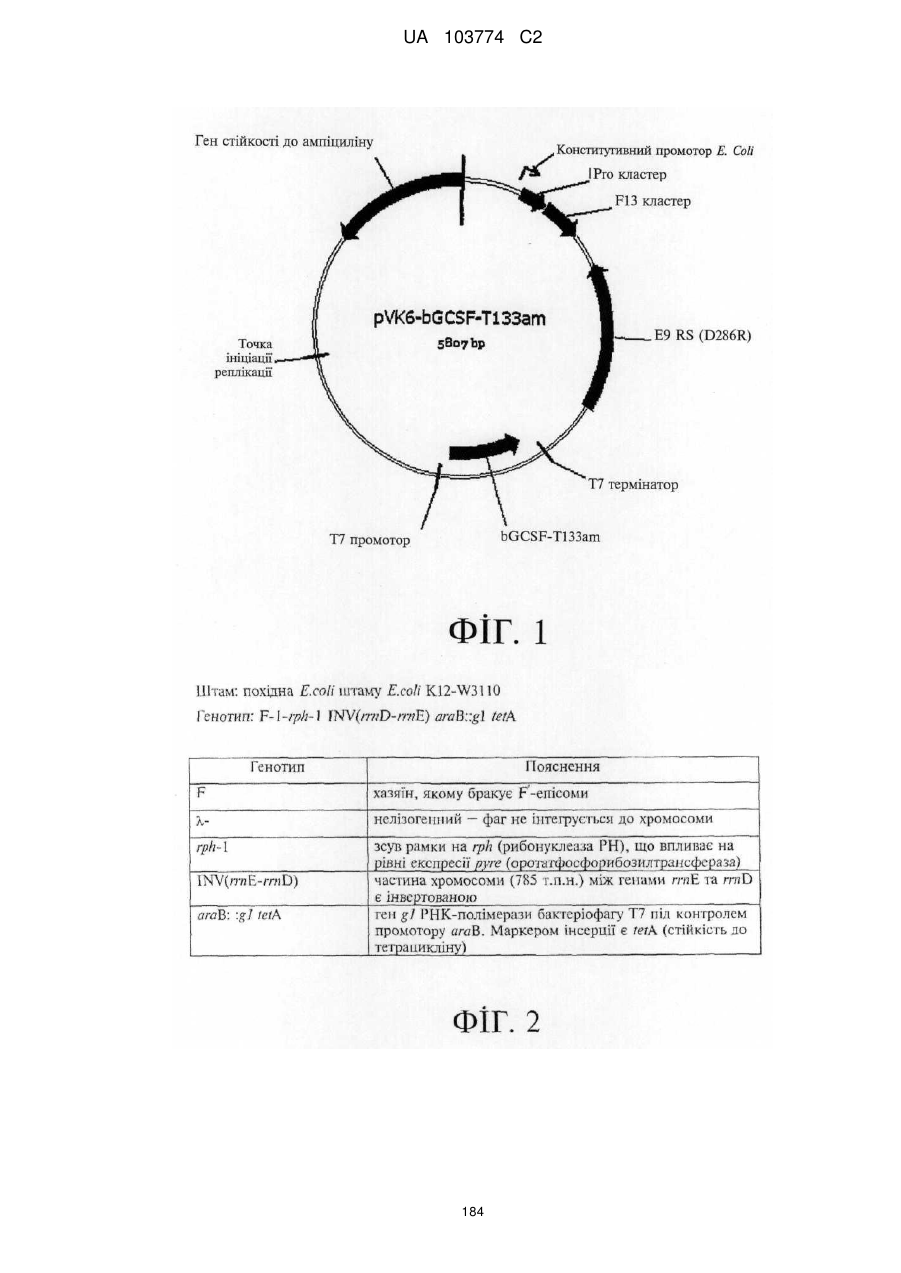
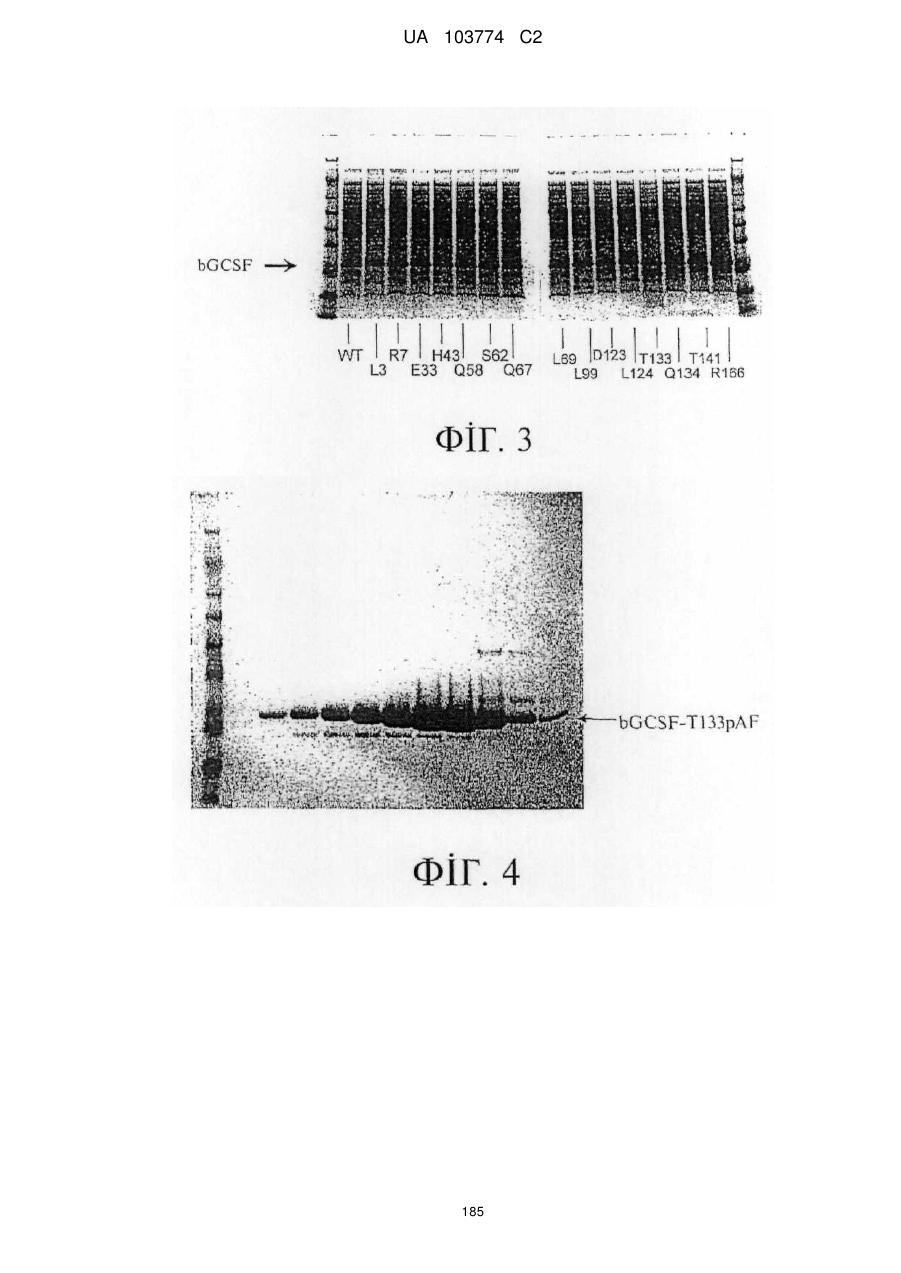
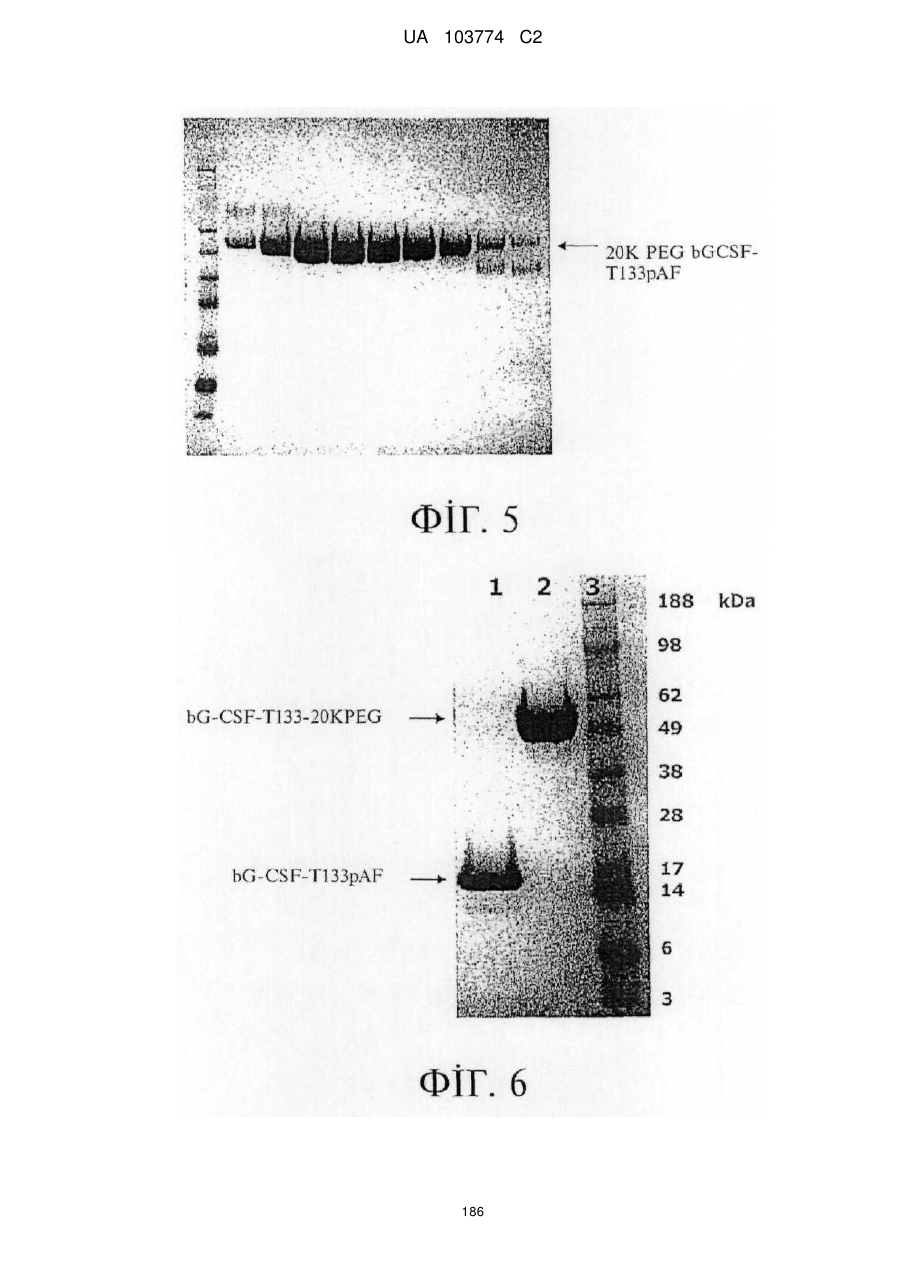
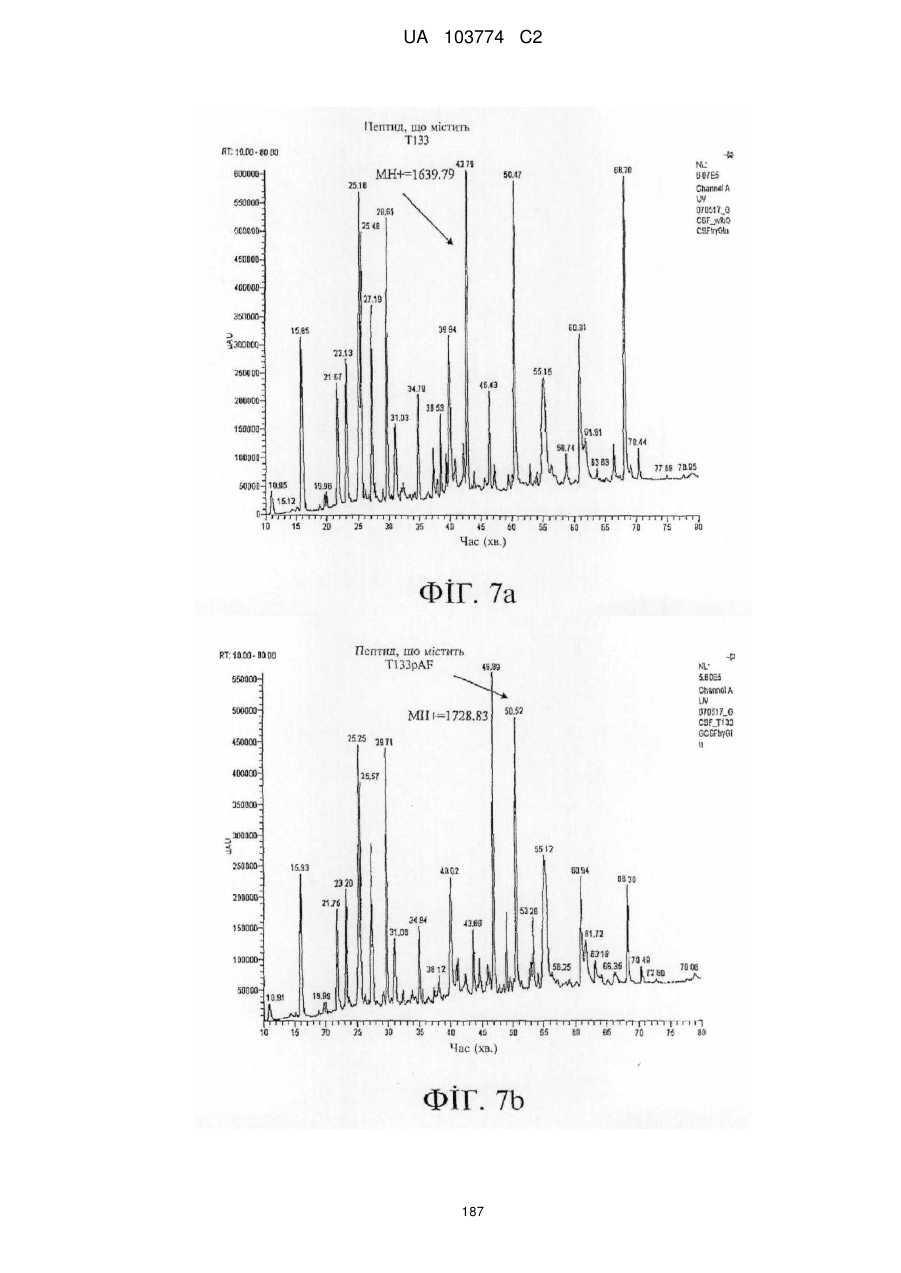
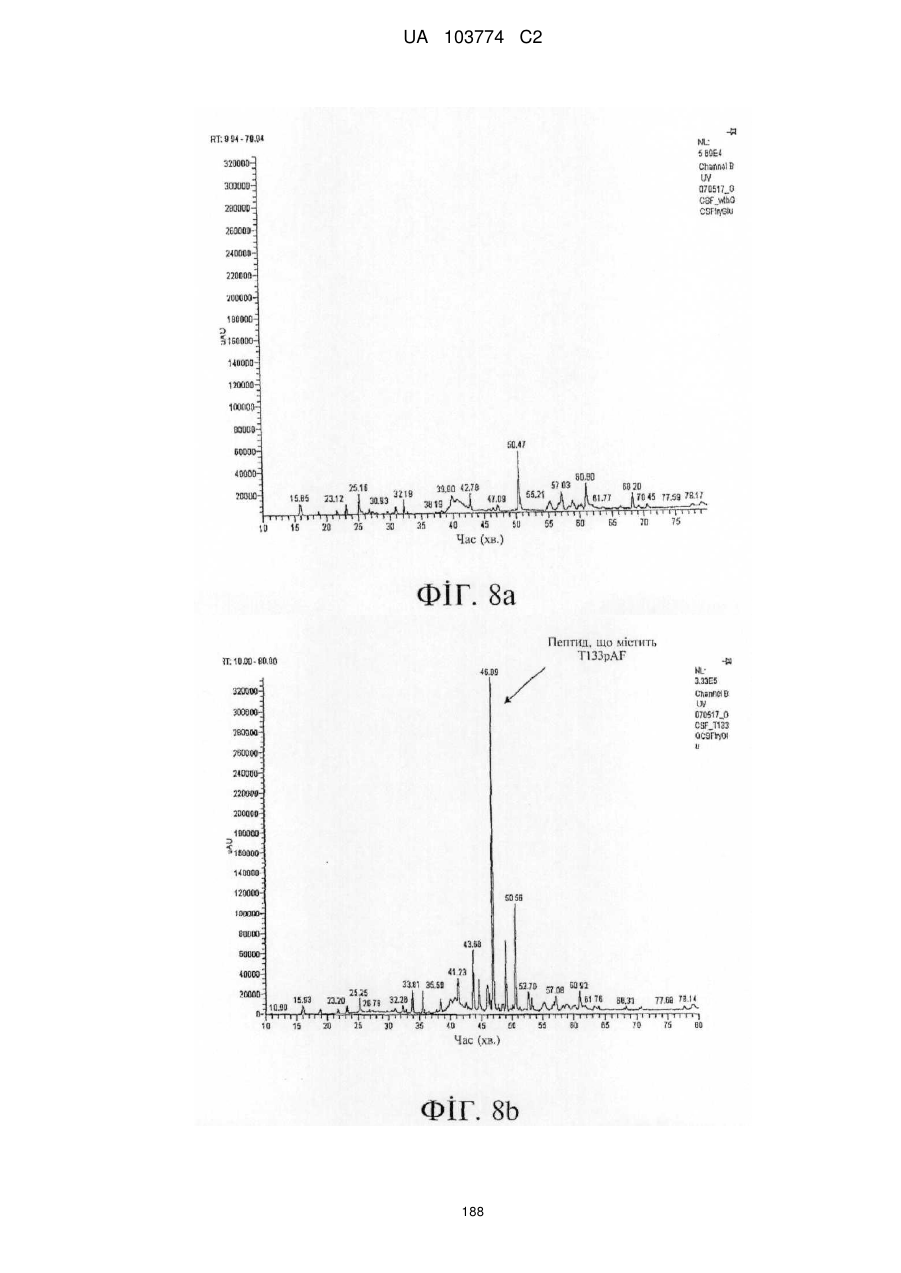
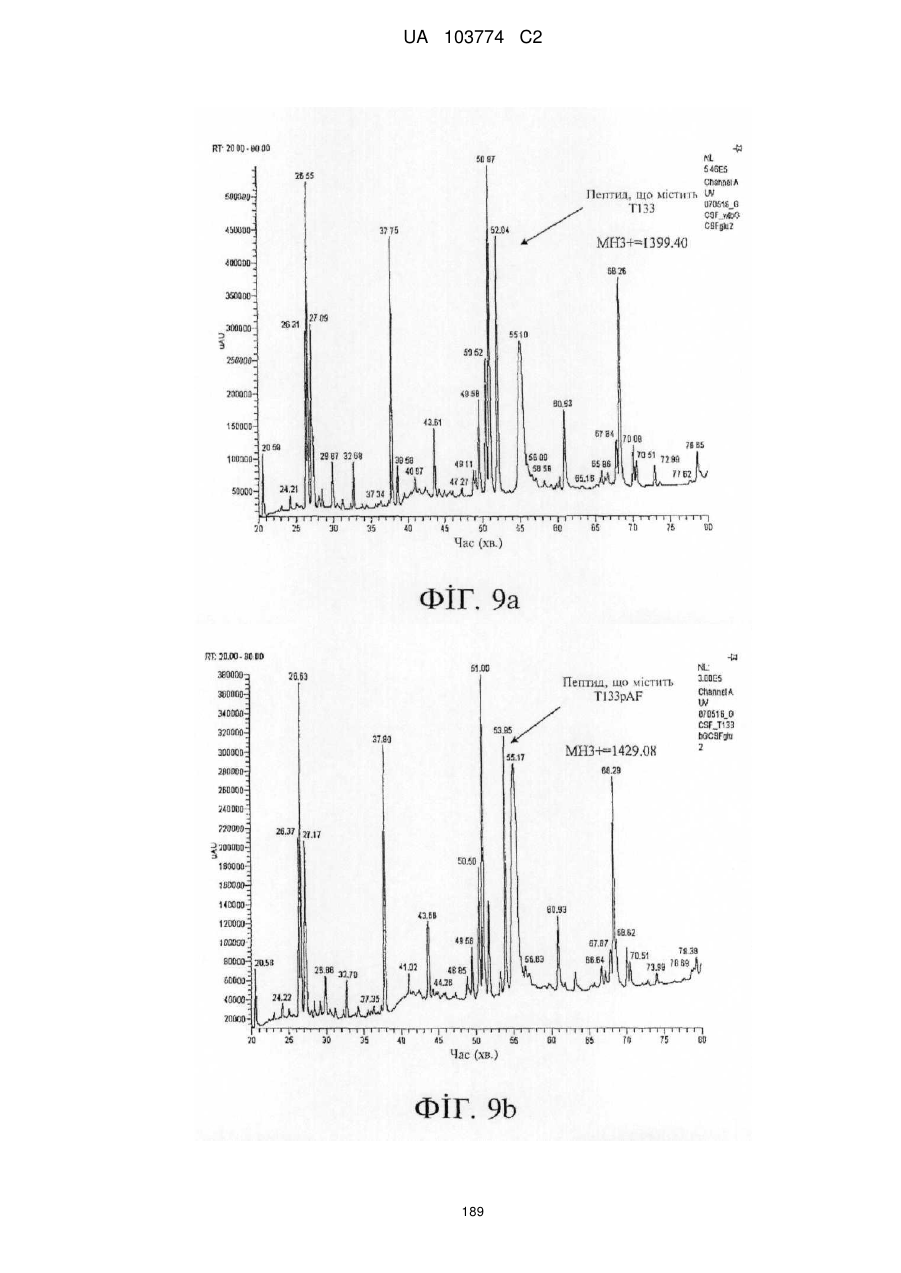
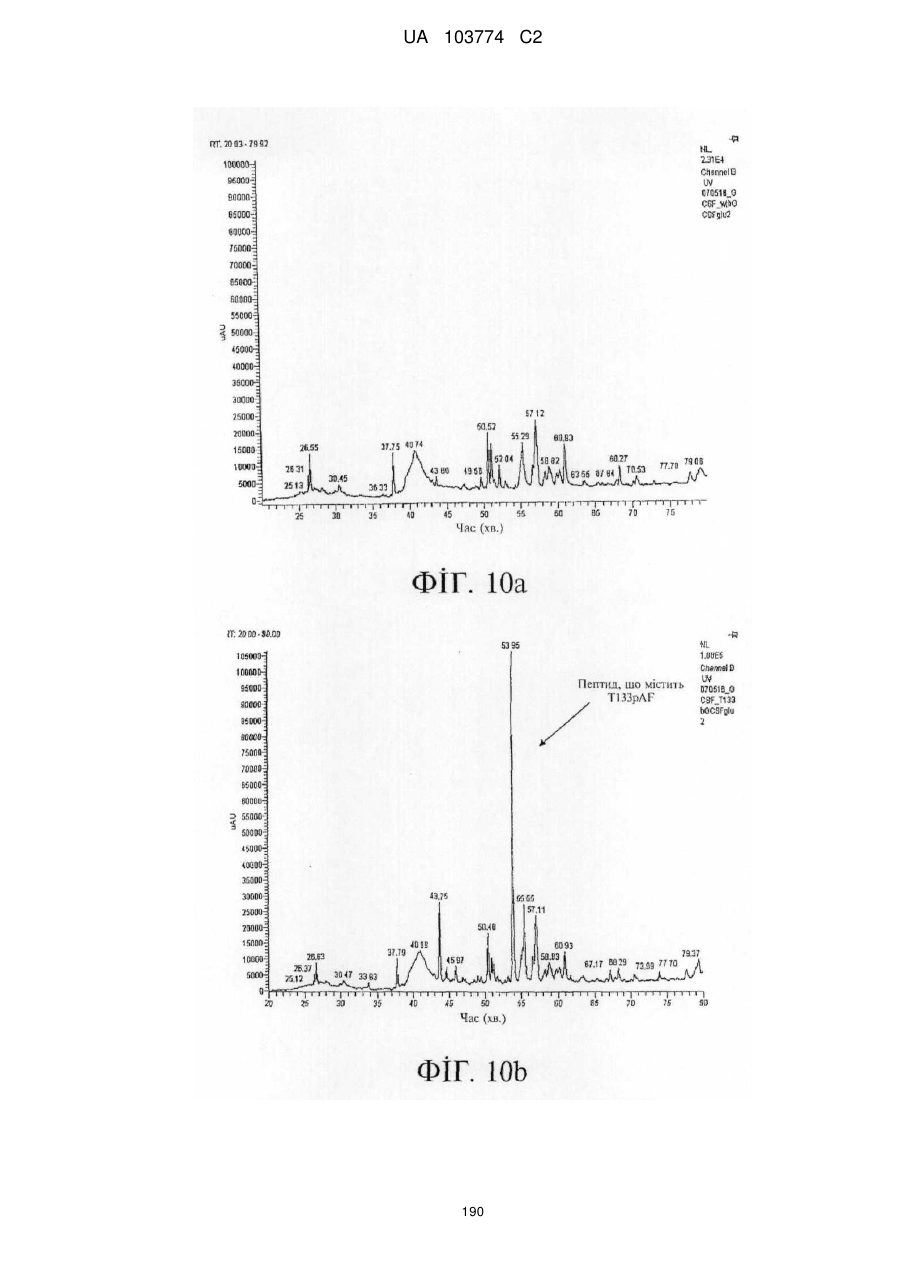
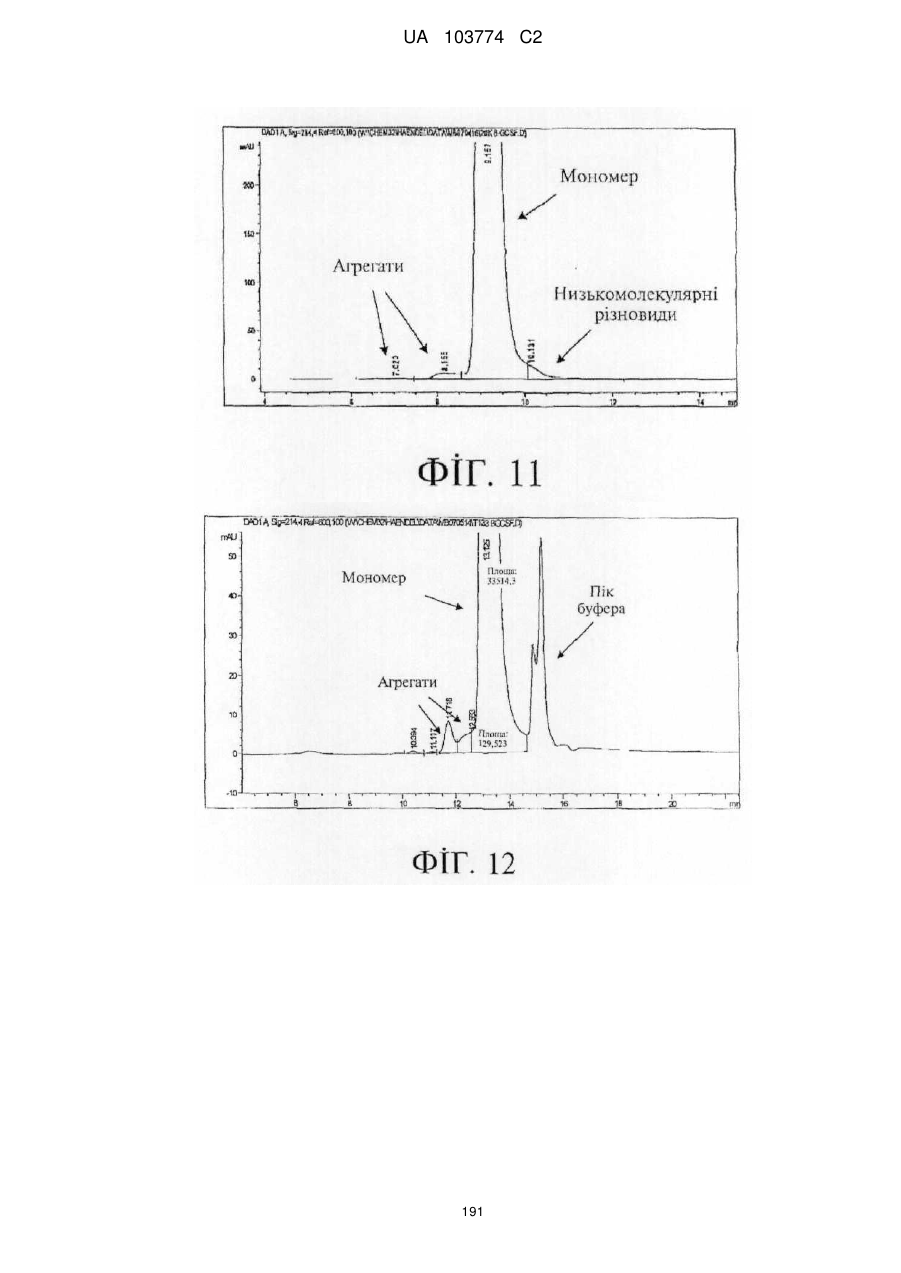
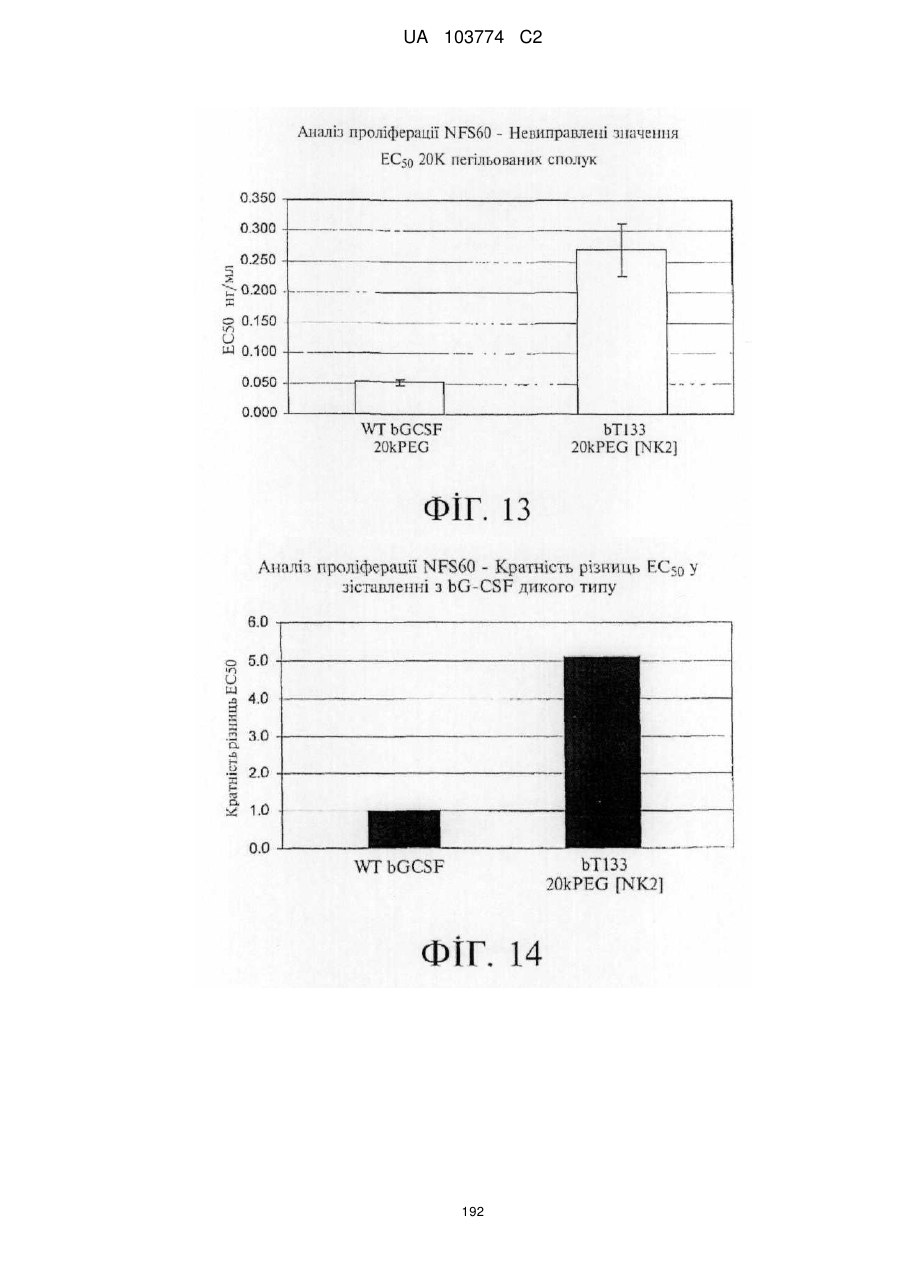
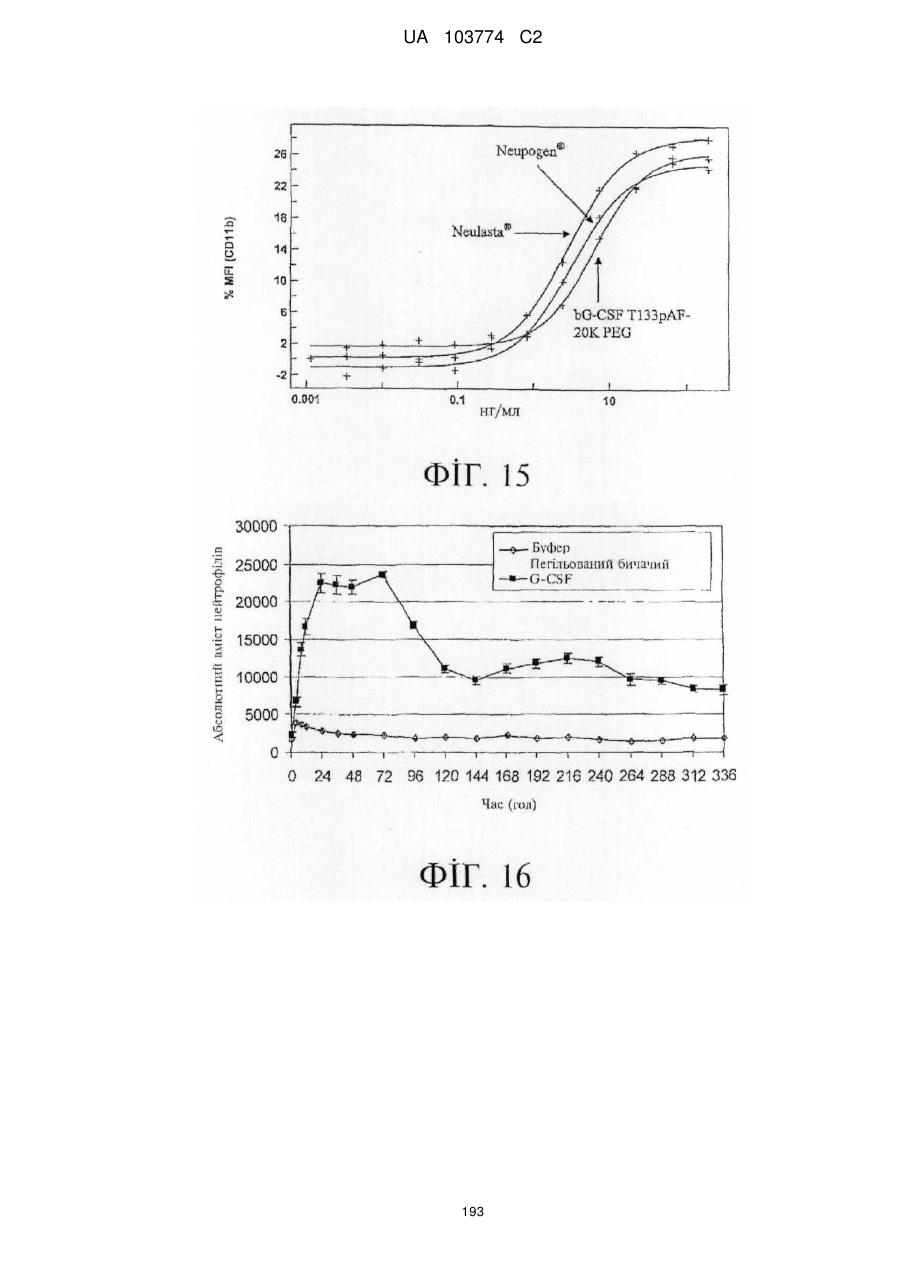
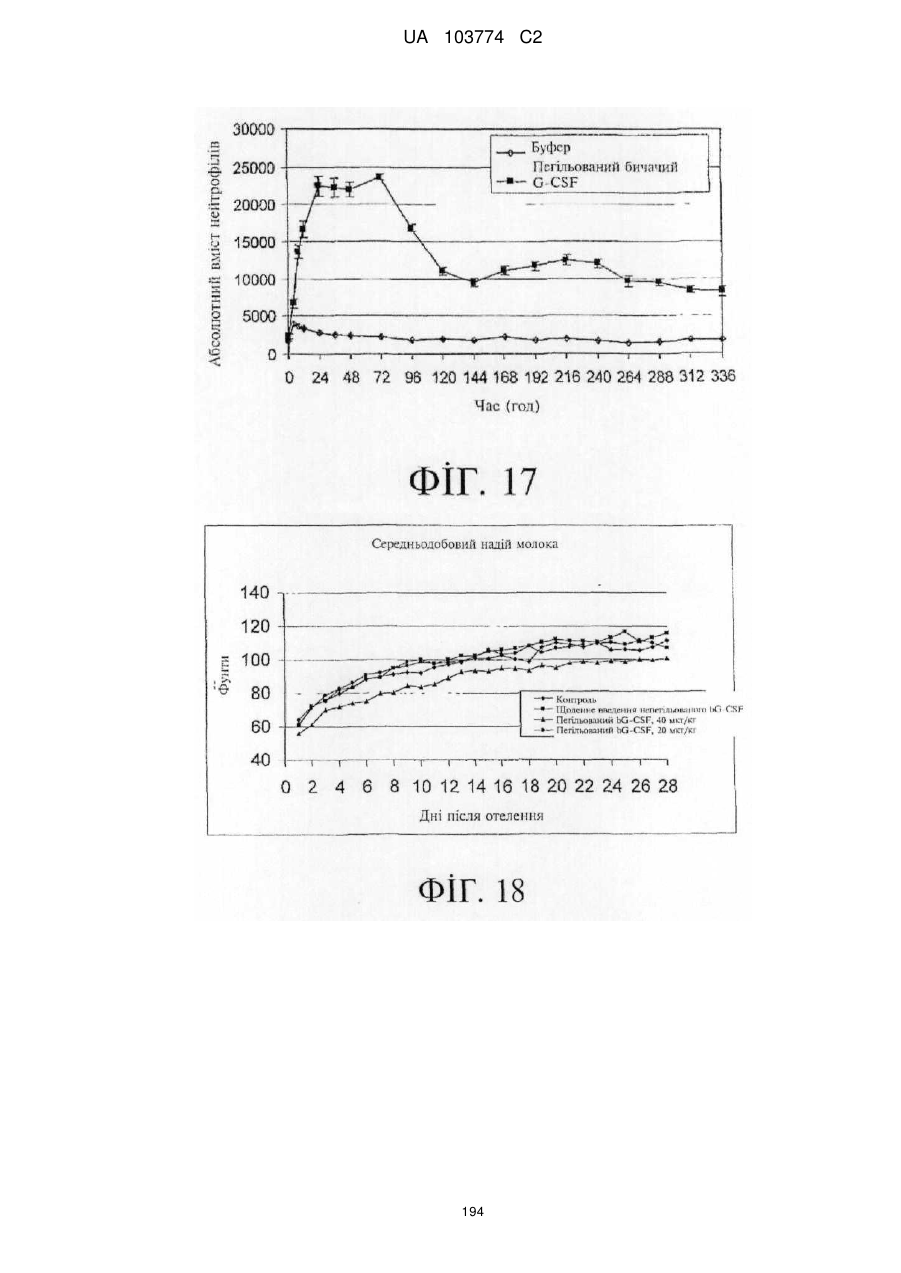
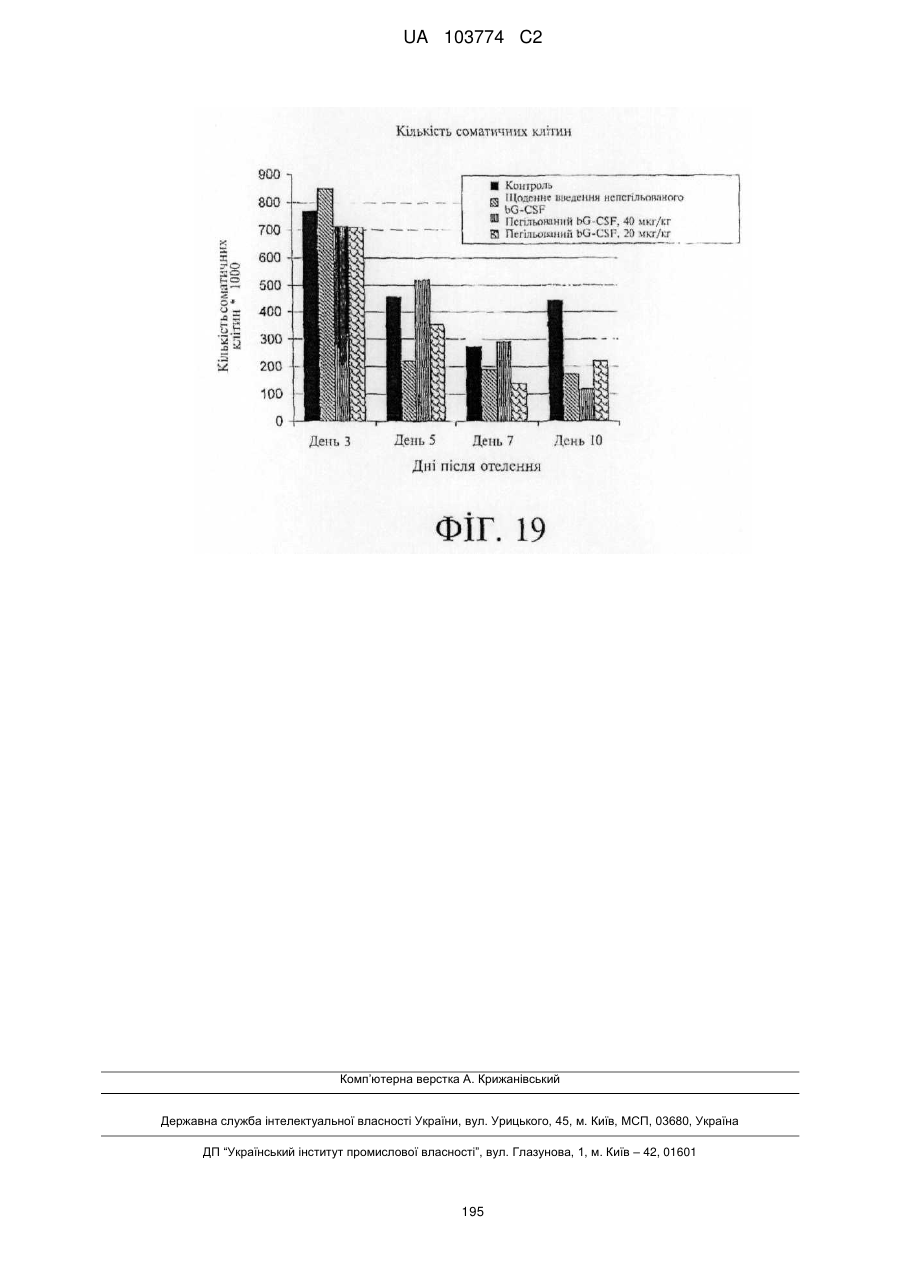
Модифіковані поліпептиди бичачого гранулоцитарного колонієстимулювального фактора (g-csf) та їх застосування
Номер патенту: 103774
Опубліковано: 25.11.2013
Автори: Норман Тія, Кнудсен Нік, Хо Лілліан, Кодер Алан, Крайнов Вадим, Каннінг Пітер С., Хейз Патман Анна-Марія А.
Формула / Реферат
1. Поліпептид bG-CSF, який містить містить послідовність SEQ ID NO:1 або послідовність SEQ ID NO:2, де положення 133 послідовності SEQ ID NO:1 або положення 134 послідовності SEQ ID NO:2 заміщене пара-ацетилфенілаланіном, і цей поліпептид сполучений із водорозчинним полімером, який містить полі(етиленгліколеву) складову.
2. Поліпептид bG-CSF за п. 1, де згаданий водорозчинний полімер має молекулярну масу від приблизно 0,1 кДа до приблизно 100 кДа.
3. Поліпептид bG-CSF за п. 1, де згаданий водорозчинний полімер має молекулярну масу від приблизно 0,1 кДа до приблизно 50 кДа.
4. Поліпептид bG-CSF за п. 1, де згаданий водорозчинний полімер має молекулярну масу 20 кДа.
5. Ізольована нуклеїнова кислота, яка кодує поліпептид bG-CSF за п. 1.
6. Вектор, який містить ізольовану нуклеїнову кислоту за п. 5.
7. Вектор за п. 6, який додатково містить нуклеїнову кислоту, яка кодує ортогональну тРНК-синтетазу та ортогональну тРНК, специфічні для введення пара-ацетилфенілаланіну у bG-CSF.
8. Клітина-хазяїн, яка містить нуклеїнову кислоту за п. 5 або вектор за п. 6 або п. 7.
9. Клітина-хазяїн за п. 8, яка додатково містить ортогональну тРНК-синтетазу та ортогональну тРНК, специфічні для введення пара-ацетилфенілаланіну у bG-CSF.
10. Спосіб одержання поліпептиду bG-CSF, що містить штучно закодовану амінокислоту, який включає: культивування клітин-хазяїв за п. 8 за умов, що уможливлюють експресію поліпептиду bG-CSF; очищення поліпептиду bG-CSF; та пегилювання поліпептиду bG-CSF.
11. Композиція, яка містить поліпептид bG-CSF за будь-яким із пп. 1-4 та фармацевтично прийнятний носій.
12. Поліпептид bG-CSF за будь-яким із пп. 1-4 або композиція за п. 11 для застосування як фармацевтичний продукт.
13. Спосіб лікування тварини, окрім людини, яка має інфекційне захворювання, модульоване bG-CSF, який включає введення цій тварині терапевтично ефективної кількості поліпептиду bG-CSF за будь-яким із пп. 1-4.
14. Спосіб за п. 13, який відрізняється тим, що твариною є велика рогата худоба.
15. Спосіб за п. 13, який відрізняється тим, що інфекційним захворюванням є мастит великої рогатої худоби.
16. Спосіб запобігання інфекційному захворюванню у тварини, окрім людини, який включає введення цій тварині терапевтично ефективної кількості поліпептиду bG-CSF за будь-яким із пп. 1-4.
17. Спосіб за п. 16, який відрізняється тим, що твариною є велика рогата худоба.
18. Спосіб за п. 16, який відрізняється тим, що інфекційним захворюванням є мастит великої рогатої худоби.
19. Застосування поліпептиду bG-CSF за будь-яким із пп. 1-4 у виготовленні фармацевтичного продукту для лікування інфекційного захворювання, модульованого bG-CSF.
20. Застосування за п. 19, причому інфекційним захворюванням є інфекційне захворювання великої рогатої худоби.
21. Застосування за п. 19, причому інфекційним захворюванням є мастит великої рогатої худоби.
22. Застосування поліпептиду bG-CSF за будь-яким із пп. 1-4 у виготовленні фармацевтичного продукту для запобігання інфекційному захворюванню, модульованому bG-CSF.
23. Застосування за п. 22, причому інфекційним захворюванням є інфекційне захворювання великої рогатої худоби.
24. Застосування за п. 22, причому інфекційним захворюванням є мастит великої рогатої худоби.
25. Застосування композиції за п. 11 у виготовленні фармацевтичного продукту для лікування інфекційного захворювання, модульованого bG-CSF.
26. Застосування за п. 25, причому інфекційним захворюванням є інфекційне захворювання великої рогатої худоби.
27. Застосування за п. 25, причому інфекційним захворюванням є мастит великої рогатої худоби.
28. Застосування композиції за п. 11 у виготовленні фармацевтичного продукту для запобігання інфекційному захворюванню, модульованому bGCSF.
29. Застосування за п. 28, причому інфекційним захворюванням є інфекційне захворювання великої рогатої худоби.
30. Застосування за п. 28, причому інфекційним захворюванням є мастит великої рогатої худоби.
Текст
Реферат: Винахід стосується поліпептиду bG-CSF, який містить містить послідовність SEQ ID NO:1 або послідовність SEQ ID NO:2, де положення 133 послідовності SEQ ID NO:1 або положення 134 послідовності SEQ ID NO:2 заміщене пара-ацетилфенілаланіном, і цей поліпептид сполучений із водорозчинним полімером, який містить полі(етиленгліколеву) складову, способу його одержання та застосування. UA 103774 C2 (12) UA 103774 C2 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь, до якої належить винахід Цей винахід стосується поліпептидів бичачого гранулоцитарного колонієстимулювального фактора (bG-CSF), факультативно модифікованих щонайменше однією штучно закодованою амінокислотою. Передумови створення винаходу [01] Економічний вплив інфекційних захворювань на обсяг виробництва продуктів тваринництва є добре задокументованим. Інфекційні захворювання зменшують прибуток, підвищують витрати виробництва і створюють загрозу безпеці продовольчих продуктів, а також негативно впливають на продуктивність, стан здоров'я та благополуччя тварини. Хвороби можуть зменшити надій та якість молока, результатом чого є великі економічні втрати для фермерів, які розводять молочну худобу, та постачальників м'ясної худоби, зокрема, коли у деяких випадках інфекційні мікробні захворювання спричинюють захворюваність та смертність новонароджених, молодих (наприклад, ремонтне поголів'я) та дорослих тварин. Два таких захворювання, мастит та респіраторні хвороби великої рогатої худоби (BRD), можуть чинити спустошувальний вплив на обсяги виробництва продуктів тваринництва. [02] Мастит визначають як запалення молочної залози. Це захворювання може уразити будь-якого ссавця, наприклад, корів, овець та кіз. Мастит великої рогатої худоби являє собою інфекцію вимені жуйних, таких як корови, яка спричинюється, головним чином, грампозитивними та грамнегативними бактеріями, зокрема, у корів, які утримуються на підприємствах з виробництва молока за інтенсивною технологією. Наслідком згаданої бактеріальної інфекції є запалення молочної залози (тобто дійок та вимені). Тварини можуть стати більш сприйнятливими до маститу унаслідок порушеної мікробіцидної функції нейтрофілів у передродовий період. Це захворювання викликає особливу занепокоєність та має значну економічну важливість, оскільки згаданий патогенний організм легко передається від однієї тварини до іншої у процесі доїння. Ця хвороба часто розвивається у перші декілька тижнів після отелення і може повторюватись з кожною лактацією. Деякими з головних патогенних мікроорганізмів, які спричинюють мастит великої рогатої худоби, є Staphylococcus aureus, Streptococcus agalactiae, Streptococcus uberis, Streptococcus dysgalactiae, Escherichia coli, Aerobacter aerogenes, Klebsiella pneumoniae та Pseudomonas aeruginosa. Дивись також публікацію Bovine Mastitis, під редакцією Glenys Bloomfield, V&O Publications 1987, яку включено до цього опису шляхом посилання. Ці мікроорганізми проникають до вимені через проток дійки і викликають запалення тканин молочної залози із спричиненням формування рубцевої тканини, яка, після утворення, може спричинювати постійне зниження молочної продуктивності корови. Інфекція може також змінити склад, кількість, зовнішній вигляд та якість молока. Патогенні мікроорганізми, які спричинюють мастит, підрозділяються на дві категорії, а саме контагіозні та такі, що заселяють навколишнє середовище. Контагіозні бактерії, такі як Streptococcus agalactiae та Staphylococcus aureus, заселяють, головним чином, такі ділянки тканини хазяїна як молочні залози, протоки дійок та пошкодження шкіри дійок, і передаються від однієї інфікованої корови до іншої під час процесу доїння. Бактерії, що заселяють навколишнє середовище, до яких часто належать стрептококи, ентерококи та коліформні мікроорганізми, існують, як правило, у середовищі, яке оточує корову, і з'являються з таких джерел як фекалії корів, грунт, матеріал рослинного походження, підстилка або вода, і інфікують тварину унаслідок випадкового умовно-патогенного контакту. Зазначена різниця між контагіозними патогенами та патогенами, що існують у навколишньому середовищі, хоча і не є вичерпною, але має практичне значення, оскільки різні групи мікроорганізмів вимагають різних заходів з догляду за молочною чередою. У разі усіх випадків маститу великої рогатої худоби, незалежно від мікроорганізму, який його спричинив, шлях проникнення патогенного мікроорганізму до внутрішньої частини вимені проходить через отвір та проток дійки. Традиційними джерелами шкідливих мікроорганізмів є забруднене доїльне обладнання, доїльний апарат, інші хворі на мастит тварини, середовище стійла у неналежному санітарному стані та процеси екскреції (дефекація/сечовипускання) самої тварини. [03] Існує цілий ряд форм або типів маститу великої рогатої худоби, які різняться за тяжкістю або симптоматологією, у тому числі такі: (1) інфекція вимені; проникнення до порожнини вимені мікроорганізмів, які розмножуються у залозі та спричинюють запалення; (2) неклінічний або субклінічний мастит; форма маститу, при якій відсутнє опухання залози і немає очевидних відхилень молока від норми, хоча молоко зазнає змін, які можуть бути виявлені специфічними тестами. Мастит цього типу є найбільш поширеним і спричинює найбільші загальні втрати у більшості черід. Його часто називають "прихованим" маститом; (3) клінічний мастит; форма маститу, у разі якої спостерігається аномальний стан вимені та секреції. Клінічний мастит у легкій формі призводить до змін молока, таких як утворення пластівців, згустків, та водянистий 1 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 або незвичний зовнішній вигляд. Підвищена температура та чутливість вимені є слабкими або відсутніми, але можуть спостерігатись ознаки напухання. Тяжкий клінічний мастит характеризується раптовим розвитком з опуханням інфікованої чверті, яка є гарячою, твердою та чутливою. Молоко має ненормальний вигляд, і надій молока зменшується. Подеколи, окрім місцевих явищ у вимені, захворює сама корова. У тварини спостерігаються ознаки лихоманки, пришвидшення пульсу, пригнічений стан, слабкість та втрата апетиту. Комбінацію цих станів часто називають гострим системним маститом, оскільки уражається не лише вим'я, а тварина у цілому; та (4) хронічний мастит; форма маститу, що спричинюється постійною інфекцією вимені, яка більшість часу існує у неклінічній формі, але періодично може переходити у гостру клінічну форму. Після цих "раптових загострень" захворювання, як правило, тимчасово повертається до неклінічної форми. (Дивись, взагалі, публікацію Current Concepts of Bovine Mastitis, опубліковану у The National Mastitis Council, Inc., 2nd Ed. 1978, стор. 5). [04] Як і раніш, мастит спричинює великі економічні втрати молочної промисловості. Мастит негативно впливає на прибутковість череди декількома шляхами, як безпосередньо, так і опосередковано, у тому числі: (1) втрата молочної продуктивності; (2) підвищена норма вибраковування інфікованих корів; (3) зменшена вартість молока; (4) вибракуване молоко після обробки антибіотиками; (5) витрати на ветеринарне обслуговування (антибіотики та візити ветеринарного лікаря); та (6) смертність. (Bovine Mastitis, Glenys Bloomfield, supra, на стор. 33). [05] Іншим поширеним захворюванням, яке уражає тваринництво на промисловій основі, є транспортна лихоманка (респіраторні хвороби великої рогатої худоби або BRD). Дехто вважає BRD "комплексом захворювань" з двох причин: транспортна лихоманка, як правило, спричинюється цілим рядом патогенних мікроорганізмів, як вірусних, так і бактеріальних, які взаємодіють між собою із спричиненням повністю розвиненого захворювання, та оскільки поведінка патогенних мікроорганізмів може являти собою послідовний процес, результатом якого, крок за кроком, стають хворі тварини. Бактеріальні патогенні мікроорганізми є найкраще відомою причиною гострого синдрому. Бактеріальні патогенні мікроорганізми можуть проникати до дихальних шляхів великої рогатої худоби після того, як тварини були ослаблені вірусною інфекцією. Передувати та додавати свій внесок до інфекції можуть також інші фактори, такі як стрес, який є наслідком відлучення, транспортування, зміни корму та коливань навколишньої температури та вологості. У багатьох випадках це додається до впливу патогенних організмів, якому піддається велика рогата худоба під час транспортування, коли худобу змішують із худобою іншого походження у вантажівках, дворах для худоби та аукціонних корівниках, результатом чого є високий рівень захворюваності великої рогатої худоби, доставленої до загороди для відгодовування. [06] Бактерії декількох видів були виділені та асоційовані з BRD, і деякими з найбільш поширених є Mannhemia haemolytica, Pasteurella multocida та (або) Histophilus somni. Haemophilus somnus являє собою вірулентний патогенний мікроорганізм, який спричинює септицемію великої рогатої худоби, і подеколи одержані в результаті прояви називають "комплексом Haemophilus somnus", однією із форм якого є респіраторна хвороба; такі віруси, наприклад, як вірус інфекційного ринотрахеїту великої рогатої худоби (IBR), вірусної діареї великої рогатої худоби (BVD) та респіраторно-синцитіальний вірус великої рогатої худоби (BRSV), також можуть приймати участь в ініціюванні комплексу BRD, часто відкриваючи двері для вторинних бактеріальних інфекцій. [07] Оскільки ліквідувати ці мікроорганізми у навколишньому середовищі практично неможливо, до комплексу BRD слід підходити з точки зору запобігання проникненню цих хвороботворних агентів, виявлення і лікування клінічних випадків з усією можливою швидкістю та ефективністю. Респіраторні захворювання є головною причиною втрат м'ясної худоби від хвороб. Загальновизнаним є те, що кінцевою причиною смерті у більшості випадків транспортної лихоманки є бактеріальна (як правило, пастерельозна) пневмонія. Pasteurella haemolytica, зокрема, тип 1A, є найпоширенішою бактерією, яка виділяється у випадках респіраторного захворювання у Північній Америці. Подеколи допомагає вакцинація проти деяких інфекційних агентів, які спричинюють транспортну лихоманку, але вакцини є доступними та ефективними лише для декількох агентів, що, як відомо, спричинюють згаданий комплекс захворювань. [08] Антибіотикотерапія є головною складовою стратегії боротьби з маститом та BRD. У патенті США № 7,182,948, який у повному обсязі включено до цього опису шляхом посилання, вказується на те, що була показана ефективність занурення дійок у дезінфекційний протимікробний розчин, який містить йод, проти інфекцій молочної залози та бактерій, які спричинюють мастит (Pankey J.W. et al., (1983) J. Dairy Sci. 66 (1), 161-167). Ці композиції, як правило, застосовують для обробки дійок шляхом занурення або обприскування дійок перед 2 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 доїнням, а також після видалення доїльних стаканів. Для зниження рівня захворюваності на мастит були розроблені наявні у продажу розчини для дезінфекції дійок шляхом занурення, які містять різноманітні протимікробні агенти, у тому числі йодофори, четвертинні сполуки амонію, сполуки, що виділяють хлор (наприклад, гіпохлорити лужних металів), окисники (наприклад, пероксид водню, надкислоти), протоновані форми карбонових кислот (наприклад, гептанова, октанова, нонанова, деканова, ундеканова кислоти), аніонні кислоти (наприклад, алкіларилсульфонові кислоти), діоксид хлору (з хлориту) та бісбігуаніди, такі як хлоргексидин. Ці агенти, які мають різний ступінь ефективності, обмежують передавання маститу шляхом зменшення чисельності популяцій патогенних мікроорганізмів на дійках. Однак існують проблеми, пов'язані із застосуванням протимікробних препаратів. Найпоширеними з них є подразнення та розтріскування дійок. Для полегшення цих ускладнень до складу таких композицій включають пом'якшувальні домішки, такі як гліцерин та ланолін. Однак, навіть незважаючи на застосування цих пом'якшувальних домішок, все ще можуть траплятись випадки подразнення шкіри. [09] У патенті США № 6,790,867, який у повному обсязі включений до цього опису шляхом посилання, зазначено, що підшкірні ін'єкції лікарських засобів, які об'єднують нестероїдний протизапальний лікарський засіб (NSAID), такий як флуніксин (flunixin), з фторованим хлорамфеніколом або антибіотиком, який є похідним тіамфеніколу, таким як флорфенікол (florfenicol), можуть бути застосовані для лікування BRD. У патентній публікації США № 2007/0155799, яка у повному обсязі включена до цього опису шляхом посилання, описані нові сполуки феніколу, які можуть застосовуватись як антибіотичні проліки та у комбінації з NSAID або іншими антибіотиками. [10] NMC (у минулому Національна рада з маститу), неприбуткова організація, діяльність якої спрямована на зниження захворюваності маститом та підвищення якості молока, підкреслює важливість відповідної гігієни дійок, а також відповідного догляду за дійками для запобігання маститу. Економічна шкода, яка спричинюється маститом, примусила до проведення багатьох досліджень, спрямованих на боротьбу із цим захворюванням. Повідомляється, що фізичні стреси, а також умови навколишнього середовища є суттєвими факторами, що сприяють виникненню маститної інфекції. Дивись патентну публікацію США № 2002/0051789, яка включена до цього опису шляхом посилання. Оскільки було документально підтверджено, що субклінічний мастит безпосередньо пов'язаний з поганим станом дійок (Neijenhuis P. et al., (2001) J. Dairy Sci. (84) 2664-2672), був розроблений цілий ряд наявних у продажу розчинів для дезінфекції дійок шляхом занурення, які містять компоненти з кондиціонувальною дією (National Mastitis Council, Summary of Peer-Reviewed Publications on Efficacy of Premilking and Postmilking Teat Disinfectants Published Since 1980; January 2002). Було показано, що затверділість та шерехатість кінців дійок мають прямий зв'язок із клінічним маститом (Neijenhuis F. et al., (2001) J. Dairy Sci. (84) 2664-2672). Зменшення розтріскування та подразнення дійок, а також підтримання гнучкості дійок відіграє дуже важливу роль у боротьбі з інфекціями молочних залоз. Гліцерин також застосовують як кондиціонер для дійок у розчинах для дезінфекції дійок шляхом занурення. Однак результати досліджень не показують значного зниження кількості бактерій, які спричинюють мастит, таких як Staphylococcus aureus, Streptococcus agalactiae або коліформи, у разі підвищення вмісту гліцерину з 2 % до 10 % у 1 % йодному розчині для дезінфекції дійок шляхом занурення (National Mastitis Council, Summary of Peer-Reviewed Publications on Efficacy of Premilking and Postmilking Teat Disinfectants Published Since 1980; January 2002). Таким чином, незважаючи на доступність таких продуктів як розчини для дезінфекції дійок шляхом занурення, все ще залишається незадоволеною необхідність зниження кількості випадків захворювання, повторюваності та/або тяжкості маститу. [11] У патенті США № 5,849,883, який у повному обсязі включений до цього опису шляхом посилання, описаний ряд антибіотиків, які застосовують при лікування маститів, у тому числі, але без обмеження, антибіотики бета-лактамового ряду, такі як пеніциліни (ампіцилін (ampicillin), клоксацилін (cloxacillin), гетацилін (hetacillin), нафцилін (nafcillin), пеніцилін G (penicillin G), (бензилпеніцилін (benzylpenicillin)), прокаїнпеніцилін (procainepenicillin)) та цефалоспорини (цефоперазон (cefoperazone), цефуроксим (cefuroxime), цефалоніум (Cefalonium), цефапірин (cefapirin), цефоксазол (cefoxazole), цефрацетрил (cefracetrile)); антибіотики аміноглікозидного ряду (фраміцетин (framycetin), неоміцин (neomycin), новобіоцин (novobiocin), стрептоміцин (streptomycin)); антибіотики макролідного ряду (еритроміцин (erythromycin)); тетрацикліни (хлортетрациклін (chlortetracycline), окситетрациклін (oxytetracycline)); та антибіотики поліпептидного ряду (поліміксин В (Polymyxin B)). Лікування маститу антибіотиками здійснюють, як правило, шляхом інтрамамарних вливань коровам у лактаційний період, у разі виявлення клінічного маститу, або у сухостійний період (лікування 3 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 сухостійних корів). (Bovine Mastitis, supra, на стор. 69). У випадках тяжких клінічних захворювань антибіотики повинні вводитись парентерально, оскільки інтрамамарні вливання є неефективними унаслідок закупорки протоків. [12] Попередні сподівання, що антибіотики забезпечать повне подолання згаданого захворювання, не справдились. Жоден із вищезгаданих антибіотиків, які були застосовані до цього часу, не виявився повністю задовільним. На додаток до цього, було встановлено, що було б дуже бажаним замінити лікування із застосуванням антибіотиків на лікування за допомогою хіміко-терапевтичних лікарських сполук неантибіотичної групи, з наведених нижче причин: (1) антибіотики, які є ефективними у галузі людської медицини, не повинні застосовуватись у ветеринарній медицині для запобігання розвитку стійкості бактеріальних штамів, які спричинюють людські захворювання; (2) антибіотики повинні зберігатись для таких захворювань, для лікування яких не існує хіміко-терапевтичної лікарської сполуки, оскільки було доказано, що у бактеріальних штамів розвивається стійкість до такого антибіотику після тривалого його застосування; та (3) у Staphylococcus aureus, одного з вищезазначених патогенних мікроорганізмів, вже розвинулась стійкість до більшості антибіотиків, які застосовують при лікуванні маститу великої рогатої худоби. [13] Один із таких способів лікування хіміко-терапевтичною лікарською сполукою неантибіотичного ряду описано у патенті США № 4,610,993, який у повному обсязі включений до цього опису шляхом посилання, та у якому описаний спосіб лікування маститу великої рогатої худоби ефективною кількістю щонайменше однієї сполуки, якою є дисульфід піридин-Nоксиду. Інший спосіб тих самих винахідників описано у патенті США № 4,401,666, який включений до цього опису шляхом посилання, та у якому описаний спосіб лікування маститу великої рогатої худоби ефективною кількістю щонайменше однієї металічної солі піридин-2-тіонN-оксиду. Незважаючи на декілька цих опублікованих способів, дуже важливим залишається віднаходження економічно ефективних способів застосування сполук неантибіотичного ряду, які б суттєво подолали недоліки антибіотиків, що застосовувались до цього моменту, і, разом із тим, були б ефективними щодо лікування та запобігання маститу. [14] Іншим розповсюдженим захворюванням, яке уражає тваринництво на промисловій основі, є транспортна лихоманка (респіраторні хвороби великої рогатої худоби). Респіраторні захворювання є головною причиною втрат м'ясної худоби від захворювань. Термін "транспортна лихоманка" вживають для опису комплексу респіраторних захворювань, які спостерігаються у худоби віком від 6 місяців і більше після транспортування до загород для відгодовування або на пасовисько. Стреси, що є наслідком відлучення, кастрації, видалення рогів, голодного витримування худоби перед забиттям, надмірної скупченості, піддання впливу інфекційних агентів, змін раціону, транспортування, перепадів температури навколишнього середовища та інших стрес-факторів, у поєднанні з вірусними, бактеріальними, мікоплазмовими та/або хламідійними інфекціями, сприяють виникненню комплексу транспортної лихоманки. Змішування телят з різних ферм та/або аукціонних залів значною мірою полегшує піддавання впливу інфекційних агентів. Патент США № 6,497,869, який включений до цього опису шляхом посилання, описує деякі початкові інфекційні агенти, які можуть уражати велику рогату худобу. Змішування поголів'я може бути більш важливим сприятливим фактором для виникнення транспортної лихоманки, аніж стрес-фактори, хоча захворювання, яке виникає без змішування та стрес-факторів, як правило, різко погіршує перебіг респіраторного захворювання. Спроби зниження стресового навантаження унаслідок відлучення, кастрації, видалення рогів тощо, а також призвичаювання худоби до нових раціонів за дні та тижні до транспортування, бувають подеколи успішними (але можуть не бути економічно ефективними) щодо зниження рівня захворюваності на транспортну лихоманку. Подеколи допомагає вакцинація проти деяких інфекційних агентів, які спричинюють транспортну лихоманку, але вакцини є доступними та ефективними лише для декількох інфекційних агентів, відомих як агенти, які спричинюють згаданий комплекс захворювань. [15] Загальновизнаним є те, що кінцевою причиною смерті у більшості випадків транспортної лихоманки є бактеріальна (як правило, пастерельозна) пневмонія. Pasteurella haemolytica, зокрема, тип 1A, є найпоширенішою бактерією, що виділяється у випадках респіраторного захворювання у Північній Америці. Спроби експериментального відтворення бактеріальної пневмонії у великої рогатої худоби є, як правило, безуспішними без тяжкого стресу та супутнього пошкодження дихальних шляхів. Вважають, як правило, що у разі стресу віруси, мікоплазми та/або хламідії найчастіше спричинюють початкове пошкодження дихальних шляхів, яке сприяє виникненню тяжкої бактеріальної інфекції та захворювання. [16] Типовий спалах клінічного респіраторного захворювання розпочинається, як правило, через декілька годин або днів після прибуття худоби до загороди для відгодовування. У 4 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 нещодавно привезеної худоби у ваговому діапазоні від 400 фунтів до 500 фунтів (181,4-226,8 кг) рівень захворюваності на хвороби органів дихання становить від 10 % до 80 %, а рівень смертності дорівнює 1-10 % або більше. У разі аналізу сироватки цієї худоби виявляють чотирикратне підвищення рівня антитіл (сероконверсія), а при мікробіологічних дослідженнях дихальних шляхів та їх секретів можуть бути ідентифіковані міріади етіологічних агентів. Можна показати, що багато тварин (як хворих, так і здорових на вигляд) перенесли інфікування одним або декількома агентами (захворювання органів дихання, ймовірно, зрідка коли викликається лише одним інфекційним агентом). Незважаючи на те, що комплекс респіраторних хвороб великої рогатої худоби клінічно розпізнається після прибуття до загороди для відгодовування, інфекції, унаслідок яких виникає клінічне захворювання, розпочинаються, ймовірно, у аукціонних залах, де спочатку збирається худоба з різних ферм. Дивись також публікацію Bovine Respiratory Disease, Loan R.W. Texas A & M University Press, 1984, яка включена до цього опису шляхом посилання. [17] Корисним у ветеринарній медицині було б введення сполуки, яка лікує або зменшує кількість випадків захворювання, повторюваність, тривалість та/або тяжкість маститу або хвороби органів дихання у великої рогатої худоби або інших інфекцій у тварин, окрім людей, у тому числі, але без обмеження, великої рогатої худоби, птиці, свиней, коней, собак та кішок. До прикладів таких інфекцій належать, але без обмеження ними, септицемія новонароджених лошат, плевропневмонія у свиней та пневмонія у тварин, окрім людей. Такі сполуки можуть відновлювати або модулювати функцію нейтрофілів у тварини. [18] Родина супергенів гормону росту (GH) (Bazan F. Immunology Today 11: 350-354 (1991); Mott H.R. and Campbell I.D. Current Opinion in Structural Biology 5: 114-121 (1995); Silvennoinen O. and Ihle J.N. (1996) Signaling by the Hematopoietic Cytokine Receptors) являє собою набір білків із подібними структурними характеристиками. До складу кожного члена цієї родини білків входить чотириспіральний пучок. Незважаючи на існування ще неідентифікованих членів цієї родини, прикладами деяких членів цієї родини є такі: гормон росту, пролактин, плацентарний лактоген, еритропоетин (EPO), тромбопоетин (TPO), інтерлейкін-2 (IL-2), IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL10, IL-11, IL-12 (субодиниця p35), IL-13, IL-15, онкостатин M, циліарний нейротропний фактор, фактор інгібування лейкозних клітин, інтерферон альфа, інтерферон бета, інтерферон гамма, інтерферон омега, інтерферон тау, інтерферон епсилон, гранулоцитарний колонієстимулювальний фактор (G-CSF), гранулоцитарно-макрофагальний колонієстимулювальний фактор (GM-CSF), макрофагальний колонієстимулювальний фактор (M-CSF) та кардіотропін-1 (CT-1) ("родина супергенів GH"). Члени родини супергенів GH мають подібні вторинні та третинні структури, незважаючи на те, що вони, як правило, мають обмежену ідентичність амінокислот або послідовностей ДНК. Спільні відмітні структурні ознаки забезпечують можливість легкої ідентифікації нових членів згаданої родини генів. Опис пептидів із чотириспіральним пучком наведений у WO 2005/074650, що має назву "Modified Human Four Helical Bundle Polypeptides and Their Uses", яка у повному обсязі включена до цього опису шляхом посилання. [19] Членом родини супергенів GH є гранулоцитарний колонієстимулювальний фактор (GCSF). Гранулоцитарний колонієстимулювальний фактор (G-CSF) є одним з декількох глікопротеїнів фактора росту, відомих як колонієстимулювальні фактори (CSF), оскільки вони підтримують проліферацію кровотворних клітин-попередників. G-CSF стимулює проліферацію специфічних клітин-попередників кісткового мозку та їх диференціацію у гранулоцити. Він відрізняється від інших CSF своє здатністю як до стимулювання утворення колоній нейтрофільних гранулоцитів у напівтвердому агарі, так і до індукування термінальної диференціації мишачих лейкозних клітин мієломоноцитарного походження in vitro. Гранулоцитарний колонієстимулювальний фактор є сильнодіючим стимулятором проліферації та визрівання нейтрофілів in vivo (Cohen et al., Proc. Natl. Acad. Sci. 1987; 84: 2484-2488, дивись також Heidari et al., Vet. Immunol. Immunopathol. 2001; 81:45-57, ці публікації включені до цього опису шляхом посилання). G-CSF є також здатним до індукування функціональної активації або "праймування" зрілих нейтрофілів in vitro (Weisbart R.H., Gasson C.G., and D.W. Golde. Annals of Internal Medicine 1989; 110:297-303). Було показано, що G-CSF праймує людські гранулоцити і посилює виділення супероксиду, стимульоване хемотактичним пептидом, N-форміл-метіоніллейцил-феналаніном (S. Kitagawa, et al., Biochem. Biophys. Res. Commun. 1987; 144:1143-1146, та C.F. Nathan, Blood 1989; 74:301-306), та активує людські нейтрофіли при IgAопосередкованому фагоцитозі (Weisbart R.H., et al., Nature 1988; 332: 647-649). [20] Нейтрофіли є критичною складовою механізмів захисту хазяїна проти бактеріальних та грибкових інфекцій. G-CSF є здатним до індукування підвищення абсолютної кількості циркулюючих нейтрофілів та стимулювання їх функції. 5 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 [21] Були описані кДНК клонування та експресія рекомбінантного людського G-CSF (hGCSF), і було підтверджено, що рекомбінантний hG-CSF демонструє більшість (якщо не усі) біологічних властивостей нативної молекули (Souza L. et al. Science 232, 61-65 (1986)). Аналіз послідовностей клонів кДНК та геномної ДНК уможливив виведення амінокислотної послідовності та встановлення, що довжина білка становить 204 амінокислоти із сигнальною послідовністю довжиною у 30 амінокислот. Довжина зрілого білка дорівнює 174 амінокислотам, і він не має потенційних сайтів N-зв'язаного глікозилування, але має декілька можливих сайтів Озв'язаного глікозилування. [22] Клонування та експресія кДНК, яка кодує людський G-CSF, були описані двома групами (Nagata S. et. al., Nature 319, 415-418 (1986); Souza L.M. et al., Science 232, 61-65 (1986)). У першому повідомленні про клон кДНК G-CSF припускалось, що зрілий білок має 177 амінокислот у довжину. Автори повідомили, що вони також ідентифікували клон кДНК GCSF, який кодував білок, якому бракувало відрізку з трьох амінокислот. Ця коротша форма кДНК G-CSF експресувала G-CSF очікуваної активності. Друге повідомлення описує послідовність кДНК, ідентичну цій короткій формі, і не згадує про інші варіанти. Оскільки ці автори підтвердили, що коротка кДНК експресує G-CSF з очікуваним профілем біологічної активності, ймовірно, що це є важлива форма G-CSF, і що довша форма є або вторинним сплайсинговим варіантом, або артефактом клонування. [23] Matsumoto et al., у Infection and Immunity, Vol. 55, No. 11, стор. 2715 (1987), обговорюють захисний ефект людського G-CSF у разі мікробної інфекції у мишей з нейтропенією. [24] Наведені нижче патентні публікації мають відношення до G-CSF: у WO 87/03689, яка включена до цього опису шляхом посилання, описані гібридоми, які продукують моноклональні антитіла, специфічні до людського G-CSF, та їх застосування при очищенні G-CSF; у WO 87/02060, яка включена до цього опису шляхом посилання, описані людські G-CSF-подібні поліпептиди та способи їх продукування; у патенті США № 4,810,643, включеному до цього опису шляхом посилання, описані людські G-CSF-подібні поліпептиди, послідовності, які їх кодують, та способи їх продукування; та у WO 86/04605 і WO 86/04506, які включені до цього опису шляхом посилання, описані ген, який кодує людський G-CSF, та інгібітори інфекційних агентів, які містять людський G-CSF. Ізоляція h-GCSF та продукування G-CSF у клітинах-хазяях, наприклад, E. сoli, описані, наприклад, у патентах США № 4,810,643; № 4,999,291; № 5,580,755; та № 6,716,606, які включені до цього опису шляхом посилання. [25] G-CSF є фармацевтично активним білком, який регулює проліферацію, диференціацію та функціональну активацію нейтрофільних гранулоцитів (Metcalf, Blood 67:257 (1986); Yan, et al. Blood 84(3): 795-799 (1994); Bensinger, et al. Blood 81(11): 3158-3163 (1993); Roberts, et al., Expt'l Hematology 22: 1156-1163 (1994); Neben, et al. Blood 81(7): 1960-1967 (1993); Welte et al. PNAS-USA 82: 1526-1530 (1985); Souza et al. Science 232: 61-65 (1986) та Gabrilove, J. Seminars in Hematology 26:2 1-14 (1989)). G-CSF було очищено до однорідності із супернатантів культури лінії клітин 5637 раку людського сечового міхура (Welte et al., Proc. Natl. Acad. Sci (1985) 82:1526-1530). Послідовність кДНК, яка кодує нативний hG-CSF, є відомою з публікації Souza et al., Science (1986) 232:61-65. Як результат альтернативного сплайсингу у другому інтроні, існує дві природні форми hG-CSF з 204 амінокислотами або 207 амінокислотами, перші 30 з яких відповідають сигнальному пептиду (Lymphokines, IRL Press, Oxford, Washington D.C., Editors D. Male and C. Rickwood). Було показано, що зрілий білок має молекулярну масу приблизно 19 кДа і 5 цистеїнових залишків, які можуть утворювати міжмолекулярні та внутрішньомолекулярні дисульфідні містки. Результати досліджень зв'язування показали, що hG-CSF зв'язується з нейтрофільними гранулоцитами. Спостерігається незначне зв'язування або повна його відсутність з еритроїдами, еозинофілами лінії клітин лімфоїдного ряду, а також з макрофагами. [26] У людей ендогенний G-CSF виявляють у плазмі крові (Jones et al. Bailliere's Clinical Hematology 2:1 83-111 (1989)). hG-CSF продукується фібробластами, макрофагами, Тклітинами, трофобластами, ендотеліальними клітинами та епітеліальними клітинами і є продуктом експресії однокопійного гена, який включає в себе чотири екзони та п'ять інтронів, розміщених на сімнадцятій хромосомі. Транскрипція цього локусу продукує різновиди мРНК, які зазнають диференційованого процесингу, результатом чого є дві форми мРНК hG-CSF, де одна із цих версій кодує білок довжиною у 177 амінокислот, а друга кодує білок довжиною у 174 амінокислоти (Nagata et al. EMBO J 5: 575-581 (1986)), і було встановлено, що форма, яка складається з 174 амінокислот, має найбільшу специфічну біологічну активність in vivo. hG-CSF дає перехресну реакцію з іншими різновидами, так що, якщо людський G-CSF вводять іншому ссавцю, такому як миша, собака або мавпа, це спричинює тривалий нейтрофільний лейкоцитоз (Moore et al. PNAS-USA 84: 7134-7138 (1987)). 6 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 [27] G-CSF можна одержати і очистити з цілого ряду джерел. Природний людський G-CSF (nhG-CSF) можна виділити із супернатантів культивованих ліній клітин людських пухлин. Розробка методу рекомбінантних ДНК (дивись, наприклад, патент США № 4,810,643 (Souza), включений до цього опису шляхом посилання) надала можливість продукування G-CSF у промисловому масштабі у глікозилованій формі як продукт експресії еукаріотних клітин-хазяїв та G-CSF у неглікозилованій формі як продукт експресії прокаріотних клітин-хазяїв. [28] Було встановлено, що G-CSF є прийнятним для лікування симптомів, у разі виникнення яких сприятливу дію може справити підвищення кількості нейтрофілів. G-CSF може мобілізувати стовбурові клітини та клітини-попередники з кісткового мозку і застосовується для лікування хворих у стані вичерпання гранулоцитів в результаті хіміотерапії або як вступний етап у разі трансплантації кісткового мозку. Наприклад, для хворих на рак G-CSF є корисним як засіб селективного стимулювання продукування нейтрофілів з метою компенсування кровотворної недостатності, яка є результатом хіміотерапії або променевої терапії. До інших варіантів застосування належить лікування різних інфекційних захворювань та споріднених станів, таких як сепсис, який, як правило, спричинюється метаболітами бактерій. G-CSF є також корисним окремо або у комбінації з іншими сполуками, такими як інші цитокіни, для культивування або експансії клітин у культурі, наприклад, для культивування клітин трансплантата кісткового мозку. [29] Рецептор G-CSF (G-CSFR) є членом родини рецепторів кровотворного фактора/цитокінного фактора/фактора росту, яка включає в себе декілька інших рецепторів фактора росту, таких як рецептори інтерлейкіну (IL)-3,-4 та -6, рецептор гранулоцитарномакрофагального колонієстимулювального фактора (GM-CSF), рецептор еритропоетину (EPO), а також рецептори пролактину та гормону росту. Дивись, Bazan, Proc. Natl. Acad. Sci USA 87: 6934-6938 (1990). Члени родини цитокінних рецепторів містять чотири консервативні цистеїнові залишки та мотив "триптофан-серин-Х-триптофан-серин", розміщений безпосередньо за межами трансмембранної ділянки. Вважають, що консервативні послідовності приймають участь у білок-білкових взаємодіях. Дивись, наприклад, Chiba et al., Biochim. Biophys. Res. Comm. 184: 485-490 (1992). Рецептор G-CSF складається з одного пептидного ланцюга, який має молекулярну масу приблизно 150 кДа (Nicola, Immunol. Today 8 (1987), 134). [30] Глікозилований hG-CSF порівнювали з деглікозилованим hG-CSF, який одержали шляхом in vitro ферментативного розщеплення нейрамінідазою та ендо-α-Nацетилгалактозамінідазою, стосовно його стабільности у залежності від pH та температури (Oheda et al., 1990, J. Biol. Chem. 265 (20): 11432-11435). Деглікозилований hG-CSF, розчинений з концентрацією 1 мкг/мл у 20 мМ розчині фосфатного буфера, який містив 0,2 М розчин NaCl та 0,01 % розчин твін-20, швидко інактивувався у межах значення рН від приблизно рН 7 до приблизно рН 8 після дводенного інкубування при температурі 37C. На відміну від цього, глікозилований hG-CSF зберігав більше 80 % своєї активності за таких самих умов. Окрім того, результати визначення термічної стабільності обох форм hG-CSF, яку визначали за допомогою біологічного аналізу та калориметричного аналізу, показали, що деглікозилований hG-CSF був менш термостабільним, аніж нативна форма hG-CSF. [31] Із метою одержання стабільних, фармацевтично прийнятних композицій на основі GCSF, здійснили ряд спроб. Одна зі спроб поліпшення композиційної стабільності G-CSF включала синтез похідних згаданого білка. У патенті США № 5,665,863 описане одержання рекомбінантних химерних білків, що містять G-CSF, зв'язаний з альбуміном, які мають нові фармакокінетичні властивості. У патенті США № 5,824,784 та патенті США № 5,320,840 описане хімічне приєднання водорозчинних полімерів до білків для поліпшення стабільності та забезпечення захисту проти протеолітичної деградації, і конкретніше, описані молекули G-CSF, модифіковані на N-кінці, які несуть хімічно приєднані полімери, у тому числі поліетиленгліколь. [32] Структури ряду цитокінів, у тому числі G-CSF (Zink et al., FEBS Lett. 314:435 (1992); Zink et al., Biochemistry 33:8453 (1994); Hill et al., Proc. Natl. Acad. Sci.USA 90:5167 (1993)), GM-CSF (Diederichs K., et al. Science 154: 1779-1782 (1991); Walter et al., J. Mol. Biol. 224:1075-1085 (1992)), IL-2 (Bazan J.F. Science 257: 410-411 (1992); McKay D.B. Science 257: 412 (1992)), IL-4 (Redfield et al., Biochemistry 30: 11029-11035 (1991); Powers et al., Science 256:1673-1677 (1992)) та IL-5 (Milburn et al., Nature 363: 172-176 (1993)), були визначені рентгенографічними та ЯМРдослідженнями і продемонстрували вражаючу консервативність, порівняно із структурою GH, незважаючи на відсутність суттєвої гомології первинної структури. [33] Альтернативний підхід до підвищення стабільності G-CSF у композиції передбачає зміну амінокислотної послідовності білка. У патенті США № 5,416,195 описані сконструйовані методами генної інженерії аналоги G-CSF, які мають поліпшену композиційну стабільність, де цистеїновий залишок, який за нормальних обставин знаходиться у положенні 17 ланцюга 7 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 зрілого поліпептиду, залишок аспарагінової кислоти, який знаходиться у положенні 27, та щонайменше один із тандемних пролінових залишків, які знаходяться у положеннях 65 та 66, замінені на сериновий залишок. У патенті США № 5,773,581 описані сконструйовані методами генної інженерії аналоги G-CSF, які були кон'юговані з водорозчинним полімером. [34] Різні форми людського G-CSF, а також методи їх одержання та очищення, прийнятні для способу лікування або запобігання маститу, докладно описані у патенті США № 4,810,643, включеному до цього опису шляхом посилання. У патенті США № 4,810,643 описані і заявлені нові сегменти генів, біологічно функціональні рекомбінантні плазміди та віруси на основі вірусної ДНК і прокаріотні та еукаріотні клітини-хазяї, які містять ген G-CSF або сконструйований методами генної інженерії варіант гена G-CSF. Клітини-хазяї експресують біологічно активний G-CSF або сконструйований методами генної інженерії варіант G-CSF. У патенті США № 5,849,883 та WO 89/10932 описані різні дослідження, проведені з людським G-CSF на великій рогатій худобі. Згадані дослідження були проведені з метою вивчення захворювань органів дихання (Pasteurella hemolytica), реакцій на бактеріальні контрольні зараження (Klebsiella pneumonia) або коліформний мастит (E. coli) у великої рогатої худоби. [35] У патенті США № 5,849,883, який у повному обсязі включений до цього опису шляхом посилання, представлені полінуклеотидна та поліпептидна послідовності зрілого бичачого GCSF (bG-CSF) та описані способи клонування, ізолювання та очищення згаданого поліпептиду та його аналогів. Зрілий b-GCSF має у довжину 174 амінокислоти (послідовність SEQ ID NO: 1) і 82 % гомологію з hG-CSF. Поліпептид bG-CSF з вихідним залишком амінокислоти метіоніну представлений як послідовність SEQ ID NO: 2. Полінуклеотидна послідовність, яка кодує послідовність SEQ ID NO: 1, представлена як послідовність SEQ ID NO: 3. Полінуклеотидна послідовність, яка кодує послідовність SEQ ID NO: 2, представлена як послідовність SEQ ID NO: 4. Heidari et al. описали експресію, очищення та біологічну активність bG-CSF у Veterinary Immunology and Immunopathology (2001) 81:45-57. [36] Ковалентне приєднання гідрофільного полімеру полі(етиленгліколю), скорочено PEG, являє собою спосіб підвищення водорозчинності, біологічної доступності, підвищення періоду напіввиведення з плазми, підвищення періоду напіввиведення терапевтично ефективної кількості, модулювання імуногенності, модулювання біологічної активності або подовження періоду циркуляції багатьох біологічно активних молекул, у тому числі білків, пептидів і, зокрема, гідрофобних молекул. PEG широко застосовують у фармацевтичних препаратах, штучних імплантатах та в інших варіантах застосування, де важливу роль відіграє біологічна сумісність, відсутність токсичності та відсутність імуногенності. З метою доведення необхідних властивостей PEG до максимального рівня, загальна молекулярна маса та гідратаційний стан полімеру PEG або полімерів, приєднаних до біологічно активної молекули, повинні бути достатньо високими для наділення корисними характеристиками, які, як правило, пов'язуються з приєднанням полімеру PEG, такими як підвищена водорозчинність та підвищений період напіввиведення з плазми, без справляння одночасного негативного впливу на біологічну активність вихідної молекули. [37] Похідні PEG часто зв'язуються з біологічно активними молекулами через реакційноздатні хімічні функціональні групи, такі як залишки лізину, цистеїну та гістидину, Nкінець та вуглеводні складові. Білки та інші молекули часто мають обмежену кількість реакційноздатних ділянок, доступних для приєднання полімеру. Часто ділянки, найбільш придатні для модифікування шляхом приєднання полімеру, відіграють суттєву роль у зв'язуванні рецептора і є необхідними для збереження біологічної активності молекули. Як результат, невпорядковане приєднання полімерних ланцюгів до таких раакційноздатних ділянок на біологічно активній молекулі часто призводить до значного зниження або навіть повної втрати біологічної активності модифікованої полімером молекули. R. Clark et al., (1996), J. Biol. Chem., 271:21969-21977. Для одержання кон'югатів із достатньою молекулярною масою полімеру для надання необхідних переваг молекулі-мішені, відомі варіанти підходів включали, як правило, довільне приєднання численних відгалужень полімеру до молекули, з підвищенням, тим самим, ризику зменшення або навіть повної втрати біологічної активності вихідної молекули. [38] Реакційноздатні ділянки, які утворюють локуси для приєднання похідних PEG до білків, визначаються структурою білка. Білки, у тому числі ферменти, складаються з різних послідовностей альфа-амінокислот, які мають загальну структуру H2N-CHR-COOH. Альфааміноскладова (H2N-) однієї амінокислоти приєднується до карбоксильної складової (-COOH) прилеглої амінокислоти з утворенням амідних зв'язків, які можуть бути представлені як -(NHCHR-CO)n-, де нижній індекс "n" може дорівнювати сотням або тисячам. Фрагмент, 8 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 представлений R, може містити реакційноздатні ділянки для біологічної активності білка і для приєднання похідних PEG. [39] Наприклад, для амінокислоти лізину, у епсилон-положенні, а також у альфа-положенні існує -NH2 складова. Епсилон -NH2 є вільною для реагування за умов основного pH. Більшість зусиль у галузі дериватизації білків PEG була спрямована на розробку похідних PEG для приєднання до епсилон -NH2 складової залишку лізину, присутнього у білках. "Polyethylene Glycol and Derivatives for Advanced PEGylation", Nektar Molecular Engineering Catalog, 2003, стор. 1-17. Усі ці похідні PEG, однак, мають спільне обмеження, яке полягає у тому, що вони не можуть селективно розміщуватись серед часто численних залишків лізину, присутніх на поверхні білків. Це може бути суттєвим обмеженням у випадках, коли залишок лізину є важливим для активності білка і знаходиться, наприклад, на ферментативно-активній ділянці, або у випадках, коли залишок лізину відіграє роль у опосередковуванні взаємодії білка з іншими біологічними молекулами, наприклад, у випадку рецептор-зв'язувальних ділянок. [40] Друге і однаково важливе ускладнення існуючих способів пегілування білків полягає у тому, що похідні PEG можуть вступити до небажаних побічних реакцій з іншими залишками, окрім необхідних. Гістидин містить реакційноздатну іміноскладову, структурно представлену як N(H)-, однак багато хімічно реакційноздатних різновидів, які реагують з епсилон -NH2, можуть також реагувати з -N(H)-. Аналогічно, бічний ланцюг амінокислоти цистеїну несе вільну сульфгідрильну групу, структурно представлену як -SH. У деяких випадках похідні PEG, спрямовані на епсилон -NH2 групу лізину, можуть також реагувати з цистеїновим, гістидиновим або іншими залишками. Це може призвести до утворення складних гетерогенних сумішей PEGдериватизованих біологічно активних молекул і до ризику знищення активності біологічної молекули, яка виступає у ролі мішені. Бажано було б розробити похідні PEG, які дозволяли б введення хімічно функціональної групи на одній ділянці у межах білка, що у подальшому могло б забезпечити можливість селективного з'єднання одного або декількох полімерів PEG з біологічно активною молекулою на конкретних ділянках на поверхні білка, які є добре визначеними та прогнозованими. [41] На додаток до залишків лізину, значні зусилля у цій галузі були спрямовані на розробку активованих реактивів PEG, за мішені для яких правлять інші бічні ланцюги амінокислот, у тому числі цистеїну, гістидину та N-кінця. Дивись, наприклад, патент США № 6,610,281, включений до цього опису шляхом посилання, та "Polyethylene Glycol and Derivatives for Advanced PEGylation", Nektar Molecular Engineering Catalog, 2003, стор. 1-17. Цистеїновий залишок можна ввести до визначеного сайту у структурі білків шляхом сайт-спрямованого мутагенезу та інших способів, відомих у цій галузі, і вільна сульфгідрильна складова, яка буде одержана, може реагувати з похідними PEG, які несуть тіол-реакційні функціональні групи. Цей підхід, однак, є складним у тому відношенні, що введення вільної сульфгідрильної групи може ускладнити експресію, укладання та стабільність білка, який буде одержано. Таким чином, бажано було б мати засіб введення хімічної функціональної групи до біологічно активних молекул, який забезпечував би селективне сполучення одного або декількох полімерів PEG із білком, з одночасною сумісністю (тобто невступленням до небажаних побічних реакцій з) із сульфгідрилами та іншими хімічно функціональними групами, які, як правило, входять до складу білків. [42] Як видно із зразків у цій галузі, багато з цих похідних, які були розроблені для приєднання до бічних ланцюгів білків, зокрема -NH2 складової бічного ланцюга амінокислоти лізину та -SH складової бічного ланцюга цистеїну, виявились проблематичними щодо синтезу та застосування. Деякі утворюють нестабільні зв'язки з білком, який піддається гідролізу, і, унаслідок цього, розкладаються, деградують або є по-іншому нестабільними у рідких середовищах, таких як кров'яне русло. Деякі утворюють більш стабільні зв'язки, однак піддаються гідролізу до утворення зв'язку, що означає, що реактивна група на похідній PEG може бути інактивована до приєднання білка. Деякі мають певну токсичність і, унаслідок цього, є менш прийнятними для застосування in vivo. Деякі реагують занадто повільно, щоб бути практично прийнятними. Деякі спричинюють втрату активності білка в результаті приєднання до ділянок, які несуть відповідальність за активність білка. Деякі не є специфічними на ділянках, до яких вони приєднуються, результатом чого також може бути втрата бажаної активності та неможливість відтворення результатів. З метою подолання проблем, пов'язаних із модифікуванням білків полі(етиленгліколевими) складовими, були розроблені похідні PEG, які є більш стабільними (наприклад, патент США № 6,602,498, включений до цього опису шляхом посилання) або які селективно реагують із тіоловими складовими на молекулах та поверхнях (наприклад, патент США № 6,610,281, включений до цього опису шляхом посилання). Безсумнівно, у цій галузі існує потреба у похідних PEG, які є хімічно нейтральними у 9 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 фізіологічному середовищі до виникнення необхідності селективного реагування для утворення стабільних хімічних зв'язків. [43] Застосування кон'югатів гідроксіалкілкрохмалю і, зокрема, застосування гідроксіетилкрохмалю (HES), ковалентно зв'язаного з поліпептидом, було описано з метою потенційної зміни імуногенності та/або алергенності поліпептиду. Сполучення нативної молекули з HES є альтернативною методикою, описаною у ряді заявок на патент, права на які були передані компанії Fresenius Kabi AB, у тому числі у патентних публікаціях США № 2005/0063943, № 2006/0121073, № 2001/0100163, № 2005/0234230, № 2005/0238723, № 2006/0019877, № 2007/0134197, № 2007/0087961, а також у патенті США № 7,285,661, усі з яких включені до цього опису шляхом посилання. HES являє собою модифікований природний полімер, який застосовують клінічно як плазмозамінник, а процес приєднання гідроксіетилкрохмалю являє собою методику сполучення лікарських речовин із похідними HES для модифікування характеристик лікарської речовини, таких як фармакокінетика або водорозчинність. Сюди належить також збільшення періоду циркуляції білка у плазмі завдяки підвищеній стабільності молекули та зниженню ниркового кліренсу, результатом чого є підвищена біологічна активність. Окрім того, може бути зменшена імуногенність або алергенність. Шляхом змінювання різних параметрів, таких як молекулярна маса HES, можна одержувати різноманітні необхідні кон'югати HES. Однак гідроксіетилкрохмаль має спільний недолік з усіма іншими доступними на цей час полімерами: його полідисперсність. Полімерні кон'югати являють собою суміш молекул, молекулярна маса яких розподіляється довкола середнього значення. Результатом браку гомогенності є низький рівень визначення хімічних та біохімічних характеристик, що може запобігти досягненню фарамацевтично активним компонентом ділянки його дії (рецептор, фермент тощо). У цих випадках лікарська речовина, яка повинна бути активною, потребує доставки у вихідній некон'югованій формі, тобто розщеплення полімеру метаболічними реакціями є необхідним для її фармацевтичної ефективності. [44] Нещодавно з'явилось повідомлення про абсолютно нову технологію у галузі наук про білок, яка обіцяє подолання більшості обмежень, пов'язаних із сайт-специфічними модифікаціями білків. Конкретно, до білкового біосинтетичного механізму клітин прокаріотів Escherichia coli (E. coli) (описаного, наприклад, у L. Wang, et al., (2001), Science 292:498-500) та клітин еукаріотів Sacchromyces cerevisiae (S. cerevisiae) (описаного, наприклад, у J. Chin et al., Science 301:964-967 (2003)) були додані нові компоненти, які надали можливість введення негенетично закодованих амінокислот до білків in vivo. За допомогою цієї методики ряд нових амінокислот з новими хімічними, фізичними або біологічними властивостями, у тому числі фотоафінні мітки та амінокислоти, які зазнають фотоізомеризації, фотозшивні амінокислоти (дивись, наприклад, Chin J.W., et al. (2002) Proc. Natl. Acad. Sci. U.S.A. 99:11020-11024; та Chin J.W., et al., (2002) J. Am. Chem. Soc. 124:9026-9027), кето-амінокислоти, амінокислоти, що містять важкі атоми, та глікозиловані амінокислоти, були ефективно та з високою надійністю введені до білків E. coli та дріжджів у відповідь на амбер-кодон, TAG. Дивись, наприклад, J.W. Chin et al., (2002), Journal of the American Chemical Society 124:9026-9027; J.W. Chin & P.G. Schultz, (2002), ChemBioChem 3(11):1135-1137; J.W. Chin, et al., (2002), PNAS United States of America 99:11020-11024; та L. Wang & P.G. Schultz, (2002), Chem. Comm., 1:1-11. Усі вищенаведені посилання у повному обсязі включені до цього опису шляхом посилання. Ці дослідження продемонстрували можливість селективного та нескладного введення хімічних функціональних груп, таких як кетогрупи, алкінові групи та азидні складові, яких немає у білках, які є хімічно нейтральними до усіх функціональних груп, що знаходяться у 20 звичайних генетично закодованих амінокислотах, і які можуть застосовуватись для ефективного та селективного реагування з утворенням стабільних ковалентних зв'язків. [45] Можливість введення до білків негенетично закодованих амінокислот надає можливість введення хімічних функціональних груп, які могли б являти собою цінні альтернативні варіанти природним функціональним групам, таким як епсилон -NH2 лізину, сульфгідрильна група -SH цистеїну, іміногрупа гістидину тощо. Відомо, що певні хімічні функціональні групи є нейтральними до функціональних груп, які знаходяться у 20 звичайних генетично закодованих амінокислотах, але чітко та ефективно реагують з утворенням стабільних зв'язків. У цій галузі відомо, наприклад, що азидні та ацетиленові групи вступають до реакції [3+2]-циклоприєднання Хьюсгена у водних умовах у присутності каталітичної кількості міді. Дивись, наприклад, Tornoe, et al., (2002) J. Org. Chem. 67:3057-3064; та Rostovtsev, et al., (2002) Angew. Chem. Int. Ed. 41:2596-2599. Шляхом введення азидної складової до структури білка, наприклад, можна ввести функціональну групу, яка є хімічно нейтральною до амінів, сульфгідрилів, карбонових кислот, гідроксильних груп, які знаходяться у білках, але яка також чітко та ефективно реагує з 10 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 ацетиленовою складовою з утворенням продукту циклоприєднання. Важливим є те, що за відсутності ацетиленової складової, азид залишається хімічно нейтральним та інертним у присутності інших бічних ланцюгів білків та за фізіологічних умов. [46] Цей винахід спрямований, разом з іншим, на проблеми, пов'язані з активністю та продукуванням поліпептидів bG-CSF, а також спрямований на продукування поліпептиду bGCSF з поліпшеними біологічними або фармакологічними властивостями та/або подовженим періодом напіввиведення його терапевтично ефективної кількості. Суть винаходу [47] Цей винахід пропонує поліпептиди bG-CSF, які містять одну або декілька штучно закодованих амінокислот. [48] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить одну або декілька посттрансляційних модифікацій. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF приєднаний до сполучного агента, полімеру або біологічно активної молекули. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF приєднаний до біфункціонального полімеру, біфункціонального сполучного агента або щонайменше одного додаткового поліпептиду bG-CSF. [49] В деяких варіантах здійснення цього винаходу штучно закодована амінокислота приєднана до водорозчинного полімеру. В деяких варіантах здійснення цього винаходу згаданий водорозчинний полімер містить полі(етиленгліколеву) складову. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота сполучена з водорозчинним полімером за допомогою сполучного агента або приєднана до водорозчинного полімеру. В деяких варіантах здійснення цього винаходу молекула полі(етиленгліколю) є біфункціональним полімером. В деяких варіантах здійснення цього винаходу біфункціональний полімер є сполученим з другим поліпептидом. В деяких варіантах здійснення цього винаходу згаданим другим поліпептидом є поліпептид bG-CSF. [50] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить щонайменше дві амінокислоти, сполучені з водорозчинним полімером, який містить полі(етиленгліколеву) складову. В деяких варіантах здійснення цього винаходу щонайменше одна амінокислота є штучно закодованою амінокислотою. [51] В деяких варіантах здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до одного або декількох із наведених нижче положень bG-CSF: перед положенням 1 (тобто на N-кінці), 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175 (тобто на карбоксильному кінці білка), та до будь-якої їхньої комбінації (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2 чи відповідні амінокислоти іншого поліпептиду bGCSF). [52] В деяких варіантах здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до одного або декількох із наведених нижче положень bG-CSF: 3, 7, 11, 33, 43, 58, 62, 67, 69, 98, 99, 123, 124, 125, 133, 134, 136, 141, 159, 166, 169, 170, 173, та будь-якої їх комбінації послідовності SEQ ID NO: 1 або відповідних амінокислот послідовності SEQ ID NO: 2. В деяких варіантах здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до одного або декількох із наведених нижче положень bG-CSF: 3, 7, 33, 43, 58, 62, 67, 69, 99, 123, 124, 133, 134, 141, 166, та будь-якої їх комбінації (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до одного або декількох із наведених нижче положень bG-CSF: 3, 7, 62, 133, 166, та будь-якої їх комбінації послідовності SEQ ID NO: 1 або відповідних амінокислот послідовності SEQ ID NO: 2. В деяких варіантах здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до одного або декількох із наведених нижче положень bG-CSF: 62, 133, та їх комбінації (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до положення 62 bG-CSF (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу одну або декілька штучно закодованих амінокислот вводять до положення 133 bG 11 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 CSF (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу поліпептид за цим винаходом містить заміну, додання або делецію однієї або декількох природних амінокислот. В деяких варіантах здійснення цього винаходу одну або декілька штучних амінокислот вводять до лідерної або сигнальної послідовності N- або C-кінця послідовності SEQ ID NO: 1, 2 або іншої послідовності bG-CSF. [53] В деяких варіантах здійснення цього винаходу штучна амінокислота у одному або декількох із цих положень сполучена з водорозчинним полімером, у тому числі, але без обмеження, у положеннях: перед положенням 1 (тобто на N-кінці), 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175 (тобто на карбоксильному кінці білка), та у будь-якій їхній комбінації (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2 чи відповідні амінокислоти іншого поліпептиду bG-CSF). [54] В деяких варіантах здійснення цього винаходу штучна амінокислота у одному або декількох із цих положень сполучена з водорозчинним полімером, у тому числі, але без обмеження, у положеннях: 3, 7, 11, 33, 43, 58, 62, 67, 69, 98, 99, 123, 124, 125, 133, 134, 136, 141, 159, 166, 169, 170, 173, та будь-якій їх комбінації (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу штучна амінокислота у одному або декількох із цих положень сполучена з водорозчинним полімером, у тому числі, але без обмеження, у положеннях: 3, 7, 33, 43, 58, 62, 67, 69, 99, 123, 124, 133, 134, 141, 166, та будь-якій їх комбінації (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу штучна амінокислота у одному або декількох із цих положень сполучена з водорозчинним полімером, у тому числі, але без обмеження, у положеннях: 3, 7, 62, 133, 166, та будь-якій їх комбінації (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу штучна амінокислота у одному або декількох із цих положень сполучена з водорозчинним полімером, у тому числі, але без обмеження, у положеннях: 62, 133, та їх комбінації (послідовність SEQ ID NO: 1 або відповідні амінокислоти послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу штучно закодована амінокислота у положенні 62 сполучена з водорозчинним полімером (послідовність SEQ ID NO: 1 або відповідна амінокислота послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу штучно закодована амінокислота у положенні 133 сполучена з водорозчинним полімером (послідовність SEQ ID NO: 1 або відповідна амінокислота послідовності SEQ ID NO: 2). В деяких варіантах здійснення цього винаходу штучна амінокислота у лідерній або сигнальній послідовності N- або C-кінця послідовності SEQ ID NO: 1, 2 або іншої послідовності bG-CSF є сполученою з водорозчинним полімером. [55] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які модулюють спорідненість поліпептиду bG-CSF до рецептора або партнера зв'язування, у тому числі, але без обмеження, білка, поліпептиду, невеликої молекули або нуклеїнової кислоти. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які підвищують стабільність поліпептиду bG-CSF при порівнянні зі стабільністю відповідного bG-CSF без заміни, додання або делеції. Стабільність та/або розчинність можна визначати із застосуванням цілого ряду різних аналізів, відомих фахівцям у цій галузі. До таких аналізів належать (але без обмеження ними) гельхроматографія за розміром молекул (SE-HPLC) та високоефективна рідинна хроматографія з оберненою фазою (RP-HPLC). В деяких варіантах здійснення цього винаходу поліпептид bGCSF містить заміну, додання або делецію, які модулюють імуногенність поліпептиду bG-CSF при порівнянні з імуногенністю відповідного bG-CSF без заміни, додання або делеції. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які модулюють період напіввиведення поліпептиду bG-CSF з плазми або час знаходження поліпептиду bG-CSF у кровообізі при порівнянні з періодом напіввиведення з плазми або часом знаходження у кровообізі відповідного bG-CSF без заміни, додання або делеції. [56] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які підвищують розчинність поліпептиду bG-CSF у воді при порівнянні із 12 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 розчинністю у воді відповідного bG-CSF без заміни, додання або делеції. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які підвищують розчинність поліпептиду bG-CSF, продукованого клітиною-хазяїном при порівнянні із розчинністю відповідного bG-CSF без заміни, додання або делеції. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які підвищують експресію поліпептиду bG-CSF у клітині-хазяїні або підвищують синтез in vitro при порівнянні з експресією або синтезом відповідного bG-CSF без заміни, додання або делеції. Поліпептид bG-CSF, який містить цю заміну, зберігає агоністичну активність і зберігає або поліпшує рівні експресії у клітині-хазяїні. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які підвищують стійкість поліпептиду bG-CSF до протеаз при порівнянні із стійкістю до протеаз відповідного bG-CSF без заміни, додання або делеції. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які модулюють активність трансдукції сигналу рецептора при порівнянні з активністю рецептора при взаємодії з відповідним поліпептидом bG-CSF без заміни, додання або делеції. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які модулюють його зв'язування з іншою молекулою, такою як рецептор, при порівнянні зі зв'язуванням відповідного поліпептиду bG-CSF без заміни, додання або делеції. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які модулюють гемопоез при порівнянні з гемопоезом у присутності відповідного поліпептиду bG-CSF без заміни, додання або делеції. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які модулюють проліферацію нейтрофілів при порівнянні з проліферацією нейтрофілів у присутності відповідного поліпептиду bG-CSF без заміни, додання або делеції. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які модулюють визрівання нейтрофілів при порівнянні з визріванням нейтрофілів у присутності відповідного поліпептиду bG-CSF без заміни, додання або делеції. [57] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить заміну, додання або делецію, які підвищують сумісність поліпептиду bG-CSF із фармацевтичними консервантами (наприклад, м-крезолом, фенолом, бензиловим спиртом) при порівнянні із сумісністю відповідного bG-CSF без заміни, додання або делеції. Ця підвищена сумісність надає можливість одержання консервованої фармацевтичної лікарської форми, яка зберігає фізикохімічні властивості та біологічну активність білка під час зберігання. [58] В деяких варіантах здійснення цього винаходу з однією або декількома штучними амінокислотами утворюють один або декілька сконструйованих зв'язків. Внутрішньомолекулярний зв'язок може бути утворений багатьма способами, у тому числі, але без обмеження, шляхом реакції між двома амінокислотами у межах білка за відповідних умов (одна або обидві амінокислоти можуть бути штучною(-ими) амінокислотою(-ами)); шляхом реакції двох амінокислот, кожна з яких може бути природно закодованою або штучно закодованою, зі сполучною групою, полімером або іншою молекулою за відповідних умов тощо. [59] В деяких варіантах здійснення цього винаходу одна або декілька амінокислотних замін у поліпептиді bG-CSF можуть відбуватись з однією або декількома природними або штучними амінокислотами. В деяких варіантах здійснення цього винаходу амінокислотні заміни у поліпептиді bG-CSF можуть відбуватись з природними або штучними амінокислотами, за умови, що щонайменше одна заміна відбувається зі штучно закодованою амінокислотою. В деяких варіантах здійснення цього винаходу одна або декілька амінокислотних замін у поліпептиді bGCSF можуть відбуватись з однією або декількома природними амінокислотами і, крім того, щонайменше одна заміна відбувається зі штучно закодованою амінокислотою. [60] В деяких варіантах здійснення цього винаходу штучно закодована амінокислота містить карбонільну групу, ацетильну групу, амінооксигрупу, гідразинову групу, гідразидну групу, семікарбазидну групу, азидну групу або алкінову групу. [61] В деяких варіантах здійснення цього винаходу штучно закодована амінокислота містить карбонільну групу. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота має структуру: (CH2)nR1COR2 55 R3HN COR4 , де n – 0-10; R1 – алкіл, арил, заміщений алкіл або заміщений арил; R 2 – H, алкіл, арил, заміщений алкіл або заміщений арил; R3 – H, амінокислота, поліпептид або амінокінцева групамодифікатор; і R4 – H, амінокислота, поліпептид або карбоксикінцева група-модифікатор. 13 UA 103774 C2 5 [62] В деяких варіантах здійснення цього винаходу штучно закодована амінокислота містить амінооксигрупу. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота містить гідразидну групу. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота містить гідразинову групу. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота містить семікарбазидну групу. [63] В деяких варіантах здійснення цього винаходу залишок штучно закодованої амінокислоти містить азидну групу. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота має структуру: (CH2)nR1X(CH2)mN3 10 15 R2HN COR3 , де n – 0-10; R1 – алкіл, арил, заміщений алкіл, заміщений арил або відсутній; X – O, N, S або відсутній; m – 0-10; R2 – H, амінокислота, поліпептид або амінокінцева група-модифікатор, і R3 – H, амінокислота, поліпептид або карбоксикінцева група-модифікатор. [64] В деяких варіантах здійснення цього винаходу штучно закодована амінокислота містить алкінову групу. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота має структуру: (CH2)nR1X(CH2)mCCH R2HN 20 25 30 35 40 45 50 55 COR3 , де n – 0-10; R1 – алкіл, арил, заміщений алкіл або заміщений арил; X – O, N, S або відсутній; m – 0-10, R2 – H, амінокислота, поліпептид або амінокінцева група-модифікатор, і R3 – H, амінокислота, поліпептид або карбоксикінцева група-модифікатор. [65] В деяких варіантах здійснення цього винаходу згаданий поліпептид є агоністом, частковим агоністом, антагоністом, частковим антагоністом або зворотним агоністом поліпептиду bG-CSF. В деяких варіантах здійснення цього винаходу агоніст, частковий агоніст, антагоніст, частковий антагоніст або зворотний агоніст поліпептиду bG-CSF містить штучно закодовану амінокислоту, сполучену з водорозчинним полімером. В деяких варіантах здійснення цього винаходу водорозчинний полімер містить полі(етиленгліколеву) складову. В деяких варіантах здійснення цього винаходу агоніст, частковий агоніст, антагоніст, частковий антагоніст або зворотний агоніст поліпептиду bG-CSF містить штучно закодовану амінокислоту та одну або декілька посттрансляційних модифікацій, сполучних агентів, полімерів або біологічно активних молекул. [66] Цей винахід пропонує також ізольовані нуклеїнові кислоти, які містять полінуклеотид, який гібридизується за суворих умов із послідовностями SEQ ID NO: 3, 4, або нуклеїнові кислоти, які кодують поліпептиди послідовностей SEQ ID NO: 1, 2. Цей винахід пропонує також ізольовані нуклеїнові кислоти, які містять полінуклеотид, який гібридизується за суворих умов з послідовностями SEQ ID NO: 3, 4, або полінуклеотиди, які гібридизуються за суворих умов з полінуклеотидами, які кодують поліпептиди, представлені послідовностями SEQ ID NO: 1, 2, де згаданий полінуклеотид містить щонайменше один селекторний кодон. Цей винахід пропонує також ізольовані нуклеїнові кислоти, які містять полінуклеотид, який кодує поліпептиди, представлені послідовностями SEQ ID NO: 1, 2. Цей винахід пропонує також ізольовані нуклеїнові кислоти, які містять полінуклеотид, який кодує поліпептиди, представлені послідовностями SEQ ID NO: 1, 2 з однією або декількома штучно закодованими амінокислотами. Фахівцю у цій галузі легко зрозуміло, що ряд різних полінуклеотидів може закодувати будь-який поліпептид за цим винаходом. [67] В деяких варіантах здійснення цього винаходу селекторний кодон вибраний з групи, яку складають амбер-кодон, охра-кодон, опал-кодон, унікальний кодон, рідкісний кодон, п'ятиосновний кодон та чотириосновний кодон. [68] Цей винахід також пропонує способи одержання поліпептиду bG-CSF, сполученого з водорозчинним полімером. В деяких варіантах здійснення цього винаходу спосіб включає введення в контакт ізольованого поліпептиду bG-CSF, який містить штучно закодовану амінокислоту, з водорозчинним полімером, який містить складову, яка контактує із штучно закодованою амінокислотою. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота, яка включена до складу поліпептиду bG-CSF, може реагувати з водорозчинним полімером, який, за інших обставин, не реагує з жодною з 20 звичайних амінокислот. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота, яка включена до складу поліпептиду bG-CSF, може реагувати зі сполучним агентом, полімером або біологічно активною молекулою, які, за інших обставин, не реагують із жодною з 20 звичайних амінокислот. 14 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 [69] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF, сполучений з водорозчинним полімером, одержують шляхом введення в реакцію поліпептиду bG-CSF, який містить карбонілвмісну амінокислоту, з молекулою полі(етиленгліколю), яка містить амінооксигрупу, гідразинову групу, гідразидну групу або семікарбазидну групу. В деяких варіантах здійснення цього винаходу амінооксигрупа, гідразинова група, гідразидна група або семікарбазидна група сполучена з молекулою полі(етиленгліколю) через амідний зв'язок. В деяких варіантах здійснення цього винаходу амінооксигрупа, гідразинова група, гідразидна група або семікарбазидна група сполучена з молекулою полі(етиленгліколю) через карбаматний зв'язок. [70] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF, сполучений з водорозчинним полімером, одержують шляхом введення в реакцію молекули полі(етиленгліколю), яка містить карбонільну групу, з поліпептидом, який містить штучно закодовану амінокислоту, яка містить амінооксигрупу, гідразинову групу, гідразидну групу або семікарбазидну групу. [71] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF, сполучений з водорозчинним полімером, одержують шляхом введення в реакцію поліпептиду bG-CSF, який містить алкінвмісну амінокислоту, з молекулою полі(етиленгліколю), яка містить азидну складову. В деяких варіантах здійснення цього винаходу азидна група або алкінова група сполучена з молекулою полі(етиленгліколю) через амідний зв'язок. [72] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF, сполучений з водорозчинним полімером, одержують шляхом введення в реакцію поліпептиду bG-CSF, який містить азидвмісну амінокислоту, з молекулою полі(етиленгліколю), яка містить алкінову складову. В деяких варіантах здійснення цього винаходу азидна група або алкінова група сполучена з молекулою полі(етиленгліколю) через амідний зв'язок. [73] В деяких варіантах здійснення цього винаходу молекула полі(етиленгліколю) має молекулярну масу у межах від приблизно 0,1 кДа до приблизно 100 кДа. В деяких варіантах здійснення цього винаходу молекула полі(етиленгліколю) має молекулярну масу у межах від приблизно 0,1 кДа до приблизно 50 кДа. [74] В деяких варіантах здійснення цього винаходу молекула полі(етиленгліколю) є розгалуженим полімером. В деяких варіантах здійснення цього винаходу кожне розгалуження розгалуженого полімеру полі(етиленгліколю) має молекулярну масу у межах від приблизно 1 кДа до приблизно 100 кДа або від приблизно 1 кДа до приблизно 50 кДа. [75] В деяких варіантах здійснення цього винаходу водорозчинний полімер, сполучений з поліпептидом bG-CSF, містить поліалкіленгліколеву складову. В деяких варіантах здійснення цього винаходу залишок штучно закодованої амінокислоти, введений до складу поліпептиду bGCSF, містить карбонільну групу, амінооксигрупу, гідразидну групу, гідразинову групу, семікарбазидну групу, азидну групу або алкінову групу. В деяких варіантах здійснення цього винаходу залишок штучно закодованої амінокислоти, введений до складу поліпептиду bG-CSF, містить карбонільну складову, а водорозчинний полімер містить амінооксигрупу, гідразидну групу, гідразинову групу або семікарбазидну складову. В деяких варіантах здійснення цього винаходу залишок штучно закодованої амінокислоти, введений до складу поліпептиду bG-CSF, містить алкінову складову, а водорозчинний полімер містить азидну складову. В деяких варіантах здійснення цього винаходу залишок штучно закодованої амінокислоти, введений до складу поліпептиду bG-CSF, містить азидну складову, а водорозчинний полімер містить алкінову складову. [76] Цей винахід також пропонує композиції, що містять фармацевтично прийнятний носій і поліпептид bG-CSF, який містить штучно закодовану амінокислоту. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота сполучена з водорозчинним полімером. [77] Цей винахід пропонує також клітини, які містять полінуклеотид, який кодує поліпептид bG-CSF, що містить селекторний кодон. В деяких варіантах здійснення цього винаходу згадані клітини містять ортогональну РНК-синтетазу та/або ортогональну тРНК для введення штучно закодованої амінокислоти до поліпептиду bG-CSF. [78] Цей винахід також пропонує способи одержання поліпептиду bG-CSF, який містить штучно закодовану амінокислоту. В деяких варіантах здійснення цього винаходу згадані способи включають культивування клітин, які містять полінуклеотид або полінуклеотиди, які кодують поліпептид bG-CSF, ортогональну РНК-синтетазу та/або ортогональну тРНК, за умов, які дозволяють експресію поліпептиду bG-CSF; і очищення поліпептиду bG-CSF з клітин та/або культурального середовища. 15 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 [79] Цей винахід також пропонує способи підвищення періоду напіввиведення терапевтично ефективної кількості поліпептидів bG-CSF, періоду напіввиведення bG-CSF з плазми або часу знаходження поліпептидів bG-CSF у кровообізі. Цей винахід також пропонує способи модулювання імуногенності поліпептидів bG-CSF. В деяких варіантах здійснення цього винаходу згадані способи включають заміну будь-якої однієї або декількох амінокислот природних поліпептидів bG-CSF на штучно закодовану амінокислоту та/або сполучення поліпептиду bG-CSF зі сполучним агентом, полімером, водорозчинним полімером або біологічно активною молекулою. [80] Цей винахід також пропонує способи лікування пацієнта, який потребує такого лікування, ефективною кількістю молекули bG-CSF за цим винаходом. В деяких варіантах здійснення цього винаходу згадані способи включають введення в організм пацієнта терапевтично ефективної кількості фармацевтичної композиції, яка містить поліпептид bG-CSF, який містить штучно закодовану амінокислоту, та фармацевтично прийнятний носій. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота сполучена з водорозчинним полімером. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF є глікозилованим. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF не є глікозилованим. [81] Цей винахід також пропонує поліпептиди bG-CSF, які містять послідовність, представлену послідовностями SEQ ID NO: 1, 2 або будь-якою іншою послідовністю поліпептиду bG-CSF, за виключенням того, що щонайменше одна амінокислота замінена штучно закодованою амінокислотою. Цей винахід також пропонує поліпептиди bG-CSF, які містять послідовність, представлену послідовностями SEQ ID NO: 1, 2. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота сполучена з водорозчинним полімером. В деяких варіантах здійснення цього винаходу водорозчинний полімер містить полі(етиленгліколеву) складову. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота містить карбонільну групу, амінооксигрупу, гідразидну групу, гідразинову групу, семікарбазидну групу, азидну групу або алкінову групу. [82] Цей винахід також пропонує фармацевтичні композиції, які містять фармацевтично прийнятний носій та поліпептид bG-CSF, який містить послідовність, представлену послідовностями SEQ ID NO: 1, 2 або будь-якою іншою послідовністю поліпептиду bG-CSF, де щонайменше одна амінокислота замінена штучно закодованою амінокислотою. Цей винахід також пропонує фармацевтичні композиції, які містять фармацевтично прийнятний носій та поліпептид bG-CSF, який містить послідовність, представлену послідовностями SEQ ID NO: 1, 2. В деяких варіантах здійснення цього винаходу штучно закодована амінокислота містить сахаридну складову. В деяких варіантах здійснення цього винаходу водорозчинний полімер сполучений з поліпептидом через сахаридну складову. В деяких варіантах здійснення цього винаходу сполучний агент, полімер або біологічно активна молекула сполучені з поліпептидом bG-CSF через сахаридну складову. [83] Цей винахід також пропонує поліпептид bG-CSF, який містить водорозчинний полімер, сполучений ковалентним зв'язком із поліпептидом bG-CSF на одній амінокислоті. В деяких варіантах здійснення цього винаходу водорозчинний полімер містить полі(етиленгліколеву) складову. В деяких варіантах здійснення цього винаходу згаданою амінокислотою, ковалентно сполученою з водорозчинним полімером, є штучно закодована амінокислота, присутня у поліпептиді. [84] В деяких варіантах здійснення цього винаходу поліпептид bG-CSF, який містить HES, сполучений ковалентним зв'язком із поліпептидом bG-CSF, є сполученим на одній амінокислоті. В деяких варіантах здійснення цього винаходу одна амінокислота, ковалентно сполучена з HES, є штучно закодованою амінокислотою, присутньою у поліпептиді. В деяких варіантах здійснення цього винаходу поліпептид bG-CSF містить численні штучно закодовані амінокислоти, які можуть бути сполучені з численними молекулами HES та/або молекулами полі(етиленгліколю). [85] Цей винахід пропонує поліпептид bG-CSF, який містить щонайменше один(-у) сполучний агент, полімер або біологічно активну молекулу, де згаданий(-а) сполучний агент, полімер або біологічно активна молекула є приєднаним(-ою) до поліпептиду за через функціональну групу штучно закодованої амінокислоти, введеної до складу згаданого поліпептиду за допомогою рибосом. В деяких варіантах здійснення цього винаходу згаданий поліпептид є монопегільованим. Цей винахід також пропонує поліпептид bG-CSF, який містить сполучний агент, полімер або біологічно активну молекулу, приєднаний(-у) до однієї або декількох штучно закодованих амінокислот, де згадана штучно закодована амінокислота введена до складу згаданого поліпептиду на заздалегідь вибраних ділянках за допомогою рибосом. 16 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 [86] До обсягу цього винаходу входить лідерна або сигнальна послідовність bG-CSF, приєднана до кодувальної ділянки bG-CSF, а також гетерологічна сигнальна послідовність, приєднана до кодувальної ділянки bG-CSF. Вибраною гетерологічною лідерною або сигнальною послідовністю повинна бути така лідерна або сигнальна послідовність, яка розпізнається та процесується, наприклад, секреторною системою клітини-хазяїна для секретування і, можливо, розщеплення сигнальною пептидазою, клітиною-хазяїном. Спосіб лікування стану або розладу із застосуванням bG-CSF за цим винаходом включає лікування із застосуванням bG-CSF з або без сигнального або лідерного пептиду. [87] Цей винахід пропонує спосіб лікування та запобігання інфекцій у тварин. Цей винахід також пропонує спосіб лікування та запобігання маститу та транспортної лихоманки у великої рогатої худоби. Цей винахід також пропонує спосіб лікування інфекцій у тварин без розвитку стійкості у бактеріальних штамів. Окрім того, цей винахід пропонує також очищений та ізольований поліпептид, який має частину або усю первинну структурну конформацію та одну або декілька біологічних властивостей природного бичачого bG-CS, та послідовності ДНК, які кодують такий бичачий bG-CSF. [88] В іншому варіанті здійснення цього винаходу інфікованій тварині з bG-CSF вводять один або декілька додаткових колонієстимулювальних факторів, у тому числі, але без обмеження, GM-CSF (гранулоцитарно-макрофагальний колонієстимулювальний фактор), M-CSF (макрофагальний колонієстимулювальний фактор) та мульти-CSF (IL-3). Згадані колонієстимулювальні фактори (CSF) вводять разом або роздільно. За іншим варіантом здійснення цього винаходу інфекції тварин лікують шляхом введення G-CSF з одним або декількома такими агентами: інтерферонами, у тому числі, але без обмеження, інтерфероном типу альфа, інтерлейкіном-2 (IL2) та фактором некрозу пухлин (TNF), або традиційними антибіотиками, у тому числі, але без обмеження, пеніцилінами, цефалоспоринами та аміноглікозидами. [89] В іншому варіанті здійснення цього винаходу лікування bG-CSF застосовують із профілактичною метою. bG-CSF можна застосовувати як профілактичний лікарський засіб для посилення захисту тварин-хазяїв із підвищеним ризиком ураження бактеріальною, дріжджовою або грибковою інфекцією. Наприклад, bG-CSF можна застосовувати як профілактичний лікарський засіб для нормальних тварин із підвищеним ризиком ураження інфекцією, у тому числі, але без обмеження, пневмонією. Термін "нормальна", який вживають у цьому описі, означає тварину, яка має нормальну імунну функцію та нормальну кількість лейкоцитів і нормальну лейкоцитарну формулу. Велику рогату худобу піддають профілактичному лікуванню перед транспортуванням або у інших випадках, які можуть ослабити худобу, з метою посилення та праймування їх здатності до супротиву інфекціям. Введення bG-CSF можна здійснювати під час обробки великої рогатої худоби, тобто під час проведення вакцинації, таврування тощо. Обробку bG-CSF можна здійснювати також у процесі лікування сухостійних корів та/або безпосередньо перед отеленням для зменшення ймовірності виникнення постнатальних ендометральних інфекцій та маститу на початкових стадіях лактації. Дивись Kehrli et al., Am. J. Vet. Res., 50, No.2, 207 (1989); Oliver et al., J. Dairy Sci. 71:2584-2606 (1988); та Kehrli et al., J. Dairy Sci. 74:4399-4412 (1991), де описане функціонування нейтрофілів великої рогатої худоби у передродовий період. Як правило, лікування антибіотиками безпосередньо перед отеленням не проводять, оскільки у молоці корови можуть з'явитись залишки антибіотиків, що зробить його непридатним для споживання. [90] В іншому варіанті здійснення цього винаходу кон'югування поліпептиду bG-CSF, який містить одну або декілька штучних амінокислот, з іншою молекулою, у тому числі, але без обмеження, молекулою полі(етиленгліколю), надає можливість одержання по суті очищеного bG-CSF завдяки унікальній хімічній реакції, яка застосовується для кон'югування із штучною амінокислотою. Кон'югування поліпептиду bG-CSF, який містить одну або декілька штучно закодованих амінокислот, з іншою молекулою, такою як молекула полі(етиленгліколю), можна здійснювати з іншими методами очищення, які здійснюють перед або після етапу кон'югування з одержанням по суті чистого bG-CSF. Короткий опис фігур [91] Фіг. 1 – Показана плазміда, яка застосовується для експресії bG-CSF. [92] Фіг. 2 – Показані подробиці щодо лінії клітин-хазяїв, яка застосовувалась для експресії bG-CSF. [93] Фіг. 3 – Показані результати SDS PAGE (електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію) аналізу експресії поліпептидів bG-CSF за цим винаходом. [94] Фіг. 4 – Показані результати SDS PAGE аналізу пікових фракцій bG-CSF з CM FF колонки перед пегілуванням. 17 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 [95] Фіг. 5 – Показані результати SDS PAGE аналізу пікових фракцій пегільованого bG-CSFT133pAF з SP HP колонки. [96] Фіг. 6 – Показані результати SDS-PAGE аналізу b-GCSF перед та після пегілування. [97] Фіг. 7a – Показано трипсиновий/Glu-C гідролізат bG-CSF дикого типу (детектування при 214 нм). [98] Фіг. 7b – Показано трипсиновий/Glu-C гідролізат bG-CSF T133pAF (детектування при 214 нм). [99] Фіг. 8a – Показано трипсиновий/Glu-C гідролізат bG-CSF дикого типу (детектування при 250 нм). [100] Фіг. 8b – Показано трипсиновий/Glu-C гідролізат bG-CSF T133pAF (детектування при 250 нм). [101] Фіг. 9a – Показано Glu-C гідролізат bG-CSF дикого типу (детектування при 214 нм). [102] Фіг. 9b – Показано Glu-C гідролізат bG-CSF T133pAF (детектування при 214 нм). [103] Фіг. 10a – Показано Glu-C гідролізат bG-CSF дикого типу (детектування при 250 нм). [104] Фіг. 10b – Показано Glu-C гідролізат bG-CSF T133pAF (детектування при 250 нм). [105] Фіг. 11 – Показані результати SEC-HPLC аналізу пегільованого поліпептиду bG-CSF. [106] Фіг. 12 – Показані результати SEC-HPLC аналізу поліпептиду bG-CSF. [107] Фіг. 13 – Показані невиправлені значення EC50 аналізу проліферації M-NFS60 з 20K пегільованим бичачим G-CSF T133pAF та bG-CSF дикого типу. [108] Фіг. 14 – Показана кратність різниць EC50 20K пегільованого бичачого G-CSF T133pAF у аналізі проліферації M-NFS60 у зіставленні з bG-CSF дикого типу. [109] Фіг. 15 – Показані результати експерименту з аналізом нейтрофілів великої рогатої худоби, забарвлених антитілом CD11b. [110] Фіг. 16 – Показані результати введення пегільованого bG-CSF на ANC (абсолютний вміст нейтрофілів). [111] Фіг. 17 – Лінійний графік, який показує абсолютний вміст нейтрофілів (середнє ± середня квадратична помилка) у телят, яким вводили буфер для лікарської форми або пегільований bG-CSF, після однієї підшкірної ін'єкції у дозі 40 мкг/кг. [112] Фіг. 18 – Лінійний графік, який показує середньодобовий надій молока від корів з прикладу з введенням 40 мкг/кг. [113] Фіг. 19 – Стовпчаста діаграма, яка показує різниці у кількості соматичних клітин у дні 3, 5, 7 та 10 після отелення між чотирма групами корів, у тому числі контрольною групою, групою, якій щоденно вводили непегільований bG-CSF, групою, якій вводили пегільований bG-CSF у дозі 40 мкг/кг, та групою, якій вводили пегільований bG-CSF у дозі 20 мкг/кг. Визначення [114] Слід розуміти, що цей винахід не обмежується конкретною методологією, методами, лініями клітин, генно-інженерними конструкціями та реактивами, опис яких наведений у цій заявці, оскільки вони можуть змінюватись. Слід розуміти, що термінологія, яка вживається у цьому описі, призначена лише для опису конкретних прикладів здійснення і не призначена для обмеження обсягу цього винаходу, який обмежується лише формулою винаходу, яка додається. [115] Слід зазначити, що у разі вживання у цьому описі і формулі винаходу, яка додається, форми однини охоплюють і форми множини, якщо контекст явно не вказує на інше. Так, наприклад, посилання на "bGCSF", "бичачий G-CSF", "bG-CSF", "поліпептид бичачого G-CSF" або "поліпептид bG-CSF" та різні форми з дефісом та без дефісу є посиланням на один білок або декілька таких білків і охоплює їх еквіваленти, відомі фахівцям у цій галузі тощо. [116] Якщо не зазначено інше, усі технічні та наукові терміни, які вживаються у цьому описі, мають загальноприйняте значення, зрозуміле для фахівця у галузі, до якої належить цей винахід. Наведений опис способів, пристроїв та матеріалів, яким віддається перевага, хоча при практичному здійсненні або випробування цього винаходу можуть бути застосовані будь-які способи, пристрої та матеріали, аналогічні або еквівалентні тим, які описані. [117] Усі публікації і патенти, на які у цьому описі є посилання, включені до нього шляхом посилань з метою опису та розкриття, наприклад, генно-інженерних конструкцій та методів, описаних у публікаціях, які можуть застосовуватись у зв'язку з винаходом, опис якого наводиться. Обговорення публікацій, згаданих у цьому описі, стосується виключно наведеної в них інформації, опублікованої перед датою подання цієї заявки. Ніщо у цій заявці не повинно розглядатись як припущення того, що винахідники не мають права датувати такий опис більш ранньою датою на підставі попереднього винаходу або з будь-якої іншої причини. [118] Словосполучення "по суті очищений" означає поліпептид bG-CSF, який може бути значною мірою або по суті вільним від компонентів, які, за нормальних обставин, супроводжують або взаємодіють з білком у його природному середовищі, тобто у нативній 18 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітині або клітині-хазяїні у разі рекомбінантно продукованих поліпептидів bG-CSF. Поліпептид bG-CSF, який може бути по суті вільним від клітинного матеріалу, включає препарати білка, які мають менше ніж приблизно 30 %, менше ніж приблизно 25 %, менше ніж приблизно 20 %, менше ніж приблизно 15 %, менше ніж приблизно 10 %, менше ніж приблизно 5 %, менше ніж приблизно 4 %, менше ніж приблизно 3 %, менше ніж приблизно 2 % або менше ніж приблизно 1 % (за сухою масою) забруднювального білка. Якщо поліпептид bG-CSF або його варіант продукується клітинами-хазяями рекомбінантним шляхом, білок може бути присутнім на рівні приблизно 30 %, приблизно 25 %, приблизно 20 %, приблизно 15 %, приблизно 10 %, приблизно 5 %, приблизно 4 %, приблизно 3 %, приблизно 2 % або приблизно 1 % чи менше від сухої маси клітин. Якщо поліпептид bG-CSF або його варіант продукується клітинами-хазяями рекомбінантним шляхом, білок може бути присутнім у культуральному середовищі на рівні приблизно 5 г/л, приблизно 4 г/л, приблизно 3 г/л, приблизно 2 г/л, приблизно 1 г/л, приблизно 750 мг/л, приблизно 500 мг/л, приблизно 250 мг/л, приблизно 100 мг/л, приблизно 50 мг/л, приблизно 10 мг/л або приблизно 1 мг/л чи менше від сухої маси клітин. Таким чином, "по суті очищений" поліпептид bG-CSF, одержаний за способами за цим винаходом, може мати рівень чистоти щонайменше приблизно 30 %, щонайменше приблизно 35 %, щонайменше приблизно 40 %, щонайменше приблизно 45 %, щонайменше приблизно 50 %, щонайменше приблизно 55 %, щонайменше приблизно 60 %, щонайменше приблизно 65 %, щонайменше приблизно 70 %, конкретно, рівень чистоти щонайменше приблизно 75 %, 80 %, 85 %, і ще конкретніше, рівень чистоти щонайменше приблизно 90 %, рівень чистоти щонайменше приблизно 95 %, рівень чистоти щонайменше приблизно 99 % або більше, при визначенні відповідними способами, наприклад, аналізом SDS/PAGE, RP-HPLC, SEC та капілярним електрофорезом. [119] Словосполучення "рекомбінантна клітина-хазяїн" або "клітина-хазяїн" означає клітину, яка містить екзогенний полінуклеотид, незалежно від способу, який застосовували для введення, наприклад, пряме захоплення, трансдукція, f-кон'югація або інші способи, відомі у цій галузі для одержання рекомбінантних клітин-хазяїв. Екзогенний полінуклеотид можна зберігати як неінтегрований вектор, наприклад, плазміду, або у іншому варіанті здійснення цього винаходу його можна інтегрувати до генотипу клітини-хазяїна. [120] Термін "живильне середовище" або "живильні середовища", який вживають у цьому описі, охоплює будь-яке культуральне середовище, розчин, тверду, напівтверду або жорстку основу, яка може підтримувати або містити будь-яку клітину-хазяїна, у тому числі бактеріальні клітини-хазяї, дріжджові клітини-хазяї, клітини-хазяї комах, клітини-хазяї рослин, еукаріотні клітини-хазяї, клітини-хазяї ссавців, клітини CHO, прокаріотні клітини-хазяї, клітини-хазяї E. coli або клітини-хазяї Pseudomonas та вміст клітин. Таким чином, згаданий термін може охоплювати живильне середовище, у якому була вирощена клітина-хазяїн, наприклад, середовище, у яке був секретований поліпептид bG-CSF, у тому числі середовище перед або після етапу проліферації. Згаданий термін може також охоплювати буфери або реактиви, які містять лізати клітин-хазяїв, наприклад, у разі, коли поліпептид bG-CSF продукується усередині клітин, і клітини-хазяї піддають лізису або руйнуванню для вивільнення поліпептиду bG-CSF. [121] Термін "відновник", який вживають у цьому описі стосовно рефолдингу білків, визначається як будь-яка сполука або матеріал, який підтримує сульфгідрильні групи у відновленому стані та відновлює внутрішньомолекулярні та міжмолекулярні дисульфідні зв'язки. До числа прийнятних відновників належать, але без обмеження ними, дитіотреітол (DTT), 2-меркаптоетанол, дитіоеритритол, цистеїн, цистеамін (2-аміноетантіол) та відновний глутатіон. Фахівцям у цій галузі легко зрозуміло, що найрізноманітніші відновники є прийнятними для застосування у способах та композиціях за цим винаходом. [122] Термін "окисник", який вживають у цьому описі стосовно рефолдингу білків, означає будь-яку сполуку або матеріал, що є здатним(-ою) до видалення електрону зі сполуки, яку піддають окисненню. До числа прийнятних окисників належать, але без обмеження ними, окиснений глутатіон, цистин, цистамін, окиснений дитіотреітол, окиснений еритреітол та кисень. Фахівцям у цій галузі легко зрозуміло, що найрізноманітніші окисники є прийнятними для застосування у способах та композиціях за цим винаходом. [123] Термін "денатуруюча речовина" або "денатурант", який вживають у цьому описі, означає будь-яку сполуку або матеріал, що спричинює оборотне розгортання білкової молекули. Сила денатуруючої речовини або денатуранту визначається як властивостями, так і концентрацією конкретної денатуруючої речовини або денатуранту. Прийнятними денатуруючими речовинами або денатурантами можуть бути хаотропи, детергенти, органічні розчинники, водозмішувальні розчинники, фосфоліпіди або комбінація двох або декількох таких речовин. До прийнятних хаотропів належать (але без обмеження ними) сечовина, гуанідин та тіоціанат натрію. До прийнятних детергентів можуть належати (але без обмеження ними) сильні 19 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 детергенти, такі як додецилсульфат натрію або прості ефіри поліоксіетилену (наприклад, такі детергенти як твін або тритон), саркозил, м'які неіоногенні детергенти (наприклад, дигітонін), м'які катіоногенні детергенти, такі як N-2,3-(діолеїлокси)пропіл-N, N,N-триметиламоній, м'які іоногенні детергенти (наприклад, холат натрію або дезоксихолат натрію) або цвіттеріонні детергенти, у тому числі, але без обмеження, сульфобетаїни (цвіттергент), 3-(3холамідопропіл)диметиламоніо-1-пропансульфат (CHAPS) та 3-(3холамідопропіл)диметиламоніо-2-гідрокси-1-пропансульфонат (CHAPSO). Органічні водозмішувальні розчинники, такі як ацетонітрил, нижчі алканоли (зокрема, C 2-C4-алканоли, такі як етанол або ізопропанол) або нижчі алкандіоли (зокрема, C 2-C4-алкандіоли, такі як етиленгліколь), можуть застосовуватись як денатуранти. Фосфоліпідами, прийнятними для цього винаходу, можуть бути природні фосфоліпіди, такі як фосфатидилетаноламін, фосфатидилхолін, фосфатидилсерин та фосфатидилінозитол, або синтетичні похідні чи варіанти фосфоліпідів, такі як дигексаноїлфосфатидилхолін або дигептаноїлфосфатидилхолін. [124] Термін "рефолдинг", який вживають у цьому описі, описує будь-який процес, реакцію або метод, що трансформує поліпептиди, які містять дисульфідні зв'язки, з невідповідно укладеного або розгорнутого стану у нативну або відповідно вкладену конформацію відносно дисульфідних зв'язків. [125] Термін "сумісне вкладання", який вживають у цьому описі, стосується конкретно процесів, реакцій або методів рефолдингу, у яких застосовують щонайменше два поліпептиди, які взаємодіють між собою, результатом яких є трансформування неукладених або невідповідно укладених поліпептидів у нативні, відповідно укладені поліпептиди. [126] Термін "гранулоцитарний колонієстимулювальний фактор" або "G-CSF", який вживають у цьому описі, означає ті поліпептиди та білки, які мають щонайменше одну біологічну активність G-CSF (наприклад, як описано у патентах США № 6,716,606; № 6,689,351; № 6,565,841; № 6,162,426; № 5,811,301; № 5,776,895; № 5,718,893; № 5,580,755; № 5,536,495; № 5,202,117; № 5,043,156; № 4,999,291; № 4,810,643 та № 4,968,618, для hG-CSF, які включено до цього опису шляхом посилання), а також аналоги G-CSF, ізоформи G-CSF, міметики G-CSF, фрагменти G-CSF, гібридні білки G-CSF, гібридні олігомерні та мультимерні білки, гомологи, глікозиловані варіанти та мутеїни, незалежно від їх біологічної активності і, окрім того, незалежно від способу їх синтезування або одержання, у тому числі, але без обмеження, рекомбінантними (продукованими з кДНК, геномної ДНК, синтетичної ДНК або нуклеїнової кислоти іншої форми), синтетичними, трансгенними методами та методами активації генів. До конкретних прикладів G-CSF належать (але без обмеження ними) пегфілграстим (pegfilgrastim ® ® (NEULASTA )), філграстим (filgrastim (NEUPOGEN )), аналог G-CSF, мутанти G-CSF, змінений глікозилований G-CSF та PEG-кон'юговані аналоги G-CSF. Конкретні приклади ліній клітин, модифікованих для експресії ендогенного людського G-CSF, описані у Devlin et al., J. Leukoc. Biol. 41:306 (1987); патентах США № 6,716,606; № 6,379,661; № 6,004,548; № 5,830,705; № 5,582,823; № 4,810,643; та № 6,242,218, які включені до цього опису шляхом посилання. [127] Термін "бичачий гранулоцитарний колонієстимулювальний фактор", "бичачий G-CSF" або "bG-CSF", який вживають у цьому описі, означає ті поліпептиди та білки, які мають щонайменше одну біологічну активність bG-CSF, а також аналоги bG-CSF, ізоформи bG-CSF, міметики bG-CSF, фрагменти bG-CSF, гібридні білки bG-CSF, гібридні олігомерні та мультимерні білки, гомологи, глікозиловані варіанти та мутеїни, незалежно від їх біологічної активності і, окрім того, незалежно від способу їх синтезування або одержання, у тому числі, але без обмеження, рекомбінантними (продукованими з кДНК, геномної ДНК, синтетичної ДНК або нуклеїнової кислоти іншої форми), синтетичними, трансгенними методами та методами активації генів. До конкретних прикладів G-CSF належать (але без обмеження ними) мутанти bG-CSF, змінений глікозилований G-CSF та PEG-кон'юговані аналоги G-CSF. [128] Термін "бичачий G-CSF (bG-CSF)" або "пептид bG-CSF" означає бичачий гранулоцитарний колонієстимулювальний фактор або G-CSF, описаний вище, а також поліпептид, який зберігає щонайменше одну біологічну активність природного bG-CSF. До поліпептидів bG-CSF належать фармацевтично прийнятні солі та проліки, а також проліки, які являють собою солі, поліморфи, гідрати, сольвати, біологічно активні фрагменти, біологічно активні варіанти та стереоізомери природного бичачого bG-CSF, а також агоністичні, міметичні та антагоністичні варіанти природного бичачого bG-CSF та його гібридні поліпептиди. До прикладів поліпептидів та міметиків bG-CSF належать описані у WO 89/10932, патентах США № 5,849,883 та № 6,497,869, які у повному обсязі включені до цього опису шляхом посилання. Гібриди, які містять додаткові амінокислоти на амінокінці, карбоксильному кінці або на обох кінцях, охоплюються терміном "поліпептид bG-CSF". До прикладів гібридів належать (але без обмеження ними), наприклад, метіоніл bG-CSF, у якого метіонін є сполученим з N-кінцем bG 20 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 CSF (такий як поліпептид, представлений послідовністю SEQ ID NO: 2), який є результатом рекомбінантної експресії зрілої форми bG-CSF, гібриди, призначені для очищення (у тому числі, але без обмеження, полігістидин або афінні антигенні детермінанти), гібриди з пептидами, які зв'язують сироватковий альбумін, та гібриди із сироватковими білками, такими як сироватковий альбумін. Відомими є нуклеїнові кислоти природного bG-CSF та амінокислотні послідовності непроцесованих та зрілих форм, а також варіанти, такі як одноамінокислотні варіанти та сплайсовані варіанти. Амінокислотна послідовність зрілого bG-CSF, а також амінокислотна послідовність метіоніл-bG-CSF представлені у цьому описі послідовністю SEQ ID NO: 1 та послідовністю SEQ ID NO: 2, відповідно. Відомі також нуклеїновокислотні молекули, які кодують мутанти bG-CSF та мутантні поліпептиди bG-CSF. [129] Бичачий гранулоцитарний колонієстимулювальний фактор, або bG-CSF, має цілий ряд біологічних активностей, у тому числі, але без обмеження, зв'язування свого рецептора, спричинення димеризації свого рецептора, стимуляції продукування нейтрофілів та стимуляції проліферації та диференціації клітин. Приклади деяких біологічних активностей гранулоцитарного колонієстимулювального фактора та hG-CSF описані вище та у патентах США № 6,676,947; № 6,579,525; № 6,531,121; № 6,521,245; № 6,489,293; № 6,368,854; № 6,316,254; № 6,268,336; № 6,239,109; № 6,165,283; № 5,986,047; № 5,830,851; № 5,043,156; та № 5,773,569, які включені до цього опису шляхом посилання. [130] Терміни "поліпептид бичачого G-CSF", "поліпептид bG-CSF", "бичачий G-CSF" або "bGCSF" та їх дефісні і бездефісні форми, які вживають у цьому описі, включають ті поліпептиди та білки, які мають щонайменше одну біологічну активність CSF, аналогів bG-CSF, мутантів GCSF, зміненого глікозилованого bG-CSF, PEG-кон'югованого bG-CSF, ізоформ bG-CSF, міметиків bG-CSF, фрагментів bG-CSF, гібридних білків bG-CSF, гібридних білків, олігомерів та мультимерів, гомологів, глікозилованих варіантів, варіантів, сплайсованих варіантів та мутеїнів, незалежно від їх біологічної активності, і, окрім того, незалежно від способу їх синтезування або одержання, у тому числі, але без обмеження, рекомбінантними методами (продукованими з кДНК, геномної ДНК, синтетичної ДНК або нуклеїнової кислоти іншої форми), in vitro, in vivo, методом мікроін'єкції молекул нуклеїнової кислоти, синтетичними, трансгенними методами та методом активації генів. Термін "поліпептид бичачого G-CSF", "поліпептид bG-CSF", "бичачий G-CSF" або "bG-CSF" охоплює поліпептиди bG-CSF, які містять одну або декілька амінокислотних замін, додань або делецій. Аналоги бичачого G-CSF дивись у патенті США № 5,849,883, включеному до цього опису шляхом посилання. [131] Були описані заміни цілого ряду амінокислотних положень bG-CSF. Заміни включають (але без обмеження ними) такі заміни, які модулюють фармацевтичну стабільність, підвищують агоністичну активність, підвищують стійкість до протеаз, перетворюють поліпептид на антагоніста тощо та охоплюються терміном "поліпептид G-CSF", "поліпептид бичачого bG-CSF", "бичачий G-CSF" або "bG-CSF". [132] У іншому варіанті здійснення цього винаходу запропоновані рекомбінантні нуклеїнові кислоти, які кодують варіантні білки, вектори експресії, які містять варіантні нуклеїнові кислоти, клітини-хазяї, які містять варіантні нуклеїнові кислоти та/або вектори експресії, і способи продукування варіантних білків. У іншому варіанті здійснення цього винаходу запропоноване лікування інфекції шляхом введення тварині варіантного білка, як правило, з фармацевтичним носієм, у терапевтично ефективній кількості. [133] Мутанти bG-CSF, які обговорюються у патенті США № 5,849,883, у повному обсязі включеному до цього опису шляхом посилання, містять поліпептиди, сконструйовані з кодоном, оптимізованим для E. coli, та гібридні білки, створені з послідовностями бичачого та людського G-CSF. Патент США № 5,416,195, у повному обсязі включений до цього опису шляхом посилання, описує мутанти hG-CSF, у яких було здійснено щонайменше одну з наведених нижче амінокислотних замін (номенклатура амінокислот відповідає зрілому білку; таким чином, у разі присутності N-кінцевого метіоніну, його положення позначається як -1 або 0): Cys17 нативної послідовності був замінений залишком Ser17, Asp27 нативної послідовності був замінений залишком Ser27, Leu15 нативної послідовності був замінений залишком Glu15, Lys23 нативної послідовності був замінений залишком Arg23, Gly28 нативної послідовності був замінений залишком Ala28, Lys40 нативної послідовності був замінений залишком Arg40, Pro44 нативної послідовності був замінений залишком Ala44, Leu49 нативної послідовності був замінений залишком Lys49, Gly55 нативної послідовності був замінений залишком Ala55, Cys60 нативної послідовності був замінений залишком Ser60, Pro111 нативної послідовності був замінений залишком Glu111, Thr115 нативної послідовності був замінений залишком Ser115 і Tyr165 нативної послідовності був замінений залишком Arg165. Багато із цих залишків є присутніми у послідовності bG-CSF, і одну або декілька із цих замін можна знайти у поліпептиду 21 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 bG-CSF за цим винаходом. Carter et al. Biologicals (2004) 32:37 описали мутований hG-CSF, якому бракує сайтів глікозилування. Подібні мутації можуть бути знайдені у поліпептидів bGCSF за цим винаходом. [134] В деяких варіантах здійснення поліпептиди bG-CSF за цим винаходом є по суті ідентичними послідовностям SEQ ID NO: 1, 2 або будь-якій іншій послідовності поліпептиду bGCSF. Нуклеїновокислотні молекули, які кодують поліпептиди bG-CSF, у тому числі мутанти, та способи експресії і очищення поліпептидів bG-CSF є добре відомими. [135] Термін "поліпептид bG-CSF" включає також фармацевтично прийнятні солі та проліки, а також проліки, які являють собою солі, поліморфи, гідрати, сольвати, біологічно активні фрагменти, біологічно активні варіанти та стереоізомери природного bG-CSF, а також агоністичні, міметичні та антагоністичні варіанти природного бичачого bG-CSF та його гібридні поліпептиди. Гібриди, які містять додаткові амінокислоти на амінокінці, карбоксильному кінці або на обох кінцях, охоплюються терміном "поліпептид bG-CSF". До прикладів гібридів належать (але без обмеження ними), наприклад, метіоніл bG-CSF, у якого метіонін є сполученим з Nкінцем bG-CSF, що є результатом рекомбінантної експресії зрілої форми bG-CSF, якій бракує лідерного або сигнального пептиду чи його частини (метіонін є сполученим з N-кінцем bG-CSF, що є результатом рекомбінантної експресії), гібриди, призначені для очищення (у тому числі, але без обмеження, полігістидин або афінні антигенні детермінанти), гібриди з пептидами, які зв'язують сироватковий альбумін, та гібриди із сироватковими білками, такими як сироватковий альбумін. Патент США № 5,750,373, включений до цього опису шляхом посилання, описує спосіб відбору нових білків, таких як гормон росту, та варіантів фрагмента антитіла, які мають змінені властивості зв'язування відповідних рецепторних молекул. Згаданий спосіб включає лігування гена, що кодує білок, який становить інтерес, з карбоксикінцевою ділянкою білкової оболонки гена III нитчастого фагу M13. Химерні молекули містять bG-CSF та одну або декілька інших молекул. Химерна молекула може містити специфічні ділянки або фрагменти одного або обох bG-CSF та інших(-ої) молекул(-и). Будь-який із таких фрагментів можна одержати з білків стандартними біохімічними методами або шляхом експресії полінуклеотиду, який кодує згаданий фрагмент. bG-CSF або його фрагмент можна одержати як гібридний білок, який містить людський сироватковий альбумін (HSA), Fc або його частину. Такі гібридні генноінженерні конструкції є придатними для посилення експресії bG-CSF або його фрагмента в еукаріотній клітині-хазяїні. До прикладів фрагментів HSA належить N-кінцевий поліпептид (амінокислоти 1-369, 1-419 та проміжні довжини, починаючи з амінокислоти 1), описаний у патенті США № 5,766,883 та WO 97/24445, включених до цього опису шляхом посилання. Інші химерні поліпептиди можуть включати білок HSA з bG-CSF або його фрагменти, приєднані до кожного з C- та N-кінців HSA. Інші гібриди можна одержати шляхом злиття bG-CSF з а) Fcфрагментом імуноглобуліну; b) аналогом Fc-фрагмента імуноглобуліну, та c) фрагментами Fcфрагмента імуноглобуліну. [136] У різних довідкових джерелах описана модифікація поліпептидів шляхом кон'югації з полімерами або глікозилування. Термін "поліпептид bG-CSF" охоплює поліпептиди, кон'юговані з полімером, таким як полі(етиленгліколь), і які можуть складатись з однієї або декількох похідних цистеїну, лізину або інших залишків. На додаток до цього, поліпептид bG-CSF може містити сполучний агент або полімер, де амінокислота, з якою кон'югується сполучний агент або полімер, може бути штучною амінокислотою за цим винаходом, або вони можуть кон'югуватись із природною амінокислотою за допомогою методів, відомих у цій галузі, наприклад, шляхом сполучення з лізином або цистеїном. [137] Було повідомлено про модифікацію поліпептидів полімерами. IFNβ згадується як один із прикладів поліпептиду, який належить до суперродини гормонів росту. У WO 00/23114 описані глікозилований та пегільований IFNβ. У WO 00/23472 описані гібридні білки IFNβ. У патенті США № 4,904,584 описані пегільовані поліпептиди з дефіцитом лізину, де щонайменше один залишок лізину був видалений або замінений залишком будь-якої іншої амінокислоти. У WO 99/67291 описаний процес кон'югування білка з полі(етиленгліколем), де щонайменше один залишок амінокислоти білка видаляється, і білок контактує з полі(етиленгліколем) за умов, достатніх для забезпечення кон'югування з білком. У WO 99/03887 описані пегільовані варіанти поліпептидів, які належать до суперродини гормонів росту, де залишок цистеїну був замінений залишком замінної амінокислоти, розміщеним на визначеній ділянці поліпептиду. У WO 00/26354 розкритий спосіб одержання глікозилованого варіанта поліпептиду із зниженою алергенністю, який містить щонайменше один додатковий сайт глікозилування у порівнянні з відповідним вихідним поліпептидом. У патенті США № 5,218,092, включеному до цього опису шляхом посилання, описана модифікація гранулоцитарного колонієстимулювального фактора (G-CSF) 22 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 та інших поліпептидів шляхом введення щонайменше одного додаткового вуглеводного ланцюга у порівнянні з нативним поліпептидом. [138] Термін "поліпептид bG-CSF" також охоплює глікозилований bG-CSF, такий як (але без обмеження), поліпептиди, глікозиловані в будь-якому амінокислотному положенні, N-зв'язані або O-зв'язані глікозиловані форми поліпептиду. Варіанти, які містять однонуклеотидні заміни, також вважаються біологічно активними варіантами поліпептиду bG-CSF. Варіанти, які містять однонуклеотидні заміни, також вважаються біологічно активними варіантами bG-CSF. Крім того, термін охоплює також сплайсовані варіанти. Термін "поліпептид bG-CSF" охоплює також гетеродимери, гомодимери, гетеромультимери або гомомультимери будь-якого одного або декількох bG-CSF чи будь-якого іншого поліпептиду, білка, вуглеводу, полімеру, невеликої молекули, сполучного агента, ліганду або іншої активної молекули будь-якого типу, приєднаних хімічними засобами або експресованими як гібридний білок (дивись патенти США № 6,261,550; № 6,166,183; № 6,204,247; № 6,261,550; № 6,017,876, включені до цього опису шляхом посилання), а також аналоги поліпептидів, які містять, наприклад, специфічні делеції чи інші модифікації, але зберігають біологічну активність (патенти США № 6,261,550; № 6,004,548; № 6,632,426, включені до цього опису шляхом посилання). [139] Усі посилання на амінокислотні положення bG-CSF, опис яких наведено, робляться на основі положень послідовності SEQ ID NO: 1, якщо не вказується інше (тобто коли вказується, що порівняння робиться на основі послідовності SEQ ID NO: 2 або іншої послідовності bG-CSF). Наприклад, амінокислотою у положенні 1 послідовності SEQ ID NO: 1 є треонін, і відповідний треонін знаходиться у послідовності SEQ ID NO: 2 у положенні 2. Фахівцям у цій галузі зрозуміло, що амінокислотні положення, які відповідають положенням послідовності SEQ ID NO: 1, можуть бути легко ідентифіковані у будь-якій іншій молекулі bG-CSF, такій як послідовність SEQ ID NO: 2. Фахівцям у цій галузі зрозуміло, що амінокислотні положення, які відповідають положенням послідовностей SEQ ID NO: 1, 2 або будь-якої іншої послідовності bGCSF, можуть бути легко ідентифіковані у будь-якій іншій молекулі bG-CSF, такій як гібриди, варіанти, фрагменти bG-CSF тощо. Наприклад, для вирівнювання та ідентифікування конкретного положення у білка, який відповідає положенню послідовності SEQ ID NO: 1, 2 або іншої послідовності bG-CSF можуть застосовуватись програми вирівнювання послідовностей, такі як BLAST. Заміни, делеції або додання амінокислот, опис яких наведено відносно послідовностей SEQ ID NO: 1, 2 або іншої послідовності bG-CSF, призначені також для посилання на заміни, делеції або додання у відповідних положеннях гібридів, варіантів, фрагменті bG-CSF тощо, опис яких наведений або які є відомими у цій галузі і явно охоплюються цим винаходом. [140] Термін "поліпептид bG-CSF" або "bG-CSF" охоплює поліпептиди bG-CSF, які містять одну або декілька амінокислотних замін, додань або делецій. Поліпептиди bG-CSF за цим винаходом можуть містити модифікації однієї або декількох природних амінокислот у поєднанні з однією або декількома модифікаціями штучних амінокислот. Були описані приклади замін різноманітних амінокислотних положень природних поліпептидів bG-CSF, у тому числі, але без обмеження, заміни, які модулюють фармацевтичну стабільність, які модулюють одну або декілька біологічних активностей поліпептиду bG-CSF, у тому числі, але без обмеження, підвищують агоністичну активність, підвищують розчинність поліпептиду, підвищують стійкість до протеаз, перетворюють поліпептид на антагоніста тощо і охоплюються терміном "поліпептид bG-CSF". В деяких варіантах здійснення цього винаходу антагоніст bG-CSF містить штучно закодовану амінокислоту, сполучену з водорозчинним полімером, який знаходиться на ділянці зв'язування рецепторів молекули bG-CSF. [141] В деяких варіантах здійснення цього винаходу поліпептиди bG-CSF також містять додання, заміну або делецію, що модулює біологічну активність поліпептиду bG-CSF. В деяких варіантах здійснення цього винаходу поліпептиди bG-CSF також містить додання, заміну або делецію, що модулює регульовану поліпептидом bG-CSF проліферацію, функціонування та/або диференціацію нейтрофілів. Наприклад, додання, заміни або делеції можуть модулювати одну або декілька властивостей або активностей bG-CSF. Наприклад, додання, заміни або делеції можуть модулювати спорідненість до рецептора, модулювати період напіввиведення поліпептиду bG-CSF з плазми, модулювати період напіввиведення терапевтично ефективної кількості поліпептиду bG-CSF, модулювати стабільність поліпептиду, модулювати розщеплення протеазами, модулювати дозу, модулювати вивільнення або біологічну доступність, полегшувати очищення або поліпшувати чи змінювати конкретний шлях введення. Подібним чином, поліпептиди bG-CSF можуть містити послідовності розщеплення протеазами, реакційноздатні групи, антигензв'язувальні центри (у тому числі, але без обмеження, FLAG або полі-His) або інші послідовності на основі спорідненості (у тому числі, але без обмеження, 23 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 FLAG, полі-His, GST тощо) чи сполучені молекули (у тому числі, але без обмеження, біотин), які поліпшують виявлення (у тому числі, але без обмеження, GST), очищення або інші відмітні ознаки поліпептиду. [142] Термін "поліпептид bG-CSF" також охоплює гомодимери, гетеродимери, гомомультимери та гетеромультимери, що є сполученими, у тому числі, але без обмеження, з гомодимерами, гетеродимерами, гомомультимерами та гетеромультимерами, сполученими безпосередньо через бічні ланцюги штучно закодованих амінокислот із бічними ланцюгами тих самих або інших штучно закодованих амінокислот, з бічними ланцюгами природних амінокислот або опосередковано через сполучний агент. До прикладів сполучних агентів належать (але без обмеження ними) невеликі органічні сполуки, водорозчинні полімери різної довжини, такі як полі(етиленгліколь) або полідекстран, чи поліпептиди різної довжини. [143] Словосполучення "штучно закодована амінокислот" означає амінокислоту, яка не є однією з 20 звичайних амінокислот або піролізином чи селеноцистеїном. Іншими словосполученнями, які можуть застосовуватись синонімічно із словосполученням "штучно закодована амінокислота" є "неприродна амінокислота" та інші варіанти цього словосполучення з дефісом або без дефісу. Словосполучення "штучно закодована амінокислота" також включає (але ними не обмежується) амінокислоти, які одержують шляхом модифікування (наприклад, посттрансляційні модифікації) природної амінокислоти (у тому числі, але без обмеження, 20 звичайних амінокислот або піролізину чи селеноцистеїну), але які самі по собі природним чином не вводяться до збільшуваного трансляційним комплексом ланцюга поліпептиду. До прикладів таких штучних амінокислот належать (але без обмеження ними) N-ацетилглюкозамініл-L-серин, N-ацетилглюкозамініл-L-треонін та O-фосфотирозин. [144] Словосполучення "амінокінцева група-модифікатор" означає будь-яку молекулу, яка може приєднуватись до амінокінця поліпептиду. Так само, словосполучення "карбоксикінцева група-модифікатор" означає будь-яку молекулу, яка може приєднуватись до карбоксильного кінця поліпептиду. До кінцевих груп-модифікаторів належать (але без обмеження ними) різні водорозчинні полімери, пептиди або білки, такі як сироватковий альбумін, або інші складові, які підвищують період напіввиведення пептидів із плазми. [145] Словосполучення "функціональна група", "активна складова", "активувальна група", "відщеплювана група", "реакційно-активна ділянка", "хімічно-активна група" та "хімічно-активна складова" вживаються у цій галузі та у цьому описі для посилання на певні визначені ділянки або елементи молекули. Згадані словосполучення є до певної міри синонімічними у галузі хімії і вживаються у цьому описі для визначення ділянок молекул, які здійснюють якусь функцію або активність і є реакційноактивними з іншими молекулами. [146] Термін "зв'язок" або "сполучний агент" вживають у цьому описі для посилання на агенти або зв'язки, які (за нормальних обставин) формуються як результат хімічної реакції і, як правило, є ковалентними зв'язками. Словосполучення "гідролітично стабільні зв'язки" означає, що зв'язки є по суті стабільними у воді і не реагують з водою при застосовуваних значеннях рН, у тому числі, але без обмеження, за фізіологічних умов впродовж тривалого періоду часу, можливо, навіть безкінечно. Словосполучення "гідролітично нестабільні або гідролітично розкладальні зв'язки" означає, що зв'язки розпадаються у воді або у водних розчинах, у тому числі, наприклад, у крові. Словосполучення "ферментативно нестабільні або ферментативно розкладальні зв'язки" означає, що зв'язок може бути розкладений одним або декількома ферментами. Як розуміється у цій галузі, поліетилен та споріднені полімери можуть мати розкладальні зв'язки у каркасі полімеру або у сполучній групі між каркасом полімеру та однією або декількома кінцевим функціональними групами полімерної молекули. Наприклад, складноефірні зв'язки, утворені в результаті реакції пегільованих карбонових кислот або PEGактивованих карбонових кислот зі спиртовими групами біологічно активного агента, зазвичай гідролізуються за фізіологічних умов з виділення згаданого агента. До інших гідролітично розкладальних зв'язків належать (але без обмеження ними) карбонатні зв'язки; імінові зв'язки, які є результатом реакції аміну та альдегіду; фосфатноефірні зв'язки, утворені шляхом реакції спирту з фосфатною групою; гідразонові зв'язки, які є продуктом реакції гідразиду та альдегіду; ацеталеві зв'язки, які є продуктом реакції альдегіду та спирту; складні ортоефірні зв'язки, які є продуктом реакції форміату та спирту; пептидні зв'язки, які утворюються аміногрупою, у тому числі, але без обмеження, на кінці полімеру, такого як полі(етиленгліколь), та карбоксильною групою пептиду; та олігонуклеотидні зв'язки, які утворюються фосфорамідитною групою, у тому числі, але без обмеження, на кінці полімеру, та 5' гідроксильною групою олігонуклеотиду. [147] Словосполучення "біологічно активна молекула", "біологічно активна складова" або "біологічно активний агент", у разі застосування у цьому описі, означає будь-яку речовину, яка може впливати на будь-які фізичні або біохімічні властивості біологічної системи, шлях, 24 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 молекулу або взаємодію, пов'язану з організмом, у тому числі, але без обмеження, вірусами, бактеріями, бактеріофагом, транспозоном, пріоном, комахами, грибами, рослинами, тваринами та людьми. Зокрема, як описано у цьому описі, до біологічно активних молекул належить (але без обмеження ними) будь-яка речовина, призначена для діагностування, лікування, заспокоєння або запобігання хвороби у людей або інших тварин чи поліпшення іншим шляхом фізичного або психічного благополуччя людей або тварин. До прикладів біологічно активних молекул належать (але без обмеження ними) пептиди, білки, ферменти, дрібномолекулярні лікарські засоби, вакцини, імуногени, сильнодіючі наркотичні лікарські засоби, слабкі наркотичні лікарські засоби, вуглеводи, неорганічні атоми або молекули, барвники, ліпіди, нуклеозиди, радіонукліди, олігонуклеотиди, токсоїди, токсини, прокаріотні та еукаріотні клітини, віруси, полісахариди, нуклеїнові кислоти та їх фрагменти, одержані з вірусів, бактерій, комах, тварин або іншої клітини чи клітини іншого типу, ліпосоми, мікрочастинки та міцели. Поліпептиди bGCSF можна додавати до лікарської форми на основі міцел. До класів біологічно активних агентів, які є прийнятними для застосування з цим винаходом, належать (але без обмеження ними) лікарські речовини, проліки, радіонукліди, візуалізаційні (контрастні) речовини, полімери, антибіотики, фунгіциди, противірусні агенти, протизапальні агенти, протипухлинні агенти, засоби для лікування серцево-судинних захворювань, антифобічні седативні засоби, гормони, фактори росту, стероїдні агенти, токсини мікробного походження тощо. [148] Словосполучення "біфункціональний полімер" означає полімер, який містить дві окремі функціональні групи, які є здатними до реагування, зокрема, з іншими складовими (у тому числі, але без обмеження, бічними групами амінокислот) з утворенням ковалентних або нековалентних зв'язків. Біфункціональна сполучна група, яка має одну функціональну групу, що може реагувати з групою конкретної біологічно активної складової, та іншу групу, що може реагувати з групою другої біологічної складової, може застосовуватись для утворення кон'югату, який містить першу біологічно активну складову, біфункціональну сполучну групу та другу біологічно активну складову. Відомо багато методів та сполучних молекул для приєднання різних сполук до пептидів. Дивись, наприклад, заявку на європатент № 188,256; патенти США № 4,671,958, № 4,659,839, № 4,414,148, № 4,699,784; № 4,680,338 та № 4,569,789, включені до цього опису шляхом посилання. Словосполучення "багатофункціональний полімер" означає полімер, який містить дві або декілька окремих функціональних груп, що є здатними до реагування, зокрема, з іншими складовими (у тому числі, але без обмеження, бічними групами амінокислот) з утворенням ковалентних або нековалентних зв'язків. Біфункціональний полімер або багатофункціональний полімер може мати будь-яку бажану довжину або молекулярну масу і його можна вибирати таким чином, щоб забезпечувати конкретний необхідний проміжок або конформацію між однією або декількома молекулами, сполученими з bG-CSF та його рецептором або bG-CSF. [149] У тому разі, коли замінні групи визначаються традиційними хімічними формулами, записаними зліва-направо, вони також охоплюють хімічно ідентичні замісники, які є результатом запису структури справа-наліво, наприклад, структура -CH2O- є еквiвалентною структурі -OCH2-. [150] Термін "замісники" включає, але не обмежується терміном "нейтральні замісники". До числа "нейтральних замісників" належать групи, які формують стабільні сполуки. До прийнятних нейтральних замісників або радикалів належать (але без обмеження ними) галоген, C1-C10алкіл, C2-C10-алкеніл, C2-C10-алкініл, C1-C10-алкоксигрупа, C1-C12-аралкіл, C1-C12-алкарил, C3-C12циклоалкіл, C3-C12-циклоалкеніл, феніл, заміщений феніл, толуоїл, ксиленіл, біфеніл, C 2-C12алкоксіалкіл, C2-C12-алкоксіарил, C7-C12-арилоксіалкіл, C7-C12-оксіарил, C1-C6-алкілсульфініл, C1C10-алкілсульфоніл, -(CH2)m-O-(C1-C10-алкіл), де m – від 1 до 8, арил, заміщений арил, заміщена алкоксигрупа, фторалкіл, гетероциклічний радикал, заміщений гетероциклічний радикал, нітроалкіл, -NO2, -CN, -NRC(O)-(C1-C10-алкіл), -C(O)-(C1-C10-алкіл), C2-C10-алкілтіоалкіл, -C(O)O(C1-C10-алкіл), -OH, -SO2, =S, -COOH, -NR2, карбоніл, -C(O)-(C1-C10-алкіл)-CF3, -C(O)-CF3, C(O)NR2, -(C1-C10-арил)-S-(C6-C10-арил), -C(O)-(C1-C10-арил), -(CH2)m-O-(-(CH2)m-O-(C1-C10-алкіл), де кожен m – від 1 до 8, -C(O)NR2, -C(S)NR2, -SO2NR2, -NRC(O)NR2, -NRC(S)NR2, їх солі тощо. Кожен R, як описано у цьому описі, являє собою H, алкіл або заміщений алкіл, арил або заміщений арил, аралкіл або алкарил. [151] Термін "галоген" охоплює фтор, хлор, йод та бром. [152] Термін "алкіл", сам по собі або як частина іншого замінника, означає, якщо не зазначено інше, вуглеводневий радикал із прямим або розгалуженим ланцюгом чи циклічний вуглеводневий радикал або їх комбінацію, який може бути повністю насиченим, моно- або поліненасиченим і може включати бі- та полівалентні радикали, які мають вказану кількість атомів вуглецю (тобто C1-C10 означає від одного до десяти атомів вуглецю). До прикладів насичених вуглеводневих радикалів належать (але без обмеження ними) такі групи як метил, 25 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 етил, н-пропіл,ізопропіл, н-бутил, трет-бутил, ізобутил, втор-бутил, циклогексил, циклогексилметил, циклопропілметил, гомологи та ізомери, наприклад, н-пентил, н-гексил, нгептил, н-октил тощо. Ненасиченою алкільною групою є група, яка має один або декілька подвійних зв'язків або потрійних зв'язків. До прикладів ненасичених алкільних груп належать (але без обмеження ними) вініл, 2-пропеніл, кротил, 2-ізопентеніл, 2-(бутадієніл), 2,4пентадієніл, 3-(1,4-пентадієніл), етиніл, 1- та 3-пропініл, 3-бутиніл і вищі гомологи та ізомери. Термін "алкіл", якщо не зазначено інше, також охоплює похідні алкілу, які докладніше визначені нижче, такі як "гетероалкіл". Алкільні групи, які є обмеженими вуглеводневими групами, позначені як "гомоалкіл". [153] Термін "алкілен", сам по собі або як частина іншого замінника, означає бівалентний радикал, який є похідною алкану, необмежувальними прикладами якого є структури -CH2CH2- та -CH2CH2CH2CH2-, і який також означає групи, які описуються нижче як "гетероалкілен". За типовим варіантом, алкільна (або алкіленова) група буде мати від 1 атома вуглецю до 24 атомів вуглецю, де ті групи, які мають 10 або менше атомів вуглецю, є конкретним прикладом здійснення способів та композицій, опис яких наведено. "Нижчим алкілом" або "нижчим алкіленом" є алкільна або алкіленова група з коротшим ланцюгом, який складається, як правило, з восьми або менше атомів вуглецю. [154] Терміни "алкокси-", "алкіламіно-" та "алкілтіо-" (або тіоалкоксигрупа) вживають у їх традиційному значенні і вони означають алкільні групи, приєднані до решти молекули через атом кисню, аміногрупу або атом сірки, відповідно. [155] Термін "гетероалкіл", сам по собі або у комбінації з іншим терміном, означає, якщо не зазначено інше, стабільний вуглеводневий радикал із прямим або розгалуженим ланцюгом чи циклічний вуглеводневий радикал або їх комбінацію, яка може складатись із зазначеної кількості атомів вуглецю і щонайменше одного гетероатому, вибраний з групи, яку складають O, N, Si та S, і де атоми азоту та сірки можуть факультативно бути окисненими, а гетероатом азоту може факультативно бути кватернізованим. Гетероатом(-и) O, N та S і Si може(-уть) бути розміщені у будь-якому внутрішньому положенні гетероалкільної групи або у положенні, у якому алкільна група приєднується до решти молекули. До прикладів належать (але без обмеження ними) CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2-S(O)-CH3, CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3 та -CH=CH-N(CH3)-CH3. До двох гетероатомів можуть бути розміщені послідовно, наприклад, -CH2-NH-OCH3 та -CH2-O-Si(CH3)3. Подібним чином, термін "гетероалкілен", сам по собі або як частина іншого замінника, означає бівалентний радикал, який є похідною гетероалкілу, наприклад, але без обмеження, -CH2-CH2S-CH2-CH2- та -CH2-S-CH2-CH2-NH-CH2-. В гетероалкіленових групах однакові або різні гетероатоми можуть також займати будь-який або обидва кінці ланцюга (у тому числі, але без обмеження, алкіленокси-, алкілендіокси-, алкіленаміно-, алкілендіаміногрупа, амінооксіалкілен тощо). Окрім того, для алкіленових та гетероалкіленових сполучних груп, орієнтація сполучної групи не визначається напрямком, у якому записується формула сполучної групи. Наприклад, формула -C(O)2R'- означає як -C(O)2R'-, так і -R'C(O)2-. [156] Терміни "циклоалкіл" та "гетероциклоалкіл", самі по собі або у комбінації з іншими термінами, означають, якщо не зазначено інше, циклічні варіанти "алкілу" та "гетероалкілу", відповідно. Так, циклоалкіл або гетероциклоалкіл включає насичені, частково ненасичені або повністю ненасичені циклічні зв'язки. Окрім того, для гетероциклоалкілу, гетероатом може займати положення, у якому гетероцикл приєднується до решти молекули. До прикладів циклоалкілу належать, але без обмеження ними, циклопентил, циклогексил, 1-циклогексеніл, 3циклогексеніл, циклогептил тощо. До прикладів гетероциклоалкілу належать, але без обмеження ними, 1-(1,2,5,6-тетрагідропіридил), 1-піперидиніл, 2-піперидиніл, 3-піперидиніл, 4морфолініл, 3-морфолініл, тетрагідрофуран-2-іл, тетрагідрофуран-3-іл, тетрагідротієн-2-іл, тетрагідротієн-3-іл, 1-піперазиніл, 2-піперазиніл тощо. Окрім того, згаданий термін охоплює біциклічні та трициклічні структури. Подібним чином, термін "гетероциклоалкілен", сам по собі або як частина іншого замінника, означає бівалентний радикал, який є похідною гетероциклоалкілу, а термін "циклоалкілен", сам по собі або як частина іншого замінника, означає бівалентний радикал, який є похідною циклоалкілу. [157] Термін "водорозчинний полімер", який вживають у цьому описі, означає будь-який полімер, який є розчинним у водних розчинниках. Результатом сполучення водорозчинних полімерів із поліпептидами bG-CSF можуть бути зміни, у тому числі, але без обмеження, підвищення або модулювання періоду напіввиведення з плазми або підвищення чи модулювання періоду напіввиведення терапевтично ефективної кількості, у порівнянні з немодифікованою формою, модульована імуногенність, модульовані характеристики фізичних зв'язків, таких як агрегування та утворення мультимерів, змінене зв'язування з рецептором, 26 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 змінене зв'язування з одним або декількома партнерами зв'язування та змінена димеризація або мультимеризація рецепторів. Водорозчинний полімер може мати або може не мати своєї власної біологічної активності, і його можна застосовувати як сполучну групу для приєднання bG-CSF до інших речовин, у тому числі, але без обмеження, до одного або декількох поліпептидів bG-CSF або однієї чи декількох біологічно активних молекул. До прийнятних полімерів належать (але без обмеження ними) поліетиленгліколь, пропіональдегід поліетиленгліколю, їх моно-C1-C10-алкокси- або арилоксипохідні (описані у патенті США № 5,252,714, включеному до цього опису шляхом посилання), монометоксиполіетиленгліколь, полівінілпіролідон, полівініловий спирт, поліамінокислоти, співполімер дивінілового ефіру/малеїнового ангідриду, N-(2-гідроксипропіл)метакриламід, декстран, похідні декстрану, у тому числі сульфат декстрану, поліпропіленгліколь, співполімер поліпропіленоксиду/етиленоксиду, поліоксіетилований поліол, гепарин, фрагменти гепарину, полісахариди, олігосахариди, глікани, целюлоза та похідні целюлози, у тому числі але без обмеження, метилцелюлозу та карбоксиметилцелюлозу, крохмаль та похідні крохмалю, поліпептиди, поліалкіленгліколь та його похідні, співполімери поліалкіленгліколів та їх похідні, ефіри полівінілетилу та альфа-бета-полі[(2-гідроксіетил)-DL-аспартамід тощо або їх суміші. До прикладів таких водорозчинних полімерів належать (але без обмеження ними) поліетиленгліколь та сироватковий альбумін. У WO 03/074087 та WO 03/074088 описане кон'югування білків або дрібних молекул із гідроксіалкілкрохмалем (HAS). До прикладів гідроксіалкілкрохмалів належить (але без обмеження) гідроксіетилкрохмаль. Кон'югати гідроксіалкілкрохмалю та іншої молекули, наприклад, можуть містити ковалентний зв'язок між кінцевими альдегідними групами HAS та реакційноздатними групами іншої молекули. [158] Термін "поліалкіленгліколь" або "полі(алкенгліколь)", який вживають у цьому описі, означає поліетиленгліколь (полі(етиленгліколь)), поліпропіленгліколь, полібутиленгліколь та їх похідні. Термін "поліалкіленгліколь" охоплює як лінійні, так і розгалужені полімери та середні молекулярні маси у межах від 0,1 кДа до 100 кДа. Інші приклади здійснення наведені, наприклад, у каталогах комерційних постачальників, таких як каталог компанії Shearwater Corporation "Polyethylene Glycol and Derivatives for Biomedical Applications" (2001). [159] Термін "арил" означає, якщо не зазначено інше, поліненасичений, ароматичний вуглеводневий замінник, який може мати один цикл або численні цикли (у тому числі, але без обмеження, від 1 циклу до 3 циклів), які конденсуються або зв'язуються між собою ковалентними зв'язками. Термін "гетероарил" означає арильні групи (або цикли), які містять від одного до чотирьох гетероатомів, вибраних з групи, яку складають N, O та S, де атоми азоту та сірки факультативно окиснені, а атом(-и) азоту факультативно кватернізований(-і). Гетероарильна група може бути приєднана до решти молекули через гетероатом. До необмежувальних прикладів арильних та гетероарильних груп належать феніл, 1-нафтил, 2нафтил, 4-біфеніл, 1-піроліл, 2-піроліл, 3-піроліл, 3-піразоліл, 2-імідазоліл, 4-імідазоліл, піразиніл, 2-оксазоліл, 4-оксазоліл, 2-феніл-4-оксазоліл, 5-оксазоліл, 3-ізоксазоліл, 4ізоксазоліл, 5-ізоксазоліл, 2-тіазоліл, 4-тіазоліл, 5-тіазоліл, 2-фурил, 3-фурил, 2-тієніл, 3-тієніл, 2-піридил, 3-піридил, 4-піридил, 2-піримідил, 4-піримідил, 5-бензотіазоліл, пуриніл, 2бензимідазоліл, 5-індоліл, 1-ізохіноліл, 5-ізохіноліл, 2-хіноксалініл, 5-хіноксалініл, 3-хіноліл та 6хіноліл. Замісники для кожної з вищезазначених арильних та гетероарильних циклічних систем вибирають із групи прийнятних замісників, опис яких наведений нижче. [160] Для стислості, термін "арил", у разі застосування у комбінації з іншими термінами (у тому числі, але без обмеження, арилокси-, арилтіоксигрупа, арилалкіл), включає як арильні, так і гетероарильні цикли, які відповідають визначенню наведеному вище. Таким чином, термін "арилалкіл" охоплює ті радикали, у яких арильна група приєднана до алкільної групи (у тому числі, але без обмеження, бензил, фенетил, піридилметил тощо), у тому числі, ті алкільні групи, у яких атом вуглецю (у тому числі, але без обмеження, метиленова група) був замінений, наприклад, атомом кисню (у тому числі, але без обмеження, феноксиметил, 2піридилоксиметил, 3-(1-нафтилокси)пропіл тощо). [161] Кожен із вищезгаданих термінів (у тому числі, але без обмеження, "алкіл", "гетероалкіл", "арил" та "гетероарил") охоплює як заміщені, так і незаміщені форми вказаного радикалу. Приклади замісників для радикалів кожного типу наведені нижче. [162] Замісниками для алкільних та гетероалкільних радикалів (у тому числі для тих груп, які часто позначають як алкіленові, алкенільні, гетероалкіленові, гетероалкенільні, алкінільні, циклоалкільні, гетероциклоалкільні, циклоалкенільні та гетероциклоалкенільні) можуть бути одна або декілька з цілого ряду груп, вибраних з-посеред наведених нижче (але без обмеження ними): -OR', =O, =NR', =N-OR', -NR'R", -SR', -галоген, -SiR'R'R"', -OC(O)R', -C(O)R', -CO2R', CONR'R", -OC(O)NR'R", -NR'C(O)R', -NR'-C(O)NR'R"', -NR'C(O)2R', -NR-C(NR'R'R'")=NR"", -NR 27 UA 103774 C2 5 10 15 20 25 30 35 40 45 50 55 60 C(NR'R")=NR'", -S(O)R', -S(O)2R', -S(O)2NR'R", -NRSO2R', -CN та -NO2 у кількості від нуля до (2m'+1), де m' – загальна кількість атомів вуглецю у такому радикалі. Кожен з R', R", R"' and R"", незалежно від інших, означає водень, заміщений або незаміщений гетероалкіл, заміщений або незаміщений арил, у тому числі, але без обмеження, арил, заміщений 1-3 атомами галогену, заміщений або незаміщений алкіл, алкоксильну або тіоалкоксильну групи чи арилалкільні групи. У разі, коли сполука за цим винаходом містить, наприклад, більше ніж одну R групу, кожна з R груп вибирається незалежно одна від одної, так само, як і кожна з R', R", R'" та R"" груп, у разі, коли присутньою є більше ніж одна із цих груп. У разі, коли R' та R" приєднуються до того самого атому азоту, вони можуть комбінуватись з атомом азоту з утворенням 5-, 6- або 7членного циклу. Наприклад, -NR'R" охоплює (але не обмежується ними) 1-піролідиніл та 4морфолініл. З вищенаведеного обговорення замісників фахівцю у цій галузі зрозуміло, що термін "алкіл" охоплює групи, які містять атоми вуглецю, приєднані до інших груп, окрім гідроксильних груп, таких як галогеналкільна (у тому числі, але без обмеження, -CF3 та -CH2CF3) та ацильною (у тому числі, але без обмеження, -C(O)CH3, -C(O)CF3, -C(O)CH2OCH3 тощо). [163] Подібно до замісників, описаних для алкільного радикалу, існують різні замісники для арильних та гетероарильних груп, які вибирають з-посеред наведених нижче (але без обмеження ними): галоген, -OR', =O, =NR', =N-OR', -NR'R", -SR', -галоген, -SiR'R'R"', -OC(O)R', C(O)R', -CO2R', -CONR'R", -OC(O)NR'R", -NR'C(O)R', -NR'-C(O)NR'R"', -NR'C(O)2R', -NRC(NR'R'R'")=NR"", -NR-C(NR'R")=NR'", -S(O)R', -S(O)2R', -S(O)2NR'R", -NRSO2R', -CN та -NO2, -R', -N3, -CH(Ph)2, фторо(C1-C4)алкокси та фторо(C1-C4)алкіл у кількості від нуля до загального числа відкритих валентностей у ароматичній циклічній системі; і де кожен з R', R", R"' та R"", незалежно від інших, вибирають з-посеред водню, алкілу, гетероалкілу, арилу та гетероарилу. У разі, коли сполука за цим винаходом містить, наприклад, більше ніж одну R групу, кожну з R груп вибирають незалежно одна від одної, так само, як і кожну з R', R", R'" та R"" груп, у разі, коли присутньою є більше ніж одна із цих груп. [164] Словосполучення "модульований період напіввиведення з плазми", яке вживають у цьому описі, означає позитивну або негативну зміну часу знаходження модифікованого bGCSFу кровообізі, порівняно з його немодифікованою формою. Період напіввиведення з плазми визначають шляхом відбирання проб крові у різні моменти часу після введення bG-CSF і визначення концентрації цієї молекули у кожній пробі. Кореляція концентрації у сироватці та часу надає можливість обчислення періоду напіввиведення з плазми. Бажаним є щонайменше двократне підвищення періоду напіввиведення з плазми, але корисним може бути і менше підвищення, наприклад, у тому разі, коли воно забезпечує задовільну схему приймання лікарського засобу або дозволяє уникнути токсичного ефекту. В деяких варіантах здійснення цього винаходу підвищення є щонайменше приблизно трикратним, щонайменше приблизно п'ятикратним або щонайменше приблизно десятикратним. [165] Словосполучення "модульований період напіввиведення терапевтично ефективної кількості", яке вживають у цьому описі, означає позитивну або негативну зміну періоду напіввиведення терапевтично ефективної кількості bG-CSF, порівняно з його немодифікованою формою. Період напіввиведення терапевтично ефективної кількості визначають шляхом визначення фармакокінетичних та/або фармакодинамічних властивостей молекули у різні моменти часу після введення. Підвищений період напіввиведення терапевтично ефективної кількості надає можливість розробки особливо сприятливої схеми приймання лікарського засобу, особливо сприятливої загальної дози та уникання небажаного ефекту. В деяких варіантах здійснення цього винаходу підвищений період напіввиведення терапевтично ефективної кількості є результатом підвищеної активності, підвищеного або зниженого зв'язування модифікованої молекули з мішенню, підвищеного або зменшеного розкладу молекули ферментами, такими як протеази, або підвищення чи зменшення іншого параметра або механізму дії немодифікованої молекули або підвищення чи зниження опосередкованого рецептором кліренсу згаданої молекули. [166] Термін "ізольована(-ий)", у разі застосування у відношенні нуклеїнової кислоти або білка, означає те, що нуклеїнова кислота або білок є вільною(-им) від принаймні деяких клітинних компонентів, з якими вона(він) є пов'язаною(-им) у природному стані, або те, що нуклеїнова кислота або білок була(був) сконцентрована(-ий) до рівня, який перевищував її(його) концентрацію у продукті in vivo або in vitro. Амінокислота(білок) може бути у однорідному стані. Ізольовані речовини можуть бути у сухому або напівсухому стані чи у розчині, у тому числі, але без обмеження, водному розчині. Амінокислота(білок) може бути складовою фармацевтичної композиції, яка містить додаткові фармацевтично прийнятні носії та/або допоміжні речовини. Чистоту і однорідність, як правило, визначають за допомогою методів аналітичної хімії, наприклад, за допомогою електрофорезу у поліакриламідному гелі або високоефективної 28
ДивитисяДодаткова інформація
Назва патенту англійськоюModified bovine g-csf polypeptides and their uses
Автори російськоюHays Putnam, Anna-Maria, A., Knudsen, Nick, Norman, Thea, Koder, Alan, Kraynov, Vadim, Ho, Lillian, Canning, Peter, C.
МПК / Мітки
МПК: C07K 14/535, A61P 11/16, A61K 38/22
Мітки: фактора, бичачого, застосування, поліпептиди, гранулоцитарного, колонієстимулювального, модифіковані, g-csf
Код посилання
<a href="https://ua.patents.su/197-103774-modifikovani-polipeptidi-bichachogo-granulocitarnogo-koloniehstimulyuvalnogo-faktora-g-csf-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Модифіковані поліпептиди бичачого гранулоцитарного колонієстимулювального фактора (g-csf) та їх застосування</a>
Попередній патент: Підшипниковий вузол для валкової дробарки
Випадковий патент: Маслоприймач поворотно-лопатевої гідромашини