Кон’югати фактора іх зі збільшеним часом напівжиття
Формула / Реферат
1. Кон'югат фактора IX і поліетиленгліколю (FIX-ПЕГ), в якому одна або декілька поліетиленгліколевих груп зв'язані з фактором IX через фрагмент, що містить ПЕГ, який з'єднує містком два цистеїнові залишки, які утворюють дисульфідний зв'язок у факторі IX.
2. Кон'югат фактора IX і поліетиленгліколю (FIX-ПЕГ), в якому одна або декілька поліетиленгліколевих груп зв'язані з фактором IX за допомогою фрагмента, що містить ПЕГ, який з'єднує містком один або декілька відновлених цистеїнових дисульфідних зв'язків.
3. Кон'югат FIX-ПЕГ за п. 2, в якому фрагмент, що містить один або декілька ПЕГ, з'єднує містком один або декілька цистеїнових дисульфідних зв'язків відповідно до наступної формули:

в якій R1 являє собою зв'язувальну групу, яка може бути прямим зв'язком, алкіленовою групою (переважно С1-10-алкіленовою групою) або, необов'язково, заміщеною арильною або гетероарильною групою;
в якій арильні групи включають фенільну і нафтильну групи;
в якій прийнятні гетероарильні групи включають піридин, пірол, фуран, піран, імідазол, піразол, оксазол, піридазин, піримідин і пурин;
в якій сполучення з полімером може здійснюватися через гідролітично лабільний зв'язок або через нелабільний зв'язок.
4. Кон'югат FIX-ПЕГ за п. 3, в якому фрагмент, що містить один або декілька ПЕГ, з'єднує містком один або декілька цистеїнових дисульфідних зв'язків відповідно до наступної формули:
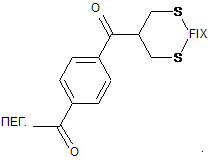
5. Кон'югат FIX-ПЕГ за пп. 1, 2, 3 або 4, в якому фрагмент, що містить один або декілька ПЕГ, має молекулярну вагу 10 kDа.
6. Кон'югат FIX-ПЕГ за пп. 1, 2, 3, 4 або 5, що має один ПЕГ-вмісний фрагмент.
7. Кон'югат FIX-ПЕГ за пп. 1, 2, 3, 4 або 5, що має два ПЕГ-вмісні фрагменти.
8. Композиція, що містить кон'югат за будь-яким з пп. 1-7, яка також містить фармацевтично прийнятний розріджувач, ад'ювант або носій.
9. Композиція за п. 8, яка складена для парентерального введення.
10. Композиція за п. 9, яка придатна для інтрадермальних, підшкірних і внутрішньом'язових ін'єкцій і для внутрішньовенних або внутрішньокісткових інфузій.
11. Композиція, що містить кон'югат за будь-яким з пп. 1-7, яка являє собою розчин, суспензію або емульсію.
12. Кон'югат за будь-яким з пп. 1-4, де кон'югат FIX-ПЕГ має більший час напівжиття в порівнянні з немодифікованим FIX.
13. Кон'югат за будь-яким з пп. 1-4, де кон'югат FIX-ПЕГ має більшу AUC в порівнянні з немодифікованим FIX.
14. Кон'югат за будь-яким з пп. 1-4, де кон'югат FIX-ПЕГ має вищу біодоступність в порівнянні з немодифікованим FIX.
15. Фармацевтична композиція, що містить кон'югат FIX-ПЕГ за будь-яким з пп. 1-7 і фармацевтично прийнятний розріджувач, ад'ювант або носій, для використання в лікуванні гемофілії В.
16. Фармацевтична композиція, що містить кон'югат FIX-ПЕГ за будь-яким з пп. 1-7 і фармацевтично прийнятний розріджувач, ад'ювант або носій, де композиція по суті вільна від фактора ІХа, для використання в зниженні ризику гемартрозу, геморагії, шлунково-кишкової кровотечі і менорагії у ссавців з гемофілією В.
17. Композиція за п. 16, для якої після трьох незалежних експериментів середній показник тромбу складає менше 1.
18. Композиція за п. 16, для якої після трьох незалежних експериментів середній показник тромбу складає менше 0,5.
19. Композиція за п. 16, для якої після трьох незалежних експериментів середній показник тромбу дорівнює 0.
20. Композиція за п. 15, яку вводять підшкірно.
21. Композиція за п. 15, яку вводять внутрішньовенно.
22. Композиція за п. 15, яка приводить до зниження випадків тромбозу в порівнянні з композиціями рекомбінантного фактора IX, що містять вимірювану кількість фактора ІХа.
23. Композиція за п. 15, яку вводять один раз на день.
24. Композиція за п. 15, яку вводять один раз на два дні.
25. Композиція за п. 15, яку вводять в дозуванні від 1 МО до 10000 МО.
26. Композиція за п. 15, яку вводять в дозуванні від 200 МО до 2500 МО.
27. Композиція за п. 15, яку вводять в дозуванні 250 МО, 500 МО, 1000 МО або 2000 МО.
28. Композиція за п. 15, яку вводять в такому дозуванні, що активність фактора IX в кровотоці складає від 1 МО/дл до 150 МО/дл.
29. Композиція за п. 15, яку вводять в такому дозуванні, що активність фактора IX в кровотоці складає від 10 МО/дл до 120 МО/дл.
30. Композиція за п. 15, яку вводять в такому дозуванні, що активність фактора IX в кровотоці складає від 20 МО/дл до 100 МО/дл.
Текст
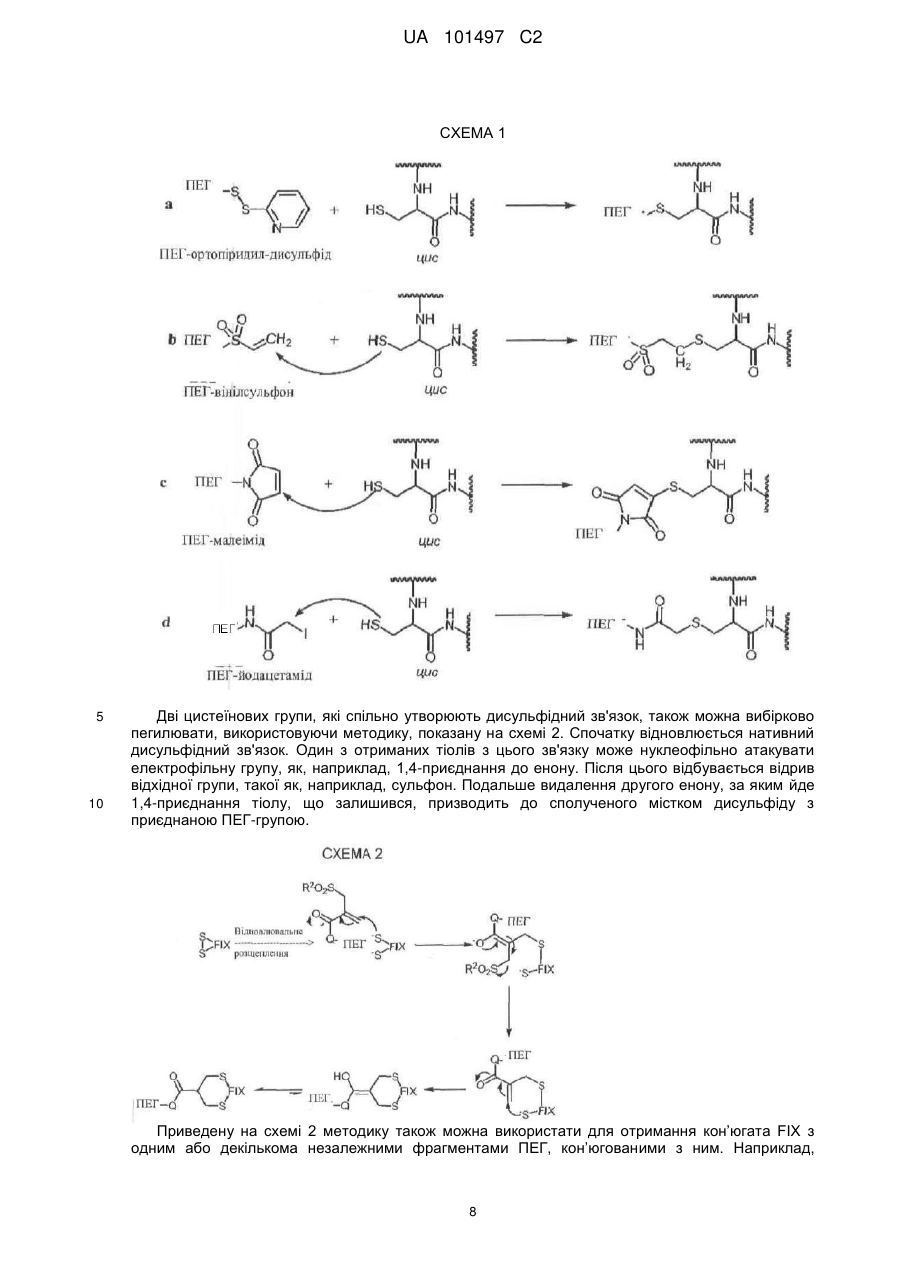
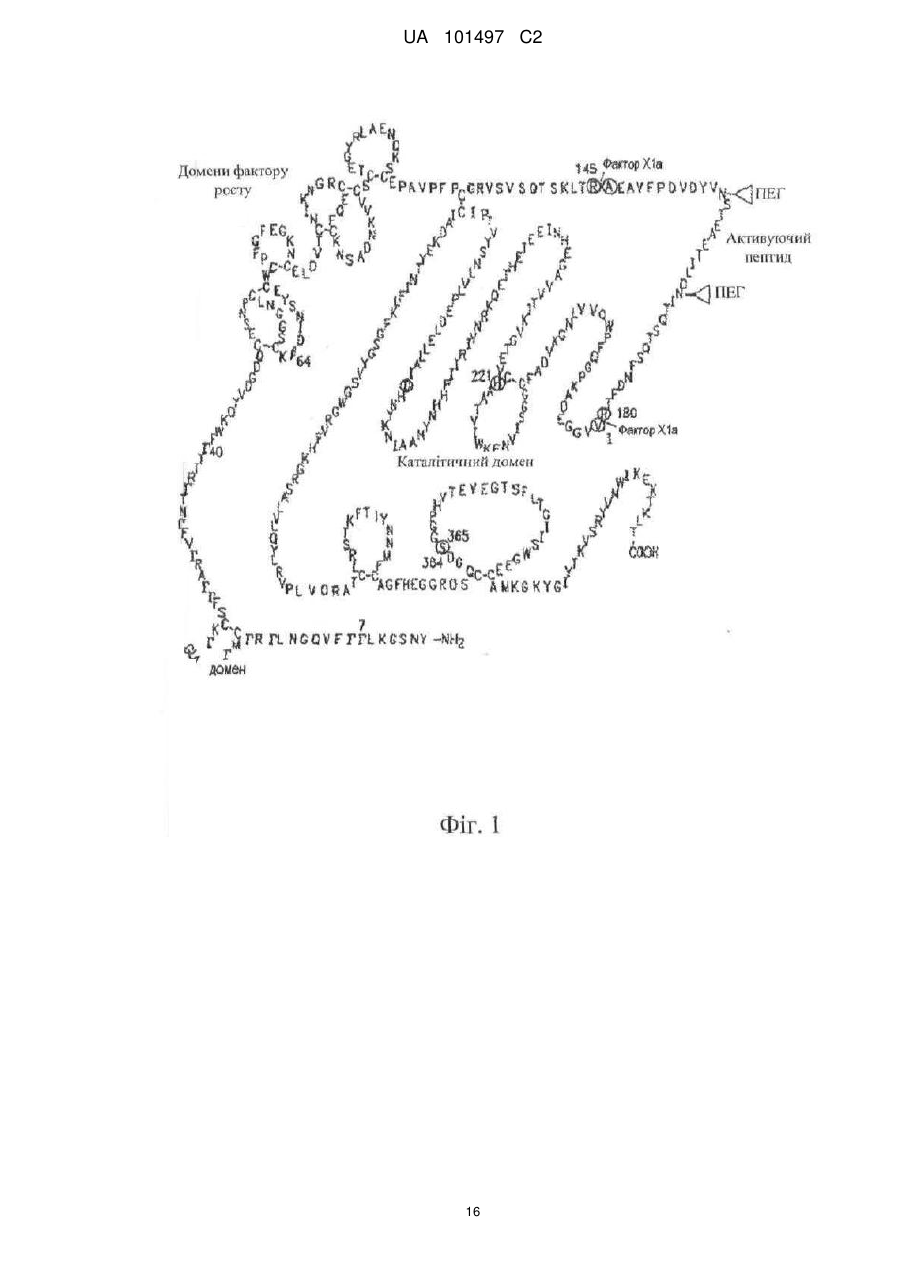
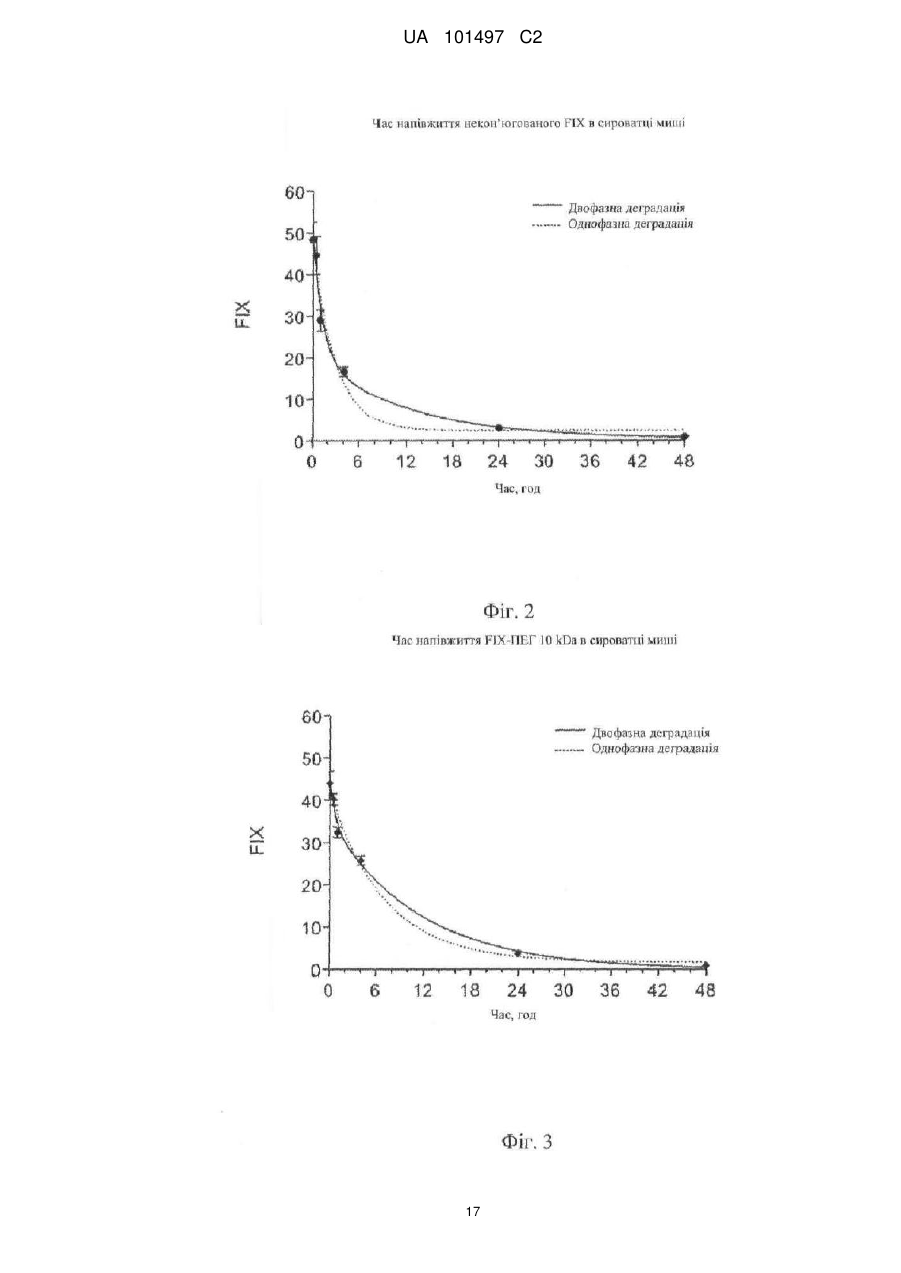
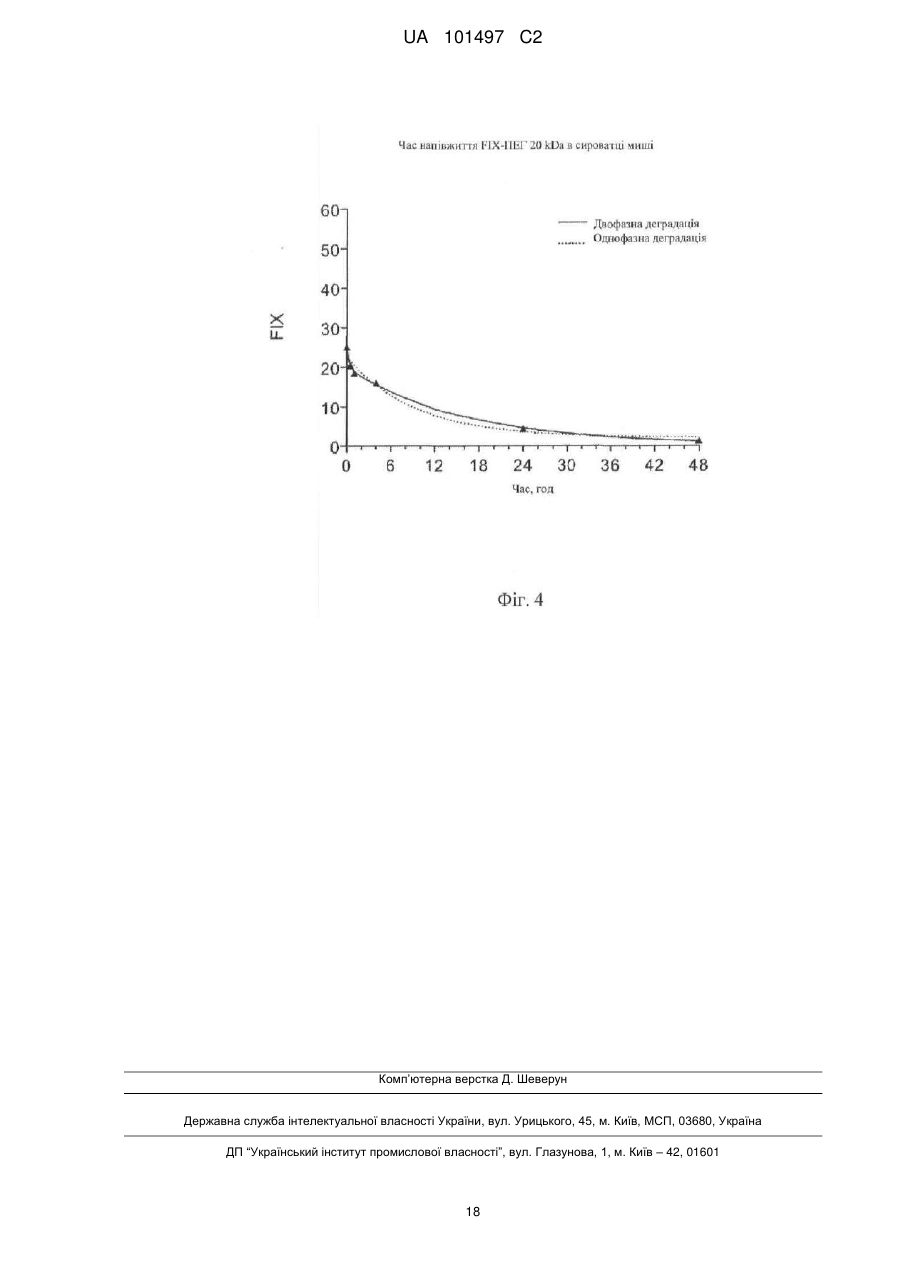
Реферат: Даний винахід належить до кон'югатів фактора IX, які модифіковані для включення біосумісного полімерного фрагмента. Кон'югати фактора IX по суті вільні від забруднення фактором ІХа. Кон'югати фактора IX мають поліпшені фармакокінетичні властивості, такі як збільшений час напівжиття, який дозволяє знизити дозування і частоту введення. UA 101497 C2 (12) UA 101497 C2 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 1. Галузь техніки Даний винахід належить до біосумісних полімерних кон’югатів фактора IX, композицій, що містять кон’югати фактора IX, і способів лікування гемофілії кон’югатами фактора IX. 2. Короткий виклад суті винаходу Автором винаходу було встановлено, що можна поліпшити виготовлення рекомбінантного фактора IX (який далі називається FIX) в результаті кон’югування FIX з одним або декількома біосумісними полімерами так, що можна ефективно відділити FIX від фактора IХа (який далі називається FIXa). Поліпшення характеристик виготовлення також включає можливість отримувати кон’югати FIX високого ступеню чистоти. Кон’югати FIX можуть мати терапевтичну перевагу, наприклад, при порівнянні з некон’югованим FIX. Така терапевтична перевага включає, але не обмежена, збільшений час напівжиття в кровотоці, знижену імуногенність, більш високу активність, менше дозування і можливість альтернативних шляхів введення (наприклад, підшкірно). У даному описі терміни «кон’югат фактора IX» або «кон’югат FIX» належать до фактора IX, який був модифікований для включення біосумісного полімеру, що дало поліпшений фармакокінетичний профіль в порівнянні з немодифікованим фактором IX. Поліпшення фармакокінетичного профілю можна спостерігати як поліпшення одного або декількох наступних параметрів: сила дії, стабільність, площа під кривою і час напівжиття в кровотоці. У конкретному варіанті здійснення винаходу описані в цьому документі кон’югати FIX з високим ступенем чистоти по суті вільні від FIXa. Відносно забруднення композицій FIX навіть слідові кількості FIXа можуть призвести до небезпечного тромбозу згідно зі статтею Gray et al. Thromb. Haemost. 1995, квітень; 73(4):675-9, включеної в даний опис шляхом посилання. Використовуваний в даному описі термін «по суті вільний від FIXа» в контексті очищення FIX і кон’югатів FIX належить до кількості FIXа нижчої 1 Од. FIXа на 1000 МО FIX. Низькі концентрації FIXа можна виміряти за допомогою методики, описаною в статті Gray et al. Thromb. Haemost. 1995, квітень; 73(4):675-9. В деяких варіантах здійснення винаходу кількість домішки FIXа може бути меншою 0,5 Од. на 1000 МО FIX. У деяких варіантах здійснення винаходу кількість домішки FIXа може бути меншою 0,25 Од. на 1000 МО FIX. У деяких варіантах здійснення винаходу кількість FIXа може бути меншою 0,1 Од. на 1000 МО FIX. Кон’югування FIX з біосумісним полімером збільшує можливість розділення кон’югата FIX і FIXа і, тому, збільшує можливість використання FIX в фармацевтичних композиціях. Більш того, біосумісний фрагмент може захищати FIX від деградації і гуморальної імунної відповіді. Кон’югати FIX можуть мати збільшений час напівжиття в кровотоці, що дає в результаті більш тривалий ефект і менш часте введення. У конкретному варіанті здійснення винаходу FIX кон’югований з одним або декількома поліетиленгліколевими (ПЕГ) фрагментами. У іншому конкретному варіанті здійснення винаходу FIX кон’югований з одним або декількома фрагментами полісіалової кислоти. У ще одному конкретному варіанті здійснення винаходу FIX кон’югований з альбуміном. Тому, в першому аспекті винахід належить до одного або декількох біосумісних полімерів, кон’югованих з FIX через один або декілька залишків цистеїну. У варіанті здійснення винаходу один або декілька ПЕГ-фрагментів кон’югований з FIX через один або декілька залишків цистеїну. У одному варіанті здійснення винаходу фрагмент біосумісного полімеру кон’югата FIX може бути пов'язаний з двома залишками цистеїну, які утворюють дисульфідний зв'язок в FIX. Таким чином, лінкер, який містить ПЕГ, з'єднує містком дисульфідний зв'язок. У конкретному варіанті здійснення винаходу біосумісний полімер кон’югований з FIX відповідно до загальної формули I: в якій обидві -S-групи належать залишкам цистеїну, які утворюють дисульфідний зв'язок в FIX, в якому Q являє собою зв'язувальну групу, яка може бути прямим зв'язком, алкіленовою групою (переважно, С1-10-алкіленовою групою) або, необов'язково, заміщеною арильною або гетероарильною групою; в якій арильні групи включають фенільну, бензоїльну або нафтильну групи; в якій прийнятні гетероарильні групи включають піридин, пірол, фуран, піран, імідазол, піразол, оксазол, піридазин, піримідин і пурин; 1 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 в якій сполучення з полімером може здійснюватися через гідролітично лабільний зв'язок або через стабільний зв'язок. Замісники, які можуть бути присутніми на необов'язково заміщеній арильній або гетероарильній групі, включають, наприклад, один або декілька однакових або різних замісників, вибраних з -CN, -NO2, -CO2R, -COH, -CH2OH, -COR, -OR, -OCOR, -OCO2R, -SR, -SOR, -SO2R, NHCOR, -NRCOR, -NHCO2R, -NR'CO2R, -NO, -NHOH, -NR'OH, -C=N-NHCOR, -C=N-NR'COR, + + + + 13 N R3, -N H3, -N HR2, -N H2R, галогену, наприклад фтору або хлору, -C≡CR, -C=CR2 і C=CHR, в яких кожний з R' або R незалежно представляє атом водню або алкільну (переважно, С 1-6) або арильну (переважно, фенільну) групу. Особливо переважна присутність електроноакцепторних замісників. У одному варіанті формули I ПЕГ кон’югований з FIX відповідно до загальної формули II: Кон’югати FIX можна виготувати таким чином, що вони будуть по суті вільні від FIXа. При деяких умовах швидкості реакції FIX і FIXа з біосумісним полімерним субстратом можуть відрізнятися. Без зв'язку з якою-небудь конкретною гіпотезою відмінність в швидкості реакції може бути наслідком різних розмірів (молекулярна вага FIX на 11 kDa вище молекулярної ваги FIXа) і/або різних конформаційних структур FIX і FIXа. На фіг. 1 приведена структура FIX, яка включає активуючий домен, що розщеплюється при активації FIX до FIXа. У результаті, бічний ланцюг амінокислотного залишку, що бере участь в реакції кон’югування в FIX або FIXа може бути більш стерично доступний полімервмісній реакційно-здатній речовині, а більш доступний залишок буде швидше вступати в реакцію з полімервмісною реакційно-здатною речовиною. Ця різниця в реакційній здатності в кінцевому результаті дозволяє кінетичне розділення FIX і FIXa. Одержуваний рекомбінантно FIX може містити малі кількості FIXа як забруднення. Іноді ці кількості можуть бути дуже низькими, близько 1 Од. FIXа на 1000 Од. FIX (Gray et al. Thromb. Haemost. 1995, квітень; 73(4): 675-9). При деяких умовах швидкість утворення кон’югата FIX, такого як FIX-ПЕГ, може бути вищою швидкості утворення FIXа-ПЕГ. У цій ситуації в реакційну суміш можна додати стехіометричну або субстехіометричну кількість ПЕГ-реагенту відносно FIX. У цьому випадку весь ПЕГ-реагент буде використаний для утворення кон’югата FIX-ПЕГ, в той час як FIXа залишається таким, що не прореагував. Властивості кон’югата FIX-ПЕГ, такі як молекулярна вага і полярність, дозволяють легко відділити його від FIXа з використанням відомих в даній галузі методик очищення, що включають, але не обмежених цим, ексклюзійну і/або іонообмінну хроматографію, які можна використовувати на стадії очищення. У деяких умовах швидкість утворення кон’югата FIXа, такого як FIXа-ПЕГ, швидша швидкості утворення FIX-ПЕГ. У цих умовах в реакційну суміш можна додати стехіометрический надлишок ПЕГ-реагенту. У цьому випадку важливо гарантувати, що весь FIXа використаний для утворення FIXа-ПЕГ, в той час як більшість FIX, якщо не весь FIX, залишається непрореагувавшим в некон’югованому стані. Властивості кон’югата FIXа-ПЕГ, такі як молекулярна вага і полярність, дозволяють легко відділити його від некон’югованого FIX з використанням відомих в даній галузі методик. У одному варіанті здійснення винаходу некон’югований FIX очищають ексклюзійною хроматографією або гель-фільтрацією. Отриманий в результаті чистий FIX потім можна кон’югувати з ПЕГ, що дає в результаті чистий кон’югат FIX-ПЕГ. Кон’югати FIX мають один або декілька типів біологічної активності немодифікованого FIX (тобто FIX без приєднаного біосумісного полімеру, такого як, наприклад, ПЕГ). Кон’югат FIX може активуватися in vivo фактором ХIа або VIIa і тканинним фактором, даючи фактор IХа. Біологічну активність кон’югатів FIX можна визначити, використовуючи описані в цьому документі аналітичні методи. У порівнянні з немодифікованим FIX кон’югати FIX за винаходом можуть мати кращі показники по одному або декількох параметрах фармакокінетичного профілю, включаючи площу під кривою (AUC), Cmax, кліренс (CL), час напівжиття, час утримання в плазмі і біодоступність, в порівнянні з немодифікованим FIX. 2 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуваний в даному описі термін «площа під кривою» або «AUC» в контексті введення пептидного лікарського препарату пацієнту визначена як загальна площа під кривою, що описує концентрацію лікарського препарату в кровотоці пацієнта як функцію часу від нуля до нескінченності. Використовуваний в даному описі термін «кліренс» або «нирковий кліренс» визначений як об'єм плазми, який містить кількість лікарського препарату, що виводиться за хвилину. Використовуваний в даному описі термін «час напівжиття» або «t1/2» в контексті введення пептидного лікарського препарату пацієнту визначений як час, який необхідний для зниження концентрації лікарського препарату в плазмі пацієнта наполовину. З пептидним лікарським препаратом може бути асоційоване більше одного значення часу напівжиття в залежності від декількох механізмів кліренсу, розподілу і інших відомих в даній галузі механізмів. Звичайно альфа і бета часу напівжиття визначені таким чином, що альфа-фаза асоційована з розподілом, а бета-фаза асоційована з кліренсом. Однак для білкових лікарських препаратів, які, в основному, обмежені кровотоком, може бути щонайменше два часи напіввиведення. Точний вплив пегилювання на альфа-фазу і бета-фазу часу напівжиття буде, як відомий в даній галузі, залежати від розміру отримуваної сполуки і інших параметрів. Подальший опис «часу напівжиття» знаходиться в Pharmaceutical Biotechnology (1997, DFA Crommelin and RD Sindelar, eds., Harwood Publishers, Amsterdam, pp 101-120). Використовуваний в даному описі термін «час утримання» в контексті введення пептидного лікарського препарату пацієнту визначений як середній час, протягом якого лікарський препарат залишається в організмі пацієнта після введення препарату. Композиції, що містять кон’югати FIX, по суті вільні від FIXа, мають підвищену безпеку. Крім того, менш ймовірно, що композиції, що містять кон’югати FIX, будуть призводити до тромбозу. У визначеному варіанті здійснення винаходу менш ймовірно, що композиції, які містять чисті кон’югати FIX, будуть призводити до венозного тромбозу. У ще одному визначеному варіанті здійснення винаходу менш ймовірно, що композиції, які містять чисті кон’югати FIX, будуть призводити до артеріального тромбозу. Кон’югати FIX за даним винаходом придатні для лікування гемофілії В. Використовувані в даному описі терміни «лікувати», «що лікує» або «лікування» означають, що тяжкість стану суб'єкта зменшена або стан, щонайменше частково, поліпшений або полегшений, і/або що отримане деяке поліпшення, зменшення або зниження щонайменше одного клінічного симптому, і/або що інгібується або затримується розвиток патологічного стану і/або затримується початок хвороби або захворювання. Терміни «лікувати», «що лікує» або «лікування» також означають контроль стану хвороби, наприклад гемофілії В. Кон’югати FIX за винаходом придатні для лікування пацієнтів, які страждають на гемофілію В, забезпечуючи цих пацієнтів фактором IX, що включає в себе введення терапевтично ефективної кількості кон’югата FIX і описаних в цьому документі композицій. Використовуваний в даному описі термін «терапевтично ефективна кількість» являє собою кількість, яка забезпечує деяке поліпшення або ефект у пацієнта. Іншими словами, «терапевтично ефективна кількість» являє собою кількість, яка забезпечує деяке поліпшення, зменшення або зниження щонайменше одного клінічного симптому. Фахівцям в даній галузі добре відомі асоційовані із захворюванням клінічні симптоми, які можна лікувати способами за винаходом. Крім того, для фахівців в даній галузі буде ясно, що терапевтичні ефекти не повинні бути повними або призводити до видужування за умови забезпечення деякого позитивного ефекту. У конкретному варіанті здійснення винаходу композиції, що містять кон’югат FIX, вільний від FIXа, забезпечують спосіб лікування гемофілії В зі зниженим ризиком тромбозу, підтвердженим зниженням середнього показника тромбу. Використовується в даному описі «середній показник тромбу» визначений нижче. Тромби можна оцінювати по шкалі від 0 до 4. Показник 0 являє собою повністю рідку кров; присутність дрібних фібринових точок оцінюється як 1, дещо більші шматочки згустків оцінюються як 2; згусток, який частково перекриває просвіт, оцінюється як 3, а оцінка 4 являє собою повністю затверділий сегмент. Середній показник тромбу повинен бути визначений з трьох або більше незалежних експериментів по протоколу зі статті Wessler et al., J. Appl. Physiol. 14:943-946 (1959). У іншому визначеному варіанті здійснення винаходу поліпшені властивості кон’югатів FIX забезпечують спосіб профілактичного лікування гемофілії В. В ще одному визначеному варіанті здійснення винаходу композиції, що містять кон’югат FIX, можна вводити пацієнтам, які страждають на гемофілію В, які піддаються хірургічному втручанню або відновлюються після хірургічного втручання. 3 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 55 60 Введення кон’югатів FIX пацієнту для лікування гемофілії В можна об'єднати з іншими терапевтичними препаратами, такими як транексамова кислота, амінокапронова кислота, фактор II (протромбін) і/або фактор Х (фактор Стюарта Прауера). Описані в цьому документі кон’югати FIX можна ввести до складу з фармацевтично прийнятним носієм. Використовуваний в даному описі термін «фармацевтично прийнятний» при використанні відносно складів за даним винаходом означає, що склад не викликає неприйнятного рівня подразнення у суб'єкта, якому вводять склад за будь-якою відомою схемою введення. Приклади подразнення включають реакції гіперчутливості на FIX. Завдяки збільшенню часу напівжиття кон’югатів FIX фармацевтичні композиції можуть містити більш низьку дозу FIX, ніж ті, які звичайно вводяться для ефективного лікування гемофілії. Фармацевтичні склади за винаходом можуть бути складені для парентерального введення, що включає, але не обмеженого цим, інтрадермальні, підшкірні і внутрішньом'язові ін'єкції, і внутрішньовенні або внутрішньокісткові інфузії. Фармацевтичні склади за даним винаходом можуть приймати форму розчинів, суспензій, емульсій, які включають кон’югат FIX, такий як FIX-ПЕГ, і фармацевтично прийнятний розріджувач, ад’ювант або носій в залежності від шляху введення. Фармацевтичні композиції за винаходом складені для доставки терапевтичної дози кон’югата FIX. Дозування кон’югата FIX можна виразити в міжнародних одиницях (МО). Використовуваний в даному описі термін №міжнародна одиниця» або «МО» належить до оцінки ефективності по міжнародному стандарту Всесвітньої Організації Охорони здоров'я. За цією оцінкою одна МО активності фактора IX на кг ваги тіла приблизно дорівнює активності фактора IX в 1 мл пульованої нормальної плазми людини і збільшує концентрацію фактора IX в плазмі на 1%. Доза кон’югатів FIX, що містяться в фармацевтичному складі, може знаходитися в діапазоні від 1 МО до 10000 МО. У деяких варіантах здійснення винаходу доза кон’югата FIX може знаходитися в діапазоні від 100 МО до 5000 МО, або від 200 МО до 2500 МО. У деяких варіантах здійснення винаходу доза кон’югата FIX може становити приблизно 250 МО, приблизно 500 МО, приблизно 1000 МО або приблизно 2000 МО. Кон’югат FIX вводять в кількості, достатній для лікування гемофілії В. Використовуваний в даному описі термін «достатня кількість» або «кількість, достатня для» досягнення певного результату, належить до кількості кон’югата FIX, яка ефективна для отримання бажаного ефекту, який, необов'язково, являє собою терапевтичний ефект (тобто в результаті введення терапевтично ефективної кількості). Наприклад, «достатня кількість» або «кількість, достатня для» може являти собою кількість, яка ефективна для зниження ризику гемартрозу, геморагії, шлунково-кишкової кровотечі і менорагії. У деяких варіантах здійснення дозування кон’югата FIX є достатнім для того, щоб активність фактора IX в кровотоці складала від 1 МО/кг до 150 МО/кг. У іншому варіанті здійснення винаходу композицію вводять в такому дозуванні, щоб активність фактора IX в кровотоці складала від 10 МО/кг до 120 МО/кг. У іншому варіанті здійснення винаходу композицію вводять в такому дозуванні, щоб активність фактора IX в кровотоці складала від 20 МО/кг до 100 МО/кг. Кон’югати за винаходом можна використовувати таким же чином, як і немодифікований FIX. Однак завдяки поліпшеним властивостям кон’югатів FIX фармацевтичні склади за винаходом можна вводити рідше некон’югованого FIX. Наприклад, кон’югати FIX можна вводити один раз на тиждень замість одного разу на день для немодифікованого рекомбінантного FIX. Даний винахід також охоплює схеми дозування, в яких для ефективного лікування гемофілії В похідні FIX можна вводити двічі на день, один раз на день, один раз кожні два, три або чотири дні, або один раз на тиждень. Очікується, що зниження частоти введення в результаті забезпечить краще дотримання пацієнтами схем лікування, що призведе до кращих результатів лікування, а також до поліпшення якості життя пацієнта. 3. Короткий опис креслень На фіг. 1 представлене схематичне зображення фактора IX, на якому приведена амінокислотна послідовність, структура і різні домени. На фіг. 2 показаний час напівжиття в кровотоці некон’югованого FIX-ПЕГ в сироватці миші. На фіг. 3 показаний час напівжиття FIX-ПЕГ 10 kDa в сироватці миші. На фіг. 4 показаний час напівжиття FIX-ПЕГ 20 kDa в сироватці миші. 4. Докладний опис винаходу У даному винаході описаний FIX, кон’югований з одним або декількома біосумісними полімерами з метою отримання кон’югата FIX, який по суті вільний від FIXа. Описані в цьому документі кон’югати FIX також мають поліпшені біологічні і фармакокінетичні властивості, що включають, але необмежені цим, збільшений час напівжиття в кровотоці або час утримання в 4 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 55 60 плазмі, в порівнянні з немодифікованим FIX. Крім того, описані в цьому документі кон’югати менш сприйнятливі до гуморальної відповіді. Даний винахід також належить до способів отримання таких кон’югатів. У визначеному варіанті здійснення винаходу кон’югатом FIX є кон’югат FIX-ПЕГ. Даний винахід додатково належить до способів застосування кон’югатів FIX для лікування гемофілії В. Винахід, зокрема, належить до кон’югатів FIX, в які біосумісний полімер кон’югований з одним або декількома залишками цистеїну. У одному варіанті здійснення винаходу кон’югатом є кон’югат FIX-ПЕГ, в якому одна або декілька ПЕГ-груп кон’юговані з FIX через один або декілька цистеїнових залишків. У визначеному варіанті здійснення винаходу кон’югат FIX-ПЕГ містить одну або декілька ПЕГ-груп, одночасно пов'язаних з двома цистеїновими залишками, які утворюють дисульфідний зв'язок в ПЕГ. Ці кон’югати можна отримати відновним розщепленням дисульфідного зв'язку з подальшою реакцією, в якій фрагмент ПЕГ зв'язується з обома тіогрупами. Отриманий кон’югат FIX містить фрагмент ПЕГ, який з'єднує містком дві сірки, які раніше утворювали дисульфідний зв'язок. Композиції за винаходом містять кон’югати FIX-ПЕГ, які по суті вільні від FIXа. Композиції за винаходом мають менший показник тромбу в порівнянні з композиціями, які містять слідові забруднення FIXа, тим самим знижуючи ризик тромболітичних виявів, включаючи, але не обмежених цим, венозний і/або артеріальний тромбоз. Даний винахід також належить до способу очищення FIX від FIXа, в якому використовується перевага різних швидкостей утворення кон’югатів FIX відносно кон’югатів FIXа в реакції кон’югування з фрагментами біосумісного полімеру. Це призводить до кінетичного розділення FIX і FIXа. У одному варіанті здійснення винаходу біосумісним полімером є ПЕГ. Кон’югати FIX за даним винаходом мають поліпшений фармакокінетичний профіль в порівнянні з немодифікованим FIX. Іншим аспектом винаходу є спосіб лікування гемофілії В, що включає в себе введення потребуючому цього пацієнту фармацевтичної композиції, що містить кон’югат FIX-ПЕГ і фармацевтично прийнятний розріджувач, ад’ювант або носій. Використовуваний в даному описі відносно введення кон’югатів FIX термін «потребуючий цього пацієнт» належить до пацієнта, у якого був поставлений діагноз гемофілії В і/або дефіциту фактора IX. 4.1 Рекомбінантний фактор IX Для отримання похідних і кон’югування за даним винаходом передбачений рекомбінантний фактор IX, отриманий будь-якими способами, відомими в даній галузі. Переважно отримувати FIX, використовуючи способи, викладені в одному або декількох з наступних патентів і публікацій, кожний з яких повністю включений шляхом посилання: патенти США №№ 5268275, 5171569, 5888809, 6531298; міжнародні патентні публікації №№ WO 2005/030039, WO 2006/101474, WO 2006/089613; публікації заявок США №№ 2003/0220247, 2005/0271644, 2006/0121574 і 2006/0194284. У деяких варіантах здійснення винаходу FIX ліофілізований або висушений при заморожуванні. У переважних варіантах здійснення винаходу FIX не ліофілізований або не висушений при заморожуванні. У деяких варіантах здійснення винаходу до FIX додають кріопротектори, наприклад, сахарозу або трегалозу. У переважних варіантах здійснення винаходу до FIX не додають кріопротектори, наприклад, сахарозу або трегалозу. 4.2 Кон’югати фактора IX У порівнянні з немодифікованим FIX кон’югати FIX за винаходом можуть мати кращі показники по одному або декільком параметрах фармакокінетичного профілю, включаючи площу під кривою (AUC), Cmax, кліренс (CL), час напівжиття, час утримання в плазмі і біодоступність. Кон’югати FIX можуть мати більшу клінічну активність in vivo в порівнянні з немодифікованим FIX. Кон’югати за винаходом можуть мати збільшені силу дії і стабільність. Очищення і виділення описаних в цьому документі кон’югатів FIX від FIXа можна провести відомими в даній галузі хроматографічними способами. Способи включають, але не обмежені, іонообмінну хроматографію і ексклюзійну хроматографію. Кон’югати FIX за винаходом можуть мати один або декілька типів біологічної активності немодифікованого FIX. Кон’югати FIX можуть активуватися in vivo фактором XIа або VIIa і тканинним фактором, даючи фактор IХа. Біологічну активність кон’югатів FIX можна визначити, використовуючи описані в цьому документі методи аналізу. FIX для модифікування за винаходом можна отримати і виділити з природних джерел, таких як плазма людини. FIX для модифікування за винаходом можна отримати рекомбінантною експресією. У одному варіанті здійснення винаходу FIX-компонент кон’югата має послідовність FIX людини, показану на фіг. 1. Як альтернатива послідовність FIX можна модифікувати або 5 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 отримати її похідні для включення однієї або декількох змін в амінокислотну послідовність, включаючи вставки, делеції або заміни. Кон’югат FIX-ПЕГ може призвести до збільшення часу напівжиття в кровотоці і часі утримання в плазмі, зниження кліренсу і збільшення клінічної активності in vivo. FIX можна модифікувати ковалентним приєднанням поліетиленгліколевого полімеру через один або декілька його амінокислотних залишків, включаючи, але не обмежених цим, лізин, гістидин, аргінін, аспарагінову кислоту, глутамінову кислоту, серин, цистеїн, а також N-кінцеві α- аміно і Скінцеві карбоксильні групи білка. Поліетиленгліколеві полімерні одиниці можуть бути лінійними або розгалуженими. Кон’югат FIX-ПЕГ можна вводити внутрішньовенно або підшкірно за допомогою ін'єкції. Кон’югат FIX-ПЕГ також можна ввести до складу таблетки, капсули, розчину або суспензії для перорального введення. Одним аспектом винаходу є кон’югат FIX-ПЕГ, в якому ПЕГ пов'язаний з однією або декількома аміногрупами FIX. Іншим аспектом винаходу є кон’югат FIX-ПЕГ, в якому поліетиленгліколевий полімер пов'язаний з однією або декількома карбоксильними групами FIX. Іншим аспектом винаходу є кон’югат FIX-ПЕГ, в якому поліетиленгліколевий полімер пов'язаний з однією або декількома спиртовими групами FIX. У визначеному варіанті здійснення винаходу ПЕГ-вмісний фрагмент може бути пов'язаний з тіольним бічним ланцюгом цистеїну. У іншому визначеному варіанті здійснення винаходу ПЕГ-вмісний фрагмент може з'єднувати містком дві тіольні групи цистеїнів, які утворюють дисульфідний зв'язок в природному FIX. Іншим аспектом винаходу є кон’югат FIX-ПЕГ, в якому поліетиленгліколевий полімер пов'язаний із залишком лізину. ε-аміногрупу лізину можна легко пегилювати за допомогою ряду методик, які включають, але не обмежених цим, алкілування і ацилування. Іншим аспектом винаходу є кон’югат FIX-ПЕГ, в якому поліетиленгліколевий полімер пов'язаний з N-кінцевою α-аміногрупою. Кон’югат N-кінцевого α-амінозалишку FIX і ПЕГ можна отримати за допомогою ряду методик, що включають, але не обмежених цим, алкілування або ацилування N-кінцевої α-аміногрупи. Іншим аспектом винаходу є кон’югат FIX, який містить один або декілька кон’югованих з ПЕГ залишків цистеїну. Приєднання молекули ПЕГ до залишку цистеїну може вимагати розщеплення дисульфідного (- S-S-) зв'язку. У одному варіанті здійснення винаходу один або декілька біосумісних полімерів приєднані до FIX через один або декілька цистеїнових залишків. У визначеному варіанті здійснення винаходу біосумісний полімерний фрагмент кон’югата FIX пов'язаний з двома залишками цистеїну, які утворюють дисульфідний зв'язок в FIX. У іншому визначеному варіанті здійснення винаходу ПЕГ-полімер кон’югований з FIX відповідно до загальної формули: в якій Q являє собою зв'язувальну групу, яка може бути прямим зв'язком, алкіленовою групою (переважно, С1-10-алкіленовою групою) або, необов'язково, заміщеною арильною або гетероарильною групою; в якій арильні групи включають фенільну і нафтильну групи; в якій прийнятні гетероарильні групи включають піридин, пірол, фуран, піран, імідазол, піразол, оксазол, піридазин, піримідин і пурин; в якій сполучення з полімером може здійснюватися через гідролітично лабільний зв'язок або через нелабільний зв'язок. Замісники, які можуть бути присутніми на необов'язково заміщеній арильній або гетероарильній групі, включають, наприклад, один або декілька однакових або різних замісників, вибраних з CN, -NO2, -CO2R, -COH, -CH2OH, -COR, -OR, -OCOR, -OCO2R, -SR, -SOR, -SO2R, NHCOR, -NRCOR, -NHCO2R, -NR'CO2R, -NO, -NHOH, -NR'OH, -C=N-NHCOR, -C=N-NR'COR, + + + + 13 N R3, -N H3, -N HR2, -N H2R, галогену, наприклад фтору або хлору, -C≡CR, -C=CR2 і C=CHR, в яких кожний з R' або R незалежно представляє атом водню або алкільну (переважно, С 1-6) або арильну (переважно, фенільну) групу. Особливо переважна присутність електроноакцепторних замісників. У ще одному визначеному варіанті здійснення винаходу ПЕГ кон’югований з FIX відповідно до загальної формули: 6 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 Існує декілька різних типів поліетиленгліколевих полімерів, які будуть утворювати кон’югати з FIX. Існують лінійні ПЕГ-полімери, які містять єдиний поліетиленгліколевий ланцюг, і існують розгалужені або з бічними відгалуженнями ПЕГ-полімери. Розгалужені поліетиленгліколі містять 2 або декілька окремих лінійних ланцюгів ПЕГ, пов'язаних разом через зв’язувальну групу. Наприклад, два ПЕГ-полімери можуть бути пов'язані один з одним залишком лізину. Один лінійний ланцюг ПЕГ пов'язаний з α-аміногрупою, в той час як інший ланцюг ПЕГ пов'язаний з εаміногрупою. Карбоксильна група лізину, яка залишилася, залишається доступною для ковалентного приєднання білка. У продажу доступні як лінійні, так і розгалужені поліетиленгліколеві полімери з різною молекулярною вагою. У одному аспекті винаходу кон’югат FIX-ПЕГ містить один або декілька лінійних поліетиленгліколевих полімерів, пов'язаних з FIX, причому кожний ПЕГ має молекулярну вагу від приблизно 2 kDa до приблизно 100 kDa. У іншому аспекті винаходу кон’югат FIX-ПЕГ містить один або декілька лінійних поліетиленгліколевих полімерів, пов'язаних з FIX, причому кожний ПЕГ має молекулярну вагу від приблизно 5 kDa до приблизно 40 kDa. У деяких варіантах здійснення винаходу кожний лінійний ПЕГ має молекулярну вагу від приблизно 5 kDa до приблизно 20 kDa. У деяких варіантах здійснення винаходу кожний лінійний ПЕГ має молекулярну вагу, що становить приблизно 10 kDa. У деяких варіантах здійснення винаходу кожний лінійний ПЕГ має молекулярну вагу, що складає менше приблизно 10 kDa. У окремих варіантах здійснення винаходу кон’югат FIX-ПЕГ містить більше одного лінійного ПЕГ-полімеру, пов'язаного з FIX, наприклад, два, три або чотири лінійних ПЕГ-полімери, пов'язаних з FIX. У деяких варіантах здійснення винаходу кон’югати FIX-ПЕГ містять два лінійних ПЕГ-полімери, причому кожний лінійний ПЕГ має молекулярну вагу приблизно 10 kDa. Кон’югат FIX-ПЕГ за даним винаходом може містити один або декілька розгалужених ПЕГполімерів, пов'язаних з FIX, причому кожний розгалужений ПЕГ має молекулярну вагу від приблизно 2 kDa до приблизно 100 kDa. У іншому аспекті винаходу кон’югат FIX-ПЕГ містить один або декілька розгалужених поліетиленгліколевих полімерів, пов'язаних з FIX, причому кожний розгалужений FIX має молекулярну вагу від приблизно 5 kDa до приблизно 40 kDa. У деяких варіантах здійснення винаходу кожний розгалужений ПЕГ має молекулярну вагу від приблизно 5 kDa до приблизно 20 kDa. У деяких варіантах здійснення винаходу кожний розгалужений ПЕГ має молекулярну вагу, що становить приблизно 10 kDa. У деяких варіантах здійснення винаходу кожний розгалужений ПЕГ має молекулярну вагу, що складає менше приблизно 10 kDa. У окремих варіантах здійснення винаходу кон’югат FIX-ПЕГ містить більше одного розгалуженого ПЕГ-полімеру, пов'язаного з FIX, наприклад, два, три або чотири розгалужених ПЕГ-полімерів, пов'язаних з FIX. У деяких варіантах здійснення винаходу кон’югати FIX-ПЕГ містять два розгалужених ПЕГ-полімери, причому кожний лінійний ПЕГ має молекулярну вагу приблизно 10 kDa. Очищення кон’югатів FIX-ПЕГ можна провести відомими в даній галузі хроматографічними способами, що включають, але не обмежені, іонообмінну хроматографію і ексклюзійну хроматографію. 4.3 Способи отримання похідних фактора IX 4.3.1 Методики пегилювання цистеїнових залишків У даній галузі існує ряд способів для утворення кон’югатів залишків цистеїну з поліетиленгліколем або пегильованих залишків цистеїну. Перевага цих методик полягає в тому, що вони вибіркові відносно цистеїну, що означає, що ці способи не торкаються інших бічних ланцюгів. На схемі 1a активований дисульфід, ПЕГ-орто-піридил-дисульфід, вступає в реакцію з тіолами, утворюючи більш стабільний симетричний дисульфід. На схемі 1b залишок цистеїну вступає в реакцію з ПЕГ-малеамідом через приєднання тіолу до активованого подвійного зв'язку в реакції приєднання по Міхаелю. На схемі 1с тіол атакує кон’югат по активованій кінцевій вінільній групі ПЕГ-вінілсульфону, даючи пегильований залишок цистеїну. На схемі 1d тіол цистеїну замінює молекулу йоду в результаті нуклеофільної атаки, даючи кон’югований з ПЕГ залишок цистеїну. 7 UA 101497 C2 СХЕМА 1 5 10 Дві цистеїнових групи, які спільно утворюють дисульфідний зв'язок, також можна вибірково пегилювати, використовуючи методику, показану на схемі 2. Спочатку відновлюється нативний дисульфідний зв'язок. Один з отриманих тіолів з цього зв'язку може нуклеофільно атакувати електрофільну групу, як, наприклад, 1,4-приєднання до енону. Після цього відбувається відрив відхідної групи, такої як, наприклад, сульфон. Подальше видалення другого енону, за яким йде 1,4-приєднання тіолу, що залишився, призводить до сполученого містком дисульфіду з приєднаною ПЕГ-групою. Приведену на схемі 2 методику також можна використати для отримання кон’югата FIX з одним або декількома незалежними фрагментами ПЕГ, кон’югованими з ним. Наприклад, 8 UA 101497 C2 5 10 відновлення першого нативного дисульфідного зв'язку проходить в контрольованих умовах, добре відомих в даній галузі. Потім, відповідно до схеми 2, до фактора приєднується перший фрагмент ПЕГ. Далі відбувається відновлення другого дисульфідного зв'язку, наприклад, при більш повних відновних умовах, добре відомих в даній галузі. Потім до фактора приєднується другий фрагмент ПЕГ, знову відповідно до схеми 2. Цю багатостадійну процедуру можна повторювати по мірі необхідності. 4.3.2 Способи отримання високочистого FIX Кон’югування FIX з біосумісними полімерами надає спосіб отримання високочистих кон’югатів FIX. Зокрема, особливо переважні способи утворення кон’югатів FIX в присутності FIXa без утворення кон’югатів FIXa. Кон’югати FIX можна легко відділити від FIXa хроматографічними способами, такими як іонообмінна або ексклюзійна хроматографія. У одному варіанті здійснення винаходу швидкість утворення FIX-ПЕГ перевищує швидкість утворення FIXа-ПЕГ. На схемі 3 нижче показана реакція вибіркового кон’югування FIX. 15 20 25 30 35 40 45 50 До реакційної суміші FIX в присутності слідових кількостей FIXa додають стехіометричну кількість ПЕГ-реагенту. У одному варіанті здійснення винаходу співвідношення ПЕГ-реагенту до FIX в реакційній суміші складає від приблизно 0,1 до приблизно 1,5. У іншому варіанті здійснення винаходу співвідношення ПЕГ-реагенту до FIX складає від приблизно 0,1 до приблизно 1,0. У іншому варіанті здійснення винаходу співвідношення ПЕГ-реагенту до FIX складає від приблизно 1,0 до приблизно 1,5. У іншому варіанті здійснення винаходу співвідношення ПЕГ-реагенту до FIX складає від приблизно 0,1 до приблизно 0,5. У іншому варіанті здійснення винаходу співвідношення ПЕГ-реагенту до FIX складає від приблизно 0,5 до приблизно 0,7. У іншому варіанті здійснення винаходу співвідношення ПЕГ-реагенту до FIX складає від приблизно 0,7 до приблизно 1,0. У одному варіанті здійснення винаходу ПЕГ-реагент можна додати до реакційної суміші відразу. У іншому варіанті здійснення винаходу ПЕГ-реагент додають повільно і поступово. ПЕГреагент можна додавати протягом періоду часу до приблизно 1, 2, 6, 12, 18 або 24 годин. Проходження реакції можна контролювати способами, що включають, але не обмеженими цим, мас-спектроскопію, швидку рідинну хроматографію білка (FPLC) або електрофорез в додецилсульфат-поліакриламідному гелі (SDS-PAGE). Важливо гарантувати, що FIXа не перетворюється в кон’югат FIXa-ПЕГ. У одному варіанті здійснення винаходу FIX практично кількісно перетворюється в FIX-ПЕГ. У іншому варіанті здійснення винаходу FIX перетворюється в FIX-ПЕГ з ефективністю приблизно від 80% до 90%, від 70% до 80%, від 60% до 70%, від 50% до 60%, від 40% до 50%, від 30% до 40%, від 20% до 30% або від 10% до 20%. FIX, який не прореагував, можна використовувати повторно в додаткових реакціях кон’югування. Кон’югат FIX-ПЕГ можна легко відділити від реакційної суміші за допомогою іон-афінної або ексклюзійної хроматографії. Після стадії розділення важливо гарантувати, що отримуваний в результаті кон’югат FIX-ПЕГ по суті вільний від FIXa. Це можна підтвердити способами, описаними в Gray et al. Thromb. Haemost. 1995, квітень; 73(4):675-9, або способами з розділу 5.3 нижче. У іншому варіанті здійснення винаходу швидкість утворення кон’югата FIXа-ПЕГ вища швидкості утворення FIX-ПЕГ. FIX, який не прореагував, потім відділяють від кон’югата FIXaПЕГ хроматографічними способами, описаними в цьому документі. Для отримання чистого FIXПЕГ з очищеним FIX, що залишився, можна провести додаткову реакцію пегилювання. На схемі 4 показано, як в цих обставинах можна синтезувати очищений FIX-ПЕГ. У цих умовах до реакційної суміші можна додати стехіометричний надлишок ПЕГ-реагенту відносно FIXа. У одному варіанті здійснення винаходу співвідношення ПЕГ-реагенту до FIXа в реакційній суміші складає від приблизно 100 до приблизно 1000. У іншому варіанті здійснення винаходу співвідношення ПЕГ-реагенту до FIXа складає від приблизно 10 до приблизно 100. У іншому варіанті здійснення винаходу співвідношення ПЕГ-реагенту до FIXа складає від приблизно 1,1 до приблизно 10. 9 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 55 60 Важливо гарантувати, що вся кількість FIXa була використана в утворенні FIXa-ПЕГ. Властивості кон’югата FIXa-ПЕГ, такі як молекулярна вага і полярність, дозволяють легко відділити його від некон’югованого FIX, використовуючи відомі в даній галузі методики. У одному варіанті здійснення винаходу некон’югований FIX очищають ексклюзійною хроматографією або гель-фільтрацією. 4.4 Способи аналізу біологічної активності Кон’югати FIX за винаходом мають один або декілька типів біологічної активності немодифікованого FIX. Способи визначення активності кон’югата FIX, отриманого за способами даного винаходу, можна провести, використовуючи добре відомі в даній галузі способи, такі як одностадійний метод активованого часткового тромбопластинового часу, описаний, наприклад, в Biggs (1972, Human Blood Coagulation Haemostasis and Thrombosis (Ed. 1), Oxford, Blackwell, Scientific, pg. 614). Стисло, для аналізу біологічної активності кон’югата FIX, утвореного за способами даного винаходу, аналіз можна провести з однаковими об'ємами активованого часткового тромбопластинового реагенту, плазмою, яка позбавлена FIX, виділеною з крові пацієнта з гемофілією В з використанням добре відомих в даній галузі методик стерильної флеботомії, і нормальною пульованою плазмою як стандартом або зразком. У цьому аналізі одну одиницю активності визначають як кількість активності, присутньої в одному мілілітрі нормальної пульованої плазми. Додатково можна провести аналіз біологічної активності, оснований на здатності FIX зменшувати час згортання плазми у пацієнтів з дефіцитом FIX до норми, як описано, наприклад, в Proctor and Rapaport (1961, Amer. J. Clin. Path. 36: 212). Біологічну активність кон’югатів FIX для гарантії відсутності забруднення FIXa можна визначити, використовуючи методи аналізу, описані також в секції 5.3. 4.4.1 Фармацевтичні композиції Даний винахід належить до фармацевтичних композицій, що містять кон’югат FIX як активний інгредієнт. Кон’югат FIX можна ввести в склад разом з фармацевтично прийнятним носієм. Завдяки збільшенню часу напівжиття кон’югата FIX фармакокінетичні композиції можуть містити менші дози FIX, ніж звичайно гемофілії, що вводяться для ефективного лікування В. Фармацевтичні склади за винаходом можна скласти для парентерального введення, включаючи, але не обмежені цим, інтрадермальні, підшкірні і внутрішньом'язові ін'єкції, і внутрішньовенні або внутрішньокісткові інфузії. Фармацевтичні склади за даним винаходом можуть являти собою розчини, суспензії або емульсії, які включають кон’югат FIX, такий як хімічно модифікований поліетиленгліколем FIX, і фармацевтично прийнятний розріджувач, ад’ювант або носій, в залежності від шляху введення. Фармацевтичні композиції за винаходом складені для доставки терапевтичної дози кон’югата FIX. Дозування кон’югата FIX можна виразити в міжнародних одиницях (МО). Доза кон’югатів FIX, що міститься в фармацевтичному складі, може знаходитися в діапазоні від 1 МО до 10000 МО. У деяких варіантах здійснення винаходу доза кон’югата FIX може знаходитися в діапазоні від 100 МО до 5000 МО, або від 200 МО до 2500 МО. У деяких варіантах здійснення винаходу доза кон’югата FIX може становити приблизно 250 МО, приблизно 500 МО, приблизно 1000 МО або приблизно 2000 МО. У деяких варіантах здійснення винаходу фармацевтичні композиції за винаходом мають переважний профіль імуногенності, наприклад, в порівнянні з аналогічною фармацевтичною композицією некон’югованого FIX. У деяких варіантах здійснення винаходу фармацевтичні композиції за винаходом по суті менше імуногени, ніж аналогічна фармацевтична композиція некон’югованого FIX, або по суті не імуногени. У споріднених варіантах здійснення винаходу такі фармацевтичні композиції з переважними профілями імуногенності підходять для підшкірного введення пацієнту, наприклад, в способі лікування гемофілії В. 4.5 Способи лікування гемофілії В Описані в цьому документі кон’югати FIX надають спосіб лікування гемофілії В. Фармацевтичні композиції за винаходом складені для доставки терапевтичної дози кон’югата FIX. У деяких варіантах здійснення дозування кон’югата FIX є достатнім для того, щоб активність FIX в кровотоці суб'єкта складала від 1 МО/дл до 150 МО/дл. У іншому варіанті здійснення винаходу композицію вводять в такому дозуванні, щоб концентрація активності FIX в кровотоці суб'єкта складала від 10 МО/дл до 120 МО/дл. У іншому варіанті здійснення винаходу композицію вводять в такому дозуванні, щоб активність FIX в кровотоці суб'єкта складала від 20 МО/дл до 100 МО/дл. У деяких варіантах здійснення винаходу активність кон’югата FIX становить приблизно 100% від активності аналогічного некон’югованого FIX. У деяких варіантах здійснення винаходу активність кон’югата FIX вище за приблизно 80%, 60% або 40% від активності аналогічного некон’югованого FIX. У переважних варіантах здійснення винаходу активність кон’югата FIX 10 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 55 60 вище за приблизно 20% від активності аналогічного некон’югованого FIX. Хоч це не є переважним, активність може бути нижчою 20%, як, наприклад, 10%, 5% або навіть 1%, і все ще переважно може використовуватися в порівнянні з некон’югованим FIX. Для одержуючих кон’югат FIX пацієнтів може бути необхідним, щоб активність FIX контролювалася медичним працівником. Описані в даному винаході кон’югати FIX можна також вводити пацієнтам, які страждають на гемофілію В, які піддаються хірургічній процедурі або відновлюються після неї. Крім того, описані в цьому документі кон’югати FIX вільні від забруднення FIXа, яке може призвести до небажаних тромболітичних ускладнень. Таким чином, описані в цьому документі кон’югати FIX і способи їх виготовлення дають чисті кон’югати FIX, які менш ймовірно викличуть небажаний тромбоз, що визначається по середньому показнику тромбу. У одному варіанті здійснення винаходу середній показник тромбу композиції кон’югата FIX складає менше 1 після трьох або декількох незалежних вимірювань. У іншому варіанті здійснення винаходу середній показник тромбу складає менше 0,5 після трьох або більше незалежних вимірювань. У іншому варіанті здійснення винаходу середній показник тромбу після трьох або декількох незалежних вимірювань складає менше 0,3. У іншому варіанті здійснення винаходу середній показник тромбу після трьох або декількох незалежних вимірювань складає менше 0,1. У ще одному варіанті здійснення винаходу середній показник тромбу становить 0 після трьох або декількох незалежних вимірювань. У деяких варіантах здійснення винаходу доза кон’югата FIX, що вводиться, приблизно дорівнює дозі, необхідній для аналогічного некон’югованого FIX. У деяких варіантах здійснення винаходу доза кон’югата FIX, що вводиться, приблизно в два рази, приблизно в три рази, приблизно в чотири рази або приблизно в п'ять разів, ніж необхідна доза для аналогічного некон’югованого FIX. Даний винахід також направлений на способи лікування гемофілії В шляхом введення потребуючому цього пацієнту кон’югата FIX і додаткового терапевтичного агента. Додатковим терапевтичним агентом може бути одна сполука або декілька з транексамової кислоти, амінокапронової кислоти, фактора II (протромбіну) і/або фактора X (фактор Стюарта Прауера). Кон’югат FIX і додатковий терапевтичний агент можна вводити послідовно або одночасно. При послідовному введенні порядок введення не принциповий. Наприклад, кон’югат FIX можна вводити перед введенням додаткового терапевтичного агента. Як альтернатива, введення додаткового терапевтичного агента може передувати введенню кон’югата FIX. Незалежно від того, чи будуть вони вводитися в окремих композиціях або в одній композиції, переважно, щоб кожна композиція фармацевтично підходила для введення. Більш того, при окремому введенні кон’югат FIX і терапевтичний агент можна вводити за допомогою одного або різних способів введення. У деяких варіантах здійснення винаходу кон’югати FIX за винаходом виявляють по суті такі ж фармацевтичні ефекти, як аналогічний некон’югований FIX. Наприклад, в деяких варіантах здійснення винаходу введення кон’югатів FIX за винаходом призводить до нормального індукованого фібрином згортання крові, що вказує на коагуляцію. 4.5.1 Схеми дозування Схеми дозування включають введення страждаючому на гемофілію В пацієнту кон’югатів за винаходом двічі на день, один раз на день, через день, два рази на тиждень, один раз на тиждень, один раз в два тижні або один раз на місяць. Медичний працівник може контролювати активність FIX у суб'єкта, який одержує кон’югат FIX, і відповідно змінювати схему дозування. У одному варіанті здійснення винаходу активність FIX у пацієнта визначають негайно після введення кон’югата FIX. У іншому варіанті здійснення винаходу активність FIX у суб'єкта визначають через 0,5 год, 1 год, 6 год, 12 год або 24 год після введення кон’югата FIX. У іншому варіанті здійснення винаходу активність FIX у суб'єкта визначають через 2 дні, 4 дні, 1 тиждень, 2 тижні або 3 тижні після введення кон’югата FIX. 5. Приклади 5.1 Синтез кон’югатів FIX Кон’югати FIX за винаходом можна легко синтезувати з використанням відомих в даній галузі способів синтезу. У наступних прикладах продемонстрований синтез кон’югата FIX-ПЕГ. 5.1.1 Приклад 1: Пегилювання FIX через утворення містка по дисульфідному зв'язку До фактора IX додавали водний розчин сечовини і 2-меркаптоетанолу. рН отриманого розчину доводили до 8,5, використовуючи 10%-й водний розчин метиламіну. Потім через реакційний розчин барботують азот протягом приблизно 30 хвилин. Продовжуючи пропускати азот, нагрівають пробірку до 37°С. Потім охолоджують реакційну суміш в крижаній бані з сіллю, а потім в реакційний розчин додають 10 мл охолодженого розчину1N HCl, що продувається 11 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 55 60 аргоном, в абсолютному етанолі. Після випадання осаду його виділяють центрифугуванням і потім промивають три рази додатковими порціями суміші HCl з абсолютним етанолом і двічі охолодженим діетиловим ефіром, що продувається азотом. Після кожного промивання осад виділяють центрифугуванням. Промитий осад потім розчиняють у деіонізованій воді, що продувається азотом, і висушують при заморожуванні, отримуючи суху тверду речовину. Часткове відновлення FIX можна підтвердити і кількісно оцінити, використовуючи тест Елмана, який дає число вільних тіолів на молекулу білка. У мікропробірці («епендорфі») частково відновлений FIX розчиняють в розчині амонію, який продувається агроном, рН 8. В окремому епендорфі полімерний кон’югуючий реагент, метокси--4-[2,2-біс[(п-толілсульфоніл)-метил]ацетил]бензамід, отриманий з поліетиленгліколю, також розчиняють в розчині амонію і цей розчин додають до розчину фактора IX. Епендорф з ПЕГ промивають свіжим розчином амонію і його також додають в основний епендорф, де проводиться реакція. Потім епендорф закривають під аргоном і гріють при 37ºC протягом приблизно 24 год, а потім дозволяють вихолонути до кімнатної температури. Охолоджений реакційний розчин потім аналізують з допомогою електрофорезу в натрійдодецилсульфатполіакриламідному гелі (SDS-PAGE). 5.1.2. Приклад 2: Вибіркове утворення і очищення FIX-ПЕГ в присутності забруднення FIXа До реакційної суміші, що містить FIX, який забруднений FIXа, додавали водний розчин сечовини і 2-меркаптоетанолу. рН отриманого розчину доводили до 8,5, використовуючи 10%-й водний розчин метиламіну. Потім через реакційний розчин барботують азот протягом приблизно 30 хвилин. Продовжуючи пропускати азот, нагрівають пробірку до 37ºC. Потім охолоджують реакційну суміш в крижаній бані з сіллю, після чого в реакційний розчин додають 10 мл охолодженого розчину1N HCl, що продувається аргоном, в абсолютному етанолі. Після випадання осаду його виділяють центрифугуванням і потім промивають три рази додатковими порціями суміші HCl з абсолютним етанолом і двічі охолодженим діетиловим ефіром, що продувається азотом. Після кожного промивання осад відділяють центрифугуванням. Промитий осад потім розчиняють у деіонізованій воді, що продувається азотом, і висушують при заморожуванні, отримуючи суху тверду речовину. Часткове відновлення FIX можна підтвердити і кількісно оцінити, використовуючи тест Елмана, який дає число вільних тіолів на молекулу білка. У епендорфі частково відновлений FIX розчиняють в розчині амонію, що продувається агроном, рН 8. В окремому епендорфі менше одного еквівалента полімерного кон’югуючого реагенту, -метокси--4-[2,2-біс[(п-толілсульфоніл)-метил]ацетил]бензаміду, отриманого з поліетиленгліколю, також розчиняють в розчині амонію і отриманий розчин додають до розчину фактора IX. Епендорф з ПЕГ промивають свіжим розчином амонію і його також додають в основний епендорф, де проводиться реакція. Потім епендорф закривають під аргоном і гріють при 37°С протягом приблизно 24 год, а потім дозволяють вихолонути до кімнатної температури. Охолоджений реакційний розчин потім аналізують за допомогою електрофорезу в натрійдодецилсульфат-поліакриламідном гелі (SDS-PAGE). Очищення FIX-ПЕГ з реакційної суміші потім проводять за допомогою ексклюзійної хроматографії. Для визначення рівня забруднення фактором IXa додатковий аналіз виділеного продукту можна провести способами, викладеними в Gray et al. Thromb. Haemost. 1995, квітень; 73(4):675-9 або розділі 5.3 нижче. 5.2. Отримання рекомбінантного фактора IX 5.2.1 Приклад 3: Первинна трансфекція клітин СНО геном фактора IX Ген фактора IX дикого типу трансфекували в клітини СНО граничним розведенням в 96ямкових планшетах. Ген фактора IX знаходиться під контролем промотору СНЕF-I. Клітинам дозволяли рости в 5% сироватці протягом 14 днів. Культуральне середовище збирали, і загальну кількість антигену фактора IX в мкг на мл визначали з допомогою твердофазного ІФА (ELISA) до фактора IX. Було проаналізовано більше 150 клонів і визначена загальна кількість фактора IX, що продукується кожним клоном. Трансфековані геном фактора IX клітини СНО продукують антиген фактора IX, який детектували з допомогою ELISA до фактора IX. 5.2.2 Приклад 4: Супертрансфекція продукуючих фактор IX клітин СНО генами VKGC і VKOR Для підвищення процентного вмісту активного фактора IX, який продукується в трансфекованих фактором IX клітках СНО, первинні трансфектанти пулювали (об'єднували клітини, отримані після першої трансфекції), розмножувати в культурі і супертрансфекували (повторно трансфекували) векторами, що містять кДНК ферментів, які вважаються важливими для ефективного гамма-карбоксилювання фактора IX, залежного від вітаміну К. Продукуючі 12 UA 101497 C2 5 10 15 20 25 30 35 40 45 50 55 60 фактор IX клони пулювали в колбі для струшування і супертрансфекували як кДНК вітамін Кзалежної гамма-карбоксилази (VKGC), так і кДНК вітамін К-залежної епоксидредуктази (VKOR). Індивідуально супертрансфековані клітини ростили, використовуючи граничне розведення в 96ямкових планшетах в 5%-й сироватці протягом 14 днів. Загальна кількість антигену фактора IX, який продукується на мл, визначали за допомогою ELISA до фактора IX. Кількість активного фактора IX вимірювали за допомогою аналізу згортання крові АРТТ (активованого часткового тромбопластинового часу) з використанням плазми, яка позбавлена фактора IX, як субстрату і отриманого з плазми фактора IX як стандарту. 5.3 Методи біологічного аналізу кон’югатів FIX 5.3.1 Приклад 5: аналіз FIX-ПЕГ і FIXa Проводили аналіз очищеної композиції FIX-ПЕГ для визначення активності FIX-ПЕГ, а також будь-якої забруднюючої активності FIXa або FIXa-ПЕГ. Аналіз проводили по протоколах, описаних в Smith, K. J. et al., Blood, 72, 1269-1277 (1988), для FIX, і Varadi, K. et al., Thromb. Haemos., 35, 576-585 (1976), для забруднення фактором IXa. 5.3.2 Приклад 6: композиція FIX-ПЕГ в in vivo аналізі тромбогенності Цей приклад використовували для визначення, чи може кон’югат FIX, очищений за способом з прикладу 2, викликати небажану коагуляцію внаслідок забруднення фактором IXa, яку вимірюють за допомогою in vivo аналізу на тромбогенність методом вимірювання стаза у кроликів по Весслеру. Препарати FIX вводять in vivo за допомогою ін'єкції у виділені, ліговані фрагменти яремних вен кролика відповідно до процедури, описаної в Wessler et al., J. Appl. Physiol. 14:943-946 (1959), для аналізу утворення застійних тромбів. Оцінку здійснюють за системою Wessler, et al. відповідно до розміру кров'яного згустку, причому оцінка +4 для згустку представляє найбільший розмір згустку, який може в нормі генеруватися з тромбогенними матеріалами у вибраній судині певного розміру і типу, а +1 являє собою найменший такий згусток, який можна візуально детектувати. Експеримент повторюють три рази і визначають арифметичне середнє. 5.3.3 Приклад 7: визначення слідів FIXa і FIXa-ПЕГ в очищених композиціях FIX-ПЕГ Референсний FIXa (25 мкл), розведений в буфері TBS з 1% альбуміном людини, або 25 мкл розведення тестованого концентрату FIX в TBS з 1% альбуміном людини вміщували в 96-ямкові мікротитрувальні планшети при 37ºC. Аналітичний реагент, що містить однакові об'єми фактора Х людини, фосфоліпіду з бичачого мозку і рекомбінантного десульфатогірудину, прогрівали протягом 5 хв. при 37ºC. Потім до реагенту додавали однакові об'єми прогрітих рекомбінантного фактора VIII і CaCl2. Відразу після змішування 125 мкл цього реагенту додавали до ямки, що містить зразки FIX або FIXa. Після 20 хвилин утворення фактора Ха при 37ºC, 50 мкл переносили в 100 мкл S-2765 (Quadratech Epsom UK). Після 2-хвилинної інкубації реакцію зупиняли доданням 50 мкл 50%-ої оцтової кислоти і реєстрували довжину хвилі поглинання. Потім для визначення кількості FIXa в тестованій суміші вимірювали рівень поглинання для тестованого субстрату при цій довжині хвилі. 5.3.4 Приклад 8: Порівняння часу напівжиття в кровотоці FIX-ПЕГ 10 kDa і FIX-ПЕГ 20 kDa з некон’югованим FIX Отримували FIX-ПЕГ 10 kDa і FIX-ПЕГ 20 kDa (в кожному з яких молекула ПЕГ є лінійною), використовуючи процедури, викладені в прикладах 1 і 2. Некон’югований FIX, FIX-ПЕГ 10 kDa і FIX-ПЕГ 20 kDa вводили мишам, позбавленим FIX, і у кожної миші вимірювали плазматичну концентрацію FIX як за допомогою ELISA, так і хромогенним методом, починаючи від 15 хв. до 48 годин після введення. Середні плазматичні концентрації FIX показані на фіг. 2, 3 і 4, відповідно. При вимірюванні за період часу, починаючи від приблизно 15 хвилин до приблизно 4 годин після введення, час напівжиття FIX-ПЕГ 10 kDa і 20 kDa був приблизно в 2-2,5 рази вищим за час напівжиття некон’югованого FIX. При вимірюванні за період часу, починаючи від приблизно 15 хвилин до приблизно 48 годин після введення, час напівжиття FIX-ПЕГ 20 kDa був приблизний в 11 разів вищим за час напівжиття некон’югованого FIX, а час напівжиття FIX-ПЕГ 10 kDa був приблизний в 8 разів вищим за час напівжиття некон’югованого FIX. 5.3.5 Приклад 9: Активність FIX-ПЕГ 10 kDa і FIX-ПЕГ 20 kDa у мишей, позбавлених FIX Активність FIX-ПЕГ 10 kDa і FIX-ПЕГ 20 kDa визначали, проводячи дослідження зовнішньої кровотечі на мишах, позбавлених FIX. Мишам вводили еквівалент дози 45 мкг/мл некон’югованого FIX. Мишам обрізали хвости, і FIX-ПЕГ 10 kDa і FIX-ПЕГ 20 kDa вводили 12 і 16 мишам, відповідно. Смерть була відвернена у 11 з 12 мишей в групі FIX-ПЕГ 10 kDa, а в групі FIX-ПЕГ 20 kDa смерть була відвернена у 12 з 16 мишей. Візуально визначали, чи є зупинка кровотечі результатом утворення фібринового згустку на відміну від тромбоцитарної зупинки 13 UA 101497 C2 кровотечі. Ці результати вказують на те, що обидва FIX-ПЕГ 10 kDa і FIX-ПЕГ 20 kDa є активними. ФОРМУЛА ВИНАХОДУ 5 10 1. Кон'югат фактора IX і поліетиленгліколю (FIX-ПЕГ), в якому одна або декілька поліетиленгліколевих груп зв'язані з фактором IX через фрагмент, що містить ПЕГ, який з'єднує містком два цистеїнові залишки, які утворюють дисульфідний зв'язок у факторі IX. 2. Кон'югат фактора IX і поліетиленгліколю (FIX-ПЕГ), в якому одна або декілька поліетиленгліколевих груп зв'язані з фактором IX за допомогою фрагмента, що містить ПЕГ, який з'єднує містком один або декілька відновлених цистеїнових дисульфідних зв'язків. 3. Кон'югат FIX-ПЕГ за п. 2, в якому фрагмент, що містить один або декілька ПЕГ, з'єднує містком один або декілька цистеїнових дисульфідних зв'язків відповідно до наступної формули: O S FIX ПЕГ 15 20 S R1 ; 1 в якій R являє собою зв'язувальну групу, яка може бути прямим зв'язком, алкіленовою групою (переважно С1-10-алкіленовою групою) або, необов'язково, заміщеною арильною або гетероарильною групою; в якій арильні групи включають фенільну і нафтильну групи; в якій прийнятні гетероарильні групи включають піридин, пірол, фуран, піран, імідазол, піразол, оксазол, піридазин, піримідин і пурин; в якій сполучення з полімером може здійснюватися через гідролітично лабільний зв'язок або через нелабільний зв'язок. 4. Кон'югат FIX-ПЕГ за п. 3, в якому фрагмент, що містить один або декілька ПЕГ, з'єднує містком один або декілька цистеїнових дисульфідних зв'язків відповідно до наступної формули: O S FIX S ПЕГ. 25 30 35 40 45 O . 5. Кон'югат FIX-ПЕГ за пп. 1, 2, 3 або 4, в якому фрагмент, що містить один або декілька ПЕГ, має молекулярну вагу 10 kDа. 6. Кон'югат FIX-ПЕГ за пп. 1, 2, 3, 4 або 5, що має один ПЕГ-вмісний фрагмент. 7. Кон'югат FIX-ПЕГ за пп. 1, 2, 3, 4 або 5, що має два ПЕГ-вмісні фрагменти. 8. Композиція, що містить кон'югат за будь-яким з пп. 1-7, яка також містить фармацевтично прийнятний розріджувач, ад'ювант або носій. 9. Композиція за п. 8, яка складена для парентерального введення. 10. Композиція за п. 9, яка придатна для інтрадермальних, підшкірних і внутрішньом'язових ін'єкцій і для внутрішньовенних або внутрішньокісткових інфузій. 11. Композиція, що містить кон'югат за будь-яким з пп. 1-7, яка являє собою розчин, суспензію або емульсію. 12. Кон'югат за будь-яким з пп. 1-4, де кон'югат FIX-ПЕГ має більший час напівжиття в порівнянні з немодифікованим FIX. 13. Кон'югат за будь-яким з пп. 1-4, де кон'югат FIX-ПЕГ має більшу AUC в порівнянні з немодифікованим FIX. 14. Кон'югат за будь-яким з пп. 1-4, де кон'югат FIX-ПЕГ має вищу біодоступність в порівнянні з немодифікованим FIX. 15. Фармацевтична композиція, що містить кон'югат FIX-ПЕГ за будь-яким з пп. 1-7 і фармацевтично прийнятний розріджувач, ад'ювант або носій, для використання в лікуванні гемофілії В. 16. Фармацевтична композиція, що містить кон'югат FIX-ПЕГ за будь-яким з пп. 1-7 і фармацевтично прийнятний розріджувач, ад'ювант або носій, де композиція по суті вільна від 14 UA 101497 C2 5 10 15 20 фактора ІХа, для використання в зниженні ризику гемартрозу, геморагії, шлунково-кишкової кровотечі і менорагії у ссавців з гемофілією В. 17. Композиція за п. 16, для якої після трьох незалежних експериментів середній показник тромбу складає менше 1. 18. Композиція за п. 16, для якої після трьох незалежних експериментів середній показник тромбу складає менше 0,5. 19. Композиція за п. 16, для якої після трьох незалежних експериментів середній показник тромбу дорівнює 0. 20. Композиція за п. 15, яку вводять підшкірно. 21. Композиція за п. 15, яку вводять внутрішньовенно. 22. Композиція за п. 15, яка приводить до зниження випадків тромбозу в порівнянні з композиціями рекомбінантного фактора IX, що містять вимірювану кількість фактора ІХа. 23. Композиція за п. 15, яку вводять один раз на день. 24. Композиція за п. 15, яку вводять один раз на два дні. 25. Композиція за п. 15, яку вводять в дозуванні від 1 МО до 10000 МО. 26. Композиція за п. 15, яку вводять в дозуванні від 200 МО до 2500 МО. 27. Композиція за п. 15, яку вводять в дозуванні 250 МО, 500 МО, 1000 МО або 2000 МО. 28. Композиція за п. 15, яку вводять в такому дозуванні, що активність фактора IX в кровотоці складає від 1 МО/дл до 150 МО/дл. 29. Композиція за п. 15, яку вводять в такому дозуванні, що активність фактора IX в кровотоці складає від 10 МО/дл до 120 МО/дл. 30. Композиція за п. 15, яку вводять в такому дозуванні, що активність фактора IX в кровотоці складає від 20 МО/дл до 100 МО/дл. 15 UA 101497 C2 16 UA 101497 C2 17 UA 101497 C2 Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 18
ДивитисяДодаткова інформація
Назва патенту англійськоюConjugates of factor ix with increased half-life
Автори англійськоюHenry, William
Назва патенту російськоюКонъюгаты фактора ix с увеличенным временем полужизни
Автори російськоюХенри Уилльям
МПК / Мітки
МПК: C12N 9/64, A61K 38/36, A61K 47/48, A61P 7/04
Мітки: фактора, збільшеним, часом, напівжиття, кон'югати
Код посилання
<a href="https://ua.patents.su/20-101497-konyugati-faktora-ikh-zi-zbilshenim-chasom-napivzhittya.html" target="_blank" rel="follow" title="База патентів України">Кон’югати фактора іх зі збільшеним часом напівжиття</a>
Попередній патент: Спосіб та пристрій для регулювання подачі газу для контролю запалювання в газових приладах, насамперед газових машинах та печах
Наступний патент: Пристрій подачі лікарського засобу
Випадковий патент: Осьовий зворотний насос