Робочий циліндр пароповітряного молота
Номер патенту: 45985
Опубліковано: 10.12.2009
Автори: Роганов Лев Леонідович, Роганов Максим Львович, Рудченко Олександр Сергійович
Формула / Реферат
Робочий циліндр пароповітряного молота, що містить корпус, поршень з встановленими на ньому кільцями, шток та втулку, який відрізняється тим, що поверхні сполучення корпусу циліндра та втулки виконані конічними з попередньо розрахованою величиною конусності, яка забезпечує потрібну радіальну деформацію втулки при повздовжньому її переміщенні відносно корпусу, фіксації втулки за допомогою дистанційних кілець та встановлення ущільнення для запобігання витокам енергоносія назовні.
Текст
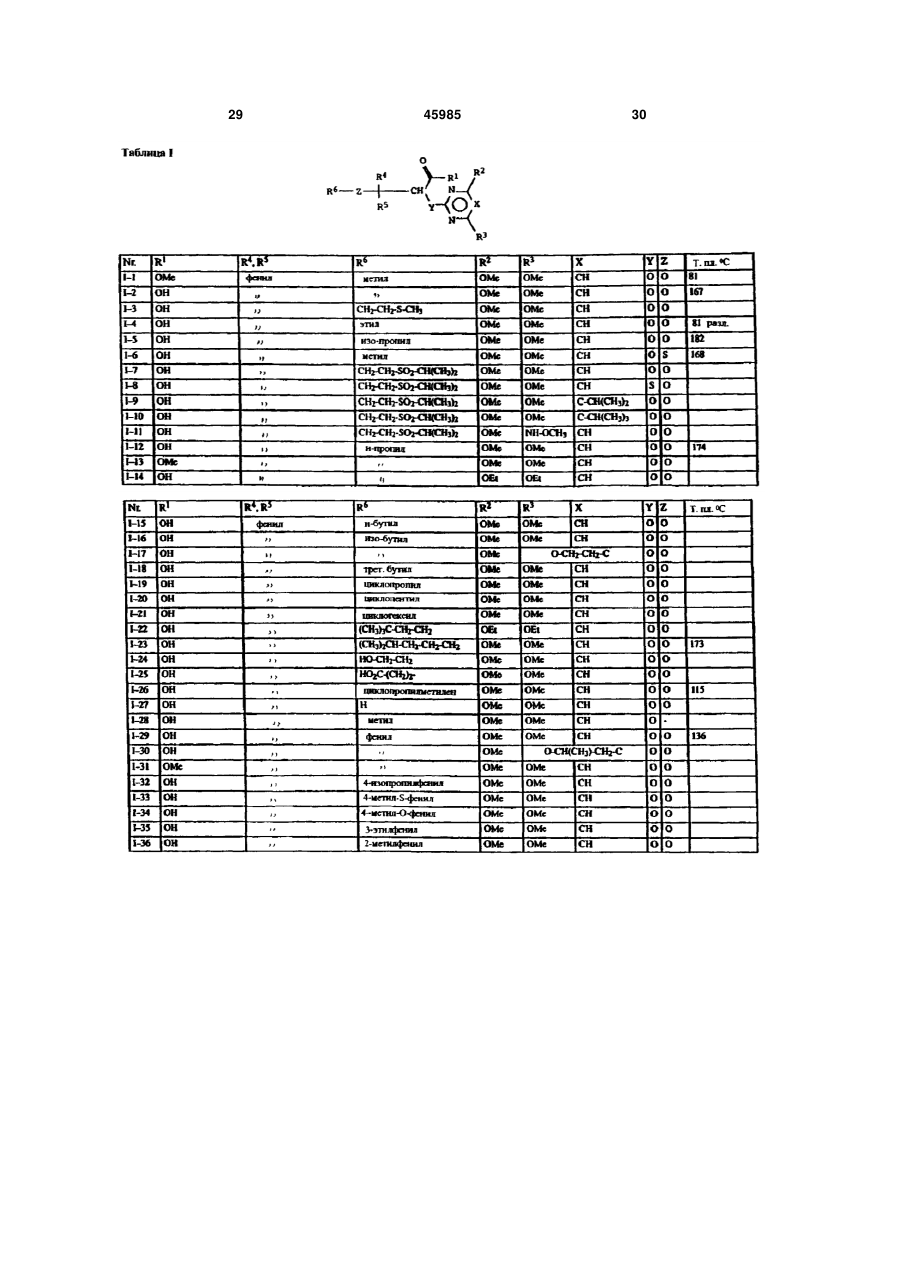
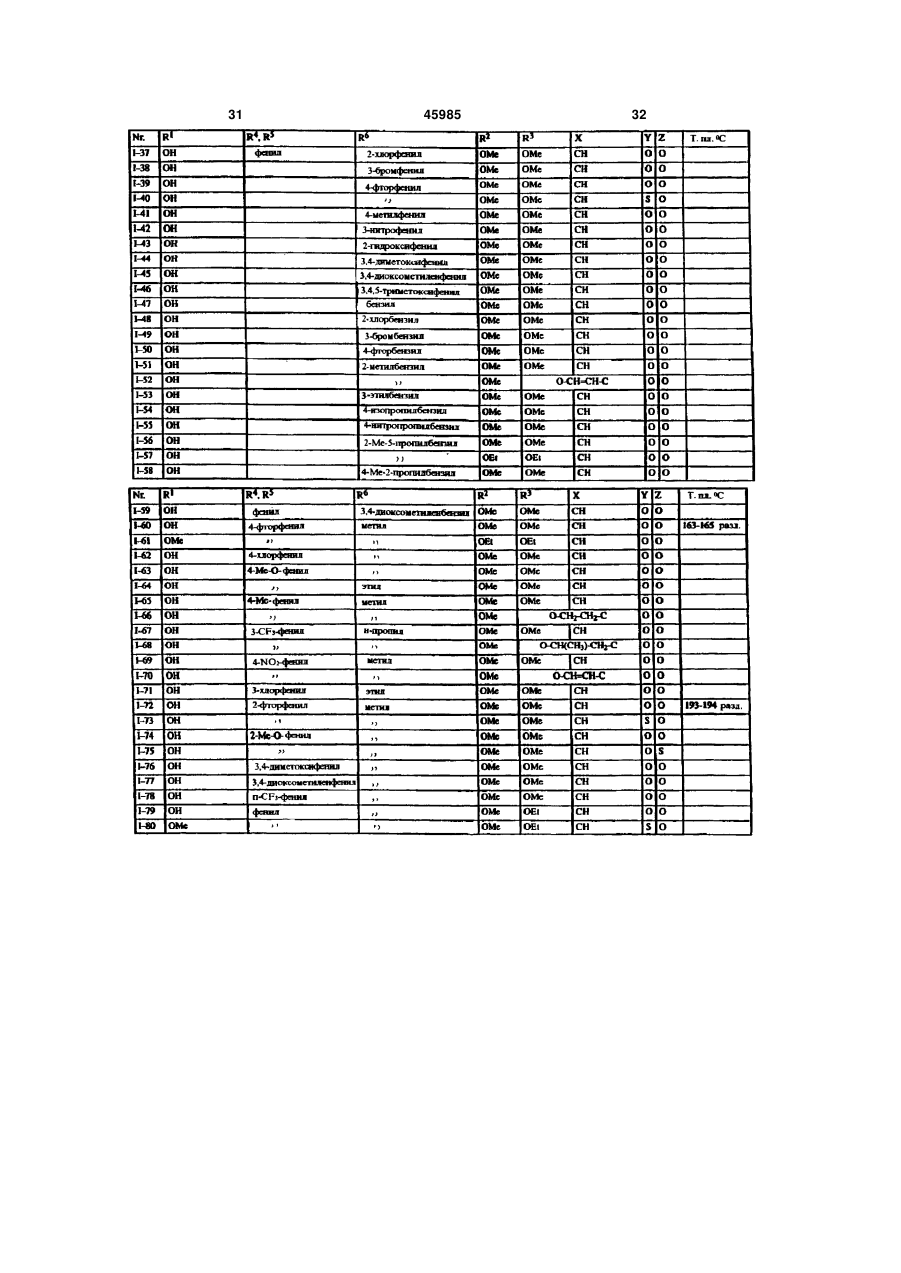
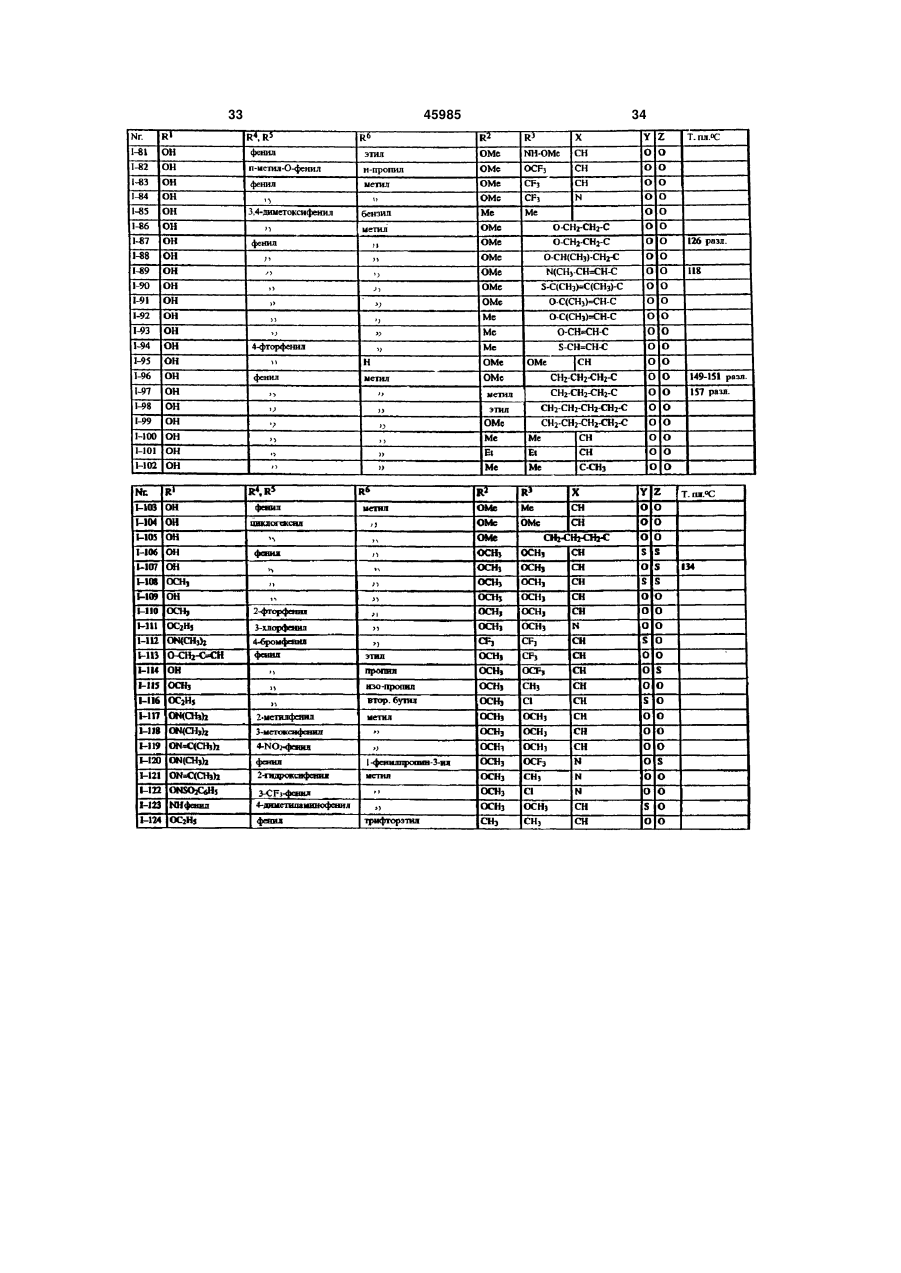
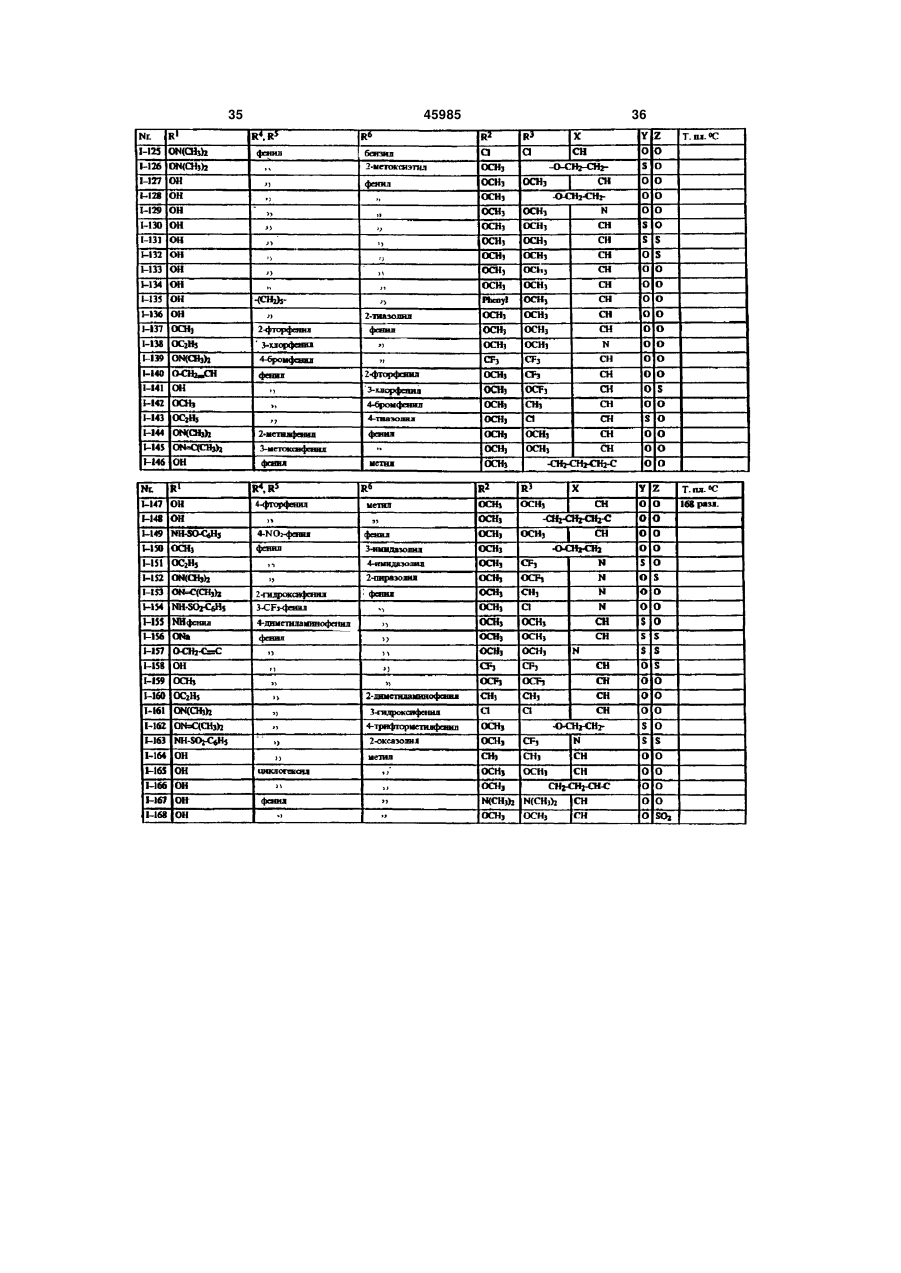
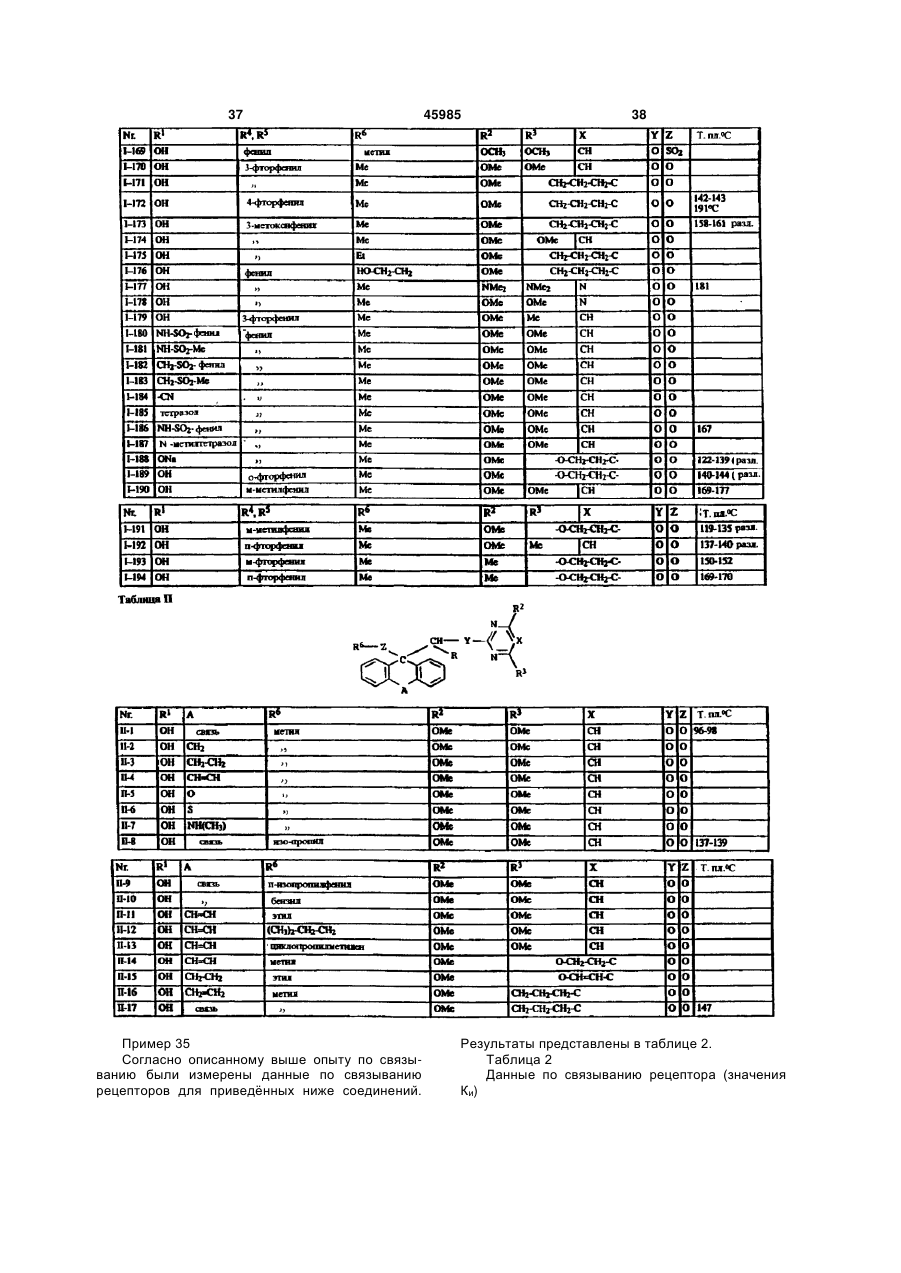
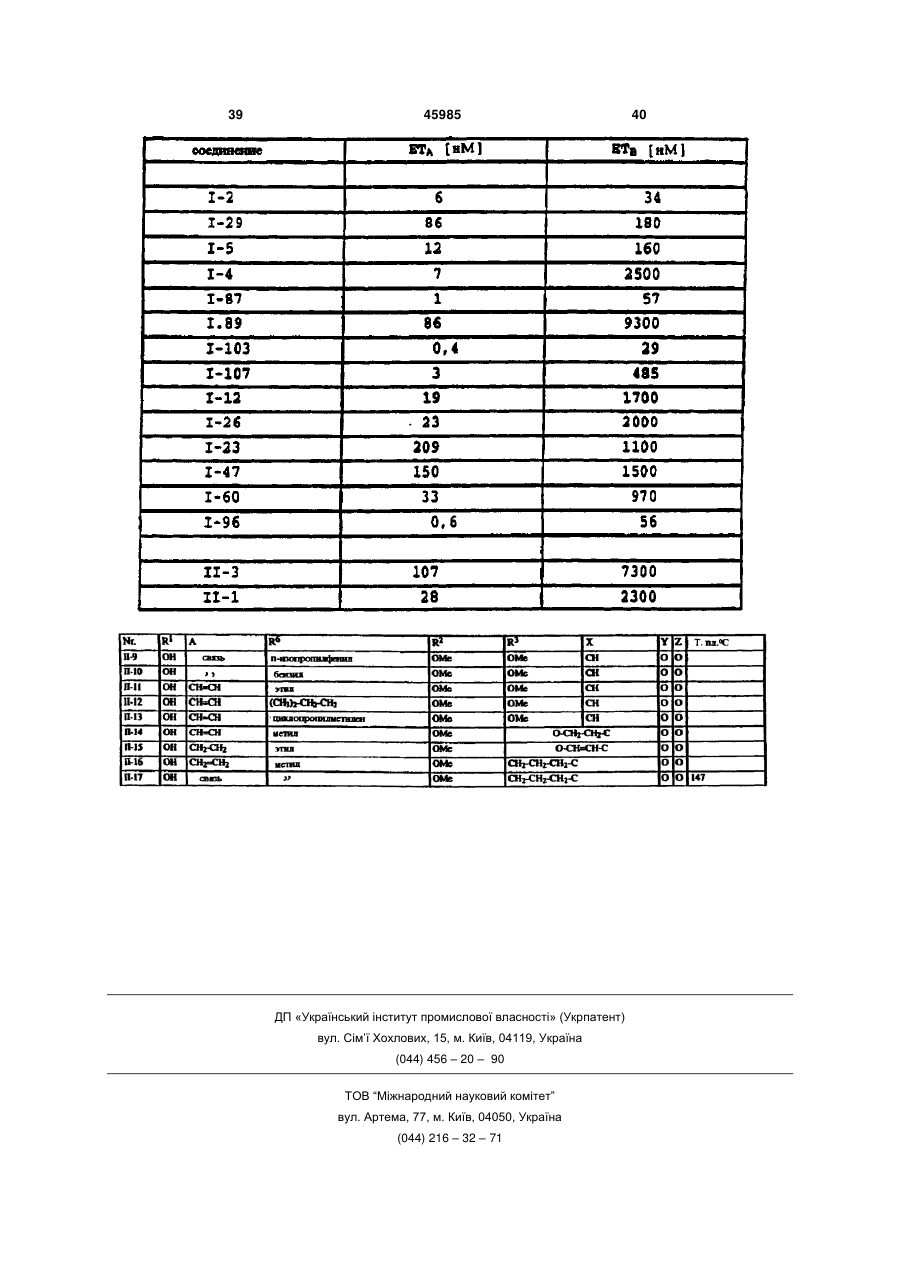
1. Производные карбоновых кислот формулы (I) в которой R означает формильную группу, тетразол, нитрил, карбоксильную группу или гидролизуемый до карбоксильной группы остаток, и остальные заместители имеют следующее значение: R2- водород, гидроксигруппа, аминогруппа, монои диалкиламиногруппа с 1-4 атомами углерода в алкильной части, галоген, алкил с 1-4 атомами углерода, галогеналкил с 1-4 атомами углерода, алкоксигруппа с 1-4 атомами углерода, галогеналкоксигруппа с 1-4 атомами углерода или алкилтиогруппа с 1 -4 атомами углерода; X - азот или радикал CR14, где R14 означает водород или алкил с 1-5 атомами углерода или CR14 вместе с CR13 образует 5- или 6-членное алкиленовое или алкениленовое кольцо, которое может быть замещено одной или двумя алкильными группами с 1-4 атомами углерода и в котором каждая метиленовая группа может быть заменена кислородом, серой, иминогруппой или алкилиминогруппой с 1-4 атомами углерода; R3 - водород, гидроксигруппа, аминогруппа, моно или диалкиламиногруппа с 1-4 атомами углерода в алкильной части, галоген, алкил с 1-4 атомами углерода, галогеналкил с 1-4 атомами углерода, алкоксигруппа с 1-4 атомами углерода, галогеналкоксигруппа с 1-4 атомами углерода, аминоалкоксигруппа с 1-4 атомами углерода, алкилтиогруппа с 1-4 атомами углерода или CR3 вместе с CR14, как указано выше, соединены в 5- или 6-членное кольцо; R4 и R5 могут быть одинаковыми или различными и означать: фенил или нафтил, которые могут быть одно- или многократно замещены следующими остатками: галоген, нитро, циано, гидрокси, алкил с 1-4 атомами углерода, галогеналкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода, галогеналкокси с 1-4 атомами углерода, фенокси, алкилтио с 1-4 атомами углерода, амино, алкиламино или диалкиламино с 1-4 атомами углерода в алкильной части; или фенил или нафтил, которые в орто-положении (19) UA (11) 45985 (13) C2 (21) 97052223 (22) 07.10.1995 (24) 15.05.2002 (86) PCT/EP95/03963, 07.10.1995 (31) P 44 36 851.8 (32) 14.10.1994 (33) DE (31) 195 33 023.4 (32) 07.09.1995 (33) DE (46) 15.05.2002, Бюл. № 5, 2002 р. 3 45985 4 соединены друг с другом прямой связью, метиле4 атомами углерода, галогеналкил с 1-4 атомами новой, этиленовой или этениленовой группой, углерода, алкокси с 1-4 атомами углерода, галогеатомом кислорода или серы или сульфонилом, налкокси с 1-4 атомами углерода, фенокси, алкилиминогруппой или алкилиминогруппой, или циклотио с 1-4 атомами углерода, алкиламино с 1-4 алкил с 3-7 атомами углерода; атомами углерода, диалкиламино с 1-4 атомами 6 R - водород, алкил с 1-8 атомами углерода, алкеуглерода, диоксометилен или диоксоэтилен; пятинил с 3-6 атомами углерода, алкинил с 3-6 атоили шестичленный гетероцикл, содержащий от мами углерода или циклоалкил с 3-8 атомами угодного до трѐх атомов азота и/или один атом серы лерода, причѐм каждый из этих остатков может или кислорода, и который может быть замещѐн быть одно- или многократно замещѐн следуюодним - четырьмя атомами галогена и/или одним щими группами: или двумя следующими остатками: алкил с 1-4 галоген, нитро, циано, алкокси с 1-4 атомами угатомами углерода, галогеналкил с 1-4 атомами лерода, алкенилокси с 3-6 атомами углерода, алуглерода, алкокси с 1-4 атомами углерода, галогекинилокси с 3-6 атомами углерода, алкилтио с 1-4 налкокси с 1-4 атомами углерода, алкилтио с 1-4 атомами углерода, галогеналкокси с 1-4 атомами атомами углерода, фенил, фенокси или феноксиуглерода, алкилкарбонил с 1-4 атомами углерода карбонил, причѐм фенильные остатки, в свою в алкильной части, алкоксикарбонил с 1-4 атоочередь, могут быть замещены от одного до пяти мами углерода в алкоксичасти, алкилкарбонилалатомами галогена и/или одним - тремя следуюкил с 3-8 атомами углерода, алкиламино с 1-4 щими остатками: алкил с 1-4 атомами углерода, атомами углерода, диалкиламино с 1-4 атомами галогеналкил с 1-4 атомами углерода, алкокси с 1углерода в алкильной части, незамещѐнный фе4 атомами углерода, галогеналкокси с 1-4 атонил или одно- или многократно, например, одномами углерода и/или алкилтио с 1-4 атомами угтрѐхкратно галогеном, нитрогруппой, цианогруплерода; пой, алкилом с 1-4 атомами углерода, галогеналпри условии, что R6 может быть водородом только килом с 1-4 атомами углерода, алкоксигруппой с в том случае, если Z не является простой свя1-4 атомами углерода, галогеналкоксигруппой с 1зью; 4 атомами углерода или алкилтиогруппой, замеY означает серу или кислород, или простую щѐнный фенил или фенокси; связь; фенил или нафтил, каждый из которых может Z означает серу или кислород, или простую быть замещѐн одним или несколькими остатками: связь. галоген, нитро, циано, гидрокси, амино, алкил с 1 Настоящее изобретение относится к новым производным карбоновых кислот, их получению и применению. Эндотелин представляет собой пептид, построенный из 21 аминокислоты, который синтезируется и выделяется сосудистым эндотелием. Эндотелии существует в трѐх изомерных формах : ЕТ-1, ЕТ-2 и ЕТ-3. В последующем понятие "эндотелии" или "ET" будет обозначать одну или все изомерные формы эндотелина. Эндотелии является потенциальным вазоконстриктором и оказывает сильный эффект на тонус сосудов. Известно, что эта вазоконстрикция вызывается связыванием эндотелина со своим рецептором (Nature, 332, 411 - 415/ 1988; FEBS Letters, 231, 440 - 444, 1988 и Biochem. Biophys. Res. Commun., 154, 868 - 875, 1988). Повышенное или ненормальное выделение эндотелина вызывает устойчивую контрактуру в периферийных, ренальных и церебральных кровяных сосудах, которая может привести к заболеваниям. Как сообщается в литературе, повышенное содержание эндотелина в плазме было обнаружено у больных гипертонией, острым инфарктом миокарда, лѐгочной гипертонией, с синдромом Рейно, атеросклерозом и в дыхательных путях астматиков. (Japan J. Hypertension, 12, 79 (1989), J. Vaskular Med. Biology 2, 207 (1990), J. Am. Med. Association 264, 2868 (1990)). Вследствие этого, соединения, которые специфически ингибируют связывание эндотелина с рецептором, должны были бы также антагонизировать вышеприведѐнные физиологические эффекты эндотелина и являться поэтому ценными фармацевтическими препаратами. Теперь было найдено, что определѐнные производные карбоновых кислот являются хорошими ингибиторами рецепторов эндотелина. Объектом изобретения являются производные карбоновых кислот формулы I в которой R означает формильную группу, тетразол, нитрил, карбоксильную группу или гиролизуемый до карбоксильной группы остаток и остальные заместители имеют следующее значение : R2 водород, гидроксигруппа, аминогруппа, моно- и диалкиламиногруппа с 1-4атомами углерода в алкильной части, галоген, алкил с 1-4 атомами углерода, галогеналкил с 1-4 атомами углерода, алкоксигруппа с 1-4 атомами углерода, галогеналкоксигруппа с 1-4 атомами углерода или ал 5 45985 6 килтиогруппа с 1 - 4 атомами углерода; алкилтио с 1 - 4 атомами углерода, алкиламино с X азот или радикал CR14, где R14 означает во1 - 4 атомами углерода, диалкиламино с 1 - 4 атодород или алкил с 1 - 5 атомами углерода или мами углерода, диоксометилен или диоксоэтилен; CR14 вместе с CR13 образует 5- или 6-членное алпяти- или шести-членный гетероцикл, содеркиленовое или алкениленовое кольцо, которое жащий от одного до трѐх атомов азота и/или один может быть замещено одной или двумя алкильатом серы или кислорода, и который может быть ными группами с 1 - 4 атомами углерода и в котозамещѐн одним - четырьмя атомами галогена ром каждая метиленовая группа может быть заи/или одним или двумя следующими остатками: менена кислородом, серой, иминогруппой или алалкил с 1 - 4 атомами углерода, галогеналкил с 1 килиминогруппой с 1 - 4 атомами углерода; 4 атомами углерода, алкокси с 1 - 4 атомами углеR3 водород, гидроксигруппа, аминогруппа, рода, галогеналкокси с 1 - 4 атомами углерода, моно- или диалкиламиногруппа с 1 - 4 атомами алкилтио с 1 - 4 атомами углерода, фенил, феуглерода в алкильной части, галоген, алкил с 1 - 4 нокси или феноксикарбонил, причѐм фенильные атомами углерода, галогеналкил с 1 - 4 атомами остатки, в свою очередь, могут быть замещены от углерода, алкоксигруппа с 1 - 4 атомами углерода, одного до пятью атомами галогена и/или одним галогеналкоксигруппа с 1 - 4 атомами углерода, тремя следующими остатками: алкил с 1 - 4 атоаминоалкоксигруппа с 1 - 4 атомами углерода, мами углерода, галогеналкил с 1 - 4 атомами угалкилтиогруппа с 1 - 4 атомами углерода или CR3 лерода, алкокси с 1 - 4 атомами углерода, галогевместе с CR14, как указано выше, соединены в 5налкокси с 1 - 4 атомами углерода и/или алкилтио или 6-членное кольцо; с 1 - 4 атомами углерода; R4 и R5 могут быть одинаковыми или различпри условии, что R6 может быть водородом ными и означать: только в том случае, если Z не является простой фенил или нафтил, которые могут быть односвязью; или многократно замещены следующими остатΥ означает серу или кислород или простую ками : галоген, нитро, циано, гидрокси, алкил с 1 связь; 4 атомами углерода, галогеналкил с 1 - 4 атомами Ζ означает серу или кислород или простую углерода, алкокси с 1 - 4 атомами углерода, галосвязь. ген алкокси с 1 - 4 атомами углерода, фенокси, Соединения формулы I, а также промежуточалкилтио с 1 - 4 атомами углерода, амино, алкиные продукты для их получения, например, соламино или диалкиламино с 1 - 4 атомами углеединения формулы IV и VI, могут иметь один или рода в алкильной части; или несколько асимметрически замещѐнных атомов фенил или нафтил, которые в орто-положении углерода. Такие соединения могут находиться, как соединены друг с другом прямой связью, метилев виде чистых энантиомеров или чистых диастеновой, этиленовой или этениленовой группой, реомеров, так и в виде их смеси. Предпочтительатомом кислорода или серы или сульфонилом, ным является применение энантиомерно чистых иминогруппой или алкилиминогруппой, или циклосоединений в качестве активного вещества. алкил с 3 - 7 атомами углерода; Далее, объектом изобретения является приR6 водород, алкил с 1 - 8 атомами углерода, менение вышеуказанных производных карбоноалкенил с 3 - 6 атомами углерода, алкинил с 3 - 6 вых кислот для получения лекарственных средств, атомами углерода или циклоалкил с 3 - 8 атомами в частности для получения ингибиторов рецептоуглерода, причѐм каждый из этих остатков может ров эндотелина. быть одно- или многократно замещѐн следуюДругим объектом изобретения является полущими группами: галоген, нитро, циано, алкокси с 1 чение соединений формулы IV в виде чистого – 4 атомами углерода, алкенилокси с 3 - 6 атоэнантиомера. Энантиоселективное эпоксидировамами углерода, алкинилокси с 3 - 6 атомами угление олефина, дважды замещѐнного фенилом, изрода, алкилтио с 1 - 4 атомами углерода, галогевестно (J. Org. Chem. 1994, 59, 4378 - 4380). Неналкокси с 1 - 4 атомами углерода, алкилкарбонил ожиданно было найдено, что сложноэфирные с 1 - 4 атомами углерода в алкильной части, алгруппы в этой системе также разрешают эпоксикоксикарбонил с 1 - 4 атомами углерода в алкокдирование с высокой оптической чистотой. сичасти, алкилкарбонилалкил с 3 - 8 атомами угПолучение соединений согласно изобретелерода, алкиламино с 1 - 4 атомами углерода, нию, в которых Ζ является серой или кислородом, диалкиламино с 1 - 4 атомами углерода в алкильпроисходит из эпоксидов формулы IV, которые ной части, незамещѐнный фенил или одно- или получают общеизвестным способом, например, многократно, например, одно- трѐхкратно галогекак описано в J. March, Advanced Organic Chemisном, нитрогруппой, цианогруппой, алкилом с 1 - 4 try, 2 изд. 1983, с. 862 и 750, которые получают из атомами углерода, галогеналкилом с 1 - 4 атокетонов II или олефинов III: мами углерода, алкоксигруппой с 1 - 4 атомами углерода, галогеналкоксигруппой с 1 - 4 атомами углерода или алкилтиогруппой группой замещѐнный фенил или фенокси; фенил или нафтил, каждый из которых может быть замещѐн одним или несколькими остатками: галоген, нитро, циано, гидрокси, амино, алкил с 1 4 атомами углерода, галогеналкил с 1 - 4 атомами углерода, алкокси с 1 - 4 атомами углерода, галогеналкокси с 1 - 4 атомами углерода, фенокси, 7 45985 8 Производные карбоновых кислот формулы VI формулы VI получают, если рацемические или могут быть получены тем, что эпоксиды общей диастереомерные соединения формулы VI подформулы IV (например, с R=ROOR10) вводят в вергают классическому расщеплению рацематов с взаимодействие с спиртами или тиолами общей подходящими энантиомерно чистыми основаформулы V, в которой R6 и Z имеют указанное в ниями, например, бруцином, стрихнином, квинипункте 1 формулы изобретения значение. ном, квинидином, хинхонидином, хинхонином, иохимбином, морфином, дегидроабиэтиламином, эфедрином (-), (+), диоксиэфедрином (+), (-), трео2-амино-1-(п-нитрофенил)-1,3-пропандиолом (+), (-), трео-2-( Ν,Ν-диметил-амино)- 1 - (п-нитрофенил)--1,3-пропандиолом (+), (-), трео-2-амино-1 Для этого нагревают соединения общей форфенил -1,3-пропандиолом (+), (-), -метил-бензимулы IV с соединениями формулы V, при молярламином (+), (-), -(1-нафтил)этиламином (+), (-), ном соотношении от около 1:1 до 1:7, предпочти-(2-нафтил)-этиламином (+), (-), аминометилпетельно 1-3 мольных эквивалентов, при темперананом, Ν,Ν-диметил-1-фенилэтиламином, N-метуре от 50° до 200°С, предпочтительно от 80° до тил-1 -фенилэтиламином, 4-нитрофенилэтилами150°С. ном, псевдоэфедрином, норэфедрином, норпсевРеакция может протекать также в присутствии доэфедрином, производными аминокислот, пепразбавителя. Для этой цели могут применяться тидными производными. все инертные по отношению к используемым реаСоединения согласно изобретению, у которых гентам растворители. Υ означает кислород и остальные заместители Примерами таких растворителей или разбавиимеют указанное для формулы I значение, могут телей являются вода, алифатические, алициклибыть получены, например, таким образом, что ческие и ароматические углеводороды, которые производные карбоновой кислоты общей формогут быть хлорированными, например, гексан, мулы VI, в которой заместители имеют указанное циклогексан, петролейный эфир, лигроин, бензол, значение, вводят в реакцию с соединениями фортолуол, ксилол, метиленхлорид, хлороформ, чемулы VII, тырѐххлористый углерод, этилхлорид и трихлорэтилен, простые эфиры, например, диизопропиловый эфир, дибутиловый эфир, метил-трет. бутиловый эфир, пропиленоксид, диоксан и тетрагидрофуран, кетоны, например, ацетон, метилэтилкетон, метилизопропилкетон и метилизобутилкетон, нитрилы, например, ацетонитрил и пропионитрил, спирты, например, метанол, этанол, изопропанол, бутанол или этиленгликоль, сложные эфиры, например, этилацетат и амилацетат, амиды кислот, например, диметилформав которой R15 означает галоген или R16-SO2- примид, диметилацетамид и N-метилпирролидон, чѐм R16 может быть алкилом с 1 - 4 атома углесульфоксиды и сульфоны, например, диметилрода, галогеналкилом с 1 - 4 атомами углерода сульфоксид и сульфолан, основания, например, или фенилом. Реакция происходит, предпочтипиридин, циклические мочевины, такие как 1,3тельно, в одном из вышеназванных инертном расдиметилимидазолидин-2-он и 1,3-диметил-3,4,5,6творителе при добавлении подходящего основатетрагидро-2( 1 Н)-пиримидинон. ния, т.е. основания, которое способствует депроРеакцию проводят предпочтительно в интертонизации промежуточного продукта формулы VI, вале температур от 0°С до температуры кипения в области температур от комнатной до темперарастворителя или смеси растворителей. туры кипения растворителя. Присутствие катализатора реакции является Соединения формулы VII являются отчасти предпочтительным. В качестве катализатора моизвестными товарными продуктами или могут гут применяться сильные органические и неоргабыть получены известным способом. нические кислоты, а также кислоты Льюиса. НаОснованиями могут служить гидрид щелочпример, среди прочих применяются серная киного или щелочноземельного металла, такой как слота, соляная кислота, трифторуксусная кислота, гидрид натрия, гидрид калия или гидрид кальция, п-толуол-сульфокислота, эфират трѐхфтористого карбонат щелочного металла, например, карбонат бора и алкоголят титана (IV). натрия или калия, гидроокись щелочного или ще4 5 Соединения формулы VI, у которых R и R лочноземельного металла, например, гидроокись означают циклоалкил, могут быть также получены, натрия или калия, металлорганическое соедине4 5 если соединения формулы VI, у которых R и R ние, например, бутиллития или амид щелочного означают фенил, нафтил или замещѐнные, как металла, например, литийизопропиламид. описано выше, фенил или нафтил, подвергать Соединения согласно изобретению, у которых гидрированию в кольце. Υ означает серу и остальные заместители имеют Соединения формулы VI могут быть получены указанное для формулы I значение, могут быть в виде чистых энантиомеров, исходя из чистых получены, например, таким образом, что произэнантиомеров формулы IV путѐм их взаимодействодные карбоновой кислоты общей формулы VIII, вия описанным способом с соединениями форкоторые известным образом получаются из сомулы V. единений общей формулы VI и у которых заместиКроме того, энантиомерно чистые соединения 9 45985 10 тели имеют вышеуказанное значение, вводят в Соединения формулы R!-A с реакцию с соединениями общей формулы IX, в реакционноспособным заместителем А являются которой R2, R3 и X имеют значение, указанное для известными или легко могут быть получены формулы I. известными способами. Это взаимодействие проводят в обычных растворителях и предпочтительно с добавкой основания, причѐм могут применяться все приведѐнные выше основания. Остаток R в формуле I может широко вариироваться. Например, R может означать группу Реакция предпочтительно проходит в одном из вышеназванных инертном разбавителе с добавлением подходящего основания, т.е. основания, способствующего депротонизации промежув которой R1 имеет следующее значение: точного продукта IX, при температуре от комната) водород; ной до температуры кипения растворителя. б) сукцинилимидоксигруппа; В качестве основания, кроме вышеназванных, в) присоединѐнный через атом азота могут служить также органические основания, напятичленный гетероцикл, например, пироллил, пример, триэтиламин, пиридин, имидизол или пиразолил, имидазолил или триазолил, имеющий диаз абициклоундекан. от одного до двух атомов галогена, в частности, Производные карбоновой кислоты формулы фтор и хлор, и/или от одного до двух следующих Vla (Z в формуле VI означает прямую связь) могут остатков: быть получены путѐм взаимодействия эпоксидов алкил с 1 - 4 атомами углерода, например, формулы IV с купратами формулы XI: метил, этил, 1-пропил, 2-про-пил, 2-метил-2пропил, 2-метил-1-пропил, 1-бутил, 2-бутил; галогеналкил с 1-4 атомами углерода, в частности, галогеналкил с 1 - 2 атомами углерода, например, фторметил, дифторметил, трифторметил, хлордифторметил, дихлорфторметил, трихлорметил, 1-фторэтил, 2фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2Купраты получают, как описано в Tetrahedron хлор-2,2-дифторэтил, 2,2-дихлор-2-фторэтил, Letters 23, 3755 (1982). 2,2,2-трихлорэтил и пентафторэтил; Соединения формулы I могут быть также галогеналкокси с 1 - 4 атомами углерода, в получены, исходя из соответствующих частности, галогеналкокси с 1 - 2 атомами карбоновых кислот, т.е. соединений формулы І, у углерода, например, дифторметокси, которых R означает карбоксильную группу, путѐм трифторметокси, хлордифторметокси, 1перевода их сначала в активную форму, фторэтокси, 2-фторэтокси, 2,2-дифторэтокси, например, галогенид кислоты, ангидрид или 1,1,2,2-тетрафторэтокси, 2,2,2-трифторэтокси, 2имидазолид, которые затем подвергают хлор-1,1,2-трифтор-этокси и пентафторэтокси, в взаимодействию с соответствующим частности, трифторметокси; гидроксильным соединением HÖR10. Это алкокси с 1 - 4 атомами углерода, например, взаимодействие проводят в обычных метокси, этокси, пропокси, 1-метиленэтокси, растворителях и часто при добавке оснований, бутокси, 1-метилпропокси, 2-метилпропокси, 1,1указанных выше. Эти обе операции могут быть диметилэтокси, в частности, метокси, этокси, 1также упрощены тем, что карбоновыми кислотами метилэтокси; действуют на гидроксильное соединение в алкилтио с 1 - 4 атомами углерода, например, присутствии водоотщепляющего средства, метилтио, этилтио, про-пилтио, 1-метилэтилтио, например, карбодиимида. бутилтио, 1-метилпропилтио, 2-метилпропил-тио, Кроме того, соединения формулы I могут 1,1 -диметилэтилтио, в частности, метилтио или быть получены таким образом, что исходят из этилтио; солей соответствующих карбоновых кислот, т.е. г) R1 означает далее остаток соединений формулы I, у которых R означает группу COR1 и R1 означает ОМ, причѐм M может быть катионом щелочного металла или эквивалентом катиона щелочноземельного металла. Эти соли можно вводить в реакцию со многими соединениями формулы R1-A, причѐм А означает нуклеофильную отходящую группу, например, галоген, такой как хлор, бром, иод, или в котором m означает 0 или 1 и R7 и R8 могут быть возможно замещѐнный галогеном, алкилом или одинаковыми или различными и имеют галогеналкилом арил- или алкилсульфонил, следующее значение: например, толуолсульфонил и метилсульфонил, водород; или другую эквивалентную отходящую группу. алкил с 1 - 8 атомами углерода, в частности, 11 45985 12 алкил с 1-4 атомами углерода; метилэтоксикарбонил, бутилоксикарбонил, 1 алкенил с 3 - 6 атомами углерода, например, метилпропилоксикарбонил, 22-пропенил, 2-бутенил, 3-бутенил, 1-метил-2метилпропилоксикарбонил, 1,1 пропенил, 2-метил-2-пропенил, 2-пентенил, 3диметилэтоксикарбонил; пентенил, 4-пентенил, 1-метил-2-бутенил, 2алкенилкарбонил с 3 - 6 атомами углерода в метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3алкенильной части, алкинилкарбонил с 3 - 6 бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, атомами углерода в алкинилыюй части, 1,1-диметил-2-пропенил, 1,2-диметил-2-пропенил, алкенилоксикарбонил с 3 - 6 атомами углерода в 1-этил-2-пропенил, 2-гексенил, 3-гексенил, 4алкенильной части и алкинилоксикарбонил с 3 - 6 гексенил, 5-гексенил, 1-метил-2-пентенил, 2атомами углерода в алкинильной части, причѐм метил-2-пентенил, 3-метил-2-пентенил, 4-метил-2алкенильные и алкинильные остатки имеют пентенил, 3-метил-3-пентенил, 4-метил-3предпочтительно значения, указанные для них пентенил, 1-метил-4-пентенил, 2-метил-4выше; пентенил, 3-метил-4-пентенил, 4-метил-4фенил, который может быть однопентенил, 1,1 -диметил-2-бутенил, 1,1 -диметил-3многократно, например, от одного до трѐх раз, бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3замещѐн галогеном, нитрогруппой, цианогруппой, бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3алкилом c 1 4 атомами углерода, бутенил, 2,2-диметил-З-бутенил, 2,3-диметил-2галогеналкилом с 1 - 4 атомами углерода, бутенил, 2,3-диметил-3-бутенил, 1-этил-2-бутенил, алкоксигруппой с 1 - 4 атомами углерода, 1-этил-3-бутенил, 2-этил-2-бутенил, 2-этил-3галогеналкокси с 1 - 4 атомами углерода или бутенил, 1,1,2-триметил-2-пропенил, 1 -этил-1 алкилтиогруппой с 1 - 4 атомами углерода, метил-2-пропенил и 1-этил-2-метил-2-пропенил, в например, 2-фторфенил, 3-хлорфенил, 4частности, 2-пропенил, 2-бутенил, 3-метил-2бромфенил, 2-метилфенил, 3-нитрофенил, 4бутенил и 3-метил-2-пентенил; цианофенил, 2-трифторметилфенил, 3алкинил с 3 - 6 атомами углерода, например, метоксифенил, 4-трифторэтокси-фенил, 22-пропинил, 2-бутинил, 3-бутинил, 1-метил-2метилтиофенил, 2,4-дихлорфенил, 2-метокси-3пропинил, 2-пентинил, 3-пентинил, 4-пентинил, 1метилфенил, 2,4-диметоксифенил, 2-нитро-5метил-3-бутинил, 2-метил-3-бутинил, 1-метил-2цианофенил, 2,6-дифторфенил; бутинил, 1,1-диметил-2-пропинил, 1-этил-2диалкиламино с 1 - 4 атомами углерода в пропинил, 2-гексинил, 3-гексинил, 4-гексинил, 5алкильной части, в частности, диметиламино, гексинил, 1-метил-2-пентинил, 1-метил-3дипропиламино, N-пропил-N-метиламино, Nпентинил, 1-метил-4-пентинил, 2-метил-3пропил-N-этиламино, диизопропиламино, Nпентинил, 2-метил 4 пентинил, 3-метил-4изопропил-N-метиламино, N-изопропил-Nпентинил, 4-метил-2-пентинил, 1,1 -диметил-2этиламино, N-изопропил-N-пропиламино; бутинил, 1,1 -диметил-3-бутинил, 1,2-диметил-3далее, R7 и R8 означают фенил, который бутинил, 2,2-диметил-3-бутинил, 1-этил-2-бутинил, может быть замещѐн одним или несколькими, 1-этил-3-бутинил, 2-этил-2-бутинил и 1-этил-1например, одним - тремя следующими остатками: метил-2-пропинил, предпочтительно, 2-пропинил, галоген, нитро, циано, алкил с 1 - 4 атомами 2-бутинил, 1-метил-2-пропинил и 1-метил-2углерода, галогеналкил с 1 - 4 атомами углерода, бутинил, в частности, 2-пропинил; алкокси с 1 - 4 атомами углерода или алкилтио с 1 циклоалкил с 3 - 8 атомами углерода, - 4 атомами углерода, как в частности указано например, циклопропил, циклобу-тил, выше; или циклопентил, циклогексил, циклогептил и R7 и R8 вместе образуют закрытую в кольцо, циклооктил, причѐм каждая из этих алкильных, желательно замещѐнную, например, алкилом с 1 циклоалкильных, алкенильных или алкинильных 4 атомами углерода, алкиленовую цепь с 4 - 7 групп может иметь от одного до пяти атомов атомами углерода, которая может содержать галогена, в частности, фтора или хлора, и/или от гетероатом, выбранный из группы: кислород, сера одной до двух следующих групп: или азот, например, -(СН2)4-, -(CH2)5-, -(СН2)6-, алкил с 1 - 4 атомами углерода, алкокси с 1 - 4 (СН2)7-, -(СН2)2-O-(СН2)2-, -CH2-S-(CH2)3-, -(СН2)2атомами углерода, алкилтио с 1 - 4 атомами О-(СН2)3-, -NH-(CH2)3-, -CH2-NH-(CH2)2-, -СН2-СН = углерода, галогеналкокси с 1 - 4 атомами СН-СН2-, -СН = СН-(СН2)3; углерода, алкенилокси с 3 - 6 атомами углерода, д) R1 означает далее группу алкенилтио с 3 - 6 атомами углерода, алкинилокси с 3 - 6 атомами углерода, причѐм имеющиеся в этих остатках алкенильные и алкинильные составляющие предпочтительно соответствуют указанным выше значениям; алкилкарбонил с 1 - 4 атомами углерода в в которой k означает 0,1 или 2, алкильной части, в частности, метилкарбонил, p означает 1, 2, 3 и 4 и 9 этилкарбонил, пропилкарбонил, 1R имеет следующие значения: метилэтилкарбонил, бутилкарбонил, 1алкил с 1 - 4 атомами углерода, галогеналкил метилпропилкарбонил, 2-метилпропилкарбонил, с 1 - 4 атомами углерода, алкенил с 3 - 6 атомами 1,1-диметилэтилкарбонил; углерода, алкинил с 3 - 6 атомами углерода или алкоксикарбонил с 1 - 4 атомами углерода в возможно замещѐнный, как в частности указано алкоксильной части, например, метоксикарбонил, выше, фенил; этоксикарбонил, пропоксикарбонил, 1е) R1 означает далее остаток OR10, где R10 13 45985 14 имеет следующие значения: алкильную группу с 2 - 6 атомами углерода, водород, катион щелочного металла, такого которая в положении 2 имеет один из следующих как литий, натрий, калий, или катион остатков: алкоксиимино с 1 - 4 атомами углерода, щелочноземельного металла, такого как кальций, алкинилоксиимино с 3 - 6 атомами углерода, магний или барий, или безвредный для галогеналкенилоксиимино с 3 - 6 атомами окружающей среды ион оганического аммония, углерода или бензилоксиимино; такой как четвертичный алкил аммония с 1 - 4 алкенильную или алкинильную группу, атомами углерода, или ион аммония; содержащие от 3 до 6 атомов углерода, каждая из циклоалкил с 3 - 8 атомами углерода, как которых, в свою очередь, может иметь от одного указано выше, который может быть замещѐн до пяти атомов галогена; одной - тремя алкильными группами с 1 - 4 R10 далее означает фенильный остаток, атомами углерода; который может иметь от одного до пяти атомов алкил с 1 - 8 атомами углерода, в частности, галогена и/или от одного до трѐх следующих метил, этил, пропил, 1-метил-этил, бутил, 1остатков: нитро, циано, алкил с 1 - 4 атомами метилпропил, 2-метилпропил, 1,1-диметилэтил, углерода, галогеналкил с 1 - 4 атомами углерода, пентил, 1-метилбутил, 2-метилбутил, 3алкокси с 1 - 4 атомами углерода, галогеналкокси метилбутил, 1,2-диметилпропил, 1,1-димес 1 - 4 атомами углерода и/или алкилтио с 1 - 4 тилпропил, 2,2-диметилпропил, 1-этилпропил, атомами углерода, как в частности указано выше; гексил, 1-метилпентил, 2-метилпентил, 3присоединенный через атом азота 5-членный метилпентил, 1-метилпентил, 1,2-диметилбутил, гетероароматический цикл, содержащий от одного 1,3-диметилбутил, 2,3-диметилбутил, 1,1до трѐх атомов азота, и который может иметь от диметилбутил, 2,2-диметилбутил, 3,3одного до двух атомов галогена и/или один или диметилбутил, 1,1,2-триметилпропил, 1,2,2два следующие остатки: алкил с 1 - 4 атомами триметилпропил, 1 -этилбутил, 2-этилбутил, 1углерода, галогеналкил с 1 - 4 атомами углерода, этил-2-метилпропил, которые могут иметь от алкокси с 1 - 4 атомами углерода, фенил, одного до пяти атомов галогена, в частности галогеналкокси с 1 - 4 атомами углерода и/или фтора или хлора и/или один из следующих алкилтио с 1 - 4 атомами углерода. В частности остатков: следует назвать: 1-пиразолил, 3-метил-1алкокси с 1 - 4 атомами углерода, алкилтио с 1 пиразолил, 4-метил-1-пиразолил, 3,5-диметил-1- 4 атомами углерода, циано, алкилкарбонил с 1 пиразолил, 3-фенил-1-пиразолил, 4-фенил-14 атомами углерода, циклоалкил с 3 - 8 атомами пиразолил, 4-хлор-1-пиразолил, 4-бром-1углерода, алкоксикарбонил с 1 - 4 атомами пиразолил, 1-имидазолил, 1-бензимидазолил, углерода, фенил, фенокси или фенилкарбонил, 1,2,4-триазол-1-ил, 3-метил-1,2,4-триазол-1-ил, 5причѐм ароматические остатки, в свою очередь, метил-1,2,4-триазол-1-ил, 1-бентриазолил, 3,4могут иметь от одного до пяти атомов галогена дихлор-имидазол-1 -ил; и/или от одного до трѐх следующих остатков: R10 означает также группу нитро, циано, алкил с 1 - 4 атомами углерода, галогеналкил с 1 - 4 атомами углерода, алкокси с 1 - 4 атомами углерода, галогеналкокси с 1 - 4 атомами углерода и/или алкилтил с 1 - 4 атомами где R11 и R12 могут быть одинаковые или углерода, как в частности это указано выше; различные и означают: алкил с 1 - 8 атомами алкильную группу с 1 - 8 атомами углерода, углерода, алкенил с 3 - 6 атомами углерода, как это указано выше, которая может иметь от алкинил с 3 - 6 атомами углерода, циклоалкил с 3 одного до пяти атомов галогена, в частности, - 8 атомами углерода, причѐм эти остатки могут фтора и/или хлора, или один из следующих быть замещены алкоксигруппой с 1 - 4 атомами остатков: 5-членный гетероцикл, содержащий от углерода, алкилтиогруппой с 1 - 4 атомами одного до трѐх атомов азота, или 5-членный углерода и/или возможно замещѐнным гетероцикл, содержащий один атом азота и один фенильным остатком, как в частности было атом кислорода или серы, и который может иметь указано выше; от одного до четырѐх атомов галогена и/или от фенил, который может иметь один или одного до двух следующих остатка: несколько, например, от одного до трѐх нитро, циано, алкил с 1 - 4 атомами углерода, следующих остатков: галоген, нитро, циано, алкил галогеналкил с 1 - 4 атомами углерода, алкокси с с 1 - 4 атомами углерода, галогеналкил с 1 - 4 1 - 4 атомами углерода, фенил, галогеналкокси с 1 атомами углерода, алкокси с 1 - 4 атомами - 4 атомами углерода и/или алкилтио с 1 - 4 углерода, галоген алкокси с 1 - 4 атомами атомами углерода, в частности следует назвать: углерода или алкилтио с 1 - 4 атомами углерода, 1-пиразолил, 3-метил-1-пиразолил, 4-метил-1причѐм эти остатки, в частности, соответствуют пиразолил, 3,5-диметил-1-пиразолил, 3-фенил-1вышеуказанным; или пиразолил, 4-фенил-1- пиразолил, 4-хлор-111 12 R и R вместе образуют алкиленовую цепь с пиразолил, 4-бром-1-пиразолил, 1-имидазолил, 13 - 12 атомами углерода, которая может иметь от бензимидазолил, 1,2,4-триазол-1 -ил, 3-метилодной до трѐх алкильных групп с 1 - 4 атомами 1,2,4-триазол-1 -ил, 5-метил-1,2,4-триазол-1 -ил, 1углерода и гетероатом, выбранный из группы безтриазолил, 3-изопропилизоксазол-5-ил, 3кислород, сера и азот, как, в частности указано метилизоксазол-5-ил, оксазол-2-ил, тиазол-2-ил, для R7 и R8; имидазол-2-ил, 3-этилизоксазол-5-ил, 3ж) R1 означает также остаток фенилизоксазол-5-ил, 3-трет.- бутилизоксазол; 15 45985 16 галоген, нитро, гидрокси, циано, меркапто, амино, алкил с 1 - 4 атомами углерода, галогеналкил с 1 4 атомами углерода, алкокси с 1 - 4 атомами углерода, галогеналкокси с 1 - 4 атомами углерода, алкилтио с 1 - 4 атомами углерода, алкиламино с 1 - 4 атомами углерода, диалкиламино с 1 - 4 атомами углерода в 13 где R означает: алкильной части, алкилкарбонил с 1 - 4 атомами алкил с 1 - 4 атомами углерода, алкенил с 3 углерода в алкильной части, алкоксикарбонил с 1 6 атомами углерода, алкинил с 3 - 6 атомами 4 атомами углерода или углерода, циклоалкил с 3 - 8 атомами углерода, R4 и R5 означают фенил или нафтил, которые как, в частности, указано выше, причѐм эти в орто-положении соединены друг с другом остатки могут быть замещены алкоксигруппой с 1 прямой связью, метиленовой, этиленовой или 4 атомами углерода, алкилтиогруппой с 1 - 4 этениленовой группой, атомом кислорода или атомами углерода и/или фенильным остатком, как серы или сульфонилом, NH- или N-алкильной указано выше; группой, или являются циклоалкилом с 3 - 7 фенил, возможно замещѐнный, как, в атомами углерода; частности, указано выше; R6 означает алкил с 1 - 8 атомами углерода, 1 з) R означает остаток алкенил с 3 - 6 атомами углерода, алкинил с 3 - 6 атомами углерода или циклоалкил с 3 - 8 атомами углерода, как это в частности указано выше, причѐм каждый из этих остатков может быть одномногократно замещѐн галогеном, гидрокси, нитро, циано, алкокси с 1 - 4 атомами углерода, алкенилокси с 3 - 6 атомами углерода, алкинилокси с 3 - 6 атомами углерода, алкилтио с где R13 имеет указанное выше значение; 1 - 4 атомами углерода, галогеналкокси с 1 - 4 R может означать также тетразол или нитрил. атомами углерода, алкилкарбонилом с 1 - 4 С учѐтом биологической активности атомами углерода, гидроксикарбонилом, предпочтительными являются производные алкоксикарбонилом с 1 - 4 атомами углерода, карбоновых кислот общей формулы I, как в виде алкиламино с 1 - 4 атомами углерода, чистых энантиомеров или диастереомеров, так и в диалкиламино с 1 - 4 атомами углерода в виде их смеси, в которых заместители имеют алкильной части или возможно замещѐнным следующее значение: фенилом или фенокси, как в частности указано R2 водород, гидрокси, диалкиламин с 1 - 4 выше; атомами углерода в алкильной части, названные, фенил или нафтил, который может быть в частности для R1 алкильная группа с 1 - 4 замещѐн одним или несколькими остатками: атомами углерода, галогеналкильная группа с 1 галоген, нитро, циано, гидрокси, амино, алкил с 1 4 атомами углерода, алкоксигруппа с 1 - 4 4 атомами углерода, галогеналкил с 1 - 4 атомами атомами углерода, галогеналкоксигруппа с 1 - 4, углерода, алкокси с 1-4 атомами углерода, алкилтиогруппа с 1 - 4 атомами углерода и атомы галогеналкокси с 1 - 4 атомами углерода, фенокси, галогена, в частности, хлор, метил, метокси, алкилтио с 1 – 4 атомами углерода, алкиламино с этокси, дифторметокси, трифторметокси; 1 - 4 атомами углерода или диалкиламино с 1 - 4 X азот или CR14, где атомами углерода в алкильной части, как это R14 означает водород или алкил или CR14 указано в частности для R7 и R4; вместе с CR3 образуют 4- 5-членное алкиленовое пяти- или шестичленнеє гетероароматическое или алкениловое кольцо, в котором каждая кольцо, содержащее от одного до трѐх атомов метиленовая группа может быть заменена азота и/или атом серы или кислорода и от одного кислородом или серой, например, -СН2-СН2-О-, до четырѐх атомов галогена и/или один или два СН = СН-О-, -СН2-СН2-СН2-О-, -СН = СН-СН2-О-, в следующих остатка: алкил с 1 - 4 атомами частности, водород, -СН2-СН2-О-, -СН(СН3)углерода, галогеналкил с 1 - 4 атомами углерода, СН(СН3)-О-, - С(СН3) = С(СН3)-О-, -СН = С(СН3)-Оалкокси с 1 - 4 атомами углерода, галогеналкокси или -C(CH3) = C(CH3)-S; с 1 - 4 атомами углерода, алкилтио с 1 - 4 атомами R3 означает названные для R1 водород, углерода, фенил, фенокси или фенилкарбонил, гидрокси, диалкиламиногруппу с 1 - 4 атомами причѐм фенильные остатки, в свою очередь, могут углерода в алкильной части, алкильную группу 1 иметь от одного до пяти атомов галогена и/ или от 4 атомами углерода, алкоксильную группу с 1 - 4 одного до трѐх следующих остатков: алкил с 1 - 4 атомами углерода, галогеналкоксигруппу с 1 - 4 атомами углерода, галогеналкил с 1 - 4 атомами атомами углерода, алкилтиогруппу с 1 – 4 углерода, алкокси с 1 - 4 атомами углерода, атомами углерода или атомы галогена, в галогеналкокси с 1 - 4 атомами углерода и/или частности хлор, метил, метокси, этокси, алкилтио с 1 - 4 атомами углерода, как в дифторметокси, трифторметокси или вместе с R14, частности указано для R4; как указано выше, соединено в 5- или 6-членное Υ означает серу, кислород или простую связь; кольцо; Ζ означает серу, кислород, тионильную R4 и R5 означают фенил или нафтил, которые группу, сульфонильную группу или простую связь. могут быть замещены одним или несколькими, Особенно предпочтительными являются например, одним-тремя следующими остатками: 17 45985 18 соединения формулы I, как в виде чистых Υ означает серу, кислород или простую связь; энантиомеров или чистых диастереомеров, так и в Ζ означает серу, кислород, тионильную виде их смеси, у которых заместители имеют группу, сульфонильную группу или простую связь. следующее значение: Соединения согласно настоящего R2 алкил с 1 - 4 атомами углерода, изобретения предлагают новые возможности для 14 X азот или CR , где лечения гипертонии, лѐгочной гипертонии, 14 R означает водород или алкил или CR14 инфаркта миокарда, стенокардии, острой вместе с CR3 образуют 4- 5-членное алкиленовое почечной недостаточности, почечной или алкениловое кольцо, например, -СН2-СH2недостаточности, спазмов сосудов головного СH2-, -СН = СН-СН2-, в котором каждая мозга, церебральной ишемии, субарахноидальных метиленовая группа может быть заменена кровоизлияний, мигреней, астмы, атеросклероза, кислородом или серой, например, -СH2-СH2-О-, эндотоксического шока, вызванной эндоксином СН = СН-О-, -СН2-СН2-СН2-О-, -СН = СН-СН2-О-, в недостаточности органов, внутрисосудистой частности, водород, -СН2-СН2-О-, -СН(СН3)коагуляции, повторных стенозов после СН(СН3)-О-, - С(СН3)=С(СН3)-О-, -СН = С(СН3)-Оангиопластии, гиперплазии доброкачественной или -С(СН3)=С(СН3)-S; простаты, ишемической и вызванной R3 означает названные для R1 алкильные интоксикацией недостаточности почек или группы с 1 - 4 атомами углерода, алкоксильные гипертонии. группы с 1 - 4 атомами углерода, алкилтиогруппы Хорошая активность соединений с 1 - 4 атомами углерода или вместе с R14 показывается на следующих опытах: соединено в 5- или 6-членное кольцо; Изучение связывания рецептора R4 и R5 являются одинаковыми или Для изучения связывания применяют различными и означают фенил, который может клонированные клетки яичников китайского быть замещѐн одним или несколькими остатками: хомячка (СНО), экспримирующие ЕТА-рецептор, и галоген, нитро, гидрокси, алкил с 1 - 4 атомами мембраны мозжечка морской свинки с > 60% ЕТвуглерода, алкокси с 1 - 4 атомами углерода, рецепторов по сравнению с ЕТА-рецепторами. алкилтио с 1 - 4 атомами углерода или Получение препарата мембран R4 и R5 являются фенильными группами, Клетки СНО, экспримирующие ЕТА-рецептор, которые в орто-положении связаны друг с другом культивируют в среде F12 с 10% телячьей прямой связью, метиленовой, этиленовой или эмбриональной сывороткой, 1% глутамином, 100 этениленовой группой, атомом кислорода или Е/мл пеницилина и 0,2% стрептомицином (Гибко серы или сульфонильной группой, группой NHБРЛ, Гайтерсбург, МД, США). Спустя 48 часов или N-алкильной группой, или клетки промывают забуференным фосфатом R4 и R5 являются циклоалкилом с 3 - 7 физиологическим раствором (ЗФР) и инкубируют 5 атомами углерода; минут в ЗФР, содержащем 0,05% трипсина. После R6 означает алкил с 1 - 8 атомами углерода, этого нейтрализуют средой Р12 и клетки алкенил с 3 - 6 атомами углерода или циклоалкил центрифугируют при ускорении 300g. Для лизиса с 3 - 8 атомами углерода, причѐм каждый их этих клеток осадок быстро промывают буфером (5мМ остатков может быть однократно или многократно Трис-HCL, рН = 7,4 с 10% глицерином) и после замещѐн галогеном, гидрокси, нитро, циано, этого инкубируют при концентрации клеток 10-7/мл алкокси с 1 - 4 атомами углерода, алкенилокси с 3 лизисного буфера в течение 30 минут при 4°С. - 6 атомами углерода, алкилтио с 1 - 4 атомами Мембраны центрифугируют при ускорении 20.000 углерода; g в течение 10 минут и осадок помещают в жидкий фенил или нафтил, который может иметь азот. Мозжечки морских свинок гомогенизируют в один или несколько следующих заместителей: гомогенизаторе Поттера-Эльвейхема и препарат галоген, нитро, циано, амино, алкил с 1 - 4 выделяют с помощью дифференциального атомами углерода, галогеналкил с 1 - 4 атомами центрифугирования в течение 10 минут при углерода, алкокси с 1 - 4 атомами углерода, ускорении 1000g и повторного центрифугирования галогеналкокси с 1 - 4 атомами углерода, фенокси, надосадочной жидкости в течение 10 минут при алкилтио с 1 - 4 атомами углерода, алкиламино с ускорении 20.000g. 1 - 4 атомами углерода или диалкиламино с 1 - 4 Испытание на связывание атомами углерода в алкильной части; Для испытания на связывание ЕТА - и ЕТв пяти- или шестичленнеє гетероароматическое рецепторов суспендируют мембраны в кольцо, содержащее атом азота и/или серы или инкубационном буфере (50мМ Трис-HCL, pH 7.4 с кислорода и имеющее от одного до четырѐх 5мМ МnСl2, 40мкг/мл бацитрацина и 0,2% бычьего атомов галогена и/или один или два следующих сыворотного альбумина) при концентрации 50мкг остатка: алкил с 1 - 4 атомами углерода, протеина на испытуемую загрузку и инкубируют галогеналкил с 1 - 4 атомами углерода, алкокси с при 25°С с 25пМ [125J]-ЕТ1 ( испытание на ЕТА1 - 4 атомами углерода, алкилтио с 1 - 4 атомами рецептор) или с 25пМ [125 J]-RZ3 ( испытание на углерода, фенил, фенокси или фенилкарбонил, ЕТв-рецептор) в присутствии или в отсутствие причѐм фенильные остатки, в свою очередь, могут испытуемого вещества. Неспецифическое иметь от одного до пяти атомов галогена и/или от связывание определяют с 10-7 Μ ЕТ1. Спустя 30 одного до трѐх следующих остатка: алкил с 1 - 4 минут свободный и связанный радиолиганд атомами углерода, галогеналкил с 1 - 4 атомами разделяют фильтрацией через фильтр со углерода, алкокси с 1 - 4 атомами углерода и/или стекловолокном (фирмы Ватман, Англия) в алкилтио с 1 - 4 атомами углерода; сборнике клеток (фирмы Скатрон, Лиер, Норвегия) 19 45985 20 и фильтр промывают охлажденным льдом веса тела животное погибает через несколько буфером Трис-HCL с pH 7,4, содержащим 0,2% минут. Летальную дозу эндотелина-1 определяют бычьего сывороточного альбумина. на небольшой группе животных. Если испытуемое Радиоактивность собранного с фильтра остатка соединение вводят внутривенно, то обычно спустя определяют количественно с помощью 5 минут следует летальная инъекция эндотелинажидкостного сцинтилляционного счѐтчика Пакард 1 в сравнительной группе животных. При других 2200 СА. способах введения это время предварительного Функциональная система испытания in vitro введения соединения удлиняется, иногда до для поиска антагонистов рецептора эндотелина нескольких часов. (подтип А) Регистрируют степень выживания и Эта система является функциональным, эффективные дозы, которые защищают 50% базирующимся на клетках испытанием для животных в течение 24 часов и более от рецептора эндотелина. Определѐнные клетки, внезапной остановки сердца, вызванной если они стимулированы эндотелином 1 (ЕТ1), эндотелином (ED 50). показывают повышение внутриклеточной Функциональное испытание сосудов на концентрации кальция. Это повышение может антагонисты рецепторов эндотелина. быть измерено в интактных клетках, которые На сегментах аорты кролика после нагружены красителями с повышенной предварительного напряжения в 2g и релаксации чувствительностью к кальцию. Выделенные у крыс в течение одного часа в растворе Кребса1-фибробласты, у которых был определѐн Хенселайта при 37°С и рН = 7,3 - 7,5 сначала эндогенный рецептор эндотелина (подтип А), снимают К+-контрактуру. После промывки строят нагружают следующим образом флюоресцентным кривую доз активности эндотелина до красителем фура-2-ан: после обработки максимального значения. Потенциальные трипсином клетки повторно суспендируют в антагонисты эндотелина наносят на другие буфере А (120мМ хлористый натрий, 5мМ препараты из той же аорты за 15 минут до хлористый калий, 1,5мМ хлористый магний, 1мМ начального значения на кривой доз активности хлористый кальций, 25мМ HEPES, 10мМ глюкоза, эндотелина. Эффекты от эндотелина pH 7,4) до плотности 2 х 106/мл и инкубируют 30 расчитывают в % К+- контрактуры. В случае минут при 37°С в темноте с фура-2-ан (2 мкм), активных антагонистов эндотелина происходит плурониксом F-127 (0,04%) и 0,2% -ным сдвиг вправо кривой доз активности. диметилсульфоксидом. После этого клетки Соединения по изобретению могут вводиться дважды промывают буфером А и повторно обычным образом орально или парентерально 6 суспендируют до плотности 2 х 10 /мл. Постоянно (подкожно, внутривенно, внутримышечно, регистрируют при 30°С сигнал флюоресценции внутрибрюшинно). Можно вводить их также через носовую полость с парами или аэрозолями. клеток с плотностью 2 106/мл при соотношении Дозировка зависит от возраста, состояния и экстинции к эмиссии равным 380 : 510. К клеткам веса пациента, а также от вида введения. Обычно добавляют испытуемое соединение и после дневная доза активного вещества составляет от инкубирования с ЕТ1 в течение 3 минут 0,5 до 50мг/кг веса тела при оральном введении и определяют максимальное изменение от 0,1 до 10мг/кг веса тела при парентеральном флюоресценции. Ответ клеток на ЕТ1 без введении. предварительного добавления испытуемого Новые соединения могут применяться в виде соединения служит контролем и означает 100%. обычных галеновых твѐрдых или жидких форм, Испытание ET-антагонистов in vivo например, в виде таблеток, покрытых оболочкой Самцов крыс SD весом 250-300г таблеток, капсул, порошков, гранул, драже, наркотизируют амобарбиталом, вводят свечей, растворов, мазей, кремов или аэрозолей. искусственное дыхание, ваготомизируют и Эти формы изготавливают обычным способом. извлекают спинной мозг. Вставляют катетры в Активные вещества могут перерабатываться Arteria carotis и Vena jugularis. У контрольных вместе с обычными в фармацевтике животных внутривенное введение 1мкг/кг ЕТ1 вспомогательными средствами, например, приводит к значительному повышению кровяного связующими, наполнителями, консервантами, давления, которое держится длительное время. разрыхлителями, средствами для регулирования За 5 минут до введения ЕТ1 испытуемым текучести, пластификаторами, смачивающими животным вводят внутривенно исследуемое средствами, диспергаторами, эмульгаторами, соединение (1мл/кг). Для определения ЕТрастворителями, средствами, замедляющими антагонистических свойств сравнивают выделение активного вещества, повышение давления у испытуемых животных иу антиокислителями и/или рабочими газами (см. H. контрольных животных. Sucker и др.: Pharmazeutische Technologie, изд. Гибель мышей вследствие внезапной Тием, Штутгарт, 1991). остановки сердца, наведѐнной эндотелином-1 Полученные таким образом Принцип испытания состоит в ингибировании фармацевтические формы содержат обычно вызванной эндотелином внезапной остановки активное вещество в количестве от 0,1 до сердца у мышей, вероятно обусловленной 90вес.%. сужением сосудов сердца, путѐм Примеры получения. предварительной обработки антагонистами Пример 1. рецептора эндотелина. После внутривенной Метиловый эфир 2-гидрокси-3-метокси-3,3инъекции 10нмоль/кг эндотелина в объѐме 5мл/кг 21 45985 22 дифенилпропионовой кислоты пиримидин-2-илокси)-3-метокси-3,3Растворяют 5г (19,6ммолей) метилового дифенилпропионовой кислоты в 4мл 1 н эфира 3,3-дифенил-2,3-эпоксипропионовой натриевой щѐлочи и 100мл воды. Раствор кислоты в 50мл абсолютного метанола и подвергают сушке вымораживанием и получают смешивают при 0°С с 0,1мл эфирата количественно натриевую соль введѐнной трѐхфтористого бора. Перемешивают 2 часа при карбоновой кислоты. 0°С и следующие 12 часов при комнатной Пример 6 температуре. Растворитель отгоняют, остаток Метиловый эфир 3,3-диІшклогексил-2поглощают этилацетатом, промывают раствором гидрокси-3-метоксипропионовой кислоты кислого углекислого натрия и водой и сушат над Растворяют 10г (34,9ммолей) метилового сульфатом магния. После отгонки растворителя эфира 2-гидрокси-3-метокси-3,3остаѐтся 5,5г ( 88% ) светло-жѐлтого масла. дифенилпропионовой кислоты в 50мл метанола и Пример 2. 50мл ледяной уксусной кислоты, смешивают с 1мл Метиловый эфир 2-гидрокси-3-фенокси-3.3гидрата оксида рутения (IV) в диоксане и дифенилпропионовой кислоты гидрируют водородом в автоклаве при 100атм и Нагревают вместе 5г ( 19,6ммолей) 100°С. Катализатор отфильтровывают, остаток метилового эфира 3,3-дифенил-2,3сгущают, смешивают с этиловым эфиром, эпоксипропионовой кислоты и 5,6г (60ммолей) промывают раствором поваренной соли, сушат фенола в течение 6 часов при 100°С. После органическую фазу и сгущают. Получают 10,1г отгонки избыточного фенола в глубоком вакууме и целевого продукта в виде масла. хроматографической очистки остатка на Пример 7 силикагеле с помощью смеси гексан/этилацетат Метиловый эфир 2-[(4,6-диметоксиполучают 4,9г (77%) светло-жѐлтого масла. пиримидин-2-ил)тио]-3-метокси-3,3Пример 3 дифенилпропионовой кислоты Метиловый эфир 2-(4,6-диметокси-пиримидинРастворяют 7,16г (25ммолей) метилового 2-илокси)-3-метокси-3,3-дифенилпропионовой эфира 2-гидрокси-3-метокси-3,3кислоты дифенилпропионовой кислоты в 50мл Растворяют 2,86г (10ммолей) метилового дихлорметана, прибавляют 3г (30ммолей) эфира 2-гидрокси-3-метокси-3,3триэтиламина и прикалывают при перемешивании дифенилпропионовой кислоты в 40мл 3.2г (28ммолей) хлорида метансульфокислоты. диметилформамида и смешивают с 0,3г Перемешивают 2 часа при комнатной (12ммолей) гидрида натрия. Перемешивают 1 час температуре, промывают водой, сушат над и затем прибавляют 2,2г (10ммолей) 4,6сульфатом магния и сгущают в вакууме. Остаток диметокси-2-метилсульфонилпиримидина. После поглощают в диметилформамиде и прикалывают к перемешивания в течение 12 часов при комнатной суспензии 12,9г (75ммолей) 4,6-диметокситемпературе осторожно гидролизуют с 10мл воды, пиримидин-2-тиола и 8,4г (100ммолей) кислого устанавливают уксусной кислотой значение рН = 5 углекислого натрия в 100мл диметилфомамида. и отгоняют растворитель в глубоком вакууме. После перемешивания в течение 2 часов при Остаток поглощают 100 мл этилацетата, комнатной темепературе и следующих 2 часов при промывают водой, сушат над сульфатом магния и 60°С выливают в 1л ледяной воды и отсасывают отгоняют растворитель. Остаток смешивают с образовавшийся осадок. После сушки остаѐтся 10мл этилового эфира и отсасывают полученный 3,19г (29%) белого порошка. осадок. После сушки остаѐтся 3, 48г (82%) белого Пример 8 порошка. Т. пл. 81°С. Метиловый эфир 2-гидрокси-3,3Пример 4 дифенилмасляной кислоты 2-(4,6-диметокси-пиримидин-2-илокси)3Растворяют 1,5г (5,9ммолей) метилового метокси-3,3-дифенилпропионовая кислота эфира 3,3-дифенил-2,3-эпоксипропионовой Растворяют 2,12г (5ммолей) 2-(4,6-диметоксикислоты в 10мл абсолютного эфира, прикалывают 3,3-дифенилпропионовой кислоты в 50мл к охлаждѐнному до -78°С раствору купрата, диоксана, смешивают с 10мл раствора 1 н полученного из 635мг (7 ммолей) цианида меди (I), калиевой щѐлочи и перемешивают 3 часа при растворѐнного в 10мл абсолютного этилового 100°С. Раствор разбавляют 300 мл воды и эфира, и 8,14мл (13ммолей) 1,6 н раствора экстрагируют для удаления непрореагировавшего метиллития. Перемешивают 1 час при -78°С и сложного эфира этилацетата. Затем с помощью дают раствору нагреться до комнатной разбавленной соляной кислоты устанавливают температуры. Затем разбавляют 100мл этилового значение pH водной фазы равное 1 - 2 и эфира и 100мл воды, эфирную фазу промывают экстрагируют этилацететом. После сушки над разбавленной лимонной кислотой и раствором сульфатом магния и отгонки растворителя кислого углекислого натрия и сушат над смешивают остаток со смесью этиловый сульфатом магния. Сырой продукт подвергают эфир/гексан и отсасывают оставшийся остаток. хроматографической очистке на силикагеле После сушки остаѐтся 1,85г (90%) белого смесью циклогексан / этилацетат и получают порошка. Т. пл. 167°С. 250мг (16%) светло-желтого масла. Пример 5 Пример 9 2-(4,6-диметокси-пиримидин-2-илокси)-32-гидрокси-3-метокси-3,3метокси-3,3-дифенилпропионат натрия дифенилпропионовая кислота Растворяют 1,68г (4ммоля) 2-(4,6-диметоксиСуспендируют 91,11г (0,5моля) бензофенона и 23 45985 24 45,92г (0,85моля) метилата натрия в 150мл метилРазделение на хиральных фазах с помощью трет.бутилового эфира (МТБ) при комнатной ВЭЖХ :100%-ное ВЭЖХ: 99,8% температуре. После охлаждения до -10°С Пример 11 прибавляют 92,24г (0,85моля) метилового эфира S-2-гидрокси-3-метокси-3,3хлоруксусной кислоты таким образом, чтобы дифенилпропионовая кислота (расщепление внутренняя температура поднялась до 40°С, рацемата с (S)-1-(4-нитрофенил)этиламином) причѐм затем опять охлаждают с помощью бани Смешивают 100г (0,368моля) 2-гидрокси-3до -10°С. Затем перемешивают ещѐ час без метокси-3,3-дифенилпропионовой кислоты в охлаждения при собственной температуре. После 750мл ацетона и 750мл МТБ при кипячении с добавления 250мл воды и короткого обратным холодильником с 30,5г (0,184моля) (S)перемешивания отделяют водную фазу. МТБ1-(4-нитрофенил)этиламина, затравливают, фазу промывают 250мл разбавленного раствора кипятят с обратным холодильником час и хлорида натрия. После замены растворителя на медленно охлаждают с кристаллизацией до метанол (250мл) прибавляют раствор 1г пкомнатной температуры. Кристаллы (S-2толуолсульфокислоты в 10мл метанола при гидрокси-3метокси-3,3-дифенилпропионовая комнатной температуре. Перемешивают час при кислота (S)-1-(4-нитрофенилфтиламин) собственной температуре и затем кипятят с отфильтровывают и промывают МТБ. После обратным холодильником. При отгонке метанола суспендирования остатка в 500мл воды и 350мл прикалывают 400г 10%-ной натриевой щѐлочи и МТБ устанавливают при комнатной температуре затем добавляют 60мл воды. Метанол отгоняют концентрированной соляной кислотой значение до тех пор, пока температура зумпфа не достигнет рН = 1,2, после перемешивания и разделения фаз 97°С. После охлаждения до 55°С смешивают с отделяют водную фазу и экстрагируют с 150мл 190мл МТБ и подкисляют 77мл МТБ. Объединѐнные органические фазы концентрированной соляной кислоты до рН = 2. экстрагируют с 100мл воды. После отгонки 370мл После охлаждения до комнатной температуры МТБ смешивают при нагревании с обратным отделяют водную фазу и концентрируют холодильником с 390мл н-гептана и медленно органическую фазу отгонкой 60мл МТБ. Добавкой охлаждают до комнатной температуры с 500мл гептана и медленным охлаждением до кристаллизацией продукта. После фильтрации, комнатной температуры выкристаллизовывают промывки н-гептаном и сушки в вакуумном продукт. Крупнокристаллический твѐрдый продукт сушильном шкафу получают 35,0г S-2-гидрокси-3отсасывают, промывают гептаном и сушат в метокси-3,3-дифенилпропионовой кислоты (выход вакуумном сушильном шкафу при 40°С до 35%, считая на рацемат). Разделение на постоянного веса. Выход 108г (80%), очистка с хиральных фазах с помощью ВЭЖХ : 100%-ное помощью ВЭЖХ > 99,5% по площади. ВЭЖХ: 99,8% Пример 10 Пример 12 S-2-гидрокси-3-метокси-3,3Бензиловый эфир 3-метокси-2-(4-метокси-6,7дифенилпропионовая кислота (расщепление дигидро-5Н-циклопентапиримидин-2-илокси)-3,3рацемата с L-ролинметиловым эфиром дифенил-пропионовой кислоты К 240г 57%-ного метанольного раствора Растворяют 24,48г (90ммолей) 3-метокси-3,3гидрохлорида L-пролинметилового эфира дифенил-2-гидроксипропионовой кислоты в 150мл (0,826моля) прикапывают при комнатной диметилформамида и смешивают с 13,7г температуре 148,8г 30%-ного метанольного (99ммолей) карбоната калия. Суспензию раствора метанолята натрия ( 0,826моль), 2,4 перемешивают 30минут при комнатной лМТБ и 225г (0,826моля) 2-гидрокси-3-метокситемпературе. Затем прикалывают за 5минут 3,3-дифенилпропионовой кислоты. После отгонки 10,7мл (90ммолей) бензилбромида и продолжают 2680мл смеси метанол-МТБ и одновременного перемешивать ещѐ час,при этом температура прикалывания 2,4л МТБ медленно охлаждают до поднимается до 32°С. комнатной температуры, кристаллы (R-2-гидроксиК этой смеси добавляют последовательно 3-метокси-3,3-дифенилпропионовая кислота L24,84г (180ммолей) карбоната калия и 20,52г пролинметиловый эфир) отсасывают и твѐрдое (90ммолей) 2-метансульфонил-4-метокси-6,7вещество промывают 150мл МТБ. Фильтрат дигидро-5Н-циклопентапиридина и перемешивают сгущают отгонкой 1,5л МТБ и смешивают с 1,0л 3 часа при 80°С. воды. При комнатной температуре Для обработки разбавляют содержимое колбы концентрированной соляной кислотой около 600мл воды, осторожно подкисляют устанавливают значение рН = 1,2 , после концентрированной соляной кислотой и перемешивании и разделении фаз отделяют прибавляют 250мл уксусного эфира. Выпадает водную фазу и экстрагируют с 0,4л МТБ. 31,4г кислого продукта, который Объединѐнные органические фазы экстрагируют с отфильтровывают. Из маточника выделяют 0,4л воды. После удаления МТБ остаток сложноэфирную фазу, водную фазу ещѐ раз растворяют при кипячении в 650мл толуола и экстрагируют этилацетатом и сгущают после затравки и медленного охлаждения объединѐнные органические выкристаллизовывают продукт. После фазы. Маслянистый остаток (19г) чистят фильтрации, промывки толуолом и сушки в хроматографически (циклогексан/этилацетат = вакуумном сушильном шкафу получают 78,7г S-29/1) и получают дополнительно ещѐ 10,5г кислого гидрокси-3-метокси-3,3-дифенилпропионовой продукта. кислоты (выход 35%, считая на рацемат). Общий выход: 41,9г (82,2 ммоль) 91% 25 45985 26 Т.пл.: 143 - 147°С Масс-спектр: МН+ = 511 30%-ного раствора в метаноле) и перемешивают 2 Пример 13 часа. Реакционный раствор упаривают, 3-метокси-2-(4-метокси-(6,7-дигидро-5Нпоглощают в этилацетате, подкисляют циклопентапиримидин-2-илокси)-3.3разбавленной соляной кислотой и этилацетатный дифенилпропионовая кислота экстракт упаривают. Остается Растворяют 40г (78,4ммоль) бензилового 15,6г масла. 1 эфира 3-метокси-2-(4-метокси-6,7-дигидро-5НH-ЯМР (диметилсульфоксид) циклопентапиримидин-2-илокси)-3,3-дифенилδ = 2,1 (квинтет, 2Н); 2,5 (с, 3Н); 2,8 (дт, 4Н); пропионовой кислоты в 400мл смеси этилацетат / 3,9 (с, 3Н ) ч/млн метанол (4:1), смешивают с около 500мг палладия Пример 18 на активированном угле (10%) и обрабатывают 2-метилсульфонил-4-метокси-6,7-дигидро-5Нводородом до прекращения поглощения газа. циклопентапиримидин Катализатор отфильтровывают, раствор Растворяют 15г (76,2ммолей) 4-метокси-2упаривают и остаток перекристаллизовывают из метилсульфонил-6,7-дигидро-5Нэтилового эфира. циклопентапиримидина в 160мл смеси ледяная Пример 14 уксусная кислота /метиленхлорид (1: 1) и Этиловый эфир 2S-3,3-дифенил-оксиран-2смешивают с 1,3г вольфрамата натрия. При 35°С карбоновой кислоты прикалывают 17,5мл (170ммолей) 30%-ного Растворяют 2,57г (10,2ммолей) этилового раствора перекиси водорода. Затем разбавляют эфира 3,3-дифенил-акриловой кислоты и 464мг 4500мл воды и 100мл метиленхлорида, фенилпиридин-N-оксида в 24мл метиленхлорида органическую фазу отделяют, сушат и упаривают. и смешивают с 432мг (6, мол.%) хлорида (5,5)-(+)Остаѐтся 14г масла, которое N,N'-бис(3,5-ди-трет.-бутилсалицилид)-1,2выкристаллизовывают из этилового эфира. 1 циклогександиамино-марганца (III). При H-ЯМР (дейтер. хлороформ), охлаждении льдом прибавляют 6,4мл 12%-ного δ = 2,2 (квинтет, 2Н); 3,0 (дт, 4Н); 3,3 (с, 3Н); раствора гипохлорида натрия, перемешивают 30 4,1 (с, 3Н )ч/млн минут при охлаждении льдом и в течение ночи при Пример 19 комнатной температуре. Реакционный раствор 1-бензолсульфонил-3-(4,6разбавляют водой до 200мл, экстрагируют диметоксипиримидин-2-илокси)-4-метокси-4,4этиловым эфиром, сушат и упаривают. Получают дифенил-бутан-2-он 2,85г бесцветного масла. После очистки с Растворяют 0,37г (2,4ммоля) помощью ВЭЖХ (циклогексан : этилацетат = 9 : 1) фенилметансульфона в 10мл сухого получают 1,12г масла с соотношением тетрагидрофурана, затем прикалывают при -70°С энантиомеров около 8:1 в пользу S-конфигурации. 2 эквивалента бутиллития (2,94мл, 1,6 молярный 1 H-ЯМР (дейтер. хлороформ), раствор в гексане). Через час при -70°С δ = 1,0 (т, 3Н); 3,9 (м, 3Н); 7,3 (м, 10Н) прикалывают 1г (2,4ммоля) метилового эфира 2Пример 15 (4,6-диметоксипиримидин-2-илокси)-3-метокси-3,32-метилсульфонил-6,7-дигидро-5Ндифенилпропиновой кислоты, растворенного в циклопентапиримидин-4-ол 5мл тетрагидрофурана. Реакционную смесь К 29,6г (528ммолей) калиевой щѐлочи в 396мл перемешивают 1 час при -70°С, 1 час при -10°С и метанола прибавляют последовательно 46,9г затем нагревают до комнатной температуры. (330ммолей) метилового эфира циклопентанон-2Для обработки прикалывают около 10мл карбоновой кислоты и 53,5г (192ммоля) сульфата насыщенного раствора хлористого аммония, 5-метилизотиомочевины и перемешивают в тщательно экстрагируют этилацетатом, течение ночи при комнатной температуре. объединѐнные органические фазы промывают Ревакционную смесь подкисляют 1 н соляной насыщенным раствором хлористого натрия и кислотой и разбавляют водой. Выпавшие сушат над сульфатом натрия. После сушки и кристаллы отфильтровывают и сушат. Получают концентрирования очищают полученный остаток 20г кристаллов. хроматографией на силикагеле (н-гептан / Пример 16 этилацетат 15% 30%) и затем с помощью 4-хлоро-2-метилсульфонил-6,7-дигидро-5НВЭЖХ на силикагеле марки RP (ацетонитрил / циклопентапиримидин вода + трифторацетат). В качестве продукта К 20г (110ммолей) 2-метилсульфонил-6,7получают 0,3г белого аморфного порошка. дигидро-5Н-циклопентапиримидина прибавляют Пример 20 255мл хлорокиси фосфора и перемешивают 3 3,3-дифенил-оксиран-2-карбонитрил часа при 80°С. Хлорокись фосфора отгоняют, Суспендируют 3,1г (54,0ммоля) метилата остаток разлагают льдом и отсасывают выпавшие натрия в 20мл сухого тетрагидрофурана, затем кристаллы. Получают 18,5г коричневатого прикалывают при -10°С смесь из 5г твѐрдого вещества. (27,4ммолей)бензофенона и 4,2г (54,9ммоля) Пример 17 хлорацетонитрила. Реакционную смесь 4-метокси-2-метилсульфанил-6,7-дигидро-5Нпродолжают перемешивать 2 часа при -10°С, циклопентапиримидин затем выливают на воду и многократно Растворяют 18,05г (90ммолей) 4-хлоро-2экстрагируют этилацетатом. Объединѐнные метилсульфанил-6,7-дигидро-5Норганические фазы сушат над сульфатом натрия, циклопентапиримидина в 200мл метанола. При сгущают и полученный остаток очищают 45°С прикалывают 16,7г метилата натрия (в виде хроматографией на силикагеле (н-гептан / 27 45985 28 этилацетат). фтористого калия и раствором хлористого натрия. Выход: 1,2г (20%) После сушки над сульфатом магния и сгущения 1 H-ЯМР (дейтер. хлороформ) остаѐтся 1,0г жѐлтого масла, которое очищают на δ = 3,9 (с, 1Н); 7,4-7,5 (м, 10 Η )ч/млн силикагеле (н-гептан / этилацетат). После Пример 21 сгущения фракций получают 60мг производного 2-гидрокси-3-метокси-3,3-дифенил1H-тетразола и 110мг производного 1-метилпропионитрил тетразола, оба в виде белых аморфных твѐрдых Растворяют 6,5г (29,4ммолей) 3,3-дифенилвеществ. оксиран-пропионитрила в 60мл метанола и 5-[2-(4,6-диметокси-пиримидин-2-илокси)-3смешивают при 0°С с 2мл раствора метокси-3,3-дифенил)-пропил]-1Н-тетразол бортрифторида с этиловым эфиром. Реакционную Масс-спектр (ионизация смесь снова перемешивают 1 час при 0°С, затем электрораспылением): 435 ( М+Н+ ) 1 продолжают перемешивать при комнатной H-ЯМР (дейтер. хлороформ): температуре в течение ночи. Для обработки δ = 3,28 (с, 3Н); 3,85 (с, 6Н); 5,75 (с, 1Н); 7,25разбавляют диэтиловым эфиром, промывают 7,40 (м, 10Н); 7,50 (с, 1Н)ч/млн. насыщенным раствором хлористого натрия, 5-[2-(4,6-диметокси-пиримидин-2-илокси) -3 органические фазы сушат над сульфатом натрия метокси-3,3-дифенил)-пропил]-1-метилтетразол и сгущают. В качестве остатка получают 7,3г Масс-спектр (ионизация белого аморфного порошка, который может электрораспылением): 471 ( М+Н+) 1 непосредственно использоваться для дальнейших H-ЯМР (дейтер. хлороформ): реакций. δ = 3,00 (с, 3Н); 3,35 (с, 3Н); 3,80 (с, 6Н); 5,75 1 H-ЯМР (дейтер. хлороформ), (с, 1Н); 7,30-7.40 (м, 11H) δ = 2,95 (шс, ОН ); 3,15 (с, ЗН); 5,3 ( с, 1Н); 7,3Пример 24 7,5 ( м, 10 Η ) ч/млн 2-(4,6-диметокси-пиримидин-2-илокси)-3Пример 22 метидсульфинил-3,3-дифенил-пропионовая 2-(4,6-диметокси-пиримидин 2-илокси) 3кислота метокси-3,3-дифенил-пропионитрид Вносят 1,2г (2,9ммолей) 2-(4,6-диметоксиРастворяют 7,3г (28,8ммолей) 2-гидрокси-3пиримидин-2-илокси)-3-метил-сульфанил-3,3метокси-3,3-дифенилпропиони-трила в 90мл дифенил-пропионовой кислоты в 15мл ледяной диметилформамида и смешивают с 4г уксусной кислоты при 0°С и прикалывают 294мкл (28,8ммолей) карбоната калия и 6,3г (28,8ммоль) 30%-ной перекиси водорода. Перемешивают в 2-метансульфонил-4,6-диметокси-пиримидина. течение ночи при комнатной температуре, Смесь перемешивают около 12 часов при выливают на воду, экстрагируют дихлорметаном и комнатной температуре, затем выливают на воду промывают растворами тиосульфата натрия и и экстрагируют этилацетатом. Объединѐнные поваренной соли. После сушки выделяют 1 г органические фазы снова промывают водой, вещества в виде белой пены. сушат и сгущают. Полученный остаток очищают Пример 25 затем на силикагеле (н-гептан / этилацетат). 2-(4,6-диметокси-пиримидин-2-илокси)-3Выход: 6,9 г белого аморфного порошка. метилсульфинил-3,3-дифенил-пропионовая Масс-спектр (метод бомбардировки быстрыми кислота атомами) : (М + Н+) Вносят 0,6г (1,45моля) 2-(4,6-диметокси1 H-ЯМР (дейтер. хлороформ), пиримидин-2-илокси)-3-метил-сульфинил-3,3δ = 3,3 (с, 3Н); 4,95 (с, 6Н), 5,85 (с, 1Н); 6,3 (с, дифенил-пропионовой кислоты в 15мл ледяной 1Н); 7,3-7,5 (т, 10Н) ч/млн уксусной кислоты при комнатной температуре и Пример 23 прикалывают 294мкл 30%-ной перекиси водорода. 5-[2-(4,6-диметокси-пиримидин-2-илокси)-3Перемешивают в течение ночи при комнатной метокси-3,3-дифенил)-пропил1-1Н-тетразол температуре, затем нагревают ещѐ 3 часа при Растворяют 0,5г (1,3ммоля) нитрила 50°С, выливают на воду, экстрагируют полученного выше соединения в 10мл толуола, дихлорметаном и промывают растворами последовательно прибавляют 85мг (1,3ммоля) тиосульфата натрия и поваренной соли. После азида натрия и 460мг (1,4ммоля) сушки выделяют 400 мг твѐрдого белого трибутилоловохлорида и затем смесь нагревают вещества. около 40 часов с обратным холодильником. После Аналогично получают приведѐнные в таблице охлаждения разбавляют этилацетатом, 1 соединения. промывают 10%-ным водным раствором 29 45985 30 31 45985 32 33 45985 34 35 45985 36 37 Пример 35 Согласно описанному выше опыту по связыванию были измерены данные по связыванию рецепторов для приведѐнных ниже соединений. 45985 38 Результаты представлены в таблице 2. Таблица 2 Данные по связыванию рецептора (значения Ки) 39 45985 ДП «Український інститут промислової власності» (Укрпатент) вул. Сім’ї Хохлових, 15, м. Київ, 04119, Україна (044) 456 – 20 – 90 ТОВ “Міжнародний науковий комітет” вул. Артема, 77, м. Київ, 04050, Україна (044) 216 – 32 – 71 40
ДивитисяДодаткова інформація
Назва патенту англійськоюWorking cylinder of steam-air hammer
Автори англійськоюRohanov Lev Leonidovych, Rohanov Maksym Lvovych, Rudchenko Oleksandr Serhiiovych
Назва патенту російськоюРабочий цилиндр паровоздушного молота
Автори російськоюРоганов Лев Леонидович, Роганов Максим Львович, Рудченко Александр Сергеевич
МПК / Мітки
МПК: F16J 10/00
Мітки: циліндр, молота, пароповітряного, робочий
Код посилання
<a href="https://ua.patents.su/20-45985-robochijj-cilindr-paropovitryanogo-molota.html" target="_blank" rel="follow" title="База патентів України">Робочий циліндр пароповітряного молота</a>
Попередній патент: Спосіб місцевого зміцнення сталевих деталей
Наступний патент: Конічна дробарка дрібного дроблення
Випадковий патент: Спосіб діагностики новоутворень яєчників