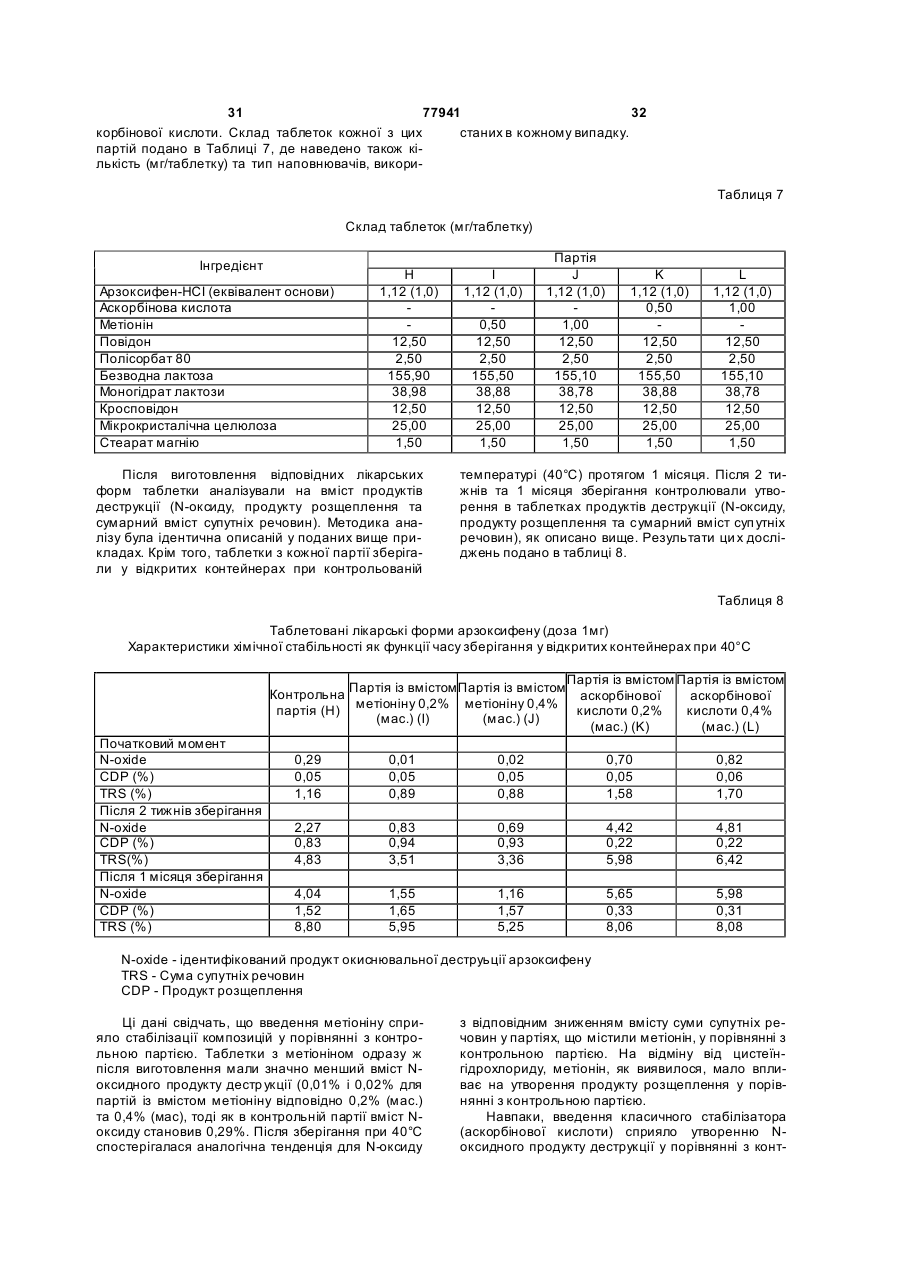
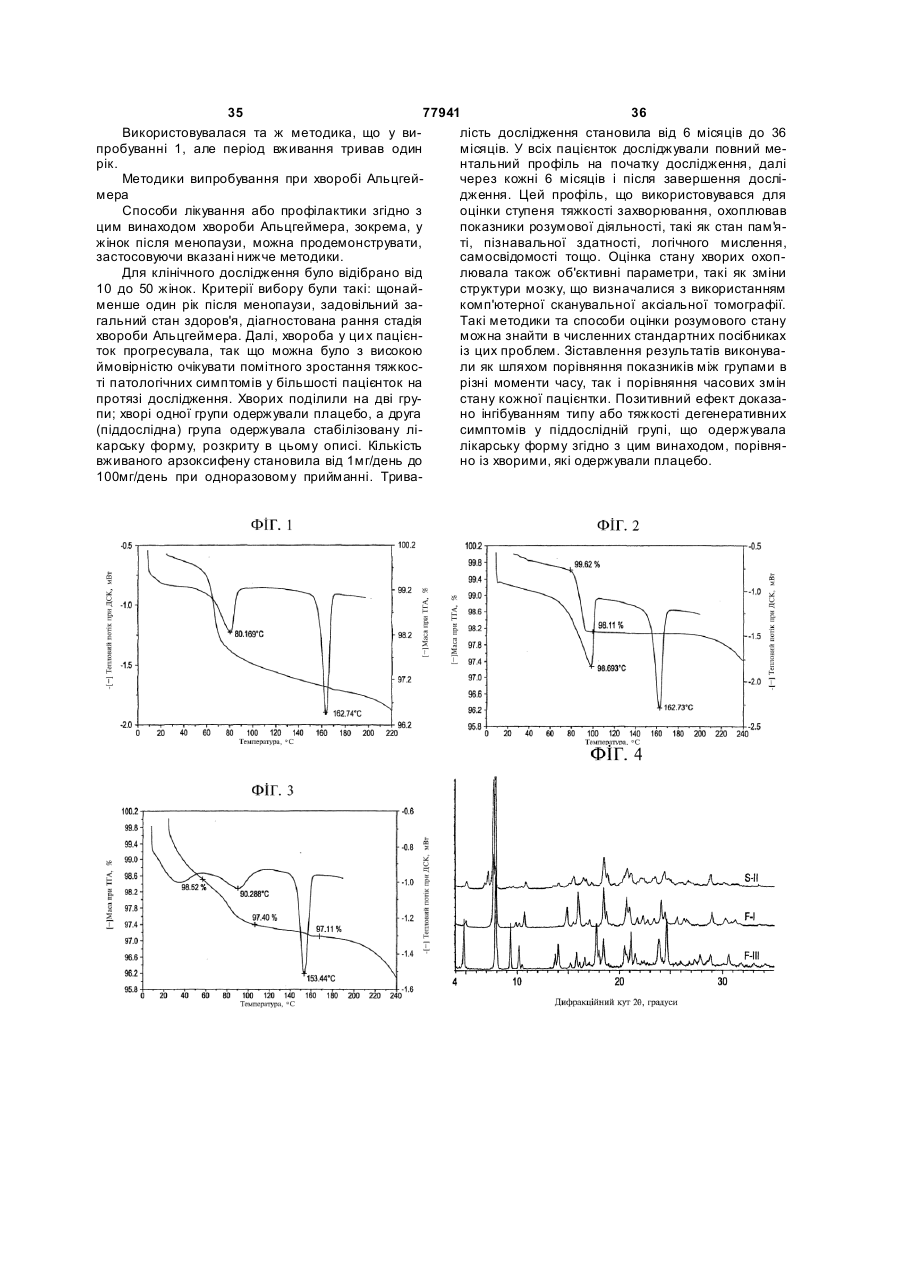
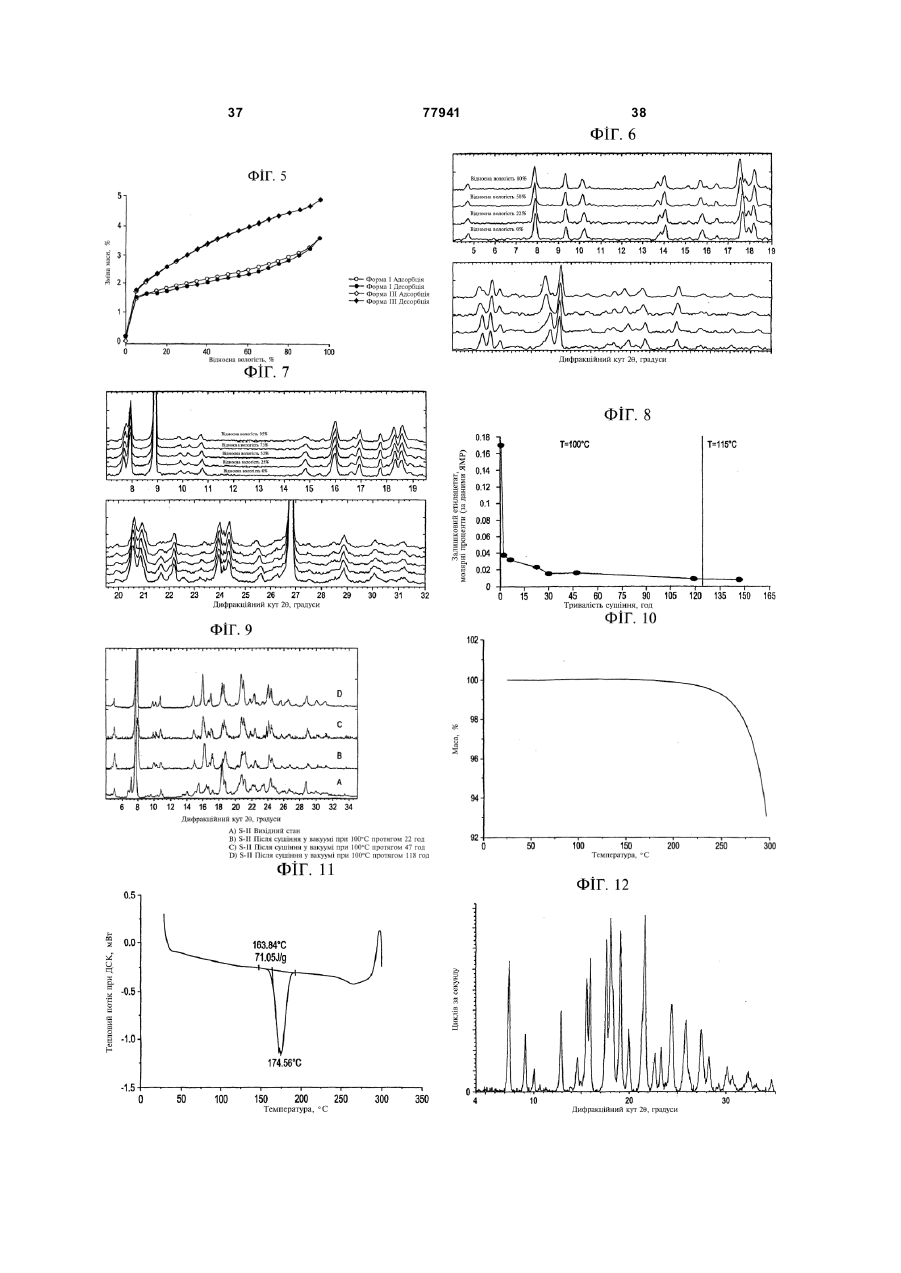
Стабілізовані композиції 6-гідрокси-3-(4-[2-(піперидин-1-іл)-етокси]фенокси)-2-(4-метоксифеніл)бензо[b]тіофену та його солей
Номер патенту: 77941
Опубліковано: 15.02.2007
Автори: ХАРТАУЕР Керрі Джон, Башор Фадія Найяр, Міннетт Майкл Дін, Рікард Юджін Кларк, Тінгл Черіл Енн
Формула / Реферат
1. Фармацевтична композиція, яка містить 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофен або його сіль;
стабілізувальний агент, вибраний із групи, до якої входять метіонін, ацетилцистеїн, цистеїн або їхні солі, в кількості, достатній для забезпечення стабілізації проти деструкції; та фармацевтично прийнятні наповнювачі.
2. Фармацевтична композиція за п. 1, яка містить стабілізувальний агент у згаданій композиції в кількості від приблизно 0,01 (мас.) до приблизно 10 % (мас.) загальної маси композиції.
3. Фармацевтична композиція за п. 2, яка містить стабілізувальний агент у згаданій композиції в кількості від приблизно 0,05 % (мас.) до приблизно 5 % (мас.) загальної маси композиції.
4. Фармацевтична композиція за будь-яким із пп. 1-3, яка містить 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофен у формі гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену.
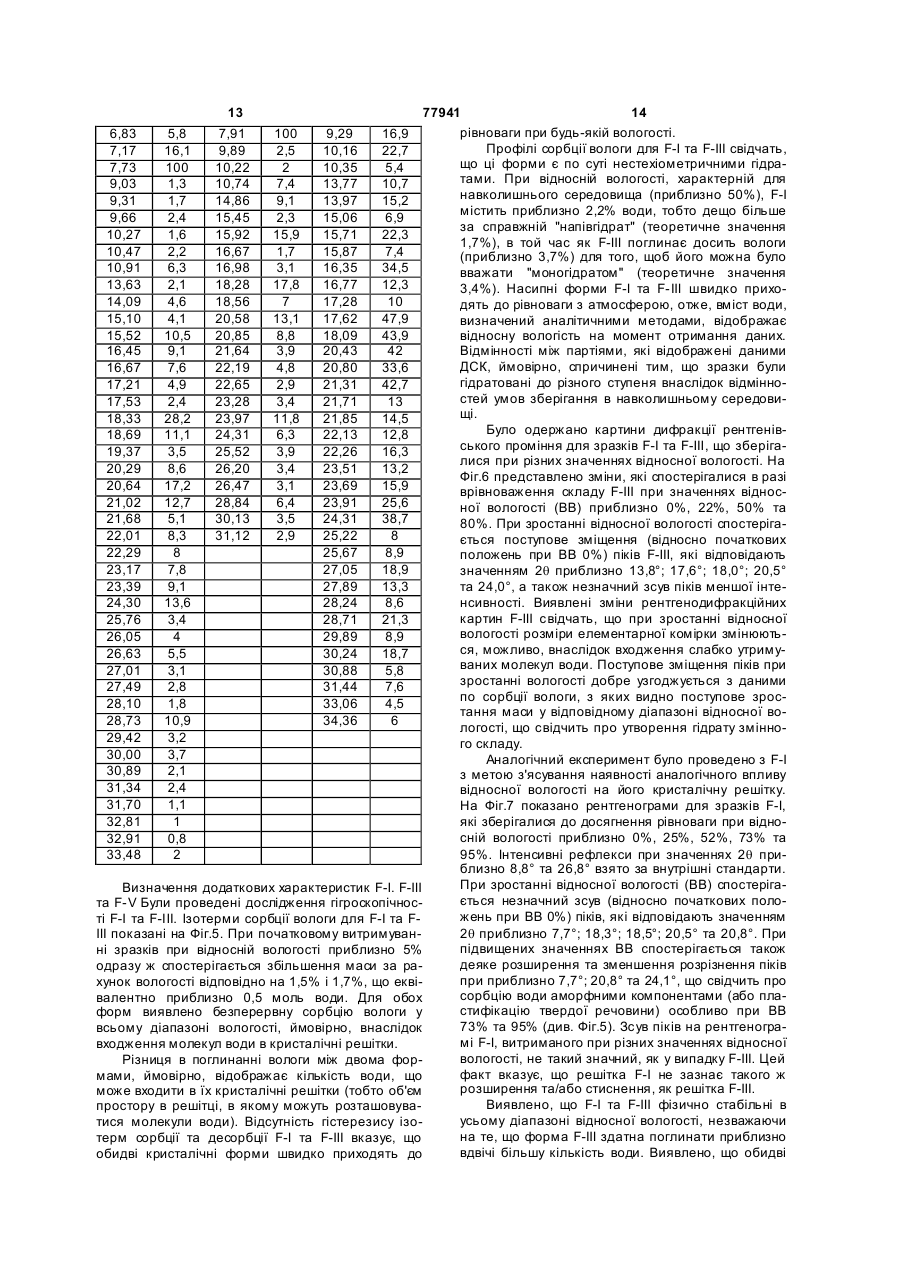
5. Фармацевтична композиція за п. 4, де згаданий гідрохлорид 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену є кристалічним гідратом гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену (F-I), що має картину розташування рентгенодифракційних ліній d, одержану з застосуванням мідного джерела випромінювання, яка включає піки з такими значеннями кута 2θ: 7,91+0,2°, 10,74±0,2°, 14,86±0,2°, 15,92±0,2°, 18,28+0,2° та 20,58±0,2°.
6. Фармацевтична композиція за п. 4, де згаданий гідрохлорид 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену є кристалічним гідратом гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену (F-III), що має картину розташування рентгенодифракційних ліній d, одержану при 25±2°С та відносній вологості 35±10 % із застосуванням мідного джерела випромінювання, яка включає піки з такими значеннями кута 2θ: 4,63±0,2°, 7,82±0,2°, 9,29±0,2°, 13,97±0,2°, 17,62±0,2°, 20,80±0,2° та 24,31±0,2°.
7. Фармацевтична композиція за п. 4, де згаданий гідрохлорид 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену є кристалічним гідратом гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену (F-V), що має картину розташування рентгенодифракційних ліній, одержану з застосуванням мідного джерела випромінювання, яка включає щонайменше один із піків із такими значеннями кута 2θ: 7,3±0,2°, 15,5±0,2°, 15,9±0,2° та 17,6±0,2°.
8. Фармацевтична композиція за п. 7, де згадана картина розташування рентгенодифракційних ліній, одержана з застосуванням мідного джерела випромінювання, додатково включає піки з такими значеннями кута 2θ:17,9±0,2°, 18,2±0,2°, 18,9±0,2° та 21,5±0,2°.
9. Фармацевтична композиція за будь-яким із пп. 1-8, де стабілізувальним агентом є цистеїн або його сіль.
10. Фармацевтична композиція за будь-яким із пп. 1-8, де стабілізувальним агентом є цистеїн-гідрохлорид.
11. Фармацевтична композиція за будь-яким із пп. 1-8, де стабілізувальним агентом є моногідрат L-цистеїн-гідрохлориду.
12. Фармацевтична композиція за будь-яким із пп. 1-8, де стабілізувальним агентом є метіонін або його сіль.
13. Фармацевтична композиція за будь-яким із пп. 1-8, де стабілізувальним агентом є ацетилцистеїн або його сіль.
14. Фармацевтична композиція за будь-яким із пп. 1-13, яка є таблеткою.
15. Фармацевтична композиція за будь-яким із пп. 1-13, яка є капсулою.
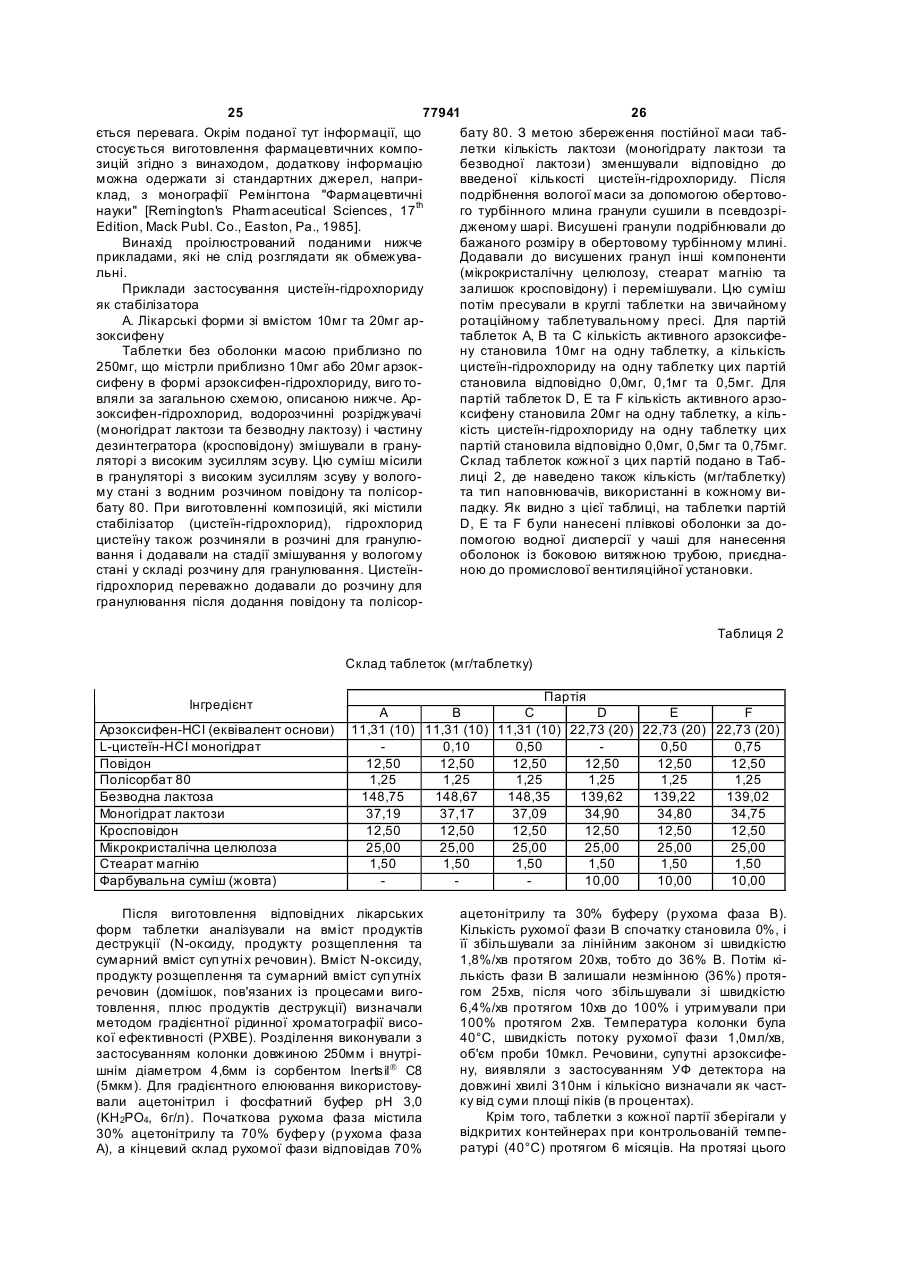
16. Фармацевтична композиція за будь-яким із пп. 4-8, що містить 20-23 мг, у варіанті, якому віддається перевага, приблизно 21,53 мг, гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)бензо[b]тіофену та 0,2-0,8 мг, у варіанті, якому віддається перевага, приблизно 0,5 мг, цистеїн-гідрохлориду.
17. Фармацевтична композиція за п. 16, яка є таблеткою масою 220-280 мг, у варіанті, якому віддається перевага, приблизно 250 мг.
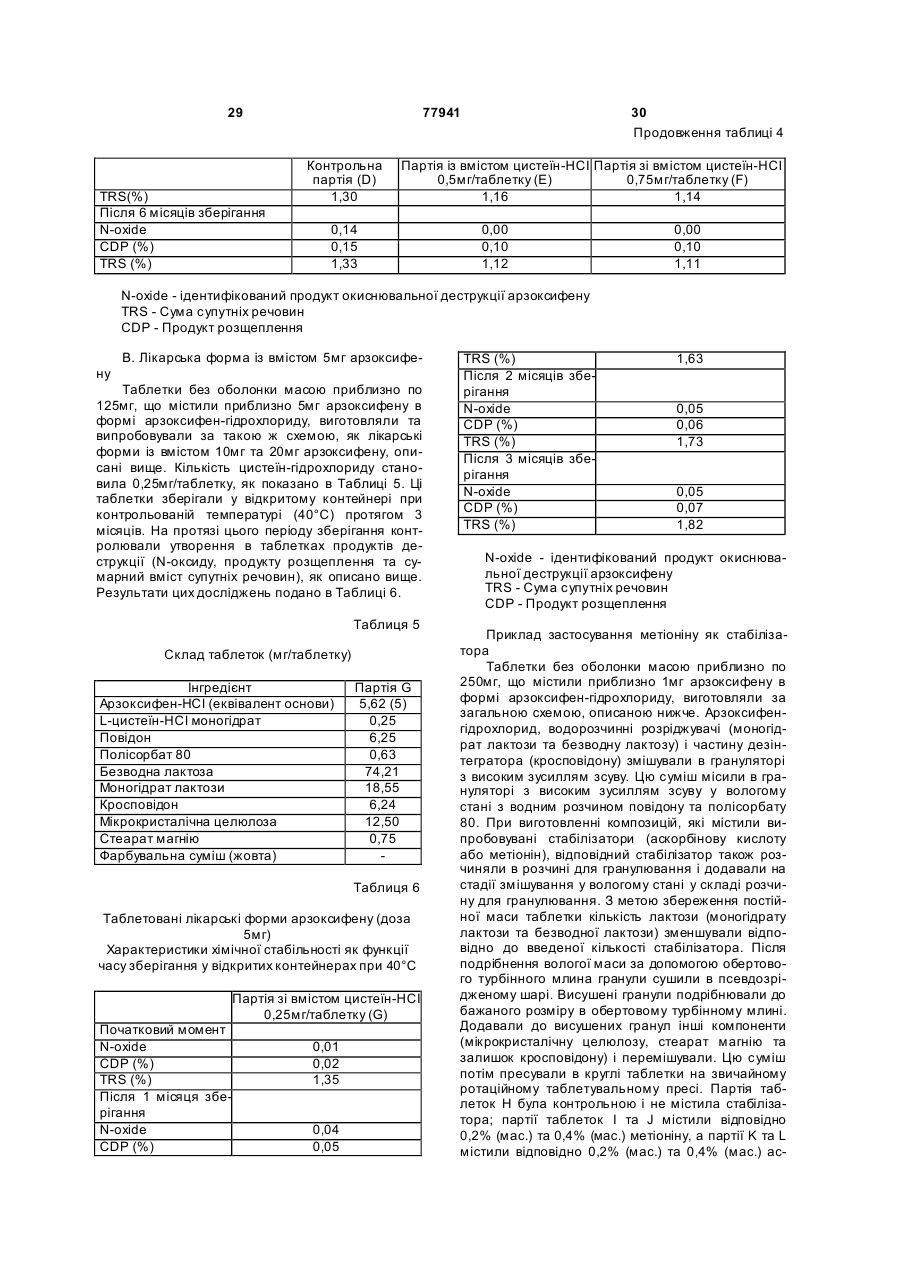
18. Фармацевтична композиція за будь-яким із пп. 4-8, що містить 5,3-5,9 мг, у варіанті, якому віддається перевага, приблизно 5,62 мг, гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)бензо[b]тіофену та 0,2-0,3 мг, у варіанті, якому віддається перевага, приблизно 0,25 мг, цистеїн-гідрохлориду.
19. Фармацевтична композиція за п. 18, яка є таблеткою масою 120-130 мг, у варіанті, якому віддається перевага, приблизно 125 мг.
20. Фармацевтична композиція за будь-яким із пп. 16-19, де цистеїн-гідрохлорид є моногідратом L-цистеїн-гідрохлориду.
21. Спосіб інгібування патологічного стану, вибраного із групи, до якої входять: фіброз матки, ендометріоз, проліферація клітин гладких м'язів аорти, рестеноз, рак молочної залози, рак матки, рак простати або доброякісне розростання простати, розрідження кісток, остеопороз, захворювання серцево-судинної системи, гіперліпідемія, розлади центральної нервової системи та хвороба Альцгеймера, який включає введення ссавцю, що потребує такого інгібування, ефективної кількості фармацевтичної композиції за п. 1.
22. Спосіб за п. 21, де патологічним станом є рак молочної залози.
23. Спосіб за п. 21, де патологічним станом є остеопороз.
24. Спосіб за п. 21, де патологічним станом є ендометріальний рак.
25. Фармацевтична композиція за будь-яким із пп. 1-20 для застосування при терапевтичному лікуванні людини або тварини.
26. Застосування фармацевтичної композиції за будь-яким із пп. 1-20 при виготовленні лікарських засобів для лікування фіброзу матки, ендометріозу, проліферації клітин гладких м'язів аорти, рестенозу, раку молочної залози, раку матки, раку простати або доброякісного розростання простати, розрідження кісток, остеопорозу, захворювання серцево-судинної системи, гіперліпідемії, розладів центральної нервової системи або хвороби Альцгеймера.
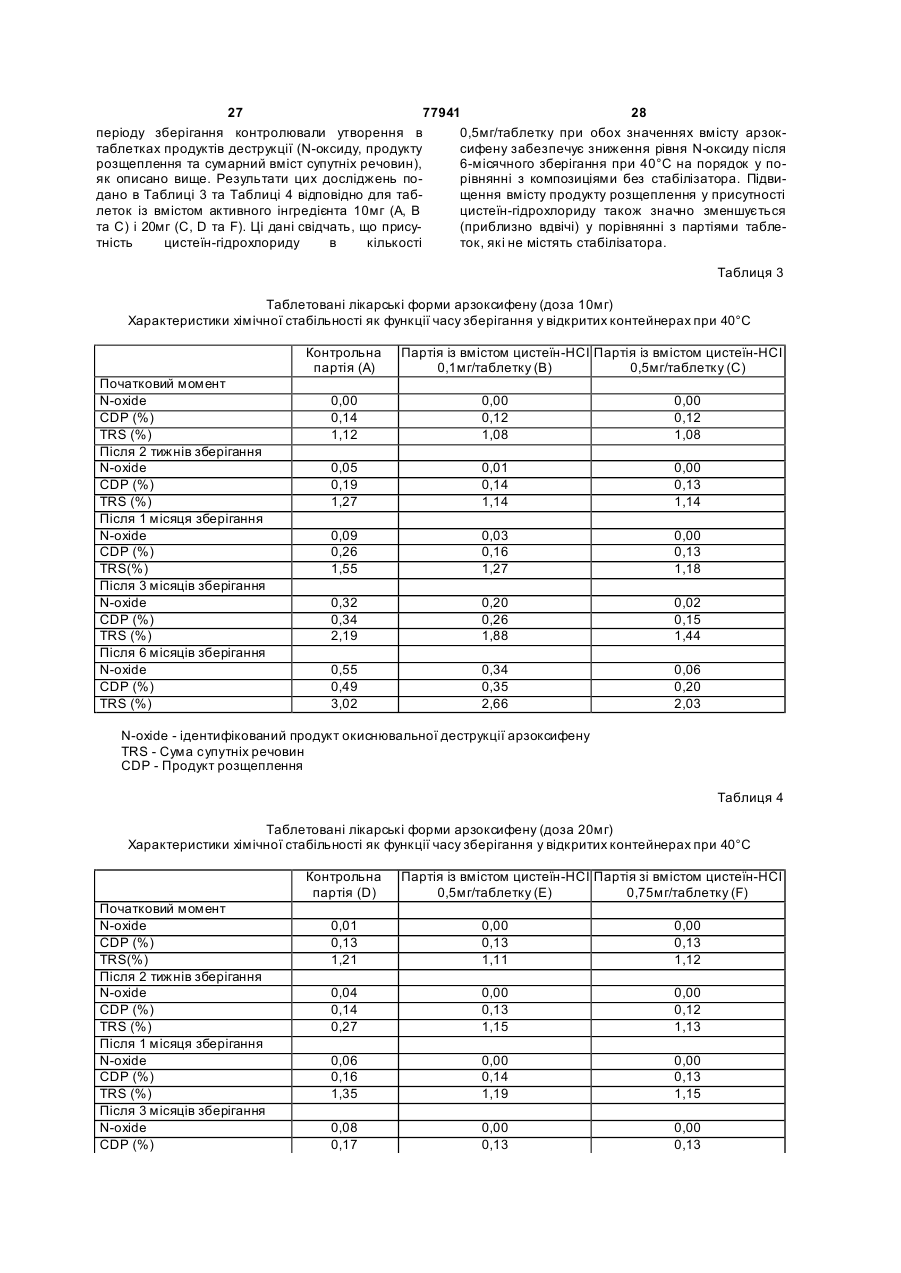
27. Спосіб стабілізації фармацевтичної композиції, що містить 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)бензо[b]тіофен або його сіль, проти деструкції, який включає введення в згадану фармацевтичну композицію, окрім терапевтично ефективної кількості згаданого 6-гідрокси-З-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)бензо[b]тіофену або його солі та одного або кількох фармацевтично прийнятних наповнювачів, стабілізувального агента, вибраного із групи, до якої входять метіонін, ацетилцистеїн, цистеїн або їх солі, в кількості, достатній для забезпечення стабілізації проти деструкції.
28. Спосіб за п. 27, де 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)бензо[b]тіофен присутній у формі гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)бензо[b]тіофену.
29. Спосіб за п. 27 або п. 28, де стабілізувальний агент присутній у згаданій композиції в кількості від приблизно 0,01 % (мас.) до приблизно 10 % (мас.) загальної маси композиції.
30. Спосіб за будь-яким із пп. 27-29, де стабілізувальним агентом є цистеїн.
31. Спосіб за будь-яким із пп. 27-30, де стабілізувальним агентом є цистеїн-гідрохлорид.
32. Спосіб за будь-яким із пп. 27-31, де стабілізувальним агентом є моногідрат L-цистеїн-гідрохлориду.
33. Спосіб за будь-яким із пп. 27-29, де стабілізувальним агентом є метіонін.
34. Спосіб за будь-яким із пп. 27-29, де стабілізувальним агентом є ацетилцистеїн.
35. Застосування кристалічного гідрату гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену (F-I), що має картину розташування рентгенодифракційних ліній d, одержану з застосуванням мідного джерела випромінювання, яка включає піки з такими значеннями кута 2θ: 7,91±0,2°, 10,74±0,2°, 14,86±0,2°, 15,92±0,2°, 18,28±0,2° та 20,58±0,2°, при виготовленні лікарських засобів для лікування фіброзу матки, ендометріозу, проліферації клітин гладких м'язів аорти, рестенозу, раку молочної залози, раку матки, раку простати або доброякісного розростання простати, розрідження кісток, остеопорозу, захворювання серцево-судинної системи, гіперліпідемії, розладів центральної нервової системи або хвороби Альцгеймера.
36. Застосування кристалічного гідрату гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену (F-III), що має картину розташування рентгенодифракційних ліній d, одержану при 25±2°С та відносній вологості 35±10 % із застосуванням мідного джерела випромінювання, яка включає піки з такими значеннями кута 2θ: 4,63±0,2°, 7,82±0,2°, 9,29±0,2°, 13,97±0,2°, 17,62±0,2°, 20,80±0,2° та 24,31±0,2°, при виготовленні лікарських засобів для лікування фіброзу матки, ендометріозу, проліферації клітин гладких м'язів аорти, рестенозу, раку молочної залози, раку матки, раку простати або доброякісного розростання простати, розрідження кісток, остеопорозу, захворювання серцево-судинної системи, гіперліпідемії, розладів центральної нервової системи або хвороби Альцгеймера.
37. Застосування кристалічного гідрату гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]-тіофену (F-V), що має картину розташування рентгенодифракційних ліній, одержану з застосуванням мідного джерела випромінювання, яка включає щонайменше один з піків із такими значеннями кута 2θ: 7,3±0,2°, 15,5±0,2°, 15,9±0,2° та 17,6±0,2°, при виготовленні лікарських засобів для лікування фіброзу матки, ендометріозу, проліферації клітин гладких м'язів аорти, рестенозу, раку молочної залози, раку матки, раку простати або доброякісного розростання простати, розрідження кісток, остеопорозу, захворювання серцево-судинної системи, гіперліпідемії, розладів центральної нервової системи або хвороби Альцгеймера.
38. Застосування за п. 37, де згадана картина розташування рентгенодифракційних ліній, одержана з застосуванням мідного джерела випромінювання, додатково включає піки з такими значеннями кута 2θ: 17,9±0,2°, 18,2±0,2°, 18,9±0,2° та 21,5±0,2°.
Текст
1. Фармацевтична композиція, яка містить 6гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2(4-метоксифеніл)-бензо[b]-тіофен або його сіль; стабілізувальний агент, вибраний із групи, до якої входять метіонін, ацетилцистеїн, цистеїн або їхні солі, в кількості, достатній для забезпечення стабілізації проти деструкції; та фармацевтично прийнятні наповнювачі. 2. Фармацевтична композиція за п. 1, яка містить стабілізувальний агент у згаданій композиції в кількості від приблизно 0,01 (мас.) до приблизно 10 % (мас.) загальної маси композиції. 3. Фармацевтична композиція за п. 2, яка містить стабілізувальний агент у згаданій композиції в кількості від приблизно 0,05 % (мас.) до приблизно 5 % (мас.) загальної маси композиції. 4. Фармацевтична композиція за будь-яким із пп. 1-3, яка містить 6-гідрокси-3-(4-[2-(піперидин-1іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]тіофен у формі гідрохлориду 6-гідрокси-3-(4-[2(піперидин-1-іл)етокси]фенокси)-2-(4метоксифеніл)-бензо[b]-тіофену. 5. Фармацевтична композиція за п. 4, де згаданий гідрохлорид 6-гідрокси-3-(4-[2-(піперидин-1іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]тіофену є кристалічним гідратом гідрохлориду 6гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2(4-метоксифеніл)-бензо[b]-тіофену (F-I), що має картину розташування рентгенодифракційних ліній d, одержану з застосуванням мідного джерела випромінювання, яка включає піки з такими зна 2 (19) 1 3 77941 4 14. Фармацевтична композиція за будь-яким із (піперидин-1-іл)етокси]фенокси)-2-(4пп. 1-13, яка є таблеткою. метоксифеніл)бензо[b]тіофену або його солі та 15. Фармацевтична композиція за будь-яким із одного або кількох фармацевтично прийнятних пп. 1-13, яка є капсулою. наповнювачів, стабілізувального агента, вибраного 16. Фармацевтична композиція за будь-яким із із групи, до якої входять метіонін, ацетилцистеїн, пп. 4-8, що містить 20-23 мг, у варіанті, якому відцистеїн або їх солі, в кількості, достатній для задається перевага, приблизно 21,53 мг, гідрохлобезпечення стабілізації проти деструкції. риду 6-гідрокси-3-(4-[2-(піперидин-128. Спосіб за п. 27, де 6-гідрокси-3-(4-[2іл)етокси]фенокси)-2-(4(піперидин-1-іл)етокси]фенокси)-2-(4метоксифеніл)бензо[b]тіофену та 0,2-0,8 мг, у ваметоксифеніл)бензо[b]тіофен присутній у формі ріанті, якому віддається перевага, приблизно 0,5 гідрохлориду 6-гідрокси-3-(4-[2-(піперидин-1мг, цистеїн-гідрохлориду. іл)етокси]фенокси)-2-(417. Фармацевтична композиція за п. 16, яка є табметоксифеніл)бензо[b]тіофену. леткою масою 220-280 мг, у варіанті, якому відда29. Спосіб за п. 27 або п. 28, де стабілізувальний ється перевага, приблизно 250 мг. агент присутній у згаданій композиції в кількості від 18. Фармацевтична композиція за будь-яким із приблизно 0,01 % (мас.) до приблизно 10 % (мас.) пп. 4-8, що містить 5,3-5,9 мг, у варіанті, якому загальної маси композиції. віддається перевага, приблизно 5,62 мг, гідрохло30. Спосіб за будь-яким із пп. 27-29, де стабілізуриду 6-гідрокси-3-(4-[2-(піперидин-1вальним агентом є цистеїн. іл)етокси]фенокси)-2-(431. Спосіб за будь-яким із пп. 27-30, де стабілізуметоксифеніл)бензо[b]тіофену та 0,2-0,3 мг, у вавальним агентом є цистеїн-гідрохлорид. ріанті, якому віддається перевага, приблизно 0,25 32. Спосіб за будь-яким із пп. 27-31, де стабілізумг, цистеїн-гідрохлориду. вальним агентом є моногідрат L-цистеїн19. Фармацевтична композиція за п. 18, яка є табгідрохлориду. леткою масою 120-130 мг, у варіанті, якому відда33. Спосіб за будь-яким із пп. 27-29, де стабілізується перевага, приблизно 125 мг. вальним агентом є метіонін. 20. Фармацевтична композиція за будь-яким із 34. Спосіб за будь-яким із пп. 27-29, де стабілізупп. 16-19, де цистеїн-гідрохлорид є моногідратом вальним агентом є ацетилцистеїн. L-цистеїн-гідрохлориду. 35. Застосування кристалічного гідрату гідрохло21. Спосіб інгібування патологічного стану, вибрариду 6-гідрокси-3-(4-[2-(піперидин-1ного із групи, до якої входять: фіброз матки, ендоіл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]метріоз, проліферація клітин гладких м'язів аорти, тіофену (F-I), що має картину розташування рентрестеноз, рак молочної залози, рак матки, рак генодифракційних ліній d, одержану з застосуванпростати або доброякісне розростання простати, ням мідного джерела випромінювання, яка вклюрозрідження кісток, остеопороз, захворювання чає піки з такими значеннями кута 2θ: 7,91±0,2°, серцево-судинної системи, гіперліпідемія, розлади 10,74±0,2°, 14,86±0,2°, 15,92±0,2°, 18,28±0,2° та центральної нервової системи та хвороба Альц20,58±0,2°, при виготовленні лікарських засобів геймера, який включає введення ссавцю, що подля лікування фіброзу матки, ендометріозу, протребує такого інгібування, ефективної кількості ліферації клітин гладких м'язів аорти, рестенозу, фармацевтичної композиції за п. 1. раку молочної залози, раку матки, раку простати 22. Спосіб за п. 21, де патологічним станом є рак або доброякісного розростання простати, розрімолочної залози. дження кісток, остеопорозу, захворювання серце23. Спосіб за п. 21, де патологічним станом є осво-судинної системи, гіперліпідемії, розладів теопороз. центральної нервової системи або хвороби Альц24. Спосіб за п. 21, де патологічним станом є енгеймера. дометріальний рак. 36. Застосування кристалічного гідрату гідрохло25. Фармацевтична композиція за будь-яким із риду 6-гідрокси-3-(4-[2-(піперидин-1пп. 1-20 для застосування при терапевтичному іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b]лікуванні людини або тварини. тіофену (F-III), що має картину розташування рент26. Застосування фармацевтичної композиції за генодифракційних ліній d, одержану при 25±2°С та будь-яким із пп. 1-20 при виготовленні лікарських відносній вологості 35±10 % із застосуванням мідзасобів для лікування фіброзу матки, ендометріоного джерела випромінювання, яка включає піки з зу, проліферації клітин гладких м'язів аорти, рестакими значеннями кута 2θ: 4,63±0,2°, 7,82±0,2°, тенозу, раку молочної залози, раку матки, раку 9,29±0,2°, 13,97±0,2°, 17,62±0,2°, 20,80±0,2° та простати або доброякісного розростання простати, 24,31±0,2°, при виготовленні лікарських засобів розрідження кісток, остеопорозу, захворювання для лікування фіброзу матки, ендометріозу, просерцево-судинної системи, гіперліпідемії, розладів ліферації клітин гладких м'язів аорти, рестенозу, центральної нервової системи або хвороби Альцраку молочної залози, раку матки, раку простати геймера. або доброякісного розростання простати, розрі27. Спосіб стабілізації фармацевтичної композиції, дження кісток, остеопорозу, захворювання серцещо містить 6-гідрокси-3-(4-[2-(піперидин-1во-судинної системи, гіперліпідемії, розладів іл)етокси]фенокси)-2-(4центральної нервової системи або хвороби Альцметоксифеніл)бензо[b]тіофен або його сіль, проти геймера. деструкції, який включає введення в згадану фар37. Застосування кристалічного гідрату гідрохломацевтичну композицію, окрім терапевтично ефекриду 6-гідрокси-3-(4-[2-(піперидин-1тивної кількості згаданого 6-гідрокси-З-(4-[2іл)етокси]фенокси)-2-(4-метоксифеніл)-бензо[b] 5 77941 6 тіофену (F-V), що має картину розташування рентостеопорозу, захворювання серцево-судинної сисгенодифракційних ліній, одержану з застосувантеми, гіперліпідемії, розладів центральної нервоням мідного джерела випромінювання, яка вклювої системи або хвороби Альцгеймера. чає щонайменше один з піків із такими значеннями 38. Застосування за п. 37, де згадана картина розкута 2θ: 7,3±0,2°, 15,5±0,2°, 15,9±0,2° та 17,6±0,2°, ташування рентгенодифракційних ліній, одержана при виготовленні лікарських засобів для лікування з застосуванням мідного джерела випромінюванфіброзу матки, ендометріозу, проліферації клітин ня, додатково включає піки з такими значеннями гладких м'язів аорти, рестенозу, раку молочної кута 2θ: 17,9±0,2°, 18,2±0,2°, 18,9±0,2° та залози, раку матки, раку простати або доброякіс21,5±0,2°. ного розростання простати, розрідження кісток, Гідрохлорид 6-гідрокси-3-(4-[2-(піперидин-1іл)етокси]фенокси)-2-(4метоксифеніл)бензо[b]тіофену (арзоксифенгідрохлорид) вперше був описаний у загальній формі в патенті США №5,510,357 (далі '357) і конкретно описаний в патенті США №5,723,474 (далі '474). Обидва патенти '357 та '474 включено до даного опису за посиланнями. Арзоксифен як у формі вільної основи, так і в формі солі є нестероїдним змішаним антагоністом/агоністом естрогену, корисним, поряд з іншими випадками, для зниження рівня холестерину в плазмі та для інгібування гіперліпідемії, остеопорозу, ракових захворювань, які залежать від естрогену, в тому числі раку молочної залози та матки, ендометриозу, розладів центральної нервової системи, в тому числі хвороби Альцгеймера, проліферації клітин гладеньких м'язів аорти та рестенозу. Згадана сполука на сьогодні проходить клінічні випробування при лікуванні та профілактиці остеопорозу та лікуванні раку матки та молочної залози у жінок. Конкретно, арзоксифен є корисним і проходить клінічні випробування при лікуванні рецепторно-позитивних метастазів раку молочної залози; при допоміжній терапії рецепторно-позитивних пацієнтів після відповідної локальної або системної терапії; для зниження частоти рецидивів інвазивного та неінвазивного раку молочної залози; для зниження частоти виникнення інвазивного раку молочної залози та протокового внутрішньоепітеліального раку (DCIS). Арзоксифен корисний також у комбінації з радіотерапією; інгібіторами ароматази, такими як аміноглютемід (CYTANDRENÒ), анастразол (ARIMIDEXÒ), летрозол (FEMAR AÒ), форместан (LENATRONÒ), ексеместан (AROMASINÒ) тощо; з аналогами LHRH (гормону вивільнення лютеїнізуючого гормону), такими як госерлін (ZOLADEXÒ), лейпролід (LUPRONÒ) тощо; і з інгібіторами ацетилхолінестерази. Відомо, що арзоксифен із часом зазнає деструкції, про що свідчить утворення продуктів деструкції, зокрема, продукту окиснення (N-оксиду) та продукту розщеплення. Утворення продуктів деструкції активного інгредієнта фармацевтичного препарату, як правило, є небажаним явищем. Такі продукти деструкції можуть спричиняти несприятливі побічні ефекти та небажаний вплив на пацієнта. Контроль продуктів деструкції або домішок регулюється рекомендаціями Міжнародної Конференції по гармонізації (International Conference on Harmonization, ICH), на основі яких розроблено вимоги національних директивних органів, наприклад, Адміністрації США з питань продуктів харчування та лікарських засобів (United States Food and Dug Administration, FDA). Рекомендації ICH стосуються рівнів таких продуктів деструкції або домішок, при перевищенні яких мають здійснюватися структурна ідентифікація та перевірка якості шляхом відповідних токсикологічних або клінічних досліджень. Перші спроби послаблення утворення продуктів дестр укції арзоксифену в фармацевтичній композиції були невдалими. Введення класичного антиоксиданту (аскорбінової кислоти) на практиці посилювали утворення N-оксидного продукту деструкції арзоксифену, а також утворення інших продуктів деструкції, при цьому спостерігалися їх підвищені концентрації безпосередньо після виготовлення та підвищена швидкість їх зростання в процесі зберігання. Як вказано в фармацевтичній літературі [див. Ейкерс - Akers M.J., Journal of Parenteral Science and Technology, 36(5): 222-227 (1982)], надійні способи прогнозування ефективності дії антиоксидантів у фармацевтичних продуктах відсутні. Заявниками виявлено, що введення стабілізувального агента, вибраного із групи, що включає метіонін, ацетил цистеїн, цистеїн або їхні солі, до складу фармацевтичної композиції таблеток арзоксифену значно послаблює утворення продуктів деструкції в процесі виробництва та/або під час зберігання згаданого лікарського препарату. На Фіг.1 показано типову криву, одержану при диференційній сканувальній калориметрії (ДСК)/термогравіметричному аналізі (ТГА) S-II. На Фіг.2 показано типову криву ДСК/ТГА для F-I. На Фіг.3 показано типову криву ДСК/ТГА для F-III. На Фіг.4 показано типову порошкову рентгенограму (ПРГ) для F-III, зняту при 25±2°С та відносній вологості 35±10%, а також ПРГ для S-II та F-I. На Фіг.5 показано ізотерми сорбції вологи для F-I та для F-III. На Фіг.6 показано зміни ПРГ для F-III в залежності від відносної вологості. На Фіг.7 показано зміни ПРГ для F-I в залежності від відносної вологості. На Фіг.8 представлено десольватацію S-II в залежності від відносної вологості та температури. На Фіг.9 представлено порошкові рентгенограми для певних моментів часу при десольватації 7 77941 8 фен-гідрохлориду в етилацетаті при її кипінні зі На Фіг.10 показано типову криву ТГА для F-V. зворотним холодильником. Після охолодження та На Фіг.11 показано типову криву ДСК для F-V. фільтрування під вакуумом твердий продукт, одеНа Фіг.12 показано типову порошкову рентгержаний за цією модифікованою методикою, являє нограму для F-V. собою кристалічний змішаний сольват арзоксиПредметом цього винаходу є фармацевтична фен-гідрохлориду з етилацетатом та водою (далі композиція, яка містить 6-гідрокси-3-(4-[2позначений як S-II), який пізніше був описаний як (піперидин-1-іл)етокси]фенокси)-2-(4вихідний матеріал для одержання F-I (іншої крисметоксифеніл)-бензо[b]-тіофен або його сіль; статалічної форми арзоксифен-гідрохлориду). білізувальний агент, вибраний із групи, до якої F-I одержують шляхом видалення етилацетату входять метіонін, ацетилцистеїн, цистеїн або їхні із кристалічної решітки S-II висушуванням у вакуусолі, в кількості, достатній для забезпечення стамі або термічною обробкою S-II при підвищеній білізації проти деструкції; та фармацевтично притемпературі. Тривалість і температура термічної йнятні наповнювачі. обробки S-II для одержання F-I різняться для різРозкрито також спосіб стабілізації фармацевних партій, однак у типовому випадку мають порятичної композиції 6-гідрокси-3-(4-[2-(піперидин-1док 5 діб при приблизно 100°С. Для здійснення іл)етокси]фенокси)-2-(4перетворення S-II в F-I необхідні високі темпераметоксифеніл)бензо[b]тіофену або його солі проти тури, оскільки суспендування S-II у воді при темдеструкції в процесі виготовлення або під час збепературі навколишнього середовища або зберірігання лікарського засобу. Спосіб включає ввегання зразка при відносній вологості 98% протягом дення до складу згаданої фармацевтичної компо3 тижнів не забезпечували перетворення в F-I. зиції, окрім терапевтично ефективної кількості Крім того, висушування S-II у конвекційній сушарці згаданого 6-гідрокси-3-(4-[2-(піперидин-1при високих температурах також не забезпечувало іл)етокси]фенокси)-2-(4десольватацію матеріалу, що дає основу для приметоксифеніл)бензо[b]тіофену або його солі та пущення, що для видалення етилацетату із крисодного або кількох фармацевтичних носіїв, розріталічної решітки S-II необхідний також вакуум. джувачів або наповнювачів, стабілізувального агеФормою арзоксифен-гідрохлориду, якій відданта, вибраного із групи, до якої входять метіонін, ється перевага, є F-III. F-lll легко одержати та видіацетилцистеїн, цистеїн або їхні солі, в кількості, лити при температурі навколишнього середовища. достатній для забезпечення стабілізації проти деПеревагою F-III є те, що для видалення малих струкції. кількостей залишкового кристалізаційного розчинКрім того, розкрито спосіб інгібування патолоника достатніми є помірні умови висушування. В гічного стану, вибраного із групи, до якої входять: цих помірних умовах висушування утворюється фіброз матки, ендометриоз, проліферація клітин твердий продукт високого ступеня чистоти та кригладеньких м'язів аорти, рестеноз, рак молочної сталічності і, таким чином, застосування F-III усузалози, рак матки, рак простати або доброякісне ває токсикологічні проблеми, пов'язані з наявністю розростання простати, розрідження кісток, остеоорганічних розчинників як залишкових домішок та пороз, серцево-судинні захворювання, гіперліпікомпонентів, включених у кристалічну решітку. демія, розлади центральної нервової системи та Крім того, виготовлення F-III є простим та ефектихвороба Альцгеймера, який включає введення вним процесом, тобто сприятливе для промислоссавцю, що потребує такого інгібування, ефективвого виробництва. ної кількості фармацевтичної композиції, розкритої F-III легко одержати та виділити при темперав цьому описі. турі навколишнього середовища шляхом кристаліДалі, розкрито стабілізовані фармацевтичні зації арзоксифен-гідрохлориду (або будь-якої його композиції, які містять кристалічні форми F-I, F-III поліморфної модифікації чи сольватної форми) з або F-V арзоксифену-гідрохлориду. суміші ізопропілового спирту (ІПС) та води. У тиАрзоксифен (тобто 6-гідрокси-3-(4-[2повому випадку арзоксифен-гідрохлорид можна (піперидин-1-іл)етокси]фенокси)-2-(4суспендувати в суміші ІПС із водою і нагріти для метоксифеніл)-бензо[b]-тіофен) та його солі можна забезпечення розчинення вихідного арзоксифенвиготовити, як описано в патентах США гідрохлориду. Після розчинення розчину дають №5,510,357 ('357) та №5,723,474 ('474). Обидва повільно охолоджуватися до кімнатної температупатенти в повному обсязі включено до даного опири, а потім піддають подальшому охолодженню (з су за посиланнями. застосуванням льодяної бані або холодильного Насипний арзоксифен-гідрохлорид, одержаний пристрою) до температури в межах від 0°С до 5°С. за методикою, описаною в патенті '474 (Приклад Після збігання часу, достатнього для кристалізації, 41, кристалізація з суміші етанолу з етилацетатом, кристали можна відділити шляхом фільтрування фільтрування та висушування відфільтрованого під вакуумом і висушити у вакуумі до постійної продукту в вакуумі при кімнатній температурі до маси з метою одержання F-III. постійної маси) був досліджений рентгенодифракДо придатних для описаної вище кристалізації ційним методом, при цьому було виявлено, що вихідних різновидів арзоксифен-гідрохлориду напродукт не є чисто кристалічним. Дослідження лежать S-II, F-I, арзоксифен-гідрохлорид, одержаметодом Ш-ЯМР підтвердило, що насипний матений за методиками, описаними в патенті '474, або ріал містив 6% етилацетату. будь-які їх суміші, але не тільки ці модифікації. Методика кристалізації, описана в патенті '474, Вихідна форма арзоксифен-гідрохлориду не має була пізніше модифікована таким чином, що етазначення, оскільки в результаті кристалізації з ІПС нол додавали до суспензії неочищеного арзоксиі води згідно з методикою, описаною вище, утвоS-II. 9 77941 10 рюються кристали F-III. Об'ємне відношення кільпературі, кристалічного твердого продукту, виділекостей води та ІПС, як правило, становить від приного при температурі навколишнього середовища близно 1:1 до 5:1. Більша перевага віддається шляхом кристалізації арзоксифен-гідрохлориду значенням цього відношення від 2,5:1 до 3,5:1. (або будь-якої його поліморфної модифікації чи Найбільша перевага віддається відношенню в месольватної форми) із метанолу, етанолу або ізожах від 2,9:1 до 3,1:1. Співвідношення кількостей пропанолу або з сумішей метанолу з водою. В разі ІПС та води не є критичним із точки зору впливу на використання етанолу або ізопропанолу перевага кристалізацію F-III, проте впливає на вихід продуквіддається вмісту води в ци х розчинниках менше ту. У варіантах, яким віддається перевага, після ніж 0,2% (розчинники для спектрофотометрії за збирання кристалів шляхом фільтрування під ваноменклатурою Американського Хімічного Товарикуумом вологий осад F-III на фільтрі перед висуства). При застосуванні сумішей води з метанолом шуванням у вакуумі промивають холодною деіоніперевага віддається вмісту води менше ніж 30% зованою водою. Крім того, перевага віддається (об'єми.). У варіантах, яким віддається більша песушінню при дещо підвищених температурах (приревага, F-V одержують висушуванням, при темпеблизно 50°С протягом 12-24год). При виготовленні ратурі навколишнього середовища або при злегка F-III у промислових масштабах може бути доцільпідвищеній температурі, твердого продукту, видіним ініціювання кристалізації з використанням F-III леного при кристалізації з водного метанолу, де як затравки. об'ємна частка води становить від 20% до 50%. У У способі, якому віддається перевага, F-III варіантах, яким віддається найбільша перевага, Fодержують, виділяють та очищають сумісно з виV одержують висушуванням у вакуумі при темпедаленням хімічним шляхом 6-ізопропілової групи ратурі від 50°С до 70°С твердого продукту, виділезахисту гідроксилу від 6-ізопропокси-3-(4-[2ного при температурі навколишнього середовища (піперидин-1-іл)етокси]фенокси)-2-(4шляхом кристалізації арзоксифен-гідрохлориду метоксифеніл)бензо-[b]тіофену (попередника А). (або будь-якої його поліморфної модифікації чи При проведенні реакції видалення групи захисту сольватної форми) з метанолу, де об'ємний вміст контролюють відщеплення ізопропілової групи; води становить 15%. визначивши, що гр упа захисту видалена практичУ типовому випадку арзоксифен-гідрохлорид но повністю, піддають реакційну суміш подальшій можна розчинити в метанолі (в кількості приблизно обробці, яка у варіанті, якому віддається перевага, 1г речовини на 20мл розчинника) і факультативно включає кристалізацію в умовах, що забезпечують нагріти для прискорення розчинення вихідного утворення F-III, як описано вище та нижче. Спосоарзоксифен-гідрохлориду. Після повного розчиби виготовлення попередника А та відщеплення нення розчин можна факультативно концентруваізопропілової групи можна знайти в патенті США ти до вмісту приблизно 1г речовини в 5мл розчин№5,723,474, відомості з якого включено до цього ника, наприклад, шляхом дистиляції, після чого опису за посиланнями. дати розчину повільно охолодитися до кімнатної В іншому способі, якому віддається перевага, температури. Після досягнення кімнатної темпераF-III одержують, виділяють та очищають сумісно з тури розчин можна факультативно піддати додатхімічним відновленням S-оксиду та з видаленням ковому охолодженню (з використанням льодяної хімічним шляхом бензильної групи захисту від 6бані або холодильного пристрою) до температури гідроксилу в 6-бензилокси-3-(4-[2-(піперидин-1в межах від 0°С до 5°С. Після збігання часу, доіл)етокси]фенокси)-2-(4статнього для кристалізації, кристали F-V можна метоксифеніл)бензо[b]тіофен-(S-оксиді) (поперевідділити шляхом фільтрування під вакуумом і дник В). При проведенні реакцій відновлення та після промивання охолодженим (приблизно до видалення групи захисту контролюють повноту 0°С) метанолом висушити до постійної маси у вавідновлення сульфоксиду до сульфіду та відщепкуумі. Перевага віддається сушінню при дещо підлення бензильної групи захисту гідроксилу. Визнавищених температурах (приблизно при 50°С прочивши, що реакції відновлення та відщеплення тягом 12-48год) при продуванні струменем азоту. групи захисту практично завершені, піддають реаПри виробництві F-V у промислових масштабах кційну суміш подальшій обробці, яка переважно може бути доцільним ініціювання кристалізації з включає кристалізацію в умовах, що забезпечують використанням F-V як затравки. утворення F-III, як описано в цьому документі. До придатних для описаної вище кристалізації Способи виготовлення попередника В, видалення вихідних різновидів арзоксифен-гідрохлориду набензильної групи та відновлення 1-сульфоксиду лежать S-II, F-I, F-III (сольватні та нестехіометричдо відповідного сульфіду можна знайти в патенті ні гідратні кристалічні форми арзоксифенСША №5,723,474, включеного вище до цього опигідрохлориду, описані в заявках PCT/US00/16332 су за посиланнями. та PCT/US00/16333, відомості з яких включено до Незалежно від хімічних процедур, використоцього опису за посиланнями), арзоксифенвуваних на стадіях відщеплення груп захисту та гідрохлорид, одержаний за методиками, описанивідновлення, кристалізація арзоксифснми в патенті '474, або будь-які їх суміші, але не гідрохлориду з суміші ізопропілового спирту з вотільки ці модифікації. Вихідна форма арзоксифендою забезпечує одержання кристалів F-III високої гідрохлориду не має значення, оскільки в резульчистоти. таті кристалізації з безводного метанолу згідно з Іншою формою арзоксифен-гідрохлориду, якій методикою, описаною вище, завжди утворюються віддається перевага, є F-V. F-V можна одержати кристали F-V. шляхом висушування, при температурі навколишІдентифікація та розрізнення S-II. F-I, F-III та Fнього середовища або при злегка підвищеній темV 11 77941 12 Для визначення характеристик S-II, F-I, F-III та ній вологості 35+10%, а також рентгенограми S-II F-V застосовують ДСК/ТГА, сорбцію/десорбцію та F-I показані на Фіг.4. На рентгенограмах F-I та вологи та рентгенодифракційний метод. ТГА часто F-III видно різкі максимуми та рівну базову лінію, є дуже корисним методом розрізнення окремих що свідчить про високий ступінь кристалічності цих твердих форм матеріалу, оскільки температура матеріалів. Відповідні відстані між лініями (d) та (температури), при якій (яких) відбуваються фізичзначення І/І0 представлені в таблиці 1. Хоча багані зміни в матеріалі, як правило, є характерними тьом інтенсивним рефлексам відповідають, як для певної поліморфної модифікації або сольвату. правило, близькі значення кутів дифракції, кожна з ДСК є способом, який часто застосовують для поформ дає свою порошкову рентгенограму, яка слідовного виявлення поліморфізму та утворення відрізняється від інших, що дозволяє надійно розсольватів речовини. Ізотерми сорбції вологи дорізнити форми S-II, F-I та F-III. зволяють оцінити ступінь гігроскопічності конкретІз кристалографії добре відомо, що для кожної ного матеріалу та ідентифікації гідратних та негідконкретної поліморфної модифікації відносні інтератних форм. Нарешті, рентгенодифракційний нсивності дифракційних піків можуть змінюватися метод дозволяє з'ясувати характеристики далековнаслідок змін переважної орієнтації, що залежать го порядку в кристалічних матеріалах. від численних факторів, наприклад, від морфології Зразки арзоксифен-гідрохлориду, одержаного кристалу. При наявності ефектів переважної орієнза методиками, описаними в патенті '474, дають тації інтенсивності піків змінюються, однак полорентгенограми з низьким відношенням сигнал-шум ження піків, характерні для конкретної поліморфта з підвищеним рівнем фону, що вказує на низьної модифікації, залишаються незмінними. ХДив., кий ступінь кристалічності цього матеріалу. Тому наприклад, Фармакопею США №23, Національний F-I та F-III зіставляли з матеріалом (S-II), одержафармацевтичний довідник (National Formulary) ним за модифікованою методикою кристалізації №18, стор.1843-1844, 1995Ї. Крім того, фахівцям із арзоксифен-гідрохлориду, розглянутою вище (докристалографії добре відомо, що для кожної конкдавання етанолу до суспензії арзоксифенретної кристалічної форми кутові положення піків гідрохлориду в етилацетаті при кипінні). також можуть незначно змінюватися. Наприклад, Типові криві ДСК/ТГА для S-II, F-I та F-III покаположення піків можуть зсуватися внаслідок змін зані відповідно на Фіг.1, Фіг.2 і Фіг.3. Крива ДСК температури дослідження зразка, зміни положення для S-II має широкий ендотермічний пік при 62°С, зразка або залежно від наявності або відсутності який відповідає виділенню етилацетату й води з внутрішнього стандарту. В випадку, що розглядарешітки кристалу. Ендотермічний пік при 152°С ється, ці потенціальні варіації враховуються як відповідає плавленню. За даними ТГА, одночасно зміни положення піків (кута 2q) в межах ±0,2°, які з першим переходом має місце втрата приблизно не заважають надійній ідентифікації форм S-II, F-I 2,5% маси, а до початку плавлення втрачається та F-III. ще 0,5% маси, що свідчить, що деякі молекули Таким чином, виходячи зі значень інтенсивнорозчинника утримуються в решітці більш сильно. сті піків та положення шків форма F-III може бути Крива ДСК для F-I має широкий ендотермічідентифікована за присутністю піків зі значеннями ний пік при 75°С з подальшим другим ендотермічкута 2q 4,63+0,2°; 7,82±0,2°; 9,29+0,2°; 13,97±0,2°; ним піком при 155°С, який відповідає плавленню. 17,62±0,2°; 20,80±0,2° та 24,31±0,2°, якщо рентгеКрива ТГА для F-I вказує на поступову втрату 0,3% нограма одержана при 25+2°С і відносній вологосмаси з подальшою різкою втратою 1,5%; обидва ці ті 35+10% із використанням мідного джерела виявища свідчать про дегідратацію решітки. Початок промінювання. першого переходу на кривій ДСК і відповідна втраДобре відомим і широко вживаним способом та маси за даними ТГА дещо зсун уті одне відносно пошуку кристалічних форм речовин в літературі, є одного внаслідок різниці швидкостей нагрівання. метод Фінка (Fink). В методі Фінка для початкового Початкова втрата маси відповідає виділенню слапошуку використовуються чотири піки найвищої бко зв'язаної гідратної води, в той час як друга інтенсивності, а потім чотири наступні піки з найвтрата маси відповідає виділенню приблизно вищими значеннями інтенсивності. Згідно з мето0,5моль води, присутньої в решітці при дуже низьдом Фінка, виходячи з інтенсивностей піків та поких значеннях відносної вологості (нижче 5%, див. ложень піків, форму F-V можна ідентифікувати за дані по сорбції вологи). наявністю піків зі значеннями 2q 7,3+0,2°; Крива ДСК для F-III відрізняється широким ни15,5±0,2°; 15,9+0,2° та 17,6±0,2°, якщо рентгеногзькотемпературним ендотермічним піком при рама одержана з використанням мідного джерела 30°С, за яким іде другий широкий пік відносно нивипромінювання. Присутність F-V можна додаткозької інтенсивності при 70°С і, нарешті, перехід во підтвердити присутністю піків зі значеннями 2q при 146°С, що відповідає плавленню. Різка втрата 17,9+0,2°; 18,2±0,2°; 18,9±0,2° та 21,5±0,2°, якщо маси (1,5%, тобто приблизно 0,5моль) на кривій рентгенограма одержана з використанням мідного ТГА, що збігається з першим ендотермічним піком, джерела випромінювання. відповідає виділенню слабко зв'язаних молекул води, а додаткова втрата приблизно 1,6% маси Таблиця 1 при температурі вище 60°С відображає виділення більш сильно зв'язаних молекул води, тобто таких, S-II F-I F-III що присутні в речовині при дуже низьких значенd (°2q) І/І0 (%) d (°2q) І/І0 (%) d (°2q) І/І0 (%) нях відносної вологості. Втрата маси, що спостері4,67 1,3 4,92 2,6 4,63 20,8 гається вище 170°С, відповідає розкладу F-III. 5,03 6 7,69 34,6 7,82 100 Рентгенограма F-III, знята при 25±2°С і віднос 77941 14 рівноваги при будь-якій вологості. Профілі сорбції вологи для F-I та F-III свідчать, що ці форми є по суті нестехіометричними гідратами. При відносній вологості, характерній для навколишнього середовища (приблизно 50%), F-I містить приблизно 2,2% води, тобто дещо більше за справжній "напівгідрат" (теоретичне значення 1,7%), в той час як F-III поглинає досить вологи (приблизно 3,7%) для того, щоб його можна було вважати "моногідратом" (теоретичне значення 3,4%). Насипні форми F-I та F-III швидко приходять до рівноваги з атмосферою, отже, вміст води, визначений аналітичними методами, відображає відносну вологість на момент отримання даних. Відмінності між партіями, які відображені даними ДСК, ймовірно, спричинені тим, що зразки були гідратовані до різного ступеня внаслідок відмінностей умов зберігання в навколишньому середовищі. Було одержано картини дифракції рентгенівського проміння для зразків F-I та F-III, що зберігалися при різних значеннях відносної вологості. На Фіг.6 представлено зміни, які спостерігалися в разі врівноваження складу F-III при значеннях відносної вологості (ВВ) приблизно 0%, 22%, 50% та 80%. При зростанні відносної вологості спостерігається поступове зміщення (відносно початкових положень при ВВ 0%) піків F-III, які відповідають значенням 2q приблизно 13,8°; 17,6°; 18,0°; 20,5° та 24,0°, а також незначний зсув піків меншої інтенсивності. Виявлені зміни рентгенодифракційних картин F-III свідчать, що при зростанні відносної вологості розміри елементарної комірки змінюються, можливо, внаслідок входження слабко утримуваних молекул води. Поступове зміщення піків при зростанні вологості добре узгоджується з даними по сорбції вологи, з яких видно поступове зростання маси у відповідному діапазоні відносної вологості, що свідчить про утворення гідрату змінного складу. Аналогічний експеримент було проведено з F-I з метою з'ясування наявності аналогічного впливу відносної вологості на його кристалічну решітку. На Фіг.7 показано рентгенограми для зразків F-I, які зберігалися до досягнення рівноваги при відносній вологості приблизно 0%, 25%, 52%, 73% та 95%. Інтенсивні рефлекси при значеннях 2q приблизно 8,8° та 26,8° взято за внутрішні стандарти. При зростанні відносної вологості (ВВ) спостерігаВизначення додаткових характеристик F-I. F-III ється незначний зсув (відносно початкових полота F-V Були проведені дослідження гігроскопічносжень при ВВ 0%) піків, які відповідають значенням ті F-I та F-III. Ізотерми сорбції вологи для F-I та FIII показані на Фіг.5. При початковому витримуван2q приблизно 7,7°; 18,3°; 18,5°; 20,5° та 20,8°. При підвищених значеннях ВВ спостерігається також ні зразків при відносній вологості приблизно 5% деяке розширення та зменшення розрізнення піків одразу ж спостерігається збільшення маси за рапри приблизно 7,7°; 20,8° та 24,1°, що свідчить про хунок вологості відповідно на 1,5% і 1,7%, що еквісорбцію води аморфними компонентами (або плавалентно приблизно 0,5 моль води. Для обох стифікацію твердої речовини) особливо при ВВ форм виявлено безперервну сорбцію вологи у 73% та 95% (див. Фіг.5). Зсув піків на рентгеногравсьому діапазоні вологості, ймовірно, внаслідок мі F-I, витриманого при різних значеннях відносної входження молекул води в кристалічні решітки. вологості, не такий значний, як у випадку F-III. Цей Різниця в поглинанні вологи між двома форфакт вказує, що решітка F-I не зазнає такого ж мами, ймовірно, відображає кількість води, що розширення та/або стиснення, як решітка F-III. може входити в їх кристалічні решітки (тобто об'єм Виявлено, що F-I та F-III фізично стабільні в простору в решітці, в якому можуть розташовуваусьому діапазоні відносної вологості, незважаючи тися молекули води). Відсутність гістерезису ізона те, що форма F-III здатна поглинати приблизно терм сорбції та десорбції F-I та F-III вказує, що вдвічі більшу кількість води. Виявлено, що обидві обидві кристалічні форми швидко приходять до 6,83 7,17 7,73 9,03 9,31 9,66 10,27 10,47 10,91 13,63 14,09 15,10 15,52 16,45 16,67 17,21 17,53 18,33 18,69 19,37 20,29 20,64 21,02 21,68 22,01 22,29 23,17 23,39 24,30 25,76 26,05 26,63 27,01 27,49 28,10 28,73 29,42 30,00 30,89 31,34 31,70 32,81 32,91 33,48 5,8 16,1 100 1,3 1,7 2,4 1,6 2,2 6,3 2,1 4,6 4,1 10,5 9,1 7,6 4,9 2,4 28,2 11,1 3,5 8,6 17,2 12,7 5,1 8,3 8 7,8 9,1 13,6 3,4 4 5,5 3,1 2,8 1,8 10,9 3,2 3,7 2,1 2,4 1,1 1 0,8 2 13 7,91 9,89 10,22 10,74 14,86 15,45 15,92 16,67 16,98 18,28 18,56 20,58 20,85 21,64 22,19 22,65 23,28 23,97 24,31 25,52 26,20 26,47 28,84 30,13 31,12 100 2,5 2 7,4 9,1 2,3 15,9 1,7 3,1 17,8 7 13,1 8,8 3,9 4,8 2,9 3,4 11,8 6,3 3,9 3,4 3,1 6,4 3,5 2,9 9,29 10,16 10,35 13,77 13,97 15,06 15,71 15,87 16,35 16,77 17,28 17,62 18,09 20,43 20,80 21,31 21,71 21,85 22,13 22,26 23,51 23,69 23,91 24,31 25,22 25,67 27,05 27,89 28,24 28,71 29,89 30,24 30,88 31,44 33,06 34,36 16,9 22,7 5,4 10,7 15,2 6,9 22,3 7,4 34,5 12,3 10 47,9 43,9 42 33,6 42,7 13 14,5 12,8 16,3 13,2 15,9 25,6 38,7 8 8,9 18,9 13,3 8,6 21,3 8,9 18,7 5,8 7,6 4,5 6 15 77941 16 форми мають порівнянні розміри кристалів, мордає профілю ДСК, який вказує на стабільність крифологію, розчинність у воді та швидкість розчисталічної форми. нення. Було виконано дослідження висушування з Таблиця 1А метою контролю процесу десольватації S-II в залежності від тривалості та температури сушіння Кут 2q І/І0 (%) Кут 2q І/І0 (%) Кут 2q І/І0 (%) (див. Фіг.8). Рентгенограми, зняті в певні моменти 7,3 45 17,6 72 22,6 19 часу, показано на Фіг.9. Ці рентгенодифракційні 9,0 22 17,9 83 23,3 20 картини відображають зміни, що відбуваються в 10,0 10 18,2 56 24,4 46 кристалічній решітці при зменшенні вмісту етила12,8 39 18,9 82 25,8 38 цетату в ній. Зразки, використані при дослідженні 14,6 15 19,8 27 27,4 32 висушування, можливо, були частково десольва15,5 50 21,5 100 28,2 18 товані, оскільки для відділення твердого продукту 15,9 64 було застосовано фільтрування під вакуумом. Багато дифракційних піків при дослідженні десольватації S-II займають аналогічні кутові положення, підтверджуючи тим самим, що кристалічні решітки S-II та F-I дуже подібні одна до одної. Зникнення піків при значеннях 2q приблизно 6,8°; 7,2° та 14,0° після мінімального підсушування (момент часу В) свідчить, що ці рефлекси можна приписати кристалографічним площинам, що містять часткову електронну густішу молекул етилацетату. При тривалому нагріванні сольватованого матеріалу у вакуумі при високих температурах утворюється F-I. Одержаний таким чином F-I при рентгенодифракційному дослідженні показав високий ступінь кристалічності. Відповідно, матеріал, одержаний шляхом кристалізації з розчину в суміші етанолу з етилацетатом із подальшим висушуванням у вакуумі протягом лише кількох годин, як описано в патенті '474, мав низький ступінь кристалічною ті, оскільки при такій процедурі утворюється частково десольватований S-II. Типову криву ТГА форми F-V показано на Фіг.10. Термогравіметричний аналіз F-V посвідчив відсутність втрати маси, що вказує на те, що виділена кристалічна форма є несольватованою. На кривій ДСК форми F-V видно різкий ендотермічний пік плавлення при 174-175°С, як показано на Фіг.11, що значно вище температури плавлення FIII. Ізотерма сорбції/десорбції вологи для F-V свідчить про збільшення маси на 0,11% в діапазоні змін відносної вологості від 0% до 95%, що вказує на стабільність безводної кристалічної форми з незначною схильністю до поглинання води або перетворення в гідратну форму арзоксифенгідрохлориду. Рентгенодифракційна картина для F-V характеризується різкими піками та плоскою базовою лінією, що є типовими рисами матеріалів високого ступеня кристалічності. Кутові положення піків (значення 2q) та відповідні значення І/І0 для всіх піків, що мають інтенсивність 10% або більше порівняно з інтенсивністю найвищого піку для F-V, представлено в Таблиці 1А. Усі дані в Таблиці 1А дано з точністю до ±0,2°. Хоча багато інтенсивних відбить відповідають, як правило, кутам дифракції, аналогічним характеристикам, представленим для S-II, F-I та F-III, кожна з цих форм має відмінну від інших порошкову рентгенограму, що дозволяє надійно розрізнити форми S-II, F-I, F-III та F-V. Порошкові рентгенограми F-V, зняті при різних температурах, не показують значних змін дифракційної картини до температури 125°С, що відпові Форми F-I та F-III мають деякі переваги перед відомою формою арзоксифен-гідрохлориду, описаною вище. У порівнянні з арзоксифенгідрохлоридом, одержаним за методиками, описаними в патенті '474, F-I та F-III є більш стабільними при температурах навколишнього середовища і тешу більш придатні для фармацевтичних розробок, тобто для розробки дозованих лікарських форм. Крім того, F-I та F-III мають значно вищий ступінь кристалічності, ніж форма, розкрита в патенті '474. Кристалічні матеріали, як правило, менш гігроскопічні та більш стабільні (тобто менше схильні до хімічної деструкції), ніж аморфні матеріали, і тому їх більш бажано використовувати при виготовленні та переробленні фармацевтичних композицій. Крім того, на відміну від форми арзоксифен-гідрохлориду, одержаної за методиками, описаними в патенті '474, яка містила в своїй кристалічній решітці етилацетат і воду, F-I та F-III містять тільки воду. Форма F-V має деякі переваги перед відомою формою арзоксифен-гідрохлориду, описаною в патенті '474, а також перед формами F-I та F-III, описаними в заявках на патенти РСТ, включеними вище до цього опису за посиланнями. У порівнянні з арзоксифен-гідрохлоридом, одержаним за методиками, описаними в патенті '474, F-V є більш стабільним при температурах навколишнього середовища і тому більш придатний для фармацевтичних розробок, тобто для розробки дозованих лікарських форм. Крім того, на відміну від форми, описаної в патенті '474, F-V має високий ступінь кристалічності. Кристалічні матеріали, як правило, менш гігроскопічні та більш стабільні (тобто менше схильні до хімічної деструкції та змін ефективності), ніж аморфні матеріали, і тому їх більш бажано використовува ти при виготовленні та переробленні фармацевтичних композицій. Крім того, на відміну від форми арзоксифен-гідрохлориду, одержаної за методиками, описаними в патенті '474, яка містила в своїй кристалічній решітці етилацетат і воду, F-V не містить ні води, ні інших розчинників. На відміну від S-II, F-I та F-III, F-V є справжньою безводною формою арзоксифенгідрохлориду, яка не має схильності до поглинання води при змінах відносної вологості. Кристалічна решітка F-V залишається стабільною до температури його плавлення. Крім того, F-V має розчинність у воді приблизно на 10% вище в порівнянні з F-III і є найбільш термодинамічно стабільною відомою формою арзоксифен-гідрохлориду при 17 77941 18 зберіганні в умовах навколишнього середовища. Рентгенодифракційні дослідження виконували Методики визначення характеристик S-II, F-I на порошковому дифрактометрі D5000 фірми та F-III Siemens, обладнаному джерелом випромінювання Дослідження методом ДСК виконували на моСuKa (l=1,54056Å) та кремнієво-літієвим твердодульованому диференційному сканувальному катільним детектором Kevex, при робочій напрузі лориметрі DSC 2920 фірми ТА Instruments, приєд50кВ і струмі 40мА. Сканування кожної рентгеногнаному до системи Thermal Analyst 3100 і рами виконували в межах 2q від 4° до 35° із крообладнаному системою охолодження. Проби (3ком 0,04° та інтервалами 2,5с. Сухі порошки вмі5мг) нагрівали в закритих гофрованих алюмінієвих щували в виїмки тримачів проб із верхнім бюксах від 10°С до 240°С при швидкості нагріванзавантаженням, главку поверхню створювали за ня 2°С/хв. допомогою скляної пластинки. Аналізи методом ТГА виконували на термоПорошкові рентгенограми при змінних темпегравіметричному аналізаторі 2050 фірми ТА ратурах одержували на порошковому дифрактоInstruments, приєднаному до системи Thermal метрі D5000 фірми Siemens, обладнаному джереAnalyst 3100. Проби (5-10мг) нагрівали в відкритих лом випромінювання СuKa (l=1,54056Å), алюмінієвих бюксах від 25°С до 250°С при швидсцинтиляційним детектором та нікелевим фільткості нагрівання 5°С/хв. ром, при робочій напрузі 50кВ і струмі 40мА. ПоРентгенодифракційні дослідження виконували рошок вміщували в тримач з верхнім завантаженна порошковому дифрактометрі D5000 фірми ням та пристроєм для контролю температури у Siemens, обладнаному джерелом випромінювання виїмці, створюючи гладку поверхню для дифракції. СuKa (l=1,54056Å) та твердотільним детектором Сканування кожного зразка виконували в межах Kevex, при робочій напрузі 50кВ і струмі 40мА. кута 2q від 2° до 35° із кроком 0,04° та інтервалами Сканування кожної рентгенограми виконували в 2,5с, починаючи з 25°С, після врівноваження промежах 2q від 4° до 35°. Перед вимірюванням зразтягом 5хв. Подальші операції сканування виконуки витримували для врівноваження при бажаній вали при підвищенні температури з кроком 25°С температурі та/або відносній вологості протягом до максимального значення 125°С. щонайменше 30хв. Способи виготовлення кристалічних форм арВимірювання гігроскопічності F-I та F-III викозоксифен-гідрохлориду, які використовуються в нували методом VTI, як описано нижче. Кожну фармацевтичних композиціях згідно з цим винахопробу висушували у вакуумі при 60°С до моменту, дом, додатково ілюстровані в поданих нижче преколи подальша втрата маси не спостерігалася; в паративних прикладах. Ці приклади не призначені цей час відносну вологість в камері із пробою додля будь-якого обмеження обсягу таких композиції водили до 0%. Ізотерми сорбції одержували при і не повинні розглядатися як обмежувальні. 25°С із застосуванням ваги VTI для зважування у Препаративний приклад 1 вакуумі при регульованій вологості у таких умовах: F-III з гідрохлориду 6-ізопропокси-3-(4-[2маса проби 10-15мг, діапазон відносної вологості (піперидин-1-іл)етокси]-фенокси)-2-(4при сорбції/десорбції 0-95%, крок відносної волометоксифеніл)бензо[b]тіофену гості при вимірюваннях 5%, інтервал зважування До розчину гідрохлориду 6-ізопропокси-3-(4-[2зразка 10хв. (піперидин-1-іл)етокси]-фенокси)-2-(4Методики визначення характеристик F-V метоксифеніл)бензо[b]тіофену (10г, 18ммоль) у Дослідження методом ДСК виконували на дихлористому метилені (100мл) в атмосфері азоту ференційному сканувальному калориметрі DSC додавали при температурі від -10°С до -20°С три2920 фірми ТА Instruments, обладнаному автомахлорид бору (4,23г, 34ммоль) із такою швидкістю, тичним пристроєм подавання проб та системою щоб температура реакційної маси не піднімалася охолодження. Пробу закривали у гофрованому вище -10°С. Після закінчення додавання залишали алюмінієвому бюксі і аналізували з застосуванням реакційну суміш при перемішуванні на 2год. Повіпорожнього бюкса для порівняння. Тепловий потік льно додавали до суміші ізопропіловий спирт (ІПС) вимірювали після врівноважування при 30°С. Гра(12,35мл, 167ммоль) при температурі нижче ніж фік залежності між тепловим потоком та темпера10°С і продовжували перемішування протягом турою інтегрували для виявлення будь-яких ендо30хв. В окрему склянку наливали воду (100мл) і термічних чи екзотермічних ефектів. охолоджували в льодяній бані приблизно до 0°С. Аналізи методом ТГА виконували на термоРозчин продукту переносили у воду з допомогою гравіметричному аналізаторі 2950 фірми ТА шприца при безперервному інтенсивному переміInstruments, обладнаному автоматичним пристрошуванні. Одержану суспензію білого кольору пеєм подавання проб. Пробу вміщували у зважений ремішували при 0°С протягом 1год. Відділяли алюмінієвий бюкс і змінювали температуру від продукт фільтруванням і промивали 25мл 40%-ної навколишньої до 300°С зі швидкістю 10°С/хв. Грасуміші хлористого метилену з водою, а потім 25мл фік залежності втрати маси від температури інтегохолодженої води. Суспендували продукт у 60мл рували для визначення втрати маси в процентах. ІПС і 60мл води і нагрівали до 60°С. Розчинення Ізотерми сорбції вологи одержували з застодосягалося при 48°С. Додавали додатково 120мл суванням проточного приладу SGA-100 (VTI). Проводи. Давали розчину охолодитися до 35°С, повіби аналізували при 25°С в діапазоні відносної вольно охолоджували одержану суспензію до 0-5°С і логості (ВВ) 0-95% при сорбції та 95-5% при перемішували протягом кількох годин. Продукт десорбції із кроком ВВ 5%. Ізотерми сорбції та відділяли фільтруванням і промивали охолоджедесорбції одержували у вигляді графіків залежносною деіонізованою водою (25мл). Осад F-III сушиті зміни маси (%) від відносної вологості (%). ли до постійної маси у вакуумі при 50°С протягом 19 77941 20 12-24год, одержуючи F-III. 50°С у вакуумі гри продуванні слабким струменем Препаративний приклад 2 азоту. Ви хід продукту 15,94г (63,86). Ефективність F-III з 6-бензилокси-3-(4-[2-(піперидин-1за даними РХВЕ 89,4% (в розрахунку на вільну іл)етокси]-фенокси)-2-(4основу), сумарний вміст супутніх речовин (ССР) метоксифеніл)бензо[b]тіофену (S-оксиду) 0,28%. Зіставлення маси продукту перед і після У склянку Парра місткістю 250мл завантажусушіння показало, що початковий вологий осад вали деіонізовану воду (5,25мл), 1 Μ хлористоводмістив 65% розчинника. неву кислоту (7,74мл, 7,75ммоль), 10%-ний палаПрепаративний приклад 5 дій на вугіллі (тип А32110, 1,37г, 1,29ммоль Pd), 6F-V: Кристалізація з метанолу з концентруванбензилокси-3-(4-|2-(піперидин-1-іл)етокси]ням фенокси)-2-(4-метоксифеніл)бензо[b]тіофен (SПробу арзоксифен-гідрохлориду (25,00г) зміокслд) (3г, 5,16ммоль) та ізопропіловий спирт шували з 500мл безводного метанолу (ступеня (32мл) при температурі навколишнього середовичистоти "для РХВЕ") і нагрівали зі зворотним хоща. Колбу приєднували до струшувального прилодильником. Тверда речовина повністю розчинястрою Парра, двічі послідовно вакуум ували та лася, утворюючи однорідний розчин світлопродували азотом, потім вакуумували і заповнюжовтого кольору. Концентрували розчин шляхом вали газоподібним воднем до надлишкового тиску видалення 375мл дистиляту під атмосферним тис30 фунтів на кв. дюйм (2,1кг/см 2). Запускали струком. На цей момент реакційна суміш являла собою шувач і нагрівали реакційну суміш до 60°С. Припрозорий однорідний розчин жовтого кольору. близно через 4год контролювали повноту реакції Припиняли дистиляцію і вносили у розчин кілька за допомогою рідинної хроматографії високої ефеміліграмів попередньо одержаного F-V як затравктивності (РХВЕ). Фільтрували реакційну суміш ку. Після внесення затравки суміші давали охолочерез шар діатоміту і промивали цей шар 0,1Μ дитися при повільному розмішуванні до темперахлористоводневою кислотою (2x10мл). Видаляли тури навколишнього середовища протягом 1год. розчинник у вакуумі при температурі приблизно За цей час утворювалася значна кількість білого 50°С. Одержаний залишок розчиняли в 30мл суосаду. Суспензію вміщували в льодяну баню і пеміші ізопропілового спирту (50%) із деіонізованою ремішували ще протягом З год. Фільтрували суводою і обережно підігрівали на паровій бані до спензію через паперовий фільтр "Ватман №1" і одержання розчину. Додавали до цього розчину промивали білий осад 50мл метанолу, попередньо деіонізовану воду (22мл) і давали розчину охолоохолодженого до 0°С. Вологий осад сушили протядитися до температури навколишнього середовигом приблизно 48год при 50°С у вакуумі при проща. Потім суспензію продукту охолоджували далі дуванні слабким струменем азоту. Вихід продукту до 0°С. Продукт відділяли фільтруванням, проми22,44г (89,8%). Ефективність за даними РХВЕ вали охолодженою деіонізованою водою (2x15мл) 91,3% (в розрахунку на вільну основу), ССР 0,26%. і сушили до постійної маси у вакуумі при 50°С, Зіставлення маси продукту перед і після сушіння одержуючи F-III. показало, що початковий вологий осад містив Препаративний приклад 3 31,5% розчинника. F-I з S-II Препаративний приклад 6 S-II сушили у вакуумній шафі (вакуум 635мм F-V: Кристалізація з метанолу в об'ємі 50 гарт.ст.) при 100°С протягом 118 годин. Одержано Fлонів (190л) I. Пробу арзоксифен-гідрохлориду (3,08кг) зміПрепаративний приклад 4 шували з 60л безводного метанолу (ступеня чисF-V: Кристалізація з метанолу без концентрутоти "для РХВЕ") і нагрівали зі зворотним холодивання льником. Тверда речовина повністю розчинялася, Пробу арзоксифен-гідрохлориду (20,00г) зміутворюючи однорідний розчин світло-жовтого кошували з 500мл безводного метанолу (ступеня льору. Концентрували розчин шляхом видалення чистоти "для РХВЕ") і нагрівали зі зворотним хо40л дистиляту під атмосферним тиском. На цей лодильником. Тверда речовина повністю розчинямомент реакційна суміш являла собою прозорий лася, утворюючи однорідний розчин світлооднорідний розчин жовтого кольору. Охолоджуважовтого кольору. Охолоджували розчин до темпели суміш для припинення кипіння і при температуратури нижче точки кипіння і додавали додатково рі приблизно 40°С відкривали люк для перевірки 5,00г арзоксифен-гідрохлориду. Знов нагрівали наявності кристалів. Після підтвердження присутрозчин до кипіння для забезпечення повного розності кристалів продовжували охолодження зі чинення твердої речовини. Давали розчину повішвидкістю 12°С/год до кінцевої температури 0°С. льно охолодитися при перемішуванні. При 50°С Суспензію кристалів перемішували протягом ночі, вносили у розчин кілька міліграмів попередньо після чого фільтрували через однорамний фільтродержаної солі F-V як затравку. Суспензії кристапрес. Із метою повного добування продукту із крилів давали охолодитися від 50°С до 30°С протягом сталізаційного апарата маточний розчин викорис1,25год. На цей момент у суміші була присутня товували для промивання апарата і потім велика кількість твердої речовини білого кольору. пропускали через фільтрпрес. Осад на фільтрі Суспензію при безперервному перемішуванні вміпромивали 11,3л безводного метанолу, поперещували в льодяну баню і перемішували ще протядньо охолодженого до 0°С. Осад сушили шляхом гом 3год. Фільтрували суспензію через паперовий створення вакууму в фільтрпресі та пропускання фільтр "Ватман №1" і промивали білий осад 50мл через оболонку фільтрпресу води з температурою метанолу, попередньо охолодженого до 0°С. Во50°С. Приблизно через 24год починали продуванлогий осад сушили протягом приблизно 48год при ня слабким струменем азоту. Загальна тривалість 21 77941 22 сушіння приблизно 36год. Вихід 2,588кг (86,27%); нами, солі четвертинного амонію, лужних металів ефективність за даними РХВЕ 92,7% (в розрахунку або лужноземельних металів. Як правило, солі на вільну основу), ССР 0,39%. кислот одержують проведенням реакції кислоти з Препаративний приклад 7 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]F-V: Кристалізація з етанолу фенокси)-2-(4-метоксифеніл)бензо-[b]-тіофеном. Етанол високої чистоти (250мл) та арзоксиСолі лужних та лужноземельних металів одержуфен-гідрохлорид (10,0г) змішували і нагрівали зі ють в результаті реакції гідроксиду металу або зворотним холодильником для забезпечення розсолі бажаного металу з 6-гідрокси-3-(4-[2чинення. Розчину давали охолодитися до темпе(піперидин-1-іл)етокси]-фенокси) 2-(4ратури навколишнього середовища протягом 3год. метоксифеніл)бензо-[b]-тіофеном. За цей час утворювався білий кристалічний осад. Термін "фармацевтичний", вжитий в цьому Твердий продукт відділяли фільтруванням і сушиописі як означення, означає практично нетоксичну ли при 50°С у вакуумі протягом ночі при продуванта практично нешкідливу для пацієнта сполуку. ні слабким струменем азоту. Вихід 5,50г, т.пл. При вживанні терміну "фармацевтична компо173°С (за даними ДСК). Одержано порошкову рензиція" мається на увазі, окрім інших обставин, що тгенограму для цього зразка, яка практично іденкомбінація розчинників, наповнювачів та солі має тична дифракційній картині для F-V, показаній на бути сумісною з активним інгредієнтом композиції. Фіг.12. Термін "сіль кислоти" стосується солі 6Препаративний приклад 8 гідрокси-3-(4-[2-(піперидин-1-іл)етокси]-фенокси)F-V: Кристалізація з ізопропанолу 2-(4-метоксифеніл)бензо-[b]-тіофену або стабілізуБезводний ізопропанол (250мл) та арзоксивальних агентів - цистеїну, ацетилцистеїну або фен-гідрохлорид (10,0г) змішували і нагрівали зі метіоніну, одержаної шляхом реакції з неорганічзворотним холодильником для забезпечення розною або органічною кислотою. Приклади фармачинення. Припиняли нагрівання і вносили у розчин цевтичних солей кислот наведено, наприклад, у кілька міліграмів F-V як затравку. Реакційній суміші роботі Берджа, Біглі та Монкхауза [S.M. Berge, L.D. давали охолодитися до температури навколишBighley and D.C. Monkhouse, J. Pharm. Sci., 66:1, нього середовища і перемішували протягом ночі; 1977]. До кислот, що звичайно використовують для за цей час утворювався білий осад. Твердий проодержання таких солей кислот, належать неоргадукт відділяли фільтруванням; одержано 12,11г нічні кислоти, такі як хлористоводнева, бромистовологого осаду. Пробу цього осаду масою 4,01г воднева, йодистоводнева, сірчана та фосфорна сушили при 60°С у вакуумі протягом ночі при прокислоти, а також органічні кислоти, такі як толуолдуванні слабким струменем азоту. Вихід 2,72г, сульфокислота, метансульфокислота, щавлева т.пл. 171,5°С (за даними ДСК). Одержано порошкислота, пара-бромфенілсульфокислота, вугільна, кову рентгенограму для цього зразка, яка практичбурштинова, лимонна, бензойна та оцтова кислоно ідентична дифракційній картині для F-V, покати, і споріднені неорганічні та органічні кислоти. заній на Фіг.12. Таким чином, до згаданих фармацевтичних солей Препаративний приклад 9 належать сульфат, піросульфат, бісульфа т, сульF-V: Одержання з вільної основи арзоксифену фіт, бісульфіт, фосфат, метафосфат, пірофосфат, Арзоксифен - вільну основу (5,07г) суспендухлорид, бромід, йодид, ацетат, пропіонат, декановали в 65,0мл метанолу. Додавали до реакційної ат, каприлат, акрилат, форміат, ізобутират, капросуміші розчин 1,41мл концентрованої хлористовонат, гептаноат, оксалат, малонат, сукцинат, субдневої кислоти і 10мл води. Нагрівали реакційну арат, себацинат, фумарат, гіп урат, малеат, бутинсуміш при 55°С протягом 15хв для забезпечення 1,4-діоат, гексин-1,6-діоат, бензоат, хлорбензоат, розчинення. Охолоджували реакційну суміш до метилбензоат, динітробензоат, гідроксибензоат, 30°С і вносили 50мг F-V як затравку. Охолоджуваметоксибензоат, фталат, сульфоват, ксилолсульли реакційну суміш до 10°С зі швидкістю 1°С/год і фонат, фенілацетат, фенілпропіонат, фенілбутиперемішували при цій температурі протягом 8год. рат, цитрат, лактат, a-гідроксибутират, гліколят, Твердий продукт відділяли фільтруванням, промитартрат, метансульфонат, пропансульфонат, нафвали метанолом, попередньо охолодженим до талін-1-сульфонат, нафталін-2-сульфонат, манде10°С, і сушили при 50°С у вакуумі протягом ночі лат то що. при продуванні слабким струменем азоту. Ви хід Термін "N-оксидний продукт деструкції арзок4,42г (87,7%); ефективність за даними РХВЕ сифену" стосується сполуки формули 99,7%; ССР 0,32%. Одержано порошкову рентгенограму для цього зразка, яка практично ідентична дифракційній картині для F-V, показаній на Фіг.12. Термін "сіль" у значенні, вживаному в пунктах формули винаходу, означає, як правило, "фармацевтично прийнятну сіль" і стосується сольових . форм 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-{4-метоксифеніл)бензо[b]-тіофену та Термін "продукт розщеплення арзоксифену" названих стабілізувальних агентів, фізіологічно стосується сполуки формули придатних для фармацевтичного застосування. Фармацевтично прийнятні солі можуть існувати в зв'язку з 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]фенокси)-2-(4-метокси-феніл)бензо[b]-тіофеном як солі з первинними, вторинними, третинними амі 23 77941 24 ним інгредієнтом композиції є гідрохлорид 6гідрокси-3-(4-[2-(піперидин-1-іл)етокси]-фенокси)2-(4-метоксифеніл)бензо-[b]-тіофену, то він присутній у кількості, достатній для введення в організм пацієнта від 0,1мг до 100мг активного інгредієнта в . день у формі разової або дробної доз. Перевага віддається присутності активного інгредієнта в Виявлено, що фармацевтичні композиції 6кількості від приблизно 1мг до приблизно 40мг або гідрокси-3-(4-[2-(піперидин-1-іл)етокси]-фенокси)від приблизно 5мг до приблизно 30мг. Найбільша 2-(4-метоксифеніл)бензо-[b]-тіофену або його соперевага віддається вживанню пацієнтом приблилей можуть бути стабілізовані проти деструкції в зно 21,53мг в день солі 6-гідрокси-3-(4-[2процесі виготовлення або під час зберігання шля(піперидин-1-іл)етокси]-фенокси)-2-(4хом додання до згаданої композиції стабілізувальметоксифеніл)бензо-[b]-тіофену, зокрема, його ного агента, вибраного із групи, до якої входять гідрохлориду, що еквівалентно приблизно 20мг метіонін, ацетилцистеїн, цистеїн або їх солі. Ці вільної основи, у формі разової або дробної доз. сполуки являють собою амінокислоти або їх солі Обізнаному фахівцю легко зрозуміти, що терапевчи похідні комерційно доступних амінокислот, кожтично ефективна кількість може варіювати в широна з яких може існувати у формі рацемату або чиких межах, зокрема, залежно від конкретного спостих D- або L-форм. Перевага віддається викориссобу вживання та використання конкретної солі танню як стабілізувального агента цистеїнабо вільної основи. Звичайно, при визначенні тегідрохлориду; найбільша перевага віддається морапевтично ефективної кількості в певній конкретногідрату L-цистеїн-гідрохлориду. ній ситуації слід брати до уваги також інші фактоДля цілей цього винаходу один або кілька розри, наприклад, масу тіла або вік пацієнта, а також критих у цьому описі стабілізувальних агентів (печас, частоту вживання та конкретну фармацевтичревага віддається одному агенту) вводять у фарну композицію, яка застосовується для лікування. мацевтичну композицію в кількості, достатній для Обізнаному фахівцеві легко оцінити цю кількість у забезпечення стабілізації композиції проти деструконкретних обставинах шляхом використання звикції. Кількість стабілізатора може варіювати від чайних способів вибору доз. приблизно 0,01% (мас.) до приблизно 10% (мас.) Фармацевтичні композиції 6-гідрокси-3-(4-[2загальної маси композиції; перевага віддається (піперидин-1-іл)етокси]-фенокси)-2-(4кількості від приблизно 0,05% (мас.) до приблизно метоксифеніл)бензо-[b]-тіофену або його солей, 5% (мас.) загальної маси композиції. Як правило, стабілізовані проти деструкції, у варіанті, якому відношення кількості них стабілізувальних агентів віддається перевага, використовуються як лікарсьдо кількості активного інгредієнта в композиції стакі форми для перорального вживання. До таких новить від приблизно 0,01 до 1,00. Точна кількість лікарських форм належать будь-які звичайні тверді стабілізувального агента, використовувана в конкабо рідкі дозовані форми, такі як, наприклад, табретній композиції, звичайно, варіює в залежності летки, капсули, порошки, суспензії тощо, в тому від кінцевої величини дозованої лікарської форми, числі будь-які препарати пролонгованої дії. Окрім конкретного типу вибраної дозованої лікарської 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]форми, кількості активного інгредієнта, присутньої фенокси)-2-(4-метоксифеніл)бензо-[b]-тіофену або в дозованій лікарській формі, кількості наповнювайого солі та стабілізувального агента, у фармацечів тощо. Досить вказати, що певна фармацевтичвтичних композиціях для перорального вживання на композиція містить стабілізувальний агент в згідно з цим винаходом використовуються фармакількості, достатній для забезпечення стабілізації цевтично прийнятні домішки, в тому числі (але не згаданої композиції проти деструкції. Це означає, тільки) розріджувачі, в'яжучі речовини, дезинтегщо деструкція композиції послаблюється, якщо в ратори, поверхнево-активні речовини, змащувальзгадану композицію введено один зі стабілізувальні агенти, плівкостворюючі полімери тощо, такі як них агентів, розкритих в цьому от сі. Кількість стаглюкоза, лактоза (безводна лактоза або моногідбілізувального агента, достатню для забезпечення рат лактози), сахароза, вторинний фосфат кальстабілізації, обізнаному фа хівцю легко визначити цію, кукурудзяний та картопляний крохмаль, мікроза допомогою добре відомих методів випробувань. кристалічна целюлоза, повідон, желатин, Зокрема, ефективність певної кількості стабілізагідроксипропілметилцелюлоза, гідроксипропілцетора можна оцінити шляхом порівняльних випролюлоза, порошкоподібна трагакантова камедь, бувань досліджуваної композиції та композицій, метилцелюлоза, кросповідон, крохмаль-гліколят що не містять стабілізатора, як описано у поданих натрію, натрієва карбоксиметилцелюлоза, полісонижче Прикладах. рбат 80, лаурилсульфат натрію, стеаринова кисСтабілізовані фармацевтичні композиції згідно лота, стеарати натрію, кальцію та магнію та інші з цим винаходом містять терапевтично ефективну домішки, а також буферні сполуки, емульгатори, кількість 6-гідрокси-3-(4-[2-(піперидин-1-іл)етокси]диспергатори, ароматизатори, барвники, пластифенокси)-2-(4-метоксифеніл)бензо-[b]-тіофену або фікатори тощо. його солі. У значенні, вживаному в цьому описі, Способи приготування фармацевтичних комтермін "терапевтично ефективна" стосується кільпозицій, розкритих у цьому описі, зрозумілі для кості активного інгредієнта або його солі, достатобізнаного фахівця. Крім того, обізнаному фахівцю ньої для введення пацієнту від приблизно 1мг до ясно, що готові фармацевтичні композиції можуть 100мг активного інгредієнта на день у формі разобути оформлені як багатодозові або дискретні одвої або дробної доз. У варіанті здійснення винахонодозові лікарські форми, причому останнім віддаду, якому віддається перевага, в разі, коли актив 25 77941 26 ється перевага. Окрім поданої тут інформації, що бату 80. З метою збереження постійної маси табстосується виготовлення фармацевтичних комполетки кількість лактози (моногідрату лактози та зицій згідно з винаходом, додаткову інформацію безводної лактози) зменшували відповідно до можна одержати зі стандартних джерел, напривведеної кількості цистеїн-гідрохлориду. Після клад, з монографії Ремінгтона "Фармацевтичні подрібнення вологої маси за допомогою обертовонауки" [Remington's Pharmaceutical Sciences, 17 th го турбінного млина гранули сушили в псевдозріEdition, Mack Publ. Co., Easton, Pa., 1985]. дженому шарі. Висушені гранули подрібнювали до Винахід проілюстрований поданими нижче бажаного розміру в обертовому турбінному млині. прикладами, які не слід розглядати як обмежуваДодавали до висушених гранул інші компоненти льні. (мікрокристалічну целюлозу, стеарат магнію та Приклади застосування цистеїн-гідрохлориду залишок кросповідону) і перемішували. Цю суміш як стабілізатора потім пресували в круглі таблетки на звичайному А. Лікарські форми зі вмістом 10мг та 20мг арротаційному таблетувальному пресі. Для партій зоксифену таблеток А, В та С кількість активного арзоксифеТаблетки без оболонки масою приблизно по ну становила 10мг на одну таблетку, а кількість 250мг, що містрли приблизно 10мг або 20мг арзокцистеїн-гідрохлориду на одну таблетку цих партій сифену в формі арзоксифен-гідрохлориду, виго тостановила відповідно 0,0мг, 0,1мг та 0,5мг. Для вляли за загальною схемою, описаною нижче. Арпартій таблеток D, Ε та F кількість активного арзозоксифен-гідрохлорид, водорозчинні розріджувачі ксифену становила 20мг на одну таблетку, а кіль(моногідрат лактози табезводну лактозу) і частину кість цистеїн-гідрохлориду на одну таблетку цих дезинтегратора (кросповідону) змішували в гранупартій становила відповідно 0,0мг, 0,5мг та 0,75мг. ляторі з високим зусиллям зсуву. Цю суміш місили Склад таблеток кожної з цих партій подано в Табв грануляторі з високим зусиллям зсуву у вологолиці 2, де наведено також кількість (мг/таблетку) му стані з водним розчином повідону та полісорта тип наповнювачів, використанні в кожному вибату 80. При виготовленні композицій, які містили падку. Як видно з цієї таблиці, на таблетки партій стабілізатор (цистеїн-гідрохлорид), гідрохлорид D, Ε та F були нанесені плівкові оболонки за доцистеїну також розчиняли в розчині для гранулюпомогою водної дисперсії у чаші для нанесення вання і додавали на стадії змішування у вологому оболонок із боковою витяжною трубою, приєднастані у складі розчину для гранулювання. Цистеїнною до промислової вентиляційної установки. гідрохлорид переважно додавали до розчину для гранулювання після додання повідону та полісорТаблиця 2 Склад таблеток (мг/таблетку) Інгредієнт Арзоксифен-НСІ (еквівалент основи) L-цистеїн-НСІ моногідрат Повідон Полісорбат 80 Безводна лактоза Моногідрат лактози Кросповідон Мікрокристалічна целюлоза Стеарат магнію Фарбувальна суміш (жовта) Паpтія А В С D Ε F 11,31 (10) 11,31 (10) 11,31 (10) 22,73 (20) 22,73 (20) 22,73 (20) 0,10 0,50 0,50 0,75 12,50 12,50 12,50 12,50 12,50 12,50 1,25 1,25 1,25 1,25 1,25 1,25 148,75 148,67 148,35 139,62 139,22 139,02 37,19 37,17 37,09 34,90 34,80 34,75 12,50 12,50 12,50 12,50 12,50 12,50 25,00 25,00 25,00 25,00 25,00 25,00 1,50 1,50 1,50 1,50 1,50 1,50 10,00 10,00 10,00 Після виготовлення відповідних лікарських форм таблетки аналізували на вміст продуктів деструкції (N-оксиду, продукту розщеплення та сумарний вміст суп утні х речовин). Вміст N-оксиду, продукту розщеплення та сумарний вміст суп утніх речовин (домішок, пов'язаних із процесами виготовлення, плюс продуктів деструкції) визначали методом градієнтної рідинної хроматографії високої ефективності (РХВЕ). Розділення виконували з застосуванням колонки довжиною 250мм і внутрішнім діаметром 4,6мм із сорбентом InertsilÒ C8 (5мкм). Для градієнтного елюювання використовували ацетонітрил і фосфатний буфер рН 3,0 (KН2РО4, 6г/л). Початкова рухома фаза містила 30% ацетонітрилу та 70% буфер у (р ухома фаза А), а кінцевий склад рухомої фази відповідав 70% ацетонітрилу та 30% буферу (р ухома фаза В). Кількість рухомої фази В спочатку становила 0%, і її збільшували за лінійним законом зі швидкістю 1,8%/хв протягом 20хв, тобто до 36% В. Потім кількість фази В залишали незмінною (36%) протягом 25хв, після чого збільшували зі швидкістю 6,4%/хв протягом 10хв до 100% і утримували при 100% протягом 2хв. Температура колонки була 40°С, швидкість потоку рухомої фази 1,0мл/хв, об'єм проби 10мкл. Речовини, супутні арзоксифену, виявляли з застосуванням УФ детектора на довжині хвилі 310нм і кількісно визначали як частку від суми площі піків (в процентах). Крім того, таблетки з кожної партії зберігали у відкритих контейнерах при контрольованій температурі (40°С) протягом 6 місяців. На протязі цього 27 77941 28 періоду зберігання контролювали утворення в 0,5мг/таблетку при обох значеннях вмісту арзоктаблетках продуктів деструкції (N-оксиду, продукту сифену забезпечує зниження рівня N-оксиду після розщеплення та сумарний вміст супутніх речовин), 6-місячного зберігання при 40°С на порядок у пояк описано вище. Результати цих досліджень порівнянні з композиціями без стабілізатора. Підвидано в Таблиці 3 та Таблиці 4 відповідно для табщення вмісту продукту розщеплення у присутності леток із вмістом активного інгредієнта 10мг (А, В цистеїн-гідрохлориду також значно зменшується та С) і 20мг (С, D та F). Ці дані свідчать, що прису(приблизно вдвічі) у порівнянні з партіями таблетність цистеїн-гідрохлориду в кількості ток, які не містять стабілізатора. Таблиця 3 Таблетовані лікарські форми арзоксифену (доза 10мг) Характеристики хімічної стабільності як функції часу зберігання у відкритих контейнерах при 40°С Контрольна партія (А) Початковий момент N-oxide CDP (%) TRS (%) Після 2 тижнів зберігання N-oxide CDP (%) TRS (%) Після 1 місяця зберігання N-oxide CDP (%) TRS(%) Після 3 місяців зберігання N-oxide CDP (%) TRS (%) Після 6 місяців зберігання N-oxide CDP (%) TRS (%) Партія із вмістом цистеїн-НСI Партія із вмістом цистеїн-НСI 0,1мг/таблетку (В) 0,5мг/таблетку (С) 0,00 0,14 1,12 0,00 0,12 1,08 0,00 0,12 1,08 0,05 0,19 1,27 0,01 0,14 1,14 0,00 0,13 1,14 0,09 0,26 1,55 0,03 0,16 1,27 0,00 0,13 1,18 0,32 0,34 2,19 0,20 0,26 1,88 0,02 0,15 1,44 0,55 0,49 3,02 0,34 0,35 2,66 0,06 0,20 2,03 N-oxide - ідентифікований продукт окиснювальної деструкції арзоксифену TRS - Сума супутніх речовин CDP - Продукт розщеплення Таблиця 4 Таблетовані лікарські форми арзоксифену (доза 20мг) Характеристики хімічної стабільності як функції часу зберігання у відкритих контейнерах при 40°С Контрольна партія (D) Початковий момент N-oxide CDP (%) TRS(%) Після 2 тижнів зберігання N-oxide CDP (%) TRS (%) Після 1 місяця зберігання N-oxide CDP (%) TRS (%) Після 3 місяців зберігання N-oxide CDP (%) Партія із вмістом цистеїн-НСI Партія зі вмістом цистеїн-НСІ 0,5мг/таблетку (Е) 0,75мг/таблетку (F) 0,01 0,13 1,21 0,00 0,13 1,11 0,00 0,13 1,12 0,04 0,14 0,27 0,00 0,13 1,15 0,00 0,12 1,13 0,06 0,16 1,35 0,00 0,14 1,19 0,00 0,13 1,15 0,08 0,17 0,00 0,13 0,00 0,13 29 TRS(%) Після 6 місяців зберігання N-oxide CDP (%) TRS (%) 77941 Контрольна партія (D) 1,30 30 Продовження таблиці 4 Партія із вмістом цистеїн-НСI Партія зі вмістом цистеїн-НСІ 0,5мг/таблетку (Е) 0,75мг/таблетку (F) 1,16 1,14 0,14 0,15 1,33 0,00 0,10 1,12 0,00 0,10 1,11 N-oxide - ідентифікований продукт окиснювальної деструкції арзоксифену TRS - Сума супутніх речовин CDP - Продукт розщеплення В. Лікарська форма із вмістом 5мг арзоксифену Таблетки без оболонки масою приблизно по 125мг, що містили приблизно 5мг арзоксифену в формі арзоксифен-гідрохлориду, виготовляли та випробовували за такою ж схемою, як лікарські форми із вмістом 10мг та 20мг арзоксифену, описані вище. Кількість цистеїн-гідрохлориду становила 0,25мг/таблетку, як показано в Таблиці 5. Ці таблетки зберігали у відкритому контейнері при контрольованій температурі (40°С) протягом 3 місяців. На протязі цього періоду зберігання контролювали утворення в таблетках продуктів деструкції (N-оксиду, продукту розщеплення та сумарний вміст супутніх речовин), як описано вище. Результати цих досліджень подано в Таблиці 6. Таблиця 5 Склад таблеток (мг/таблетку) Інгредієнт Арзоксифен-НСІ (еквівалент основи) L-цистеїн-НСІ моногідрат Повідон Полісорбат 80 Безводна лактоза Моногідрат лактози Кросповідон Мікрокристалічна целюлоза Стеарат магнію Фарбувальна суміш (жовта) Партія G 5,62 (5) 0,25 6,25 0,63 74,21 18,55 6,24 12,50 0,75 Таблиця 6 Таблетовані лікарські форми арзоксифену (доза 5мг) Характеристики хімічної стабільності як функції часу зберігання у відкритих контейнерах при 40°С Партія зі вмістом цистеїн-НСІ 0,25мг/таблетку (G) Початковий момент N-oxide CDP (%) TRS (%) Після 1 місяця зберігання N-oxide CDP (%) 0,01 0,02 1,35 0,04 0,05 TRS (%) Після 2 місяців зберігання N-oxide CDP (%) TRS (%) Після 3 місяців зберігання N-oxide CDP (%) TRS (%) 1,63 0,05 0,06 1,73 0,05 0,07 1,82 N-oxide - ідентифікований продукт окиснювальної деструкції арзоксифену TRS - Сума супутніх речовин CDP - Продукт розщеплення Приклад застосування метіоніну як стабілізатора Таблетки без оболонки масою приблизно по 250мг, що містили приблизно 1мг арзоксифену в формі арзоксифен-гідрохлориду, виготовляли за загальною схемою, описаною нижче. Арзоксифенгідрохлорид, водорозчинні розріджувачі (моногідрат лактози та безводну лактозу) і частину дезінтегратора (кросповідону) змішували в грануляторі з високим зусиллям зсуву. Цю суміш місили в грануляторі з високим зусиллям зсуву у вологому стані з водним розчином повідону та полісорбату 80. При виготовленні композицій, які містили випробовувані стабілізатори (аскорбінову кислоту або метіонін), відповідний стабілізатор також розчиняли в розчині для гранулювання і додавали на стадії змішування у вологому стані у складі розчину для гранулювання. З метою збереження постійної маси таблетки кількість лактози (моногідрату лактози та безводної лактози) зменшували відповідно до введеної кількості стабілізатора. Після подрібнення вологої маси за допомогою обертового турбінного млина гранули сушили в псевдозрідженому шарі. Висушені гранули подрібнювали до бажаного розміру в обертовому турбінному млині. Додавали до висушених гранул інші компоненти (мікрокристалічну целюлозу, стеарат магнію та залишок кросповідону) і перемішували. Цю суміш потім пресували в круглі таблетки на звичайному ротаційному таблетувальному пресі. Партія таблеток Η була контрольною і не містила стабілізатора; партії таблеток І та J містили відповідно 0,2% (мас.) та 0,4% (мас.) метіоніну, а партії K та L містили відповідно 0,2% (мас.) та 0,4% (мас.) ас 31 77941 32 корбінової кислоти. Склад таблеток кожної з цих станих в кожному випадку. партій подано в Таблиці 7, де наведено також кількість (мг/таблетку) та тип наповнювачів, викориТаблиця 7 Склад таблеток (мг/таблетку) Інгредієнт Арзоксифен-НСІ (еквівалент основи) Аскорбінова кислота Метіонін Повідон Полісорбат 80 Безводна лактоза Моногідрат лактози Кросповідон Мікрокристалічна целюлоза Стеарат магнію Η 1,12 (1,0) 12,50 2,50 155,90 38,98 12,50 25,00 1,50 Після виготовлення відповідних лікарських форм таблетки аналізували на вміст продуктів деструкції (N-оксиду, продукту розщеплення та сумарний вміст супутніх речовин). Методика аналізу була ідентична описаній у поданих вище прикладах. Крім того, таблетки з кожної партії зберігали у відкритих контейнерах при контрольованій І 1,12 (1,0) 0,50 12,50 2,50 155,50 38,88 12,50 25,00 1,50 Партія J 1,12 (1,0) 1,00 12,50 2,50 155,10 38,78 12,50 25,00 1,50 K 1,12 (1,0) 0,50 12,50 2,50 155,50 38,88 12,50 25,00 1,50 L 1,12 (1,0) 1,00 12,50 2,50 155,10 38,78 12,50 25,00 1,50 температурі (40°С) протягом 1 місяця. Після 2 тижнів та 1 місяця зберігання контролювали утворення в таблетках продуктів деструкції (N-оксиду, продукту розщеплення та сумарний вміст суп утніх речовин), як описано вище. Результати ци х досліджень подано в таблиці 8. Таблиця 8 Таблетовані лікарські форми арзоксифену (доза 1мг) Характеристики хімічної стабільності як функції часу зберігання у відкритих контейнерах при 40°С Партія із вмістом Партія із вмістом Контрольна Партія із вмістом Партія із вмістом аскорбінової аскорбінової партія (Η) метіоніну 0,2% метіоніну 0,4% кислоти 0,2% кислоти 0,4% (мас.) (І) (мас.) (J) (мас.) (K) (мас.) (L) Початковий момент N-oxide CDP (%) TRS (%) Після 2 тижнів зберігання N-oxide CDP (%) TRS(%) Після 1 місяця зберігання N-oxide CDP (%) TRS (%) 0,29 0,05 1,16 0,01 0,05 0,89 0,02 0,05 0,88 0,70 0,05 1,58 0,82 0,06 1,70 2,27 0,83 4,83 0,83 0,94 3,51 0,69 0,93 3,36 4,42 0,22 5,98 4,81 0,22 6,42 4,04 1,52 8,80 1,55 1,65 5,95 1,16 1,57 5,25 5,65 0,33 8,06 5,98 0,31 8,08 N-oxide - ідентифікований продукт окиснювальної деструьції арзоксифену TRS - Сума супутніх речовин CDP - Продукт розщеплення Ці дані свідчать, що введення метіоніну сприяло стабілізації композицій у порівнянні з контрольною партією. Таблетки з метіоніном одразу ж після виготовлення мали значно менший вміст Nоксидного продукту дестр укції (0,01% і 0,02% для партій із вмістом метіоніну відповідно 0,2% (мас.) та 0,4% (мас), тоді як в контрольній партії вміст Nоксиду становив 0,29%. Піcля зберігання при 40°С спостерігалася аналогічна тенденція для N-оксиду з відповідним зниженням вмісту суми супутніх речовин у партіях, що містили метіонін, у порівнянні з контрольною партією. На відміну від цистеїнгідрохлориду, метіонін, як виявилося, мало впливає на утворення продукту розщеплення у порівнянні з контрольною партією. Навпаки, введення класичного стабілізатора (аскорбінової кислоти) сприяло утворенню Nоксидного продукту деструкції у порівнянні з конт 33 77941 34 рольною партією як безпосередньо після виготовінгібування вищезгаданих хворобливих станів в лення, так і після зберігання при 40°С. Після вигокомбінації з відповідною радіотерапією та/або товлення таблеток сумарний вміст суп утні х речоефективними кількостями інгібіторів ароматази, з вин в обох партіях з аскорбіновою кислотою (0,2% аналогами LHRH та/або з інгібіторами ацетилхолі(мас.) та 0,4% (мас.)) був вищим, ніж у контрольній нестерази. партії, і продукт набував слабкого рожевого забарЩодо інгібіторів ароматази, то, за визначенвлення. Хоча аскорбінова кислота також забезпеням, яєчники жінки після менопаузи не функціонучила сприятливий ефект з точки зору зниження ють. Єдиним джерелом естрогенів в її організмі є рівня продукту розщеплення після зберігання при конверсія андрогенів, що продукуються наднирко40°С, загальний ефект, з урахуванням збільшення вими залозами, в естрогени під впливом ферменту вмісту N-оксиду та суми суп утніх речовин, а також ароматази, яка знаходиться в периферичних тказміни кольору продукту, був негативним. нинах (в тому числі в жировій тканині, м'язах та Корисність самій пухлині молочної залози). Таким чином, ліТерміни "інгібування" та "інгібувати" вживакарські засоби, що інгібують ароматазу (інгібітори ються в їх загальноприйнятих значеннях, тобто ароматази), викликають дефіцит циркулюючих стосуються запобігання, протидії, обмеження, поестрогенів в організмі жінки після менопаузи. легшення, покращення, сповільнення, припинення Створення естрогенного дефіциту шля хом інгібуабо зворотного розвитку чи тяжкості будь-якого вання ароматази є важливим варіантом терапії патологічного стану, згаданого в цьому описі, або пацієнтів із метастазами раку молочної залози. його ускладнень. Комерційно доступними є різноманітні інгібітори Терміни "запобігаючий", "запобігання", "профіароматази. До інгібіторів ароматази належать, лактика", "профілактичний" та "запобігати" вживанаприклад, аміноглютемід (CYTANDREN Ò ) (250ються в цьому описі як еквівалентні і стосуються 1250 мг/день, у варіанті, якому віддається перевазменшення ймовірності того, що в особи, яка вжига, по 250мг чотири рази на день), анастразол ває стабілізовану лікарську форму, виникнуть або (ARIMIDEXÒ ) (1-5 мг/день, у варіанті, якому віддабудуть розвиватися будь-які патологічні стани, ється перевага, 1мг один раз на день), летрозол згадані в цьому описі, або їх ускладнення. (FEMAR AÒ ) (2,5-10мг/день. у варіанті, якому віддаТермін "естрогенний дефіцит" стосується стається перевага, 2,5мг один раз на день), формесну, що виник природним шляхом або індукований тан (LENATRONÒ ) (250-1250 мг/тиждень, у варіанклінічно, в якому організм жінки не може продукуті, якому віддається перевага, по 250 мг двічі на вати естрогенні гормони в кількості, достатній для тиждень), ексеместан (AROMASIN Ò ) (25підтримання функцій, які залежать від естрогенів, 100мг/день, у варіанті, якому віддається перевага, наприклад, менструацій, гомеостазу маси кісток, 2мг один раз на день) тощо. нейронної функції, стану серцево-судинної систеЩодо аналогів LHRH (гормону вивільнення ми тощо. Такі стани естрогенного дефіциту винилютеїнізуючого гормону), то тривала дія аналогів кають у зв'язку з менопаузою та хірургічною або LHRH інгібує продукування естрогенів у жінок пехімічною оваріоектомією, в тому числі з її функціоред менопаузою внаслідок десенсибілізації гіпофінальними еквівалентами, наприклад, терапією зу, який втрачає здатність стимулювати продукуагоністами або антагоністами гормону виділення вання естрогенів у яєчниках. Клінічним ефектом є гонадотропіну, ІСІ 182780 тощо, але не тільки в "медична оваріоектомія", яка зникає після припитаких випадках. нення вживання аналога LHRH. До аналогів LHRH Патенти США №5,510,357 та №5,723,474 вканалежать, наприклад, госерлін (ZOLADEXÒ ) (3зують, зокрема, що арзоксифен є корисним, поряд 15мг за три місяці, у варіанті, якому віддається з іншими випадками, для зниження рівня холестеперевага, 3,6-7,2мг один раз на три місяці), лейприну в плазмі та для інгібування гіперліпідемії, ролід (LUPRONÒ ) (3-15мг на місяць, у варіанті, остеопорозу, ракових захворювань, які залежать якому віддається перевага, 3,75-7,5мг один раз на від естрогену, в тому числі раку молочної залози місяць) тощо. та матки, ендометриозу, проліферації клітин глаВибрані методики випробувань деньких м'язів аорти та рестенозу. Згадана сполуМетодики випробування при фіброзі матки ка на сьогодні проходить клінічні випробування Способи інгібування фіброзу матки згідно з при лікуванні та профілактиці остеопорозу та лікуцим винаходом можна продемонструвати, застованні раку матки та молочної залози у жінок. совуючи вказані нижче методики. У зв'язку зі сказаним вище, арзоксифен є таВипробування 1 кож корисним і проходить клінічні випробування Від 3 до 20 жінок з ознаками фіброзу матки при лікуванні рецепторно-позитивних метастазів вживали стабілізовану лікарську форму, розкриту раку молочної залози; при допоміжній терапії рев цьому описі. Кількість вживаного арзоксифену цепторно-позитивних пацієнтів після відповідної становила від 1мг/день до 100мг/день, а тривалокальної або системної терапії; для зниження лість вживання - 3 місяці. Пацієнтки спостерігаличастоти рецидивів інвазивного та неінвазивного ся в період вживання, а також на протязі періоду раку молочної залози; для зниження частоти винидо 3 місяців після припинення вживання препарату кнення інвазивного раку молочної залози та протоз метою виявлення його впливу на фіброз матки. кового внутрішньоепітеліального раку (DCIS). СтаВипробування 2 білізовані лікарські форми арзоксифену згідно з Використовувалася та ж методика, що у вицим винаходом також є корисними при вищезгадапробуванні 1, але період вживання тривав 6 місяних захворюваннях. ців. Крім того, арзоксифен є корисним також для Випробування З 35 77941 36 Використовувалася та ж методика, що у вилість дослідження становила від 6 місяців до 36 пробуванні 1, але період вживання тривав один місяців. У всіх пацієнток досліджували повний мерік. нтальний профіль на початку дослідження, далі Методики випробування при хворобі Альцгейчерез кожні 6 місяців і після завершення дослімера дження. Цей профіль, що використовувався для Способи лікування або профілактики згідно з оцінки ступеня тяжкості захворювання, охоплював цим винаходом хвороби Альцгеймера, зокрема, у показники розумової діяльності, такі як стан пам'я жінок після менопаузи, можна продемонструвати, ті, пізнавальної здатності, логічного мислення, застосовуючи вказані нижче методики. самосвідомості тощо. Оцінка стану хворих охопДля клінічного дослідження було відібрано від лювала також об'єктивні параметри, такі як зміни 10 до 50 жінок. Критерії вибору були такі: щонайструктури мозку, що визначалися з використанням менше один рік після менопаузи, задовільний закомп'ютерної сканувальної аксіальної томографії. гальний стан здоров'я, діагностована рання стадія Такі методики та способи оцінки розумового стану хвороби Альцгеймера. Далі, хвороба у ци х пацієнможна знайти в численних стандартних посібниках ток прогресувала, так що можна було з високою із цих проблем. Зіставлення результатів виконуваймовірністю очікувати помітного зростання тяжкосли як шляхом порівняння показників між групами в ті патологічних симптомів у більшості пацієнток на різні моменти часу, так і порівняння часових змін протязі дослідження. Хворих поділили на дві грустану кожної пацієнтки. Позитивний ефект доказапи; хворі одної групи одержували плацебо, а друга но інгібуванням типу або тяжкості дегенеративних (піддослідна) група одержувала стабілізовану лісимптомів у піддослідній групі, що одержувала карську форму, розкриту в цьому описі. Кількість лікарську форму згідно з цим винаходом, порівнявживаного арзоксифену становила від 1мг/день до но із хворими, які одержували плацебо. 100мг/день при одноразовому прийманні. Трива 37 77941 38 39 Комп’ютерна в ерстка О. Гапоненко 77941 Підписне 40 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюStabilized pharmaceutical formulations containing 6-hydroxy-3-(4-[2-(piperidin-1-yl)ethoxy]phenoxy)-2-(4-methoxyphenyl)benzo(b)thiophene or a salt thereof
Назва патенту російськоюСтабилизированные композиции 6-гидрокси-3-(4-[2-(пиперидин-1-ил) этокси]фенокси)-2-(4-метоксифенил)-бензо[b]-тиофена и его солей
МПК / Мітки
МПК: A61K 31/445, A61K 9/20
Мітки: 6-гідрокси-3-(4-[2-(піперидин-1-іл)-етокси]фенокси)-2-(4-метоксифеніл)бензо[b]тіофену, солей, композиції, стабілізовані
Код посилання
<a href="https://ua.patents.su/20-77941-stabilizovani-kompozici-6-gidroksi-3-4-2-piperidin-1-il-etoksifenoksi-2-4-metoksifenilbenzobtiofenu-ta-jjogo-solejj.html" target="_blank" rel="follow" title="База патентів України">Стабілізовані композиції 6-гідрокси-3-(4-[2-(піперидин-1-іл)-етокси]фенокси)-2-(4-метоксифеніл)бензо[b]тіофену та його солей</a>
Попередній патент: Спосіб рекультивації глибоких кар’єрів
Наступний патент: Спосіб водного екстрагування і фракціонування матеріалу з олійного насіння
Випадковий патент: 4-амінобензолсульфонілоксамінат 9-метиламіноакридинію, який має протигрибкову активність