Спосіб модуляції провідності устячка рослини
Формула / Реферат
1. Спосіб регулювання провідності устячка рослини, який включає модуляцію в рослині рівня й/або активності гексокінази специфічним стосовно замикаючої клітини чином, причому зазначена гексокіназа являє собою гексокіназу типу В, здатну до регулювання провідності устячка, із регулюванням тим самим провідності рослини, при якому, коли зазначена модуляція являє собою підвищувальну регуляцію, зазначену підвищувальну регуляцію забезпечують введенням у рослину конструкції нуклеїнової кислоти, яка містить послідовність нуклеїнової кислоти, що кодує гексокіназу при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цис-положенні регуляторного елемента, причому зазначена гексокіназа являє собою гексокіназу типу В, здатну до регулювання провідності устячка, і при якому, коли зазначеною модуляцією є понижуюча регуляція, зазначену понижуючу регуляцію забезпечують введенням у рослину засобу нуклеїнової кислоти для сайленсингу, здатного до понижуючої регуляції зазначеної гексокінази типу В, при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цис-положенні регуляторного елемента.
2. Спосіб зниження провідності устячка рослини, який включає введення в клітину рослини конструкції нуклеїнової кислоти, яка містить послідовність нуклеїнової кислоти, що кодує гексокіназу при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цис-положенні регуляторного елемента, причому зазначена гексокіназа являє собою гексокіназу типу В, здатну до регулювання провідності устячка, зі зниженням тим самим провідності устячка рослини.
3. Спосіб збільшення ефективності використання води в рослині, який включає введення в клітину рослини конструкції нуклеїнової кислоти, яка містить послідовність нуклеїнової кислоти, що кодує гексокіназу при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цис-положенні регуляторного елемента, причому зазначена гексокіназа являє собою гексокіназу типу В, здатну до регулювання провідності устячка, зі збільшенням тим самим ефективності використання води рослиною.
4. Спосіб посилення витривалості рослини до посухи, засоленості або температурного стресу, який включає введення в клітину рослини конструкції нуклеїнової кислоти, яка містить послідовність нуклеїнової кислоти, що кодує гексокіназу при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цис-положенні регуляторного елемента, причому зазначена гексокіназа являє собою гексокіназу типу В, здатну до регулювання провідності устячка, зі збільшенням тим самим витривалості рослини до посухи, засоленості або температурного стресу.
5. Спосіб збільшення біомаси, потужності або врожайності рослини, який включає введення в клітину рослини конструкції нуклеїнової кислоти, яка містить послідовність нуклеїнової кислоти, що кодує гексокіназу при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цис-положенні регуляторного елемента, причому зазначена гексокіназа являє собою гексокіназу типу В, здатну до регулювання провідності устячка, зі збільшенням тим самим біомаси, потужності або врожайності рослини.
6. Спосіб посилення витривалості рослини до біотичного стресу, який включає введення в клітину рослини конструкції нуклеїнової кислоти, яка містить послідовність нуклеїнової кислоти, що кодує гексокіназу при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цис-положенні регуляторного елемента, причому зазначена гексокіназа являє собою гексокіназу типу В, здатну до регулювання провідності устячка, з посиленням тим самим витривалості рослини до біотичного стресу.
7. Спосіб за будь-яким із пп. 2-5, який додатково включає вирощування рослини в умовах дефіциту води.
8. Спосіб за будь-яким із пп. 2-5, який додатково включає вирощування рослини при засоленості.
Текст
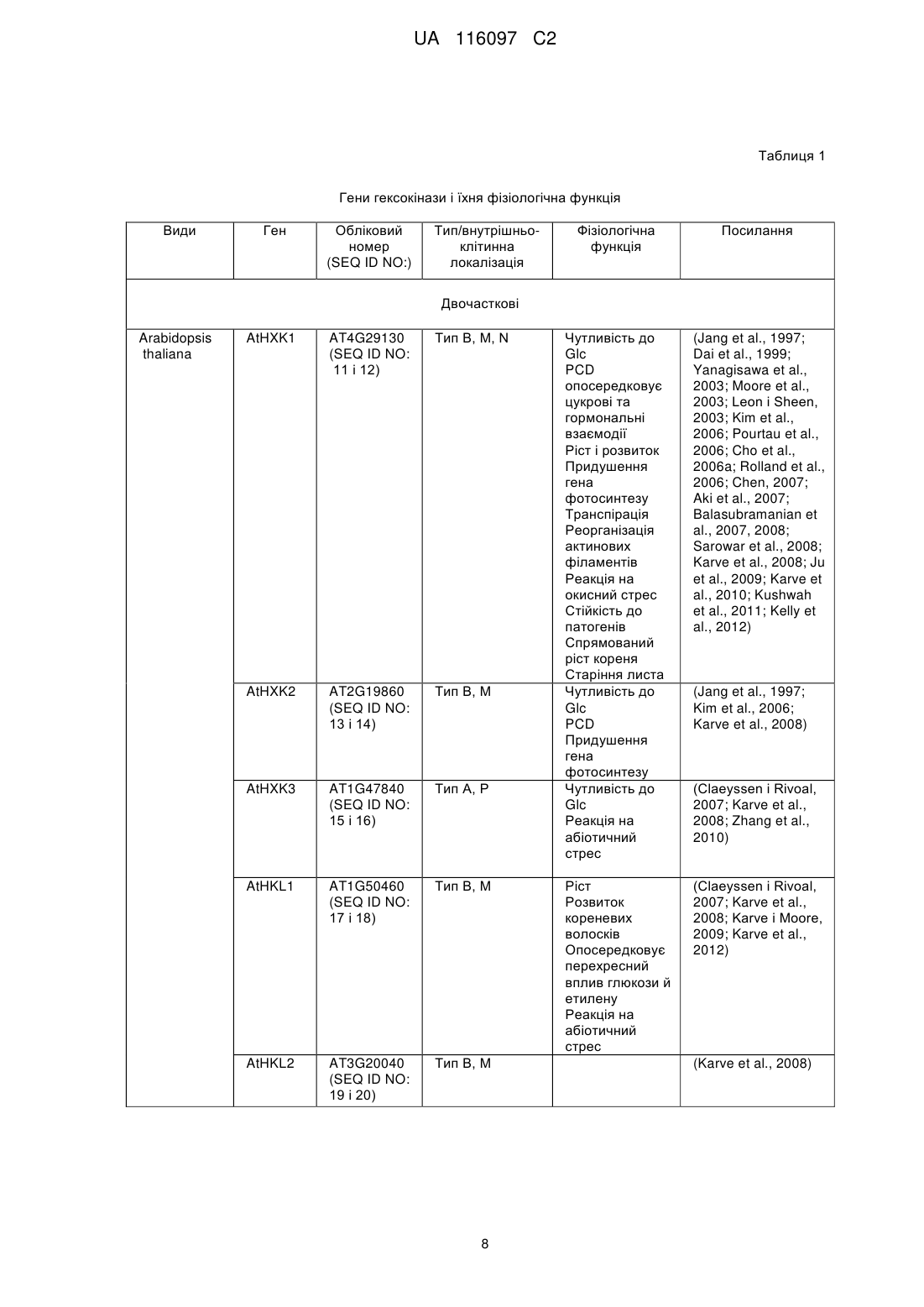
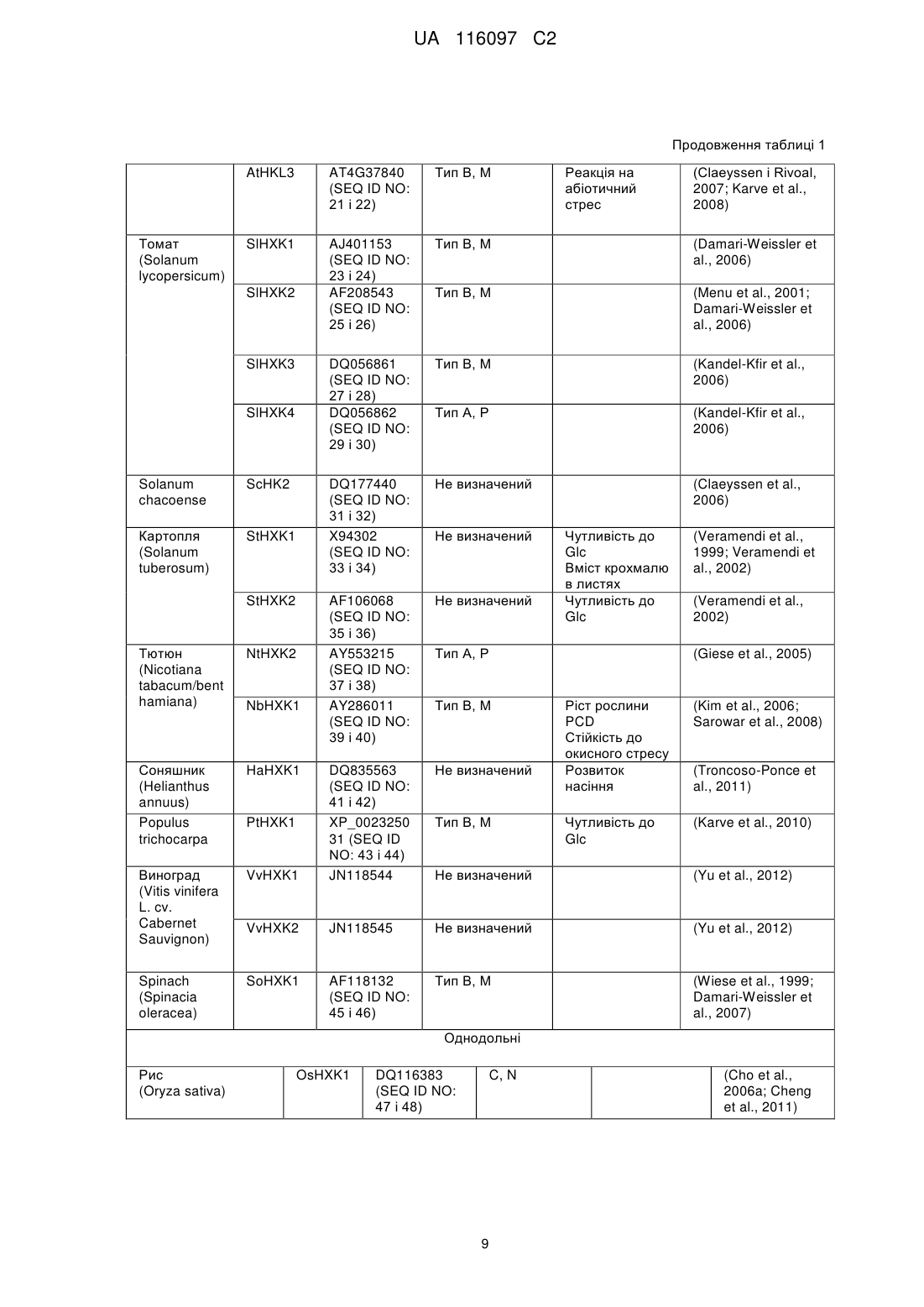
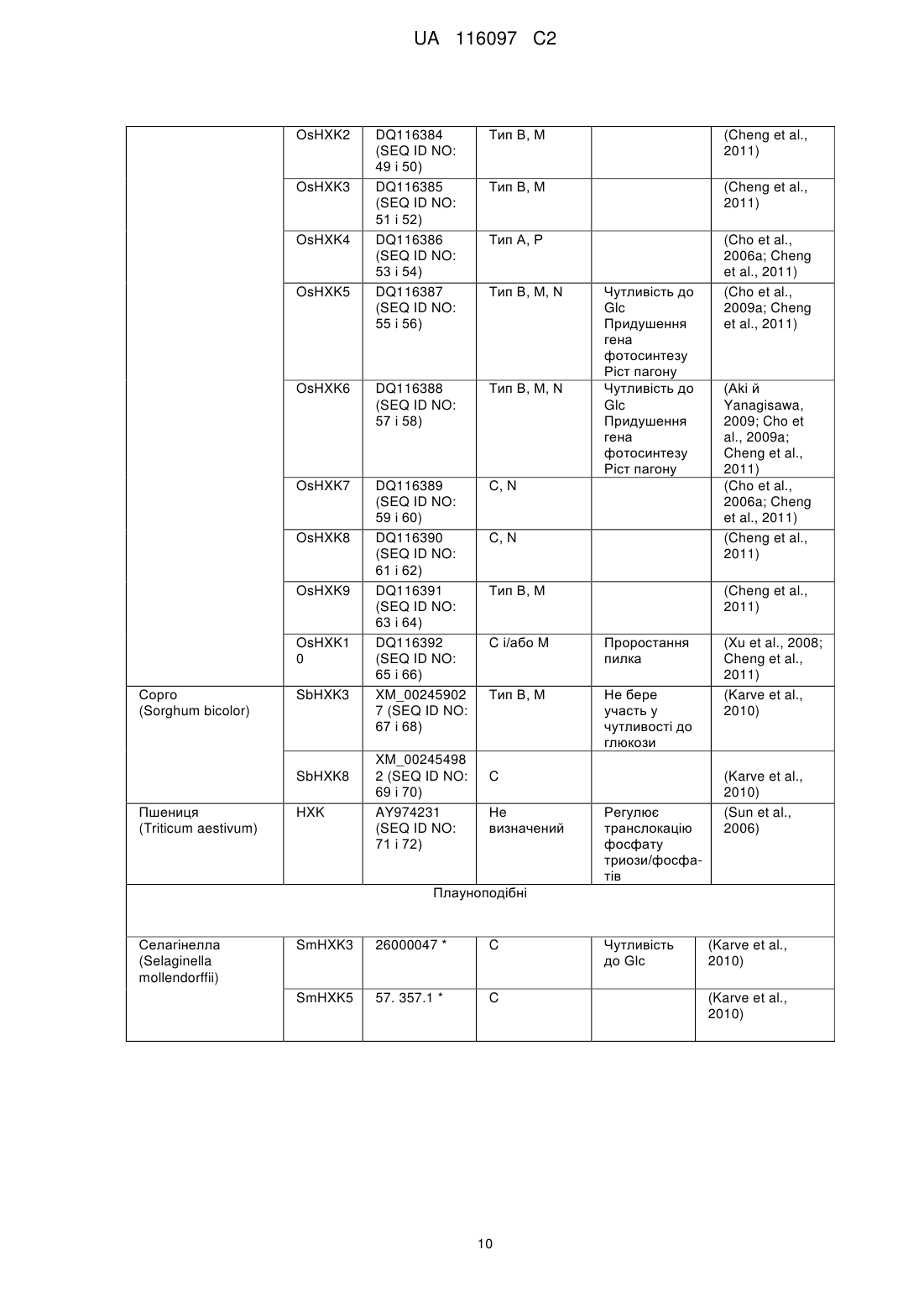
Реферат: Винахід належить до способу регулювання провідності устячка рослини, який включає модуляцію в рослині рівня та/або активності гексокінази типу В шляхом введення у рослину конструкції нуклеїнової кислоти, яка містить послідовність нуклеїнової кислоти, що кодує гексокіназу типу В при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цис-положенні регуляторного елемента. UA 116097 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОПИС Дана заявка претендує на пріоритет за статтею 35 U.S.C. § 119(e) відповідно до попередньої заявки на видачу патенту США з серійним № 61/569251, поданої 11 грудня 2011 р., зміст якої включений в даний документ за допомогою посилання у всій своїй повноті. Область техніки Даний винахід відповідно до деяких його варіантів здійснення відноситься до способів модуляції провідності устячка та до рослинних експресійних конструкцій для їхнього здійснення. Рівень техніки Устячка - це динамічні пори в непроникній захисній кутикулі, що покриває надземні частини сухопутних рослин, що розвилися, головним чином для збереження води. Устячко, що складається з двох замикаючих клітин і пори, яку вони оточують, відкривається на світанку для того, щоб забезпечити надходження атмосферного діоксиду вуглецю (CO 2) для фотосинтезу за рахунок екстенсивної транспіраційної втрати води. Устячко закривається, коли фіксація та використання вуглецю менш ефективні, для того, щоб знизити втрату води в результаті транспірації (Assmann, 1993). На механістичному рівні устячко відкривається у відповідь на підвищення осмолярності замикаючих клітин. За цим підвищенням осмолярності слідує рух води в замикаючі клітини, що збільшує їхній об'єм і відкриває устячко (Taiz и Zeiger, 1998). Закриття устячка відбувається протилежним чином; у міру того, як осмолярність замикаючих клітин знижується, їхній об'єм зменшується. Недостача води є серйозною проблемою, що буде загострюватися через глобальну зміну клімату. Абіотичні стреси, особливо посуха та підвищена засоленість, є основними причинами втрати врожаю в усьому світі. Більше того, у цей час сільське господарство використовує понад 70 % (86 % у країнах, що розвиваються) доступної прісної води. Один із підходів, який може бути прийнятий у сільському господарстві для збереження води, полягає в одержанні рослин, що використовують менше води і при цьому зберігають високу врожайність в умовах недостачі води. Оскільки рослини гублять понад 95 % своєї води шляхом транспірації через устячка, керування активністю устячка являє собою багатообіцяючий підхід для зниження потреби культур у воді та підвищення продуктивності в стресових умовах. Cominelli et al., Transcription. 2010 Jul.-Aug.; 1(1): 41-45, представляють огляд останніх розробок із ідентифікації регуляторів транскрипції, які регулюють рухи устячка та залучені у закриття устячка. Додаткові документи з рівня техніки містять у собі: патентний документ США 7423203, який викладає спосіб збільшення врожайності рослин за допомогою експресії грибної гексокінази під дією специфічного для насіння промотору; заявку на видачу патенту США № 20090265812, яка викладає спосіб посилення витривалості рослини до високотемпературного стресу за допомогою експресії гексокінази під дією специфічного для пилка промотору. Сутність винаходу Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до рослинної експресійної конструкції, що містить послідовність нуклеїнової кислоти, яка кодує гексокіназу при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цисположенні регуляторного елемента. Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до рослинної експресійної конструкції, що містить послідовність нуклеїнової кислоти, яка кодує засіб нуклеїнову кислоту для сайленсингу експресії гексокінази, при цьому експресія засобу нуклеїнової кислоти перебуває під транскрипційним регулюванням специфічного стосовно замикаючої клітини діючого в цис-положенні регуляторного елемента. Відповідно до деяких варіантів здійснення даного винаходу специфічний стосовно замикаючої клітини діючий у цис-положенні регуляторний елемент є індуцибельним. Відповідно до деяких варіантів здійснення даного винаходу специфічний стосовно замикаючої клітини діючий у цис-положенні регуляторний елемент є конститутивним. Відповідно до деяких варіантів здійснення даного винаходу специфічний стосовно замикаючої клітини діючий у цис-положенні регуляторний елемент є специфічним стосовно замикаючої клітини промотором. Відповідно до деяких варіантів здійснення даного винаходу, специфічний стосовно замикаючої клітини промотор є промотором KST1. Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до способу регулювання провідності устячка рослини, при цьому спосіб включає модуляцію в рослини рівня й/або активності гексокінази специфічним стосовно замикаючої клітини чином із регулюванням тим самим провідності рослини. 1 UA 116097 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до деяких варіантів здійснення даного винаходу модуляцією є підвищувальна регуляція. Відповідно до деяких варіантів здійснення даного винаходу підвищувальну регуляцію забезпечують введенням конструкції нуклеїнової кислоти за п. 1 у рослину. Відповідно до деяких варіантів здійснення даного винаходу модуляцією є понижуюча регуляція. Відповідно до деяких варіантів здійснення даного винаходу понижуючу регуляцію забезпечують введенням у рослину засобу нуклеїнової кислоти для сайленсингу при транскрипційному регулюванні специфічного стосовно замикаючої клітини діючого в цисположенні регуляторного елемента. Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до способу зниження провідності устячка рослини, при цьому спосіб включає введення в клітину конструкції нуклеїнової кислоти рослини зі зниженням тим самим провідності устячка рослини. Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до способу збільшення ефективності використання води рослиною, при цьому спосіб включає введення в клітину рослини конструкції нуклеїнової кислоти зі збільшенням тим самим ефективності використання води рослиною. Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до способу збільшення витривалості рослини до посухи, засоленості або температурного стресу, при цьому спосіб включає введення в клітину рослини конструкції нуклеїнової кислоти зі збільшенням тим самим витривалості рослини до посухи, засоленості або температурного стресу. Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до способу збільшення біомаси, потужності або врожайності рослини, при цьому спосіб включає введення в клітину рослини конструкції нуклеїнової кислоти зі збільшенням тим самим біомаси, потужності або врожайності рослини. Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до способу посилення витривалості рослини до біотичного стресу, при цьому спосіб включає введення в клітину рослини конструкції нуклеїнової кислоти з посиленням тим самим витривалості рослини до біотичного стресу. Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до трансгенної рослини або до її частини, що містить рослинну експресійну конструкцію. Відповідно до аспекту деяких варіантів здійснення даний винахід відноситься до виділеної рослинної клітини або культури рослинних клітин, що містить рослинну експресійну конструкцію. Відповідно до деяких варіантів здійснення даного винаходу частиною трансгенної рослини є насіння. Відповідно до деяких варіантів здійснення даного винаходу частиною трансгенної рослини є лист. Відповідно до деяких варіантів здійснення даного винаходу насінням є гібридне насіння. Відповідно до деяких варіантів здійснення даного винаходу спосіб додатково включає вирощування рослини в умовах дефіциту води. Відповідно до деяких варіантів здійснення даного винаходу, спосіб додатково включає вирощування рослини при засоленості. Якщо не зазначене інше, всі технічні й/або наукові терміни, використовувані в даному документі, мають ті самі значення, що зазвичай маються на увазі фахівцем в області, до якої відноситься даний винахід. Хоча при здійсненні або тестуванні варіантів здійснення даного винаходу можуть бути використані способи і матеріали, подібні або еквівалентні описаним у даному документі, нижче описуються ілюстративні способи і/або матеріали. У випадку конфлікту контролем буде служити опис даного винаходу, у тому числі визначення. Крім того, матеріали, способи і приклади є винятково ілюстративними та не призначені в обов'язковому порядку бути обмежуючими. Короткий опис креслень Деякі варіанти здійснення даного винаходу описуються в даному документі винятково як приклад із посиланням на прикладені графічні матеріали. Далі слідує конкретне посилання на графічні матеріали у подробицях, варто підкреслити, що деталі показані як приклад і з метою ілюстративного розгляду варіантів здійснення даного винаходу. У зв'язку з цим, опис разом із графічними матеріалами для фахівців у даній області робить очевидною реалізацію варіантів здійснення даного винаходу. У графічних матеріалах: На фіг. 1A-C зображені графіки, які показують, що сахароза стимулює закриття устячка за допомогою гексокінази. На фіг. 1A представлені репрезентативні, отримані за допомогою 2 UA 116097 C2 5 10 15 20 25 30 35 40 45 50 55 60 світлової мікроскопії зображення устячка, взятого з епідермальних відбитків через 3 години після обробки 100 мМ сорбітом або 100 мМ сахарозою (біла смужка=20 мкм). На B представлена реакція устячка на сахарозу в дикого типу (WT) і в рослин, які експресують AtHXK1 (HK4), оцінювали на інтактних листях, занурених на 3 години на штучний апопластичний сік (Wilkinson і Davies, 1997), що містить 100 мМ сорбіту (як осмотичний контроль), 100 мМ сахарози або 100 мМ сахарози разом із 20 мМ інгібітора гексокінази Nацетилглюкозаміну (NAG). Потім брали епідермальні відбитки і вимірювали щілину устячка. На С представлені реакції устячка в рослин WT на різні комбінації цукрів, які оцінювали, як описано у фіг. 1B з 200 мМ маннітом, який служить як додатковий осмотичний контроль. Дані, показані на фіг. 1B, C являють собою середнє значення 300 устячок із шести незалежних біологічних повторів ± SE. Різні букви означають значиме розходження (t-критерій, P HK4 > HK37) (Dai et al., 1999). Дані по щілині являють собою середнє значення 200 устячок із чотирьох незалежних повторів ± SE. Дані провідності устячка являють собою середнє значення шести незалежних повторів ± SE. Різні букви означають значиме розходження (t-критерій, P < 0,05). На фіг. 2C показано, як швидкість транспірації, нормалізовану на загальну площу листя відслідковували одночасно та безупинно протягом доби, і дані представлені як середнє значення ± SE для кожної 10-ої точки забору зразків (n=6). На фіг. 2D показано, що негативну кореляцію спостерігали між відносною добовою транспірацією всієї рослини й відносною активністю гексокіназного фосфорилювання. Дані транспірації нормалізували на загальну площу листя та на кількість води, що усмоктується щодня зануреним поряд тампоном фіксованого розміру, яку приймали за 100 %. Активність гексокінази WT приймали за 100 %. На фіг. 3A-E показано, що AtHXK1 знижує транспірацію переважно при експресії в листях. Процедури реципрокного щеплення (фіг. 3A) та потрійне щеплення (фіг. 3D) виконували на стадії проростків, фотографували рослини і використовували для вимірів транспірації приблизно через 4 тижні після щеплення. Жовті стрілки і дужки вказують на локалізацію привоїв. На фіг. 3B показана відносна добова транспірація всієї рослини реципрокно щеплених рослин. Дані нормалізували на загальну площу листя та на кількість води, що усмоктується щодня зануреним поряд тампоном фіксованого розміру, яку приймали за 100 %. Дані представлені у вигляді середнього значення чотирьох незалежних повторів ± SE. Різні букви означають значиме розходження (t-критерій, P < 0,05). На фіг. 3C показано, що швидкість транспірації, нормалізовану на загальну площу листя реципрокно щеплених рослин, відслідковували одночасно та безупинно протягом доби. Дані представлені у вигляді середнього значення ± SE для кожної 10-ої точки забору зразків (n=4). На фіг. 3E показана відносна добова транспірація всієї рослини з потрійним щепленням, розраховане як на (фіг. 3B). На фіг. 4A-B представлені графіки, які показують, що супресія HXK інгібує закриття устячка у відповідь на сахарозу. На фіг. 4A представлені кількісні виміри в реальному часі експресії генів томату LeHXK1-3 у томату дикого типу (WT) і у двох незалежних ліній томатів із антизначеннєвою супресією HXK, aHK1 й aHK2. Дані являють собою середнє значення трьох незалежних біологічних повторів ± SE. Зірочки означають значимі розходження у порівнянні з WT (t-критерій, P < 0,05). На фіг. 4B представлена відповідь устячка на сахарозу в WT, двох ліній з антизначеннєвою супресією (aHK1 й aHK2) і лінії, які експресують AtHXK1 (HK4), що оцінювали на інтактних листях, занурених на 3 години на штучний апопластичний сік (Wilkinson і Davies, 1997), що містить 100 мМ сахарози. Дані представлені як середнє значення 400 устячок із восьми незалежних біологічних повторів ± SE. Різні букви означають значиме розходження (tкритерій, P < 0,05). На фіг. 5 представлений графік, який показує, що глюкоза (Glc) і цукри, які можуть бути фосфориловані, але не метаболізовані, стимулюють закриття устячка. Відповіді устячка на різні цукри оцінювали на інтактних листях рослин дикого типу. Листи занурювали на 3 години на штучний апопластичний сік (Wilkinson і Davies, 1997), що містить манніт (як осмотичний контроль), глюкозу, 2-дезоксиглюкозу (2-d) або маннозу. Потім брали епідермальні відбитки і вимірювали щілину устячка. Дані представлені як середнє значення 400 устячок із восьми незалежних біологічних повторів ± SE. Різні букви означають значиме розходження (t-критерій, P < 0,05). На фіг. 6A-F показано, що сахароза стимулює ABA-залежне продукування NO у замикаючих клітинах, яке опосередковане HXK. На фіг. 6A-B показано, як рівні оксиду азоту (NO) відслідковували в замикаючих клітинах із епідермальних оболонок рослин дикого типу (WT) і рослин, які експресують AtHXK1 (HK4), з використанням флуоресцентного індикатора NO 3 UA 116097 C2 5 10 15 20 25 30 35 40 45 50 55 барвника DAF-2DA. Відносні рівні флуоресценції замикаючих клітин (білі стовпчики) і щілин устячка (чорні стовпчики) визначали через 30 хвилин обробки буфером MES (контроль) або MES, що містить або 100 мМ сахарози, або 100 мМ сорбіту в якості осмотичного контролю. Типові зображення флуоресценції представлені над стовпчиками флуоресценції (смужка = 10 мкм). Дані представлені як середнє значення ±SE 90 устячок (фіг. 6A) або 60 устячок (фіг. 6B) для кожного типу обробки з трьома або чотирма незалежними біологічними повторами для кожної обробки. На фіг. 6C показано, як відносні рівні флуоресценції замикаючих клітин WT визначали через 30 хвилин обробки буфером MES (контроль), MES, що містить 20 мМ інгібітора гексокінази - тN-ацетилглюкозаміну (NAG), або 100 мМ сахарози з 20 мМ NAG або без такого. Типові зображення флуоресценції представлені над стовпчиками флуоресценції (смужка=10 мкм). Дані представлені як середнє значення 60 устячок із трьох незалежних біологічних повторів на обробку ± SE. На фіг. 6D представлені конфокальні зображення продукування NO у замикаючих клітинах епідермальних оболонок, оброблених тільки 20 мМ NAG (ліворуч), через 30 хвилин після додавання 100 мМ сахарози (у середині) і через 30 хвилин після відмивання NAG 100 мМ сахарозою (праворуч). Аналіз проводили одночасно з фотографуванням того самого вузького довгого шматочка епідермісу (смужка=20 мкм). На фіг. 6E показані відносні рівні флуоресценції замикаючих клітин із вузького довгого шматочка епідермісу, обробленого як на фіг. 6D. Дані представлені як середнє значення 40-60 устячок ± SE. На фіг. 6F представлені конфокальні зображення продукування NO у замикаючих клітинах епідермальних шарів Sitiens (ABA-дефіцитні мутанти) через 30 хвилин після обробки буфером MES, що містить або 100 мМ сахарози (ліворуч), або 100 мМ ABA (праворуч); смужка=10 мкм. Різні малі літери на фіг. 6A-C, E означають значиме розходження між обробками для даних флуоресценції, а різні прописні букви на фіг. 6A означають значиме розходження між обробками для даних за щілиною устячка (t-критерій, P < 0,05). На фіг. 7A-E показано, що експресія GFP під контролем промотору KST1 специфічна для замикаючих клітин. На фіг. 7A представлені конфокальні зображення дикого типу (WT) (панелі 1-4) і листя томату трансгенних рослин (панелі 5-8) зі специфічною стосовно замикаючої клітини експресією GFP (позначені GCGFP) під контролем промотору KST1. Панелі 1 і 5 - це зображення флуоресценції GFP (зелене фарбування), панелі 2 і 6 – це аутофлуоресценція хлорофіли (фарбування фуксином), панелі 3 і 7 - це зображення в білому світлі, і панелі 4 і 8 це сполучені зображення. На B-E представлені конфокальні зображення рослин WT (ліворуч) і трансгенних рослин Arabidopsis GCGFP (праворуч). Зображення були зроблені на листях (фіг. 7B і C, смужки=50 мкм і 5 мкм, відповідно), гіпокотилях (фіг. 7D, смужка = 100 мкм) і коріннях (фіг. 7E, смужка = 50 мкм). Всі панелі є сполученими зображеннями в білому світлі, аутофлуоресценції хлорофілу (фуксин) і флуоресценції GFP (зелений). На фіг. 8A-F показано, що специфічна стосовно замикаючої клітини експресія AtHXK1 індукує закриття устячка та знижує транспірацію в рослин томату й Arabidopsis. На фіг. 8A показані типові зображення дикого типу (WT) і двох незалежних трансгенних ліній томату, які експресують AtHXK1 особливо в замикаючих клітинах (GCHXK7 і 12). На фіг. 8B і C показана провідність устячка (gs, ) і відносна добова транспірація всієї рослини у WT і двох незалежних трансгенних ліній томату (GCHXK7 і 12). Дані провідності устячка представлені у вигляді середнього значення чотирьох незалежних повторів ±SE. Дані транспірації нормалізували на загальну площу листя та на кількість води, що усмоктується щодня зануреним поряд тампоном фіксованого розміру, яку приймали за 100 %. Представлені дані трьох послідовних днів. Дані для кожного дня представлені у вигляді середнього значення чотирьох незалежних повторів ± SE. На фіг. 8D представлені типові зображення Arabidopsis WT (екотип Col.) і двох незалежних трансгенних ліній, які експресують AtHXK1 специфічно в замикаючих клітинах (GCHXK1 і 2). Фіг. 8E і F - Провідність устячка та вимірювання транспірації у WT, двох незалежних трансгенних ліній Arabidopsis, GCHXK1 і GCHXK2 (екотипу Col.) і gin 2-1 (нульового мутанта AtHXK1, екотипу Ler.). Стрілки вказують на зростання або зниження провідності та транспірації у порівнянні з WT. Дані представлені як середнє значення (±SE) 8 і 12 незалежних повторів для ліній GCHXK і gin2-1, відповідно. Зірочки означають значимі розходження у порівнянні з WT (t-критерій, P < 0,05). На фіг. 9 показано, що експресія GFP під контролем промотору FBPase специфічна стосовно мезофільних клітин. Конфокальні зображення листя рослин трансгенного томату й Arabidopsis з мезофільною специфічною експресією GFP (позначеною MCGFP) під контролем промотору FBPase. Зображення є сполученням флуоресценції GFP (зелене фарбування) і зображень у білому світлі (смужка=100 мкм). Флуоресценція є специфічною стосовно мезофільних клітин. 4 UA 116097 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг. 10A-D представлені графіки, які демонструють, що підвищена експресія гексокінази в замикаючих клітинах знижує транспірацію, у той час як фотосинтез залишається незмінним, з поліпшенням, таким чином, текучої ефективності використання води. Газообмінний аналіз рослин GCHXK і WT проводили з використанням портативної газообмінної системи Li-6400 (LICOR), провідність устячка (фіг. 10A), транспірацію (фіг. 10B), фотосинтез (фіг. 10C) і поточну ефективність використання води (IWUE, Фіг. 10D) вимірювали та розраховували при сприятливих умовах росту. Дані представлені як середнє значення ±SE (n=10 для WT і n=20 для 10 різних трансгенних ліній, по два виміри для кожної). Зірочка означає значиме розходження (tкритерій, P < 0,05). На фіг. 11A-C показано, що підвищена експресія гексокінази в замикаючих клітинах знижує транспірацію цілої рослини і підвищує ефективність використання води. На фіг. 11A-B показано, як відносну добову транспірацію цілої рослини (RDT) аналізували з використанням широкомасштабної лізиметричної системи, як описано у прикладі 1. WT і дві трансгенні лінії GCHXK (GCHXK7, GCHXK12) поміщали на ваги. Транспірацію та загальну масу рослини реєстрували кожні 3 хвилини під час експерименту, при якому рослини вирощували при нормальних умовах протягом 10 днів, потім піддавали стресу посухи протягом 3 днів із наступним відновлювальним зрошенням протягом додаткових 7 днів. Дані нормалізували на загальну масу рослини і на кількість води, що усмоктується щодня зануреним поряд тампоном фіксованого розміру, яку приймали за 100 % й яка служила як еталон для тимчасових варіацій потенційної транспірації. На фіг. 11A показана по днях відносна добова транспірація під час усього експерименту. Дані представлені як середнє значення чотирьох незалежних повторів ± SEM. На фіг. 11B показана відносна добова транспірація вибіркових днів для кожного типу обробки. Дані представлені як середнє значення чотирьох незалежних повторів ± SEM. Зірочка означає значиме розходження (t-критерій, P
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods of modulating stomata conductance and plant expression constructs for executing same
Автори англійськоюGranot, David, Kelly, Gilor, Moshelion, Menachem
Автори російськоюГранот Дэвид, Кэлли Гилор, Мошелион Мэначем
МПК / Мітки
МПК: A01H 5/12, A01H 5/10, C12N 15/54, C12N 15/82, C12N 15/113, A01H 5/02
Мітки: модуляції, устячка, спосіб, провідності, рослини
Код посилання
<a href="https://ua.patents.su/205-116097-sposib-modulyaci-providnosti-ustyachka-roslini.html" target="_blank" rel="follow" title="База патентів України">Спосіб модуляції провідності устячка рослини</a>
Попередній патент: Спосіб приготування зшитої бітум/полімерної композиції зі зниженим виділенням сірководню h2s
Наступний патент: Спосіб одержання еритритолу
Випадковий патент: Спосіб моделювання місцевого відмежованого перитоніту