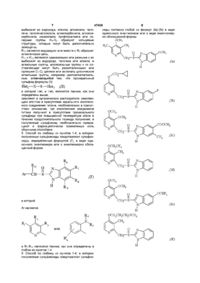
Спосіб синтезу заміщених сульфоксидів (варіанти) та сульфоксид
Номер патенту: 47409
Опубліковано: 15.07.2002
Автори: СТЕНХЕДЕ Урбан Ян, КОТТОН Ханна Крістіна, СЬОРЕНСЕН Хенрік, ЛАРССОН Ерік Магнус, ВОН УНГЕ Пер Оскар Сверкер
Формула / Реферат
1. Способ энантиоселективного синтеза сульфоксида формулы (I) или его щелочной соли в виде одиночного энантиомера или в энантиомерно обогащенной форме:
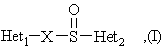
в которой:
Het1 является:
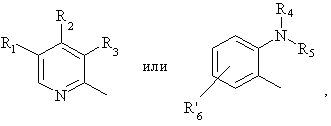
Het2 является:
и Х является:
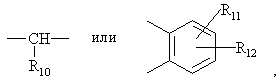
где:
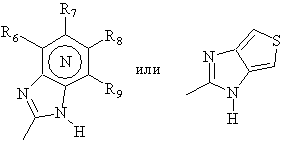
N внутри бензольного кольца бензимидазольной составляющей означает, что один из атомов углерода, замещенных R6-R9, необязательно может быть заменен на атом азота без каких-либо заместителей;
R1, R2 и R3 являются одинаковыми или разными и их выбирают из водорода, алкила, алкилтио, алкокси, необязательно замещенных фтором, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогеном, фенилалкилом и фенилалкокси;
R4 и R5 являются одинаковыми или разными и их выбирают из водорода, алкила и аралкила;
R'6 является водородом, галогеном, трифторметилом, алкилом и алкокси;
R6-R9 являются одинаковыми или разными и их выбирают из водорода, алкила, алкоксила, галогена, галогеналкоксила, алкилкарбонила, алкоксикарбонила, оксазолила, трифторалкила или соседние группы R6-R9 образуют кольцевые структуры, которые могут быть дополнительно замещены;
R10 является водородом или вместе с R3 образует алкиленовую цепь;
R11 и R12 являются одинаковыми или разными и их выбирают из водорода, галогена или алкила, и алкильные группы, алкоксигруппы и их составляющие могут быть разветвленными или прямыми С1-С9 цепями или включать циклические алкильные группы, например циклоалкилалкильные, отличающийся тем, что прохиральный сульфид формулы (ІІ)
![]()
в которой Het1 и Het2 являются такими, как они определены выше,
окисляют в органическом растворителе окисляющим агентом в присутствии хирального комплексного соединения титана и основания, и полученный сульфоксид необязательно превращают в его фармацевтически приемлемую соль обычными способами.
2. Способ энантиоселективного синтеза сульфоксида формулы (I) в виде одиночного энантиомера или в энантиомерно обогащенной форме:
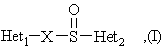
в которой:
Het1 является:
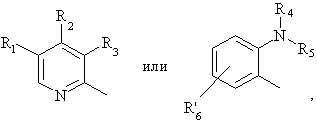
Het2 является:

и Х является:
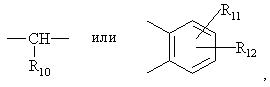
где:
N внутри бензольного кольца бензимидазольной составляющей означает, что один из атомов углерода, замещенных R6-R9, необязательно может быть заменен на атом азота без каких-либо заместителей;
R1, R2 и R3 являются одинаковыми или разными и их выбирают из водорода, алкила, алкилтио, алкокси, необязательно замещенных фтором, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогеном, фенилалкилом и фенилалкокси;
R4 и R5 являются одинаковыми или разными и их выбирают из водорода, алкила и аралкила;
R'6 является водородом, галогеном, трифторметилом, алкилом и алкокси;
R6–R9 являются одинаковыми или разными и их выбирают из водорода, алкила, алкоксила, галогена, галогеналкоксила, алкилкарбонила, алкоксикарбонила, оксазолила, трифторалкила или соседние группы R6-R9 образуют кольцевые структуры, которые могут быть дополнительно замещены;
R10 является водородом или вместе с R3 образует алкиленовую цепь;
r11 и R12 являются одинаковыми или разными и их выбирают из водорода, галогена или алкила, и алкильные группы, алкоксильные группы и их составляющие могут быть разветвленными или прямыми С1-С9 цепями или включать циклические алкильные группы, например циклоалкилалкильные, отличающийся тем, что прохиральный сульфид формулы (II)
![]()
в которой Het1 и Het2 являются такими, как они определены выше,
окисляют в органическом растворителе окисляющим агентом в присутствии хирального комплексного соединения титана, необязательно в присутствии основания, где комплексное соединение титана получают в присутствии прохирального сульфида и полученный сульфоксид необязательно превращают в фармацевтически приемлемую соль обычными способами.
3. Способ энантиоселективного синтеза сульфоксида формулы (I) в виде одиночного энантиомера или в энантиомерно обогащенной форме:
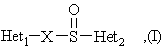
в которой:
Het1 является:
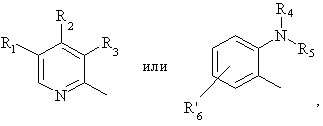
Het2 является:

и Х является:
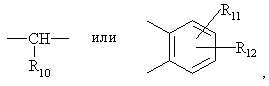
где:
N внутри бензольного кольца бензимидазольной составляющей означает, что один из атомов углерода, замещенных R6-R9, необязательно может быть заменен на атом азота без каких-либо заместителей;
R1, R2 и R3 являются одинаковыми или разными и их выбирают из водорода, алкила, алкилтио, алкокси, необязательно замещенных фтором, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогеном, фенилалкилом и фенилалкокси;
r4 и R5 являются одинаковыми или разными и их выбирают из водорода, алкила и аралкила;
R'6 является водородом, галогеном, трифторметилом, алкилом и алкокси;
R6-R9 являются одинаковыми или разными и их выбирают из водорода, алкила, алкоксила, галогена, галогеналкоксила, алкилкарбонила, алкоксикарбонила, оксазолила, трифторалкила или соседние группы R6-R9 образуют кольцевые структуры, которые могут быть дополнительно замещены,
R10 является водородом или вместе с R3 образует алкиленовую цепь;
r11 и R12 являются одинаковыми или разными и их выбирают из водорода, галогена или алкила, и алкильные группы, алкоксильные группы и их составляющие могут быть разветвленными или прямыми С1-С9 цепями или могут включать циклические алкильные группы, например циклоалкилалкильные, отличающийся тем, что прохиральный сульфид формулы (ІІ)
![]()
в которой Het1 и Het2 являются такими, как они определены выше,
окисляют в органическом растворителе окисляющим агентом в присутствии хирального комплексного соединения титана, необязательно в присутствии основания, где комплексное соединение титана получают при повышенной температуре и/или в течение продолжительного периода получения, и полученный сульфоксид необязательно превращают в фармацевтически приемлемую соль обычными способами.
4. Способ энантиоселективного синтеза сульфоксида формулы (I) в виде одиночного энантиомера или в энантиомерно обогащенной форме
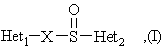
в которой:
Het1 является:
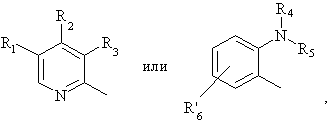
Het2 является:

и Х является:
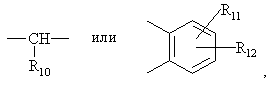
где:
N внутри бензольного кольца бензимидазольной составляющей означает, что один из атомов углерода, замещенных R6-R9, необязательно может быть заменен на атом азота без каких-либо заместителей;
R1, R2 и R3 являются одинаковыми или разными и их выбирают из водорода, алкила, алкилтио, алкокси, необязательно замещенных фтором, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогеном, фенилалкилом и фенилалкокси;
R4 и R5 являются одинаковыми или разными и их выбирают из водорода, алкила и аралкила;
R'6 является водородом, галогеном, трифторметилом, алкилом и алкокси;
R6-R9 являются одинаковыми или разными и их выбирают из водорода, алкила, алкоксила, галогена, галогеналкоксила, алкилкарбонила, алкоксикарбонила, оксазолила, трифторалкила или соседние группы R6-R9 образуют кольцевые структуры, которые могут быть дополнительно замещены;
R10 является водородом или вместе с R3 образует алкиленовую цепь;
r11 и R12 являются одинаковыми или разными и их выбирают из водорода, галогена или алкила, и алкильные группы, алкоксильные группы и их составляющие могут быть разветвленными или прямыми С1-С9 цепями или включать циклические алкильные группы, например циклоалкилалкильные, отличающийся тем, что прохиральный сульфид формулы (ІІ)
![]()
в которой Het1 и Het2 являются такими, как они определены выше,
окисляют в органическом растворителе окисляющим агентом в присутствии хирального комплексного соединения титана, необязательно в присутствии основания, где комплексное соединение титана получают в присутствии прохирального сульфида при повышенной температуре и/или в течение продолжительного периода получения, и полученный сульфоксид необязательно превращают в фармацевтически приемлемую соль обычными способами.
5. Способ по любому из пунктов 1-4, в котором полученные сульфоксиды представляют сульфоксиды, определенные формулой (I'), в виде одиночного энантиомера или в энантиомерно обогащенной форме:
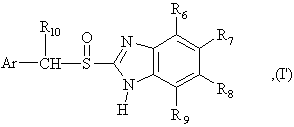
в которой:
Ar является
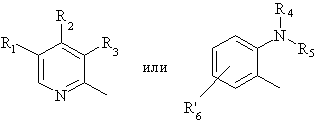
и R1-R10 являются такими, как они определены в любом из пунктов 1-4.
6. Способ по любому из пунктов 1-4, в котором полученные сульфоксиды представляют сульфоксиды согласно любой из формул (Ia)-(Ih) в виде одиночного энантиомера или в виде энантиомерно обогащенной формы:
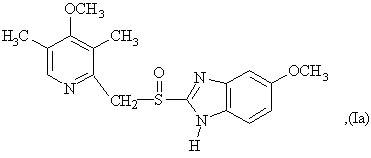
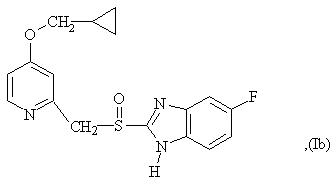
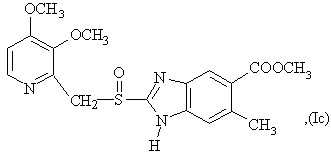
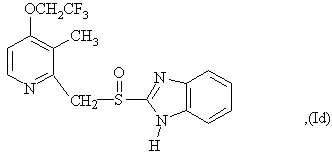
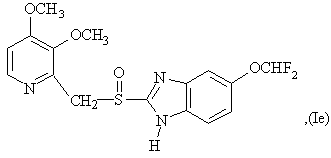
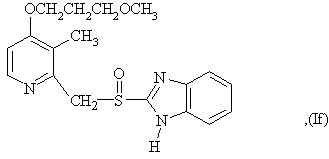
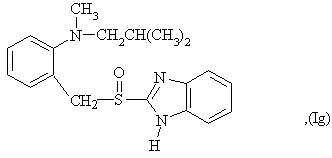
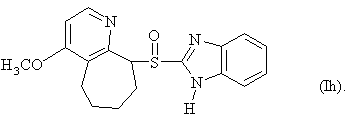
7. Способ по любому из пунктов 1-4, отличающийся тем, что прохиральный сульфид формулы (II) окисляют окисляющим агентом в форме гидропероксида кумола.
8. Способ по любому из пунктов 1-4, отличающийся тем, что комплексное соединение титана получают из соединения титана (IV), предпочтительно из алкоксида титана (IV), более предпочтительно из изопропоксида титана (IV).
9. Способ по любому из пунктов 1-4, отличающийся тем, что хиральный лиганд в комплексном соединении титана представляет хиральный разветвленный или неразветвленный алкилдиол или ароматический диол, предпочтительно хиральный сложный эфир винной кислоты, наиболее предпочтительно (+)-диэтил-L-тартрат и (-)-диэтил-D-тартрат.
10. Способ по любому из пунктов 1-4, отличающийся тем, что количество хирального комплексного соединения титана составляет 0,05-0,50 эквивалентов.
11. Способ по любому из пунктов 1-4, отличающийся тем, что окисление проводят при температуре между 20-40°С, предпочтительно при комнатной температуре.
12. Способ по любому из пунктов 1-4, отличающийся тем, что органический растворитель выбирают из группы, состоящей из толуола и этилацетата.
13. Способ по любому из пунктов 1-4, отличающийся тем, что окисление проводят в присутствии основания, выбранного из группы органических оснований, предпочтительно амина, наиболее предпочтительно триэтиламина и N,N-диизопропилэтиламина.
14. Способ по любому из пунктов 3-4, отличающийся тем, что продолжительность времени получения хирального комплексного соединения титана составляет 1-5 часов и повышенная температура равна от 30 до 40°С.
15. Способ по любому из пунктов 1-4, отличающийся тем, что он дополнительно включает стадию обработки образованного продукта водным раствором аммиака.
16. Способ по любому из пунктов 1-4, отличающийся тем, что он дополнительно включает стадии кристаллизации полученного неочищенного продукта.
17. Способ по любому из пунктов 1-4, отличающийся тем, что полученный сульфоксид представляет собой (+)-5-метокси-2-//(4-мeтокси-3,5-диметил-2-пиридинил)метил/сульфинил/-1Н-бензимидазол, (-)-5-метокси-2-//(4-метокси-3,5-диметил-2-пиридинил)метил/сульфинил/-1Н-бензимидазол или их фармацевтически приемлемую соль в соответствии с любым из пунктов 1-16.
18. Сульфоксид формулы (I), выбранный из группы:
один из одиночных энантиомеров 2-///4-(3-метоксипропокси)-3-метил-2-пиридинил/метил/сульфинил/-1Н-бензимидазола,
один из одиночных энантиомеров 2-(2-(N-изобутил-N-метиламино)-бензилсульфинил)-бензимидазола,
один из одиночных энантиомеров более липофильного диастереомера 2-((4-метокси-6,7,8,9-тетрагидро-5Н-циклогепта(b)пиридин-9-ил)сульфинил)-1Н-бензимидазола, один из одиночных энантиомеров менее липофильного диастереомера 2-((4-метокси-6,7,8,9-тетрагидро-5Н-циклогепта(b)пиридин-9-ил)сульфинил)-1Н-бензимидазола или их фармацевтически приемлемая соль.
Текст
1 Способ энантиоселективного синтеза сульфоксида формулы (I) или его щелочной соли в виде одиночного энантиомера или в энантиомерно обогащенной форме О Het-X-S-Het ,(1) в которой Heti является или Het2 является или н и X является •СН— R или 10 где N внутри бензольного кольца бензимидазольной составляющей означает, что один из атомов углерода, замещенных R6-R9, необязательно может быть заменен на атом азота без каких-либо заместителей, R-i, R2 и R3 являются одинаковыми или разными и их выбирают из водорода, алкила, алкилтио, алкокси, необязательно замещенных фтором, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогеном, фенилалкилом и фенилалкокси, R4 и Rs являются одинаковыми или разными и их выбирают из водорода, алкила и аралкила, R*6 является водородом, галогеном, трифторметилом, алкилом и алкокси, R6-R9 являются одинаковыми или разными и их выбирают из водорода, алкила, алкоксила, галогена, галогеналкоксила, алкилкарбонила, алкоксикарбонила, оксазолила, трифторалкила или соседние группы R6-R9 образуют кольцевые структуры, которые могут быть дополнительно замещены, R-іо является водородом или вместе с R3 образует алкиленовую цепь, Rn и R-I2 являются одинаковыми или разными и их О о выбирают из водорода, галогена или алкила, и алкильные группы, алкоксигруппы и их составляющие могут быть разветвленными или прямыми C-i-Cg цепями или включать циклические алкильные группы, например циклоалкилалкильные, отличающийся тем, что прохиральный сульфид формулы (II) Не^—X— S— Het 2 ,(Д) в которой Heti и Het2 являются такими, как они определены выше, окисляют в органическом растворителе окисляющим агентом в присутствии хирального комплексного соединения титана и основания, и полученный сульфоксид необязательно превращают в его фармацевтически приемлемую соль обычными способами 2 Способ энантиоселективного синтеза сульфоксида формулы (І) в виде одиночного энантиомера или в энантиомерно обогащенной форме О Het-X-S-Het ,(1) в которой Heti является 47409 4 быть заменен на атом азота без каких-либо заместителей, R-i, F 2 и R3являются одинаковыми или разными и ? их выбирают из водорода, алкила, алкилтио, алкокси, необязательно замещенных фтором, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогеном, фенилалкилом и фенилалкокси, R4 и Rs являются одинаковыми или разными и их выбирают из водорода, алкила и аралкила, R'e является водородом, галогеном, трифторметилом, алкилом и алкокси, R6-R9 являются одинаковыми или разными и их выбирают из водорода, алкила, алкоксила, галогена, галогеналкоксила, алкилкарбонила, алкоксикарбонила, оксазолила, трифторалкила или соседние группы R6-R9 образуют кольцевые структуры, которые могут быть дополнительно замещены, R-іо является водородом или вместе с R3 образует алкиленовую цепь, Rn и R-I2 являются одинаковыми или разными и их выбирают из водорода, галогена или алкила, и алкильные группы, алкоксильные группы и их составляющие могут быть разветвленными или прямыми C-i-Cg цепями или включать циклические алкильные группы, например циклоалкилалкильные, отличающийся тем, что прохиральный сульфид формулы (II) Не^—X— S— Het2 или Het? является ,(П) в которой Heti и Het2 являются такими, как они определены выше, окисляют в органическом растворителе окисляющим агентом в присутствии хирального комплексного соединения титана, необязательно в присутствии основания, где комплексное соединение титана получают в присутствии прохирального сульфида и полученный сульфоксид необязательно превращают в фармацевтически приемлемую соль обычными способами 3 Способ энантиоселективного синтеза сульфоксида формулы (І) в виде одиночного энантиомера или в энантиомерно обогащенной форме О Het-X-S-Het или ,(1) в которой Heti является н или и X является -СН— или R 10 где N внутри бензольного кольца бензимидазольной составляющей означает, что один из атомов углерода, замещенных R6-R9, необязательно может Het2 является: 47409 или 6 чения, и полученный сульфоксид необязательно превращают в фармацевтически приемлемую соль обычными способами 4 Способ энантиоселективного синтеза сульфоксида формулы (І) в виде одиночного энантиомера или в энантиомерно обогащенной форме О Het-X-S-Het Н в которой Heti является и X является: СН— ,(1) или или R 10 где Het? является N внутри бензольного кольца бензимидазольной составляющей означает, что один из атомов углерода, замещенных R6-R9, необязательно может быть заменен на атом азота без каких-либо заместителей, R-i, R2 и R3 являются одинаковыми или разными и их выбирают из водорода, алкила, алкилтио, алкокси, необязательнозамещенных фтором, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогеном, фенилалкилом и фенилалкокси, R4 и Rs являются одинаковыми или разными и их выбирают из водорода, алкила и аралкила, R'e является водородом, галогеном, трифторметилом, алкилом и алкокси, R6-R9 являются одинаковыми или разными и их выбирают из водорода, алкила, алкоксила, галогена, галогеналкоксила, алкилкарбонила, алкоксикарбонила, оксазолила, трифторалкила или соседние группы R6-R9 образуют кольцевые структуры, которые могут быть дополнительно замещены, R-іо является водородом или вместе с R3 образует алкиленовую цепь, Rn и R-I2 являются одинаковыми или разными и их выбирают из водорода, галогена или алкила, и алкильные группы, алкоксильные группы и их составляющие могут быть разветвленными или прямыми C-i-Cg цепями или могут включать циклические алкильные группы, например циклоалкилалкильные, отличающийся тем, что прохиральный сульфид формулы (II) Не^—X— S— Het 2 ,(П) в которой Heti и Het2 являются такими, как они определены выше, окисляют в органическом растворителе окисляющим агентом в присутствии хирального комплексного соединения титана, необязательно в присутствии основания, где комплексное соединение титана получают при повышенной температуре и/или в течение продолжительного периода полу или н и X является •СН— R или 10 где N внутри бензольного кольца бензимидазольной составляющей означает, что один из атомов углерода, замещенных R6-R9, необязательно может быть заменен на атом азота без каких-либо заместителей, R-i, R2 и R3 являются одинаковыми или разными и их выбирают из водорода, алкила, алкилтио, алкокси, необязательно замещенных фтором, алкоксиалкокси, диалкиламино, пиперидино, морфолино, галогеном, фенилалкилом и фенилалкокси, R4 и Rs являются одинаковыми или разными и их выбирают из водорода, алкила и аралкила, R^ является водородом, галогеном, трифторметилом, алкилом и алкокси, R6-R9 являются одинаковыми или разными и их 47409 8 выбирают из водорода, алкила, алкоксила, галосиды согласно любой из формул (la)-(lh) в виде гена, галогеналкоксила, алкилкарбонила, алкоксиодиночного энантиомера или в виде энантиомеркарбонила, оксазолила, трифторалкила или соно обогащенной формы седние группы R6-R9 образуют кольцевые осн структуры, которые могут быть дополнительно замещены, R-іо является водородом или вместе с R3 образует ОСН. алкиленовую цепь, Rn и R-I2 являются одинаковыми или разными и их выбирают из водорода, галогена или алкила, и алкильные группы, алкоксильные группы и их составляющие могут быть разветвленными или прямыми C-i-Cg цепями или включать циклические алкильные группы, например ц и клоал кил алкильные, отличающийся тем, что прохиральный сульфид формулы (II) Не^—X— S— Het 2 ,(П) в которой Heti и Het2 являются такими, как они определены выше, окисляют в органическом растворителе окисляющим агентом в присутствии хирального комплексного соединения титана, необязательно в присутствии основания, где комплексное соединение титана получают в присутствии прохирального сульфида при повышенной температуре и/или в течение продолжительного периода получения, и полученный сульфоксид необязательно превращают в фармацевтически приемлемую соль обычными способами 5 Способ по любому из пунктов 1-4, в котором полученные сульфоксиды представляют сульфоксиды, определенные формулой (Г), в виде одиночного энантиомера или в энантиомерно обогащенной форме R в которой А г является или и Ri-Rio являются такими, как они определены в любом из пунктов 1-4 6 Способ по любому из пунктов 1-4, в котором полученные сульфоксиды представляют сульфок 47409 10 13 Способ по любому из пунктов 1-4, отличаюСНз щийся тем, что окисление проводят в присутствии ,N-CH 2 CH(CH 3 ) 2 основания, выбранного из группы органических оснований, предпочтительно амина, наиболее предпочтительно триэтиламина и N,Nдиизопропилэтиламина 14 Способ по любому из пунктов 3-4, отличающийся тем, что продолжительность времени получения хирального комплексного соединения титана составляет 1-5 часов и повышенная температура равна от 30 до 40°С 15 Способ по любому из пунктов 1-4, отличающийся тем, что он дополнительно включает стадию обработки образованного продукта водным раствором аммиака Oh) 16 Способ по любому из пунктов 1-4, отличающийся тем, что он дополнительно включает стадии кристаллизации полученного неочищенного 7 Способ по любому из пунісгов 1-4, отличаюпродукта щийся тем, что прохиральный сульфид формулы 17 Способ по любому из пунктов 1-4, отличаю(II) окисляют окисляющим агентом в форме гидрощийся тем, что полученный сульфоксид предпероксида кумола ставляет собой (+)-5-метокси-2-//(4-метокси-3,58 Способ по любому из пунктов 1-4, отличаюдиметил-2-пиридинил)метил/сульфинил/-1Нщийся тем, что комплексное соединение титана бензимидазол, (-)-5-метокси-2-//(4-метокси-3,5получают из соединения титана (IV), предпочтидиметил-2-пиридинил)метил/сульфинил/-1Нтельно из алкоксида титана (IV), более предпочтибензимидазол или их фармацевтически приемлетельно из изопропоксида титана (IV) мую соль в соответствии с любым из пунктов 1-16 9 Способ по любому из пунктов 1-4, отличаю18 Сульфоксид формулы (I), выбранный из групщийся тем, что хиральный лиганд в комплексном пы соединении титана представляет хиральный разветвленный или неразветвленный алкилдиол или один из одиночных энантиомеров 2-///4-(3ароматический диол, предпочтительно хиральный метоксипропокси)-3-метил-2сложный эфир винной кислоты, наиболее предпиридинил/метил/сульфинил/-1Н-бензимидазола, почтительно (+)-диэтил-1_-тартрат и (-)-диэтил-Оодин из одиночных энантиомеров 2-(2-(Nтартрат изобутил-г\І-метиламино)-бензилсульфинил)бензимидазола, 10 Способ по любому из пунктов 1-4, отличаюодин из одиночных энантиомеров более липощийся тем, что количество хирального комплексфильного диастереомера 2-((4-метокси-6,7,8,9ного соединения титана составляет 0,05-0,50 эктетрагидро-5Н-циклогепта(Ь)пиридин-9вивалентов ил)сульфинил)-1Н-бензимидазола, один из оди11 Способ по любому из пунктов 1-4, отличаюночных энантиомеров менее липофильного диащийся тем, что окисление проводят при темперастереомера 2-((4-метокси-6,7,8,9-тетрагидро-5Нтуре между 20-40°С, предпочтительно при комциклогепта(Ь)пиридин-9-ил)сульфинил)-1Ннатной температуре бензимидазола или их фармацевтически прием12 Способ по любому из пунктов 1-4, отличаюлемая соль щийся тем, что органический растворитель выбирают из группы, состоящей из толуола и этилацетата Настоящее изобретение относится к способу энантиоселективного синтеза одиночных энантиомеров замещенных сульфоксидов или упомянутых соединений в энантиомерно обогащенной форме Такими замещенными сульфоксидами, которые могут быть получены новым способом, являются, например, одиночные энантиомеры омепразола, а также одиночные энантиомеры других структурно родственных сульфоксидов Полученные продукты можно затем превратить посредством общепринятых способов в их фармацевтически приемлемые соли Кроме того, изобретение относится к некоторым новым отдельным энантиомерным соединениям, которые могут быть получены новым способом, и к их при менению в медицине Существует большое количество патентов и заявок на патент, в которых описаны различные замещенные 2-(2-пири-динилметилсульфонил)1Н-бензимидазолы Этот класс соединений обладает свойствами, которые делают эти соединения пригодными в качестве ингибиторов секреции желудочной кислоты Так например, соединение (5метокси-2-[[(4-метокси-3,5-диметил-2пиридинил)]метил]сульфонил]-1Н-бензимидазол), имеющее общее название омепразол и описанное в ЕР 5129, является пригодным в качестве противоязвенного средства Другими представляющими интерес соединениями являются, например, соединения, имеющие общепринятые названия лан 12 11 47409 сопразол, пантопразол, парипразол и леминопратетрамети-линдено- [5, б-d] -имидазола-6- (1Н) зол один), смотри Euro J Biochem 166 (1987) 453 Описанный способ основан на энантиоселективЭти соединения, а также структурно родстном окислении соответствующего прохирального венные сульфоксиды, имеют стереогенный центр сульфида в упомянутый сульфоксид Эксперимену атома серы и поэтому существуют в виде двух тальные условия окисления устанавливают в сооптических изомеров, т е энантиомеров Если в ответствии с асимметричным способом окисления молекуле есть другой стереогенный центр, эти сульфида, разработанным Каганом и сотрудникасоединения могут существовать в виде пар энанми (Pitchen, Р, Deshmukh, М , Dunach, Е, Kagan тиомеров Соответствующие сульфиды таких соН В J Am Chem Soc 106 (1984), 8188) Авторы единений, которые уже содержат стереогенный сообщают, что полученный сырой продукт сульцентр, являются не прохиральными соединенияфоксид, показывающий энантиомерный избыток ми, а хиральными соединениями Однако атом (ее), составляющий 30%, можно очистить до, по серы в этих соединениях не имеет асимметрии и существу, оптически чистого сульфоксида поэтому их относят в настоящем изобретении к [(е е )>95%] посредством нескольких стадий крипрохиральным сульфидам сталлизации Однако, о выходах и количестве Несмотря на то, что этот класс хиральных стадий кристаллизации не сообщается сульфоксидов обсуждается в научной литературе с 70-х годов, до сих пор не описано эффективного асимметричного способа для синтеза их одиночных энантиомеров К одиночным энантиомерам фармакологически активных соединений, вследствие их улучшенных фармакокинетических и биологических свойств, был проявлен повышенный интерес Поэтому существует большая потребность и необходимость в создании такого энатиоселективного способа, который можно использовать в крупном масштабе для производства одиночных энантиомеров фармакологически активных соединений, например, таких как оптически чистые, замещенные 2(2пиридинилметилсульфинил) -1 Н-бензими-дазолы Существуют разные способы разделения различных замещенных 2-(2-пиридинил метилсульфинил)-1Н-бензимидазолов, раскрытые в предшествующем уровне техники в данной области Такие способы описаны, например, в DE 4035455 и W094/27988 Эти способы включают стадии синтеза, во время которых из рацемата соответствующих замещенных 2-(2пиридинилметилсульфинил)-1Н бензимидазолов синтезируют диастереомерную смесь Затем диостереомеры разделяют, и, в конечном счете, один из отделенных диастереомеров превращают на стадии гидролиза в оптически чистый сульфоксид Эти способы разделения, включающие диостеромерные промежуточные соединения, обладают, по крайней мере тремя существенными недостатками, а именно замещенный 2-(2пиридинилметилсульфинил)-1Н-бензи-мидазол в виде рацемического промежуточного соединения затем, перед получением одиночных энантиомеров, должен быть подвергнут обработке на двух реакционных стадиях, описанные способы разделения включают сложные стадии выделения, существует большое количество потерь высокочистого материала в том случае, когда нежелательный стереоизомер, находящийся в форме противоположного диастереомера, отделяют и выбрасывают В предшествующем уровне техники описан, кроме того, энантиоселективный синтез одиночных энантиомеров сульфоксидного реагента Ro 18-5364 (5,7-дигидро-2-[[4-метокси-3-метил-2пиридинил) метил] -сульфонил] -5,5,7, 7 Интересно отметить, что попытки Заявителя повторить описанные выше экспериментальные условия получения одиночных энантиомеров Ro 18-5364 позволили получить сырой сульфоксид с энантиомерным избытком, составляющим только 16% Для того, чтобы получить представляющие интерес оптически чистые 2-(2пиридинилметилсульфинил)-1Н-бензимидазолы, например один из одиночных энантиомеров омепразола, Заявитель получил при использовании вышеописанного способа сырые сульфоксиды с обычным энантиомерным избытком около 5% или даже ниже, Смотри ссылочный пример А, приведенный ниже В вышеупомянутом способе асимметричного окисления сульфидов в сульфоксиды, разработанном Каганом и сотрудниками (J Amer Chem Soc (1984), процитированном выше) окисление осуществляют с использованием в качестве окислителя трет-бутилгидропероксида в присутствии одного эквивалента хирального комплексного соединения, полученного из Ті (OiPr) s,l{+) или ()диэтилтартрата/воды при молярном отношении 1 21 Каган и сотрудники сообщили, что сульфоксидные продукты с самой высокой энантиоселективностью могут быть получены, когда асимметричному окислению подвергают сульфиды, содержащие два заместителя очень разных размеров Когда асимметричному окислению подвергают, например, арилметилсульфиды, можно получить арилметилсульфоксиды при энантиомерном избытке (е е ) более, чем 90% Однако, когда заместители, присоединенные к атому серы прохирального сульфида, имеют относительно одинаковые размеры, получают посредственную или плохую энантиоселективность Когда, например, окислению в условиях, предложенных Каганом и сотрудниками, подвергают бензил-р-толилсульфоксид, то получают е е , равный только 7% Были предприняты попытки усовершенствовать условия асимметричного окисления сульфидов Например, Каган и сотрудники (Zha, S, Samuel, Kagan, H В Tetrahedron (1987), 43,5135) обнаружили, что повышенную энантиоселективность можно обычно получить, если в системе, ука 14 13 47409 занной выше, заменить трет-бутилгидропероксид лось, что сульфоксид получили с хорошим химипри окислении сульфида гидропероксидом кумоческим выходом, но энантиомерный избыток ла Энантиомерный избыток, равный 96%, можно, сульфоксида при этом был равен 0% (рацемиченапример, получить при асимметричном окислеская смесь) нии метил-р-толилсульфида Однако эти обескураживающие результаты не явились неожиданными для химика, так как в лиПоэтому в предложенном способе асимметтературе указывались самые высокие энантиосеричного окисления сульфидов Каган использовал лективности для реакций моделируемых тертрагидропероксид кумола с системой Ті(0том титана в случае окисления стойких (например, |Рг)4/диэтилтартрат/вода (1 2 1) в метиленхлориде циклических) сульфидов или сульфидов, имеюпри -23°С Авторы сообщают о снижении энантиощих два заместителя очень отличающихся размеселективности, когда количество титанового реаров Авторы сделали вывод, что на энантиоселекгента составляет менее, чем 0,5 эквивалента тивность этого типа окисления влияют, главным (Смотри Tetrahedron (1987), указанный выше) образом, стерические эффекты Используя этот усовершенствованный способ асимметрического окисления с одним эквиваленПринимая во внимание информацию, опублитом титанового реагента для получения оптически кованную в литературе, и для того, чтобы иметь чистых 2-(2-пиридинилметилсульфи-нил)-1Нподходящий прохиральный субстрат для асимбензимидазолов, например, одного из одиночных метричного окисления, Питчен и сотрудники энантиомеров омепразола, Заявитель получил (смотри Tetrahedron Letters (1994), указанный выобычный энантиомерный избыток, составляющий ше), решили уменьшить размер одного из замес10%, Смотри Ссылочный пример В, приведенный тителей, присоединенных в сульфиде к атому сениже ры Выбранным промежуточным соединением для такого процесса может быть N-защищенный 4,5Реакционные условия и их применимость в дифенил-2-имидазолилметилсульфид, который отношении энантиомерного избытка, полученного получают после окисления в виде соответствуюдля хиральных сульфоксидов, в общем также общего сульфоксида Энантиомерный избыток обрасуждались Каганом и сотрудниками, Смотри зованных сульфоксидов находится в диапазоне Synlett (1990), 643 Так, например, было найдено, 98-99% Однако, при использовании промежуточчто для получения высокой энантиоселективности ного соединения синтетический способ становится необходима температура -20°С и в некоторых еще более сложным, чем первоначально предлослучаях для получения самой высокой энантиосеженный способ асимметричного окисления 2-[5лективности Каган и сотрудники использовали (3,5-диметилпиразол-1-ил)пентилтио]-4,5такую низкую температуру как -40°С Кроме того, дифенилимидазола Если исходить из 4,5авторы установили, что изменение органического дифенил-2-имидазолтиола, синтетический способ растворителя, используемого при окислении, надолжен включать следующие стадии синтеза пример, метиленхлорида, на толуол, приведет к уменьшению энантиоселективности В качестве 1) Метилирование меркаптогруппы предпочтительных растворителей для окисления 2) Присоединение защитной группы к одному обсуждались метиленхлорид и 1,2-дихлорэтан из атомов азота в имидазольной составляющей Следует отметить, что ни низкие температуры, ни 3) Асимметричное окисление сульфида в предложенные растворители не являются удовлесульфоксид творительными с промышленной точки зрения 4) Взаимодействие полученного производного, метил-сульфоксида с сильным основанием, Недавно Питченом и сотрудниками (Pitchen, таким как диизопропиламид лития (LDA), для того, Р, France, C J , Me Farlane, I M , Newton, C G , чтобы забрать протон у метильной группы Thompson, D M Tetrahedron Letters (1994), 35, 485) был разработан крупномасштабный асимметрич5) Алкилирование литиевой соли производный синтез ингибитора ацилхолестеринацилной метил-сульфоксида 4-хлор-1-иодбутаном с трансферазы (АСАТ) Указанный ингибитор АСАТ получением 5-хлорпентил-сульфоксида под общепринятым названием, "соединение RP 6) Присоединение пиразолильной группы к н73163" представляет хиральный сульфоксид, сопентильной цепи держащий одну 4,5-дифенил-2-имидазолиль-ную 7) Удаление защитной группы группу и одну 5-(3,5-диметил-1-пиразолил)-1Ясно, что предложенный способ, усложненный пентильную группу в стереогенном центре, т е на оптимизацией размера заместителей, не подходит атоме серы Однако, соединение, которое не явдля получения продуктов, особенно в небольшом ляется соединением в соответствии с настоящим масштабе изобретением типа замещенного 2-(2Следует отметить, что способ в соответствии пиридинилме-тилсульфинил)-1Н-бензимидазола, с настоящим изобретением, примененный к проимеет две больших замещающих группы, присоехиральному сульфиду RP 73163, позволяет, к диненные к стереогенному центру, точно так же удивлению, получить RP 73163 с энантиомерным как и соединения, полученные в настоящем изоизбытком > 85-90%, Смотри ссылочные примеры бретении Е и F,приведенные ниже Сначала соответствующий прохиральный В литературе предшествующего уровня техсульфид RP 73163, имеющий эти два больших ники в данной области не раскрывается и не заместителя уатома серы, окисляли с использопредлагается подходящий энантиоселективный ванием вышеупомянутого способа асимметричноспособ, который можно применять в крупном масго окисления, предложенного Каганом (смотри штабе для получения одиночных энантиомеров 2Tetrahedron (1987), указанный выше) Сообща(2-пири-динилметилсульфинил)-1Н 15 16 47409 бензимидазолов Поэтому все еще существует большая потребность в таком энантиоселективном способе производства замещенных оптически чистых 2-(2-пиридинилметилсульфинил)-1Нбензимидазолов, а также других структурно родственных сульфоксидов Настоящее изобретение предлагает новый способ энантиоселективного синтеза одиночных энантиомеров омепразола, других оптически чистых замещенных 2-(2-пиридинилметилсульфинил)-1 Н-бензимидазолов, а также структурно родственных сульфоксидов, в котором получают неожиданно высокую энантиоселективность Новый способ отличается тем, что прохиральный сульфид асимметрично окисляют в одиночный энантиомер или энантиомерно обогащенную форму соответствующего сульфоксида Новое асимметричное окисление к удивлению дает возможность получить представляющие интерес соединения с чрезвычайно высоким энантиомерным избытком, даже, если соответствующий прохиральный сульфид имеет заместители у атома серы примерно одинакового размера Способ является простым, включает одну стадию реакции, что делает его приемлемым для крупномасштабного производства энантиомерных соединений с высоким выходом и высоким энантиомерным избытком Выражения "прохиральный (ые) сульфид (ы)" используют для сульфидов соответствующих сульфоксидов, полученных новым способом в соответствии с настоящим изобретением Если соответствующий сульфид уже содержит стереогенный центр в молекуле, такой сульфид является не прохиральным соединением, а хиральным соединением Так как атом серы сульфидов не имеет асимметрии, такое соединение в настоящем описании и формуле изобретения относят к прохиральному сульфиду Настоящее изобретение также относится к оптически чистым соединениям, полученным в соответствии с заявляемым способом, и некоторым новым отдельным энантиомерным соединениям Способ изобретения определен в пункте 1 формулы изобретения, и некоторые альтернативные способы описаны в независимых пунктах 2-4 Зависимые пункты 5-23 относятся к некоторым конкретным предпочтительным вариантам изобретения и предпочтительным продуктам, полученным новым способом, которые определены в пунктах 24-33 формулы изобретения Настоящее изобретение относится к новому способу получения сульфоксида формулы (I) в виде одиночного энантиомера или в виде энантиомерно обогащенной формы Het? является и X является в которой N внутри бензольного кольца бензимидазольной составляющей означает, что один из атомов углерода, замещенных F 6 -Rg, необязательно мо? жет быть заменен на атом азота без каких-либо заместителей, R-i, R2 и R3 являются одинаковыми или разными и их выбирают из водорода, алкила, алкилтио, алкокси, необязательно замещенных фтором, алкоксиалкокси, диалкиламино, пиперидине, морфолино, галогеном, фенилалкилом и фенилалкокси, R4 и Rs являются одинаковыми или разными и их выбирают из водорода, алкила и аралкила, R6 является водородом, галогеном, трифторметилом, алкилом или алкокси, R6 -Rg являются одинаковыми или разными и их выбирают из водорода, алкила, галогена, галоген-алкокси, алкилкар-бонила, оксазолило, трифторалкила или соседние группы R6 -Rg, образуют кольцевые структуры, которые затем могут быть дополнительно замещены R-іо является водородом или вместе с R3 образует алкиленовую цепь, и Rn -R12 являются одинаковыми или разными и их выбирают из водорода, галогена и алкила В вышеприведенных определениях алкильные группы, алкоксильные группы и их составляющие могут представлять разветвленные или прямые Сі -Cg - цепи или включают циклические алкильные группы, например циклоалкилалкильные Сульфоксиды, полученные новым способом, представляют предпочтительно сульфоксиды формулы (І) в виде одиночного энантиомера или в виде энантиомерно обогащенной формы Ьо Het,—X-S—Hel2 (I) (I) в которой Heti является в которой А г является 47409 17 18 ОСИ, X X or чл О ,OCHF2 Q»— g — J} —— & ^ . и Ri -Rio являются такими, как они определены выше для формулы (I) Наиболее предпочтительными сульфоксидами, полученными новым способом, являются сульфоксиды формул 1 а-1 h в виде одиночного энантиомера или в виде энантиомерно обогащенной формы ОС HjC HjC HgOG Hg ОС В, (1а) (1b) Од) (1с) (1d) Соединения, определенные вышеприведенными формулами 1,1 и 1 а-1 h, могут быть превращены общепринятыми способами в их фармацевтически приемлемые соли Способ настоящего изобретения характеризуется асимметричным окислением в органическом растворителе прохирального сульфида формулы (П) Heti - X - S - Het2 (П) в которой Heti и Het2 являются такими, как они определены выше, окисляющим агентом и хиральным комплексным соединением титана, необязательно в присутствии основания В соответствии с одним аспектом изобретения асимметричное окисление осуществляют в присутствии основания 19 47409 Альтернативно, окисление осуществляют в отсутствии основания, если получение хирального комплексного соединения титана осуществляют конкретным способом в отношении порядка добавления, температуры, при которой осуществляют получение, и/или времени получения Например, в соответствии с одним предпочтительным аспектом изобретения, получение хирального комплексного соединения титана осуществляют в присутствии прохирального сульфида, т е прохиральный сульфид загружают в реакционный сосуд перед загрузкой компонентов, используемых для получения хирального комплексного соединения титана В соответствии с другим предпочтительным аспектом изобретения получение хирального комплексного соединения титана осуществляют при повышенной температуре и/или в течение продолжительного времени получения В соответствии с еще одним предпочтительным аспектом изобретения получение хирального комплексного соединения титана осуществляют при повышенной температуре и/или в течение продолжительного времени получения и в присутствии прохирального сульфида В соответствии с наиболее предпочтительным аспектом изобретения асимметричное окисление осуществляют в присутствии основания и получение хирального комплексного соединения титана осуществляют при повышенной температуре и/или в течение продолжительного времени получения и в присутствии прохирального сульфида Окисление осуществляют в органическом растворителе Неожиданно, выбор растворителя не является существенным для энантиоселективного окисления, как это сообщалось Каганом и сотрудниками Растворитель может быть выбран в соответствии с подходящими условиями с промышленной точки зрения, а также с точки зрения охраны окружающей среды Подходящими органическими растворителями являются, например, толуол, этилацетат, метилэтилкетон, метилизобутилкетон, диэтилкарбонат, трет-бутилметиловый эфир, тетрагидрофуран, метиленхлорид и т п С точки зрения окружающей среды предпочтительными являются не хлорированные растворители Окисление осуществляют предпочтительно в органическом растворителе при комнатной температуре или чуть выше комнатной температуры, например между 20-40°С К удивлению, нет необходимости использовать температуру ниже -20°С, которая как описывалось Каганом и сотрудниками является важной для достижения хорошей энантиоселективности Такая низкая температура приводит к значительному времени реакции Однако, если время реакции изменяется, температуру реакции можно выбрать ниже, а также выше предпочтительных температур 20-40°С Подходящий температурный диапазон ограничен только зависимостью от разложения соединений и тем, что время протекания реакции значительно меньше при комнатной температуре, чем при -20°С, поскольку представляющие интерес сульфиды при такой низкой температуре окисляются очень медленно 20 Окислителем, подходящим для использования в новом асимметричном окислении, может быть гидропероксид, например, такой, как третбутил гид ропероксид или гидропероксид кумола, при этом последний является предпочтительным Комплексное соединение титана, подходящее для катализа в способе изобретения, получают из хирального лиганда и соединения титана (IV), предпочтительно такого, как алкок-сид титана (IV) и, необязательно, в присутствии воды В особенности предпочтительным алкоксидом титана (IV) является изопропоксид титана (IV) или пропоксид титана (IV) Количество хирального комплексного соединения титана не является критическим Предпочтительным является количество менее, чем примерно 0,50 эквивалентов и в особенности предпочтительное количество составляет 0,050,30 эквивалентов Неожиданно, в способах, в соответствии с настоящим изобретением, с превосходным результатом могут быть использованы даже очень незначительные количества комплексного соединения, например, такие как 0,04 эквивалента Комплексное соединение титана может быть также получено путем взаимодействия тетрахлорида титана с хиральным лигандом в присутствии основания Хиральный лиганд, используемый при получении комплексного соединения титана, является предпочтительно хиральным спиртом, например хиральным диолом Диол может быть разветвленным или неразветвленным алкилдиолом или ароматическим диолом Предпочтительными хиральными диолами являются эфиры винной кислоты, в особенности предпочтительными являются (+)диэтил L-тартрат или (-)- диэтил D-тартрат Как обсуждалось выше и более подробно ниже, хиральное комплексное соединение титана может быть получено в присутствии прохирального сульфида или до добавления прохирального сульфида в реакционный сосуд Как упоминалось выше, в соответствии с одним аспектом изобретения, окисление осуществляют в присутствии основания Удивительно высокую энантиоселективность наблюдают тогда, когда основание присутствует во время окисления Эту заслуживающую внимания высокую энантиоселективность получают даже несмотря на то, что субстратами являются прохиральные сульфиды с заместителями у атома серы, имеющими приблизительно одинаковый размер Основание может быть неорганическим или органическим основанием, например таким, как угольная кислота, амид или амин Амин включает гуанидин или амидин Предпочтительными являются органические основания и в особенности подходящими основаниями являются амины, предпочтительно триэтиламин или N.N-диизопропилэтиламин Количество основания, добавляемого к реакционной смеси, не является критическим и его следует регулировать в зависимости от реакционной смеси Эта конкретная обосенность, состоящая в добавлении основания к реакционной смеси для увеличения энантиоселективности окисления, приведена в примерах двух экспериментов с 5 21 47409 метокси-2-[[(4-метокси-3,5-диметил-2пиридинил)метил] тио-1Н-бензимидазолом, используемым в качестве прохирального сульфида в реакции Смотри сравнительные примеры D и Е Условия реакции являются одинаковыми в обоих экспериментах, за исключением добавления основания к реакционной смеси в одном из экспериментов Ссылочный пример D осуществляют в соответствии с пунктом 1 настоящего изобретения, т е асимметричное окисление осуществляют в присутствии основания Сравнительный пример С осуществляют в отсутствии основания без изменения параметров способа Результаты показывают, что окисление без добавления основания в соответствии со Сравнительным примером С позволяет получить сульфоксидный продукт с энантиомерным избытком ( е е ) 23%, в то время как присутствие основания, такого как диизопропилэтиламин, в соответствии со Сравнительным примером D позволяет получить сульфоксидный продукт с энантиомерным избытком, равным 78% Альтернативно, способ изобретения можно осуществить в отсутствии основания При таких условиях способы получения хирального комплексного соединения титана являются существенными Получение хирального комплексного соединения титана осуществляют предпочтительно в присутствии прохирального сульфида При изменении порядка добавления по сравнению со способами, представленными в предшествующем уровне техники, энантиоселективность окисления неожиданно возрастает Другими существенными признаками при получении хирального комплексного соединения титана является то, что получение комплексного соединения осуществляют при повышенной температуре и/или в течение длительного времени Использование повышенной температуры означает температуру выше комнатной, например такую как 30-70°С, предпочтительно 4060°С Длительное время получения означает период времени более примерно 20 минут, предпочтительно 1-5 часов Подходящий период времени для стадии получения продукта зависит от температуры получения и прохирального сульфида, необязательно присутствующего во время получения хирального комплексного соединения титана Продукты, образованные во время реакции окисления, могут быть экстрагированы водным раствором аммиака или другого N-содержащего основания для того, чтобы избежать осаждения и/или образования нерастворимых солей титана Водную фазу полученной смеси отделяют от органической фазы и выделенную водную фазу нейтрализуют добавлением нейтрализующего реагента, что приводит к протонированию оптически активного сульфоксида Таким образом, другая предпочтительная особенность способа изобретения состоит в том, что соли титана, которые могут быть образованы во время процесса, можно сохранить в растворе путем добавления водного раствора аммиака Общепринятая методика, описанная в литературе для вымывания солей титана, состоит в обработке 22 реакционной смеси водной или водными растворами гидроксида натрия, приводящий к образованию геля, который очень трудно отфильтровать Другой методикой вымывания солей титана, описанной в предшествующем уровне техники в данной области, является, например, применение ІМ НС 1, предложенной в работе Питчена и сотрудников (Tetrahedron Letters (1994), источник указан выше) Эта методика не может быть использована для продуктов, которые являются неустойчивыми в отношении кислоты, например, таких как 2-(2пиридинилметилсульфинил)-1Н-бензи-мидазолы, которые в кислых условиях почти сразу же разрушаются Полученный сырой продукт можно экстрагировать в органический растворитель Его можно также кристаллизовать в органическом или водном растворителе, что приводит к получению оптически чистого продукта, например, такого как один из одиночных энантиомеров 2-(2пиридинилметилсульфинил)-1Н-бензимидазола в нейтральной форме Кислотный протон в бензимидазольной составляющей может быть удален обработкой сырого продукта основанием, например NaOH, после которой осуществляют кристаллизацию образованной соли в растворителе, в результате такой обработки получают продукт, имеющий улучшенную оптическую чистоту Изобретение далее проиллюстрировано более подробно с помощью следующих примеров ПРИМЕРЫ Пример 1 Асимметричный синтез натриевой соли (-)-5метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1 Н-бензимидазола, (-)-(la)-Na 59г (180ммолей) 5-метокси-2-[[(4-метокси-3,5диме-тил-2-пиридинил)метил]тио]-1Нбензимидазола растворили в 200 мл этилацетата К раствору при комнатной температуре добавили 0,3мл (17ммолей) воды К смеси добавили 37г (180ммолей) (+)-диэтил1_-тартрата, 25г (ЭОммолей) изопропоксида титана (IV) и 16мл (ЭОммолей) диизопропилэтиламина Затем в течение 90 минут при 34°С осуществляли добавление 30мл (160ммолей) гидропероксида кумола (80%) После охлаждения до комнатной температуры в течение 120 минут отобрали небольшую пробу смеси для хирального и ахирального хром ато граф и чес ко го анализа Смесь состояла из 82% сульфоксида с энантиомерным избытком ( е е ) 87% Смесь разбавили 60мл изооктана и 40мл этилацетата, после чего продукт три раза экстрагировали водным раствором аммиака (12%) , имеющим общий объем 480мл Смешанные водные фазы нейтрализовали добавлением 50мл концентрированной уксусной кислоты После этого осуществили экстракцию, выпаривание, добавление гидроксида натрия и кристаллизацию, после чего получили 32,7г названного соединения с чистотой 95,2% (ахиральный анализ) и энантиомерным избытком ( е е ) 99,8% (хи-ральный анализ) Общий выход составил 47,2% Пример 2 Асимметричный синтез (+)-5-мето кс и-2-[[4метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1 Н-бензимидазола, 23 47409 24 течение 50 минут при 50°С и затем приблизительно при 30°С добавили N.N-диизопропилэтиламин К раствору (+)-диэтил1_-тартрата (1 5мл, (0 085мл, 0 50ммолей) Затем добавили гидропе9 Оммолей), растворенного в толуоле (10мл), при роксид кумола (83% 2 1мл, 11 Эммоля) и смесь перемешивании добавили изопропоксид титана перемешали в течение 15 минут при 30°С Анализ (IV) (1 Змл, 4 5ммолей) и воду (41мкл, 2 Зммоля) сырой смеси показал, что она состоит из 3 6% Смесь перемешивали при комнатной температуре сульфида, 2 7% сульфона и 93% сульфоксида с в течение 20 минут и затем добавили 5-метокси-2оптической чистотой, соответствующей энантио[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]мерному избытку 9 1 % Продукт в чистом виде не 1Н-бен-зимидазол (3 Ог, Эммолей) и диизопропиполучали лэтиламин (0 45мл, 2 бммоля) При 30°С добавили гидропероксид кумола (технический, 80%, 1 8мл, Пример 6 9 Эммоля) Через 3 часа при 30°С смесь состояла Асимметричный синтез (+)-3-метокси-2-[[(4из 2 1% сульфида, 8 8% сульфона и 86 8% сульметокси-3,5-диметил-2-пиридинил) метил] сульфоксида с энантиомерным избытком 74% финил]-1 Н-бензимидазола, ( + )-(1а) Пример 3 В метиленхлориде (50мл) растворили (+)Асимметричный синтез (+)-5-мето кс и-2-[[4диэтил L-тартрат (1 71мл, 10ммолей) и изопропокметокси-3,5-диметил-2сид титана (IV) (1 5мл, 5ммолей) При перемешивании добавили воду (90мл 5ммолей) и полученпиридинил)метил]сульфонил]-1Н-бензимидазола, ную смесь кипятили в колбе с обратным (+)-(1а) холодильником в течение 1 часа Смесь охладили К смеси (+)-диэтил L-тартрата (4 2г, до комнатной температуры После этого при ком20ммолей), изопропоксида титана (IV) (2 9г, натной температуре добавили 5-метокси-2-[[(410ммолей) и этилацетата добавили воду (0 18мл, метокси-3,5-диметил-2-пиридинил) метил] тио]-1 Н10ммолей) Раствор перемешали в течение 20 бензимидазол (1 65г, 5ммолей) и гидропероксид минут, после чего вместе с КНСОз (0 31 г, кумола (80%, 1 05г, 5 5ммолей) Раствор в тече31ммоля) и гидропероксидом кумола (1 8мл, ние 90 минут перемешали при комнатной темпе10ммолей) добавили 5-метокси-2-[[(4-метокси-3,5ратуре Анализ показал, что сырая смесь состоит диметил-2-пиридинил)метил] тио] -1Низ 42 8% сульфида, 4 1% сульфона и 48 3% сульбензимидазол (3 4 г, 10 ммолей) Добавление фоксида с оптической чистотой, соответствующей осуществили при комнатной температуре Через энантиомерному избытку 43% Продукт в чистом 1 5 часа осуществили анализ HPLC (высокоэфвиде не получали фективной жидкостной хроматографией), который показал наличие 63 3% сульфоксида с энантиоПример 7 мерным избытком 38 9% Асимметричный синтез (+)-5-метрокси-2-[[(4метрокси3,5-диметил -2Пример 4 Асимметричный синтез натриевой соли (-)-5пиридинил)метил]сульфинил]-1 Н-бензимидазола, метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил) (+)-(1а) метил] тио]-1 Н-бен-зимидазола, (-)-(Ia)-Na В метиленхлориде (50мл) растворили 5метокси-2-[[(4-метокси-3 ,5-диметил-2-пиридинил) При комнатной температуре к раствору (+)метил] тио] -1Н-бензимидазол (1 65г, 5ммолей) диэтил L-тартрата (8 5мл, 50ммолей) и изопропокПри перемешивании добавили диэтил L-тартрат сида титана (IV) (7 4мл, 25ммолей) в 250мл мети(1 71 мл, 10ммолей), изопропоксид титана (IV) ленхлорида добавили воду (0 45мл, 25ммолей) (1 5мл, 5ммолей) и воду (90цл, 5ммолей) ПолуЧерез 20 минут добавили 5-мето кс и-2-[[(4ченную смесь в течение 20 минут перемешали при метокси-3,5-диметил-2-пиридинил)метил]тио]-1Нкомнатной температуре Затем при комнатной бензимидазол (8 2г, 25ммолей) и диизопропилэтемпературе добавили гидропероксид кумола тиламин (1 Змл, 7ммолей) и раствор охладили до (80%, 1 05г, 5 5ммолей) и раствор перемешивали 20°С После добавления кумолгидропероксида в течение 90 минут при комнатной температуре (51 мл 80% раствора, 28ммолей) реакционную Анализ показал, что сырая смесь состоит из 38 9% смесь в течение 66 часов выдерживали при +2°С сульфида, 8 4% сульфона и 47 6% сульфоксида с Добавили раствор гидроксида натрия 2x125мл, оптической чистотой, соответствующей энантиозатем, с помощью хлорида аммония, осуществили мерному избытку 32% Продукт в чистом виде не нейтрализацию водной фазы После чего осущеполучали ствили экстракцию, выпаривание, тонкослойную хроматографию, добавление гидроксида натрия и Пример 8 кристаллизацию, в результате чего получили 1 23г Асимметричный синтез (+)-5-метокси-2-[[(4(13 4%) названного соединения с энантиомерным метокси-3,5-диметил-2-пиридинил) метил] сульизбытком (е е ) 99 8% (хиральный анализ) финил]-1 Н-бензимидазола, (+)-(1а) Пример 5 Асимметричный синтез (-)-5-мето кс и-2- [[(4метокси- 3,5-диметил-2-пиридинил) метил] сульфинил]-1 Н-бензимидазола, (-)-(Іа) 3-метокси-2-[[(4-метокси-3,5-диметил-2пиридинил) метил] тио] -1Н-бензимидазол (4 Ог, 12 1ммоля) суспендировали в толуоле (12мл) При перемешивании при 50°С добавили (-)-диэтил Dтартрат (0 17мл, 1 Оммоля) и изопропоксид титана (IV) (0 15мл, 0 50ммолей) Смесь перемешивали в В толуоле (2 5мл) суспендировали 5-метокси2-[[(4-метокси-3,5-диметил-2-пиридинил) метил]тио]-1 Н-бензимидазол (0 5г, 1,5ммоля) При 50°С добавили 9 2мкл воды (0 5ммоля), (+)-диэтил L-тартрат (О 39мл, 2 Зммоля) и изопропоксид титана (IV) (0 27мл, 0 91ммоля) Смесь нагревали при 50°С в течение 90 минут, затем 0 25мл раствора перенесли в пробирку После этого в пробирку добавили 25мкл гидропероксида кумола (80%), проведенный почти сразу после этого ана 47409 26 25 лиз показал, что смесь состояла из 4 1 % желаАсимметричный синтез натриевой соли ( + )-5тельного сульфоксида с оптической чистотой, сометокси-2-[[(4-метокси-3,5-диметил-2ответствующей энантиомерному избытку 69 5% пиридинил)метил]сульфинил]-1Н-бензимидазола, Продукт в чистом виде не получали Пример 9 6 2кг (18 8ммолей) метокси-2-[[4- метокси- 3,5диметил-2-пиридинил)метил]тио]-1НАсимметричный синтез натриевой соли (-)-5бензимидазола в толуоловой суспензии (25л) наметокси-2-[[(4-метокси-3,5-диметил-2-пириди-нил) грели до 54°С При перемешивании добавили вометил] сульфинил] -1Н-бензимидазола, (-)-(Ia)-Na ду (44мл, 2 4моля), (-) -диэтил D-тартрат (2 35кг, В 7 5 л этил ацетата растворили 1,6кг 11 4моля) и изопропоксид титана (IV) (1,60кг, (5 Омолей) 5-метокси-2-[[(4-метокси-3,5-диметил5 бмоля) и затем смесь перемешивали при 54°С в 2-пиридинил)метил]тио]-1Н-бензимидазола К растечение 50 минут Установили температуру 30°С и твору добавили 31мл (1 7моля) воды К смеси при после этого к раствору добавили N, Nкомнатной температуре добавили 860мл (5 Омоля) диизопропилэтиламин (720г, 5 бмоля) Затем до(+)-диэтил L-тартрата, 740мл (2 5моля) изопропокбавили гидропероксид кумола (83 5%, 3 30кг, сида титана (IV) и 430мл (2 5моля) диизопропилэ18 2моля) и смесь перемешивали при 30°С в тетиламина Затем в течение 50 минут при 30°С дочение одного часа Анализ показал, что сырая бавляли 830 мл (4 5 моля) гидропероксида кумола смесь состоит из 7% сульфида, 1 2% сульфона и (80%) Через час выдержки при 30°С реакция за90 6% сульфоксида с оптической чистотой, соотвершилась Хиральный и ахиральный хроматоветствующей энантиомерному избытку 94 3% графические анализы показали, что смесь состояДобавили водный раствор аммиака (12 5%, 20л) ла из 75% сульфоксида с энантиомерным Раствор три раза экстрагировали водным раствоизбытком ( е е ) 80%, 19% не прореагировавшего ром аммиака (Зх20л) К смешанным водным слосульфида и 3 8% сульфона Смесь охладили до ям добавили метилизобутилкетон (9л) С помо10°С и после добавления 1 5л изооктана и 0 5л щью уксусной кислоты довели рН водного слоя, и этил ацетата продукт три раза экстрагировали затем слой разделили Дополнительной порцией водным раствором аммиака (12%), имеющим объметилизобутилкетона (9л) экстрагировали водный ем 14л Смешанные водные фазы нейтрализоваслой Чтобы получить натриевую соль, к раствору ли добавлением 1,5л концентрированной уксусной добавили водный раствор NaOH (49 6%, 1 07 кг, кислоты 13 2 ммоля) и ацетонитрил (70л) После конценЗатем осуществили экстракцию, выпаривание, трирования раствора продукт начал кристаллизодобавляли гидроксид натрия и кристаллизовали, ваться Выделили 3 83 кг (+)-энантиомера натриеполучая 0 80кг названного соединения с чистотой вой соли омепразола с оптической чистотой, 99 3% (ахиральный анализ) и с энантиомерным соответствующей энантиомерному избытку 99 6% избытком ( е е ) 99 8% (хиральный анализ) Общий выход составил 44% Пример 12 Пример 10 Асимметричный синтез (+)-5-фтор-2 -[[(4Асимметричный синтез натриевой соли (+)-5циклопропилметокси-2-пиридинил) метил] сульметокси-2- [[(4-метокси-З, 5-диметил-2-пиридинил) финил]-1 Н-бензимидазола, (+) -(1Ь) метил] сульфинил ] -1Н-бензимидазола, ( + )-(1а)При перемешивании к смеси (+)- диэтил LNa тартрата (10 3мл, бОммолей) и метиленхлорида (60мл) добавили изопропоксид титана (IV) (8 9мл, В 6 1л этил ацетата растворили 1,6кг (5 0 моЗОммолей) и воду (0 54мл, ЗОммолей) Раствор лей) 5-метокси-2-[[(4-метокси-3,5-диметил-2перемешивали в течение 30 минут при комнатной пиридинил)метил]тио] -1Н-бензимидазола К растемпературе и затем ввели 5-фтор-2-[[(4твору добавили 31мл (1 7моля) воды К смеси при циклопропилме-токси-2-пиридинил) метилтио] комнатной температуре добавили 860мл сульфинил] -1Н-бензимидазол (9 9г, ЗОммолей) и (5 Омолей) (-)-диэтил D-тартрата, 740мл (2 5моля) диизопропилэтиламин (1 5 мл, 8 7 ммолей) При изопропоксида титана (IV) и 430мл (2 5моля) диикомнатной температуре добавили гидропероксид зопропилэтиламина Затем в течение 25 минут кумола (технический, 80%, 6 9мл, ЗЗммоля) Через при 30°С добавляли 830 мл (4 5 моля) гидропе3 часа при комнатной температуре смесь состояла роксида кумола (80%) Через 30 минут выдержки из сырого сульфоксида с энантиомерным избытпри 30°С реакцию завершили Хиральный и ахиком (е е ) 60% После очистки на силикагеле с исральный хроматографический анализы показали, пользованием в качестве элюента метаночто смесь состоит из 71% сульфоксида с энантиола/метилен хлорида и повторных кристаллизации мерным избытком ( е е ) 73% Смесь охладили до из этанола получили 1 1г (11%) названного соеди10°С и после добавления 1 7л изооктана продукт нения с энантиомерным избытком 98 6% три раза экстрагировали водным раствором аммиака (12%) при общем объеме 14л Смешанные Пример 13 водные фазы нейтрализовали добавлением 1 5л Асимметричный синтез (-) -5-фтор -2-[[(4концентрированной уксусной кислоты Затем осуциклопропилме- токси-2-пиридинил) метил] сульществили экстракцию, выпаривание, добавляли финил]-1 Н-бензимидизола, (-)-(Ib) гидроксид натрия и кристаллизовали, получая В толуоле (60мл) суспендировали 5-фтор-20 45кг названного соединения с чистотой 99 9% [[(4-цикло-пропилметокси-2-пиридинил) метил] (ахиральный анализ) и с энантиомерным избыттио]-1Н-бензимидазол (15 Ог, 45ммолей) При пеком ( е е ) 99 8% (хиральный анализ) Общий выремешивании и температуре 50°С добавили воду ход составил 24 6% (34мкл, 1 Эммоля) и изопропоксид титана (IV) (1 Змл, 4 5ммоля) Смесь перемешивали в течеПример 11 27 47409 ниє 50 минут при 40°С и затем добавили N, Nдиизопропилэтиламин (0 79мл, 4,5ммоля) Установили температуру 35°С и затем добавили гидропероксид кумола (83%, 8 1 мл, 45 ммолей) Смесь перемешивали при 35°С в течение 30 минут Анализ показал, что сырая смесь состояла из 6 5% сульфида, 2 7% сульфона и 90% сульфоксида с оптической чистотой, соответствующей энантиомерному избытку 87 7% Во время окисления продукт начал кристаллизоваться и его отделили фильтрацией от реакционной смеси Получили 11 7г желаемого продукта с оптической чистотой, соответствующей энантиомерному избытку 98 8% Анализ показал, что продукт состоит из 2 2% сульфида и 0 9% сульфона Выход 71 2% Пример 14 Асимметричный синтез (-)-5-фтор-2-[[(4циклопропилме-токси-2-пиридинил) метил] сульфинил]-1 Н-бензимидазола, (-)-(Ib) С толуолом (30мл) смешали 5 Ог (15ммолей) 5-фтор-2- [[(4-циклопропилметокси-2-пиридинил) метил] ти о] -111-бен-зимидазола К смеси добавили 32мкл (1 8ммоля) воды, 1 Змл (7 бммоля) (-)диэтил D-тартрата и 0 90мл (3 Оммоля) изопропоксида титана (IV) Смесь перемешали в течение 60 минут при 50°С и затем охладили до 30°С После этого к раствору добавили 2 8мл (15ммолей) гидропероксида кумола (80%) Смесь перемешали в течение одного часа при 30°С и затем охладили до 0°С К смеси добавили этил ацетат (20мл) и полученный раствор три раза экстрагировали водным раствором аммиака (12%) при общем объеме 60мл Смешанные водные слои нейтрализовали добавлением 17мл концентрированной уксусной кислоты и затем экстрагировали этил ацетатом (4х60мл) Органический слой сушили над сульфатом магния и затем удалили, получив при этом сырой продукт с оптической чистотой, соответствующей энантиомерному избытку 59% Остаток в виде масла (3 2г) растворили в ацетоне (8мл) Отфильтровали образованный осадок Получили 1 6г желаемого соединения в виде белого твердого вещества Анализ показал, что оптическая чистота соответствует энантиомерному избытку 87% Пример 15 Асимметричный синтез (+)- 5-фтор-2-[[(4циклопропилме- токси-2 -пиридинил) метил] сульфонил]-1Н - бензимидазола, (+)(1Ь) В толуоле (15л) суспендировали 5-фтор-2-[[(4циклопро-пилметокси-2-пиридинил)метил]тио]-1Нбензимидазол (3 бкг, ЮЭмолей) При перемешивании и 40°С добавили воду (8 9мл, 0 49моля), (+)-диэтил L-тартрат (460г, 2 2моля) и изопропоксид титана (IV) (31 Ог, 1 ОЭмоля) Смесь перемешивали в течение 50 минут при 40°С и затем добавили N, N-диизопропилэтиламин (190мл, I ОЭмоля) Установили температуру 30°С и затем добавили кумолгидропероксид (83%, 2 Окг, I I молей) и в течение 30 минут окисление завершилось Анализ показал, что сырая смесь состоит из 8 9% сульфида, 3 3% сульфона и 87% сульфоксида с оптической чистотой, соответствующей энантиомерному избытку 86% Во время окисления начал кристаллизоваться продукт и, с помощью фильтрации, его отделили от реакционной 28 смеси Получили 2 68кг продукта с оптической чистотой, соответствующей энантиомерному избытку 96% Анализ показал, что материал состоит из 2 3% сульфида и 1 7% сульфона Продукт перекристаллизовали в MeTaHonefronyone Получили 1 66кг (выход 44%) желаемого продукта с оптической чистотой 99 7% Содержание сульфида и сульфона составило соответственно менее, чем 0 1% и 0 3% Пример 16 Асимметричный синтез (-)- 5-фтор-2-[[(4циклопропилме-токси-2- пиридинил) метил] сульфинил]-1 Н-бензимидазола, (+)- 1Ь) В толуоле (14 4л) суспендировали 5-фтор-2[[(4-цикло-пропилметокси-2-пиридинил) метил] тио] -1Н-бензимидазол (3 6кг, 10 Эмолей) При перемешивании и температуре 40°С добавили воду (10мл, 0 55ммоля), (-)-диэтил D-тартрат (460г, 2 2моля) и изопропоксид титана (IV) (31 Ог, 1 Юмоля) Смесь перемешивали в течение 50 минут при 40°С и затем добавили N, Nдиизопропилэтиламин (190мл, 1 1моля) Установили температуру 35°С и затем добавили гидропероксид кумола (83%, 2 Окг, 11 молей) Смесь перемешивали в течение 1 часа при 35°С Анализ показал, что сырая смесь состоит из 8 7% сульфида, 4 8% сульфона и 85% сульфоксида с оптической чистотой, соответствующей энантиомерному избытку 78% Во время окисления продукт начал кристаллизоваться и его отделили от реакционной смеси фильтрацией Получили 2 78кг продукта с оптической чистотой, соответствующей энантиомерному избытку 97% Анализ показал, что продукт состоит из 1 9% сульфида и 2 5% сульфона Продукт перекристаллизовывали в мета Honefronyone Получили 1 67кг (выход 44%) желаемого продукта в виде не совсем белых кристаллов ( е е ) 99 8% Содержание сульфида и сульфона составило соответственно менее 0 1% и 0 6% Пример 17 Асимметричный синтез (+)-5-карбометокси-6метил-2[[3,4-диметокси-2-пиридинил) метил] сульфинил]-1Н-бензимидазол, (+)- (1с) В толуоле (20мл) суспендировали 3 4г (9 1 ммоля) 5-кабометокси-6-метил-2-[[3,4диметокси-2-пиридинил) метил] тио] -1Нбензимидазола К смеси добавили 41 мкл (2 Зммоля) воды, 1 7мл (Юммолей) (+)- диэтил Lтартрата и 1 Зг (4 бммоля) изопропоксида титана (IV) Смесь перемешивали в течение 60 минут при 50°С и затем добавили 0 78мл (4 5ммоля) N, Nдиизопропилэтиламина Смесь охладили до 30°С и добавили толуол (10 мл) Затем к смеси добавили 1 7мл (80%, 9 2ммоля) гидропероксида кумола Через несколько минут добавили толуол (70мл) и через один час при 30°С смесь состояла из 12 5% сульфида, 3 5% сульфона и 84% сульфоксида с оптической чистотой, соответствующей энантиомерному избытку 95 6% Смесь охладили до комнатной температуры и отфильтровали образованный осадок Получили 2 5г сырого продукта, состоящего из желаемого соединения, в виде твердого вещества, которое имело оптическую чистоту, соответствующую энантиомерному избытку 98 2% 29 47409 Пример 18 Асимметричный синтез (-)-5-карбометокси- 6метил-2- [[(3, 4-диметокси-2-пиридинил) метил] сульфинил]- 1Н-бензимидазола, (-) - (1с) К смеси (-)- диэтил D-тартрата (8 6мл, 50ммолей) и метилен хлорида (50мл) при перемешивании добавили изопропоксид титана (IV) (7 5мл, 25ммолей) и воду (0 45мл, 25ммолей) Раствор перемешивали в течение 30 минут при комнатной температуре и затем ввели 5карбометокси-6-метил-2-[[(3,4-диметокси-2пиридинил) метил] тио]-1 Н-бензимидазол (9 Зг, 25ммолей) и диизопропилэтиламин (1 25мл, 7 2ммоля) При комнатной температуре добавили гидропероксид кумола (технический, 80%, 5 1мл, 27ммолей) и в течение трех часов при комнатной температуре произошла реакция Сырой продукт состоял из сырого сульфоксида с энантиомерным избытком (е е ) 71% После очистки на силикагеле метанолом/метиленхлоридом, используемым в качестве элюента, и последующих повторных перекристаллизации из этанола получили 2 9г (30%) названного соединения с энантиомерным избытком 99 4% Пример 19 Асимметричный синтез (-)-5-карбометокси-6метил-2-[[(3,4-диметокси-2- пиридинил) метил] сульфинил] -1Н-бензимидазола, (-)-(Іс) В метиленхлориде (100мл) растворили 4 7г (12 5ммолей) 5-карбометокси-6-метил-2-[[(3, 4диметокси-2-пиридинил) метил] тио]-1Нбензимидазола К раствору добавили 80мкл (4,5ммоля) воды, 3 2мл (19ммолей) (-) -диэтил Dтартрата и 2 2мл (7 5ммолей) изопропоксида титана (IV) Смесь перемешали в течение 60 минут при нагревании в колбе с обратным холодильником и затем охладили до комнатной температуры Добавили 0 88 мл (5 Оммолей) N, N- диизопропилэтиламина и смесь перемешали в течение 30 минут Добавили 2 15мл (12ммолей) гидропероксиди кумола (80%) и через два часа при комнатной температуре смесь состояла из 23% сульфида и 72% сульфоксида с оптической чистотой, соответствующей энантиомерному избытку 88% К смеси добавили метиленхлорид (100 мл) и полученный раствор три раза экстрагировали водным раствором аммиака (12%) при общем объеме 300мл Смешанные водные слои нейтрализовали добавлением 50мл концентрированной уксусной кислоты, после чего начали осаждаться белые кристаллы Кристаллы отфильтровали, промыли диэтиловым эфиром и сушили до получения 2 34г (48%) белых кристаллов названного соединения, состоящего из 1 5% сульфида и 1 8% сульфона с оптической чистотой, соответствующей энантиомерному избытку 92% Пример 20 Асимметричный синтез (+)-5-карбометокси-6метил-2-[[(3,4-диметокси-2-пиридинил) метил] сульфинил]- 1Н- бензимидазола, (+)-(1с) В метиленхлориде растворили 4 7г (12 5ммолей) 5- карбометокси-6 -метил-2-[[(3, 4диметокси-2-пиридинил) метил] тио]- 1Н- бензимидазола К раствору добавили 80мкл, (4 5ммоля) воды, 3 2мл (19ммолей) (+)- диэтил L-тартрата и 2 2мл (7 5ммолей) изопропоксида титана (IV) 30 Смесь перемешивали в течение 60 минут при нагревании в колбе с обратным холодильником и затем охладили до комнатной температуры Добавили 1 1мл (6 Зммоля) N, Nдиизопропилэтиламина и затем смесь перемешали в течение 30 минут Затем добавили 2 15мл (12ммолей) гидропероксида кумола (80%) и через 2 часа при комнатной температуре смесь состояла из 19% сульфида и 77% сульфоксида с оптической чистотой, соответствующей энантиомерному избытку 90% К смеси добавили метиленхлорид (100мл) и полученный раствор три раза экстрагировали водным раствором аммиака (12%) при общем объеме 300мл Смешанные водные слои нейтрализовали добавлением концентрированной уксусной кислоты (50мл), при этом получили белые кристаллы Кристаллы отфильтровывали, промыли диэтиловым эфиром и сушили до получения 3 29г (68%) белых кристаллов названного соединения с оптической чистотой, соответствующей энантиомерному избытку 93% Материал также состоял из 2 2% сульфида и 0 9% сульфона Пример 21 Асимметричный синтез (-)-2-[[(3-метил-4-(2, 2, 2-трифторэтокси)- 2-пиридинил) метил] сульфинил]-1Н-бензимидазола, (-)-(Id) В толуоле (50мл) растворили 2 1 г (6 Оммолей) 2[[[3-метил-4-(2,2,2-трифторэтокси)-2пиридинил]- метил] тио]-1Н-бензиимидазола К раствору добавили 65мкл (3 6ммоля) воды, 2 6мл (15 Оммолей) (-)- диэтил D-тартрата и 1 8мл (6 Оммолей) изопропоксида титана (IV) Смесь перемешивали в течение 60 минут при 50°С и затем охладили до комнатной температуры Добавили 1 05мл (6 Оммолей) N, N-диизопропилэтиламина и 1 1мл (6 Оммолей) гидропероксида кумола (80%) После перемешивания в течение 16 часов при комнатной температуре смесь в соответствии с ахиральной высокоэффективной жидкостной хроматографией состояла из 11% сульфида, 7% сульфона и 78% сульфоксида К смеси добавили 50мл толуола и полученный раствор три раза экстрагировали водным раствором аммиака (12%) при общем объеме 150мл Смешанные водные слои нейтрализовали добавлением концентрированной уксусной кислоты (30мл) После этого осуществили экстракцию, выпаривание и тонкослойную хроматографию, получая 1 2г названного соединения с чистотой 99 9% (ахиральный анализ) и с энантиомерным избытком ( е е ) 55% (хиральный анализ) После обработки остатка ацетонитрила получили осадок, который удалили фильтрацией После выпаривания фильтрата получили масло с повышенной оптической чистотой Повторив эту процедуру два раза, получили 0 63г (29%) желаемого соединения в виде масла с оптической чистотой, соответствующей энантиомерному избытку 99 5% Пример 22 Асимметричный синтез (+)-2-[[[3-метил-4-(2, 2, 2-три- фторэтокси)-2-пиридинил] метил] сульфинил]-1Н -бензимидазола, (+)- (Id) В 50мл толуола растворили 2 1 г (6 Оммолей) 2-[[[3-метил-4-(2,2,2-трифторэтокси)-2-пиридинил] метил] тио]-1Н- бензимидазола К раствору доба 31 47409 вили 65мкл (3 6ммоля) воды, 2 6мл (15 0ммолей) (+)-диэтил L-тартрата и 1 8мл (6 Оммолей) изопропоксида титана (IV) Смесь перемешивали при 50°С в течение 60 минут и затем охладили до комнатной температуры Добавили 1 05 мл (6 Оммолей) N, N- диизопропилэтиламина и (1 1 мл 6 Оммолей) гидропероксида кумола (80%) После перемешивания в течение 16 часов при комнатной температуре смесь, в соответствии с ахиральной высокоэффективной жидкостной хроматографией, состояла из 13% сульфида, 8% сульфона и 76% сульфоксида К смеси добавили толуол (50мл) и полученный раствор три раза экстрагировали водным раствором аммиака (12%) при общем объеме 150мл Смешанные водные слои нейтрализовали добавлением концентрированной уксусной кислоты (30мл) После этого осуществили экстракцию, выпаривание и тонкослойную хроматографию, при этом получили 0 85г названного соединения с чистотой 99 9% (ахиральный анализ) и с энантиомерным избытком ( е е ) 46% (хиральный анализ) После обработки остатка ацетонитрилом получили осадок, который удалили фильтрацией После выпаривания фильтрата получили масло с повышенной оптической чистотой Повторив эту процедуру два раза, получили 0 31 г (14%) желаемого соединения в виде масла с оптической чистотой, соответствующей энантиомерному избытку 99 6% Пример 23 Асимметричный синтез (-)-5-дифторметокси-2[[(3,4-диметокси-2-пиридинил) метил] сульфинил] -1Н-бензимидазола, (-)- (1е) В метиленхлориде (25мл) растворили 1 1г (3 Оммоля) 5-дифторметокси-2-[[(3,4-диметокси-2пиридинил) метил] тио]-1Н- бензимидазола К раствору добавили 20мкл (1 1ммоля) воды, 0 81мл (4 7ммоля) (-)- диэтил D-тартрата и 0 56мл (1 9 ммоля) изопропоксида титана (IV) Смесь перемешивали в течение 60 минут при нагревании в колбе с обратным холодильником и затем охладили до комнатной температуры После этого добавили 0 22мл (1 Зммоля) N, Nдиизопропилэтиламина и затем 0 57мл (80%, 3 1 ммоля) гидропероксида кумола (80%) Через 21 час при комнатной температуре смесь состояла из 10% сульфида и 89% сульфоксида с оптической чистотой, соответствующей энантиомерному избытку 86% К смеси добавили метиленхлорид (25мл) и полученный раствор три раза экстрагировали водным раствором аммиака (12%) при общем объеме 300мл Смешанные водные слои нейтрализовали добавлением 25мл концентрированной уксусной кислоты и затем экстрагировали метиленхлоридом (ЗхІООмл) Остаток в виде масла (1 16г) растворили в горячем ацетонитриле (20мл) Когда раствор охладили до комнатной температуры, образовался белый осадок и, после фильтрации, получили 0 35г (29%) желаемого соединения Из фильтрата путем его выпаривания получили 0 71 г желаемого соединения с невысокой оптической чистотой Анализ показал, что оптическая чистота кристаллов и фильтрата отвечала соответственно энантиомерному избытку 97 4% и 75% Пример 24 32 Асимметричный синтез (+)- 5-дифторметокси2-[[(3 ,4-диметокси-2- пиридинил) метил] сульфинил]-1Н-бензимидазола, (-)-(Іе) В метиленхлориде (25мл) растворили 1 1г (3 Оммоля) 5-дифторметокси-2-[[(3, 4-диметокси-2пиридинил) метил] тио]-1Н-бензимидазола К раствору добавили 20мкл (1 1 ммоля) воды, 0 81мл (4 7ммоля) (+)- диэтил L-тартрата и 0 56мл (1 Эммоля) изопропоксида титана (IV) Смесь перемешивали в течение 60 минут при нагревании в колбе с обратным холодильником и затем охладили до комнатной температуры После этого добавили 0 22мл (1 Зммоля) N, N- диизопропилэтиламина и затем 0 57мл (80%, 3 1 ммоля) гидропероксида кумола (80%) Через 21 час при комнатной температуре смесь состояла из 8% сульфида и 92% сульфоксида с оптической чистотой, соответствующей энантиомерному избытку 87% К смеси добавили метиленхлорид (25мл) и полученный раствор три раза экстрагировали водным раствором аммиака (12%) при общем объеме 300 мл Смешанные водные слои нейтрализовали добавлением 25мл концентрированной уксусной кислоты и затем экстрагировали метиленхлоридом (3x100 мл) Растворитель удалили и остаток в виде масла (0 86г) растворили в горячем ацетонитриле (20мл) Когда раствор охладили до комнатной температуры, образовался белый осадок, который фильтровали, получая 0 Збг (30%) желаемого соединения с невысокой оптической чистотой Оптическая чистота кристаллов и фильтрата отвечала соответственно энантиомерному избытку 97 4% и 78% Пример 25 Асимметричный синтез (-)-2-[[[4метоксипропокси- З-метил-2-пиридинил] метил] сульфинил] -1Н-бензимидазола,(-)- (If) В 50мл толуола растворили 2 1 г (6 Зммоля) 2[[[ 4-(3-метоксипропокси- 3- метил-2-пиридинил] метил] тио]-1Н-бензи-мидазола К раствору добавили 40мкл (2 2ммоля) воды, 1 6мл (9 4ммоля) (-)диэтил D-тартрата и 1 1мл (3 8ммоля) изопропоксида титана (IV) Смесь перемешивали в течение 60 минут при 50°С и затем охладили до комнатной температуры Добавили 0 44мл (2 бммоля) N, Nдиизопропилэтиламина и 1 1мл (6 Оммолей) гидропероксида кумола (80%) После перемешивания в течение 2-х часов при комнатной температуре смесь, в соответствии с ахиральной высокоэффективной жидкостной хроматографией, состояла из 9% сульфида, 4% сульфона и 86% сульфоксида К смеси добавили толуол (50мл) и полученный раствор три раза экстрагировали водным раствором аммиака при общем объеме 150мл Смешанные водные слои нейтрализовали добавлением концентрированной уксусной кислоты (30мл) После этого осуществили экстракцию, выпаривание и тонкослойную хроматографию, при этом получили 1 62г названного соединения с чистотой 99 8% (ахиральный анализ) и энантиомерным избытком ( е е ) 90% (хиральный анализ) После обработки материала ацетонитрилом образовался осадок, который можно было удалить фильтрацией После концентриро-вания фильтрата получили 1 Збг (60%) названного соединения в виде масла с оптической чистотой, соответствующей энантио 33 47409 мерному избытку 91 5% Пример 26 Асимметричный синтез (+)- 2-[[[4-(3- метоксипропокси)- 3- метил-2-пиридинил] метил] сульфинил]-1Н -бензимидазола, (+)- (If) В 50мл толуола растворили 2 1 г (6 Зммоля) 2[[[4-(3-метоксипропокси)З-метил-2-пиридинил] метил] тио]-1Н -бензимидазола К раствору добавили 40мкл (2 2ммоля) воды, 1 6мл (3 8ммоля) изопропоксида титана (IV) Смесь перемешивали в течение 60 минут при 50°С и затем охладили до комнатной температуры К раствору добавили 0,44мл (2 бммоля) N, N- диизопропилэтиламина и 1 1мл (6 Оммолей) гидропероксида кумола (80%) После перемешивания в течение 2-х часов при комнатной температуре смесь, в соответствии с высокоэффективной жидкостной хроматографией, состояла из 9% сульфиди, 4% сульфона и 85% сульфоксида К смеси добавили толуол (50мл) и полученный раствор три раза экстрагировали водным раствором аммиака (12%) при общем объеме 150мл Смешанные водные слои нейтрализовали добавлением концентрированной уксусной кислоты (30мл) После этого осуществили экстракцию, выпаривание и тонкослойную хроматографию, получая 1 63г названного соединения с чистотой 99 9% (ахиральный анализ) и с энантиомерным избытком ( е е ) 9 1 % (хиральный анализ) После обработки материала ацетонитрилом образовался осадок, который можно было удалить фильтрацией После концентрирования фильтрата получили 1 1 г (49%) названного соединения в виде масла с оптической чистотой, соответствующей энантиомерному избытку 96% Пример 27 Асимметричный синтез (-)- 2- [2-(г\І-изобутилN-метиламино) бензилсульфинил]бензимидазола, (-)- (Ig) В толуоле (6мл) растворили 2 Ог (6 1 ммоля) 2[2-(г\І-изобутил-г\І-метиламино) бензилтио]- бензимидазола При 50°С и перемешивании добавили 40мкл (2 2моля) воды, 1 6мл (9 Зммоля) (+)-диэтил L-тартрата и 1 1мл (3 7ммоля) изопропоксида титана (IV) Полученную смесь перемешивали при 50°С в течение 1 часа и затем добавили 0 53мл (3 Оммол) N, N-диизопропилэтиламина Затем реакционную смесь охладили до 30°С, после чего добавили 1 1мл (6 1 ммоля) гидропероксида кумола (80%) Смесь перемешивали при 30°С в течение 50 минут Анализ реакционной смеси показал, что оптическая чистота» образованного сульфоксида соответствовала экантиомерному избытку 92% Смесь охладили до комнатной температуры и разбавили небольшим количеством метиленхлорида При использовании колоночной хроматографии силикагель, элюировали 4% МеОН/СНгСЬ (насыщенный ІЧНз) получили масло, которое подвергли повторной хроматографии (силикагель, элюировали 20% ЕЮАс( гексаном) Полученный сырой продукт (1 6г) в виде масла обработали небольшим количеством ацетонитрила для того, чтобы увеличить оптическую чистоту Фильтрацией удалили образованный осадок (270мг) Из фильтрата удалили растворитель, при этом получили 1,2г желаемого соединения в виде масла Оптическая чистота материала соответствовала 34 энантиомерному избытку 96% Пример 28 Асимметричный синтез (+) -2-[2-(N- изобутилN-метиламино) бензилсульфинил]бензимидазола, (+)- (Ig) В толуоле (6мл) растворили 2 Ог (6 1 ммоля) 2[2-(г\І-изобутил-М-метиламино) бензилтио]- бензимидазола При 50°С и перемешивании добавили 40л (2 2ммоля) воды, 1 6мл (9 Зммоля) (-)-диэтил D- тартрата и 1 1мл (3 7ммоля) изопропоксида титана (IV) Полученную смесь перемешивали при 50°С в течение 1 часа и затем добавили 0 53 мл (3 0 ммоля) N, N- диизопропилэтиламина Затем реакционную смесь охладили до 30°С, после чего добавили 1 1мл (9 1 ммоля) гидропероксида кумола (80%) Смесь перемешали при 30°С, после чего добавили 1 1мл (6 1 ммоля) кумолгидропероксида (80%) Смесь перемешивали при 30°С в течение 50 минут Анализ реакционной смеси показал, что оптическая чистота образованного сульфоксида соответствовала энантиомерному избытку 9 1 % Смесь охладили до комнатной температуры и разбавили количеством мети-ленхлорида При использовании колоночной хроматографии [силикагель, элюировали 4% МЕОН/СЬЬСЬ (насыщенный ІЧНз)] получили сырой продукт в виде масла Этот материал обработали смесью этил ацетата и гексана (10% ЕЮАс) Образованный осадок (140мг) удалили фильтрацией Из фильтрата удалили растворитель, при этом получили 0 95г желаемого соединения в виде масла Оптическая чистота материала соответствовала энантиомерному избытку 96% Пример 29 Асимметричный синтез двух стереоизомеров 2-[(4-метокси-6,7,8,9- тетрагидро-5Н-циклогепта [Ь] пиридин-9-ил) сульфинил]-1Н - бензимидазола, (In) В последующем примере первый диастереомер вышеуказанного соединения, элюированного на прямой фазе (силикагель), назвали диастереомером А, а второй диастереомер представлен как диастереомер В Синтез В 20мл толуола суспендировали 0 51 г (1 57ммолей) рацемата 2-[(4-метокси-б,7,8,9тетрагидро-5Н-циклогепта [Ь] пиридин-9-ил) тио]1Н- бензимидазола При комнатной температуре и перемешивании добавили 0 34г (1 бммоля) (+)диэтил L-тартрата, 7мл (0 4ммоля) воды и 0 22г (0 78ммоля) изопропоксида титана (IV) Смесь перемешивали при 50°С в течение 50 минут и затем при комнатной температуре добавили 100мг (0 78ммоля) N, N- диизопропилэтиламина Затем в течение 5 минут при комнатной температуре добавляли 0 ЗЗг (160ммолей) гидропероксида кумола (80%), после чего раствор перемешивали при комнатной температуре в течение 24 часов Стереоизомерный состав названного соединения в сырой смеси был таким, как указано далее Отношение диастереомеров составило 4 3 в пользу диастереомера А Оптическая чистота (-)энантиомера диастереомера А соответствовала энантиомерному избытку 76% и оптическая чистота (+)-энантиомера диастереомера В соответствовала энантиомерному избытку 68% Полученную смесь промыли водой (Зх25мл), сушили над 35 36 24 6% (-)-энантиомера сульфоксида и 26 7% (+)энантиомера сульфоксида (т е э и =4%) Сравнительный пример В Окисление 5-метокси-2- [[(4-метокси-3,5 диметил-2пиридинил) метил] тио]-1 Нбензимидазола с использованием гидропероксида кумола при -22°С без добавления основания (Использованный способ окисления описан в Tetrahedron (1987), 43, 5/35) Проводили эксперимент с использованием тех же самых условий, что и в ссылочном Примере А, за исключением того, что вместо третбутилгидропероксида использовали гидропероксид кумола Через 120 часов при -22°С смесь состояла из 29% сульфида, 3 8% сульфона, 29 1% (-)-энантиомера сульфоксида и 35 5% (+)-энантиомера сульфоксида (т е э й =10%) Сравнительный пример С Окисление 5-метокси-2-[[(4-метокси-3,5- диметил-2-пиридинил) метил] тио] -1Н-бензимидазола с использованием гидропероксида кумола в нейтральных условиях К раствору (+)- диэтил L-тратрата (8 5мл, 50ммолей) и изопропоксида титана (IV) (7 4мл, 25ммолей) в 50мл метиленхлорида при комнатной температуре добавили воду (450мкл, 25ммолей) Через 20 минут добавили 5-мето кс и-2-[[(4метокси-3 ,5-диметил-2-пиридинил) метил] тио] 1Н-бензимидазол (8 2г, 25ммолей) и смесь разделили на три части К одной из частей при комнатной температуре добавили гидропероксид кумола (1 7мл, 80% растворителя, 9 2ммоля) и через 3 часа 20 минут взяли пробу Смесь состояла из 29 4% сульфида, 6 3% сульфона, 22% (-)энантиомера сульфоксида и 35% (+)-энантиомера сульфоксида (т е э и =23%) 47409 Na2SO4 и растворитель удалили С помощью Флэш хроматографии остатка (метанолметиленхлорид от 0 до 5%) получили 0 25г (47%) энантиомерно обогащенного диастереомерного сульфоксида в виде сиропа Разделение диастереомеров Разделение двух диастереомеров осуществили с использованием повторного хром ато граф и чес ко го состава (метанол-метиленхлорид от 0 до 5%) Таким образом получили (-)-энантиомер диастереомера А в виде сиропа (0 14г) с оптической чистотой, соответствующей энантиомерному избытку 77% (+)Энантиомер диастереомера В получили также в виде сиропа (0 085г) с оптической чистотой, соответствующей энантиомерному избытку 68%, однако диастереомер В был загрязнен приблизительно 10% диастереомера А Оптическая очистка Оптическую чистоту (-)энантиомера диастереомера А увеличили путем добавления приблизительно 2мл ацетонитрила к энантиомерно обогащенному составу диастереомера А (0 14г) После перемешивания в течение ночи образованный осадок (почти рацемический диастереомер А) отфильтровали и из фильтрата пленочным испарением удалили растворитель Таким образом получили 85 мг (-)- энантиомера диастереомера А в виде сиропа с оптической чистотой, соответствующей энантиомерному избытку 88% Оптическую чистоту (+) -энантиомера диастереомера В увеличили подобным способом Таким образом, посредством добавления ацетонитрила (2мл) к энантиомерно обогащенному составу диастереомера В (0 085г), после которого осуществили перемешивание в течение ночи, получили осадок, который отфильтровали В результате получили 0 050 г (+)- энантиомера диастереомера В с оптической чистотой, соответствующей энантиомерному избытку 95% Наилучшим способом осуществления настоящего изобретения, известным в настоящее время, является такой, который описан в Примере 11 Сравнительный пример А Окисление 5-метокси-2[[(4-метокси-3,5диметил-2-пиридинил) метил] тио]-1Нбензимидазола с использованием третбутилгидропероксида в нейтральных условиях (Использованный способ тот же, что и способ, использованный в- Euro J Biochem 166 (1987) 453-459, и описанный в J Am Chem Soc 106(1984)8188) К раствору (+)- диэтил L-тартрата (1 7мл, 10моллей) и изопропоксида титана (1 У)(1 5мл, 5ммолей) в 50мл метиленхлорида при комнатной температуре добавили воду (90мк, 5ммолей) Через 20 минут в реакционной смеси растворили 5метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил) метил] тио]-1Н- бензимидазол (6 6г, 5ммолей) и раствор охладили до -20°С Добавили ЗМ раствор третбутилгидропероксида в толуоле (1 8мл, 5 5ммолей) и смесь выдерживали при -20°С в течение 120 часов По истечении этого времени смесь состояла из 28% сульфида (исходный материал), 8 6% сульфона, 30 6% (-)- энантиомера сульфоксида и 28 1% (+)- энантиомера сульфоксида (те э й =4%) В подобном эксперименте, проведенном при +8°С в течение 7 часов смесь состояла из 32 4% сульфида, 8 7% сульфона, Сравнительный пример D Окисление 5-метокси-2-[[(4-метокси-3,5диметил-2-пири-динил) метил] тио]-1Н[бензимидазола с использованием гидропероксида кумола при добавлении основания согласно одному из вариантов настоящего изобретения Эксперимент проводили с использованием тех же самых условий, которые описаны в Сравнительном примере С При этом различие состояло в том, что вместе с гидропероксидом кумола добавили один эквивалент диизопропилэтиламина Через 3 часа 20 минут смесь состояла из 17 2% сульфида, 3,5% сульфона, 8 7% (-)-энантиомера сульфоксида и 69 3% (+)-энантиомера сульфоксида (т е э й =78%) Сравнительный пример Е Асимметричный синтез (+)-2-[5-(3,5диметилпиразол-1-ил) пентилсульфинил]-4,5дифенилимидазола В толуоле (20мл) растворили 0 8г (1 Эммоля) 2- [5-(3,5-диметилпиразол-1-ил) пентилсульфинил]-4,5- дифенилимидазола Раствор концентрировали на роторном испарителе до тех пор, пока не удалили половину объема К смеси в указанном порядке добавили 20мкл (1 1ммоля) воды, 1 Ог (4 8ммоля) (н-)-диэтил L-тартрата и 0 45 г (1 Эммоля) изопропоксида титана (IV) Смесь перемешали в течение 60 минут при 50°С и затем добавили 0 25г (1 Эммоля) N, N- диизопропилэтиламина Затем смесь перемешали при комнатной 37 47409 температуре в течение 30 минут, после чего добавили 0 Збг (80%, 1 Эммоля) гидропероксида кумола Смесь перемешали в течение четырех часов при комнатной температуре и проведенный затем анализ показал, что реакция завершилась Раствор промыли водой (2мл) и затем удалили органический слой Хроматографией на силикагеле (метанолметиленхлорид от 0 до 5%) очистили маслянистый остаток Получили 0 7г желаемого продукта в виде масла, которое имело оптическую чистоту, соответствующую энантиомерному избытку 87% Сравнительный пример F Асимметричный синтез (-)- 2-[5- (3, 5диметилпиразол-1-ил) пентилсульфинил]-4, 5дифенилимидазола В толуоле (40мл) растворили 1 5г (3 бммоля) 2-[5-(3,5-диметилпиразол-1-ил) пентилтио]-4, 5дифенилимидазола Раствор концентрировали на роторном испарителе до тех пор, пока не удалили половину объема К смеси в указанном порядке добавили 38мкл (2 1ммоля) воды, 1 85г (9 Оммолей) (-)- диэтил D-тартрата и 1 01 г (3 бммол) изопропоксида титана (IV) Смесь перемешали в течение 60 минут при 50°С Смесь разделили на две части и затем к одной половине смеси добавили 0 23г (1 Эммоля) N, Nдиизопропилэтиламина Затем эту смесь перемешали при комнатной температуре в течение 15 минут, после чего добавили 0 35г (80%, 1 8ммоля) гидропероксида кумола Смесь перемешали в течение четырех часов при комнатной температуре и проведенный затем анализ показал, что реакция завершилась Раствор перемешали с водой (2мл) и затем удалили органический слой Хроматографией на силикагеле (метанол-метиленхлорид от 0 до 5%) очистили маслянистый остаток Получили 0 65г желаемого продукта в виде масла, которое имело оптическую чистоту, соответствующую энантиомерному избытку 92% Выводы Примеры показывают, что самый высокий энантиомерный избыток получают в том случае, если принимают во внимание все признаки изобретения В соответствии с одним вариантом изобретения для высокой энантиоселективности является важным добавлением во время окисления основания Но высокий энантиомерный избыток можно также получить в соответствии с другими вариантами изобретения, если изменить порядок добавления компонентов в реакционный сосуд, и альтернативно во время получения хирального комплексного соединения титана принимать во внимание время и/или температуру Получение хирального комплексного соединения титана осуществляют предпочтительно в присутствии прохирального сульфида, в течение длительного времени и при повышенной температуре Определение энантиомерного избытка в примерах и Сравнительных примерах Значение энантиомерного избытка в каждом примере, приведенном выше, показывает относительные количества каждого полученного энантиомера Значение определяют как разность между относительными процентными содержаниями двух энантиомеров Таким образом, например, 38 когда процентное содержание (-)-энантиомера образованного сульфоксида составляет 97 5% и процентное содержание (+)-энантиомера составляет 2 5%, энантиомерный избыток (-)энантиомера равен 95% Энантиомерный состав полученного сульфоксида определяли хиральной высокоэффективной жидкостной хроматографией (HPLC) с использованием или колонки Chiralpak AD R или колонки Chiral AGPR при следующих условиях, определенных для каждого соединения Таблицаї Соединение формулы (1а) Колонка Chiralpak AD 50x4 6мм Элюент Изогексан (100мл), этанол (100мл) и уксусная кислота (Юл) Скорость тока по 0 5мл/мин Объем впрыскивания 50мкл Длина волны 302нм Время жания удер Время жания удер (-) -энантиомера 4 0 мин (+) -энантиомера 5 8 мин Таблица2 Соединение формулы (Ib) Колонка Chiralpak A D 50x4 6мм Элюент Изогексан (125мл), 2-пропанол (25мл), этанол (50мл) и уксусная кислота (30мл) Скорость потока 0 4мл/мин Объем впрыскивания 50мкл Длина волны 287нм Время удерживания (+) -энантиомера 6 5 мин Время удерживания (-) -энантиомера 13 8 мин ТаблицаЗ Соединение формулы (1с) 39 Колонка ChiralpakAD 50x4 6мм Элюент Изогексан (100мл), этанол (100мл) и уксусная кислота (10мл) Скорость тока по 40 47409 Время удерживания (-) -энантиомера 9 5 мин Время удерживания (+) -энантиомера 13 3 мин 0 4мл/мин Объем впрыскивания Соединение формулы (If) 50мкл Длина волны Таблицаб ЗОнм Колонка Элюент Время удерживания (-) -энантиомера 9 4 мин Натриифосфатныи буферный раствор (рН 7 0) 1=0 025 (430мл) и ацетонитрил (70 мл) (+) -энантиомера 6 4 мин Время удерживания Chiral- AGP 100x4 0мм 0 5мл/мин Соединение формулы (Id) Колонка Chiral-AGP 100x4 0 мм Элюент Натриифосфатныи буферный раствор (рН 7 0) 1=0 025 (500мл) и ацетонитрил (70мл) 0 5мл/мин Объем впрыскивания 20мкл Длина волны Таблица4 Скорость потока Скорость потока 210нм Время удерживания (+) -энантиомера 4 1 мин Время удерживания (-) -энантиомера 6 8 мин Таблица7 Объем впрыскивания 20мкл Длина волны 210нм Время удерживания (+) -энантиомера 6 2 мин Время удерживания (-) -энантиомера 7 2 мин Соединение формулы (Ig) Колонка ChiralpakAD 50x4 6мм Элюент Изогексан (200мл) и этанол (10мл) Скорость потока 0 5мл/мин Объем впрыскивания 50мкл Длина волны 285нм Таблица5 Соединение формулы (1е) Колонка Элюент ChiralpakAD 50x4 6мм Изогексан (150мл), этанол (50мл) и уксусная кислота (Юмкл) Время вания удержи Время вания удержи (-) -энантиомера 9 0 мин (+) -энантиомера 9 8 мин Соединение формулы (In) Скорость потока 0 5мл/мин Объем впрыски ваня Длина волны Колонка ChiralpakA D 50x4 6мм 50мкл Элюент Изогексан (150мл) и 2пропанол (50мл) 290нм Скорость потока 0 4мл/мин 47409 41 Объем впрыскивания В Сравнительных примерах Е и F энантиомерный состав продуктов определяли хиральной HPLC с использованием следующих условий Колонка Chiral AD 50x4 6мм 50мкл Длина волны 285нм Время вания удержи- (-) -энантиомера диастереомера А 6 9 мин Время вания удержи- (+) -энантиомера диастереомера А 8 1 мин Время вания Время вания 42 удержи- (+) -энантиомера диастереомера В 8 8 мин удержи- (-) -энантиомера диастереомера В 11 0 мин Первый диастереомер соединения (1h), элюированного на прямой фазе, (ахиральная силикагельная хроматография смотри ниже) назван диастереомером А, а второй диастереомер диастереомером В Таблица8 Элюент Изогексан (200мл), этанол (5мл) и уксусная кислота (Юмкл) Скорость потока 1 мл/мин Объем впрыскивания 50мкл Длина волны 280нм Время удер(+) -энантиомера 13 5 мин живания Время удер(-) -энантиомера 17 3 мин живания Следует отметить, что в примерах, относящихся к одиночным энантиомерам омепразола или его щелочным солям, знак оптического вращения одиночной энантиомернои формы омепразола, определенной в воде, является противоположным такому знаку, который определяет упомянутое соединение в его нейтральной форме в хлороформе Сравнительные примеры Е и F ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for synthesis of substituted sulphoxides (variants) and sulphoxide
Назва патенту російськоюСпособ синтеза замещенных сульфоксидов (варианты) и сульфоксид
МПК / Мітки
МПК: C07B 57/00, A61K 31/415, B01J 21/06, C07D 235/28, C07B 61/00, C07D 401/12, A61P 43/00, A61K 31/4184, A61P 1/04, B01J 31/16
Мітки: синтезу, сульфоксид, варіанти, сульфоксидів, заміщених, спосіб
Код посилання
<a href="https://ua.patents.su/21-47409-sposib-sintezu-zamishhenikh-sulfoksidiv-varianti-ta-sulfoksid.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу заміщених сульфоксидів (варіанти) та сульфоксид</a>
Попередній патент: Вулик безфальцевий багатокорпусний з магазинами
Наступний патент: Спосіб стереоселективного відновлення за участю мікроорганізмів та штам мікробактерій
Випадковий патент: Пристрій для перетворення енергії хвиль водної поверхні в електричну