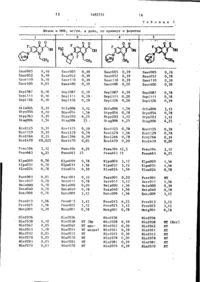
Спосіб одержання заміщених діазабіціклоалкілхінолон карбонових кислот мостиковим зв’язком або їх фармацевтично прийнятних адитивний солей
Формула / Реферат
Способ получения замещенных диазабициклоалкилхинолон карбонових кислот с мостиковой связью общей формулы
где Y - С1-С3-алкил, С1-С3-галоалкил, циклопропил, винил;
п - фторфенил или N-метиламино;
А - СН, ССl или СF, или А - углерод и взятый вместе с Y, углеродом и азотом, с которыми А и Y связаны, образуют шестичленное кольцо, содержащее кислород, к которому может быть присоединен метил;
R - диазабициклоалкиловый заместитель с мостиковой связью, выбранный из группы формул
где Q - водород или С1-С3-алкил, или их фармацевтически приемлемых аддитивных солей, отличающийся тем, что соединение формулы
где А и Y имеют указанные значения; Наl - галоген,
подвергают взаимодействию с соединением общей формулы RН, где R - имеет указанное значение с выделением целевого продукта в свободном виде или в виде фармацевтически приемлемой аддитивной соли кислоты.
Текст
СОЮЗ СОВЕТСНИХ СОЦИАЛИСТИЧЕСКИХ РЕСПУБЛИН (19) SU01, 1482531 (5D4 С 07 D 487/18//А 61 К 31/47 ГОСУДАРСТВЕННЫЙ НОМИТЕТ ПО ИЗОБРЕТЕНИЯМ И ОТИРЫТИЯМ ПРИ ГННТ СССР ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ (21) 4028142/23-04 (22) 17.09.36 (31) 777471 , .. ' * (32) 18.09,85 (33) US .. (46) 23.05.89.Бюл. № 19 (71) Пфайэер Инк (US) (72) Мартин Раймонд Джефсон и Пол Роберт Мк.Гвирк (US) (53) 547.587.25.07(038.8) (56) Патент Великобритании ( 2085875, С кл. С 07 D 401/04, опублик. 06.05.82. связаны, образуют шестичленное кольцо, содержащее кислород, к которому может быть присоединен метил; R - диазабицикло алкиловый заместитель с МОСТИКОВОЙ СВЯЗЬЮ (снг> 1 N Ґ54) СПОСОБ ПОЛУЧЕНИЯ. ЗАМЕЩЕННЫХ ДИАЗАБИЦИКЛОАЛКИЛХИНОЛОН КАРБОНОВЫХ КИСЛОТ С МОСТИКОВОП СВЯЗЬЮ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ АДДИТИВНЫХ СОЛЕЙ * . , (Ш2); N Q і (57) Изобретение относится к гетероциклическим соединениям, в частности к получению замещенных диазабицикло- t алкилхинолон карбоновых кислот с мостиковой связью Лпрмулы где О водород или С 4 -С 3 -алкил, или их фармацевтически приемлемых аддитивных солей кислот, обладающих антибактериальной активностью. Цель изобретения - разработка способа получения новых более активных соединений. Синтез ведут из соединения формулы где Y- С(-С}-алкил, С,-С3-галоалкил, циклопропил, винил, п-фторфенил или N-метиламино; А-СН, СС1 или CF, или А - углерод и взятый вместе с Y f углеродом и азотом, с которыми А и V где А и Y указано выше, Hal - галоген и соединения формулы RH;, где К - указано выше. Целевой продукт выделяют в свободном виде и в виде фармацевтически приемлемой аддитивной соли кислоты. 3 т.абл. 1 Изобретение относится к способу получения новых замещенных диазабициклоалкилхинолон карбоновых кислот с мостиковой связью или их кислотных производных, обладающих антибактериальной активностью. I . --—•»— 'і і С • 1482531 Цель изобретения - синтез новых соединений, обладающих более высокой биологической активностью по сравнению с известным соединением, обладаю- 5 щим тем же видом активности. . П р и м е р 1. 1-Этил-6-фтор-1,4-дигидро-7-(8-метил-З,8~диаэабицикло [3.2, Г] -окт-3-ил)-4-оксо-3-хинолин1 карбоновая кислота (Y-этил , А-СН; 10 R-a; Q-метил). Перемешиваемую суспензию 1-этил-6,7-дифтор-4-оксо-1,4-дигидро-З-хинолинкарбоновой кислоты (3,0 г, 11,9 ммоль) и 8-метил-З,8-диазаби15 цикло [Ъ.2.V] октандигидрохлорида (4,5 г, 22,7 ммоль) в 15 мл сухого пиридина в атмосфере азота обрабатывают 1,8-диазабицикло [5,4. 6J ундек-7-еном (7,0 г, 4,6 ммоль). Смесь на-20 гревают до 80°С 3 ч. Полученный раствор охлаждают до комнатной температуры и сливают в 50 мл воды. Водный раствор промывают пять раз 100 мл хлороформа. Объединенный органический 25 слой сушат над N a L S 0 4 . Фильтруют и концентрируют под вакуумом. Полученное твердое вещество промывают диэтиловым эфиром, растворяют в воде при рН 1 1N соляной кислотой и про30 мывают хлороформом. Водный слой нейтрализуют насыщенным водным бикарбонатом Натрия и продукт экстрагируют хлороформом (5 х 100 м л ) . Хлороформный слой сушат над Na^SO 4 t фильтруют 35 и концентрируют примерно до 25 мл хлороформа. Чистый продукт осаждают в виде белого твердого вещества 75 мл диэтилового эфира. Твердое вещество собирают фильтрацией под ваку- 4 0 умом и промывают диэтиловым эфиром с получением 2,77 г (выход 65%) соедииения, указанного в названии, т.пл. 244-245°С. _ П р и м е р 2 . 1-Этил-6,8-дифтор- 45 -1,4-дигидро-7-(8-метил-3,8-диазабнцикло [3.2.1] окт-3-ил)-4-оксо-3-хинолинкарбоновая кислота (Y-этил; A-CFJ Й-aJ Q-метил). Указанное в названии соединение 5о получают в соответствии с примером 1 путем взаимодействия 1-зтил-6,7,8-трифтор-4-оксо~1,4-дигидрохинолин-3-карбоновой кислоты с 8-метил-З,8диазабицикло [3.2.1 j октан дигидрохло- 55 ридом, т.пл. 215-219е С. П р и м е р 3. 1-Фторэтил-6,8-дифтор-1,4-дигидро-7-(8-метил-З,8-диазабицикло [І3.2,1]окт-3-ил)--4-оксо~ -3-хинолинкарбоновая кислота (Y-фторэтил,' A-CF; R-a; 0-СН 5 ). Соединение, указанное в названии получают в соответствии с примером 1\ путем взаимодействия 1-фтор-этил-6,7,8-трифтор-4-оксо-1,4-дигидро— хинолин-3-карбоновой кислоты с 8-ме-тил-3,8-диаэабициклор3.2.0октан дигидрохлоридом, т.пл. 216-219 С. П р и м е р 4. 1-Метил-б-фтор-1,4-дигидро-7-(8-метил-3,8-диазабицикло [3.2. і]окт-3-ил)-4-оксо-3~хннопиккарбононая кислота (Y-CH,*,А-СН*9 R-a; Q - C H 3 ) . Соединение, указанное в названии (выход 63%) получают в соответствии с примером 1 путем взаимодействия . 1-метил-6,7-дифтор-4-оксо-1,4-дигидрохинолин.-3-карбоновой кислоты с 8-метил-З,8-диазабицикло£з.2.1^октан дигидрохлоридом, т.пл, 251°С. П р и м е р 5. 1-Винил-6-фтор-1,4-дигидро-7-(8-метил-З(8-диаэабиц*«сло [з,2.і]окт-3-ил)-4-оксо-3-хинолинкарбоновая кислота (У-винил; А-СН; R-a; Q-метил). Указанное в названии соединение (276 мл, выход 66%) получают в соответствии с примером 1 путем взаимодействия 1-винил-6,7-дифтор-4-окса-1,4-дигидрохинолин-З-карбоновой кислоты (296 мг, 1,18 ммоль) с 8-метил-3,8-диазабицикло[3.2.1J октан дигидрохлоридом (471 мг, 2,36 ммоль), т.пл. 225-232°С при разложении. П р и м е р 6. 1-п-Фторфенил-6-фтор-1,4-ДИГИДРО-7-(8-метил-З,8 -диазабицикло[3.2.1] окт-3-ил)-4-ок со-3-хинолинкарбоновая кислота (Тп-фторфенйл^ А-СН; R-a^ Q-CHj). Ъервмешиваемую суспензию 1-п-фторфенил-6,7-дифтор-4-оксо-1,4-дигидро-3-хинолинкарбоновой кислоты (319 мг, 1,0 ммоль) и 8-метил-З,8-диазабицикло[3.2.і[|октан ди гидрохлорида (400 мг, 2,02 ммоль) в 8 мл сухого пиридина в атмосфере азота обрабатывают If 8-диазабицикло(_5.4.6] ундек-7-еном (604 мг. 4,00 ммоль). Смесь нагревают до 80 С,3 ч, охлаждают до комнатной температуры и сливают в 25 мл воды. Водный слой экстрагируют пять раз 75 мл хлороформа. Сло^і хлороформа сушат над Na^SO-л, фильтруют и концентрируют в вакууме. Полученное твердое вещество промывают несколько раз диэтиловым эфиром IN HC1 до тех пор, пока рН будет равйо 1. Водно 482531 нерастворимую гидрохлоридную соль пол) с получением 13,59 г соединения, фильтруют и сушат воздухом. При переуказанного в названии, в виде белых кристаллизации из ацетонитрила полукристаллов, т.пл, 210-211 С, выход чают 150 мг (выход 35%) белое твердое 7,8%. Кроме того, 42,9 г побочного провещество, т.пл. 319-320 С (с разложедукта, определенного как 2-(3,4-дением), гндропиперидин-1-ил)ацетамид выделяI П р и м е р 7 , 1-Этил-6-фтор-1,4ют в виде белых пластин, т.пл.121-дигидро-7-(1,4-днаэабицикло\3,2. 2J 122 С, выход 24,7%, нон-4-ил)-4-оксо-3-хннолинкарбоновая 1 Б. ),4-Диазабицикло [3.2. 2J нойан„ кислота (Y-этил, А-СН; R.-б). Алюмогидрид лития (2,£Гг, Перемешиваемую суспензию 1-этял~ 51,4 ммоль) суспендируют в 250 мл -6,7-дифтор-А-оксо-1,4-днгидро-З-хисухого тетрагидроЛурана и 3-оксонолинкарбоновой кислоты (76 мг, 0,302 ммоль) и 1,4-дназабицикло[3.2.2]-15 нонана (95 мг, 0,754 ммоль) в 3 мл -1,4-диазабицикло[3.2,2]нонан (3,6 г, 25,7 ммоль) осторожно добавляют в ви де твердого вещества по одной порции при комнатной температуре. Полу сухого пиридина в атмосфере азота нагревают до 90 С 18 ч. Смесь охлаждают до комнатной температуры и разбавченную смесь затем нагревают в мягляют 50 мл воды. Водный раствор 20 ких условиях с обратным холодильниэкстрагируют два раза 50 мл хлорофорком в течение 20 ч. Реакции охлаждама. Объединенные органические слои ют до комнатной температуры и быстро затем промывают водой, сушат над охлаждают путем медленного добавлеNa^SO 4 , фильтруют и концентрируют в ния 2,5 мл воды. Соли фильтруют и вакууме. Твердое вещество растирают 25 промывают несколько раз диэтиловым в порошок несколько раз диэтиловым эфиром в количестве 1,0 л. Эти проэфиром и фильтруют с получением мывные воды и всплывающий слой сое(27 мг, выход 25%) бледно-желтого диняют,- сушат над сульфатом магния твердого вещества, т.пл. 223-225 С. н концентрируют с получением 2,09 г * П р и м е р е . 1-Этил-6,8-дифтор- 30 (64,5%) указанного в названии сое-1(4-дигидро-7-(1,4-диазабициклодинения в виде бледно-желтого масла. |3«2.2]нон-4-ил)-4-оксо-3-хинолинкарЯМР ( ° С , 63 MHZ, CDCl,)-, 59, И,' боновая кислота (Y-этил; A-CF; R-6J 47,97', 46,67; 43,67;' 29,43. П-Н). С. 6,7,8-Трнфтор-1-этил-1,4-диА, З-Оксо-t,4~диазабицикло[3,2. 2J - 35 гидро-4-оксо-З-хннолинкарбоновую киснонан. лоту (271 мг, 1,0 ммоль) растворяют Гидрохлорид хиноклидона (200 г, в 5 мл сухого пиридина и нагревают 1,24 моль) растворяют в концентриродо 90°С. 1,4-Дназабицикло[3.2.2]нованной серной кислоте (500 мл) и охнан (3,15 м г ) . Смесь нагревают при лаадают до 0-5° С в очень большой 40 90 С в течение 2,5 ч. Затем раствор водно-ледяной бане, NaN,(200 г, охлаждают до 10 С с получением oca#3,07 моль) добавляют небольшими порка, который фильтруют и промывают нециями в течение 2 ч. Полученную смесь сколько раз этилацетатом и сушат над перемешивают при 0°С в течение 4 ч. вакуумом с получением 103 мг (27%) Реакционную смесь затем медленно 45 указанного в названии соединения в и осторожно разбавляют 1 л воды и виде кремового твердого вещества, подвергают быстрому охлаждению растт.пл. 2б1-263°С. вором гидроокиси натрия (900 г, П р и м е р 9. 1-(2-Фторэтип)-622,5 моль) в 1,5 л воды. После быст-фтор-1,4-дигидро-7-(1,4-диазабицикрого охлаждения рН реакционной сме* 50 ло [3.2, 2 ] НОН-4-ИЛ-) 4-оксо-З-хинолинси равна примерно 13,5. Полученный карбоновая кислота (v-2-фторэтил' сульфат натрия фильтруют и затем проА-СИ; R-б; о-н). мывают 2 л хлороформа. Водный восплыУказанное в названии соединение по--_ вающий слой экстрагируют т.ри раза 2 л лучают с выходом 50,1% в соответствии хлороформа. Объединенные экстракты 55 с примером 3 путем взаимодействия сушат сульфатом магния и концентри6,7~дифтор-1-(2~фторэтил)~1,4-дигидруют с получением 94,9 г твердого ро-4-оксо-З-хинолипкарбоновой кислоты, остатка. Этот остаток хроматографирус 1,4-диаэабицикло[3.2.2]нонаном, ют (2,0 кг SiOj, 9:1 хлороформ:метат.пл. 256-253°С. 1482531 8 до комнатной температуры и сливают П р и м е р Ю . 1-Винші-6-фторв 250 мл воды. Водную смесь экстраги~1,4-дигидро-7-(1,4~диаэабициклоруют три раза 250 мл хлороформа. [3.2, 2J нон-4-ил)-4-оксо-З-хинолинкарбоновая кислота (Y-винил; A-CH',R-6; Объединенные хлороформные экстракQ-H). ., * ты затем еще три раза экстрагируют • 1,0N HC1 (250 м л ) . Водные кислотные экстракты объединяют и нейтрализуют до рН 7,0 6N NaOH и эатем экстрагируют три раза 250 мл хлороформа. Объединенные хлороформные экстракты сушат над сульфатом натрия и растворитель отгоняют с получением твердого остатка, который суспендируют в этилацетате, фильтруют, промывают этилацетатом и сушат с получением указанного в названии соединения (55 мг, выход 14%\в виде бледно-желтого твердого вещества, т.пл. 230-232 С. П р и м е р 14. 1-(2-Фто"рэтил)-6$8* -дифтор-1,4-дигндро-7-(1,4-днаэаби- ! цикло[3.2.21нон-4-ил)-4-оксо-З-хинолинкарбоновая кислота (Y-2-фторзтилі A-CFJ R - 6 ) , Соединение, указанное в названии, получают с выходом 13,3% в соответствии с примером 8 путем взаимодейст—" вия 6,7,8-трифтор-1-(2-фторэтил)-1,4-дигидро-4-оксо~3-хинолинкарбоновой кислоты с 1,4-диазабицикло[3.2.2JH
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing substituted diazabicycloalkylquinolon carboxylic acids with cross-linking bond or their pharmaceutically acceptable additive salts
Автори англійськоюMartin Raymond Jefson, Paul Robert Mc.Gvirck
Назва патенту російськоюСпособ получения замещенных диазабициклоалкилхинолон карбоновых кислот с мостиковой связью или их фармацевтически приемлемых аддитивных солей
Автори російськоюМартин Раймонд Джефсон, Пол Роберт Мк.Гвирк
МПК / Мітки
МПК: A61K 31/535, A61K 31/55, C07D 487/08, A61P 31/04, C07D 471/08, C07D 487/04, C07D 519/00, A61K 31/47, C07D 498/06, C07D 243/00
Мітки: спосіб, адитивний, зв'язком, фармацевтично, мостиковим, карбонових, прийнятних, одержання, солей, кислот, діазабіціклоалкілхінолон, заміщених
Код посилання
<a href="https://ua.patents.su/16-6340-sposib-oderzhannya-zamishhenikh-diazabicikloalkilkhinolon-karbonovikh-kislot-mostikovim-zvyazkom-abo-kh-farmacevtichno-prijjnyatnikh-aditivnijj-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщених діазабіціклоалкілхінолон карбонових кислот мостиковим зв’язком або їх фармацевтично прийнятних адитивний солей</a>
Попередній патент: Кристалізатор і спосіб безперевного вертикального лиття стальної стрічки
Наступний патент: Пристрій для тривалого визволення лікарської речовини у рубцево-сітковому відділі шлунку жуйних тварин
Випадковий патент: Напій