Полісахаридна сполука з імуностимулювальною активністю, спосіб її одержання, застосування та фармацевтичний препарат на її основі
Формула / Реферат
1. Полісахарид формули І
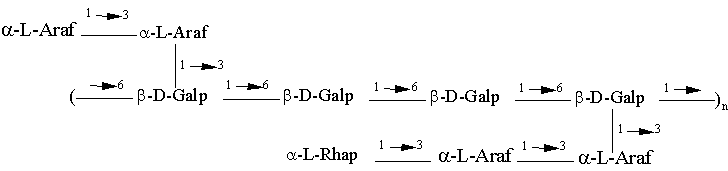 , I
, I
де n=7-8,
Araf означає арабінофуранозу, Galp означає галактопіранозу і Rhap означає рамнопіранозу.
2. Сполука за п. 1 для застосування як терапевтичного засобу.
3. Сполука за п. 1 для застосування у лікуванні імуносупресорних захворювань.
4. Сполука за п. 1 для застосування у лікуванні імуносупресорних захворювань, таких як рак, туберкульоз, грип, нежить, алергії, червоний вовчак, псоріаз та СНІД.
5. Сполука за п. 1 для застосування у лікуванні раку печінки, раку легень, раку нирок, раку товстої кишки, раку молочної залози, раку передміхурової залози або аденокарциноми передміхурової залози; раку головного мозку, такого як астроцитома та гліобластома; раку шийки матки та раку сечового міхура.
6. Спосіб одержання сполуки за п. 1, який включає:
1) відокремлення квітів рослини Calendula officinalis,
2) одержання з них витяжки у такий спосіб:
a) очищення квітів від забруднень;
b) подрібнення квітів;
c) обробка подрібнених квітів лазерним випроміненням;
d) суспендування суміші, одержаної на стадії с), у воді;
e) мацерація суспензії, одержаної на стадії d);
f) відокремлення одержаної рідини
та 3) піддання рідини, що була одержана на стадії f), процесу виділення, що включає осадження метанолом, центрифугування та хроматографічне відокремлення за результатами біопроби.
7. Спосіб за п. 6, який відрізняється тим, що стадія 3) включає:
g) ліофілізацію рідини, що була одержана на стадії f);
h) осадження ліофілізованої речовини, що була одержана на стадії g), метанолом;
і) відокремлення твердої фази від рідкої фази;
j) осадження твердої фази, що була одержана на стадії і), метанолом з одержанням кінцевих концентрацій - 25 %, 50 % та 67 %;
k) розчинення у воді осадів, що були одержані на стадії j) з концентраціями 50 % та 67 %, центрифугування та здійснення хроматографічного відокремлення супернатанту;
l) ідентифікування активної фракції за допомогою біопроби;
m) здійснення другого хроматографічного відокремлення активної фракції;
n) ідентифікування активної фракції за допомогою біопроби;
о) видалення елюенту.
8. Спосіб за п. 6 або 7, який відрізняється тим, що обробку лазерним випроміненням здійснюють за допомогою червоного лінійного лазерного діода, що генерує монохромне випромінення з довжиною хвилі у діапазоні 150-810 нм, потужністю 1-60 Вт та діаметром плями 1-6 мм.
9. Спосіб за п. 8, який відрізняється тим, що довжина хвилі знаходиться у діапазоні 200-400 нм, за варіантом, якому віддається перевага, 250 нм, потужність дорівнює 20 Вт і діаметр плями дорівнює 4 мм.
10. Спосіб за будь-яким пп. 6-9, який відрізняється тим, що кожен кілограм подрібненої речовини обробляють лазерним випроміненням впродовж 3-10 хв, за варіантом, якому віддається перевага, впродовж 5 хв.
11. Застосування сполуки за п. 1 для виготовлення лікарського засобу.
12. Застосування за п. 11 для виготовлення лікарського засобу для лікування імуносупресорних захворювань.
13. Застосування за п. 12 для виготовлення лікарського засобу для лікування раку, туберкульозу, грипу, нежиті, алергій, червоного вовчака, псоріазу та СНІДу.
14. Застосування за п. 13 для виготовлення лікарського засобу для лікування раку печінки, раку легень, раку нирок, раку товстої кишки, раку молочної залози, раку передміхурової залози або аденокарциноми передміхурової залози; раку головного мозку, такого як астроцитома та гліобластома; раку шийки матки та раку сечового міхура.
15. Фармацевтичний препарат, що містить сполуку за п. 1.
16. Фармацевтичний препарат за п. 15, що додатково містить фармацевтично прийнятний носій.
17. Фармацевтичний препарат за пп. 15 та 16, що додатково містить щонайменш ще одну іншу фармацевтично активну сполуку.
Текст
Цей винахід має відношення до полісахаридної сполуки формули І, що має імуностимулювальну активність, до способу її одержання, до її використання у лікуванні імуносупресорних захворювань та до фармацевтичних композицій, що її містять. Імунну систему можна визначити як сукупність молекул, клітин та органів, комплексна взаємодія яких утворює систему невідкладної допомоги, яка, у цілому, є здатною до забезпечення захисту індивіда як від чужорідних факторів, так і від своїх власних змінених клітин. Імунну систему можна розділити на дві функціонально різні частини: на ті елементи, які є вродженими, та на ті, які є набутими. Вроджений імунітет означає ті імунні елементи, які є неспецифічними та неадаптивними. Вони спроможні розрізнити чужорідні тканини/мікроорганізми, однак є нездатними до розпізнання конкретного чужорідного фактору. їх краще підрозділити на бар'єри (шкіра та слизові оболонки), неспецифічні хімічні агенти (ферменти, присутні у секретах слизової оболонки, хініни та гістаміни) та неспецифічні ефекторні клітини (макрофаги). Набутий імунітет означає елементи, які є специфічними та адаптивними. Вони здатні розрізнити чужорідні та власні клітини, і можуть відрізнити один чужорідний антиген від іншого. Набутий імунітет має пам'ять. Це забезпечує можливість імунізації та набуття стійкості до повторного інфікування тим же самим мікроорганізмом. Клітинами, які несуть відповідальність за набутий імунітет, є лімфоцити. Існує два підкласи лімфоцитів: В та Т-клітини. Набутий імунітет може з'явитись унаслідок природного інфікування або вакцинації (активний шлях) або введенням імунних клітин (пасивний шлях). У той час, як перший шлях забезпечує довгостроковий ефект і може бути навіть постійним, другий шлях забезпечує нетривалий результат. Пацієнтів, що страждають на імуносупресорні захворювання, лікують імуностимуляторами з метою активації їх імунної системи. З патентів США №№4801578, 5417979, WO 9851319 відомі різні імуностимулятори. З патентів DE 19817177 та ЕР 0225496 відомі полісахаридні імунні стимулятори. Ці патенти розкривають полісахаридні сполуки з імуностимулювальною активністю та їх одержання з культур рослинних клітин. Прикладами рослин, що використовуються з цією метою, є Echinacea purpurea, Echinacea angustifolia та Calendula officinalis. Однак жодна з цих імуностимулювальних сполук не забезпечує задовільного рівня активності для імуносупресорних захворювань. Таким чином, у цій галузі існує, потреба в альтернативних імунних стимуляторах, що виявляють виражену і широку активність. Цей винахід надає полісахаридну сполуку формули І з імуностимулювальною активністю, спосіб її одержання, її використання у лікуванні імуносупресорних захворювань та фармацевтичні композиції, що її включають. Один з аспектів цього винаходу має відношення до полісахаридної сполуки формули І де n= 7-8. Другий аспект цього винаходу має відношення до способу одержання полісахаридної сполуки формули І. Цей спосіб включає, по-перше, одержання водної витяжки з рослини Calendula officinalis у спосіб, що розкривається у нашій заявці і розглядається одночасно, по-друге, виділення полісахариду за допомогою комбінації методик відокремлення за результатами біопроби. Додатковий аспект цього винаходу відноситься до використання полісахаридної сполуки формули І за цим винаходом як терапевтичного засобу у лікуванні імуносупресорних захворювань, таких як рак, туберкульоз, грип, нежить, алергії, червоний вовчак, псоріаз та СНІД. Додатковий аспект цього винаходу має відношення до фармацевтичних композицій, що включають полісахаридну сполуку формули І. Ця заявка включає представлені фігури та таблиці: Фіг.1 - схема виділення PF2. Фіг.2 - схема виділення PF2R. Фіг.3 - спектр 1H-ЯМР PF2RS8A. Фіг.4 - спектр 13С-ЯМР PF2RS8A. Фіг.5 - тонкошарова хроматограма (TLC) гідролізатів PF2RS8A з трифтороцтовою кислотою та інших моноцукрів. Фіг.6 - схема виділення PF2RS8B2, тобто полісахариду формули І. Фіг.7 - профіль високоефективного рідинного хроматографування (HPLC) PF2RS8B2 під випарним світлорозсіювальним детектором. Фіг.8 - профіль HPLC PF2RS8B2 під фотодіодним УФ-детектором. Фіг.9 - спектр 1Н-ЯМР PF2RS8B2. У таблиці 1 представлено вплив зразків PF2RS8A та PF2RS8B2 на бластотрансформаційну активність лімфоцитів. Фіг.10 - спектр 13С-ЯМР PF2RS8B2, тобто полісахариду формули І. Фіг.11 - спектр DEPT-135 (невикривленого підсилення шляхом переносу поляризації) PF2RS8B2. Фіг.12 - спектр DEPT-90 PF2RS8B2. Фіг.13 - спектр HMQC (багатоквантовий ЯМР) PF2RS8B2. Фіг.14 - 1H-1H COSY (двомірна кореляційна спектроскопія) PF2RS8B2. Фіг.15 - спектр 1H-1 Η COSY PF2RS8B2. Фіг.16 - спектр HMQC PF2RS8B2. У таблиці 2 представлено спектр 13С-ЯМР PF2RS8B2. Фіг.17 - спектр НМВС PF2RS8B2. Фіг.18 - спектр НМВС PF2RS8B2. Фіг.19 - тонкошарова хроматограма гідролізатів PF2RS8B2 з трифтороцтовою кислотою та інших моноцукрів. Фіг.20 - схема визначення молекулярної маси. Як згадувалось вище, перший аспект цього винаходу має відношення до полісахаридної сполуки формули І: де n= 7-8. Конфігураційна структура сполуки формули І: де n= 7-8. Полісахаридна сполука має середню молекулярну масу приблизно 10000. Другий аспект цього винаходу відноситься до способу одержання полісахаридної сполуки формули І. Цей спосіб включає, по-перше, одержання водної витяжки з рослини Calendula officinalis у спосіб, що розкривається у нашій заявці і розглядається одночасно, названій "Спосіб одержання водних витяжок з рослин і витяжки, одержані у такий спосіб" та поданій одночасно з цією заявкою за №_________, та, по-друге, виділення полісахариду за допомогою комбінації методик відокремлення за результатами біопроби. Водну витяжку з Calendula officinalis одержують підданням квітів цієї рослини такому процесу: a) Очищення квітів від забруднень. b) Подрібнення квітів. c) Обробка подрібнених квітів лазерним випроміненням. d) Суспендування суміші, одержаної на стадії с), у воді, e) Мацерація суспензії, одержаної на стадії d). f) Відокремлення одержаної рідини. Очищення (стадія а) здійснюється промиванням квітів Calendula officinalis водою. Кількість води, що використовується на цій стадії, не визначається і може коливатись у залежності від стану забруднення рослини. Хоча вищі та нижчі температури не виключаються, температура води повинна бути у межах 10-40°С, за варіантом, якому віддається перевага, у межах 20-35°С, за варіантом, якому віддається найбільша перевага, вона повинна дорівнювати 28°С. Для полегшення цієї стадії може використовуватись тунельна мийна машина. Як кількість води, так і час перебування рослини у тунельній мийній машині не визначаються, і можуть, таким чином, коливатись у залежності від стану забруднення рослини. Промивка може здійснюватись декілька разів з просушуванням між промивками. Просушування за варіантом, якому віддається перевага, здійснюється розміщенням рослини під прямим сонячним промінням. Після ретельного очищення квітів їх подрібнюють (стадія b) традиційними способами, наприклад, за допомогою подрібнювальної машини або навіть вручну. Хоча вищі та нижчі температури не виключаються, температура, при якій подрібнюються квіти, повинна знаходитись у межах 10-40°С. Після цього подрібнені квіти піддають обробці лазерним випроміненням (стадія с). Як джерело лазерного випромінювання, за варіантом, якому віддається перевага, може використовуватись червоний лінійний лазерний діод зі здатністю до генерації монохромного проміння з довжиною хвиль у діапазоні 150-810нм. Довжина хвиль лазерного випромінювання за варіантом, якому віддається більша перевага, становить 200400нм, за варіантом, якому віддається найбільша перевага, вона дорівнює 250нм. Потужність лазерного випромінення за варіантом, якому віддається перевага, становить 1-60Вт, за варіантом, якому віддається більша перевага, 10-30Вт, та за варіантом, якому віддається найбільша перевага, 20Вт. Діаметр плями за варіантом, якому віддається перевага, становить 1-6мм, за варіантом, якому віддається більша перевага, в межах 2-5мм, та за варіантом, якому віддається найбільша перевага, він дорівнює 4мм. Подрібнену рослину піддають лазерному опроміненню таким чином, що опромінюється суміш у цілому або більша її частина. Це забезпечується або ручним переміщенням лазерного генератору над подрібненою рослиною або шляхом переміщення подрібненого матеріалу конвеєрною стрічкою через групу з декількох лазерних генераторів. За варіантом, якому віддається перевага, кожен кілограм подрібненої речовини обробляють лазерним випроміненням впродовж 3-10хв., за варіантом, якому віддається більша перевага, впродовж 5хв. Хоча вищі та нижчі температури не виключаються, температура, при якій подрібнена рослина піддається лазерному опроміненню, повинна знаходитись у межах 10-40°С. Далі оброблена лазером речовина суспендується у воді (стадія d). На цій стадії може використовуватись будь-яка комерційна мінеральна вода. Суспензію одержують таким чином, щоб кожен літр води містив 50300г, за варіантом, якому віддається перевага, 100-250г обробленої лазером речовини. Хоча вищі та нижчі температури не виключаються, температура, при якій подрібнена рослина суспендується у воді, повинна знаходитись у межах 10-40°С. Після цього суспензію витримують впродовж 5-20 діб, за варіантом, якому віддається перевага, 7-15 діб, при температурі 2-10°С, за варіантом, якому віддається перевага, 4-8°С, для того, щоб відбулась мацерація суміші (стадія e). І, нарешті, після стадії мацерації здійснюється відокремлення рідкої фази від твердої фази (стадія f). Для полегшення відокремлення тверду речовину можна пресувати. Відокремлення можна здійснювати тільки декантацією або, за варіантом, якому віддається перевага, декантацією з подальшою фільтрацією. Фільтрацію за варіантом, якому віддається перевага, здійснюють під тиском. За варіантом, якому віддається більша перевага, прес-фільтрацію послідовно здійснюють тричі на фільтрах з діаметром пор 5мкм, 1мкм та 0,22мкм. Хоча вищі та нижчі температури не виключаються, температура, при якій здійснюється відокремлення, повинна знаходитись у межах 10-40°С. Остаточно одержують водну витяжку жовтого кольору. Витяжку, що одержали таким чином, далі піддають процесу виділення, що включає осадження метанолом, центрифугування та хроматографічне відокремлення за результатами біопроби. Біопробу, що застосовувалась, здійснювали in vitro додаванням зразків до лімфоцитів, виділених від мишей за методикою, опис якої наведено у літературному джерелі Макс В. (Max W.) et al., Journal of Natural Products, vol. 54, №6, 1531-1542 (1991). Спостерігали за включенням тимідину, що свідчить про реплікацію ДНК. Це включення вказує як на зростання кількості лімфоцитів, так і на підвищення активності лімфоцитів. Застосовані способи відокремлення включають повторне осадження етанолом, центрифугування, діаліз та/або хроматографування на колонках. Таким чином, попередньо одержані 112л водної витяжки ліофілізували з одержанням 800г порошку жовтобрунатного кольору ("PF2"). Цей порошок фракціонували на МеОН-розчинний та МеОН-нерозчинний залишок (PF2R, 350г), який проявляв бластотрансформаційну активність лімфоцитів. Частину (80г) цього матеріалу піддавали осадженню за допомогою МеОН, центрифугуванню, діалізу та/або хроматографуванню на колонках (DEAE-сефадекс) із виділенням ряду кристалічних речовин, які виявились неактивними неорганічними солями (Фіг.1). Порцію (270г) PF2R піддали осадженню за допомогою МеОН з одержанням активних осадів із кінцевими концентраціями 25%, 50% та 67%. Найактивнішим матеріалом був осад, що одержали з 50% розчину МеОН (PF2RS8, 51,2г, LT (бластотрансформаційна активність лімфоцитів)=+1059%). Порцію 5г PF2RS8 розчиняли у воді, піддавали центрифугуванню та хроматографічному відокремленню супернатанту на колонці із сефадексом G-25 з одержанням активної, збагаченої полісахаридом фракції, яку позначили як PF2RS8A (0,13г, LT=+1074%). Після цього, із другої порції (6г) 50% осаду МеОН одержали ідентичну фракцію, яка була позначена PF2RS8' (0,3г). Як показано на Фіг.2, виділили ряд інших фракцій та кристалічних речовин, жодна з яких, однак, не виявила рівня бластотрансформаційної активності лімфоцитів, показаного PF2RS8A. Характеристики PF2RS8A визначали спектроскопічним (спектри 1H-ЯМР, 13С-ЯМР та DEPT) та хімічним аналізом (гідроліз трифтороцтовою кислотою та аналіз тонкошаровим хроматографуванням на силікагелі). Дивись Фіг.3, Фіг.4, Фіг.5. Більш активну суміш полісахаридів PF2RS8A (1,4г) виділили із залишкової частини 50% осаду МеОН (PF2RS8). Одночасно з цим, обробкою порції (2,0г) 67% МеОН-нерозчинної фракції (PF2RS9; LT=+735%), виділили суміш полісахаридів (PF2RS9A, 0,3г), яка, за результатом 1H-ЯМР аналізу, була ідентичною PF2RS8A. Таким чином, PF2RS9A (0,2г) об'єднували з PF2RS8A (1,4г), і цю суміш, позначену як "PF2S8B", піддавали додатковому відокремленню на колонках із сефадексом G-50 (20-80мм), як показано на Фіг.6. Після елюювання водою одержали шість фракцій (PF2RS8B1, 2, 3, 4, 5 та 6). За результатами аналізу засобами HPLC, гомогенним виявився лише головний ізолят PF2RS8B2 (як при випарному світлорозсіювальному детектуванні, так і при УФ-детектуванні) (Фіг.7 та Фіг.8). 1 Hта 13С-ЯМР спектральний аналіз (Фіг.9 та Фіг.10) показав, що спектри цього ізоляту були дуже схожими на спектри, що були одержані для PF2RS8A (Фіг.3та Фіг.4), що вказує на те, що він є головним полісахаридом згаданої суміші. Таким чином, фракція PF2RS8B2 складається з полісахариду формули І та води. Вода може бути видалена способами, відомими у цій галузі техніки. Одночасна біопроба гомогенного ізоляту PF2RS8B2 та його вихідної суміші PF2RS8A показала бластотрансформаційну активність лімфоцитів (LT) 6203% та 3532%, відповідно (Таблиця 1). Більш високий рівень активності, що демонструвався ізолятом, дозволяє зробити припущення, що цей полісахарид є головною активною складовою біологічного ефекту цієї витяжки. Активний полісахарид PF2RS8B2 (полісахарид формули І) виявили спектроскопічним (спектри 1H-, 13СЯМР, HMQC та 2D 1H-1 H COSY) та хімічним аналізом (гідроліз трифтороцтовою кислотою та аналіз шляхом тонкошарового хроматографування на силікагелі). Так, 1H-ЯМР сигнали (Фіг.9) при δ 5,3млн-1 та 3,2млн-1 вказують на полісахарид. 13С-ЯМР сигнали (Фіг.10-12) при δ 111,9 (дублет) млн. -1, 110,1 (дублет) млн. -1 були віднесені до аномерних атомів вуглецю сполученої (1®3) зв'язком a-L-арабінофуранози та кінцевої a-Lарабінофуранози (позначених Araf та Araf, відповідно). Сигнали при δ 106,1 (дублет) млн.-1 та 105,9 (дублет) млн. -1 були віднесені до аномерних атомів вуглецю сполученої (1®6) зв'язком b-D-галактопіранози та сполученої (1®3), (1®6) зв'язком b-D-галактопіранози (позначених Galp' та Galp відповідно), у той час як сигнал при δ 100,2 (дублет) млн-1 було віднесено до аномерних атомів вуглецю a-L-рамнопіранози (позначеної Rhap). Сигнали аномерних протонів (Н-1) також легко розпізнавались завдяки їхньому відносно невеликому зсуву у бік слабкого поля у 1H-ЯМР спектрі. Шляхом прямої кореляції між сигналами протонів та вуглецю-13, що спостерігались у спектрі HMQC (Фіг.13), встановили, що 1H-ЯМР сигнали δ 5,08 (широкий синглет) млн.-1, 5,23 (широкий синглет) млн.-1, 4,47 (дублет, J=7,9Гц) млн.-1, 4,53 (дублет, J=7,3Гц) млн.-1 та 5,1 (широкий синглет) млн.-1 належали аномерним протонам a-L-арабінофуранози (Araf), a-L-арабінофуранози (Araf), b-Dгалактопіранози (Galp'), b-D-галактопіранози (Galp) та a-L-рамнопіранози (Rhap). У разі використання цих сигналів як еталону, інші сигнали протонів можна виявити шляхом аналізування спектрів 2D 1Н-1Н COSY (Фіг.14, Фіг.15). Подібним же чином, відповідні сигнали вуглецю були визначені за спектрами HMQC (Фіг.13, Фіг.16 та Таблиця 2). Послідовність цукрових одиниць була встановлена таким чином. Зсув у бік слабкого поля сигналу на С-3 Araf (δ 79,4) та Galp (δ 82,8) та сигналів на С-6 Galp та Galp' (δ 69,2) дозволив зробити припущення про те, що ці атоми вуглецю належали іншим цукровим одиницям. Спостереження кореляції на великому інтервалі між С-1 Araf та С-6 Galp та Galp' у спектрі НМВС (Фіг.17) дозволило зробити припущення про сполучений (1®6) зв'язком остів b-D-галактопіранози. За результатами спостереження кореляції на великому інтервалі між С-1 Araf та С-3 Galp було встановлено, що Araf була сполучена (1®3) зв'язком із Galp (Фіг.18). За 1Н-ЯМР спектром (Фіг.9) обчислили, що співвідношення цукрів відповідно до інтеграційних значень піків аномерних протонів мало такий вигляд: Araf:Araf:Galp:Galp':Rhap/3:1:2:2:1. Таким чином встановили, що PF2RS8B2 представляв собою полісахарид із довгим розгалуженим ланцюгом, первинна структура якого показана формулою І (Схема І). На Схемі II представлена та сама структура зі стереохімічною конфігурацією окремих цукрів. Для підтвердження природи складових цукрів, PF2RS8B2 гідролізували трифтороцтовою кислотою (0,5М, температура 100-120°С) із подальшим тонкошаровим хроматографічним аналізом (Фіг.19). Легко встановили присутність головних цукрів a-L-арабінофуранози та b-D-галактопіранози, у той час як присутність другорядного цукру, a-L-арабінофуранози, була встановлена з більшими труднощами, можливо, унаслідок кількості гідролізату, яку було нанесено на хроматографічну пластину. Молекулярну масу PF2RS8B2 встановили засобами гельпроникного (ексклюзійного ситового) хроматографування. Визначена таким чином середня молекулярна маса PF2RS8B2 становила 10000 (дивись Фіг.20). Полісахаридна сполука формули І несподівано виявила дуже високу активність як імуностимулятор, що відображено у подальшому прикладі. Таким чином, третій аспект цього винаходу має відношення до використання полісахаридної сполуки формули складу І як терапевтичного засобу у лікуванні імуносупресорних захворювань, таких як рак, туберкульоз, грип, нежить, алергії, червоний вовчак, псоріаз та СНІД. Необмежувальними прикладами раків є рак печінки, рак легень, рак нирок, рак товстої кишки, рак молочної залози, рак передміхурової залози або аденокарцинома передміхурової залози; рак головного мозку, такий як астроцитома та гліобластома; рак шийки матки та рак сечового міхура. Четвертий аспект цього винаходу має відношення до фармацевтичних композицій, що містять полісахаридну сполуку формули І. Полісахарид за цим винаходом може вводитись окремо у вигляді чистої речовини або у формі фармацевтичних препаратів, хоча сполуку за цим винаходом, за варіантом, якому віддається перевага, вводять у комбінації. Терапевтичною комбінацією за варіантом, якому віддається перевага, є лікарський засіб, що (1) містить лише полісахарид за цим винаходом; (2) містить одну або декілька відповідних зв'язувальних речовин, носіїв та/або додаткові матеріали та (3) може крім того включати додаткові терапевтично активні речовини. Носії, зв'язувальні речовини та/або допоміжні матеріали повинні бути фармацевтично та фармакологічно стерпними для того, щоб вони могли комбінуватись з іншими складовими композиції або препарату і не справляти несприятливих впливів на організм, що піддається лікуванню. До згаданих композицій належать композиції, придатні для перорального або парентерального (у тому числі підшкірного, внутрішньошкірного, внутрішньом'язового та внутрішньовенного) уведення, хоча найкращий шлях уведення залежить від стану пацієнта. Згадані композиції можуть бути у формі разових доз. Композиції одержують за способами, відомими у фармакології. Відповідні кількості активних речовин, придатні для введення, можуть коливатись як функція конкретного виду лікування. Взагалі, концентрація активної речовини у однодозовій композиції може становити від 5% до 95% від загальної маси композиції. Винахід, що надається цією заявкою, ілюструється прикладами, наведеними нижче. Приклад 1. Одержання водної витяжки із квітів Calendula officinalis способом за цим винаходом. 500г квітів Calendula officinalis вносять до тунельної мийної машини і піддають ретельній мийці водою при температурі приблизно 28°С. Після цього квіти подрібнюють за допомогою подрібнювальної машини. Потім 500г подрібненої речовини піддають обробці за допомогою червоного лінійного лазерного діода зі здатністю до генерації монохромного випромінення з довжиною хвилі 250нм, потужністю 20Вт та діаметром плями 4мм. Обробка здійснюється ручним переміщенням лазерного генератору над подрібненою речовиною впродовж 2,5хв, завдяки чому опромінюється суміш у цілому або більша її частина. Після цього оброблену лазером речовину суспендують у 2л води при температурі приблизно 20°С. Далі суспензію витримують впродовж 12 діб при температурі 4°С. І, нарешті, здійснюють відокремлення рідкої та твердої фаз, спочатку декантацією рідини (тверду речовину пресують для полегшення відокремлення), після чого трьома послідовними пресфільтраціями через фільтри з діаметром пор 5мкм, 1мкм та 0,22мкм при температурі приблизно 20°С. Цей процес дає приблизно 1,7л розчину (водної витяжки) жовтого кольору. Приклад 2. Виділення полісахариду формули І здійснюють, як розкривається на стор.7-8 опису. Приклад 3. Полісахарид формули І піддавали випробуванню з метою встановлення його активності як імуностимулятора шляхом кількісного визначення бластотрансформаційної активності лімфоцитів (LTA). Під бластотрансформаційною активністю лімфоцитів розуміють той факт, що лімфоцити переходять зі стану спокою до активного стану, який є необхідним для подолання хвороб через посередництво імунологічного механізму або для відновлення імунної системи, яка може бути послаблена різними факторами. Це випробування здійснювали за методикою, опис якої наведено у літературному джерелі Max W. et al, Journal of Natural Products, vol.54, №6, 1531-1542 (1991), додаванням in vitro розчину полісахариду за цим винаходом до лімфоцитів, які були виділені від мишей. Спостерігали за включенням тимідину, що свідчить про реплікацію ДНК. Це включення вказує як на зростання кількості лімфоцитів, так і на підвищення активності лімфоцитів. Відносно нестимульованих лімфоцитів полісахарид формули І виявив бластотрансформаційну активність +6203%. Таблиця 1 Вплив зразків PF2RS8A та PF2RS8B2 на бластотрансформаційну активність лімфоцитів (мишачі мононуклеарні клітини селезінки, самиці) Зразок Концентрація сполуки 0 0,01 0,1 1 10 100 Конканавалін А 8мг/мл Без конканаваліну А Без конканаваліну А PF2RS8B2 PF2RS8A Mean±S.D. 165±31 311±41 371±51 556±26 3829±380 5993±1760 1762±349 % Mean±S.D. % 0 +91 +127 +237 +2220 +3532 197±51 205±49 361±76 649±148 2348±305 12417±3153 1507±250 0 +24 +83 +229 +1092 +6203 MeaniS.D. - середнє значення ± середнє квадратичне відхилення Mean±S.D. % Mean±S.D. %
ДивитисяДодаткова інформація
Назва патенту англійськоюA polysaccharide compound presenting immune stimulating activity, a process for its preparation, use and a pharmaceutical preparation based thereon
Назва патенту російськоюПолисахаридное соединение с иммуностимулирующей активностью, способ его получения, применение и фармацевтический препарат на его основе
МПК / Мітки
МПК: A61K 36/28, C08B 37/00
Мітки: одержання, застосування, активністю, основі, полісахаридна, фармацевтичний, препарат, імуностимулювальною, спосіб, сполука
Код посилання
<a href="https://ua.patents.su/21-74406-polisakharidna-spoluka-z-imunostimulyuvalnoyu-aktivnistyu-sposib-oderzhannya-zastosuvannya-ta-farmacevtichnijj-preparat-na-osnovi.html" target="_blank" rel="follow" title="База патентів України">Полісахаридна сполука з імуностимулювальною активністю, спосіб її одержання, застосування та фармацевтичний препарат на її основі</a>
Попередній патент: Каркас для пристрою відображення інформації з принаймні однією поверхнею відображення
Наступний патент: Сполуки спіропіразолу
Випадковий патент: Машина тертя












