Кристалічні форми 1-бензоїл-4-[2-[4-метокси-7-(3-метил-1н-1,2,4-триазол-1-іл)-1-[(фосфонокси)метил]-1н-пірол[2,3-с]піридин-3-іл]-1,2-діоксоетил]піперазину
Номер патенту: 94928
Опубліковано: 25.06.2011
Автори: Левонс Йакван Калані, Діджіугно Дон, Чен Чанг-Пін Х., Янг Бінг-шіу, Гао Кі, Гу Чонг-Хьюі
Формула / Реферат
1. Кристалічна форма сполуки (І):
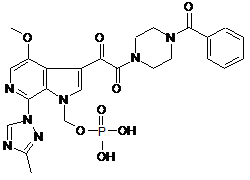 ,
,
яка містить форму 01-Н2-1, що являє собою дигідрат, який має емпіричну формулу C25H26N7O8P1·2Н2О.
2. Кристалічна форма за п. 1, яка відрізняється тим, що її параметри елементарної комірки є такими:
просторова група
моноклінна, Р2(1)/с
розміри елементарної комірки
а=17,2174(18)Å
a=90°
b=18,1242(19)Å
b=105,191(4)°
с=9,3705(9)Å
g=90°
кількість молекул/елем. комірку
4,
де зазначена кристалічна форма є при температурі від 20 °С до 25 °С.
3. Кристалічна форма за п. 1, яка відрізняється тим, що її дробові атомні координати є такими:
X
Y
Z
U (екв.)
P(1)
8692(3)
2452(3)
886(5)
58(2)
O(1)
7863(7)
2046(8)
691(11)
85(4)
О(2)
9208(6)
2345(5)
2464(10)
74(3)
О(3)
9134(6)
2119(5)
-166(11)
85(4)
О(4)
8450(6)
3230(6)
438(9)
73(3)
О(5)
4159(9)
1141(5)
590(10)
57(3)
О(6)
5716(9)
2151(6)
4721(15)
81(5)
О(7)
4141(9)
2605(7)
2202(13)
82(5)
О(8)
2990(8)
-173(7)
6428(13)
82(5)
N(1)
6889(16)
1504(10)
1580(30)
55(6)
N(2)
5481(18)
686(7)
-1765(18)
62(6)
N(3)
6844(14)
911(12)
-1530(30)
50(4)
N(4)
7493(18)
443(9)
-982(15)
59(5)
N(5)
7666(15)
1106(13)
-2890(20)
57(6)
N(6)
3989(13)
1677(11)
3686(18)
62(5)
N(7)
2982(11)
670(9)
4620(20)
61(5)
С(1)
6560(20)
1757(8)
2710(20)
49(6)
С(2)
6280(20)
1218(13)
520(50)
54(11)
С(3)
6160(20)
942(11)
-950(30)
58(8)
С(4)
4815(13)
753(9)
-1190(30)
54(6)
С(5)
4880(20)
1092(11)
190(30)
56(8)
С(6)
5580(20)
1328(11)
1000(40)
64(13)
С(7)
5780(20)
1689(10)
2440(30)
49(8)
С(8)
7729(15)
1491(9)
1654(17)
61(6)
С(9)
6967(18)
1280(10)
-2670(30)
57(6)
C(10)
7994(15)
588(13)
-1820(40)
63(7)
С(11)
8805(12)
276(9)
-1620(20)
95(6)
С(12)
3391(11)
1028(9)
-411(18)
82(6)
С(13)
5320(20)
1956(9)
3520(30)
53(6)
С(14)
4470(20)
2089(14)
3030(20)
63(7)
С(15)
3197(13)
1884(8)
3658(16)
56(5)
С(16)
2626(10)
1235(11)
3533(16)
71(7)
С(17)
3762(14)
410(8)
4532(17)
63(5)
С(18)
4348(10)
1045(10)
4757(15)
57(5)
С(19)
2655(14)
360(13)
5690(30)
55(6)
C(20)
1920(20)
614(14)
5970(20)
80(10)
С(21)
1278(19)
186(12)
6130(20)
95(9)
С(22)
629(17)
530(20)
6570(30)
154(13)
С(23)
630(20)
1270(20)
6770(30)
153(12)
С(24)
1240(20)
1703(14)
6640(30)
124(11)
С(25)
1878(12)
1340(20)
6199(19)
96(10)
О(1W)
10482(16)
1379(15)
2580(30)
375(14)
О(2W)
11290(90)
1740(100)
410(180)
340(80)
4. Кристалічна форма за п. 1, яка відрізняється порошковою рентгенограмою, яка містить принаймні чотири величини 2q (СuКa λ=1,5418 Å), вибрані із сукупності, що складається із 5,3±0,2, 7,2±0,2, 9,7±0,2, 10,6±0,2, 10,9±0,2, 11,7±0,2, 13,2±0,2, 13,8±0,2, 14,5±0,2, 15,7±0,2, 17,0±0,2, 17,7±0,2, 18,2±0,2, 19,6±0,2 і 20,3±0,2, при температурі від 20 °С до 25 °С.
5. Кристалічна форма за п. 4, яка відрізняється також порошковою рентгенограмою, яка містить принаймні п'ять величин 2q (СuКa λ=1,5418 Å), вибраних із сукупності, що складається із 5,3±0,2, 7,2±0,2, 9,7±0,2, 10,6±0,2, 10,9±0,2, 11,7±0,2, 13,2±0,2, 13,8±0,2, 14,5±0,2, 15,7±0,2, 17,0±0,2, 17,7±0,2, 18,2±0,2, 19,6±0,2 і 20,3±0,2, при температурі від 20 °С до 25 °С.
6. Кристалічна форма за п. 1, яка відрізняється порошковою рентгенограмою (PXRD) при температурі від 20 °С до 25 °С, котра є однаковою з показаною на Фіг. 1.
7. Кристалічна форма за п. 1, яка відрізняється термограмою диференціальної сканувальної калориметрії (DSC), котра є однаковою з показаною на Фіг. 2.
8. Кристалічна форма за п. 1, яка відрізняється діаграмою термогравіметричного аналізу (TGA), котра є однаковою з показаною на Фіг. 2.
9. Кристалічна форма за п. 1 у монокристалічній формі.
10. Кристалічна форма сполуки (І):
 ,
,
яка містить форму 02-S А-1, що являє собою геміетанолатоктагідрат двоосновної солі натрію з емпіричною формулою C25H24N7O8P1Na2·8Н2О·0,5С2Н5ОН.
11. Кристалічна форма за п. 10, яка відрізняється тим, що її параметри елементарної комірки є такими:
розміри комірки
а=6,4392(12)Å
a=99,082(11)°
b=13,349(2)Å
b=95,975(12)°
с=21,041(4)Å
g=90,207(12)°
просторова група
триклінна, Р-1
кількість молекул/елем. комірку
2,
де зазначена кристалічна форма є при температурі від 163 K до 183 K.
12. Кристалічна форма за п. 10, яка відрізняється тим, що її атомні координати є такими:
X
У
Z
U (екв.)
Р(1)
-4237(3)
7620(2)
623(1)
16(1)
О(1)
-4989(9)
8163(4)
1326(3)
25(1)
О(2)
-5171(8)
6554(4)
520(3)
22(1)
О(3)
-5197(8)
8294(4)
166(3)
22(1)
О(4)
-1871(8)
7657(4)
690(3)
25(1)
О(5)
2971(9)
6724(5)
3257 (3)
37(2)
О(6)
-443(9)
4328(5)
1972(3)
34(2)
О(7)
-623(10)
5024(5)
3498(3)
34(2)
О(8)
8772(10)
2512(5)
2958(3)
40(2)
N(1)
-3283(10)
7198(5)
2088(3)
22(2)
N(2)
83(11)
9077(6)
3216(4)
33(2)
N(3)
-2903(11)
9486(5)
2603(4)
25(2)
N(4)
-4611(12)
9754(5)
2928(4)
31(2)
N(5)
-4533(12)
10601(5)
2080(4)
31(2)
N(6)
2561(12)
4517(6)
3211(4)
34(2)
N(7)
5741(12)
3115(6)
3293(4)
32(2)
C(1)
-2782(13)
6193(6)
1988(4)
25(2)
С(2)
-1727(12)
7723(6)
2524(4)
21(2)
С(3)
-1474(13)
8732 (6)
2781(4)
25(2)
С(4)
1524(14)
8414(7)
3380(5)
33(2)
С(5)
1479(14)
7403(7)
3130(5)
29(2)
С(6)
-279(12)
7022(6)
2704(4)
24(2)
С(7)
-951(13)
6043(6)
2361(4)
24(2)
С(8)
-5253(12)
7582(6)
1812(4)
22(2)
С(9)
-2903(13)
10008(6)
2114(4)
25(2)
С(10)
-5520(14)
10418(7)
2588(4)
27(2)
С(11)
-7555(15)
10885(7)
2743(5)
39(3)
С(12)
4739(15)
7096(8)
3710(6)
44(3)
С(13)
-149(13)
5019(7)
2410(5)
27(2)
С(14)
656(14)
4851(7)
3085(5)
29(2)
С(15)
3338(15)
4299(7)
3846(5)
36(2)
С(16)
4190(14)
3229 (8)
3772(5)
36(2)
С(17)
4981(14)
3376(7)
2664(5)
32(2)
С(18)
4121(14)
4434(7)
2745(5)
31(2)
С(19)
7652 (14)
2726(7)
3400(5)
33(2)
С(20)
8481(14)
2595(7)
4058(5)
32(2)
С(21)
8767(16)
3406(8)
4583(5)
39(2)
С(22)
9755(17)
3241(10)
5166(6)
54(3)
С(23)
10388(18)
2291(11)
5258(6)
59(4)
С(24)
10121(18)
1497(10)
4760(6)
54(3)
С(25)
9200(16)
1651(8)
4168(6)
42(3)
Na(1)
-27(5)
4278(2)
751(2)
32(1)
Na(2)
584(5)
824(2)
799(2)
27(1)
О(1W)
-582(9)
2420(4)
342(3)
30(2)
О(2W)
702(10)
5950(5)
649(4)
41(2)
О(3W)
3223(10)
3816(5)
1156(3)
33(2)
О(4W)
-3536(9)
4645(4)
623(3)
27(1)
О(5W)
-2364(9)
19(4)
135(3)
26(1)
О(6W)
929(9)
-739(4)
1222(3)
30(2)
О(7W)
3859(9)
1718(4)
1081(3)
29(1)
О(8W)
-868(11)
1918(5)
1629(4)
40(2)
О(101)
-3944
9520
4308
48
С(101)
-4921
10189
4691
79
С(102)
-5079
9811
5309
79
13. Кристалічна форма за п. 10, яка відрізняється порошковою рентгенограмою (PXRD), котра містить принаймні чотири величини 2q (СuКa λ=1,5418 Å), вибрані із сукупності, що складається із 4,3±0,2, 6,7±0,2, 7,4±0,2, 8,5±0,2,10,0±0,2, 11,8±0,2, 12,9±0,2, 13,5±0,2, 14,1±0,2, 14,8±0,2, 15,5±0,2, 16,0±0,2, 16,5±0,2, 17,1±0,2, 18,5±0,2, при температурі від 163 K до 183 K.
14. Кристалічна форма за п. 13, яка відрізняється порошковою рентгенограмою (PXRD), котра містить принаймні п'ять величин 2q (СuКa λ=1,5418 Å), вибраних із сукупності, що складається із 4,3±0,2, 6,7±0,2, 7,4±0,2, 8,5±0,2, 10,0±0,2, 11,8±0,2, 12,9±0,2, 13,5±0,2, 14,1±0,2, 14,8±0,2, 15,5±0,2, 16,0±0,2, 16,5±0,2, 17,1±0,2, 18,5±0,2, при температурі від 163 K до 183 K.
15. Кристалічна форма за п. 10, яка відрізняється порошковою рентгенограмою (PXRD), котра при температурі від 20 °С до 25 °С є однаковою з показаною на Фіг. 4.
16. Кристалічна форма за п. 10 у монокристалічній формі.
17. Кристалічна форма сполуки (І):
 ,
,
яка містить форму 03-Е.5-1, яка являє собою геміетанолат солі моно-трис з емпіричною формулою C25H26N7O8P1×С4Н11N1О3×0,5С2Н5ОН.
18. Кристалічна форма за п. 17, яка відрізняється тим, що її параметри елементарної комірки є такими:
розміри комірки
а=35,594(2)Å
a=90°
b=6,2790(4)Å
b=97,080(3)°
с=30,6961(19)Å
g=90°
просторова група
моноклінна, С2/с
кількість молекул/елем. комірку
8,
де зазначена кристалічна форма є при температурі від 20 °С до 25 °С.
19. Кристалічна форма за п. 17, яка відрізняється тим, що атомні координати є такими:
X
У
Z
U (екв.)
Р(1)
2596(1)
6394(2)
2987(1)
40(1)
О(1)|
2976(1)
7325(4)
2829( 1)
44(1)
О(2)
2545(1)
7326(4)
3424(1)
49(1)
О(3)
2295(1)
6805(4)
2618(1)
49(1)
О(4)
2670(1)
3962 (4)
3055(1)
49(1)
О(5)
4192(1)
1209(5)
4004(1)
54(1)
О(6)
3534(1)
5503(5)
4738(1)
65(1)
О(7)
4409(1)
5226(5)
4729(1)
61(1)
О(8)
3768(1)
-3613 (6)
5844(1)
96(1)
N(1)
3483(1)
6854(5)
3404(1)
38(1)
N(2)
3986(1)
2708(6)
2844(1)
52(1)
N(3)
3667(1)
5526(6)
2482(1)
43(1)
N(4)
3842(1)
7331(7)
2362(1)
59(1)
N(5)
3364(1)
6428(7)
1848(1)
56(1)
N(6)
4143(1)
2180(6)
4952(1)
45(1)
N(7)
4070(1)
-758(6)
5621(1)
46(1)
С(1)
3483(1)
6826(6)
3842(1)
38(1)
С(2)
3703(1)
5168(7)
3281(1)
36(1)
С(3)
3787(1)
4441(8)
2880(1)
41(1)
С(4)
4121(1)
1637(7)
3212(2)
51(1)
С(5)
4061(1)
2252(7)
3627(2)
41(1)
С(6)
3847(1)
4108(7)
3670(1)
36(1)
С(7)
3705(1)
5188(7)
4030(1)
37(1)
С(8)
3262(1)
8359(7)
3107(1)
46(1)
С(9)
3383(1)
5037(8)
2172(2)
52(1)
C(10)
3645(1)
7796(8)
1981(2)
58(1)
С(11)
3740(2)
9697(9)
1724(2)
115(2)
С(12)
4433(1)
-573(7)
3969(2)
63(2)
С(13)
3761(1)
4840(7)
4507(2)
43(1)
С(14)
4140(1)
4025(8)
4732(1)
45(1)
С(15)
4480(1)
1450(7)
5226(1)
49(1)
С(16)
4374(1)
812(7)
5670(1)
49(1)
С(17)
3733(1)
-2(7)
5348(2)
59(1)
С(18)
3834(1)
626(7)
4904(2)
55(1)
С(19)
4062(2)
-2603(9)
5839(2)
53(1)
С(20)
4418(1)
-3458(7)
6084(2)
44(1)
С(21)
4741(1)
-3755(7)
5886(2)
51(1)
С(22)
5054(2)
-4692(8)
6112(2)
65(2)
С(23)
5052(2)
-5317(8)
6535(2)
76(2)
С(24)
4730(2)
-5082(8)
6736(2)
83(2)
С(25)
4410(2)
-4182(8)
6508(2)
66(2)
N(101)
2345(1)
1293(6)
3682(1)
44(1)
С(100)
2381(1)
1642(7)
4167(1)
40(1)
C(101)
2762(1)
720(7)
4368(2)
55(1)
О(101)
3063(1)
1335(6)
4132(1)
65(1)
С(102)
2353(1)
4024(7)
4246(1)
57(1)
О(102)
2678(1)
5114(5)
4152(1)
67(1)
С(103)
2058(2)
516(8)
4341(2)
73(2)
О(10A)
1756(3)
1422(14)
4227(3)
75(3)
O(10B)
2000(3)
-1430(20)
4230(4)
92(4)
О(10С)
2038(3)
504(16)
4742(4)
59(3)
О(201)
4628(2)
8300(11)
2632(2)
79(2)
О(201)
4808(10)
10130(30)
2382(19)
125(11)
О(202)
5201(10)
10250(30)
2474(18)
125(11)
20. Кристалічна форма за п. 17, яка відрізняється порошковою рентгенограмою (PXRD), котра містить принаймні чотири величини 2q (СuКa λ=1,5418Å), вибрані із сукупності, що складається із 5,0±0,2, 5,8±0,2, 7,2±0,2, 8,1±0,2, 10,0±0,2, 11,0±0,2, 11,6±0,2, 12,0±0,2, 13,2±0,2, 16,1±0,2, 17,0±0,2, 17,5±0,2, 19,0±0,2, 20,4±0,2, 21,1±0,2, при температурі від 20 °С до 25 °С.
21. Кристалічна форма за п. 20, яка відрізняється також порошковою рентгенограмою (PXRD), котра містить принаймні п'ять величин 2q (СuКa λ=1,5418Å), вибраних із сукупності, що складається із 5,0±0,2, 5,8±0,2, 7,2±0,2, 8,1±0,2, 10,0±0,2, 11,0±0,2, 11,6±0,2, 12,0±0,2, 13,2±0,2, 16,1±0,2, 17,0±0,2, 17,5±0,2, 19,0±0,2, 20,4±0,2, 21,1 ±0,2, при температурі від 20 °С до 25 °С.
22. Кристалічна форма за п. 17, яка відрізняється порошковою рентгенограмою (PXRD), котра при температурі від 20 °С до 25 °С є однаковою з показаною на Фіг. 6.
23. Кристалічна форма за п. 17, яка відрізняється термограмою диференціальної сканувальної калориметрії (DSC), котра є однаковою з показаною на Фіг. 7.
24. Кристалічна форма за п. 17, яка відрізняється діаграмою термогравіметричного аналізу (TGA), котра є однаковою з показаною на Фіг. 7.
25. Кристалічна форма за п. 17 у монокристалічній формі.
26. Кристалічна форма сполуки (І):
 ,
,
яка містить форму 03-SA-2, яка являє собою геміацетонат-гемігідрат солі моно-трис з емпіричною формулою C25H26N7O8P1×С4Н11N1О3×0,5H2O×0,5С3Н6О.
27. Кристалічна форма за п. 26, яка відрізняється тим, що її параметри елементарної комірки є такими:
розміри комірки
а=43,985(2)Å
a=90°
b=6,3142(3)Å
b=125,742(4)°
с=30,2438(17)Å
g=90°
просторова група
моноклінна, С2/с
кількість молекул/елем. комірку
8,
де зазначена кристалічна форма є при температурі від 20 °С до 25 °С.
28. Кристалічна форма за п. 26, яка відрізняється тим, що її атомні координати є такими:
X
Y
Z
U (екв.)
P(1)
2400(1)
-1012(2)
2897(1)
45(1)
О(1)
2024(1)
-1939(5)
2360(1)
49(1)
О(2)
2448(1)
-1930(5)
3390(1)
54(1)
О(3)
2702(1)
-1428(5)
2826(1)
53(1)
О(4)
2324(1)
1394(5)
2883(1)
53(1)
О(5)
826(1)
4216(6)
2334(2)
61(1)
О(6)
1425(1)
-139(7)
3709(2)
78(1)
О(7)
567(1)
349(7)
2788(2)
80(1)
О(8)
1221(1)
8772(9)
4661(2)
108(2)
N(1)
1519(1)
-1468(6)
2434(2)
46(1)
N(2)
1038(1)
2675(7)
1370(2)
55(1)
N(3)
1357(1)
-156(7)
1330(2)
49(1)
N(4)
1192(1)
-2003(8)
1064(2)
64(1)
N(5)
1659(1)
-1090(8)
996(2)
61(1)
N(6)
842(1)
3250(7)
3322(2)
56(1)
N(7)
909(1)
6073(7)
4090(2)
55(1)
С(1)
1507(1)
-1409(8)
2876(2)
48(1)
С(2)
1306(1)
222(8)
2098(2)
45(1)
С(3)
1232(1)
939(8)
1609(2)
46(1)
С(4)
910(2)
3798(9)
1614(2)
58(1)
С(5)
956(1)
3162(8)
2084(2)
48(1)
С(6)
1160(1)
1313(8)
2339(2)
43(1)
С(7)
1286(1)
216(8)
2836(2)
45(1)
С(8)
1740(2)
-2980(8)
2365(2)
49(1)
С(9)
1633(2)
333(9)
1288(2)
54(1)
С(10)
1385(2)
-2495(10)
869(2)
64(2)
С(11)
1306(3)
-4438(12)
534(4)
113(3)
С(12)
582(2)
6006(9)
2048(2)
67(2)
С(13)
1213(2)
567(8)
3248(2)
56(2)
С(14)
843(2)
1470(9)
3088(2)
55(1)
С(15)
505(2)
4004(9)
3261(2)
58(1)
С(16)
599 (2)
4552(8)
3812(2)
56(1)
С(17)
1247(2)
5284(10)
4157(2)
66(2)
С(18)
1160(2)
4730(9)
3614(3)
66(2)
С(19)
923(2)
7838(10)
4344(2)
62(2)
С(20)
575(2)
8704(9)
4248(2)
61(2)
С(21)
269(2)
9248(10)
3739(3)
69(2)
C(22)
-38(2)
10196(11)
3670(3)
89(2)
С(23)
-38(3)
10616(17)
4102(5)
138(4)
С(24)
271(4)
10150(20)
4619(4)
186(6)
С(25)
580(3)
9187(16)
4693(3)
124(3)
C(100)
2600(1)
3753(7)
4292(2)
45(1)
N(101)
2642(1)
4084(6)
3838(2)
45(1)
С(101)
2226(2)
4698(9)
4112(2)
57(2)
О(101)
1928(1)
4131(8)
3578(2)
66(1)
С(102)
2612(2)
1344(9)
4382 (2)
60(2)
О(102)
2286(1)
338(6)
3960(2)
70(1)
С(103)
2924(2)
4818(10)
4795(3)
75(2)
О(103)
3003(3)
6699(15)
4729(4)
79(2)
О(1A3)
3240(4)
3680(20)
5004(5)
69(4)
О(1В3)
2913(8)
5010(40)
5196(12)
93(7)
О(1W)
0
-1790(80)
2500
151(17)
О(201)
49(9)
5520(50)
705(14)
129(10)
С(201)
-372(16)
4640(90)
-100(20)
150(20)
С(202)
-23(16)
5270(70)
270(20)
111(14)
С(203)
229(17)
5170(90)
220(30)
140(20)
29. Кристалічна форма за п. 26, яка відрізняється порошковою рентгенограмою (PXRD), котра містить принаймні чотири величини 2q (СuКa λ=1,5418Å), вибрані із сукупності, що складається із 5,0±0,2, 7,2±0,2, 8,2±0,2, 9,9±0,2, 10,9±0,2, 11,8±0,2, 14,9±0,2, 15,4±0,2, 15,9±0,2, 16,7±0,2, 17,3±0,2, 17,7±0,2, 20,1±0,2, 20,6±0,2, 21,9±0,2, при температурі від 20 °С до 25 °С.
30. Кристалічна форма за п. 29, яка відрізняється також порошковою рентгенограмою (PXRD), котра містить принаймні п'ять величин 2q (СuКa λ=1,5418Å), вибраних із сукупності, що складається із 5,0±0,2, 7,2±0,2, 8,2±0,2, 9,9±0,2, 10,9±0,2, 11,8±0,2, 14,9±0,2, 15,4±0,2, 15,9±0,2, 16,7±0,2, 17,3±0,2, 17,7±0,2, 20,1±0,2, 20,6±0,2, 21,9±0,2, при температурі від 20 °С до 25 °С.
31. Кристалічна форма за п. 26, яка відрізняється порошковою рентгенограмою (PXRD), котра при температурі від 20 °С до 25 °С є однаковою з показаною на Фіг. 9.
32. Кристалічна форма за п. 26, яка відрізняється термограмою диференціальної сканувальної калориметрії (DSC), котра є однаковою з показаною на Фіг. 10.
33. Кристалічна форма за п. 26, яка відрізняється діаграмою термогравіметричного аналізу (TGA), котра є однаковою з показаною на Фіг. 10.
34. Кристалічна форма за п. 26 у монокристалічній формі.
35. Кристалічна форма сполуки (І):
 ,
,
яка включає у себе форму 03-DSA-2, яка являє собою сіль моно-трис, яка має дегідратовану і десольватовану форму 03-SA-2, де форма 03-SA-2 являє собою геміацетонат-гемігідрат солі моно-трис з емпіричною формулою C25H26N7O8P1·C4H11N1O3·0,5Н2О·0,5С3Н6О.
36. Кристалічна форма за п. 35, яка відрізняється порошковою рентгенограмою (PXRD), котра при температурі від 20 °С до 25 °С є однаковою з показаною на Фіг. 12.
37. Кристалічна форма за п. 35, яка відрізняється термограмою диференціальної сканувальної калориметрії (DSC), котра є однаковою з показаною на Фіг. 13.
38. Кристалічна форма за п. 35, яка відрізняється діаграмою термогравіметричного аналізу (TGA), котра є однаковою з показаною на Фіг. 13.
39. Кристалічна форма за п. 35, яка відрізняється порошковою рентгенограмою (PXRD), котра містить принаймні чотири величини 2q (СuКa λ=1,5418Å), вибрані із сукупності, що складається із 5,0±0,2, 7,3±0,2, 8,3±0,2, 10,1±0,2, 11,0±0,2, 14,4±0,2, 15,0±0,2, 15,5±0,2, 16,0±0,2, 17,4±0,2, 18,4±0,2, 18,9±0,2, 19,4±0,2, 20,2±0,2, 20,6±0,2, при температурі від 20 °С до 25 °С.
40. Кристалічна форма за п. 39, яка відрізняється також порошковою рентгенограмою (PXRD), котра містить принаймні п'ять величин 2q (СuКa λ=1,5418Å), вибраних із сукупності, що складається із 5,0±0,2, 7,3±0,2, 8,3±0,2, 10,1 ±0,2, 11,0±0,2, 14,4±0,2, 15,0±0,2, 15,5±0,2, 16,0±0,2, 17,4±0,2, 18,4±0,2, 18,9±0,2, 19,4±0,2, 20,2±0,2, 20,6±0,2, при температурі від 20 °С до 25 °С.
41. Композиція, яка містить принаймні 5 % (мас.) кристалічної форми за п. 1 у розрахунку від маси складу.
42. Кристалічна форма за п. 1, де зазначена сполука (І), її солі або сольвати є чистими.
43. Кристалічна форма за п. 42, де чистою є маса сполуки (І), а її солі або сольвати складають принаймні 90 % загальної маси.
Текст
1. Кристалічна форма сполукиО(6) (І): O О(7) 2452(3) 886(5) 58(2) 7863(7) 2046(8) 691(11) 85(4) 9208(6) 2345(5) 2464(10) 74(3) 9134(6) 2119(5) -166(11) 85(4) 8450(6) 3230(6) 438(9) 73(3) 4159(9) 1141(5) 590(10) 57(3) 5716(9) 2151(6) 4721(15) 81(5) 4141(9) 2605(7) 2202(13) 82(5) О(8) 2990(8) -173(7) 6428(13) 82(5) N(1) 6889(16) 1504(10) 1580(30) 55(6) N(2) 5481(18) 686(7) -1765(18) 62(6) N(3) 6844(14) 911(12) -1530(30) 50(4) N(4) 7493(18) 443(9) -982(15) 59(5) P OH N(5) 7666(15) 1106(13) -2890(20) 57(6) N(6) 3989(13) 1677(11) 3686(18) 62(5) OH N(7) 2982(11) 670(9) 4620(20) 61(5) 1757(8) 2710(20) 49(6) 1218(13) 520(50) 54(11) 942(11) -950(30) 58(8) 753(9) -1190(30) 54(6) 1092(11) 190(30) 56(8) 1328(11) 1000(40) 64(13) 1689(10) 2440(30) 49(8) 1491(9) 1654(17) 61(6) 1280(10) -2670(30) 57(6) 588(13) -1820(40) 63(7) 276(9) -1620(20) 95(6) 1028(9) -411(18) 82(6) N O С(1) , 6560(20) яка містить форму 01-Н2-1, що являє С(2) 6280(20) собою дигідрат, який має емпіричну формулу C25H26N7O8P1·2Н2О. С(3) 6160(20) 2. Кристалічна форма за С(4) 1, яка п. 4815(13) відрізняється тим, що її параметри елементарної С(5) 4880(20) комірки є такими: просторова група С(6) моноклінна, Р2(1)/с 5580(20) розміри елементарної комірки а=17,2174(18)Å С(7) 5780(20) =90° С(8) b=18,1242(19)Å 7729(15) С(9) =105,191(4)° 6967(18) с=9,3705(9)Å C(10) 7994(15) =90° С(11)4, 8805(12) кількість молекул/елем. комірку де зазначена кристалічна форма є при С(12) 3391(11) температурі від 20 °С до 25 °С. (13) 94928 N N O N (11) N UA N (19) O C2 8692(3) O O N 3. Кристалічна форма за п. 1, яка відрізняється тим, що її дробові атомні координати є такими: X Y Z U (екв.) 3 94928 13) 5320(20) 1956(9) 3520(30) 4470(20) 2089(14) 3030(20) 63(7) 15) 3197(13) 1884(8) 3658(16) 56(5) 16) 2626(10) 1235(11) 3533(16) 71(7) 17) 3762(14) 410(8) 4532(17) 63(5) N 18) 4348(10) 1045(10) 4757(15) 57(5) 19) 2655(14) 360(13) 5690(30) 55(6) 20) 1920(20) 614(14) 5970(20) 21) 1278(19) 186(12) 6130(20) 80(10) N 95(9) 22) 629(17) 530(20) 6570(30) 154(13) 23) 630(20) 1270(20) 6770(30) 24) 1240(20) 1703(14) 6640(30) 25) 1878(12) 1340(20) 6199(19) 1W) 10482(16) 1379(15) 2580(30) 2W) 11290(90) 1740(100) 410(180) O 53(6) 14) 4 4. Кристалічна форма за п. 1, яка відрізняється порошковою рентгенограмою, яка містить принаймні чотири величини 2 (СuК λ=1,5418 Å), вибрані із сукупності, що складається із 5,3±0,2, 7,2±0,2, 9,7±0,2, 10,6±0,2, 10,9±0,2, 11,7±0,2, 13,2±0,2, 13,8±0,2, 14,5±0,2, 15,7±0,2, 17,0±0,2, 17,7±0,2, 18,2±0,2, 19,6±0,2 і 20,3±0,2, при температурі від 20 °С до 25 °С. 5. Кристалічна форма за п. 4, яка відрізняється також порошковою рентгенограмою, яка містить принаймні п'ять величин 2 (СuК λ=1,5418 Å), вибраних із сукупності, що складається із 5,3±0,2, 7,2±0,2, 9,7±0,2, 10,6±0,2, 10,9±0,2, 11,7±0,2, 13,2±0,2, 13,8±0,2, 14,5±0,2, 15,7±0,2, 17,0±0,2, 17,7±0,2, Р(1) 18,2±0,2, 19,6±0,2 і 20,3±0,2, при температурі від О(1) 20 °С до 25 °С. 6. Кристалічна форма за О(2) 1, яка п. відрізняється порошковою рентгенограмою О(3) (PXRD) при температурі від 20 °С до 25 °С, котра є О(4) однаковою з показаною на Фіг. 1. 7. Кристалічна форма за О(5) 1, яка п. відрізняється термограмою диференціальної сканувальної калориметрії (DSC), О(6) котра є однаковою з показаною на Фіг. 2. О(7) 8. Кристалічна форма за п. 1, яка О(8) відрізняється діаграмою термогравіметричного аналізу (TGA), котра є однаковою з показаною на N(1) Фіг. 2. N(2) 9. Кристалічна форма за п. 1 у монокристалічній формі. N(3) 10. Кристалічна форма сполуки (І): N(4) O O N N O N N N O O P OH OH , яка містить форму 02-S А-1, що являє 153(12) собою геміетанолатоктагідрат двоосновної солі 124(11) натрію з емпіричною формулою C25H24N7O8P1Na2·8Н2О·0,5С2Н5ОН. 96(10) 11. Кристалічна форма за п. 10, яка 375(14) відрізняється тим, що її параметри елементарної комірки є такими: 340(80) розміри комірки а=6,4392(12)Å =99,082(11)° b=13,349(2)Å =95,975(12)° с=21,041(4)Å =90,207(12)° просторова група триклінна, Р-1 кількість молекул/елем. комірку 2, де зазначена кристалічна форма є при температурі від 163 K до 183 K. 12. Кристалічна форма за п. 10, яка відрізняється тим, що її атомні координати є такими: X У Z U (екв.) -4237(3) 7620(2) 623(1) 16(1) -4989(9) 8163(4) 1326(3) 25(1) -5171(8) 6554(4) 520(3) 22(1) -5197(8) 8294(4) 166(3) 22(1) -1871(8) 7657(4) 690(3) 25(1) 2971(9) 6724(5) 3257 (3) 37(2) -443(9) 4328(5) 1972(3) 34(2) -623(10) 5024(5) 3498(3) 34(2) 8772(10) 2512(5) 2958(3) 40(2) -3283(10) 7198(5) 2088(3) 22(2) 83(11) 9077(6) 3216(4) 33(2) -2903(11) 9486(5) 2603(4) 25(2) -4611(12) 9754(5) 2928(4) 31(2) N(5) -4533(12) 10601(5) 2080(4) 31(2) N(6) 2561(12) 4517(6) 3211(4) 34(2) N(7) 5741(12) 3115(6) 3293(4) 32(2) C(1) -2782(13) 6193(6) 1988(4) 25(2) С(2) -1727(12) 7723(6) 2524(4) 21(2) С(3) -1474(13) 8732 (6) 2781(4) 25(2) С(4) 1524(14) 8414(7) 3380(5) 33(2) С(5) 1479(14) 7403(7) 3130(5) 29(2) 5 94928 6 6) -279(12) 7022(6) 2704(4) 7) -951(13) 6043(6) 2361(4) 8) -5253(12) 7582(6) 1812(4) 9) -2903(13) 10008(6) 2114(4) 10) -5520(14) 10418(7) 2588(4) 11) -7555(15) 10885(7) 2743(5) 15. Кристалічна форма за п. 10, яка 24(2) відрізняється порошковою рентгенограмою 24(2) (PXRD), котра при температурі від 20 °С до 25 °С є 22(2) однаковою з показаною на Фіг. 4. 16. Кристалічна форма за п. 10 у 25(2) монокристалічній формі. 27(2) 17. Кристалічна форма сполуки (І): O 39(3) 12) 4739(15) 7096(8) 3710(6) 44(3) 13) -149(13) 5019(7) 2410(5) 27(2) 14) 656(14) 4851(7) 3085(5) 29(2) 15) 3338(15) 4299(7) 3846(5) 36(2) N 16) 4190(14) 3229 (8) 3772(5) 36(2) 17) 4981(14) 3376(7) 2664(5) 32(2) 18) 4121(14) 4434(7) 2745(5) 31(2)N 19) 7652 (14) 2726(7) 3400(5) 8481(14) 2595(7) 4058(5) 21) 8767(16) 3406(8) 4583(5) 22) 9755(17) 3241(10) 5166(6) 23) 10388(18) 2291(11) 5258(6) 24) 10121(18) 1497(10) 4760(6) 25) 9200(16) 1651(8) 4168(6) (1) -27(5) 4278(2) 751(2) O N N O N N N O O P OH 33(2) 20) O (2) 584(5) 824(2) 799(2) 1W) -582(9) 2420(4) 342(3) 2W) 702(10) 5950(5) 649(4) 3W) 3223(10) 3816(5) 1156(3) 4W) -3536(9) 4645(4) 623(3) 5W) -2364(9) 19(4) 135(3) 6W) 929(9) -739(4) 1222(3) 7W) 3859(9) 1718(4) OH , яка містить форму 03-Е.5-1, яка являє 32(2) собою геміетанолат солі моно-трис з емпіричною 39(2) формулою C25H26N7O8P1С4Н11N1О30,5С2Н5ОН. 54(3) 18. Кристалічна форма за п. 17, яка відрізняється тим, що її параметри елементарної 59(4) комірки є такими: 54(3) розміри комірки а=35,594(2)Å =90° 42(3) b=6,2790(4)Å 32(1) =97,080(3)° с=30,6961(19)Å 27(1) =90° 30(2) просторова група моноклінна, С2/с 41(2) кількість молекул/елем. комірку 8, де зазначена кристалічна форма є при 33(2) температурі від 20 °С до 25 °С. 27(1) 19. Кристалічна форма за п. 17, яка відрізняється тим, що атомні координати є 26(1) такими: 30(2) X У Z U (екв.) 29(1) 2596(1) 6394(2) 2987(1) 40(1) 8W) -868(11) 1918(5) 1081(3) Р(1) 1629(4) О(1)| 2829( 1) 44(1) -3944 9520 4308 О(2) 40(2) 2976(1) 48 2545(1) 7325(4) 101) 7326(4) 3424(1) 49(1) 101) -4921 10189 4691 О(3) 79 2295(1) 6805(4) 2618(1) 49(1) 102) -5079 9811 О(4) 5309 79 2670(1) 3962 (4) 3055(1) 49(1) 4192(1) 1209(5) 4004(1) 54(1) 3534(1) 5503(5) 4738(1) 65(1) 4409(1) 5226(5) 4729(1) 61(1) 3768(1) -3613 (6) 5844(1) 96(1) 3483(1) 6854(5) 3404(1) 38(1) 3986(1) 2708(6) 2844(1) 52(1) 3667(1) 5526(6) 2482(1) 43(1) 3842(1) 7331(7) 2362(1) 59(1) 3364(1) 6428(7) 1848(1) 56(1) 4143(1) 2180(6) 4952(1) 45(1) 4070(1) -758(6) 5621(1) 46(1) 3483(1) 6826(6) 3842(1) 38(1) 13. Кристалічна форма за О(5) 10, яка п. відрізняється порошковою рентгенограмою О(6) (PXRD), котра містить принаймні чотири величини О(7) 2 (СuК λ=1,5418 Å), вибрані із сукупності, що О(8) 7,4±0,2, складається із 4,3±0,2, 6,7±0,2, 8,5±0,2,10,0±0,2, 11,8±0,2, 12,9±0,2, 13,5±0,2, N(1) 14,1±0,2, 14,8±0,2, 15,5±0,2, 16,0±0,2, 16,5±0,2, N(2) 17,1±0,2, 18,5±0,2, при температурі від 163 K до 183 K. N(3) 14. Кристалічна форма за п. 13, яка N(4) відрізняється порошковою рентгенограмою (PXRD), котра містить принаймні п'ятьN(5) величин 2 (СuК λ=1,5418 Å), вибраних із сукупності, що N(6) складається із 4,3±0,2, 6,7±0,2, 7,4±0,2, 8,5±0,2, N(7) 10,0±0,2, 11,8±0,2, 12,9±0,2, 13,5±0,2, 14,1±0,2, С(1) 14,8±0,2, 15,5±0,2, 16,0±0,2, 16,5±0,2, 17,1±0,2, 18,5±0,2, при температурі від 163 K до 183 K. 7 94928 8 2) 3703(1) 5168(7) 3281(1) 3) 3787(1) 4441(8) 2880(1) 4) 4121(1) 1637(7) 3212(2) 5) 4061(1) 2252(7) 3627(2) 6) 3847(1) 4108(7) 3670(1) 7) 3705(1) 5188(7) 4030(1) 8) 3262(1) 8359(7) 3107(1) 9) 3383(1) 5037(8) 2172(2) 10) 3645(1) 7796(8) 1981(2) 11) 3740(2) 9697(9) 1724(2) 12) 4433(1) -573(7) 3969(2) 13) 3761(1) 4840(7) 4507(2) 14) 4140(1) 4025(8) 4732(1) 15) 4480(1) 1450(7) 5226(1) 16) 4374(1) 812(7) 5670(1) 16,1±0,2, 17,0±0,2, 17,5±0,2, 19,0±0,2, 20,4±0,2, 36(1) 21,1 ±0,2, при температурі від 20 °С до 25 °С. 41(1) 22. Кристалічна форма за п. 17, яка 51(1) відрізняється порошковою рентгенограмою (PXRD), котра при температурі від 20 °С до 25 °С є 41(1) однаковою з показаною на Фіг. 6. 36(1) 23. Кристалічна форма за п. 17, яка 37(1) відрізняється термограмою диференціальної сканувальної калориметрії (DSC), котра є 46(1) однаковою з показаною на Фіг. 7. 52(1) 24. Кристалічна форма за п. 17, яка відрізняється діаграмою термогравіметричного 58(1) аналізу (TGA), котра є однаковою з показаною на 115(2) Фіг. 7. 63(2) 25. Кристалічна форма за п. 17 у монокристалічній формі. 43(1) 26. Кристалічна форма сполуки (І): 45(1) O 49(1) O O N 49(1) 17) 3733(1) -2(7) 5348(2) 59(1) 18) 3834(1) 626(7) 4904(2) 55(1) 19) 4062(2) -2603(9) 5839(2) 53(1) 20) 4418(1) -3458(7) 6084(2) 44(1) 21) 4741(1) -3755(7) 5886(2) 51(1) 22) 5054(2) -4692(8) 6112(2) 65(2) 23) 5052(2) -5317(8) 6535(2) 76(2) 24) 4730(2) -5082(8) 6736(2) 25) 4410(2) -4182(8) 6508(2) 101) 2345(1) 1293(6) 3682(1) 100) 2381(1) 1642(7) 4167(1) 101) 2762(1) 720(7) 4368(2) 101) 3063(1) 1335(6) 4132(1) 102) 2353(1) 4024(7) 4246(1) 102) 2678(1) 5114(5) 4152(1) 103) 2058(2) 516(8) 4341(2) 10A) 1756(3) 1422(14) 4227(3) 10B) 2000(3) -1430(20) 4230(4) 10С) 2038(3) 504(16) 4742(4) 201) 4628(2) 8300(11) 2632(2) 201) 4808(10) 10130(30) 2382(19) 202) 5201(10) 10250(30) 2474(18) 20. Кристалічна форма за п. 17, яка P(1) відрізняється порошковою рентгенограмою (PXRD), котра містить принаймні чотири величини О(1) 2 (СuК λ=1,5418Å), вибрані із сукупності, що О(2) складається із 5,0±0,2, 5,8±0,2, 7,2±0,2, 8,1±0,2, О(3) 10,0±0,2, 11,0±0,2, 11,6±0,2, 12,0±0,2, 13,2±0,2, 16,1±0,2, 17,0±0,2, 17,5±0,2, 19,0±0,2, 20,4±0,2, О(4) 21,1±0,2, при температурі від 20 °С до 25 °С. О(5) 21. Кристалічна форма за п. 20, яка О(6) відрізняється також порошковою рентгенограмою (PXRD), котра містить принаймні п'ятьО(7) величин 2 (СuК λ=1,5418Å), вибраних із сукупності, що О(8) складається із 5,0±0,2, 5,8±0,2, 7,2±0,2, 8,1±0,2, N(1) 10,0±0,2, 11,0±0,2, 11,6±0,2, 12,0±0,2, 13,2±0,2, N N O N N N N O O P OH OH , яка містить форму 03-SA-2, яка являє 83(2) собою геміацетонат-гемігідрат солі моно-трис з 66(2) емпіричною формулою 44(1) 25H26N7O8P1С4Н11N1О30,5H2O0,5С3Н6О. C 27. Кристалічна форма за п. 26, яка 40(1) відрізняється тим, що її параметри елементарної 55(1) комірки є такими: 65(1) розміри комірки а=43,985(2)Å =90° 57(1) b=6,3142(3)Å 67(1) =125,742(4)° 73(2) с=30,2438(17)Å =90° 75(3) просторова група моноклінна, С2/с 92(4) кількість молекул/елем. комірку 8, де зазначена кристалічна форма є при 59(3) температурі від 20 °С до 25 °С. 79(2) 28. Кристалічна форма за п. 26, яка 125(11) відрізняється тим, що її атомні координати є такими: 125(11) X Y Z U (екв.) 2400(1) -1012(2) 2897(1) 45(1) 2024(1) -1939(5) 2360(1) 49(1) 2448(1) -1930(5) 3390(1) 54(1) 2702(1) -1428(5) 2826(1) 53(1) 2324(1) 1394(5) 2883(1) 53(1) 826(1) 4216(6) 2334(2) 61(1) 1425(1) -139(7) 3709(2) 78(1) 567(1) 349(7) 2788(2) 80(1) 1221(1) 8772(9) 4661(2) 108(2) 1519(1) -1468(6) 2434(2) 46(1) 9 94928 10 5) 956(1) 3162(8) 2084(2) 6) 1160(1) 1313(8) 2339(2) 7) 1286(1) 216(8) 2836(2) 8) 1740(2) -2980(8) 2365(2) 9) 1633(2) 333(9) 1288(2) 10) 1385(2) -2495(10) 869(2) 11) 1306(3) -4438(12) 534(4) 12) 582(2) 6006(9) 2048(2) 13) 1213(2) 567(8) 3248(2) 14) 843(2) 1470(9) 3088(2) 15) 505(2) 4004(9) 3261(2) 16) 599 (2) 4552(8) 3812(2) 55(1) (СuК λ=1,5418Å), вибрані із сукупності, що 2 складається із 5,0±0,2, 7,2±0,2, 8,2±0,2, 9,9±0,2, 49(1) 10,9±0,2, 11,8±0,2, 14,9±0,2, 15,4±0,2, 15,9±0,2, 64(1) 16,7±0,2, 17,3±0,2, 17,7±0,2, 20,1±0,2, 20,6±0,2, 61(1) 21,9±0,2, при температурі від 20 °С до 25 С. 30. Кристалічна форма за п. 29, яка 56(1) відрізняється також порошковою рентгенограмою 55(1) (PXRD), котра містить принаймні п'ять величин 2 48(1) (СuК λ=1,5418Å), вибраних із сукупності, що складається із 5,0±0,2, 7,2±0,2, 8,2±0,2, 9,9±0,2, 45(1) 10,9±0,2, 11,8±0,2, 14,9±0,2, 15,4±0,2, 15,9±0,2, 46(1) 16,7±0,2, 17,3±0,2, 17,7±0,2, 20,1±0,2, 20,6±0,2, 58(1) 21,9±0,2, при температурі від 20 °С до 25 °С. 31. Кристалічна форма за п. 26, яка 48(1) відрізняється порошковою рентгенограмою 43(1) (PXRD), котра при температурі від 20 °С до 25 °С є 45(1) однаковою з показаною на Фіг. 9. 32. Кристалічна форма за п. 26, яка 49(1) відрізняється термограмою диференціальної 54(1) сканувальної калориметрії (DSC), котра є 64(2) однаковою з показаною на Фіг. 10. 33. Кристалічна форма за п. 26, яка 113(3) відрізняється діаграмою термогравіметричного 67(2) аналізу (TGA), котра є однаковою з показаною на 56(2) Фіг. 10. 34. Кристалічна форма за п. 26 у 55(1) монокристалічній формі. 58(1) 35. Кристалічна форма сполуки (І): 56(1) O 17) 1247(2) 5284(10) 4157(2) 66(2) 18) 1160(2) 4730(9) 3614(3) 66(2) 2) 1038(1) 2675(7) 1370(2) 3) 1357(1) -156(7) 1330(2) 4) 1192(1) -2003(8) 1064(2) 5) 1659(1) -1090(8) 996(2) 6) 842(1) 3250(7) 3322(2) 7) 909(1) 6073(7) 4090(2) 1) 1507(1) -1409(8) 2876(2) 2) 1306(1) 222(8) 2098(2) 3) 1232(1) 939(8) 1609(2) 4) 910(2) 3798(9) 1614(2) O O N N 19) 923(2) 7838(10) 4344(2) 62(2) 20) 575(2) 8704(9) 4248(2) 61(2) 21) 269(2) 9248(10) 3739(3) 69(2) 22) -38(2) 10196(11) 3670(3) 89(2) 23) -38(3) 10616(17) 4102(5) 24) 271(4) 10150(20) 4619(4) 138(4) N 186(6) 25) 580(3) 9187(16) 4693(3) 100) 101) 101) 101) 102) 102) 103) 103) 1A3) 1В3) 1W) 201) 201) 202) 203) N O N N N O O P OH OH 124(3) , яка включає у себе форму 03-DSA-2, яка являє 2600(1) 3753(7) 4292(2) 45(1) собою сіль моно-трис, яка має дегідратовану і 2642(1) 4084(6) 3838(2) 45(1) десольватовану форму 03-SA-2, де форма 03-SA2226(2) 4698(9) 4112(2) 57(2) являє собою геміацетонат-гемігідрат солі моно2 трис з емпіричною формулою 1928(1) 4131(8) 3578(2) 66(1) C25H26N7O8P1·C4H11N1O3·0,5Н2О·0,5С3Н6О. 2612(2) 1344(9) 4382 (2) 60(2) 36. Кристалічна форма за п. 35, яка 2286(1) 338(6) 3960(2) 70(1) відрізняється порошковою рентгенограмою (PXRD), котра при температурі від 20 °С до 25 °С є 2924(2) 4818(10) 4795(3) 75(2) однаковою з показаною на Фіг. 12. 3003(3) 6699(15) 4729(4) 79(2) 37. Кристалічна форма за п. 35, яка 3240(4) 3680(20) 5004(5) 69(4) відрізняється термограмою диференціальної сканувальної калориметрії (DSC), котра є 2913(8) 5010(40) 5196(12) 93(7) однаковою з показаною на Фіг. 13. 0 -1790(80) 2500 151(17) 38. Кристалічна форма за п. 35, яка 49(9) 5520(50) 705(14) 129(10) відрізняється діаграмою термогравіметричного аналізу (TGA), котра є однаковою з показаною на -372(16) 4640(90) -100(20) 150(20) Фіг. 13. -23(16) 5270(70) 270(20) 111(14) 39. Кристалічна форма за п. 35, яка 229(17) 5170(90) 220(30) 140(20) відрізняється порошковою рентгенограмою (PXRD), котра містить принаймні чотири величини 29. Кристалічна форма за п. 26, яка 2 (СuК λ=1,5418Å), вибрані із сукупності, що відрізняється порошковою рентгенограмою складається із 5,0±0,2, 7,3±0,2, 8,3±0,2, 10,1±0,2, (PXRD), котра містить принаймні чотири величини 11,0±0,2, 14,4±0,2, 15,0±0,2, 15,5±0,2, 16,0±0,2, 11 94928 12 17,4±0,2, 18,4±0,2, 18,9±0,2, 19,4±0,2, 20,2±0,2, 20,6±0,2, при температурі від 20 °С до 25 °С. 40. Кристалічна форма за п. 39, яка відрізняється також порошковою рентгенограмою (PXRD), котра містить принаймні п'ять величин 2 (СuК λ=1,5418Å), вибраних із сукупності, що складається із 5,0±0,2, 7,3±0,2, 8,3±0,2, 10,1 ±0,2, 11,0±0,2, 14,4±0,2, 15,0±0,2, 15,5±0,2, 16,0±0,2, 17,4±0,2, 18,4±0,2, 18,9±0,2, 19,4±0,2, 20,2±0,2, 20,6±0,2, при температурі від 20 °С до 25 °С. 41. Композиція, яка містить принаймні 5 % (мас.) кристалічної форми за п. 1 у розрахунку від маси складу. 42. Кристалічна форма за п. 1, де зазначена сполука (І), її солі або сольвати є чистими. 43. Кристалічна форма за п. 42, де чистою є маса сполуки (І), а її солі або сольвати складають принаймні 90 % загальної маси. Дана заявка претендує на корисний ефект попередньої заявки США сер. № 60/750,247 від 14 грудня 2005 р. Даний винахід у цілому стосується кристалічних форм 1-бензоїл-4-[2-[4-метокси-7-(3метил-1Н-1,2,4-триазол-1-іл)-1[(фосфонокси)метил]-1H-пірол[2,3-с]піридин-3-іл]1,2-діоксоетил]піперазину. Крім того, винахід стосується фармацевтичного складу, який містить запропоновані кристалічні форми, а також способів застосування цих кристалічних форм у лікуванні від ВІЛ-інфекції і/або від СНІДу та процесів виготовлення таких кристалічних форм. ВІЛ-1 (вірус-1 імунодефіциту людини) інфекція на сьогоднішній день залишається головною проблемою медицини. Згідно з оцінками, на кінець 2002 р. в усьому світі цим вірусом було інфіковано 42 мільйони людей. Кількість випадків зараження ВІЛ і захворювання на СНІД (синдром набутого імунодефіциту) швидко зростає: у 2002 р. нараховувалося ~5,0 мільйонів новоінфікованих і 3,1 мільйона померлих від СНІДу. Загальнодоступними ліками для лікування від ВІЛінфекції сьогодні є дев'ять нуклеозидних інгібіторів зворотної транскриптази (RT: reverse transcriptase) або схвалених одно-пілюльних комбінацій: зидовудин або AZT (чи Retrovir®), диданозин (або Videx®), ставудин (або Zerit®), ламівудин (або ЗТС чи Epivir®), зальцитабін (або DDC чи Hivid®), абакавірсукцинат (або Ziagen®), тенофовірдизопроксилфумаратова сіль (або Viread®), Combivir® (містить -ЗТС плюс AZT), Trizivir® (містить абакавір, ламівудин і зидовудин); три ненуклеозидні інгібітори зворотної транскриптази: невірапін (або Viramune®), делавірдин (або Rescriptor®) та ефавіренц (або Sustiva®), та вісім пептидоміметичних інгібіторів протеази, а також поліпшені препарати: саквінавір, індинавір, ритонавір, нельфінавір, ампренавір, лопінавір, Kaletra® (лопінавір і ритонавір), й атазанавір (Reyataz®). Ці лікувальні засоби при відокремленому застосуванні будь-якого з них є здатними лише тимчасово обмежити вірусну реплікацію. Але використовувані в комбінаціях ці ліки вчиняють досить сильну дію на віруси в крові і на розвиток хвороби. Нещодавно були задокументовані значні зниження коефіцієнтів смертності серед хворих на СНІД внаслідок широкого застосування комбінаційної терапії. Проте, незважаючи на ці позитивні результати, комбінаційна терапія для 30-50% хворих кінець кінцем виявляється безсилою. Недостатня потужність ліків, недотримання режиму їх прийому, обмежена проникність у тканини організму і медикаментозно-специфічні обмеження у деяких типів клітин (наприклад, більшість нуклеозидних аналогів не можуть фосфорилюватися у „дрімаючих клітинах") можуть ставати причинами неповного придушення вразливих вірусів. Крім того, висока швидкість реплікації і швидкий оборот популяції ВІЛ-1, поєднаний з частим вбудовуванням мутацій, призводять до появи медикаментозно-стійких варіантів вірусу, і в результаті при наявності концентрацій ліків нижче оптимальних курс лікування стає неефективним (Larder and Kemp; Gulick; Kuritzkes; Morris-Jones et al; Schinazi et al; Vacca and Condra; Flexner; Berkhout and Ren et al; (Ref. 6-14)). Таким чином, для збільшення можливостей анти-ВІЛ терапії є очевидною нагальна потреба в нових лікувальних засобах, які б демонстрували відмінні типи стійкості, сприятливі фармакокінетичні властивості та профілі безпеки. У заявці США сер. № 11/066,745, поданій 25 лютого 2005 р. (що претендує на корисний ефект попередніх заявок США сер. № 60/635,231 від 10 грудня 2004 р. і сер. № 60/553,320 від 15 березня 2004 p., включених даним тут в усій їхній повноті шляхом посилання) описаний клас сполук (та їхніх фармацевтично прийнятних солей), які відповідають структурній формулі: де: X є С або N за умови, що коли X є N, 1 компонент R не існує; W є С або N за умови, що коли W є N, 2 компонент R не існує; V є C; 1 R є водень, метокси або галоген; 2 R є водень; 3 R є метокси або гетероарил, кожний з яких необов'язково може бути незалежно заміщений одним замісником, вибраним із G; де гетероарил є триазоліл, піразоліл або оксадіазоліл; Ε є водень або його фармацевтично прийнятна одноосновна чи двоосновна сіль; Υ вибраний із сукупності, що складається із 13 10 11 12 13 94928 14 15 16 17 R , R , R , R , R , R , R , R кожний незалежно є Η або метил, за умови, що метилами 10 17 є не більше двох із R -R ; 18 R вибраний із сукупності, що складається із С(О)фенілу, С(О)-піридинілу, піридинілу, піримідинілу, хінолінілу, ізохінолінілу, хіназолінілу, хіноксалінілу, нафтиридинілу, фталазинілу, азабензофурилу та азаіндолілу, кожний з яких необов'язково може бути незалежно заміщений одним-двома членами сукупності, що складається із метилу, -аміно, -NHMe, -NMe2, метокси, гідроксиметилу і галогену; D вибраний із сукупності, що складається із 24 21 22 ціано, S(O)2R , галогену, C(O)NR R , фенілу і гетероарилу; де зазначені феніл або гетероарил необов'язково є незалежно заміщеними однимтрьома однаковими або різними галогенами або одним-трьома однаковими або різними замісниками, вибраними із G; де гетероарил вибраний із сукупності, що складається із піридинілу й оксадіазолілу; А вибраний із сукупності, що складається із фенілу, піридинілу, фурилу, тієнілу, ізоксазолілу та оксазолілу, де зазначені феніл, піридиніл, фурил, тієніл, ізоксазоліл та оксазоліл необов'язково є незалежно заміщеними одним-трьома однаковими або різними галогенами або одним-трьома однаковими або різними замісниками, вибраними із G; G вибраний із сукупності, що складається із (С1-6)алкілу, (С1-6)алкенілу, фенілу, гідрокси, 23 метокси, галогену, -NR C(O)-(C1-6)алкілy, 24 25 24 25 26 24 25 NR R , -S(O)2NR R , COOR і -CONR R ; де зазначений (С1-6)алкіл необов'язково є заміщений на гідрокси, диметиламіно або одним-трьома однаковими чи різними галогенами; 26 R вибраний із сукупності, що складається із водню і (С1-6)алкілу; 20 21 22 23 24 25 R , R , R , R , R , R є незалежно вибраними із сукупності, що складається із водню, 27 28 (С1-6)алкілу і -(CH2)nNR R ; nє 0-6; а 27 28 R і R кожний незалежно є Η або метил. У заявці США сер. № 11/066,745 також описана, зокрема, сполука Існує потреба в різних формах сполуки, вираженої формулою: 1-бензоїл-4-[2-[4-метокси-7(3-метил-1Н-1,2,4-триазол-1-іл)-1[(фосфонокси)метил]-1H-пірол[2,3-с]піридин-3-іл) 14 1,2-діоксоетил]піперазин (назва, рекомендована ІЮПАК: (3-((4-бензоїлпіперазин-1-іл)(оксо)ацетил)4-метокси-7-(3-метил-1H-1,2,4-триазол-1-іл)-1Hпірол[2,3-с]піридин-1-іл)метилдигідрофосфат), її солях і сольватах, оскільки її різні форми можуть мати різні фізичні і/або хімічні властивості. Існує також потреба у виготовленні стабільної форми 1бензоїл-4-[2-[4-метокси-7-(3-метил-1H-1,2,4триазол-1-іл)-1-[(фосфонокси)метил]-1H-пірол[2,3с]піридин-3-іл]-1,2-діоксоетил]піперазину, його солей і сольватів для тривалого зберігання тощо. Крім того, існує потреба в надійних і відтворюваних процесах виготовлення, очистки і готування препаратів, які б дозволяли здійснювати її поточне виробництво. Даним винаходом пропонуються кристалічні форми 1-бензоїл-4-[2-[4-метокси-7-(3-метил-1Н1,2,4-триазол-1-іл)-1-[(фосфонокси)метил]-1Нпірол[2,3-с]піридин-3-іл]-1,2-діоксоетил]піперазину, його солей і сольватів. Деякі з варіантів здійснення цих кристалічних форм охарактеризовані в даному описі під назвами: -01-Н2-1, -02-SA-1, -03-Е.5-1, 03-SA-2, -03-DSA-2 тощо. Ці назви, котрі характеризують специфічність кожної з даних форм, наприклад, "-01-Н2-1" та інших, слід розглядати не як такі, що несуть у собі ознаки обмеження по відношенню до будь-якої іншої речовини, яка володіє такими самими або ідентичними фізичними та хімічними властивостями, а лише як ідентифікатори, котрі асоціюються з інформацією, що стосується характеризації описаних тут матеріалів. 1-Бензоїл-4-[2-[4-метокси-7-(3-метил-1Н-1,2,4триазол-1-іл)-1-[(фосфонокси)метил]-1H-пірол[2,3с]піридин-3-іл]-1,2-діоксоетил]піперазин ідентифікований тут назвою "сполука (І)" і описується структурною формулою (І): Перший варіант практичного здійснення даного винаходу стосується кристалічної форми сполуки (І), яка включає у себе форму 01-Н2-1 сполуки (І). Другий варіант практичного здійснення даного винаходу стосується кристалічної форми сполуки (І), яка включає у себе форму 02-SA-1 сполуки (І). Третій варіант практичного здійснення даного винаходу стосується кристалічної форми сполуки (D, яка включає у себе форму 03-Е.5-1 сполуки (І). Четвертий варіант практичного здійснення даного винаходу стосується кристалічної форми сполуки. (І), яка включає у себе форму 03-SA-2 сполуки (І). П'ятий варіант практичного здійснення даного винаходу стосується кристалічної форми сполуки (І), яка включає у себе форму 03-DSA-2 сполуки (І). 15 Ці та інші варіанти здійснення винаходу отримають роз'яснення у подальшому викладенні даного опису. СКОРОЧЕНИЙ ОПИС ФІГУР КРЕСЛЕННЯ Даний винахід ілюстрований описаними нижче супровідними кресленнями, де: - на Фіг. 1. показані експериментальні і розрахункові порошкові рентгенограми (СuKα λ=1,5418 Å при Т = 293 K) форми 01-Н2-1 сполуки (І); - на Фіг. 2. показана криві диференціальної сканувальної калориметриї і термогравіметричного аналізу форми 01-Н2-1 сполуки (І); - на Фіг. 3. показані позначення атомів (за винятком атомів Н) у формі 01-Н2-1 сполуки (І); - на Фіг. 4. показана розрахункова порошкова рентгенограма (СuKα, λ =1,5418 Å при Τ = 173 K) форми 02-SA-1 сполуки (І); - на Фіг. 5. показані позначення атомів (за винятком атомів Н) у формі 02-SA-1 сполуки (І); - на Фіг. 6. показані експериментальні і розрахункові порошкові рентгенограми (СuKα λ =1,5418 Å при Τ ~293 K) форми 03-Е.5-1 сполуки (І); - на Фіг. 7 показані криві диференціальної сканувальної калориметри!' і термогравіметричного аналізу форми 03-Е.5-1 сполуки (І); - на Фіг. 8 показані позначення атомів (за винятком атомів Н) у формі 03-Е.5-1 сполуки (І); - на Фіг. 9. показані експериментальні і розрахункові порошкові рентгенограми (СuKα λ =1,5418 Å при Τ = 293 K) форми 03-SA-2 сполуки (І); - на Фіг. 10. показані криві диференціальної сканувальної калориметри!' і термогравіметричного аналізу форми 03-SA-2 сполуки (І); - на Фіг. 11. показані позначення атомів (за винятком атомів Н) у формі 03-SA-2 сполуки (І); - на Фіг. 12. показані експериментальні і розрахункові порошкові рентгенограми (СuKα λ =1,5418 Å при Τ = 293 K) форми 03-DSA-2 сполуки (І); - на Фіг. 13. показані криві диференціальної сканувальної калориметри!' і термогравіметричного аналізу форми 03-DSA-2 сполуки (І). Даним винаходом принаймні в одній його частині пропонуються кристалічні форми сполуки (І), її солей і сольватів. Крім того, винахід стосується також фармацевтичних складів, що містять кристалічні форми (або форму), а також способів застосування кристалічних форм (або форми) у лікуванні від ВІЛ-інфекції і/або СНІДу і процесів виготовлення таких кристалічних форм (або форми). Сполукою (І) є 1-бензоїл-4-[2-[4метокси-7-(3-метил-1Н-1,2,4-триазол-1-іл)-1[(фосфонокси)метил]-1Н-пірол[2,3-с]піридин-3-іл]1,2-діоксоетил]піперазин. Сполука (І) має структурну формулу (І): 94928 16 Визначення термінів Використовуваний у даному описі термін "поліморфи" означає кристалічні форми, які мають однакові хімічні склади, але різні просторові розташування молекул, атомів і/або іонів, що утворюють кристали. Використовуваний у даному описі термін "сольват" означає кристалічну форму молекули, атомів і/або іонів, яка, крім того, містить молекули розчинника або розчинників, вбудовані в структуру кристалічної решітки. Молекули розчинника в сольваті можуть бути наявними в упорядкованому і/або в неупорядкованому розташуванні. Сольват може мати стехіометричну або нестехіометричну кількість молекул розчинника. Наприклад, сольват з нестехіометричною кількістю молекул розчинника може утворюватися внаслідок часткової втрати розчинника із сольвату. Сольвати можуть виникати як димери або олігомери, які містять більше однієї молекули або сполуки (І) у структурі кристалічної решітки. Використовуваний у даному описі термін "аморфний" означає тверду форму молекул, атомів і/або іонів, яка не є кристалічною. Аморфне тверде тіло не дає чітко визначеної рентгенограми. Використовуваний у даному описі термін "практично чистий" як характеристика кристалічної форми служить ознакою сполуки, яка має чистоту більше 90 %(мас), тобто більше 90, 91, 92, 93, 94, 95, 96, 97, 98 і 99 %(мас), включаючи рівень ~100 %(мас), сполуки (І) відносно маси цієї сполуки. Решту матеріалу при цьому складають інші форми даної сполуки і/або домішки, що виникають внаслідок проведення реакцій чи обробок у процесі її виготовлення. Наприклад, кристалічна форма сполуки (І) може вважатися практично чистою, якщо вона є чистою більш, ніж на 90 %(мас), при вимірюванні за допомогою засобів, загальноприйнятих на сьогоднішній день у даній галузі, у той час як решту, тобто менше 10 %(мас), маси матеріалу складають інші форми (або форма) сполуки (І) і/або домішки, що виникають внаслідок проведення реакцій чи обробок у процесі її виготовлення. Термін "фармацевтично прийнятний" у тому розумінні, в якому він використовується в даному описі, служить ознакою для тих сполук, матеріалів, складів і/або лікарських форм, які в рамках загальноприйнятої медичної оцінки є підходящими для контактування з тканинами організму людини або тварини і не викликають при цьому умов надмірної токсичності, подразнення, алергічної реакції та інших проблемних ускладнень, 17 пропорційних прийнятному співвідношенню між користю та ризиком. У деяких кращих варіантах здійснення винаходу сполука (І) або її солі чи сольвати є у практично чистій формі. Термін "практично однаковий" у тому розумінні, в якому він використовується в даному описі, означає однаковість об'єктів один з одним, яка б мала місце з погляду фахівця в даній галузі при врахуванні таких змінних, як інструментальні обмеження, інструментальні варіації і т.п. Термін "практично чистий кристал" у тому розумінні, в якому він використовується в даному описі, означає зразки кристалічних форм з практично чистою фазовою гомогенністю і вказує на наявність у ньому домінуючої кількості одного поліморфу і припустимо дуже невеликі кількості одного чи більше інших поліморфів. Наявність у даному зразку більш ніж одного поліморфів може бути визначена за допомогою, наприклад, методів порошкового рентгеноструктурного аналізу (PXRD: powder x-ray diffraction) або твердофазної ЯМРспектроскопії. Так, наприклад, поява на експериментальній порошковій рентгенограмі додаткових піків, відсутніх на розрахунковій порошковій рентгенограмі, може означати наявність у даному зразку більше одного поліморфів. Розрахункові порошкові PXRDрентгенограми можуть бути побудовані за рентгеноструктурними даними для монокристалів (Smith, D.K., "A FORTRAN Program for Calculating X-Ray Powder Diffraction Patterns," Lawrence Radiation Laboratory, Livermore, California, UCRL7196 (April 1963)). Термін "густа суспензія" у тому розумінні, в якому він використовується в даному описі, означає насичений розчин сполуки, який може також містити додаткову кількість сполуки і, таким чином, являти собою гетерогенну суміш сполуки і розчинника при даній температурі. Вираз "терапевтично ефективна кількість" передбачає в тому числі кількість кристалічної форми сполуки (І), що є ефективною при її введенні відокремлено або в комбінації для лікування від ВІЛ-інфекції і СНІДу. Кристалічні форми сполуки (І) та фармацевтичні склади, що їх містять, можуть використовуватися для лікування від ВІЛ-інфекції або СНІДу. Якщо сполука (І) використовується в комбінації з іншим медикаментом, то описане тут комбінування сполук може давати синергічний ефект. Як описано, наприклад, в роботі (Chou and Talalay, Adv. Enzyme ReguL 1984, 22, 27-55), синергізм має місце, коли ефект від уведення комбінації сполук є більшим за простий адитивний ефект від відокремленого введення сполук як індивідуальних засобів. Використовуваний у даному описі термін "лікування" означає лікування хворого стану у ссавця, зокрема, у людини, і передбачає в тому числі: (а) запобігання виникненню хворого стану у ссавця, особливо коли такий ссавець є до даної хвороби схильним, але ще не має поставленого в нього її діагнозу; (b) інгібування хворого стану, тобто припинення його розвитку; і/або (с) 94928 18 полегшення хворого стану, тобто викликання зворотного розвитку даного хворого стану. Синтез сполуки (І) Сполука (І) може виготовлятися за допомогою процесів, добре відомих фахівцям у галузі органічного синтезу, а також процесів, описаних у непопередній патентній заявці США загальної власності сер. № 11/066,745 (поданої 25 лютого 2005 p.), включеній даним тут в усій її повноті шляхом посилання. Загальний процес виготовлення кристалічних матеріалів Процеси виготовлення кристалічних форм є в даній галузі добре відомими. Це можуть бути, наприклад, процеси кристалізації або рекристалізації із підходящого розчинника, сублімації, вирощування із розплаву, перетворення в твердому стані із іншої фази, кристалізації із надкритичної рідини і струминного розпорошування. До числа процесів кристалізації та рекристалізації кристалічних форм зі змішаного розчинника належать, наприклад, випарювання розчинника, зниження температури змішаного розчинника, засівання перенасиченого змішаного розчинника молекулярними або сольовими зародками кристалізації, сублімаційна сушка змішаного розчинника і додавання до змішаного розчинника антирозчинників (протирозчинників). У виготовленні кристалічних форм, включаючи поліморфи, можуть використовуватися високопродуктивні процеси кристалізації. Докладний опис різноманітних кристалічних ліків, включаючи їхні поліморфи, процесів їх виготовлення і методів аналізу можна знайти в публікації (Solid-State Chemistry of Drugs, S.R. nd Byrn, R.R. Pfeiffer, and J.G. Stowell, 2 Edition, SSCI, West Lafayette, Indiana (1999)). Якщо кристалізацію здійснюють із застосуванням розчинника, то останній вибирають з урахуванням, як правило, розчинності сполуки, процесу кристалізації і тиску пари розчинника. Можуть використовуватися і комбіновані розчинники. При цьому сполуці може бути надано більшої розчинності поміщенням її в перший розчинник з утворенням у ньому її розчину, а потім додаванням антирозчинника розчинність сполуки в цьому розчині може бути знижена для сприяння утворенню кристалів. Антирозчинником є середовище, в котрому розчинність сполуки є низькою. Підходящими для одержання кристалів є полярні і неполярні розчинники, тобто такі, наприклад, як n-пентан, n-гесан, n-гептан, n-октан, n-декан, n-додекан, діетиловий етер, метилтретинний бутиловий етер, триетиламін, діізопропіловий етер, дибу тиловий етер, 1,4діоксан, тетрагідрофуран, хлороформ, 1,1дихлоретан, етилацетат, 1,2-дихлоретан, 1,2диброметан, дихлорметан, бутилетаноат, 1бутанол, 2-метил-2-пропанол, 1-пропанол, 1октанол, етанол, метилетилкетон, ацетон, циклогексанон, 2-гексанон, циклопентанон, 2гептанон, 4-метил-2-пентанон, ацетонітрил, бутаннітрил, етиленгліколь, метанол, діетиламін, гліцерин, вода, метилацетат, ізопропілацетат, 19 бутилацетат, t-бутилацетат, гексахлорацетон, 2бутанол, t-бутиловий спирт, діетиленгліколь, 1-, 2або 3-пентанол, 2-метил-1-пропанол і 2-бутанол. Згідно з одним із процесів виготовлення кристалів вибрану сполуку суспендують і/або перемішують у підходящому розчиннику, утворюючи густу суспензію, котру для активації розчиняння нагрівають. Для активування кристалізації до кристалізаційної суміші додають зародки кристалів. Зародки кристалів можуть використовуватися для регулювання росту того чи іншого поліморфу або для регулювання гранулометричного складу кристалічного продукту. Таким чином, потрібну кількість зародків визначають відповідно до розмірів зародків кристалізації, наявних у розпорядженні, і бажаного середнього розміру часток продукту як описано, наприклад, у роботі ("Programmed Cooling of Batch Crystallizers," J.W. Mullin and J. Nyvlt, Chemical Engineering Science, 1971,26, 369-377). У загальному випадку зародки малих розмірів потребуються для ефективного регулювання росту кристалів у партії продукту. Зародки малих розмірів можна одержувати шляхом просіювання, помелу або тонкого здрібнення грубих кристалів, або шляхом мікрокристалізації із розчинів. При цьому, здійснювати помел або тонке здрібнення кристалів слід дуже обережно, щоб не завдати змін кристалічності цільового продукту (тобто не змінити його на аморфний або на інший поліморфний матеріал). В одному з варіантів процесу охолоджену кристалізаційну суміш фільтрують у вакуумі, а відокремлені тверді частки промивають підходящим розчинником, яким може бути холодний розчинник рекристалізації, і сушать у потоці азоту, одержуючи в результаті бажану кристалічну форму. Для підтвердження утворення потрібної кристалічної форми продукту відокремлені тверді частки можуть піддаватися аналізу відповідним спектроскопічним або аналітичним методом, наприклад, твердофазного ядерного магнітного резонансу, диференціальної сканувальної калориметрії, порошкового рентгеноструктурного аналізу тощо. Утворювана в такому процесі кристалічна форма зазвичай виробляється в кількості більше 70 %(мас.) відокремленого продукту, а в кращому варіанті - в кількості 90 %(мас.) відокремленого продукту, від маси сировинної сполуки, поданої на вхід процесу кристалізації. У разі потреби цей продукт для роздрібнення грудок може піддаватися спільному помелу або перепускатися через сито. Кристалічні форми можуть одержуватися безпосередньо із реакційного середовища кінцевого процесу, призначеного для виготовлення сполуки (І). Для цього на завершальній стадії процесу може використовуватися, наприклад, розчинник або суміш розчинників, із котрих може кристалізуватися сполука (І). Інакше кристалічні форми можуть одержуватися методами дистиляції або додавання розчинника. Підходящими для цього є, наприклад, згадані вище неполярні і полярні розчинники, включаючи протонні полярні 94928 20 розчинники, такі як спирти, та апротонні полярні розчинники, такі як кетони. Вимірювання характеристик Характеристики кристалічних форм сполуки (І), її солей і сольватів можуть вимірятися за допомогою різноманітних методів і зокрема, наприклад, порошкового рентгеноструктурного аналізу (PXRD: Powder X-Ray diffraction), моделювання порошкових рентгенограм (Yin. S.; Scaringe, R. P.; DiMarco, J.; Galella, M. and Gougoutas, J. Z., American Pharmaceutical Review, 2003, 6,2, 80), диференціальної сканувальної калориметрії (DSC), твердофазної С-13 ЯМР спектроскопії (W.L. Earl and D.L. VanderHart, J. Magn. Resort., 1982, 48, 35-54), рамановської спектроскопії, інфрачервоної спектроскопії, ізотерм сорбції вологи (VTI: ізотерм змінної температури), методів гарячого стану. Кристалографічні параметри кристалічних форм можна виміряти і розрізняти за допомогою рентгеноструктурного аналізу монокристалів, в основі якого лежать вимірювання елементарної комірки монокристалу певної форми при фіксованій температурі. Детальний опис елементарних комірок можна знайти у публікації (Stout & Jensen, X-Ray Structure Determination: A Practical Guide, Macmillan Co., New York (1968), Chapter 3), включеній даним тут шляхом посилання. Інакше унікальне просторове розташування атомів у кристалічній решітці можна характеризувати відповідно до визначених експериментально дробових атомних координат. Іншим способом характеризування кристалічної структури є порівняння ряду величин 2Θ виміряних порошкових дифракційних рентгенограм та аналогічних розрахункових рентгенограм, змодельованих для чистого матеріалу і такої ж температури аналізу. Добре відомо, що експериментальна рентгенограма може мати похибку вимірювань, яка залежить від умов їх проведення. Зокрема, в залежності від умов експерименту можуть варіювати рівні інтенсивності на рентгенограмі. Крім того, в залежності від умов експерименту можуть варіювати також рівні відносної інтенсивності, у зв'язку з чим точний порядок інтенсивності не повинен братися до уваги. Що стосується похибки вимірювань кута дифракції на звичайній рентгенограмі, то вона, як правило, не перевищує 5% і тому повинна враховуватися як така, що має відношення до вищезгаданих кутів дифракції. Таким чином, кристалічні форми згідно з даним винаходом не обмежуються лише тими з них, що мають рентгенограми, абсолютно ідентичні рентгенограмам, відображеним на доданих тут фігурах креслення. Отже, об'ємом даного винаходу охоплюються кристалічні форми, які мають рентгенограми, практично ідентичні рентгенограмам, відображеним на доданих тут фігурах креслення. Оцінка ступеню практичної ідентичності рентгенограм лежить у сфері компетенції пересічного фахівця в даній галузі. Так само будь-яка кристалічна форма, у котрої характеристики диференціальної сканувальної калориметрії (DSC), термогравіметричного аналізу 21 (TGA) і/або ізотерм сорбції вологи є практично ідентичними відповідним характеристикам, поданим тут на супровідних фігурах креслення, охоплюється об'ємом даного винаходу. Оцінка ступеню практичної ідентичності цих характеристик лежить у сфері компетенції пересічного фахівця в даній галузі. Застосування Кристалічні форми сполуки (І), її солей і сольватів, взяті окремо або в комбінації з іншими сполуками, можуть використовуватися для лікування від СНІДу і/або ВІЛ-інфекції. Кристалічні форми згідно з винаходом можуть входити до складу фармацевтичних препаратів разом з ексципієнтами та іншими матеріалами, що надають препаратам властивості, підходящі для лікування вищезазначених показань. Кристалічні форми згідно з даним винаходом можуть уводитися різноманітними способами, а перед уведенням розчинятися в будь-яких підходящих розчинниках. Винаходом пропонується також спосіб лікування і фармацевтичний склад для лікування від таких вірусних інфекцій, як ВІЛ, та від СНІДу. Запропонований спосіб передбачає введення пацієнту, який потребує такого лікування, фармацевтичного складу, який містить фармацевтичний носій і терапевтично ефективну кількість кристалічної форми за даним винаходом. Фармацевтичний склад згідно з винаходом може мати форму призначених для перорального введення суспензій або таблеток, носових розпорошувачів, стерильних препаратів для ін'єкцій, наприклад, стерильних водних чи масляних суспензій для ін'єкцій, супозиторіїв і т.п. При пероральному введенні у формі суспензії такі склади готують за допомогою добре відомих процесів, загальноприйнятих у галузі фармацевтики, і можуть містити мікрокристалічну целюлозу для надання препарату об'ємності, альгінову кислоту або альгінат натрію в ролі суспендувального засобу, метилцелюлозу для підвищення в'язкості, а також звичайні для фармацевтичних препаратів коригенти смаку та запаху. Приготовані формі таблеток, розрахованих на негайне вивільнення активного інгредієнта, ці склади можуть містити мікрокристалічну целюлозу, двоосновний фосфат кальцію, крохмаль, стеарат магнію і лактозу чи інші ексципієнти, зв'язуючі, наповнювачі, дезінтегратори, розріджувачі та мастила, добре відомі фахівцям у даній галузі. Розчини та суспензії для ін'єкцій можуть готуватися відповідно до загальноприйнятої практики, використовуючи підходящі нетоксичні, парентерально прийнятні розріджувачі та розчинники, такі як маніт, 1,3-бутандіол, вода, розчин Рінгера або ізотонічний розчин хлориду натрію, а також підходящі диспергатори, зволожувачі та суспендувальні засоби, такі як стерильні, заспокійливі, жирні масла, включаючи синтетичні моно- чи дигліцериди, та жирні кислоти, включаючи олеїнову кислоту. Сполука (І) може мати незвичну кристалічну форму, наприклад, сольвату і/або гідрату. У виготовленні сольватів сполуки (І) можуть 94928 22 використовуватися найрізноманітніші розчинники, серед яких кращими є, наприклад, полярні розчинники, включаючи полярні протонні і полярні апротонні розчинники. У кращому варіанті, як розчинники у препаратах згідно з винаходом використовують DMF або ацетон, причому кращим серед них є ацетон. Кількісне співвідношення сполуки (І) до розчинника в сольватах може бути різним і залежить, у тому числі, від використовуваних розчинників і процесів одержання сольватів. Кращими серед сольватів для цілей даного винаходу є моносольвати, напівсольвати, нестехіометричні та дисольвати. Скорочення Нижче перелічені скорочення, які використовуються в даному описі і більшість із яких є добре відомими фахівцям у даній галузі. год. rt моль ммоль г мг мл TFA DCE СН2СІ2 ТРАР THF DEPBT DMAP P-EDC EDC DMF Hunig's Base mCPBA азаіндол 4-азаіндол 5-азаіндол 6-азаіндол 7-азаіндол РМВ DDQ OTf NMM PIP-COPh NaHMDS EDAC TMS DCM DCE MeOH EtOAc LDA TMP-Li DME DIBALH HOBT година кімнатна температура моль мілімоль грам міліграм мілілітр трифтороцтова кислота 1,2-дихлоретан дихлорметан тетрапропіламонійперутенат тетрагідрофуран 3-(діетоксифосфорилокси)-1,2,3бензотриазин-4(3Н)-он 4-диметиламінопіридин 1-(3-диметиламінопропіл)-3етилкарбодіімід на полімерній основі 1-(3-диметиламінопропіл)-3етилкарбодіімід N,N-диметилформамід N,N-діізопропілетиламін мета-хлорпербензойна кислота 1Н-піролпіридин 1Н-пірол[3,2-b]піридин 1Н-пірол[3,2-с]піридин 1Н-пірол[2,3-с]піридин 1Н-пірол[2,3-b]піридин 4-метоксибензил 2,3-дихлор-5,6-диціано-1,4бензохінон трифторметансульфонокси 4-метилморфолін 1-бензоїлпіперазин гексаметилдисилазид натрію 1-(3-диметиламінопропіл)-3етилкарбодіімід триметилсиліл дихлорметан дихлоретан метанол етилацетат літійдіізопропіламід 2,2,6,6-тетраметилпіперидиніл-літій диметоксіетан діізобутилалюмінійгідрид 1-гідроксибензотіазол 23 CBZ PCC Me Ph бензилоксикарбоніл піридинхлорхромат метил феніл Описані тут кристалічні матеріали сполуки (І) можуть уводитися до фармацевтичних складів і/або використовуватися у терапевтичних і/або профілактичних способах лікування. Такі способи включають у себе, наприклад, введення кристалічної сполуки (і) самої або в комбінації з одним чи більше інших фармацевтично активних засобів, у тому числі засобів, які можуть використовуватися в лікуванні згаданих тут розладів. Способи згідно з даним винаходом у кращому варіанті включають у себе введення пацієнту фармацевтично ефективної кількості запропонованих винаходом кристалів у комбінації з одним чи більше фармацевтично прийнятних носіїв і/або ексципієнтів. Кількісні пропорції між активним інгредієнтом і носієм і/або ексципієнтом можуть визначатися, наприклад, розчинністю і хімічною природою матеріалів, вибраного способу введення і стандартною фармацевтичною практикою. Лікарськими формами для перорального введення кристалічних сполук (І) пацієнту можуть служити таблетки, капсули (причому ті й інші можуть являти собою препарати пролонгованого вивільнення або вивільнення, заданого в часі), пілюлі, порошки, гранули, еліксири, настоянки, суспензії, сиропи та емульсії. Запропоновані сполуки можуть уводитися також у внутрішньовенних (болюс або вливання), інтраперитонеальних, підшкірних та внутрішньом'язових лікарських формах, добре відомих фахівцям у галузі фармацевтики. Вони можуть уводитися відокремлено, але, як правило, до складу їх препарату входить також фармацевтичний носій, вибраний відповідно до бажаного способу введення і стандартної фармацевтичної практики. Схема дозування кристалічних форм сполуки (І) залежить, звичайно, від таких відомих чинників, як фармакодинамічні характеристики застосовуваного лікувального засобу та спосіб і шлях його введення; біологічний вид, вік, стать, загальний стан здоров'я, медичний стан і маса тіла реципієнта; природа і ступінь розвитку симптомів; вид паралельного курсу лікування; частота терапевтичного втручання; спосіб уведення, ниркова і печінкова функції пацієнта, а також бажаного ефекту від застосування ліків. Лікар-куратор або ветеринар визначає і призначає ефективну кількість ліків, потрібну для запобігання, протистояння або припинення розвитку даного тромбоемболічного розладу. Цілком очевидно, що приблизно одночасно можуть уводитися декілька одиничних лікарських форм. Дозування кристалічної форми сполуки (І), яке буде найбільш підходящим для профілактики або лікування, може бути різним залежно від форми уведення, конкретної кристалічної форми вибраної сполуки і фізіологічних характеристик 94928 24 пацієнта, що приймає лікування. У загальному випадку початкові дози можуть у разі потреби бути малими, а далі з невеликими нарощуванням поступово зростати доти, поки не буде досягнутий бажаний ефект у даних умовах лікування. Для дорослих пацієнтів підходящі дози, як правило, лежать в інтервалі приблизно від 0,001 до 1000 мг/кг маси тіла, а всі комбінації підінтервалів доз лежать у цьому широкому інтервалі і визначаються в кожному конкретному випадку індивідуально. Кращі дози при інгаляції можуть складати приблизно від 0,01 до 100 мг/кг маси тіла на день, ще краще - від 0,1 до 70, і ще краще - від 0,5 до 20 мг/кг маси тіла на день при пероральному введенні, і приблизно від 0,01 до 50, краще - від 0,01 до 10 мг/кг маси тіла на день при внутрішньовенному введенні. У кожному конкретному випадку дози визначаються з урахуванням індивідуальних особливостей реципієнта, таких як вік, маса тіла, загальний стан здоров'я та інші характеристики, які можуть впливати на ефективність медичного продукту. Кристалічні форми сполуки (І) можуть уводитися однократною денною дозою, або ж загальна денна доза може поділятися на дві, три чи чотири піддози. При пероральному введенні у твердому стані таблетки або капсули кристалічні форми сполуки (І) можуть об'єднуватися з нетоксичним, фармацевтично прийнятним інертним носієм, таким як лактоза, крохмаль, сахароза, глюкоза, метилцелюлоза, стеарат магнію, двоосновний фосфат кальцію, сульфат кальцію, маніт, сорбіт і т. п. Як правило, окрім активного інгредієнта тверді лікарські форми містять низку додаткових інгредієнтів, які узагальнено звуться тут "ексципієнтами". До числа таких ексципієнтів можуть входити розріджувачі, зв'язуючі, мастила, пластифікатори та дезінтегратори. До складу такої лікарської форми можуть уходити також барвники. "Розріджувачами" в даному описі звуться засоби, які надають препарату об'єму, достатнього для виготовлення шляхом пресування таблетки вигідних у вживанні розмірів. Такими розріджувачами можуть служити, наприклад, лактоза і целюлоза. "Зв'язуючими" в даному описі звуться засоби, які надають порошковому матеріалу когезивності для того, щоб забезпечити достатню міцність таблетки після пресування, а також щоб поліпшити вільну текучість самого порошку. Типовими зв'язуючими є, наприклад, лактоза, крохмаль і різноманітні цукри. "Мастилами" в даному описі звуться засоби, які виконують декілька функцій, включаючи запобігання адгезії таблеток до пресувального обладнання і поліпшення текучості гранул перед їх пресуванням або введенням у капсули. Мастила у більшості випадків є гідрофобними матеріалами. Проте надмірна кількість мастила є небажаною, оскільки вона може призводити до погіршення дезінтеграції препарату і/або затриманого розчинення лікувальної речовини. "Пластифікаторами" в даному описі звуться речовини, здатні поліпшувати характеристики 25 текучості гранульованого матеріалу. Пластифікаторами можуть служити, наприклад, тальк і колоїдний двоокис кремнію. "Дезінтеграторами" в даному описі звуться речовини або суміші речовин, які додаються для полегшення руйнування чи дезінтеграції твердої лікарської форми після її введення. Матеріалами, котрі можуть служити дезінтеграторами, є крохмалі, глини, целюлози, альгіни, смоли і зшиті полімери. Деякі дезінтегратори, що складають групу так званих "супердезінтеграторів", у загальному випадку використовують у твердих лікарських формах у малих кількостях, зазвичай від 1%(мас.) до 10%(мас.) відносно загальної маси дозової одиниці. Так наприклад, зшитою целюлозою є кроскармелоза, зшитим полімером є кроспровідон, зшитим крохмалем натрійкрохмальгліколят. Серед них, наприклад, натрійкрохмальгліколят, розбухаючи в сімдванадцять разів за менш ніж ЗО секунд, ефективно дезінтегрує гранули, що в ньому містяться. Кращими для цілей даного винаходу дезінтеграторами є матеріали, вибрані із сукупності, що складається із модифікованих крохмалів, натрійкроскармелози, кальційкарбоксиметилцелюлози і кросповідону. Серед них найкращим для цілей даного винаходу дезінтегратором є модифікований крохмаль, наприклад, натрійкрохмальгліколят. Кращими носіями є капсули або спресовані таблетки, в котрих містяться описані тут тверді фармацевтичні лікарські форми. У загальному випадку капсульна або спресована таблетована форма містить терапевтично ефективну кількість кристалічної форми сполуки (І) та принаймні один дезінтегратор у кількості більше 10%(мас.) відносно загальної маси вмісту капсули або таблетки. Капсульні препарати можуть містити кристалічні форми сполуки (І) у кількості приблизно від 5 до 1000 мг на капсулу. У кращому варіанті спресовані таблетовані препарати містять кристалічні форми сполуки (І) у кількості приблизно від 5 мг до 800 мг на таблетку. У ще кращому варіанті такі препарати містять приблизно від 50 до 200 мг на капсулу або спресовану таблетку. У кращому варіанті капсульна або спресована таблетована фармацевтична лікарська форма містить: терапевтично ефективну кількість кристалічної форми сполуки (І); поверхнево-активну речовину; дезінтегратор; зв'язуюче; мастило; і в разі потреби - додаткові фармацевтично прийнятні ексципієнти, наприклад, розріджувачі, пластифікатори і т. п; де дезінтегратор вибирають серед модифікованого крохмалю, натрійкроскармелози, кальційкарбоксиметилцелюлози і кросповідону. Для перорального введення в рідкому стані кристалічні форми сполуки (І) можуть об'єднуватися з будь-яким пероральним нетоксичним, фармацевтично прийнятним інертним носієм, наприклад, етанолом, гліцерином, водою і т. п. Такого типу рідкий склад може містити засіб для підсолоджування, який 94928 26 робить його більш приємним на смак при вживанні. Засіб для підсолоджування вибирають серед таких речовин, як сахароза, маніт, сорбіт, ксилітол, лактоза тощо, або замінників цукру, таких як цикламат, сахарин, аспартам і т. п. Якщо засобом для підсолоджування служить замінник цукру, то кількість його у складі згідно з винаходом повинна бути значно меншою, ніж при використанні цукру. Таким чином, кількість засобу для підсолоджування у фармацевтичному складі згідно з винаходом може становити приблизно від 0,1 до 50%(мас), включаючи в цей інтервал всі можливі комбінації та субкомбінації конкретних кількостей. У кращому варіанті кількісний інтервал засобу для підсолоджування лежить у межах від 0,5 до 30%(мас). Кращими порівняно з іншими засобами для підсолоджування є цукри і особливо сахароза. Як виявилося, розмір часток використовуваного сахарозного порошку значно впливає на зовнішній вигляд кінцевого фармацевтичного продукту та його смакові якості. Кращим для сахарозного компонента є розмір часток в діапазоні від 200 до 325 меш стандартного сита США (US Standard Screen), включаючи всі комбінації інтервалів та індивідуальних розмірів часток у цьому діапазоні. Стерильні розчини для ін'єкцій можуть готуватися шляхом змішування потрібних кількостей кристалічних форм сполуки (І) у відповідному розчиннику з різноманітними іншими потрібними інгредієнтами, переліченими в даному описі, і наступної фільтрувальної стерилізації. Дисперсії в загальному випадку можуть готуватися шляхом включення стерилізованого активного інгредієнта у стерильний носій, який містить дисперсне середовище та інші потрібні інгредієнти. Такою дисперсією може бути, наприклад, стерильний порошок для готування стерильних розчинів для ін'єкцій. Виготовляти такі продукти можна, наприклад, за допомогою процесів вакуумної сушки та ліофілізації, які дозволяють отримувати порошок активного інгредієнта плюс будь-який бажаний додатковий інгредієнт із підданого попередній стерильній фільтрації їхнього розчину. Для фахівця в даній галузі, ознайомленого з цим описом, повинно бути цілком зрозуміло, що, будучи розчиненою, сполука (І) втрачає свою кристалічну структуру і стає вже розчином сполуки (І). Проте, для готування рідких препаратів, у котрих сполука (І) є, наприклад, у розчиненому або суспендованому стані, можуть використовуватися всі форми згідно з даним винаходом. Крім того, кристалічні форми сполуки (І) можуть бути включені у тверді фармацевтичні препарати. Рідкі склади згідно з винаходом можуть також містити інші компоненти, які зазвичай використовуються у фармацевтичних препаратах. Одним із таких компонентів є лецитин. У складах згідно з винаходом він використовується як емульгатор і додається в кількості від 0,05 до 1%(мас), включаючи в цей інтервал всі можливі комбінації та субкомбінації конкретних кількостей. Ще кращою для емульгаторів є кількість приблизно від 0,1 до 0,5%(мас). Серед інших 27 компонентів, які можуть використовуватися у складах згідно з винаходом слід згадати такі: антимікробні консерванти, наприклад бензойну кислоту або парабени; суспендувальні засоби, наприклад колоїдний двоокис кремнію; антиоксиданти; місцеві пероральні анестетики; коригенти смаку та запаху; барвники. Вибір таких довільних компонентів та визначення їхньої кількості у складах згідно з винаходом є у сфері компетенції фахівця у даній галузі і більш детально розглядається у наведених нижче робочих прикладах здійснення винаходу. Кристалічні форми сполуки (І) можуть бути також зв'язаними з розчинними полімерами, що використовуються як носії для націлюваних на об'єкт лікування ліків. Такими полімерами можуть бути, наприклад, полівінілпіролідин-пірановий співполімер, полігідроксипропілметакриламідфенол, полігідроксіетил-аспартамідфенол і поліоксіетилен-полілізин, заміщений пальмітоїловими залишками. Желатинові капсули кристалічних форм сполуки (І) можуть містити кристалічну сполуку (І) та описані тут рідкі або тверді склади. Желатинові капсули можуть містити також порошкові носії, зокрема, лактозу, крохмаль, похідні целюлози, стеарат магнію, стеаринову кислоту і т. п. Аналогічні вищеописаним розріджувачі можуть використовуватися для виготовлення пресованих таблеток. Як таблетки, так і капсули, можуть виготовлятися як препарати пролонгованої дії із забезпеченням безперервного вивільнення медикаменту протягом багатьох годин. Таблетки можуть покриватися цукром або плівкою, що маскує їхній неприємний смак і захищає їх від атмосферного впливу, або нести ентеросолюбільне покриття для селективної дезінтеграції у шлунково-кишковому тракті. У загальному випадку в розчинах для парентерального введення носіями можуть служити вода, підходяща олія, фізіологічний розчин, водний розчин декстрози (глюкози), підходящі цукрові розчини та гліколі, такі як пропіленгліколь або поліетиленгліколі. Розчини для парентерального застосування готують шляхом розчиняння кристалічного ефавіренцу в носії і, в разі потреби, додавання буферних речовин, Підходящими стабілізаторами для них є антиокислювальні речовини, такі як бісульфіт натрію, сульфіт натрію та аскорбінова кислота, використовувані самі або в комбінаціях між собою. Можуть використовуватися також лимонна кислота, її солі та натрій-EDTA. Парентеральні розчини можуть також містити консерванти, такі як бензалконійхлорид, метил- або пропілпарабен і хлорбутанол. Підходящі фармацевтичні носії описані в публікації (Remington's Pharmaceutical Sciences, Mack Publishing Co.), включеній даним тут в усій її повноті шляхом посилання. Краща кристалічна форма сполуки (І) може служити компонентом (а) даного винаходу і бути незалежно будь-якою лікарською формою, що відповідає викладеному вище, а також може вводитися в різноманітних комбінаціях згідно з 94928 28 описаним вище. У подальшому тексті даного опису під компонентом (b) маються на увазі описані тут засоби, підходящі для застосування в комбінаційній терапії. Винаходом передбачені також фармацевтичні набори, які можуть використовуватися для лікування різноманітних розладів і які містять терапевтично ефективну кількість фармацевтичного складу, до котрого входить нова форма сполуки (І) в одному чи більше стерильних контейнерах. Ці набори можуть, крім того, містити звичайні для фармацевтичних наборів компоненти, які повинні бути цілком очевидними для фахівців у даній галузі у світлі викладеного в цьому описі. Стерилізувати контейнери можна за допомогою звичайних методів і засобів, добре відомих фахівцям у даній галузі. Форма 01-Н2-1 сполуки (І) Формою 01-Н2-1 сполуки (І) є дигідрат, який має емпіричну формулу C25Η25Ν7Ο8Ρ1 · 2Н2О. Монокристал форми 01-Н2-1 охарактеризований у Табл. 1. Атоми (за винятком Н) у формі 01-Н2-1 позначені відповідно до показаного на Фіг. 3. Дробові атомні координати подані у Табл. 2. Форма 02-SA-1 сполуки (І) Формою 02-SA-1 сполуки (І) є геміетанолатоктагідрат двоосновної солі натрію з емпіричною формулою C25Η25Ν7Ο8Ρ1Na2 · 8Н2О · 0,5С2Н5ОН. Монокристал форми 02-SA-1 охарактеризований у Табл. 3. Атоми (за винятком Н) у формі 02-SA-1 позначені відповідно до показаного на Фіг. 5. Дробові атомні координати подані у Табл. 4. Форма 03-Е.5-1 сполуки (І) Формою 03-Е.5-1 сполуки (І) є геміетанолат солі моно-трис з емпіричною формулою C25Η25Ν7Ο8Ρ1 · C4H11N1O3 · 0,5 С2Н5ОН. Монокристал форми 03-Е.5-1 охарактеризований у Табл. 5. Атоми (за винятком Н) у формі 03-Е.5-1 позначені відповідно до показаного на Фіг. 8. Дробові атомні координати подані у Табл. 6. Форма 03-SA-2 сполуки (І) Формою 03-SA-2 сполуки (І) є геміацетонатгемігідрат солі моно-трис з емпіричною формулою C25Η25Ν7Ο8Ρ1 · C4H11N1O3 - 0,5Н2О · 0,5С3Н6О. Монокристал форми 03-SA-2 охарактеризований у Табл. 7. Атоми (за винятком Н) у формі 03-SA-2 позначені відповідно до показаного на Фіг. 11. Дробові атомні координати подані у Табл. 8. Форма 03-DSA-2 сполуки (І) Формою 03-DSA-2 сполуки (І) є сіль моно-трис, яка являє собою дегідратовану і десольватовану форму 03-SA-2. Характеристики монокристалу форми Температура Довжина хвилі Кристалографічна система, просторова група 293(2) K 1,54178 Å Моноклінна, Р2(1 29 Розміри елементарної комірки 94928 30 а = 17,2174(18) Å С(20) 1920(20) 614(14) α = 90° С(21) 1278(19) 186(12) b = 18,1242(19) Å С(22) 629(17) 530(20) β = 105,191(4)° С(23) 630(20) 1270(20) с = 9,3705(9) Å С(24) 1240(20) 1703(14) γ = 90° С(25) 1878(12) 1340(20) 3 Об'єм 2821,9(5) А O(1W) 10482(16) 1379(15) 3 Z, Розрахункова густина 4, 1,458 мг/м O(2W) 11290(90) 1740(100) -1 Коефіцієнт абсорбції 1,474 мм F(000) 1296 Розміри кристалу 0,18 × 0,15 × 0,01 мм Інтервал Θ для збору даних 2,66-39,60° Характеристики монокристалу форми Обмежувальні індекси -13
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline forms of 1-benzoyl-4-[2-[4-methoxy-7-(3-methyl-1h-1,2,4-triazol-1-yl)-1-[(phosphonooxy)methyl]-1h-pyrrolo[2,3-c]pyridin-3-yl]-1,2-dioxoethyl]-piperazine
Автори англійськоюChen Chung-Pin H., Digiugno Dawn, Gao Qi, Gu Chong-Hui, Levons Jaquan Kalani, Yang Bing-Shiou
Назва патенту російськоюКристаллические формы 1-бензоил-4-[2-[4-метокси-7-(3-метил-1н-1,2,4-триазол-1-ил)-1-[(фосфонокси)метил]-1н-пиррол[2,3-с]пиридин-3-ил]-1,2-диоксоэтил]пиперазина
Автори російськоюЧен Чанг-Пен Х., Диджиугно Дон, Гао Ки, Гу Чонг-Хьюи, Левонс Йакван Калане, Янг Бинг-Шиу
МПК / Мітки
МПК: C07F 9/09, C07D 471/04, A61K 31/437, A61P 31/18
Мітки: 1-бензоїл-4-[2-[4-метокси-7-(3-метил-1н-1,2,4-триазол-1-іл)-1-[(фосфонокси)метил]-1н-пірол[2,3-с]піридин-3-іл]-1,2-діоксоетил]піперазину, кристалічні, форми
Код посилання
<a href="https://ua.patents.su/21-94928-kristalichni-formi-1-benzol-4-2-4-metoksi-7-3-metil-1n-124-triazol-1-il-1-fosfonoksimetil-1n-pirol23-spiridin-3-il-12-dioksoetilpiperazinu.html" target="_blank" rel="follow" title="База патентів України">Кристалічні форми 1-бензоїл-4-[2-[4-метокси-7-(3-метил-1н-1,2,4-триазол-1-іл)-1-[(фосфонокси)метил]-1н-пірол[2,3-с]піридин-3-іл]-1,2-діоксоетил]піперазину</a>
Попередній патент: Спосіб одержання продукту в конденсованій фазі з одного або декількох газофазових реагентів
Наступний патент: Водно-дисперсійна композиція для ізоляційного покриття
Випадковий патент: Розкидач органічних добрив із куп












