Новий функціонально активний, високоочищений, стабільний кон’югат інтерферону альфа з поліетиленгліколем, представлений одним позиційним ізомером пег-naн-іфн, зі зменшеною імуногенністю, із пролонгованою біолог
Номер патенту: 99766
Опубліковано: 25.09.2012
Автори: Руденко Єлєна Гєоргієвна, Морозов Дмітрій Валєнтіновіч, Чєрновская Татьяна Вєніаміновна, Клєнова Ангєліна Всєволодовна, Дєнісов Лєв Алєксандровіч
Формула / Реферат
1. Стабільний кон'югат ПЕГильованого інтерферону-а формули (І), що являє собою один позиційний ізомер
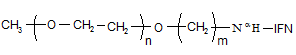 (I),
(I),
де:
n - цілі значення від 227 до 10000;
m - ціле число ≥ 4;
![]() - інтерферон-α.
- інтерферон-α.
2. Кон'югат за п. 1, у якому m являє собою ціле число рівне 4.
3. Кон'югат за п. 1, у якому інтерферон-a являє собою природний або рекомбінантний інтерферон-аα-2b.
4. Кон'югат за п. 1, у якому середня молекулярна маса поліетиленгліколю складає від 10 до 40кДа.
5. Кон'югат за п. 1, у якому N- кінцева група представлена залишком цистеїну (Cys).
6. Фармацевтична композиція, що має противірусну, антипроліферативну і імуномодулюючу активність, що містить кон'югат загальної формули (І) в ефективній кількості і фармацевтично прийнятні допоміжні компоненти.
7. Фармацевтична композиція за п. 6 для застосування як лікарського засобу для лікування вірусних і онкологічних захворювань і захворювань, що супроводжуються первинними або вторинними імунодефіцитними станами.
8. Фармацевтична композиція за п. 7, де вірусне захворювання являє собою гепатит С або гепатит В.
9. Фармацевтична композиція за п. 7, де онкологічне захворювання являє собою мієлолейкоз.
10. Фармацевтична композиція за п. 7, де онкологічне захворювання являє собою меланому.
11. Лікарський засіб, що включає кон'югат формули (І), що має противірусну, антипроліферативну і імуномодулюючу активність.
12. Лікарський засіб за п. 11, що включає буфер, ізотонуючий агент, стабілізатор і воду.
13. Лікарський засіб за п. 12, що включає тригідрат ацетату натрію, оцтову кислоту, натрію хлорид, полісорбат 80, ЕДТА, воду для ін'єкцій.
14. Застосування кон'югата формули (І) для одержання лікарського засобу, що має противірусну, антипроліферативну і імуномодулюючу активність.
15. Застосування за п. 14 для одержання лікарського засобу, що має противірусну активність у відношенні гепатиту С або гепатиту В.
16. Спосіб профілактики і/або лікування вірусних захворювань, при якому вводять терапевтично ефективну кількість кон'югата формули (І).
17. Спосіб за п. 16, де вірусне захворювання являє собою гепатит С або гепатит В.
18. Спосіб за п. 16, при якому додатково вводять терапевтично ефективну кількість рибавірину.
19. Спосіб профілактики і/або лікування захворювань, що супроводжуються первинними або вторинними імунодефіцитними станами, при якому вводять терапевтично ефективну кількість кон'югата формули (І).
20. Спосіб профілактики і/або лікування онкологічних захворювань, при якому вводять терапевтично ефективну кількість кон'югата формули (І).
21. Спосіб за п. 20, де онкологічне захворювання являє собою мієлолейкоз.
22. Спосіб за п. 20, де онкологічне захворювання являє собою меланому.
23. Контейнер, герметично запаяний у стерильних умовах, що відповідають зберіганню перед застосуванням, який включає фармацевтичну композицію за п. 6.
24. Контейнер за п. 23, де зазначений контейнер являє собою попередньо заповнений шприц, флакон або автоінжектор.
25. Набір, що включає контейнер за п. 24 і інструкцію по застосуванню.
Текст
Реферат: Винахід належить до нового функціонально активного, високоочищеного, стабільного кон'югата інтерферону альфа з поліетиленгліколем, представленого одним позиційним ізомером ПЕГα N H, зі зменшеною імуногенністю, із пролонгованою біологічною дією, придатного для медичного застосування, з поліпшеними фармакокінетичними параметрами, загальної формули: CH3 O CH2 CH2 n O CH2 m IFN (І) , де: n - цілі значення від 227'до 10000 так, що молекулярна маса ПЕГ складає приблизно 1000040000 Да; m - ціле число ≥ 4; IFN - природний або рекомбінантний поліпептид, що має активність ІФН-альфа, UA 99766 C2 (12) UA 99766 C2 та до імунобіологічного засобу на його основі. Також винахід належить до лікарських засобів, що містять заявлений кон'югат формули (І), фармацевтичних композицій, придатних для лікування вірусних і онкологічних захворювань і захворювань, що супроводжуються первинними або вторинними імунодефіцитними станами, що містять заявлений кон'югат ПЕГ-ІФН і терапевтично прийнятні допоміжні компоненти. UA 99766 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід належить до фармацевтики і медицини, а саме, до нових фізіологічно активних кон'югатів інтерферону, зокрема, до нових кон'югатів інтерферону з поліетиленгліколем, що можна використовувати в медицині, наприклад, для лікування вірусних, імунних і онкологічних захворювань. Інтерферони (ІФН) - це група біологічно активних білків або глікопротеїдів, що продукуються різними клітинами у відповідь на вірусну інфекцію або при впливі на клітини деяких хімічних і біологічних речовин (Isaacs & Lindeman, 1957; Pestka et al., 2007). Зв'язування ІФН із клітинними рецепторами приводить до індукції синтезу цілого ряду внутрішньоклітинних білків, що опосередковують противірусну, імуномодулюючу та антипроліферативну дію ІФН (Pestka et al., 2004; Bekisz, 2004). Гени різних ІФН людини були клоновані і експресовані в бактеріальних і тваринних клітинах, в результаті було отримано та очищено багато рекомбінантних ІФН (Pestka et al., 2004; Pestka, 2007). Лікарські препарати, що містять рекомбінантні ІФН, застосовуються в клінічній практиці для лікування цілого ряду вірусних, онкологічних і імунних захворювань (Pestka et al., 2004; Chevaliez & Pawlotsky, 2009). На даний час препарати на основі ІФН застосовуються в клінічній практиці для лікування цілого ряду вірусних, онкологічних і імунних захворювань (Pestka et al., 2004). Найбільш широке використання препарати ІФН одержали для лікування вірусних гепатитів (Chevaliez & Pawlotsky, 2009), що представляють одну з найбільш серйозних соціальних проблем. На даний час у світі нараховується близько 350 млн. хронічно хворих гепатитом В та 170 млн. хворих гепатитом С (Marcellin, 2009). Захворювання гепатитом С в більшості випадків набуває хронічного плину з формуванням тяжких наслідків - цирозу печінки і гепатоцелюлярної карциноми (Modi & Liang, 2008). За даними ВООЗ з 1961 року в США і країнах Західної Європи хронічні гепатити і цирози печінки, як причина смерті, перемістилися з 10 на 5 місце (Marcellin, 2009). Відомо також застосування препаратів, що містять ІФН-α для лікування ряду лейкозів і солідних пухлин, у тому числі рецидивної меланоми (Bukowski et al., 2002; Decantris et al., 2002; Qintas-Cardama et al., 2006). Ефективність дії препаратів нативних ІФН обмежена швидким усмоктуванням з підшкірних тканин, великим об'ємом розподілу, відносно низькою стабільністю, коротким періодом напіввиведення, високою імуногенністю і токсичністю (Wills, 1990). В результаті, протягом декількох годин після введення спостерігається швидке падіння концентрації ІФН у плазмі крові, при цьому інтерферон не визначається в плазмі вже через 24 години після ін'єкції (Chatelut et al., 1999). Зниження концентрації інтерферону створює умови для поновлення реплікації вірусу і збільшення концентрації вірусних частинок (Lam et al., 1997). Тому виникає необхідність частих введень препарату для досягнення ефективних терапевтичних концентрацій у плазмі крові, що призводить до виникнення дозозалежних побічних ефектів. Внаслідок зазначених особливостей монотерапія хронічного гепатиту С (ХГС) ІФН-α2b протягом 12 міс. приводила до стійкої вірусологічної відповіді усього у 15-20 % пацієнтів, у хворих з генотипом їв і високим вірусологічним навантаженням ефективність препарату не спостерігалася зовсім (McHutchinson et al., 1998). Терапевтична ефективність ІФН може бути підвищена при використанні препаратів пролонгованої дії, зокрема, "ПЕГильованих" ІФН (Manns et al., 2001; Hadziyannis et al., 2004; Zeuzem et al., 2001). Одержання ПЕГильованих ІФН полягає в хімічному зв'язуванні молекули інтерферону з полімером - монометоксиполіетиленгліколем (мПЕГ), що складається з повторюваних субодиниць етиленоксиду з метоксигрупою на одному кінці і гідроксильною групою - на іншому. Молекула мПЕГ може мати різну молекулярну масу і стереохімічну структуру (лінійна або розгалужена). Для проведення реакції ПЕГилювання гідроксильну групу на кінці мПЕГ активують різними реактивними функціональними групами. Активований мПЕГ може ковалентно зв'язуватися з білком в одному або в кількох місцях, що залежить від природи активованої групи та умов реакції (Zalipsky & Hurris, 1997; Roberts et al., 2002). ПЕГилювання ІФН приводить до поліпшення фармакокінетики, збільшення часу напіввиведення з крові, зниження коливань концентрації в крові, зниження імуногенності і токсичності, збільшення активності in vivo (при зниженні активності in vitro); збільшення стабільності (Glue et al., 2000; Reddy et al., 2001). Зниження активності в системі in vitro прямо залежить від молекулярної маси використовуваного ПЕГ. Приєднання невеликих молекул ПЕГ з молекулярною масою ≤ 5000 Да викликає незначні зміни активності in vitro (Grace et al., 2005). Фармакодинамічні і фармакокінетичні властивості ПЕГильованих білків, що містять ПЕГ з такою масою, і немодифікованих білків практично не відрізняються. Приєднання ПЕГ з більшою молекулярною 1 UA 99766 C2 5 10 15 20 25 30 35 40 45 50 55 масою і множинними ділянками приводить до значного зниження біоактивності in vitro, в результаті неефективного зв'язування з рецептором, однак у цьому випадку спостерігається поліпшення фармакокінетичних і фармакодинамічних властивостей ПЕГильованих білків (Delgado et al., 1992), що в результаті приводить до збільшення біологічної активності in vivo (Bailon & Berthold, 1998). Форма ПЕГ також впливає на біоактивність і фармакокінетичні властивості - кон'югат з лінійним ПЕГ поширюється на більший об'єм, ніж з ПЕГ, що має розгалужену структуру (Caliceti et al., 2003). Противірусна активність і біологічні властивості кон'югатів ПЕГ-ІФН у значній мірі залежать також від використовуваних активованих мПЕГ, функціональні групи яких відрізняються за здатністю модифікувати різні амінокислотні залишки білка і за типом утворених з білком хімічних зв'язків (Roberts et al., 2002). При одержанні ПЕГильованих білків найбільш широке застосування знайшли активовані мПЕГи, здатні зв'язуватися з вільними аміногрупами білків (сукцинімідилкарбонатні, сукцинімідилсукцинатні, трезилатні, триазинові, гідроксисукцинімідні ефіри, ацетальдегіди та ін.). З рівня техніки відомі різні кон'югати ПЕГ-ІФН. Відомий кон'югат ПЕГ-ІФН-α2а з лінійним ПЕГ з молекулярною масою 1-5000 Да (патент США № 5382657, 1995). Для кон'югації використовували етандіольні похідні мПЕГ, реакцію проводили при pH 10 при кімнатній температурі протягом 0,5-4 годин. Для проведення реакції ПЕГилювання ІФН використовували 3х кратний надлишок ПЕГ. У використовуваних умовах зв'язування ПЕГ з ІФН відбувалося через стерично доступні вільні аміногрупи різних лізинів (Lys-31, Lys133, Lys134, Lys23, Lys131, Lys121, Lys70, Lys83, Lys49 і Lys 112) з утворенням карбамідного зв'язку (Monkarsh et al., 1997). Таким чином, отриманий кон'югат ПЕГ-ІФН-α2а складався із суміші позиційних ізомерів, де кожний ізомер містив один ПЕГ. В порівнянні з немодифікованим ІФН питома противірусна активність ізомерів варіювала від 6 % (для Lys112) до 40 % (для Lys133). Сумарна питома активність отриманого кон'югата, що складається з 11 ізомерів, складала 34 % від немодифікованого ІФН. Активність отриманих кон'югатів in vitro також залежала від молекулярної маси ПЕГ і варіювала від 45 % (для ПЕГ - 2500 Да) до 25 % (у випадку ПЕГ - 10000 Да). Недоліками отриманого кон'югата є: 1. використання етандіол-активованих мПЕГ з низькою молекулярною масою (≤5000 Да), в результаті чого фармакокінетичні параметри отриманого кон'югата ПЕГ-ІФН і немодифікованого ІФН відрізнялися незначно, у зв'язку з чим даний кон'югат не знайшов застосування в клініці; 2. утворення великої кількості позиційних ізомерів з різною питомою активністю, у яких ПЕГ був зв'язаний з молекулою ІФН через вільні аміногрупи різних лізинів. Відомі кон'югати ПЕГ-ІФН-α2b, отримані при кон'югації нативного ІФН-α2b з лінійною (патент Росії № 2311930, 2004) або розгалуженою (патент Росії №2382048, 2008) похідною мПЕГ з молекулярною масою 13000-17000 Да. Реакцію проводили при pH 9,5 протягом 60 годин (для лінійного мПЕГ) або при pH 7,5 протягом 12 годин (для розгалуженого мПЕГ), використовуючи 50-100 кратний молярний надлишок активованого ПЕГ. В результаті були отримані кон'югати ПЕГ-ІФН, сумарна противірусна активність якого варіювала від 29 до 38 % від активності немодифікованого ІФН. Дані про стабільність зв'язку, кількість позиційних ізомерів і їх питому противірусну активність не приведено. Недоліками отриманих кон'югатів є: 1. використання трезил-похідних активованого мПЕГ з часом напівжиття у водних розчинах менше 20 хв. Раніше було показано, що при взаємодії трезилат-похідних ПЕГ з білками, крім стабільних амідних зв'язків через аміногрупи, утворяться також нестабільні сульфаматні зв'язки (Gais & Ruppert, 1995); 2. зв'язування трезил-активованих ПЕГ з білками відбувається через усі стерично доступні вільні аміногрупи лізину (Roberts et al., 2002), що приводить до утворення декількох позиційних ізомерів; 3. проведення реакції ПЕГилювання ІФН при високих значеннях pH (pH=10) протягом тривалого часу (60 годин) може привести до зміни структури ІФН; 4. значний надлишок активованого ПЕГ при проведенні реакції ПЕГилювання ІФН (молярне співвідношення ПЕГ/білок складало 50-100/1) приводить до високої вартості отриманого продукту. Відомий кон'югат ПЕГ-ІФН-α2b, отриманий при зв'язуванні нативного ІФН-α2b з розгалуженою триазиновою похідною мПЕГ з молекулярною масою 7500-35000 Да (патент Росії № 2298560, 2004), сумарна противірусна активність якого складала 6,4 % від активності немодифікованого ІФН. Даних про стабільність зв'язку, кількість позиційних ізомерів і їх питому противірусну активність не приведено. Недоліками отриманого кон'югата є: 2 UA 99766 C2 5 10 15 20 25 30 35 40 45 50 55 1. використання триазин-хлорид похідних активованого мПЕГ, що крім вільних аміногруп здатні зв'язуватися з функціональними групами інших амінокислот - серину, тирозину, треоніну і гістидину, що приводить до появи ряду ізомерів, частина з яких характеризується нестабільним зв'язком. Більш того, триазинові похідні на даний час не використовуються через їх високу токсичність (Veronese & Pasut, 2005); 2. низька питома активність кон'югата ПЕГ-ІФН. Відомий кон'югат ПЕГ-ІФН-α2а, отриманий при кон'югації ІФН-α2а з розгалуженим ПЕГ з молекулярною масою 40 кДа (патент Росії № 2180595, 1997). Для кон'югації використовували Nгідроксисукцинімід-ефірну похідну мПЕГ, що вибірково взаємодіє з доступними вільними аміногрупами білка з утворенням стабільного амідного зв'язку. Реакцію проводили при pH 9 при 4 °C протягом 2 годин при співвідношенні мПЕГ/білок рівному трьом. Реакцію зупиняли та очищення отриманого кон'югата проводили на сорбенті Fractogel EMD CM 650 (М). Вихід очищеного кон'югата складав 40-45 %. У цьому випадку був отриманий кон'югат ІФН-ПЕГ, що складається з 6 позиційних ізомерів, кожний з який був зв'язаний з однією молекулою ПЕГ стабільним зв'язком через вільні аміногрупи лізинів - Lys31, Lys121, Lys131, Lys134, Lys70 і Lys83 (Bailon et al., 2001; Foser et al., 2003). Ізомери, зв'язані з ПЕГ через лізини в положенні 31, 121, 131 і 134, у сумі складали 94 %. Активність сумарного кон'югата, що складається з 6 позиційних ізомерів, складала 1-7 % від нативного ІФН-α2а (Bailon et al., 2001; Boulestin et al., 2006). Незважаючи на низьку противірусну активність in vitro, даний кон'югат в порівнянні з немодифікованим ІФН мав поліпшені фармакокінетичні властивості (Silva et al., 2006, Boulestin et al., 2006), і на даний час використовується в клініці під назвою "Пегасис" (виробництво фірми "Хоффманн-Ля Рош). Недоліками отриманого кон'югата є: 1. використання N-гідроксисукцинімід-ефір активованого ПЕГ, що зв'язується з усіма стерично доступними аміногрупами, в результаті отриманий кон'югат представляв суміш з 6 ізомерів, що відрізняються питомою активністю. 2. низька противірусна питома активність отриманого кон'югата in vitro. Прототипом даного винаходу є кон'югат ПЕГ-ІФН-α2b, описаний у патенті США № 5951974, 1999). Для реакції ПЕГилювання використовували лінійний мПЕГ, активований сукцинімідил карбонатною групою (SC-mPEG) з молекулярною масою від 5000 до 12000Да. За описаним методом був отриманий кон'югат ІФН із ПЕГ з молекулярною масою 12кДа, що на даний час застосовується в клініці для лікування вірусних гепатитів - препарат "Пегінтрон" (фірма "SheringPlough", США). Встановлено, що отриманий кон'югат ПЕГ-ІФН-α2b (препарат "Пегінтрон") складається з 13 позиційних ізомерів, кожний з який містить одну молекулу ПЕГ, приєднану до різних ділянок молекули білка (Wang et al. 2000; Grace et al., 2001; Youngster et al., 2002). Було показано, що молекула ПЕГ була зв'язана з інтерфероном не тільки через вільні аміногрупи лізинів (Lys31 Lys 49, Lys83, Lys121, Lys131, Lys133, Lys134 і Lys164) і N- кінцевого цистеїну (Cysl), але і через імідазольне кільце гістидину (His7, His34), тирозину (Туr129) і ОН-групу серину (Ser163). Вміст окремих ізомерів варіював від 0,8 (Туr129) до 47 % (His34). Противірусна активність сумарного препарату Пегінтрону, що складається з 13 позиційних ізомерів, складала 28 % від нативного білка. Питома активність окремих ізомерів варіювала від 11 до 37 % від нативного ІФН-α2b (Youngster et al., 2002). Найбільша питома активність була в основного ізомеру, скон'югованого з ПЕГ через His34, що складала 37 % від нативного білка. Вільні аміногрупи ІФН були з'єднані з ПЕГ через стабільний зв'язок, тоді як в основному ізомері, що складає приблизно 47 %, ПЕГ був з'єднаний з імідазольним кільцем гістидину (His34) через нестабільний (у водних розчинах) карбаматний зв'язок (Roberts et al., 2002). Фармакокінетичні параметри отриманого кон'югата були краще, ніж у немодифікованого ІФН (Silva et al., 2006). Недоліками отриманого кон'югата є: 1. використання сукцинімідил карбонат активованого ПЕГ, що зв'язується не тільки з вільними аміногрупами ІФН, але і з функціональними групами інших амінокислот. В результаті отриманий кон'югат складався із суміші 13 позиційних ізомерів, що відрізняються противірусною питомою активністю; 2. утворення нестабільного імідазол-карбонатного (карбаматного) зв'язку в основному (His34) ізомері кон'югата ПЕГ-ІФН приводить до того, що при потраплянні в організм препарату "Пегінтрон" гідролізується і вивільняється нативний ІФН, що чинить біологічну дію. Таким чином, препарат "Пегінтрон" найкраще розцінювати як про-ліки, які після введення в організм розщеплюються з утворенням активного інтерферону (Foster, 2004). Через нестабільність ПЕГ 3 UA 99766 C2 5 10 ІФН у розчині, лікарська форма "Пегінтрону" зберігається тільки у вигляді ліофільно-висушеного порошку. Задача даного винаходу полягала в одержанні нового стабільного кон'югата ПЕГильованого ІФН, з активністю ІФН альфа, що складається з одного позиційного ізомеру, з поліпшеною стабільністю, зі зниженої імуногенністю, з поліпшеними фармакокінетичними параметрами, з оптимальним поєднанням параметрів молекулярної маси ПЕГ і противірусної активності, придатного для створення лікарського препарату медичного призначення, що сприяє розширенню арсеналу лікарських засобів заданої спрямованості, фармацевтичної композиції на основі отриманого ПЕГ-ІФН. Поставлена задача вирішується створенням нової молекули функціонально активного кон'югата ПЕГ-ІФН з активністю інтерферон-альфа, у якому лінійна молекула ПЕГ з молекулярною масою від 10 до 40000 Да зв'язана з молекулою ІФН-α стабільним зв'язком строго через альфа аміногрупу N- кінцевого цистеїну так, що загальна формула кон'югата ПЕГІФН із лінійним мПЕГ являє собою наступну сполуку (І): CH3 15 20 30 35 40 45 50 CH2 CH2 n O CH2 m IFN (І), де: n - цілі значення від 227 до 10000; m - ціле число 4; IFN - природний або рекомбінантний поліпептид, що має активність ІФН-альфа. В отриманому кон'югаті лінійний ПЕГ з молекулярною масою 10000-40000Да зв'язаний з альфа аміногрупою N- кінцевої амінокислоти ІФН. Вибірковість модифікації ІФН строго за альфа-аміногрупою N- кінцевої амінокислоти досягається за рахунок використання альдегід-активованих мПЕГ загальної формули (II) і проведення реакції ПЕГилювання при pH6: CH3 25 O O CH2 CH2 n O CH2 C m-1 O H (II) , де: n - цілі значення від 227 до 10000, так що молекулярна маса ПЕГ складає приблизно 10000-40000 Да; m - ціле число 4. Оптимальне співвідношення параметрів молекулярної маси ПЕГ і противірусної активності досягається за рахунок використання активованого мПЕГ (II) зі значенням m4. Зниження імуногенності, токсичності і поліпшення фармакокінетичних параметрів досягається за рахунок збільшення молекулярної маси приєднаного ПЕГ. Новим в порівнянні з прототипом є: 1. для одержання кон'югата ПЕГ-ІФН використані альдегідні похідні активованих мПЕГ; 2. структурна формула кон'югата ПЕГ-ІФН; 3. отриманий кон'югат ПЕГ-ІФН представлений одним позиційним ізомером; 4. стабільний зв'язок між молекулою ПЕГ і молекулою ІФН; 5. збільшення молекулярної маси кон'югата ПЕГ-ІФН за рахунок розміру приєднаного ПЕГ; 6. поліпшені фармакокінетичні параметри. Для одержання заявленого кон'югата ПЕГ-ІФН був використаний рекомбінантний ІФН-α2b людини (виробництво ЗАТ "Біокад") і бутир- або пентальалдегідні похідні мПЕГ формули (II) з молекулярною масою 20000 Да. Реакцію кон'югування проводили при pH нижче 6,0 у присутності агента, що відновлює, при температурі, рівній або нижче 20 °C. Молярне співвідношення ПЕГ/білок складало 2,5-5/1. Контроль утворення кон'югата ПЕГ-ІФН проводили за допомогою електрофорезу в поліакриламідному гелі (ПААГ) у присутності додецилсульфату натрію (ДДС) в умовах, що відновлюють, і зворотно-фазної високоефективної хроматографії (ЗФ ВЕРХ). Очищення моноПЕГ-ІФН від продуктів реакції, немодифікованого ІФН і від небажаних форм ПЕГ-ІФН, що містять дві і більше молекул ПЕГ на молекулу білка, проводили за допомогою хроматографії на катіонообмінних сорбентах. Елюцію моноПЕГ-ІФН проводили градієнтом концентрації хлористого натрію від 0,05 до 0,2 г в буферному розчині з pH нижче 6. Очищений препарат моноПЕГ-ІФН діалізували проти 10-50 мМ буферного розчину з pH 4-5, додавали солі або полісахариди, або багатоатомні спирти, або полівінілпіролідони, або моносахариди, або аміносахари, або білки, або амінокислоти та неіонні детергенти і зберігали в пластикових або скляних флаконах із силіконізованою поверхнею при температурі 4±2 °C. 4 UA 99766 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для характеристики отриманого кон'югата моноПЕГ-ІФН-2b досліджували його чистоту, гомогенність, фізико-хімічні, біологічні і фармакокінетичні параметри в порівнянні з немодифікованим ІФН. Пропонований винахід ілюструється фігурами графічного зображення, де представлені: Фіг. 1. Кінетика утворення кон'югата ІФН-2b при проведенні реакції з використанням бутиральдегідної похідної мПЕГ. Фіг. 2. Зворотнофазна ВЕРХ кон'югата ПЕГ-ІФН-α2b на колонці "Symmetry С18" (4,6 × 150 мм). Фіг. 3. Електрофоретичний аналіз кон'югата ПЕГ-ІФН-α2b в порівнянні з немодифікованим ІФН-α2b. Фіг. 4. MALDI мас-спектри немодифікованого ІФН-α2b і кон'югата ПЕГ-ІФН-α2b. Фіг. 5. Локалізація сайту ПЕГилювання в кон'югаті ПЕГ-ІФН-α2b. Порівняння мас-спектрів триптичних пептидів немодифікованого ІФН-α2b (А) і кон'югата ПЕГ-рчІФН-α2 (У) у діапазоні m/z 1200-1400. Фіг. 6. Термостабільність кон'югата ПЕГ-ІФН-α2. Фіг. 7. Протеолітична стабільність кон'югата ПЕГ-ІФН-α2b при обробці трипсином. Фіг. 8. Імуногенність кон'югата ПЕГ-ІФН-α2b в порівнянні з немодифікованим ІФН-α2b. Фіг. 9. Фармакокінетика кон'югата ПЕГ-ІФН-α2b в порівнянні з немодифікованим ІФН-α2b. Приклади конкретного виконання способу одержання ПЕГ-ІФН-2b і дослідження його властивостей приведені нижче. Кон'югати ПЕГ-ІФН-α2 формули (І), що є об'єктом даного винаходу, можуть бути використані для одержання лікарських засобів для профілактики і/або лікування вірусних захворювань, оскільки крім високої стабільності і зниженої імуногенності мають високе значення противірусної активності. Також фармацевтичні композиції, що містять в якості активного інгредієнта ефективну кількість кон'югата формули (І) і отримані відомими методами, що застосовують у фармацевтиці, можуть використовуватися як окремо, так і разом з іншими терапевтичними засобами (наприклад, рибавірин) для профілактики і/або лікування вірусних захворювань (хронічний активний гепатит (зокрема, гепатити В і С) (Jay et al., 2006; McHutchison et al., 2009). Об'єктом даного винаходу також є спосіб профілактики і/або лікування вірусних захворювань, наприклад, гепатиту С і гепатиту В, що включає введення терапевтично ефективної кількості заявленого кон'югата формули (І). З рівня техніки відомо також використання ІФН-α і ПЕГильованих інтерферонів-а в якості імуномодуляторів для лікування онкологічних захворювань, зокрема, волосатоклітинного лейкозу, папіломатозу гортані, меланоми, ниркової карциноми, мієлолейкозів, саркоми Капоши (Decatris et al., 2002; Bukowski et al., 2002; Qintas-Cardama et al., 2006; Loquai et al., 2008; Kaehler et al., 2010). Ha підставі відомого з рівня техніки етіопатогенеза даних захворювань і застосування ІФН-α, а також з кон'югатів для їх профілактики і/або лікування, об'єктами даного винаходу є також лікарські засоби і фармацевтичні композиції, що містять заявлений кон'югат ПЕГ-ІФН-α в ефективній кількості, що мають антипроліферативну і імуномодулюючу дію, що можуть застосовуватися для профілактики і/або лікування онкологічних захворювань і захворювань, що супроводжуються первинними або вторинними імунодефіцитними станами, а також об'єктом даного винаходу є спосіб профілактики і/або лікування онкологічних захворювань і захворювань, що супроводжуються первинними або вторинними імунодефіцитними станами, що включає введення терапевтично ефективної кількості кон'югата ПЕГ-ІФН-α формули (І). Кон'югат формули (І) з необов'язковим фармакологічно прийнятним наповнювачем, розріджувачем і/або фармацевтично прийнятними допоміжними речовинами вводять внутрішньовенно, підшкірно, внутрішньом'язово або яким-небудь іншим придатним способом, наприклад, у вигляді капсул, сиропу, спрея, краплин, ін'єкції або супозиторія. Шлях введення змінюють в залежності, наприклад, від симптомів і віку, частоту введення та інтервал між введеннями змінюють в залежності від захворювання і його тяжкості або від мети (терапевтичне або профілактичне використання), ефективна кількість активного початку ПЕГ-ІФН-α вибирається з урахуванням вищевикладених факторів. У якості фармацевтично прийнятних допоміжних компонентів, що можуть входити у фармацевтичну композицію з ПЕГ-ІФН-α2, можнавикористати: буферні солі (наприклад, ацетатний, цитратний, водень-карбонатний, фосфатний буфери), стабілізатори (наприклад, полісорбати, ЕДТА, полівінілпіролідони, декстрани, ЧСА, ефіри параоксибензойної кислоти, спирти (наприклад, бензиловий спирт), феноли, сорбінова кислота), компонент, що знезаражує (наприклад, бензиловий спирт), регулятор осмотичного тиску (наприклад, хлорид натрію, хлорид калію, поліоли, наприклад, гліцерин, арабітол, сорбітол, манітол, лактоза, декстран), 5 UA 99766 C2 5 10 15 20 25 30 35 40 45 50 55 60 сурфактанти (наприклад, ЧСА, полівінілпіролідон, лецитин, Твін 80, поліоксіетиленполіоксипропілен сополімер, казеїн), поверхнево-активні речовини (наприклад, блок-сополімери етиленоксиду і пропіленоксиду, пропіленоксиду і етиленоксиду, сорбітанмонолаурат, складний ефір сорбіту, складний ефір жирної кислоти полігліцирину, кокамід DEA лаурилсульфат, алканоламід, стеарит поліоксіетиленпропіленгліколю, лауриновий ефір поліоксіетилену, цетиловий ефір поліоксіетилену, полісорбат, моностеарат гліцерину, дистеарат гліцерину, монопальмітат сорбіту, сорбітанмоноолеат поліоксіетилену, сорбітанмонолаурат поліоксіетилену і моностеарат пропіленгліколю), антиоксиданти (наприклад, Трилон Б, Lцистеїн, сульфіт натрію, аскорбат натрію, глутатіон, 2-меркаптоетанол, дитіотриітол, цистеїнгідрохлорид моногідрат, аскорбінова кислота) і розріджувачі (наприклад, вода). Приклад 1 Одержання кон'югата ПЕГ-ІФН-α2b з використанням бутиральдегідної похідної мПЕГ До 785 мл буферного розчину (100 мМ натрій-ацетату, 150 мМ натрію хлористого, pH 5,0), що містить рекомбінантний ІФН-α2 в концентрації 1,7 мг/мл, додавали 16 мл 1М розчину ціаноборгідриду натрію, перемішували і додавали 5 г сухої бутиральдегідної похідної ПЕГ з молекулярною масою 20000 дальтон. Суміш ретельно перемішували і інкубували протягом 22 годин при температурі 17±3 °C. Через різні проміжки часу з реакційної суміші відбирали аліквоти по 50 мкл і аналізували кінетику утворення кон'югата ПЕГ-ІФН-α2 за допомогою методу електрофорезу в ПААГ у присутності ДДС. Для цього до відібраної проби додавали 1/3 об'єму буфера, що містить 125 мМ Трис-НСl, pH 6,8, 20 % гліцерин, 3 % ДДС, 0,005 % бромфеноловий синій, і нагрівали 3 хв. на киплячій водяній бані. Проби в об'ємі 5 мкл вносили в лунки підготовлених пластин ПААГ і проводили електрофорез у 12,5 % ПААГ у присутності ДДС. По закінченні електрофорезу гель офарблювали за допомогою Кумасі R-250. Кінетика утворення кон'югата ПЕГ-ІФН-α2 представлена на фіг. 1. У момент часу, коли вміст ПЕГ-ІФН складав більше 70 %, реакційну суміш розводили в 10 разів 5 мМ натрій-ацетатним буфером, pH 5,0. Приклад 2 Одержання кон'югата ПЕГ-ІФН-α2b з використанням пентальальдегідної похідної мПЕГ До 100 мл буферного розчину (100 мМ натрій-ацетату, 150 мМ натрію хлористого, pH 5,5), що містить рекомбінантний ІФН-α2b в концентрації 2,2 мг/мл, додавали 2,05 мл 1 М розчину ціаноборгідриду натрію, перемішували і додавали 0,9 г сухої пентальдегідної похідної ПЕГ з молекулярною масою 20000 дальтон. Суміш ретельно перемішували і інкубували протягом 24 годин при температурі 6±2 °C. Через різні проміжки часу з реакційної суміші відбирали аліквоти по 50 мкл і аналізували кінетику утворення кон'югата ПЕГ-ІФН за допомогою методу електрофорезу в ПААГ, як описано в прикладі 1. У момент часу, коли вміст ПЕГ-ІФН складав більше 70 %, реакційну суміш розводили в 10 разів 5 мМ натрій-ацетатним буфером, pH 5,0. Приклад 3 Очищення кон'югатамоноПЕГ-ІФН-α2b за допомогою іонообмінної хроматографії на катіонообмінному сорбенті Розведений розчин, отриманий у прикладі 1, наносили на колонку з катіонообмінним сорбентом (СМ-сефароза, 300 мл), врівноваженим 5 мМ натрій-ацетатним буфером, pH 5,0, (буфер А) зі швидкістю 5 мл/хв. Колонку із сорбентом промивали послідовно буфером А і буфером А, що містить градієнт концентрації NaCl від 0,05 до 0,2 М. З кожної фракції відбирали аліквоти для аналізу проб методом електрофорезу в ПААГ, як описано в прикладі 1. Фракції, що містять моноПЕГильований кон'югат ПЕГ-ІФН-α2, поєднували, діалізували проти 10 об'ємів 20 мМ натрій-ацетатного буфера, що містить 150 мМ натрію хлористого, проводили стерильну фільтрацію і зберігали при температурі 4±2 °C. Приклад 4 Очищення кон'югатамоноПЕГ-ІФН-α2b за допомогою іонообмінної хроматографії на катіонообмінному сорбенті Розведений розчин, отриманий у прикладі 2, наносили на колонку з катіонообмінним сорбентом (SP-сефароза, 50 мл), врівноваженим 5 мМ натрій-ацетатним буфером, pH 5,0, (буфер А) зі швидкістю 5 мл/хв. Колонку із сорбентом промивали послідовно буфером "А" і буфером А, що містить градієнт концентрації NaCl від 0,03 до 0,3 М. З кожної фракції відбирали аліквоти для аналізу проб методом електрофорезу в ПААГ, як описано в прикладі 1. Фракції, що містять моноПЕГильований кон'югат ПЕГ-ІФН-α2, поєднували, діалізували проти 10 об'ємів 20 мМ натрій-ацетатного буфера, що містить 150 мМ натрію хлористого, проводили стерильну фільтрацію і зберігали при температурі 4±2 °C. Приклад 5 Аналіз кон'югата ПЕГ-ІФН-α2b за допомогою методу зворотно-фазної високоефективної рідинної хроматографії 6 UA 99766 C2 5 10 15 Кон'югат ПЕГ-ІФН-α2, отриманий за п. 3, розводили 20 мМ натрій-ацетатним буфером, pH 5,0, до концентрації 0,1 мг/мл і 100 мкл отриманої проби вносили на колонку Symmetry C18 (4,6 × 150 мм). Дослідження проводили на хроматографі "Breeze" фірми Waters при 214 нм. З результатів, представлених на фіг. 2, випливає, що за даними ЗФ ВЕРХ чистота заявленого кон'югата ПЕГ-ІФН-α2 складає більше 99 %. Приклад 6 Визначення рівня ендотоксинів Вміст бактеріальних ендотоксинів (БЕ) у пробах кон'югата ПЕГ-ІФН-α2, приготовлених за п. 3 і п. 4, визначали in vitro за допомогою ЛАЛ-теста (модифікація гель-тромб тест) відповідно до вимог ЗФС 42-0002-00. У роботі використовували діагностичний багатокомпонентний набір фірми Associates of CAPE COD, Inc. ЛАЛ-реактив PYROTELL® с чутливістю 0,03 ЕЕ/мл, контрольний стандарт ендотоксину (КСЕ, 0,5 мкг у флаконі), воду для ЛАЛ-теста. З результатів, представлених у табл. 1, видно, що вміст БЕ в пробах кон'югата складає менше 1,5 одиниць ендотоксину (oЕ) на мг білка, що набагато нижче рівня БЕ, припустимого для медичних препаратів на основі рекомбінантних білків. Таблиця 1 Вміст бактеріальних ендотоксинів у кон'югаті ПЕГ-ІФН-α2 Препарат кон'югата ПЕГ-ІФН-α2 ПЕГ-ІФН-α2, отриманий за п. 3 ПЕГ-ІФН-α2, отриманий за п. 4 20 25 30 35 40 45 50 Вміст ендотоксинів (oЕ/мг білка) ≤1,5 ≤1,4 Приклад 7 Електрофоретичний аналіз кон'югата ПЕГ-ІФН-α2b в порівнянні з немодифікованим ІФН-αb Пробу кон'югата ПЕГ-ІФН, отриману за п. 3, аналізували методом електрофорезу в ПААГ, як описано в п. 1. Електрофорез проводили з навантаженням на лунку 40 мкг білка в умовах, що не редукують. Фарбування білків у гелі проводили барвником Кумасі R-250. Одночасно проводили електрофорез немодифікованого ІФН-α2. Кон'югат ПЕГ-ІФН був представлений однією смугою (фіг. 3, трек 1). З електрофореграм кон'югата ПЕГ-ІФН-α2 і немодифікованого ІФН-α2, представлених на фіг 3, видно, що кон'югат ПЕГ-ІФН-α має більш високу молекулярну масу, ніж рчIФН-α (фіг. 3, треки 1 і 2). Слід зазначити, що методом ЕФ точне значення молекулярної маси для ПЕГильованих білків визначити не можна, тому що приєднання гідрофільної молекули ПЕГ до білка значно збільшує радіус Стокса комплексу, що утворився. В результаті просування комплексу ПЕГ-білок у гелі сповільнюється, і значення його молекулярної маси виявляється значно вище, ніж сума молекулярних мас білка і ПЕГ. Приклад 8 Визначення молекулярної маси кон'югата ПЕГ-ІФН-2 в порівнянні з немодифікованим ІФН2 методом мас-спектрометри 1 мкл проби кон'югата ПЕГ-ІФН, отриманої за п. 3, і 0,3 мкл розчину 2,5-дигідроксибензойної -1 кислоти (Aldrich, 10 мг мл у 20 % ацетонітрилі у воді з 0,5 % ТФО) змішували і висушували на повітрі. Аналогічним способом готували пробу немодифованого ІФН-α2. Mac-спектри були отримані на MALDI-час-пролітному мас-спектрометрі Ultraflex II BRUKER (Німеччина), оснащеному УФ лазером (Nd). Мас-спектри отримані в режимі позитивних іонів, у лінійному режимі, погрішність виміру середньої маси не перевищує 10-15 Да. Результати з мас-спектрометричного аналізу немодифікованого рчІФН-2 і кон'югата ПЕГІФН-α2 у діапазоні m/z від 10000-50000 приведені на фіг. 4. 3 фіг. 4А видно, що мас-спектр + рчІФН-2 містить основний пік, що відповідає однозарядному іону [М] з молекулярною масою 19295 Да. У мас-спектрі кон'югата ПЕГ-ІФН-2, приведеному на фіг. 3 В, представлений розмитий + основний пік, що відповідає однозарядному іону [М] з молекулярною масою 40498 Да. Розмитість піка пов'язана з гетерогенністю препаратів монометоксиПЕГ. Для кон'югата ПЕГ-ІФН виміряне значення m/z у максимумі піка (40498 Да) збігається з розрахунковими даними по сумі молекулярних мас ІФН-2 (19295 Да) і приєднаного ПЕГ (20000 Да). Приклад 9 Локалізація сайту ПЕГилювання в кон'югатіПЕГ-ІФН-2b До 5 мкл проби кон'югата ПЕГ-ІФН, отриманої за п. 3, додавали 5 мкл розчину -1 модифікованого трипсину (Promega) у 0,05 М NH 4HCO3 з концентрацією 15 мкг мл . Гідроліз проводили протягом 16 годин при 37 °C, потім до розчину додавали 10 мкл 0,5 % ТФО в 10 % 7 UA 99766 C2 5 10 15 розчині ацетонітрилу у воді і ретельно перемішували. Аналогічним способом готували пробу немодифованого ІФН. Отримані розчини використовували для одержання MALDI-мас-спектрів. Локалізацію сайту зв'язування ПЕГ з молекулою ІФН визначали шляхом порівняння масспектрів триптичного гідролізату кон'югата ПЕГ-ІФН-α2 і немодифікованого рчІФН-α2. У триптичному гідролізаті кон'югата ПЕГ-ІФН-α2 повинний бути відсутнім пептид, що відповідає ділянці білка, по якому відбулася модифікація. У табл. 2 представлені мас-спектри експериментальних триптичних пептидів для немодифікованого ІФН-α і кон'югата ПЕГ-ІФН-α2. З таблиці видно, що мас-спектри триптичних пептидів немодифікованого ІФН-α2b практично збігаються з мас-спектрами триптичних пептидів кон'югата ПЕГ-ІФН-α2 (табл. 2), але в триптичному переварі кон'югата ПЕГ-ІФН-α2 відсутній пептид з молекулярною масою 1313,649, що є присутнім у триптичному переварі немодифікованого рчІФН-α2 (див. також фіг. 5). Відповідно до аналізу теоретичних мас триптичного гідролізату ІФН-α2 пік з m/z 1313,649 відповідає N- кінцевому пептиду білка (табл. 2). Його відсутність у триптичному переварі кон'югата ПЕГ-ІФН-α2 свідчить про модифікацію N- кінцевого пептиду, що, ставши важче на масу ПЕГ, перебуває за межами досліджуваної області спектра. Зв'язування ПЕГ з молекулою ІФН відбулося по єдиній вільній аміногрупі, що присутня у цьому пептиді - по аміногрупі Nкінцевого цистеїну. Таблиця 2 Експериментальні мас-спектри триптичних пептидів кон'югата ПЕГ-ІФН-α2 і немодифікованого ІФН-α2 в порівнянні з теоретичними значеннями Експериментально виявлені пептиди + + [М+H ] ІФН-α2b Кон'югат ПЕГ-ІФН 1313,649 1232,720 1232,673 1076,598 1076,558 910,463 910,463 2225,976 2225,928 2459,264 2459,239 772,447 772,421 902,471 902,443 1030,590 1030,546 741,431 741,424 750,492 750,476 1337,695 1337,651 1209,565 1209,539 1481,783 1481,735 20 25 Теоретичні і пептиди + + Маса [М+H ] 1313,6266 1232,6966 1076,5955 910,5066 2225,9999 2459,3002 772,456 902,4941 1030,5891 741,4042 750,4760 1337,6670 1209,5721 1481,7594 Пептид 1-12 13-22 14-22 24-31 32-49 50-70 99-106 113-120 113-121 121-125 126-131 134-144 135-144 150-162 Послідовність CDLPQTHSLGSR RTLMLLAQMR TLMLLAQMR ISLFSCLK DRHDFGFPQEEFG AETIPVLHEMIQQI VIQGVGVT EDSILAVR EDSILAVRK KYFQR ITLYLK KYSPCAWEVVR YSPCAWEVVR SFSLSTNLQESLR Приклад 10 Визначення специфічної противірусної активності кон'югата ПЕГ-ІФН-α2b У пробах, отриманих за п. 3 і за п. 4, досліджували противірусну специфічну активність відповідно до протоколу, описаного в Європейській фармакопеї з використанням культури клітин, що перевиваються, MBDK, чутливих до інтерферону альфатипу і вірусу везикулярного стоматиту (VSV). У табл. 3 представлені результати дослідження противірусної активності. Як стандарт був використаний міжнародний референс стандарт. З табл. 3 видно, що, незважаючи на приєднання молекули ПЕГ з молекулярною масою 20000 Да, противірусна активність отриманих кон'югатів складає 42-45 % від активності немодифікованого ІФН-α2. Слід зазначити, що кон'югат ПЕГ-ІФН, описаний у способі-прототипі, що містить ПЕГ з молекулярною масою 12000 Да, мав більш низьку активність (28-30 %). 30 8 UA 99766 C2 Таблиця 3 Питома противірусна активність кон'югата ПЕГ-ІФН-α2 в порівнянні з немодифікованим ІФН-α2 Препарат ІФН-α2 Кон'югат ПЕГ-ІФН-α2, отриманий за п. 3 Кон'югат ПЕГ-ІФН-α2, отриманий за п. 4 5 10 15 20 25 30 Специфічна противірусна активність % від активності немодифікованого (МО/мг) ІФН-α2b 8 2,1 × 10 100 % 8 0,7 × 10 40 % 8 0,9 × 10 45 % Приклад 11 Дослідження термостабільності кон'югата ПЕГ-ІФН-α2b 5 мл проби кон'югата ПЕГ-ІФН, отриманого за п. 3, поміщали у водяну баню при температурі (50±2)°С і через різні інтервали часу досліджували появу мутності в розчині білка, вимірюючи оптичну густину при 340 нм. Аналогічно проводили дослідження термостабільності немодифікованого ІФН-α2. Утворення нерозчинних агрегатів білка приводило до появи мутності і до збільшення оптичної густини при 340 нм. На фіг. 6 представлені результати дослідження. За період спостереження (28 годин) кон'югат ПЕГ-ІФН-α2 залишався стабільним, тоді як немодифікований ІФН-α2b через 28 годин практично весь випав в осад. Таким чином, отримані дані дозволяють зробити висновок про значне збільшення термостабільності кон'югата ПЕГ-ІФН-α2 в порівнянні з немодифікованим білком. Приклад 12 Дослідження протеолітичної стабільності кон'югата ПЕГ-ІФН-α2b при обробці трипсином До 1 мл кон'югата ПЕГ-ІФН, отриманого за п. 3, додавали 150 мкл М трис-НСІ буфера, pH 8,5, 2 мкл 0,5 М розчину СаСl2 і 15 мкл трипсину (Promega) з концентрацією 20 мкг/мл. Проби інкубували при 37 °C. Через певні проміжки часу відбирали аліквоти в 100 мкл і додавали 150 мкл 0,5 % розчину трифтороцтової кислоти для зупинки реакції. Аналогічно готували проби, що містять немодифікований ІФН-α2. Далі проби аналізували за допомогою зворотно-фазової ВЕРХ і визначали площу основного піка. Результати дослідження, приведені на фіг. 7, показують, що при обробці трипсином протеолітична стабільність кон'югата ПЕГ-ІФН-α2 вище, ніж у немодифікованого ІФН-α2b. Приклад 13 Визначення стабільності кон'югата ПЕГ-ІФН-α2b при зберіганні З проби, отриманої за п. З, відбирали аліквоти в стерильні пробірки з кришками, типу "Еппендорф". Концентрація білка в кон'югаті ПЕГ-ІФН-α2 складала 1 мг/мл. Проби поміщали в холодильник при температурі (6±2)°С. Через певні проміжки часу відбирали проби та аналізували специфічну противірусну активність і гомогенність препарату за допомогою ЗФ ВЕРХ і електрофорезу (ЕФ) у ПААГ у присутності ДДС в умовах, що не редукують, як описано в п. 1.3 даних табл. 4 видно, що при зберіганні при температурі (6±2)°С кон'югат ПЕГ-ІФН-α2 стабільний протягом, щонайменш, 24 місяців. Таблиця 4 Стабільність кон'югата ПЕГ-ІФН-α2b при температурі (6±2)°С Термін зберігання (місяці) 0 3 6 9 12 8 8 8 8 8 Активність (МО/мл) 0,7 × 10 0,75 × 10 0,7 × 10 0,75 × 10 0,72 × 10 Гомогенність, % 99,67 99,28 99,61 99,30 99,6 (ЗФ ВЕРХ) Гомогенність, % ≥98 ≥98 ≥98 ≥98 ≥98 (ЕФ у ПААГ) Параметри 35 18 8 0,7 × 10 24 8 0,75 × 10 99,21 99,35 ≥98 ≥98 Приклад 14 Дослідження імуногенності кон'югата ПЕГ-ІФН-α2b Кон'югати ПЕГ-ІФН, отримані за п. 3 і за п. 4, розводили до концентрації 5 млн. МО/мл і вводили по 200 мкл (1 млн. МО/миша) внутрішньом'язово мишам ICR з масою тіла 20-22 г 1 раз на тиждень, протягом 5 тижнів (5 груп по 5 мишей у групі). Паралельно готували пробу немодифікованого ІФН і вводили аналогічним образом мишам також у дозі 1 млн. Наприкінці п'ятого тижня у тварин відбирали кров за допомогою ретроорбітальної пункції. Сироватку крові 9 UA 99766 C2 5 10 15 20 25 30 35 40 отримували стандартним методом. Титр антитіл у сироватках, отриманих в результаті імунізації мишей немодифікованим ІФН і кон'югатами ПЕГ-ІФН, визначали за допомогою прямого твердофазного імуноферментного методу (ІФА). Для цього в лунки мікропланшета вносили по 100 мкл розчину немодифікованого ІФН-α2 у концентрації 200 нг/100 мкл. Антисироватки, отримані від різних груп тварин, вносили в лунки планшета в серії з послідовних розведень у два рази. Для детекції імунного комплексу, що утворився, використовували антимишачі імуноглобуліни, скон'юговані з пероксидазою. Титр антисироватки після введення немодифікованого ІФН складав 1/1024. Титр антисироваток після введення кон'югатів ПЕГ-ІФН складав 1/128. Результати дослідження представлені на фіг. 8. Таким чином, з отриманих результатів випливає, що імуногенність отриманих кон'югатів ПЕГ-ІФН-α2 у 8 разів нижче, ніж у немодифікованого ІФН. Приклад 15 Дослідження фармакокінетики кон'югата ПЕГ-ІФН-α2b Пробу кон'югата ПЕГ-ІФН, отриманого за прикладом 3, у дозі 1 млн. МО вводили внутрішньочеревно мишам-самцям. Паралельно іншій групі мишей вводили немодифікований ІФН-α2. Через певні проміжки часу у тварин відбирали кров за допомогою ретроорбітальної пункції. Сироватку крові одержували стандартним методом. Наявність інтерферону в сироватці визначали за противірусною активністю. Результати фармакокінетики представлені на фіг. 9. З результатів випливає, що заявлений кон'югат ПЕГ-ІФН-α2 має значний пролонгований ефект. При введенні нативного ІФН-α2 його вміст у крові тварин досягав максимуму через 1 годину після введення, а потім дуже швидко знижувався. При введенні кон'югата ПЕГ-ІФН, максимальний вміст ІФН у крові тварин спостерігався через 12 годин (фіг. 9), і цей рівень зберігався протягом 50 годин, і тільки потім відбувалося повільне зниження вмісту ІФН-α2 протягом 350 годин. Площа під кривою (AUC) для заявленого кон'югата ПЕГ-ІФН більш ніж у 50 разів перевищувала відповідне значення для немодифікованого ІФН. Потрібно відзначити, що для описаного в способі-прототипі кон'югата ПЕГ-ІФН-α2b, зв'язаного з ПЕГ з молекулярною масою 12000 Да, величина AUC перевищувала величину AUC для ІФН усього в 3-10 разів. Виходячи з отриманих результатів (фіг. 9), були розраховані основні фармакокінетичні параметри для заявленого кон'югата ПЕГ-ІФН-α2. Результати показали, що всмоктування з місця введення, об'єм розподілу, кліренс кон'югата ПЕГ-ІФН значно уповільнені в порівнянні з немодифікованим ІФН, що і забезпечило тривалу циркуляцію заявленого кон'югата ПЕГ-ІФН у крові (більше 14 днів). Приклад 16 Порівняльна характеристика заявленого кон'югата ПЕГ-ІФН-α2b в порівнянні з кон'югатом ПЕГ-ІФН-α2b, що описаний в способі-прототипі Проведено порівняння структури, основних фізико-хімічних та фармакокінетичних параметрів заявленого кон'югата ПЕГ-ІФН-α2b в порівнянні з кон'югатом ПЕГ-ІФН-α2b, що описаний в способі-прототипі (табл. 5). Дані, що представлені в табл. 5, свідчать про значне покращення властивостей заявленого кон'югата ПЕГ-ІФН в порівнянні з кон'югатом зі способупрототипу. Таблиця 5 Основні фізико-хімічні і фармакокінетичні параметри заявленого кон'югата ПЕГ-ІФН-α2 в порівнянні з кон'югатом ПЕГ-ІФН-α2, що описаний в способі-прототипі (патент США № 5951974) Параметри ІФН Структура ПЕГ Молекулярна маса ПЕГ (кДа) Структурна формула кон'югата ПЕГ-ІФН* Кон'югат ПЕГ-ІФН Кон'югат, що описаний в способіЗаявлений кон'югат ПЕГ-ІФН прототипі (патент США № 5951974) ІФН-α2b ІФН-а2b Лінійний Лінійний 20 O H3C 12 O nO Інтерферон альфа 2b H3C 10 O nO Інтерферон альфа 2b UA 99766 C2 Питома активність, % від нативного рчІФН Число позиційних ізомерів Тип зв'язку ПЕГ з білком 40 28 1 13 Нестабільний (для основного ізомеру, зв'язаного з ПЕГ через His34) Стабільний Стабільність в водних Стабільний розчинах Фармакокінетичні параметри Відношення AUC ПЕГІФН/ІФН Нестабільний 50 3-10 * - Структурна формула кон'югата ПЕГ-ІФН, що отриманий за способом-прототипом, дана за посиланням "WHO Drug Information", 2001, v. 15, N. 3-4, p. 206. Приклад 17 Приклади фармацевтичних композицій на основі заявленого кон'югата ПЕГ-ІФН-α2b (А) 5 ПЕГ-ІФН-α2b за п. 3 Натрій-ацетат тригідрат Оцтова кислота крижана Натрій хлористий Полісорбат 80 ЕДТА динатрієва сіль Вода для ін'єкцій 10-500 мкг 1-5 мг до pH 5,0 8-9 мг 0,01-0,1 мг 0,01-0,1 мг 1,0 мл (Б) ПЕГ-ІФН-α2b за п. 4 Натрій-ацетат Оцтова кислота Манітол Декстран Полісорбат 80 ЕДТА динатрієва сіль Вода для ін'єкцій 10 (В) ПЕГ-ІФН-α2b за п. 4 Натрій-ацетат Оцтова кислота Манітол Альбумін людини Полісорбат 80 ЕДТА динатрієва сіль Вода для ін'єкцій 15 20 10-500 мкг 0,4-2,0 мг до pH 5,5 50 мг 15-30 мг 0,01-0,1 мг 0,01-0,1 1,0 мл 10-500 мкг 0,4-2,0 мг до pH 5,5 50 мг 10-12,5 мг 0,01-0,1 мг 0,01-0,1 1,0 мл Приклад 18 Упакування в контейнер лікарського засобу, що містить ПЕГ-ІФН-α2b Лікарський засіб, що включає ефективну кількість заявленого ПЕГ-ІФН-α2b (Приклад 17), розливають у стерильних умовах по 0,5, 0,8, 1,0 і 1,2 мл (для дозування 100 мкг/мл), по 0,5, 0,6, 0,75 і 0,9 мл (для дозування 200 мкг/мл), по 0,5, 0,6, 0,8, 1,0 і 1,2 мл (для дозування 300 мкг/мл) у шприци з нейтрального скла І гідролітичного класу, з упаяними голками, покритими ковпачками захисними еластичними або твердими, закупорені наконечниками на поршні з бутилкаучуку, ламінованого фторполімером. Приклад 19 Упакування в контейнер лікарського засобу, що містить ПЕГ-ІФН-2b 11 UA 99766 C2 5 10 15 20 25 30 35 40 45 50 55 Лікарський засіб, що включає ефективну кількість ПЕГ-інтерферону альфа-2b (Приклад 17), розливають у стерильних умовах по 0,5, 0,8, 1,0 і 1,2 мл (для дозування 100 мкг/мл), по 0,5, 0,6, 0,75 і 0,9 мл (для дозування 200 мкг/мл), по 0,5, 0,6, 0,8, 1,0 і 1,2 мл (для дозування 300 мкг/мл) у флакони з нейтрального скла І гідролітичного класу, закупорені фторгумовими або бутилгумовими пробками з тефлоновим покриттям, обтиснутими алюмінієвими ковпачками. Приклад 20 Набір, що включає упакований в контейнери лікарський засіб, який містить ПЕГ-ІФН-α2b Набір містить по 1 або 4 шприци в комплекті з поршнем (1 або 4, відповідно) /флакона в контурному комірковому упакуванні з плівки полімерної разом з інструкцією по застосуванню, що поміщають у пачку з картону. Джерела інформації: Патент Росії № 2311930, 2004; Патент Росії № 2382048, 2008; Патент Росії № 2298560, 2004; Патент Росії № 2180595, 2005; Патент США № 5951974, 1999; Bailon P., Berthold W., (1998), "Polyethylene glycol-conjugated pharmaceutical proteins", Pharm., Sci. Technol. Today, 1,352-356. Bailon P., Palleroni A., Schaffer С. A., et al., (2001). "Rational design of a potent, long-lasting form of interferon: a 40-kDa branched polyethylene glycol-conjugated interferon alpha-2a forthe treatment of hepatitis C". Bioconjug. Chem. /12:195-202. Bekisz, J., Schmeisser, H., Hernandez, J., Goldman, N. D., Zoon K. С., (2004), "Human Interferons Alpha, Beta and Omega". Growth Factors, Vol. 22 (4), pp. 243-251. Boulestin A., Kamar N., Sandres-saune K, et al. (2006). "Pegylation of IFN-a_and Antiviral Activity", /. Interferon &Cytokine Res. 26:849-853. Bukowski R., Ernstoff M. S., Gore M. E., Nemunaitis J. J., Amato R., Gupta S. K., Tendler C. L. (2002). "Pegylated interferon alfa-2b treatment for patients with solid tumors: a phase I/II study", Clin. Oncol., 2002;20(18):3841-3849. Caliceti P., Veronese F. M (2003), "Pharmacokinetic and biodistribution properties of poly(ethylene glycol)-protein conjugates", Adv. Drug. Deliv. Rev.;55(10): 1261-77. Chatelut E., Rostaing L., Gregoire N., Payen J. L., Pujol A., Izopet J., Houin G., Canal P. A. (1999) "Pharmacokinetic model for alpha interferon administered subcutaneously". Br. J. Clin. Pharmacol.; 47: 365-371. Chevaliez S., Pawlotsky J. M., 2009, "Interferons and their use in persistent viral infections". Handb. Exp. Pharmacol.; (189):203-41. Decatris M., Santhanam S., O'Byrne K (2002). "Potential of interferon-alpha in solid tumours: part 1", BioDrugs. 2002;16(4):261-81. Delgado C., Francis D., Fisher G. E (1992) "The uses and properties of PEG-linked proteins", Crit. Rev. Ther. Drug Carrier Syst, 9 (1992) 249-304. Foser S, Schacher A, Weyer KA, Brugger D, Dietel E, Marti S, Schreitmüller T. (2003), "Isolation, structural characterization, and antiviral activity of positional isomers of monopegylated interferon alpha-2a (PEGASYS)". Protein Expr. Purif., 30(1):78-87. Foster G. R. (2004) "Pegylated interferons: chemical and clinical differences". Aliment Pharmacol. Ther.; 20: 825-830. Glue P., Fang J. W., Rouzier-Panis R., et al. (2000) "Pegylated interferon-alpha2b: pharmacokinetics, pharmacodynamics, safety, and preliminary efficacy data". Clin. Pharmacol. Ther.; 68: 556-67. Grace M., Youngster S., Gitlin G., et al. (2001) "Structural and biologic characterization of pegylated recombinant IFN-alpha2b". J. Interferon Cytokine Res., 21: 1103-1115. Grace, M. J., Lee, S., Bradshaw, S., Chapman, J., et al., (2005) "Site of PEGylation and polyethylene glycol molecule size attenuate interferon-a antiviral and antiproliferative activities through the JAK/STAT signaling pathway", J. Biol. Chem., 280 6327 6336. Isaacs, A. and Lindenmann, J. (1957), "Virus interference: the interferon", Proc.R. Soc. Med., 147: 258-267. Jay H. et al., (2006) "Peginterferon and Ribavirin for Chronic Hepatitis C", The New England J. of medicine, том 356, стор. 1269-1271, 2006. Kaehler K. C., Sondak V. K., Schadendorf D., Hauschild A. (2010), "Pegylated interferons: prospects for the use in the adjuvant and palliative therapy of metastatic melanoma", Eur. J. Cancer. 2010,46(1):41-6. Lam N. P., Pitrak D., Speralakis R., Lau A. H, Wiley T. E., Layden T. J. (1997), "Effect of obesity on pharmacokinetics and biologic effect of interferon-alpha in hepatitis C", Dig. Dis. Sci.; 42(1): 17885. 12 UA 99766 C2 5 10 15 20 25 30 35 40 Manns M. P., McHutchison J. G., Gordon S. C, et al. (2001) " Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomized trial". Lancet, 358: 958-65. Marcellin P. (2009) "Hepatitis В and hepatitis С in2009", Liver International., 29(s1): 1-8. Monkarsh S. P., Ma Y., Aglione A., Bailon P., et al., (2007), "Positional Isomers of Monopegylated Interferon -2a: Isolation, Characterization, and Biological Activity", Analytical Biochemistry, 247:434440. McHutchinson J., Gordon S. C., Schiff E. R. et al., (1998), "Interferon alfa-2b alone or in combination with ribavirin as initial treatment for chronic hepatitis C" TV. Engl. J. Med. Vol. 339, 21,1485-1492. McHutchison J. et al., (2009) "Peginterferon Alfa-2b or Alfa-2a with Ribavirin for Treatment of Hepatitis С Infection", The New England J. of medicine, том 361, стор. 580-593, 2009. Modi A. A., Liang T. J. (2008), "Hepatitis C: a clinical review", Oral. Dis.,v. 14(1): 10-4. Pestka, S., Krause, С. D., Walter M. R (2004), "Interferons, interferon-like cytokines, and their receptors", Immunological Reviews, 202: 8-32. Pestka, S. (2007). "The interferons: 50 years after their discovery, there is much more to learn", J. Biol. Chem., 13;282(28):20047-51. Pestka, S. (2007). "Purification and cloning of interferon alpha", Curr Top Microbiol Immunol.; 316:23-37. Ouintas-Cardama A., Kantarjian H. M., Giles F., Verstovsek S. (2006), "Pegylated interferon therapy for patients with Philadelphia chromosome-negative myeloproliferative disorders". Semin Thromb Hemost., 2006;32(4 Pt 2):409-16. Reddy K. R., Wright Т. L., Pockros P. J., Shiffman M., Everson G. et al., 2001, "Efficacy and safety of pegylated (40-kd) interferon -2a compared with interferon -2a in noncirrhotic patients with chronic hepatitis C", Hepatology, 33, 433-438. Roberts M. J., Bentlev M. D., Harris J. M. (2002)" Chemistry for peptide and protein PEGylation". Adv Druz Deliv Rev., 54(4):459-76. Silva M., Poo J., Wagner F. et al. (2006) "A randomised trial to compare pharmacokinetic, pharmacodynamic, and antiviral effects peginterferon alfa-2b and peginterferon alfa-2a in patients with chronic hepatitis С (COMPARE)", Journal Hepatology, 45: 204-213. Wang, Y. -S., Youngster S., Bausch J., Zhang R., McNemar C, Wyss D. F. (2000), "Identification of the major positional isomer of pegylated interferon alpha-2b" Biochemistry, 2000, 39(35): 1063410640. Wills R. J. "Clinical Pharmacology of interferons". Clin Pharmacokin. 1990; 19:390-399. Youngster S., Wang Y. S., Grace M, Bausch J., Bordens R., Wyss D. F. (2002). " Structure, biology, and therapeutic implications of pegylated interferon alpha-2b" Curr Pharm Des.;8(24):21392157. Zalipsky S (1995). "Functionalized poly(ethylene glycol) for preparation of biologically relevant conjugates", Bioconj. Chem. 6, 150-165. Zeuzem S., Heathcote J. E., Martin N., Nieforth K., Modi M. (2001), "Peginterferon alfa-2a (40 kDa) monotherapy: a novel agent for chronic hepatitis С therapy", Expert Opin Investig Drugs, 10 (12):2201-2213. ФОРМУЛА ВИНАХОДУ 45 1. Стабільний кон'югат ПЕГильованого інтерферону-α формули (І), що являє собою один позиційний ізомер CH3 50 55 O CH2 CH2 n O CH2 m IFN (I), де: n - цілі значення від 227 до 10000; m - ціле число ≥ 4; NH IFN - інтерферон-α. 2. Кон'югат за п. 1, у якому m являє собою ціле число рівне 4. 3. Кон'югат за п. 1, у якому інтерферон-α являє собою природний або рекомбінантний інтерферон-α-2b. 4. Кон'югат за п. 1, у якому середня молекулярна маса поліетиленгліколю складає від 10 до 40кДа. 13 UA 99766 C2 5 10 15 20 25 30 35 5. Кон'югат за п. 1, у якому N-кінцева група представлена залишком цистеїну (Cys). 6. Фармацевтична композиція, що має противірусну, антипроліферативну і імуномодулюючу активність, що містить кон'югат загальної формули (І) в ефективній кількості і фармацевтично прийнятні допоміжні компоненти. 7. Фармацевтична композиція за п. 6 для застосування як лікарського засобу для лікування вірусних і онкологічних захворювань і захворювань, що супроводжуються первинними або вторинними імунодефіцитними станами. 8. Фармацевтична композиція за п. 7, де вірусне захворювання являє собою гепатит С або гепатит В. 9. Фармацевтична композиція за п. 7, де онкологічне захворювання являє собою мієлолейкоз. 10. Фармацевтична композиція за п. 7, де онкологічне захворювання являє собою меланому. 11. Лікарський засіб, що включає кон'югат формули (І), що має противірусну, антипроліферативну і імуномодулюючу активність. 12. Лікарський засіб за п. 11, що включає буфер, ізотонуючий агент, стабілізатор і воду. 13. Лікарський засіб за п. 12, що включає тригідрат ацетату натрію, оцтову кислоту, натрію хлорид, полісорбат 80, ЕДТА, воду для ін'єкцій. 14. Застосування кон'югата формули (І) для одержання лікарського засобу, що має противірусну, антипроліферативну і імуномодулюючу активність. 15. Застосування за п. 14 для одержання лікарського засобу, що має противірусну активність у відношенні гепатиту С або гепатиту В. 16. Спосіб профілактики і/або лікування вірусних захворювань, при якому вводять терапевтично ефективну кількість кон'югата формули (І). 17. Спосіб за п. 16, де вірусне захворювання являє собою гепатит С або гепатит В. 18. Спосіб за п. 16, при якому додатково вводять терапевтично ефективну кількість рибавірину. 19. Спосіб профілактики і/або лікування захворювань, що супроводжуються первинними або вторинними імунодефіцитними станами, при якому вводять терапевтично ефективну кількість кон'югата формули (І). 20. Спосіб профілактики і/або лікування онкологічних захворювань, при якому вводять терапевтично ефективну кількість кон'югата формули (І). 21. Спосіб за п. 20, де онкологічне захворювання являє собою мієлолейкоз. 22. Спосіб за п. 20, де онкологічне захворювання являє собою меланому. 23. Контейнер, герметично запаяний у стерильних умовах, що відповідають зберіганню перед застосуванням, який включає фармацевтичну композицію за п. 6. 24. Контейнер за п. 23, де зазначений контейнер являє собою попередньо заповнений шприц, флакон або автоінжектор. 25. Набір, що включає контейнер за п. 24 і інструкцію по застосуванню. 14 UA 99766 C2 15 UA 99766 C2 16 UA 99766 C2 17 UA 99766 C2 18 UA 99766 C2 Комп’ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 19
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel functionally active, highly purified, stable peg-interferon alpha conjugate represented by one positional isomer peg- nah with reduced immunogenity, prolonged biological action, useful for medicinal use, with improved pharmacokinetic parameters and immunobiological agent based thereon
Автори англійськоюChernovskaia Tat’iana Veniaminovna, Denisov Lev Aleksandrovich, Morozov Dmitrii Valentinovich, Rudenko Elena Heorhievna, Klenova Anhelina Vsevolodovna
Назва патенту російськоюНовый функционально активный, високоочищенный, стабильный конъюгат интерферона альфа с полиэтиленгликолем, представленный одним позиционным изомером пэг-naн-ифн, с уменьшенной иммуногенностью, с пролонгированным биологическим действием, пригодный для медицинского применения, и иммунобиологическое средство на его основе
Автори російськоюЧерновская Татьяна Вениаминовна, Денисов Лев Александрович, Морозов Дмитрий Валентинович, Руденко Елена Георгиевна, Кленова Ангелина Всеволодовна
МПК / Мітки
МПК: C07K 14/555, C07K 14/52, A61K 38/21, C07K 14/57
Мітки: високоочищений, ізомером, альфа, кон'югат, зменшеною, поліетиленгліколем, функціонально, позиційним, біолог, імуногенністю, новий, представлений, одним, пролонгованою, стабільний, пег-naн-іфн, активний, інтерферону
Код посилання
<a href="https://ua.patents.su/21-99766-novijj-funkcionalno-aktivnijj-visokoochishhenijj-stabilnijj-konyugat-interferonu-alfa-z-polietilenglikolem-predstavlenijj-odnim-pozicijjnim-izomerom-peg-nan-ifn-zi-zmenshenoyu-imun.html" target="_blank" rel="follow" title="База патентів України">Новий функціонально активний, високоочищений, стабільний кон’югат інтерферону альфа з поліетиленгліколем, представлений одним позиційним ізомером пег-naн-іфн, зі зменшеною імуногенністю, із пролонгованою біолог</a>
Попередній патент: Газогенератор на твердому паливі
Наступний патент: Спосіб вдування вугільного пилу у доменну піч
Випадковий патент: Пристрій для ушивання невеликих дефектів (w1) передньої черевної стінки при лапароскопічних втручаннях