Спосіб терапії злоякісної пухлини
Номер патенту: 112522
Опубліковано: 26.09.2016
Автори: Оліва Аргельс Брісайда Майлін, Хіл Вальдес Хеованіс, Рейєс Акоста Освальдо, Мусакчіо Ласа Алексіс, Фернандес Массо Хуліо Рауль, Герра Вальеспі Марібель
Формула / Реферат
1. Пептид зі здатністю зв'язувати домен СОММ, який характеризується тим, що він складається з SEQ ID NO: 3, в якій N-кінець захищений ацетилюванням і включенням D-амінокислот в положення пролін-6 і лейцин-11.
2. Застосування пептиду за п. 1 для збільшення ядерної локалізації білка COMMD1 в клітині злоякісної пухлини.
3. Застосування пептиду за п. 1 для виготовлення композиції, що містить засіб, який збільшує ядерну локалізацію білка CОMMD1 в клітинах злоякісної пухлини, для лікування злоякісної пухлини.
4. Застосування за п. 2, в якому засіб, що збільшує ядерну локалізацію білка COMMD1 в клітинах злоякісної пухлини, є пептидом з амінокислотною послідовністю Ac-HARIKpTFRRIKWKYKGKFW.
5. Застосування за п. 3, в якому засіб, що збільшує ядерну локалізацію білка COMMD1 в клітинах злоякісної пухлини, є пептидом з амінокислотною послідовністю Ac-HARIKpTFRRIKWKYKGKFW.
6. Застосування за п. 3, яке характеризується тим, що злоякісна пухлина є пухлиною, асоційованою з запаленням і метастазами.
7. Застосування за п. 6, де пухлина, асоційована із запаленням і метастазами, розташована в ободовій кишці, прямій кишці, стравоході, легенях, передміхуровій залозі, грудях, підшлунковій залозі або печінці.
8. Фармацевтична композиція для терапії злоякісної пухлини, в якій засіб, що збільшує ядерну локалізацію білка COMMD1 в клітині злоякісної пухлини, являє собою пептид з амінокислотною послідовністю, ідентифікованою як SEQ ID NO: 3 за п. 1.
9. Фармацевтична композиція за п. 8, що містить засіб, ідентифікований як SEQ ID NO: 3, і фармацевтично прийнятні ексципієнти або носії.
10. Фармацевтична комбінація для лікування злоякісної пухлини, яка містить SEQ ID NO: 3 в комбінації з одним або кількома лікарськими засобами, специфічними для стандартної хіміотерапії злоякісної пухлини.
11. Фармацевтична комбінація за п. 10, де лікарський засіб, специфічний для стандартної хіміотерапії, вибраний з цисплатину і 5-FU.
12. Застосування пептиду за п. 1 для лікування захворювань, де член сімейства COMMD залучений до розвитку захворювання.
Текст
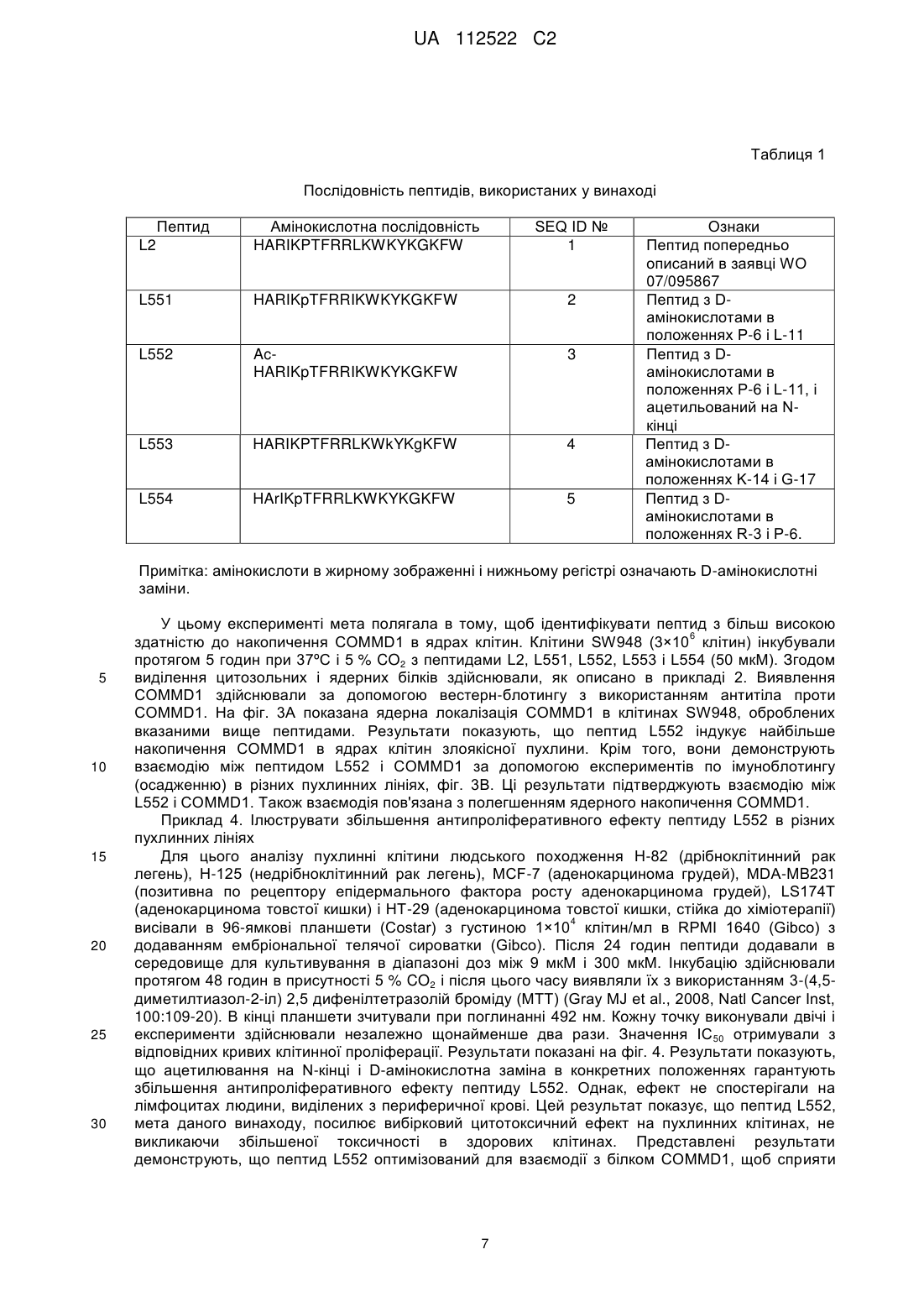
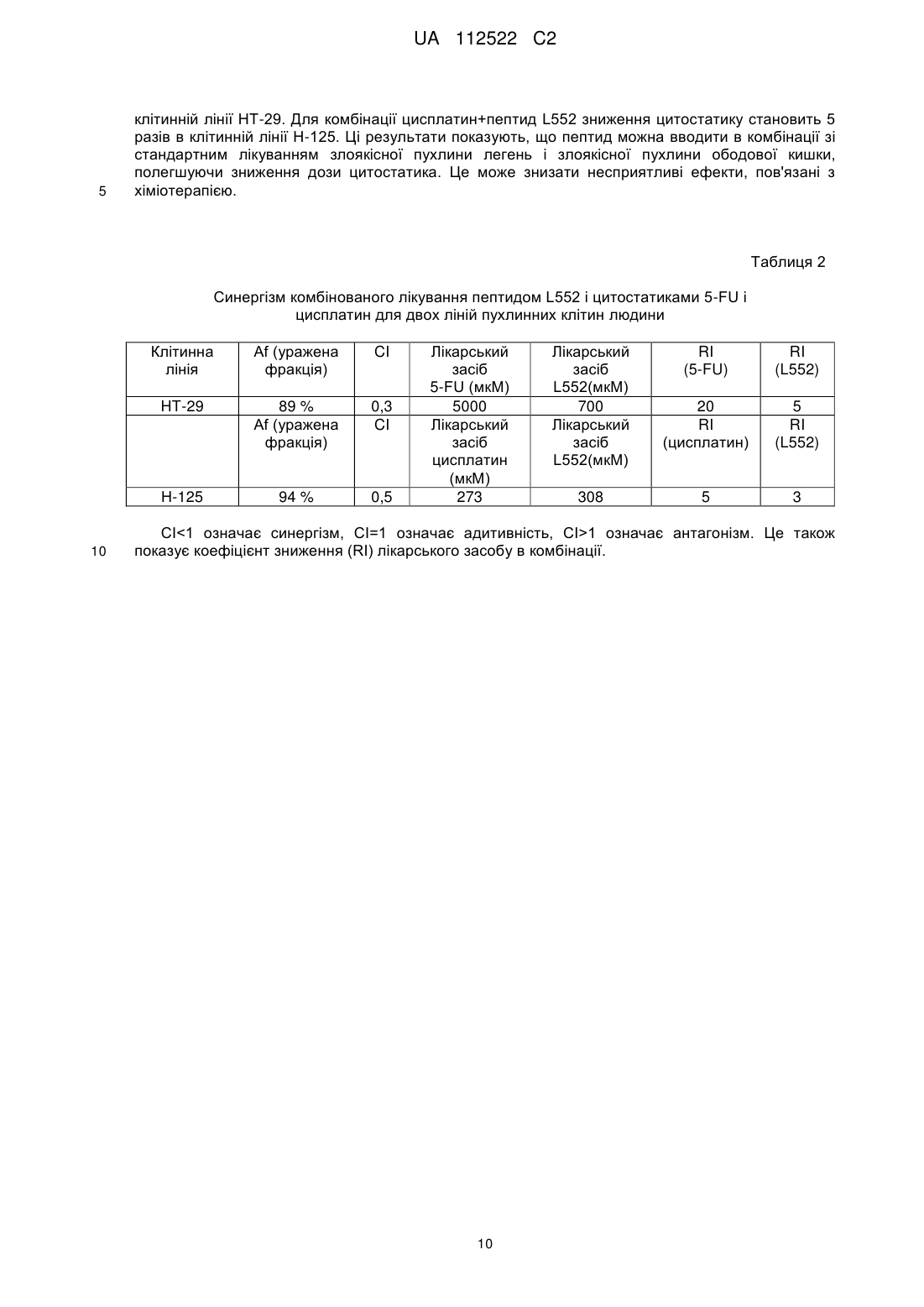
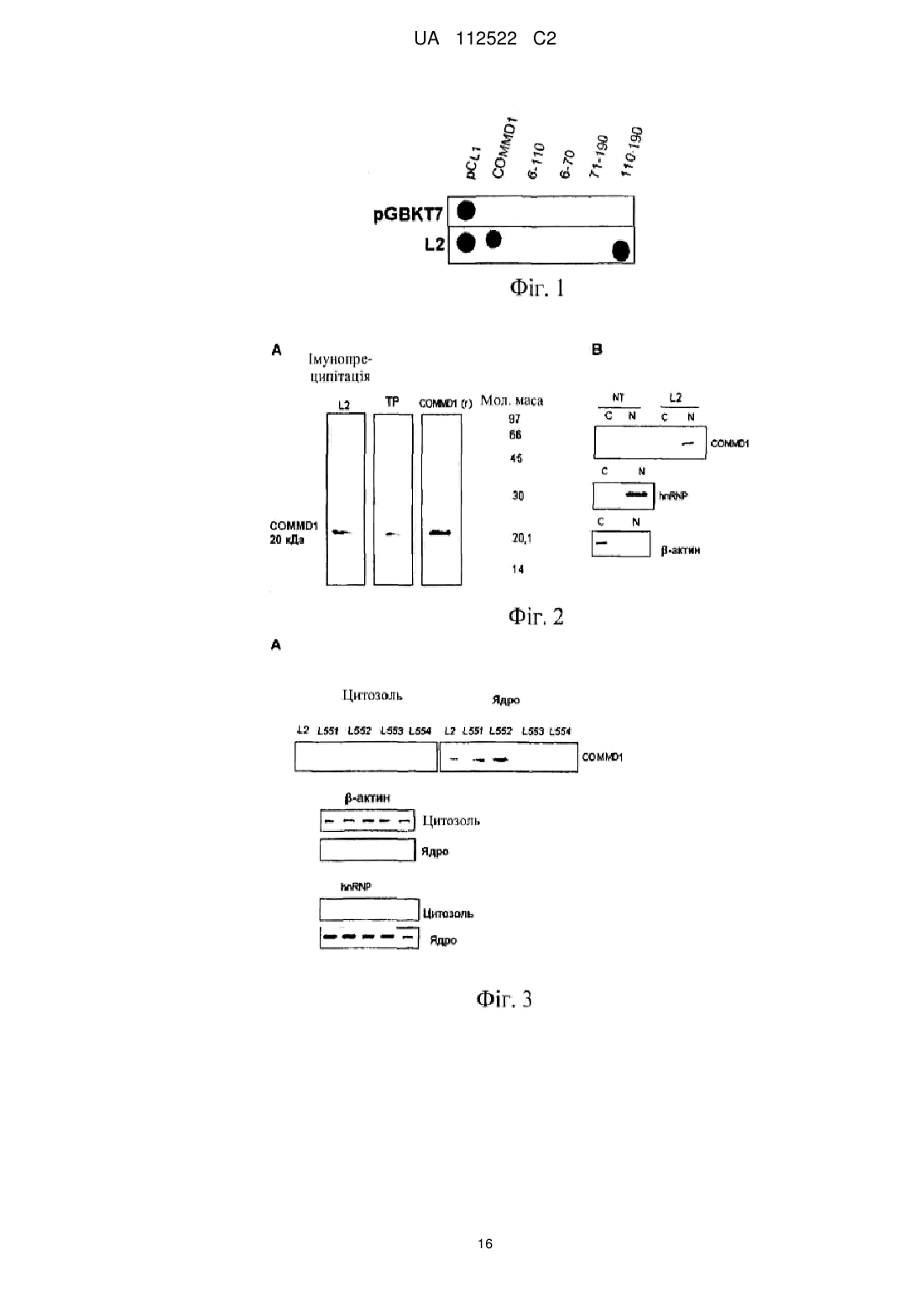
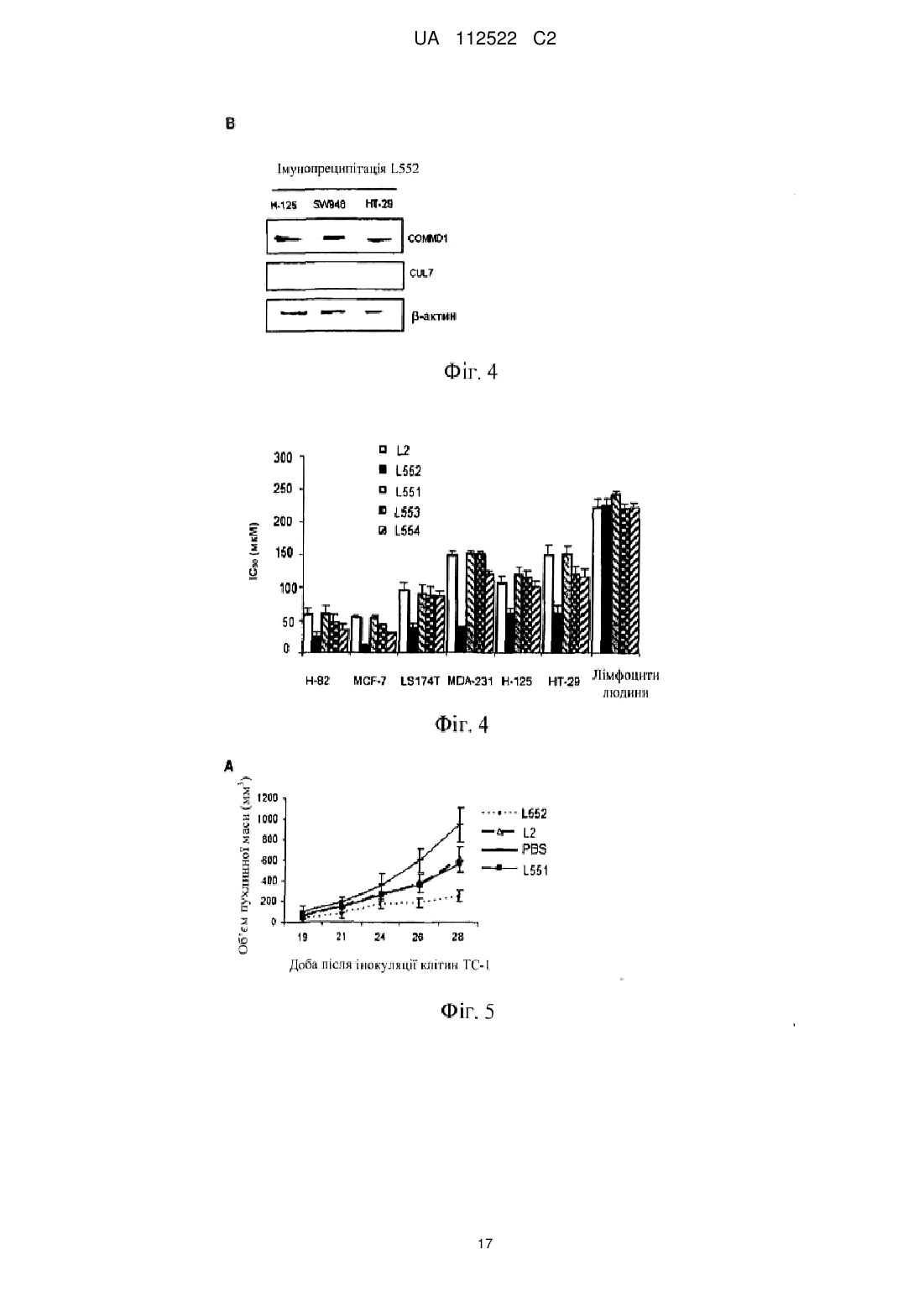
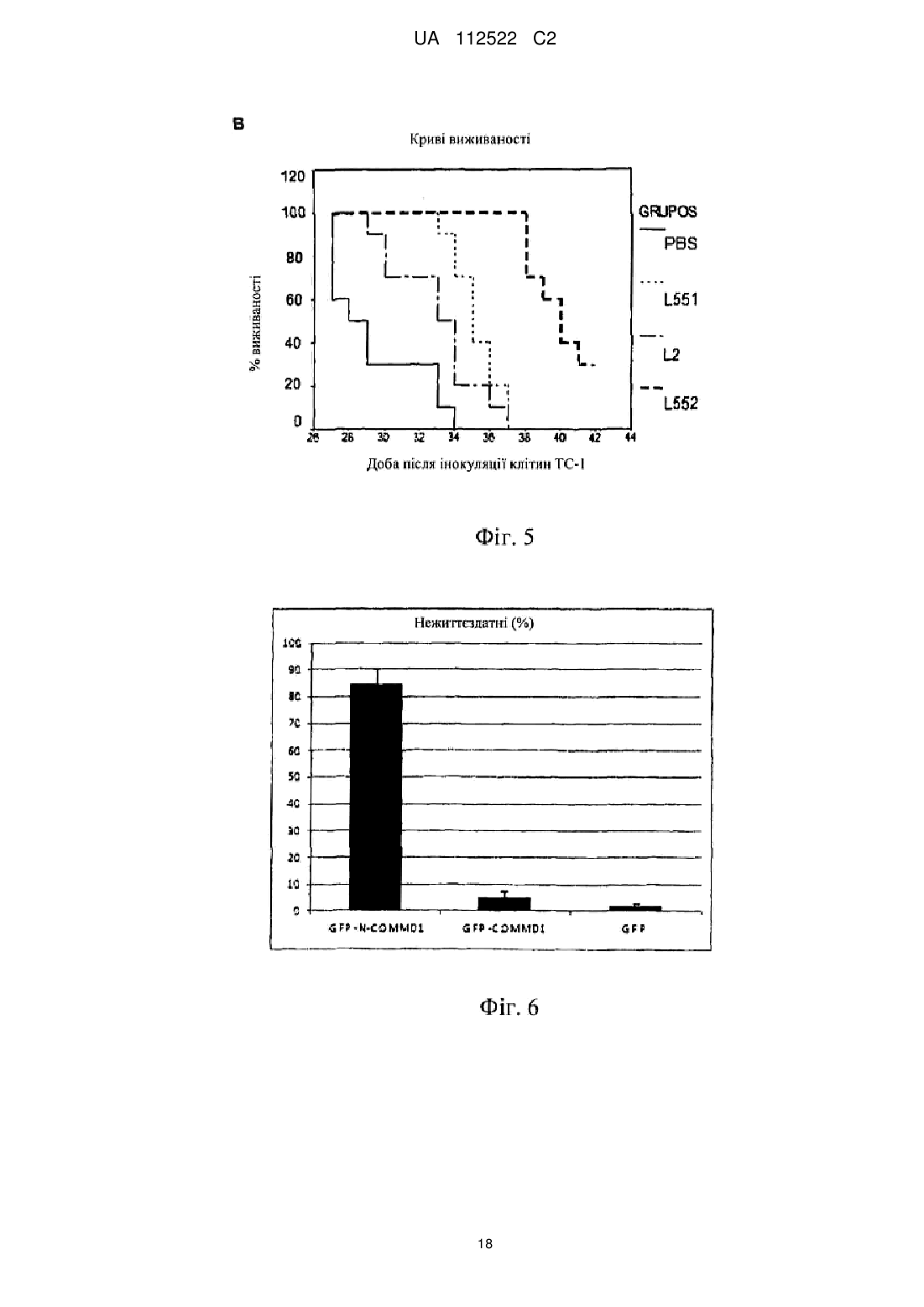
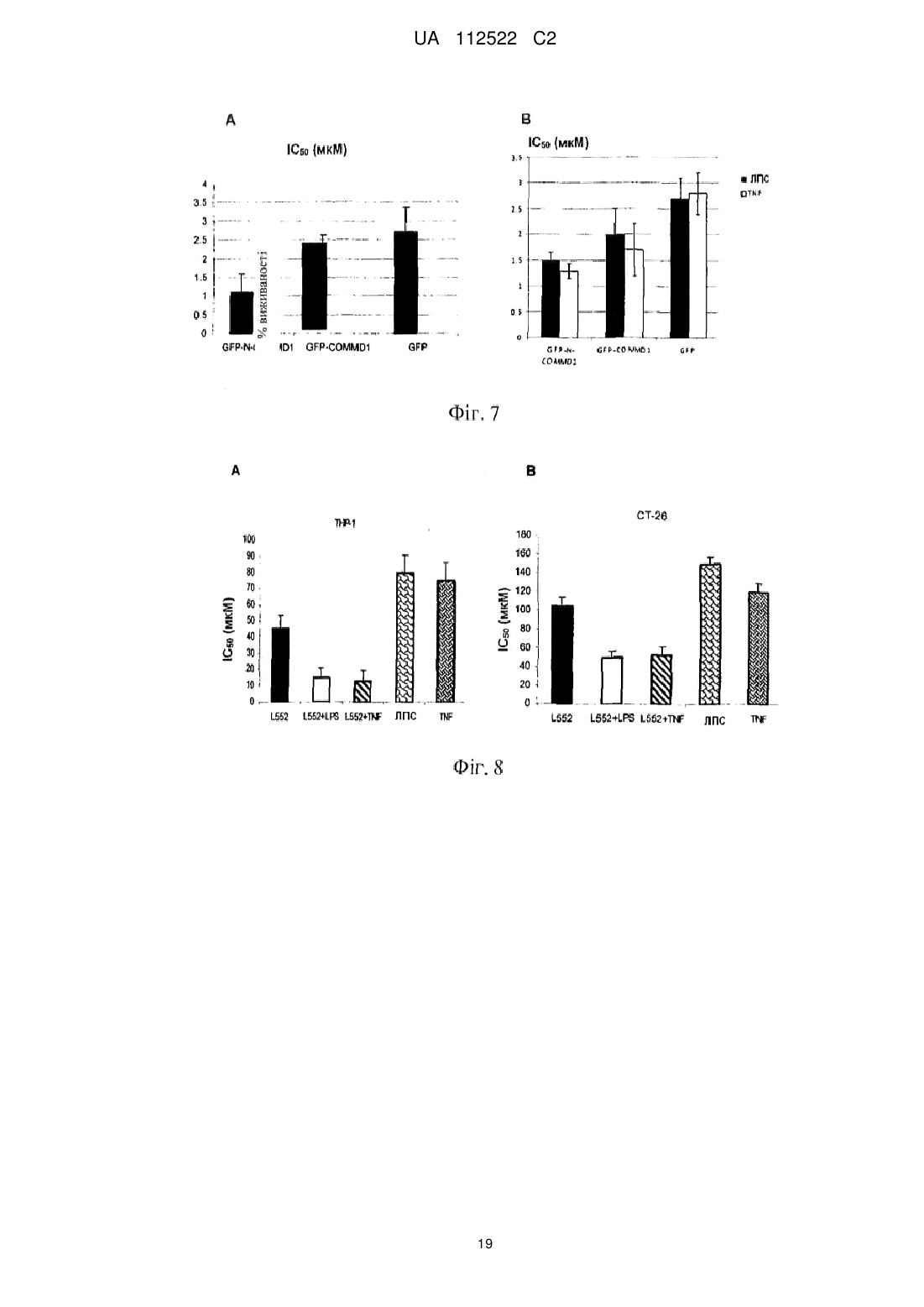
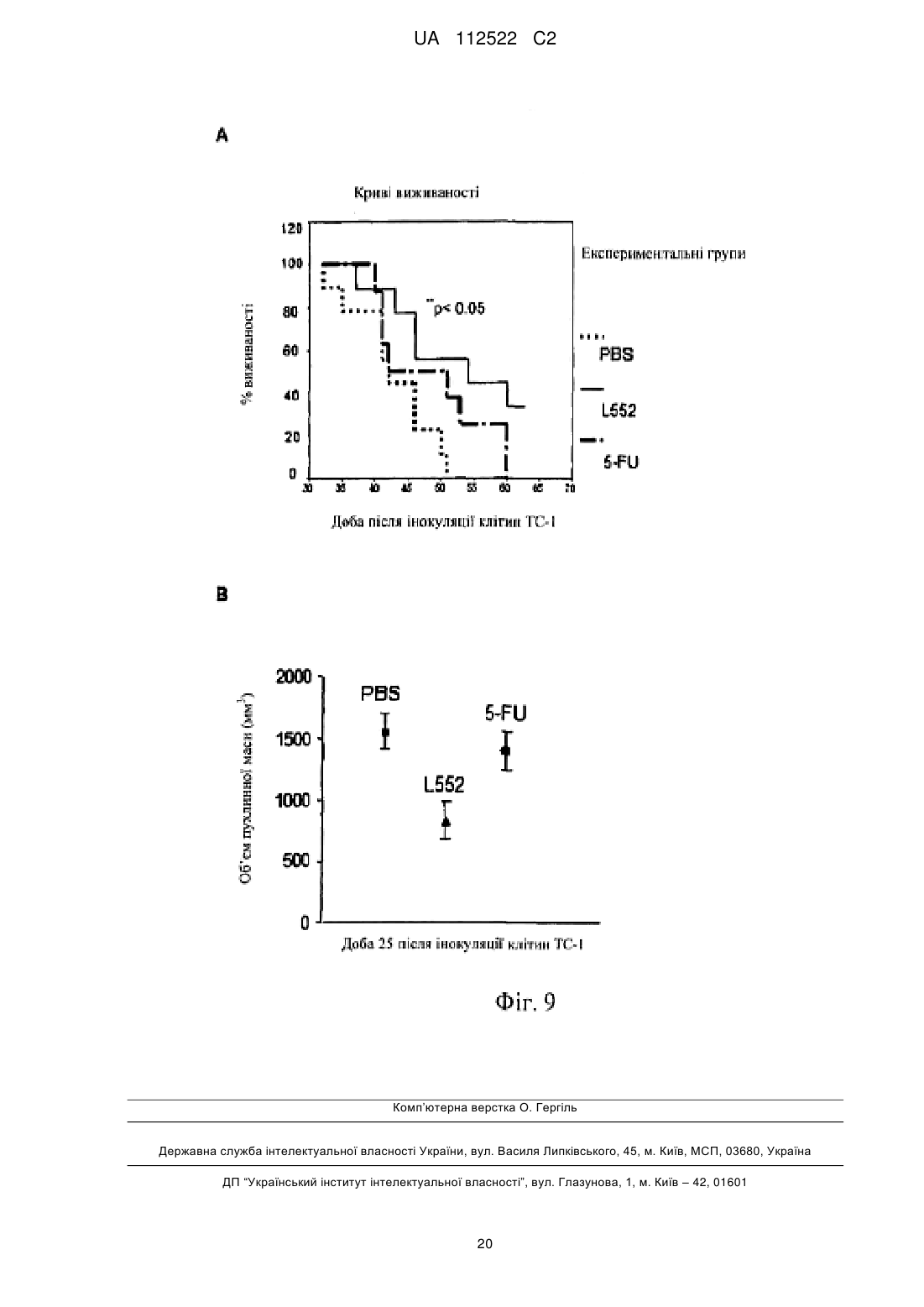
Реферат: У цьому винаході описаний спосіб лікування злоякісної пухлини за допомогою збільшення ядерної локалізації білка COMMD1, яке асоційоване зі зниженням або блокуванням проліферації клітин злоякісної пухлини. Винахід також стосується застосування засобів, які збільшують ядерну локалізацію білка COMMD1, у виготовленні лікарського засобу для терапії злоякісної пухлини. Ці засоби можуть являти собою пептиди або білки, серед інших сполук. Винахід також стосується оптимізації пептиду, що походить з послідовності HARIKPTFRRLKWKKYKGKFW, для збільшення ядерної локалізації білка COMMD і, таким чином, для збільшення протипухлинного ефекту цього пептиду. UA 112522 C2 (12) UA 112522 C2 UA 112522 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ Даний винахід стосується галузі біомедицини, зокрема, терапії злоякісної пухлини, за рахунок розкриття нової терапевтичної мішені для розробки лікарських засобів проти злоякісних пухлин. Ці лікарські засоби, в зв'язку з їх більшою вибірковістю і ефективністю, вносять внесок в поліпшення сучасних способів лікування пацієнтів зі злоякісними пухлинами. Описаний спосіб лікування злоякісної пухлини за допомогою експресії і накопичення білка COMMD1 в ядрі клітини злоякісної пухлини. Хімічні модифікації, що вводяться в первинну структуру пептиду HARIKPTFRRLKWKYKGKFW, збільшують ядерну локалізацію білка COMMD1 і протипухлинну активність цього пептиду in vitro і in vivo. ПЕРЕДУМОВИ ВИНАХОДУ Незважаючи на значні успіхи в терапії злоякісних пухлин, існує великий інтерес до розробки нових засобів проти злоякісних пухлин з новим механізмом дії, внаслідок розвитку пухлинними клітками стійкості до існуючих лікарських засобів проти злоякісних пухлин. Пептиди все ще представляють великий інтерес як нові терапевтичні лікарські засоби в зв'язку з роллю медіаторів важливих біологічних функцій і властивих їм унікальних властивостей, які роблять їх особливо привабливими терапевтичними засобами. Пептиди виявляють високу біологічну активність, пов'язану з низькою токсичністю і високою специфічністю. Користь, яка походить від цих ознак, включає високу специфічність зв'язування з бажаною мішенню, мінімізацію небажаної взаємодії лікарський засіб-лікарський засіб і підтверджене більш низьке накопичення в тканинах, що знижує ризик ускладнень в зв'язку з проміжними метаболітами (Vlieghe et al., 2010, Drug Discovery Today, 15:40-56). В цей час існують способи терапії злоякісних пухлин, в яких використовують пептиди і/або низькомолекулярні сполуки з вибірковістю зв'язування зі специфічним цільовим білком, який має важливу біологічну функцію в розвитку злоякісної пухлини. У першому сценарії мають місце способи терапії, які можуть бути націлені на те, щоб інгібувати функцію конкретного білка і викликати апоптоз клітини злоякісної пухлини, наприклад: Inhibitors of Heat Shock Proteins (HSP) (Subbarao et al., 2004, Pharmacology & Therapeutics, 101:227-257); Tyrosine kinase inhibitors (Garrido et al., 2007, Rev Med Chil, 10:1327-1332). В більшості ситуацій ці білки вважають аберантними в процесі озлоякіснення в порівнянні з нормальною тканиною. У другому сценарії лікарський засіб зв'язується з білковою мішенню, яка може бути або може не бути аберантною в процесі озлоякіснення в порівнянні з нормальною тканиною, в цьому випадку відбувається ураження шляхів передачі сигналу, активація яких відбувається в процесі злоякісного новоутворення, наприклад: інгібітори реплікації дезоксирибонуклеїнової кислоти (ДНК), інгібітори збирання мікротрубочок і інгібітори фактора транскрипції NFκВ. Незважаючи на те, що перший сценарій високо ефективний в певних гематопоетичних злоякісних новоутвореннях, більшість цих способів терапії мають обмежену ефективність в комплексності солідних пухлин. На відміну від цього, другий сценарій включає деякі з найбільш ефективних і більш токсичних лікарських засобів проти злоякісних пухлин в онкологічній фармакопеї. З цієї причини прогрес потребує пошуків нових лікарських засобів, які стають більш вибірковими і ефективними, мінімізуючи їх токсичність. У цьому відношенні ідентифікація нових терапевтичних мішеней і розуміння їх ролі в розвитку злоякісних пухлин буде допомагати ідентифікувати нові механізми стійкості до лікарських засобів і полегшувати розробку нових лікарських засобів, які зберігають більш високу активність і які можна комбінувати з існуючими лікарськими засобами, знижуючи їх токсичність і підвищуючи якість життя пацієнтів зі злоякісними пухлинами. Білок COMMD1, раніше відомий як MURR1 (van de Sluis et al., 2002, Human Molecular Genetics, 11:165-173) стосується нового сімейства білків, відомих під їх абревіатурою COMMD (домен гена метаболізму міді MURR1, скорочено COMMD). Десять членів сімейства білків високо консервативні в багатоклітинних організмах і повсюдно експресуються, але біологічні функції більшості його членів невідомі. Ключова характеристика цього сімейства складається в присутності домену COMM (домен метаболізму міді Murr1), консервативного і унікального, що містить амінокислотні залишки 110-190 С-кінцевої області (Burstein et al., 2005, The Journal of Biological Chemistry, 280:22222-22232). COMMD1 залучений до різних біологічних процесів, таких як: контроль метаболізму міді (Tao et al., 2003, Journal of Biological Chemistry, 278:41593-41596), регуляція внутрішньоклітинного транспорту натрію (Biasio et al., 2004, Journal of Biological Chemistry, 279:5429-5434), інгібування фактора транскрипції NFκB (Maine et al., 2007, The EMBO Journal, 26:436-447), інгібування експресії генів, регульованих індукованим гіпоксією фактором (HIF)-1α (van de Sluis et al., 2007, Molecular and Cellular Biology, 27:4142-4156). COMMD1 демонструє фізичну взаємодію з RelA (p65), субодиницею з транскрипційного фактора NFκB, з каталітичною-α субодиницею з фактора HIF-1α і з ΔENaC в натрієвих каналах 1 UA 112522 C2 5 10 15 20 25 30 35 40 45 50 55 60 епітелію. У всіх випадках ця взаємодія веде до руйнування цих "обслуговуваних" білків через механізм, який включає шляхи убіквітинілювання і руйнування протеосом. Показано, що домен COMM бере участь в білок-білкових взаємодіях, як для "обслуговуваних" білків COMMD1, а також для взаємодії серед членів сімейства. Існує припущення про тривимірну структуру Nкінцевої області COMMD1, але все ще не доступна третинна структура для домену COMM (Sommerhalter et al., 2007, Journal of Molecular Biology, 365:715-721). Убіквітинілювання і руйнування протеосом керують базальною експресією COMMD1 в клітині через серію залишків лейцину, розташованих в домені COMM (Maine et al., 2009, Biochemical Journal, 417:601-609). Нещодавно повідомлялося про те, що COMMD1 має конститутивний механізм транспорту цитоплазма-ядро через сигнали ядерного експорту (NES), також розташовані в його домені COMM. Повідомлялося, що руйнування лейцинової послідовності і/або засобу, які інгібує руйнування протеосом, створюють збільшення експресії COMMD1 в клітинах. Додатково, руйнування послідовностей NES в COMMD1 збільшує придушення транскрипційної активності факторів NFκB і HIF-1α (Muller et al., 2009, Traffic, 10:514-527). Клітини злоякісної пухлини, які надекспресують різні білки, такі як білок XIAP (X-зв'язаний інгібітор апоптозу) і секреторний кластерин (sCLU). Обидва білки сприяють руйнуванню COMMD1 і полегшують активацію NFκB і виживаності пухлинних клітин. Повідомлялося, що інгібітори протеосом, такі як MG132 (Shirley et al., 2005, Neoplasia, 7:1104-1111; Zhou et al., 2009, Cancer Research, 21:333-339) демонстрували протипухлинний ефект за допомогою інгібування механізму убіквитинілювання і руйнування протеосом. Сполуки, які зв'язуються з XIAP, індукують апоптоз за допомогою блокування інгібуючого ефекту цього білка, що надається на активацію каспази-3 і каспази-9 (Vogler et al., Cancer Research, 2009, 69:2425-2434). Передбачають, що інтерферуюча рибонуклеїнова кислота (RNAi), розроблена для того, щоб інгібувати функцію sCLU, має протипухлинний ефект за рахунок стабілізації цитоплазматичного інгібітору фактора NFκB, відомого як I-kB (Zoubeidi et al., 2010, Molecular Cancer Research, 8:1930). У міжнародній патентній заявці WO 07/095867 суть винаходу пов'язана з пептидами, що отримуються з області 32-51 білка LALF (антиліпополісахаридний фактор Limulus), в яких заміни амінокислот створювали для того, щоб гарантувати порушення ЛПС-зв'язувальної здатності і збільшити протипухлинну і імуномоделюючі активності. Один з цих пептидів являє собою пептид, який називається L2. Додатково, в іншому винаході (міжнародна заявка PCT/CU2008/000006) показана здатність вказаних вище пептидів проникати в клітини. Однак, в таких винаходах механізм дії таких пептидів не розкритий і не дані припущення відносно нього. У цей час існує множина способів терапії для лікування злоякісної пухлини (хіміотерапія, променева терапія, імунотерапія і т. п.), багато які з яких знаходяться в клінічних дослідженнях. Однак все ще мають місце недоліки, пов'язані з цими способами терапії, такі як: низька вибірковість, токсичність і розвиток стійкості до лікарських засобів. Інший важливий аспект для розгляду в даній галузі полягає у виборі біологічних маркерів, які можна використовувати як діагностичні засоби і/або як прогностичні фактори ефективності лікарського засобу. Отже, зберігається необхідність дослідити і вивчати нові молекули, які можна використовувати в лікуванні і/або діагностиці злоякісної пухлини, і розробляти лікарські засоби, більш вибіркові і ефективні при меншій токсичності. ОПИС ВИНАХОДУ Даний винахід вирішує вказану вище проблему за допомогою опису способу лікування злоякісної пухлини за допомогою збільшення ядерної локалізації білка COMMD1. Це збільшення спричиняє зниження або блокування проліферації клітин злоякісної пухлини. У цьому винаході вперше виявлено, що пептид L2 (з послідовністю HARIKPTFRRLKWKKYKGKFW, SEQ ID №1) і COMMD1 взаємодіють в клітинах і що ядерна локалізація COMMD1 асоційована із загибеллю клітин злоякісної пухлини. Таким чином, даний винахід стосується використання білка COMMD1 в ідентифікації сполук з протипухлинною активністю, які сприяють ядерній локалізації і накопиченню COMMD1. Надані в цьому винаході дані показують, що пептид L2 взаємодіє з COMMD1, зокрема, в області між амінокислотами 110-190. Додатково, пептид L2 спричиняє ядерне накопичення COMMD1. Крім того, вперше в цьому винаході повідомляється про те, що експресія білка COMMD1, що несе послідовності ядерної локалізації (NLS) є достатньою для того, щоб індукувати загибель клітин. Отже, в даному винаході продемонстроване використання COMMD1 як терапевтичної мішені в лікуванні злоякісних пухлин. Додатково, пептид L552 (SEQ ID №3) оптимізували, починаючи від пептиду L2 (SEQ ID №1), для того, щоб сприяти накопиченню білка COMMD1 в ядрі клітини злоякісної пухлини, і 2 UA 112522 C2 5 10 15 20 25 30 35 40 45 50 55 60 збільшити протипухлинний ефект цього пептиду. Пептид L552 (SEQ ID №3), описаний в цьому винаході, які поліпшували для того, щоб сприяти ядерній локалізації COMMD1, має наступну послідовність: Ac-HARIKpTFRRIKWKYKGKFW SEQ ID №3 Оптимізація основана на хімічних модифікаціях, що виконуються за допомогою заміни природної амінокислоти неприродним амінокислотами (D-амінокислоти) в конкретних положеннях (представлених в нижньому регістрі і жирному зображенні в послідовності, включеній вище) і за допомогою захисту N-кінця ацетилуванням (означають як Ac- в послідовності, включеній вище). Ці модифікації, виконані в пептиді L2 (SEQ ID №1), які далі початок пептиду L552 (SEQ ID №3), забезпечують найвище накопичення білка COMMD1 в ядрах клітин і збільшення протипухлинної активності пептиду L552 відносно вихідного пептиду L2. Отже, пептид L552 являє собою новий клас молекул, які взаємодіють з COMMD1, сприяючи його ядерній локалізації і інгібуючи проліферацію клітин злоякісної пухлини. Інша мета даного винаходу полягає в застосуванні засобів, які збільшують ядерну локалізацію білка COMMD1, у виготовленні лікарських засобів для терапії злоякісної пухлини. Серед засобів або сполук, які сприяють ядерному накопиченню COMMD1, включені, наприклад: білки (включаючи антитіла), мутеїни, пептиди, полінуклеотиди, аптамери, нуклеїнові кислоти і малі органічні молекули. Ці сполуки можна виділяти з природних джерел, отримувати синтетично або за допомогою рекомбінантної технології або будь-якого їх поєднання. У конкретному варіанті здійснення засіб, який збільшує ядерну локалізацію білка COMMD1, являє собою пептид L552 (SEQ ID №3). У контексті даного винаходу збільшувати або посилювати ядерну локалізацію білка COMMD1 і нагромаджувати COMMD1 в ядрах клітин має однакове значення. У іншому конкретному варіанті здійснення засіб, який збільшує ядерну локалізацію білка COMMD1, може являти собою нуклеїнову кислоту певного типу, наприклад, експресуючий вектор, в клітинах ссавців, який містить послідовність ДНК, яка кодує білок COMMD1, який містить введені NLS. Вектор цього типу можна використовувати як генну терапію. Також частиною винаходу є фармацевтична композиція для лікування злоякісних пухлин, що містять засіб, який збільшує ядерну локалізацію білка COMMD1. У одному з варіантів здійснення винаходу фармацевтична композиція містить ефективну кількість засобу, яка збільшує ядерну локалізацію білка COMMD1 (що визначається за допомогою його інгібуючої концентрації 50 (IC50), і ексципієнти або фармацевтично прийнятні носії. Композицію можна вводити за допомогою парентерального або топічного шляху. Введення фармацевтичної композиції, що містить засіб, який збільшує ядерну локалізацію білка COMMD1, складає спосіб лікування або профілактики солідної пухлини у суб'єкта, де спосіб включає введення ефективної кількості засобу, яке сприяє ядерній локалізації COMMD1, щоб знизити або блокувати ріст пухлинних клітин. У одному з варіантів здійснення винаходу засіб, який збільшує ядерну локалізацію білка COMMD1, можна вводити пацієнтам з лейкозом, зокрема, з мієлоцитарним лейкозом, щоб блокувати проліферацію клітин злоякісної пухлини. Цей засіб може бути ефективним навіть в присутності запального стимулу, такого як бактерійний ліпополісахарид (ЛПС). У даному винаході показано, що пептид L552 можна використовувати в комбінації зі стандартної хіміотерапією для отримання синергічного ефекту і зниження дози цитостатиків, такого як цисплатин і 5-фторурацил (5-FU). Отже, також мета даного винаходу полягає в фармацевтичній комбінації для лікування злоякісних пухлин, що містить один або декілька засобів, які збільшують ядерну локалізацію білка COMMD1, і один або декілька лікарських засобів, специфічних для хіміотерапії злоякісної пухлини. У одному з варіантів здійснення винаходу таким засобом є пептид L552 і специфічний лікарський засіб для стандартної хіміотерапії вибирають між цисплатином і 5-FU. У цій фармацевтичній комбінації засоби і лікарські засоби, включені в неї, можна вводити одночасно, окремо або послідовно під час лікування. З іншого боку, останні дані розширили ідею про те, що запалення є вирішальним компонентом в розвитку пухлини. Сьогодні запальне мікрооточення каталогізоване як характерна ознака пухлини, яка займає місце серед шести найбільш важливих ознак злоякісної пухлини, описаних авторами Hanahan and Weinbergs (Perwez et al., 2007, Int J Cancer, 121:23732380). Дані, надані в цьому винаході показують, що пептид L552 ефективний при блокуванні росту клітин злоякісної пухлини в присутності запального стимулу. Аналогічним чином, білок GFPNCOMMD1 (який несе послідовності ядерної локалізації), яким тимчасово трансфіковані клітини злоякісної пухлини, забезпечує такий же ефект, що і пептид L552. Більш конкретно, результати демонструють, що пептид L552 сприяє загибелі клітин злоякісної пухлини в присутності запального стимулу, такого як ЛПС і TNF (фактор некрозу пухлини α). Аналогічним чином, 3 UA 112522 C2 5 10 15 20 25 30 35 40 45 50 55 60 експериментальні дані демонструють ефективність пептиду в моделі пухлини ободової кишки на мишах, в якій мишей стимулювали запальним стимулом за допомогою ін'єкції ЛПС. З цієї причини даний винахід також стосується способу інгібування розвитку пухлин, асоційованих із запаленням, і їх метастазів, який включає введення пептиду L552 суб'єкту, потребуючому цього. Серед пухлин, асоційованих із запаленням і метастазами знаходять, наприклад, наступні злоякісні пухлини: товстої кишки, стравоходу, легень, передміхурової залози, грудей, підшлункової залози і печінки. Також введення пептиду L552 можна використовувати профілактично для запобігання розвитку злоякісної пухлини, асоційованої з хронічним запаленням, таким як хвороба Крони, виразковий коліт, панкреатит, цироз і т. д. Отже, також мета даного винаходу полягає в способі попередження злоякісної пухлини, асоційованої з хронічним запаленням, який відрізняється введенням пептиду L552 або композиції, що містить вказану пептид, суб'єкту, потребуючому цього. Відносно дози і схеми лікування, щоб дотримуватися композицій, які містять пептид L552, як засіб, який збільшує ядерну локалізацію білка COMMD1, фахівець може легко визначити дозу і схему лікування (профілактичного або терапевтичного). Ефективна кількість може варіюватися залежно від відносної активності окремих композицій, і можна його обчислювати, основуючись на молекулярній масі пептиду і IC 50 in vitro або в дослідженнях на тваринах. Наприклад, знаючи молекулярну масу сполуки (хімічну структуру) і ефективну експериментальну дозу (IC50), дозу в мг/кг можна обчислити звичайним способом. Загалом, дози складають від 0,2 до 4 мг/кг маса. Пептид або композицію, що містить його, можна вводити один або декілька разів, щотижня або навіть протягом декількох місяців. Винахід також стосується використання COMMD1 як нового прогностичного маркера для пацієнтів зі злоякісними пухлинами за допомогою визначення присутності або відсутності ядерної локалізації білка COMMD1 в зразку. Аналогічним чином пептид L552 надає активний засіб для лікування захворювань, де білки COMM відіграють певну роль або беруть участь в розвитку захворювання. Це можливо, наприклад, при захворюваннях, в яких кількість будь-якого члена сімейства COMMD збільшена або знижена і/або його активність збільшена або знижена, і це спричиняє захворювання. Здатність пептиду L552 зв'язувати домен COMM, що міститься між амінокислотними залишками 110-190 С-кінці білків COMMD, підтверджує його терапевтичну активність. КОРОТКИЙ ОПИС ФІГУР Фіг. 1. На фігурі проілюстрована фізична взаємодія між пептидом L2 і COMMD1. Це здійснювали способом з двома гібридами в дріжджах. Як негативні контролі використовували схрещування штаму дріжджів AH109, трансформованого пустим вектором (pGBKT7), і штаму Y187, трансформованим фрагментами COMMD1. Для ідентифікації взаємодії, здійснювали схрещування штаму AH109, трансформованого вектором, що несе послідовність L2, і кожного фрагмента COMMD1, трансформованого в штам Y187. Як позитивний контроль використовували схрещування pCL1, який несе фактор транскрипції GAL4. Як можна відмітити, взаємодія виникає з плазмідами, які несуть повну послідовність гена COMMD1, і конструкцію, що містить амінокислоти 110-190 білка COMMD1. Фіг. 2. (А) на фігурі проілюстроване підтвердження взаємодії пептиду L2 з COMMD1 за допомогою імунопреципітації (осадження) в клітинах SW948. У цьому експерименті показані 100 мкг загального білка (ЗБ), рекомбінантний білок COMMD1, що отримується в Escherichia coli, (COMMD1 r) і стандарт молекулярної маси (MW). (В) На фігурі проілюстрована субклітинна локалізація COMMD1 в клітинах SW948, які обробляли пептидом L2: експресія COMMD1 в ядрі (N), експресія COMMD1 в цитоплазмі (С), необроблені клітини (NT). -актин показаний як контроль цитоплазматичної фракції, а рибонуклеарний білок людини (hnRPN) як контроль ядерної фракції. Фіг. 3. (А) На фігурі проілюстроване більш високе ядерне накопичення COMMD1 за рахунок оптимізованого пептиду L552. Білки -актин і hnRNP використовували як контроль цитозольної і ядерної фракції, відповідно. (В) на фігурі показана взаємодія між пептидом L552 і білком COMMD1 в різних лініях пухлинних клітин в експериментах імунопреципітації (осадження). Взаємодію не виявляли при використанні білка кулін 7 (CUL7). Присутність -актину показана в екстрактах загального білка з декількох клітинних ліній. Фіг. 4. Антипроліферативний ефект пептидів в пухлинних клітинах різного гістологічного походження, LØ (лімфоцити людини, виділені з периферичної крові). Фіг. 5. Протипухлинний ефект пептиду L552 в моделі пухлини TC-1. (А) Показані криві інгібування пухлинного росту. (В) Показаний кумулятивний процент виживаності різних експериментальних груп. 4 UA 112522 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 6. Експресія білка COMMD1, який несе послідовності ядерної локалізації (NLS), достатня для того, щоб індукувати загибель клітин. Показана процентна частка нежиттєздатних клітин, тимчасово трансфікованих: зеленим флуоресцентним білком (GFP) як негативним контролем і генетичними конструкціями GFP-COMMD1 і GFP-N-COMMD1. Фіг. 7. (А) показана хемочутливість до 5-FU в клітинах карциноми ободової кишки HT-29, трансфікованих GFP-N-COMMD1. Показані значення IC50. (В) проілюстрований ефект запального оточення додавання ЛПС і TNF-α від IC50. Фіг. 8. Проілюстрований ефект пептиду L552, що надається на проліферацію клітин злоякісної пухлини в присутність іншого запального стимулу. (А) Клітини мієлолейкозу людини (THP-1) і (В) карциноми ободової кишки миші (CT-26), оброблені з використанням ЛПС і TNF-α. Приведені значення IC50. Фіг. 9. Протипухлинний ефект пептиду L552 в моделі злоякісної пухлини ободової кишки на мишах BALB/с, яких піддавали запальному стимулу за допомогою ін'єкції ЛПС. (А) Показаний кумулятивний процент виживаності різних експериментальних груп. (С) Показаний середній об'єм пухлини для кожної експериментальної групи. ПРИКЛАДИ Приклад 1. Фізична взаємодія між пептидом L2 і COMMD1. Щоб ідентифікувати взаємодію протипухлинного пептиду L2 і білка, використовували двогібридну дріжджову систему. Для клонування послідовностей, відповідних пептиду, олігонуклеотиди конструювали таким чином: L2F: CATGCACGCTAGAATCAAGCCAACCTTCAGAAGATTGAAGTGGAAGTACAAGGGTAAGTTCT GGTAA L2R: GATCTTACCAGAACTTACCCTTGTACTTCCACTTCAATCTTCTGAAGGTTGGCTTGATTCTAGC GTG відповідно до послідовності пептиду L2: HARIKPTFRRLKWKYKGKFW Для клонування цих послідовностей у векторі pGBKT7 NcoI-BamHI, послідовності, комплементарні цим ділянкам, додавали на кінці олігонуклеотидів. Рекомбінантну плазміду pGBKL2-1, яка несе послідовність пептиду L2, верифікували за допомогою рестрикційного аналізу і секвенування. Плазміду трансформували в штам дріжджів AH109 способом з ацетатом літію і ростили в середовищі SD-Trp. Верифіковано, що він не може активувати сам себе, коли його вирощують на чашках SD-Trp-His. Для скринінгу взаємодій використовували бібліотеку кДНК печінки людини, трансформовану в штам Y187. Для формування диплоїду і відбору 8 8 взаємодій, 5×10 клітин AH109, що містять плазміду pGBKL2-1, вирощували з 5×10 клітин Y187, що містять бібліотеку ДНК печінки людини, протягом 4 годин, на твердому середовищі YPDA при 30ºC. Десять мл стерильної води додавали на поверхню чашок YPDA і клітини обережно суспендували шпателем і переносили в 15 чашок з мінімальним середовищем SD-Trp-Leu-HisAde і ростили при 30ºC протягом 7 діб. Отримані 74 колонії переносили в рідке середовище SDTrp-Leu в глибокі 96-ямкові планшети. Після спостереження росту в рідкому середовищі, здійснювали очищення ДНК дріжджів. Кожну окрему ДНК трансформували в штам Е. coli DH10B, їх ДНК очищали і зберігали при -20ºC. Кожен окремий клон трансформували в штам дріжджів Y187 і взаємодію верифікували за допомогою схрещування зі штамом AH109, трансформованим плазмідами pGBKT7 і pGBKL2-1. ДНК позитивних клонів секвенували. Аналіз послідовностей з використанням програми Blast (Altschul et al., 1990. J Mol Biol, 215:403-410) показав, що один з клонів (L2-21) відповідає послідовності гена, що кодує амінокислоти 6-190 білка COMMD1, і що цей клон здатний взаємодіяти з плазмідою, що містить послідовність пептиду L-2. Щоб конкретно ідентифікувати область білка COMMD1, що відповідає за цю взаємодію, здійснювали делеції в плазміді pGBKL2-1, створюючи клони: pGBKL2 (6-110), pGBKL2 (6-70), pGBKL2 (71-190), pGBKL2 (110-190). Як показано на фіг. 1, взаємодія збережена тільки в плазміді pGBKL2 (110-190), що містить домен COMM, що відповідає за взаємодії білків, описані для сімейства COMMD. Цей результат показує, що пептид L2 конкретно зв'язує область амінокислотами 110-190. Приклад 2. Експерименти по імунопреципітації (осадженню) і визначенню ядерної локалізації COMMD1 в клітинах злоякісної пухлини, оброблених пептидом L552. Експерименти розділили на два блоки: (А) Синтетичний пептид L2 (SEQ ID №1), синтезований з використанням твердофазної процедури, біотинілювали і використовували як "наживку", прикріплену до стрептавідинової сефарозної смоли. Білок загального екстракту з SW948 (клітинна лінія карциноми ободової кишки людини) використовували як "здобич". Ці експерименти відомі як "осадження". Білок 5 UA 112522 C2 7 5 10 15 20 25 30 35 загального екстракту отримували з 2×10 клітин з використанням буфера для екстрагування (Triton X-100 0,5 % 25 мМ HEPES, pH 7,5, 100 мМ NaCl, 1 мМ ЕДТА, 10 % гліцерин, 1 мМ дитиотреїтол (DTT), і інгібітору протеаз). Біотинільований пептид (300 мкг) інкубували з 50 мкл стрептавідинової сефарозної смоли (GE Healthcare), протягом 1 години і промивали фосфатносольовим буфером (PBS 1×) плюс 1 мМ DTT. Потім, 500 мкл загального білка інкубували з 50 мкл смоли, що містить біотинільований пептид, при кімнатній температурі протягом 5 годин. Згодом смолу промивали ретельно в PBS 1× і 1 мМ DTT. Білки, що залишилися прикріпленими до смоли, являють собою білки, які взаємодіють з пептидом, і їх суспендували в 25 мкл буфера для електрофорезу (62,5 мМ Tris HCl, pH 6,9, 0,1 M DTT, 20 % додецилсульфат натрію (SDS), 10 % гліцерин і 0,01 % бромфенол синій). Щоб виявити білок, що представляє інтерес, здійснювали електрофорез в поліакриламідному гелі (7,5 %), за чим йшла імунодетекція за допомогою Вестерн-блотингу. Щоб виявити білок COMMD1, використовували моноклональне антитіло до білка COMMD1 (Sigma, clone 2A12). Екстракт загального білка (100 мкг) і рекомбінантний білок COMMD1, отриманий в Е. coli, використовували як позитивний контроль. Результати, представлені на фіг. 2A, показують, що пептид L2 концентрує білок COMMD1 в експерименті по осадженню, коли його порівнюють з екстрактом загального білка. Це показує взаємодію між L2 і COMMD1. 6 (В) Клітини SW948 (3×10 клітин) інкубували протягом 5 годин при 37ºC і 5 % CO2 з пептидом L2 (50 мкМ). Згодом цитозольні і ядерні білки отримували, як повідомлялося (Vancurova et al., 2001, Journal of Biological Chemistry, 276: 19746-19752). Виявлення COMMD1 здійснювали за допомогою Вестерн-блотингу з використанням антитіла проти COMMD1. На фіг. 2B показана ядерна локалізація COMMD1 в клітинах SW948, оброблених пептидом L2. β-актин використовували як контроль для цитоплазматичної фракції, а рибонуклеопротеїн людини (hnRNP) як контроль ядерної фракції. Приклад 3. Оптимізація пептиду L552 для ядерного накопичення COMMD1 Враховуючи те, що пептид L2 і COMMD1 мають фізичну взаємодію, і це корелює з ядерною локалізацією COMMD1, декілька пептидів конструювали, починаючи від L2 (SEQ ID №1), з метою посилення ядерного накопичення COMMD1. Пептиди за даним винаходом синтезували з використанням твердофазної процедури. Неочищений пептид екстрагували з використанням розчину 30 % оцтової кислоти; його ліофілізували і потім очищали за допомогою хроматографії із оберненою фазою (ВЕРХ-ОФ). Молекулярну масу очищених пептидів верифікували за допомогою мас-спектрометрії. Препарат, що отримується, є неантигенним, непірогенним і фармацевтично прийнятною для введення тварині і людині. У певних точках виконували заміни, що вводять D-амінокислоти в конкретні положення у вихідному пептиді L2, послідовність якого являє собою HARIKPTFRRLKWKYKGKFW (SEQ ID №1), як показано в таблиці 1. В одному випадку N-кінець також блокували за допомогою ацетилювання. 6 UA 112522 C2 Таблиця 1 Послідовність пептидів, використаних у винаході L2 Пептид Амінокислотна послідовність HARIKPTFRRLKWKYKGKFW SEQ ID № 1 L551 HARIKpTFRRIKWKYKGKFW 2 L552 AcHARIKpTFRRIKWKYKGKFW 3 L553 HARIKPTFRRLKWkYKgKFW 4 L554 HArIKpTFRRLKWKYKGKFW 5 Ознаки Пептид попередньо описаний в заявці WO 07/095867 Пептид з Dамінокислотами в положеннях Р-6 і L-11 Пептид з Dамінокислотами в положеннях Р-6 і L-11, і ацетильований на Nкінці Пептид з Dамінокислотами в положеннях K-14 і G-17 Пептид з Dамінокислотами в положеннях R-3 і Р-6. Примітка: амінокислоти в жирному зображенні і нижньому регістрі означають D-амінокислотні заміни. 5 10 15 20 25 30 У цьому експерименті мета полягала в тому, щоб ідентифікувати пептид з більш високою 6 здатністю до накопичення COMMD1 в ядрах клітин. Клітини SW948 (3×10 клітин) інкубували протягом 5 годин при 37ºC і 5 % CO2 з пептидами L2, L551, L552, L553 і L554 (50 мкМ). Згодом виділення цитозольних і ядерних білків здійснювали, як описано в прикладі 2. Виявлення COMMD1 здійснювали за допомогою вестерн-блотингу з використанням антитіла проти COMMD1. На фіг. 3А показана ядерна локалізація COMMD1 в клітинах SW948, оброблених вказаними вище пептидами. Результати показують, що пептид L552 індукує найбільше накопичення COMMD1 в ядрах клітин злоякісної пухлини. Крім того, вони демонструють взаємодію між пептидом L552 і COMMD1 за допомогою експериментів по імуноблотингу (осадженню) в різних пухлинних лініях, фіг. 3B. Ці результати підтверджують взаємодію між L552 і COMMD1. Також взаємодія пов'язана з полегшенням ядерного накопичення COMMD1. Приклад 4. Ілюструвати збільшення антипроліферативного ефекту пептиду L552 в різних пухлинних лініях Для цього аналізу пухлинні клітини людського походження Н-82 (дрібноклітинний рак легень), Н-125 (недрібноклітинний рак легень), MCF-7 (аденокарцинома грудей), MDA-MB231 (позитивна по рецептору епідермального фактора росту аденокарцинома грудей), LS174T (аденокарцинома товстої кишки) і HT-29 (аденокарцинома товстої кишки, стійка до хіміотерапії) 4 висівали в 96-ямкові планшети (Costar) з густиною 1×10 клітин/мл в RPMI 1640 (Gibco) з додаванням ембріональної телячої сироватки (Gibco). Після 24 годин пептиди додавали в середовище для культивування в діапазоні доз між 9 мкМ і 300 мкМ. Інкубацію здійснювали протягом 48 годин в присутності 5 % CO2 і після цього часу виявляли їх з використанням 3-(4,5диметилтиазол-2-іл) 2,5 дифенілтетразолій броміду (MTT) (Gray MJ et al., 2008, Natl Cancer Inst, 100:109-20). В кінці планшети зчитували при поглинанні 492 нм. Кожну точку виконували двічі і експерименти здійснювали незалежно щонайменше два рази. Значення IC 50 отримували з відповідних кривих клітинної проліферації. Результати показані на фіг. 4. Результати показують, що ацетилювання на N-кінці і D-амінокислотна заміна в конкретних положеннях гарантують збільшення антипроліферативного ефекту пептиду L552. Однак, ефект не спостерігали на лімфоцитах людини, виділених з периферичної крові. Цей результат показує, що пептид L552, мета даного винаходу, посилює вибірковий цитотоксичний ефект на пухлинних клітинах, не викликаючи збільшеної токсичності в здорових клітинах. Представлені результати демонструють, що пептид L552 оптимізований для взаємодії з білком COMMD1, щоб сприяти 7 UA 112522 C2 5 10 15 20 25 30 35 40 45 50 55 60 його додатковому накопиченню в ядрі і збільшувати вибірковий антипроліферативний ефект, що надається на клітини злоякісної пухлини. Приклад 5. Протипухлинний ефект пептиду L552 в моделі пухлини TC-1 на мишах У цих аналізах використовували самиць C57BL/6 у віці між 8 і 10 тижнями (n=10 тварин на експериментальну групу). Для імплантації пухлини в цій моделі використовували клітини TC-1, отримані з клітин епітелію легень з озлоякіснених C57BL/6, які суспендували в фізіологічному 4 розчині (PBS). Клітини в кількості 5×10 в об'ємі 200 мкл інокулювали мишам підшкірно в праву задню ногу. П'ять доз пептидів (L2, L552 і L551) вводили з інтервалами в 2 доби, підшкірно в 3 праву задню ногу, як тільки пухлини досягли об'єму 100 мм . У цьому дослідженні оцінювали дозу 0,2 мг пептиду на кг масу (4 мкг/миша). Оцінюваними параметрами для вимірювання протипухлинного ефекту пептидів, що представляють інтерес, були виживаність тварин і пухлинна маса, як показано на фіг. 5A і 5B. Пептид L552 був більш ефективний з точки зору здатності інгібувати розвиток пухлини і збільшувати виживаність мишей в порівнянні з пептидами L2 і L551. Ці результати доводять, що модифікації, введені в L552, збільшували протипухлинну ефективність in vivo. Статистичні аналізи здійснювали за допомогою логарифмічного рангового способу, щоб визначити значні відмінності між групами. Результати демонструють, що пептид L552 значно збільшує (*р
ДивитисяДодаткова інформація
Назва патенту англійськоюCancer therapy method
Автори англійськоюGuerra Vallespi, Maribel, Fernandez Masso, Julio, Raul, Musacchio Lasa, Alexis, Gil Valdes, Jeovanis, Reyes Acosta, Osvaldo, Oliva Arguelles, Brizaida, Maylin
Автори російськоюГерра Вальеспи Марибель, Фернандэс Массо Хулио Рауль, Мусакчио Ласа Алексис, Хил Вальдес Хеованис, Рейес Акоста Освальдо, Олива Аргельс Брисайда Майлин
МПК / Мітки
МПК: A61K 38/10, A61P 35/00
Мітки: злоякісної, спосіб, терапії, пухлини
Код посилання
<a href="https://ua.patents.su/22-112522-sposib-terapi-zloyakisno-pukhlini.html" target="_blank" rel="follow" title="База патентів України">Спосіб терапії злоякісної пухлини</a>
Попередній патент: Антитіло проти gdf8 людини
Наступний патент: Спосіб одержання метану з біомаси
Випадковий патент: Консольний візок мостового однобалочного крану