Композиція для назального застосування з покращеною стабільністю
Формула / Реферат
1. Фармацевтична композиція з покращеною стабільністю для місцевого застосування для лікування ринітів, причому композиція представлена у вигляді водної композиції і причому композиція містить:
а) щонайменше один альфа-симпатоміметик на основі імідазоліну або його фізіологічно прийнятну сіль, причому альфа-симпатоміметик на основі імідазоліну вибирають з ксилометазоліну і причому композиція містить компонент а), в перерахунку на композицію, в кількості від 0,02 до 1,0 мас. %;
б) пантотенол (декспантенол), причому композиція містить компонент б), в перерахунку на композицію, в кількості від 0,5 до 8 мас. %; і
в) щонайменше один консервант і/або дезінфекційний засіб, причому консервант і/або дезінфекційний засіб вибирають з хлориду бензалконію і причому композиція містить компонент в), в перерахунку на композицію, в кількості від 0,001 до 10 мас. %;
причому значення рН композиції встановлюють і/або підтримують постійним в межах від 5,2 до 5,9, причому встановлення й/або підтримання постійним значення рН композиції здійснюють за допомогою щонайменше однієї хімічної буферної системи, причому як хімічну буферну систему застосовують дигідрофосфатну/моногідрофосфатну буферну систему ("Н2РО4-/НРО42--буфер (система)" відповідно "фосфатний буфер (система)"), причому композиція має вміст продукту(ів) розщеплення діючої речовини а) щонайбільше 2 мас. %, у перерахунку на діючу речовину а), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців, і
причому композиція має вміст продукту(ів) розщеплення діючої речовини б) кожного разу щонайбільше у 5 мас. %, у перерахунку на діючу речовину б), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців.
2. Композиція за п. 1, яка відрізняється тим, що композиція представлена у вигляді водної композиції у формі водного розчину або водної солюбілізації.
3. Композиція за п. 1 або 2, яка відрізняється тим, що композиція містить щонайменше одну хімічну буферну систему, причому композиція як хімічну буферну систему містить дигідрофосфатну/моногідрофосфатну буферну систему ("Н2РО4-/НРО42--буфер (система)" відповідно "фосфатний буфер (система)").
4. Композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що композиція містить щонайменше одну хімічну буферну систему, причому композиція як хімічну буферну систему містить дигідрофосфатну/моногідрофосфатну буферну систему ("Н2РО4-/НРО42--буфер (система)" відповідно "фосфатний буфер (система)"), причому дигідрофосфатну/моногідрофосфатну буферну систему застосовують з молярним співвідношенням дигідрофосфат/моногідрофосфат більше 5:1.
5. Композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що композиція має осмотичність в межах від 300 до 600 мосмоль/кг і що композиція при температурі у 20 °С і під тиском у 1013,25 мбар має відносну густину, у перерахунку на чисту воду, в межах від 1,001 до 1,2.
6. Композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що композиція при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % є стабільною при зберіганні щонайменше 6 місяців, причому композиція має вміст продукту(ів) розщеплення діючої речовини а), зокрема забруднення А, щонайбільше 1 мас. %, у перерахунку на діючу речовину а); і причому композиція має вміст продукту(ів) розщеплення діючої речовини б), зокрема амінопропанолу і/або D-пантолактону, кожного разу щонайбільше у 3 мас. %.
7. Композиція за будь-яким з попередніх пунктів для застосування при профілактичному і/або лікувальному місцевому лікуванні ринітів, зокрема Rhinitis acuta.
8. Пристрій для застосування для місцевого назального застосування у формі ємності з крапельним пристроєм або розбризкувачем, який містить композицію за будь-яким з попередніх пунктів.
9. Застосування композиції за будь-яким з попередніх пунктів для одержання лікарського засобу для профілактичного і/або лікувального місцевого лікування ринітів, зокрема Rhinitis acuta.
10. Застосування режиму рН від 5,2 до 5,9 для стабілізації діючої речовини а) і діючої речовини б) у сумісному водному розчині фармацевтичної композиції з покращеною стабільністю для місцевого застосування для лікування ринітів, причому композиція представлена у вигляді водної композиції і причому композиція містить:
а) щонайменше один альфа-симпатоміметик на основі імідазоліну або його фізіологічно прийнятну сіль, причому альфа-симпатоміметик на основі імідазоліну вибирають з ксилометазоліну і причому композиція компонент а), в перерахунку на композицію, в кількості від 0,02 до 1,0 мас. %;
б) пантотенол (декспантенол), причому композиція компонент б), в перерахунку на композицію, в кількості від 0,5 до 8 мас. %; і
в) щонайменше один консервант і/або дезінфекційний засіб, причому консервант і/або дезінфекційний засіб вибирають з хлориду бензалконію і причому композиція компонент в), в перерахунку на композицію, в кількості від 0,001 до 10 мас. %;
причому значення рН композиції встановлюють і/або підтримують постійним в межах від 5,2 до 5,9, причому встановлення й/або підтримання постійним значення рН композиції здійснюють за допомогою щонайменше однієї хімічної буферної системи, причому як хімічну буферну систему застосовують дигідрофосфатну/моногідрофосфатну буферну систему ("Н2РО4-/НРО42--буфер (система)" відповідно "фосфатний буфер (система)"), причому композиція має вміст продукту(ів) розщеплення діючої речовини а) щонайбільше 2 мас. %, у перерахунку на діючу речовину а), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців, і причому композиція має вміст продукту(ів) розщеплення діючої речовини б) кожного разу щонайбільше у 5 мас. %, у перерахунку на діючу речовину б), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців.
11. Спосіб стабілізації діючої речовини а) і діючої речовини б) у сумісному водному розчині фармацевтичної композиції з покращеною стабільністю для місцевого застосування для лікування ринітів за допомогою встановлення і/або підтримання постійним значення рН в межах від 5,2 до 5,9, причому композиція представлена у вигляді водної композиції і причому композиція містить:
а) щонайменше один альфа-симпатоміметик на основі імідазоліну або його фізіологічно прийнятну сіль, причому альфа-симпатоміметик на основі імідазоліну вибирають з ксилометазоліну і причому композиція містить компонент а), в перерахунку на композицію, в кількості від 0,02 до 1,0 мас. %;
б) пантотенол (декспантенол), причому композиція містить компонент б), в перерахунку на композицію, в кількості від 0,5 до 8 мас. %; і
в) щонайменше один консервант і/або дезінфекційний засіб, причому консервант і/або дезінфекційний засіб вибирають з хлориду бензалконію і причому композиція містить компонент в), в перерахунку на композицію, в кількості від 0,001 до 10 мас. %;
причому значення рН композиції встановлюють і/або підтримують постійним в межах від 5,2 до 5,9, причому встановлення й/або підтримання постійним значення рН композиції здійснюють за допомогою щонайменше однієї хімічної буферної системи, причому як хімічну буферну систему застосовують дигідрофосфатну/моногідрофосфатну буферну систему ("Н2РО4-/НРО42--буфер (система)" відповідно "фосфатний буфер (система)"), причому композиція має вміст продукту(ів) розщеплення діючої речовини а) щонайбільше 2 мас. %, у перерахунку на діючу речовину а), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців, і причому композиція має вміст продукту(ів) розщеплення діючої речовини б) кожного разу щонайбільше у 5 мас. %, у перерахунку на діючу речовину б), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців.
Текст
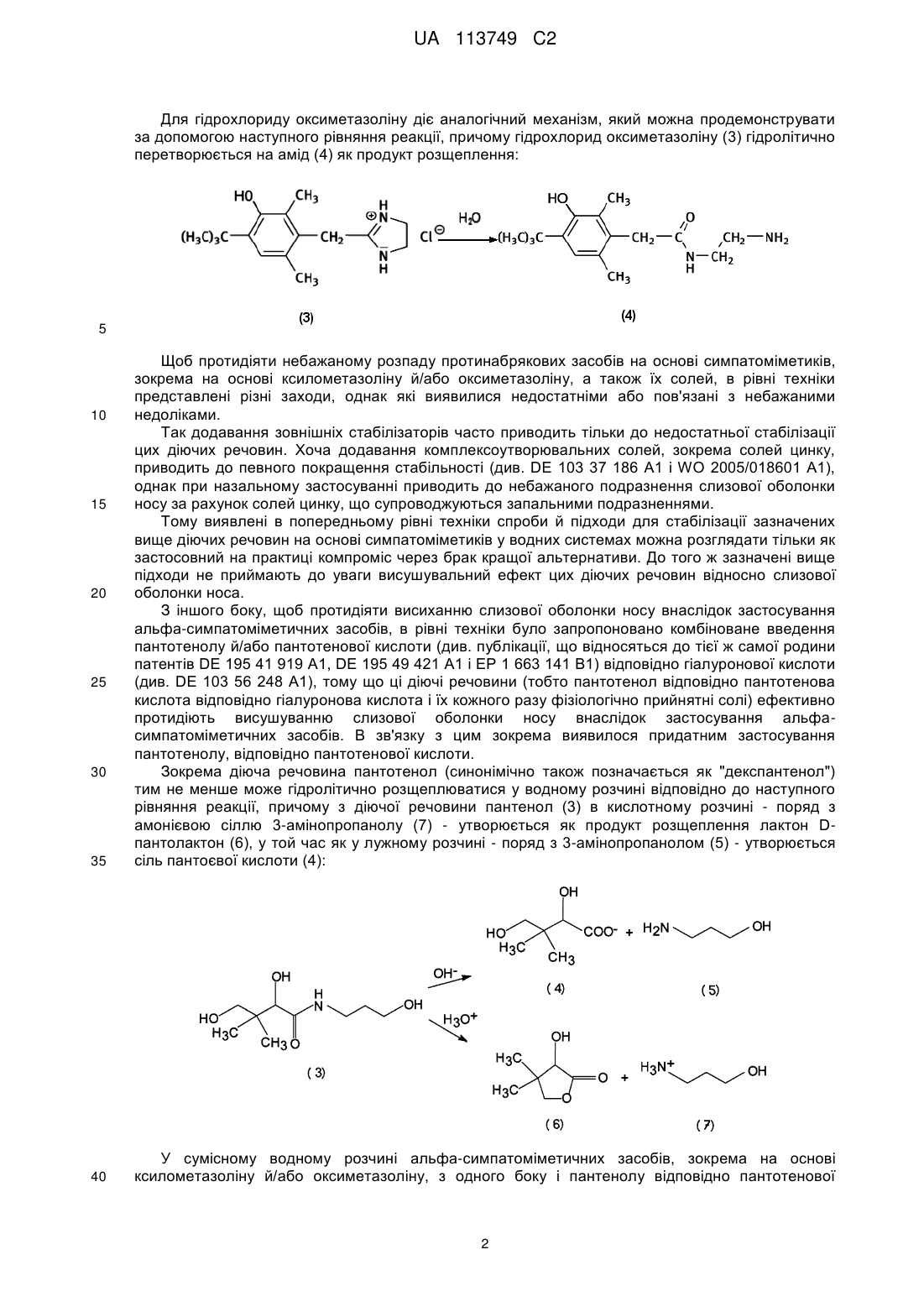
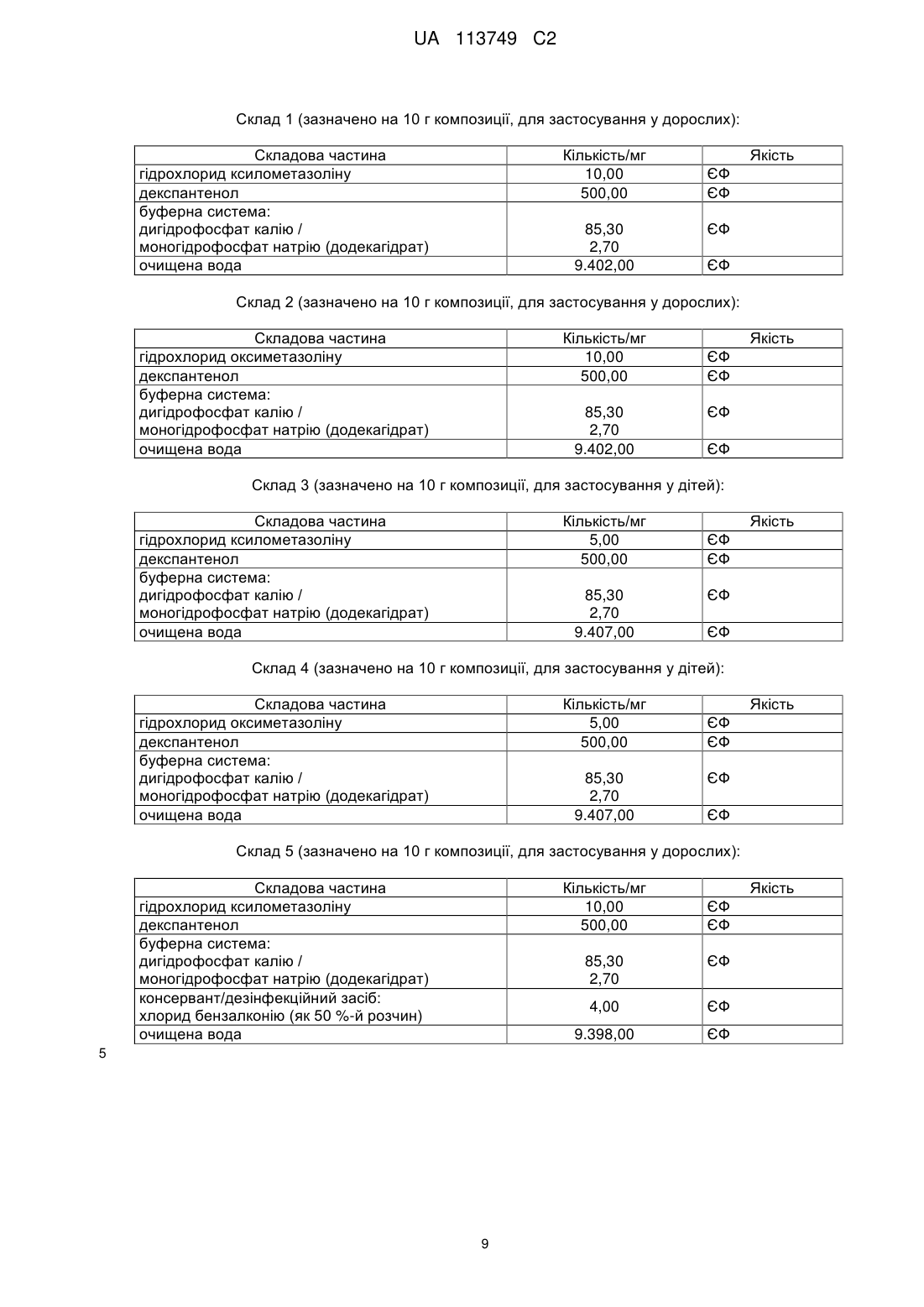
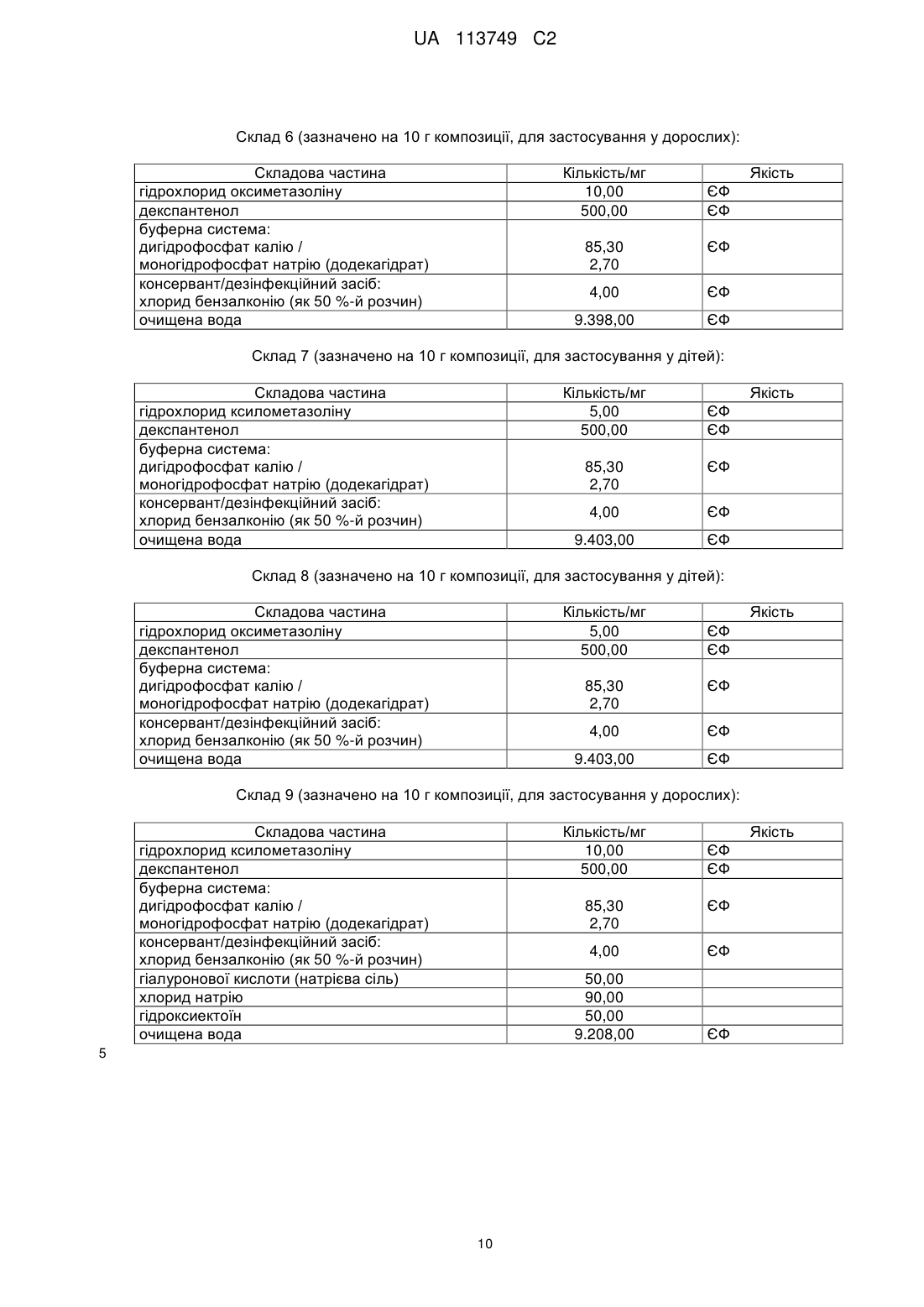
Реферат: Винахід стосується фармацевтичної композиції з покращеною стабільністю для місцевого застосування для лікування ринітів, причому композиція представлена у вигляді водної композиції і причому композиція містить: UA 113749 C2 (12) UA 113749 C2 а) щонайменше один альфа-симпатоміметик на основі імідазоліну або його фізіологічно прийнятну сіль, причому альфа-симпатоміметик на основі імідазоліну вибирають з ксилометазоліну; б) пантотенол (декспантенол); і в) щонайменше один консервант і/або дезінфекційний засіб, причому консервант і/або дезінфекційний засіб вибирають з хлориду бензалконію; причому значення рН композиції встановлюють і/або підтримують постійним в межах від 5,2 до 5,9. UA 113749 C2 5 10 15 20 25 30 35 40 45 Даний винахід відноситься до галузі лікування ринітів. Зокрема даний винахід відноситься до композиції, зокрема до фармацевтичної композиції, з покращеною стабільністю, яка придатна переважно для місцевого, зокрема назального, переважно інтраназального застосування, зокрема для лікування ринітів, і до застосування цієї композиції, а також пристрою для застосування, що містить цю композицію. Під ринітом (синонімічно принагідно також позначається як катаральний риніт, нежить або гострий нежить) в контексті даного винаходу зокрема розуміють гостре або хронічне запалення слизової оболонки носу, причому риніт зокрема може мати інфекційне, алергійне або псевдоалергійне походження. Частіше за все риніт з'являється в ході так званої застуди. Поряд з розрізненням гострого риніту з одного боку і хронічного риніту з іншого боку також розрізняють різні форми риніту, наприклад, Rhinitis acuta, Rhinitis atrophicans, Rhinitis allergica, Rhinitis hypertrophica, Rhinitis medicamentosa, Rhinitis pseudomembranacea, Rhinitis sicca і Rhinitis vasomotorica. Так званий гострий риніт (Rhinitis acuta), тобто звичайний нежить, як правило, представляє собою в цілому нешкідливе зараження слизової оболонки носу і тим самим інфекційний риніт, який може викликатися цілою низкою вірусів (зокрема риновіруси і/або аденовіруси); головною ознакою гострого риніту є так заний ніс, що тече і закладення носу внаслідок набряку слизової оболонки. В сукупності відомо про більш ніж 200 "вірусів нежиті" як можливих ініціаторів вірусного риніту, які звичайно можуть зустрічатися в ході звичайної застуди. Однак в ході застуди, яка загалом починається з риніту, в цілому Rhinitis acuta зникає. Однак при нагоді іноді можна також дійти до хронізації, яка часто супроводжується збільшенням в об'ємі слизової оболонки в тому числі в області носової раковини з утрудненням носового дихання. Стосовно подальших подробиць відносно поняття риніту зокрема може бути зроблене посилання на Pschyrembel, Medizinisches Wörterbuch, 257-е видання, сс. 1331/1332, зокрема ключові слова: "Rhinitis", "Rhinitis allergica", "Rhinitis atrophicans", "Rhinitis hyperplastica", "Rhinitis pseudomembranacea", "Rhinitis sicca" і "Rhinitis vasomotorica". Таким чином, оскільки є безліч різних типів вірусів, які можуть викликати риніт, і тому що існує безліч причин виникнення риніту, то риніти, зокрема гострі риніти, в цілому можуть лікуватися не тільки причинно, а й симптоматично, переважно місцево, частіше за все із застосуванням симпатоміметичних засобів (синонімічно також позначаються як так звані "протинабрякові засоби" або "антиконгестанти"), переважно альфа-симпатоміметків, таких як ксилометазолін і оксиметазолін або їх фізіологічно прийнятних солей. Хоча ці симпатоміметичні засоби внаслідок їх судинозвужувальних властивостей після локального відповідно місцевого застосування в носі приводять до зменшення набряку слизової оболонки носу, однак при повторному застосуванні часто спричиняють висушування слизової оболонки носу, що супроводжується запальними подразненнями слизової оболонки носу - що нерідко приводить до підвищеної загрози інфекції, тому що слизові оболонки носу у висушеному і запальному стані вже більше не можуть виконувати їх захисні й фільтраційні функції у повному обсязі і отже, збудники хвороб можуть безперешкодно потрапляти в дихальні шляхи. До того ж ці симпатоміметичні засоби, зокрема ксилометазолін і оксиметазолін, а також їх фізіологічно прийнятні солі, не здатні зберігатися необмежено у водному розчині, так що небажано і неконтрольовано можуть утворюватися продукти розщеплення цих діючих речовин, які можуть перешкоджати застосуванню відповідним водних розчинів цих діючих речовин. Так, наприклад, для альфа-симпатоміметика гідрохлорид ксилометазоліну відомо, що він у водному розчині може розщеплюватися гідролітично. Як показує наведене нижче рівняння реакції гідрохлорид ксилометазоліну (1) у водному розчині розщеплюється гідролітично при відкритті кільця імідазолу, так що як продукт розщеплення утворюється амід (2), який в монографії Європейської Фармакопеї (ЄФ) також позначається як так зване "забруднення A": 50 1 UA 113749 C2 Для гідрохлориду оксиметазоліну діє аналогічний механізм, який можна продемонструвати за допомогою наступного рівняння реакції, причому гідрохлорид оксиметазоліну (3) гідролітично перетворюється на амід (4) як продукт розщеплення: 5 35 Щоб протидіяти небажаному розпаду протинабрякових засобів на основі симпатоміметиків, зокрема на основі ксилометазоліну й/або оксиметазоліну, а також їх солей, в рівні техніки представлені різні заходи, однак які виявилися недостатніми або пов'язані з небажаними недоліками. Так додавання зовнішніх стабілізаторів часто приводить тільки до недостатньої стабілізації цих діючих речовин. Хоча додавання комплексоутворювальних солей, зокрема солей цинку, приводить до певного покращення стабільності (див. DE 103 37 186 A1 і WO 2005/018601 A1), однак при назальному застосуванні приводить до небажаного подразнення слизової оболонки носу за рахунок солей цинку, що супроводжуються запальними подразненнями. Тому виявлені в попередньому рівні техніки спроби й підходи для стабілізації зазначених вище діючих речовин на основі симпатоміметиків у водних системах можна розглядати тільки як застосовний на практиці компроміс через брак кращої альтернативи. До того ж зазначені вище підходи не приймають до уваги висушувальний ефект цих діючих речовин відносно слизової оболонки носа. З іншого боку, щоб протидіяти висиханню слизової оболонки носу внаслідок застосування альфа-симпатоміметичних засобів, в рівні техніки було запропоновано комбіноване введення пантотенолу й/або пантотенової кислоти (див. публікації, що відносяться до тієї ж самої родини патентів DE 195 41 919 A1, DE 195 49 421 A1 і EP 1 663 141 B1) відповідно гіалуронової кислоти (див. DE 103 56 248 A1), тому що ці діючі речовини (тобто пантотенол відповідно пантотенова кислота відповідно гіалуронова кислота і їх кожного разу фізіологічно прийнятні солі) ефективно протидіють висушуванню слизової оболонки носу внаслідок застосування альфасимпатоміметичних засобів. В зв'язку з цим зокрема виявилося придатним застосування пантотенолу, відповідно пантотенової кислоти. Зокрема діюча речовина пантотенол (синонімічно також позначається як "декспантенол") тим не менше може гідролітично розщеплюватися у водному розчині відповідно до наступного рівняння реакції, причому з діючої речовини пантенол (3) в кислотному розчині - поряд з амонієвою сіллю 3-амінопропанолу (7) - утворюється як продукт розщеплення лактон Dпантолактон (6), у той час як у лужному розчині - поряд з 3-амінопропанолом (5) - утворюється сіль пантоєвої кислоти (4): 40 У сумісному водному розчині альфа-симпатоміметичних засобів, зокрема на основі ксилометазоліну й/або оксиметазоліну, з одного боку і пантенолу відповідно пантотенової 10 15 20 25 30 2 UA 113749 C2 5 10 15 20 25 30 35 40 45 50 55 кислоти з іншого боку, стабілізація окремих складових частин є особливо важкою, тому що окремі діючі речовини (тобто ксилометазолін відповідно оксиметазолін з одного боку і пантенол відповідно декспантенол з іншого боку) мають їх оптимальне значення стабільності в різних діапазонах pH. Задача, що лежить в основі даного винаходу полягає в тому, щоб надати придатну для місцевого, зокрема назального, переважно інтраназального застосування, зокрема для лікування ринітів, композицію, зокрема фармацевтичну композицію, яка представлені вище недоліки попереднього рівня техніки щонайменше багато в чому усуває або ж щонайменше пом'якшує, зокрема має покращену стабільність (наприклад, стійкість при зберіганні). Зокрема така композиція після тривалого зберігання також не повинна мати ніяких відповідно ніяких значних кількостей продуктів розщеплення складових частин, зокрема ніяких значних кількостей продуктів розщеплення ксилометазоліну і/або оксиметазоліну і пантенолу відповідно пантотенової кислоти. Для вирішення описаної вище проблеми в даному винаході - відповідно до першого аспекту даного винаходу - пропонується композиція, зокрема фармацевтична композиція, за п. 1; додаткові, зокрема переважні варіанти виконання композиції відповідно до винаходу є об'єктом відповідних залежних пунктів формули винаходу. Крім того, даний винахід - згідно з другим аспектом даного винаходу - відноситься до пристрою для застосування, що містить композицію відповідно до винаходу, згідно з відповідним пунктомформули винаходу, що стосується пристрою. Наприкінці даний винахід - згідно з додатковим і третім аспектом даного винаходу відноситься до застосування композиції, що пропонується у винаході відповідно до даного винаходу, як це визначено у відповідних пунктах формули винаходу, що стосуються застосування. Само собою зрозуміло в наступних варіантах виконання, що форми здійснення, форми виконання, переваги тощо, які в подальшому з метою уникнути повторень здійснені тільки для одного аспекту винаходу, звичайно також відповідним чином розповсюджуються відносно інших аспектів даного винаходу, хоча це і не потребує окремого згадування. У всіх зазначених в подальшому відносних відповідно процентних віднесених до ваги даних, зокрема зазначеннях кількості, надалі слід звертати увагу на те, що вони в контексті даного винаходу вибираються спеціалістом в даній галузі техніки таким чином, що вони в сумі з включенням всіх компонентів відповідно складових частин, зокрема як визначено нижче, постійно доповнюють відповідно підсумовують до 100 % відповідно 100 мас. %; це само собою зрозуміло для спеціаліста в даній галузі техніки. Що стосується всього іншого, то спеціаліст в даній галузі техніки - орієнтований на галузь застосування або обумовлений поодиноким випадком - може відхилятися від наведених надалі вагових, кількісних даних і параметрів діапазону, не виходячи за межі даного винаходу. До того ж вважається, що всі зазначені надалі значення - відповідно данні параметрів або тому подібні в принципі можуть бути встановлені відповідно визначені нормованими відповідно стандартизованими або явно зазначеними способами визначення або в іншому випадку спеціалістом в даній галузі техніки відомими способами визначення відповідно вимірювання. З урахуванням наведеного вище, тепер даний винахід надалі буде пояснений більш докладно. Таким чином, об'єктом даного винаходу - відповідно до першого аспекту даного винаходу - є композиція, зокрема фармацевтична композиція, яка переважно придатна для місцевого, зокрема назального, переважно інтраназального застосування, зокрема для лікування ринітів, причому композиція містить: a) щонайменше один альфа-симпатоміметик на основі імідазоліну або його фізіологічно прийнятну сіль; і б) (б1) пантотенол (декспантенол) або його фізіологічно прийнятний складний ефір і/або (б2) пантотенову кислоту або її фізіологічно прийнятні солі, причому значення pH композиції встановлюється і/або підтримується постійним у межах від 0,5 до 6,2. Тому що, як зовсім несподівано було виявлено заявником, при встановленні відповідно постійному підтриманню цього дуже вузького діапазону pH від 5,0 до 6,2, вдається ефективним способом стабілізувати з одного боку альфа-симпатоміметик на основі імідазоліну, а з іншого боку також пантотенол (декспантенол) відповідно пантотенову кислоту, однак не виникає значного або іншого розкладання цих обох діючих речовин відповідно компонентів діючих речовин. 3 UA 113749 C2 5 10 15 20 25 30 35 40 45 50 55 60 Іншими словами при дотриманні зазначеного вище, дуже вузького режиму pH від 5,0 до 6,2 можна досягти стабілізації обох діючих речовин a) і б) також й у сумісному водному розчині, зокрема без додаткового застосування стабілізаторів або консервантів. Це є більш ніж дивним, як у цьому злегка кислому діапазоні pH від 5,0 до 6,2 слід було б очікувати гідролітичне розщеплення як альфа-симпатоміметику, так і пантотенолу відповідно пантотенової кислоти, тому що цей феномен спостерігається у розчинах окремих діючих речовин. Однак, несподіваним чином не виникає гідролітичного розщеплення обох компонентів діючої речовини a) і б), оскільки з одного боку обидва названі вище компоненти діючої речовини a) і б) знаходяться у сумісному розчині й з іншого боку стабілізується відповідно встановлюється цей прицільний і близько вибраний діапазон значень pH від 5,0 до 6,2. Винайдення цього ефекту, зокрема приймаючи до уваги стабілізацію композиції, є цілком несподіваним і таким чином у світлі представленого раніше відомого рівня техніки був неочікуваним. На цьому в подальшому ще буде зроблено більш детальна зупинка. Відповідно до винаходу в контексті даного винаходу визначення відповідно вимірювання значення pH здійснюється спеціалістом в даній галузі техніки відомими по собі відповідно звичними або ж стандартизованими методами, зокрема при 20 °C і атмосферному тиску (1.013,25 мбар). Як відомо, так зване значення pH позначається безрозмірною числовою мірою, яка відповідно до DIN 19260: 1971-03 визначається як негативний десятинний логарифм активності іонів водню. В контексті даного винаходу зазначення значення pH зокрема відноситься до методу визначення згідно з DIN 19266: 2000-01, який замінює більш давній DIN 19266: 1979-08. Стосовно подальших подробиць стосовно поняття значення pH і його вимірювання й визначення зокрема можна зробити посилання на RÖMPP Lexikon Chemie, 10-е видання, Georg-Thieme-Verlag, Stuttgart/New York, том 4, 1998, сс. від 3230 до 3232, ключове слово: "pH", а також на реферовані там літературні джерела, причому загальне назване вище місце з літературного джерела разом з реферованими там літературними джерелами тим самим включені як посилання. Що стосується компонента a) відповідно альфа-симпатоміметика на основі імідазоліну композиції відповідно до винаходу, то цей компонент a) згідно з одним особливим варіантом виконання даного винаходу зокрема вибирають з ксилометазоліну або оксиметазоліну, зокрема у формі їх фізіологічно прийнятних солей, особливо переважно у формі їх гідрохлоридних солей. Згідно з одним переважним варіантом виконання даного винаходу компонент a) відповідно альфа-симпатоміметик на основі імідазоліну вибирають з ксилометазоліну, зокрема у формі його фізіологічно прийнятних солей, особливо переважно у формі його гідрохлоридної солі (гідрохлорид ксилометазоліну). Що стосується компоненту б) композиції відповідно до винаходу, то його вибирають зокрема з пантотенолу (декспантенол) або його фізіологічно прийнятних складних ефірів. Переважно компонент б) композиції відповідно до винаходу представляє собою пантотенол (декспантенол). Згідно з одним особливим варіантом виконання композиція відповідно до винаходу містить: a) щонайменше один альфа-симпатоміметик на основі імідазоліну з групи ксилометазоліну і/або оксиметазолін або їх фізіологічно прийнятних солей, особливо переважно у формі їх гідрохлоридних солей; і б) пантотенол (декспантенол) або його фізіологічно прийнятний складний ефір. Згідно з одним переважним варіантом здійснення відповідно до винаходу композиція відповідно до винаходу містить a) ксилометазолін або його фізіологічно прийнятні солі, особливо переважно у формі його гідрохлоридної солі (гідрохлорид ксилометазоліну); і б) пантотенол (декспантенол) або його фізіологічно прийнятний складний ефір, переважно пантотенол (декспантенол). Як представлено надалі, при місцевому, зокрема назальному, переважно інтраназальному застосуванні композиції відповідно до винаходу, зокрема при лікуванні ринітів, діючий компонент a) з причини його судинозвужувальних властивостей викликає зменшення набряку слизової оболонки носу, у той час як діючий компонент б) протидіє висушуванню і запальному подразненню слизової оболонки, зокрема внаслідок застосування альфа-симпатоміметика. Кількість компоненту a) в композиції відповідно до винаходу може варіюватися у широкому діапазоні. Щоб забезпечити достатню дію компонента a) в композиції відповідно до винаходу, є сприятливим, коли композиція відповідно до винаходу містить компонент a), в перерахунку на композицію відповідно до винаходу, в кількості від 0,001 до 2 мас. %, зокрема від 0,005 до 1,5 мас. %, переважно від 0,01 до 1,2 мас. %, переважно від 0,02 до 1,0 мас. %, особливо 4 UA 113749 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно від 0,03 до 0,5 мас. %, найбільш особливо переважно від 0,04 до 0,2 мас. %. Тим не менше спеціаліст в даній галузі техніки орієнтований на галузь застосування або обумовлений поодиноким випадком може відхилятися від наведених вище зазначень кількості, не виходячи за межі даного винаходу. Рівним чином кількість компонента б) в композиції відповідно до винаходу може також варіюватися у широкому діапазоні. Однак, щоб забезпечити достатню дію завдяки компоненту б), є сприятливим, якщо композиція відповідно до винаходу містить компонент б), в перерахунку на композицію відповідно до винаходу, в кількості від 0,01 до 10 мас. %, зокрема від 0,1 до 9 мас. %, переважно від 0,5 до 8 мас. %, переважно від 1 до 7 мас. %, особливо переважно від 2 до 6 мас. %, найбільш особливо переважно від 3 до 6 мас. %. Тим не менше спеціаліст в даній галузі техніки орієнтований на галузь застосування або обумовлений поодиноким випадком може відхилятися від наведених вище зазначень кількості, не виходячи за межі даного винаходу. Для достатньої дії з одного боку і надійної стабілізація обох компонентів a) і б) з іншого боку також має значення кількісне співвідношення компонента a) до компонента б). Зокрема у зв'язку з цим є переважним, коли композиція відповідно до винаходу містить компоненти a) і б) у кількісному співвідношенні компонента a) до компонента б) в межах від 1:10 до 1:1.000, зокрема від 1:15 до 1:500, переважно від 1:20 до 1:250, переважно від 1:25 до 1:200, особливо переважно від 1:30 до 1:175, найбільш особливо переважно від 1:40 до 1:150, ще більш переважно від 1:45 до 1:125. завдяки цьому рівним чином гарантується ефективність дії й стабільність, зокрема стійкість при зберіганні. Тим не менше не виключається, що спеціаліст в даній галузі техніки, обумовлений поодиноким випадком або орієнтований на галузь застосування, може відхилятися від зазначених раніше діапазонів значень, не виходячи за межі даного винаходу. В цілому, композиція відповідно до винаходу представлена у вигляді водної композиції. Зокрема композиція відповідно до винаходу також має водну основу відповідно композиція відповідно до винаходу представлена приготовленою як водна, зокрема у формі водного розчину або водної солюбілізації. Тим самим переважно композиція відповідно до винаходу представлена як водна система, зокрема як водна однофазна система, переважно як водний розчин або водна солюбілізація. При цьому композиція відповідно до винаходу має таким чином наповнювач або носій на водній основі. В цілому композиція відповідно до винаходу представлена у вигляді прозорого, безбарвного водного розчину. З одного боку це має перевагу спрощеного застосування. З іншого боку у прозорому, безбарвному водному розчині можна легко помітити зміни. Як пояснюється вище стабілізація композиції відповідно до винаходу, зокрема діючих речовин a) і б) композиції відповідно до винаходу, вдається завдяки встановленню і/або підтриманню постійним значення pH композиції відповідно до винаходу в межах від 5,0 до 6,2. Особливо гарні результати, зокрема приймаючи до уваги стабільність, одержують, коли значення pH композиції відповідно до винаходу встановлюють і/або підтримують постійним в межах від 5,0 до 6,0, зокрема в межах від 5,1 до 6,0, переважно в межах від 5,2 до 5,9. Зазвичай встановлення й/або підтримання постійним значення pH композиції відповідно до винаходу здійснюють за допомогою щонайменше однієї хімічної буферної системи, зокрема за допомогою буферної солі(ей). Стосовно поняття хімічного буфера буферної системи зокрема можна зробити посилання на RÖMPP Lexikon Chemie, 10-е видання, Georg-Thieme-Verlag, Stuttgart/New York, том 5, 1998, сс. 3618/3619, ключове слово: "Буфер", а також на реферовані там літературні джерела. Іншими словами композиція відповідно до винаходу також містить щонайменше одну хімічну буферну систему, зокрема буферну сіль (солі). В цьому контексті зокрема виявилося, якщо для встановлення й/або підтримання постійним значення pH композиції відповідно до винаходу застосовують дигідрофосфат/моногідрофосфатну буферну систему, яка також позначається як 2"H2PO4 /HPO4 -буфер (система)" відповідно "фосфатний буфер (система)"; відповідно до винаходу особливо переважною є лужна дигідрофосфатна/лужна моногідрофосфатна буферна система. Тому що, як несподіваним чином показали проведені заявником дослідження стабільності, тільки така система фосфатного буфера - у порівнянні з іншими можливими застосовними буферними системами - сприяє бажаній і надійній довготривалій стабілізації композиції відповідно до винаходу також протягом більше двох років. Проте з іншими буферними системами, які можна застосовувати у порівняному діапазоні значень pH, таких як, наприклад 5 UA 113749 C2 5 10 15 20 25 30 35 40 45 50 55 60 буферна система вугільна кислота/бікарбонат, буферна система вугільна кислота/силікат, буферна система оцтова кислота/ацетат, буферна система лимонна кислота/цитрат або т. п., неможливо або майже неможливо отримати такі гарні відповідно не завжди надійні результати стабільності. Не бажаючи бути прив'язаними до будь-якої конкретної теорією, цей ефект застосовної системи фосфатного буфера відповідно до винаходу можливо може привести до вторинних ефектів, таких як реакцій комплексування або т. п. Приймаючи до уваги бажану довготривалу стабільність відповідно довготривалу стабілізацію композиції відповідно до винаходу виявилося особливо придатним, якщо відповідно до винаходу для встановлення відповідно підтримання постійним значення pH використовувану дигідрофосфатну/моногідрофосфатну буферну систему застосовують з молярним співвідношенням дигідрофосфат/моногідрофосфат вище 5:1, зокрема в межах від 5: 1 до 110:1, особливо переважно в межах від 6:1 до 105:1, найбільш особливо переважно в межах від 7:1 до 100:1. Іншими словами композиція відповідно до винаходу із зазначених вище причин містить дигідрофосфатну/моногідрофосфатну буферну систему переважним чином з молярним відношенням дигідрофосфат/моногідрофосфат вище 5:1, зокрема в межах від 5:1 до 110:1, особливо переважно в межах від 6:1 до 105:1, найбільш особливо переважно в межах від 7:1 до 100:1. Далі відповідно до винаходу може бути передбачено, що композиція відповідно до винаходу як іншу діючу відповідно складову частину в) містить щонайменше один консервант і/або дезінфекційний засіб. Необов'язково наявний консервант і/або дезінфекційний засіб при цьому зокрема може бути вибраний з групи (i) хлоридів алкілбензилдиметиламонію, зокрема хлоридів C8-C18-алкілбензилдиметиламонію, і сумішей різних хлоридів алкілбензилдиметиламонію, переважно хлориду бензалконію, (ii) складних ефірів пара-гідроксибензойної кислоти і сумішей різних складних ефірів пара-гідроксибензойної кислоти, переважно Nipa-ефірів, (iii) хлоргексидин, а також комбінацій зазначених вище сполук. Особливо переважно як консервант і/або дезінфекційний засіб, якщо присутній, застосовують хлорид бензалконію; хлорид бензалконію представляє собою суміш з хлоридів алкілбензилдиметиламонію, їх алкільна частина складається з C8-C18-ланцюжків, причому хлорид бензалконію зокрема відомий своєю дезінфекційною й консервувальною дією. Оскільки композиція містить консервант і/або дезінфекційний засіб, то кількість консерванту і/або дезінфекційного засобу, в перерахунку на композицію відповідно до винаходу, повинна складати від 0,001 до 10 мас. %, зокрема від 0,005 до 5 мас. %, переважно від 0,01 до 2 мас. %, переважно від 0,01 до 1 мас. %, особливо переважно від 0,01 до 0,5 мас. %. В контексті даного винаходу заявник зміг повністю неочікуваним чином виявити, що застосування консерванту і/або дезінфекційного засобу, зокрема хлориду бензалконію, приводить до додаткової стабілізації компонентів діючих речовин a) і б). Окрім цього, застосування консерванту відповідно дезінфекційного засобу також має практично спрямовані переваги, тому що дезінфекційний ефект консерванту відповідно дезінфекційного засобу підтримує дію компонентів діючої речовини a) і б) і крім того, ефективно протидіє утворенню зародків кристалізації в композиції відповідно до винаходу. Крім того, може бути передбачено, що композиція відповідно до винаходу як іншу діючу відповідно складову частину г) містить щонайменше один переважно кислий глікозаміноглікан або його фізіологічно прийнятні солі або похідні, зокрема гіалуронової кислоти або її фізіологічно прийнятні солі, зокрема в кількості від 0,0001 до 10 мас. %, зокрема 0,001 до 5 мас. %, переважно від 0,01 до 2 мас. %, в перерахунку на композицію відповідно до винаходу. Як несподівано було винайдено заявником, глікозаміноглікани, зокрема гіалуронової кислоти відповідно її солі, можуть підтримувати дію інших діючих відповідно складових частин, зокрема пантенолу відповідно пантотенової кислоти. Зокрема глікозаміноглікани, переважно гіалуронової кислоти, можуть корисно впливати стосовно послаблення інфекцій і запалень слизової оболонки носу і крім того, викликати прискорення регенерації запаленої тканини. Крім того, відповідно до винаходу може бути передбачено, що композиція відповідно до винаходу як додаткову діючу відповідно складову частину д) містить ектоїн або щонайменше похідне ектоїну, зокрема гідроксиектоїн, зокрема в кількості від 0,0001 до 10 мас. %, зокрема 0,001 до 5 мас. %, переважно від 0,01 до 2 мас. %, в перерахунку на композицію. Як несподівано було винайдено заявником, застосування ектоїну відповідно похідного ектоїну являє собою перевагу, приймаючи до уваги прискорення регенерації запаленої слизової оболонки носу. Окрім цього, відповідно до винаходу може бути передбачено, що композиція відповідно до винаходу як додаткову діючу відповідно складову частину е) містить хлорид натрію, зокрема в кількості від 0,001 до 5 мас. %, зокрема 0,01 до 2 мас. %, переважно 0,1 до 1 мас. %, в 6 UA 113749 C2 5 10 15 20 25 30 35 40 45 50 55 60 перерахунку на композицію. Хлорид натрію зокрема сприяє зволоженню слизової оболонки носу і тим самим прискоренню регенерації запаленої слизової оболонки носу. Рівним чином може бути передбачено, що композиція відповідно до винаходу містить щонайменше одну іншу складову частину. Ця інша складова частина зокрема може біти вибрана з групи допоміжних речовин для переробки, стабілізаторів, емульгаторів, антиоксидантів, регуляторів вологості, загусників, антисептиків, барвників, ароматизаторів, запашних речовин, віддушок, наповнювачів, зв'язувальних речовин, змочувальних агентів, вітамінів, мікроелементів, мінеральних речовин, харчових мікроелементів і/або ефірних олій, а також їх комбінацій. Крім того, важливе значення має осмотичність композиції відповідно до винаходу. Осмотичність композиції відповідно до винаходу може варіюватися в широкому діапазоні. Для того, що забезпечити гарну сумісність композиції відповідно до винаходу відносно слизової оболонки носу, переважним є, якщо композиція згідно з даним винаходом має осмотичність в межах від 300 до 600 мосмоль/кг, зокрема в межах від 310 до 550 мосмоль/кг, переважно в межах від 300 до 525 мосмоль/кг, переважно в межах від 325 до 510 мосмоль/кг, особливо переважно в межах від 350 до 500 мосмоль/кг. Таким чином, при місцевому застосуванні композиції відповідно до винаходу гарантується гарна сумісність зі слизовою оболонкою носу. Далі, для гарної зручності у користуванні композиції відповідно до винаходу перевагою є те, якщо композиція відповідно до винаходу при температурі у 20 °C і під тиском у 1.013,25 мбар має відносну густину, у перерахунку на чисту воду, в межах від 1,001 до 1,2, зокрема в межах від 1,005 до 1,15, переважно в межах від 1,005 до 1,105. Як було описано вище, виходячи із заходів відповідно до винаходу, які були представлені раніше, композиція відповідно до винаходу має чудову стабільність відповідно довготривалу стабільність, зокрема стійкість при зберіганні. Зокрема композиція відповідно до винаходу при температурах в межах від 20 °C до 50 °C, під тиском у 1.013,25 мбар і при відносній вологості повітря в межах від 50 % до 90 % є стабільною зокрема стабільною при зберіганні щонайменше, 6 місяців, зокрема щонайменше 12 місяців, переважно щонайменше 24 місяці, переважно щонайменше 36 місяців. Стабільність композиції відповідно до винаходу може бути визначена й охарактеризована наявністю відповідно вмістом продуктів розщеплення діючих речовин a) і б). Як вже було представлено на початку характерним продуктом розщеплення ксилометазоліну відповідно гідрохлориду ксилометазоліну є так зване забруднення A. Як вже рівним чином було описано на початку типовими продуктами розщеплення діючої речовини б), зокрема пантотенолу, є амінопропанол відповідно його амонієва сіль і D-пантолактон. У зв'язку з цим композиція відповідно до винаходу має вміст продукту(ів) розщеплення діючої речовини a), зокрема забруднення A, щонайбільше 5 мас. %, зокрема щонайбільше 3 мас. %, переважно щонайбільше 2 мас. %, особливо переважно щонайбільше 1 мас. %, у перерахунку на діючу речовину a); цей у всякому випадку гранично незначний вміст продукту(ів) розщеплення діючої речовини a) також ще підтримується після зберігання композиції відповідно до винаходу при температурах в межах від 20 °C до 50 °C, під тиском у 1.013,25 мбар і при відносній вологості повітря в межах від 50 % до 90 % щонайменше у 6 місяців, зокрема щонайменше 12 місяців, переважно щонайменше 24 місяці, переважно щонайменше 36 місяців. Крім того, у цьому зв'язку композиція відповідно до винаходу має вміст продукт(ів) розщеплення діючої речовини б), зокрема амінопропанолу і/або D-пантолактону, кожного разу щонайбільше у 5 мас. %, зокрема кожного разу щонайбільше у 3 мас. %, переважно кожного разу щонайбільше у 2 мас. %, особливо переважно кожного разу щонайбільше у 1 мас. %, у перерахунку на діючу речовину б); цей у всякому випадку гранично незначний вміст продукту(ів) розщеплення діючої речовини б) також ще підтримується після зберігання композиції при температурах в межах від 20 °C до 50 °C, під тиском у 1.013,25 мбар і при відносній вологості повітря в межах від 50 % до 90 % щонайменше у 6 місяців, зокрема щонайменше 12 місяців, переважно щонайменше 24 місяці, переважно щонайменше 36 місяців. Зокрема даний винахід відноситься до представленої раніше композиції для застосування при профілактичному і/або лікувальному місцевому лікуванні ринітів, зокрема Rhinitis acuta. Крім того, даний винахід - згідно з другим аспектом даного винаходу - відноситься до пристрою для застосування, який містить описану раніше композицію згідно з даним винаходом, причому відповідно до винаходу пристрій є придатним для застосування зокрема для місцевого, зокрема назального, переважно інтраназального застосування і переважно представлений у формі ємності з крапельним пристроєм або розбризкувачем. Відповідно до винаходу є переважним, якщо пристрій для застосування відповідно до винаходу має розбризкувач для переважно рівномірного введення композиції згідно з даним 7 UA 113749 C2 5 10 15 20 25 30 35 40 45 50 55 винаходом у кількості на впорскування в межах від 25 мкл до 300 мкл, зокрема в межах від 50 мкл до 200 мкл, переважно в межах від 75 мкл до 125 мкл. При цьому зокрема передбачено, що пристрій для застосування відповідно до винаходу має ємність відповідно ресивер з об'ємом в межах від 5 мл до 100 мл, зокрема 10 мл до 50 мл. В такому випадку ця ємність відповідно цей ресивер служить для прийняття композиції відповідно до винаходу. Стосовно подальших подробиць відносно пристрою для застосування відповідно до винаходу можна зробити посилання на зазначені вище форми здійснення композиції відповідно до винаходу, які застосовуються відповідним чином приймаючи до уваги пристрій для застосування відповідно до винаходу. Іншим об'єктом даного винаходу - згідно з третім аспектом даного винаходу - є застосування раніше описаної композиції, що пропонується в даному винаході для профілактичного і/або лікувального місцевого лікування ринітів всіх видів, зокрема Rhinitis acuta, відповідно застосування описаної вище композиції, що пропонується в даному винаході для одержання лікарського засобу для профілактичного і/або лікувального місцевого лікування ринітів всіх видів, зокрема Rhinitis acuta. Зокрема композицію відповідно до винаходу можна застосовувати для лікування ринітів всіх видів, зокрема Rhinitis acuta, Rhinitis allergica, Rhinitis atrophicans, Rhinitis hyperplastica або hypertrophicans, Rhinitis mutilans, Rhinitis nervosa або vasomotorica або Rhinitis pseudomembranacea, переважно Rhinitis acuta. Як описано вище, в контексті застосування відповідно до винаходу композицію, що пропонується в даному винаході, як описано вище, можна застосовувати місцево, зокрема назально, переважно інтраназально. При цьому зокрема використовують пристрій для застосування відповідно до винаходу, як він описаний вище. Більш детальну інформацію щодо застосування відповідно до винаходу можна зробити посилання на зазначені вище форми виконання решти аспектів винаходу, які відносно застосування відповідно до винаходу використовують відповідним чином. Додаткові форми виконання, модифікації і варіації, а також переваги даного винаходу без проблем можуть бути розпізнані й реалізовані спеціалістом в даній галузі техніки при прочитанні опису, при цьому не виходячи за межі даного винаходу. Наступні приклади виконання служать тільки для наочного зображення даного винаходу, однак тим самим не обмежують його. Приклади здійснення: 1. Приклади одержання: Загальна інструкція з виготовлення Для одержання кожного разу 1.000 г прозорого водного розчину композиції відповідно до винаходу діють відомим по собі спеціалісту в даній галузі техніки способом: спочатку при кімнатній температурі й під тиском навколишнього середовища у відповідну скляну ємність з мішалкою поміщають певну кількість очищеної води (наприклад 300 мл до 600 мл) і після цього розчином вибраної буферної системи встановлюють до заданого значення pH у межах між 5,2 і 5,9 (наприклад значення pH прибл. у 5,5) під наступним контролем досягнутого значення pH. Потім туди додають зазначену надалі у прикладах складів кількість декспантенолу, і після цього все повністю розчиняють за допомогою ретельного перемішування. Потім до розчину при необхідності додають консервант відповідно дезінфекційний засіб, зокрема хлорид бензалконію, переважно у формі водного розчину й рівним чином розчиняють при перемішуванні. Слідом додають бажану кількість ксилометазоліну відповідно гідрохлориду оксиметазоліну, з наступним доповненням водою до кінцевої ваги у 1.000 г і гомогенно перемішують. При перемішуванні розчин фільтрують через нейтральний целюлозний фільтр. На завершення значення pH контролюють ще раз. Також решту відповідних специфікацій розчину перепровіряють на встановлені відповідно попередньо вибрані діапазони значень (наприклад осмотичність: 400 до 490 мосмоль/кг; відносну густину при 20 °C: 1,01 до 1,05; мікробіологічну чистоту і стерильність; видалення забруднень, зокрема продуктів розщеплення складових частин і діючих речовин). Наприкінці частину одержаного розчину наповнюють у пляшки з вузьким горлечком зі скла коричневого кольору до 10 мл або 20 мл, які за вибором можуть бути оснащені піпеткою або помпою-дозатором для розпилення; для застосування згідно з приписом можна декілька разів щоденно вводити від однієї до трьох крапельок відповідно впорскувати від одного до двох впорскувань у кожну ніздрю. Іншу частину одержаного розчину застосовують для описаного надалі дослідження стабільності. Згідно з цією загальною інструкцією одержання готують наступні специфіковані склади. 60 8 UA 113749 C2 Склад 1 (зазначено на 10 г композиції, для застосування у дорослих): Складова частина гідрохлорид ксилометазоліну декспантенол буферна система: дигідрофосфат калію/ моногідрофосфат натрію (додекагідрат) очищена вода Кількість/мг 10,00 500,00 85,30 2,70 9.402,00 Якість ЄФ ЄФ ЄФ ЄФ Склад 2 (зазначено на 10 г композиції, для застосування у дорослих): Складова частина гідрохлорид оксиметазоліну декспантенол буферна система: дигідрофосфат калію / моногідрофосфат натрію (додекагідрат) очищена вода Кількість/мг 10,00 500,00 85,30 2,70 9.402,00 Якість ЄФ ЄФ ЄФ ЄФ Склад 3 (зазначено на 10 г композиції, для застосування у дітей): Складова частина гідрохлорид ксилометазоліну декспантенол буферна система: дигідрофосфат калію / моногідрофосфат натрію (додекагідрат) очищена вода Кількість/мг 5,00 500,00 85,30 2,70 9.407,00 Якість ЄФ ЄФ ЄФ ЄФ Склад 4 (зазначено на 10 г композиції, для застосування у дітей): Складова частина гідрохлорид оксиметазоліну декспантенол буферна система: дигідрофосфат калію / моногідрофосфат натрію (додекагідрат) очищена вода Кількість/мг 5,00 500,00 85,30 2,70 9.407,00 Якість ЄФ ЄФ ЄФ ЄФ Склад 5 (зазначено на 10 г композиції, для застосування у дорослих): Складова частина гідрохлорид ксилометазоліну декспантенол буферна система: дигідрофосфат калію / моногідрофосфат натрію (додекагідрат) консервант/дезінфекційний засіб: хлорид бензалконію (як 50 %-й розчин) очищена вода Кількість/мг 10,00 500,00 Якість ЄФ ЄФ 85,30 2,70 4,00 9 ЄФ 9.398,00 5 ЄФ ЄФ UA 113749 C2 Склад 6 (зазначено на 10 г композиції, для застосування у дорослих): Складова частина гідрохлорид оксиметазоліну декспантенол буферна система: дигідрофосфат калію / моногідрофосфат натрію (додекагідрат) консервант/дезінфекційний засіб: хлорид бензалконію (як 50 %-й розчин) очищена вода Кількість/мг 10,00 500,00 Якість ЄФ ЄФ 85,30 2,70 ЄФ 4,00 ЄФ 9.398,00 ЄФ Склад 7 (зазначено на 10 г композиції, для застосування у дітей): Складова частина гідрохлорид ксилометазоліну декспантенол буферна система: дигідрофосфат калію / моногідрофосфат натрію (додекагідрат) консервант/дезінфекційний засіб: хлорид бензалконію (як 50 %-й розчин) очищена вода Кількість/мг 5,00 500,00 Якість ЄФ ЄФ 85,30 2,70 ЄФ 4,00 ЄФ 9.403,00 ЄФ Склад 8 (зазначено на 10 г композиції, для застосування у дітей): Складова частина гідрохлорид оксиметазоліну декспантенол буферна система: дигідрофосфат калію / моногідрофосфат натрію (додекагідрат) консервант/дезінфекційний засіб: хлорид бензалконію (як 50 %-й розчин) очищена вода Кількість/мг 5,00 500,00 Якість ЄФ ЄФ 85,30 2,70 ЄФ 4,00 ЄФ 9.403,00 ЄФ Склад 9 (зазначено на 10 г композиції, для застосування у дорослих): Складова частина гідрохлорид ксилометазоліну декспантенол буферна система: дигідрофосфат калію / моногідрофосфат натрію (додекагідрат) консервант/дезінфекційний засіб: хлорид бензалконію (як 50 %-й розчин) гіалуронової кислоти (натрієва сіль) хлорид натрію гідроксиектоїн очищена вода Кількість/мг 10,00 500,00 Якість ЄФ ЄФ 85,30 2,70 4,00 10 ЄФ 50,00 90,00 50,00 9.208,00 5 ЄФ ЄФ UA 113749 C2 Склад 10 (зазначено на 10 г композиції, для застосування у дітей): Складова частина гідрохлорид ксилометазоліну декспантенол буферна система: дигідрофосфат калію / моногідрофосфат натрію (додекагідрат) консервант/дезінфекційний засіб: хлорид бензалконію (як 50 %-й розчин) гіалуронової кислоти (натрієва сіль) хлорид натрію гідроксиектоїн очищена вода 5 10 15 20 25 30 35 40 45 Кількість/мг 5,00 500,00 Якість ЄФ ЄФ 85,30 2,70 ЄФ 4,00 ЄФ 50,00 90,00 50,00 9.213,00 ЄФ 2. Дослідження постмаркетингового застосування й клінічні дослідження: Кожні 20 пробандів з колективу пробандів, що складається зі 100 пацієнтів у віці від 28 до 79 років (56 чоловіків, 44 жінок), які страждають на гострі риніти, піддавали лікуванню певними, призначеними для лікування дорослих складами, 1 відповідно 2 відповідно 5 відповідно 6 відповідно 9 протягом тривалості захворювання (в цілому від 3 до 10 днів); склади застосовували місцево декілька разів на день як спрей. Судинозвужувальний ефект гідрохлориду ксилометазоліну відповідно гідрохлориду оксиметазоліну, з точки зору покращення симптоматики набряку носу й утруднення носового дихання, можна було суттєво виявити у всіх пацієнтів. Завдяки наявності компоненту декспантенолу, а також при необхідності інших компонентів (наприклад гіалуронової кислоти відповідно гідроксиектоїну відповідно хлориду натрію) не спостерігалися ніякі подразнювальні дії слизової оболонки носу внаслідок гідрохлориду ксилометазоліну відповідно гідрохлориду оксиметазоліну. Зокрема також не виявляється ніяких подразнень слизової оболонки носу в результаті так званого "ефекту віддачі", який звичайно виникає при застосуванні гідрохлориду ксилометазоліну відповідно гідрохлориду оксиметазоліну як єдиної діючої речовини (тобто без наявності декспантенолу) після повторного застосування. Аналогічним чином і з порівняним успіхом лікування по 5 пробандів колективу пробандів, що складається з 25 пацієнтів у віці від 3 до 12 років (14 хлопчиків, 11 дівчаток), які рівним чином страждають на гострі риніти, піддавали лікуванню призначеними для лікування дітей складами 3 відповідно 4 відповідно 7 відповідно 8 відповідно 10 протягом тривалості захворювання (в цілому рівним чином від 3 до 10 днів). Крім того, подальші клінічні дослідження, а також додаткові рандомізовані контрольовані за допомогою плацебо подвійні сліпі дослідження підтвердили заявникові синергізм впливів діючих речовин композиції відповідно до винаходу, що при лікуванні ринітів приводить до клінічно більш значного покращення, а саме чітко виходить за межі єдиної діючої речовини. 3. Дослідження стабільності: Надалі показані результати цілої низки досліджень стабільності. З цією метою, кожного разу при визначених умовах зберігання, які у кожному випадку зазначені нижче, проводили дослідження довготривалої стабільності відповідних композицій, причому через певні проміжки часу вимірювали спеціальні перевіювані параметр композицій і порівнювали з відповідними специфікаціями (наприклад, зовнішній вигляд композиції, значення pH, відносна густина, осмотичність, а також вміст діючих речовин, а також забруднень). Оскільки надалі чітко не визначене інше, зберігання відбувалося при визначеній температурі у 25±2 °C і при відносній вологості повітря навколишнього середовища у 60±5 %. Характерною мірою для стабільності композиції з одного боку є постійність значення pH, а також постійність вмісту діючих речовин (тобто гідрохлориду ксилометазоліну відповідно гідрохлориду оксиметазоліну, а також декспантенолу). Далі може бути визначений вміст продуктів розщеплення діючих речовин, щоб оцінити стабільність композиції. Як вже представлено на початку, так зване забруднення A є типовим продуктом розщеплення гідрохлориду ксилометазоліну, у той час як характерними продуктами розщеплення декспантенолу є амінопропанол відповідно його амонієва сіль і D-пантолактон. У подальшому описі результатів досліджень стабільності зазначення процентів діючих речовин гідрохлориду ксилометазоліну відповідно гідрохлориду оксиметазоліну і декспантенолу відносяться до зазначення вагових процентів відносно композиції, у той час як на відміну від 11 UA 113749 C2 5 10 15 20 25 30 35 40 45 50 55 60 цього процентні зазначення вмісту всіх забруднень кожного разу наведені як зазначення вагових процентів відносно первинної діючої речовини, тобто, наприклад, вміст забруднення A як зазначення вагових процентів відносно гідрохлориду ксилометазоліну і вміст амінопропанолу відповідно D-пантолактону як зазначення вагових процентів відносно декспантенолу. Іншими словами у випадку забруднень зазначення вагових процентів безпосередньо не відносяться до композиції, а до вмісту відповідної діючої речовини, з розщеплення якої утворюється відповідне забруднення. a) Дослідження стабільності З партії композиції ї відповідно до винаходу згідно з раніше описаним складом 1 здійснювали дослідження стабільності. З цією метою з одного боку визначали як вміст гідрохлориду ксилометазоліну (див. фіг. 1), так і вміст його продукту розщеплення (забруднення A) (див. фіг. 2), а саме кожного разу після зазначеного на фіг. 1 і 2 терміну зберігання у 3 місяці, 6 місяців, 9 місяців, 12 місяців, 18 місяців, 24 місяці й 36 місяців. З іншого боку також були визначені значення pH протягом того ж самого проміжку часу для заданих термінів зберігання (див. фіг. 3) так і вміст декспантенолу (див. фіг. 4). Зберігання здійснювали при визначеній температурі у 25±2 °C і при відносній вологості повітря навколишнього середовища у 60±5 %. Одержані результати представлені на зображеннях фігур від 1 до 4. На фіг. 1 показаний відносний вміст ксилометазоліну у вагових процентах, в перерахунку на композицію, протягом проміжку часу зберігання у 36 місяців. Виявляється чудова стабільність гідрохлориду ксилометазоліну, тобто по суті не відбувається ніякого розщеплення. Це корелює з результатами, які представлені на фіг. 2, причому на фіг. 2 показаний відносний вміст забруднень A у вагових процентах, у перерахунку на гідрохлорид ксилометазоліну, протягом терміну зберігання. Протягом перших 12 місяців термін зберігання вміст забруднення A не був встановлений. Також протягом решти 24 місяців вміст забруднення A суттєво не підвищується і знаходиться значно нижче припустимої межі специфікації у 2 мас. %, у перерахунку на гідрохлорид ксилометазоліну. Як далі показано на фіг. 3, значення pH композиції відповідно до винаходу для сукупного проміжку часу зберігання у 36 місяців також залишається явно в межах специфікації між 5,0 і 6,2. На закінчення фіг. 4 також підтверджує стабільність композиції відповідно до винаходу, відображає вміст декспантенолу в композиції відповідно до винаходу у вагових процентах, в перерахунку на композицію, причому відповідний вміст декспантенолу незначно зменшується протягом сукупного терміну зберігання у 36 місяців, але все ж явно залишається в межах специфікації між 4,75 мас. % і 5,25 мас. %, в перерахунку на композицію. Результати підтверджують чудову довготривалу стабільність композиції відповідно до винаходу. б) Інші дослідження стабільності З іншої партії композиції відповідно до винаходу згідно зі складом 1 рівним чином здійснювали дослідження довготривалої стабільності. Результати наведені у таблиці 1. в) Вплив різних параметрів на стабільність композиції Вплив на значення pH Були приготовлені різні композиції аналогічно складу 1, причому однак на відміну від складу 1 значення pH варіювало в межах від 4,5 до 7,5. Результати зведені в таблиці 2. Як показують результати, нижче значення pH у 5,0 і вище значення pH у 6,2 виникає швидке розкладання композиції відповідно до винаходу. У передбаченому відповідно до винаходу діапазоні pH між 5,0 і 6,2 напроти одержували гарні результати. Особливо гарні результати можливо одержати у діапазоні pH від 5,0 до 6,0, зокрема від 5,1 до 6,0, особливо від 5,2 до 5,9. Вплив виду буферної системи Крім того були проведені дослідження з різними буферними системами. Поряд із застосованою відповідно до винаходу системою фосфатного буфера також досліджували буферні системи на основі вугільна кислота/бікарбонат, оцтова кислота/ацетат, вугільна кислота/силікат і лимонна кислота/цитрат. Початкові значення pH всіх композицій встановлювали до прибл. 5,5. Тільки із застосовною системою фосфатного буфера відповідно до винаходу можна досягти надійної довготривалої стабільності. Результати представлені в таблиці 3. Вплив в присутності консерванту відповідно дезінфекційного засобу Далі був досліджений вплив консерванту відповідно дезінфекційного засобу відносно стабільності композиції. Як показують дослідження, завдяки наявності консерванту відповідно дезінфекційного засобу (хлорид бензалконію), довготривала стабільність композиції покращується ще більше. Відповідні результати представлені в таблиці 4. 12 UA 113749 C2 5 10 15 Вплив молярного співвідношення дигідрофосфат/моногідрофосфат Далі досліджували вплив молярного співвідношення дигідрофосфат/моногідрофосфат. Тільки з вибраним молярним співвідношенням відповідно до винаходу можливо одержати особливо ефективну довготривалу стабільність композиції. Як підтверджують представлені вище результати досліджень стабільності, проведених заявником, для винайденні стабільної композиції для лікування ринітів відповідно до даного винаходу з боку заявника були необхідними значні витрати на дослідження. Представлені вище дослідження стабільності показують ступінь складності винайденого заявником складу розчину. Це включає в себе сумісну присутність діючих речовин a) і б) у визначеному кількісному співвідношенні при одночасному дотриманні відповідно підтриманні постійним значення pH композиції у визначеному раніше діапазоні - так само як й інших співфакторів, таких як зокрема вибір придатної буферної системи, а також придатного молярного співвідношення компонентів цієї буферної системи. Додаткове покращення стабільності можливо досягти за допомогою консерванту і/або дезінфекційного засобу, зокрема на основі хлориду бензалконію. В результаті склад розчину відповідно до винаходу несподіваним чином співіснує з тільки малими додатковими складовими частинами, однак які не мають негативного впливу на дію самих діючих речовин; приймаючи до уваги передбачувану фармацевтичну дію це має вирішальне значення. 20 Таблиця 1 Перевірюваний Специфікація Початок 3 місяці 6 місяців 9 місяців 12 місяців 18 місяців 24 місяці 36 місяців параметр Безбарвна прозора рідина Зовнішній вигляд (прозорість: відповідає відповідає відповідає відповідає відповідає відповідає відповідає відповідає 1 >1 (мас. %) декспантенол 5,00(4,50-5,25) 5,19 5,01 4,83 4,69 3 >3 >3 (мас. %) 13 18 24 місяці місяців 0,0890 0,0802 >1 >1 3 UA 113749 C2 Таблиця 2 Порядк. № 2B 2C 2D 2E* 2F* Перевірюваний параметр гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) Специфікація Початок 3 місяці 6 місяців 9 місяців 12 місяців 18 24 місяці місяців 0,100 0,1013 (0,095-0,105) 0,1029 0,1021 0,1022 0,1030 0,1019 0,1033 макс. 1,0 н.в. н.в. 0,019 0,070 0,079 0,089 0,090 5,00(4,505,25) 5,21 5,20 5,23 5,19 5,24 5,13 5,10 макс. 3,0 0,35 0,45 0,67 0,81 0,93 1,02 1,12 0,1036 0,1028 0,1020 0,1032 0,1017 0,1044 0,100 0,1013 (0,095-0,105) макс. 1,0 н.в. н.в. н.в. 0,068 0,070 0,075 0,092 5,00(4,505,25) 5,21 5,24 5,24 5,15 5,25 5,17 5,19 макс. 3,0 0,29 0,37 0,52 0,65 0,75 0,82 0,99 0,1016 0,1018 0,1022 0,1033 0,1019 0,1010 0,100 0,1013 (0,095-0,105) макс. 1,0 н.в. н.в. н.в. н.в. 0,055 0,061 0,071 5,00(4,505,25) 5,21 5,21 5,21 5,20 5,24 5,20 5,19 макс. 3,0 0,31 0,43 0,51 0,63 0,72 0,88 0,98 0,1000 0,1018 0,0999 0,0955 0,0901 0,0802 0,100 0,1011 (0,095-0,105) макс. 1,0 0,056 0,260 0,988 >1 >1 >1 >1 5,00(4,505,25) 5,21 5,01 4,90 4,80 4,70 < 4,50 3 >3 >3 >3 0,1000 0,1018 0,0999 0,0955 0,0901 0,0802 0,100 0,1010 (0,095-0,105) макс. 1,0 0,075 0,489 >1 >1 >1 >1 >1 5,00(4,505,25) 5,20 4,99 4,80 4,60 3 >3 >3 н.в. = не визначається (нижче межі аналізу) * = не відповідно до винаходу Початкове значення pH композиції 2A: 4,0 / Початкове значення pH композиції 2B: 5,0 / Початкове значення pH композиції 2C: 5,2 Початкове значення pH композиції 2D: 5,5 / Початкове значення pH композиції 2E: 6,5 / Початкове значення pH композиції 2F: 7,5 / 14 UA 113749 C2 Таблиця 3 Порядк. № 3A* 3B* 3C 3D* 3E* Перевірюваний параметр гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) гідрохлорид ксилометазоліну (мас. %) забруднення А (мас. %) декспантенол (мас. %) 3-амінопропанол (мас. %) Специфікація Початок 3 місяці 6 місяців 9 місяців 12 місяців 18 24 місяці місяців 0,100 0,1013 (0,095-0,105) 0,1011 0,0997 0,0988 0,0942 0,0890 0,0800 макс. 1,0 0,039 0,342 0,663 0,897 >1 >1 >1 5,00 (4,50-5,25) 5,21 5,10 5,00 4,86 4,57 < 4,50 3 >3 >3 0,1012 0,1010 0,1003 0,0995 0,0978 0,0922 0,100 0,1013 (0,095-0,105) макс. 1,0 н.в. 0,220 0,362 0,443 0,677 >1 >1 5,00 (4,50-5,25) 5,21 5,20 5,08 4,98 4,67 3 >3 0,1016 0,1018 0,1022 0,1033 0,1019 0,1010 0,100 0,1013 (0,095-0,105) макс. 1,0 н.в. н.в. н.в. н.в. 0,055 0,061 0,071 5,00 (4,50-5,25) 5,21 5,21 5,21 5,20 5,24 5,20 5,19 макс. 3,0 0,33 0,41 0,52 0,63 0,77 0,87 0,95 0,1009 0,1000 0,0999 0,0955 0,0940 0,0902 0,100 0,1011 (0,095-0,105) макс. 1,0 0,046 0,255 0,560 0,789 0,999 >1 >1 5,00 (4,50-5,25) 5,22 5,11 5,01 4,99 4,67 3 >3 0,1014 0,1011 0,1001 0,0990 0,0980 0,0902 0,100 0,1012 (0,095-0,105) макс. 1,0 н.в. 0,190 0,370 0,489 0,789 0,999 >1 5,00 (4,50-5,25) 5,21 5,19 5,11 5,00 4,78 3 >3 н.в. = не визначається (нижче межі аналізу) * = не відповідно до винаходу буфер: 3A: вугільна кислота/бікарбонат / 3B: оцтова кислота/ацетат / 3C: фосфатний буфер (за винаходом) 3D: вугільна кислота/силікат / 3E: лимонна кислота/цитрат 15 UA 113749 C2 Таблиця 4 Порядк. Перевірюваний 12 Специфікація Початок 3 місяці 6 місяців 9 місяців № параметр місяців гідрохлорид 0,100 ксилометазоліну 0,1013 0,1016 0,1018 0,1022 0,1033 (0,095-0,105) (мас. %) забруднення А макс. 1,0 н.в. н.в. н.в. н.в. 0,055 (мас. %) 4A декспантенол 5,00 5,21 5,21 5,21 5,20 5,24 (мас. %) (4,50-5,25) 3-амінопропанол макс. 3,0 0,33 0,43 0,52 0,66 0,73 (мас. %) гідрохлорид 0,100 ксилометазоліну 0,1013 0,1016 0,1016 0,1020 0,1029 (0,095-0,105) (мас. %) забруднення А макс. 1,0 н.в. н.в. н.в. н.в. н.в. (мас. %) 4B декспантенол 5,00 5,21 5,21 5,21 5,20 5,20 (мас. %) (4,50-5,25) 3-амінопропанол макс. 3,0 0,32 0,42 0,51 0,64 0,73 (мас. %) 18 24 місяці місяців 0,1019 0,1010 0,061 0,071 5,20 5,19 0,87 0,98 0,1020 0,1015 0,033 0,049 5,20 5,20 0,86 0,97 композиція 4A: без хлориду бензалконію композиція 4B: як композиція 4A, однак з хлоридом бензалконію (0,02 мас. %) ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 1. Фармацевтична композиція з покращеною стабільністю для місцевого застосування для лікування ринітів, причому композиція представлена у вигляді водної композиції і причому композиція містить: а) щонайменше один альфа-симпатоміметик на основі імідазоліну або його фізіологічно прийнятну сіль, причому альфа-симпатоміметик на основі імідазоліну вибирають з ксилометазоліну і причому композиція містить компонент а), в перерахунку на композицію, в кількості від 0,02 до 1,0 мас. %; б) пантотенол (декспантенол), причому композиція містить компонент б), в перерахунку на композицію, в кількості від 0,5 до 8 мас. %; і в) щонайменше один консервант і/або дезінфекційний засіб, причому консервант і/або дезінфекційний засіб вибирають з хлориду бензалконію і причому композиція містить компонент в), в перерахунку на композицію, в кількості від 0,001 до 10 мас. %; причому значення рН композиції встановлюють і/або підтримують постійним в межах від 5,2 до 5,9, причому встановлення й/або підтримання постійним значення рН композиції здійснюють за допомогою щонайменше однієї хімічної буферної системи, причому як хімічну буферну систему 2застосовують дигідрофосфатну/моногідрофосфатну буферну систему ("Н 2РО4 /НРО4 -буфер (система)" відповідно "фосфатний буфер (система)"), причому композиція має вміст продукту(ів) розщеплення діючої речовини а) щонайбільше 2 мас. %, у перерахунку на діючу речовину а), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців, і причому композиція має вміст продукту(ів) розщеплення діючої речовини б) кожного разу щонайбільше у 5 мас. %, у перерахунку на діючу речовину б), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців. 2. Композиція за п. 1, яка відрізняється тим, що композиція представлена у вигляді водної композиції у формі водного розчину або водної солюбілізації. 3. Композиція за п. 1 або 2, яка відрізняється тим, що композиція містить щонайменше одну хімічну буферну систему, причому композиція як хімічну буферну систему містить 2дигідрофосфатну/моногідрофосфатну буферну систему ("Н 2РО4 /НРО4 -буфер (система)" відповідно "фосфатний буфер (система)"). 4. Композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що композиція містить щонайменше одну хімічну буферну систему, причому композиція як хімічну буферну систему 16 UA 113749 C2 5 10 15 20 25 30 35 40 45 50 55 2 містить дигідрофосфатну/моногідрофосфатну буферну систему ("Н 2РО4 /НРО4 -буфер (система)" відповідно "фосфатний буфер (система)"), причому дигідрофосфатну/моногідрофосфатну буферну систему застосовують з молярним співвідношенням дигідрофосфат/моногідрофосфат більше 5:1. 5. Композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що композиція має осмотичність в межах від 300 до 600 мосмоль/кг і що композиція при температурі у 20 °С і під тиском у 1013,25 мбар має відносну густину, у перерахунку на чисту воду, в межах від 1,001 до 1,2. 6. Композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що композиція при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % є стабільною при зберіганні щонайменше 6 місяців, причому композиція має вміст продукту(ів) розщеплення діючої речовини а), зокрема забруднення А, щонайбільше 1 мас. %, у перерахунку на діючу речовину а); і причому композиція має вміст продукту(ів) розщеплення діючої речовини б), зокрема амінопропанолу і/або D-пантолактону, кожного разу щонайбільше у 3 мас. %. 7. Композиція за будь-яким з попередніх пунктів для застосування при профілактичному і/або лікувальному місцевому лікуванні ринітів, зокрема Rhinitis acuta. 8. Пристрій для застосування для місцевого назального застосування у формі ємності з крапельним пристроєм або розбризкувачем, який містить композицію за будь-яким з попередніх пунктів. 9. Застосування композиції за будь-яким з попередніх пунктів для одержання лікарського засобу для профілактичного і/або лікувального місцевого лікування ринітів, зокрема Rhinitis acuta. 10. Застосування режиму рН від 5,2 до 5,9 для стабілізації діючої речовини а) і діючої речовини б) у сумісному водному розчині фармацевтичної композиції з покращеною стабільністю для місцевого застосування для лікування ринітів, причому композиція представлена у вигляді водної композиції і причому композиція містить: а) щонайменше один альфа-симпатоміметик на основі імідазоліну або його фізіологічно прийнятну сіль, причому альфа-симпатоміметик на основі імідазоліну вибирають з ксилометазоліну і причому композиція компонент а), в перерахунку на композицію, в кількості від 0,02 до 1,0 мас. %; б) пантотенол (декспантенол), причому композиція компонент б), в перерахунку на композицію, в кількості від 0,5 до 8 мас. %; і в) щонайменше один консервант і/або дезінфекційний засіб, причому консервант і/або дезінфекційний засіб вибирають з хлориду бензалконію і причому композиція компонент в), в перерахунку на композицію, в кількості від 0,001 до 10 мас. %; причому значення рН композиції встановлюють і/або підтримують постійним в межах від 5,2 до 5,9, причому встановлення й/або підтримання постійним значення рН композиції здійснюють за допомогою щонайменше однієї хімічної буферної системи, причому як хімічну буферну систему 2застосовують дигідрофосфатну/моногідрофосфатну буферну систему ("Н 2РО4 /НРО4 -буфер (система)" відповідно "фосфатний буфер (система)"), причому композиція має вміст продукту(ів) розщеплення діючої речовини а) щонайбільше 2 мас. %, у перерахунку на діючу речовину а), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців, і причому композиція має вміст продукту(ів) розщеплення діючої речовини б) кожного разу щонайбільше у 5 мас. %, у перерахунку на діючу речовину б), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців. 11. Спосіб стабілізації діючої речовини а) і діючої речовини б) у сумісному водному розчині фармацевтичної композиції з покращеною стабільністю для місцевого застосування для лікування ринітів за допомогою встановлення і/або підтримання постійним значення рН в межах від 5,2 до 5,9, причому композиція представлена у вигляді водної композиції і причому композиція містить: а) щонайменше один альфа-симпатоміметик на основі імідазоліну або його фізіологічно прийнятну сіль, причому альфа-симпатоміметик на основі імідазоліну вибирають з ксилометазоліну і причому композиція містить компонент а), в перерахунку на композицію, в кількості від 0,02 до 1,0 мас. %; б) пантотенол (декспантенол), причому композиція містить компонент б), в перерахунку на композицію, в кількості від 0,5 до 8 мас. %; і 17 UA 113749 C2 5 10 15 в) щонайменше один консервант і/або дезінфекційний засіб, причому консервант і/або дезінфекційний засіб вибирають з хлориду бензалконію і причому композиція містить компонент в), в перерахунку на композицію, в кількості від 0,001 до 10 мас. %; причому значення рН композиції встановлюють і/або підтримують постійним в межах від 5,2 до 5,9, причому встановлення й/або підтримання постійним значення рН композиції здійснюють за допомогою щонайменше однієї хімічної буферної системи, причому як хімічну буферну систему 2застосовують дигідрофосфатну/моногідрофосфатну буферну систему ("Н 2РО4 /НРО4 -буфер (система)" відповідно "фосфатний буфер (система)"), причому композиція має вміст продукту(ів) розщеплення діючої речовини а) щонайбільше 2 мас. %, у перерахунку на діючу речовину а), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців, і причому композиція має вміст продукту(ів) розщеплення діючої речовини б) кожного разу щонайбільше у 5 мас. %, у перерахунку на діючу речовину б), також після зберігання композиції при температурах в межах від 20 до 50 °С, під тиском у 1013,25 мбар і при відносній вологості повітря в межах від 50 до 90 % щонайменше у 6 місяців. 18 UA 113749 C2 19 UA 113749 C2 Комп’ютерна верстка Т. Вахричева Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП "Український інститут інтелектуальної власності", вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition for nasal application with improved stability
Автори англійськоюGreve, Harald
Автори російськоюГрэвэ Харальд
МПК / Мітки
МПК: A61K 31/4174, A61K 31/164, A61K 31/525, A61K 31/415
Мітки: покращеною, назального, застосування, композиція, стабільністю
Код посилання
<a href="https://ua.patents.su/22-113749-kompoziciya-dlya-nazalnogo-zastosuvannya-z-pokrashhenoyu-stabilnistyu.html" target="_blank" rel="follow" title="База патентів України">Композиція для назального застосування з покращеною стабільністю</a>
Попередній патент: Система для розділення та подачі макаронних виробів
Наступний патент: Склад (+)-2-[1-(3-етокси-4-метоксифеніл)-2-метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діону
Випадковий патент: Крем для попередження сонячних опіків