Склад (+)-2-[1-(3-етокси-4-метоксифеніл)-2-метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діону
Формула / Реферат
1. Фармацевтична композиція, яка містить
(А) композицію серцевини, де композиція серцевини містить
(і) сполуку А
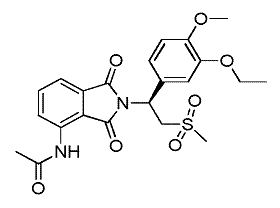 (A)
(A)
або її фармацевтично прийнятну сіль в кількості від приблизно 5 % до приблизно 15 % за масою відносно загальної композиції серцевини; лактозу; мікрокристалічну целюлозу; кроскармелозу і стеарат магнію; і
(В) склад для нанесення оболонки, який складається з полівінілового спирту, поліетиленглікою, тальку і суміші забарвлювальних речовин.
2. Фармацевтична композиція за п. 1, де лактоза присутня у кількості приблизно 50-65 % за масою щодо загальної композиції серцевини.
3. Фармацевтична композиція за п. 1, де целюлоза присутня у кількості приблизно 20-30 % за масою щодо загальної композиції серцевини.
4. Фармацевтична композиція за п. 1, де кроскармелоза присутня у кількості приблизно 1-5 % за масою щодо загальної композиції серцевини.
5. Фармацевтична композиція за п. 1, де стеарат магнію присутній у кількості приблизно 0,5-1 % за масою щодо загальної композиції серцевини.
6. Фармацевтична композиція за п. 1, де полівініловий спирт присутній у кількості приблизно 35-45 % за масою щодо загального складу для нанесення оболонки.
7. Фармацевтична композиція за п. 1, де поліетиленгліколь присутній у кількості приблизно 20-25 % за масою щодо загального складу для нанесення оболонки.
8. Фармацевтична композиція за п. 1, де тальк присутній у кількості приблизно 10-15 % за масою щодо загального складу для нанесення оболонки.
9. Фармацевтична композиція за п. 1, де забарвлювальні речовини присутні у кількості приблизно 25-30 % за масою щодо загального складу для нанесення оболонки.
10. Таблетка, яка містить:
(А) композицію серцевини, де композиція серцевини містить:
(і) сполуку А
 (A)
(A)
або її фармацевтично прийнятну сіль у кількості приблизно 10 % за масою щодо загальної композиції серцевини;
(іі) лактозу у кількості приблизно 60 % за масою щодо загальної композиції серцевини;
(ііі) мікрокристалічну целюлозу у кількості приблизно 26,25 % за масою щодо загальної композиції серцевини;
(iv) кроскармелозу у кількості приблизно 3 % за масою щодо загальної композиції серцевини; і
(v) стеарат магнію у кількості приблизно 0,75 % за масою щодо загальної композиції серцевини; і
(В) склад для нанесення оболонки, де склад для нанесення оболонки містить:
(і) полівініловий спирт у кількості приблизно 40 % за масою щодо загального складу для нанесення оболонки;
(іі) поліетиленгліколь у кількості приблизно 20 % за масою щодо загального складу для нанесення оболонки;
(ііі) тальк у кількості приблизно 15 % за масою щодо загального складу для нанесення оболонки; і
(iv) суміш забарвлювальних речовин у кількості приблизно 25 % за масою щодо загального складу для нанесення оболонки.
11. Спосіб лікування, попередження або керування перебігом захворювання або розладу, який включає введення пацієнту фармацевтичної композиції за п. 1, де захворювання або розлад являє собою псоріаз, артрит, дерматит, акне, дерматоміозит, ульцеративний коліт, хворобу Бехчета, хворобу Крона, саркоїдоз, увеїт, розацеа або червоний плоский лишай.
12. Спосіб за п. 11, де псоріаз являє собою бляшковий псоріаз.
13. Спосіб за п. 11, де артрит являє собою псоріатичний артрит, ревматоїдний артрит, остеоартрит або гострий подагричний артрит.
14. Спосіб за п. 11, де дерматит являє собою атопічний дерматит або контактний дерматит.
15. Спосіб за п. 11, де саркоїдоз являє собою хронічний шкірний саркоїдоз.
16. Спосіб лікування, попередження або керування перебігом захворювання або розладу, який включає введення пацієнту фармацевтичної композиції за п. 10, де захворювання або розлад являє собою псоріаз, артрит, дерматит, акне, дерматоміозит, ульцеративний коліт, хворобу Бехчета, хворобу Крона, саркоїдоз, увеїт, розацеа або червоний плоский лишай.
17. Спосіб за п. 16, де псоріаз являє собою бляшковий псоріаз.
18. Спосіб за п. 16, де артрит являє собою псоріатичний артрит, ревматоїдний артрит, остеоартрит або гострий подагричний артрит.
19. Спосіб за п. 16, де дерматит являє собою атопічний дерматит або контактний дерматит.
20. Спосіб за п. 16, де саркоїдоз являє собою хронічний шкірний саркоїдоз.
Текст
Реферат: Винахід стосується фармацевтичної композиції (+)-2-[1-(3-етокси-4-метоксифеніл)-2метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діону або його фармацевтично прийнятної солі, а також способу лікування, попередження або керування перебігом різних захворювань або розладів. UA 113750 C2 (12) UA 113750 C2 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 1. Галузь техніки, до якої належить винахід У цьому документі надають склади і лікарські форми (+)-2-[1-(3-етокси-4-метоксифеніл)-2метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діону. Способи застосування складів і лікарських форм також надані в цьому документі. 2. Передумови створення винаходу Лікарські речовини звичайно вводять як частину складу в комбінації із однією або декількома іншими речовинами, які несуть різні і спеціальні фармацевтичні функції. Лікарські форми різних типів можуть бути виготовлені в результаті селективного використання фармацевтичних ексципієнтів. Оскільки фармацевтичні ексципієнти мають різні функції, то і внесок свій у фармацевтичні склади роблять багатьма різноманітними шляхами, наприклад, через солюбілізацію, розведення, згущення, стабілізацію, консервацію, забарвлювання, ароматизування і так далі. Властивості, які звичайно враховуються при введенні до складу активної лікарської речовини, включають біологічну доступність, простоту виготовлення, легкість введення і стабільність лікарської форми. Через властивості активної лікарської речовини, які варіюються, яка повинна бути введена до складу, для лікарських форм звичайно потрібні фармацевтичні ексципієнти, які індивідуальним чином підбираються спеціально для активної лікарської речовини для того, щоб домогтися переважних фізичних і фармацевтичних властивостей. (+)-2-[1-(3-етокси-4-метоксифеніл)-2-метансульфонілетил]-4-ацетиламіно-ізоіндолін-1,3-діон ("сполука А") являє собою сполуку із протизапальною активністю в клінічному дослідженні відносно лікування різноманітних хронічних запальних станів. Фармакологічно, сполука А блокує деградацію циклічного аденозин-монофосфату (cAMP) через інгібування ферменту фосфодіестерази IV-типу (PDE4), що приводить до збільшення cAMP у PDE4-експресуючих клітинах, які включають моноцити, Т-клітини і нейтрофіли. Дані ферментного аналізу із використанням очищеного ферменту PDE4 із моноцитарних лейкоцитів людини U937 указують на те, що сполука А має значення IC50 (PDE4), яке дорівнює приблизно 74 нМ. Сполука А і способи її синтезу описані, наприклад, у патенті США № 6962940, розкриття якого включено в цей документ шляхом посилання в повному його обсязі. Завдяки його різноманітним фармакологічним властивостям, сполука А є корисною у лікуванні, попередженні, і/або в керуванні перебігом захворювань або розладів. Таким чином, існує потреба в лікарських формах сполуки А, які мають переважні фізичні і фармацевтичні властивості. 3. Короткий виклад суті винаходу У цьому документі забезпечують фармацевтичні лікарські форми (+)-2-[1-(3-етокси-4метоксифеніл)-2-метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діону ("сполука А"), або його фармацевтично прийнятні проліки, сіль, сольват, гідрат або клатрат. Також у цьому документі забезпечують способи лікування, керування перебігом, або попередження захворювань і станів, таких як рак, біль, макулярна дегенерація, шкірне захворювання, легеневий розлад, розлад, який викликаний вдиханням азбестового пилу, паразитарне захворювання, імунодефіцитний стан, розлад центральної нервової системи (CNS), ураження CNS, атеросклероз, розлад сну, гемоглобінопатія, анемія, запальне захворювання, аутоімунне захворювання, вірусне захворювання, генетичне захворювання, алергічне захворювання, бактеріальне захворювання, офтальмологічне неоваскулярне захворювання, хоріоїдальне неоваскулярне захворювання, неоваскулярне захворювання сітківки, і рубеоз райдужки, без обмежень, із застосуванням сполуки А, або її фармацевтично прийнятного стереоізомера, проліків, солі, сольвату, гідрату або клатрату, у лікарських формах, які описані у цьому документі. 4. Докладний опис винаходу 4.1. Визначення Як використовують у цьому документі, термін "сполука А" стосується енантіомерно чистого 2-[1-(3-етокси-4-метоксифеніл)-2-метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діону. Не будучи обмеженими теорією, вважають, що сполука А являє собою (+)-2-[1-(3-етокси-4метоксифеніл)-2-метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діон, який має наступну структуру: 1 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 Як використано в цьому документі, і якщо не зазначено інше, композиція, яка "по суті, вільна" від сполуки, означає, що композиція містить менше приблизно 20 % за масою, більш переважно менше приблизно 10 % за масою, навіть більш переважно менше приблизно 5 % за масою, і найбільше переважно менше приблизно 3 % за масою сполуки. Як використано в цьому документі, і якщо не зазначено інакше, термін "стереоізомерно чистий" означає композицію, яка містить один стереоізомер сполуки і є, по суті, вільною від інших стереоізомерів тієї сполуки. Наприклад, стереоізомерно чиста композиція сполуки, яка має один хіральний центр, буде, по суті, вільною від протилежного енантіомера сполуки. Стереоізомерно чиста композиція сполуки, яка має два хіральні центри, буде, по суті, вільною від інших діастереомерів сполуки. Звичайна стереоізомерно чиста композиція містить більше приблизно 80 % за масою одного стереоізомера сполуки і менше приблизно 20 % за масою інших стереоізомерів сполуки, більш переважно більше приблизно 90 % за масою одного стереоізомера сполуки і менше приблизно 10 % за масою інших стереоізомерів сполуки, навіть більш переважно більше приблизно 95 % за масою одного стереоізомера сполуки і менше приблизно 5 % за масою інших стереоізомерів сполуки, і найбільше переважно більше приблизно 97 % за масою одного стереоізомера сполуки і менше приблизно 3 % за масою інших стереоізомерів сполуки. Як використано в цьому документі, і якщо не зазначено інше, термін "енантіомерно чистий" означає стереоізомерно чисту композицію сполуки, яка має один хіральний центр. Як використано в цьому документі, і якщо не зазначено інше, термін "фармацевтично прийнятна(і) сіль (солі)" включає солі кислотних і основних фрагментів сполуки, яка забезпечується в цьому документі, але не обмежується цим. Основні фрагменти можуть утворювати широкий ряд солей із різними неорганічними і органічними кислотами. Кислоти, які можуть бути використані для отримання фармацевтично прийнятних солей приєднання кислоти для таких основних сполук, являють собою кислоти, які утворюють нетоксичні солі приєднання кислоти, тобто, солі, які містять фармакологічно прийнятні аніони. Придатні органічні кислоти включають малеїнову, фумарову, бензойну, аскорбінову, бурштинову, оцтову, мурашину, щавлеву, пропіонову, винну, саліцилову, лимонну, глюконову, молочну, мигдальну, коричну, олеїнову, дубильну, аспарагінову, стеаринову, пальмітинову, гліколеву, глутамінову, глюконову, глюкаронову, цукрову, ізонікотинову, метансульфонову, етансульфонову, паратолуолсульфонову, бензолсульфонові кислоти, або памову (тобто, 1,1'-метилен-біс-(2-гідрокси3-нафтоат)) кислоти, але не обмежуються цим. Придатні неорганічні кислоти включають соляну, бромистоводневу, йодистоводневу, сірчану, фосфорну або азотну кислоти, але не обмежуються цим. Сполуки, які включають амінофрагмент, можуть утворювати фармацевтично прийнятні солі із різними амінокислотами, на додаток до кислот, згаданих вище. Хімічні фрагменти, які є кислотними за природою, можуть утворювати основні солі із різними фармакологічно прийнятними катіонами. Приклади таких солей являють собою солі лужних металів або лужноземельних металів і, зокрема, солі кальцію, магнію, натрію, літію, цинку, калію або заліза. Як використано в цьому документі, і якщо не задане інше, термін "сольват" означає сполуку, яка забезпечується в цьому документі, або її сіль, яка додатково включає стехіометричну або нестехіометричну кількість розчинника, зв'язаного нековалентними внутрішньомолекулярними силами. У тому випадку, коли розчинник являє собою воду, сольват являє собою гідрат. Як використано в цьому документі, і якщо не зазначено інше, термін "проліки" означає похідне сполуки, яка може гідролізуватися, окислитися, або іншим способом прореагувати у біологічних умовах (in vitro або in vivo) із забезпеченням сполуки. Приклади проліків включають похідні талідоміду, які включають біогідролізовані фрагменти, такі як біогідролізовані аміди, біогідролізовані складні ефіри, біогідролізовані карбамати, біогідролізовані карбонати, біогідролізовані уреїди і біогідролізовані фосфатні аналоги, але не обмежуються цим. Інші приклади проліків включають похідні талідоміду, які включають фрагменти -NO, -NO2, -ONO або -ONO2. 2 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як використано в цьому документі, і якщо не зазначено інше, терміни "біогідролізований карбамат", "біогідролізований карбонат", "біогідролізований уреїд", "біогідролізований фосфат" означають, відповідно, карбамат, карбонат, уреїд або фосфат сполуки, який або: 1) не впливає на біологічну активність сполуки, але може надавати цій сполуці переважні властивості in vivo, такі як накопичення, тривалість дії або початок прояву дії; або 2) є біологічно неактивним, але перетворюється in vivo у біологічно активну сполуку. Приклади біогідролізованих карбаматів включають нижчі алкіламіни, заміщені етилендіаміни, амінокислоти, гідроксіалкіламіни, гетероциклічні і гетероароматичні аміни, і аміни простих поліефірів, але не обмежуються цим. Як використано в цьому документі, і якщо не зазначено інше, термін "біогідролізований складний ефір" означає складний ефір сполуки, який або: 1) не впливає на біологічну активність сполуки, але може надати тій сполуці переважні властивості in vivo, такі як накопичення, тривалість дії або початок прояву дії; або 2) є біологічно неактивним, але перетворюється in vivo у біологічно активну сполуку. Приклади біогідролізованих складних ефірів включають складні нижчі алкілефіри, складні алкоксіацилоксіефіри, алкілациламіноалкілові складні ефіри і холінові складні ефіри, але не обмежуються цим. Як використано в цьому документі, і якщо не зазначено інше, термін "біогідролізований амід" означає амід сполуки, який або: 1) не впливає на біологічну активність сполуки, але може надати тій сполуці переважні властивості in vivo, такі як накопичення, тривалість дії або початок прояву дії; або 2) є біологічно неактивним, але перетворюється in vivo у біологічно активну сполуку. Приклади біогідролізованих амідів включають нижчі алкіламіди, аміди -амінокислот, алкоксіациламіди і алкіламіноалкілкарбоніламіди, але не обмежуються цим. Як використано в цьому документі, і якщо не задане інше, терміни "лікувати", "процедура лікування" і "лікування" припускають дію, яка відбувається тоді, коли пацієнт страждає на конкретне захворювання або розладом, що знижує тяжкість захворювання або розладу, або відтерміновує або сповільнює розвиток даного захворювання або розладу. Як використано в цьому документі, і якщо не задане інше, терміни "попереджувати", "попередження" і "профілактика" стосується попередження початку прояву, рецидиву або поширення захворювання або розладу, або його одного або більше симптомів. Терміни "попереджувати", "попередження" і "профілактика" передбачають дію, яка відбувається до того, як пацієнт починає страждати на конкретне захворювання або розлад, що дозволяє інгібувати або знизити тяжкість захворювання або розладу. Як використано в цьому документі, і якщо не зазначено інше, терміни "керувати перебігом", "керування перебігом" і "ведення" охоплюють попередження рецидиву конкретного захворювання або розладу у пацієнта, який вже страждав захворюванням або розладом, і/або продовження періоду часу, протягом якого пацієнт, який страждав на захворювання або розлад, перебуває у стані ремісії. Терміни охоплюють модулювання межі, розвитку і/або тривалості захворювання або розладу, або зміна відповідної реакції пацієнта на захворювання або розлад. Як використано в цьому документі, і якщо не зазначено інше, термін "приблизно", при використанні у зв'язку із дозами, кількостями або масовим відсотком інгредієнтів композиції або лікарської форми, означає, що охоплена доза, кількість або масовий відсоток, яка визначена середніми фахівцями в даній галузі для забезпечення фармакологічного ефекту, еквівалентного фармакологічному ефекту, який отримують у результаті застосування заданої дози, кількості або масового відсотка. Зокрема, термін "приблизно" дозволяє припускати, що охоплена доза, кількість або масовий відсоток у межах 30 %, 25 %, 20 %, 15 %, 10 %, 5 %, 1 %, 0,5 %, або 0,25 % щодо заданої дози, кількості або масового відсотка. Як використано в цьому документі, і якщо не зазначено інше, термін "стабільний", при використанні відносно складу або лікарської форми, означає, що активний інгредієнт складу або лікарської форми залишається солюбілізованим протягом заданої кількості часу і значною мірою не розкладається і не агрегується, і не стає модифікованим іншим чином (наприклад, таким чином, що може бути визначено, наприклад, фізичними методами, такими як візуальне вивчення, або аналітичними методами, такими як HPLC (ВЕРХ - високоефективна рідинна хроматографія)). 4.2. Склади і лікарські форми У цьому документі надають фармацевтичні склади і лікарські форми (+)-2-[1-(3-етокси-4метоксифеніл)-2-метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діону (сполука А), або його фармацевтично прийнятного(их) проліків, солі, сольвату, гідрату або клатрату. У деяких варіантах здійснення, лікарські форми придатні для перорального введення пацієнту. В інших варіантах здійснення, склади і лікарські форми, надані в цьому документі, показують переважні фізичні і/або фармакологічні властивості. Такі властивості включають швидку розпадуваність, низьку стираність, простоту кількісного визначення, однорідність складу, властивості плинності 3 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 для виготовлення, розчинення і біологічна доступність, і/або стабільність, але не обмежуються цим. Також у цьому документі надаються набори, які містять фармацевтичні склади і лікарські форми, які забезпечуються в цьому документі. Також у цьому документі надаються способи лікування, керування перебігом, і/або попередження захворювання або стану, які включають введення пацієнту, який цього потребує, фармацевтичного складу або лікарської форми, яка забезпечується у цьому документі. У деяких варіантах здійснення, склади і лікарські форми, надані в цьому документі, придатні для перорального введення, зокрема, у формі таблетки. У деяких варіантах здійснення, склади і лікарські форми включають серцевину, яка містить активний інгредієнт, і нефункціональне плівкове покриття. В одному варіанті здійснення, у цьому документі надається склад серцевини, який містить сполуку А. В одному із варіантів здійснення, склад серцевини містить сполуку А у кількості приблизно 0,5 % - приблизно 30 %, приблизно 1 % - приблизно 25 %, приблизно 5 % приблизно 25 %, приблизно 5 % - приблизно 20 %, приблизно 10 % - приблизно 15 %, або приблизно 5 % - 15 % за масою щодо загальної композиції серцевини. В одному із варіантів здійснення, склад серцевини містить сполуку А у кількості приблизно 1 %, 5 %, 10 %, 15 %, 20 %, або 25 % за масою щодо загальної композиції серцевини. В особливому варіанті здійснення, склад серцевини містить сполуку А у кількості приблизно 10 % за масою щодо загальної композиції серцевини. В одному із варіантів здійснення, склад серцевини, який містить сполуку А, додатково містить один/одне або більше наповнювачів, дезінтегрантів і/або лубрикантів. В одному із варіантів здійснення, наповнювач являє собою лактозу. В особливому варіанті здійснення, наповнювач являє собою моногідрат лактози (наприклад, Fast-Flo®). В одному із варіантів здійснення, склад серцевини містить лактозу у кількості приблизно 20 % - приблизно 85 %, приблизно 30 % - приблизно 75 %, приблизно 40 % - приблизно 70 %, або приблизно 50 % - приблизно 65 % за масою щодо загальної композиції серцевини. В одному із варіантів здійснення, склад серцевини містить лактозу у кількості приблизно 20 %, приблизно 30 %, 40 %, 50 %, 60 %, 70 %, 80 % або 85 % за масою щодо загальної композиції серцевини. У конкретному варіанті здійснення, склад серцевини містить лактозу у кількості приблизно 60 % за масою щодо загальної композиції серцевини. В одному із варіантів здійснення, наповнювач являє собою целюлозу. В особливому варіанті здійснення, наповнювач являє собою мікрокристалічну целюлозу (наприклад, Avicel®). В одному із варіантів здійснення, склад серцевини містить целюлозу у кількості приблизно 5 % приблизно 60 %, приблизно 10 % - приблизно 50 %, приблизно 15 % - приблизно 40 %, приблизно 20 % - приблизно 30 %, або приблизно 25 % - приблизно 30 % за масою щодо загальної композиції серцевини. В одному із варіантів здійснення, склад серцевини містить целюлозу у кількості приблизно 5 %, приблизно 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, і 50 % за масою щодо загальної композиції серцевини. У конкретному варіанті здійснення, склад серцевини містить целюлозу у кількості приблизно 26,25 % за масою щодо загальної композиції серцевини. В одному із варіантів здійснення, склади або лікарські форми, надані в цьому документі, можуть містити два або більше наповнювачів. В одному із варіантів здійснення, дезінтегрант являє собою кроскармелозу. У конкретному варіанті здійснення, дезінтегрант являє собою кроскармелозу натрію (наприклад, Ac-di-sol®). В одному із варіантів здійснення, склад серцевини містить кроскармелозу у кількості приблизно 0,1 % - приблизно 10 %, приблизно 0,5 % - приблизно 8 %, приблизно 1 % - приблизно 5 %, або приблизно 2 % - приблизно 8 % за масою щодо загальної композиції серцевини. В одному із варіантів здійснення, склад серцевини містить кроскармелозу у кількості приблизно 0,1 %, 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 % або 8 % за масою щодо загальної композиції серцевини. В особливому варіанті здійснення, склад серцевини містить кроскармелозу у кількості приблизно 3 % за масою щодо загальної композиції серцевини. В одному із варіантів здійснення, лубрикант являє собою стеарат магнію. В одному із варіантів здійснення, склад серцевини містить стеарат магнію у кількості приблизно 0,1 % приблизно 5 %, приблизно 0,25 % - приблизно 5 %, приблизно 0,3 % - приблизно 2 %, приблизно 0,5 % - приблизно 1 %, або приблизно 0,5 % - приблизно 2 % за масою щодо загальної композиції серцевини. В одному із варіантів здійснення, склад серцевини містить стеарат магнію у кількості приблизно 0,1 %, 0,2 %, 0,3 %, 0,4 %, 0,5 %, 0,6 %, 0,7 %, 0,8 %, 0,9 %, 1 %, 2 %, 3 %, 4 % або 5 % за масою щодо загальної композиції серцевини. В особливому варіанті здійснення, склад серцевини містить стеарат магнію у кількості приблизно % за масою щодо загальної композиції серцевини. 4 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному із варіантів здійснення, у цьому документі надається склад серцевини, який містить: сполуку А у кількості приблизно 10 % за масою щодо загальної композиції серцевини; лактозу у кількості приблизно 60 % за масою щодо загальної композиції серцевини; мікрокристалічну целюлозу у кількості приблизно 26,25 % за масою щодо загальної композиції серцевини; кроскармелозу у кількості приблизно 3 % за масою щодо загальної композиції серцевини; і стеарат магнію у кількості приблизно 0,75 % за масою щодо загальної композиції серцевини. У таблетованих складах часто спостерігають зміну кольору (наприклад, знебарвлення), що не зв'язують із якою-небудь конкретною теорією. Це явище, відоме як ефект вицвітання, виникає в тому випадку, коли речовина із більш низькою молекулярною масою, яка використовується у складі, дифундує до поверхні в умовах більш високої температури і вологості. Наприклад, ексципієнти, такі як середньоланцюгові тригліцериди, які звичайно використовуються як пластифікатори в плівкових покриттях, можуть мігрувати або дифундувати до поверхні таблетки, викликаючи тим самим зміну кольору. Однак, таке явище не завжди спостерігається, коли в складах використовуються речовини із більш низькою молекулярною масою, тобто, присутність речовин із більш низькою молекулярною масою може викликати або може не викликати ефект вицвітання. Виявлено, що взаємодія конкретної речовини більш низької молекулярної маси із іншими інгредієнтами складу, а також фактична кількість речовини більш низької молекулярної маси і інших інгредієнтів є вирішальними у визначенні, чи буде виявляти конкретний склад нестабільність із точки зору зміни кольору або зовнішнього вигляду. Згідно із вищевикладеним, у деяких варіантах здійснення, склади або лікарські форми, які надаються в цьому документі, не містять ексципієнт більш низької молекулярної маси, який може дифундувати до поверхні композиції. В інших варіантах здійснення, пероральні склади або лікарські форми, які надаються в цьому документі, містять ексципієнт більш низької молекулярної маси, але у кількості, яка не ініціює ефект вицвітання. В інших варіантах здійснення, пероральні склади або лікарські форми, які надаються у цьому документі, містять ексципієнт більш низької молекулярної маси в умовах наявності інших ексципієнтів у деякому співвідношенні, при якому ефект вицвітання не спостерігається для складів або лікарських форм, які виходять у результаті. У зв'язку із цим, склади і лікарські форми, які надаються у цьому документі, показують поліпшену стабільність, особливо стосовно зміни кольору або зовнішнього вигляду. В одному із варіантів здійснення, у цьому документі надаються склади для нанесення оболонки на таблетку. В одному із варіантів здійснення, такі склади не містять середньоланцюгові тригліцериди. У такому варіанті здійснення, склади можуть містити інші різні ексципієнти, такі як агенти для нанесення оболонки, які зв'язують речовини, лубриканти, стабілізуючі речовини, пластифікатори, адгезиви (клейкі речовини), гліданти, і/або розріджувачі, але не обмежуються цим. У деяких варіантах здійснення, склади для нанесення оболонки, надані в цьому документі, необов'язково містять забарвлювальні речовини. Ці ексципієнти добре відомі в даній галузі. В одному із варіантів здійснення, у цьому документі надаються склади для нанесення оболонки, які не містять середньоланцюгові тригліцериди. В одному із варіантів здійснення, де склади для нанесення оболонки не містять середньоланцюгові тригліцериди, ексципієнт являє собою полідекстрозу. В особливому варіанті здійснення, полідекстроза являє собою полідекстрозу FCC. В одному із варіантів здійснення, полідекстроза присутня у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % приблизно 50 %, приблизно 20 % - приблизно 40 %, або приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, полідекстроза присутня у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 % або 30 % за масою щодо загального складу для нанесення оболонки. У конкретному варіанті здійснення, полідекстроза присутня у кількості приблизно 26 % за масою щодо загального складу для нанесення оболонки. В одному аспекті цього варіанта здійснення, ексципієнт являє собою гіпромелозу. У конкретному варіанті здійснення, ексципієнт являє собою гіпромелозу 15сР. В одному із варіантів здійснення, гіпромелоза присутня у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 25 % - приблизно 40 %, або приблизно 30 % приблизно 35 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, гіпромелоза присутня у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 %, 30 % або 35 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, гіпромелоза присутня у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки. 5 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 У ще одному аспекті цього варіанта здійснення, ексципієнт являє собою тальк. В одному із варіантів здійснення, тальк присутній у кількості приблизно 0,1 % - приблизно 25 %, приблизно 1 % - приблизно 20 %, приблизно 3 % - приблизно 15 %, або приблизно 5 % - приблизно 10 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, тальк присутній у кількості приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, тальк присутній у кількості приблизно 7 % за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, ексципієнт являє собою мальтодекстрин. В одному із варіантів здійснення, мальтодекстрин присутній у кількості приблизно 0,1 % приблизно 25 %, приблизно 1 % - приблизно 20 %, приблизно 3 % - приблизно 15 %, або приблизно 5 % - приблизно 10 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, мальтодекстрин присутній у кількості приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, мальтодекстрин присутній у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, ексципієнти являють собою одну або більше забарвлювальних речовин, які можуть бути корисні у розпізнаванні лікарських форм, які містять різні кількості активного інгредієнта. Приклади забарвлювальних речовин включають оксиди заліза (наприклад, червоні, жовті і чорні) і діоксид титану, але не обмежуються цим. Прийнятні забарвлювальні речовини можуть бути змішані для того, щоб отримати бажаний колір складу для нанесення оболонки. У деяких варіантах здійснення, у складах для нанесення оболонки можуть бути використані дві або більше забарвлювальні речовини. В одному із варіантів здійснення забарвлювальні речовини містять діоксид титану і червоний оксид заліза. В іншому варіанті здійснення забарвлювальні речовини містять діоксид титану, червоний оксид заліза і жовтий оксид заліза. У ще одному варіанті здійснення забарвлювальні речовини містять діоксид титану, червоний оксид заліза, жовтий оксид заліза і чорний оксид заліза. В іншому аспекті цього варіанта здійснення забарвлювальні речовини присутні у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 20 % приблизно 40 %, або приблизно 25 % - приблизно 35 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 %, 30 % або 35 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, у цьому документі надається склад для нанесення оболонки, який містить: полідекстрозу у кількості приблизно 26 % за масою щодо загального складу для нанесення оболонки; гіпромелозу у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки; тальк у кількості приблизно 7 % за масою щодо загального складу для нанесення оболонки; мальтодекстрин у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки; і суміш забарвлювальних речовин у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, де склади для нанесення оболонки не містять середньоланцюгові тригліцериди, ексципієнт являє собою полідекстрозу. У конкретному варіанті здійснення, полідекстроза являє собою полідекстрозу FCC. В одному із варіантів здійснення, полідекстроза присутня у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % приблизно 50 %, приблизно 20 % - приблизно 40 %, або приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, полідекстроза присутня у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 %, або 30 % за масою щодо загального складу для нанесення оболонки. У конкретному варіанті здійснення, полідекстроза присутня у кількості приблизно 26 % за масою щодо загального складу для нанесення оболонки. В одному аспекті цього варіанта здійснення, ексципієнт являє собою гіпромелозу. У конкретному варіанті здійснення, ексципієнт являє собою гіпромелозу 15сР. В одному із варіантів здійснення, гіпромелоза присутня у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 25 % - приблизно 40 %, або приблизно 30 % приблизно 35 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, гіпромелоза присутня у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 %, 30 % або 35 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, гіпромелоза присутня у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки. 6 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 У ще одному аспекті цього варіанта здійснення, ексципієнт являє собою тальк. В одному із варіантів здійснення, тальк присутній у кількості приблизно 0,1 % - приблизно 25 %, приблизно 1 % - приблизно 20 %, приблизно 3 % - приблизно 15 %, або приблизно 5 % - приблизно 10 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, тальк присутній у кількості приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, тальк присутній у кількості приблизно 7 % за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, ексципієнт являє собою мальтодекстрин. В одному із варіантів здійснення, мальтодекстрин присутній у кількості приблизно 0,1 % приблизно 25 %, приблизно 1 % - приблизно 20 %, приблизно 3 % - приблизно 15 %, або приблизно 5 % - приблизно 10 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, мальтодекстрин присутній у кількості приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, мальтодекстрин присутній у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, ексципієнт являє собою триацетин. В одному із варіантів здійснення, триацетин присутній у кількості приблизно 0,1 % - приблизно 20 %, приблизно 0,5 % - приблизно 25 %, приблизно 1 % - приблизно 10 %, або приблизно 1 % приблизно 5 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, триацетин є присутнім у кількості приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, триацетин присутній у кількості приблизно 4 % за масою щодо загального складу для нанесення оболонки. У ще одному аспекті цього варіанта здійснення забарвлювальні речовини присутні у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 20 % приблизно 40 %, або приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 % або 30 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 27 % за масою щодо загального складу для нанесення оболонки. У конкретному варіанті здійснення, у цьому документі надається склад для нанесення оболонки, який містить: полідекстрозу у кількості приблизно 26 % за масою щодо загального складу для нанесення оболонки; гіпромелозу у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки; тальк у кількості приблизно 7 % за масою щодо загального складу для нанесення оболонки; мальтодекстрин у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки; триацетин у кількості приблизно 4 % за масою щодо загального складу для нанесення оболонки; і суміш забарвлювальних речовин у кількості приблизно 27 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, де склади для нанесення оболонки не містять середньоланцюгові тригліцериди, ексципієнт являє собою полівініловий спирт. В одному із варіантів здійснення, полівініловий спирт присутній у кількості приблизно 20 % - приблизно 75 %, приблизно 25 % - приблизно 65 %, приблизно 30 % - приблизно 55 %, або приблизно 35 % приблизно 45 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, полівініловий спирт присутній у кількості приблизно 10 %, 20 %, 30 %, 40 %, 50 % або 60 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, полівініловий спирт присутній у кількості приблизно 40 % за масою щодо загального складу для нанесення оболонки. В одному аспекті цього варіанта здійснення, ексципієнт являє собою поліетиленгліколь. В одному особливому варіанті здійснення, ексципієнт являє собою поліетиленгліколь 3350. В одному із варіантів здійснення, поліетиленгліколь присутній у кількості приблизно 5 % приблизно 50 %, приблизно 10 % - приблизно 40 %, приблизно 15 % - приблизно 30 %, або приблизно 20 % - приблизно 25 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, поліетиленгліколь присутній у кількості приблизно 10 %, 20 %, 30 %, 40 % або 50 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, поліетиленгліколь присутній у кількості приблизно 20 % (наприклад, 20,2 %) за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, ексципієнт являє собою тальк. В одному із варіантів здійснення, тальк присутній у кількості приблизно 1 % - приблизно 30 %, приблизно 3 % - приблизно 25 %, приблизно 5 % - приблизно 20 %, або приблизно 10 % - приблизно 15 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, тальк 7 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 присутній у кількості приблизно 1 %, 5 %, 10 %, 15 %, 20 %, 25 % або 30 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, тальк присутній у кількості приблизно 15 % (наприклад, 14,8 %) за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, ексципієнти являють собою одну або більше забарвлювальних речовин. В одному із варіантів здійснення забарвлювальні речовини присутні у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 20 % - приблизно 40 %, або приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 % або 30 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 25 % за масою щодо загального складу для нанесення оболонки. У конкретному варіанті здійснення в цьому документі надається склад для нанесення оболонки, який містить: полівініловий спирт у кількості приблизно 40 % за масою щодо загального складу для нанесення оболонки; поліетиленгліколь у кількості приблизно 20 % за масою щодо загального складу для нанесення оболонки; тальк у кількості приблизно 15 % за масою щодо загального складу для нанесення оболонки; і суміш забарвлювальних речовин у кількості приблизно 25 % за масою щодо загального складу для нанесення оболонки. У ще одному варіанті здійснення, де склади для нанесення оболонки не містять середньоланцюгові тригліцериди, ексципієнт являє собою лактозу. В одному із варіантів здійснення, лактоза присутня у кількості приблизно 10 % - приблизно 60 %, приблизно 20 % приблизно 50 %, приблизно 25 % - приблизно 40 %, або приблизно 30 % - приблизно 35 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, лактоза присутня у кількості приблизно 5 %, 15 %, 25 %, 35 %, 45 %, 55 % або 65 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, полівініловий спирт присутній у кількості приблизно 33 % за масою щодо загального складу для нанесення оболонки. В одному аспекті цього варіанта здійснення, ексципієнт являє собою гіпромелозу. У конкретному варіанті здійснення, ексципієнт являє собою гіпромелозу 6сР. В одному із варіантів здійснення, гіпромелоза присутня у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 25 % - приблизно 40 %, або приблизно 30 % - приблизно 35 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, гіпромелоза присутня у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 %, 30 % або 35 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, гіпромелоза присутня у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, ексципієнт являє собою поліетиленгліколь. В одному конкретному варіанті здійснення, ексципієнт являє собою поліетиленгліколь 3350. В одному із варіантів здійснення, поліетиленгліколь є присутнім у кількості приблизно 0,1 % приблизно 20 %, приблизно 0,3 % - приблизно 10 %, приблизно 0,5 % - приблизно 15 %, або приблизно 1 % - приблизно 5 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, поліетиленгліколь присутній у кількості приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, поліетиленгліколь присутній у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, ексципієнт являє собою триацетин. В одному із варіантів здійснення, триацетин присутній у кількості приблизно 0,1 % - приблизно 20 %, приблизно 0,5 % - приблизно 25 %, приблизно 1 % - приблизно 10 %, або приблизно 1 % приблизно 5 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, триацетин присутній у кількості приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, триацетин присутній у кількості приблизно 4 % за масою щодо загального складу для нанесення оболонки. У ще одному аспекті цього варіанта здійснення, ексципієнти являють собою одну або більше забарвлювальних речовин. В одному із варіантів здійснення, забарвлювальні речовини присутні у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 20 % - приблизно 40 %, або приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 % або 30 % за масою щодо загального складу для 8 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 нанесення оболонки. В особливому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 27 % за масою щодо загального складу для нанесення оболонки. У конкретному варіанті здійснення, у цьому документі надається склад для нанесення оболонки, який містить: лактозу у кількості приблизно 33 % за масою щодо загального складу для нанесення оболонки; гіпромелозу у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки; поліетиленгліколь у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки; триацетин у кількості приблизно 4 % за масою щодо загального складу для нанесення оболонки; і суміш забарвлювальних речовин, у кількості приблизно 27 % щодо загальної маси складу для нанесення оболонки. В інших варіантах здійснення, у цьому документі надаються склади для нанесення оболонки, які містять середньоланцюгові тригліцериди і інші ексципієнти, що навіть не викликають ефект вицвітання, наприклад, зміни кольору або зовнішнього вигляду при збереженні. В одному із варіантів здійснення, де склади для нанесення оболонки містять середньоланцюгові тригліцериди, середньоланцюгові тригліцериди присутні у кількості приблизно 0,1 % - приблизно 15 %, приблизно 0,5 % - приблизно 10 %, приблизно 1 % приблизно 5 %, або приблизно 1 % - приблизно 3 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, середньоланцюгові тригліцериди присутні у кількості приблизно 0,1 %, 0,5 %, 1 %, 1,5 %, 2 %, 2,5 %, 3 %, 3,5 %, 4 %, 4,5 % або 5 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, середньоланцюгові тригліцериди присутні у кількості приблизно 2 % за масою щодо загального складу для нанесення оболонки. В одному аспекті цього варіанта здійснення, інший ексципієнт являє собою полідекстрозу. В одному із варіантів здійснення, полідекстроза присутня у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 20 % - приблизно 40 %, або приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, полідекстроза присутня у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 %, або 30 % за масою щодо загального складу для нанесення оболонки. У конкретному варіанті здійснення, полідекстроза присутня у кількості приблизно 26 % за масою щодо загального складу для нанесення оболонки. У ще одному аспекті цього варіанта здійснення, інший ексципієнт являє собою гіпромелозу. В одному конкретному варіанті здійснення, гіпромелоза являє собою гіпромелозу 15сР. В одному із варіантів здійснення, гіпромелоза присутня у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 25 % - приблизно 40 %, або приблизно 30 % приблизно 35 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, гіпромелоза присутня у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 %, 30 % або 35 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, гіпромелоза присутня у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки. У ще одному аспекті цього варіанта здійснення, інший ексципієнт являє собою тальк. В одному із варіантів здійснення, тальк присутній у кількості приблизно 1 % - приблизно 20 %, приблизно 3 % - приблизно 15 %, приблизно 5 % - приблизно 10 %, або приблизно 5 % приблизно 10 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, тальк присутній у кількості приблизно 1 %, 5 %, 10 %, 15 % або 20 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, тальк присутній у кількості приблизно 7 % за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, інший ексципієнт являє собою мальтодекстрин. В одному із варіантів здійснення, мальтодекстрин присутній у кількості приблизно 0,1 % приблизно 20 %, приблизно 0,5 % - приблизно 25 %, приблизно 1 % - приблизно 10 %, або приблизно 1 % - приблизно 5 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, мальтодекстрин присутній у кількості приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, мальтодекстрин присутній у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки. У ще одному аспекті цього варіанта здійснення, ексципієнти являють собою одну або більше забарвлювальних речовин. В одному із варіантів здійснення забарвлювальні речовини присутні у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 20 % - приблизно 40 %, або приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 % або 30 % за масою щодо загального складу для 9 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 нанесення оболонки. В особливому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 29 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, у цьому документі надається склад для нанесення оболонки, який містить: полідекстрозу у кількості приблизно 26 % за масою щодо загального складу для нанесення оболонки; гіпромелозу у кількості приблизно 31 % за масою щодо загального складу для нанесення оболонки; тальк у кількості приблизно 7 % за масою щодо загального складу для нанесення оболонки; мальтодекстрин у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки; середньоланцюгові тригліцериди у кількості приблизно 2 % за масою щодо загального складу для нанесення оболонки; і суміш забарвлювальних речовин у кількості приблизно 29 % щодо загальної маси складу для нанесення оболонки. В іншому варіанті здійснення, де склади для нанесення оболонки містять середньоланцюгові тригліцериди, середньоланцюгові тригліцериди присутні у кількості приблизно 0,1 % - приблизно 15 %, приблизно 0,5 % - приблизно 10 %, приблизно 1 % приблизно 5 %, або приблизно 1 % - приблизно 3 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, середньоланцюгові тригліцериди присутні у кількості приблизно 0,1 %, 0,5 %, 1 %, 1,5 %, 2 %, 2,5 %, 3 %, 3,5 %, 4 %, 4,5 % або 5 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, середньоланцюгові тригліцериди присутні у кількості приблизно 4 % за масою щодо загального складу для нанесення оболонки. В одному аспекті цього варіанта здійснення, інший ексципієнт являє собою полідекстрозу. В одному із варіантів здійснення, полідекстроза присутня у кількості приблизно 1 % - приблизно 40 %, приблизно 5 % - приблизно 30 %, приблизно 10 % - приблизно 20 %, або приблизно 10 % - приблизно 15 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, полідекстроза присутня у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 %, або 30 % за масою щодо загального складу для нанесення оболонки. У конкретному варіанті здійснення, полідекстроза присутня у кількості приблизно 13 % за масою щодо загального складу для нанесення оболонки. У ще одному аспекті цього варіанта здійснення, інший ексципієнт являє собою гіпромелозу. В одному конкретному варіанті здійснення, гіпромелоза являє собою гіпромелозу 15сР. В одному із варіантів здійснення, гіпромелоза присутня у кількості приблизно 10 % - приблизно 65 %, приблизно 20 % - приблизно 60 %, приблизно 25 % - приблизно 50 %, або приблизно 35 % приблизно 45 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, гіпромелоза присутня у кількості приблизно 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 % або 60 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, гіпромелоза присутня у кількості приблизно 44 % за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, інший ексципієнт являє собою тальк. В одному із варіантів здійснення, тальк присутній у кількості приблизно 1 % - приблизно 20 %, приблизно 3 % - приблизно 15 %, приблизно 5 % - приблизно 10 %, або приблизно 5 % - приблизно 10 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, тальк присутній у кількості приблизно 1 %, 5 %, 10 %, 15 % або 20 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, тальк присутній у кількості приблизно 7 % за масою щодо загального складу для нанесення оболонки. В іншому аспекті цього варіанта здійснення, інший ексципієнт являє собою мальтодекстрин. В одному із варіантів здійснення, мальтодекстрин присутній у кількості приблизно 0,1 % приблизно 20 %, приблизно 0,5 % - приблизно 25 %, приблизно 1 % - приблизно 10 %, або приблизно 1 % - приблизно 5 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, мальтодекстрин присутній у кількості приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % або 10 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення, мальтодекстрин присутній у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки. У ще одному аспекті цього варіанта здійснення, ексципієнти являють собою одну або більше забарвлювальних речовин. В одному із варіантів здійснення забарвлювальні речовини присутні у кількості приблизно 10 % - приблизно 60 %, приблизно 15 % - приблизно 50 %, приблизно 20 % - приблизно 40 %, або приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 5 %, 10 %, 15 %, 20 %, 25 % або 30 % за масою щодо загального складу для нанесення оболонки. В особливому варіанті здійснення забарвлювальні речовини присутні у кількості приблизно 27 % за масою щодо загального складу для нанесення оболонки. 10 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 В особливому варіанті здійснення, у цьому документі надається склад для нанесення оболонки, який містить: полідекстрозу у кількості приблизно 13 % за масою щодо загального складу для нанесення оболонки; гіпромелозу у кількості приблизно 44 % за масою щодо загального складу для нанесення оболонки; тальк у кількості приблизно 7 % за масою щодо загального складу для нанесення оболонки; мальтодекстрин у кількості приблизно 5 % за масою щодо загального складу для нанесення оболонки; середньоланцюгові тригліцериди у кількості приблизно 4 % за масою щодо загального складу для нанесення оболонки; і суміш увальних речовин, у кількості приблизно 27 % щодо загальної маси складу для нанесення оболонки. Може бути використана будь-яка комбінація складів серцевини і складів для нанесення оболонки, наданих у цьому документі. В одному із варіантів здійснення, у цьому документі надається склад, який містить сполуку А або її фармацевтично прийнятну сіль; наповнювач; дезінтегрант; і лубрикант, де сполука А присутня у кількості приблизно 5 % - приблизно 25 % за масою щодо всієї композиції. В одному аспекті цього варіанта здійснення, наповнювач являє собою лактозу і присутній у кількості приблизно 20-85 % за масою щодо всієї композиції. В іншому аспекті цього варіанта здійснення, композиція додатково містить целюлозу як наповнювач і присутня у кількості приблизно 10 % приблизно 50 % за масою щодо всієї композиції. В іншому аспекті цього варіанта здійснення, дезінтегрант являє собою кроскармелозу і присутній у кількості приблизно 2 % - приблизно 8 % за масою щодо всієї композиції. В іншому аспекті цього варіанта здійснення, лубрикант являє собою стеарат магнію і присутній у кількості приблизно 0,25 % - приблизно 5 % щодо всієї композиції. В одному із варіантів здійснення, фармацевтичну композицію покривають складом для нанесення оболонки, де склад для нанесення оболонки містить один або більше ексципієнтів, де ексципієнт являє собою полівініловий спирт і присутній у кількості приблизно 35 % приблизно 45 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, ексципієнт являє собою поліетиленгліколь і присутній у кількості приблизно 20 % приблизно 25 % за масою щодо загального складу для нанесення оболонки. У ще одному варіанті здійснення, ексципієнт являє собою тальк і присутній у кількості приблизно 10 % приблизно 15 % за масою щодо загального складу для нанесення оболонки. В іншому варіанті здійснення, ексципієнти являють собою одну або більше забарвлювальних речовин, які присутні у кількості приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. У конкретному варіанті здійснення, у цьому документі надається склад, який містить (1) сполуку А або її фармацевтично прийнятну сіль; у кількості приблизно 5 % - приблизно 25 % за масою щодо всієї композиції; (2) лактозу у кількості приблизно 20-85 % за масою щодо всієї композиції; (3) целюлозу у кількості приблизно 10 % - приблизно 50 % за масою щодо всієї композиції; (4) кроскармелозу у кількості приблизно 2 % - приблизно 8 % за масою щодо всієї композиції; і (5) стеарат магнію у кількості приблизно 0,25 % - приблизно 5 % щодо всієї композиції. У конкретному варіанті здійснення, фармацевтичну композицію покривають складом для нанесення оболонки, де склад для нанесення оболонки містить: (1) полівініловий спирт у кількості приблизно 35 % - приблизно 45 % за масою щодо загального складу для нанесення оболонки; і/або (2) поліетиленгліколь у кількості приблизно 20 % - приблизно 25 % за масою щодо загального складу для нанесення оболонки; і/або (3) тальк у кількості приблизно 10 % приблизно 15 % за масою щодо загального складу для нанесення оболонки; і/або (4) одну або більше забарвлювальних речовин, у кількості приблизно 25 % - приблизно 30 % за масою щодо загального складу для нанесення оболонки. У конкретному варіанті здійснення, у цьому документі надається склад сполуки А, де склад серцевини містить наступне: сполуку А у кількості приблизно 10 % за масою щодо загальної композиції серцевини; лактозу у кількості приблизно 60 % за масою щодо загальної композиції серцевини; мікрокристалічну целюлозу у кількості приблизно 26,25 % за масою щодо загальної композиції серцевини; кроскармелозу у кількості приблизно 3 % за масою щодо загальної композиції серцевини; і стеарат магнію у кількості приблизно 0,75 % за масою щодо загальної композиції серцевини; і склад для нанесення оболонки містить наступне: полівініловий спирт у кількості приблизно 40 % за масою щодо загального складу для нанесення оболонки; поліетиленгліколь у кількості приблизно 20 % за масою щодо загального складу для нанесення оболонки; тальк у кількості приблизно 15 % за масою щодо загального 11 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 складу для нанесення оболонки; і суміш забарвлювальних речовин у кількості приблизно 25 % за масою щодо загального складу для нанесення оболонки. Фармацевтичні композиції і склади, надані в цьому документі, можуть бути представлені у вигляді дискретних лікарських форм. Хоча краща пероральна стандартна лікарська форма має форму таблетки, також можуть бути застосовані і іншої форми лікарських форм. Наприклад, можна використовувати склад серцевини стосовно до інших форм лікарських форм, таких як капсула або капсулоподібна таблетка. У деяких варіантах здійснення, склад знаходиться у формі таблетки. У деяких варіантах здійснення, оскільки звичайно отримують сполуку А, або її фармацевтично прийнятні проліки, сіль, сольват або клатрат, із ступенем чистоти менше 100 %, склади і лікарські форми, які надані в цьому документі, можуть бути визначені як композиції, склади або лікарські форми, які містять сполуку А, або її фармацевтично прийнятні проліки, сіль, сольват або клатрат, у кількості, що забезпечує дієвість, яка відповідає заданій кількості сполуки А із 100 %-ним ступенем чистоти. У деяких варіантах здійснення, у цьому документі надаються безводні фармацевтичні композиції і лікарські форми, які включають активний інгредієнт, оскільки вода може сприяти деградації деяких сполук. Наприклад, додавання води (наприклад, 5 %) широко прийнято у фармацевтичній галузі як засіб моделювання терміну зберігання, тобто, тривалого зберігання, для того, щоб визначити характеристики, такі як термін придатності або стабільность складів із часом. Див., наприклад, Jens T. Carstensen, Drug Stability: Principles & Practice, 2d. Ed., Marcel Dekker, NY, 1995, pp. 379-80. По суті, вода і тепло прискорюють розкладання. Таким чином, вплив води на склад може мати велике значення, оскільки під час виготовлення складів, поводження із ними, їх упакування, зберігання, транспортування, і застосування звичайно мають місце волога і/або вологість. Безводна фармацевтична композиція повинна бути приготовлена і збережена таким чином, щоб можна було зберегти безводну природу. Відповідно до цього, у деяких варіантах здійснення, безводні композиції упаковують із використанням матеріалів, відомих у запобіганні впливу води, для того, щоб вони могли бути включені в придатні набори ліків, які зареєстровані у формулярі ліків. Приклади придатних упаковок включають герметично-запечатану фольгу, пластик або тому подібне, контейнери із одноразовою дозою, блістерні упакування, і контурні безкоміркові упакування, але не обмежуються цим. У цьому зв'язку у цьому документі також надається спосіб виготовлення твердого фармацевтичного складу, який включає активний інгредієнт, шляхом змішування активного інгредієнта і ексципієнта у безводних умовах або в умовах низької вологи/вологості, де інгредієнти є, по суті, вільними від води. Спосіб може додатково включати упаковування безводного або негігроскопічного твердого складу в умовах низької вологості. При використанні таких умов, ризик контакту із водою знижується, і деградація активного інгредієнта може бути попереджена або істотно знижена. 4.1.1. Другі активні речовини У деяких варіантах здійснення, у цьому документі надаються композиції і лікарські форми сполуки А, або її фармацевтично прийнятні проліки, солі, сольвати або клатрати, які можуть додатково містити один або більше вторинних активних інгредієнтів. Деякі комбінації можуть працювати синергічно в лікуванні конкретних типів захворювань або розладів, і станів, і симптомів, які супроводжують такі захворювання або розлад. Сполука А, або її фармацевтично прийнятні проліки, сіль, сольват або клатрат, також може працювати, купіруючи небажані ефекти, пов'язані із дією деяких других активних речовин, і навпаки. Конкретні другі активні сполуки, які можуть міститися в складах і лікарських формах, наданих у цьому документі, варіюються залежно від конкретного показання, яке підлягає лікуванню, попередженню або керуванню. Наприклад, для лікування, попередження або керування перебігом ракового захворювання, другі активні речовини включають: семаксаніб; циклоспорин; етанерцепт; доксициклін; бортезоміб; аківіцин; акларубіцин; акодазолу гідрохлорид; акронін; адозелесин; альдеслейкін; альтретамін; амбоміцин; аметантрону ацетат; амсакрин; анастрозол; антраміцин; аспарагіназу; асперлін; азацитидин; азетепу; азотоміцин; батимастат; бензодепу; бікалутамід; бісантрену гідрохлорид; біснафіду димезилат; бізелесин; блеоміцину сульфат; бреквінару натрієву сіль; бропіримін; бісульфан; кактиноміцин; калустерон; карацемід; карбетимер; карбоплатин; кармустин; карубіцину гідрохлорид; карзелесин; цедефінгол; целекоксиб; хлорамбуцил; циролеміцин; цисплатин; кладрибін; криснатолу мезилат; циклофосфамід; цитарабін; дакарбазин; дактиноміцин; даунорубіцину гідрохлорид; децитабін; дексормаплатин; дезагуанін; дезагуаніну мезилат; діазиквон; доцетаксел; доксорубіцин; доксорубіцину гідрохлорид; 12 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 дролоксифен; дролоксифену цитрат; дромостанолону пропіонат; діазоміцин; едатрексат; ефлорнітину гідрохлорид; елсамітруцин; енлоплатин; енпромат; епіпропідин; епірубіцину гідрохлорид; ербулозол; езорубіцину гідрохлорид; естрамустин; естрамустинфосфат натрію; етанідазол; етопозид; еторозиду фосфат; етоприн; фадрозолу гідрохлорид; фазарабін; фенретинід; флоксуридин; флударабіну фосфат; флуороурацил; флуроцитабін; фосквідон; фостриецину натрієву сіль; гемцитабін; гемцитабіну гідрохлорид; гідроксисечовину; ідарубіцину гідрохлорид; іфосфамід; ілмофосин; іпроплатин; іринотекан; іринотекану гідрохлорид; ланреотиду ацетат; летрозол; лейпроліду ацетат; ліарозолу гідрохлорид; лометрексолу натрієву сіль; ломустин; лосоксатрону гідрохлорид; масопрокол; майтансин; мехлоретаміну гідрохлорид; мегестролу ацетат; меленгестролу ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексату натрієву сіль; метоприн; метуредепу; мітиндомід; мітокарцин; мітокромін; мітогілін; мітомалцин; мітоміцин; мітоспер; мітотан; мітоксантрону гідрохлорид; мікофенольну кислоту; нокодазол; ногаламіцин; ормаплатин; оксисуран; паклітаксел; пегаспаргазу; пеліоміцин; пентамустин; пепломіцину сульфат; перфосфамід; піпоброман; піпосульфан; піроксантрону гідрохлорид; плікаміцин; пломестан; порфімеру натрієву сіль; порфіроміцин; преднімустин; прокарбазину гідрохлорид; пуроміцин; пуроміцину гідрохлорид; піразофурин; рибоприн; сафінгол; сафінголу гідрохлорид; семустин; симтразен; спарфосату натрієву сіль; спарсоміцин; спірогерманію гідрохлорид; спіромустин; спіроплатин; стрептонігрин; стрептозоцин; сулофенір; талісоміцин; текогалану натрієву сіль; таксотер; тегафур; телоксантрону гідрохлорид; темопорфін; теніпозид; тероксирон; тестолактон; тіаміприн; тіогуанін; тіотепу; тіазофурин; тірапазамін; тореміфену цитрат; трестолону ацетат; трицирибіну фосфат; триметрексат; триметрексату глюкуронат; трипторелін; тубулозолу гідрохлорид; урацилмустард; уредепу; вапреотид; вертепорфін; вінбластину сульфат; вінкристину сульфат; віндезин; віндезину сульфат; вінепідину сульфат; вінгліцинату сульфат; вінлейросину сульфат; вінорельбіну тартрат; вінрозидину сульфат; вінзолідину сульфат; ворозол; зеніплатин; зіностатин; і зорубіцину гідрохлорид, але не обмежуються цим. Інші другі речовини містять у собі: 20-епі-1,25-дигідроксивітамін D3; 5-етилурацил; абіратерон; акларубіцин; ацилфульвен; адеципенол; адозелесин; альдеслейкін; антагоністи ALL-TK; алтретамін; амбамустин; амідокс; аміфостин; амінолевулінову кислоту; амрубіцин; амсакрин; анагрелід; анастрозол; андрографолід; інгібітори ангіогенезу; антагоніст D; антагоніст G; антарелікс; антидорсалізуючий морфогенетичний білок-1; антиандроген; антиестроген; антинеопластон; антисмислові олігонуклеотиди; афідиколіну гліцинат; модулятори генів апоптозу; регулятори апоптозу; апуринову кислоту; ара-CDP-DL-PTBA; аргініндеаміназу, азулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; похідні бакатину III; баланол; батимастат; антагоністи BCR/ABL; бензохлорини; бензоїлстауроспорин; похідні бета-лактаму; бета-алетин; бета-кламіцин В; бетулінову кислоту; інгібітор bFGF; бікалутамід; бісантрен; бісазиридинілспермін; біснафід; бістратен A; бізелесин; брефлат; бропіримін; будотитан; бутіоніну сульфоксимін; кальципотріол; калфостин С; похідні камптотецину; капецитабін; карбоксамідамінотриазол; карбоксіамідотриазол; CaRest M3; CARN 700; інгібітор на основі хряща; карзелесин; інгібітори казеїнкінази (ICOS); кастаноспермін; цекропін B; цитрорелікс; хлорини; хлорхіноксаліну сульфонамід; цикапрост; цис-порфірин; кладрибін; аналоги кломіфену; клотримазол; колісміцин А; колісміцин В; комбретастатин А4; аналог комбретастатину; конагенін; крамбесцидин 816; криснатол; криптофіцин 8; похідні криптофіцину А; курацин А; циклопентантрахінони; циклоплатам; ципеміцин; цитарабіну окфосфат; цитолітичний фактор; цитостатин; дакліксимаб; децитабін; дегідродидемнін В; деслорелін; дексаметазон; дексифосфамід; дексразоксан; дексверапаміл; діазиквон; дідемнін В; дідокс; діетилнорспермін; дигідро-5-азацитидин; 9дигідротаксол; діоксаміцин; дифенілспіромустин; доцетаксел; докозанол; доласетрон; доксифлуридин; доксорубіцин; дролоксифен; дронабінол; дуокарміцин SA; ебселен; екомустин; едельфосин; едреколомаб; ефлорнітин; елемен; емітефур; епірубіцин; епристерид; аналог естрамустину; агоністи естрогену; антагоністи естрогену; етанідазол; етопозиду фосфат; екземестан; фадрозол; фазарабін; фенретинід; філграстим; фінастерид; флавопіридол; флезеластин; флуастерон; флударабін; флуородаунорубіцину гідрохлорид; форфенімекс; форместан; фостриецин; фотемустин; гадолінію тексафірин; галію нітрат; галоцитабін; ганірелікс; інгібітори гелатинази; гемцитабін; інгібітори глутатіону; гепсульфам; герегулін; гексаметиленбісацетамід; гіперицин; ібандронову кислоту; ідарубіцин; ідоксифен; ідрамантон; ілмофосин; іломастат; іматиніб (Gleevec®); іміквімод; імуностимулюючі пептиди; інгібітор рецептора інсуліноподібного фактора росту 1; агоністи інтерферону; інтерферони; інтерлейкіни; іобенгуан; іододоксорубіцин; 4-іпомеанол; іроплакт; ірсогладин; ізобенгазол; ізогомогалікондрин В; ітасетрон; джасплакінолід; кахалалід F; ламеларин-N-триацетат; ланреотид; лейнаміцин; 13 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 ленограстим; лентинану сульфат; лептолстатин; летрозол; лейкемічний інгібуючий фактор; лейкоцитарний альфа-інтерферон; лейпролід+естроген+прогестерон; лейпрорелін; левамізол; ліарозол; лінійний аналог поліаміну; ліпофільний дисахаридний білок; ліпофільні сполуки платини; лісоклінамід 7; лобаплатин; ломбрицин; лометрексол; лонідамін; лозоксантрон; локсорибін; луртотекан; лютецію тексафірин; лізофілін; літичні пептиди; майтансин; маностатин А; маримастат; мазопрокол; маспін; інгібітори матрилізину; інгібітори матриксної металопротеїнази; меногарил; мербарон; метерелін; метіоніназу; метоклопрамід; інгібітор MIF; міфепристон; мілтефозин; міримостим; мітогуазон; мітолактол; аналоги мітоміцину; мітонафід; мітотоксиновий фактор росту фібробласту-сапорин; мітоксантрон; мофаротен; молграмостим; Ербітукс (Erbitux), хоріонічний гонадотропін людини; монофосфорил-ліпід А + мікобактеріальну клітинну стінку sk; мопідамол; мустиновий протираковий засіб; мікапероксид В; екстракт стінки мікобактеріальної клітини; міриапорон; N-ацетилдиналін; N-заміщені бензаміди; нафарелін; нагрестип; налоксон+пентазоцин; напавін; нафтерпін; нартограстим; недаплатин; неморубіцин; неридронову кислоту; нілутамід; нізаміцин; модулятори оксиду азоту; антиоксидант на основі нітроксиду; нітрулін; облімерсен (Genasense®); O6-бензилгуанін; октреотид; окиценон; олігонуклеотиди; онапристон; ондансетрон; орацин; оральний індуктор цитокінів; ормаплатин; озатерон; оксаліплатин; оксауноміцин; паклітаксел; аналоги паклітакселу; похідні паклітакселу; палауамін; пальмітоїлризоксин; памідронову кислоту; панакситріол; паноміфен; парабактин; пазеліптин; пегаспаргазу; пелдезин; пентозанполісульфат натрію; пентостатин; пентрозол; перфлуброн; перфосфамід; периліловий спирт; феназиноміцин; фенілацетат; інгібітори фосфатази; піцибаніл; пілокарпіну гідрохлорид; пірарубіцин; піритрексим; плацетин А; плацетин В; інгібітор активатора плазміногену; комплекс платини; сполуки платини; комплекс платинатриамін; порфімеру натрієву сіль; порфіроміцин; преднізон; пропіл-біс-акридон; простагландин J2; інгібітори протеасоми; імуномодулятор на основі білка А; інгібітор протеїнкінази С; інгібітори протеїнкінази С; мікроалгал; інгібітори протеїнтирозинфосфатази; інгібітори пуриннуклеозидфосфорилази; пурпурини; піразолоакридин; піридоксилований кон’югат гемоглобіну і поліоксіетилену; антагоністи raf; ралтитрексед; рамосетрон; інгібітори фарнезилпротеїнтрансферази ras; інгібітори ras; інгібітор ras-GAP; деметилований ретеліптин; етидронат ренію Re 186; ризоксин; рибозими; ретинамід RII; рохітукін; ромуртид; роквінімекс; рубігінон В1; рубоксил; сафінгол; саїнтопін; Sar CNU; саркофітол А; сарграмостим; міметики Sdi 1; семустин; інгібітор фізіологічного старіння 1; cмислові олігонуклеотиди; інгібітори сигнальної трансдукції; сизофіран; собузоксан; борокаптат натрію; фенілацетат натрію; солверол; білок, який зв'язує соматомедин; сонермін; спарфозову кислоту; спікаміцин D; спіромустин; спленопентин; спонгістатин 1; скваламін; стипіамід; інгібітори стромелізину; сульфінозин; антагоніст суперактивного вазоактивного інтестинального пептиду; сурадисту; сурамін; свайнсонін; талімустин; метіодид тамоксифену; тауромустин; тазаротен; текогалану натрієву сіль; тегафур; телурапірилій; інгібітори теломерази; темопорфін; теніпозид; тетрахлордекаоксид; тетразомін; талібластин; тіокоралін; тромбопоетин; тромбопоетиновий міметик; тималфазин; агоніст рецептора тимопоетину; тимотринан; тироїд-стимулюючий гормон; етилетіопурпурин олова; тирапазамін; біхлорид титаноцену; топсентин; торемуфен; інгібітори трансляції; третиноїн; триацетилуридин; трицирибін; триметрексат; трипторелін; тропісетрон; туростерид; інгібітори тирозинкінази; тирфостини; інгібітори UBC; убенімекс; фактор, який інгібуює ріст тканин урогенітального синуса; антагоністи рецептора урокінази; вапреотид; варіолін В; веларезол; верамін; вердини; вертепорфін; вінорелбін; вінксалтин; вітаксин; ворозол; занотерон; зеніплатин; зіласкорб; і стималамер зиностатину, але не обмежуються цим. Додаткові інші другі активні речовини включають 2-метоксіестрадіол, теломестатин, індуктори апоптозу в клітинах множинної мієломи (такі як, наприклад, TRAIL), статини, семаксаніб, циклоспорин, етанерцепт, доксициклін, бортезоміб, облімерсен (Genasense®), ремікад, доцетаксел, целекоксиб, мелфалан, дексаметазон (Decadron®), стероїди, гемцитабін, цисплатин, темозоломід, етопозид, циклофосфамід, темодар, карбоплатин, прокарбазин, гліадел, тамоксифен, топотекан, метотрексат, Arisa®, таксол, таксотер, фторурацил, лейковорин, іринотекан, кселоду, CPT-11, інтерферон альфа, пегильований інтерферон альфа (наприклад, PEG INTRON-A), капецитабін, цисплатин, тіотепу, флударабін, карбоплатин, ліпосомальний даунорубіцин, цитарабін, доксетаксол, пацилітаксел, вінбластин, IL-2, GM-CSF, дакарбазин, вінорелбін, золедронову кислоту, пальмітронат, біаксин, бусульфан, преднізон, бісфосфонат, триоксид миш'яку, вінкристин, доксорубіцин (Doxil®), паклітаксел, ганцикловір, адріаміцин, естрамустин-натрію фосфат (Emcyt®), суліндак, і етопозид, але не обмежуються цим. 14 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті здійснення, приклади конкретних других речовин відповідно до показань, які підлягають лікуванню, попередженню або керуванню, можуть бути виявлені в наступних посиланнях, усі із яких включені в цей документ у повному своєму обсязі: патент США № 6281230 і 5635517; публікації США № 2004/0220144, 2004/0190609, 2004/0087546, 2005/0203142, 2004/0091455, 2005/0100529, 2005/0143344, 2005/0214328, 2005/0239842, 2006/0122228, 2006/0154880 і 2006/0188475. Приклади других активних речовин, які можуть бути використані у лікуванні, попередженні і/або керуванні перебігом больових відчуттів, включають звичайно застосовувані терапевтичні засоби, які використовуються для лікування або попередження болю, такі як антидепресанти, протисудомні засоби, гіпотензивні засоби, анксіолітичні засоби, блокатори кальцієвих каналів, м'язові релаксанти, ненаркотичні аналгетичні засоби, опіоїдні аналгетичні засоби, протизапальні засоби, інгібітори ЦОГ-2, імуномодулюючі засоби, агоністи або антагоністи альфаадренергічного рецептора, імунодепресивні засоби, кортикостероїди, гіпербаричний кисень, кетамін, інші анестетики, антагоністи NMDA і інші лікарські препарати, наведені, наприклад, у Рhуsісіаn's Desk Reference, 2003, але не обмежуються цим. Конкретні приклади включають ацетилсаліцилову кислоту (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетамін, габапентин (Neurontin®), фенітоїн (Dilantin®), карбамазепін (Tegretol®), окскарбазепін (Trileptal®), вальпроєву кислоту (Depakene®), морфіну сульфат, гідроморфон, преднізон, гризеофульвін, пентоній, алендронат, дифенгідрамід, гуанетидин, кеторолак (Acular®); тирокальцитонін, диметилсульфоксид (ДМСО), клонідин (Catapress®), бретилій, кетансерин, резерпін, дроперидол, атропін, фентоламін, бупівакаїн, лідокаїн, ацетамінофен, нортриптилін (Pamelor®); амітриптилін (Elavil®), іміпрамін (Tofranil®), доксепін (Sinequan®), кломіпрамін (Anafranil®), флуоксетин (Prozac®, сертралін (Zoloft®), напроксен, нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропіон (Wellbutrin®), мексилетин, ніфедипін, пропранолол, трамадол, ламотригін, віокс, зіконотид, кетамін, декстрометорфан, бензодіазепіни, баклофен, тизанідин і феноксибензамін, але не обмежуються цим. Приклади других активних речовин, які можуть бути використані для лікування, попередження і/або керування перебігом макулярної дегенерації і пов'язаних із цим захворюванням синдромів, включають стероїд, світловий сенсибілізатор, інтегрин, антиоксидант, інтерферон, похідне ксантину, гормон росту, нейротрофічний фактор, регулятор неоваскуляризації, анти-VЕGF-антитіло, простагландин, антибіотик, фітоестроген, протизапальну сполуку або інгібуючу ангіогенез сполуку, або їх комбінацію, але не обмежуються цим. Конкретні приклади включають, не обмежуючись цим, вертепорфін, пурлітин, ангіостатичний стероїд, rhuFab, інтерферон-2, пентоксифілін, етіопурпурин олова, мотексафін, люцентис, лутетій, 9-фтор-11,21-дигідрокси-16,17-1-метилетилідинбіс(окси)прегна-1,4-дієн-3,20діон, латанопрост (див. патент США № 6225348), тетрациклін і його похідні, рифаміцин і його похідні, макроліди, метронідазол (патенти США № 6218369 і 6015803), геністеїн, геністин, 6'-ОMal геністин, 6'-О-Ac геністин, даїдзеїн, даїдцин, 6'-О-Mal даїдцин, 6'-О-Ac даїдцин, гліцитеїн, гліцитин, 6'-О-Mal гліцитин, біоханін А, формононетин (патент США № 6001368), триамцинолону ацетомід, дексаметазон (патент США № 5770589), талідомід, глутатіон (патент США № 5632984); основний фактор росту фібробластів (bFGF), трансформуючий фактор росту b (TGFb), нейротрофічний фактор головного мозку (BDNF), фактор активатора плазміногена 2-го типу (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), міравант і імплантат RETISERT (Bausch&Lomb). Усі джерела, цитовані в даному документі, у повному своєму обсязі включені шляхом посилання. Приклади других активних речовин, які можуть бути використані для лікування, попередження і/або керування перебігом шкірних хвороб, включають кератолітики, ретиноїди, -гідроксикислоти, антибіотики, колаген, ботулінічний токсин, інтерферон, стероїди і імуномодулятори, але не обмежуються цим. Конкретні приклади включають 5-фторурацил, мазопрокол, трихлороцтову кислоту, саліцилову кислоту, молочну кислоту, лактат амонію, сечовину, третиноїн, ізотретиноїн, антибіотики, колаген, ботулінічний токсин, інтерферон, кортикостероїди, трансретиноєву кислоту і колагени, такі як плацентарний колаген людини, плацентарний колаген тварин, дермалоген, алодерм, фасціа, циметру, аутологен, зидерм, зипласт, резопласт і ізолаген, але не обмежуються цим. Приклади других активних засобів, які можуть бути використані для лікування, попередження і/або керування перебігом легеневої гіпертензії і пов'язаних із цим захворюванням порушень, включають антикоагулянти, діуретики, серцеві глікозиди, блокатори кальцієвих каналів, вазодилататори, аналоги простацикліну, антагоністи ендотеліну, інгібітори фосфодіестерази (наприклад, інгібітори PDE V), інгібітори ендопептидази, засоби, які знижують вміст ліпідів, інгібітори тромбоксану і інші терапевтичні засоби, про які відомо, що вони 15 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 знижують легеневий артеріальний тиск, але не обмежуються цим. Конкретні приклади включають варфарин (Coumadin®), діуретик, серцевий глікозид, дигоксин-кисень, дилтіазем, ніфедипін, вазодилататор, такий як простациклін (наприклад, простагландин I2 (PGI2), епопростенол (EPO, Floran®), трептостиніл (Remodulin®), оксид азоту (NO), бозентан (Tracleer®), амлодипін, епопростенол (Floran®), трепростиніл (Remodulin®), простациклін, тадалафіл (Cialis®), симвастатин (Zocor®), омапатрилат (Vanlev®), ірбесартан (Avapro®), правастатин (Pravachol®), дигоксин, L-аргінін, ілопрост, бетапрост і силденафіл (Viagra®), але не обмежуються цим. Приклади других активних речовин, які можуть бути використані для лікування, попередження і/або керування перебігом захворювань, викликаних вдиханням азбестового пилу, включають антрациклін, платину, алкілуючий агент, облімерсен (Genasense®), цисплатин, циклофосфамід, темодар, карбоплатин, прокарбазин, гліадел, тамоксифен, топотекан, метотрексат, таксотер, іринотекан, капецитабін, цисплатин, тіотепу, флударабін, карбоплатин, ліпосомальний даунорубіцин, цитарабін, доксетаксол, пацилітаксел, вінбластин, IL-2, GM-CSF, дакарбазин, вінорелбін, золедронову кислоту, пальмітронат, біаксин, бусульфан, преднізон, бісфосфонат, триоксид миш'яку, вінкристин, доксорубіцин (Doxil®), паклітаксел, ганцикловір, адриаміцин, блеоміцин, гуалуронідазу, мітоцин С, мепакрин, тіотепу, тетрациклін і гемцитабін, але не обмежуються цим. Приклади других активних речовин, які можуть бути використані для лікування, попередження і/або керування перебігом паразитарних захворювань, включають хлорохін, хінін, хінідин, піриметамін, сульфадіазин, доксициклін, кліндаміцин, мефлохін, галофантрин, примахін, гідроксихлорохін, прогуаніл, атоваквон, азитроміцин, сурамін, пентамідин, меларсопрол, ніфуртимокс, бензнідазол, амфотерецин В, сполуки п'ятивалентної сурми (наприклад, стибоглюкуронату натрію), інтерферон-гамма, інтраконазол, комбінацію убитих промастигот і BCG, лейковорин, кортикостероїди, сульфонамід, спіраміцин, IgG (серологія), триметоприм і сульфаметоксазол, але не обмежуються цим. Приклади других активних речовин, які можуть бути використані для лікування, попередження і/або керування перебігом імунодефіцитних станів, включають: антибіотики (у терапевтичних або профілактичних цілях), такі як, без обмежень, ампіцилін, тетрациклін, пеніцилін, цефалоспорини, стрептоміцин, канаміцин і еритроміцин; противірусні препарати, такі як, без обмежень, амантадин, римантадин, ацикловір і рибавірин; імуноглобулін; плазму; посилюючі імунологічний потенціал лікарські засоби, такі як, без обмежень, левамізол і ізопринозин; біологічні препарати, такі як, без обмежень, гаммаглобулін, трансферфактор, інтерлейкіни і інтерферони; гормони, такі як, без обмежень, гормон тимусу; і інші імунологічні препарати, такі як, без обмежень, стимулятори В-клітин (наприклад, BAFF/BlyS), цитокіни (наприклад, IL-2, IL-4 і IL-5), фактори росту (наприклад, TGF-); антитіла (наприклад, антиCD40-антитіла і IgМ), олігонуклеотиди, які містять неметиловані CpG-мотиви, і вакцини (наприклад, вірусні вакцини і вакцини на основі пухлинних пептидів), але не обмежуючи цим. Приклади других активних речовин, які можуть бути використані для лікування, попередження і/або керування перебігом розладів ЦНС, включають: опіоїди; агоніст або антагоніст дофаміну, такий як, без обмежень, леводопу, L-DOPA, кокаїн, -метилтирозин, резерпін, тетрабеназин, бензотропін, паргілін, фенодолпаму мезилат, каберголін, праміпексолу дигідрохлорид, ропінорол, амантадину гідрохлорид, селегіліну гідрохлорид, карбідопу, перголіду мезилат, синемет CR і симетрел; інгібітор MAO, такий як, без обмежень, іпроніазид, клоргілін, фенелзин і ізокарбоксазид; інгібітор COMT, такий як, без обмежень, толкапон і ентакапон; інгібітор холінестерази, такий як, без обмежень, фізостигміну саліклат, фізостигміну сульфат, фізостигміну бромід, меостигміну бромід, неостигміну метилсульфат, амбеноніму хлорид, едрофонію хлорид, такрин, палідоксиму хлорид, обідоксиму хлорид, тримедоксиму бромід, діацетилмоноксим, ендрофоній, піридостигмін і демекарій; протизапальний препарат, такий як, без обмежень, напроксену натрієва сіль, диклофенаку натрієва сіль, диклофенаку калієва сіль, целекоксиб, суліндак, оксапрозин, дифлунізал, етодолак, мелоксикам, ібупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномід, сульфасалазин, солі золота, імуноглобулін Rho-D, мікофенілат мофетил, циклоспорин, азатіоприн, такролімус, базиліксімаб, даклізумаб, саліцилова кислота, ацетилсаліцилова кислота, метилсаліцилат, дифлунізал, салсалат, олсалазин, сульфасалазин, ацетамінофен, індометацин, суліндак, мефенамова кислота, меклофенамату натрієва сіль, толметин, кеторолак, диклофенак, флурбінпрофен, оксапрозин, піроксикам, мелоксикам, ампіроксикам, дроксикам, півоксикам, теноксикам, фенілбутазон, оксифенбутазон, антипірин, амінопірин, апазон, зилейтон, ауротіоглюкозу, тіомалат золота і натрію, ауранофін, метотрексат, колхіцин, алопуринол, пробенецид, сульфінпіразон і бензбромарон або бетаметазон, і інші глюкокортикоїди; і протиблювотні засоби, такі як, без 16 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 обмежень, метоклопромід, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамід, ондансетрон, гранісетрон, гідроксизин, ацетиллейцин моноетаноламін, алізаприд, азасетрон, бензхінамід, біетанаутин, бромоприд, буклізин, клебоприд, циклізин, дименгідринат, дифенідол, доласетрон, меклізин, металлатал, метопімазин, набілон, оксиперидил, піпамазин, скополамін, сульпірид, тетрагідроканабінол, тіетилперазин, тіопроперазин, тропісетрон і їх суміші, але не обмежуються цим. Приклади других активних речовин, які можуть бути використані для лікування, попередження і/або керування перебігом ушкоджень ЦНС і пов'язаних із цими захворюваннями синдромів, включають імуномодулюючі засоби, імунодепресивні засоби, гіпотензивні препарати, протисудомні препарати, фібринолітичні засоби, антитромбоцитарні засоби, антипсихотики, антидепресанти, бензодіазепіни, буспірон, амантадин і інші відомі і традиційні засоби, які застосовують у пацієнтів із травмою/ушкодженням ЦНС і пов'язаними із цим синдромами, але не обмежуються цим. Конкретні приклади включають: стероїди (наприклад, глюкокортикоїди, такі як, без обмежень, метилпреднізолон, дексаметазон і бетаметазон); протизапальний препарат, включаючи, не обмежуючи цим, напроксену натрієву сіль, диклофенаку натрієву сіль, диклофенаку калієву сіль, целекоксиб, сулундак, оксапрозин, дифлунізал, етодолак, мелоксикам, ібупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномід, сульфасалазин, солі золота, імуноглобулін Rho-D, мікофенілат мофетил, циклоспорин, азатіоприн, такролімус, базиліксимаб, даклізумаб, саліцилову кислоту, ацетилсаліцилову кислоту, метилсаліцилат, дифлунізал, салсалат, олсалазин, сульфасалазин, ацетамінофен, індометацин, суліндак, мефенамову кислоту, меклофенамату натрієву сіль, толметин, кеторолак, диклофенак, флурбінпрофен, оксапрозин, піроксикам, мелоксикам, ампіроксикам, дроксикам, півоксикам, теноксикам, фенілбутазон, оксифенбутазон, антипірин, амінопірин, апазон, зилейтон, ауротіоглюкозу, тіомалат золота і натрію, ауранофін, метотрексат, колхіцин, алопуринол, пробенецид, сульфінпіразон і бензбромарон; аналог cAMP, включаючи, не обмежуючись цим, db-cAMP; засіб, що включає метилфенідат, який містить l-треометилфенідат, d-трео-метилфенідат, dl-трео-метилфенідат, l-еритро-метилфенідат, d-еритрометилфенідат, dl-еритро-метилфенідат і їх суміші; і діуретичний засіб, такий як, без обмежень, маніт, фуросемід, гліцерин і сечовина, але не обмежуються цим. Приклади других активних речовин, які можуть бути використані для лікування, попередження і/або керування перебігом порушень сну і пов'язаних із цим синдромів, включають трициклічний антидепресант, селективний інгібітор зворотного захоплення серотоніну, антиепілептичний засіб (габапентин, прегабалін, карбамазепін, окскарбазепін, левітирацетам, топірамат), антиаритмічний засіб, блокатор натрієвих каналів, селективний інгібітор медіаторів запалення, опіоїдний засіб, іншу імуномодулюючу сполуку, комбінований препарат і інші відомі і традиційні препарати, які застосовують для лікування порушень сну, але не обмежуються цим. Конкретні приклади включають нейронтин, оксиконтин, морфін, топірамат, амітриптилін, нортриптилін, карбамазепін, леводопу, L-DOPA, кокаїн, -метилтирозин, резерпін, тетрабеназин, бензотропін, паргілін, фенодолпаму мезилат, каберголін, праміпексолу дигідрохлорид, ропінорол, амантадину гідрохлорид, селегіліну гідрохлорид, карбідопу, перголіду мезилат, синемет CR, симетрел, іпроніазид, клоргілін, фенелзин, ізокарбоксазид, толкапон, ентакапон, фізостигміну саліклат, фізостигміну сульфат, фізостигміну бромід, меостигміну бромід, неостигміну метилсульфат, амбеноніму хлорид, едрофонію хлорид, такрин, пралідоксиму хлорид, обідоксиму хлорид, тримедоксиму бромід, діацетилмоноксим, ендрофоній, піридостигмін, демекарій, напроксену натрієву сіль, диклофенаку натрієву сіль, диклофенаку калієву сіль, целекоксиб, суліндак, оксапрозин, дифлунізал, етодолак, мелоксикам, ібупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномід, сульфасалазин, солі золота, імуноглобулін Rho-D, мікофенілат мофетил, циклоспорин, азатіоприн, такролімус, базиліксимаб, даклізумаб, саліцилову кислоту, ацетилсаліцилову кислоту, метилсаліцилат, дифлунізал, салсалат, олсалазин, сульфасалазин, ацетамінофен, індометацин, суліндак, мефенамову кислоту, меклофенамату натрієву сіль, толметин, кеторолак, диклофенак, флурбінпрофен, оксапрозин, піроксикам, мелоксикам, ампіроксикам, дроксикам, півоксикам, теноксикам, фенілбутазон, оксифенбутазон, антипірин, амінопірин, апазон, зилейтон, ауротіоглюкозу, тіомалат золота і натрію, ауранофін, метотрексат, колхіцин, алопуринол, пробенецид, сульфінпіразон, бензбромарон, бетаметазон і інші глюкокортикоїди, метоклопромід, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамід, ондансетрон, гранісетрон, гідроксизин, ацетиллейцин моноетаноламін, алізаприд, азасетрон, бензхінамід, біетанаутин, бромоприд, буклізин, клебоприд, циклізин, дименгідринат, дифенідол, доласетрон, меклізин, металатал, метопімазин, набілон, оксиперидил, піпамазин, скополамін, 17 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 сульпірид, тетрагідроканабінол, тіетилперазин, тіопроперазин, тропісетрон і їх суміші, але не обмежуються цим. Приклади других активних речовин, які можуть бути використані для лікування, попередження і/або керування перебігом гемоглобінопатії і пов'язаних із цим захворюванням порушень, включають: інтерлейкіни, такі як IL-2 (включаючи рекомбінантний IL-II ("rIL2") і канарипокс IL-2), IL-10, IL-12 і IL-18; інтерферони, такі як інтерферон альфа-2а, інтерферон альфа-2b, інтерферон альфа-n1, інтерферон альфа-n3, інтерферон бета-Ia і інтерферон гаммаIb; і G-CSF; гідроксисечовину; бутирати або похідні бутиратів; оксид азоту; гідроксисечовину; HEMOXIN (NIPRISAN; див. патент США № 5800819); антагоністи каналів Gardos, такі як клотримазол або похідні триарилметану; дефероксамін; протеїн С; і системи переливання крові або кровозамінника, такі як Hemospan або Hemospan PS (Sangart), але не обмежуються цим. 4.2. Спосіб виготовлення лікарських форм Лікарські форми, надані в даному документі, можуть бути виготовлені будь-якими способами, звичайно застосовуваними у фармації, але всі способи включають стадію об'єднання активного інгредієнта із ексципієнтом, який складається з одного або більше необхідних інгредієнтів. Загалом, композиції виготовляють змішуванням до однорідної маси (наприклад, прямим змішуванням) активного інгредієнта із рідкими ексципієнтами або дрібно подрібненими твердими ексципієнтами, або і з тими, і з іншими ексципієнтами одночасно, і потім, за необхідності, наданням продукту бажаної форми (наприклад, компактуванням, таким як вальцювання). Якщо бажано, то таблетки можна покрити оболонками із використанням стандартних способів, у яких застосовуються водні або неводні рідини. Лікарська форма, яка розкривається в даному документі, може бути виготовлена пресуванням або формуванням, необов'язково з одним або більше допоміжними інгредієнтами. Пресовані таблетки можуть бути виготовлені із використанням придатного апарата пресуванням активного інгредієнта в сипкій формі, такій як порошок або гранули, необов'язково в суміші із ексципієнтом, зазначеним вище, і/або із поверхнево-активною або диспергуючою речовиною. Формованні таблетки можуть бути виготовлені формуванням суміші порошкоподібної сполуки, змоченої інертним рідким розріджувачем, на придатному апараті. Інкапсулювання лікарських форм, наданих у даному документі, можна провести із використанням капсул із метилцелюлози, альгінату кальцію або желатину. У деяких варіантах здійснення, активні інгредієнти і ексципієнти піддають прямому змішуванню і вводять, наприклад, у капсули, або піддають прямому пресуванню із отриманням таблеток. У деяких випадках лікарська форма, отримана прямим змішуванням, може бути більш переважною порівняно з лікарською формою, отриманою компактуванням (наприклад, вальцюванням), оскільки пряме змішування може знизити або навіть цілком усунути шкідливі для здоров'я ефекти, причиною яких можуть бути зважені в повітрі частинки інгредієнтів, які утворюються у виробництві із використанням процесу компактування. У деяких випадках склади, отримані прямим змішуванням, можуть мати переваги, оскільки для них потрібна тільки одна стадія змішування активного інгредієнта і ексципієнтів перед їх переробкою, у ході якої отримують кінцеву лікарську форму, наприклад, таблетку або капсулу. Це може знизити до мінімуму утворення зважених у повітрі частинок або пилу, тоді як для процесів вальцювання характерне утворення пилу. У процесі вальцювання, підданий компактуванню матеріал часто подрібнюють до більш дрібних частинок для додаткової обробки. При подрібнюванні можуть утворюватися значні кількості зважених у повітрі частинок, оскільки метою даної стадії виробництва є зменшення розміру частинок. Потім подрібнений матеріал змішують із іншими інгредієнтами перед виготовленням кінцевої лікарської форми. Для деяких активних інгредієнтів, зокрема, для сполуки із низькою розчинністю, розмір частинок активного інгредієнта зменшують до розміру частинок дрібного порошку з метою сприяння підвищенню швидкості солюбілізації активного інгредієнта. Підвищення швидкості солюбілізації часто є необхідним для ефективного всмоктування активного інгредієнта у шлунково-кишковому тракті. Однак, дрібним порошкам, які повинні бути піддані прямому змішуванню і введені у капсули, ексципієнти переважно повинні додати деякі характеристики, які роблять інгредієнти придатними для процесу прямого змішування. Приклади таких характеристик включають прийнятну сипкість, але не обмежуються цим. Тому, в одному варіанті здійснення, розкриваються застосування і композиції, які містять ексципієнти, що можуть забезпечити характеристики, які роблять отримувану у результаті суміш придатною для процесу прямого змішування, наприклад гарну сипкість. У деяких варіантах здійснення, технологія виробництва таблеток із використанням сухого змішування є кращим способом виготовлення таблеток, які розкриваються в цьому документі. 18 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 4.2.1. Розподіл за розміром на ситах (просіювання) Спосіб виготовлення фармацевтичних композицій за винаходом переважно включає розподіл за розміром на ситах (просіювання) активного інгредієнта і ексципієнта(ів). В одному варіанті здійснення, активний інгредієнт пропускають через сито із отворами розміром приблизно 200 мкм - приблизно 750 мкм. У ще одному варіанті здійснення, активний інгредієнт пропускають через сито із отворами розміром приблизно 200 мкм - приблизно 400 мкм. У ще одному варіанті здійснення, активний інгредієнт пропускають через сито із отворами розміром приблизно 300 мкм - приблизно 400 мкм. Залежно від використовуваного(их) ексципієнта(ів), отвори сита варіюються. Наприклад, дезінтегранти і зв’язувальні речовини пропускають через отвори розміром приблизно 430 мкм - приблизно 750 мкм, приблизно 600 мкм - приблизно 720 мкм або приблизно 710 мкм. Лубриканти звичайно пропускають через сито із більш дрібними отворами, наприклад, розміром приблизно 150 мкм - приблизно 250 мкм. В одному варіанті здійснення, лубрикант пропускають через сито із отворами розміром приблизно 210 мкм. 4.2.2. Попереднє змішування Після просіювання інгредієнтів ексципієнт і активний інгредієнт змішують у дифузійному змішувачі. В одному варіанті здійснення, час змішування знаходиться в межах від приблизно 1 хв. до приблизно 50 хв., від приблизно 5 хв. до приблизно 45 хв., від приблизно 10 хв. до приблизно 40 хв. або від приблизно 10 хв. до приблизно 25 хв. У ще одному варіанті здійснення, час змішування складає приблизно 15 хв. У тому випадку, коли використовують більше одного ексципієнта, ексципієнти можна змішувати у барабанному блендері протягом приблизно 1 хв. - приблизно 20 хв. або протягом приблизно 5 хв. - приблизно 10 хв., перед змішуванням із активним інгредієнтом. 4.2.3. Вальцювання В одному варіанті здійснення, попередню суміш можна необов'язково пропустити через вальцьовий прес із молотковим млином, приєднаним до розвантажувального механізму преса. 4.2.4. Кінцева суміш У тому випадку, коли використовують лубрикант, наприклад, стеарилфумарат натрію і стеарат магнію, лубрикант змішують із попередньою сумішшю наприкінці процесу із отриманням фармацевтичної композиції. Таке додаткове змішування проводять протягом приблизно 1 хв. приблизно 10 або хв. приблизно 3 хв. - приблизно 5 хв. 4.2.5. Таблетування Суміш складу для виготовлення лікарської форми може бути піддана таблетуванню (наприклад, компактуванням, пресуванням або формуванням) із отриманням таблетки бажаного розміру і бажаної форми із використанням, наприклад, таблеткового преса або іншого звичайно застосовуваного устаткування для таблетування і стандартних технологій. 4.2.6. Інкапсулювання Суміш складу для виготовлення лікарської форми також може бути необов'язково інкапсульована в оболонку капсул бажаного розміру із використанням, наприклад, апарата для заповнення капсул або роторного таблеткового преса. 4.3. Набори Також забезпечуються фармацевтичні упакування або набори, які містять фармацевтичні композиції або лікарські форми, які розкриваються в даному документі. Приклад набору містить повідомлення у формі, запропонованій державним органом, який регулює виробництво, застосування або продаж фармацевтичних або біологічних продуктів, де в даному повідомленні приводиться дозвіл цієї організації на виробництво, застосування або продаж відповідного фармацевтичного або біологічного продукту для введення людям. 4.4. Способи лікування, попередження і керування перебігом захворювання У цьому документі розкриваються способи лікування, попередження і/або керування перебігом деяких захворювань або порушень із використанням складів, композицій або лікарських форм, наданих у даному документі. Приклади захворювань або розладів включають ті розлади, які пов'язані із PDE4, TNF, cAMP і/або ангіогенезом, і включають захворювання або розлади, такі як різні запальні захворювання, легеневі захворювання, аутоімунні захворювання і імунологічні захворювання, але не обмежуються цим. Конкретні приклади включають запалення і його різні форми, рак, розлади, які супроводжують ангіогенез, біль, включаючи, без обмежень, Комплексний Регіонарний Больовий Синдром ("CRPS"), Макулярну Дегенерацію ("MD") і пов'язані синдроми, шкірні захворювання, легеневі розлади, розлади, викликані вдиханням азбестового пилу, паразитарні захворювання, імунодефіцитні розлади, розлади ЦНС, ушкодження ЦНС, атеросклероз і пов'язані розлади, порушення сну і пов'язані розлади, гемоглобінопатію і пов'язані порушення (наприклад, анемію), туберкульоз і пов'язані розлади, порушення, пов'язані 19 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 із PDE4/TNF, інфекційні захворювання і інші різні захворювання і розлади, але не обмежуються цим. В одному варіанті здійснення, захворювання або розлади, які наводяться як приклад, включають запальні, вірусні, генетичні, алергічні, шкірні і аутоімунні захворювання, але не обмежуються цим. Конкретні приклади включають артрит, ВІЛ, гепатит, акне, синдром розладу дихання у дорослих, захворювання, пов'язані із кістковою резорбцією, хронічні легеневі запальні захворювання, дерматит, дерматоміозит, кістозний фіброз, червоний плоский лишай, септичний шок, сепсис, ендотоксиновий шок, гемодинамічний шок, септичний синдром, постішемічне реперфузійне ушкодження, менінгіт, псоріаз, фіброзне захворювання, кахексію, реакцію "трансплантат проти хазяїна", відторгнення трансплантата, аутоімунне захворювання, ревматоїдний спондиліт, хворобу Бехчета, дерматит, хворобу Крона, ульцеративний (неспецифічний) коліт, запальне захворювання кишечнику, рожеві вугри, множинний склероз, системний червоний вовчак, розростання прокази, саркоїдоз, радіаційне ураження, рак, астму, увеїт або гіпероксичне альвеолярне ураження, але не обмежуються цим. В одному варіанті здійснення, захворювання являє собою псоріаз. В іншому варіанті здійснення, псоріаз являє собою бляшковий псоріаз. У ще одному варіанті здійснення, захворювання являє собою артрит. В іншому варіанті здійснення, артрит являє собою псоріатичний артрит, ревматоїдний артрит, остеоартрит або гострий подагричний артрит. В іншому варіанті здійснення, захворювання являє собою шкірне захворювання. В іншому варіанті здійснення, шкірне захворювання являє собою акне, дерматит або дерматоміозит. В іншому варіанті здійснення, дерматит являє собою атопічний дерматит або контактний дерматит. У ще одному варіанті здійснення, захворювання являє собою ульцеративний коліт. У ще одному варіанті здійснення, захворювання являє собою хворобу Бехчета. У ще одному варіанті здійснення, захворювання являє собою хворобу Крона. У ще одному варіанті здійснення, захворювання являє собою саркоїдоз. У ще одному варіанті здійснення, саркоїдоз являє собою хронічний шкірний саркоїдоз. В іншому варіанті здійснення, захворювання являє собою увеїт. В іншому варіанті здійснення, захворювання являє собою рожеві вугри. У ще одному варіанті здійснення, захворювання являє собою червоний плоский лишай. В інших варіантах здійснення, у цьому документі надаються способи лікування, попередження і/або керування перебігом різних інших захворювань або розладів із застосуванням композицій і складів, які наводяться в даному документі. Нижче представлені приклади інших захворювань або розладів. Приклади ракових захворювань і передракових станів включають захворювання і стани, описані в патентах: США № 6281230 і 5635517, Muller et al.; у різних публікаціях патентів США, Zeldis, включаючи публікацію № 2004/0220144А1, яка опублікована 4 листопада 2004 (Treatment of Myelodysplastic Syndrome); 2004/0029832А1, яка опублікована 12 лютого 2004 (Treatment of Various Types of Cancer); і 2004/0087546, яка опублікована 6 травня 2004 (Treatment of Myeloproliferative Diseases), але не обмежуються цим. Приклади також включають захворювання, описані в міжнародній заявці WO 2004/103274, яка опублікована 2 грудня 2004. Усі ці джерела в повному обсязі включені в даний документ шляхом посилання. Деякі приклади ракового захворювання включають ракові захворювання: шкіри, як, наприклад, меланома; лімфатичного вузла; молочної залози; шийки матки; матки; органів шлунково-кишкового тракту; легенів; яєчників; предміхурової залози; обідкової кишки; прямої кишки; ротової порожнини; мозку; голови і шиї; горла; яєчок; нирок; підшлункової залози; кісток; селезінки; печінки; сечового міхура; гортані; носових шляхів; і пов'язані зі СНІДом ракові захворювання, але не обмежуються цим. Сполуки також є корисними для лікування ракових захворювань крові і кісткового мозку, таких як множинна мієлома і гострий і хронічний лейкози, наприклад, лімфобластний, мієлогенний, лімфоцитарний і мієлоцитарний лейкози. Сполуки, які наводяться в даному документі, можуть бути використані для лікування, попередження або керування перебігом первинних або метастатичних пухлин. Інші ракові захворювання включають пухлину на пізніх стадіях, амілоїдоз, нейробластому, менінгіому, гемангіоперицитому, множинні метастази в мозок, мультиформну гліобластому, гліобластому; гліому стовбура мозку, злоякісну пухлину мозку із несприятливим прогнозом, злоякісну гліому, рецидивуючу злоякісну гліому, анапластичну астроцитому, анапластичну олігодендрогліому, нейроендокринну пухлину, ректальну аденокарциному, колоректальний рак із поширеністю C&D по Dukes, неоперабельну колоректальну карциному, метастатичну гепатоцелюлярну карциному, саркому Капоші, гострий мієлобластний лейкоз зі зміною 20 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 каріотипу, хронічний лімфоцитарний лейкоз (CLL), лімфому Ходжкіна, неходжкінську лімфому, шкірну Т-клітинну лімфому, шкірну В-клітинну лімфому, дифузійну В-клітинну великоклітинну лімфому, фолікулярну лімфому низького ступеня злоякісності, метастатичну меланому (локалізовану меланому, включаючи, без обмежень, окулярну меланому); злоякісну мезотеліому, синдром мезотеліоми із злоякісним плевральним випотом, перитонеальну карциному, папілярну серозну карциному, гінекологічну саркому, саркому м'яких тканин, склеродерму, шкірний васкуліт, гістіоцитоз із клітин Лангерганса, лейоміосаркому, прогресуючу осифікуючу фібродисплазію, гормонорезистентний рак предміхурової залози, резектовану саркому м'яких тканин із високим ризиком, неоперабельну гепатоцелюлярну карциному, макроглобулінемію Вальденстрома, в'ялоплинну мієлому, індолентну мієлому, рак фалопієвих труб, андроген-незалежний рак предміхурової залози, андроген-залежний неметастатичний рак предміхурової залози на IV стадії, гормон-незалежний рак предміхурової залози, нечуттєвий до хіміотерапії рак предміхурової залози, папілярну карциному щитовидної залози, фолікулярну карциному щитовидної залози, медулярну карциному щитовидної залози і лейоміому, але не обмежуються цим. У конкретному варіанті здійснення, ракове захворювання є метастатичним. У ще одному варіанті здійснення, ракова пухлина є стійкою або резистентною до хіміотерапії або променевої терапії. В одному варіанті здійснення, захворювання або порушення являють собою різні форми лейкозів, такі як хронічний лімфоцитарний лейкоз, хронічний мієлоцитарний лейкоз, гострий лімфобластний лейкоз, гострий мієлогенний лейкоз і гострий мієлобластний лейкоз, включаючи лейкози, які є рецидивуючими, рефрактерними або резистентними, які розкриті в публікації патенту США № 2006/0030594, що опублікована9 лютого 2006, яка у повному обсязі включена в даний документ шляхом посилання. Термін "лейкоз" стосується злоякісних новоутворень кровотворних тканин. Лейкози включають хронічний лімфоцитарний лейкоз, хронічний мієлоцитарний лейкоз, гострий лімфобластний лейкоз, гострий мієлогенний лейкоз і гострий мієлобластний лейкоз, але не обмежуються цим. Лейкоз може бути рецидивуючим, рефрактерним або резистентним до звичайно застосовуваної терапії. Термін "рецидивуючий" стосується випадків, коли у пацієнтів, у яких була ремісія лейкозу після терапії, відбувається рецидив росту лейкозних клітин у кістковому мозку і зниження кількості нормальних клітин у крові. Термін "рефрактерний або резистентний" стосується випадків, коли у пацієнтів навіть після інтенсивної терапії зберігаються залишкові лейкозні клітинки в їх кістковому мозку. У ще одному варіанті здійснення, захворювання або порушення являють собою різні типи лімфом, включаючи неходжкінську лімфому (NHL). Термін "лімфома" стосується гетерогенної групи новоутворень, які виникають у ретикулоендотеліальній і лімфатичній системах. "NHL" стосується злоякісної моноклональної проліферації лімфоїдних клітин у центрах імунної системи, включаючи лімфатичні вузли, кістковий мозок, селезінку, печінку і шлунково-кишковий тракт. Приклади NHL включають лімфому із клітин мантійної зони (MCL), лімфоцитарну лімфому із проміжним ступенем диференціювання, проміжну лімфоцитарну лімфому (ILL), дифузійну слабодиференційовану лімфоцитарну лімфому (PDL), центроцитарну лімфому, дифузійну дрібноклітинну лімфому із розщепленими ядрами (DSCCL), фолікулярну лімфому і будь-який тип лімфом із клітин мантійної зони, які можна знайти під мікроскопом (нодулярну, дифузійну і бластну лімфому із клітин мантійної зони), але не обмежуються цим. Приклади захворювань і порушень, які асоційовані з або які характеризуються небажаним ангіогенезом, включають запальні захворювання, аутоімунні захворювання, вірусні захворювання, спадкові захворювання, алергічні захворювання, бактеріальні захворювання, неоваскулярні захворювання очей, хоріоїдальні неоваскулярні захворювання, неоваскулярні захворювання сітківки і рубеоз (неоваскуляризацію кута передньої камери ока), але не обмежуються цим. Конкретні приклади захворювань і порушень, які асоційованих з або які характеризуються небажаним ангіогенезом, включають артрит, ендометріоз, хворобу Крона, серцеву недостатність, серцеву недостатність на пізніх стадіях захворювання, порушення функції нирок, ендотоксемію, синдром токсичного шоку, остеоартрит, реплікацію ретровірусів, виснаження, менінгіт, викликаний діоксидом кремнію, фіброз, фіброз, викликаний вдиханням азбестового пилу, ветеринарне захворювання, гіперкальцемію, яка супроводжує злоякісну пухлину, інсульт, циркуляторний шок, періодонтит, гінгівіт, макроцитарну анемію, рефрактерну анемію і 5q-делеційний синдром, але не обмежуються цим. Приклади больових станів включають больові стани, описані в публікації патенту США № 2005/0203142, яка опублікована 15 вересня 2005, яка включена в даний документ шляхом посилання, але не обмежуються цим. Конкретні типи больового стану включають ноцицептивний біль, нейропатичний біль, змішаний біль із ноцицептивним і нейропатичним 21 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 60 болем, вісцеральний біль, мігрень, головний біль і післяопераційний біль, але не обмежуються цим. Приклади ноцицептивного болю включають біль, пов'язаний із хімічними або термічними опіками, порізами на шкірі, забитими місцями шкіри (синцями), остеоартритом, ревматоїдним артритом, тендонітом, і міофасціальний біль, але не обмежуються цим. Приклади нейропатичного болю включають CRPS типу I, CRPS типу II, рефлекторну симпатичну дистрофію (RSD), рефлекторну нейроваскулярну дистрофію, рефлекторну дистрофію, синдром симпатично зберігаючого болю, каузалгію, атрофію кісток Судека, алгонейродистрофію, синдром плече-рука, посттравматичну дистрофію, невралгію трійчастого нерва, постгерпетичну невралгію, біль, пов'язаний із раковим захворюванням, фантомний біль у кінцівках, фіброміалгію, синдром хронічної втоми, біль при травмі спинного мозку, центральний постінсультний біль, радикулопатію, діабетичну нейропатію, постінсультний біль, нейропатію при сифілісі і інші хворобливі нейропатичні стани, такі як стани, викликані лікарськими препаратами, такими як вінкристин і велкейд, але не обмежуються цим. Як використовуються в даному документі, терміни "комплексний регіонарний больовий синдром", "CRPS" і "CRPS і пов'язані синдроми", означають хронічний больовий синдром, який характеризується одним або більше із наступного: болем, спонтанним або індукованим, включаючи алодинію (больову реакцію на стимул, яка звичайно не є больовою) і гіпералгезію (посилену реакцію на стимул, яка звичайно є лише злегка больовою); болем, який є диспропорційним відносно події, яка її викликала (наприклад, сильним болем протягом багатьох років після розтягування гомілковостопного суглоба); регіональним болем, який не обмежується по ходу одного периферичного нерва; і автономною дисрегуляцією (наприклад, набряком, зміною кровотоку і гіпергідрозом), яка супроводжує трофічну зміну шкіри (аномалії росту волосся і нігтів і шкірні виразки). Приклади MD і пов'язаних синдромів включають захворювання, описані в публікації патенту США № 2004/0091455, що опублікована 13 травня 2004, яка включена в даний документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають атрофічну (суху) MD, ексудативну (вологу) MD, вікову макулопатію (ARM), хоріоїдальну неоваскуляризацію (CNVM), відшарування пігментного епітелію сітківки (PED) і атрофію пігментного епітелію сітківки (RPE), але не обмежуються цим. Приклади шкірних захворювань включають захворювання, описані в публікації патенту США № 2005/0214328А1, що опублікована 29 вересня 2005, яка включена в даний документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають кератози і пов'язані симптоми, шкірні захворювання або порушення, які характеризуються підвищеним ростом епідермісу, акне і зморшки, але не обмежуються цим. Використовуваний у даному документі термін "кератоз" стосується будь-якого ураження в епідермісі із чітко вираженою наявністю осередкового надлишкового росту рогового шару, включаючи актинічний кератоз, себорейний кератоз, кератоакантому, фолікулярний кератоз (хвороба Дар'є), інвертований фолікулярний кератоз, долонно-підошовну кератодерму (PPK, кератоз долонь і стоп), кератоз повік і штукатурний кератоз, але не обмежуючи цим. Термін "актинічний кератоз" також стосується старечого кератозу, сенільного кератозу, старечих бородавок, старечих плоских бородавок, сонячного кератозу, кератодерми або кератоми. Термін "себорейний кератоз" також стосується себорейних бородавок, старечих бородавок або базально-клітинної папіломи. Для кератозу характерний один або більше із наступних симптомів: грубий зовнішній вигляд, лускаті, еритематозні папули, бляшки, спікули або вузлики на відкритих поверхнях (наприклад, обличчі, руках, вухах, шиї, ногах і в області грудної клітки), розростання кератину, які називаються як рогові кератоми, гіперкератоз, телеангіектазії, еластоз, пігментовані висипання, акантоз, паракератоз, дискератози, папіломатоз, гіперпігментація базальних клітин епідермісу, клітинна атипія, мітотичні фігури, аномальна клітинна адгезія, щільні запальні інфільтрати і невелика частина плоскоклітинних карцином. Приклади шкірних хвороб або порушень, які характеризуються надлишковим ростом епідермісу, включають будь-які стани, захворювання або порушення із чітко вираженою наявністю надлишкового росту епідермісу, включаючи, без обмежень, інфекції, які супроводжують вірус папіломи, арсенікальні кератози, симптом Лесера-Трелата, бородавкову дискератому (WD), пучкоподібне волосся (TS), варіабельну еритрокератодермію (EKV), іхтіоз плоду (іхтіоз Арлекіна), вроджену вузлуватість пальців, шкірну меланоакантому, порокератоз, псоріаз, плоскоклітинну карциному, зливний і ретикулярний папіломатоз (CRP), м'які бородавки, рогову кератому, хворобу Коудена (синдром множинної гамартоми), папульозний дерматоз чорношкірих (DPN), синдром епідермального невусу (ENS), іхтіоз вульгарний, молюск контагіозний, вузлувате пруриго і чорний акантоз (AN), але не обмежуються цим. 22 UA 113750 C2 5 10 15 20 25 30 35 40 45 50 55 Приклади захворювань легенів включають захворювання, описані в публікації патенту США № 2005/0239842А1, що опублікована 27 жовтня 2005, яка включена в даний документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають легеневу гіпертензію і пов'язані порушення. Приклади легеневої гіпертензії і пов'язаних порушень включають: первинну легеневу гіпертензію (PPH); вторинну легеневу гіпертензію (SPH); сімейну форму РРН; спорадичну РРН; прекапілярну легеневу гіпертензію; легеневу артеріальну гіпертензію (РАН); гіпертензію легеневої артерії; ідіопатичну артеріальну гіпертензію; тромботичну легеневу артеріопатію (ТРА); плексогенну легеневу артеріопатію; легеневу гіпертензію функціонального класу I-IV; і легеневу гіпертензію, яка супроводжує, має відношення до або вторинна до дисфункції лівого шлуночка, хвороби мітрального клапана, констриктивному перикардиту, стенозу аорти, кардіоміопатії, медіастинальному фіброзу, аномальному дренажу легеневої вени, венооклюзивному захворюванню легенів, колагенової хвороби судин, вродженому захворюванню серця, ВІЛ-інфекції, впливу лікарських препаратів і токсинів, таких як фенфлураміни, вродженому пороку серця, легенево-венозної гіпертензії, хронічному обструктивному захворюванню легенів, інтерстиціальному захворюванню легенів, порушенню дихання у сні, синдрому альвеолярної гіповентиляції, тривалому впливу високогірних умов, захворюванню легенів у немовлят, альвеолярно-капілярної дисплазії, хвороби серповидних еритроцитів, інших порушень коагуляції, хронічної тромбоемболії, захворюванню з’єднувальної тканини, вовчака, включаючи системний і шкірний вовчак, шистосомозу, саркоїдозу або легеневому капілярний гемангіоматозу, але не обмежуються цим. Приклади захворювань, викликаних вдиханням азбестового пилу, включають захворювання, описані в публікації патенту США № 2005/0100529, що опублікована 12 травня 2005, яка включена в даний документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають мезотеліому, асбестоз, злоякісну плевральну ефузію, доброякісну ексудативну ефузію, плевральні бляшки, кальциноз плеври, дифузійне плевральне ущільнення, округлий ателектаз, фіброзні маси і рак легенів, але не обмежуються цим. Приклади паразитарних захворювань включають захворювання, описані в публікації патенту США № 2006/0154880, що опублікована 13 липня 2006, яка включена в даний документ шляхом посилання, але не обмежуються цим. Паразитарні захворювання включають захворювання і порушення, викликані внутрішньоклітинними паразитами людини, такими як, без обмежень, P. falcifarium, P. ovale, P. vivax, P. malariae, L. donovari, L. infantum, L. aethiopica, L. major, L. tropica, L. mexicana, L. braziliensis, T. Gondii, B. microti, B. divergens, B. coli, C. parvum, C. cayetanensis, E. histolytica, I. belli, S. mansonii, S. haematobium, Trypanosoma ssp., Toxoplasma ssp. і O. volvulus. Також включаються інші захворювання і порушення, викликані внутрішньоклітинними паразитами, які не стосуються людини, такими як, без обмежень, Babesia bovis, Babesia canis, Babesia Gibsoni, Besnoitia darlingi, Cytauxzoon felis, Eimeria ssp., Hammondia ssp. і Theileria ssp. Конкретні приклади включають малярію, бабезіоз, трипаносомоз, лейшманіоз, токсоплазмоз, менінгоенцефаліт, кератит, амебіаз, гіардіаз, криптоспоридіоз, ізоспороз, циклоспороз, мікроспоридіоз, аскаридоз, трихоцефалез, анкілостомоз, стронгілоїдоз, токсокароз, трихінельоз, лімфатичний філяріоз, онхоцеркоз, філяріоз, шистосомоз, і дерматит, викликаний шистосомами, які паразитують у тварин, але не обмежуються цим. Приклади імунодефіцитних розладів містять у собі захворювання, описані в публікації патенту США № 2006/0188475, яка опублікована 24 серпня 2006, але не обмежуються цим. Конкретні приклади включають недостатність аденозиндеамінази, дефіцит антитіл із нормальним або підвищеним рівнем Ig-ів, атаксію-телеангіектазію, непідтверджений лімфоцитарний синдром, загальний варіабельний імунодефіцит, недостатність Ig із гіперпродукцією IgМ, делеції важкого ланцюга Ig, недостатність IgA-типу, імунодефіцит із тимомою, ретикулярний дисгенез, синдром Незелофа, селективну недостатність субкласу IgG, тимчасову гіпогаммаглобулінемію немовлят, синдром Віскотта-Алдриха; Х-зчеплену агаммаглобулінемію, Х-зчеплений важкий комбінований імунодефіцит, але не обмежуються цим. Приклади розладів ЦНС включають, не обмежуючи цим, захворювання, описані в публікації патенту США № 2005/0143344, що опублікована 30 червня 2005, яка включена в цей документ шляхом посилання. Конкретні приклади охоплюють аміотрофічний бічний склероз, хворобу Альцгеймера, хворобу Паркінсона, хворобу Гантінгтона, розсіяний склероз, інші нейроімунологічні розлади, такі як синдром Туретта, делірій, або незначні порушення у свідомості, які мають місце протягом короткого періоду часу, і амнестичний розлад, або часткові порушення пам'яті, які мають місце за відсутності інших порушень центральної нервової системи, але не обмежуються цим. 23 UA 113750 C2 5 10 15 20 25 Приклади ушкоджень ЦНС і пов'язаних синдромів включають ушкодження, описані в публікації патенту США № 2006/0122228, що опублікована 8 червня 2006, яка включена в даний документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають ушкодження/порушення ЦНС і пов'язані синдроми, включаючи, без обмежень, первинне ушкодження головного мозку, вторинне ушкодження головного мозку, травматичне ушкодження головного мозку, фокальне ушкодження головного мозку, дифузійне аксональне ушкодження, травму голови, струс, синдром після струсу, церебральну контузію і травматичну рану, субдуральну гематому, епідермальну гематому, посттравматичну епілепсію, хронічний вегетативний стан, повний SCI, неповний SCI, гострий SCI, підгострий SCI, хронічний SCI, синдром центральної частини спинного мозку, синдром Брауна-Секварда, синдром передньої частини спинного мозку, синдром мозкового конуса, синдром "кінського хвоста", нейрогенний шок, спінальний шок, змінену свідомість, головний біль, нудоту, блювання, втрату пам'яті, запаморочення, диплопію, розпливчастий зір, емоційну лабільність, порушення сну, дратівливість, нездатність до концентрації, нервовість, поведінкові порушення, когнітивний дефіцит, і судоми, але не обмежуються цим. Приклади атеросклерозу і пов'язаних станів включають захворювання, описані в публікації патенту США № 2002/0054899, що опублікована 9 травня 2002, яка включена в цей документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають усі форми станів, які включають атеросклероз, зокрема, рестеноз після втручання на судинах, такого як ангіопластика, стентування, атеректомія і трансплантація, але не обмежуються цим. У даному документі передбачаються усі види втручань на судинах, включаючи втручання на судинах, які мають місце при захворюваннях серцево-судинної системи і нирок, такі як, без обмежень, ангіопластика ниркових судин, перкутанне коронарне втручання (PCI), перкутанна транслумінальна коронарна ангіопластика (PTCA), перкутанна транслумінальна ангіопластика сонної артерії (PTA), аортокоронарне шунтування, ангіопластика із імплантацією стента, периферичне перкутанне транслумінальне втручання на клубовій, стегновій або підколінній артеріях, і хірургічне втручання із використанням імпрегнованих штучних трансплантатів. У наступній таблиці наводиться перелік основних системних артерій, для яких може бути потрібне лікування, усі із яких передбачаються в даному документі: 30 Артерія пахвова плечова плечоголовна черевна загальна сонна загальна клубова коронарна глибока стегнова пальцева тильна артерія ступні зовнішня сонна зовнішня клубова стегнова шлункова печінкова нижня брижова внутрішня сонна внутрішня клубова ліва шлункова середня сакральна яєчникова долонна дуга малогомілкова підколінна великогомілкова легенева радіальна Області тіла, які вона постачає кров'ю плече і пахвова западина верхня частина руки голова, шия і рука розділяється на ліву шлункову, селезінкову і печінкову артерії шия розділяється на зовнішню і внутрішню клубові артерії серце стегно пальці ступні шия і зовнішні області голови стегнова артерія стегно шлунок печінка, жовчний міхур, підшлункова залоза і дванадцятипала кишка спадна кишка, пряма кишка і стінка таза шия і внутрішні області голови пряма кишка, сечовий міхур, зовнішні статеві органи, сідниці, матка і піхва стравохід і шлунок крижі яєчники рука ікра коліно ікра легені передпліччя 24 UA 113750 C2 ниркова селезінкова підключична верхня брижова тестикулярна ліктьова 5 10 15 20 25 30 35 40 45 50 нирки шлунок, підшлункова залоза і селезінка плече підшлункова залоза, тонкий кишечник, висхідна і поперечна ободова кишка сім’яники лікоть Приклади порушень сну і пов'язаних синдромів включають стани, розкриті в публікації патенту США № 2005/0222209 A1, що опублікована 6 жовтня 2005, яка включена в даний документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають хропіння під час сну, апное під час сну, безсоння, нарколепсію, синдром "неспокійних ніг", жахи під час сну, ходіння під час сну, прийом їжі під час сну, і порушення сну, пов'язані із хронічними неврологічними або запальними станами, але не обмежуються цим. Хронічні неврологічні або запальні стани включають комплексний регіонарний больовий синдром, хронічний біль у нижньому відділі спини, м’язовоскелетний біль, артрит, радикулопатію, біль, який супроводжує рак, фіброміалгію, синдром хронічної втоми, вісцеральний біль, біль у сечовому міхурі, хронічний панкреатит, нейропатії (діабетичні, постгерпетичні, травматичні або запальні), і нейродегенеративні порушення, такі як хвороба Паркінсона, хвороба Альцгеймера, аміотрофічний бічний склероз, розсіяний склероз, хвороба Гантінгтона, брадикінезія; ригідність м'язів; паркінсонічний тремор; паркінсонічна хода; "феномен застигання"; депресія; послаблення довгострокової пам'яті, синдром Рубінштейна-Тайбі (RTS); деменція; постуральну нестабільність; гіпокінетичні розлади; розлади, опосередковані синуклеїном; полісистемні атрофії; стриатонігріальну дегенерацію; оливопонтоцеребральна атрофія; хворобу Ши-Драгера; хворобу моторних нейронів із ознаками паркінсонізму; деменцію із тільцями Леві; Таупатологічні розлади; прогресуючий над'ядерний параліч; кортикобазальну дегенерацію; фронтотемпоральну деменцію; амілоїдні патологічні розлади; помірне когнітивне порушення; хворобу Альцгеймера із паркінсонізмом; хворобу Вільсона; хворобу Галлервордена-Шпатца; хворобу Хедіака-Гагаші; спіноцеребральну атаксію SCA-3; Х-зчеплену дистонію-паркінсонізм; пріонову хворобу; гіперкінетичні розлади; хорею; балізм; дистонічний тремор; аміотрофічний бічний склероз (ALS); травму ЦНС і міоклонічні судоми, але не обмежуються цим. Приклади гемоглобінопатії і пов'язаних синдромів включають захворювання, описані в публікації патенту США № 2005/0143420А1, що опублікована 30 червня 2005, яка включена в даний документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають гемоглобінопатію, серпоподібноклітинну анемію, і будь-які інші розлади, пов'язані із диференціюванням CD34+клітин, але не обмежуються цим. Приклади туберкульозу (ТВ) і пов'язаних розладів включають захворювання, описані в публікації згідно із PCT № WO 2010/093588, що опублікована 9 лютого 2010, яка включена в даний документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають легеневий TB і позалегеневий ТВ (віддалені TB ураження), як, наприклад, без обмежень, урогенітальний ТВ (наприклад, нирковий ТВ), туберкульозний менінгіт, військовий ТВ, туберкульозний перитоніт, туберкульозний перикардит, туберкульозний лімфаденіт, ТВ кісток і суглобів, шлунковокишковий TB, і ТВ печінки, але не обмежуються цим. У деяких варіантах здійснення, у даному документі надаються способи лікування, попередження, і/або керування розвитком симптомів, які супроводжують TB. Приклади включають кашель, диспное, прикореневу лімфаденопатію, сегментарний ателектаз, набрякання лімфатичних вузлів, лобарний ателектаз, утворення порожнини в легені, гарячковий стан, безперервний головний біль, нудоту, гіперсомнію, патологічне заціпеніння (ступор), кому, ригідність потилиці, слабість і дисфорію, але не обмежуються цим. Розлади, пов'язані із TB, включають інші мікобактеріальні інфекції, симптоми яких нагадують симптоми TB. Приклади таких розладів включають розлади, викликані мікобактеріальним комплексом M. avium (MAC; M. avium і M. intracellulare), мікобактеріями M. kansasii, M. xenopy, M. marinum, M. ulcerans, M. leprae, і мікобактеріальним комплексом M.fortuitum (M. fortuitum і M. chelonei), але не обмежуються цим. Приклади розладів, викликаних цими мікобактеріями, включають легеневі захворювання, лімфаденіт, шкірні хвороби, рани, і інфекції, зумовлені стороннім тілом, але не обмежуються цим. У деяких варіантах здійснення, також охопленими в даному документі є лікування, попередження і/або керування перебігом інших гранулематозних хвороб. Приклади таких захворювань включають викликані збудниками інфекції захворювання, такі як гістоплазмоз, криптококова інфекція, шистосомоз, і лейшманіоз; викликані алергічними реакціями захворювання, такі як бериліоз; викликані неінфекційними агентами захворювання, 25 UA 113750 C2 5 10 15 20 25 30 35 такі як аспіраційна пневмонія і реакція на стороннє тіло; генетичні захворювання, такі як хронічне гранулематозне захворювання; і захворювання незрозумілої етіології, такі як саркоїдоз, хвороба Крона і лихоманка котячих подряпин, але не обмежуються цим. Приклади розладів, пов'язаних із TNF, включають захворювання, описані в міжнародних заявках WO 98/03502 і WO 98/54170, обидві із яких у повному своєму обсязі включені в даний документ шляхом посилання, але не обмежуються цим. Конкретні приклади включають ендотоксемію або синдром токсичного шоку; кахексію; респіраторний дистрес-синдром у дорослих; захворювання, пов'язані із резорбцією кісток, такі як артрит; гіперкальцемію; реакцію "трансплантат проти хазяїна"; церебральну малярію; запалення; ріст пухлини; хронічні запальні захворювання легенів; реперфузійне ушкодження; інфаркт міокарда; інсульт; циркуляторний шок; ревматоїдний артрит; хворобу Крона; ВІЛ-інфекцію і СНІД; інші порушення, такі як ревматоїдний артрит; ревматоїдний спондиліт; остеоартрит; псоріатичний артрит і інші артритичні стани; септичний шок; сепсис; ендотоксичний шок; синдром "трансплантат проти хазяїна"; виснаження; хвороба Крона; виразковий коліт; розсіяний склероз; системний червоний вовчак; ENL при проказі; ВІЛ; СНІД і опортуністичні інфекції при СНІДі; порушення, такі як септичний шок, сепсис, ендотоксичний шок, гемодинамічний шок і септичний синдром; постішемічне реперфузійне ушкодження; малярію; мікобактеріальну інфекцію; менінгіт; псоріаз; застійну серцеву недостатність; фіброз легенів; кахексію; відторгнення трансплантата; онкогенні або ракові стани; астму; аутоімунне захворювання; променеві ураження і альвеолярне ушкодження в результаті гіпероксії; вірусні інфекції, такі як інфекції, викликані герпес-вірусами; вірусний кон'юнктивіт; або атопічний дерматит, але не обмежуються цим. В інших варіантах здійснення, також охопленим є застосування складів, композицій або лікарських форм, наданих у даному документі, у різних імунологічних застосуваннях, зокрема, як ад'ювантів для вакцин, особливо, ад’ювантів для протиракових вакцин, які розкриті в публікації патенту США № 2007/0048327, що опублікована 1 березня 2007, яка у повному своєму обсязі включена в даний документ шляхом посилання. Дані варіанти здійснення також стосуються застосувань композицій, складів або лікарських форм, представлених у даному документі, у комбінації із вакцинами для лікування або попередження раку або інфекційних захворювань, і до інших різних застосувань, таких як зниження або десенсибілізація алергічних реакцій. 5. Приклади Варіанти здійснення, представлені в даному документі, можна зрозуміти повніше при звертанні до наступних прикладів. Дані приклади призначені для ілюстрації фармацевтичних композицій і лікарських форм, представлених у даному документі, і ніяким чином не є обмежуючими. 5.1. Склад серцевини Таблиця 1 ілюструє склад серії і склад пероральної лікарської форми для серцевинної частини, яка містить сполуку А. Таблиця 1 Торгова назва Сполука А 316, Fast-Flo Avicel РH-102 Ac-Di-Sol Тривіальна назва Моногідрат лактози Мікрокристалічна целюлоза Кроскармелоза натрію Стеарат магнію Масовий відсоток 10,00 % 60,00 % 26,25 % 3,00 % 0,75 % 100,0 % 40 45 Склад серцевини виготовляють відповідно до масового відсотка, наведеного вище. У таблиці значення для сполуки А приймається, виходячи із дієвості 100 % мас./мас. Фактично масу, яка вводиться, коректують залежно від привласненого ступеня чистоти і вмісту води. Вміст лактози коректують так, щоб зберегти масу складу однієї серії. 5.2. Склади для нанесення оболонки 5.2.1. Склад для нанесення оболонки 1 Три склади для нанесення оболонки, які мають, відповідно, рожевий, коричневий і бежевий кольори, виготовляють із використанням інгредієнтів, наведених у таблиці 2 нижче: 26 UA 113750 C2 Таблиця 2 Інгредієнт (% мас./мас.) Полівініловий спирт Макрогол /ПЕГ 3350 Тальк Діоксид титану Червоний оксид заліза Жовтий оксид заліза Чорний оксид заліза 5 Рожевий 40,0 20,2 14,8 24,6 0,4 Коричневий 40,0 20,2 14,8 12,13 1,22 11,65 Бежевий 40,0 20,2 14,8 22,99 1,18 0,43 0,4 5.2.2. Склад для нанесення оболонки 2 Три склади для нанесення оболонки, які мають, відповідно, рожевий, коричневий і бежевий кольори, виготовляють із використанням інгредієнтів, наведених у таблиці 3 нижче: Таблиця 3 Інгредієнт (% мас./мас.) Моногідрат лактози Гіпромелоза 6сР Макрогол/ПЕГ 3350 Триацетин Діоксид титану Червоний оксид заліза Жовтий оксид заліза Чорний оксид заліза 10 Рожевий 33,0 31,0 5,0 4,0 26,5 0,5 Коричневий 33,0 31,0 5,0 4,0 12,47 2,1 12,43 Бежевий 31,0 [уточнене?] 31,0 5,0 4,0 26,0 [уточнене?] 1,7 0,6 0,7 5.2.3. Склад для нанесення оболонки 3 Три склади для нанесення оболонки, які мають, відповідно, рожевий, коричневий і бежевий кольори, виготовляють із використанням інгредієнтів, наведених у таблиці 4 нижче: Таблиця 4 Інгредієнт (% мас./мас.) Полідекстроза FCC Гіпромелоза 15сР Тальк Мальтодекстрин Середньоланцюгові тригліцериди Діоксид титану Червоний оксид заліза Жовтий оксид заліза Чорний оксид заліза 15 Рожевий 26,0 31,0 7,0 5,0 2,0 28,5 0,5 Коричневий 26,0 31,0 7,0 5,0 2,0 14,47 2,1 12,43 Бежевий 26,0 31,0 7,0 5,0 2,0 26,0 1,7 0,6 0,7 5.2.4. Склад для нанесення оболонки 4 Три склади для нанесення оболонки, які мають, відповідно, рожевий, коричневий і бежевий кольори, виготовляють із використанням інгредієнтів, наведених у таблиці 5 нижче: 27 UA 113750 C2 Таблиця 5 Інгредієнт (% мас./мас.) Полідекстроза FCC Гіпромелоза 15сР Тальк Мальтодекстрин Діоксид титану Червоний оксид заліза Жовтий оксид заліза Чорний оксид заліза 5 Рожевий 26,0 31,0 7,0 5,0 30,5 0,5 Коричневий 26,0 31,0 7,0 5,0 16,47 2,1 12,43 Бежевий 26,0 31,0 7,0 5,0 28,0 1,7 0,6 0,7 5.2.5. Склад для нанесення оболонки 5 Три склади для нанесення оболонки, які мають, відповідно, рожевий, коричневий і бежевий кольори, виготовляють із використанням інгредієнтів, наведених у таблиці 6 нижче: Таблиця 6 Інгредієнт (% мас./мас.) Полідекстроза FCC Гіпромелоза 15сР Тальк Мальтодекстрин Триацетин Діоксид титану Червоний оксид заліза Жовтий оксид заліза Чорний оксид заліза 10 Рожевий 26,0 31,0 7,0 5,0 4,0 26,5 0,5 Коричневий 26,0 31,0 7,0 5,0 4,0 12,47 2,1 12,43 Бежевий 26,0 31,0 7,0 5,0 4,0 24,0 1,7 0,6 0,7 5.2.6. Склад для нанесення оболонки 6 Три склади для нанесення оболонки, які мають, відповідно, рожевий, коричневий і бежевий кольори, виготовляють із використанням інгредієнтів, наведених у таблиці 7 нижче: Таблиця 8 Інгредієнт (% мас./мас.) Полідекстроза FCC Гіпромелоза 15сР Тальк Мальтодекстрин Середньоланцюгові тригліцериди Діоксид титану Червоний оксид заліза Жовтий оксид заліза Чорний оксид заліза 15 Рожевий 13,0 44,0 7,0 5,0 4,0 26,5 0,5 Коричневий 13,0 44,0 7,0 5,0 4,0 12,47 2,1 12,43 Бежевий 13,0 44,0 7,0 5,0 4,0 24,0 1,7 0,6 0,7 5.3. Склад таблетки (Серцевина + Оболонка) Повний склад таблетки, який включає серцевину і оболонку, виготовляють із використанням інгредієнтів, наведених у таблиці 8 нижче: 28
ДивитисяДодаткова інформація
Назва патенту англійськоюFormulations of (+)-2-[1-(3-ethoxy-4-methoxy-phenyl)-2-methanesulfonyl-ethyl]-4-acetyl aminoisoindoline-1,3-dione
Автори англійськоюBhat, Steenivas, S., Kelly, Michael, T.
Автори російськоюБхат Среенивас С., Кэлли Майкл Т.
МПК / Мітки
МПК: A61K 9/20, A61K 31/4035
Мітки: склад, +)-2-[1-(3-етокси-4-метоксифеніл)-2-метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діону
Код посилання
<a href="https://ua.patents.su/33-113750-sklad-2-1-3-etoksi-4-metoksifenil-2-metansulfoniletil-4-acetilaminoizoindolin-13-dionu.html" target="_blank" rel="follow" title="База патентів України">Склад (+)-2-[1-(3-етокси-4-метоксифеніл)-2-метансульфонілетил]-4-ацетиламіноізоіндолін-1,3-діону</a>
Попередній патент: Композиція для назального застосування з покращеною стабільністю
Наступний патент: Спосіб і пристрій для відновлення залізооксидовмісних сировинних матеріалів
Випадковий патент: Спосіб отримання катіонних крохмалів












