Спосіб лікування staphylococcus aureus
Номер патенту: 114286
Опубліковано: 25.05.2017
Автори: Філлер Скотт Дж., Хеннесі Джон П., Джр., Фу Юе, Йіман Майкл Р., Едвардс Джон Е., Джр., Ібрагім Ашраф С.
Формула / Реферат
1. Спосіб лікування ссавця, що має інфекцію шкіри або м'яких тканин, що викликається Staphylococcus aureus, який включає етапи:
введення згаданому ссавцю імуногенної кількості вакцини, яка включає виділений білок Als3, що складається з амінокислотної послідовності SEQ ID NO: 2 та фармацевтично прийнятного середовища.
2. Спосіб за п. 1, який відрізняється тим, що згаданий білок Als3 включає білок Als3, що складається з амінокислотної послідовності SEQ ID NO: 2 та отриманий з штаму Candida, вибраного з групи, що складається з Candida albicans, Candida krusei, Candida tropicalis, Candida glabrata та Candida parapsilosis.
3. Спосіб за п. 1, який відрізняється тим, що згаданий білок включає Als3p Candida albicans.
4. Спосіб за п. 1, який відрізняється тим, що згаданий білок включає N-кінцевий домен Als3p Candida albicans або його імуногенний фрагмент.
5. Спосіб за п. 1, який відрізняється тим, що згаданим виділеним білком є білок Als3p, який відрізняється тим, що амінокислотна послідовність згаданого Als3p складається з SEQ ID NO: 2.
6. Спосіб за п. 1, який відрізняється тим, що згаданим білком є імуногенний фрагмент білка Als3p, причому амінокислотна послідовність згаданого Als3p складається з SEQ ID NO: 2.
7. Спосіб за п. 1, який відрізняється тим, що згаданим Staphylococcus aureus є штам MRSA Staphylococcus aureus.
8. Спосіб за п. 1, який відрізняється тим, що згаданим Staphylococcus aureus є штам MSSA Staphylococcus aureus.
9. Спосіб за п. 1, який відрізняється тим, що згаданим Staphylococcus aureus є стійкий до ванкоміцину (VRSA) або стійкий до даптоміцину (DRSA) штам Staphylococcus aureus.
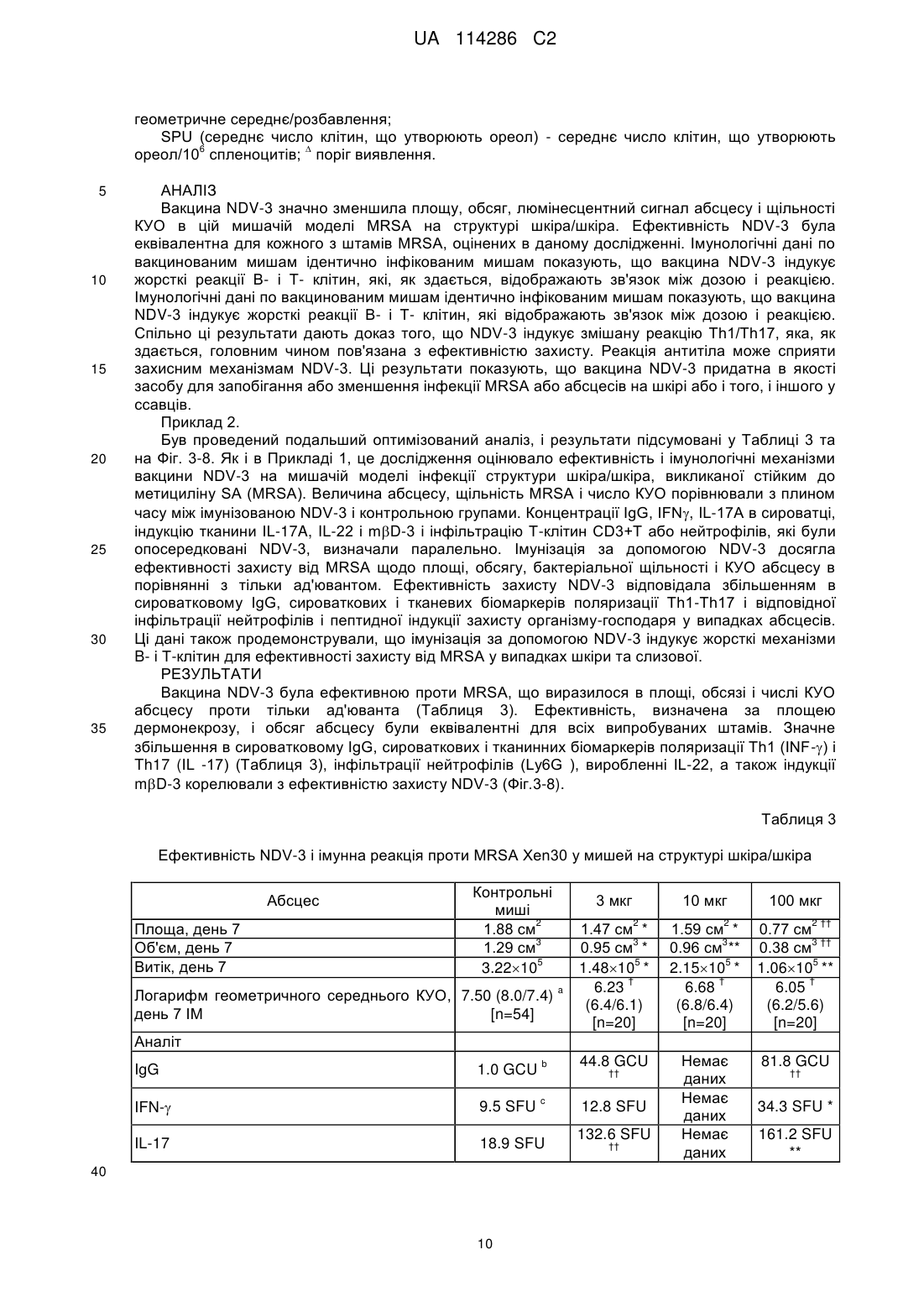
10. Спосіб за п. 1, який відрізняється тим, що згаданий білок кон'югований з носієм.
11. Спосіб за п. 10, який відрізняється тим, що згаданий носій включає гемоціанін фіссурелли (KLH), CRM197, токсоїд правця, токсоїд дифтерії, фрагменти ентеротоксину В або білковий комплекс зовнішньої мембрани N. meningitides.
12. Спосіб за п. 10, який відрізняється тим, що згаданим носієм є фаг, дріжджі, вірус, віросома або рекомбінантна вірусоподібна частинка.
13. Спосіб за п. 1, який відрізняється тим, що згадану вакцину вводять внутрішньом'язово, підшкірно, внутрішньошкірно, перорально або сублінгвально або призначають для інгаляції у формі мікрочастинок.
14. Спосіб за п. 1, який відрізняється тим, що згадане введення крім того включає введення бустер-дози.
15. Спосіб за п. 1, який відрізняється тим, що згадана вакцина включає імуностимулюючий ад'ювант.
16. Спосіб за п. 1, крім того включає введення антибіотика.
17. Спосіб за п. 16, який відрізняється тим, що згаданий антибіотик змішують в одній лікарській формі або вводять спільно із згаданою вакциною.
18. Спосіб за п. 1, який відрізняється тим, що згадану вакцину вводять як фармацевтичну композицію.
Текст
Реферат: Винахід стосується способу лікування ссавця, що має інфекцію шкіри або м'яких тканин, що викликається Staphylococcus aureus, який включає введення згаданому ссавцю імуногенної кількості вакцини, яка включає виділений білок Als3p, що складається з амінокислотної послідовності SEQ ID NO: 2 та фармацевтично прийнятного середовища. UA 114286 C2 (12) UA 114286 C2 UA 114286 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднені заявки Справжня заявка претендує на пріоритет попередньої заявки США № 61/510,896, поданої 22 липня 2011 року, яка включена в даний документ шляхом посилання. Заява про дослідження, профінансоване федеральним урядом Справжній винахід був профінансований за рахунок гранту № W81XWH-10-2-0035 Міністерства оборони, присудженого Службою зі закупівель медичних досліджень Збройними силами США, 820 Чендлер Стріт, Форт-Детрік MD 21702-5014, яка також виступає в якості відомства управління закупівлями. Зміст розкритої тут інформації необов'язково відображає позицію або політику Уряду, і ніяке офіційне підтвердження не повинно передбачатися. Уряд має певні права на винахід. Передумови для створення винаходу Винахід відноситься до вакцин проти золотистого стафілококу (Staphylococcus aureus). Staphylococcus aureus є провідною причиною шкірних інфекцій, включаючи целюліт і фурункулез, і входить до числа найпоширеніших причин бактеріємії. Штами S. aureus, які проявляють фенотип, стійкий до метициліну (MRSA), є основними причинами медичних та громадських інфекцій, включаючи інвазивне захворювання імунокомпетентних клітин господарів, придушення імунної реакції (наприклад, нейтропенія, трансплантати твердого органу або кісткового мозку) і спадкові дисфункції імунної системи, що спричиняють зворотну шкірну інфекцію (наприклад, синдром Джобса, хронічне гранулематозне захворювання). Значний вплив MRSA на здоров'я суспільства представляє особливе занепокоєння у світлі високих показників смертності, пов'язаних з інвазивним захворюванням S. aureus навіть при відповідній протимікробній терапії (наприклад, 15-40 % при бактеріємії і ендокардиті). Збільшення числа випадків загрозливих для життя інфекцій і зниження чутливості до антибіотиків вимагають розробки ефективної вакцини, націленої на Staphylococcus aureus. Заявлений винахід виконує цю вимогу. Розкриття винаходу Загалом, винахід відноситься до способу вакцинації проти Staphylococcus aureus, який включає етапи: a) ідентифікації ссавця (наприклад, людини або ссавця, що не відноситься до людського роду, такого як домашня худоба, наприклад, корова, кінь, свиня або вівця, або домашній ссавець, наприклад, собака або кішка), що має ризик розвитку інфекції Staphylococcus aureus на шкірі або м'якій тканині; та b) введення згаданому ссавцю імуногенної кількості вакцини, що включає поліпептид, який містить виділений білок 3 (Als3p) агглютинино-подібної послідовності (Als) або його імуногенний фрагмент, у фармацевтично прийнятному середовищі. Приклади поліпептидів включають Als3p Candida albicans (наприклад, Als3p, показаний на Фіг. 1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2, або його імуногенний фрагмент). В інших варіантах здійснення поліпептид включає N-кінцевий домен Als3p Candida albicans або його імуногенний фрагмент. Розкритий тут спосіб особливо підходить для вакцинації від стійкого до метициліну штаму Staphylococcus aureus (MRSA). Розкритий тут спосіб також підходить для вакцинації від інших стійких до ліків штамів S. aureus (наприклад, стійких до ванкоміцину, стійких до даптоміцину і т.д.) або чутливих до метициліну штамів S. aureus (MSSA). В інших варіантах здійснення поліпептид кон'югований з носієм, таким як гемоцианін фіссурелли (KLH), CRM197, токсоїд правця, токсоїд дифтерії, фрагменти ентеротоксину B, білковий комплекс зовнішньої мембрани N. meningitides або будь-який інший білок-носій, що використовується в кон'югатних вакцинах в даній області. Такі носії також можуть включати фаг, дріжджі, вірус, віросому або рекомбіновану вірусоподібну частинку. Вакцину зазвичай вводять внутрішньом'язово, підшкірно, внутрішньошкірно, перорально або сублінгвально, або ж призначають для інгаляції у формі мікрочастинок . За бажанням, вакцину вводять як бустер-дозу. За бажанням, вакцина може включати імуностимулючий ад'ювант. В інших варіантах здійснення спосіб включає введення антибіотика проти S. aureus у поєднанні з вакциною, наприклад, коли антибіотик об'єднують в одній формі або вводять спільно з вакциною. У ще одному аспекті винахід пропонує спосіб вакцинації ссавця (наприклад, людини або ссавця, що не відноситься до людського роду, такого як домашня худоба, наприклад, корова, кінь, свиня або вівця, абодомашній ссавець, наприклад, собака або кішка) проти Staphylococcus aureus, що включає етапи: a) ідентифікація ссавця з ризиком розвитку інфекції Staphylococcus aureus на шкірі або м'якій тканині; та b) введення згаданому ссавцю ефективної кількості вакцини, що включає полінуклеотид (наприклад, виділений полінуклеотид), що кодує поліпептид, який включає Als3p, або його імуногенний фрагмент, введений в підходяще середовище доставки, яке може включати одно- або двохниткову ДНК або РНК, плазмід або вірусний вектор двохниткової ДНК, у фармацевтично прийнятному середовищі, при цьому полінуклеотид експресують in vivo, і ссавець генерує імунну реакцію. Вакцина, що містить 1 UA 114286 C2 5 10 15 20 25 30 35 40 45 50 55 60 полінуклеотид, активує імунну реакцію у ссавця, наприклад, продукування антитіл до Als3p, які проявляють специфічність до Als3p. У ще одному аспекті винахід пропонує виділений білок Als3 або його імуногенний фрагмент для використання в способі лікування або профілактики інфекції Staphylococcus aureus на шкірі або м'якій тканині у ссавця. У ще одному аспекті винахід пропонує вакцину, що включає виділений білок Als3 або його імуногенний фрагмент, для використання в способі лікування або профілактики інфекції Staphylococcus aureus на шкірі або м'якій тканині у ссавця. Такі Als3p, які підходять для приготування виділених білків або вакцин, включають ідентифіковані в Candida albicans, Candida krusei, Candida tropicalis, Candida glabrata та Candida parapsilosis, а також ті білки Alsp3, які ідентифіковані при пошуках в загальнодоступних базах даних. У ще одному аспекті винахід пропонує виділений білок Als3, причому амінокислотна послідовність виділеного білка Als3 складається з SEQ ID NO: 2. У ще одному аспекті винахід пропонує фармацевтичну композицію, що включає виділений білок Als3, причому амінокислотна послідовність виділеного білка Als3 складається з SEQ ID NO: 2, і фармацевтично прийнятний наповнювач. У ще одному аспекті винахід пропонує вакцину, що включає виділений білок Als3, причому амінокислотна послідовність виділеного білка Als3 складається з SEQ ID NO: 2. У деяких варіантах здійснення цей білок кон'югований з носієм, таким як гемоціанин фіссурелли (KLH), CRM197, токсоїд правця, токсоїд дифтерії, фрагменти ентеротоксину B, білковий комплекс зовнішньої мембрани N. meningitides або будь-який інший білок-носій, використовуваний в кон'югатних вакцинах в даній області. Такі носії також можуть включати фаг, дріжджі, вірус, віросому або рекомбіновану вірусоподібну частинку. Вакцину зазвичай вводять внутрішньом'язово, підшкірно, внутрішньошкірно, перорально або сублінгвально, або призначають для інгаляції у формі мікрочастинок. За бажанням, вакцину вводять як бустердозу. Вакцина, за вибором, може включати імуностимулюючий ад'ювант. В інших варіантах здійснення вакцина може включати поєднання виділеного білка Als3 і одного або кількох інших виділених білків Als, наприклад, похідних від штаму Candida, обраного з групи, що складається з Candida albicans, Candida krusei, Candida tropicalis, Candida glabrata та Candida parapsilosis. У ще одному аспекті винахід пропонує вакцину, що включає полінуклеотид (наприклад, виділений полінуклеотид), що кодує поліпептид, який включає Als3p, або його імуногенний фрагмент, введений в підходяще середовище доставки, яке може включати одно- або двохниткову ДНК або РНК, плазмід або вірусний вектор двохниткова ДНК, у фармацевтично прийнятному середовищі. Наприклад, імуногенна полінуклеотидна вакцина Als3, наприклад, нуклеїнокислотна послідовність, яка містить або складається з SEQ ID NO: 3 частково або повністю і яка підходить для використання в якості вакцини, може бути виготовлена, наприклад, з гена Als3 або його імуногенного фрагмента. Вакцина може крім того включати полінуклеотид, що кодує імуностимулюючий поліпептид, який експресований спільно з Als3p. Такі полінуклеотидні вакцини можуть бути приготовані як вакцини для ін'єкцій, наприклад, у формі фізіологічно прийнятних рідких розчинів або емульсій для введення полінуклеотиду. Полінуклеотид може бути пов'язаний з ліпосомами, такими як ліпосоми лецитину або іншими ліпосомами, відомими в даній галузі, такими як ліпосома нуклеїнової кислоти (наприклад, яка описана в опублікованій міжнародної заявці WO 93/24640), або полінуклеотид може бути пов'язаний з ад'ювантом. Ліпосоми, що включають катіонні ліпіди, спонтанно і швидко реагують з поліаніонами, такими як ДНК і РНК, результатом чого є комплекси ліпосоми /нуклеїнової кислоти, які захоплюють до 100 % полінуклеотиду. Крім цього, ці полікатіонні комплекси зливаються з клітинними мембранами, що призводить до доставки в клітини полінуклеотида, який обходить ферменти, що руйнуються, ліпосомного компартменту. В опублікованій міжнародної заявці WO 94/27435 описані композиції для генетичної імунізації, що включають катіонні ліпіди і полінуклеотиди. Переважно, можна використовувати агенти, які сприяють клітинному прийому полінуклеотидів, такі як іони кальцію, вірусні білки, агенти, що сприяють електропорації і трансфекції. Рідкі, а також ліофілізовані форми, які повинні бути відновлені, переважно включають буфери в кількостях, необхідних для підходящого регулювання pH розчину для ін'єкцій. У даному документі вирази "інфекція Staphylococcus aureus на шкірі або м'якій тканині", "інфекція Staphylococcus aureus на структурі шкіра/шкіра" використовуються взаємозамінно і відносяться до інфекції на шкірі або м'якій тканині (наприклад, целюліту, абсцесу м'якої тканини, дермонекрозу, міозиту або інших інфекцій), що є результатом надходження в організм S. aureus в місця, де шкіра порушена порізом, садном, укусом або іншою раною. У деяких випадках 2 UA 114286 C2 5 10 15 20 25 30 35 40 45 50 55 60 інфекція S. aureus на структурі шкіра/шкіра є результатом S. aureus, що живе в організмі, і може відбуватися спонтанно при відсутності видимого місця травми або рани на шкірі. Такі інфекції можуть впливати на шари шкіри або більш глибокі тканини, такі як м'язові і сполучні тканини (переплітається каркас тканини, який формує зв'язки, сухожилля та інші опорні структури тіла). Абсцеси шкіри також можуть з'являтися в тих областях шкіри, де організм боровся з інфекцією S. aureus. Більш важливими штамами S. aureus, відповідальними за інфекції на шкірі або м'якій тканині, є стійкий до антибіотиків Staphylococcus, відомий як стійкий до метицілліну Staphylococcus aureus (MRSA); стійкі до ванкоміцину і даптоміцину штами S. aureus також можуть викликати інфекцію на структурі шкіра /шкіра. MRSA стійкий до звичайних антибіотиків. Інфекція Staphylococcus aureus на структурах шкіра/шкіра також може бути викликана чутливим до метициліну Staphylococcus aureus (MSSA). Ссавці з ризиком розвитку інфекції S. aureus на шкірі або м'якій тканині можуть бути вилікувані в профілактичному режимі. Альтернативно, ссавці можуть отримувати лікування в присутності симптомів інфекції S. aureus на шкірі або м'якій тканині. Описана тут вакцинація буде знижувати важкість, затримувати або перешкоджати розвитку симптомів. Ссавці мають підвищений ризик інфекції, якщо вони госпіталізовані або тривалий час знаходяться в лікувальному закладі, отримують лікування антибіотиками або мають імунодефіцит, включаючи дітей з ВІЛ/СНІД або іншими захворюваннями, які погіршують імунну функцію, пацієнтів, що мають часті контакти з системою охорони здоров'я, мають хронічне захворювання, таке як діабет, рак, ВІЛ/СНІД, які є дуже молодими або дуже старими, часто використовують антибіотики, які мають відкриту рану, дерматит або ураження шкіри, погано харчуються або погано дотримуються гігієни. Інші ссавці з ризиком включають проживаючих в обмежених побутових умовах, військовослужбовців, особливо в діючій армії, спортсменів та ув'язнених. Також до ризику розвитку інфекції S. aureus на шкірі або м'якій тканині схильні ті особи, які раніше мали такі інфекції, або пацієнти, яким призначені або проведена хірургічна або інвазивна медична операція. Під "Als3p" розуміється поліпептид, який по суті ідентичний амінокислотній послідовності, показаної на Фіг.1A, наприклад SEQ ID NO: 1 або SEQ ID NO: 2, або білку Candida ALS3, ідентифікованому в GenBank: XP_710431.1, XP_710435.1, AAO72959.1, XP_712646.1, XP_712666.1, EAK91173.1, EAK91169.1, AAO72958.1, EAK93494.1, EAK93472.1, O74623.1, AAD02580.1, EAK90704.1, XP_709985.1. Бажано, щоб Als3p мав щонайменше 70%, 75%, 80%, 85%, 90%, 95%, 99% або навіть 100% ідентичність з послідовністю, показаній на Фіг.1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2 . Під "Als3p - фрагментом" або "фрагментом Als3p" розуміється частина поліпептиду Als3p, що містить менше ніж 1050, 1025, 1000, 975, 950 або 945 амінокислот. У деяких варіантах здійснення фрагменти Als3p мають у довжину 300-350 або 250-500 амінокислот. У деяких варіантах здійснення фрагмент має в довжину менше ніж 1050, 1025, 1000, 975, 950 або 945, 940, 937, 936, 935, 934, 933, 932, 931 або 930, 920, 910, 900, 890, 880, 870, 860, 850, 840, 830, 820, 810, 800, 790, 780, 770, 760, 750, 740, 730, 720, 710, 700, 690, 680, 670, 660, 650, 640, 630, 620, 610, 600, 590, 580, 570, 560, 550, 540, 530, 520, 510, 500, 490, 480, 470, 460, 450, 440, 430, 420, 410, 400, 390, 380, 370, 360, 350, 340, 330, 320, 310, 300, 290, 280, 270, 260, 250, 240, 230, 220, 210, 200, 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 90, 80, 70, 60, 50, 40, 30, 25, 20, 15 або 10 амінокислот і в деяких випадках є імуногенним. Одним прикладом фрагмента Als3p є SEQ ID NO: 2, яка показана на Фіг.1A, або її фрагменти. У деяких випадках фрагменти Als3p мають у довжину від 14 до 20 амінокислот. Загалом, фрагмент може мати в довжину менше ніж, наприклад 325, 320, 310, 300, 290, 280, 270, 260, 250, 240, 230, 220, 210, 200, 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 90, 80, 70, 60, 50, 40, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12 або 11 амінокислот і бажано є імуногенним. У деяких випадках фрагмент Als3p має в довжину від 14 до 20 амінокислот. Крім цього, фрагменти Als3p, наприклад, можуть містити одну або кілька консервативних замін амінокислот в послідовності, показаній на Фіг.1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2. Інші бажані фрагменти Als3p містять одну або кілька консервативних замін амінокислот в послідовності, показаній на Фіг.1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2, та/або щонайменше одну фланкуючу амінокислоту (наприклад, 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 фланкуючих амінокислот) на N- та/або C-кінці послідовності, показаній на Фіг. 1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2. Інші переважні фрагменти Als3p містять сім чи більше безперервних амінокислот послідовності, показаної на Фіг.1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2. Необмежені приклади фрагмента Als3p включають 1-40, 10-50, 20-60, 30-70, 40-80, 50-90, 60-100, 70-110, 80-120, 90-130, 100-140, 110-150, 120-160, 130-170, 140-180, 150-190, 160-200, 3 UA 114286 C2 5 10 15 20 25 30 35 40 45 50 55 60 170-210, 180-220, 190-230, 200-240, 210-250, 220-260, 230-270, 240-280, 250-290, і 260-300, 270310, 280-320 і 290-331 амінокислот послідовності, показаної на Фіг.1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2; і ці фрагменти мають один або декілька з наступних ознак: одну або декілька консервативних замін амінокислот (наприклад, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 або 16 консервативних замін амінокислот) в послідовності, показаній на Фіг.1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2; одну або кілька амінокислот (наприклад, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 або 16 амінокислот), відсічених від N- та/або C-кінця послідовності, показаної на Фіг.1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2; і щонайменше одну фланкуючу амінокислоту (наприклад, 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 фланкуючих амінокислот) на N- і/або Cкінці послідовності, показаної на Фіг.1A, наприклад, SEQ ID NO: 1 або SEQ ID NO: 2. Під "по суті ідентичною" розуміється амінокислотна послідовність або нуклеїнокислотна послідовність, яка має щонайменше 50% ідентичність з контрольною послідовністю. Така послідовність зазвичай щонайменше, наприклад, на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% або 99% ідентична контрольній послідовності на рівні амінокислот або рівні нуклеїнових кислот. Загалом, для поліпептидів довжина послідовностей порівняння може становити щонайменше п'ять амінокислот, наприклад, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 250, 300 або більше амінокислот, аж до повної довжини поліпептиду. Для нуклеїнових кислот довжина послідовностей порівняння звичайно може становити щонайменше 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 250, 300, 400, 500, 600, 700, 800, 900 або більше нуклеотидів, аж до повної довжини молекули нуклеїнової кислоти. При цьому розуміється, що для цілей визначення ідентичності послідовності при порівнянні послідовності ДНК з послідовністю РНК нуклеотид тимін еквівалентний нуклеотиду урацилу. Також розглядаються нуклеїнокислотні послідовності, які кодують будь-який з поліпептидів Als3p або їх фрагментів, згаданих у цьому документі. У тому сенсі, як це тут використовується, коли поліпептидна або нуклеїнокислотна послідовність згадується як та, що має "щонайменше X% ідентичності послідовності" з контрольною послідовністю, під цим розуміється, що щонайменше X відсотків амінокислот або нуклеотидів в поліпептиді або нуклеїновій кислоті ідентичні таким у контрольній послідовності, коли такі послідовності оптимально вирівняні. Оптимальне вирівнювання послідовностей можна визначити різними способами, які відомі в даній галузі, наприклад, використовуючи алгоритм вирівнювання Сміта-Уотермена (Smith et al., J. Mol. Biol. 147:195-7, 1981) і комп'ютерні програми BLAST (Basic Local Alignment Search Tool; Altschul et al., J. Mol. Biol. 215: 403-10, 1990). Ці та інші алгоритми вирівнювання доступні за допомогою використання загальнодоступного комп'ютерного програмного забезпечення, такого як "Best Fit" (Smith and Waterman, Advances in Applied Mathematics, 482-489, 1981), яке включене до GeneMatcher PlusTM (Schwarz and Dayhof, Atlas of Protein Sequence and Structure, Dayhoff, M.O., Ed pp 353-358, 1979), BLAST, BLAST-2, BLAST-P, BLAST-N, BLAST-X, WU-BLAST-2, ALIGN, ALIGN-2, CLUSTAL або Megalign (DNASTAR). Крім цього, фахівці в даній області можуть визначити відповідні параметри для вимірювання вирівнювання, включаючи будь-які алгоритми, необхідні для досягнення оптимального вирівнювання по довжині порівнюваних послідовностей. Під "ад'ювантом" розуміється одне або кілька речовин, які викликають стимуляцію імунної системи. У цьому контексті ад'ювант використовують для посилення імунної реакції на один або кілька антигенів або антитіл вакцини. Ад'ювант може бути введений пацієнту до, разом або після введення вакцини або антитіла. Приклади хімічних сполук, що використовуються в якості ад'ювантів, включають, але без обмеження, сполуки алюмінію (наприклад, галун, Альгідрогель), масла, блок-полімери, комплекси, стимулюючі імунну систему, вітаміни та мінерали (наприклад, вітамін E, вітамін A, селен і вітамін B12), Quil A (сапоніни), компоненти клітинних стінок бактерій і грибків (наприклад, ліпополісахариди, ліпопротеїни і глікопротеїни), гормони, цитокіни і костимулюючі фактори. Під "носієм" у контексті кон'югату розуміється частка або частинка, наприклад, KLH, CRM197, токсоїд правця, токсоїд дифтерії, фрагментів ентеротоксину B, білкового комплексу зовнішньої мембрани N. meningitides, будь-якого іншого білка-носія, фага, дріжджів, вірусу, віросоми або рекомбінантної вірусоподібної частинки, яка підходить для зв'язку з описаним тут поліпептидом або його відображенням. Під "кон'югатом" розуміється з'єднання, яке включає поліпептид винаходу, пов'язаний з іншого часткою або частинкою, наприклад, KLH, CRM197, токсоїд правця, токсоїд дифтерії, фрагментів ентеротоксину B, білкового комплексу зовнішньої мембрани N. meningitides, будьякого іншого білка-носія, фага, дріжджів, вірусу, віросоми або рекомбінантної вірусоподібної частинки. Під "імуногенним" розуміється будь-яка речовина, яке здатна індукувати імунну реакцію у 4 UA 114286 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнта. Під "імуногенною кількістю" у контексті вакцини розуміється кількість вакцини, необхідна для індукції імунної реакції у пацієнта клінічно релевантним способом. Імуногенна кількість вакцини, що використовується при здійсненні на практиці способів вакцинації, які тут описані, змінюється залежно від способу введення, віку, маси тіла і загального здоров'я пацієнта. У кінцевому рахунку, рішення про підходящу кількість та режим дозування приймає лікар, який виписує вакцину. Під "виділеним" або "очищеним" розуміється відокремлене від інших природньо супроводжуючих компонентів. Зазвичай з'єднання (наприклад, нуклеїнова кислота, поліпептид, антитіло або невелика молекула) по суті виділено, якщо воно щонайменше на 60% за масою вільне від білків і/або зустрічаються в природі органічних молекул, з якими воно природньо пов'язане. Це визначення також поширюється, наприклад, на поліпептид або молекулу нуклеїнової кислоти, виділену з її фланкуючих послідовностей (наприклад, для амінокислотної послідовності "виділена" відноситься до послідовності, яка вільна від фланкуючих амінокислот, з якими ця послідовність природно пов'язана в поліпептиді). У деяких випадках з'єднання виділено щонайменше на 75%, більш переважно щонайменше на 90% і найбільш переважно щонайменше на 99% за масою. Виділене з'єднання, наприклад поліпептид, може бути отримано стандартними способами, наприклад, екстракцією з натурального джерела (наприклад, очищення з клітки, інфікованої Candida); експресією рекомбінантної нуклеїнової кислоти, що кодує Als3p, фрагмент або варіант Als3p або його складовий білок, в будь-якій стандартній системі експресії, яка включає, але без обмеження, E. coli або Saccharomyces cerevisiae, або хімічним синтезом поліпептиду. Чистота може бути виміряна будь-яким підходящим способом, наприклад, хроматографією, електрофорезом на поліакриламідному гелі або аналізом РХВР. Під "пов'язаним з" або "кон'югованим з" в контексті кон'югату розуміється ковалентна або нековалентна взаємодія між поліпептидом і носієм або об'єктом, що зв’язується. Нековалентні взаємодії включають, але без обмеження, водневий зв'язок, іонні взаємодії між зарядженими групами, електростатичне зв'язування, ванн-дер-ваальсові взаємодії, гідрофобні взаємодії між неполярними групами, ліофобні взаємодії і тяжіння, засновані на LogP. Терміни "пептид", "поліпептид" і "білок" використовуються взаємозаміно і відносяться до будь-якого ланцюга з двох і більше натуральних або ненатуральних амінокислот, незалежно від пост-трансляційної модифікації (наприклад, глікозилювання або фосфорилювання), яка складає весь або частину поліпептиду або пептиду, який зустрічається в природі або не зустрічається в природі, що описаний в даному документі. Терміни "фармацевтично прийнятний носій" і "фармацевтично прийнятний наповнювач" використовуються як взаємозаміно і означають носій або наповнювач, який фізіологічно прийнятний для ссавця, що отримує лікування, при збереженні терапевтичних властивостей з'єднання, з яким його вводять. Одним прикладом речовини фармацевтично прийнятного носія є фізіологічний розчин. Інші фізіологічно прийнятні носії і їх склади відомі фахівцям в даній області і описані, наприклад, у фармацевтиці Ремінгтона (21-е видання), під ред. Е. Геннаро, 2005, Lippincott, Williams & Wilkins, Philadelphia, штат Пенсільванія. Під "фармацевтичною композицією" розуміється композиція, що містить поліпептид, кон'югат, вакцину або антитіло винаходу, разом з фармацевтично прийнятним наповнювачем, яка виробляється і продається зі схвалення державного регулюючого органу як частина терапевтичного режиму для лікування або профілактики захворювання або події у ссавця. Фармацевтичні композиції можуть мати форму, наприклад, для внутрішньовенного введення (наприклад, стерильний розчин, вільний від частинок, що закупорюють, і в системі розчинника, підходящого для внутрішньовенного застосування), для перорального введення (наприклад, таблетка, капсула, овальна таблетка, желатинова капсула або сироп) або будь-яку іншу форму, описану в цьому документі, наприклад, форму разових доз. Під "лікуванням" розуміється медичний догляд за ссавцем, наприклад, людиною або ссавцем, що не відноситься до людського роду, з наміром вилікувати, зменшити, стабілізувати, знизити ймовірність або запобігти захворюванню, патологічний стан, порушення або подію шляхом введення фармацевтичної композиції. Цей термін включає активне лікування, тобто лікування, специфічно спрямоване на поліпшення, або пов'язане з лікуванням захворювання, патологічного стану, порушення або події, а також включає етіотропну терапію, тобто лікування, спрямоване на усунення причини відповідного захворювання, патологічного стану, порушення або події. Крім того, цей термін включає паліативне лікування, тобто лікування, призначене для зниження симптомів, а не на лікування захворювання, патологічного стану, порушення або події; симптоматичне лікування, тобто лікування, спрямоване на системні симптоми відповідного захворювання, патологічного стану, порушення або події; профілактичне лікування, 5 UA 114286 C2 5 10 15 20 25 30 35 40 45 50 55 60 тобто лікування, спрямоване на мінімізацію або часткове або повне інгібування розвитку відповідного захворювання, патологічного стану, порушення або події, наприклад у ссавця, яке ще не хворе, але яке сприйнятливе або має інший ризик до конкретного захворювання, патологічного стану, порушення або події; та підтримуючу терапію, тобто лікування, що застосовується для доповнення іншої специфічної терапії, спрямованої на поліпшення відповідного захворювання, патологічного стану, порушення або події. Під "вакциною", як вона тут використовується, розуміється композиція, яка викликає імунну реакцію у пацієнта, якому вона введена. Режим введення, доза і кількість введень можуть бути оптимізовані фахівцями в даній області відомим способом. Під терміном "вакцинувати", як він тут використовується, розуміється лікування ссавця шляхом введення вакцини, наприклад для запобігання або зменшення симптомів захворювання, патологічного стану, порушення або події. Інші ознаки та переваги винаходу стануть очевидними з подальшого детального опису, креслень і формули винаходу. Короткий опис креслень На Фіг.1A наведено лістинг двох амінокислотних послідовностей Als3p, SEQ ID NO: 1 і SEQ ID NO: 2. На Фіг.1Б наведено лістинг однієї нуклеїнокислотної послідовності Als3, SEQ ID NO: 3. На Фіг.2 наведено набір фотографій, що показують порівняльну кінетику ефективності NDV3, оцінену шляхом отримання зображень in vivo. Фотографії показують мишей в кожній з груп дозування в дні 2, 4 і 7 після інфікування. На Фіг.3 наведено графік, який показує, що NDV-3 обмежує обсяг абсцесу MRSA у мишей на 3 структурі шкіра/шкіра. Графік показує середній обсяг (см ) абсцесів у контрольній групі та в групах дозування 3 мкг, 10 мкг, 30 мкг і 100 мкг NDV-3. На Фіг.4 наведені дві фотографії, які показують, що NDV-3 обмежує обсяг абсцесу MRSA у мишей на структурі шкіра/шкіра. Зліва миша з контрольної групи; праворуч миша з групи дозування 100 мкг NDV-3. На Фіг.5 наведено графік, який показує, що NDV-3 пригнічує проліферацію MRSA у мишей на структурі шкіра/шкіра. Графік показує середнє надлишкове виділення/абсцес для контрольної групи і для груп дозування 3 мкг, 10 мкг, 30 мкг і 100 мкг NDV-3. На Фіг.6 наведено набір зображень, які показують, що NDV-3 обмежує проліферації MRSA і збільшує число нейтрофілів. Наведені дані взяті в групі дозування 100 мкг NDV-3 на день 7 після інфікування. На Фіг.7 наведено набір зображень, які показують, що NDV-3 збільшує число Т-клітин CD3+ і індукує експресію IL-17. Наведені дані взяті в групі дозування 100 мкг NDV-3 на день 7 після інфікування. На Фіг.8 наведено набір зображень, які показують, що NDV-3 стимулює експресію IL-22 і реакцію -дефензину. Наведені дані взяті в групі дозування 100 мкг NDV-3 на день 7 після інфікування. На Фіг.9 наведено графік, що показує площу серединного бічного абсцесу у контрольних і вакцинованих мишей. На Фіг. 10 представлений графік, що показує обсяг серединного бічного абсцесу у контрольних і вакцинованих мишей. На Фіг.11 представлений графік, що показує середній обсяг абсцесу внаслідок штамів MRSA у контрольних і вакцинованих мишей на день 7 після інфікування. Зірочками вказано значне зменшення порівняно з відповідним контролем. На Фіг.12 наведено складене зображення імунофлуоресценції абсцесу MRSA у миші, вакцинованій NDV-3 (100 мкг). Фіг.13 наведено складене зображення імунофлуоресценції абсцесу MRSA від контрольної миші. Файл патенту або заявки містить креслення (Фіг.2, 4, 6-8, 12 і 13) в кольорі. Копії цієї публікації патенту або патентної заявки з кольоровими кресленнями будуть надані Відомством за запитом та при сплаті необхідного мита. Детальний опис Як буде сказано нижче, білок 3 агглютиніно-подібної послідовності (Als3p) дозволяє вакцинувати від S. aureus ссавців, ідентифікованих як ті, що мають ризик розвитку інфекції S. aureus на шкірі або м'якій тканині. У наведених нижче аналізах (зокрема в пілотному дослідженні Прімера 1 і оптимізованому дослідженні Прімера 2), призначених для оцінки ефективності вакцини Als3p проти розвитку інфекції S. aureus на шкірі або м'якій тканині на мишачій моделі інфекції MRSA структури 6 UA 114286 C2 5 10 15 20 25 30 35 40 45 50 55 60 шкіра/шкіра (на структурі шкіра/шкіра), організми і способи описані вперше. ОРГАНІЗМИ Штами MRSA MRSA Xen30 ( lux +) Roche-16 MRSA LAC-USA300 USA300 MRSA MW2 USA400 Штам Xen30 Staphylococcus aureus використовували в цих дослідженнях in vivo. Він отриманий з батьківського штаму S. aureus MRSA-16 (Roche) і містить оперон luxA-E в одному сайті хромосомної інтеграції. Цей штам MRSA продукує фермент люциферази і альдегідний субстрат і конститутивно подає біолюмінісцентний сигнал у метаболічно активному стані. Його вірулентність еквівалентна іншим штамам MRSA в мишачій моделі на структурі шкіра/шкіра, використаної як перевірена в пілотних дослідженнях, і всі випробувані штами мали в іншому подібні фенотипи та характеристики зростання. Log-фазні клітини (BHI; 37°C) були культивовані з кількісно підтверджених основних банків клітин з підтвердженою вірулентністю, зібрані і суспендовані у фосфатному буфері, піддані дії ультразвуку та кількісно визначені спектрофотометрією до бажаного числа КУО. СПОСОБИ Ефективність вакцини NDV-3 оцінювали на мишах на моделі структури шкіра/шкіра проти стійкого до метициліну SA (MRS): Xen30 (lux+); LACUSA300 або MW2 (USA400). NDV-3 являється складом з рекомбінантного N-кінця білка Als3 поверхневого білка Candida (Фіг. A; SEQ ID NO: 2) і ад'юванта Альгідрогель® у фосфатному буферному фізіологічному розчині, pH 7, наприклад, з дозою 0,5 мл, яка містить, наприклад, 30-300 мкг білка Als3 і, за вибором, крім того містить гідроксид алюмінію в концентрації 1,0 мг Al/мл. Ефективність порівнювали між режимами NDV-3, що вводились з ад'ювантом альгідрогелем (IM) в день 0 і як бустер-доза в день 21. Контрольні миші отримували тільки ад'ювант. Інфікування шляхом підшкірної інокуляції двох фланків (2x107 КУО) відбулось через 14 діб після бустер-дози. Площа, обсяг і КУО абсцесу кількісно визначали протягом декількох діб після інфікування. Зображення in vivo (IVIS) закінчення абсцесу були отримані на мишах, інфікованих Xen30. Реакції на сивороточний IgG (ELISA), IFN- і IL-17A (ELISpot) були кількісно визначені в паралельних режимах вакцини. Тканина IL-17A, IL-22, mD-3, клітку CD3+ і сигнали нейтрофілів оцінили в день 7 після інфікування за допомогою імуногістохімії. Вакцина. Вакцинація NDV-3 була оцінена для діапазону дозування з використанням ідентичного режиму ад'юванта альгідрогеля. Дози 3, 10, 30, 100 або 300 мкг (IM) досліджували паралельно. Після первинної вакцинації (день 0) ввели ідентичну бустер-дозу на день 21 дослідження. Мишей інфікували через 14 діб після бустер-дози (день 35 дослідження ). Мишача модель структури шкіра/шкіра. Всі дослідження на тваринах виконували згідно схваленої політиці LABioMed використання тварин Медичного центру UCLA в Харборі. Мишей Balb/C (компанії Harlan) вакцинували, як сказано вище. Моделлю підшкірного абсцесу шкіри/ м'якої тканини для цих досліджень послужила модифікована модель Дінга та ін. (Ding et al.) (J Bacteriol 2008 190:7123-9) та/або Войіча та ін. (Voyich et al.) (J Infect Dis 2006 194:1761-1770). У день 35 дослідження мишей анестезували, фланки виголили і стерилізували, і інокуляти 2x107 КУО (без гранул або матриксу) ввели в підшкірний компартмент шляхом ін'єкції (100 мкл). У кожному дослідженні використовували як мінімум 20 мишей для контрольної чи вакцинованої груп. Кількісне визначення абсцесу. Площа/обсяг абсцесу вимірювали в кожному боці миші протягом періоду дослідження аж до 14 діб після інфікування. Для цього мишей анестезували, і оцінювали довжину (l) і ширину (w) місця ураження, щоб кількісно визначити площу абсцесу або 2 3 дермонекроза (см ). Обсяг абсцесу (см ) вирахували згідно формули для сферичного еліпсоїда: 2 [v=( /6) x l x w ]. Дослідження зображень. Штам Xen30 MRSA має власний оперон lux, інтегрований в його хромосому. Цей конструкт кодує альдегідний субстрат і сам фермент люциферази; таким чином, екзогенного субстрату люциферина не потрібно (Kadurugamuwa et al., Infect Immun 2003 71:882-890). У певні дні дослідження отримували зображення in vivo (IVIS) контрольних і вакцинованих мишей, використовуючи систему IVIS (компанія Caliper Life Sciences, Inc.). Сигнали люмінесценції фіксували за період п'ять хвилин і аналізували, використовуючи програмне забезпечення Living Image, як фотони/хв/абсцес. Кількісна культура. У певні моменти часу після інфікування мишей гуманно умертвляли і обробляли для отримання кількісної культури абсцесів. Кожен бік розрізали асептично, абсцес видаляли і готували для культивування. Абсцеси гомогенізували окремо і послідовно розбавляли в стерильному фосфатному буфері для кількісної культури на агарових планшетах 7 UA 114286 C2 5 10 15 20 25 30 35 40 45 50 55 60 з овечої кров'ю. Культури інкубували (37°C) протягом 24 годин і підраховували отримані колонії. Імунологічні механізми. Множинні і комплементарні підходи використовували для оцінки потенційних корелятів ефективності вакцини NDV-3 на мишачій моделі з інфекцією MRSA на структурі шкіра/шкіра. Ці дослідження були спрямовані на штам Xen30, що дозволяє кореляцію з даними системи IVIS в кінцевій точці 7 діб. A. Кількісне визначення антитіла. Рівні антитіла сироваткового IgG визначали у форматі ELISA з 96 лунками для деякого діапазону розбавлень. Значення представляють розбавлення, скориговане на геометричне середнє, трьох однакових аналізів для порівняння імунізованих сироваток з контрольною. B. Кількісне визначення цитокіну. Реакції T-клітин IFN- і IL-17A визначали шляхом ELISpotаналізу спленоцитів, виділених з імунізованих проти контрольних мишей, і піддавали впливу імуногену NDV-3. Число клітин, що утворюють ореол, визначали кількісно для 106 клітин, що продукують або IFN-, або IL-17A. Життєздатність клітин перевіряли продукуванням IFN- після стимуляції форбол-12-міристат-13-ацетатом (ФМА) і іономіціном за встановленими протоколами. C. Імуногістохімія. Імунологічні детермінанти, пов'язані з ефективністю вакцини, оцінювали стандартними способами в тканинах, отриманих від вакцинованих і контрольних тварин через 7 діб після інфікування. Коротко, для імуногістохімічних досліджень вертикальні зрізи 3 мкм, введені в парафін, були депарафінізовані і повторно гідровані, після чого було проведено пошук індукованого теплом антигену в цільовому розчині для пошуку (компанія Dako, Карпінтерія, Каліфорнія). Зрізи інкубували з подвійним ендогенних блокуючим буфером (компанія Dako) протягом 15 хв при кімнатній температурі, щоб блокувати активність ендогенної пероксидази, і неспецифічне зв'язування антитіла блокували шляхом інкубації з 5% нормальної сироваткою, що відповідає первинному антитілу. Потім зрізи інкубували протягом ночі при 4°C з первинним антитілом, націленим на специфічний антиген, який представляє інтерес (Таблиця 1). Потім зрізи промили і інкубували протягом 30 хв з відповідним вторинним антитілом (Таблиця 1), або кон'югованим з пероксидазою хрону, або біотинованим (компанія Santa Cruz Biotechnology, Санта- Круз, Каліфорнія). Потім було досягнуто імуногістохімічний прояв шляхом 30-хвилинного прояву в стрептавідині-пероксидази хрону (компанія Dako і 3,3'-діамінобензидіні (ДАБ; компанія Vector Laboratories, Берлінгейм, Каліфорнія) і контрастно пофарбували гематоксиліном. Зображення отримували, використовуючи мікроскоп Olympus BX43 з цифровою камерою для отримання зображень. D. Імунофлуоресценція. Для оцінки впливу вакцини NDV-3 на взаємозв'язки імунологічних детермінант і S. aureus в контексті інфікування in vivo, дослідження імунофлуоресценціі з використанням конфокальної мікроскопії були виконані встановленими способами. Коротко, зрізи, введені в парафін, були приготовлені, як сказано вище, і інкубовані з імунофлуоресцентним буфером (1% бичачий сироватковий альбумін і 2% фетальна теляча сироватка) протягом однієї години при кімнатній температурі. Первинні антитіла, спрямовані на антигени-мішені, які представляють інтерес (Таблиця 1), інкубували зі зрізами тканин від контрольних та вакцинованих мишей при 4°C протягом ночі. Далі відповідні вторинні антитіла (Таблиця 1), розбавлені в буфері IFF (2 мкг/мл), інкубували протягом 60 хвилин. Зрізи потім промили у фосфатному буфері і встановили,використовуючи Vectashield H-1500 (компанія Vector Laboratories, Берлінгейм, Каліфорнія) так, щоб мінімізувати фото-знебарвлення. Зображення отримували за допомогою конфокального мікроскопа Leica SP2, використовуючи аргоновий (488 нм), криптоновий (568 нм) і гелій-неоновий (633 нм) лазери і конфокальне програмне забезпечення версії 2.0 (компанія Leica Instruments, Німеччина). Таблиця 1. Антитіла, використані для імуногістологічних або імунофлуоресцентних досліджень. Первинні антитіла Антиген-мішень Ly - 6G (гранулоцити) Ly - 6C (моноцити/макрофаги) Мишачий -дефензин-1 (mB -1) Мишачий -дефензин-3 (mBD -3) Мишачий тромбоцитарний фактор 4 (P -4) Staphylococcus aureus (миші) Staphylococcus aureus (кролика) Стафілококовий білок A CD3- CD3- 8 UA 114286 C2 5 10 15 20 IL-17 IL-22 Вторинні антитіла Кон'юговане з Alexa 488 осляче антитіло до кролика Кон'юговане з Alexa 488 осляче антитіло до щура Кон'юговане з Alexa 555 козяче антитіло до щура Кон'юговане з Alexa 568 осляче антитіло до кролика Кон'юговане з Alexa 633 осляче антитіло до кози Кон'юговане з Alexa 647 осляче антитіло до кролика Кон'югований з Alexa 633 стрептавідин. Статистичні аналізи. Відмінності в результатах експериментів порівняли на підставі оцінок ступенів, які показують, що 16-20 мишей в групі дають ступінь > 85%, щоб детектувати 1 logрізницю в КУО на 1 грам тканини, або площа абсцесу 2 мм (a = 0,05; U-критерій Манна-Уїтні). Значення P вказані в Таблиці 2 і Таблиці 3 (нижче). Приклад 1. У пілотному дослідженні вакцинацію NDV-3 виконали із зменшеними параметрами на структурі шкіра/шкіра через MRSA з еквівалентною ефективністю в обмеженні площі та об'єму абсцесу і КУО для штамів Xen30, USA300 і MW2. Мишачу імунну реакцію корелювали з ефективністю захисту, пов'язаного з дозою NDV-3. Ці результати показані в Таблиці 2 і на Фіг.2. Ці результати показують, що вакцина NDV-3 індукувала жорсткі реакції B- і T- клітин, причому ці реакції відповідали ефективності захисту від MRSA в мишачій моделі на структурі шкіра/шкіра. Таблиця 2 Ефективність NDV-3 в MRSA Xen30 на структурі шкіра/шкіра і імунна реакція в мишачих моделях Абсцес Площа, день 7 Об'єм, день 7 Витік, день 7 Логарифм медіанного значення КУО, день 7 ІМ Логарифм медіанного значення КУО, день 14 ІМ Логарифм медіанного значення КУО, день 14 SubQ Аналіт Контрольні миші 3мкг 10мкг 2 1.47 см 3 0.95 см 1.9210 5 30мкг 1.59 см 3* 0.96 см 1.4810 5* 1.8110 1.0710 1.6510 7.9 (7.6/8.0) [n=36] 7.8 (7.8/7.8) [n=20] 8.1 (7.8/7.8) [n=20] 8.1 (7.9/7.9) [n=36] 7.9 (7.5/8.0) [n=36] 1.70 (1.0/2.8) [n=48] 0.05 (0.05/1.3) [n=39] Немає даних Немає даних 0.05 (0.05/1.7) [n=39] 3.54 (2.6/6.9) [n=20] 3.92 (3.2/5.5) [n=20] Немає даних Немає даних 2.26 (1.8/3.6) [n=20] IgG 1.0 GCU 44.8 GCU IFN- 9.5 SPU 12.8 SPU IL-17 18.9 SPU 132.6 SPU 1.29 см 2†† 3** 0.46 см 3†† 5 0.77 см 0.34 см 5* ∆†† * 25 0.99 см 300мкг 2* 1.88 см 2* 100мкг 2†† 0.69 см 3†† 0.29 см 5* 9.0310 † 7.5 (7.4/7.8) [n=36] ∆†† †† Немає даних Немає даних Немає даних ** 97.8 GCU †† 81.8 GCU 1.48 (0.05/2.6) [n=17] ** 2.40 (1.4/3.8) [n=20] †† Немає даних * Немає даних ** Немає даних 21.9 SPU 34.3 SPU 62.2 SPU † 161.2 SPU †† 3†† 4†† ** †† 2†† (25%/75% квартильних показників); Р
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods and compositions for vaccinating against staphylococcus aureus
Автори англійськоюYeaman, Michael, R., Edwards, John, E., Jr., Filler, Scott, G., Ibrahim, Ashraf, S., Fu, Yue, Hennessey, John, P., Jr.
Автори російськоюЙиман Майкл Р., Эдвардс Джон Э., Джр., Филлер Скотт Дж., Ибрагим Ашраф С., Фу Юе, Хеннеси Джон П., Джр.
МПК / Мітки
МПК: A61K 39/085
Мітки: aureus, staphylococcus, лікування, спосіб
Код посилання
<a href="https://ua.patents.su/22-114286-sposib-likuvannya-staphylococcus-aureus.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування staphylococcus aureus</a>
Попередній патент: Дисплейний пристрій підвищеної яскравості з інтегрованими фотогальванічними елементами
Наступний патент: Засіб для боротьби з ендопаразитами
Випадковий патент: Сульфонаміди як trpm8-модулятори