Спосіб лікування і/або профілактики антиаритмічних нападів
Номер патенту: 85546
Опубліковано: 10.02.2009
Автори: Штрауб Маттіас, де Вріес Міхель Хенрікус, Каутреельс Вернер, Янсен Йоханнес Вільхельмус Катаріне Маріа, Штайнборн Клаус Рудольф
Формула / Реферат
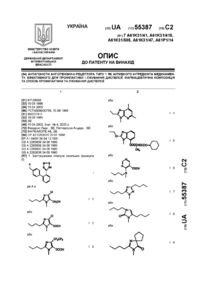
1. Спосіб лікування і/або профілактики антиаритмічних нападів у людини, переважно при конверсії недавнього початку передсердної фібриляції (Afib) або тріпотіння в нормальний синусовий ритм (NSR) у людини, де рідку фармацевтичну композицію, що містить терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану формули І
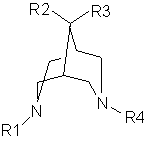 , I
, I
де
R1 означає алкільну групу, що містить 1-6 атомів вуглецю, алкіленову групу, що містить 3-6 атомів вуглецю, що має подвійний зв'язок, який не зв'язується безпосередньо з атомом азоту, циклоалкілалкільну групу, що містить 4-9 атомів вуглецю, або бензильну групу,
R2 означає нижчу алкільну групу, та
R3 означає нижчу алкільну групу, або
R2 та R3 утворюють разом алкіленовий ланцюг, що містить 3-6 атомів вуглецю, та
R4 означає алкільну групу, що містить 1-6 атомів вуглецю, алкенільну групу, що містить 3-6 атомів вуглецю, що має подвійний зв'язок, який не зв'язується безпосередньо з атомом азоту, циклоалкілалкільну групу, що містить 4-9 атомів вуглецю, групу, що відповідає формулі а:
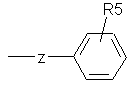 , а
, а
де
R5 означає водень, галоїд, нижчий алкіл або нижчий алкокси, і
Z означає алкіленовий ланцюг, що містить 1-3 атоми вуглецю, або пропеніленовий ланцюг, що має подвійний зв'язок, який є спряженим з фенільною групою, або групу, що відповідає формулі б:
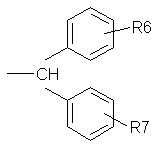 , б
, б
де
R6 означає водень, галоїд, нижчий алкіл або нижчий алкокси, та
R7 означає водень, галоїд, нижчий алкіл або нижчий алкокси,
або її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, вводять згаданому пацієнту ступенево, повністю переривчастим і/або необов'язково тільки частково безперервним шляхом введення, переважно двоетапним введенням двох фаз, що вводять безперервно.
2. Спосіб лікування і/або профілактики за п. 1, де рідку фармацевтичну композицію, що містить згадану терапевтично ефективну кількість похідної 3,7-діазабіцикло[3.3.1]нонану або її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, вводять шляхом інфузійного введення, переважно ступеневим інфузійним введенням, причому необов'язково кожен етап є частково безперервним інфузійним введенням, переважно двоступеневим інфузійним введенням двох фаз, що вводять безперервною інфузією.
3. Спосіб лікування і/або профілактики за будь-яким з пп. 1 або 2, де рідку фармацевтичну композицію, що містить першу терапевтично ефективну кількість згаданої похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, що є достатньою для лікування і/або профілактики антиаритмічних нападів у людини, вводять впродовж першого періоду часу приблизно 10±2 хв., переважно приблизно 10±1 хв., найбільш переважно приблизно 10±0,5 хв., і другу терапевтично ефективну кількість згаданої похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, що є достатньою для продовження лікування і/або профілактики антиаритмічних нападів у людини, вводять впродовж другого періоду часу приблизно 20±5 хв., переважно приблизно 20±3 хв., найбільш переважно приблизно 20±1 хв.
4. Спосіб лікування і/або профілактики за будь-яким з пп. 1-3, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де R1 означає алкільну групу, що містить 1-6 атомів вуглецю, або циклоалкільну групу, що містить 4-7 атомів вуглецю.
5. Спосіб лікування і/або профілактики за будь-яким з пп. 1-2, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де R4 означає алкільну групу, що містить 1-6 атомів вуглецю, циклоалкілалкільну групу, що містить 4-7 атомів вуглецю, або групу, що відповідає формулі б.
6. Спосіб лікування і/або профілактики за будь-яким з пп. 1-2, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де R1 означає алкільну групу, що містить 1-6 атомів вуглецю. або циклоалкільну групу, що містить 4-7 атомів вуглецю, та R4 означає алкільну групу, що містить 3-6 атомів вуглецю, циклоалкілалкільну групу, що містить 4-7 атомів вуглецю.
7. Спосіб лікування і/або профілактики за п. 6, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де сполука вказаного 3,7-діазабіцикло[3.3.1]нонану являє сполуку 9,9-алкілен-3,7-діазабіцикло[3.3.1]нонану формули І, де R2 та R3 утворюють разом алкіленовий ланцюг, що містить 4-5 атомів вуглецю, a R1 та R4 означають кожен незалежно один від одного лінійну або розгалужену алкільну групу з 3-4 атомами вуглецю або циклопропілметильну групу.
8. Спосіб лікування і/або профілактики за будь-яким з пп. 1-2, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де сполука вказаного 3,7-діазабіцикло[3.3.1]нонану являє сполуку 9,9-алкілен-3,7-діазабіцикло[3.3.1]нонану, що містить 1,5 моля фумарової кислоти на моль сполуки формули І.
9. Спосіб лікування і/або профілактики за п. 8, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де згадану сполуку 3,7-діазабіцикло[3.3.1]нонану вибирають із групи, яка складається з N,N'-дициклопропілметил-9,9-тетраметилен-3,7-діазабіцикло[3.3.1]нонану, N-ізобутил-N'-ізопропіл-9,9-пентаметилен-3,7-діазабіцикло[3.3.1]нонану.
10. Спосіб лікування і/або профілактики за будь-яким з пп. 1-6 та 8, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де згадана сполука 3,7-діазабіцикло[3.3.1]нонану являє собою сіль фумарової кислоти з N,N'-дициклопропілметил-9,9-тетраметилен-3,7-діазабіцикло[3.3.1]нонаном або N-ізобутил-N'-ізопропіл-9,9-пентаметилен-3,7-діазабіцикло[3.3.1]нонаном, що містить 1,5 моля фумарової кислоти на моль згаданої похідної 9,9-алкілен-3,7-діазабіцикло[3.3.1]нонану.
11. Спосіб лікування і/або профілактики за будь-яким з пп. 1-10, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де згадана сполука 3,7-діазабіцикло[3.3.1]нонану є сіллю хлористоводневої кислоти.
12. Фармацевтичний продукт, який містить як лікарський засіб в рідкій фармацевтичній композиції терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану формули І, принаймні її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, як визначено у будь-якому з пп. 1-11, і етикетку, листок і/або пакувальний вкладиш, які вказують, що згадана похідна 3,7-діазабіцикло[3.3.1]нонану формули І може бути введена ступенево, повністю переривчасто і/або необов'язково тільки частково безперервно, переважно двоетапним введенням двох фаз, що вводять безперервно.
13. Фармацевтичний продукт за п. 12, який відрізняється тим, що на етикетці, листку або пакувальному вкладиші викладено стисло, що рідка фармацевтична композиція застосовна для інфузії, переважно для ступеневого інфузійного введення, причому необов'язково кожен етап є частково безперервним інфузійним введенням, переважно для двоетапного інфузійного введення двох фаз, що вводять безперервно інфузією.
14. Фармацевтичний продукт за будь-яким з пп. 12 або 13, який відрізняється тим, що на етикетці, листку або пакувальному вкладиші викладено стисло, що похідна 3,7-діазабіцикло[3.3.1]нонану може бути введена згідно зі схемою введення, за якою рідку фармацевтичну композицію, що містить першу терапевтично ефективну кількість згаданої похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, що є достатньою для лікування і/або профілактики антиаритмічних нападів у людини, вводять впродовж першого періоду часу приблизно 10±2 хв., переважно приблизно 10±1 хв., найбільш переважно приблизно 10±0,5 хв., і другу терапевтично ефективну кількість згаданої похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, що є достатньою для продовження лікування і/або профілактики, вводять впродовж другого періоду часу приблизно 20±5 хв., переважно приблизно 20±3 хв., найбільш переважно приблизно 20±1 хв.
15. Фармацевтичний продукт за будь-яким з пп. 12-14, де рідка фармацевтична композиція містить як лікарський засіб терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, як визначено в будь-якому зпп. 3-11.
Текст
1. Спосіб лікування і/або профілактики антиаритмічних нападів у людини, переважно при конверсії недавнього початку передсердної фібриляції (Afib) або тріпотіння в нормальний синусовий ритм (NSR) у людини, де рідку фармацевтичну композицію, що містить терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану формули І 2 ,б 3 85546 де R6 означає водень, галоїд, нижчий алкіл або нижчий алкокси, та R7 означає водень, галоїд, нижчий алкіл або нижчий алкокси, або її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, вводять згаданому пацієнту ступенево, повністю переривчастим і/або необов'язково тільки частково безперервним шляхом введення, переважно двоетапним введенням двох фаз, що вводять безперервно. 2. Спосіб лікування і/або профілактики за п. 1, де рідку фармацевтичну композицію, що містить згадану терапевтично ефективну кількість похідної 3,7-діазабіцикло[3.3.1]нонану або її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, вводять шляхом інфузійного введення, переважно ступеневим інфузійним введенням, причому необов'язково кожен етап є частково безперервним інфузійним введенням, переважно двоступеневим інфузійним введенням двох фаз, що вводять безперервною інфузією. 3. Спосіб лікування і/або профілактики за будьяким з пп. 1 або 2, де рідку фармацевтичну композицію, що містить першу терапевтично ефективну кількість згаданої похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, що є достатньою для лікування і/або профілактики антиаритмічних нападів у людини, вводять впродовж першого періоду часу приблизно 10±2 хв., переважно приблизно 10±1 хв., найбільш переважно приблизно 10±0,5 хв., і другу терапевтично ефективну кількість згаданої похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, що є достатньою для продовження лікування і/або профілактики антиаритмічних нападів у людини, вводять впродовж другого періоду часу приблизно 20±5 хв., переважно приблизно 20±3 хв., найбільш переважно приблизно 20±1 хв. 4. Спосіб лікування і/або профілактики за будьяким з пп. 1-3, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де R1 означає алкільну гр упу, що містить 1-6 атомів вуглецю, або циклоалкільну групу, що містить 4-7 атомів вуглецю. 5. Спосіб лікування і/або профілактики за будьяким з пп. 1-2, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де R4 означає алкільну гр упу, що містить 1-6 атомів вуглецю, циклоалкілалкільну групу, що містить 4-7 атомів вуглецю, або груп у, що відповідає формулі б. 6. Спосіб лікування і/або профілактики за будьяким з пп. 1-2, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де R1 означає алкільну гр упу, що містить 1-6 атомів вуглецю. або циклоалкільну групу, що містить 4-7 4 атомів вуглецю, та R4 означає алкільну групу, що містить 3-6 атомів вуглецю, циклоалкілалкільну груп у, що містить 4-7 атомів вуглецю. 7. Спосіб лікування і/або профілактики за п. 6, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де сполука вказаного 3,7-діазабіцикло[3.3.1]нонану являє сполуку 9,9-алкілен-3,7діазабіцикло[3.3.1]нонану формули І, де R2 та R3 утворюють разом алкіленовий ланцюг, що містить 4-5 атомів вуглецю, a R1 та R4 означають кожен незалежно один від одного лінійну або розгалужену алкільну групу з 3-4 атомами вуглецю або циклопропілметильну груп у. 8. Спосіб лікування і/або профілактики за будьяким з пп. 1-2, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де сполука вказаного 3,7-діазабіцикло[3.3.1]нонану являє сполуку 9,9-алкілен-3,7діазабіцикло[3.3.1]нонану, що містить 1,5 моля фумарової кислоти на моль сполуки формули І. 9. Спосіб лікування і/або профілактики за п. 8, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де згадану сполуку 3,7-діазабіцикло[3.3.1]нонану вибирають із групи, яка складається з N,N'дициклопропілметил-9,9-тетраметилен-3,7діазабіцикло[3.3.1]нонану, N-ізобутил-N'-ізопропіл9,9-пентаметилен-3,7-діазабіцикло[3.3.1]нонану. 10. Спосіб лікування і/або профілактики за будьяким з пп. 1-6 та 8, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де згадана сполука 3,7-діазабіцикло[3.3.1]нонану являє собою сіль фумарової кислоти з N,N'дициклопропілметил-9,9-тетраметилен-3,7діазабіцикло[3.3.1]нонаном або N-ізобутил-N'ізопропіл-9,9-пентаметилен-3,7діазабіцикло[3.3.1]нонаном, що містить 1,5 моля фумарової кислоти на моль згаданої похідної 9,9алкілен-3,7-діазабіцикло[3.3.1]нонану. 11. Спосіб лікування і/або профілактики за будьяким з пп. 1-10, де вводять терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, де згадана сполука 3,7-діазабіцикло[3.3.1]нонану є сіллю хлористоводневої кислоти. 12. Фармацевтичний продукт, який містить як лікарський засіб в рідкій фармацевтичній композиції терапевтично ефективну кількість принаймні однієї похідної 3,7-діазабіцикло[3.3.1]нонану формули І, принаймні її фізіологічно прийнятної кислотноадитивної солі і/або сольвату, як визначено у будь-якому з пп. 1-11, і етикетку, листок і/або пакувальний вкладиш, які вказують, що згадана похідна 3,7-діазабіцикло[3.3.1]нонану формули І може бути введена ступенево, повністю переривчасто 5 85546 6 і/або необов'язково тільки частково безперервно, переважно двоетапним введенням двох фаз, що вводять безперервно. 13. Фармацевтичний продукт за п. 12, який відрізняється тим, що на етикетці, листку або пакувальному вкладиші викладено стисло, що рідка фармацевтична композиція застосовна для інфузії, переважно для ступеневого інфузійного введення, причому необов'язково кожен етап є частково безперервним інфузійним введенням, переважно для двоетапного інфузійного введення двох фаз, що вводять безперервно інфузією. 14. Фармацевтичний продукт за будь-яким з пп. 12 або 13, який відрізняється тим, що на етикетці, листку або пакувальному вкладиші викладено стисло, що похідна 3,7-діазабіцикло[3.3.1]нонану може бути введена згідно зі схемою введення, за якою рідку фармацевтичну композицію, що містить першу терапевтично ефективну кількість згаданої похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або со львату, що є достатньою для лікування і/або профілактики антиаритмічних нападів у людини, вводять впродовж першого періоду часу приблизно 10±2 хв., переважно приблизно 10±1 хв., найбільш переважно приблизно 10±0,5 хв., і другу терапевтично ефективну кількість згаданої похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, що є достатньою для продовження лікування і/або профілактики, вводять впродовж другого періоду часу приблизно 20±5 хв., переважно приблизно 20±3 хв., найбільш переважно приблизно 20±1 хв. 15. Фармацевтичний продукт за будь-яким з пп. 12-14, де рідка фармацевтична композиція містить як лікарський засіб терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, як визначено в будь-якому з пп. 3-11. Даний винахід стосується застосування похідних 3,7-діазабіцикло[3.3.1]нонану, краще - похідних 9,9-алкілен-3,7-діазабіцикло[3.3.1]нонану та найкраще - тедисамілу, та їх фізіологічно прийнятних кислотно-адитивних солей і/або сольватів у вигляді рідких фармацевтичних препаратів для лікування і/або профілактики антиаритмічних явищ у людини, краще при конверсії недавнього початку фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм у пацієнтів. Крім того, винахід стосується способу лікування та фармацевтичних продуктів. Похідні 9,9-алкілен-3,7-діазабіциклононану формули І та їх фармакологічна активність відомі з опублікованого [патенту EP 103833, що відповідає патенту US 4450112 та патенту FI 76338]. Сполуки формули І є підгрупою похідних 9,9-N,N'тетразаміщених 3,7-діазабіцикло[3.3.1]нонану, що наведені в описах згаданих вище патентів, і можуть бути одержані описаними у них способами. Описи згаданих вище патентів розкривають, що сполуки мають корисні кардіотонічні властивості, особливо ефекти збереження кисню та вплив на швидкість серцевих скорочень і серцевий ритм, зокрема, і відрізняються високою фізіологічною переносимістю. Так, сполуки проявляють задовільну антиаритмічну дію навіть при низьких дозах. Більш того, небажаний негативний вплив на скорочувальну здатність серця надзвичайно незначний; тобто сполуки мають особливо сприятливе відношення антиаритмічного або рефрактерного періоду триваючої серцевої діяльності до негативних інотропних вторинних активностей. Крім того, як випливає з [патента US 5164401 на ім'я Burow та ін.], сполуки мають також тривалу діуретичну дію з сприятливим співвідношенням між натрієвою та калієвою екскрецією. Крім того, спеціальні солі та їх одержання з похідних 3,7-діазабіцикло[3.3.1]нонану, особливо похідних 9,9-алкілен-3,7-діазабіцикло[3.3.1]нонану, описані в [патенті US 324732]. Так, [патент US 5324732] описує солі згаданих сполук із фумаровою кислотою, що містять 1,5 моль фумарової кислоти на моль сполуки. Фібріляція передсердь (Afib) є найбільш широко розповсюдженою стійкою серцевою аритмією, що вимагає госпіталізації та вражає мільйони людей у всьому світі. Переважання Afib збільшується з віком і при наявності структурного серцевого захворювання, вона небагато частіше зустрічається в чоловіків, ніж у жінок. Фібріляція передсердь асоціюється зі значною смертністю й поширеністю захворювання та значно впливає на якість життя. Відновлення нормального синусового ритму (NSR) у пацієнтів із цими аритміями може поліпшити їх гемодинамічний стан, послабити симптоми та, можливо, знизити небезпеку емболії. Хоча це може бути досягнуто з використанням електроімпульсної терапії при постійному струмі, методика має обмеження, такі, як загальна анестезія та госпіталізація. Відповідно як притягальна альтернатива запропонована фармакологічна конверсія; із цією метою було випробувано велику кількість антиаритмічних препаратів. Однак багато із цих агентів мають серйозні побічні ефекти, такі, як потенціал для проаритмії, порушення функції лівого шлуночка (LV) або екстракардіальні небажані ефекти. Отже, існує необхідність у створенні нових антиаритмічних препаратів не тільки з гарною клінічною ефективністю, але також зі сприятливим профілем безпеки. Тедисаміл є антиаритмічним агентом нового класу III, що блокує множинні калієві канали та сповільнює синусовий ритм. Він продовжує потенційну тривалість як атріальної, так і вентрикулярної дії шляхом блокування перехідного зовнішнього It0, АТФ-залежного IK-АТФ та уповільнених випрямних калієвих струмів І Kr, IKs та І Ku . Тедисаміл 7 85546 подовжує потенційну тривалість дії сильніше в передсердях, ніж у шлуночках. На відміну від інших препаратів, що селективно блокують калієві канали, тедисаміл не має оборотні залежні від інтенсивності впливи на атріальну рефрактерність, що робить його набагато менш схожим на проаритмічний препарат. Нарешті, тедисаміл має також значні антистенокардичні й антиішемічні властивості. Даний проспективний, рандомізований, контрольований дослід виявив ефективність і безпеку тедисамілу для швидкої конверсії фібриляції передсердь (Afib) або тріпотіння передсердь (AfIu). Об'єктом винаходу є забезпечення нових фармацевтичних композицій та нових способів лікарського лікування пацієнтів, що потребують лікування і/або профілактиці антиаритмічних станів. Іншим об'єктом винаходу є забезпечення нових антиаритмічних композицій, що мають поліпшений ефект у людини, яка потребує в лікуванні і/або профілактиці антиаритмічних станів. Подальшою метою даного винаходу є забезпечення фармацевтичних продуктів, що пов'язані зі згаданими вище цілями. Цілі винаходу досягаються шляхом несподіваного виявлення того факту, що відомі сприятливі фармакологічні властивості похідних 3,7діазабіцикло[3.3.1]нонану, краще похідних 9,9алкілен-3,7-діазабіцикло[3.3.1]нонану та найкраще тедасамілу, та їх фармацевтично прийнятних кислотно-адитивних солей і/або сольватів, і/або депоформ згаданих сполук, особливо можуть бути надалі посилені при лікуванні і/або профілактиці антиаритмічних станів в пацієнтів, краще при конверсії недавнього початку фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм (NSR) людини, коли вводяться у вигляді рідкої композиції у відповідності зі специфічним шляхом введення або схемою замість повністю однократного і/або тривалого введення. Відповідно до подальших аспектів за винаходом, цілі досягаються шляхом забезпечення антиаритмічної рідкої фармацевтичної композиції, що включає антиаритмічну кількість, ефективну для людини, щонайменше однієї активної в антиаритмічному відношенні похідної 3,7діазабіцикло[3.3.1]нонану, як описано в даному винаході, способу лікування та фармацевтичних продуктів, адаптованих або придатних для специфічного та винахідницького шляху введення або схеми. Предметом винаходу тому є рідка фармацевтична композиція, що включає терапевтично ефективну кількість принаймні однієї похідної 3,7діазабіцикло[3.3.1]нонану, принаймні фізіологічно прийнятної її кислотно-адитивної солі і/або сольвату, і/або депо-форми, для лікування і/або профілактики антиаритмічних станів у пацієнтів, краще при конверсії недавнього початку фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм (NSR) людини, рідка фармацевтична композиція, яку краще застосовувати для ступінчастого, для повністю переривчастого і/або необов'язково для тільки частково безперервного введення, краще шляхом двоступінчастого введення двох фаз, що вводять безперервно. 8 Зокрема, предмет винаходу має відношення до рідкої фармацевтичної композиції, яка відрізняється тим, що вона придатна для інфузії, краще для ступінчастого інфузійного введення, причому необов'язково кожен етап є частково безперервним інфузійним введенням, краще шляхом двоступінчастого інфузійного введення двох фаз, що вводять щляхом безперервної інфузії. Термін «рідка» означає будь-яку текучу форму похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятну кислотно-адитивну сіль і/або сольват, і/або депо-форму, що придатні для введення людині. Отже, рідка композиція може бути розчином, емульсією, включаючи мікроемульсію та наноемульсію, або суспензією, включаючи мікросуспензію та наносуспензію. Терміни «ступінчасте» і/або «повністю переривчасте» вказують, що рідка композиція за винаходом не застосовується на етапі повністю однократного і/або безперервного введення або в схемі з повністю однократним і/або безперервним введенням, але застосовується або на одному етапі принаймні із двома фазами за схемою дози, що вводиться по-різному, або принаймні у два етапи за схемою дози, що вводить по-різному. Кожна фаза або етап можуть бути самі або безперервними або тільки частково безперервними. Найкраще, коли кожна фаза або етап є безперервним. Похідні 3,7-діазабіцикло[3.3.1]нонану, їх фізіологічно прийнятні кислотно-адитивні солі і/або сольвати, і/або їх депо-форми, які можуть бути застосовані за даним винаходом у фармацевтичних композиціях для лікування і/або профілактики антиаритмічних станів у пацієнтів, кращими при конверсії недавнього початку фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм (NSR) людини, є похідні 3,7діазабіцикло[3.3.1]нонану, що відповідають формулі І: І, де R1 означає алкільну груп у, що містить 1-6 атомів вуглецю, алкіленову груп у, що містить 3-6 атомів вуглецю, яка має подвійний зв'язок, що не зв'язується безпосередньо з атомом азоту, циклоалкільну груп у, що містить 4-9 атомів вуглецю, або бензильну гр упу, R2 означає (низч.)алкільну гр упу, і R3 означає (низч.)алкільну гр упу або R2 та R3 утворюють разом алкіленовий ланцюг, що містить 3-6 атомів вуглецю, і R4 означає алкільну груп у, що містить 1-6 атомів вуглецю, алкенільну групу, що містить 3-6 атомів вуглецю, що має подвійний зв'язок, який не зв'язується безпосередньо з атом азоту, циклоалкільну групу, що містить 4-9 атомів вуглецю, гр упу, що відповідає формулі а: 9 85546 а, де R5 означає водень, галоїд, (низч.)алкіл або (низч.)алкокси, та Z означає алкіленовий ланцюг, що містить 1-3 атома вуглецю, або пропеніленовий ланцюг, що має подвійний зв'язок, який спряжений з фенольною групою, або груп у, що відповідає формулі б: б, де R6 означає водень, галоїд, (низч.)алкіл або (низч.)алкокси, і R7 означає водень, галоїд, (низч.)алкіл або (низч.)алкокси, або їх фізіологічно прийнятна кислотно-адитивна сіль і/або сольват. Особливо корисними сполуками за винаходом є сполуки формули І, де R1 означає алкільну групу, що містить 1-6 атомів вуглецю, або циклоалкільну групу, що містить 4-7 атомів вуглецю. У додаткових кращих сполуках формули І замісник R4 означає алкільну гр упу, що містить 1-6 атомів вуглецю, циклоалкільну груп у, що містить 4-7 атомів вуглецю, або гр упу, що відповідає формулі б. Кращими сполуками, корисними за даним винаходом, є сполуки формули І, де R1 означає алкільну групу, що містить 3-6 атомів вуглецю, або циклоалкільну групу, що містить 4-7 атомів вуглецю, та R4 означає алкільну груп у, що містить 3-6 атомів вуглецю, або циклоалкільну групу, що містить 4-7 атомів вуглецю. Згадана похідна 3,7діазабіцикло[3.3.1]нонан може бути похідною 9,9алкілен-3,7-діазабіцикло[3.3.1]нонану формули І, де R2 та R3 утворюють разом алкіленовий ланцюг, що містить 4-5 атомів вуглецю, a R1 та R4 означають кожен незалежно один від одного лінійну або розгалужену алкільну групу з 3-4 атомами вуглецю або циклопропілметильну гр упу, та її фізіологічно прийнятною кислотно-адитивною сіллю і/або сольватом. Кращими солями для даної групи сполук є солі фумарової кислоти з похідною 9,9алкілен-3,7-діазабіцикло[3.3.1]нонану, що містять 1,5 моль фумарової кислоти на моль сполуки формули І. Додатковими кращими корисними сполуками за даним винаходом є сполуки, що вибрані із групи, яка містить N,N'-дициклопропілметил-9,9тетраметилен-3,7-діазабіцикло[3.3.1]нонан (тедисаміл), N-ізобутил-N'-ізопропіл-9,9-пентаметилен3,7-діазабіцикло[3.3.1]нонан та їх фізіологічно прийнятні кислотно-адитивні солі і/або сольвати. Кращими солями для даної групи сполук є солі 10 фумарової кислоти з N,N'-дициклопропілметил9,9-тетраметилен-3,7-діазабіцикло[3.3.1]нонаном (тедисамілом) або N-ізобутил-N'-ізопропіл-9,9пентаметилен-3,7-діазабіцикло[3.3.1]нонаном, що містять 1,5 моль фумарової кислоти на моль згаданої похідної 9,9-алкілен-3,7діазабіцикло[3.3.1]нонану. Альтернативно як кислотно-адитивні солі похідних 3,7-діазабіцикло[3.3.1]нонану, солі із хлористоводневою кислотою є також дуже корисними в контексті за даним винаходом. Особливо кращими похідними 3,7діазабіцикло[3.3.1]нонану є похідна 9,9-алкілен3,7-діазабіцикло[3.3.1]нонану тедисаміл та її фізіологічно сумісні кислотно-адитивні солі і/або сольвати, і/або депо-форми. Вони є найбільш кращими для застосування як сполуки в рідких фармацевтичних композиціях. Якщо застосовується кислотно-адитивна сіль тедисамілу, вона може краще застосовуватися за винаходом у формі гідрохлориду тедисамілу або у формі полуторафумарату тедисамілу. Додаткові фармакологічно сумісні кислотно-адитивні солі тедисамілу відомі з [EP 103833]. Так, солі з неорганічними кислотами, наприклад, сірчаною кислотою або галоїдоводневими кислотами, особливо хлористоводневою кислотою; або з органічними кислотами, наприклад, нижчими аліфатичними монокарбоновими або дикарбоновими кислотами, такими, як оцтова кислота, фумарова кислота, винна кислота, молочна кислота, малеїнова кислота, лимонна кислота або саліцилова кислота; або із сульфоновими кислотами, наприклад, нижчими алкілсульфоновими кислотами, такими, як метансульфонова кислота або бензолсульфонова кислота, необов'язково заміщеними за бензольним кільцем галоїдом або (низч.)алкілом, така, як n-толуолсульфонова кислота, є корисні як фізіологічно прийнятні кислотноадитивні солі сполук формули І. Несподівано було помічено, що 3,7,9,9тетразаміщені похідні 3,7діазабіцикло[3.3.1]нонану, що відповідають формулі І, відрізняються гарними посиленими ефектами в пацієнтів з антиаритмічними станами, особливо при конверсії недавнього початку фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм (NSR) людини, на додаток до вищезгаданих вже відомих загальних властивостей впливу на серце, при введенні у вигляді рідкої фармацевтичної композиції ступінчасто, повністю переривчастим і/або необов'язково тільки частково безперервним шляхом, краще при застосуванні у ви гляді двоступінчастого введення двох фаз, які безперервно вводять, за схемою за даним винаходом, як описано в більш ілюстративних подробицях нижче, зокрема, при введенні в режимі інфузії. Наприклад, рідка фармацевтична композиція за даним винаходом може бути такою, що містить першу терапевтично ефективну кількість згаданої похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, що є достатньою для лікування і/або профілактики антиаритмічних станів у пацієнтів, яка вводиться впродовж першого 11 85546 періоду часу приблизно 10±2хв., краще приблизно 10±1хв., найкраще приблизно 10±0,5хв., і др угу, що вводиться згодом, терапевтично ефективну кількість згаданої похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, що є достатньою для продовження лікування і/або профілактики, що вводиться впродовж другого періоду часу приблизно 20±5хв., краще приблизно 20±3хв., найкраще приблизно 20±1хв. Дані періоди часу є найбільш бажаними, однак кваліфікований спеціаліст може модифікувати певною мірою дану схему доз ування. Подальший варіант втілення за винаходом стосується фармацевтичних продуктів. Отже, винахід стосується фармацевтичного продукту і/або упаковки, що містить як лікарський засіб у рідкій фармацевтичній композиції терапевтично ефективну кількість щонайменше однієї похідної 3,7діазабіцикло[3.3.1]нонану, щонайменше її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, як визначено вище, етикетку, листок і/або пакувальний вкладиш, які вказують, що згадана похідна 3,7діазабіцикло[3.3.1]нонану може бути введена ступінчасто, повністю переривчасто і/або необов'язково тільки частково безперервно, краще двоступінчастим введенням двох фаз, що вводять безперервно. Такий фармацевтичний продукт і/або така упаковка за винаходом можуть відрізнятися тим, що на етикетці, листку або пакувальному вкладиші зазначається, що рідка фармацевтична композиція може бути застосована для інфузії, краще для ступінчастого інфузійного введення, причому необов'язково кожен етап є частково безперервним інфузійним введенням, краще шляхом двоступінчастого інфузійного введення двох фаз, що вводять безперервною інфузією. Зокрема, у даному варіанті втілення за винаходом фармацевтичний продукт і/або упаковка відрізняються тим, що на етикетці, листку і/або пакувальному вкладиші зазначається, що похідна 3,7діазабіцикло[3.3.1]нонану може бути введена у відповідності зі схемою введення, у якій рідка фармацевтична композиція, що включає першу терапевтично ефективну кількість згаданої похідної 3,7-діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, що є достатньою для лікування і/або профілактики антиаритмічних станів у пацієнтів, вводиться впродовж першого періоду часу приблизно 10±2хв., краще приблизно 10±1хв., найкраще приблизно 10±0,5хв., та другу терапевтично ефективну кількість згаданої похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, що є достатньою для продовження лікування і/або профілактики, вводиться впродовж другого періоду часу приблизно 20±5хв., краще приблизно 20±3хв., найкраще приблизно 20±1хв. Бажано фармацевтичний продукт і/або упаковка відповідно до варіанта втілення за винаходом містять як лікарський засіб терапевтично ефективну кількість щонайменше однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнят 12 ної кислотно-адитивної солі і/або сольвату, і/або депо-форми, як визначено вище, у рідкій фармацевтичній композиції. У ще додатковому варіанті втілення, винахід стосується способу лікування і/або профілактики. Отже, винахід включає спосіб лікування і/або профілактики антиаритмічних станів у пацієнтів, краще при конверсії недавнього початку фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм (NSR) людини, де рідка фармацевтична композиція, що включає терапевтично ефективну кількість щонайменше однієї похідної 3,7-діазабіцикло[3.3.1]нонану або її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, вводиться згаданому пацієнту шля хом ступінчастого, повністю переривчастого і/або необов'язково тільки частково безперервного введення, краще шляхом двоступінчастого введення двох фаз, які безперервно вводяться. Зокрема, у даному способі лікування і/або профілактики за винаходом рідка фармацевтична композиція, що включає згадану терапевтично ефективну кількість похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, вводиться шляхом інфузії, краще східчастим інфузійним введенням, причому кожен етап необов'язково є частково безперервним інфузійним введенням, краще шляхом двоступінчастого введення двох фаз, які безперервно вводяться. Кращий спосіб лікування і/або профілактики за винаходом відрізняється тим, що рідка фармацевтична композиція, що включає першу терапевтично ефективну кількість згаданої похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, що є достатньою для лікування і/або профілактики антиаритмічних станів у пацієнтів, вводиться впродовж першого періоду часу приблизно 10±2хв., краще приблизно 10±1хв., найкраще приблизно 10±0,5хв., та другу терапевтично ефективну кількість згаданої похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, що є достатньою для продовження лікування і/або профілактики, вводиться впродовж другого періоду часу приблизно 20±5хв., краще приблизно 20±3хв., найкраще приблизно 20±1хв. У даному способі лікування і/або профілактики за винаходом вводиться бажано терапевтично ефективна кількість щонайменше однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, як визначено докладно вище. Відповідно до найбільш кращих варіантів втілення даного винаходу, наприклад, рідкі фармацевтичні композиції придатні для введення у вигляді двоступінчастого інфузійного режиму, де впродовж першого періоду часу приблизно 10±2хв., краще приблизно 10±1хв., найкраще приблизно 10±0,5хв. вводиться перша терапевтично ефективна кількість згаданої похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, що є достатньою для лікування і/або 13 85546 профілактики антиаритмічного стану в пацієнта, і потім згодом для продовження лікування і/або профілактики друга терапевтично ефективна кількість згаданої похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, що є достатньою для продовження лікування і/або профілактики, вводиться впродовж другого періоду часу приблизно 20±5хв., краще приблизно 20±3хв., найкраще приблизно 20±1хв. Для даних періодів часу найбільш кращі дози для двох етапів або фаз будуть наведені в прикладах нижче дещо докладніше. Однак ясно, що кваліфікований спеціаліст, якщо потрібно, може модифікувати певною мірою дану схему дозування. Звичайно загальна кількість похідної 3,7діазабіцикло[3.3.1]нонану, краще тедисамілу або однієї з його солей, перерахована на кількість основної сполуки, може змінюватися від приблизно 0,16мг/кг до приблизно 0,64мг/кг. Приклади специфічних кількостей, які повинні бути введені в кращому режимі двоступінчастої інфузії, усередині даного діапазону можуть досягати до 0,16мг/кг, 0,24мг/кг, 0,32мг/кг, 0,48мг/кг або 0,64мг/кг. Приблизно половина (наприклад, 50±5мас. %) від загальної кількості (100мас. %) вводиться в перший період часу, наприклад, 10±2хв., і приблизно друга половина (наприклад, решта 50±5мас. % до 100мас. %) вводиться впродовж другого періоду часу, наприклад, приблизно 20±5хв. У специфічному прикладі за даним винаходом використовували 0,32мг/кг тедисамілу-основи, вводячи шляхом інфузії половину дози впродовж 10хв. та половину дози впродовж 20хв. Як правило, даний винахід можна застосовувати до пацієнтів будь-якого віку і/або обох статей. Однак у специфічному варіанті втілення винаходу досягнення за даним винаходом особливо корисні для лікування і/або профілактики антиаритмічних станів у пацієнтів чоловічої статі, краще при конверсії недавнього початку фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм (NSR) у пацієнтів чоловічої статі. Отже, у даному особливому аспекті, винахід стосується також способу лікування і/або профілактики антиаритмічних станів у пацієнтів чоловічої статі, краще при конверсії недавнього прояву фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм (NSR) у пацієнтів чоловічої ста ті, де рідка фармацевтична композиція, що включає терапевтично ефективну кількість щонайменше однієї похідної 3,7діазабіцикло[3.3.1]нонану, її фізіологічно прийнятної кислотно-адитивної солі і/або сольвату, і/або депо-форми, вводиться згаданим пацієнтам чоловічої статі східчастим, повністю переривчастим і/або необов'язково тільки частково безперервним шляхом введення, але найкраще, коли призначається у вигляді двоступінчастого введення двох фаз, що вводять безперервно. У даному контексті винахід включає також рідкі фармацевтичні композиції, які корисні також для ступінчастого, для повністю переривчастого і/або необов'язково для тільки частково безперервного введення, але найкраще корисні для призначення у вигляді двосту 14 пінчастого введення двох фаз, що вводять безперервно, похідних 3,7-діазабіцикло[3.3.1]нонану, наприклад, тедисамілу та його кислотноадитивних солей пацієнту чоловічої статі. Додатковий аспект даного варіанта втілення за винаходом, що стосується лікування пацієнтів чоловічої статі, спрямований на фармацевтичний продукт і/або упаковку, що містить як лікарський засіб у рідкій фармацевтичній композиції терапевтично ефективну кількість щонайменше однієї похідної 3,7-діазабіцикло[3.3.1]нонану, щонайменше її фізіологічно прийнятні солі і/або сольвату, і/або депоформи, як визначено додатково вище за винаходом, та етикетку, листок і/або пакувальний вкладиш, де зазначено, що згадана похідна 3,7діазабіцикло[3.3.1]нонану може бути введена пацієнту чоловічої статі ступінчасто, повністю переривчасто і/або необов'язково тільки частково безперервно, найкраще у вигляді двоетапного введення двох фаз, що вводять безперервно. Подробиці, описані в контексті вищезгаданих загальних варіантів втілення за винаходом, повністю застосовні також до даного специфічного варіанта втілення винаходу, що пов'язаний з лікуванням і/або профілактикою антиаритмічних станів у пацієнтів чоловічої статі. Гарний антиаритмічний ефект сполук формули І у людини може бути продемонстрований за допомогою фармакокінетичної/фармакодинамічної (ФК/ФД) моделі та підтверджується даними клінічного дослідження, які доводять несподівану збільшену корисність й ефективність похідних 3,7діазабіцикло[3.3.1]нонану, наприклад, тедисамілу та його кислотно-адитивних солей, при лікуванні і/або профілактиці антиаритмічних ефектів у людини, краще при конверсії недавнього початку фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм (NSR) у пацієнтів при введенні у вигляді рідкої фармацевтичної композиції за схемою ступінчастого, повністю переривчастого і/або необов'язково тільки частково безперервного введення згідно з даним винаходом. Опис структури й результатів клінічного дослідження Створення двоетапного інфузійного режиму для швидкої конверсії недавнього початку предсердної фібриляції/тріпотіння в нормальний синусовий ритм із використанням ФК/ФД моделі Передумови: тедисаміл (ТЕДИ) є новим антиаритмічним агентом класу III, що блокує при розвитку різні вихідні струми калію, такі, як IKur, Ito, IKr, IKs та IKTP, для швидкої конверсії недавнього початку фібриляції передсердь (Afib) або тріпотіння передсердь (AfI) у нормальний синусовий ритм (NSR). Внутрішньовенні дози ТЕДИ-основи до 0,24мг/кг, інфузовані впродовж 10хв., не роблять ніякої конверсії в пацієнтів з Afib/AfI. Був розроблений двоетапний інфузійний режим з використанням ФК/ФД моделі, щоб збільшити концентрацію/вплив препарату в ділянці дії. ФК/ФД модель була заснована на даних вивчення однократної інфузії. Трьохкомпартментна ФК модель і результат компартментної моделі з лінійним зв'язком дали найкращий збіг. Модель для ФД ефекту була 15 85546 простою лінійною моделлю. Результати моделювання були оцінені в подвійному сліпому, контрольованому плацебо, рандомізованому, що складається із двох періодів, перехресному дослідженні на 18 здорових суб'єктах чоловічої статі, у якому використали двоетапний інфузійний режим з 0,32мг/кг ТЕДИ-основи, инфузируя половину дози впродовж 10хв. і половину дози впродовж 20хв. Ціль: завданнями дослідження були оцінка безпеки та переносимості ТЕДИ, кореляція між концентраціями ТЕДИ в плазмі, а також QT, QTc і швидкістю серцевих скорочень та порівняння цих результатів з даними стимуляції. Способи та результати: ТЕДИ був безпечний і добре переноситься. Очікувана ФД дія, тобто подовження інтервалів QT та QTc та чітке зниження швидкості серцевих скорочень спостерігали впродовж 2год. ФК та ФД результати досить близько збігалися зі стимуляціями, що основані на ФК/ФД моделі однократної інфузії: оцінки стимуляції, основані на однократній інфузії, перебували в межах 95% довірчого інтервалу поблизу прогнозованого вибіркового середнього значення дослідження. Висновок: двоетапний інфузійний режим є сприятливим при введенні похідних 3,7діазабіцикло[3.3.1]нонану, наприклад, тедисамілу та його кислотно-адитивних солей, для лікування і/або профілактики антиаритмічних ефектів, краще для конверсії недавнього прояву фібриляції передсердь (Afib) або тріпотіння передсердь у нормальний синусовий ритм (NSR) при введенні у вигляді рідкої фармацевтичної композиції за схемою ступінчастого, повністю переривчастого і/або необов'язково тільки частково безперервного введення, у такий спосіб збільшуючи час впливу на фізіологічній ділянці ефекту. Наступна виписка зі звіту про клінічні випробування представляє додаткові подробиці наведеної в прикладах двоетапної інфузійної методики Подвійне сліпе плацебо, що контолюється, рандомізоване, з однократною внутрішньовенною дозою, що складається із двох періодів перехресного дослідження для оцінки безпеки, переносимості, фармакодинаміки та фармакокінетики в ході та після двоетапної інфузії тедисамілу в здорових суб'єктів чоловічої статі було проведено з наступним препаратом і дозами: дигідрохлорид тедисамілу (0,4мг/кг маси тіла), інфузований впродовж 30хв. Цілі 1. Оцінити безпеку та переносимість тедисамілу в здорових суб'єктів чоловічої статі в ході та після схеми двоетапної інфузії (0,4мг/кг маси тіла, інфузовані впродовж 30хв., з половиною дози, що інфузована впродовж 10хв., і половиною дози, що інфузована впродовж 20хв., що залишаються). 2. Досліджувати кореляцію між концентраціями тедисамілу в плазмі, фармакодинамічними змінними QT, QTc та серцевим ритмом, обчисленими на основі RR-інтервалу, використовуючи ФК/ФД модель, та порівняти ці результати з результатами, отриманими від попереднього стимуляційного дослідження. 16 Методологія Це було одноцентрове, подвійне сліпе, контрольоване плацебо, рандомізоване, з однократною внутрішньовенною дозою, що складається із двох періодів перехресного дослідження. Суб'єкти були рандомізовано розподілені по послідовності лікування або тедисаміл-плацебо, або плацеботедисаміл. Число пацієнтів (планованих, відібраних, рандомізованих й аналізованих): планованих 18, відібраних - 27, рандомізованих - 18, аналізованих - 18 у ФК/ФД аналізах й аналізах безпеки. Діагноз й основний критерій для включення Суб'єкти включалися в дослідження, якщо тільки вони були здоровими чоловіками, їх вік був у діапазоні 18-40 років (включно), індекс їх маси тіла (IMT) був між 18кг/м 2 та 28кг/м 2. Досліджуваний продукт, доза та тип введення: дигідрохлорид тедисамілу; концентрація 2мг/мл; доза 0,4мг/кг маси тіла, інфузовані впродовж 30хв., при половині дози, що інфузована впродовж 10хв., і половині дози, що інфузована впродовж 20хв., що залишаються. Шлях введення -внутрішньовенний. Тривалість лікування Один день на період, при якому проводиться інфузія впродовж загальної тривалості часу 30 хв. Обоє введення препарату були розділені періодом промивання в один тиждень. Критерії оцінки Ефективність/фармакодинаміка Електрокардіограми (ЕКГ) з 12 відведеннями були записані в декількох точках у часі, щоб досліджувати фармакодинамічні ефекти тедисамілу (впливу на QT та QTc) у ході та після інфузії. Максимальне значення та максимальне збільшення були отримані для QT та QTc, і мінімальне значення та максимальне зниження були отримані для серцевого ритму. Були також обчислені площа під кривій [AUC (0-24)], максимум для скоректованих за допомогою плацебо QTc та QT й AUC(0-24) і мінімум для скоректованого за допомогою плацебо серцевого ритму. Безпека Відбірні оцінки включали дослідження фізичного стану, ЕКГ, скринінг на ВІЛ/гепатит, вимірювання кров'яного тиску та швидкості серцевих скорочень, скринінг на препарат у сечі, пробу на алкоголь у види хуваному повітрі й історію хвороби. Наступні оцінки включали дослідження фізичного стану, ЕКГ, вимірювання кров'яного тиску, швидкості серцевих скорочень і питання про побічні ефекти й супутню лікарську терапію. У ході суп утнього введення тедисамілу реєстрували кров'яний тиск, швидкість серцевих скорочень та ЕКГ. Побічні ефекти й супутню лікарську терапію контролювали впродовж усього дослідження. Фармакокінетика Зразки крові для визначення концентрації тедисамілу в плазмі брали в різні точки часу в ході та після внутрішньовенного введення препарату в обидва періоди випробувань. Наступні фармакокінетичні параметри були визначені: AUC(O-inf), AUC(0-t), максимальна концентрація С mах, час максимальної концентрації в плазмі Тmах, час напіввиведення t1/2, CL (кліренс), MRT (середній час знаходження), і багато які з даних, які отримані у 17 85546 точках, враховували при визначенні кінцевого часу напіввиведення. Статистичні методики Фармакодинаміка Дані, отримані від суб'єктів, які завершили обидва періоди дослідження, вважалися дійсними для фармакодинамічного/фармакокінетичного аналізу. Описову статистику ЕКГ проводили для інтервалів QT, QTs, RR, PR, QRS і для швидкості серцевих скорочень із урахуванням лікування (тедисаміл, плацебо й «тедисаміл-плацебо») та тимчасової точки. Індивідуальні та середні (середні арифметичні значення ± стандартне відхилення (SD)) профілі часу для інтервалів ЕКГ і серцевого ритму були графічно представлені для обох видів лікування. Отримані параметри, тобто максимальне значення й максимальне збільшення для QTc й QT, та максимальне зниження швидкості серцевих скорочень були піддані окремим аналізам (ко)варіантності (коваріантність тільки для максимальних і мінімальних значень), включаючи об'єкт, лікування, послідовність і період як групові ефекти (та індивідуальне значення попередньої дози як коварианта). Точкові оцінки та 95% довірчі інтервали були створені для розходження «тедисамілплацебо» з використанням залишкової варіантності. Модельні припущення були перевірені шляхом візуального контролю графіків, що залишилися. Додатково описові статистичні дані були розраховані для параметрів, одержаних від лікування, і для розходження «тедисаміл-плацебо». Описові статистичні дані для скоректованих за допомогою плацебо AUC(0-24) значень QTc та QT і швидкості серцевих скорочень і скоректованого за допомогою плацебо максимального ефекту (максимуму для QTc та QT і мінімуму для швидкості серцевих скорочень) були обчислені. Крім того, були отримані 95% довірчі інтервали, основані на нормально розподілених результатах. Безпека Суб'єкти, які одержували досліджуваний лікарський засіб, вважалися дійовими для оцінки безпеки. Побічні реакції, які виникали в результаті лікування, що визначались як будь-яка побічна реакція, що є присутньою на вихідному рівні, що посилюється, або будь-яка реакція, що починається після терапії досліджуваним лікарським засобом, були підсумовані за допомогою терміна COSTART для кожної групи, що одержувала лікування. Кожна побічна реакція оцінювалася по частоті появи, тривалості, інтенсивності, вжитим заходам, результату та відношенню до введення досліджуваного лікарського засобу. Побічні реакції були внесені в список для кожного суб'єкта. Перерахування аномальних або значень, що випадають із діапазону, для кожного суб'єкта були представлені для основних показників стану організму, лабораторних аналізів і фізичних досліджень. Побічні реакції, кров'яний тиск, серцевий 18 ритм і клінічні лабораторні дані були аналізовані описово й розглянуті, щоб оцінити безпеку для всіх рандомізованих суб'єктів. Будь-які клінічні аномалії були описані. Фармакокінетика Геометричні середні значення та відповідні 90% довірчі інтервали були обчислені для концентрації тедисамілу в кожній тимчасовій точці, для AUC, AUC(0-t), CL та Смакс. Середні арифметичні значення та відповідні 90% довірчі інтервали були обчислені для інших змінних величин (Vss, lz, t1/2, MRT). Значення Тмакс було описано з використанням мінімуму, медіани, максимуму та частоти показань. Криві індивідуальної та середньої концентрації в плазмі залежно від часу були представлені у вигляді графіків з використанням як лінійної, так і логарифмічної шкали. Фармакодинаміка/фармакокінетика Нелінійні моделі змішаних ефектів використовували, щоб охарактеризувати фармакокінетику й фармакодинамику тедисамілу після двоетапної інфузії. Вибіркові середні прогнозовані профілі й межі довірчості впродовж часу були отримані із прогнозованих PK та PD профілів, генерованих для кожного суб'єкта. Фармакокінетична та фармакодинамічна модель інфузії тедисамілу, створена в ході раннього дослідження однократної інфузії, була підтверджена у три етапи: і) була визначена сама придатна PK модель за сукупністю даних однократної інфузії; іі) об'єднаний PK/PD аналіз був здійснений за сукупністю даних, збільшеної за допомогою даних дослідження однократної інфузії; ііі) вибіркові середні PK/PD прогнозовані профілі, що основані на стимуляціях, були зіставлені з такими, що основані на дослідженні однократної інфузії. Неосновні контролі здійснювали за допомогою загальних залишкових графіків і графіків значень, що спостерігаються, проти очікуваних. PK/PD компартментні моделі PK модель для концентрації в плазмі (Cп) була трьохкомпартментною постійною інфузійною моделлю. Щоб моделювати PD впливи, що спостерігаються, на параметри ЕКГ, була використана послідовна PK/PD модель ефект-компартмент із лінійним зв'язком. Аналізи популяції Програма NONMEM V була використана для всього фармакокінетичного моделювання. PK/PD лінійно зв'язана модель була придатна з використанням SAS macro NLINMIX для нелінійного змішаного моделювання. Підсумок і висновки Результати ефективності Фармакодинаміка Результати описової статистики для отриманих параметрів інтервалів QT, QTc і серцевого ритму підсумовані нижче в Таблиці А. 19 85546 20 Таблиця А Стисле зведення аналізів отриманих параметрів Параметр Інтервал QT (мсек) Інтервал QTc Макс. (мсек) Серцевий ритм (удари за хв) Тедисаміл, середнє арифметичне (станд. відхилення) 474,2 (39,2) 76,0 (22,4) 455,9 (30,0) 61,1 (30,3) 49,2 (7,0) 10,6(3,8) Отриманий параметр Максимум Макс. збільшення Максимум Збільшення Мінімум Макс. зниження Плацебо, середнє арифметичне (станд. відхилення) 416,9 (19,4) 18,0 (11,5) 421,9 (21,5) 27,0 (13,9) 52,7 (4,8) 6,4 (3,4) Результати аналізів отриманих параметрів інтервалів QT, QTc та серцевого ритму для тедисамілу-плацебо наведені в таблиці нижче. Таблиця Б Результати аналізів отриманих параметрів Параметр Інтервал QT (мсек) Інтервал QTc (мсек) Серцевий ритм (удари за хв) Отриманий параметр Максимум Макс. збільшення Максимум Макс. збільшення Мінімум Макс. зниження Оцінка (ТЕДИ-плацебо) 58,4 57,9 34,0 34,1 -4,01 4,22 Для аналізів максимуму або мінімуму значення попередньої дози розглядалися як ковариант. Спостерігалося помітне подовження інтервалів QT й QTc та різне зниження швидкості серцевих скорочень, що показане за допомогою статистичного аналізу отриманих параметрів, наведеного вище. Кожне з наведених вище порівнянь було статистично значимим (р
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for treatment and/or prevention of arrhythmic events
Автори англійськоюSTRAUB MATTHIAS, JANSEN JOHANNES WILHELMUS CATH, DE VRIES MICHIEL HENRICUS, STEINBORN CLAUS RUDOLF, CAUTREELS WERNER
Назва патенту російськоюСпособ лечения и/или профилактики аритмических приступов
Автори російськоюШтрауб Маттиас, Янсен Йоханнес Вильхельмус Катарине Мария, де Вриес Михель Хенрикус, Штайнборн Клаус Рудольф, Каутреельс Вернер
МПК / Мітки
МПК: A61P 9/06, A61K 31/439
Мітки: антиаритмічних, лікування, спосіб, нападів, профілактики
Код посилання
<a href="https://ua.patents.su/22-85546-sposib-likuvannya-i-abo-profilaktiki-antiaritmichnikh-napadiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування і/або профілактики антиаритмічних нападів</a>
Попередній патент: Пристрій для лиття під тиском фасонних виробів з пластмаси
Наступний патент: Спосіб та пристрій для передачі даних по зворотному каналу в системах зв’язку
Випадковий патент: Спосіб виробництва порошкоподібного соусу