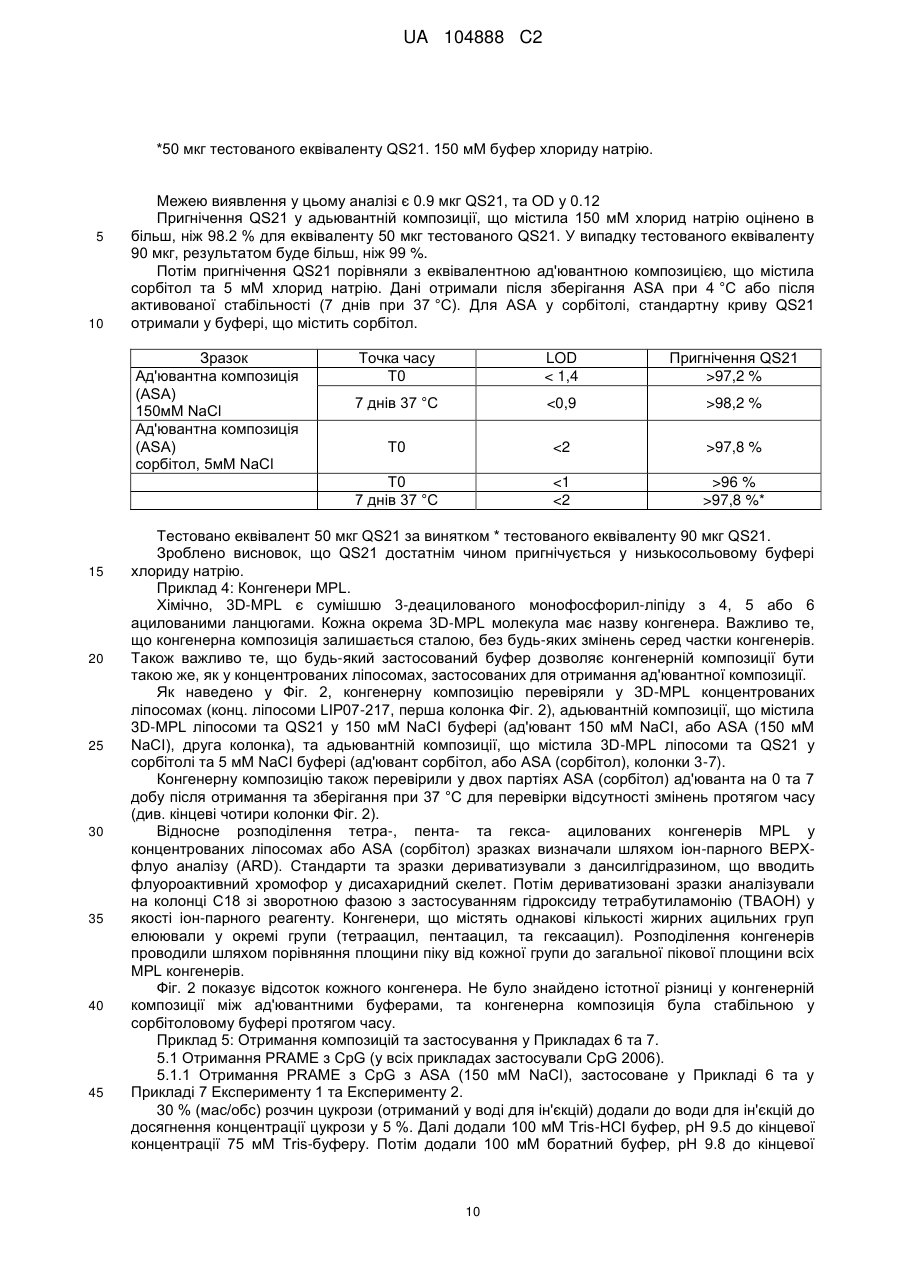
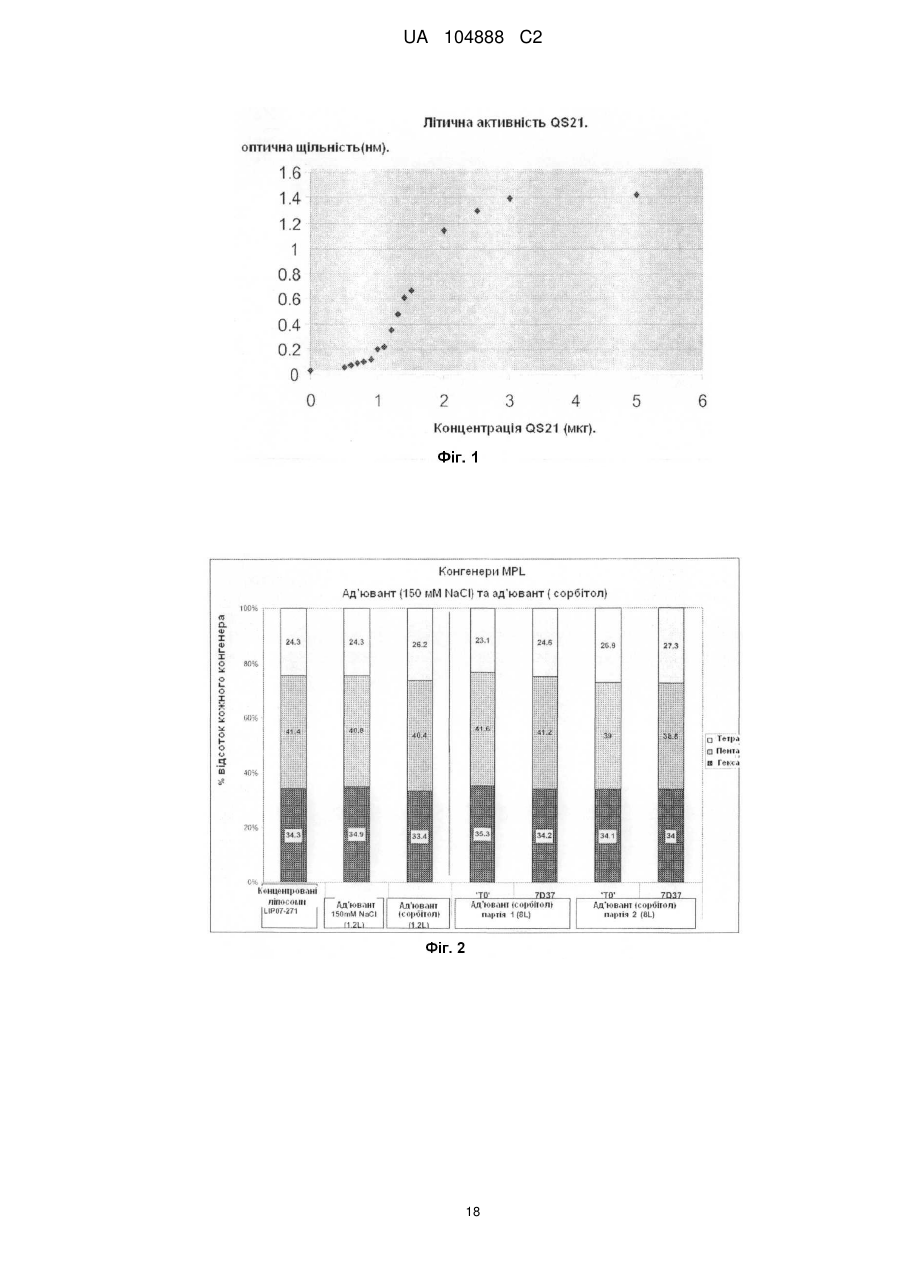
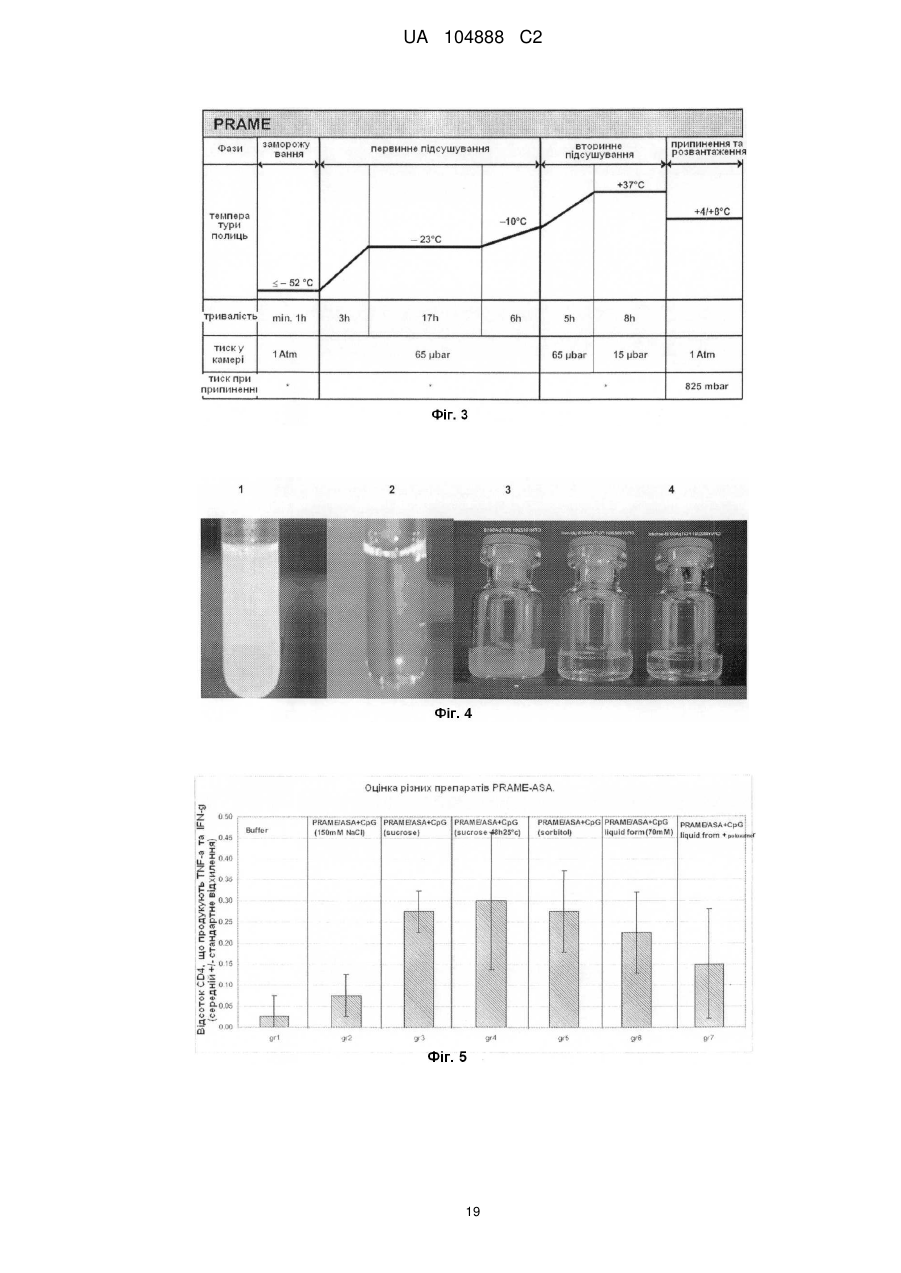
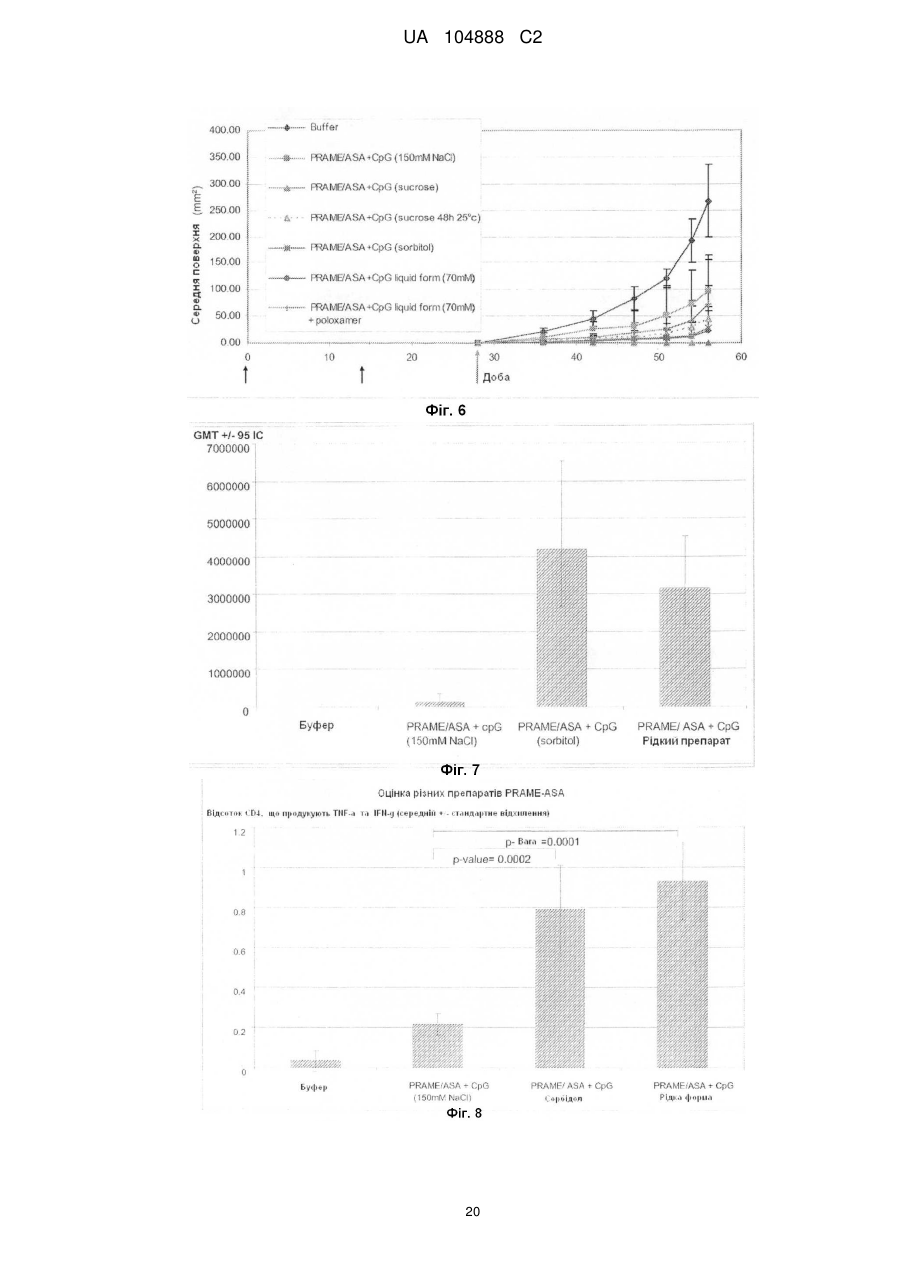
Ад’ювантна композиція, що містить неіонний ізотонічний агент
Формула / Реферат
1. Водна ад'ювантна композиція, що містить: (a) TLR4 агоніст та сапонін у ліпосомальному препараті; та (b) неіонний ізотонічний агент, де концентрація хлориду натрію або іонна сила у ад'ювантній композиції є меншою ніж 100 мМ.
2. Водна ад'ювантна композиція за п. 1, де концентрація хлориду натрію або іонна сила є меншою ніж 80 мМ.
3. Водна ад'ювантна композиція за п. 2, де концентрація хлориду натрію або іонна сила є меншою ніж 30 мМ.
4. Водна ад'ювантна композиція за п. 3, де концентрація хлориду натрію або іонна сила є меншою ніж 10 мМ.
5. Водна ад'ювантна композиція за п. 4, де концентрація хлориду натрію або іонна сила є меншою ніж 5 мМ.
6. Водна ад'ювантна композиція за п. 5, що практично не містить хлориду натрію.
7. Водна ад'ювантна композиція за будь-яким з попередніх пунктів, де неіонний ізотонічний агент є поліолом.
8. Водна ад'ювантна композиція за п. 7, де поліол є сорбітолом.
9. Водна ад'ювантна композиція за п. 8, де концентрація сорбітолу складає від 3 до 15 % (мас./об.).
10. Водна ад'ювантна композиція за п. 9, де концентрація сорбітоліу складає від 4 до 10 % (мас./об.).
11. Водна ад'ювантна композиція за будь-яким попереднім пунктом, де вказаний агоніст TLR4 є 3D-MPL.
12. Водна ад'ювантна композиція за будь-яким попереднім пунктом, де вказаний сапонін є Quil А або його похідною.
13. Водна ад'ювантна композиція за п. 12, де похідною Quil А є QS21.
14. Водна ад'ювантна композиція за будь-яким попереднім пунктом, що містить приблизно 5 мМ хлориду натрію та сорбітол у межах 5-6 % (мас./об.).
15. Імуногенна композиція, що містить антиген або антигенний препарат та водну ад'ювантну композицію за будь-яким з пп. 1-14.
16. Імуногенна композиція за п. 15, де вказаний антиген або антигенний препарат є нерозчинним у сольових концентратах або у розчинах з іонною силою, вищою ніж 5 мМ, 10 мМ, 20 мМ, 30 мМ, 40 мМ, 50 мМ, 60 мМ, 70 мМ, 80 мМ, 90 мМ або 100 мМ.
17. Імуногенна композиція за пп. 15, 16, де антиген або антигенний препарат походить від ВІЛ, менінгококу або є пухлинним антигеном.
18. Імуногенна композиція за п. 17, де антиген є вибраним з PRAME або з NY-ESO-1, або є їх фрагментом або похідною.
19. Імуногенна композиція за будь-яким з пп. 15-18, що додатково містить олігонуклеотид CpG.
20. Спосіб отримання імуногенної композиції за будь-яким з пп. 15-19, що містить етап відновлення ліофілізованої композиції, яка містить принаймні один антиген або антигенний препарат з водною ад'ювантною композицією, як визначено у будь-якому з пп. 1-14.
21. Спосіб за п. 20, де вказана ліофілізована композиція додатково містить TLR9 агоніст.
22. Спосіб за п. 21, де вказаний TLR9 агоніст є імуностимуляторним олігонуклеотидом CpG.
23. Спосіб за будь-яким з пп. 20-22, де антиген або антигенний препарат є нерозчинним у сольових концентратах або у розчинах з іонною силою, вищою ніж 10 мМ, 20 мМ, 30 мМ, 40 мМ, 50 мМ, 60 мМ, 70 мМ, 80 мМ, 90 мМ або 100 мМ.
24. Набір, що охоплює (і) ліофілізовану композицію, яка містить антиген або антигенний препарат та (іі) водну ад'ювантну композицію за будь-яким з пп. 1-14.
25. Набір за п. 24, де вказана ліофілізована композиція додатково містить TLR9 агоніст.
26. Набір за п. 25, де вказаний TLR9 агоніст є імуностимуляторним олігонуклеотидом CpG.
27. Набір за будь-яким з пп. 24-26, де антиген або антигенний препарат є нерозчинним у сольових концентратах або у розчинах з іонною силою, вищою ніж 10 мМ, 20 мМ, 30 мМ, 40 мМ, 50 мМ, 60 мМ, 70 мМ, 80 мМ, 90 мМ або 100 мМ.
Текст
Реферат: Винахід належить до водної ад'ювантної та імуногенної композиції, що містить TLR4 агоніст та сапонін у ліпосомальному препараті та неіонний ізотонічний агент, де концентрація хлориду натрію або іонна сила є меншою ніж 100 мМ. UA 104888 C2 (12) UA 104888 C2 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується водних ад'ювантних композицій, що містять неіонний ізотонічний агент, та мають низькі концентрації солі, особливо концентрації хлориду натрію близько 100 мМ або нижче. Заявлений винахід також стосується імуногенних композицій, що містять антиген, або препарат антигену та вказаної водної ад'ювантної композиції. Ад'юванти іноді застосовують для покращення імунної відповіді, викликаної будь-яким обраним антигеном. Проте, включення ад'ювантів у вакцину або імуногенну композицію підвищує складність отримання компонентів, а також складність розповсюдження та отримання препарату вакцинної композиції. Отримання кожного з ад'ювантних компонентів, а також сам антигенний компонент повинні бути уважно розглянуті розробниками. Зокрема, повинна бути розглянута сумісність антигенного компонента з ад'ювантним компонентом. Це особливо стосується випадку, коли ліофілізовані антигени, або антигенні препарати призначені для відтворення з ад'ювантним препаратом. У такому разі, важливим є те, щоб буфер ад'ювантного препарату був прийнятним для антигену або антигенного препарату та щоб ад'ювант не впливав на імуногенність або розчинність антигену. Автори цього винаходу виявили, що деякі антигени є особливо чутливі до феномену, відомого, як " висолювання ", який можна визначити як осадження білка з його розчину шляхом насичення сіллю, як-то хлоридом натрію. Автори цього винаходу виявили, що чутливі антигени можуть агрегувати та осаджуватися при концентрації хлориду натрію до 150 мМ. Отже, заявлений винахід стосується водної ізотонічної ад'ювантної композиції, що містить агоніст тол-подібного рецептора (TLR) 4 та сапонін у ліпосомальному препараті та неіонний ізотонічний агент, де концентрації хлориду натрію у вказаній композиції є меншими, ніж 100 мМ. Заявлений винахід, крім того, стосується водної ізотонічної ад'ювантної композиції, що містить TLR4 агоніст та сапонін у ліпосомальному препараті та неіонний ізотонічний агент, де іонна сила у вказаній композиції є меншою, ніж 100 мМ. Додатково, заявлений винахід стосується водної ізотонічної ад'ювантної композиції, що може бути застосованою для поширення кола білкових антигенів, включаючи тих, що сприйнятливі та несприйнятливі до "висолювання". Заявлений винахід також стосується імуногенної композиції, що містить антиген, або антигенний препарат та водну ад'ювантну композицію, що містить TLR4 агоніст та сапонін у ліпосомальному препараті та неіонний ізотонічний агент, де концентрація хлориду натрію у вказаної ад'ювантної композиції є меншою, ніж 100 мМ, та способів отримання вказаних імуногенних композицій. Стислий опис фігур. Фіг. 1. Крива літичної активності QS21. Фіг. 2. Відсоток кожного конгенера 3D-MPL у різних препаратах ASА. Фіг. 3. Цикл сублімаційного висушування, застосований для ліофілізації PRAME/CpG. Фіг. 4. Ілюстроване порівняння між PRAME та NYESO-1, відтворене у ASА(150 мМ NaCI) та ASА(сорбітол). Фіг. 5. Гуморальна відповідь мишей, імунізованих PRAME/CpG, отриманою з різними ад'ювантними композиціями у експерименті 1. Фіг. 6. Пухлинний захист у мишей, імунізованих PRAME/CpG, отриманою з різними ад'ювантними композиціями у експерименті 1. Фіг. 7. Гуморальна відповідь мишей, імунізованих PRAME/CpG, отриманою з ASА (150 мМ NaCI), ASА (сорбітол) або рідким препаратом ASА (70 мМ NaCI) у експерименті 2. Фіг. 8. CD4+ відповідь мишей, імунізованих PRAME/CpG, отриманою з ASА (150 мМ NaCI), ASА (сорбітол) або рідким препаратом ASА у експерименті 2. Фіг. 9. Пухлинний захист у мишей, імунізованих PRAME/CpG, отриманою з ASА (150 мМ NaCI), ASА (сорбітол) або рідким препаратом ASА у експерименті 2. Заявлений винахід стосується заміщення, або часткового заміщення ізотонічного агента, який є сіллю, як-то хлоридом натрію, у водній ад'ювантній композиції з неіонним ізотонічним агентом. Добре відомо, що для парентерального введення розчини повинні бути фізіологічно ізотонічними (тобто мати фармацевтично прийнятну осмоляльність) для запобігання клітинної деформації або лізису. " Ізотонічний агент " є з'єднанням, що фізіологічно добре переноситься та додає відповідну тонічність препарату (наприклад, імуногенним композиціям винаходу) для запобігання витікання води крізь клітинні мембрани, що знаходяться у контакті з препаратом. Як відомо, водні ад'ювантні композиції містять 100 мМ хлорид натрію, або більше, наприклад, ад'ювантна система (ASA) у WO2005/12991 та WO2008/142133, або ліпосомальні ад'юванти, наведені у WO2007/068907. Як зазначено у WO2008/142133, подібні ад'ювантні композиції можуть бути застосовані у якості розріджувачів для відновлення ліофілізованих 1 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 60 композицій, що містять антигени або антигенні препарати перед вакцинацією. Важливо, що такі відтворені композиції є ізотонічними, тобто містять концентрацію солі, що в значній мірі дорівнює тій, яка знайдена у клітинах тіла та крові, щоб не виникало стискування або розширення клітин, спричиненого ін'єкцією. Загалом, у якості ізотонічного агента застосовують хлорид натрію. Автори цього винаходу виявили, що деякі антигени є особливо чутливими до " висолювання ", процесу, за допомогою якого білки у розчині агрегують, або коагулюють, коли у розчині міститься висока концентрація солі. Концентрації солі, при яких агрегують білкові антигени, змінюються від білка до білка. Автори винаходу визначили групу антигенів, що здатні агрегувати при відносно низьких концентраціях солі, наприклад, при приблизно 100 мМ хлориду натрію, або менше. Це означає, що деякі відомі ад'ювантні композиції є неприйнятними для відновлення або для застосування з композиціями, що містять ці антигени, якщо відбувається агрегація. Заявлений винахід стосується водних ад'ювантних композицій, які можуть бути застосовані з подібними антигенами, тобто антигенами, що агрегують при концентраціях хлориду натрію нижче 100 мМ. Водні ад'ювантні композиції винаходу містять TLR4 агоніст, сапонін у ліпосомальному препараті та неіонний ізотонічний агент, де концентрація хлориду натрію у ад'ювантній композиції є нижчою, ніж 100 мМ, наприклад, нижче 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 40 мМ, 30 мМ, 20 мМ або 15 мМ. У окремому втіленні, концентрація хлориду натрію у ад'ювантній композиції є нижчою, ніж 10 мМ, або дорівнює, або є нижчою, ніж 5 мМ. У іншому певному втіленні, ад'ювантна композиція є практично вільною від хлориду натрію. Під практично вільною мається на увазі те, що концентрація хлориду натрію дорівнює, або дуже наближається до 0 мМ (тобто 1 мМ, 2 мМ, або 3 мМ). Фахівець може легко перевірити концентрацію обох іонів, іону натрію (Na+) та хлору (Cl-) за допомогою відомих способів та наборів. Наприклад, натрій можна визначити за допомогою набору, як-то Sodium Enzymatic Assay Kit (Catalog Number: BQ011 EAEL) від Biosupply. Для визначення хлорид-іону можна застосувати, наприклад, набор Chloride Enzymatic Assay Kit (Catalog Number: BQ006EAEL) від Biosupply. Заявлений винахід також стосується водної ізотонічної ад'ювантної композиції, що містить TLR4 агоніст та сапонін у ліпосомальному препараті та неіонний ізотонічний агент, де іонна сила є меншою, ніж 100 мМ, наприклад, нижче 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 40 мМ, 30 мМ, 20 мМ, або 15 мМ. У окремому втіленні, іонна сила у ад'ювантній композиції є нижчою, ніж 10 мМ або дорівнює, або нижче, ніж 5 мМ. У іншому певному втіленні, ад'ювантна композиція має іонну силу, що дорівнює, або дуже наближається до 0 мМ. Іонна сила ад'юванту або імуногенної композиції винаходу може бути виміряною з застосуванням відомих фахівцям способів, наприклад, за допомогою кондуктометру. Прийнятний неіонний ізотонічний агент для застосування у водній ад'ювантній композиції винаходу, який має бути об'єднаний з антигенною композицією, повинен бути прийнятним для застосування до людини, а також бути сумісним з антигенами в межах антигенної композиції та також сумісним з іншими компонентами ад'ювантної композиції. Зокрема, водна ад'ювантна композиція повинна бути такою, щоб антигени в межах антигенної композиції, при поєднанні з ад'ювантною композицією, були здатними разом залишатися у розчині та зберігати свою імуногенність. У одному втіленні заявленого винаходу, прийнятні неіонні ізотонічні агенти охоплюють поліоли, цукри (особливо цукрозу, фруктозу, декстрозу або глюкозу) або амінокислоти, як-то гліцин. У одному втіленні, поліол є цукровим спиртом, головним чином, C3-6 цукровим спиртом. Типові цукрові спирти охоплюють гліцерин, еритритол, трейтол, арабітол, ксилітол, рибітол, сорбітол, манітол, дульцит та ідитол. У певному прикладі цього втілення, прийнятний неіонний ізотонічний агент є сорбітолом. У окремому втіленні винаходу, неіонний ізотонічний агент у композиції винаходу є цукрозою та/або сорбітолом. У одному втіленні, прийнятна концентрація поліолу в межах водної ад'ювантної композиції дорівнює близько 3-15 % (мас/обс), зокрема 3-10 % (мас/обс), наприклад, 3-7 % (мас/обс), наприклад, 4-6 % (мас/обс). У певному прикладі цього втілення, поліол є сорбітолом. Водна ад'ювантна композиція містить тол-подібний рецепторний агоніст (TLR) 4 та сапонін у ліпосомальному препараті. В даному випадку це означає, що сапонін та TLR4 агоніст отримані разом з ліпосомами. Термін " ліпосоми " звичайно має відношення до одно- або мультиламелярних (особливо 2, 3, 4, 5, 6, 7, 8, 9, або 10- ламелярних у залежності від кількості сформованих ліпідних мембран) ліпідних структур, що оточують водний вміст. Ліпосоми та ліпосомні препарати є добре відомі. Ліпіди, що здатні утворювати ліпосоми охоплюють всі речовини, що мають жирові або жироподібні властивості. Ліпіди, що можуть складати ліпіди у ліпосомах можуть бути вибрані з 2 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 групи, що містить гліцериди, гліцерофосфоліпіди, гліцерофосфохіноліпіди, фосхіноліпіди, гліцерофосфоноліпіди, сульфоліпіди, сфінголіпіди, фосфоліпіди, iізопреноїди, стероїди, стеарини, стероли, археоліпіди, синтетичні катіонові ліпіди та ліпіди, що містять вуглеводи. У одному втіленні, ліпосоми містять фосфоліпід. Прийнятні фосфоліпіди охоплюють (але без обмеження): фосфохолін (PC), який є проміжною речовиною у синтезі фосфатидилхоліну; похідні природного фосфоліпіду: яєчний фосфохолін, соєвий фосфохолін, гідрований соєвий фосфохолін, сфінгоміелін як природний фосфоліпід; та похідні синтетичного фосфоліпіду: фосфохолін (дидеканойл-L-α-фосфатидилхолін [DDPC], дилауройлфосфатидилхолін [DLPC], диміристойлфосфатидилхолін [DMPC], дипальмітойлфосфатидилхолін [DPPC], дистеаройлфосфатидилхолін [DSPC], діолеойлфосфатидилхолін [DOPC], 1-пальмітойл, 2олеойлфосфатидилхолін [POPC], діелайдойлфосфатидилхолін [DEPC]), фосфогліцерин(1^диміристойл-sn-гліцеро-S-фосфогліцерин [DMPG], 1,2-дипальмітойл-sn-гліцеро-3фосфогліцерин [DPPG], 1,2-дистеаройл-sn-гліцеро-3-фосфогліцерин [DSPG], 1-пальмітойл-2олеойл-sn-гліцеро-3-фосфогліцерин [POPG], фосфатидну кислоту (1,2-диміристойл-sn-гліцеро3-фосфатидна кислота [DMPA], дипальмітойл-фосфатидну кислоту [DPPA], дистеаройлфосфатидну кислоту [DSPA], фосфоетаноламін (1,2-диміристойл-sn-гліцеро-3фосфоетаноламін [DMPE], 1,2-дипальмітойл-sn-гліцеро-3-фосфоетаноламін [DPPE], 1,2дистеаройл-sn-гліцеро-3-фосфоетаноламін[DSPE], 1,2-діолеойл-sn-гліцеро-3-фосфоетаноламін [DOPE], фосфосерин, поліетиленгліколь [PEG] фосфоліпід (mPEG-фосфоліпід, полігліцеринфосфоліпід, funcitionilized-фосфоліпід, термінально-активований фосфоліпід). У одному втіленні, ліпосоми містять 1-пальмітойл -2-олеойл-гліцеро-3-фосфоетанолaмін. У одному втіленні, застосували високоочищений фосфатидилхолін, який може бути вибраний від групи, що містить фосфатидилхолін (яєчний), гідрований фосфатидилхолін (яєчний), фосфатидилхолін (соєвий), та гідрований фосфатидилхолін (соєвий). У наступному втіленні ліпосоми містили фосфатидилетаноламін [POPE] або його похідну. Розмір ліпосом може змінюватися від 30 нм до декількох мкм у залежності від фосфоліпідної композиції та способу, застосованого для її отримання. У окремих втіленнях винаходу, розмір ліпосом знаходиться у діапазоні 50 нм - 500 нм, та у подальших втіленнях - 50 нм - 200 нм. Динамічне розсіяння лазерного випромінювання є способом, застосованим для вимірювання розміру ліпосоми, який є добре відомий фахівцям. Ліпосоми, відповідно, містять нейтральний ліпід, наприклад, фосфатидилхолін, який, відповідно, є монокристалічним при кімнатній температурі, наприклад, фосфатидилхолін яєчного жовтка, діолеойл-фосфатидилхолін (DOPC), або дилаурил-фосфатидилхолін. У окремому втіленні, ліпосоми заявленого винаходу містять DOPC. Ліпосоми також можуть містити заряджений ліпід, що підвищує стабільність ліпосом - сапонінової структури для ліпосом, що складаються з насичених ліпідів. У таких випадках кількість зарядженого ліпіду дорівнює відповідно 1-20 % мас/мас, переважним чином 5-10 %. Співвідношення стеролу до фосфоліпіду дорівнює 1-50 % (моль/моль), відповідно 20-25 %. Особливо прийнятним сапоніном для застосування у заявленому винаході є Quil А та його похідні. Quil А є сапоніновим препаратом, отриманим з північно-американського дерева Quillaja Saponaria Molina, який вперше був описаний у Dalsgaard et al. у 1974 ("Saponin adjuvants", Archiv. fur die gesamte Virusforschung, Vol. 44, Springer Verlag, Berlin, p243-254), та має ад'ювантну активність. Очищені фрагменти Quil А, отримані за допомогою ВЕРХ (HPLC) зберігали ад'ювантну активність без токсичності, пов'язаної з Quil А (EP 0 362 278), наприклад, QS7 та QS21 (також відомі, як QA7 та QA21). QS-21 є природним сапоніном, отриманим з кори Quillaja saponaria Molina, який індукує CD8+ цитотоксичні T клітини (CTLs), Th1 клітини та домінуючу відповідь антитіл lgG2. QS21 є бажаним сапоніном у контексті заявленого винаходу. У прийнятній формі заявленого винаходу, сапоніновий ад'ювант в межах імуногенної композиції є похідним saponaria molina quil A, переважним чином у вигляді імунологічно-активної фракції Quil АA, як-то QS-17 або QS-21, відповідно QS-21. У певному втіленні, QS21 надано у своєму менш реактогенному складі, де він послаблюється екзогенним стеролом, як-то, наприклад, холестерином. Існують різні окремі форми менш реактогенних композицій, де QS21 також послаблюється екзогенним холестерином. Сапонін/стерол знаходиться у структурі ліпосомального препарату (WO 96/33739, Приклад 1). Прийнятні стероли охоплюють β-ситостерин, стигмастерин, ергостерин, ергокальциферол. У одному окремому втіленні, ад'ювантна композиція містить холестерин у якості стеролу. Ці стероли є добре відомими, наприклад, холестерин, наведений у Merck Index, 11th Edn., page 341, у якості стеролу, що природно зустрічається у тваринному жирі. 3 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 60 Коли активною сапоніновою фракцією є QS21, співвідношення QS21 до стеролу буде звичайно у діапазоні від 1:100 до 1:1 (мас/мас), відповідно 1:10-1:1 (мас/мас), та, переважним чином, 1:5-1:1 (мас/мас). Відповідно, якщо присутній надлишок стеролу, то співвідношення QS21 до стеролу буде щонайменш 1:2 (мас/мас). У одному втіленні, співвідношення QS21 до стеролу дорівнює 1:5 (мас/мас). Відповідно, стерол є холестерином. Водна ад'ювантна композиція містить агоніст тол-подібного рецептора 4 (TLR-4). Під терміном " TLR-агоніст " слід розуміти компонент, який здатен спричинювати сигнальну відповідь за допомогою сигнального шляху TLR, або у вигляді спрямованого ліганда або непрямим шляхом створення ендогенного або екзогенного ліганда (Sabroe et al, Jl 2003 p16305). TLR4 агоніст здатен спричинювати сигнальну відповідь за допомогою сигнального шляху TLR-4. Прийнятним прикладом TLR4-агоніста є ліпополісахарид, відповідно, нетоксична похідна ліпіду A, особливо монофосфорил-ліпід А, або, більш прийнятно, 3-деацилірований монофосфорил-ліпід А (3D-MPL). 3D-MPL продається під назвою MPL від GlaxoSmithKline Biologicals N.A. та позначений у документі, як MPL або 3D-MPL. див., наприклад, US Patent Nos. 4,436,727; 4,877,611; 4,866,034 та 4,912,094. 3D-MPL в першу чергу сприяє CD4+T клітинним відповідям з IFN-g (Th1) фенотипом. 3D-MPL може бути отриманий відповідно до способів, наведених у GB 2 220 211 A. Хімічно він є сумішшю 3-деацилованого монофосфорил - ліпіда А з 4, 5 або 6 ацилованими ланцюгами. У композиції заявленого винаходу мала частинка 3D-MPL може бути застосованою для отримання водної ад'ювантної композиції. Мала частинка 3D-MPL має такий розмір, що дозволяє її стерильно відфільтрувати через 0.22 мкм фільтр. Такі отримання описані у WO 94/21292. Переважним чином, 3D-MPL у порошковому стані застосовують для отримання водної ад'ювантної композиції заявленого винаходу. Іншими TLR4-агоністами, які також можуть бути застосованими, є фосфати алкілглюкозамініду (AGPs), як-то наведені у WO98/50399 або у US patent No. 6,303, 347 (також наведені способи для отримання AGP), відповідно, RC527 або RC529, або фармацевтично прийнятні солі AGP, наведені у US Patent No. 6,764,840. Інші прийнятні TLR4-агоністи описані у WO2003/011223 та у WO 2003/099195, як-то суміш I, суміш Il та суміш III, наведені на 4-5 стор. WO2003/011223 або на 3-4 стор.WO2003/099195, особливо ті суміші, що наведені у WO2003/011223 як ER803022, ER803058, ER803732, ER804053, ER804057m ER804058, ER804059, ER804442, ER804680 та ER804764. Наприклад, один прийнятний TLR4 агоніст є ER804057. Водні ад'ювантні композиції винаходу містять разом сапонін та TLR4-агоніст. У окремому втіленні, водна ад'ювантна композиція містить QS21 та 3D-MPL. TLR4-агоніст, як-то ліпополісахарид, як-то 3D-MPL, може бути застосований у кількостях 1 – 100 мкг на дозу ад'ювантної композиції для людини. 3D-MPL може бути застосований приблизно на рівні 50 мкг, наприклад, 40-60 мкг, відповідно, 45-55 мкг, 49-51 мкг, або 50 мкг. У подальшому втіленні, доза ад'ювантної композиції для людини містить 3D-MPL у кількості біля 25 мкг, наприклад, 20 – 30 мкг, відповідно, 21 – 29 мкг, 22 – 28 мкг, 28 – 27 мкг, 24 – 26 мкг, або 25 мкг. Сапонін, як-то QS21, може бути застосований у кількостях 1-100 мкг на дозу ад'ювантної композиції для людини. QS21 може бути застосований у кількості близько 50 мкг, наприклад, 4060 мкг, відповідно, 45-55 мкг, 49-51 мкг, або 50 мкг. У подальшому втіленні, доза ад'ювантної композиції для людини містить QS21 у кількості близько 25 мкг, наприклад, 20 – 30 мкг, відповідно, 21 – 29 мкг, 22 – 28 мкг, 28-27 мкг, 24-26 мкг, або 25 мкг. Обидві речовини, TLR4 агоніст та сапонін присутні у водній ад'ювантній композиції, де вагове співвідношення TLR4-агоніста до сапоніну дорівнює, відповідно, 1:5-5:1, відповідно, 1:1. Наприклад, де 3D-MPL є присутнім у кількості у 50 мкг або 25 мкг, тоді, відповідно, QS21 також може бути присутнім у кількості у 50 мкг або 25 мкг, відповідно, на дозу для людини у водній ад'ювантній композиції. Коли ад'ювант є об'єднаним з рідкою формою антигенної композиції, прийнятний обсяг дози ад'ювантної композиції для людини буде дорівнювати приблизно половину призначеного кінцевого об'єму дози для людини. Наприклад, 500 мкл обсяг ад'юванта для призначеної кінцевий дози для людини у 1 мл, або 250 мкл обсяг для призначеної кінцевої дози для людини у 0.5 мл. Ад'ювантну композицію розбавляють при об'єднанні з антигенною композицією для забезпечення кінцевої дози для людини у вакцині. Кінцевий обсяг такої дози буде, звичайно, змінюватися у залежності від початкового обсягу ад'ювантної композиції та обсягу антигенної композиції, доданої до ад'ювантної композиції. У альтернативному втіленні, водний ад'ювант застосовують для відновлення ліофілізованої антигенної композиції. У цьому втіленні, прийнятний обсяг дози ад'ювантної композиції для людини приблизно дорівнює кінцевому обсягу дози для людини. Рідку ад'ювантну композицію додають до пляшки, що містить 4 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 60 ліофілізовану антигенну композицію та застосовують для відновлення ліофілізованої антигенної композиції. Заявлений винахід отже, стосується процесу отримання імуногенної композиції, що містить етапи відновлення ліофілізованої композиції, що містить щонайменш один антиген або антигенний препарат, як тут описано, з водною ад'ювантною композицією, як визначено тут. У подальшому втіленні винаходу, передбачено набор, що охоплює (i) ліофілізовану композицію, що містить антиген, або антигенний препарат та (ii) водну ад'ювантну композицію, як тут описано. У окремому втіленні винаходу, передбачено набор, що охоплює (i) ліофілізовану композицію, що містить антиген, або антигенний препарат, як тут описано та (ii) водну ад'ювантну композицію, як тут описано. У одному втіленні, ліофілізована композиція, крім того, містить TLR-9 агоніст, наприклад, як зазначено у WO 2008/142133. У альтернативному втіленні, передбачено набор, де CpG не є співліофілізованим з антигеном. CpG може бути або змішаним з водною ад'ювантною композицією, або знаходитись у окремому флаконі у водній або ліофілізованій формі. Таким чином, у альтернативному втіленні, передбачено набор, що охоплює (i) ліофілізовану композицію, що містить антиген, як тут описано; (ii) водну ад'ювантну композицію; та (iii) TLR9 агоніст (наприклад, як імуностимуляторний CpG олігонуклеотид). TLR9 агоніст для застосування у наборах винаходу являє собою імуностимуляторний олігонуклеотид, зокрема олігонуклеотид, що містить неметіловану CpG послідовність. Такі олігонуклеотиди добре відомі та описані, наприклад, у WO 96/02555, WO 99/33488 та US 5,865, 462. Прийнятні TLR9 агоністи для застосування у описаних тут імуногенних композиціях являють собою олігонуклеотиди, що містять CpG, вибірково, що містять дві або більше динуклеотидні CpG послідовності, відокремлені щонайменш трьома, відповідно, щонайменш шістьма або більше, нуклеотидами. CpG послідовність являє собою цитозиновий нуклеотид, за яким знаходиться гуаніновий нуклеотид. У одному втіленні, міжнуклеотидний зв'язок у олігонуклеотиді є фосфородитіоатним, або фосфородитіоатний зв'язок є можливим, хоча можуть бути застосовані фосфодіефірні та інші міжнуклеотидні зв'язки, в тому числі олігонуклеотиди зі змішаними міжнуклеотидними зв'язками. Способи отримання фосфородитіоатних олігонуклеотидів або фосфородитіоату описані у US5,666,153, US5,278,302 та WO95/26204. Олігонуклеотид, що містить різни міжнуклеотидні зв'язки, передбачений, наприклад, змішаними фосфородитіоатними фосфодіефірами. Також можуть бути застосовані інші міжнуклеотидні зв'язки, що стабілізують олігонуклеотид. Приклади CpG олігонуклеотидів, прийнятні для включення у описані тут імуногенні композиції мають наступні послідовності. У одному втіленні, ці послідовності містять фосфородитіоатні модіфіковані міжнуклеотидні зв'язки. OLIGO 1(SEQ ID NO:1): TCC ATG ACG TTC CTG ACG TT (CpG 1826) OLIGO 2 (SEQ ID NO:2): TCT CCC AGC GTG CGC CAT (CpG 1758) OLIGO 3(SEQ ID NO:3): ACC GAT GAC GTC GCC GGT GAC GGC ACC ACG OLIGO 4 (SEQ ID NO:4): TCG TCG TTT TGT CGT TTT GTC GTT (CpG 2006) OLIGO 5 (SEQ ID NO:5): TCC ATG ACG TTC CTG ATG CT (CpG 1668) Альтернативно, CpG олігонуклеотиди можуть містити вищезгадані послідовності, у яких вони мають незначні делеції або додавання до них. Заявлений винахід також стосується імуногенної композиції, що містить антиген або антигенний препарат та водну ад'ювантну композицію, як тут описано, де вказана імуногенна композиція має концентрацію хлориду натрію приблизно нижче 100 мМ, наприклад, нижче 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 40 мМ, 30 мМ, 20 мМ, або 15 мМ. У окремому втіленні, концентрація хлориду натрію у імуногенній композиції є нижчою, ніж 10 мМ, або дорівнює, або нижче,ніж приблизно 5 мМ. У наступному окремому втіленні, імуногенна композиція є практично вільною від хлориду натрію. Під практично вільною розуміється те, що концентрація хлориду натрію дорівнює, або дуже наближається до 0 мМ. Заявлений винахід також стосується імуногенної композиції, що містить антиген або антигенний препарат та водну ад'ювантну композицію, як тут описано, де іонна сила імуногенної композиції є меншою, ніж 100 мМ, наприклад, нижче 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 40 мМ, 30 мМ, 20 мМ, або 15 мМ. У окремому втіленні, іонна сила у імуногенній композиції нижче, ніж 10 мМ або дорівнює, або нижче, ніж 5 мМ. У наступному окремому втіленні, імуногенна композиція має іонну силу, що дорівнює, або дуже наближається до 0 мМ. Буде очевидно те, що, якщо імуногенна композиція буде отримана з застосуванням ліофілізованої антигенної композиції, що містить TLR-9 агоніст, то імуногенна композиція також буде містити TLR-9 агоніст. Отже, у одному втіленні, передбачено імуногенну композицію, що 5 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 містить антиген або антигенний препарат, TLR9 агоніст, TLR4 агоніст та сапонін у ліпосомальному препараті, де імуногенна композиція має сольову концентрацію нижче приблизно 100 мМ, наприклад, нижче 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 40 мМ, 30 мМ, 20 мМ або 15 мМ. У певному прикладі цього втілення концентрація хлориду натрію у імуногенній композиції є нижчою, ніж 10 мМ, або дорівнює, або нижче, ніж приблизно 5 мМ. У подальшому втіленні, передбачено імуногенну композицію, що містить антиген або антигенний препарат, TLR9 агоніст, TLR4 агоніст та сапонін у ліпосомальному препараті, де іонна сила є нижчою, ніж 100 мМ, наприклад, нижче, ніж 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 40 мМ, 30 мМ, 20 мМ або 15 мМ. У окремому втіленні, іонна сила у імуногенній композиції є нижчою, ніж 10 мМ, або дорівнює, або нижче, ніж 5 мМ. У наступному окремому втіленні, імуногенна композиція має іонну силу, що дорівнює, або дуже наближається до 0 мМ. У додатковому втіленні, передбачено імуногенну композицію, що містить антиген або антигенний препарат, TLR9 агоніст, 3D-MPL та QS21 у ліпосомальному препараті, де імуногенна композиція має сольову концентрацію, що нижче, ніж 100 мМ, наприклад, нижче 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 40 мМ, 30 мМ, 20 мМ або 15 мМ. У певному прикладі цього втілення концентрація хлориду натрію у імуногенній композиції є нижчою, ніж 10 мМ, або дорівнює, або нижче, ніж приблизно 5 мМ. У подальшому втіленні, передбачено імуногенну композицію, що містить антиген або антигенний препарат, TLR9 агоніст, 3D-MPL та QS21 у ліпосомальному препараті, де іонна сила є нижчою, ніж 100 мМ, наприклад, нижче 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 40 мМ, 30 мМ, 20 мМ або 15 мМ. У окремому втіленні, іонна сила у імуногенній композиції є нижчою, ніж 10 мМ, або дорівнює, або нижче, ніж 5 мМ. У наступному окремому втіленні, імуногенна композиція має іонну силу, що дорівнює або дуже наближається до 0 мМ. У подальшому втіленні, передбачено імуногенну композицію, що містить антиген або антигенний препарат, 3D-MPL та QS21 у ліпосомальному препараті, та CpG олігонуклеотид, де імуногенна композиція має сольову концентрацію нижче 50 мМ, наприклад, нижче 40 мМ, 30 мМ, 20 мМ, або 15 мМ. У певному прикладі цього втілення концентрація хлориду натрію у імуногенній композиції є нижчою, ніж 10 мМ, або дорівнює, або нижче, ніж 5 мМ. У одному втіленні, антиген, або антигенний препарат, застосований у імуногенній композиції винаходу є будь-яким антигеном, що осаджується, коагулює або агрегує після змішування з розчином (або розчинення у розчині), що містить концентрацію хлориду натрію вище, ніж 50 мМ, 60 мМ, 70 мМ, 80 мМ, 90 мМ або 100 мМ. У одному втіленні, антиген або антигенний препарат, застосований у імуногенній композиції винаходу є будь-яким антигеном, що осаджується, коагулює або агрегує після змішування з розчином (або розчинення у розчині), де іонна сила є меншою, ніж 100 мМ, наприклад, нижче 90 мМ, 80 мМ, 70 мМ, 60 мМ, 50 мМ, 40 мМ, 30 мМ, 20 мМ, 15 мМ, або 10 мМ. У окремому втіленні, антигени винаходу осаджуються, коагулюють або агрегують у розчині з іонною силою, що дорівнює, або нижче 5 мМ. Досвідчений фахівець може визначити, чи відповідає антиген цьому визначенню шляхом перемішування антигену у такому розчині. Антиген, що не відповідає цьому визначенню буде залишатися у розчині, тобто рідина буде залишатися прозорою, без осаду, ще через 24 години після розчинення. Антиген, що осаджується, коагулює або утворює агрегат після перемішування та/або розчинення у розчині, можна побачити при візуальному огляді у вигляді осаду, як помутніння розчину. Додатково, агрегацію, яку не в змозі визначити візуально, можна спостерігати з застосуванням відомих фахівцям способів, що охоплюють, але без обмеження, ексклюзійну ВЕРХ (SEC-HPLC). У подальшому втіленні, антиген, або антигенний препарат походить від ВІЛ, менінгококу, або є пухлинним антигеном. У окремому втіленні, пухлинний антиген є вибраним від або PRAME, або NYESO-1, або від їх фрагменту або похідної. PRAME (також відомий, як DAGE) є антигеном, що може бути застосованим у якості пухлинного антигену заявленого винаходу. Антиген та його отримання описані у US patent No. 5, 830, 753. PRAME знаходиться у базі даних Annotated Human Gene Database H-lnv DB під реєстраційними номерами: U65011.1, BC022008.1, AK129783.1, BC014974.2, CR608334.1, AF025440.1, CR591755.1, BC039731.1, CR623010.1, CR61 1321.1, CR618501.1, CR604772.1, CR456549.1, та CR620272.1. Також можуть бути застосовані гібридні білки, що містять PRAME антиген. PRAME, або його фрагмент, або похідна можуть бути застосовані, вибірково, у вигляді гібридного білка з гетерологічним гібридним партнером. Зокрема, PRAME антиген може, відповідно, бути застосованим у вигляді гібридного білка з D - білком Haemophilus influenzae B, або його часткою, 6 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 або його похідною. Частка білка D, що може бути застосованою, відповідно не повинна містити секреторні або сигнальні послідовності. Відповідно, гібридний білок - партнер містить амінокислоти Met-Asp-Pro біля, або всередині N-кінця гібридної білкової послідовності, де гібридний білок – партнер не містить секреторні, або сигнальні послідовності білка D. Наприклад, гібридний білок - партнер може містити або складатися з приблизної, або точної кількості 17-127, 18-127, 19-127 або 20-127 амінокислот білка D. Прийнятні PRAME антигени на основі гібридних білків з білком D описані у WO2008/087102, що включена тут у якості посилання у своєї повноті. NY-ESO-1 є іншим антигеном, що може бути застосований у якості пухлинного антигену заявленого винаходу. NY-ESO-1, або його фрагмент, або похідна, може бути застосований, вибірково, у вигляді гібридного білка з гетерологічним гібридним партнером. NY-ESO-1 є описаним у US5804381, що включений тут у якості посилання у своєї повноті. Білок NY-ESO-1 сягає приблизно 180 амінокислот у довжину та складається з трьох ділянок: (a) N-кінцева ділянка, що містить приблизно 1-70 амінокислот; (б) центральна ділянка, що містить приблизно 71-134 амінокислот; та (в) C-кінцева ділянка, що містить приблизно 135-180 амінокислот. NYESO-1 може бути застосований у вигляді гібридного білка, наприклад, гібрида з LAGE-1, який є додатковим CT антигеном, або його фрагментом, див. WO2008/089074, що включена тут у якості посилання у своєї повноті. Коли застосовані фрагменти NY-ESO-1, вони, відповідно, охоплюють один, або декілька епітопів MHC першого або другого класу, наприклад, епітопи, що відомі, як A31, DR1, DR2, DR4, DR7, DP4, B35, B51, Cw3, Cw6 та A2 (див. WO2008/089074). Хоча він не є чутливим до NaCI, додатковий антиген, що може бут застосований у відповідності з заявленим винаходом є MAGE антигеном, або його фрагментом, або похідною, наприклад, родини MAGE-3, як-то MAGE-A3. MAGE-3 антигени, наприклад, були описані в якості прийнятних для отримання у комбінації з NY-ESO-1 - див. WO2005/105139, що включена тут у якості посилання у своєї повноті. Також можуть бути застосовані MAGE антигени, як-то MAGE-A3, або його похідна, наприклад, хімічно модифікована похідна та/або гібридний білок з гетерологічним гібридним партнером. Наприклад, MAGE антиген може містити скорочені дисульфідні містки для утворення вільних тіолів, що можуть бути дериватизовані, наприклад, з карбоксамідними або карбоксиметильними групами, див. WO99/40188, що включена тут у якості посилання у своєї повноті. Зокрема, MAGE антигени можуть відповідно бути застосованими у вигляді гібридних білків з білком D Haemophilus influenzae B, або його часткою чи похідною. Наприклад, приблизно перша третина білка D або N-кінець у 100-110 амінокислот білка D може бут застосований у якості гібридного партнера, див. WO99/40188. У подальшому втіленні, антиген, або антигенні композиції можуть бути похідними будь-якого з антигенів, описаних тут. Як тут застосовано, термін "похідна" має відношення до антигену, який є модифікованим відносно своєї природної форми. Похідні заявленого винаходу є достатнім чином подібні до нативних антигенів, зберігаючи антигенні властивості та залишаючись здатними викликати підвищену імунну відповідь, порівняно з нативним антигеном. Наявність або відсутність у похідних такої підвищеної імунної відповіді можна виміряти прийнятним імунологічним аналізом, як-то ВЕРХ (ELISА), або проточною цитометрією. Термін "фрагмент" як тут застосовано, має відношення до фрагменту пухлинного антигену, або похідної антигену, що містить щонайменш один епітоп, наприклад, CTL епітоп, звичайно, це пептид з щонайменш 8 амінокислотами. Фрагменти, довжиною щонайменш 8, наприклад, 8-10 амінокислот, або до 20, 50, 60, 70, 100, 150, або 200 амінокислот розглядаються в межах обсягу винаходу доки фрагмент проявляє антигенні властивості, тобто, що основні епітопи (наприклад, CTL епітопи) зберігаються цим фрагментом, та фрагмент є здатним індукувати імунну відповідь, що перехресно реагує з природним пухлинним антигеном. Типові фрагменти можуть мати довжину 8-10, 10-20, 20-50, 50-60, 60-70, 70-100, 100-150, 150-200 амінокислотних залишків (включаючи будь-яке значення в межах цих діапазонів). Заявлений винахід стосується імуногенної композиції, як тут описано, для застосування у медицині, особливо у лікуванні та/або запобіганні захворювання. Заявлений винахід також стосується імуногенної композиції, як тут описано, для застосування у імунотерапевтичному лікуванні раку. У особливих прикладах цього втілення винахід стосується імуногенної композиції, як тут описано, для застосування у імунотерапевтичному лікуванні одного, або декількох захворювань на рак, вибраних від групи, що складається з раку простати, молочної залози, товстої кишки, легенів, підшлункової залози, нирок, яєчників або меланоми. 7 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 Заявлений винахід також стосується способу терапії або профілактики раку у пацієнта, що цього потребує, що містить стадію надання вказаному пацієнту ефективної кількості імуногенної композиції, як тут. У особливих прикладах цього втілення винахід стосується способу терапії або профілактики захворювань на рак, вибраних від групи, що складається з раку простати, молочної залози, товстої кишки, легенів, підшлункової залози, нирок, яєчників або меланоми. Заявлений винахід далі буде більш докладно описаний за допомогою наступних необмежених прикладів. Приклади. Приклад 1: Отримання ад'ювантної композиції ASА (сорбітол). Була отримана адьювантна композиція, що містить 3-деацилований MPL та QS21 у ліпосомальному препараті. Вона була отримана таким чином: Спосіб отримання ліпосом: Суміш ліпіду (як-то синтетичного фосфатидилхоліну), холестерину та 3-O-деацилованого MPL у органічному розчиннику висушили у вакуумі. Далі додали водний розчин (як-то сольовий розчин, буферизований фосфатом [100 мМ NaCI, 20 мМ фосфат pH 6.1]), та колбу коливали, доки весь ліпід був у суспензії. Потім цю суспензію попередньо гомогенізували на мішалці з великою швидкістю зсуву та гомогенізували під високим тиском, доки розмір ліпосом не знизили до близько 90нм+/-10нм, що було виміряне на DLS. Потім ліпосоми стерильно відфільтрували. B. ASА препарат: Етап 1: Розведення концентрованих ліпосом. Nа2К фосфатний буфер 100 мМ, pH 6.1 при десятиразовому розведенні та 1,5 М NaCl додали у воду для ін'єкцій до досягнення 10 мМ концентрації фосфатного буфера у кінцевому препараті. Потім додали 30 % (мас/обс) розчин сорбітолу у воді для ін'єкцій (WFI) до кінцевої концентрації 4.7 % у кінцевому препараті та все перемішували протягом 15-45 хвилин при кімнатній температурі. Концентровані ліпосоми (створені з DOPC, холестерину та MPL з 40мг/мл, 10мг/мл та 2мг/мл відповідно) потім додали до досягнення концентрації 100 мкг/мл MPL у кінцевому препараті. Далі суміш перемішували протягом 15-45 хвилин при кімнатній температурі. Етап 2: Додавання QS21. За допомогою перистальтичного насосу, сипкий продукт QS21 (відтаював 24 год. при кімнатній температурі або два дня при 4 °C для 200мл) додали зі швидкістю 200мл/хв. до розчинених ліпосом з магнітним перемішуванням до досягнення концентрації 100 мкг/мл у кінцевому препараті. Суміш перемішували протягом 15-45 хвилин. Етап 3: pH, як перевірено, дорівнював 6.1+/-0.3. Етап 4: Стерильна фільтрація. Стерильну фільтрацію проводили з постійною швидкістю у 400мл/хв. на поліефірсульфоновому (PES) фільтрі від PALL Corporation. Етап 5: Зберігання при +2 °C - +8 °C. Була отримана ад'ювантна композиція, що містила 3-0- деацилований MPL та QS21 у ліпосомальному препараті та сорбітол (позначений ASА (сорбітол)), яку далі зберігали при 4 °C. Приклад 2: Отримання ад'ювантної композиції ASА (150 мМNaCI). Суміш ліпіду (як-то синтетичний фосфатидилхолін), холестерину та 3 -деацилованого MPL (3D-MPL) у органічному розчиннику ліофілізували у вакуумі, потім додали сольовий розчин, буферизований фосфатом, та колбу струшували, доки всі ліпід знаходився у суспензії. Суспензію далі пре-гомогенізували на мішалці з високою швидкістю зсуву та потім гомогенізували під високим тиском, доки не понизили розмір ліпосом до близько 90нм+/-10нм, що було виміряне на DLS. Далі ліпосоми стерильно відфільтрували на 0.22мкм PES мембрані. Отримання ASА: Етап 1: Розведення концентрованих ліпосом. 100 мМ Na2/K 10-разово розведений фосфатний буфер, pH 6.45 та 1.5M NaCI додали до води для ін'єкції до досягнення концентрацій, відповідно, 10 мМ для фосфату та 150 мМ для NaCI у кінцевому препараті. Цю суміш перемішували протягом 5 хвилин при кімнатній температурі. Потім додали концентровані ліпосоми (зроблені з DOPC, холестерину та MPL з 40мг/мл, 10мг/мл та 2мг/мл, відповідно) до досягнення концентрації MPL у 100 мкг/мл у кінцевому препараті. Суміш потім перемішували протягом 5-15 хвилин при кімнатній температурі. Етап 2: Додавання QS21. 8 UA 104888 C2 5 10 15 20 25 30 35 40 Сипкий продукт QS21 (відтаяний 24 год. при кімнатній температурі або протягом двох діб при 4 °C для 200 мл) додали до розведених ліпосом з магнітним перемішуванням до досягнення концентрації 100 мкг/мл у кінцевому препараті. Суміш перемішували при кімнатній температурі. Етап 3: pH, як перевірено, дорівнював 6.1+/-0.1. Етап 4: Стерильна фільтрація. Стерильну фільтрацію проводили за допомогою поліефірсульфонового (PES) фільтру від PALL Corporation. Етап 5: Зберігання при +2 °C - +8 °C. Кінцева композиція ASА містила 2мг DOPC, 500 мкг холестерину, 100 мкг 3-O-деацилованого MPL, 100 мкг QS21 на1 мл. Приклад 3. Літична активність QS21. QS21, як відомо, лізує червоні клітини крові (RBC). Ад'ювантну композицію ASА (сорбітол), що була отримана, як наведено у Прикладі 1, перевірили для підтвердження того, що літична активність QS21 пригнічувалася таким саме чином, як спостерігалося у еквівалентній ад'ювантній композиції, що містить 150 мМ NaCI (ASА (150 мМ NaCI)). Літичну активність QS21 вимірювали за допомогою аналізу гемолізу з застосуванням червоних клітин крові курчат (RBC). RBC центрифугували при 550g при 4 °C. Супернатант видалили. Осад ретельно рeсуспендовали у буфері PBS до досягнення початкового обсягу, та ту ж саме операцію повторювали, доки супернатант не перестав мати червоне забарвлення (звичайно, це тривало три години). Осад, що не був безпосередньо застосований, зберігали при 4 °C протягом максимум 3-4 діб (та знову промивали у день застосування) або розбавляли приблизно у 10 разів у буфері при застосуванні у той же день. Криву діапазону дозування QS21 отримали у буфері ASА (у солі або у сорбітоловому буфері слідом за перевіреним зразком ASА) та отримали зразки ад'юванта (що містили 50 мкг або 90 мкг еквіваленту QS21, еквівалентно 500 мкл або 900 мкл ASA). Кінцевий обсяг коригували до 900 мкл у стандартах та зразках з відповідним буфером (що вибірково містив або не містив сорбітол). Завдяки своєї опалесценції, ASА діє на оптичну щільність (OD). Отже, були отримані ASА " прогалини ", та їх оптичну щільність відняли від оптичної щільності перевірених зразків ASА. Ці прогалини відповідали таким же обсягам ASА, як ті, що були перевірені у зразках, але доведені до 1 мл з буфером. RBC до таких прогалин не додавали. Стандарти та зразки потім інкубували з RBC (100мкл розведеного RBC додавали до 900 мкл стандартів та зразків) протягом 30 хвилин при кімнатній температурі (RT). Потім зразки центрифугували 5 хвилин при 900g. Оптичну щільність при 540 нм вимірювали після центрифугування. Визначення літичної активності проводили шляхом випробування на граничній вміст. 1. Межу виявлення (LOD) було визначено у вигляді найнижчої концентрації QS21, що приводить до оптичної щільності (OD): - вищої, ніж базовий рівень (OD>0.1) - приблизно в три рази вищої, ніж OD буферу (" 0 мкг " для QS21) - у висхідній частині кривої - визначено для кожної перевірки. 2. Літична активність QS21 вважалася позитивною у ад'ювантних зразках, якщо OD для ад'ювантного зразка була більшою, ніж ODlod. Приклад кривої QS21: Мкг QS21 0 0,5 0,6 0,7 0,8 0,9 1 1,1 1,2 1,3 1,4 1,5 2 2,5 3 3,5 Ад'ювант* Оптична щільність 0,029 0,052 0,073 0,091 0,096 0,12 0,195 0,212 0,348 0.479 0,612 0,669 1,139 1,294 1,391 1,416 0,03 9 Пригнічення QS21 NA 97,6 % >97,4 % >97,2 % >97 % >96 % >95 % >94 % >90 % >98,2 % UA 104888 C2 *50 мкг тестованого еквіваленту QS21. 150 мМ буфер хлориду натрію. 5 10 Межею виявлення у цьому аналізі є 0.9 мкг QS21, та OD у 0.12 Пригнічення QS21 у адьювантній композиції, що містила 150 мМ хлорид натрію оцінено в більш, ніж 98.2 % для еквіваленту 50 мкг тестованого QS21. У випадку тестованого еквіваленту 90 мкг, результатом буде більш, ніж 99 %. Потім пригнічення QS21 порівняли з еквівалентною ад'ювантною композицією, що містила сорбітол та 5 мМ хлорид натрію. Дані отримали після зберігання ASА при 4 °C або після активованої стабільності (7 днів при 37 °C). Для ASА у сорбітолі, стандартну криву QS21 отримали у буфері, що містить сорбітол. Зразок Ад'ювантна композиція (ASА) 150мМ NaCl Ад'ювантна композиція (ASА) сорбітол, 5мМ NaCl 20 25 30 35 40 45 LOD 97,2 % 7 днів 37 °C 98,2 % Т0 97,8 % Т0 7 днів 37 °C 15 Точка часу Т0 97,8 %* Тестовано еквівалент 50 мкг QS21 за винятком * тестованого еквіваленту 90 мкг QS21. Зроблено висновок, що QS21 достатнім чином пригнічується у низькосольовому буфері хлориду натрію. Приклад 4: Конгенери MPL. Хімічно, 3D-MPL є сумішшю 3-деацилованого монофосфорил-ліпіду з 4, 5 або 6 ацилованими ланцюгами. Кожна окрема 3D-MPL молекула має назву конгенера. Важливо те, що конгенерна композиція залишається сталою, без будь-яких змінень серед частки конгенерів. Також важливо те, що будь-який застосований буфер дозволяє конгенерній композиції бути такою же, як у концентрованих ліпосомах, застосованих для отримання ад'ювантної композиції. Як наведено у Фіг. 2, конгенерну композицію перевіряли у 3D-MPL концентрованих ліпосомах (конц. ліпосоми LIP07-217, перша колонка Фіг. 2), адьювантній композиції, що містила 3D-MPL ліпосоми та QS21 у 150 мМ NaCI буфері (ад'ювант 150 мМ NaCI, або ASА (150 мМ NaCI), друга колонка), та адьювантній композиції, що містила 3D-MPL ліпосоми та QS21 у сорбітолі та 5 мМ NaCI буфері (ад'ювант сорбітол, або ASА (сорбітол), колонки 3-7). Конгенерну композицію також перевірили у двох партіях ASА (сорбітол) ад'юванта на 0 та 7 добу після отримання та зберігання при 37 °C для перевірки відсутності змінень протягом часу (див. кінцеві чотири колонки Фіг. 2). Відносне розподілення тетра-, пента- та гекса- ацилованих конгенерів MPL у концентрованих ліпосомах або ASА (сорбітол) зразках визначали шляхом іон-парного ВЕРХфлуо аналізу (ARD). Стандарти та зразки дериватизували з дансилгідразином, що вводить флуороактивний хромофор у дисахаридний скелет. Потім дериватизовані зразки аналізували на колонці C18 зі зворотною фазою з застосуванням гідроксиду тетрабутиламонію (TBAOH) у якості іон-парного реагенту. Конгенери, що містять однакові кількості жирних ацильних груп елюювали у окремі групи (тетраацил, пентаацил, та гексаацил). Розподілення конгенерів проводили шляхом порівняння площини піку від кожної групи до загальної пікової площини всіх MPL конгенерів. Фіг. 2 показує відсоток кожного конгенера. Не було знайдено істотної різниці у конгенерній композиції між ад'ювантними буферами, та конгенерна композиція була стабільною у сорбітоловому буфері протягом часу. Приклад 5: Отримання композицій та застосування у Прикладах 6 та 7. 5.1 Отримання PRAME з CpG (у всіх прикладах застосували CpG 2006). 5.1.1 Отримання PRAME з CpG з ASА (150 мМ NaCI), застосоване у Прикладі 6 та у Прикладі 7 Експерименту 1 та Експерименту 2. 30 % (мас/обс) розчин цукрози (отриманий у воді для ін'єкцій) додали до води для ін'єкцій до досягнення концентрації цукрози у 5 %. Далі додали 100 мМ Tris-HCI буфер, pH 9.5 до кінцевої концентрації 75 мМ Tris-буферу. Потім додали 100 мМ боратний буфер, pH 9.8 до кінцевої 10 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 концентрації 5 мМ боратного буферу. Потім додали 10 % (мас/обс) розчин Poloxamer188 (отриманий у воді для ін'єкцій) до кінцевої концентрації у 0.313 %. Далі суміш перемішували на магнітній мішалці (150 об/хв) протягом 5 хвилин при кімнатній температурі. Далі додали розчин CpG з концентрацією близько 20 мг/мл (у воді для ін'єкцій) до кінцевої концентрації 1050 мкг/мл у кінцевому препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 5 хвилин при кімнатній температурі. Потім додали PRAME антиген до досягнення кінцевої концентрації білка у 1250 мкг/мл. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 15 хвилин при кімнатній температурі. Далі перевірили pH (9.51) та отриману суміш розподілили по 0.5 мл у 3 мл скляні флакони та потім сублімували. Фіг.3 показує цикл сублімаційного сушіння, застосований для PRAME (тривалість - 40 год.). Отриманий після сушіння осад відновили у 625 мкл водної ад'ювантної композиції, отриманої, як наведено у Прикладі 2, що містила 150 мМ NaCI. Осад після ліофілізації, що містив 1.25-кратне перевищення дози антиген мав належне співвідношення антиген/ад'ювант після відновлення з кінцевої композиції 16 мМ Tris, 4 мМ боратного буферу, 4 % цукрози, 0.24 % Poloxamer 188, 840 мкг/мл CpG та 1000 мкг/мл PRAME. 5.1.2 Отримання PRAME з CpG для " рідкого препарату " (70 мМ NaCI) у Експерименті 1 Прикладу 7. 10-кратно концентрований PBS, pH 6.1, розбавлений у 10 разів додали до води для ін'єкцій до досягнення одноразово концентрованого буфера у кінцевому препараті. Окремо отримали попередньо перемішаний розчин ліпосом та попередньо розведеного QS21 (400 мкг/мл). Цей розчин перемішували з застосуванням магнітної мішалки протягом 15 хв. при кімнатній температурі. Концентровані ліпосоми, застосовані у попередньо перемішаному розчині отримали з 40мг/мл DOPC, 10мг/мл холестерину та 2мг/мл 3-деацилованого MPL. Попередньо перемішаний розчин додали до PBS до досягнення концентрації MPL концентрації у 200 мкг/мл та QS21 концентрації у 200 мкг/мл у кінцевому препараті. Суміш перемішували на магнітній мішалці протягом 15-30 хвилин при кімнатній температурі. Потім додали CpG з концентрацією приблизно 23мг/мл до кінцевої концентрації 1680 мкг/мл. Суміш перемішували на магнітній мішалці протягом 15-30 хвилин при кімнатній температурі. pH, як перевірено, дорівнював 6.1 +/0.1. ASА відфільтрували на 0.22 мкм PES фільтрі та зберігали, доки застосовували, при 4 °C. 25 % цукрозу, 25 мМ боратний буфер, pH9.8 та 10 % Лутрол додали до WFI до досягнення, відповідно, 9.25 %, 5 мМ та 0.24 % у кінцевому препараті. Дворазово концентрований ASА + CpG препарат додали з отриманням одноразового концентрування у кінцевому препараті. Суміш перемішували протягом 5 хвилин при кімнатній температурі. Потім додали 3.15 % PRAME антиген у цукрозі, 5 мМ боратний буфер, та суміш перемішували протягом 5 хвилин при кімнатній температурі. 5.1.3 Отримання PRAME з CpG для " рідкого препарату " у Експерименті 2 Прикладу 7. ASА для рідкого препарату отримали таким чином. 1M фосфатний буфер (pH 6.1 при 100разовому розбавленні) додали з перемішуванням на магнітній мішалці до WFI до досягнення кінцевої 45 мМ (беручи до уваги 50 мМ) фосфатної концентрації у концентрованих ліпосомах. Далі додали 35 % сорбітол до кінцевої концентрації 21.15 %. До суміші додали концентровані ліпосоми, отримані з 40 мг/мл DOPC, 10 мг/мл холестерину та 2 мг/мл 3-деацилованого MPL до досягнення кінцевий концентрації MPL у 450 мкг/мл. Обсяг QS21 (приблизно 5000 мкг/мл) додали до кінцевої концентрації QS21 у 450 мкг/мл. Суміш перемішували протягом 15 хвилин при кімнатній температурі. pH перевірили та скоригували до pH 6.1+/-0.1. Кінцевими концентраціями у цій ASА були відповідно 450 мкг/мл для MPL, 450 мкг/мл для QS21, 45 мМ фосфат, 22.5 мМ NaCI, 21.15 % сорбітол. 30 % (мас/обс) розчин цукрози (отриманий у воді для ін'єкцій) додали до води для ін'єкцій до досягнення концентрації цукрози у 4 % у кінцевому препараті. Потім додали 1 M Tris-HCI буфер, pH 9.0 до кінцевої концентрації у 16 мМ Tris буфера у кінцевому препараті. Потім додали 100 мМ боратний буфер, pH 9.8 до кінцевої концентрації 4 мМ боратного буфера у кінцевому препараті. Потім додали 10 % (мас/обс) розчин Poloxamer188 (отриманий у воді для ін'єкцій) до кінцевої концентраці 0.24 % у кінцевому препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 5 хвилин при кімнатній температурі. Потім додали розчин CpG з концентрацією близько 20 мг/мл (у воді для ін'єкцій) до кінцевої концентрації 840 мкг/мл у кінцевому препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 5 хвилин при кімнатній температурі. Потім додали буфер PRAME антигена (5 мМ боратний буфер 3.15 % цукроза, pH 9.8) до досягнення концентрації PRAME антигена у 1000 мкг/мл. Потім додали PRAME антиген до кінцевої білкової концентрації 8 мкг/мл у кінцевому препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 15 хвилин при кімнатній температурі. 11 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 60 4.5 - кратно концентрований ASА у сорбітолі додали до кінцевої концентрації 100 мкг/мл MPL та QS21. Перевірений pH дорівнював +/-8.0. 5.1.4 Отримання PRAME з CpG для ASА (сорбітол) та ASА (цукроза) у Експерименті 1 Прикладу 7. 30 % (мас/обс) розчин цукрози (отриманий у воді для ін'єкцій) додали до води для ін'єкцій до досягнення 5 % концентрації цукрози у препараті. Потім додали 100 мМ боратний буфер, pH 9.8 до кінцевої 5 мМ концентрації боратного буфера у цьому препараті. Потім додали 100 мМ TrisHCI буфер, pH 9.0 з 20-разовим розведенням до кінцевої 5 мМ концентрації Tris-буфера у цьому препараті. Потім додали 10 % (мас/обс) розчин Poloxamer188 (отриманий у воді для ін'єкцій) до кінцевої концентрації 0.3 % у препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 5 хвилин при кімнатній температурі. Потім додали розчин CpG з концентрацією близько 20 мг/мл (у воді для ін'єкцій) до кінцевої концентрації 1050 мкг/мл у препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 5 хвилин при кімнатній температурі. Потім додали PRAME антиген до кінцевої концентрації білка 1250 мкг/мл у кінцевому препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 15 хвилин при кімнатній температурі. Виміряний pH дорівнював 9.4. Отриману суміш розподілили по 0.5 мл у 3 мл скляні флакони, та потім сублімували. ASА (сорбітол) отримали, як вказано у Прикладі 1 з деякими незначними відмінностями: концентрація сорбітолу сягала 4.6 % та QS21 попередньо розбавили до 400 мкг/мл перед додаванням до розбавлених концентрованих ліпосом. ASА (цукроза) отримали, як вказано у Прикладі 1 з наступними відмінностями: сорбітол замінили цукрозою (застосували базовий розчин 30 % мас/обс цукрози та кінцева концентрація цукрози дорівнювала 8.3 %) та QS21 попередньо розбавили до 400 мкг/мл перед додаванням до розбавлених концентрованих ліпосом. Отриманий після сушіння осад відновили у 625 мкл водної ад'ювантної композиції та кінцева композиція містила 4 мМ Tris, 4 мМ боратний буфер, 4 % цукрозу, 0.24 % Poloxamer 188, 840 мкг/мл CpG та 1000 мкг/мл PRAME. 5.1.5 Отримання PRAME з CpG для ASА (сорбітол) у Експерименті 2 Прикладу 7. 30 % (мас/обс) розчин цукрози (отриманий у воді для ін'єкцій) додали до води для ін'єкцій до досягнення 5 % концентрації цукрози у препараті. Потім додали 1 M Tris-HCI буфер, pH 9.0 з 20разовим розведенням до кінцевої концентрації 20 мМ Tris-буфера у цьому препараті. Потім додали 100 мМ боратний буфер, pH 9.8 з 20-разовим розведенням до кінцевої концентрації 5 мМ боратного буфера у цьому препараті. Далі додали 10 % (мас/обс) розчин Poloxamer188 (отриманий у воді для ін'єкцій) до кінцевої концентрації 0.3 % у препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 5 хвилин при кімнатній температурі. Потім додали розчин CpG з концентрацією близько 20 мг/мл (у воді для ін'єкцій) до кінцевої концентрації 1050 мкг/мл у препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 5 хвилин при кімнатній температурі. Потім додали PRAME антиген до кінцевої концентрації білка 1250 мкг/мл у кінцевому препараті. Суміш перемішували на магнітній мішалці (150 об/хв) протягом 15 хвилин при кімнатній температурі. Виміряний pH дорівнював 9.1. Отриману суміш розподілили по 0.5 мл у 3 мл скляні флакони, та потім сублімували. ASА сорбітол отримали, як описано у Приклад 1. Отриманий після сушіння осад відновили у 625 мкл водної ад'ювантної композиції та кінцева композиція містила 16 мМ Tris, 4 мМ боратний буфер, 4 % цукрозу, 0.24 % Poloxamer 188, 840 мкг/мл CpG та 1000 мкг/мл PRAME. 5.2 Отримання NY-ESO1 з CpG 5.2.1 Отримання NY-ES01 з CpG у Прикладі 6. 200 мМ Na/K2 фосфатний буфер, pH 6.3 з 20-разовим розведенням додали з перемішуванням на магнітній мішалці до води для ін'єкцій до досягнення 12.5 мМ у кінцевому препараті. Далі до суміші додали наступні допоміжні речовини у наступному порядку: 10 % мас/обс монотіогліцерин до кінцевої концентрації 0.3125 %; 5 % мас/обс Poloxamer 188 до кінцевої концентрації 0.0625 %; 25 % цукроза до кінцевої концентрації 5 % та 287 мМ Lаргінінова основа до кінцевої концентрації 6.25 мМ. Потім додали до цей суміші приблизно 20мг/мл CpG до досягнення концентрації 1050 мкг/мл у кінцевому препараті. Суміш перемішували на магнітній мішалці (приблизно 150об/хв) при кімнатній температурі протягом 10 хвилин. Перевірений pH дорівнював 7.1+/-0.3. Магнітне перемішування збільшили для створення вихору. Потім додали NY-ESO1 до кінцевої кінцевий концентрації у 750 мкг/мл. Далі магнітне перемішування зменшили до близько 150об/хв та суміш перемішували при кімнатній температурі протягом 5 хвилин. Аліквоту суміші взяли для перевірки кінцевого pH (що мав дорівнювати 7.02). Готовий матеріал ліофілізовали. Отриманий після сушіння осад відновили у 625 мкл ASА буферів (150 мМ NaCI та сорбітол). 12 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 6. Запобігання " висолювання " у ад'ювантній композиції, що містить сорбітол у якості буфера. Фіг. 4 показує, що зниження сольової концентрації до 5 мМ та включення сорбітолу у ад'ювантну композицію запобігає " висолюванню " PRAME та NY-ESO-1 у імуногенній композиції (як отримано у Прикладах 5.1.1 та 5.2.1 відповідно). у Фіг. 4: 1. PRAME антиген відтворений у ASА 150 мМ NaCI буфері. 2. PRAME антиген відтворений у ASА сорбітоловому буфері. 3. NYESO-1 антиген відтворений у ASА 150 мМ NaCI буфері. 4. NYESO-1 антиген відтворений у ASА сорбітоловому буфері. Фіг. 4 являє собою фотографічне порівняння між PRAME та NYESO-1, відтвореними у ASА (150 мМ NaCI) та ASА (сорбітол). Як можна побачити, PRAME, відтворений у ASА (150 мМ NaCI) виявляється більш мутним порівняно до PRAME, відтвореного у ASА (сорбітол). Так саме, NYESO, відтворений у ASА (150 мМ NaCI) виявляється більш мутним порівняно до NY-ESO антигену, відтвореного у ASА (сорбітол). Приклад 7. Мишача модель in vivo. Експеримент 1: 7 груп 20 мишей CB6F1 жіночої статі (гібрид мишей C57BL/6 та Balb/C) у віці 6-8 тижнів двічі внутрішньом'язово імунізували (кожні два тижня, поперемінними ін'єкціями у лівий та правий литковий м'яз) отриманим PRAME білком з фіксованою дозою ASА+ CpG, що відповідала 1/10 частині дози для людини (50мкл, що містили 5 мкг MPL, 5 мкг QS21 та 42 мкг CpG 7909). Через 14 днів після останньої імунізації чотири групи мишей (n=8 у кожній групі) підшкірно інфікували пухлинними клітинами 10e5 CT26-PRAME, як описано нижче. Досліджували сім груп мишей: - група 1: буфер; група 2: співліофілізовані PRAME+CpG, ресуспендовані у "класичному" ASА (150 мМ NaCI), у якому осаджується PRAME білок; група 3: співліофілізовані PRAME+CpG, ресуспендовані у ASА (цукроза); група 4: співліофілізовані PRAME+CpG, ресуспендовані у ASА (цукроза - інкубування 48год. при 25 °C) група 5: співліофілізовані PRAME+CpG, ресуспендовані у ASА (сорбітол) група 6: PRAME+ASА - " рідкий " препарат, що містить 70 мМ NaCI+CpG група 7: PRAME+ASА - "рідкий " препарат, що містить 70 мМ NaCI+CpG (+полоксамер) Через 7 днів після останньої імунізації, аналізували клітинну відповідь шляхом здатності Tклітин виробляти цитокіни (n=4 групи по 3 миші). Всі миші отримали 0.4 мкг PRAME (відповідно 1/10 частині дози для людини) у ASА та ад'ювантну систему CpG (5 мкг MPL, 5 мкг QS21 та 42 мкг CpG). Середній рост пухлин протягом часу, як було поверхнево виміряне (мм²) (+SD) на групу, наведений у Фіг. 6. Отриманий PRAME ASА (150 мМ NaCI) + CpG та PRAME у рідкому препараті ASА свідчить о низькому антипухлинному захисті (більш велике зростання пухлин), ніж PRAME ASА (сорбітол) + CpG. Клітинна відповідь (7 днів після двох імунізацій- n=4 групи по 3 миші на групу лікування): Для відображення здатності різних препаратів індукувати функціональну клітинну відповідь застосували частоту CD4 та CD8 T-клітин, здатних виробляти цитокіни, подібні до IFNγ та TNFα після імунізації мишей з PRAME ASA-CpG пухлинним антигеном. Через 7 днів після другої імунізації, відсотки T-клітин CD4 та CD8, що виробляють цитокіни (IFNγ та TNFα) виміряли шляхом внутрішньоклітинного цитокінового забарвлення (ICS) у клітинах селезінки імунізованих мишей. Відсотки CD4, що виробляють IFNγ та TNFα (середнє +/- стандартне відхилення), наведені у Фіг. 5. Ніякої придатної до вимірювання відповіді CD8 у цьому експерименті знайдено не було. Було видно, що білок PRAME, отриманий у ASА (150 мМ NaCI) + CpG був здатен осаджуватися та викликати менш специфічну T-клітину відповідь порівняно до PRAME, що був отриманий у ASА (сорбітол) + CpG. Подібну добру PRAME- специфічну CD4 відповідь отримали при отриманні білка PRAME у ASА (сорбітол) + CpG та у ASА " рідкого " препарату (70 мМ NaCI) + CpG (статистичної різниці не було). Також перевірили гуморальну імунну відповідь, але дані після двох ін'єкцій були не інтерпретовані. Експеримент 2: Чотири групи 24 мишей CB6F1 (гібрид C57BL/6 та Balb/C мишей) жіночої статі у віці 6-8 тижнів чотириразово внутрішньом'язово імунізували (кожні два тижні, поперемінними ін'єкціями 13 UA 104888 C2 5 10 15 20 25 30 35 40 45 50 55 у лівий та правий литковий м'яз) отриманим PRAME білком з фіксованою дозою ASА+ CpG, що відповідала 1/10 частині дози для людини (50 мкл, що містила 5 мкг MPL, 5 мкг QS21 та 42 мкг CpG 7909). Через 14 днів після останньої імунізації чотири групи мишей (n=12 у кожній групі) інфікували підшкірно пухлинними клітинами 10e5 CT26-PRAME, як описано нижче. Цими чотирма групами мишей були: група 1: буфер. група 2: співліофілізовані PRAME+CpG, ресуспендований у " класичному " ASА (150 мМ NaCI), у якому осаджується білок PRAME. група 3: співліофілізовані PRAME+CpG, ресуспендований у ASА (сорбітол). група 4: PRAME+ASА - " рідкий " препарат + CpG (+ полоксамер) Через 14 днів після останньої імунізації, імунну відповідь аналізували з застосуванням різних зчитувань даних таким чином: Гуморальна відповідь (n=12). Клітинна відповідь по здатності T-клітин виробляти цитокіни (n=4 групи по 3 миші). Захисна дія проти пухлинного інфікування (n=12). Всі миші отримали 0.4 мкг PRAME, що відповідало 1/10 частині дози для людини ASА + CpG ад'ювантної системи (5 мкг MPL, 5 мкг QS21 та 42 мкг CpG). Середнє зростання пухлин протягом часу, як було поверхнево виміряне (мм²) (+SD) на групу, наведено у Фіг.9. Отриманий PRAME ASА (150 мМ NaCI) + CpG свідчить о низькому антипухлинному захисті (більш велике зростання пухлин), ніж PRAME ASА (сорбітол) + CpG та PRAME у рідкому препараті ASА + CpG). Мишачу сироватку (n=12) перевіряли за допомогою ІФА на присутність PRAME-специфічних антитіл через 14 днів після останньої з чотирьох імунізацій, як описано нижче. Відповідь антитіл (загальний імуноглобулін) оцінювали шляхом ІФА з застосуванням очищеного рекомбінантного PRAME білка у якості антигену покриття. Сироватку з імунізованих тварин аналізували на присутність PRAME – специфічних антитіл. Середні геометричні стандартні титри (n=12 мишей) +/- 95 % довірчі інтервали, отримані після 4 імунізацій наведені у Фіг. 7. Суміш PRAME/ASА + CpG, що містить класичний ASА (150 мМ NaCI) індукувала дуже малу відповідь антитіл, у той час, як PRAME/ASА + CpG, що містила ASА (сорбітол) індукувала дуже високі титри антитіл. Ця відповідь є подібною до індукованої рідким препаратом ASA. Клітинна відповідь (14 днів після чотирьох імунізацій – n=4 групи по 3 миші на групу лікування): Частота CD4 та CD8 T-клітин, здатних продукувати цитокіни, подібні до IFNγ та TNFα після імунізації мишей з PRAME ASA-CpG пухлинним антигеном була застосована для відображення здатності різних препаратів індукувати функціональну клітинну відповідь. Через 14 днів після четвертої імунізації, відсотки CD4 та CD8 T-клітин, що виробляють цитокіни (IFNγ та TNFα) виміряли шляхом внутрішньоклітинного цитокінового забарвлення (ICS) у клітинах селезінки імунізованих мишей. Відсотки CD4, що виробляють IFNγ та TNFα (середнє +/- стандартне відхилення) наведені у Фіг. 8. p-значення, що значно нижчі, ніж 0.05, демонструють істотну різницю між групою 2 та групами 3 та 4. Ніякої придатної до вимірювання відповіді CD8 у цьому експерименті знайдено не було. Було видно, що білок PRAME, отриманий у ASА (150 мМ NaCI) + CpG був здатен осаджуватися та викликати статистично меншу специфічну T-клітину відповідь, порівняно до PRAME, що був отриманий у ASА (сорбітол) + CpG. На відміну, подібну добру PRAME специфічну CD4 відповідь отримали при отриманні білка PRAME у ASА (сорбітол) + CpG та у ASА " рідкого " препарату + CpG. Клітинну лінію CT26-PRAME отримали шляхом трансфекції клітин раку товстої кишки CT26 з pCДНК3, плазмідою, що експресується у ссавців, яка кодує кДНК для PRAME (Invitrogen, Carlsbad, CA). За допомогою відбору з G418 (200 мкг/мл) та клонування з обмеженим розведенням отримали клон, що експресує PRAME (CT26-PRAME), як визначено кількісною ПЛР у реальному часі (10e-3 PRAME мРНК копії / копія мишачого β-актину, який знаходиться у діапазоні рівня експресії PRAME людськими пухлинами). Клітини CT26 PRAME підрощували in vitro при 37 °C з 5 % CO2 у середовищі RPMI з 10 % телячою ембріональною сироваткою, 1 % L- глутаміном, 1 % пеніцилін-стрептоміцином, 1 % другорядних амінокислот, 1 % піруватом натрію та 0.1 % β-меркаптоетанолом. Клітини трипсінізували, двічі промили у вільному від сироватки середовищі та ввели з 200мкл середовища RPMI підшкірно у правий підвздох чотирьом групам мишей CB6F1 через 14 днів після останньої імунізації з PRAME, як описано вище. Індивідуальне зростання пухлин 14 UA 104888 C2 5 10 15 20 25 30 35 40 45 вимірювали двічі на тиждень. Появу кожної пухлини двох головних діаметрів додатково записували та дані наведені у вигляді середньої пухлинної поверхні (мм²) у кожній групі тварин. Перед додаванням сироватки на імунологічний планшет нанесли PRAME антиген та інкубували при 4 °C протягом ночі. Після реакції з сироваткою протягом 90 хв. при 37 °C, додали біотініловані нормальні антитіла кролів проти мишачих імуноглобулінів з інкубацією протягом 90 хв. при 37 °C. Комплекс "антиген-антитіло" виявляли шляхом інкубування з стрептавидінбіотинілованим пероксидазним комплексом протягом 30 хв. при 37 °C. Потім цей комплекс виявляли додаванням тетраметилбензидину (TMB) з інкубацією у 10 хв. при кімнатній температурі. Реакцію зупинили 0.2 M H2SO4. Оптичні щільності записали при 450 нм. Продукування IFNg та TNF T-клітинами CD4 та CD8 вимірювали за допомогою проточної цитометрії (LSR2 від Becton Dickinson) з застосуванням внутрішньоклітинного цитокінового забарвлення (ICS) у клітинах селезінки імунізованих мишей (4 групи, по 3 миші на групу) після двохгодинного стимулювання з групою 15-мерних пептидів, що перекриваються та покривають повну послідовність білка PRAME. Клітини селезінки імунізованих тварин повторно стимулювали групою 123 15-мерних пептидів, що перекриваються 11 амінокислотами та покривають повну послідовність білка PRAME. Пептиди (1 мкг/мл/пептид) перемішали з T- клітинами 10e6 (клітини селезінки) з двохгодинним інкубуванням при 37 °C у 96-лунковому планшеті (U) у кінцевому обсязі у 200 мкл RPMI 5 % FCS, що містив 2 мкг/мл анти - CD49d та анти - CD28 (2 мкг/мл). Після інкубування додали 50мкл брефелдину (1/1000) у RPMI 5 % FCS. Внутрішньоклітинне забарвлення: - CD4/CD8 забарвлення: Клітини перенесли у 96 – лункові планшети (конічні лунки). Центрифугування при 1000 об/хв 5' при 4 °C Промивання з 250 мкл буферу FACS (PBS 1 % FCS) Осад клітин інкубували з 50 мкл 2.4 G2 1/50 у буфері FACS протягом 10' при 4 °C - 50 мкл Master mix CD4-PE (розведення моноклональних антитіл: 1/200) та CD8 Per Cp (розведення моноклональних антитіл: 1/200) у FACS буфері додали з інкубуванням 30' при 4 °C - Промивання у FACS буфері (1200 об/хв -10') - Пермеабілізація клітин: Осади інкубували з 200 мкл розчину cytoFix-cytoPerm протягом 20' при 4 °C. - Промивання з 1x permWASH (1200 об/хв -10')- permWASH розчин був 10x концентрованим, розведення у стерильній воді. - I IFNγ та TNFα внутрішньоклітинне забарвлення: Осади інкубували протягом 2 годин при 4 °C з 50 мкл суміші IFNγ APC (розведення моноклональних антитіл: 1/50) та TNFα FITC (розведення моноклональних антитіл: 1/50) у 1x розчині permWASH. - Промивання з 1x permWASH (1200 об/хв -10') осади ресуспендували у FACS буфері. - FACS аналіз. Брефелдин (Gologi Plug): BD cat.555029. Cytofix / cytoperm: Pharmingen (BD) Cat № 54722. Perm/wash буфер: Pharmingen(BD) Cat №° 554723. Щурячий анти-мишачий CD49d, очищений NLE: BD Cat № 553154. Щурячий анти-мишачий CD28, очищений NLE: BD Cat № 553295 Щурячий анти-мишачий CD8 perСр: BD Cat № 553036 Щурячий анти-мишачий CD4 PE: BD Cat № 556616 Щурячий анти-мишачий IFNγ APC: BD Cat № 554413 Щурячий анти-мишачий TNFα FITC: BD Cat № 554418 Анті-мишачий CD16/CD32 (2.4G2) Becton Dickinson Cat № 553142 (0.5мг/мл). 50 15 UA 104888 C2 ФОРМУЛА ВИНАХОДУ 5 1. Водна ад'ювантна композиція, що містить: (a) TLR4 агоніст та сапонін у ліпосомальному препараті; та (b) неіонний ізотонічний агент, де концентрація хлориду натрію або іонна сила у ад'ювантній композиції є меншою ніж 100 мМ. 16 UA 104888 C2 5 10 15 20 25 30 35 40 45 2. Водна ад'ювантна композиція за п. 1, де концентрація хлориду натрію або іонна сила є меншою ніж 80 мМ. 3. Водна ад'ювантна композиція за п. 2, де концентрація хлориду натрію або іонна сила є меншою ніж 30 мМ. 4. Водна ад'ювантна композиція за п. 3, де концентрація хлориду натрію або іонна сила є меншою ніж 10 мМ. 5. Водна ад'ювантна композиція за п. 4, де концентрація хлориду натрію або іонна сила є меншою ніж 5 мМ. 6. Водна ад'ювантна композиція за п. 5, що практично не містить хлориду натрію. 7. Водна ад'ювантна композиція за будь-яким з попередніх пунктів, де неіонний ізотонічний агент є поліолом. 8. Водна ад'ювантна композиція за п. 7, де поліол є сорбітолом. 9. Водна ад'ювантна композиція за п. 8, де концентрація сорбітолу складає від 3 до 15 % (мас./об.). 10. Водна ад'ювантна композиція за п. 9, де концентрація сорбітоліу складає від 4 до 10 % (мас./об.). 11. Водна ад'ювантна композиція за будь-яким попереднім пунктом, де вказаний агоніст TLR4 є 3D-MPL. 12. Водна ад'ювантна композиція за будь-яким попереднім пунктом, де вказаний сапонін є Quil А або його похідною. 13. Водна ад'ювантна композиція за п. 12, де похідною Quil А є QS21. 14. Водна ад'ювантна композиція за будь-яким попереднім пунктом, що містить приблизно 5 мМ хлориду натрію та сорбітол у межах 5-6 % (мас./об.). 15. Імуногенна композиція, що містить антиген або антигенний препарат та водну ад'ювантну композицію за будь-яким з пп. 1-14. 16. Імуногенна композиція за п. 15, де вказаний антиген або антигенний препарат є нерозчинним у сольових концентратах або у розчинах з іонною силою, вищою ніж 5 мМ, 10 мМ, 20 мМ, 30 мМ, 40 мМ, 50 мМ, 60 мМ, 70 мМ, 80 мМ, 90 мМ або 100 мМ. 17. Імуногенна композиція за пп. 15, 16, де антиген або антигенний препарат походить від ВІЛ, менінгококу або є пухлинним антигеном. 18. Імуногенна композиція за п. 17, де антиген є вибраним з PRAME або з NY-ESO-1, або є їх фрагментом або похідною. 19. Імуногенна композиція за будь-яким з пп. 15-18, що додатково містить олігонуклеотид CpG. 20. Спосіб отримання імуногенної композиції за будь-яким з пп. 15-19, що містить етап відновлення ліофілізованої композиції, яка містить принаймні один антиген або антигенний препарат з водною ад'ювантною композицією, як визначено у будь-якому з пп. 1-14. 21. Спосіб за п. 20, де вказана ліофілізована композиція додатково містить TLR9 агоніст. 22. Спосіб за п. 21, де вказаний TLR9 агоніст є імуностимуляторним олігонуклеотидом CpG. 23. Спосіб за будь-яким з пп. 20-22, де антиген або антигенний препарат є нерозчинним у сольових концентратах або у розчинах з іонною силою, вищою ніж 10 мМ, 20 мМ, 30 мМ, 40 мМ, 50 мМ, 60 мМ, 70 мМ, 80 мМ, 90 мМ або 100 мМ. 24. Набір, що охоплює (і) ліофілізовану композицію, яка містить антиген або антигенний препарат та (іі) водну ад'ювантну композицію за будь-яким з пп. 1-14. 25. Набір за п. 24, де вказана ліофілізована композиція додатково містить TLR9 агоніст. 26. Набір за п. 25, де вказаний TLR9 агоніст є імуностимуляторним олігонуклеотидом CpG. 27. Набір за будь-яким з пп. 24-26, де антиген або антигенний препарат є нерозчинним у сольових концентратах або у розчинах з іонною силою, вищою ніж 10 мМ, 20 мМ, 30 мМ, 40 мМ, 50 мМ, 60 мМ, 70 мМ, 80 мМ, 90 мМ або 100 мМ. 17 UA 104888 C2 18 UA 104888 C2 19 UA 104888 C2 20 UA 104888 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюAdjuvant compositions comprising a non-ionic isotonicity agent
Автори англійськоюHenderickx, Veroneque, Lemoine, Dominique, Ingrid
Автори російськоюГендерикс Вероник, Лемоин Доминик Ингрид
МПК / Мітки
МПК: A61P 37/02, A61P 35/00, A61K 39/39
Мітки: містить, ад'ювантна, композиція, ізотонічний, агент, неіонний
Код посилання
<a href="https://ua.patents.su/23-104888-adyuvantna-kompoziciya-shho-mistit-neionnijj-izotonichnijj-agent.html" target="_blank" rel="follow" title="База патентів України">Ад’ювантна композиція, що містить неіонний ізотонічний агент</a>
Попередній патент: Синергічні комбінації активних речовин
Наступний патент: Спосіб керування пральною машиною
Випадковий патент: Перемішуючий пристрій