Спосіб активної клітинної імунотерапії раку шляхом застосування пухлинних клітин, знищених за допомогою високого гідростатичного тиску, і дендритних клітин
Формула / Реферат
1. Фармацевтична композиція для викликання імунної реакції проти пухлинних клітин, що включає
a) пухлинні клітини, що є апоптотичними, причому апоптоз викликається шляхом обробки високим гідростатичним тиском, що дорівнює або більше 100 МПа від 10 хв. до 2 год., і
b) дендритні клітини.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що пухлинні клітини були піддані обробці гідростатичним тиском впродовж принаймні 10 хвилин під тиском як мінімум 200 МПа.
3. Фармацевтична композиція за п. 1, яка відрізняється тим, що пухлинні клітини були піддані обробці гідростатичним тиском 200-300 МПа.
4. Фармацевтична композиція за будь-яким з пп. 1-3, яка відрізняється тим, що апоптотичні пухлинні клітини не є некротичними.
5. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що пухлинні клітини були взяті з ліній пухлинних клітин.
6. Фармацевтична композиція за будь-яким з пп. 1-4, яка відрізняється тим, що пухлинні клітини були взяті з пухлини, виділеної з організму пацієнта, який підлягає лікуванню.
7. Фармацевтична композиція за будь-яким з пп. 1-6, яка відрізняється тим, що незрілі дендритні клітини були навантажені апоптотичними пухлинними клітинами, обробленими високим гідростатичним тиском.
8. Фармацевтична композиція за п. 7, яка відрізняється тим, що незрілі дендритні клітини були одержані шляхом лейкаферезу.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що незрілі дендритні клітини були одержані шляхом лейкаферезу і культивування in vitro у присутності цитокінів.
10. Фармацевтична композиція за будь-яким з пп. 1-9 для застосування в лікуванні пацієнтів, які страждають на рак ранньої, а також пізньої стадій.
11. Фармацевтична композиція за будь-яким з пп. 1-9 для застосування в лікуванні пацієнтів, які страждають на солідні ракові пухлини, такі як рак передміхурової залози, рак яєчників або рак легень.
12. Фармацевтична композиція за п. 10 для застосування в лікуванні пацієнтів, причому рак пізньої стадії являє собою рак передміхурової залози з резистентним до гормонального лікування метастатичним раком передміхурової залози.
13. Спосіб одержання фармацевтичної композиції за будь-яким з пп. 1-11, який відрізняється тим, що незрілі дендритні клітини навантажують апоптотичними пухлинними клітинами, які були оброблені високим гідростатичним тиском з наступним дозріванням дендритних клітин.
14. Спосіб лікування людини шляхом протиракової вакцинації, який полягає у тому, що виділяють незрілі дендритні клітини з організму пацієнта і виділяють пухлинні клітини з організму пацієнта, причому вищезгадані пухлинні клітини приводять в апоптозний стан шляхом обробки впродовж від 10 хв. до 2 год. високим гідростатичним тиском, що дорівнює або більше 100 МПа, навантажують ними незрілі дендритні клітини і дендритні клітини доводять до зрілості перед застосуванням фармацевтичної композиції для пацієнта.
15. Спосіб лікування людини шляхом протиракової вакцинації, який полягає у тому, що виділяють незрілі дендритні клітини з організму пацієнта і навантажують вищезазначені дендритні клітини пухлинними клітинами, одержаними з лінії пухлинних клітин, які приводять в апоптозний стан шляхом обробки впродовж від 10 хв. до 2 год. високим гідростатичним тиском, що дорівнює або більше 100 МПа, і, таким чином, дендритні клітини необов'язково доводять до зрілості перед застосуванням фармацевтичної композиції для пацієнта.
Текст
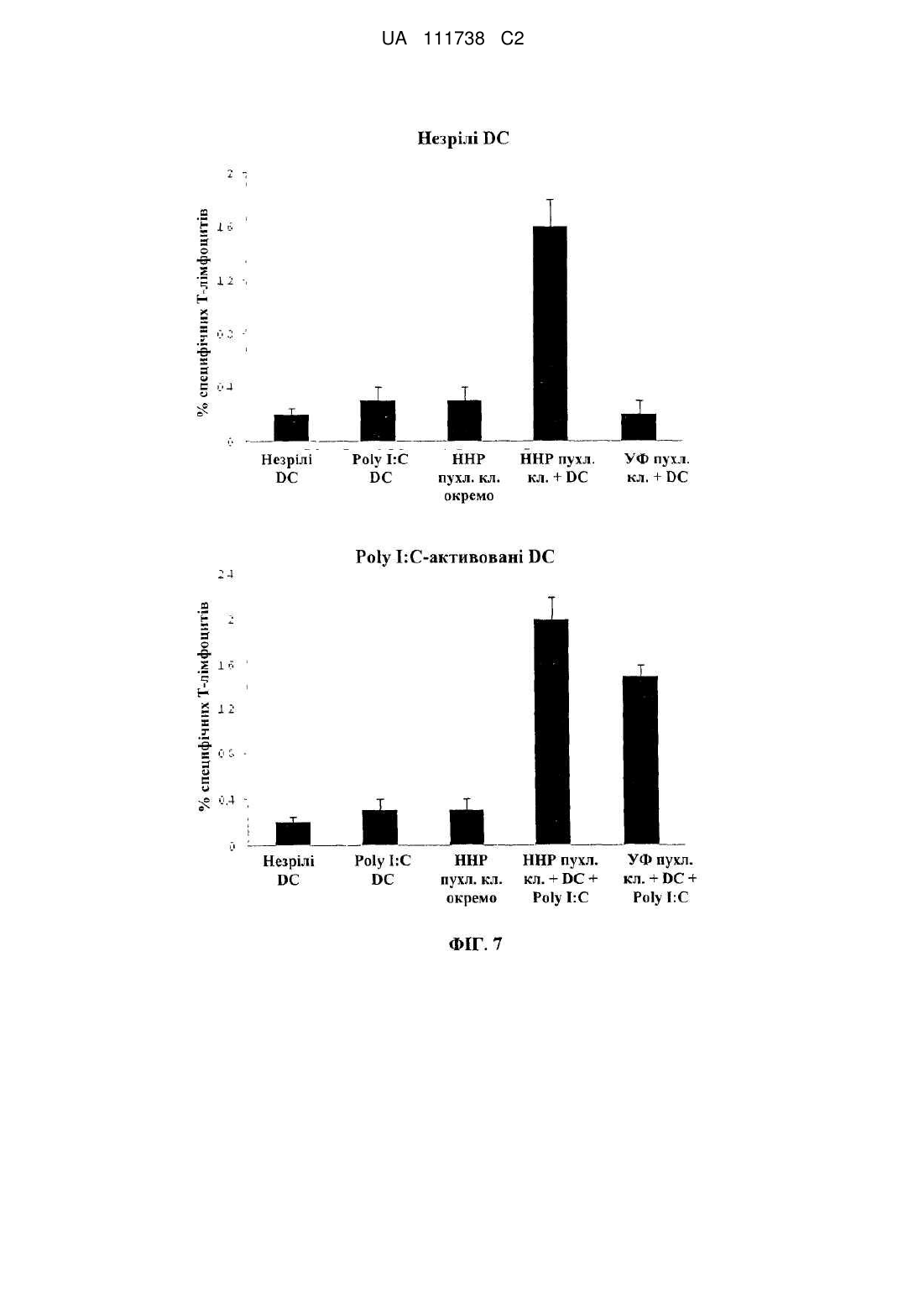
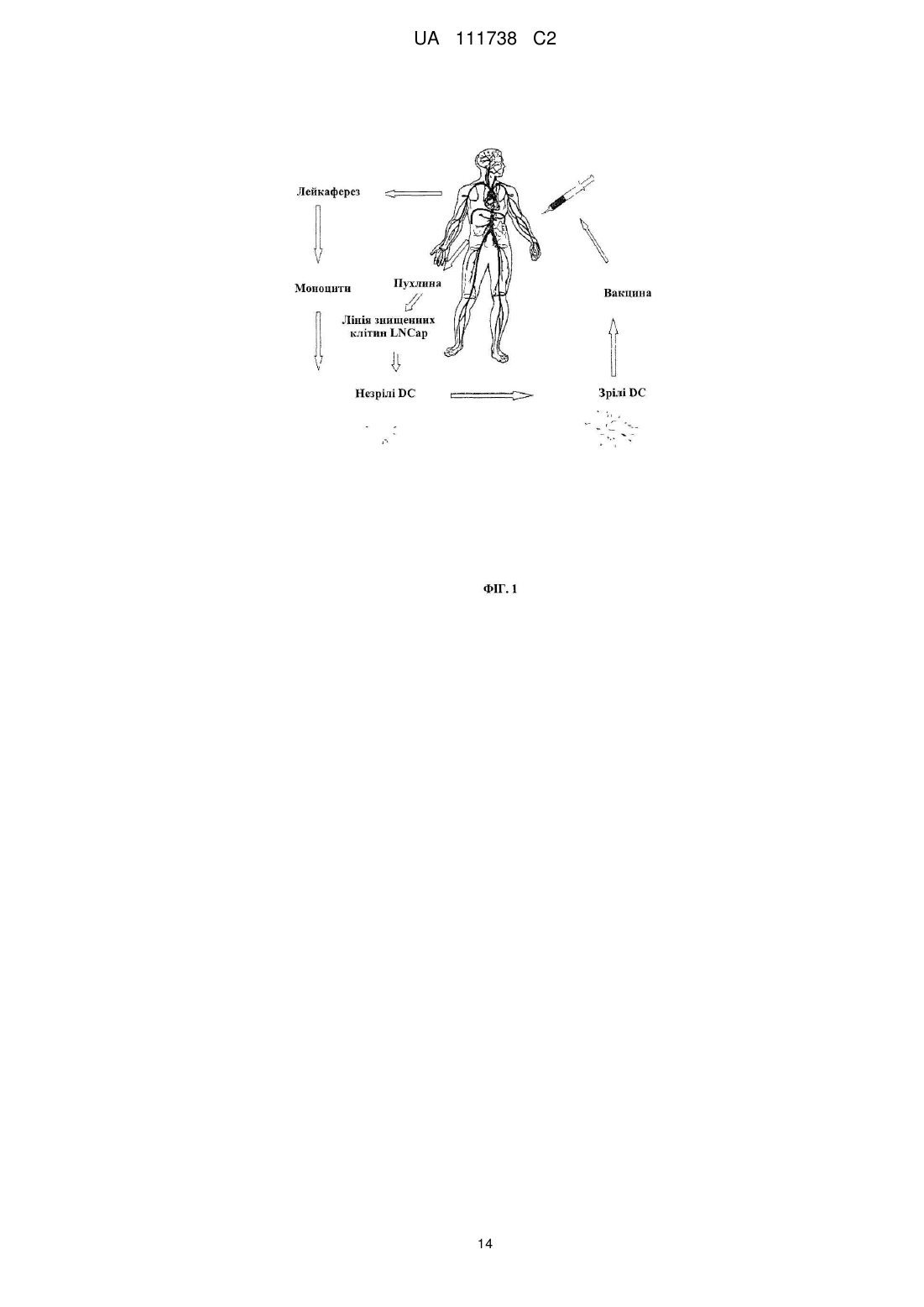
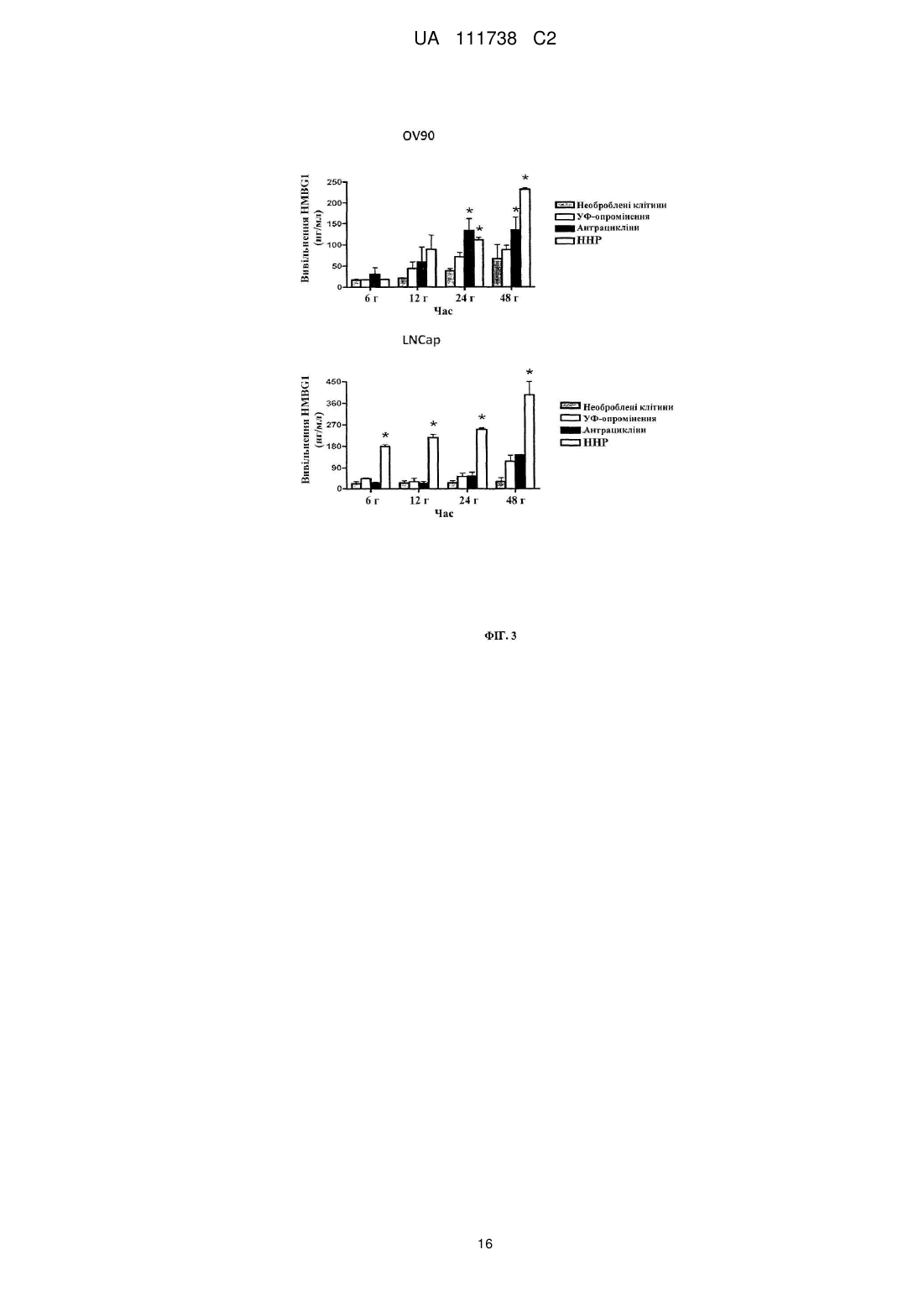
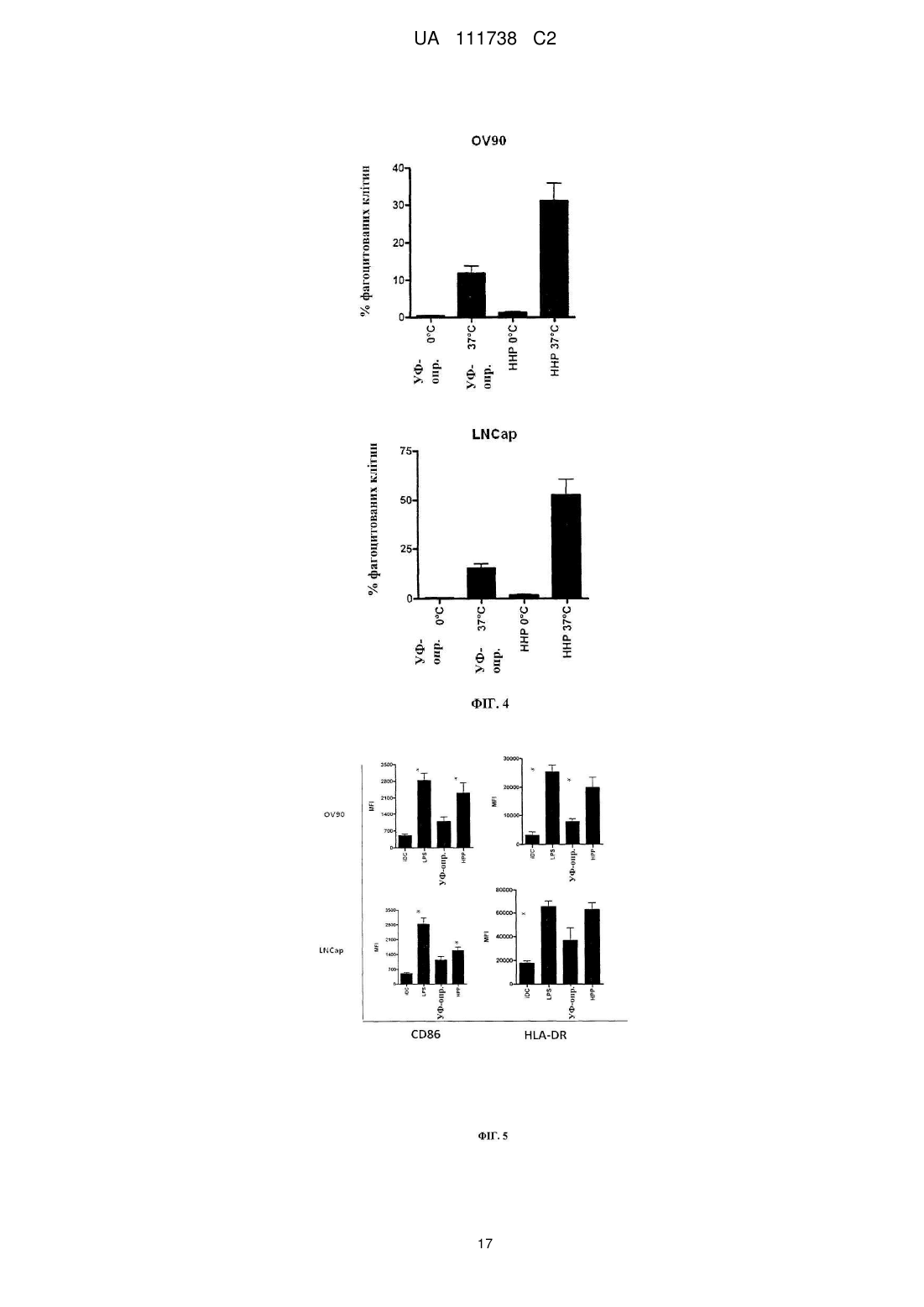
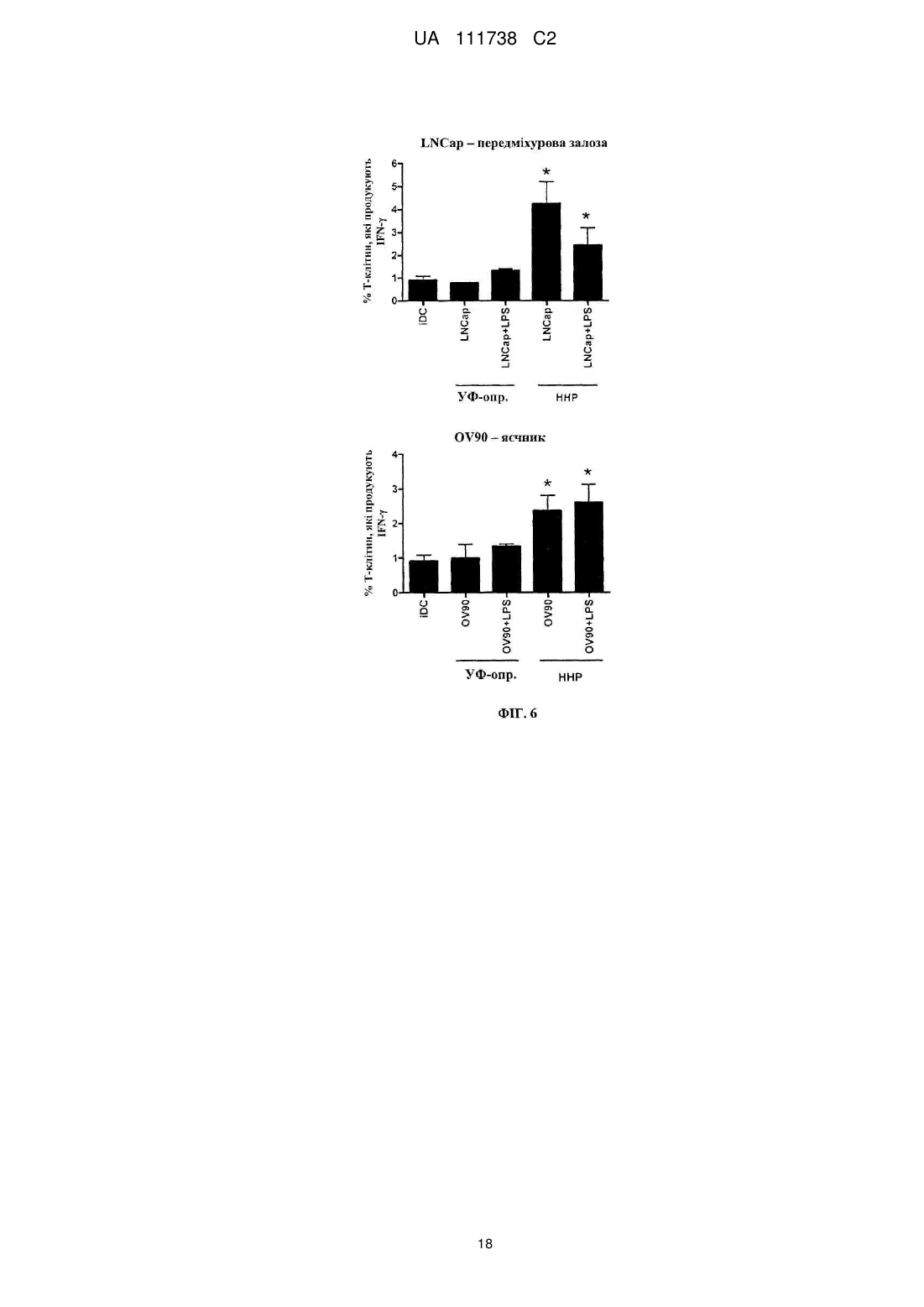
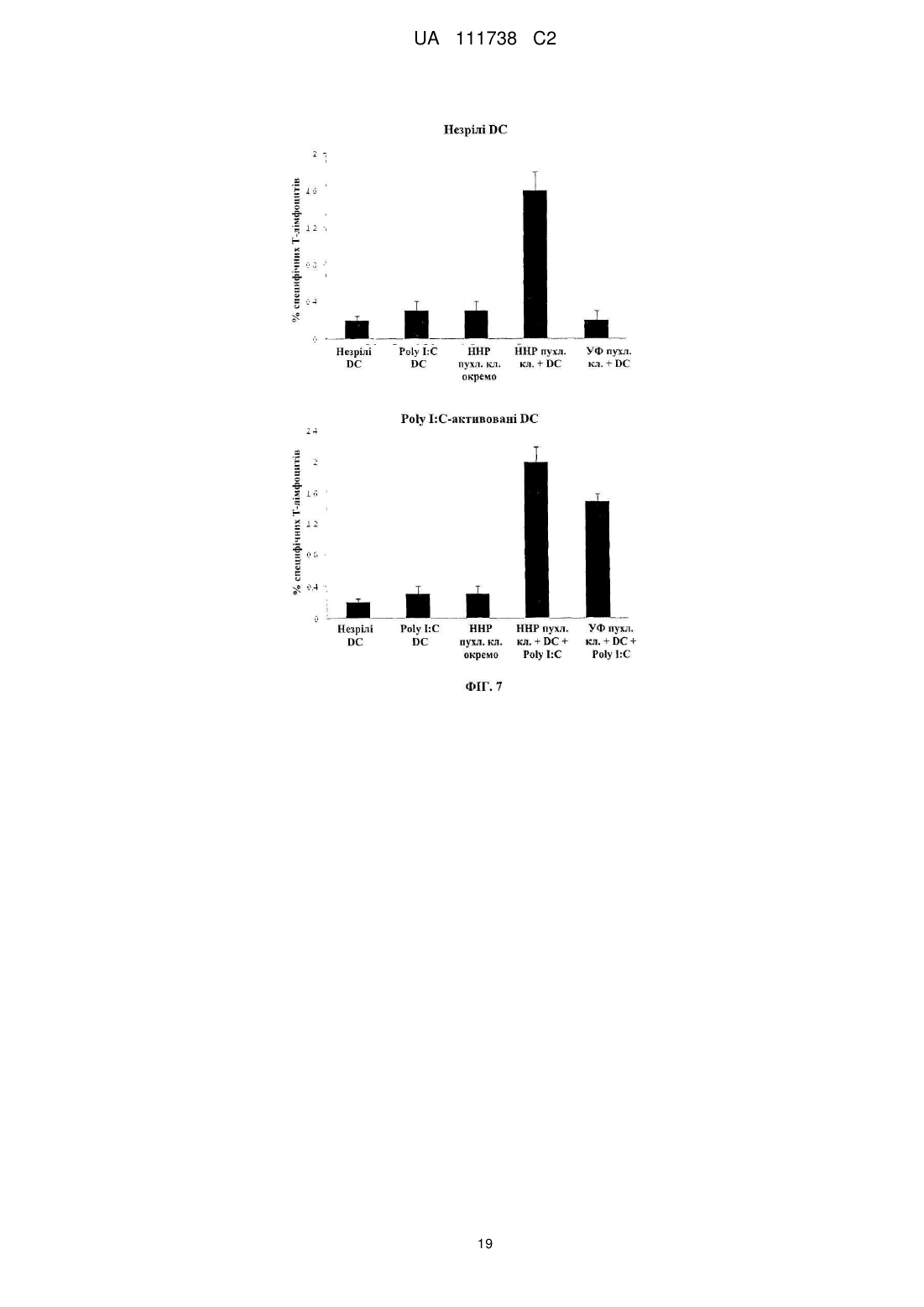
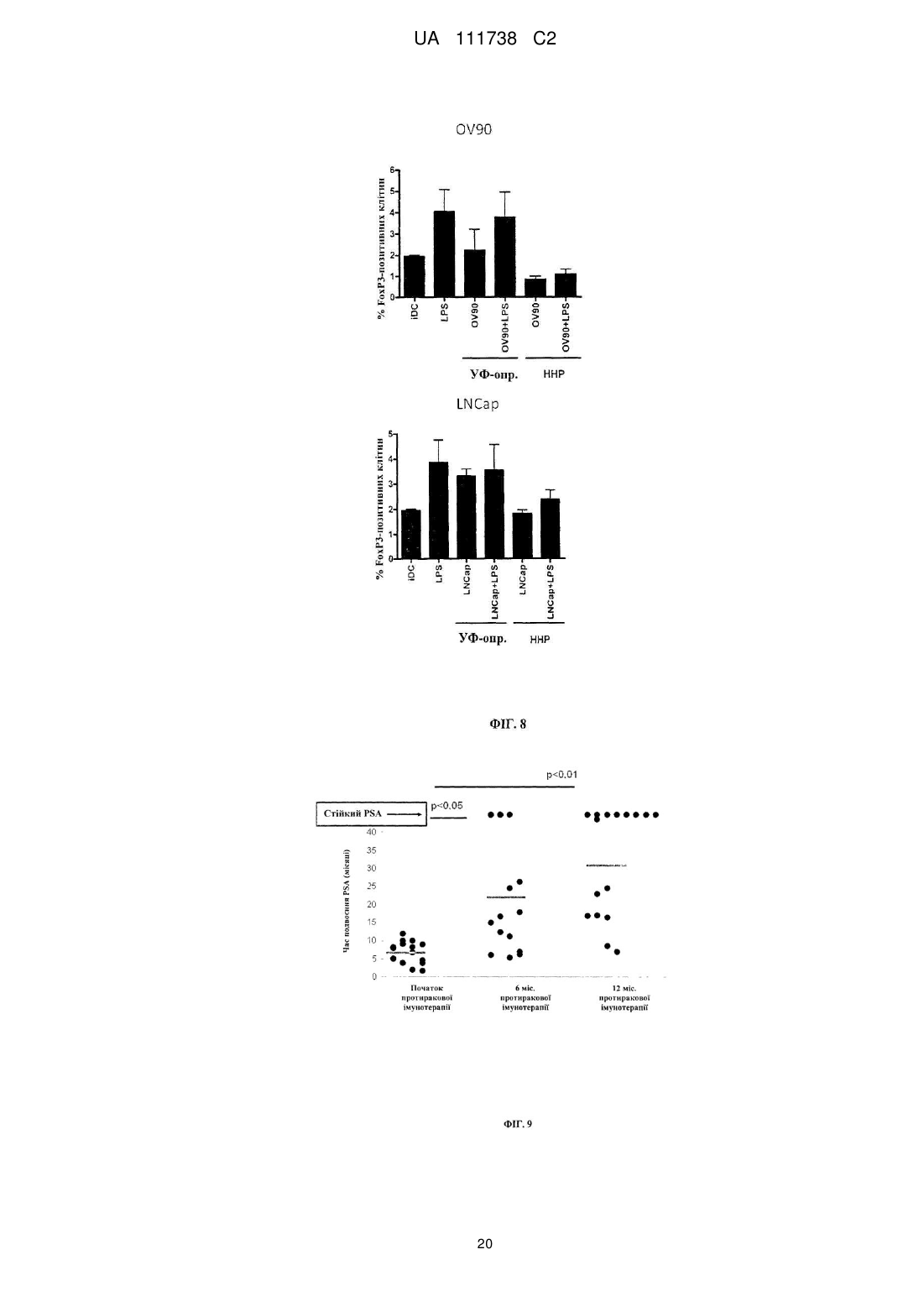
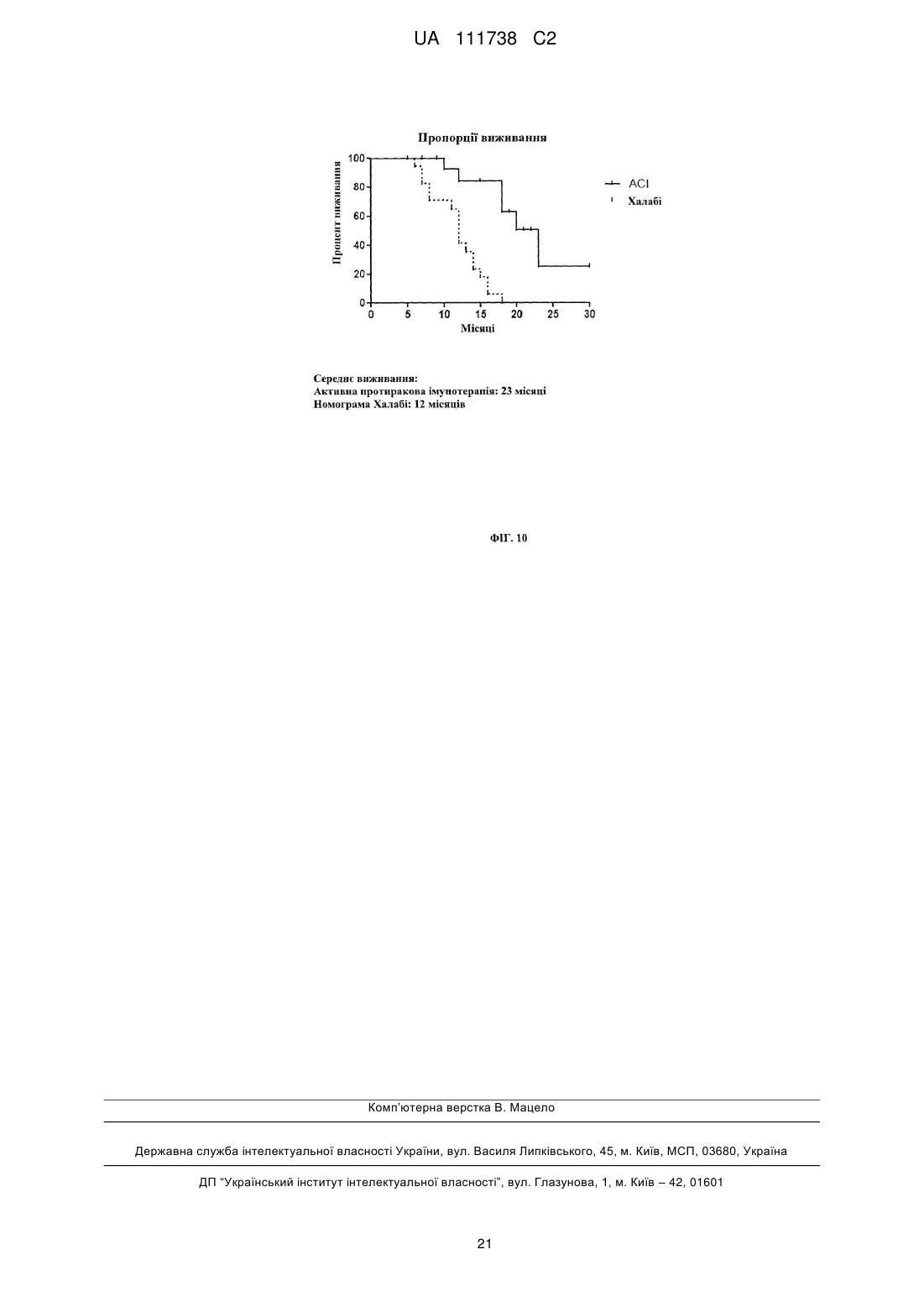
Реферат: Винахід стосується фармацевтичної композиції для викликання імунної реакції проти пухлинних клітин, що включає пухлинні клітини, приведені в апоптотичний стан шляхом обробки високим гідростатичним тиском, і дендритні клітини. Винахід стосується способу одержання даної композиції та способу лікування людини шляхом протиракової вакцинації. UA 111738 C2 (12) UA 111738 C2 UA 111738 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки даного винаходу Хвороби, викликані різними пухлинами, залишаються головною проблемою для медицини і охорони здоров'я. Поєднання хірургії, хіміотерапії та променевої терапії в значній мірі покращує прогнози для страждаючих на рак пацієнтів. Незважаючи на те, що такий підхід часто забезпечує значне зниження маси пухлини, невелика популяція пухлинних клітин-попередників або ракових стволових клітин нерідко виживає і згодом дає початок нової популяції пухлинних клітин, що призводить до рецидиву. Навіть якщо основна пухлина видаляється хірургічним та / або іншими способами, невелика кількість циркулюючих пухлинних клітин може викликати метастатичні пухлини в різних ділянках організму. Тому постійно існує потреба в альтернативних медикаментах і засобах лікування, які могли б застосовуватися окремо або, що краще, поєднуватися з іншими способами лікування раку. Рівень техніки У документі WO 2006/095330 описуються способи заборони зростання популяцій клітин шляхом термічного, механічного та / або хімічного руйнування клітин, що несуть антиген і введення вищезгаданих клітин у вигляді агрегату з антигенпредставляючими клітинами в організм пацієнтів. У публікації Frank et al. "Harnessing Naturally Occurring Tumor Immunity; A Clinical Vaccine Trial in Prostate Cancer", PLOS ONE, т. 5, № 9, 1 січня 2010 р. (2010-01-01), стор. E12367, розкривається протипухлинна вакцина, що включає аутологічні дендритні клітини і апоптотичні опромінені ультрафіолетовими променями андрогенозалежні клітини аденокарциноми простати людини. У публікації Minarik et al. "Phase I / II of Clinical Study of Prostate Cancer Immunotherapy Using Dendritic Cell Vaccination Strategy-First Results", European Urology Supplements, т. 9, № 6, 1 вересня 2010 р., стор. 629, розкриваються попередні результати клінічного дослідження фази I / II імунотерапії раку передміхурової залози з використанням дендритних клітин підданих приміюванню апоптотичними андрогенозалежними клітинами аденокарциноми простати людини, знищеними за допомогою УФА-випромінювання. У публікації Weiss et al. "Ex vivo-and in vivo-induced dead tumor cells as modulators of antitumor responses", Annals of the New York Academy of Sciences, т. 1209, № 1, 1 жовтня 2010 р. (2010-1001), стор. 109-117, розкривається обробка пухлинних клітин високим гідростатичним тиском. Відмерлі пухлинні клітини безпосередньо використовуються в якості протиракових вакцин в тваринних моделях. У публікації Weiss et al. "High hydrostatic pressure treatment generates inactivated mammalian tumor cells with immunogeneic features", Journal of Immunotoxicology, т. 7, № 3, 1 вересня 2010 р., с 194-204, розкривається, що обробка високим гідростатичним тиском викликає апоптоз, при якому пухлинні клітини втрачають активність і є імуногенними. Антитіла, спрямовані проти пухлинних клітин, були вироблені і розпізнані в мишачих моделях. У документі US 2008/0286314 розкриваються протиракові вакцини, що включають антигенпредставляючі клітини, навантажені підданими тепловому шоку раковими клітинами, які є неапоптотичними і можуть використовуватися для лікування ракових пацієнтів. Короткий опис даного винаходу Даний винахід належить до фармацевтичних композицій, які можуть застосовуватися для викликання протипухлинної імунної реакції, зокрема, при вакцинації пухлини, яка змушує організм виробляти імуногенну реакцію проти пухлинних клітин. Пухлинні клітини, знищені стандартними способами, такими, як опромінення, звичайно є неімуногенними. При застосуванні для створення продуктів для протиракової імунотерапії опромінені пухлинні клітини повинні вводитися в комбінації з сильнодіючою допоміжною речовиною. При використанні для приміювання антигенпредставляючими клітинами, такими, як дендритні клітини, знищені опроміненням пухлинні клітини не забезпечують активуючого сигналу. Таким чином, дендритні клітини вимагають активації з боку іншої речовини, наприклад, молекул патогенного походження. Описується новий спосіб, який викликає імуногенну смерть людських пухлинних клітин, зокрема, клітин раку яєчника і передміхурової залози, і клітин гострого лімфобластного лейкозу людського походження. Пухлинні клітини, знищені за допомогою високого гідростатичного тиску (далі також вказується як HHP), забезпечують потужний активуючий стимул для дендритних клітин, зокрема, для незрілих дендритних клітин, навіть за відсутності додаткових стимулів. Пухлинні клітини, знищені цим способом, експресують високий рівень маркерів смерті імуногенних клітин, і дендритні клітини, навантажені цими імуногенними пухлинними клітинами, викликають велику кількість пухлиноспецифічних Т-лімфоцитів без зростання небажаних регуляторних Т-лімфоцитів. Експериментальні дані відповідно до даного винаходу показують, 1 UA 111738 C2 5 10 15 20 25 30 35 40 45 50 55 60 що комбінація пухлинних клітин, знищених шляхом застосування високого гідростатичного тиску, і дендритних клітин в результаті забезпечує фагоцитоз і ефективну презентацію пухлинних антигенів і викликання сильних протипухлинних імунних реакцій. Пухлинні клітини не мають або мають лише слабку імуногенність і зазвичай не здатні викликати пухлиноспецифічну імунну реакцію при застосуванні за відсутності сильнодіючої допоміжної речовини. Недавні дослідження показали, що пухлинні клітини, знищені деякими хіміотерапевтичними засобами, такими, як бортезоміб, оксаліплатин і антрацикліни, можуть викликати пухлиноспецифічну імунну реакцію. Ця смерть імуногенних клітин характеризується молекулярними подіями, загальними для всіх описаних хіміотерапевтичних засобів. Протягом декількох годин після ініціації смерті імуногенних клітин предапоптотичні пухлинні клітини переміщають калретикулін і білки теплового шоку з ендоплазматичного ретикулюма на поверхню клітини разом з іншими молекулами, які служать сигналами "з'їж мене" (фосфатидилсерин). У той же час, пухлинні клітини, котрі піддаються знищенню імуногенних пухлинних клітин, знижують експресію сигналів "не їж мене" (наприклад, поверхневого CD47) для сприяння розпізнаванню пухлинних клітин і поглинанню дендритними клітинами. Крім того, після пермеабілізаціі цитоплазматичної мембрани клітини вивільняють білок групи з високою рухливістю пізнього маркеру апоптозу (HMGB1) в позаклітинне середовище. HMGB1 може зв'язуватися з кількома рецепторами розпізнавання структур (PRR), такими, як Toll-подібний рецептор 2 (TLR2), TLR4 і рецептор кінцевих продуктів глікозилювання (RAGE). Очевидно, вивільнення цього білка потрібно для кращої презентації антигенів з відмираючих пухлинних клітин, приміювання T-клітин дендритними клітинами і подальшого опосередкованого Tклітинами видалення пухлини. Застосування пухлинних клітин, знищених таким чином, щоб вони набували імуногенність, надзвичайно важливо для планування імунотерапевтичних протиракових стратегій. Введення імуногенних пухлинних клітин може викликати пухлиноспецифічну імунну реакцію, яка потім контролює ріст пухлинних клітин. Це сповільнює або навіть стабілізує прогресування хвороби і покращує прогноз для ракових пацієнтів. Також передбачається, що розподіл циркулюючих в організмі пухлинних клітин і виникнення метастазів може бути як мінімум істотно знижено. Кращі варіанти здійснення даного винаходу Описуються новий спосіб і фармацевтичні композиції, які викликають смерть імуногенних клітин пухлин людини, зокрема, клітин раку яєчника і передміхурової залози і клітин гострого лімфобластного лейкозу, в значно більшій мірі порівняно з нещодавно описаними хіміотерапевтичними засобами. Пухлинні клітини, знищені цим способом і захоплені дендритними клітинами, експресують високий рівень маркерів смерті імуногенних клітин і індукують велику кількість пухлиноспецифічних Т-лімфоцитів, не індукуючи регуляторних Tклітин, які можуть інгібувати протипухлинну імунну реакцію. Було виявлено, що ступінь протипухлинної імунної реакції, яка досягається завдяки комбінації пухлинних клітин, оброблених відповідно до даного винаходу, і дендритних клітин, приблизно в 10 разів вище, ніж імунна реакція, що викликається лише імуногенними пухлинними клітинами. Загальний принцип кращого протоколу протиракової імунотерапії на основі введення зрілих дендритних клітин (DC), навантажених знищеними пухлинними клітинами, зображений на Фігурі 1. Всі етапи одержання готової фармацевтичної композиції виконуються згідно з умовами Належної виробничої практики на відповідному обладнанні. У кращому варіанті здійснення першим етапом процесу одержання фармацевтичної композиції для кожного пацієнта є лейкаферез, що виконується з метою збору великої кількості моноцитів з периферичної крові. У кращому варіанті здійснення продукт лейкаферезу потім розбавляють у відповідному буфері, такому, як PBS+1 mM EDTA (Lonza, Vierviers, Бельгія), і мононуклеарні клітини відокремлюють шляхом градієнтного центрифугування за допомогою пристрою Premium Ficoll Paque (GE Healthcare, Little Chalfont, Великобританія). Зібрані мононуклеарні клітини (PBMC) потім промивають [наприклад, у PBS+1 мM EDTA (Lonza)], ресуспендують в середовищі Cell Gro і висівають у три флакони (наприклад, NUNC, Roskilde, Данія) у кількості 1 × 106 клітин на см2 площі поверхні. Через дві години клітини, які не прилипли, промивають PBS (Lonza). Прилиплі моноцити культивують протягом 6 днів в середовищі Cell Gro з 20 нг / мл IL-4 (Gentaur) і 500 U / мл GM-CSF (Gentaur), на 3-й день додають свіжі цитокіни. Незрілі DC збирають на 6-й день і навантажують знищеними пухлинними клітинами (наприклад, лінії клітин раку передміхурової залози, лінії клітин раку яєчника, лінії клітин гострого лімфобластного лейкозу). Свіжорозморожені незрілі DC (день 3-6) навантажують пухлинними клітинами у фіксованому співвідношенні DC: пухлинних клітин 5:1 протягом 4 год. 2 UA 111738 C2 5 10 15 20 25 30 35 40 45 50 55 60 Співвідношення дендритних клітин з обробленими пухлинними клітинами в кращому варіанті перебуває в межах від 1:1 до 10:1, більш краще-приблизно від 4:1 до 6:1. Відповідно до даного винаходу, застосовують дендритні клітини, які перебувають на різних стадіях диференціації, дозрівання і / або активації. На стадію дозрівання дендритних клітин можуть впливати фактори дозрівання. Примійовані пухлинними клітинами DC потім у кращому варіанті дозрівають в 25 мкг / мл Poly I: C під час добової інкубації, піддаються кріоконсервації і зберігаються в рідкому азоті. 7 Перед введенням 1 × 10 зрілих DC, примійованих пухлинними клітинами, ресуспендують в 0,9 % NaCl (Baxter) і вводять підшкірно в пахову і плечову область протягом 12 годин, у кращому варіанті - від 30 хвилин до 12 годин. Застосування цієї форми протиракової імунотерапії в кращому варіанті повторюють з регулярними інтервалами в 2-6 тижнів з метою безперервної підтримки імунної реакції. Передбачається, що спосіб що розкривається авторами перешкоджає відновленню викликаної пухлиною імунологічної толерантності. Терапевтична ефективність цієї форми імунотерапії документально підтверджувалася у пацієнтів, які страждають від раку передміхурової залози на різних клінічних стадіях, з біохімічним рецидивом раку передміхурової залози і кастраційно-резистентним метастатичним раком передміхурової залози, можливо, також на метастатичній гормонально-чутливій стадії. Однак вищеописаний кращий варіант здійснення жодним чином не є обмежуючим. У самому широкому обсязі винахід може здійснюватися альтернативними шляхами залежно від конкретних потреб лікування раку. У зазначеному вище кращому варіанті здійснення описується винахід, в якому пухлинні клітини отримують з організму пацієнта, що підлягає лікуванню, або з ліній пухлинних клітин, або з банків ліній пухлинних клітин. Дендритні клітини в кращому варіанті також отримують з організму пацієнта, що підлягає лікуванню. Однак у більш загальному плані даний винахід стосується фармацевтичної композиції для викликання імунної реакції проти пухлинних клітин, яка включає a) a) пухлинні клітини, що є апоптотичними, причому апоптоз викликається шляхом обробки високим гідростатичним тиском, і b) дендритні клітини. Важливим аспектом даного винаходу є те, що пухлинні клітини, застосовувані у фармацевтичній композиції, є апоптотичними клітинами, а не некротичними клітинами. Фахівцям в даній галузі відомі відмінності між апоптозом і некрозом. Смерть клітини і наступні посмертні зміни, звані некрозом, є складовою частиною нормального циклу розвитку і дозрівання. Незважаючи на важливість цього процесу, механізми, що лежать в основі смерті клітин, до цих пір до кінця не вивчені, хоча існує кілька публікацій, що стосуються механізмів, присутніх при смерті клітини. Апоптоз в контексті даного винаходу слід розуміти як запрограмовану, керовану форму смерті клітини, а некроз являє собою невпорядковану і випадкову форму вмирання клітини. У контексті даного винаходу апоптоз слід розуміти як форму смерті клітини, яка відбувається в нормальних фізіологічних умовах, і клітина є активним учасником власної загибелі. Клітини, що зазнають апоптозу, демонструють характерні морфологічні та біохімічні особливості. До цих особливостей відносяться агрегація хроматину, ядерна та цитоплазматична конденсація, поділ цитоплазми і ядра на мембранозв'язані везикули (апоптотичні тіла), що містять рибосоми, морфологічно інтактні мітохондрії і ядерний матеріал. Оскільки ці апоптотичні тіла in vivo нормально розпізнаються і фагоцитуються макрофагами або суміжними епітеліальними клітинами, важливо, щоб пухлинні клітини, що використовуються згідно даному способу, були якомога більш схожими на апоптотичні пухлинні клітини. Апоптоз зазвичай обмежується окремими клітинами і не викликає запальних реакцій. З іншого боку, некроз відбувається тоді, коли клітини піддаються впливу екстремальних фізіологічних умов, які в результаті можуть призводити до пошкодження цитоплазматичної мембрани. Некроз починається з погіршення здатності клітини до підтримання гемостазу, що веде до проникнення води і позаклітинних іонів. Внутрішньоклітинні органели, головним чином, мітохондрії, і вся клітина набухають і розриваються. Через остаточне руйнування цитоплазматичної мембрани зміст цитоплазми, включаючи лізосомальні ферменти, вивільняється в позаклітинну рідину. Таким чином, некротична смерть клітини in vivo часто пов'язана з великим ушкодженням тканини, що призводить до інтенсивної запальної реакції. Важливо, щоб пухлинні клітини, застосовувані в фармацевтичних композиціях, були апоптотичними, а не некротичними. Відповідно до даного винаходу, апоптотичні клітини отримують шляхом обробки високим гідростатичним тиском. Високий гідростатичний тиск в контексті даного винаходу визначається як гідростатичний напір, який дорівнює або перевищує 100 МПа [1 МПа = 10 бар = 9,86923 атм. 3 UA 111738 C2 5 10 15 20 25 30 35 40 45 50 55 60 = 145,0377 psi]. Високий гідростатичний тиск може створюватися за допомогою обладнання, яке, наприклад, описується в публікації Weiss et al., Journal of Immunotoxicology, 2010, стор. 194209, зокрема, на Фігурі 1. Обробку пухлинних клітин високим гідростатичним тиском у кращому варіанті виконують в автоклаві високого тиску. Пухлинні клітини поміщають у відповідні кріогенні пробірки, повністю наповнені суспензією клітин і щільно закриті, щоб уникнути появи бульбашок повітря. Після ® цього пробірки герметично запечатують гнучкою плівкою (наприклад, parafilm ) і підготовлені пробірки поміщають в камеру тиску, яка наповнюється середовищем передачі тиску. Після цього за допомогою відповідного пристрою створюють високий тиск і клітини тримають протягом достатнього часу під цим високим тиском. У кращому варіанті здійснення високий гідростатичний тиск підтримують впродовж принаймні 10 хвилин на рівні як мінімум 200 МПа. У більш кращому варіанті здійснення пухлинні клітини підтримують протягом періоду від 10 хвилин до 12 годин, у кращому варіанті - від 10 хвилин до 1 години, найкраще - від 10 до 30 хвилин, під тиском в діапазоні 200-300 МПа, у кращому варіанті – 200-250 МПа. Пухлинні клітини, призначені для використання у фармацевтичній композиції, можуть виходити з різних джерел. В одному конкретному варіанті здійснення пухлинні клітини беруть з первинної пухлини або з метастатичної пухлини пацієнта який підлягає лікуванню. Пухлинні клітини можуть бути одержані шляхом біопсії або хірургії. Тканину відокремлюють і відокремлені і очищені пухлинні клітини можуть використовуватися відразу ж. Також бажаним є створення лінії клітин первинної пухлини і застосування одержаних таким чином клітин для вакцинації пухлини. В альтернативному варіанті пухлинні клітини можуть бути одержані із прийнятних ліній пухлинних клітин. Такі лінії пухлинних клітин можуть бути одержані з аутологічної пухлини. В альтернативному варіанті можуть застосовуватися пухлинні клітини, які можуть бути придбані у організацій, які займаються зберіганням, таких, як, наприклад, ATCC. Іншим компонентом фармацевтичної композиції є дендритні клітини. Відповідно до даного винаходу, можуть застосовуватися дендритні клітини на різних стадіях. Також можливе використання дендритних клітин, одержуваних безпосередньо з організму пацієнта шляхом відділення дендритних клітин від крові. Однак можлива також подальша класифікація дендритних клітин залежно від їх стадії. В одному варіанті здійснення даного винаходу для приготування протипухлинної вакцини використовують незрілі дендритні клітини, відокремлені від моноцитів периферичної крові. Відомо, що існує три типи антигенпредставляючих клітин в периферичних лімфоїдних органах, які можуть активувати T-клітини, а саме: дендритні клітини, макрофаги і B-клітини. Найбільш ефективними з них є дендритні клітини, відома функція яких полягає в презентації чужорідних антигенів T-клітинам. Незрілі дендритні клітини знаходяться в тканинах по всьому організму, включаючи шкіру, кишечник і дихальні шляхи. Дендритні клітини існують у двох функціонально і фенотипічно різних стадіях: незрілі і зрілі дендритні клітини. Незрілі дендритні клітини мають високу ендоцитозну активність, спеціалізуються на захопленні антигену і обробці і перебуванні в периферичних тканинах in vivo. Незрілі дендритні клітини відіграють ключову роль у індукуванні і підтримці периферичної толерантності. При впливі похідних від патогенів продуктів або внутрішніх прозапальних сигналів дендритні клітини втрачають свою фагоцитарну активність і мігрують в дренуючі лімфатичні вузли, перетворюючись у зрілі дендритні клітини. Зрілі дендритні клітини мають високу антигенпрезентуючу здатність і здатність до стимулювання T-клітин завдяки експресії високого рівня антигенпрезентуючих, адгезивних і костимулюючих молекул, а також інших специфічних до дендритних клітин маркерів, таких, як CD83 і DC-LAMP. Незрілі дендритні клітини, застосовувані у фармацевтичній композиції, можуть бути одержані з різних джерел. У кращому варіанті здійснення незрілі дендритні клітини відокремлюють від моноцитів пацієнта, який підлягає лікуванню. Однак в альтернативному варіанті незрілі дендритні клітини можуть бути одержані з інших джерел, таких, як препарати крові серійного виробництва, придбані у підприємств, що займаються зберіганням крові. Для приготування фармацевтичної композиції згідно з даним винаходом готують незрілі дендритні клітини. Дендритні клітини (DC) можуть бути одержані різними способами і можуть бути з різними властивостями. У кращому варіанті здійснення даного винаходу дендритні клітини отримують з моноцитів, виділених шляхом лейкаферезу. DC включають менше 1 % мононуклеарних клітин у периферичній крові. Лейкаферез 6 7 застосовується для виділення приблизно від 10 до 10 дендритних клітин і може поєднуватися зі способами позитивної та негативної селекції. Хоча безпосереднє виділення дендритних клітин з периферичної крові дозволяє швидко готувати дендритні клітини, воно може вимагати 4 UA 111738 C2 5 10 15 20 25 30 35 40 45 50 55 60 повторного лейкаферезу, якщо протоколом вимагається множинна імунізація. У кращому варіанті здійснення даного винаходу моноцити виділяють шляхом лейкаферезу через адгезію до пластичних матеріалів. Дендритні клітини диференціюються у присутності цитокінів, у кращому варіанті - коктейлю з різних цитокінів, причому перевага віддається гранулоцитарно-макрофагальному колонієстимулюючому фактору (GM-CSF) у комбінації з інтерлейкіном 4. Особливо бажаний спосіб одержання дендритних клітин полягає в їх генерації ex vivo. Моноцити являють собою прекурсори дендритних клітин, які можуть бути виділені з мононуклеарних клітин периферичної крові такими способами, як лейкаферез, адгезія до пластику, центрифугування в градієнті щільності, позитивна селекція клітин CD14+, негативна селекція B-і T-клітин і комбінації цих способів. DC можуть культивуватися і диференціюватися шляхом обробки популяції збагачених клітин-прекурсорів протягом приблизно 3-7, у кращому варіанті - 7 днів, цитокінами, зокрема, гранулоцитарно-макрофагальним колонієстимулюючим фактором (GM-CSF) + інтерлейкін 4 або інтерлейкін 13. Перевага цього варіанту здійснення полягає в тому, що більше 109 DC можна отримати з одного продукту лейкаферезу, і такий препарат може застосовуватися для множинних вакцинація надалі за допомогою кріоконсервації препарату DC, переважно в рідкому азоті. Хоча DC можуть культивуватися в різних середовищах, перевага віддається застосуванню або бессироватковим середовищам, або середовищам, які містять аутологічну сироватку. Для промислового виробництва фармацевтичної композиції особлива перевага віддається приготуванню незрілих дендритних клітин у великому масштабі, таким чином, щоб уникати випадків анафілактичних реакцій (наприклад, через сироватки ембріонів великої рогатої худоби) або вірусного забруднення. На наступному етапі приготування фармацевтичної композиції незрілі дендритні клітини навантажують апоптотичними пухлинними клітинами, одержуваними шляхом обробки високим гідростатичним тиском. У кращому варіанті здійснення незрілі дендритні клітини, піддані контакту з апоптотичними пухлинними клітинами доводять до зрілості шляхом застосування різних стимулів, таких, як додавання фактора некрозу пухлин α (TNF-α) або ліпополісахариду або Poly I:C. Одержана фармацевтична композиція може зберігатися для подальшого введення, у кращому варіанті - шляхом кріоконсервації. Кріоконсервація біологічних зразків широко практикується в клінічній медицині і біомедичних дослідженнях. Проте вплив цього процесу на життєздатність і, особливо, функціональність іноді недооцінюється. Таким чином, застосовуваний спосіб заморожування препаратів клітин перед застосуванням у протираковій вакцині вимагає обережного ставлення. Ефект кріоконсервації, звичайно, залежить від конкретних застосовуваних клітин, і слід перевіряти, чи не змінюється активність фармацевтичної композиції через кріоконсервацію. Може вимагатися додавання захисних компонентів, таких, як неімуногенні полісахариди або DMSO. Фармацевтична композиція згідно з даним винаходом може вводитися внутрішньовенно (IV), внутрішньошкірно, підшкірно або внутрішньолімфатично, причому особлива перевага віддається підшкірному введенню. Оптимальні доза і частота імунізації для фармацевтичної композиції залежать від типу пухлини, віку та стану пацієнта і стадії прогресування пухлинного захворювання. У кращому варіанті здійснення спочатку застосовують імунізуючу дозу фармацевтичної композиції, після якої слідує довгострокове введення вторинних ін'єкцій, застосовуваних з інтервалами від 2 до 8 тижнів. Вакцинація пухлини, як описується авторами, може успішно застосовуватися до всіх форм пухлин. У кращих варіантах здійснення фармацевтичні композиції призначаються для застосування в лікуванні пацієнтів, які перебувають на пізній стадії раку, а також для тих, які перебувають на ранній стадії раку. В особливо кращому варіанті здійснення вакцинацію пухлини застосовують для пацієнтів на пізній стадії раку передміхурової залози з резистентним до гормонального лікування метастатичним раком передміхурової залози. Під "ранньою стадією раку" слід розуміти форми раку, при яких можливий діагноз. Нерідко пацієнти не виявляють ознак хвороби. На "пізніх стадіях раку" пацієнт часто страждає від важких наслідків хвороби, таких, як біль або слабкість. Хоча фахівцям в даній галузі відомо застосування допоміжних речовин при вакцинації в рамках протиракової терапії, в контексті даного винаходу бажано не застосовувати додаткових допоміжних речовин, таких, як ліпополісахарид, неповний ад'ювант Фрейнда або білки теплового шоку. Важливим аспектом даного винаходу є те, що пухлинні клітини, оброблені високим гідростатичним тиском, перебувають на такій стадії, що не можуть рости утворювати 5 UA 111738 C2 5 10 15 20 25 30 35 40 45 50 55 60 метастатичну пухлину після застосування до пацієнта. Це було підтверджено численними експериментами, включаючи оцінку клоногенності. Описана авторами фармацевтична композиція може застосовуватися для лікування людини шляхом протиракової імунотерапії (вакцинації). Пухлинні клітини, взяті у пацієнта який підлягає лікуванню, наводяться в апоптозний стан за допомогою вищеописаної обробки високим гідростатичним тиском. В альтернативному варіанті застосовують відповідні лінії пухлинних клітин. Незрілі дендритні клітини в кращому варіанті отримують шляхом лейкаферезу з організму одного пацієнта, і клітини культивують ex vivo шляхом обробки цитокінами. Підходяща 7 8 кількість таких незрілих дендритних клітин (наприклад, 10 -10 клітин) навантажують апоптотичними пухлинними клітинами при оптимальному співвідношенні незрілих дендритних клітин: апоптотичних пухлинних клітин від 10:1 до 1:1, в кращому варіанті - від 5:1 до 3:1. Після дозрівання дендритних клітин фармацевтична композиція може застосовуватися для лікування пацієнта. Дендритні клітини, які захопили пухлинні клітини, знищені за допомогою високого гідростатичного тиску, можуть застосовуватися безпосередньо для вакцинації пухлини. Однак можлива і додаткова активація або дозрівання клітин, наприклад, шляхом обробки цитокінами перед введенням пацієнту. Відповідно до даного винаходу, у кращому варіанті застосовують такі матеріали та способи: Було продемонстровано, що 10-хвилинна обробка клітин раку яєчника і передміхурової залози і гострого лімфобластного лейкозу високим гідростатичним тиском (200 МПа) при приблизно 21° C веде до викликання некрозу імуногенних пухлинних клітин. Пухлинні клітини, знищені за допомогою HHP (високого гідростатичного тиску), є імуногенними в значно більшому ступені, ніж пухлинні клітини, знищені антрациклінами - єдиними відомими цитостатиками, що викликають смерть імуногенних клітин, або шляхом УФ-опромінення. Знищені за допомогою HHP імуногенні пухлинні клітини інтенсивно піддаються фагоцитозу з боку антигенпредставляючих клітин і викликають їх дозрівання навіть за відсутності додаткових стимулів патогенного походження, таких, як LPS. Антигенпредставляючі клітини, навантажені знищеними за допомогою HHP пухлинними клітинами, викликають стійкі опосередковані CD4 і CD8 реакції пухлиноспецифічних T-клітин і не індукують потенційно небезпечних регуляторних T-клітин. Таким чином, знищені за допомогою HHP пухлинні клітини представляють собою потужний інструмент для клінічної протиракової імунотерапії. Незважаючи на безперервне впровадження нових ліків і подальше вдосконалення протоколів хіміотерапії, існує ймовірність, що в якийсь момент хіміотерапія досягне своєї межі, і клінічна ефективність зупиниться на рівні плато. Крім того, незважаючи на незаперечні успіхи в лікуванні деяких злоякісних новоутворень, при деяких пухлинах, зокрема, солідних пухлин, хіміотерапія рідко забезпечує лікування. Комбінація способів лікування є стандартною стратегією для лікування раку, і класичним прикладом є комбінація хірургії з хіміотерапією або променевою терапією. Зусилля варто докладати не тільки до розробки сучасних імунотерапевтичних методик, а й до включення імунотерапевтичних підходів в існуючі хіміотерапевтичні протоколи. Таким чином, відтепер хіміотерапія та імунотерапія не повинні розглядатися як протиборчі форми терапії, і, можливо, їх раціональне поєднання істотно поліпшить прогнози для пацієнтів, які страждають на рак. Кращі лінії клітин: застосовувалися лінії клітин гострого лімфобластного лейкозу (REH, DSMZ, Braunschweig, Німеччина), клітини раку яєчника (OV90, ATCC, Teddington, Великобританія), клітини раку передміхурової залози (LNCap, ATCC, Teddington, Великобританія). Всі лінії клітин культивували в середовищі RPMI 1640 (Gibco). Всі середовища доповнювали 10 % термоінактивованою ембріональною бичачою сироваткою (Lonza), 100 U / мл пеніциліну і 2 ммоль / л L-глутаміну. Виділення первинних пухлинних клітин: первинні клітини раку яєчника і передміхурової залози брали у пацієнтів, які зазнали хірургії. Лейкозні бластні клітини пацієнтів з гострим лімфобластним лейкозом брали з кісткового мозку пацієнтів з гострим лімфобластним лейкозом шляхом градієнтного центрифугування з фіколл-градієнтом. Викликання і виявлення апоптозу: смерть пухлинних клітин викликали шляхом 10-хвилинної обробки високим гідростатичним тиском. Для порівняльних випробувань смерть пухлинних 2 клітин викликали шляхом УФ-випромінення. У цьому випадку енергію 7,6 Дж/см застосовували протягом 10 хвилин. Смерть клітин оцінювали за допомогою фарбування аннексіна V, міченим 5 флуоресцеїнізотіоціанатом. Збирали 2 × 10 клітин на зразок, промивали у PBS, гранульованих і ресуспендували в інкубаційному буфері, що містить антитіло, забарвлене аннексином V, міченим флуоресцеїнізотіоціанатом. Зразки зберігали в темряві і інкубували протягом 15 хвилин перед додаванням ще 400 мкл інкубаційного буфера 0,1 % пропідіум йодиду і подальшим аналізом на клітинному сортері з активацією флуоресценції Aria (BD Bioscience) із 6 UA 111738 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосуванням програми FlowJo. Проточний цитометричний аналіз hsp70, hsp90 і CRT (калретикуліну) на поверхні клітин: 5 всього 10 клітин висівали в 12-лункові планшети і обробляли на наступний день зазначеними агентами, або ж, як контрольні зразки, опромінювали ультрафіолетовими променями (7,6 2 Дж/см ) протягом 6, 12 або 24 годин або обробляли протягом 10 хв високим гідростатичним тиском при 21 С. Клітини збирали і двічі промивали PBS. Клітини інкубували протягом 30 хвилин первинним антитілом, розведеним у холодному блокуючому буфері (2 % ембріональна бичача сироватка в PBS) з наступними промиванням і інкубацією з Alexa 648-кон'югованим моноклональним вторинним антитілом в блокуючому розчині. Кожен зразок потім аналізували за допомогою FACScan (BD Bioscience) для виявлення hsp70, hsp90 і CRT на поверхні клітин. Виявлення вивільнення HMGB1: комплекти для твердофазного імуноферментного аналізу HMGB1 купували у SHINO-TEST CORPORATION (Токіо, Японія). Клітини REH, клітини OV90, андрогенозалежні клітини аденокарциноми простати людини, первинні клітини яєчника і 6 лейкозні бластні клітини (10 ) висівали в 1 мл повного середовища, що відповідає типу клітин. Супернатанти збирали в різні моменти часу, пухлинні клітини, що відмирають видаляли шляхом центрифугування і супернатанти виділяли і відразу заморожували. Визначення кількості HMGB1 в супернатантах виробляли шляхом твердофазного імуноферментного аналізу відповідно до інструкцій виробника. Флуоресцентна мікроскопія: імунофлуоресценція: для виявлення CRT на поверхні клітини поміщали на лід, двічі промивали PBS і фіксували в 0,25 % Параформальдегід в PBS протягом 5 хв. Потім клітини двічі промивали в PBS і протягом 30 хвилин додавали первинне антитіло, розбавлене в холодному блокуючому буфері. Після двох промивань в холодному PBS клітини інкубували протягом 30 хвилин з відповідним Alexa 648-кон'югованим вторинним антитілом. Клітини фіксували 4 % параформальдегідом протягом 20 хвилин, промивали у PBS протягом 20 хвилин і поміщали на предметні скло. Для фагоцитозу DC фарбували розчином для мічення клітин Vybrant ® DiO (Invitrogen). Пухлинні клітини фарбували розчином для мічення клітин Vybrant ® DiI (Invitrogen) і культивували в присутності антрациклінів, з УФ-опроміненням або 10-хвилинної обробкою високим гідростатичним тиском при 21 С. Незрілі DC (5-й день) навантажували пухлинними клітинами в співвідношенні DC / пухлинних клітин 1:5. Клітини фіксували 4 % параформальдегідом протягом 20 хвилин, промивали у PBS протягом 20 хвилин і поміщали на предметні скло з реагентом, що перешкоджає вицвітанню ProLong Gold (Invitrogen). Генерація навантажених пухлинами DC та викликання смерті пухлинних клітин: DC генерували шляхом культивування очищених клітин CD14 +, виділених з лейкоцитарних плівок у присутності гранулоцитарно-макрофагального колонієстимулюючого фактора (GM-CSF) (Gentaur, Брюссель, Бельгія) і інтерлейкіну-4 (IL-4) (Gentaur, Брюссель, Бельгія). Пухлинні клітини знищували шляхом 10-хвилинної обробки високим гідростатичним тиском при 21 С, або ж, як контрольні зразки, обробляли УФ-опроміненням або антрациклінами. Ступінь апоптозу спостерігали через фарбування анексином-V/PI. Клітини ретельно промивали перед подачею до DC. Незрілі DC (5-й день) навантажували пухлинними клітинами в співвідношенні DC / пухлинних клітин 1:5. У деяких експериментах примійовані DC стимулювали 100 нг / мл ліпополісахариду (LPS) (Sigma) протягом 12 год. або 25 мг / мл Poly I: C (від Invivogen). FACS-аналіз фенотипу DC після взаємодії зі знищеними пухлинними клітинами: фенотип DC, культивованих з пухлинними клітинами, спостерігали за допомогою проточної цитометрії. Пухлинні клітини знищували із застосуванням обраного цитостатика або УФ-опромінення (порівняльні приклади) або 10-хвилинної обробки високим гідростатичним тиском при 21° С (згідно з даним винаходом) і культивували протягом 24 годин з незрілими DC. Для деяких експериментів DC і пухлинні клітини мітили барвником перед спільним культивуванням для спостереження за фагоцитозом. Застосовували моноклональні антитіла (mAbs) проти наступних молекул: CD80-FITC, CD83-FITC, CD86-PE, CD14-PE (Immunotech, Марсель, Франція), CD11c-PE, HLA-DR (BD Biosciences, Сан-Хосе, Каліфорнія, США). DC фарбували протягом 30 хвилин при 4° C, двічі промивали у фосфатно-буферному сольовому розчині (PBS) і аналізували за допомогою FACS Aria (BD Biosciences) із застосуванням програми FlowJo. DC відбирали у відповідності з властивостями FSC і SSC. Включали відповідні ізотіпічні контрольні матеріали і для кожного експерименту отримували 50000 життєздатних DC. Оцінка IFN-γ-продукуючих пухлиноспецифічних T-клітин: непримійовані або навантажені пухлинними клітинами DC додавали до аутологічних T-клітин у співвідношенні 1:10 на 0-й і 7-й дні культивування. IL-2 (25-50 міжнародних одиниць / мл; PeproTech) додавали на 2-й і 7-й дні культивування. Культури випробовували на присутність пухлиноспецифічних T-клітин через 7-9 7 UA 111738 C2 5 10 15 20 25 30 35 40 45 50 55 60 днів після останнього стимулювання з використанням DC. Індукування реагуючих на пухлину, інтерферон (IFN)-γ-продукуючих T-клітин що реагують на специфічний антиген передміхурової залози (PSA) T-клітин навантажених пухлиною DC визначали шляхом проточної цитометрії. Tклітини фарбували CD8/IFN-γ проти людини. Частоту регуляторних Т-лімфоцитів в культурі аналізували шляхом фарбування CD4/CD25 і FoxP3. Регуляторні T-клітини розпізнавали за допомогою проточної цитометрії як CD4-позитивні, CD25- позитивні і FoxP3- позитивні. Винахід і результати, одержані в ході експериментів, пояснюються на фігурах: Фігура 1 Схематичне зображення показує, яким чином може бути одержана фармацевтична композиція згідно з даним винаходом. Пухлинні клітини, одержані або з організму пацієнта, або з лінії клітин, обробляють високим тиском, в результаті чого клітини стають апоптотичними. Дендритні клітини виділяють за допомогою лейкаферезу. Незрілі дендритні клітини і апоптотичні пухлинні клітини комбінують, в результаті чого отримують зрілі дендритні клітини, які можуть застосовуватися в якості вакцини. Фігура 2 Високий гідростатичний тиск викликає експресію білків теплового шоку на людських пухлинних клітинах. Показані зведені дані 5 експериментів. * Значення P для порівняння з опроміненими пухлинними клітинами, P
ДивитисяДодаткова інформація
Назва патенту англійськоюMeans and methods for active cellular immunotherapy of cancer by using tumor cells killed by high hydrostatic pressure and dendritic cells
Автори англійськоюBartunkova, Jirina, Spisek, Radek
Автори російськоюБартункова Йиржина, Шпишек Радек
МПК / Мітки
МПК: A61K 39/00
Мітки: клітин, раку, знищених, тиску, високого, спосіб, активної, застосування, пухлинних, шляхом, імунотерапії, дендритних, допомогою, гідростатичного, клітинної
Код посилання
<a href="https://ua.patents.su/23-111738-sposib-aktivno-klitinno-imunoterapi-raku-shlyakhom-zastosuvannya-pukhlinnikh-klitin-znishhenikh-za-dopomogoyu-visokogo-gidrostatichnogo-tisku-i-dendritnikh-klitin.html" target="_blank" rel="follow" title="База патентів України">Спосіб активної клітинної імунотерапії раку шляхом застосування пухлинних клітин, знищених за допомогою високого гідростатичного тиску, і дендритних клітин</a>
Попередній патент: Виконана з можливістю попередньої затяжки за допомогою витиснення матеріалу втулка і оснащена цією втулкою опора
Наступний патент: Імідазопіридазини як інгібітори аkt-кінази
Випадковий патент: Вібраційний сепаратор для важкосипких продуктів