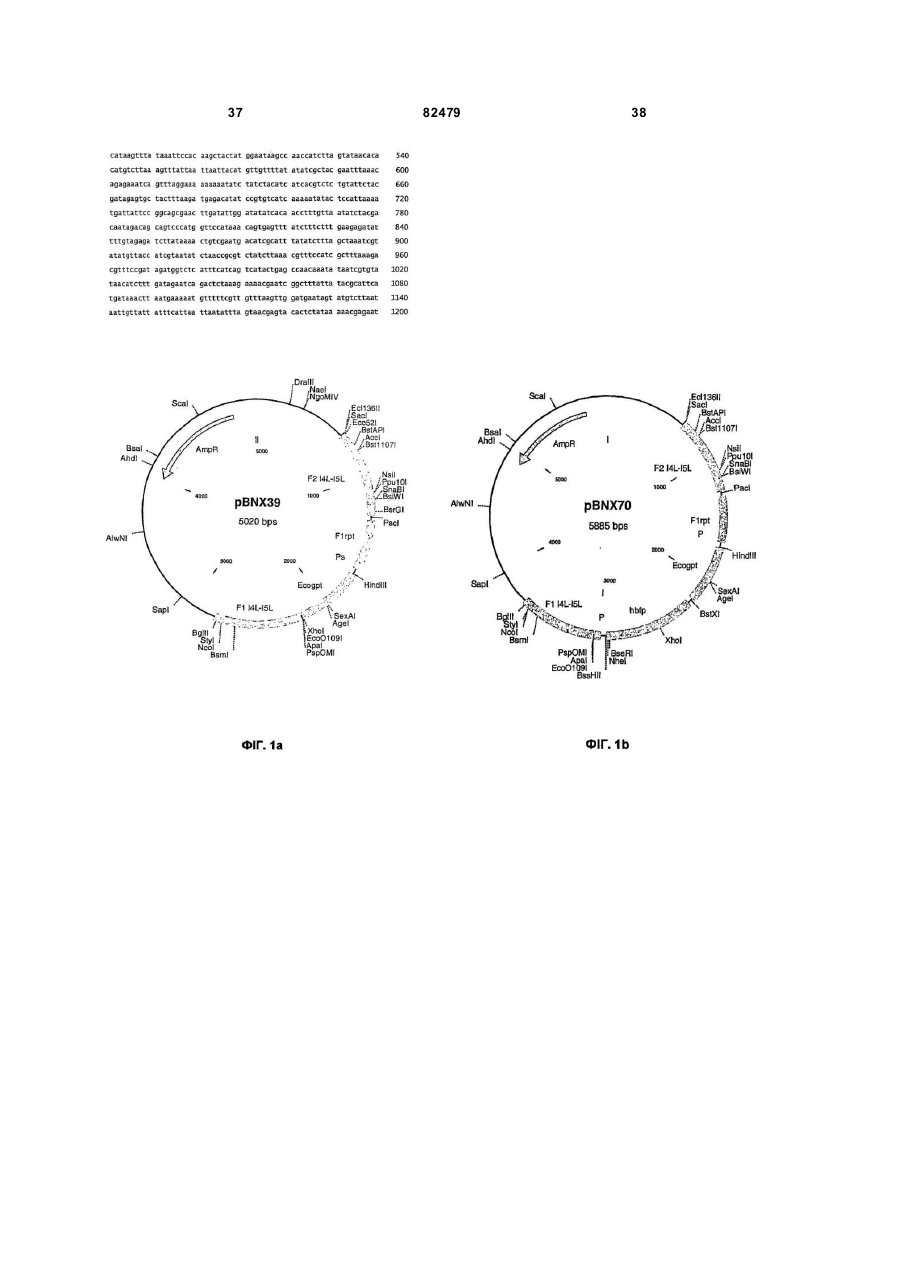
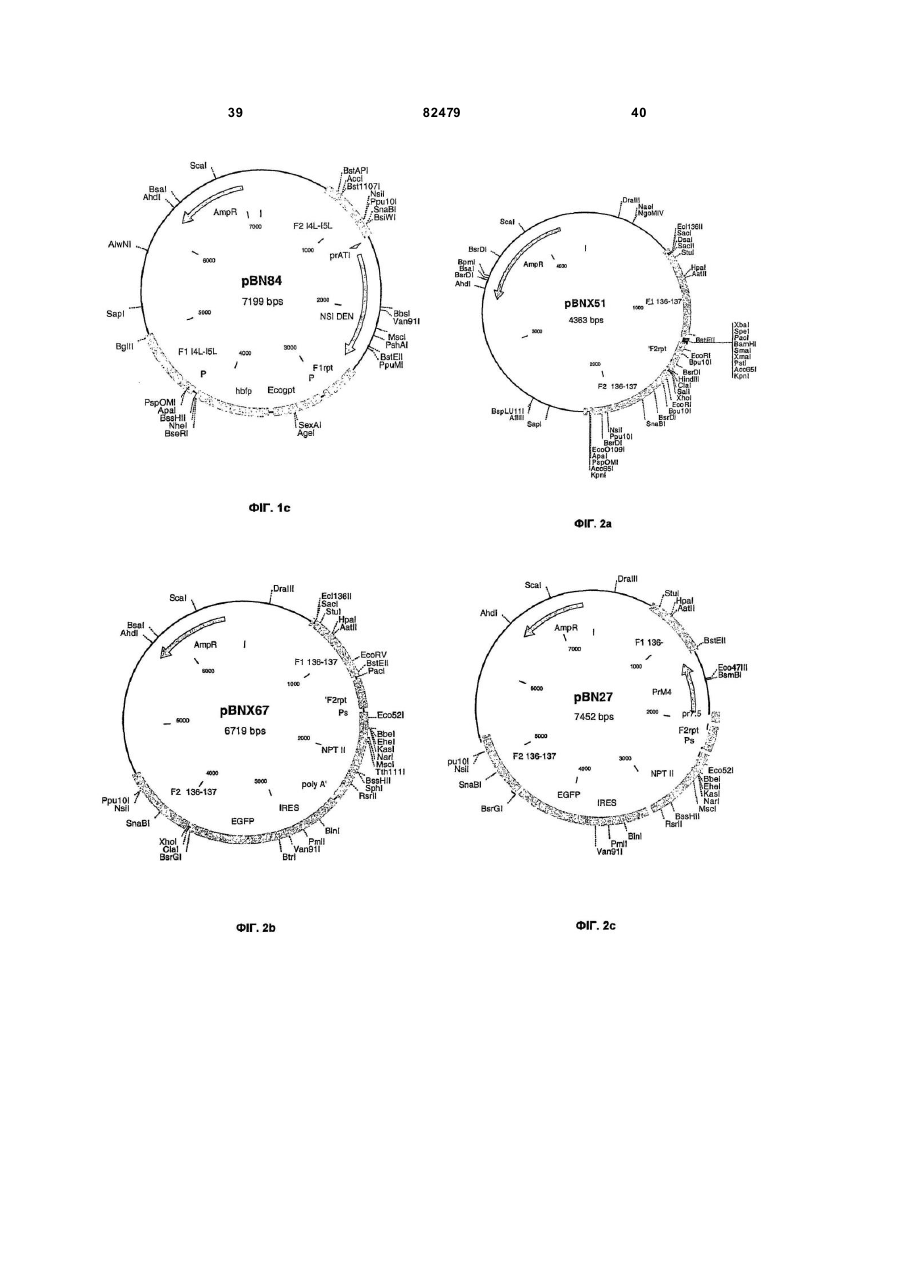
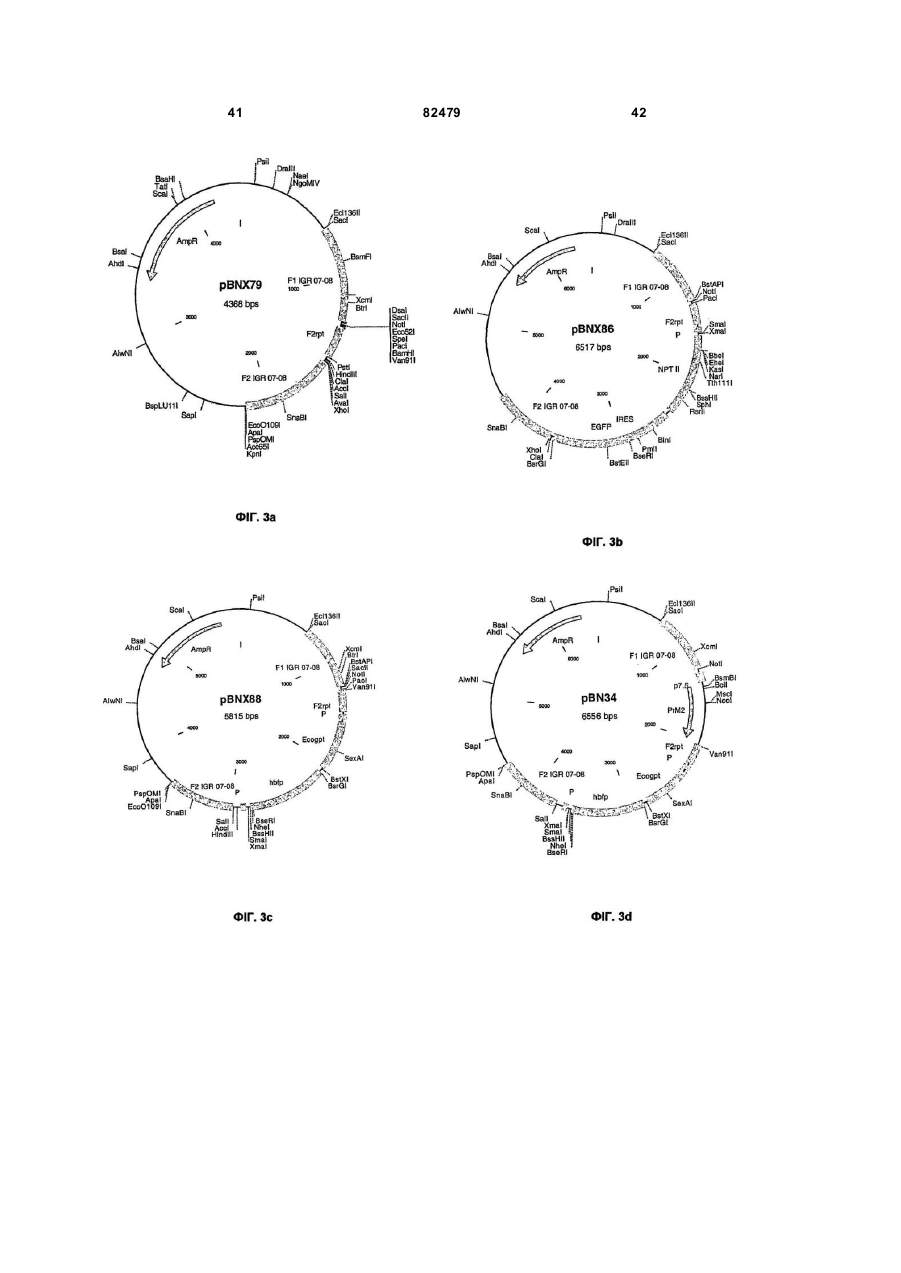
Міжгенні регіони як сайти вставки в геном модифікованого вірусу коров’ячої віспи ankara (mva)
Формула / Реферат
1. Рекомбінантний модифікований вірус коров'ячої віспи Ankara (MVA), який містить гетерологічну послідовність ДНК, вставлену в міжгенний регіон (IGR) вірусного геному.
2. MVA, згідно з пунктом формули 1, де гетерологічна послідовність ДНК вставлена в IGR між двома відкритими рамками зчитування (ORF), вибраними з групи, яка включає: 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L.
3. MVA, згідно з пунктами 1 або 2, де гетерологічна послідовність ДНК включає принаймні одну кодуючу послідовність, бажано, під транскрипційним контролем поксвірусного елемента керування транскрипції.
4. MVA, згідно з пунктами 1-3, де гетерологічна послідовність ДНК кодує один або більше протеїнів, поліпептидів, пептидів, чужорідних антигенів або антигенних епітопів.
5. MVA, згідно з пунктами 1-4, де гетерологічна послідовність ДНК походить з вірусу тропічної лихоманки, вірусу японського енцефаліту, вірусу гепатиту В, вірусу гепатиту С та/або вірусів імунодефіциту, переважно вірусу імунодефіциту людини (ВІЛ).
6. MVA, згідно з пунктом формули 5, де гетерологічна послідовність ДНК, що походить з вірусу тропічної лихоманки, вибрана з групи яка включає NS1 та РrМ.
7. MVA, згідно з пунктом формули 6, де ген NS1 вставлений в IGR між ORF 064L-065L.
8. MVA, згідно з пунктами 6 або 7, де ген РrМ походить з одного або більше 4-х серотипів вірусу тропічної лихоманки.
9. MVA, згідно з пунктами 6-8, де ген РrМ вставлений в IGR між ORF, вибраних з групи, яка включає: 007R-008L, 044L-045L, 136L- 137L, 148R-149L.
10. MVA, згідно з пунктом формули 5, де гетерологічна послідовність ДНК, яка походить з вірусу імунодефіциту, кодує HIV env.
11. MVA, згідно з пунктом формули 10, де ген HIV env вставлений в IGR між ORF 007R-008L.
12. MVA, згідно з пунктами 1-11, де MVA є депонований в ЕСАСС із депозитним номером V00083008.
13. MVA, згідно з пунктами 1-12, для використання як медикаменту та/або вакцини.
14. Використання MVA, згідно з пунктами 1-13, для виготовлення медикаменту та/або вакцини для лікування та/або профілактики вірусної інфекції та/або проліферативного захворювання.
15. Використання MVA, згідно з пунктом 14, для лікування або профілактики інфекції вірусу тропічної лихоманки або інфекції вірусу імунодефіциту, переважно ВІЛ-інфекції.
16. Вакцина, яка включає MVA, згідно з пунктами 1-13.
17. Фармацевтична композиція, яка включає MVA, згідно з пунктами 1-13, та фармацевтичнo прийнятний носій, дилюент, ад'ювант та/або добавку.
18. Спосіб впливу, переважно індукування імунологічної відповіді в живому організмі тварини та людини, який включає застосування MVA згідно з пунктами 1-13, вакцини згідно з пунктом 16 та/або композиції згідно з пунктом 17 до тварини та людини, які цього потребують.
19. Спосіб одержання протеїну, поліпептиду, пептиду, антигену або епітопу in vitro, який включає етапи: інфікування клітини-хазяїна рекомбінантним MVA згідно з пунктами 1-13, культивування інфікованої клітини-хазяїна у сприятливих умовах, виділення та/або збагачення поліпептиду, протеїну, пептиду, антигену, епітопу та/або вірусу, продукованого вказаною клітиною-хазяїном.
20. Спосіб введення послідовності ДНК в клітину in vitro, вказана послідовність ДНК є гомологічною та/або гетерологічною до геному вказаної клітини, де вказана клітина є інфікованою MVA згідно з пунктами 1-13.
21. Спосіб введення послідовності ДНК в клітину ex vivo, вказана послідовність ДНК є гомологічною та/або гетерологічною до геному вказаної клітини, де вказана клітина є інфікованою MVA згідно з пунктами 1-13 та де інфікована клітина, також, застосовується до живого організму тварини та людини.
22. Спосіб введення послідовності ДНК до живого організму тварини та людини, вказана послідовність ДНК, котра є гомологічною та/або гетерологічною до геному живого організму тварини, застосуванням MVA згідно з пунктами 1-13, вакцини згідно з пунктом 16 та/або композиції згідно з пунктом 17 до тварини та людини.
23. Клітина, яка включає MVA, згідно з пунктами 1-13.
24. Плазмідний вектор, який включає
послідовність ДНК, яка керує вставкою послідовності ДНК, гетерологічної до геному вірусу MVA ("гетерологічна послідовність"), за допомогою гомологічної рекомбінації в IGR, розташованому між двох суміжних ORF геному MVA,
вказану гетерологічну послідовність та,
за необхідності, репортерну та/або селекційну генну касету.
25. Плазмідний вектор за п. 24, який відрізняється тим, що вказана послідовність ДНК включає весь або частину фрагмента послідовності IGR.
26. Плазмідний вектор за п. 24 або 25, який відрізняється тим, що вказана послідовність ДНК включає послідовності, що фланкують IGR, з двох суміжних ORF.
27. Плазмідний вектор за пп. 24-26, який відрізняється тим, що послідовність IGR одержана з IGR між ORF, вибраними з групи, яка включає 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L.
28. Плазмідний вектор за пп. 24-27, який відрізняється тим, що послідовність, одержана з IGR, включає послідовність, вибрану з групи, яка включає нуклеотидні послідовності
нуклеотиди 527-608 з SeqlD No. 32;
нуклеотиди 299-883 з SeqlD No. 33;
нуклеотиди 339-852 з SeqlD No. 34;
нуклеотиди 376-647 з SeqlD No. 35;
нуклеотиди 597-855 з SeqlD No. 36;
нуклеотиди 400-607 з SeqlD No. 37.
29. Плазмідний вектор за пп. 24-28, який відрізняється тим, що послідовності, що фланкують IGR, з двох суміжних ORF вибрані з групи, яка включає 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L.
30. Плазмідний вектор за пп. 24-29, який відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF включають послідовність, вибрану з групи, яка включає нуклеотидні послідовності
нуклеотиди 1-526 та 609-1190 з SeqlD No. 32;
нуклеотиди 101-298 та 884-1198 з SeqlD No. 33;
нуклеотиди 1-338 та 853-1200 з SeqlD No. 34;
нуклеотиди 1-375 та 648-1200 з SeqlD No. 35;
нуклеотиди 1-596 та 856-1200 з SeqlD No. 36;
нуклеотиди 1-399 та 608-1081 з SeqlD No. 37.
31. Плазмідний вектор за пп. 24-30, який відрізняється тим, що послідовність ДНК керує вставкою гетерологічної послідовності в IGR геному MVA, депонованого в ЕСАСС під депозитним номером V00083008.
32. Спосіб одержання MVA за пп. 1-13, який включає етапи
трансфекції клітини плазмідним вектором за пп. 24-31;
інфікування трансфікованої клітини MVA;
ідентифікації, виділення та, за необхідності, очищення MVA за пп. 1-13.
33. Спосіб за пп. 32, який відрізняється тим, що клітину інфікують MVA, депонованим в ЕСАСС під депозитним номером V00083008.
34. ДНК, яка включає
послідовність ДНК, яка керує вставкою послідовності ДНК, гетерологічної до геному вірусу MVA ("гетерологічна послідовність"), за допомогою гомологічної рекомбінації в IGR, розташовану між двох суміжних ORF геному MVA, та
вказану гетерологічну послідовність.
35. Послідовність ДНК за п. 34, яка відрізняється тим, що послідовність ДНК, яка керує вставкою гетерологічної послідовності в IGR геному MVA, включає весь або частину фрагмента послідовності IGR.
36. Послідовність ДНК за п. 34 або 35, яка відрізняється тим, що послідовність ДНК, яка керує вставкою гетерологічної послідовності в IGR геному MVA, включає послідовності, що фланкують IGR, з двох суміжних ORF.
37. Послідовність ДНК за пп. 34-36, яка відрізняється тим, що послідовність IGR одержана з IGR між ORF, вибраними з групи, яка включає 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L.
38. Послідовність ДНК за пп. 34-37, яка відрізняється тим, що послідовність, одержана з IGR, включає послідовність, вибрану з групи, яка включає нуклеотидні послідовності
нуклеотиди 527-608 з SeqlD No. 32;
нуклеотиди 299-883 з SeqlD No. 33;
нуклеотиди 339-852 з SeqlD No. 34;
нуклеотиди 376-647 з SeqlD No. 35;
нуклеотиди 597-855 з SeqlD No. 36;
нуклеотиди 400-607 з SeqlD No. 37.
39. Послідовність ДНК за пп. 34-38, яка відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF вибрані з групи, що включає 007R-008L, 018L- 019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L.
40. Послідовність ДНК за пп. 34-39, яка відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF включають послідовність, вибрану з групи, що включає нуклеотидні послідовності
нуклеотиди 1-526 та 609-1190 з SeqlD No. 32;
нуклеотиди 101-298 та 884-1198 з SeqlD No. 33;
нуклеотиди 1-338 та 853-1200 з SeqlD No. 34;
нуклеотиди 1-375 та 648-1200 з SeqlD No. 35;
нуклеотиди 1-596 та 856-1200 з SeqlD No. 36;
нуклеотиди 1-399 та 608-1081 з SeqlD No. 37.
41. Послідовність ДНК за пп. 34-40, яка відрізняється тим, що послідовність ДНК керує вставкою гетерологічної послідовності в IGR геному MVA, депонованого в ЕСАСС під депозитним номером V00083008.
42. Застосування плазмідного вектора, який включає
послідовність ДНК, яка керує вставкою послідовності ДНК, гетерологічної до геному вірусу MVA ("гетерологічна послідовність"), за допомогою гомологічної рекомбінації в IGR, розташовану між двох суміжних ORF геному MVA,
вставлений у вказану IGR послідовність сайт клонування для вставки згаданої гетерологічної послідовності та,
за необхідності, репортерну та/або селекційну генну касету для генерування та/або одержання рекомбінантного MVA за пп. 1-13.
43. Застосування за п. 42, яке відрізняється тим, що вказана послідовність ДНК включає весь або частину фрагмента послідовності IGR.
44. Застосування за п. 42 або 43, яке відрізняється тим, що послідовність ДНК включає послідовності, що фланкують IGR, з двох суміжних ORF.
45. Застосування за пп. 42-44, яке відрізняється тим, що послідовність IGR одержана з IGR між ORF, вибраними з групи, яка включає 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L.
46. Застосування за пп. 42-45, яке відрізняється тим, що послідовність, одержана з IGR, включає послідовність, вибрану з групи, що включає нуклеотидні послідовності
нуклеотиди 527-608 з SeqlD No. 32;
нуклеотиди 299-883 з SeqlD No. 33;
нуклеотиди 339-852 з SeqlD No. 34;
нуклеотиди 376-647 з SeqlD No. 35;
нуклеотиди 597-855 з SeqlD No. 36;
нуклеотиди 400-607 з SeqlD No. 37.
47. Застосування за пп. 42-46, яке відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF, вибрані з групи, яка включає 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L.
48. Застосування за пп. 42-47, яке відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF, включають послідовність, вибрану з групи, яка включає нуклеотидні послідовності
нуклеотиди 1-526 та 609-1190 з SeqlD No. 32;
нуклеотиди 101-298 та 884-1198 з SeqlD No. 33;
нуклеотиди 1-338 та 853-1200 з SeqlD No. 34;
нуклеотиди 1-375 та 648-1200 з SeqlD No. 35;
нуклеотиди 1-596 та 856-1200 з SeqlD No. 36;
нуклеотиди 1-399 та 608-1081 з SeqlD No. 37.
49. Застосування за пп. 42-48, яке відрізняється тим, що послідовність ДНК керує вставкою гетерологічної послідовності в IGR геному MVA, депонованого в ЕСАСС під депозитним номером V00083008.
50. Застосування ДНК, яка керує вставкою послідовності ДНК, гетерологічної до геному вірусу MVA ("гетерологічна послідовність"), за допомогою гомологічної рекомбінації в IGR, розташований між двома суміжними ORF геному MVA, для генерування та/або одержання плазмідного вектора за пп. 24-31 та/або для генерування та/або одержання рекомбінантного MVA за пп. 1-13.
51. Застосування за п. 50, яке відрізняється тим, що послідовність ДНК, яка керує вставкою гетерологічної послідовності в IGR геному MVA, включає весь або частину фрагмента послідовності IGR.
52. Застосування за п. 50 або 51, яке відрізняється тим, що послідовність ДНК, яка керує вставкою гетерологічної послідовності в IGR геному MVA, включає послідовності, які фланкують IGR, з двох суміжних ORF.
53. Застосування за пп. 50-52, яке відрізняється тим, що послідовність IGR одержують з IGR між ORF, вибраними з групи, яка включає 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L.
54. Застосування за пп. 50-53, яке відрізняється тим, що послідовність, одержана з IGR, включає послідовність, вибрану з групи, яка включає нуклеотидні послідовності
нуклеотиди 527-608 з SeqlD No. 32;
нуклеотиди 299-883 з SeqlD No. 33;
нуклеотиди 339-852 з SeqlD No. 34;
нуклеотиди 376-647 з SeqlD No. 35;
нуклеотиди 597-855 з SeqlD No. 36;
нуклеотиди 400-607 з SeqlD No. 37.
55. Застосування за пп. 50-54, яке відрізняється тим, що послідовності, що фланкують IGR, з двох суміжних ORF, вибрані з групи, яка включає 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L.
56. Застосування за пп. 50-55, яке відрізняється тим, що послідовності, що фланкують IGR, з двох суміжних ORF, включають послідовність, вибрану з групи, яка включає нуклеотидні послідовності
нуклеотиди 1-526 та 609-1190 з SeqlD No. 32;
нуклеотиди 101-298 та 884-1198 з SeqlD No. 33;
нуклеотиди 1-338 та 853-1200 з SeqlD No. 34;
нуклеотиди 1-375 та 648-1200 з SeqlD No. 35;
нуклеотиди 1-596 та 856-1200 з SeqlD No. 36;
нуклеотиди 1-399 та 608-1081 з SeqlD No. 37.
57. Застосування за пп. 50-56, яке відрізняється тим, що послідовність ДНК керує вставкою гетерологічної послідовності в IGR геному MVA, депонованого в ЕСАСС під депозитним номером V00083008.
Текст
1. Рекомбінантний модифікований вірус коров'ячої віспи Ankara (MVA), який містить гетерологічну послідовність ДНК, вставлену в міжгенний регіон (IGR) вірусного геному. 2. MVA, згідно з пунктом формули 1, де гетерологічна послідовність ДНК вставлена в IGR між двома відкритими рамками зчитування (ORF), вибраними з групи, яка включає: 007R-008L, 018L019L, 044L-045L, 064L-065L, 136L-137L, 148R3. MVA, 149L. згідно з пунктами 1 або 2, де гетерологічна послідовність ДНК включає принаймні одну кодуючу послідовність, бажано, під транскрипційним контролем поксвірусного елемента керування транскрипції. 4. MVA, згідно з пунктами 1-3, де гетерологічна послідовність ДНК кодує один або більше протеїнів, поліпептидів, пептидів, чужорідних антигенів або антигенних епітопів. 5. MVA, згідно з пунктами 1-4, де гетерологічна послідовність ДНК походить з вірусу тропічної лихоманки, вірусу японського енцефаліту, вірусу гепатиту В, вірусу гепатиту С та/або вірусів імуно 2 (19) 1 3 82479 композиції згідно з пунктом 17 до тварини та людини, які цього потребують. 19. Спосіб одержання протеїну, поліпептиду, пептиду, антигену або епітопу in vitro, який включає етапи: інфікування клітини-хазяїна рекомбінантним MVA згідно з пунктами 1-13, культивування інфікованої клітини-хазяїна у сприятливих умовах, виділення та/або збагачення поліпептиду, протеїну, пептиду, антигену, епітопу та/або вірусу, продукованого вказаною клітиною-хазяїном. 20. Спосіб введення послідовності ДНК в клітину in vitro, вказана послідовність ДНК є гомологічною та/або гетерологічною до геному вказаної клітини, де вказана клітина є інфікованою MVA згідно з пунктами 1-13. 21. Спосіб введення послідовності ДНК в клітину ex vi vo, вказана послідовність ДНК є гомологічною та/або гетерологічною до геному вказаної клітини, де вказана клітина є інфікованою MVA згідно з пунктами 1-13 та де інфікована клітина, також, застосовується до живого організму тварини та людини. 22. Спосіб введення послідовності ДНК до живого організму тварини та людини, вказана послідовність ДНК, котра є гомологічною та/або гетерологічною до геному живого організму тварини, застосуванням MVA згідно з пунктами 1-13, вакцини згідно з пунктом 16 та/або композиції згідно з пунктом 17 до тварини та людини. 23. Клітина, яка включає MVA, згідно з пунктами 113. 24. Плазмідний вектор, який включає послідовність ДНК, яка керує вставкою послідовності ДНК, гетерологічної до геному вірусу MVA ("гетерологічна послідовність"), за допомогою гомологічної рекомбінації в IGR, розташованому між двох суміжних ORF геному MVA, вказану гетерологічну послідовність та, за необхідності, репортерну та/або селекційну генну касету. 25. Плазмідний вектор за п. 24, який відрізняється тим, що вказана послідовність ДНК включає весь або частину фрагмента послідовності IGR. 26. Плазмідний вектор за п. 24 або 25, який відрізняється тим, що вказана послідовність ДНК включає послідовності, що фланкують IGR, з двох суміжних ORF. 27. Плазмідний вектор за пп. 24-26, який відрізняється тим, що послідовність IGR одержана з IGR між ORF, вибраними з групи, яка включає 007R008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L. 28. Плазмідний вектор за пп. 24-27, який відрізняється тим, що послідовність, одержана з IGR, включає послідовність, вибрану з групи, яка включає нуклеотидні послідовності нуклеотиди 527-608 з SeqlD No. 32; нуклеотиди 299-883 з SeqlD No. 33; нуклеотиди 339-852 з SeqlD No. 34; нуклеотиди 376-647 з SeqlD No. 35; нуклеотиди 597-855 з SeqlD No. 36; нуклеотиди 400-607 з SeqlD No. 37. 29. Плазмідний вектор за пп. 24-28, який відрізняється тим, що послідовності, що фланкують IGR, з двох суміжних ORF вибрані з групи, яка включає 4 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L. 30. Плазмідний вектор за пп. 24-29, який відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF включають послідовність, вибрану з групи, яка включає нуклеотидні послідовності нуклеотиди 1-526 та 609-1190 з SeqlD No. 32; нуклеотиди 101-298 та 884-1198 з SeqlD No. 33; нуклеотиди 1-338 та 853-1200 з SeqlD No. 34; нуклеотиди 1-375 та 648-1200 з SeqlD No. 35; нуклеотиди 1-596 та 856-1200 з SeqlD No. 36; нуклеотиди 1-399 та 608-1081 з SeqlD No. 37. 31. Плазмідний вектор за пп. 24-30, який відрізняється тим, що послідовність ДНК керує вставкою гетерологічної послідовності в IGR геному MVA, депонованого в ЕСАСС під депозитним номером V00083008. 32. Спосіб одержання MVA за пп. 1-13, який включає етапи трансфекції клітини плазмідним вектором за пп. 24-31; інфікування трансфікованої клітини MVA; ідентифікації, виділення та, за необхідності, очищення MVA за пп. 1-13. 33. Спосіб за пп. 32, який відрізняється тим, що клітину інфікують MVA, депонованим в ЕСАСС під депозитним номером V00083008. 34. ДНК, яка включає послідовність ДНК, яка керує вставкою послідовності ДНК, гетерологічної до геному вірусу MVA ("гетерологічна послідовність"), за допомогою гомологічної рекомбінації в IGR, розташовану між двох суміжних ORF геному MVA, та вказану гетерологічну послідовність. 35. Послідовність ДНК за п. 34, яка відрізняється тим, що послідовність ДНК, яка керує вставкою гетерологічної послідовності в IGR геному MVA, включає весь або частину фрагмента послідовності IGR. 36. Послідовність ДНК за п. 34 або 35, яка відрізняється тим, що послідовність ДНК, яка керує вставкою гетерологічної послідовності в IGR геному MVA, включає послідовності, що фланкують IGR, з дво х суміжних ORF. 37. Послідовність ДНК за пп. 34-36, яка відрізняється тим, що послідовність IGR одержана з IGR між ORF, вибраними з групи, яка включає 007R008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L. 38. Послідовність ДНК за пп. 34-37, яка відрізняється тим, що послідовність, одержана з IGR, включає послідовність, вибрану з групи, яка включає нуклеотидні послідовності нуклеотиди 527-608 з SeqlD No. 32; нуклеотиди 299-883 з SeqlD No. 33; нуклеотиди 339-852 з SeqlD No. 34; нуклеотиди 376-647 з SeqlD No. 35; нуклеотиди 597-855 з SeqlD No. 36; нуклеотиди 400-607 з SeqlD No. 37. 39. Послідовність ДНК за пп. 34-38, яка відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF вибрані з групи, що включає 007R-008L, 018L- 019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L. 5 82479 40. Послідовність ДНК за пп. 34-39, яка відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF включають послідовність, вибрану з групи, що включає н уклеотидні послідовності нуклеотиди 1-526 та 609-1190 з SeqlD No. 32; нуклеотиди 101-298 та 884-1198 з SeqlD No. 33; нуклеотиди 1-338 та 853-1200 з SeqlD No. 34; нуклеотиди 1-375 та 648-1200 з SeqlD No. 35; нуклеотиди 1-596 та 856-1200 з SeqlD No. 36; нуклеотиди 1-399 та 608-1081 з SeqlD No. 37. 41. Послідовність ДНК за пп. 34-40, яка відрізняється тим, що послідовність ДНК керує вставкою гетерологічної послідовності в IGR геному MVA, депонованого в ЕСАСС під депозитним номером V00083008. 42. Застосування плазмідного вектора, який включає послідовність ДНК, яка керує вставкою послідовності ДНК, гетерологічної до геному вірусу MVA ("гетерологічна послідовність"), за допомогою гомологічної рекомбінації в IGR, розташовану між двох суміжних ORF геному MVA, вставлений у вказану IGR послідовність сайт клонування для вставки згаданої гетерологічної послідовності та, за необхідності, репортерну та/або селекційну генну касету для генерування та/або одержання рекомбінантного MVA за пп. 1-13. 43. Застосування за п. 42, яке відрізняється тим, що вказана послідовність ДНК включає весь або частину фрагмента послідовності IGR. 44. Застосування за п. 42 або 43, яке відрізняється тим, що послідовність ДНК включає послідовності, що фланкують IGR, з двох суміжних ORF. 45. Застосування за пп. 42-44, яке відрізняється тим, що послідовність IGR одержана з IGR між ORF, вибраними з групи, яка включає 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L. 46. Застосування за пп. 42-45, яке відрізняється тим, що послідовність, одержана з IGR, включає послідовність, вибрану з групи, що включає нуклеотидні послідовності нуклеотиди 527-608 з SeqlD No. 32; нуклеотиди 299-883 з SeqlD No. 33; нуклеотиди 339-852 з SeqlD No. 34; нуклеотиди 376-647 з SeqlD No. 35; нуклеотиди 597-855 з SeqlD No. 36; нуклеотиди 400-607 з SeqlD No. 37. 47. Застосування за пп. 42-46, яке відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF, вибрані з групи, яка включає 007R008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L. 48. Застосування за пп. 42-47, яке відрізняється тим, що послідовності, які фланкують IGR, з двох суміжних ORF, включають послідовність, вибрану з групи, яка включає нуклеотидні послідовності нуклеотиди 1-526 та 609-1190 з SeqlD No. 32; нуклеотиди 101-298 та 884-1198 з SeqlD No. 33; 6 нуклеотиди 1-338 та 853-1200 з SeqlD No. 34; нуклеотиди 1-375 та 648-1200 з SeqlD No. 35; нуклеотиди 1-596 та 856-1200 з SeqlD No. 36; нуклеотиди 1-399 та 608-1081 з SeqlD No. 37. 49. Застосування за пп. 42-48, яке відрізняється тим, що послідовність ДНК керує вставкою гетерологічної послідовності в IGR геному MVA, депонованого в ЕСАСС під депозитним номером V00083008. 50. Застосування ДНК, яка керує вставкою послідовності ДНК, гетерологічної до геному вірусу MVA ("гетерологічна послідовність"), за допомогою гомологічної рекомбінації в IGR, розташований між двома суміжними ORF геному MVA, для генерування та/або одержання плазмідного вектора за пп. 24-31 та/або для генерування та/або одержання рекомбінантного MVA за пп. 1-13. 51. Застосування за п. 50, яке відрізняється тим, що послідовність ДНК, яка керує вставкою гетерологічної послідовності в IGR геному MVA, включає весь або частину фрагмента послідовності IGR. 52. Застосування за п. 50 або 51, яке відрізняється тим, що послідовність ДНК, яка керує вставкою гетерологічної послідовності в IGR геному MVA, включає послідовності, які фланкують IGR, з двох суміжних ORF. 53. Застосування за пп. 50-52, яке відрізняється тим, що послідовність IGR одержують з IGR між ORF, вибраними з групи, яка включає 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L. 54. Застосування за пп. 50-53, яке відрізняється тим, що послідовність, одержана з IGR, включає послідовність, вибрану з групи, яка включає нуклеотидні послідовності нуклеотиди 527-608 з SeqlD No. 32; нуклеотиди 299-883 з SeqlD No. 33; нуклеотиди 339-852 з SeqlD No. 34; нуклеотиди 376-647 з SeqlD No. 35; нуклеотиди 597-855 з SeqlD No. 36; нуклеотиди 400-607 з SeqlD No. 37. 55. Застосування за пп. 50-54, яке відрізняється тим, що послідовності, що фланкують IGR, з двох суміжних ORF, вибрані з групи, яка включає 007R008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148R-149L. 56. Застосування за пп. 50-55, яке відрізняється тим, що послідовності, що фланкують IGR, з двох суміжних ORF, включають послідовність, вибрану з групи, яка включає нуклеотидні послідовності нуклеотиди 1-526 та 609-1190 з SeqlD No. 32; нуклеотиди 101-298 та 884-1198 з SeqlD No. 33; нуклеотиди 1-338 та 853-1200 з SeqlD No. 34; нуклеотиди 1-375 та 648-1200 з SeqlD No. 35; нуклеотиди 1-596 та 856-1200 з SeqlD No. 36; нуклеотиди 1-399 та 608-1081 з SeqlD No. 37. 57. Застосування за пп. 50-56, яке відрізняється тим, що послідовність ДНК керує вставкою гетерологічної послідовності в IGR геному MVA, депонованого в ЕСАСС під депозитним номером V00083008. 7 82479 Даний винахід відноситься до нових сайтів вставки, придатних для інтеграції екзогенних послідовностей в геном MVA. Модифікований вірус коров'ячої віспи Ankara (MVA) є членом родини Orthopoxvirus, який було створено приблизно 570-ма послідовними пасажами на фібробластах ембріону курча штаму Ankara вірусу коров'ячої віспи (CVA) [для ознайомлення дивись Mayr, A., et al. [1975], Infection 3, 614]. В результаті цих пасажів отриманий вірус MVA мав на 31kb менше геномної інформації порівняно із CVA й був дуже обмежений у виборі клітин хазяїв [Me yer, Η. et al., J. Gen. Virol. 72, 1031 -1038 [1991]]. MVA характеризувався значною ослабленістю, а саме зниженою вірулентністю та інфекційність, але зберігав відмінну імуногенність. Після випробування на різноманітних тваринних моделях, MVA був визнаний авірулентним, навіть для імунопригнічених осіб. Більш важливим є те, що відмінні властивості штаму MVA було продемонстровано при широких клінічних випробуваннях [Ma yr et al., Zbl. Bakt. Hyg. I, Abt. Org. В 167, 375390 [1987]]. Під час цих досліджень не було виявлено побічної дії більш ніж у 120,000 людей, включаючи пацієнтів високого ризику [Stickl et al., Dtsch. med. Wschr. 99, 2386-2392 [1974]]. Також було одержано дані про те, що MVA блокується на пізній стадії реплікаційного циклу в клітинах ссавців [Sutter, G. and Moss, В. [1992] Proc. Natl. Acad. Sci. USA 89, 10847-10851]. Таким чином, MVA повністю реплікує свою ДНК, проміжні та остаточні генні продукти, але не здатний збирати зрілі інфекційні віріони, які могли б бути вивільнені з інфікованої клітини. З цієї причини, а саме обмеженої реплікації, MVA пропонується як вектор експресії генів. Пізніше, MVA було використано для створення рекомбінантних вакцин, які експресували антигенні послідовності вставлені або в сайт гену тимідинкінази (tk) (US5,185,146), або в сайт, в якому природно зустрічається делеції в геномі MVA (PCT/EP96/02926). Хоча інсерційний локус вставки tk широко використовується для створення рекомбінантних поксвірусів, зокрема для створення рекомбінантних вірусів коров'ячої віспи [Mackett, et al.[1982] P.N.A.S. USA 79, 7415-7419] ця технологія не є придатною для MVA. Scheiflinger et al. продемонстрували, що MVA є значно більш чутливий до модифікацій в геномі порівняно із іншими поксвірусами, котрі можуть бути використані для створення рекомбінантних поксвірусів. Scheiflinger et al. продемонстрували, зокрема, що один з найбільш використовуваних сайтів інтеграції гетерологічної ДНК в поксвірусні геноми, а саме генний локус тимідинкінази (tk), не можуть бути використані для створення рекомбінантного MVA. Будь-який одержаний рекомбінантний tk (-) MVA, виявлявся надзвичайно нестабільним, та при очищенні одразу видаляє вставлену ДНК разом із частинами геномної ДНК MVA [Scheiflinger et al. [1996], Arch Virol 141: pp. 663-669]. 8 Нестабільність і, таким чином, висока ймовірність геномної рекомбінації є відомою проблемою в вірусології поксвірусів. В дійсності, MVA було створено шляхом довготермінових пасажів, користуючись тим, що вірусний геном CVA є нестабільним при культивуванні in vitro в клітинах тканинної культури. Декілька тисяч нуклеотидів (31kb) було видалено з геному MVA, котрі характеризуються 6ма великими й великою кількістю малих делеції, порівняно із первинним геномом CVA. Геномна організація геному MVA була нещодавно описана [Antoine et al.[1998], Virology 244, 365-396]. 178kb геному MVA є щільно упакованими і мають 192 відкритих рамки зчитування (ORF), котрі кодують протеїни довжиною, принаймні, 63 амінокислоти. Порівняно із високо інфекційним вірусом натуральної віспи, а такожпрототипом вірусу коров'ячої віспи, а саме, штамом Copenhagen, більшість ORF MVA були фрагментовані або урізані [Antoine et al. [1998], Virology 244, 365-396]. Однак, за дуже малим виключенням всі ORF, включаючи фрагментовані та урізані ORF, були транскрибовані й трансльовані у протеїни. Надалі буде використовуватися номенклатура за Antoine et al. та, де можливо, також буде вказано номенклатуру основану на гідролізаті рестрикційного ферменту Hind III. До теперішнього часу, лише вставки екзогенної ДНК в сайти природних делецій геному MVA призводять до стабільних рекомбінантних MVA (PCT/EP96/02926). Нажаль, є лише обмежена кількість сайтів природних делецій в геномі MVA. Також було показано, що інші інсерційні сайти, такі як, наприклад, локус гену tk є часто використовуваними для одержання рекомбінантних MVA [Scheiflinger et al. [1996], Arch Virol 141: pp 663669]. Об'єктом даного винаходу є ідентифікування додаткових сайтів вставок геному MVA та створення векторів інсерції, котрі спрямовують інсерцію екзогенних послідовностей ДНК у згадані нововизначені сайти вставки геному MVA. Також об'єктом даного винаходу є створенні рекомбінантного MVA, котрий включає екзогенні послідовності ДНК стабільно інтегровані в нові сайти вставки геному MVA. Винахідники даного винаходу ідентифікували нові сайти для інсерції екзогенних послідовностей ДНК в геном модифікованого вірусу коров'ячої віспи Ankara (MVA). Нові інсерційні сайти знаходяться в міжгенних регіонах (IGR) вірусного геному, де згадані IGR є розвернутими, розташованими між або фланковані двома сусідніми відкритими рамками зчитування (ORF) геному MVA. Таким чином, даний винахід відноситься до рекомбінантних MVA, котрі містять гетерологічну послідовність ДНК, вставлену в IGR вір усного геному. Згідно даного винаходу, одна або більше екзогенних послідовностей ДНК можуть бути вставлені в один або більше IGR. 9 82479 Неочікувано було виявлено, що екзогенні послідовності ДНК, залишаються дійсно стабільно вставленими в IGR геному MVA. Як вже було зазначено раніше, геном MVA розглядається як надзвичайно нестабільний. Виявляється, що гени або послідовності ДНК не важливі для розмноження вірусу є видаленими або фрагментованими. Незважаючи на те, що, також неочікувано, було виявлено, що стабільні рекомбінантні MVA одержували при введенні гетерологічних послідовностей ДНК в сайти природних делецій геному MVA (PCT/EP96/02926), з іншого боку було, виявлено, що гени кругу носіїв як, наприклад, tk-локус, що широко використовується для одержання рекомбінантних поксвірусів не є придатними інсерційними сайтами у MVA. Той факт, що Vero-MVA має ще одну додаткову геномну делецію (РСТ/ЕР01/02703) також вказує та те, що геном є динамічним, в тому сенсі, що він одразу видаляє гени, котрі не є необхідними для розмноження. Отже, можна зробити висновок, про те, що введення гетерологічних послідовностей ДНК в місця між ORF не є необхідним для вірусного розмноження й слід очікувати, що вони також будуть видалені з вірусного геному. Тоді як нуклеотидна послідовність ORF кодує амінокислотну послідовність, яка утворює пептид, поліпептид або протеїн, IGR між двома ORF не мають кодуючої здатності, але можуть містити регуляторні елементи, сайти зв'язування, промоторні та/або енхансерні послідовності, необхідні для або включені до транскрипційного керування експресією вірусних генів. Таким чином IGR може бути включений до регуляторного керування вірусним життєвим циклом. Однак, винахідники даного винаходу, також показали, що нові інсерційні сайти мають несподівану перевагу, яка полягає в тому, що екзогенні послідовності ДНК можуть бути стабільно вставленими в геном MVA без впливу або зміни типових характеристик та генної експресії MVA. Нові інсерційні сайти є особливо корисними, оскільки не змінюється жодна ORF або кодуюча послідовність MVA. Більш того, було неочікувано виявлено, що рівень експресії чужорідного гену вставленого в IGR є вищим за рівень експресії чужорідного гену вставленого в сайт делеції геному MVA (дивись, також Приклад 1). Нуклеотидна послідовність ORF регулярно починається стар-кодоном й закінчується стопкодоном. Залежно від орієнтації двох розташованих поруч ORF IGR, регіон між цими ORF, є фланкованим або двома стоп-кодонами двох розташованих поруч ORF, або двома старт-кодонами двох розташованих поруч ORF, або стоп-кодоном одного ORF та старт-кодоном другого ORF, або старткодоном першого ORF та стоп-кодоном другого ORF. Відповідно, інсерційний сайт для послідовності екзогенної ДНК в IGR може бути нижче або 3 стопкодону першого ORF. У випадку розташованого поруч ORF, також названого другий ORF, має таку саму орієнтацію, що й перший ORF, цей інсерційний сайт нижче стоп-кодону першого ORF лежить вище або 5 стартового кодону другого ORF. 10 У випадку, коли другий ORF має протилежну орієнтацію відносно першого ORF, що вказує на взаємну орієнтацію двох розташованих поруч ORF, ви ходить, що інсерційний сайт лежить нижче стоп-кодонів обох ORF. У третьому варіанті, у випадку двох розташованих поруч ORF зчитування в протилежному напрямку, але орієнтація двох розташованих поруч ORF вказує в протилежні боки, що є синонімічним із розташуванням, котре характеризується тим, що стартові кодони двох ORF є наближеними один до одного, й тоді екзогенна ДНК вставляється нижче по відношенню до обох стартових кодонів. ORF в геномі MVA зустрічаються в двох кодувальних напрямках. Наприклад, полімеразна активність зустрічається зліва направо, тобто, в прямому напрямку, та відповідно зправа наліво (реверсний напрямок). У практиці поксвірусології часто зустрічається та стало стандартною класифікацією для вірусів коров'ячої віспи ідентифікувати ORF за їхньою орієнтацією та їхнім положенням на різних Hindlllрестрикційних фрагментах геному. Для номенклатури різні Hindlll-фрагменти іменуються заголовними літерами у порядку їхнього зменшення. ORF нумеруються зліва направо на кожному Hindlllфрагменті й напрямок ORF зазначається заголовною літерою L (розташований для транскрипції справа наліво) або R (розташований для транскрипції зліва направо). До того ж, у більш сучасних публікаціях стосовно геномної структури MVA, котрі використовують іншу номенклатуру, просто нумеруються ORF від лівого кінця геному до правого, вказуючи їхню орієнтацію заголовними літерами L або R [Antoine et al. [1998], Virology 244, 365-396]. Як приклад можна привести I4L ORF, згідно до старої номенклатури, відповідає 064L ORF за Antoine et al. Якщо не зазначено інше, даний винахід використовує номенклатуру за Antoine et al. Згідно даного винаходу, ге терологічні послідовності ДНК можуть бути вставлені в один або більше IGR між двома розташованими поруч ORF вибраними з групи яка включає: 001L-002L, 002L003L, 005R-006R, 006L-007R, 007R-008L,008L009L, 017L-018L, 018L-019L, 019L-020L, 020L-021L, 023L-024L, 024L-025L, 025L-026L, 028R-029L, 030L-031L, 031L-032L, 032L-033L, 035L-036L, 036L037L, 037L-038L, 039L-040L, 043L-044L, 044L-045L, 046L-047R, 049L-050L, 050L-051L, 051L-052R, 052R-053R, 053R-054R, 054R-055R, 055R-056L, 061L-062L, 064L-065L, 065L-066L, 066L-067L, 077L078R, 078R-079R.080R-081R, 081R-082L, 082L083R, 085R-086R, 086R-087R.088R-089L, 089L090R, 092R-093L, 094L-095R, 096R-097R, 097R098R, 101R-102R, 103R-104R, 105L-106R, 107R108L, 108L-109L,109L-110L, 110L-111L, 113L-114L, 114L-115L, 115L-116R, 117L-118L, 118L-119R, 122R-123L, 123L-124L, 124L-125L, 125L-126L, 133R-134R, 134R-135R, 136L-137L, 137L-138L, 141L-142R, 143L-144R, 144R-145R, 145R-146R, 146R-147R, 147R-148R, 148R-149L, 152R-153L, 153L-154R, 154R-155R, 156R-157L, 157L-158R, 159R-160L, 160L-161R, 162R-163R, 163R-164R, 164R-165R, 165R-166R, 166R-167R, 167R-168R, 170R-171R, 173R-174R, 175R-176R.176R-177R, 11 82479 178R-179R, 179R-180R, 180R-181R, 183R-184R, 184R-185L, 185L-186R, 186R-187R, 187R-188R, 188R-189R, 189R-190R, 192R-193R. Згідно старої номенклатури, ORF 006L відповідає C10L, 019L відповідає C6L, 020L - N1L, 021L - N2L, 023L - K2L, 028R - K7R, 029L - F1L, 037L F8L, 045L - F15L, 050L - E3L, 052R - E5R, 054R E7R, 055R - E8R, 056L - E9L, 062L - 11L, 064L - I4L, 065L - I5L, 081R - L2R, 082L - L3L, 086R -J2R, 088R - J4R, 089L - J5L, 092R - H2R, 095R - H5R, 107R D10R, 108L -D11L, 122R - A11R, 123L - A12L, 125L - А14L 126L - A15L, 135R - A24R, 136L - A25L, 137L - A26L, 141L - A30L, 148R - A37R, 149L - A38L, 152R - A40R, 153L - A41L, 154R - A42R, 157L A44L, 159R - A46R, 160L - A47L, 165R -A56R, 166R - A57R, 167R - B1R, 170R - B3R, 176R - B8R, 180R - B12R, 184R - B16R, 185L - B17L, 187R - B19R. Переважно, гетерологічні послідовності вставляються в IGR, франкований двома сусідніми ORF вибраними з групи яка включає: 007R -008L, 018L019L, 044L-045L, 064L-065L, 136L-137L, 148R149L. Гетерологічні або екзогенні послідовності ДНК є послідовностями, які, природно, зазвичай не виявляються асоційованими із поксвірусом, як це використовується згідно даного винаходу. Згідно наступного втілення даного винаходу, екзогенна послідовність ДНК включає, принаймні, одну кодуючу послідовність. Кодуюча послідовність функціонально зв'язана із елементом керування транскрипцією, переважно до поксвірусного елементу керування транскрипцією. Також, можуть застосовуватися комбінації поксвірусних елементів керування транскрипцією та, наприклад, зовнішніх сайтів входу в рибосому. Згідно наступного втілення, екзогенна послідовність ДНК також може містити дві або більше кодуючі послідовності зв'язані з одним або декількома елементами керування транскрипцією. Бажано, щоб кодуючі послідовності кодували один або більше протеїни, поліпептиди, пептиди, чужорідні антигени або антигенні епітопи, особливо із терапевтично корисних генів. Терапевтично корисними генами, згідно даного винаходу, можуть бути гени, одержані з або гомологічні до генів патогенних або інфекційних мікроорганізмів, котрі можуть спричиняти захворювання. Відповідно, в контексті даного винаходу, такі терапевтично корисні гени є презентовані імунній системі організму для дії на нього, переважно для індукування специфічної імунної відповіді та, таким чином, вакцинації або профілактичного захисту організму від інфікування цим мікроорганізмом. В наступному бажаному втіленні даного винаходу терапевтично корисні гени вибираються з генів інфекційних вірусів, наприклад, але не обмежуючи до, вірусу тропічної лихоманки, вірусу японського енцефаліту, вірусу гепатиту В або С, вірусу імунодефіциту такого як, ВІЛ. Гени отримані із вірусу тропічної лихоманки, переважно гени NS1 та РrМ, де вказані гени можуть бути одержані з одного, двох, трьох або з усіх 4 серотипів вірусу тропічної лихоманки. Ген NS1, переважно одержують з вірусу тропічної лихоманки серотипу 2, та переважно вставляють в IGR між 12 ORF 064L-065L (I4L-I5L). Гени РrМ, переважно одержують з усіх 4 серотипів вірусу тропічної лихоманки, переважно вставляють в IGR між ORF вибраними з 007R-008L, 044L-045L, 136L-137L, 148R-149L Більш бажано, гени РrМ, одержують з 1-го серотипу вірусу тропічної лихоманки (рrМ 1), вставляють в IGR 148R-149L, РrМ 2 в IGR 007R008L, РrМ 3 в IGR ORF 044L-045L, та РrМ 4 в IGR 136L-137L. Відповідно до наступного бажаного втілення даного винаходу гетерологічна послідовність ДНК одержана із ВІЛ й кодує HIV en v, де ген HIV env є бажано вставлений в IGR між ORF 007R-008L. Також, терапевтично корисні гени, згідно даного винаходу, також включають захворювання пов'язані із генами, котрі мають терапевтичну дію на проліферативні розлади, рак або метаболічні захворювання. Наприклад, терапевтично корисним геном по відношенню до раку може бути раковий антиген, котрий має здатність викликати специфічну протиракову реакцію. Згідно наступного втілення даного винаходу, кодуюча послідовність включає, принаймні, один маркер або селекційний ген. Селекційні гени надають певну резистентність клітині, коли певний метод відбору є можливим. Особа досвідчена в цій галузі є знайомою з різноманітними селекційними генами, котрі можуть бути використані в поксвірусній системі. Серед таких є: ген резистентності до неоміцину (NPT) або ген фосфорибозилтрансферази (gpt). Маркерні гени також індукують кольорові реакції в перетворених клітинах, котрі можуть бути використані для ідентифікації перетворених клітин. Особа досвідчена в цій галузі є знайомою із різноманітними маркерними генами, котрі можуть бути використані в поксвірусній системі. Серед таких є ген, що кодує, наприклад, β-галактозидазу (β-gal), β-глюкозидазу (β-glu), зелений флуоресцентний протеїн (EGFP) або синій флуоресцентний протеїн. Відповідно до ще одного наступного втілення даного винаходу екзогенна послідовність ДНК включає спейсерну послідовність, яка відділяє поксвірусний елемент керування транскрипцією та/або кодуючу послідовність екзогенної ДНК від стоп-кодону та/або старт-кодону сусідніх ORF. Спейсерна послідовність між стоп/старт кодоном сусіднього ORF та вставленою кодуючою послідовністю екзогенної ДНК має здатність стабілізувати вставлену екзогенну ДНК та, таким чином, будьякий отриманий вірус. Розмір спейсерної послідовності може змінюватися так само як і послідовність без власної кодуючої або регуляторної функції. Згідно наступного втілення, спейсерна послідовність розділяє поксвірусний елемент регуляції транскрипції та/або кодуючу послідовність в екзогенній послідовності ДНК від стоп-кодону сусіднього ORF та має, принаймні довжину в один нуклеотид. Згідно наступного втілення даного винаходу, спейсерна послідовність відділяє поксвірусний елемент регуляції транскрипції та/або кодуючу послідовність в екзогенній послідовності ДНК від 13 82479 старт-кодону сусіднього ORF та має, принаймні 30 нуклеотидів. Зокрема, у випадках, коли типовий промоторний елемент вірусу коров'ячої віспи ідентифіковано в положенні вище старт-кодону, вставка екзогенної ДНК може не відокремлювати промоторний елемент від старт-кодону сусідньої ORF. Типовий промоторний елемент вірусу коров'ячої віспи може бути ідентифікований скануванням, наприклад, послідовності "ТАААТ" для пізніх промоторів [Davison & Moss, J. Моl. Biol. 1989; 210: 771-784] та А/Т збагачених доменів для ранніх промоторів. Спейсерна послідовність приблизно в 30 нуклеотидів є бажаною відстанню для забезпечення того, щоб поксвірусний промотор, розташований вище старт-кодону ORF, не був задіяний. До того ж, відповідно до бажаного втілення, відстань між вставленою екзогенною ДНК та стартовим кодоном сусідньої ORF є приблизно 50 нуклеотидів, та більш бажано приблизно 100 нуклеотидів. Згідно наступного переважного втілення даного винаходу, спейсерна послідовність включає додатковий поксвірусний елемент керування транскрипцією, котрий здатен керувати транскрипцією сусідньої ORF. Типовим штамом MVA, котрий може бути використано, згідно даного винаходу, для одержання рекомбінантного MVA є MVA-575, котрий депоновано в Європейській Колекції Тваринних Клітинних Культур під депозитним номером ЕСАСС V00120707. Наступним переважним штамом MVA є MVAVero або його похідні. Штами MVA-Vero були депоновані в Європейській Колекції Тваринних Клітинних Культур під депозитними номерами ЕСАСС V99101431 та 01021411. Безпечність MVA-Vero відображено його біологічними, хімічними та фізичними характеристиками, як описано в [Міжнародній патентній заявці РСТ/ЕР01/02703]. Порівняно із іншими штамами MVA, Vero-MVA має ще одну додаткову геномну делецію. Ще інший, більш бажаний штам MVA є MVABN. MVA-BN депоновано в Європейській Колекції Тваринних Клітинних Культур під депозитним номером ЕСАСС V00083008. Вірус MVA-BN є надзвичайно ослабленим вірусом, також одержаний із модифікованого вірусу коров'ячої віспи Ankara (PCT/EP01/13628). Термін „похідні’’ вірусу, згідно даного винаходу, відноситься до вірусного потомства, яке проявляє такі самі характерні ознаки, як і батьківський вірус але й демонструє відмінності в одній або більше частинах свого геному. Термін „похідний MVA’’ описує вір ус, котрий має такі самі функціональні характеристики як і MVA. Наприклад, похідний MVA-BN має характерні ознаки MVA-BN. Одна з Цих ознак MVA-BN або його похідних є ослабленість або нездатність до реплікації в клітинах HaCat людини. Рекомбінантний MVA, згідно даного винаходу є корисним як медикамент або вакцина. Це, згідно до наступного втілення, використовується для введення екзогенної кодуючою послідовності в цільову клітину, така послідовність може бути як гомологічною так і гетерологічною для геному клітини-мішені. 14 Введення екзогенної кодуючою послідовності в клітину-мішень може бути виконано in vitro для одержання протеїнів, поліпептидів, пептидів, антигенів або антигенних епітопів. Спосіб включає інфікування клітини-хазяїна рекомбінантним MVA, згідно винаходу, культивування інфікованої клітини-хазяїна за прийнятних умов, й виділення та/або збагачення поліпептиду, пептиду, протеїну, антигену, епітопу та/або вірусу, продукованого вказаною клітиною-хазяїном. Далі, спосіб для введення однієї або більше гомологічної або однієї або більше гетерологічної послідовності в клітини може застосовуватися для in vitro та in vi vo терапії. Для терапії in vitro, виділені клітини, котрі перед тим були інфіковані (ex vivo) рекомбінантним вірусом MVA, згідно винаходу вводяться в живий організм тварини, переважно для індукування імунної відповіді. Для терапії in vivo, рекомбінантний поксвірус, згідно винаходу, безпосередньо вводиться в живий організм тварини, переважно для індукування імунної відповіді. В цьому випадку, клітини, які оточують місце інокуляції, також клітини, до яких вірус потрапив через, наприклад, кровотік, є безпосередньо інфікованими рекомбінантним вірусом MVA, згідно винаходу. Після інфікування, ці клітини синтезують протеїни, пептиди або антигенні епітопи терапевтичних генів, котрі кодуються екзогенними кодуючими послідовностями, й отже, презентують їх або їхні частини на клітинній поверхні. Спеціалізовані клітини імунної системи розпізнають презентацію таких гетерологічних протеїнів, пептидів або епітопів й запускають специфічну імунну відповідь. Отже, MVA має значну обмеженість росту, та таким чином, значну ослабленість, що є корисним для лікування широкого спектру ссавців, включаючи людину, включаючи тварин або людей із ослабленим імунітетом. Даний винахід, також, пропонує фармацевтичні композиції та вакцини для індукування імунної відповіді в живому організмі тварини, включаючи людину. Фармацевтична композиція, в загальному випадку може включати один або більше фармацевтично прийнятний та/або дозволений носії, добавки, антибіотики, консерванти, ад'юванти, дилюенти та/або стабілізатори. Такими допоміжними речовинами можуть бути вода, сольовий розчин, гліцерин, етанол, зволожуючі або емульгуючі агенти, рН-буферні речовини, та їм подібні. Придатні носії є, зазвичай, великими, повільно розщеплюваними молекули такими як протеїни, полісахариди, полімолочні кислоти, полігліколеві кислоти, полімерні амінокислоти, сополімери амінокислот, ліпідні агрегати або подібні до них. Для одержання вакцин, рекомбінантний поксвірус, згідно винаходу, перетворюється у фізіологічно прийнятну форму. Це може бути виконано ґрунтуючись на досвіді виготовлення поксвірусних вакцин, які використовувалися для вакцинації проти віспи [як описано Stickl, Η. et al. [1974] Dtsch. med. Wschr. 99, 2386- 2392]. Наприклад, очищений вірус зберігають при 80°С із титром 5x10Е8 ТСID50/mІ у 10 mМ Tris, 140 mМ NaCI при рН 7.4. Для виготовлення вакцинних 15 82479 доз, наприклад, 10Е2-10Е8 часток вірусу ліофілізують в 100мл фосфатно-буферного сольового розчину в присутності 2% пептону та 1% альбуміну людини в ампули, переважно в скляні ампули. Також, вакцинні дози можуть бути одержані поступовою ліофільною сушкою вірусу в композиції. Композиція додатково може містити добавки, такі як манітол, декстран, цукор, гліцин, лактоза або полівінілпіролідон або інші допоміжним, такі як антиоксиданти або інертний газ, стабілізатори або рекомбінантні протеїни (наприклад, сироватковий альбумін людини) придатні для застосування in vi vo. Скляна ампула потім запаюється й зберігається при температурі в межах від 4°С до кімнатної протягом декількох місяців. Хоча, за відсутності потреби майже необмежено можна зберігати при температурі нижче -20°С. Для вакцинації або терапії ліофілізат може бути розведений у від 0,1 до 0,5мл водного розчину, переважно фізіологічному розчині або Tris-буфері та застосовуватись системно або локально, наприклад, парентерально, підшкірно, внутрішньом'язево, скарифікацією або будь-яким шляхом введення, відомим досвідченій особі. Спосіб застосування, доза та кількість застосувань може бути оптимізовані особою, із досвідом у цій галузі, відомим методом. Однак, в найбільш загальному випадку, пацієнт вакцинується другою ін'єкцією приблизно через інтервал від місяця до шести тижнів після першої вакцинації. Даний винахід також відноситься до плазмідних векторів, котрі можуть бути використані для отримання рекомбінантної MVA, для даного винаходу, та також відноситься до певних послідовностей ДНК: А саме, IGR розташований між або фланкований двома сусідніми ORF включає нуклеотидну послідовність, в яку може бути вставлена екзогенна послідовність ДНК, що цікавить. Відповідно, плазмідний вектор, згідно даного винаходу включає послідовність ДНК, одержану з або гомологічну до геному MVA, де вказана послідовність ДНК включає весь або частину фрагменту послідовності IGR, розташовану між або фланковану двома сусідніми ORF вірусного геному. Бажано, щоб плазмідний вектор включав вставлену у вказану послідовність, одержану з IGR, принаймні один сайт клонування для вставки бажаної екзогенної послідовності ДНК та, переважно, для вставки поксвірусного елементу керування транскрипцією, функціонально зв'язаного із вказаною послідовністю ДНК. Також, необов'язково, плазмідний вектор може включати репортерну та/або селекційну генетичну касету. Плазмідний вектор, бажано, також включає послідовності двох сусідніх ORF, котрі фланкують повний або частковий фрагмент послідовності IGR. Були ідентифіковані деякі IGR, котрі не включали нуклеотидні послідовності. У цих випадках, плазмідний вектор включав послідовності ДНК послідовностей, що фланкують IGR, наприклад, послідовності ДНК двох розташованих поруч ORF. Бажано, щоб сайт клонування для вставки гетерологічної послідовності ДНК був вставлений в IGR. ДНК послідовності, які фланкують IGR, використа 16 ні для вставки екзогенної послідовності ДНК, у відповідну IGR в геномі MVA. Такий плазмідний вектор також може додатково включати повний або частковий фрагмент послідовності IGR, котрий включає сайт для вставки гетерологічної послідовності ДНК та, необов'язково, репортерну та/або селекційну генетичну касету. Послідовності IGR-DNA, так само як і послідовності, що фланкують IGR двох сусідніх ORF, переважно вибрані з IGR та ORF, які відповідно, вибрані з групи, яка включає: 001L-002L, 002L-003L, 005R-006R, 006L-007R, 007R-008L, 008L-009L, 017L-018L, 018L-019L, 019L-020L, 020L-021L, 023L-024L, 024L-025L, 025L026L, 028R-029L, 030L-031L, 031L-032L, 032L033L, 035L-036L, 036L-037L, 037L-038L, 039L-040L, 043L-044L, 044L-045L, 046L-047R, 049L-050L, 050L-051L, 051L-052R, 052R-053R, 053R-054R, 054R-055R, 055R-056L, 061L-062L, 064L-065L, 065L-066L, 066L-067L, 077L-078R, 078R-079R, 080R-081R, 081R-082L, 082L-083R, 085R-086R, 086R-087R, 088R-089L, 089L-090R, 092R-093L, 094L-095R, 096R-097R, 097R-098R, 101R-102R, 103R-104R, 105L-106R, 107R-108L, 108L109L,109L-110L,110L-111L, 113L-114L, 114L-115L, 115L-116R, 117L-118L, 118L-119R, 122R-123L, 123L-124L, 124L-125L, 125L-126L, 133R-134R, 134R-135R,136L-137L, 137L-138L, 141L-142R, 143L-144R, 144R-145R, 145R-146R, 146R-147R, 147R-148R, 148R-149L, 152R-153L, 153L-154R, 154R-155R, 156R-157L, 157L-158R, 159R160L,160L-161R, 162R-163R, 163R-164R, 164R165R, 165R-166R, 166R-167R, 167R-168R, 170R171R, 173R-174R, 175R-176R.176R-177R, 178R179R, 179R-180R,180R-181R, 183R-184R, 184R185L, 185L-186R, 186R-187R, 187R-188R, 188R189R, 189R-190R, 192R-193R. Послідовності, більш бажано, вибрані з IGR та ORF, відповідно, вибрані з групи, яка включає: 007R-008L, 018L-019L, 044L-045L, 064L-065L, 136L-137L, 148L-149L. Послідовності, одержані з IGR є, переважно, вибрані з групи, що включає нуклеотидні послідовності - nо. 527-608 з SeqID No. 32; - nо. 299-883 з SeqID No. 33; - nо. 339-852 з SeqID No. 34; - nо. 376-647 з SeqID No. 35; - nо. 597-855 з SeqID No. 36; - nо. 400-607 з SeqID No. 37. Послідовності, що фланкують IGR дво х сусідніх ORF, переважно вибрані з групи, яка включає нуклеотидні послідовності: - nо. 1-525 та 609-1190 з SeqID No. 32; - no. 101-298 та 884-1198 з SeqID No. 33; - no. 1-338 та 853-1200 з SeqID No. 34; - no. 1-375 та 648-1200 з SeqID No. 35; - no. 1-596 та 856-1200 з SeqID No. 36; - no. 1-399 та 608-1081 з SeqID No. 37. Послідовності ДНК, переважно одержані із або гомологічні геному MVA, який депоновано в ЕСАСС під депозитним номером V00083008. Для одержання плазмідного вектора, згідно даного винаходу, послідовності виділяються та клонуються в стандартний вектор клонування, такий як pBluescript (Stratagene), в якому вони 17 82479 фланкують екзогенну ДНК, вставлену в геном MVA. Необов'язково, такий плазмідний вектор включає репортерну або селекційну генетичну касету, котра може бути видалена в готовому рекомбінантному вірусі, завдяки повторюваній послідовності, включеній у вказану касету. Способи введення екзогенних послідовностей ДНК за допомогою плазмідного вектору в геном MVA та способи одержання рекомбінантної MVA є добре відомими спеціалістам, обізнаним у даній галузі та можуть бути знайдені в наступних джерелах: - [Molecular Cloning, A laboratory Manual. Second Edition. By J. Sambrook, E. F. Fritsch and T. Maniatis. Cold Spring Harbor Laboratory Press. 1989]: описано техніку та „know-how’’ для стандартних молекулярно-біологічних методів, таких як клонування ДНК, виділення РНК, аналіз „western blot’’, методи ампліфікації RT-PCR та PCR; - [Virology Methods Manual. Edited by Brian WJ Mahy and Hillar О Kangro. Academic Press. 1996]: описано техніку зберігання та маніпулювання вірусами; - [Molecular Virology: A Practical Approach. Edited by AJ Davison and RM Elliott. The Practical Approach Series. IRL Press at Oxford University Press. Oxford 1993. Chapter 9]: експресія генів векторами вірусу коров'ячої віспи; - [Current Protocols in Molecular Biology. Publisher: John Wiley and Son Inc. 1998. Chapter 16, section IV: Expression of proteins in mammalian cells using Vaccinia viral vector]: описано техніку та „know-how’’ зберігання та маніпулювання та генетичної інженерії MVA. MVA, згідно даного винаходу, переважно MVA депонований в ЕСАСС із депозитним номером V00083008, можуть бути одержані трансфекцією клітин плазмідним вектором, згідно даного винаходу, інфікуванням клітиною трансфікованою MVA, та також, ідентифіковано, виділено, та необов'язково очищено MVA, відповідно до даного винаходу. Послідовності ДНК, згідно даного винаходу, можуть використовуватися для ідентифікації або виділення MVA або їхніх похідних, згідно даного винаходу та клітин або осіб інфікованих MVA, згідно даного винаходу. Послідовності ДНК, наприклад, використані для одержання PCR-праймерів, гібридизаційних зондів або матричних те хнологій. Фігура 1: Карта рестрикції векторних конструктів pBNX39 (Фігура 1a), pBNX70 (Фігура 1b) та pBN84 (Фігура 1с), мають приблизно 600bр послідовностей MVA, котрі фланкують сайт вставки після I4L ORF. Плазміди додатково включають екзогенну ДНК (Ecogpt and hBFP, відповідно) під транскрипційним контролем поксвірусного промотора Р) між фланкуючих послідовностей: Фланк 1 (F1I4L-I5L) та Фланк 2 (F2I4L-I5L). F1rpt ставиться для повторюваної послідовності Фланку 1 для забезпечення делеції репортерної касети з готового рекомбінантного вірусу. pBN84 (Фігура 1с) додатково кодує протеїн NS1 вірусу тропічної лихоманки (NS1 DEN). Наступні скорочення: AmpR = ген резистентності до ампіциліну; bps = пари основ. 18 Фігура 2: Карта рестрикції векторних конструктів pBNX51 (Фігура 2а), pBNX67 (Фігура 2b) та pBN27 (Фігура 2с), мають приблизно 600bр послідовностей MVA фланкують сайт вставки після ORF 137L (Фланк 1:F1136-137 відповідає позиції 129340-129930 геному MVA; Фланк 2: F2136-137 відповідає позиції 129931 - 130540 геному MVA). Також вектор pBNX67 (Фігура 2b) містить екзогенну ДНК (NPT II ген = резистентність до неоміцину) під транскрипційним контролем поксвірусного промотора Р) між фланкуючих послідовностей. F2rpt ставиться для повторюваної послідовності Фланку 2 для забезпечення делеції репортерної касети з готового рекомбінантного вірусу. pBN27 (Фігура 2с) додатково кодує протеїн РrМ4 вірусу тропічної лихоманки під контролем поксвірусного промотора. Наступні скорочення: AmpR = ген резистентності до ампіциліну; bps = пари основ; IRES = зовнішній сайт входу рибосоми; EGFP = ген посиленого зеленого флуоресцентного протеїну. Фігура 3: Карта рестрикції векторних конструктів pBNX79 (Фігура 3а), pBN X86 (Фігура 3b), pBNX88, (Фігура 3с), pBN34 (Фігура 3d) та pBN56 (Фігура 3е), мають приблизно 600 bps послідовностей MVA фланкують сайт вставки між ORF 007R та 008L (Фланк 1: F1 IGR 07-08 починається з позиції 12200 геному MVA; Фланк 2: F2 IGR 07-08 закінчується в позиції 13400 геному MVA). F2rpt ставиться для повторюваної послідовності Фланку 2 для забезпечення делеції репортерної касети з готового рекомбінантного вірусу. Додатково вектор pBNX88 (Фігура 3с) та pBNX86 (Фігура 3b) включають послідовність ДНК (BFP + gpt та NPT II + EGFP, відповідно) під транскрипційним контролем поксвірусного промотора Р) між фланкуючих послідовностей. F2rpt ставиться для повторюваної послідовності Фланку 2 для забезпечення делеції репортерної касети з готового рекомбінантного вірусу. PBN56 (Фігура 3е) додатково кодує протеїн HIV-1 env, та pBN34 (Фігура 3d) містить кодуючу послідовність РrМ2 вірусу тропічної лихоманки під контролем поксвірусного промотора. Наступні скорочення: AmpR = ген резистентності до ампіциліну; bps = пари основ. Фігура 4: Карта рестрикції векторних конструктів pBNX80 (Фігура 4а), pΒΝΧ87 (Фігура 4b) та pΒΝ47 (Фігура 4с) мають приблизно 600/640 bps послідовностей MVA фланкують сайт вставки між ORF 044L та 045L (Фланк 1: F1 IGR44-45 починається в позиції 36730 геному MVA; Фланк 2: F2 IGR44-45 починається в позиції 37970 геному MVA). Також, вектор pBNX87 (Фігура 4b) містить екзогенну ДНК (ген NPTII + EGFP) під транскрипційним контролем поксвірусного промотору Р) між фланкуючих послідовностей. F2rpt ставиться для повторюваної послідовності Фланку 2 для забезпечення делеції репортерної касети з готового рекомбінантного вірусу. PBN47 (Фігура 4с) додатково кодує РrМ3 вірусу тропічної лихоманки під контролем поксвірусного промотора. Наступні скорочення: AmpR = ген резистентності до ампіциліну; bps = пари основ. Фігура 5: Карта рестрикції векторних конструктів pBNX90 (Фігура 5а), pBNX92 (Фігура 5b) та pBN54 (Фігура 5с), мають приблизно 596/604 bps 19 82479 послідовностей MVA фланкують сайт вставки між ORF 148R та 149L (Фланк 1: F1IGR148-149 починається з позиції 136900 геному MVA; Фланк 2: F2 IGR148-149 закінчується в позиції 138100 геному MVA). Також, вектор pBNX92 (Фігура 5b) містить ендогенну ДНК (gpt + BFP) під транскрипційним контролем поксвірусного промотору Р) між фланкуючих послідовностей. PBN54 (Фігура 5с) додатково кодує РrМ1 вір усу тропічної лихоманки. F2rpt ставиться для повторюваної послідовності Фланк 2 для забезпечення делеції репортерної касети з готового рекомбінантного вірусу. Наступні скорочення: AmpR = ген резистентності до ампіциліну; bps = пари основ. Фігура 6: С хематичне представлення міжгенного сайту вставки MVA (Genbank Ac.U94848). Фігура 7: PCR - аналіз IGR I4L-I5L в рекомбінантному MVA із NS1 вірусу тропічної лихоманки вставленого у IGR I4L-I5L. Смуга "BN" вказує на PCR-продукт з використанням пустого вектору MVA-BN. Використовуючи NS1 рекомбінантний MVA можуть визначатися фрагменти більшого розміру (1,2, 3,4: різні концентрації ДНК). Μ = маркер молекулярної маси, Н20 негативний водний контроль. Фігура 8: Фігура 8а: PCR-аналіз IGR 136-137 в рекомбінантному MVA із РrМ4 вірусу тропічної лихоманки вставлений у IGR 136-137. Смуга "ΒΝ" вказує на PCR-продукт з використанням пустого вектору MVA-BN. Використовуючи РrМ4 рекомбінантний MVA можуть визначатися фрагменти більшого розміру (mBN23,1/10, 1/100: різні концентрації ДНК). Μ = маркер молекулярної маси, Н20 негативний водний контроль, pΒΝ27 = плазмідний позитивний контроль. Фігура 8b: Крива багатоетапного росту пустого вектору MVA-BN та рекомбінантного MVA із РrМ4 вставленого в IGR 136-137 (MVA-mBN23). Фігура 9: Фігура 9а: PCR-аналіз IGR 07-08 в рекомбінантному MVA із РrМ2 вірусу тропічної лихоманки вставлений у IGR 07-08. Смуга 3 вказує PCR-продукт із використанням пустого вектору MVA-BN. Із використанням РrМ2 рекомбінантного MVA можуть визначатися фрагменти більшого розміру (смуга 2). М= маркер молекулярної маси, смуга 1 = негативний водний контроль. Фігура 9b: Крива багатоетапного росту пустого вектору MVA-BN та рекомбінантного MVA із РrМ2 вставленого IGR 07-08 (MVA-mBN25). Фігура 10: PCR-аналіз IGR 07-08 в рекомбінантному MVA із HIV env вставлений у IGR 07-08. Смуга BN вказує PCR-продукт із використанням пустого вектору MVA-BN. Із використанням РrМ2 рекомбінантного MVA можуть визначатися фрагменти більшого розміру (смуга 1, 2, 3). М= маркер молекулярної маси, - = негативний водний контроль. + = плазмідний позитивний контроль. Фігура 11: Фігура 11а: PCR-аналіз IGR 44-45 в рекомбінантному MVA із РrМ3 вірусу тропічної лихоманки вставлений у IGR 44-45. Смуга BN вказує PCR-продукт із використанням пустого вектору MVA-BN. Із використанням РrМ3 рекомбінантного MVA можуть визначатися фрагменти більшого розміру (смуги 1-4 різні концентрації ДНК). М= ма 20 ркер молекулярної маси, - = негативний водний контроль. Фігура 11b: Крива багатоетапного росту пустого вектору MVA-BN та рекомбінантного MVA із РrМ3 вставленого IGR 44-45(MVA-mBN28). Фігура 12: Фігура 12а: PCR-аналіз IGR 148-149 в рекомбінантному MVA із РrМ1 вірусу тропічної лихоманки вставлений у IGR 148-149. Смуга BN вказує PCR-продукт із використанням пустого вектору MVA-BN. Із використанням РrМ1 рекомбінантного MVA можуть визначатися фрагменти більшого розміру (смуга 1). М = маркер молекулярної маси, - = негативний водний контроль, + = плазмідний позитивний контроль. Фігура 12b: Крива багатоетапного росту пустого вектору MVA-BN та рекомбінантного MVA із РrМ1 вставленого IGR 44-45 (MVA-mBN33). Наступні приклади глибше ілюструють даний винахід. Само по собі, будь-якій особідосвідченій в даній галузі, є зрозумілим, що наведені приклади ні в якому разі не можуть тлумачитись як обмеження даного винаходу до цих прикладів. Межі даного винаходу встановлюються лише межами поставленими у формулі. Приклад 1 Вставка векторів pBNX39, pBNX70 та pBN84 Для вставки екзогенних послідовностей в міжгенний регіон поблизу 065L ORF (сайт вставки знаходиться в геномі в позиції 56760) MVA, було сконструйовано вектор, котрий включає приблизно 1200 bр фланкуючих послідовностей поблизу сайту рестрикції. Ці фланкуючі послідовності відокремлені двома фланками, один з яких 065L ORF має приблизно 610 bр (альтернативна номенклатура:I4L ORF) й на іншій частині близько 580 bр міжгенного регіону позаду 065L ORF так само як і частина ближнього ORF. Між цих фланкуючих послідовностей ген Ecogpt (gpt ставиться для фосфорибозилтрансферазного гену виділеного з Е. соlі) та BFP (синього флуоресцентного протеїну), відповідно, розташованого під транскрипційним контролем поксвірусного промотору. Також, є принаймні один клонувальний сайт для вставки додаткових генів або послідовностей, котрі мають бути вставлені в міжгенний регіон після I4L ORF. Зразок векторного конструкту, згідно даного винаходу приведено на Фігурі 1 а) та b) (pBNX39, pBN X70). У векторі pBN84 (Фігура 1с) кодуючий регіон NS1 вірусу тропічної лихоманки вставлено у клонувальний сайт pBNX70 (Фігура 1b). Створення рекомбінантного MVA шляхом гомологічної рекомбінації Чужорідні гени можуть бути вставлені в геном MVA шляхом гомологічної рекомбінації. Для цієї цілі чужорідний ген, що цікавить, клонується в плазміднии вектор, як описано раніше. Цей вектор трансфікується в клітини інфіковані MVA. Рекомбінація відбувається в цитоплазмі інфікованих та трансфікованих клітин. За допомогою селекційної та/або репортерної касети, котра також міститься в інсерційному векторі, клітини, що містять рекомбінантні віруси, ідентифікуються й виділяються. Для гомологічної рекомбінації клітин ВНК (Baby hamster kidney - нирки малюка хом'яка) або CEF (primary chicken embryo fibroblasts -первинні 21 82479 фібробласти курячих ембріонів) висаджуються на 6-лункові платівки за допомогою DMEM (Dulbecco's Modified Eagles Medium, Gibco BRL) + 10% ембріональної телячої сироватки (FCS) або VP-SFM (Gibco BRL) + 4mmol/l L-глютаміну для без сироваткового процесу. Потрібно щоб клітини залишалися у фазі росту і, таким чином досягли 60-80% конфлюенції на день трансфекції. Клітини підраховують перед висаджуванням, оскільки потрібно знати кількість клітин для визначення ступеня розповсюдження інфекції (moi). Для інфекції зразок MVA розводили в DMEM/FCS або VP-SFM/L-глютаміні таким чином щоб 500мкл містили певну кількість вірусу, що дало б значення mоi 0.1-1.0. Вважалося, що клітини поділялися одноразово після висаджування. Середовище відокремлювалося від клітин і клітини інфікували 500мкл розведеного вірусу й на протязі 1 години збовтували при кімнатній температурі. Інокулят видаляли й клітини відмивали DMEM/VPSFM. Ін фіковані клітини залишалися в 1.6ml DMEM/FCS та VP-SFM/L-глютаміні, відповідно, поки тривала реакція трансфекції (Qiagen Effectene Kit). Для трансфекції використовували трансфекційний набір "Effectene" (Qiagen). Трансфекційна суміш виготовлялася з 1-2г лінеаризованого вставочного вектору (загальна кількість для множинної трансфекції) із буфером ЕС для досягнення остаточного об'єму 100мкл. Додають 3.2мкл Enhancer, поміщують на мішалку та інкубують при кімнатній температурі протягом 5хв. Потім Effectene у кількості 10мкл додають після перемішування у пробірку й інтенсивно перемішують й інкубують на протязі 10хв. Додають 600мкл DMEM/FCS та VPSFM/L-глютаміну, відповідно, перемішують й потім уся трансфекційна суміш додається до клітин, котрі вже покрито середовищем. Чашки із трансфекційною реакцією починають обережно перемішувати. Інкубування триває при 37°С із 5% СО2 на протязі ночі. Наступного дня середовище видаляють й замінюють на свіжий DMEM/FCS або VPSFM/L-глютамін. Інкубування триває до третього дня. Одержані клітини зішкрябають у середовище, потім клітинну суспензію переносять у відповідні пробірки й заморожують при -20°С для короткотермінового зберігання та при -80°С для довгострокового зберігання. Вставка Ecogpt в сайт вставки I4L MVA Спочатку клітини були інфіковані MVA, згідно вище наведеного протоколу та потім були трансфіковані вектором вставки pBNX39 (Фігура 1а), котрий містив ген Ecogpt (Ecogpt або скорочено до gpt, означає ген фосфорибозилтрансферази) як ген репортер. Одержані рекомбінантні віруси були очищені 3-ма етапами пляшкового очищення при фосфорибозилтрансферазній метаболічній селекції додаванням мікофенольної кислоти, ксантину та гіпоксантину. Мікофенольна кислота (МРА) інгібує інозинову монофосфатдегідрогеназу й призводить до блокування пуринового синтезу та інгібування вірусної реплікації у більшості клітинних 22 ліній. Це блокування може бути подолане експресією Ecogpt від конститутивного промотора й забезпечення субстратів ксантину та гіпоксантину. Одержані рекомбінантні віруси були ідентифіковані стандартним PCR-аналізом з використанням праймерної пари, яка селективно ампліфікує очікуваний сайт вставки. Для ампліфікації сайту вставки I4L було використано бічну праймерну пару BN499 (САА СТС ТСТ ТСТ TGA ТТА СС, SEQID N0.: 1) та BN500 (CGA ТСА AAG ТС А АТС ТАТ G, SEQID N0.: 2). У випадку, коли ампліфікувалася ДНК порожнього вірусного вектору MVA очікуваний PCR-фрагмент мав довжину 328 нуклеотидів (nt), у випадку ампліфікування рекомбінантного MVA, котрий включав екзогенну ДНК в сайті вставки I4L, фрагмент відповідно збільшувався. Вставка NS1 у сайт вставки IGR 064L-065L (x4L-I5L) MVA Спочатку, клітини були інфіковані MVA, згідно вище описаного протоколу та потім, додатково, трансфіковані вектором вставки pBN84 (Фігура 1с), який містив ген Ecogpt для селекції та BFP (Blue fluorescence protein - синій флуоресцентний протеїн) як репортерний ген. Одержані рекомбінантні віруси очищували за 7 етапів пляшкового очищення при фосфорибозилтрансферазній метаболічній селекції додаванням мікофенольної кислоти, ксантину та гіпоксантину. Мікофенольна кислота (МРА) інгібує інозинову монофосфатдегідрогеназу й призводить до блокування пуринового синтезу та інгібування вірусної реплікації у більшості клітинних ліній. Це блокування може бути подолане експресією Ecogpt від конститутивного промотора й забезпечення субстратів ксантину та гіпоксантину. Одержані рекомбінантні віруси були ідентифіковані за допомогою стандартного PCR-аналізу з використанням праймерної пари, яка селективно ампліфікує очікуваний сайт вставки. Для ампліфікації сайту вставки I4L було використано бічну праймерну пару BN499 (САА СТС ТСТ ТСТ TGA ТТА СС, SEQID NO.: 1) та BN500 (CGA TCA AAG ТСА АТС ТАТ G, SEQID N0.: 2). У випадку, коли ампліфікувалася ДНК порожнього вірусного вектору MVA, очікуваний PCR-фрагмент мав довжину 328 нуклеотидів (nt), у випадку ампліфікування рекомбінантного MVA із NS1, котрий включав кодуючий регіон NS1 вірусу тропічної лихоманки в сайті вставки I4L, фрагмент мав бути довжиною 1683 bр. Результати PCR на Фіг.7 чітко показують стабільну вставку NS1 у вставочний сайт I4L після 17 етапів ампліфікації вірусу. Тестування recMVA, яка включала NS1 (MVABN22) in vitro Колби Т25 із моношарами клітин ВНК, які сполучалися між собою було інокульовано 100мкл вірусної культури і розведено до 1x107 МЕМа із 1% FCS та перемішано при кімнатній температурі на протязі 30хв. 5мл МЕМа із 1% FCS було додано в кожну колбу та інкубовано при 30°С в СО2інкубаторі. Колби обробляли через 48 годин. Супернатант видаляли з колб і піддавали 260g на протязі 10хв. при 4°С. Супернатант зберігали в аліквотах при -80°С. Пелети двічі відмивали 5мл 1xPBS та потім ре суспендували в 1мл гіпотонічно 23 82479 го відмивного буферу із 1% ТХ100. Клітинні лізати були зібрані й піддані 16,000g на протязі 5хв. й потім супернатанти зберігалися в мікроцентрифужних пробірках при -80°С. Колби інокулювали MVA який включав GFP, MVA який включав ген NS1 в сайті делеції (MVA-BN07), та контрольні колби були також інфіковані у такий спосіб як описано вище. Клітинний/вірусний лізат та супернатант було оброблено в невідновлюючих/відновлюючих буферах за умов нагрівання/ненагрівання. Протеїни відділяти в 10% SDS PAGE та переносили на нітроцелюлозні мембрани. Плями було протестовано на протязі ночі об'єднаною сироваткою виздоровлюючих пацієнтів (PPCS) у розведенні 1:500. Після триразового відмивання 1XPBS плями знову інкубували із IgGHRP людини (DAKO) на протязі 2 годин при кімнатній температурі. Після цього плями мили як описано вище, фарбування виконували 4-хлоро-1-нафтолом. Результати „western blot’’ показують, що NS1 в MVA-BN22 експресується у великій кількості. NS1 експресувався в правій конформації, як димер за умов не нагрівання та, як мономер за умов нагрівання. Експресію NS1 було порівняно із MVA-BN22 та MVA- BN07. ВНК-клітини було інокульовано таким самим pfu та досліджено через 48 годин. Результати вказують на те, що експресія NS1 була значно вищою в BN22 ніж у BN07. Результати „western blot’’ також вказують на те, що більше NS1 секретувалося в супернатант із конструктом BN22 порівняно до BN07. Результати, також вказують на те, що NS1 експресований в клітинах, інфікованих BN22 є антигенним та розпізнається об'єднаною сироваткою виздоровлюючих пацієнтів. На закінчення, NS1 експресується у великих кількостях та в привій конформації в клітинах ВНК інфікованих BN22. І димер, і мономер є антигенними та розпізнаються об'єднаною сироваткою виздоровлюючих пацієнтів. Приклад 2 Вектор вставки pBNX67 та pBN27 Послідовності MVA, наближені до нового сайту вставки (в геномній позиції 129940) між ORF 136L та 137L були виділені стандартною PCRампліфікацією цільової послідовності з використанням наступних праймерів: PCR-фрагмент, який включає Фланк 1, було оброблено рестрикційними ферментами Sacll та Xbal та леговано до обробленого Sacll/Xbal та дефосфорильованого основного вектора, такого як pBluescript (Stratagene). 24 Одержана плазміда була оброблена Xhol/Apal, дефосфорильована та легована до PCRфрагменту обробленого Xhol/Apal, який містив Фланк 2. Необов'язково, повторювана послідовність Фланку 2, була виділена за допомогою PCR із застосуванням праймерів oBN545 (CGGCTGCAGGGTACCTTCACGTTC AGCCTTC AT GC; SEQID NO.: 7) та oBN546 (CGGAAGCTTTATATGGTTTAGGATATTCTGTTTT; SEQID NO.: 8) та котрий став обробленим Hindlll/Pstl, був вставлений до сайту Hindlll/Pstl остаточного вектору. Фігура 2а) демонструє вектор (pBNX51). Репортерною касетою, яка включала синтетичний промотор, ген NPT II (резистентність до неоміцину), регіон полі-Α, IRES, ген EGFP (Ps-NPTIIпoлi-A-IRES-EGFP) була оброблена Ec1136ll/Xhol та включена в сайт Hindlll/Xhol вектору вставки, де сайт Hindlll був тупо закінчений полімеразою Т4 DNA (Roche). Карта рестрикції типового векторного конструкта, згідно цього прикладу описано на Фігурі 2b) (pBNX67). Для конструювання pBN27 (Фіг.2с) РrМ вір усу тропічної лихоманки серотипу 4 був вставлений в одиничний Pacl-сайт pBNX67. Одержання рекомбінантного MVA шляхом гомологічної рекомбінації Вектор pBNX67 (Фігура 2b) може бути використаний для створення рекомбінантного MVA використовуючи раніше згаданий протокол, наприклад, використовуючи pBN27 (Фіг.2с) для гомологічної рекомбінації призводило до появи рекомбінантного MVA, котрий несе РrМ4 вірусу тропічної лихоманки в міжгенному регіоні між двома сусідніми ORF. Вставка РrМ4 в сайт вставки IGR 136-137 MVA Спочатку, клітини були інфіковані MVA, згідно вище описаному протоколу й додатково трансфіковані вектором вставки pBN27 (Фіг.2с), який містить ген NPT для селекції та EGFP (enhanced green fluorescence protein -посилений зелений флуоресцентний протеїн) як репортерний ген. Одержані рекомбінантні віруси були очищені 4-ма циклами очищення бляшок при селекції G418. Одержані рекомбінантні віруси ідентифікувалися стандартним PCR-тестом, з використанням праймерної пари, яка селективно ампліфікувала бажаний сайт інсерції. Для ампліфікації IGR136137 була застосована вставкова бічна праймерна пара, BN900 (cgttcgcatgggttacctcc, SEQID NO.: 9) та BN901 (gacgcatgaaggctgaac, SEQID NO.: 10). У випадку коли ампліфікувалася ДНК пустого векторного вірусу MVA, очікуваний PCR-фрагмент мав довжину 88 нуклеотидів (nt), у випадку рекомбінантного MVA ампліфікувався РrМ4, котрий включав кодуючий регіон РrМ4 вірусу тропічної лихоманки у сайті вставки IGR 136-137, фрагмент повинен був мати 880 bр. Результати PCR на Фіг.8а) ясно показують стабільну вставку РrМ4 в сайті вставки IGR136-137 після 22 циклів вірусної ампліфікації. Рекомбінантний MVA все ще демонструє такі самі характеристики росту як і MVA-BN. Він реплікується в фібробластах курячого ембріону (клітини 25 82479 CEF) й ослабленим росте в клітинах ссавців (Фіг.8b). Приклад 3 Вектор вставки pBNX79, pBNX86, pBNX88, pBN34 та pBN56 Послідовності MVA, сусідні до сайту вставки (в геномній позиції 12800) між ORF 007R та 008L були виділені стандартною PCR-ампліфікаціею бажаної послідовності за допомогою наступних праймерів: PCR-фрагмент, який включає Фланк 1, було оброблено рестрикційними ферментами Sacll та Sacl та леговано до обробленого Sacll/Sacl та дефосфорильованого основного вектору, такого як pBluescript (Stratagene). Одержана плазміда була оброблена Xhol/Apal, дефосфорильована та легована до обробленого Xhol/Apal PCR-фрагменту, який включає Фланк 2. Необов'язково, повторювана послідовність Фланку 2 котра була виділена за допомогою PCR з використанням праймерів IGR 07/08 F2up (CCGCTCGAGCGCGGATCCCAATATATGGC ATAG AAC; SEQID NO.:13) та IGR 07/08 F2mid (TTTCTGC AGTGATATTTATCCAATACTA; SEQID NO.: 15) та котрі оброблено BamHI/Pstl, були вставлені в сайт BamHI/Pstl остаточного вектору. Будь-яка касета, що включає репортерний або терапевтичний ген має, наприклад, поксвірусний промотор, маркерний ген, регіон полі-Α та необов'язково елемент IRES, та ген, наприклад, який експресує терапевтично активну речовину або генетичний продукт, може бути сліпо закінчений полімеразою Т4 ДНК (Roche) після рестрикційного оброблення та вставлена у придатний клонувальний сайт плазмідного вектору. Карта рестрикції типового векторного конструкта, відповідно до цього прикладу описано Фігурі 3а) (pBNX79). Вставка селекційної касети NPT/EGFP дає вектор pBNX86 (Фіг.3b) та вставка селекційної касети gpt/BFP дає вектор pBNX88 (Фіг.3с), відповідно. Зважаючи на те, що експресійна конструкція для терапевтичного гену, яка включає терапевтичний ген й функціонально зв'язаний промотор, то ця експресійна одиниця вставляється в сайт Расl. Для конструювання pBN34 (Фіг.3d) був клонований РrМ2 вірусу тропічної лихоманки в pBNX88 (Фіг.3с) та для синтезу pBN56 (Фіг.3е) був клонований кодуючий регіон HIV en v Расl в pBNX86 (Фіг.3b). Створення рекомбінантного MVA шляхом гомологічної рекомбінації Вектори pBNX86 (Фіг.3b) та pBNX88 (Фіг.3с), відповідно, можуть бути застосовані для створення рекомбінантного MVA за допомогою раніше згаданого протоколу. Використання pBN34 (Фіг.3d) для гомологічної рекомбінації призводить до оде 26 ржання рекомбінантного MVA, який несе РrМ2 вірусу тропічної лихоманки в міжгенному регіоні між двома сусідніми ORF. Рекомбінація pBN56 (Фігура 3е) геномом MVA-BN призводить до рекомбінантного MVA, котрий містить ген HIV env у відповідному IGR. Вставка РrМ2 у сайт вставки IGR07-08 MVA На першому етапі клітини були інфіковані MVA, згідно до раніше наведеного протоколу й додатково трансфіковані вектором вставки pBN34 (Фіг.3d), котрий включав ген gpt для селекції та BFP як репортерний ген. Одержані рекомбінантні віруси були очищені 3-ма циклами очищення бляшок при селекції мікофенольною кислотою, як описано в прикладі 1. Одержані рекомбінантні віруси ідентифікували стандартним PCR-аналізом з використанням праймерної пари, яка селективно ампліфікує очікуваний сайт вставки. Для ампліфікації бічної праймерної пари IGR07-08, використовувалися BN902 (ctggataaatacgaggacgtg, SEQID NO.: 16) та BN903 (gacaattatccgacgcaccg, SEQID NO: 17). У випадку коли ампліфікувалася ДНК пустого векторного вірусу MVA, очікуваний PCR-фрагмент мав довжину 190 нуклеотидів (nt), у випадку рекомбінантного MVA ампліфікувався РrМ2, котрий включав кодуючий регіон РrМ2 вірусу тропічної лихоманки у сайті вставки IGR 07-08, фрагмент повинен був мати 950 bр. Результати PCR на Фіг.9а) ясно показують стабільну вставку РrМ2 в сайті вставки IGR 07-08 після 20 циклів вірусної ампліфікації. Рекомбінантний MVA все ще демонструє такі самі характеристики росту як і MVA-BN. Він реплікується в фібробластах курячого ембріону (клітини CEF) й ослабленим росте в клітинах ссавців (Фіг.9b). Вставка HIV en v в сайт вставки IGR 07-08 MVA Спочатку клітини були інфіковані MVA, згідно раніше приведеного протоколу, й потім додатково трансфіковані вектором вставки pBN56 (Фіг.3е) котрий включав ген NPT для селекції та EGFP як репортерний ген. Одержані рекомбінантні віруси були очищені 6-ма циклами очищення бляшок при селекції G418. Одержані рекомбінантні віруси ідентифікували стандартним PCR-аналізом з використанням праймерної пари, яка селективно ампліфікує очікуваний сайт вставки. Для ампліфікації бічної праймерної пари IGR07-08, використовувалися BN902 (ctggataaatacgaggacgtg, SEQID NO.: 16) та BN903 (gacaattatccgacgcaccg, SEQID NO: 17). У випадку коли ампліфікувалася ДНК пустого векторного вірусу MVA, очікуваний PCR-фрагмент мав довжину 190 нуклеотидів (nt), у випадку рекомбінантного MVA ампліфікувався HIV env, котрий включав кодуючий регіон РrМ2 вірусу тропічної лихоманки у сайті вставки IGR 07-08, фрагмент повинен був мати 2,6 кbр. Результати PCR на Фіг.10 ясно показують стабільну вставку HIV en v в сайті вставки IGR 07-08 після 20 циклів вірусної ампліфікації. Приклад 4 Вектор вставки pΒΝΧ80, pΒΝΧ87 та pΒΝ47 Послідовності MVA сусідні до сайту вставки (в геномній позиції 37330) між ORF 044L та 045L бу 27 82479 ли виділені стандартною PCR-ампліфікацією бажаної послідовності за допомогою наступних праймерів: PCR-фрагмент, який включає Фланк 1 було оброблено рестрикційними ферментами Sacll та Sacl та леговано до обробленого Sacll/Sacl та дефосфорильованого основного вектору, такого як pBluescript (Stratagene). Одержана плазміда була оброблена Xhol/Apal, дііфосфорильована та легована до обробленого Xhol/Apal PCR-фрагмонту, який включає Фланк 2. Необов'язково, повторювана послідовність Фланку 2 котра була виділена за допомогою PCR з використанням праймерів: IGR 44/45 F2mid (TTTCTGC AGCCTTCCTGGGTTTGTATTAACG; SEQID NO.: 22) та котрі оброблено BamHI/Pstl, були вставлені в сайт BamHI/Pstl остаточного вектору. Будь-яка касета, що включає репортерний або терапевтичний ген має, наприклад, поксвірусний промотор, маркерний ген регіон полі-Α та необов'язково елемент IRES, та ген, наприклад, який експресує терапевтично активну речовину або генетичний продукт, може бути сліпо закінчений полімеразою Т4 ДНК (Roche) після рестрикційного оброблення та вставлена у придатний клонувальний сайт плазмідного вектору. Оскільки касета репортерного гену містить Psll, EcoRl, EcoRV, Ніndlll, Aval або Xhol рестрикційний сайт між фланк 1 та фланк 2 для сайту клонування бажане повторення. Для конструювання pΒΝΧ87 (Фіг.4b) селекційна касета NPT/EGFP була вставлена в рВNХ80 (Фіг.4a). Оскільки експресійна одиниця терапевтичного гену, включає терапевтичний ген та функціонально зв'язаний промотор, експресійна одиниця вставляється у сайт Расl. Рестрикційна карта типового векторного конструкту, згідно даного прикладу приведено на Фігура 4а) та b) (pBNX80, pBNX87). Для одержання рекомбінантного MVA може бути використаний вектор - згідно вище наведеного протоколу – який несе екзогенну послідовність в міжгенному регіоні між двома сусідніми ORF. Для конструювання pΒΝ47 (Фіг.4с) РrM вірусу тропічної лихоманки 3-го серотину був клонований у pBNX87 (Фіг.4b). Вставка РrМ3 у сайт вставки IGR 44-45MVA Спочатку клітини були інфіковані MVA, згідно раніше приведеного протоколу, й потім додатково трансфіковані вектором вставки pBN47 (Фіг.4с) 28 котрий включав ген ΝΡΤ для селекції тa EGFP як репортерний ген. Одержані рекомбінантні віруси були очищені 3-ма циклами очищення бляшок при селекції G418. Одержані рекомбінантні віруси ідентифікували стандартним PCR-аналізом з використанням праймерної пари, яка селективно ампліфікує очікуваний сайт вставки. Для ампліфікації бічної праймерної пари IGR 44-45, використовувалися, BN904 (cgttagacaacacaccgacgatgg, SEQID NO: - 23) and BN905 (cggatgaaaaatttttggaag, SEQIDNO: 24). У випадку коли ампліфікувалася ДНК пустого векторного вірусу MVA, очікуваний РСR-фрагмент мав довжину 185 нуклеотидів (nt), у випадку рекомбінантного MVA ампліфікувався PrM3 котрий включав кодуючий регіон РrМ3 вірусу тропічної лихоманки у сайті вставки IGR 44-45, фрагмент повинен був мати 850кbр. Результати PCR на Фіг.11а) ясно показують стабільну вставку РrМ3 в сайті вставки IGR 44-45 після 19 циклів вірусної ампліфікації. Рекомбінантний MVA все ще демонструє такі самі характеристики росту як і MVA-BN. Він реплікується в фібробластах курячого ембріону (клітини СEF) й ослабленим росте в клітинах ссавців (Фіг.11b). Приклад 5 Вектор вставки pBNX90, pBNX92 та pBN54 Послідовності MVA сусідні до сайту вставки (в геномній позиції 137496) між ORF 148R та 149L були виділені стандартною PCR-ампліфікацією бажаної послідовності за допомогою наступних праймерів: IGR 148/149 F1up (TCCCCGCGGGGACTC ATAGATTATCGACG; SEQID NO: 25) та IGR 148/149 F1end (CTAGTCTAGACTAGTCTATTAATCCAC AGAAATA C; SEQID NO.: 26) для виділення Фланк 1; PCR-фрагмент, який включає Фланк 1 було оброблено рестрикційними ферментами Sacll та Sacl та ліговано до обробленого Sacll/Sacl та дефосфорильованого основного вектору, такого як pBluescript (Stratagene). Одержана плазміда була оброблена Xhol/Apal, дефосфорильована та легована до обробленого Xhol/Apal PCR-фрагменту, який включає Фланк 2. Необов'язково, повторювана послідовність Фланку 2 котра була виділена за допомогою PCR з використанням праймерів: Будь-яка касета, що включає репортерний або терапевтичний ген має, наприклад, поксвірусний промотор, маркерний ген, регіон полі-Α та необо 29 82479 в'язково елемент IRES, та ген, наприклад, який експресує терапевтично активну речовину або генетичний продукт, може бути сліпо закінчений полімеразою Т4 ДНК (Roche) після рестрикційного оброблення та вставлена у придатний клонувальний сайт плазмідного вектору. Для конструювання pBNX92 (Фіг.5b) експресійна касета gpt/BFP була вставлена в цей клонувальний сайт. Оскільки касета репортерного гену містить Pstl, EcoRI, EcoRV та Hindlll, сайт рестрикційного ферменту між фланк 1 та фланк 2-повтор для сайту клонування бажане. Оскільки експресійна одиниця терапевтичного гену, включає терапевтичний ген та функціонально зв'язаний промотор, експресійна одиниця вставляється у сайт Расl. Для конструювання вірусу тропічної лихоманки pBN54 (Фіг.5с) РrМ1 був вставлений у цей сайт Расl. Рестрикційна карта типового векторного конструкту, згідно даного прикладу приведено на Фігура 5а) та b) (pBNX90, pBNX92 b). Для одержання рекомбінантного MVA може бути використаний вектор, згідно вище наведеного протоколу, який несе екзогенну послідовність в міжгенному регіоні між двома сусідніми ORF. Для одержання рекомбінантного MVA, який експресує конструювання РrМ1 вірусу тропічної лихоманки (Фіг.5с) pBN54 був використаний для гомологічної рекомбінації. Вставка РrМ1 в сайт вставки IGR148-149 MVA Спочатку клітини були інфіковані MVA, згідно раніше приведеного протоколу, й потім додатково трансфіковані вектором вставки pBN54 (Фіг.5с), котрий включав ген gpt для селекції та BFP як репортерний ген. Одержані рекомбінантні віруси були очищені 3-ма циклами очищення бляшок при селекції мікофенольною кислотою. Одержані рекомбінантні віруси ідентифікували стандартним PCR-аналізом з використанням праймерної пари, яка селективно ампліфікує очікуваний сайт вставки. Для ампліфікації бічної праймерної пари IGR 148-149, використовувалися, BN960 (ctgtataggtatgtcctctgcc, SEQIDNO.: 30) та BN961 (gctagtagacgtggaaga, SEQIDNO.: 31). У випадку коли ампліфікувалася ДНК пустого векторного вірусу MVA, очікуваний PCR-фрагмент мав довжину 450 нуклеотидів (nt), у випадку рекомбінантного MVA ампліфікувався РrМ1, котрий мак включений кодуючий регіон включав кодуючий регіон РrМ1 вірусу тропічної лихоманки у сайті вставки IGR 148-149, фрагмент повинен був мати 1200 кbр. Результати PCR на Фіг.12а) ясно показують стабільну вставку РrМ3 в сайті вставки IGR 44-45 після 23 циклів вірусної ампліфікації. Рекомбінантний MVA все ще демонструє такі самі характеристики росту, як і MVA-BN. Він реплікується в фібробластах курячого ембріону (клітини CEF) й ослабленим росте в клітинах ссавців (Фіг.12b). 30 31 82479 32 33 82479 34 35 82479 36 37 82479 38 39 82479 40 41 82479 42 43 82479 44 45 82479 46 47 Комп’ютерна в ерстка І.Скворцов а 82479 Підписне 48 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюIntergene regions as insertion site into ankara modified vaccinia ankara (mva) virus genome
Автори англійськоюLEYRER SONJA, Leirer Sonia
Назва патенту російськоюМежгенные регионы в качестве сайтов вставки в геном модифицированного вируса коровьей оспы ankara (mva)
Автори російськоюХаули Пол, Лейрер Сонья
МПК / Мітки
МПК: C07K 14/18, A61K 31/70, C07K 14/07, C12N 15/863, C07K 14/16
Мітки: ankara, коров'ячої, вставки, міжгенні, модифікованого, вірусу, віспи, mva, геном, регіони, сайті
Код посилання
<a href="https://ua.patents.su/24-82479-mizhgenni-regioni-yak-sajjti-vstavki-v-genom-modifikovanogo-virusu-korovyacho-vispi-ankara-mva.html" target="_blank" rel="follow" title="База патентів України">Міжгенні регіони як сайти вставки в геном модифікованого вірусу коров’ячої віспи ankara (mva)</a>
Попередній патент: Покриття
Наступний патент: Застосування комбінації донепезилу та мемантину для лікування хвороби альцгеймера
Випадковий патент: Спосіб видалення речовин із ємностей, зокрема заглиблених у ґрунт