Емульсія перфторорганічних сполук медичного призначення та спосіб її отримання
Номер патенту: 85220
Опубліковано: 12.01.2009
Формула / Реферат
1. Емульсія перфторорганічних сполук медичного призначення, що містить перфторорганічну сполуку перфтордекалін або перфтороктилбромід, що швидко виводиться, перфторорганічну добавку і фосфоліпіди, яка відрізняється тим, що як компонент, що швидко виводиться, використовується композиція із перфтордекаліну і перфтороктиброміду, перфторована добавка являє собою суміш перфторованих третинних амінів, фосфоліпіди використовуються у вигляді дисперсії у водно-сольовому середовищі.
2. Емульсія за п. 1, яка відрізняється тим, що вона містить 2-40 об'ємних % перфторорганічних сполук.
3. Емульсія за п. 1, яка відрізняється тим, що композиція перфторорганічних сполук, що швидко виводяться, містить перфтордекалін і перфтороксилбромід у співвідношенні від 10:1 до 1:10.
4. Емульсія за п. 1, яка відрізняється тим, що вміст перфторорганічної добавки становить від 1 до 50 % від сумарного вмісту композиції перфторорганічних сполук, що швидко виводяться.
5. Емульсія за п. 1, яка відрізняється тим, що суміш перфторованих третинних амінів містить суміш перфтортрипропіламіну та його копродуктів: цис- і транс- ізомери перфтор-1-пропіл-2,4-диметилпіролідону і перфтор-1-пропіл-4-метилпіперидину.
6. Емульсія за будь-яким з пп. 1 і 5, яка відрізняється тим, що суміш перфторованих третинних амінів додатково містить перфтор-N-метилциклогексилпіперидин та його копродукти.
7. Емульсія за п. 1, яка відрізняється тим, що вона містить дисперсію фосфоліпідів у водно-сольовому середовищі в концентрації від 0,2 до 5 ваг. %.
8. Емульсія за п. 1, яка відрізняється тим, що дисперсія фосфоліпідів у водно-сольовому середовищі містить фосфоліпіди яєчного жовтка або фосфоліпіди сої, або їх суміш.
9. Емульсія за п. 1, яка відрізняється тим, що дисперсія фосфоліпідів у водно-сольовому середовищі містить ад'ювант рослинної олії в кількості від 1 до 1 % від сумарного вмісту фосфоліпідів.
10. Емульсія за п. 9, яка відрізняється тим, що ад'ювантом є соєва олія.
11. Емульсія за п. 9, яка відрізняється тим, що ад'ювантом є соняшникова олія.
12. Емульсія за п. 9, яка відрізняється тим, що ад'ювантом є рицинова олія.
13. Емульсія за п. 9, яка відрізняється тим, що ад'ювантом може бути суміш вказаних олій, взятих в ефективному співвідношенні у вигляді подвійної або потрійної суміші.
14. Емульсія за п. 1, яка відрізняється тим, що до складу водно-сольового середовища входять натрієві і калієві солі хлоридів і фосфатів і моносахарид манітол у воді для ін'єкцій.
15. Емульсія за п. 1, яка відрізняється тим, що концентрація компонентів водно-сольового середовища має осмотичний тиск в діапазоні від 100 до 350 мосмолів на літр.
16. Емульсія за п. 1, яка відрізняється тим, що середній діаметр частинок не перевищує 0,2 мкм і знаходиться в межах 0,06-0,2 мкм.
17. Спосіб отримання емульсії перфторорганічних сполук, що включає гомогенізацію під високим тиском, який відрізняється тим, що процес проводять в кілька етапів, що включають отримання дисперсії фосфоліпідів у водно-сольовому середовищі, теплову стерилізацію готової емульсії і наступне зберігання в незамороженому вигляді при +4 °С не менше ніж 6 місяців.
18. Спосіб отримання емульсії за п. 17, який відрізняється тим, що дисперсія фосфоліпідів у водно-сольовому середовищі отримується гомогенізацією під високим тиском, не меншим ніж 100 атмосфер, з наступною тепловою стерилізацією.
19. Спосіб отримання емульсії за п. 17, який відрізняється тим, що перфторорганічні сполуки гомогенізують в дисперсії фосфоліпідів під тиском від 300 до 650 атмосфер.
20. Спосіб отримання емульсії за п. 17, який відрізняється тим, що дисперсія фосфоліпідів стерилізується при температурі 100 °С.
21. Спосіб отримання емульсії за п. 17, який відрізняється тим, що емульсія перфторорганічних сполук стерилізується при температурі 100 °С.
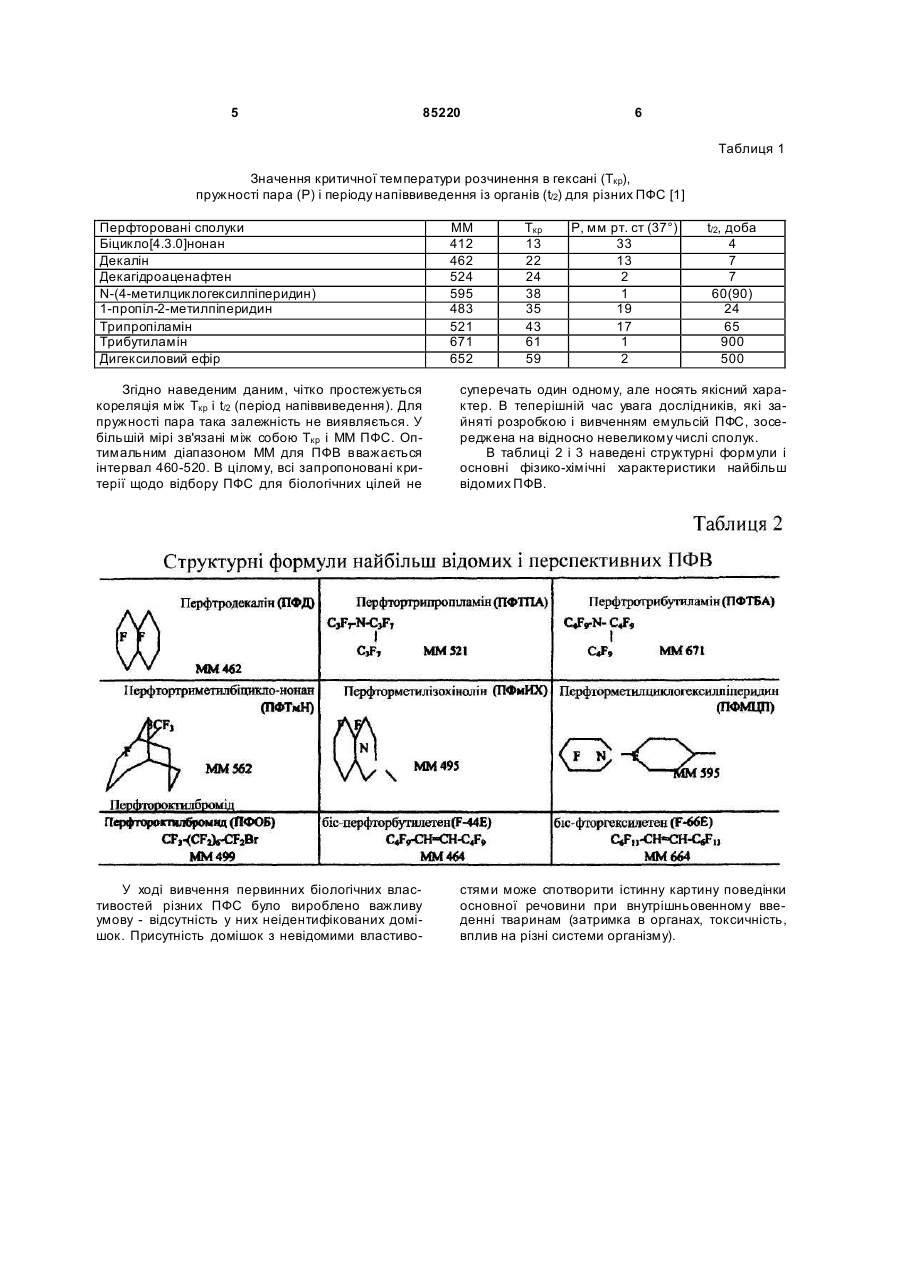
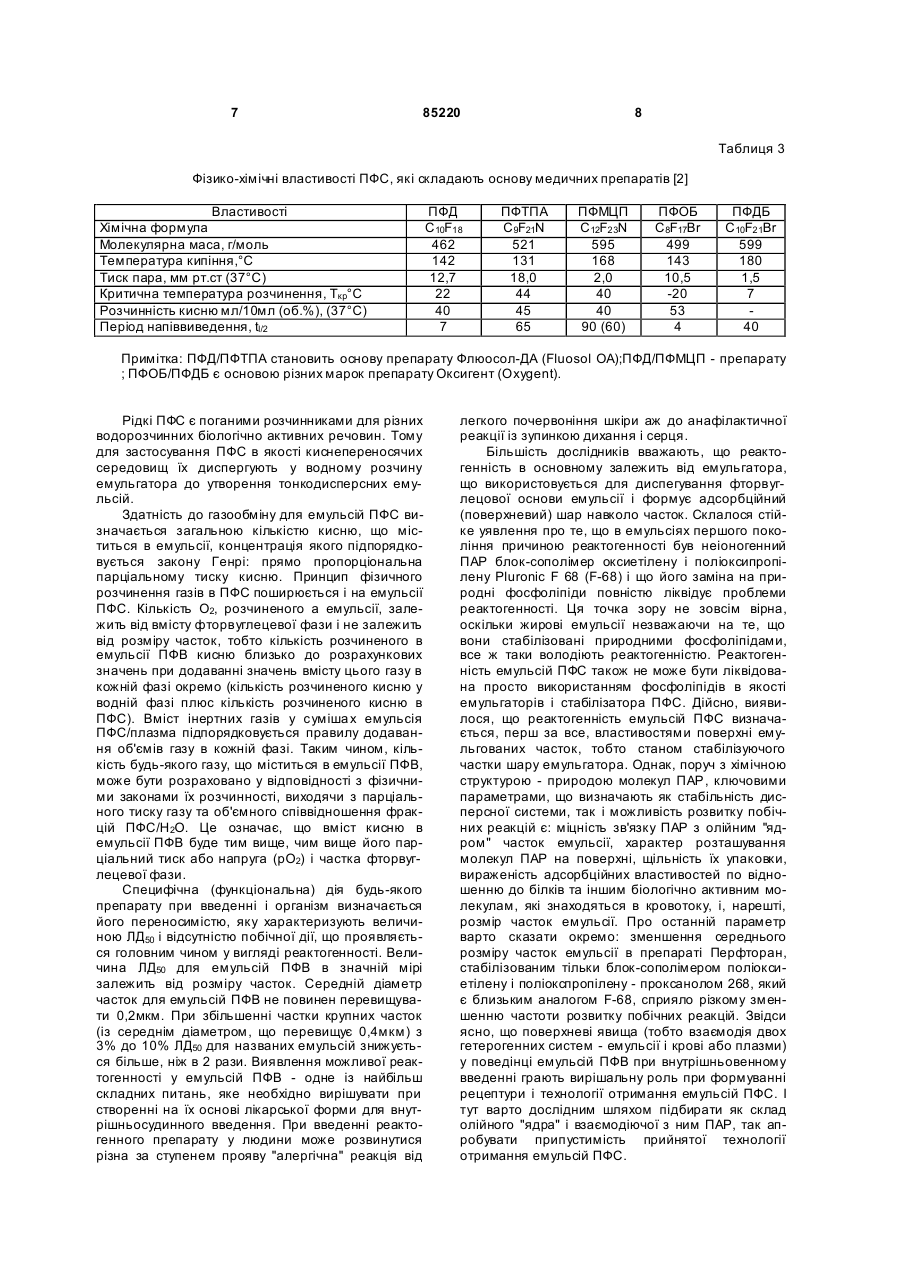
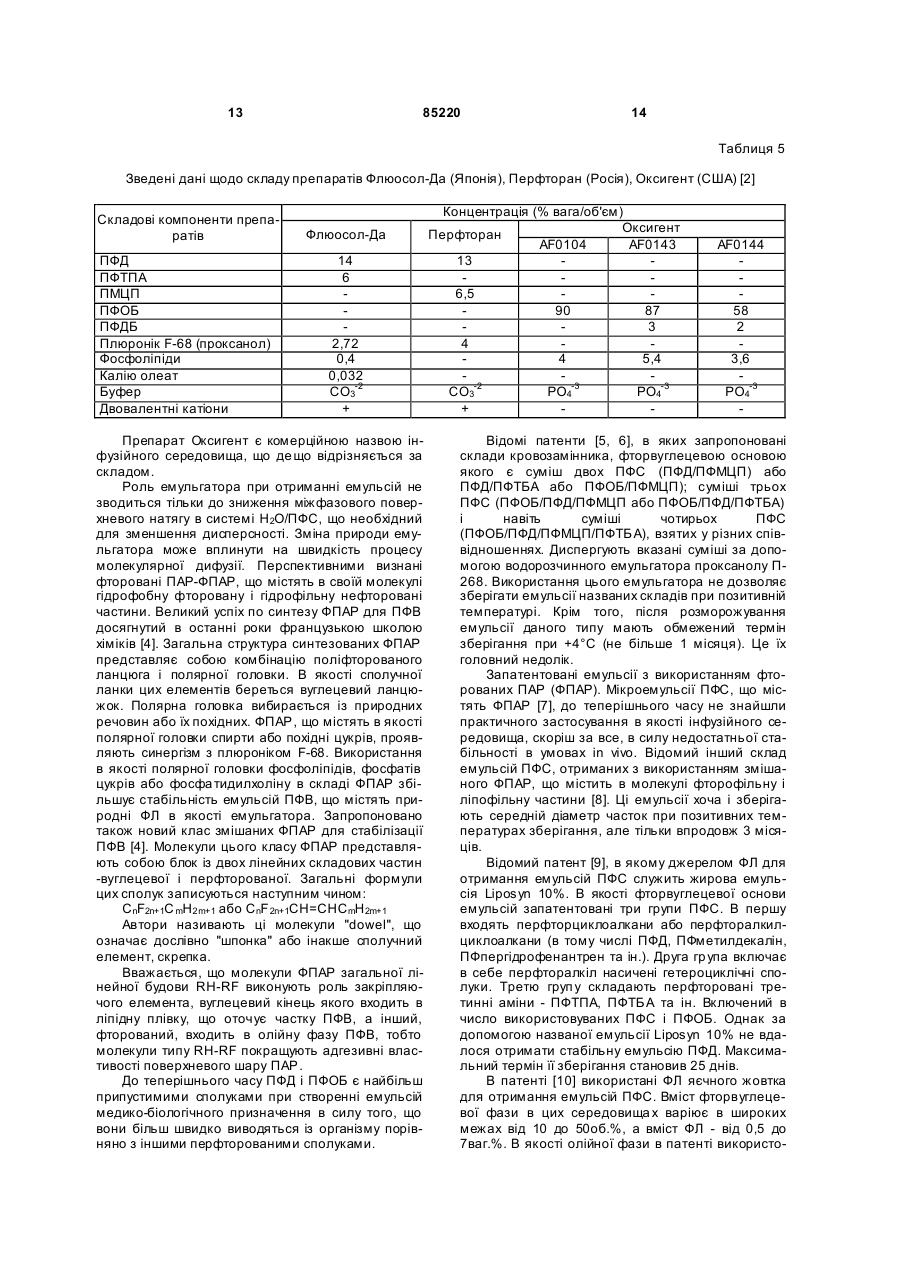
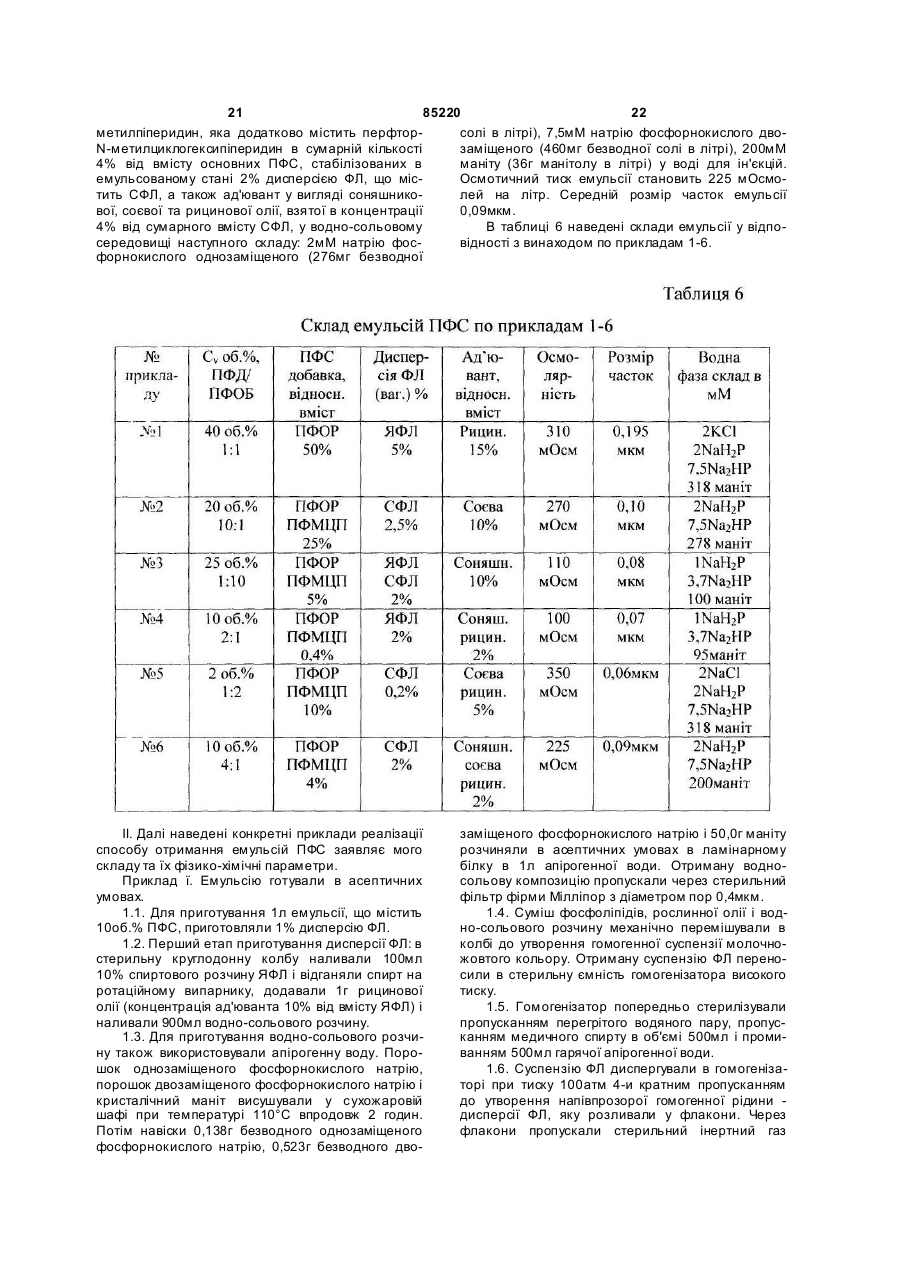
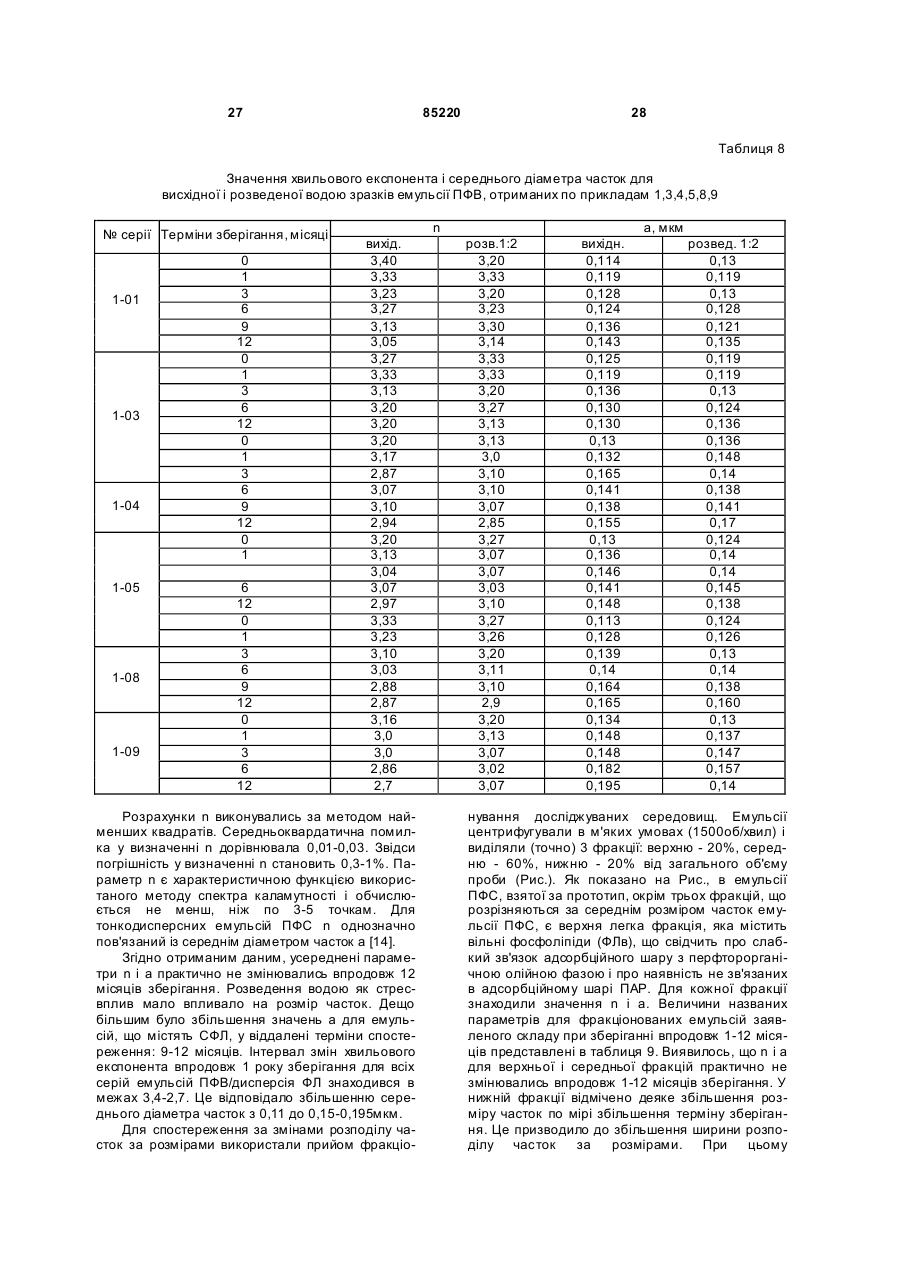
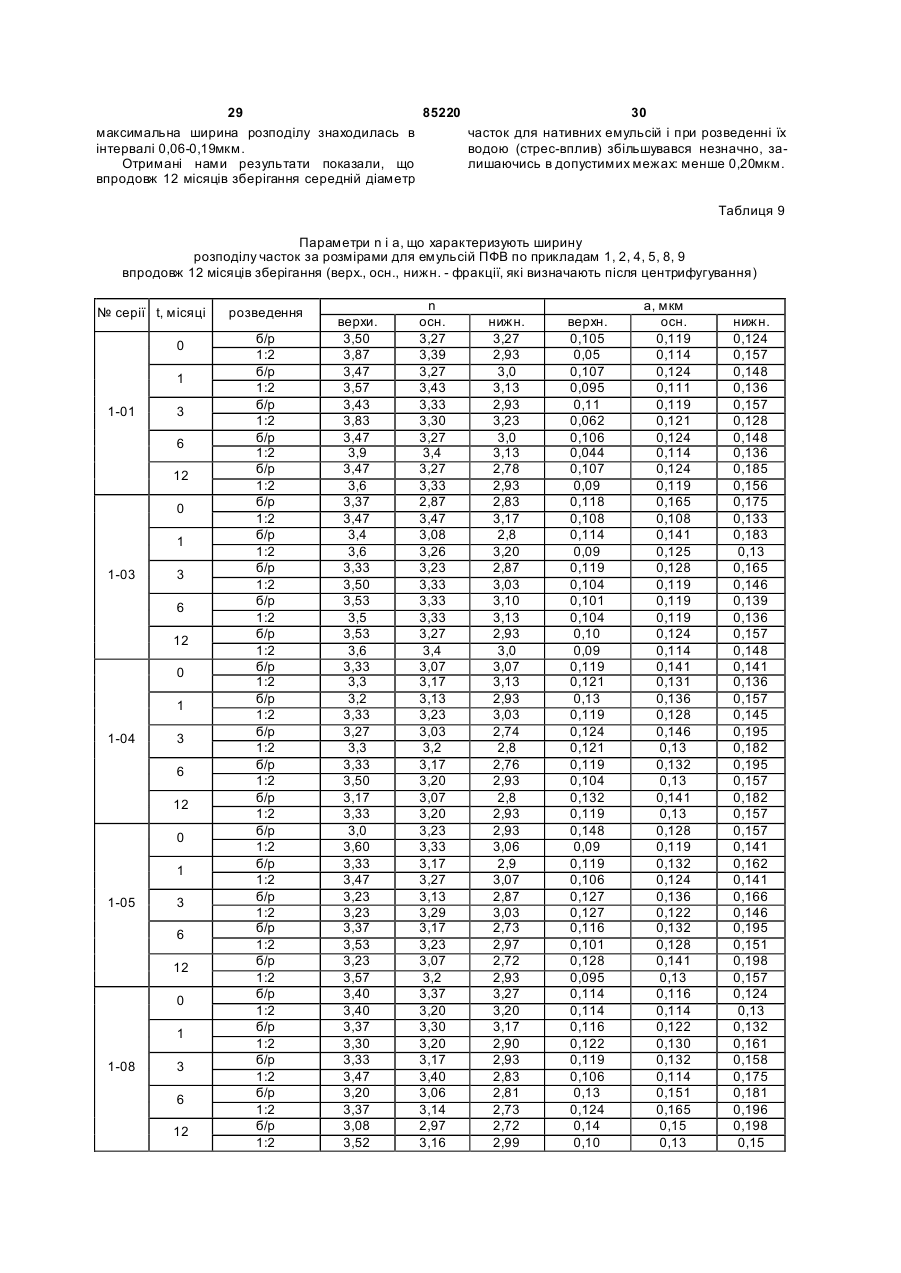
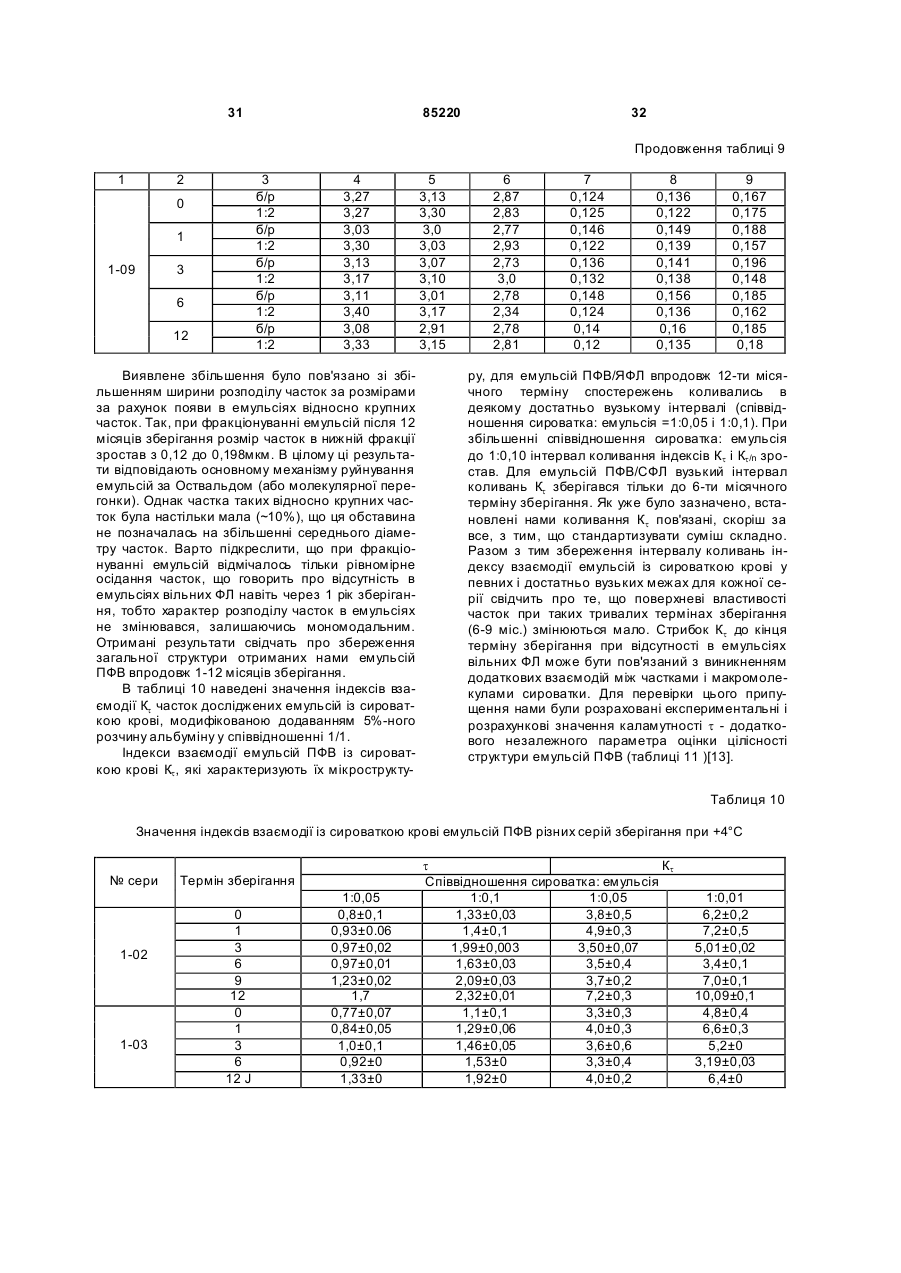
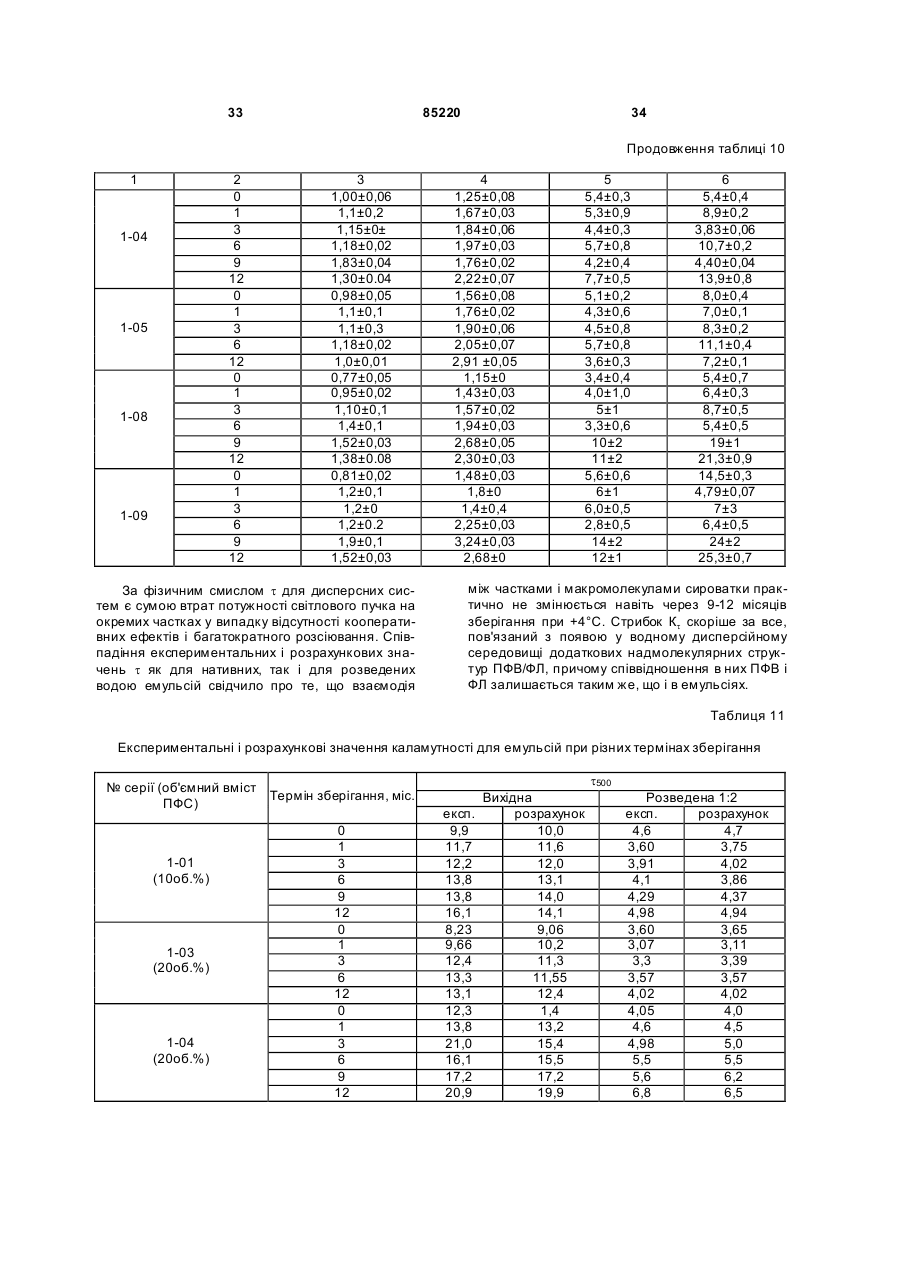
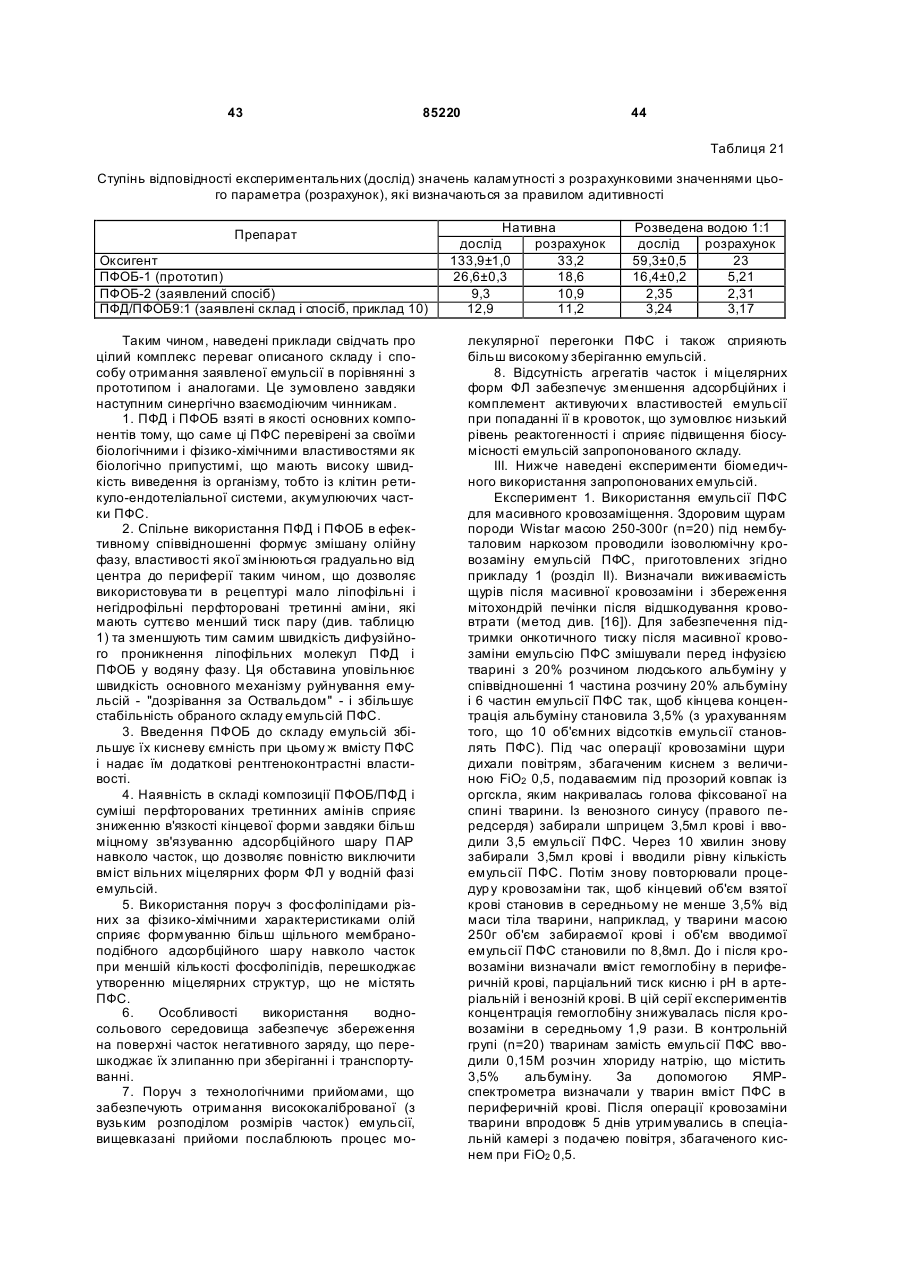
Текст
1. Емульсія перфторорганічних сполук медичного призначення, що містить перфторорганічну сполуку перфтордекалін або перфтороктилбромід, що швидко виводиться, перфторорганічну добавку і фосфоліпіди, яка відрізняється тим, що як компонент, що швидко виводиться, використовується композиція із перфтордекаліну і перфтороктиброміду, перфторована добавка являє собою суміш перфторованих третинних амінів, фосфоліпіди використовуються у вигляді дисперсії у водно-сольовому середовищі. 2. Емульсія за п. 1, яка відрізняється тим, що вона містить 2-40 об'ємних % перфторорганічних сполук. 3. Емульсія за п. 1, яка відрізняється тим, що композиція перфторорганічних сполук, що швидко виводяться, містить перфтордекалін і перфтороксилбромід у співвідношенні від 10:1 до 1:10. 4. Емульсія за п. 1, яка відрізняється тим, що вміст перфторорганічної добавки становить від 1 до 50 % від сумарного вмісту композиції перфторорганічних сполук, що швидко виводяться. 5. Емульсія за п. 1, яка відрізняється тим, що суміш перфторованих третинних амінів містить суміш перфтортрипропіламіну та його копродуктів: цис- і транс- ізомери перфтор-1-пропіл-2,4диметилпіролідону і перфтор-1-пропіл-4метилпіперидину. 2 (19) 1 3 85220 4 довищі, теплову стерилізацію готової емульсії і генізують в дисперсії фосфоліпідів під тиском від наступне зберігання в незамороженому вигляді 300 до 650 атмосфер. при +4 °С не менше ніж 6 місяців. 20. Спосіб отримання емульсії за п. 17, який відрі18. Спосіб отримання емульсії за п. 17, який відрізняється тим, що дисперсія фосфоліпідів стерилізняється тим, що дисперсія фосфоліпідів у воднозується при температурі 100 °С. сольовому середовищі отримується гомогенізаці21. Спосіб отримання емульсії за п. 17, який відрією під високим тиском, не меншим ніж 100 атмосзняється тим, що емульсія перфторорганічних фер, з наступною тепловою стерилізацією. сполук стерилізується при температурі 100 °С. 19. Спосіб отримання емульсії за п. 17, який відрізняється тим, що перфторорганічні сполуки гомо Винахід відноситься до області біофізики і медицини, зокрема до лікарських засобів, які призначені для лікування крововтрат, гіпоксичних та і шемічних станів, покращення доставки кисню кров'ю, збереження ізольованих перфузуючи х органів і тканин. Перелік умовних позначень, символів, одиниць і термінів ПАР поверхнево-активна речовина П-268, F- проксалон 268, плюронік-268 268 ПФД перфтордекалін ПФМЦП перфторметилциклогексилпіперидин ПФОБ перфтороктилбромід ПФОР перфторорганічна рідина, представляє суміш перфтортрипропіламіну та його копродуктів: цис- і трасн-ізомери перфтор-1-пропіл-3,4диметилпіролідону і перфтор-1пропіл-4-метилпіридин ПФС, ПФВ перфторвуглеводи, перфторовані сполуки ПФТБА перфтортрибутиламін ПФТБА перфтортрипропіламін (ПАФ-3) СФЛ фосфоліпіди сої ФЛ фосфоліпіди ЯФЛ фосфоліпіди яєчного жовтка n хвильовий експонент Cv об'ємний вміст фторвуглеводної фази в емульсіях ПФВ (мл/дл) a середній діаметр часток довжина хвилі l Ip індекс реактогенності Успіх розробки інфузійних середовищ, що включає в себе емульсії перфторорганічних сполук (ПФС), багато в чому залежить від фізико хімічних властивостей вибраних ПФС, фізикохімічних властивостей емульсій на їх основі і технології отримання емульсій ПФС. ПФС, які призначені для створення на їх основі медичних препаратів, представляють собою повністю фторовані органічні сполуки різних класів. За зовнішнім видом це прозорі безкольорові рідини без запаху, великої щільності - приблизно в 2 рази важче за воду. Незвичайна міцність зв'язку СF (485,6кДж/моль) призводить до того, що міжмолекулярні сили у цих сполук дуже слабкі. Проявом слабких міжмолекулярних сил в ПФВ є їх аномально висока здатність розчинювати гази, в тому числі і гази крові. Завдяки міцності зв'язку C-F, ПФС характеризуються хімічною інертністю. ПФС погано розчиняються в Н2О і не піддаються метаболізму в організмі. Хімічна інертність ПФС не означає інертності біологічної. ПФВ, введені внутрішньовенно у вигляді емульсій, затримуються в органах і тканинах, причому час перебування в органах залежить від природи ПФС і дози вводимої емульсії. Вивчення біологічних властивостей ПФС різних класів показали, що швидкість виведення із органів залежить від ряду пов'язаних між собою фізико-хімічних параметрів цих сполук: структури і молекулярної маси, температури кипіння і пружності пара, а також критичної температури розчинення ПФВ в гексані (Ткр). Ткр - це температура, при якій змішуються один з одним рівні об'єми досліджуваної сполуки і гексану. Ткр розглядають як захід відносної розчинності ПФВ в ліпідах, яка характеризує швидкість їх проходження через мембрани. Чим нижче Ткр, тим краще сполука розчинна в ліпідах і тим вона швидше виводиться із організму. В таблиці 1 наведені значення фізикохімічних параметрів, що використовуються в якості критерію вибору для ПФВ медичного призначення. 5 85220 6 Таблиця 1 Значення критичної температури розчинення в гексані (Ткр), пружності пара (Р) і періоду напіввиведення із органів (t/2) для різних ПФС [1] Перфторовані сполуки Біцикло[4.3.0]нонан Декалін Декагідроаценафтен N-(4-метилциклогексилпіперидин) 1-пропіл-2-метилпіперидин Трипропіламін Трибутиламін Дигексиловий ефір MM 412 462 524 595 483 521 671 652 Ткр 13 22 24 38 35 43 61 59 P, мм рт. ст (37°) 33 13 2 1 19 17 1 2 t/2, доба 4 7 7 60(90) 24 65 900 500 Згідно наведеним даним, чітко простежується кореляція між Ткр і t/2 (період напіввиведення). Для пружності пара така залежність не виявляється. У більшій мірі зв'язані між собою Ткр і ММ ПФС. Оптимальним діапазоном MM для ПФВ вважається інтервал 460-520. В цілому, всі запропоновані критерії щодо відбору ПФС для біологічних цілей не суперечать один одному, але носять якісний характер. В теперішній час увага дослідників, які зайняті розробкою і вивченням емульсій ПФС, зосереджена на відносно невеликому числі сполук. В таблиці 2 і 3 наведені структурні формули і основні фізико-хімічні характеристики найбільш відомих ПФВ. У ході вивчення первинних біологічних властивостей різних ПФС було вироблено важливу умову - відсутність у них неідентифікованих домішок. Присутність домішок з невідомими властиво стями може спотворити істинну картину поведінки основної речовини при внутрішньовенному введенні тваринам (затримка в органах, токсичність, вплив на різні системи організму). 7 85220 8 Таблиця 3 Фізико-хімічні властивості ПФС, які складають основу медичних препаратів [2] Властивості Хімічна формула Молекулярна маса, г/моль Температура кипіння,°С Тиск пара, мм рт.ст (37°С) Критична температура розчинення, Ткр°С Розчинність кисню мл/10мл (об.%), (37°С) Період напіввиведення, tl/2 ПФД C10F18 462 142 12,7 22 40 7 ПФТПА C9F21N 521 131 18,0 44 45 65 ПФМЦП C12F23N 595 168 2,0 40 40 90 (60) ПФОБ C8F17Br 499 143 10,5 -20 53 4 ПФДБ C10F21Br 599 180 1,5 7 40 Примітка: ПФД/ПФТПА становить основу препарату Флюосол-ДА (Fluosol ОА);ПФД/ПФМЦП - препарату ; ПФОБ/ПФДБ є основою різних марок препарату Оксигент (Oxygent). Рідкі ПФС є поганими розчинниками для різних водорозчинних біологічно активних речовин. Тому для застосування ПФС в якості киснепереносячих середовищ їх диспергують у водному розчину емульгатора до утворення тонкодисперсних емульсій. Здатність до газообміну для емульсій ПФС визначається загальною кількістю кисню, що міститься в емульсії, концентрація якого підпорядковується закону Генрі: прямо пропорціональна парціальному тиску кисню. Принцип фізичного розчинення газів в ПФС поширюється і на емульсії ПФС. Кількість О2, розчиненого а емульсії, залежить від вмісту фторвуглецевої фази і не залежить від розміру часток, тобто кількість розчиненого в емульсії ПФВ кисню близько до розрахункових значень при додаванні значень вмісту цього газу в кожній фазі окремо (кількість розчиненого кисню у водній фазі плюс кількість розчиненого кисню в ПФС). Вміст інертних газів у суміша х емульсія ПФС/плазма підпорядковується правилу додавання об'ємів газу в кожній фазі. Таким чином, кількість будь-якого газу, що міститься в емульсії ПФВ, може бути розраховано у відповідності з фізичними законами їх розчинності, виходячи з парціального тиску газу та об'ємного співвідношення фракцій ПФС/Н2О. Це означає, що вміст кисню в емульсії ПФВ буде тим вище, чим вище його парціальний тиск або напруга (рO2) і частка фторвуглецевої фази. Специфічна (функціональна) дія будь-якого препарату при введенні і організм визначається його переносимістю, яку характеризують величиною ЛД50 і відсутністю побічної дії, що проявляється головним чином у вигляді реактогенності. Величина ЛД50 для емульсій ПФВ в значній мірі залежить від розміру часток. Середній діаметр часток для емульсій ПФВ не повинен перевищувати 0,2мкм. При збільшенні частки крупних часток (із середнім діаметром, що перевищує 0,4мкм) з 3% до 10% ЛД50 для названих емульсій знижується більше, ніж в 2 рази. Виявлення можливої реактогенності у емульсій ПФВ - одне із найбільш складних питань, яке необхідно вирішувати при створенні на їх основі лікарської форми для внутрішньосудинного введення. При введенні реактогенного препарату у людини може розвинутися різна за ступенем прояву "алергічна" реакція від легкого почервоніння шкіри аж до анафілактичної реакції із зупинкою дихання і серця. Більшість дослідників вважають, що реактогенність в основному залежить від емульгатора, що використовується для диспегування фторвуглецової основи емульсії і формує адсорбційний (поверхневий) шар навколо часток. Склалося стійке уявлення про те, що в емульсіях першого покоління причиною реактогенності був неіоногенний ПАР блок-сополімер оксиетілену і поліоксипропілену Pluronic F 68 (F-68) і що його заміна на природні фосфоліпіди повністю ліквідує проблеми реактогенності. Ця точка зору не зовсім вірна, оскільки жирові емульсії незважаючи на те, що вони стабілізовані природними фосфоліпідами, все ж таки володіють реактогенністю. Реактогенність емульсій ПФС також не може бути ліквідована просто використанням фосфоліпідів в якості емульгаторів і стабілізатора ПФС. Дійсно, виявилося, що реактогенність емульсій ПФС визначається, перш за все, властивостями поверхні емульгованих часток, тобто станом стабілізуючого частки шару емульгатора. Однак, поруч з хімічною структурою - природою молекул ПАР, ключовими параметрами, що визначають як стабільність дисперсної системи, так і можливість розвитку побічних реакцій є: міцність зв'язку ПАР з олійним "ядром" часток емульсії, характер розташування молекул ПАР на поверхні, щільність їх упаковки, вираженість адсорбційних властивостей по відношенню до білків та іншим біологічно активним молекулам, які знаходяться в кровотоку, і, нарешті, розмір часток емульсії. Про останній параметр варто сказати окремо: зменшення середнього розміру часток емульсії в препараті Перфторан, стабілізованим тільки блок-сополімером поліоксиетілену і поліокспропілену - проксанолом 268, який є близьким аналогом F-68, сприяло різкому зменшенню частоти розвитку побічних реакцій. Звідси ясно, що поверхневі явища (тобто взаємодія двох гетерогенних систем - емульсії і крові або плазми) у поведінці емульсій ПФВ при внутрішньовенному введенні грають вирішальну роль при формуванні рецептури і технології отримання емульсій ПФС. І тут варто дослідним шляхом підбирати як склад олійного "ядра" і взаємодіючої з ним ПАР, так апробувати припустимість прийнятої технології отримання емульсій ПФС. 9 85220 10 При розробці представленої в даному винахоЕмульсія з таким вмістом не F¯ не придатна ні для ді емульсії ПФС медичного призначення і способу відшкодування крововтрати, ні для збереження її отримання ми дослідили кожну рецептуру і елеперфузованих органів, її слід очищати від надлишмент технології по біологічному ефекту за допомокової кількості F¯ за допомогою пропускання через гою анімаційної моделі. Відомо, що у кролів одним іонообмінну смолу. Другим недоліком емульсій із еквівалентів реактогенної реакції на введенні ПФС, отриманих за допомогою ультразвукового емульсій ПФС є різке падіння вмісту нейтрофільдиспергування є надзвичайно широка величина них лейкоцитів в периферийній крові В експеримедисперсії: при середньому розмірі часток 0,1мкм нті при оцінці можливої реактогенності емульсій може зустрічатися значна доля часток з розміром ПФС використовується показник, який називається більше 0,4мкм і часток з розміром менше 0,01мкм. індекс реактогенності Ір, який визначається за наМе ханічне диспергування за рахунок струшуступною формулою: Ір=Ск/Со , де Ск і Co кількість вання або енергічного перемішування дозволяє нейтрофілів у відсотках до вихідного рівня в контотримати тільки грубодисперсійні емульсії ПФС з рольній і дослідній групах тварин. Якщо величина неприпустимим для біомедичного використання Ір через 5 і 20 хвилин після введення препарату не розміром: більше мм. Для отримання тонкодиспеперевищує 3, то ймовірність реактогенності мінірсних емульсій використовують метод видавлюмальна [3]. вання речовини дисперсної фази через тонкі отвоВідомі різні способи отримання емульсій ПФС. ри в дисперсійне середовище під великим тиском Емульсії олія-вода, до яких відносяться емульсії (метод екструзії), що призводить до розриву руПФС і фторвуглецева основа, є олійною фазою, шійної струмини рідини на краплі. Диспергування отримують із затратою енергії. Подрібнення олійвикликається градієнтом тиску і силами гідравлічної фази проводять за допомогою впливу ультраного тертя. Звичайно наробку емульсій ПФС здійсзвуку або механічним шляхом. нюють на гомогенізаторах високого тиску. ЗакріпПри ультразвуковому впливові диспергування лення досягнутого на гомогенізаторах подрібнення відбувається за рахунок зусиль різких локальних часток, тобто стабілізація емульсій, досягається за змін тиску, що розриваються, виникають внаслідок допомогою ПАР або емульгаторів. Їх стабілізуюча двох причин. По-перше, чергування локальних дія пояснюється двома причинами: по-перше, стиснень і розширень в рідині при проходженні зниженням надлишку міжфазної поверхневої енерхвилі; по-друге, вплив кавітацій, тобто утворення і гії або зниженням поверхневого натягу; по-друге, спадання порожнин, які заповнюються розчиненим утворення структурно-механічного бар'єру (адсорв рідині газом. Енергія і потужність ультразвуковобційного шару), що забезпечує стійкість часток і го впливу, необхідного для отримання субмікронперешкоджає їх контакту або злипанню. ної емульсії, такі великі, що поруч з диспергуванСеред великого числа ПАР тільки небагато хто ням призводять до розриву зв'язку C-F. У відповідає вимогам можливості їх використання результаті у водній емульсії з'являється високо для отримання препаратів, які призначені для внутоксичні концентрації іонів, порядку F¯, 3-5мМ. трішньовенного введення (таблиця 4). 11 85220 До теперішнього часу використовуються головним чином два емульгатори для отримання емульсій ПФС - проксанол-268 (плоронік -F-68) і фосфоліпіди природної сировини (яєчного жовтка, сої тощо). Структура проксанолу не відповідає характерним особливостям молекул водорозчинним ПАР, які мають полярну головку (гідрофільна частина) і неполярний хвіст (гідрофобна частина). У проксанолу два ланцюги поліокису етилену (ПОЕ) зумовлює гідрофільний характер молекул, утворюючи водневі зв'язки з молекулами Н2О. Ме тильні групи блоку поліокису пропілену (ПОПр) зумовлюють ліпофільні властивості його молекули. Співвідношення блоків ПОЕ: ПОПр для F-68 і П-268 в середньому однаково і становить 80:20. Стабілізуюча дія цих емульгаторів головним чином зумовлена захисною плівкою, що утворююється молекулами ПАР навколо часток ПФВ. При цьому поруч з ПАР, зв'язаним в адсорбційному шарі, значна частина молекул ПАР утворює різноманітні міцелярні структури у водній фазі, в тому числі вільні від ПФС. Між молекулами ПАР, що знаходяться в адсорбційному шарі і в міцелах у водній фазі, встановлюється динамічна рівновага, яка необхідна для стабілізації адсорбційного шару з одного боку, а з другого - порушує щільність упаковки молекул ПАР в адсорбційному шарі при тривалому зберіганні. Фосфоліпіди (ФЛ) представляють собою суміш сполук природного походження, загальна структура яких відображена в таблиця 4. ФЛ не розчинні у воді і одночасно не є хорошим ліпофільним агентом по відношенню до різних ПФС, хоча у біошарі часток фосфатидилхоліну (ФХ) частково розчиняються ПФД і ПФТПА. Взаємодія ФЛ і ПФС у водній фазі носить двоякий характер. Можливо заключения ПФС в ламелярні структури ФЛ і (або) утворення моношарів ФЛ, необоротно зв'язаних з поверхнею часток. Можливо існування неоднорідних часток в емульсіях ПФС/ФЛ, тобто часток, покритих захисним шаром ФЛ і вільних ФЛ. Ця неоднорідність може бути пов'язана з особливостями технологічного процесу і/або з надлишком ΦЛ по відношенню до фторвуглецевої фази. Для тонкодисперсних емульсій ПФС визначальним механізмом зниження ступеня дисперсності (укрупнення часток) є ізометрична або молекулярна перегонка речовини дисперсної фази від дрібних часток в більш крупні частки шляхом дифузії молекул ПФС через дисперсійне середовище. Цей процес називають ще дозріванням емульсії за Оствальдом або переконденсацією. Рушівною силою цього процесу є великий тиск насиченого пара над частками менших розмірів порівняно з більш крупними. В цьому випадку важливим параметром є також ступінь розчинності ПФС у водному середо 12 вищі. Запобігання переконденсації може мати вирішальне значення для збереження агрегаційної стійкості емульсій ПФВ, тобто збереження ними дисперсності і індивідуальності часток. Основні шляхи дестабілізації -молекулярна дифузія і менша значимість флокуляції або коагуляції характерні і для відносно розбавлених емульсій ПФВ, в яких вміст фторвуглецевої фази не перевищує 20% (за об'ємом), і для більш концентрованих емульсій ПФВ, в яких об'ємна фракція фторвуглецевої фази становить 50%. Відомі шляхи стабілізації ПФВ. Загальний принцип стабілізації колоїдних систем - попередження механізмів їх руйнування. Введення емульсії ПФС/ФЛ цукрів і негативно заріджених соемульгаторів (мінорних компонентів ФЛ) попереджає процес флокуляції часток за рахунок зміни просторових взаємодій молекул ПАР в адсорбційному шарі, а також і за рахунок збільшення елетростатичних сил відштовхування між частками. Зниження основного процесу руйнування емульсій ПФС, викликаного молекулярною дистрофією, досягають звично введенням у фторвуглецеву основу др угого компоненту (додаткової перфторованої сполуки) менше розчинної у воді, яка має більш високу температур у кипіння і уповільнює цей процес. Цей принцип стабілізації використано при розробці препаратів Флюозол-ДА, Перфторан і Оксигент. В таблиці 5 представлені зведені дані щодо складу і фізико-хімічних властивостей названих препаратів. У перших двох препаратів до ПФД, що становить більшу частину олійної фази, введені домішки перфторованих сполук ПФТПА і ПФМЦП, більш висококиплячих і менш розчинних у воді. В якості емульгатора використано водорозчинний плюронік F-68 з домішками ФЛ (Флюозол ДА) або його аналог проксанол-268 (Перфторан). За фізикохімічними параметрами препарати не дуже відрізняються один від одного. їх відносять до препаратів першого покоління, загальний недолік яких заключається в необхідності зберігання у замороженому стані через недостатню стабільність. У випадку препарату Оксигент до його фторвуглецевої основи - ПФОБ додано ПФДБ, який має більш високу температуру кипіння і менш розчинний у воді. Перевага препарату Оксигент, який відноситься до другого покоління, визначається можливістю зберігання його в незамороженому стані. Крім того, ПФОБ, який становить фторвуглецеву основу препарату, швидко виводиться із організму, приблизно з тією ж швидкістю, що і ПФД (tl/2~4 i 7 днів відповідно). 13 85220 14 Таблиця 5 Зведені дані щодо складу препаратів Флюосол-Да (Японія), Перфторан (Росія), Оксигент (США) [2] Складові компоненти препаратів Флюосол-Да ПФД ПФТПА ПМЦП ПФОБ ПФДБ Плюронік F-68 (проксанол) Фосфоліпіди Калію олеат Буфер Двовалентні катіони 14 6 2,72 0,4 0,032 СО3-2 + Препарат Оксигент є комерційною назвою інфузійного середовища, що де що відрізняється за складом. Роль емульгатора при отриманні емульсій не зводиться тільки до зниження міжфазового поверхневого натягу в системі Н 2О/ПФС, що необхідний для зменшення дисперсності. Зміна природи емульгатора може вплинути на швидкість процесу молекулярної дифузії. Перспективними визнані фторовані ПАР-ФПАР, що містять в своїй молекулі гідрофобну фторовану і гідрофільну нефторовані частини. Великий успіх по синтезу ФПАР для ПФВ досягнутий в останні роки французькою школою хіміків [4]. Загальна структура синтезованих ФПАР представляє собою комбінацію поліфторованого ланцюга і полярної головки. В якості сполучної ланки цих елементів береться вуглецевий ланцюжок. Полярна головка вибирається із природних речовин або їх похідних. ФПАР, що містять в якості полярної головки спирти або похідні цукрів, проявляють синергізм з плюроніком F-68. Використання в якості полярної головки фосфоліпідів, фосфатів цукрів або фосфа тидилхоліну в складі ФПАР збільшує стабільність емульсій ПФВ, що містять природні ФЛ в якості емульгатора. Запропоновано також новий клас змішаних ФПАР для стабілізації ПФВ [4]. Молекули цього класу ФПАР представляють собою блок із двох лінейних складових частин -вуглецевої і перфторованої. Загальні формули цих сполук записуються наступним чином: CnF2n+1C mH2m+1 або CnF 2n+1CH=CHCmH2m+1 Автори називають ці молекули "dowel", що означає дослівно "шпонка" або інакше сполучний елемент, скрепка. Вважається, що молекули ФПАР загальної лінейної будови RH-RF виконують роль закріпляючого елемента, вуглецевий кінець якого входить в ліпідну плівку, що оточує частку ПФВ, а інший, фторований, входить в олійну фазу ПФВ, тобто молекули типу RH-RF покращують адгезивні властивості поверхневого шару ПАР. До теперішнього часу ПФД і ПФОБ є найбільш припустимими сполуками при створенні емульсій медико-біологічного призначення в силу того, що вони більш швидко виводяться із організму порівняно з іншими перфторованими сполуками. Концентрація (% вага/об'єм) Оксигент Перфторан AF0104 AF0143 13 6,5 90 87 3 4 4 5,4 СО3-2 РО4-3 РО4-3 + AF0144 58 2 3,6 РО4-3 Відомі патенти [5, 6], в яких запропоновані склади кровозамінника, фторвуглецевою основою якого є суміш двох ПФС (ПФД/ПФМЦП) або ПФД/ПФТБА або ПФОБ/ПФМЦП); суміші трьох ПФС (ПФОБ/ПФД/ПФМЦП або ПФОБ/ПФД/ПФТБА) і навіть суміші чотирьох ПФС (ПФОБ/ПФД/ПФМЦП/ПФТБА), взятих у різних співвідношеннях. Диспергують вказані суміші за допомогою водорозчинного емульгатора проксанолу П268. Використання цього емульгатора не дозволяє зберігати емульсії названих складів при позитивній температурі. Крім того, після розморожування емульсії даного типу мають обмежений термін зберігання при +4°С (не більше 1 місяця). Це їх головний недолік. Запатентовані емульсії з використанням фторованих ПАР (ФПАР). Мікроемульсії ПФС, що містять ФПАР [7], до теперішнього часу не знайшли практичного застосування в якості інфузійного середовища, скоріш за все, в силу недостатньої стабільності в умовах in vivo. Відомий інший склад емульсій ПФС, отриманих з використанням змішаного ФПАР, що містить в молекулі фторофільну і ліпофільну частини [8]. Ці емульсії хоча і зберігають середній діаметр часток при позитивних температурах зберігання, але тільки впродовж 3 місяців. Відомий патент [9], в якому джерелом ФЛ для отримання емульсій ПФС служить жирова емульсія Liposyn 10%. В якості фторвуглецевої основи емульсій запатентовані три групи ПФС. В першу входять перфторциклоалкани або перфторалкилциклоалкани (в тому числі ПФД, ПФметилдекалін, ПФпергідрофенантрен та ін.). Друга гр упа включає в себе перфторалкіл насичені гетероциклічні сполуки. Третю груп у складають перфторовані третинні аміни - ПФТПА, ПФТБА та ін. Включений в число використовуваних ПФС і ПФОБ. Однак за допомогою названої емульсії Liposyn 10% не вдалося отримати стабільну емульсію ПФД. Максимальний термін її зберігання становив 25 днів. В патенті [10] використані ФЛ яєчного жовтка для отримання емульсій ПФС. Вміст фторвуглецевої фази в цих середовища х варіює в широких межах від 10 до 50об.%, а вміст ФЛ - від 0,5 до 7ваг.%. В якості олійної фази в патенті використо 15 85220 16 вується будь-який один ПФС, вибраний із широкоЕмульсія характеризується тим, що містить го класу сполук. Зокрема, група перфторгідрофедисперсію ΦЛ яєчного жовтка або дисперсію ФЛ нантренів з числом атомів фтор у від 1 до 24, а сої або їх суміш у водно-сольовому середовищі в також ПФД; перфторовані аміни; ПФОБ; перфторконцентрації від 0,2 до 5ваг.%. метиладамантан і перфторпергідрофенантрен. Емульсія, що характеризується тим, що дисОсновна увага в двох вищеназваних патентах персія ФЛ у водно-сольовому середовищі містить приділяється методам збереження різних органів і ад'ювант у кількості від 1 до 15% від сумарного систем з використанням отриманих емульсій змівмісту ФЛ; ад'ювантом є рослинна олія: соєва, шують з кристалоїдними розчинами і/або з онкотисоняшникова або рицинова, або їх суміш в ефекчними агентами (альбумін, гідроксиетилкрохмаль). тивному співвідношенні у вигляді подвійної або Запропоновані емульсії хоча і відносяться до емупотрійної суміші. Емульсія характеризується тим, льсій другого покоління, але мають суттєвий недощо до складу водно-сольового середовища вхолік. В обох патентах відсутні результати спостередять натрієві і калієві солі хлоридів і фосфатів і жень за стабільністю запропонованих емульсій, моносахарид манітол у воді для ін'єкцій і конценттобто збереженні розміру часток при тривалих рація компонентів водно-сольового середовища термінах зберігання (більше місяця). Патенти [9, має осмотичний тиск в діапазоні від 100 до 350 10] ми розглядаємо в якості аналогів. мосмолів на літр. Більш близькою по суті до заявляємої емульсії Емульсія характеризується тим, що середній ПФС є емульсія, запропонована в [11]. Ця емульдіаметр часток не перевищує 0,2мкм і знаходиться сія, взята нами за прототип, відноситься до числа в межах 0,06-0,2мкм. емульсій другого покоління і містить перфторовану Спосіб отримання заявленої емульсії ПФС месполуку в кількості від 40 до 50об.%, що швидко тодом гомогенізації, що характеризується тим, що виводиться і перфоровану добавку більш високо процес проводять в кілька етапів, які включають киплячої сполуки в кількості від 5 до 10об.%. В отримання дисперсії ФЛ у водно-сольовому сереякості ПФС, що швидко виводиться, використовудовищі, гомогенізування ПФС в дисперсії ФЛ, тепють ПФД або ПФОБ (основний компонент), а в лову стерилізацію готової емульсії і наступне збеякості добавки - ПФМЦП. Емульгатором служать рігання в незамороженому вигляді при +4°С не ФЛ яєчного жовтка або сої. менше 6 місяців. ПФМЦП є стабілізатором емульсії, що знижує Спосіб отримання заявленої емульсії ПФС хашвидкість процесу молекулярної дифузії (перекорактеризується тим, що дисперсію ФЛ у воднонденсації) основного компонента ПФД або ПФОБ і сольовому середовищі отримують гомогенізацію використовується при отриманні емульсій другого під високим тиском не менше 100атм з наступною складу, зокрема препарату Перфторан. Головним тепловою стерилізацією. недоліком заявленої в [11] емульсії ПФС є відносСпосіб отримання заявленої емульсії ПФС хано більший середній діаметр часток - більше рактеризується тим, що гомогенізують ПФС в дис0,2мкм. персіїФЛ під тиском від 300 до 650атм. Задачею даного винаходу є збільшення стабіСпосіб отримання заявленої емульсії ПФС хальності емульсії і покращення її якості, тобто зберактеризується тим, що дисперсію ФЛ і емульсію реження біосумісності з біологічним середовищем ПФС стерилізують при температурі 100°С. (кров'ю, плазмою або сироватковою) при збереЯк вказано вище, задачею винаходу є збільженні в незамороженому стані не менше 6-12 мішення стабільності емульсії і покращення її якості, сяців. тобто збереження біосумісності з біологічним сеДля цього запропонована емульсія ПФС мередовищем (кров'ю, плазмою або сироваткою) при дичного призначення, що містить сполуки ПФД або збереженні в незамороженому стані не менше 6ПФОБ, що швидко виводяться, перфторорганічну 12 місяців. (перфторовану ) добавку і фосфоліпід, яка харакТермін "біосумісність" включає в себе різні теризується тим, що в якості компонента, який значення і потребує уточнення стосовно емульсій швидко виводиться, використовується композиція ПФС. В цитованих вище патентах [8-11] під термііз суміші ПФД і ПФОБ, перфторована добавка ном біосумісність використовуються наступні уявпредставляє собою суміш перфторованих третинлення - відносно велика швидкість виведення із них амінів, а фосфоліпіди використовуються у виорганів вибраних ПФС; здатність зберігати тканини гляді дисперсії у водно-сольовому середовищі. і органи, через судини яких перфузується емульсія Емульсія характеризується тим, що сумарна ПФС; порівняно низька токсичність для тварин (на концентрація ПФС в емульсії знаходиться в межах рівні не менше двох об'ємів циркулюючої крові). Ці від 2 до 40об.%. уявлення не виключають один одного, але не віЕмульсія характеризується тим, що композидображає самого першого етапу - взаємодії дисція ПФС, що швидко виводяться, містить ПФД і персних часток ПФС з плазмою і кров'ю при попаПФОБ у співвідношенні від 10:1 до 1:10, перфтоданні емульсії ПФС в судинне русло. Ми рорганічна добавка становить від 1% до 50% від розглядаємо явища біосумісності, починаючи зі загального вмісту ПФС в емульсії і містить: суміш ступеня вираженості взаємодії (реагування) емуперфтортрипропіламіну та його копродуктів: цис- і льсії ПФС з біологічним середовищем (кров'ю, трасн-ізомери перфтор-1-пропіл-3,4плазмою або сироваткою). Результат цієї взаємодиметилпіролідону і перфтор-1-пропіл-4дії можна оцінити не тільки in vivo, але, перш за метилпіперидин і додатково перфтор-Nвсе, в дослідах in vitro за ступенем стабільності метилциклогексилпіперидин та його копродукти. емульсії при впливові на неї ряду чинників, що 17 85220 18 моделюють пошкодження адсорбційного шару при жати від міцності і стану поверхнево-активної резберіганні і попаданні емульсії в кровоток. човини навколо частки. Тому необхідно одночасно Якість і стабільність емульсій ПФС прийнято отримати інформацію щодо розміру часток і струкхарактеризувати, виходячи із розміру часток: сетурних змін, що мають місце в досліджуваних середній діаметр часток в емульсіях ПФВ не повинен редовищах при тих чи інши х вплива х. перевищувати 0,2-0,3мкм. Такий підхід недостатДля теоретичного опису та аналізу змін струкній для дисперсних препаратів медикотури емульсій ПФС, як основи інфузійних середобіологічного призначення, що вводяться внутрішвищ, запропоновано виділити наступні уявлення ньовенно. Це пов'язано з тим, що частки ПФВ, як [13]: чужерідний матеріал, при попаданні в судинне 1) "Загальну структур у" емульсій ПФВ та її змірусло взаємодіють з білками і молекулами інших ни. Цей аспект характеризується діаметром і розсполук, що знаходяться в плазмі, а також з клітиподілом часток за розмірами; нами крові. Загальний характер взаємодії зале2) "Мікроструктур у", яка визначається станом жить від властивостей поверхні часток. Функціонаемульгатора в оболонці, ступенем його взаємодії з льна активність (газотранспортна функція) ПФВ, взаємним розташуванням молекул ПАР, їх емульсій ПФВ також багато в чому залежить від упорядкованістю, щільністю упаковки, ступенем сумісності поверхні емульгованих часток з кров'ю і окисленості, фазовим станом структурованих моплазмою, оскільки у випадку, наприклад, активації лекул. системи комплементу на чужерідній поверхні відДо теперішнього часу всі дослідники обмежубувається запуск каскаду реакції, що викликає валися аналізом "загальної структури", що вкрай спазм судин і порушення реґіонарного кровотоку. недостатньо, оскільки стабільність емульсій, біоВарто зазначити також, що стабільність емульсій в сумісність і, зокрема, поверхневі властивості часумовах багато in vitro в чому визначається властиток і їх адсорбційна здатність визначаються "міквостями адсорбційного шару ПАР навколо часток роструктурою". (міцність, топографія поверхні та ін.). У світлі скаПредставлені в даному винаході емульсії ПФС заного питання щодо стабільності емульсій ПФВ порівнювались з прототипом і досліджувались, поне може бути вирішене тільки за допомогою звиперше, за параметрами, що характеризують зміни чайних колоїдно-хімічних методів вивчення розмі"загальної структури" в різні терміни зберігання ру часток без оцінки особливостей структури. Дуже отриманих емульсій. актуальним є розробка для цієї мети достатньо По-друге, моделювали вплив пошкоджуючих простих методів і підходів, що дозволяють отриемульсію чинників в умовах, котрі дозволяють оцімувати інформацію про розмір часток і цілісності їх нювати стан "мікроструктури" емульсії ПФВ. Зокструктури. При цьому необхідно також уточнити рема використовували "стрес-вплив" у вигляді само поняття структури стосовно емульсій ПФВ. розведення емульсії водою і визначали зміни паПрогрес у вивченні стабільності емульсій ПФВ раметрів порівняно з нативною емульсією. Розвеin vitro та in vivo пов'язаний з розширенням і подення емульсій ПФВ водою порушує рівновага, що глибленням самого поняття структури емульсій склалася, між адсорбційним шаром ПАР (оболонПФВ і розробкою методів її вивчення. Поняття кою) і молекулами ПАР в дисперсійному середостабільності будь-якого препарату або речовини вищі. Тому вона має певну передбачувану силу у визначається стійкістю його властивостей. Паравідношенні збереження стабільності метастабільметри, що використовуються для характеристики ної системи ) емульсії ПФС) або її руйнування. властивостей емульсій ПФВ, не є вичерпними хаКрім того, спостерігали зміни мікроструктури і рактеристиками їх стабільності. У наших дослідах сумісність емульсій ПФС при контакті із сироватми розширили уявлення про критерії стабільності кою крові як модельною системою (вивчення біоемульсій ПФС з урахуванням особливостей їх сумісності емульсій ПФС в дослідах in vitro). Взаєструктури. модія двох гетерогенних дисперсних систем Стабільність емульсій ПФВ прийнято оцінювасироватки крові та емульсії ПФВ - характеризує ти на підставі змін розміру часток при зберіганні. зміни поверхневих властивостей при попаданні в Такий чисто колоїдно-хімічний підхід недостатній. кровоток та зміни мікроструктури емульсій ПФВ Для емульсій ПФВ, що є основною препаратів, при зберіганні. Спостереження за динамікою "запризначених для внутрішньовенного введення, гальної структури" і "мікроструктури" проводили в велике значення набуває інформація про їх стабіодні і ті ж терміни впродовж 12 місяців зберігання льність не тільки в дослідах in vitro, але й можлиемульсій ПФВ. вість передбачати їх стабільність при циркуляції у Для виявлення відмінностей в названих парасудинному руслі. Отримання таких відомостей метрах стану при зберіганні емульсій ПФС вимаможе бути досягнуто, якщо більш чітко окреслити гались методи і підходи, які не вносили б додаткоуявлення про структур у емульсій ПФВ. Частки вих зб урень в досліджувану систему при емульсій ПФВ мають структур у дво шарової кулі, в проведенні відповідних вимірів. В якості таких буцентрі якої знаходиться ПФВ (ядро частки), а на ли вибрані, апробовані і розроблені оптичні метоповерхні шар емульгатора (оболонка) [12]. Товщиди контролю. на оболонки емульгатора мала і становить не біДля оцінки загальної структури нами був вибльше 5-10% від діаметра часток. Але все ж таки раний метод спектротурбідиметрії або метод спекповедінка емульсій ПФВ у судинному руслі (взаєтра каламутності (СК) [14]. Його ж використали для модія з білками плазми і клітинами крові, швидоцінки розподілу часток за розмірами в досліджукість виведення та ін.), а також стабільність при ваних емульсіях після їх центрифугування і фрактривалому зберіганні багато в чому будуть залеціонування. Зміни мікроструктури емульсій або 19 85220 20 поверхневих властивостей часток, викликані змідиметил піролі дону і перфтор-1-пропіл-4ною взаємозв'язків молекул ПАР в адсорбційному метилпіперидин, яка додатково містить перфторшарі навколо ПФС, оцінювали за допомогою неN-метилциклогексипіперидин в сумарній кількості 5% від вмісту основних ПФС, стабілізованих в прямого методу знаходження індексу взаємодії (Кt ) емульгованому стані 2% дисперсією ФЛ, що місдосліджуваної емульсії із сироваткою крові по відтить суміш ЯФЛ і СФЛ, а також і ад'ювант у вигляді ношенню до фізіологічного розчину: відносна касоняшникової олії, взятої в концентрації 5% від ламутність Кt =t1/t2 , де t 1 і t2 - каламутності сумісумарного вмісту ФЛ, у водно-сольовому середошей '"сироватка/емульсія" і вищі наступного складу: 1мМ натрію фосфорноки"сироватка/фізіологічний розчин" при відповідних слого однозаміщеного (138мг безводної солі в літзмінах співвідношень компонентів сумішей [15]. рі), 3,7мМ натрію фосфорнокислого Додатково для підтвердження незмінності природи двозаміщеного (230мг безводної солі в літрі), емульгованих часток ПФВ (відсутності вільних ФЛ) 100мМ маніту (18г манітолу в літрі) у воді для ін'єпроводили зіставлення експериментальних і розкцій. Осмотичний тиск емульсії становить 105 мОрахункових значень t: tрозрах=ΣΝі·tі (ΣΝі=1), де tі і Νі смолей на літр. Середній розмір часток емульсії каламутність і частка виділеної фракції; tскен. - ка0,08мкм. ламутність тієї ж проби емульсії до франціонуванСклад 4. Емульсія по прикладу 1, відрізняєтьня. ся тим, що Емульсія містить 10об.% фторвуглецеІ. Нижче наведені конкретні склади запропонової фази (Cv) у вигляді ПФД і ПФОБ, взятих у співваної емульсії ПФС у відповідності з даним винавідношенні 2:1, з перфторованою добавкою суміші ходом. перфтортрипропіламіну та його копродуктів: цис- і Склад 1. Емульсія містить 40об.% фторвуглетранс-ізомерів перфтор-1-пропіл-3,4цевої фази (Cv) у вигляді ПФД і ПФОБ, взятих у диметилпіролідону і перфтор-1-пропіл-4співвідношенні 1:1, з перфторованою добавкою у метилпіперидин, яка додатково містить перфторвигляді суміші перфтортрипропіламіну та його коN-метилциклогексипіперидин в сумарній кількості продуктів: цис- і транс-ізомерів-1-пропіл-3,40,2% від вмісту основних ПФС, стабілізованих в диметилпіролідону і перфтор-1-пропіл-4емульсованому стані 2% дисперсією ФЛ, що місметилпіперидин в кількості 50% від сумарного вмітить ЯФЛ, а також ад'ювант у вигляді соняшникосту основних ПФС, стабілізованих в емульгованової і рицинової олії, взятої в концентрації 2% від му стані 5% дисперсією ФЛ, що містить ЯФЛ і сумарного вмісту ЯФЛ, у водно-сольовому сереад'ювант у ви гляді рицинової олії, взятої в концендовищі наступного складу: 1мМ натрію фосфорнотрації 15% від сумарного вмісту ЯФЛ у воднокислого однозаміщеного (138мг безводної солі в сольовому середовищі наступного складу: 2мМ літрі), 3,7мМ натрію фосфорнокислого двозаміще(115мг в літрі) хлориду натрію, 2мМ калію фосфоного (230мг безводної солі в літрі), 90мМ маніту рнокислого однозаміщеного (310мг безводної солі (13г манітолу в літрі) у воді для ін'єкцій. Осмотичв літрі), 7,5мМ натрію фосфорнокислого двозаміний тиск емульсії становить 100 мОсмолей на літр. щеного (460мг безводної солі в літрі), 318мМ маніСередній розмір часток емульсії 0,07мкм. ту (57г манітолу в літрі) у воді для ін'єкцій. ОсмоСклад 5. Емульсія по прикладу 1, відрізняєтьтичний тиск емульсії становить 310 мОсмолей на ся тим, що Емульсія містить 2об.% фторвуглецелітр. Середній розмір часток емульсії 0,195мкм. вої фази (Cv) у вигляді ПФД і ПФОБ, взятих у співСклад 2. Емульсія по прикладу (складу 1), відвідношенні 1:2, з перфторованою добавкою суміші різняється тим, що Емульсія містить 20об.% фторперфтортрипропіламіну та його копродуктів: цис- і вуглецевої фази (Cv) у вигляді ПФД і ПФОБ, взятих транс-ізомерів перфтор-1-пропіл-3,4у співвідношенні 10:1, з перфторованою добавкою диметилпіролідону і перфтор-1-пропіл-4суміші перфтортрипропіламіну та його копродуктів: метилпіперидин, яка додатково містить перфторцисі транс-ізомерів перфтор-1-пропіл-3,4Н-метилциклогексипіперидин в сумарній кількості диметил піролі дону і перфтор-1-пропіл-410% від вмісту основних ПФС, стабілізованих в метилпіперидин, яка додатково містить перфторемульгованому стані 0,2% дисперсією ФЛ, що місN-метилциклогексипіперидин в сумарній кількості тить СФЛ, а також ад'ювант у вигляді соєвої і ри25% від вмісту основних ПФС, стабілізованих в цинової олії, взятої в концентрації 5% від сумарноемульгованому стані 2,5% дисперсією ФЛ, що місго вмісту СФЛ, у водно-сольовому середовищі тить СФЛ і ад'ювант у вигляді соєвої олії, взятої в наступного складу: 2мМ (115мг в літрі) хлориду концентрації 10% від сумарного вмісту ЯФЛ, у вонатрію, 2мМ натрію фосфорнокислого однозамідно-сольовому середовищі наступного складу: щеного (276мг безводної солі в літрі), 7,5мМ на2мМ натрію фосфорнокислого однозаміщеного трію фосфорнокислого двозаміщеного (460мг без(276мг безводної солі в літрі), 7,5мМ натрію фосводної солі в літрі), 318мМ маніту (58г манітолу в форнокислого двозаміщеного (460мг безводної літрі) у воді для ін'єкцій. Осмотичний тиск емульсії солі в літрі), 278мМ маніту (50г манітолу в літрі) у становить 350 мОсмолей на літр. Середній розмір воді для ін'єкцій. Осмотичний тиск емульсії станочасток емульсії 0,06мкм. вить 270 мОсмолей на літр. Середній розмір часСклад 6. Емульсія по прикладу 1, відрізняєтьток емульсії 0,1мкм. ся тим, що Емульсія містить 10об.% фторвуглецеСклад 3. Емульсія по прикладу 1, відрізняєтьвої фази (Cv) у вигляді ПФД і ПФОБ, взятих у співся тим, що Емульсія містить 15об.% фторвуглецевідношенні 4:1, з перфторованою добавкою суміші вої фази (Cv) у вигляді ПФД і ПФОБ, взятих у співперфтортрипропіламіну та його копродуктів: цис- і відношенні 1:10, з перфторованою добавкою транс-ізомерів перфтор-1-пропіл-3,4суміші перфтортрипропіламіну та його копродуктів: диметилпіролідону і перфтор-1-пропіл-4цисі транс-ізомерів перфтор-1-пропіл-3,4 21 85220 22 метилпіперидин, яка додатково містить перфторсолі в літрі), 7,5мМ натрію фосфорнокислого двоN-метилциклогексипіперидин в сумарній кількості заміщеного (460мг безводної солі в літрі), 200мМ 4% від вмісту основних ПФС, стабілізованих в маніту (36г манітолу в літрі) у воді для ін'єкцій. емульсованому стані 2% дисперсією ФЛ, що місОсмотичний тиск емульсії становить 225 мОсмотить СФЛ, а також ад'ювант у вигляді соняшниколей на літр. Середній розмір часток емульсії вої, соєвої та рицинової олії, взятої в концентрації 0,09мкм. 4% від сумарного вмісту СФЛ, у водно-сольовому В таблиці 6 наведені склади емульсії у відпосередовищі наступного складу: 2мМ натрію фосвідності з винаходом по прикладам 1-6. форнокислого однозаміщеного (276мг безводної II. Далі наведені конкретні приклади реалізації способу отримання емульсій ПФС заявляє мого складу та їх фізико-хімічні параметри. Приклад ї. Емульсію готували в асептичних умовах. 1.1. Для приготування 1л емульсії, що містить 10об.% ПФС, приготовляли 1% дисперсію ФЛ. 1.2. Перший етап приготування дисперсії ФЛ: в стерильну круглодонну колбу наливали 100мл 10% спиртового розчину ЯФЛ і відганяли спирт на ротаційному випарнику, додавали 1г рицинової олії (концентрація ад'юванта 10% від вмісту ЯФЛ) і наливали 900мл водно-сольового розчину. 1.3. Для приготування водно-сольового розчину також використовували апірогенну воду. Порошок однозаміщеного фосфорнокислого натрію, порошок двозаміщеного фосфорнокислого натрію і кристалічний маніт висушували у сухожаровій шафі при температурі 110°С впродовж 2 годин. Потім навіски 0,138г безводного однозаміщеного фосфорнокислого натрію, 0,523г безводного дво заміщеного фосфорнокислого натрію і 50,0г маніту розчиняли в асептичних умовах в ламінарному білку в 1л апірогенної води. Отриману водносольову композицію пропускали через стерильний фільтр фірми Мілліпор з діаметром пор 0,4мкм. 1.4. Суміш фосфоліпідів, рослинної олії і водно-сольового розчину механічно перемішували в колбі до утворення гомогенної суспензії молочножовтого кольору. Отриману суспензію ФЛ переносили в стерильну ємність гомогенізатора високого тиску. 1.5. Гомогенізатор попередньо стерилізували пропусканням перегрітого водяного пару, пропусканням медичного спирту в об'ємі 500мл і промиванням 500мл гарячої апірогенної води. 1.6. Суспензію ФЛ диспергували в гомогенізаторі при тиску 100атм 4-и кратним пропусканням до утворення напівпрозорої гомогенної рідини дисперсії ФЛ, яку розливали у флакони. Через флакони пропускали стерильний інертний газ 23 85220 24 (азот, аргон або суміш азоту з вуглекислотою) водно-сольового розчину, стр ушували, переносивпродовж 2-4 хвилин. ли в гомогенізатор, диспергували, розливали у 1.7. Флакони закривали гумовими пробками і флакони, стерилізували, як в прикладі 1. Підготовзавальцовували під обкатку алюмінієвими ковпачлювали фторвуглецеву фазу. До 160мл ПФД доками. Після цього флакони стерилізували термодавали 40мл ПФОБ, відбирали 160мл цієї компообробкою при 100°С впродовж 1 години. Флакони зиції і змішували її з 40мл ПФТПА. 200мл зберігали при кімнатній температурі до початку отриманої суміші ПФС після очистки прокапували наступного етапу отриманні емульсії ПФС. в гомогенізатор, в якому було 800мл дисперсії 1.8. Наступний етап заключався в обробці СФЛ. Отриману емульсію розливали у флакони і ПФС. Змішували 72мл ПФД з 8мл ПФОБ. До 80мл стерилізували. цієї композиції ПФС додавали 20мл ПФТПА. Склад емульсії: Cv=20об.%, співвідношення Отриману композицію суміші ПФД і ПФОБ з ПФС ПФД/ПФОБ=8/2, відносний вміст ПФТПА - 20%, добавкою змішували з рівним об'ємом спирту меконцентрація СФЛ дорівнювала 2ваг.%, відносний дичного. Перфторвуглецеву фазу як більш важку вміст ад'юванта (суміш двох олій - олія сої/олія відділяли від спирту на ділильну лійку (питома рицинова у співвідношенні ½) становить 15%. Севага ПФС майже в два рази перевищує питому рія 3. вагу води). Приклад 4. Емульсію отримували, як в при1.9. Далі отримували емульсію. В робочу ємкладі 1, за виключенням того, що співвідношення ність гомогенізатора вносили 900мл дисперсії ФЛ і компонентів в композиції ПФД/ПФОБ також було 100мл обробленої суміші ПФС (композицію тим же самим і дорівнювало 8/2. До 170мл цієї ПФД/ПФОБ-9/1+ПФТПА - 20%), весь вміст робочої композиції додавали 30мл ПФМЦП, перемішували ємності механічно переміщували і піддавали дисструшуванням, очищали стандартним чином і пропергуванню під тиском 500атм, пропускаючи весь капували в гомогенізатор, де було 800мл дисперсії об'єм 8 разів через камеру високого тиску, до СФЛ (отриманої, як в прикладі 3), що містила той утворення напівпрозорої опалесцюючої жовтуватої же ад'ювант - суміш двох олій: олія сої/олія рицирідини - субмікробної емульсії ПФС. Емульсію нова у співвідношенні ½ в кількості 15% від вмісту розливали у флакони по 100мл, закривали гумоСФЛ. Емульсію диспергували під тиском 400атм. вими пробками і завальцьовували алюмінієвими Склад емульсії: Cv=20об.%, співвідношення ковпачками. ПФД/ПФОБ=8/2; відносний вміст ПФМЦП - 15%; 1.10. Флакони з емульсією ПФС стерилізували концентрація СФЛ дорівнювала 2ваг.%, відносний нагріванням при 100°С впродовж 1 години, охоловміст ад'юванта (суміші двох олій: олія сої/олія джували і зберігали при 4°С протягом року. рицинова у співвідношенні ½) в дисперсії СФЛ Склад отриманої емульсії: вміст фторвуглецестановить 15%. Серія 4. вої фази (Cv) дорівнює 10об.%, співвідношення Приклад 5. Емульсію отримували, як в приПФД/ПФОБ дорівнює 9/1, відносна кількість кладі 1, за виключенням того, що використовували ПФТПА у суміші ПФС становить 20%, концентрація іншу кількість ЯФЛ для отримання дисперсії ФЛ. ЯФЛ - 1ваг.%, концентрація рицинової олії - 0,1% 50мл спиртового розчину ЯФЛ помістили в кругло(відносна кількість рицинової олії як ад'юванта у донну колбу, відганяли спирт на ротаційному висуспензії дорівнює 10% від сумарного вмісту ЯФЛ. парнику, помістили туди 0,6г соняшникової олії, Серія 1. додавали 0,95л сольового розчину, перемішували Визначали в'язкість цієї серії у віскозиметрі струшуванням і гомогенізували при тиску 150атм. ВПЖ-2. Її величина становила 0,953спз. Для поріКомпозицію ПФД/ПФОБ у співвідношенні 5/5 готувняння в'язкість препарату Перфторан з тим же вали змішуванням 25 ПФД з 25мл ПФОБ. 49,5мл вмістом фторвуглецевої фази становить 2,5спз. цієї суміші змішували з 0,5мл ПФТПА. Приготовані Приклад 2. Емульсію ПФС готували, як описа50мл суміші ПФС, після очистки прокапували в но в прикладі 1, ідентичного складу. Тільки в якості гомогенізатор, куди попередньо було залито 0,95м ад'юванта до ЯФЛ брали суміш двох олій: рициносуспензії ЯФЛ. Гомогенізацію попередньої грубої вої і олії сої у співвідношенні 1/1. Склад Cv дисперсії здійснювали при тиску 350атм. Розлив і 10об.%, співвідношення ПФД/ПФОБ дорівнює 9/1, стерилізацію тонкодисперсної емульсії проводили відносний вміст ПФТПА становить 20%, концентзгідно вказаним правилам. рація ЯФЛ - 1ваг.%, відносний вміст ад'юванта Склад отриманої емульсії: Cv=5об.%, співвідсуміші двох олій (рицинова олія/соєва олія=1/1) ношення ПФД/ПФОБ=5/5, відносний вміст ПФТПА становить 10%. Серія 2. становить 1%; концентрація ЯФЛ дорівнювала Приклад 3. Емульсію ПФС готували, як описа0,5ваг.%; відносний вміст соняшникової олії, взятої но в прикладі 1, але в об'ємі 800мл і вмістом в якості ад'юванта, становить 12%. Серія 5. 20об.% ПФС, ідентичного прикладу 1 складу. В Приклад 6. 50мл 10% спиртового розчину СФЛ круглодонну колбу вносили 200мл 10% спиртового помістили в круглодонну колбу, відігнали спирт за розчину рицинових ФЛ (СФЛ). Спирт відганяли на описаною методикою, помістили туди 0,6г рициноротаційному випарнику, додавали в колбу ад'ювої олії, додали 950мл сольового розчину, після вант - суміш соєва олія / рицинова олія у співвідпереміщування перенесли в гомогенізатор для ношенні ½ - в сумарній кількості 3г, що становило отримання дисперсії при тиску 180атм. Після сте15% від загальної кількості СФЛ. Водно-сольовий рилізації її використали для отримання емульсії. розчин містив 0,276г безводного однозаміщеного Композицію ПФД/ПФОБ (співвідношення 5/5) фосфорнокислого натрію, 1,046г безводного двоотримували змішуванням 25мл ПФД з 25мл ПФОБ. заміщенного фосфорнокислого натрію і 10,0г маніДо 49,5мл цієї композиції додали 0,5мл ПФМЦП. ту. В колбу, що містить СФЛ і ад'ювант, вносили 1л Після очистки спиртом 50мл отриманої суміші про 25 85220 26 капали її в гомогенізатор, в якому було 950мл диснізаторі при 200атм до утворення однорідного сеперсії СФЛ. Гомогенізацію проводили, як було вкаредовища жовтува то-білого кольору. Стерилізувазано раніше, в два етапи. Спочатку при тиску ли його як було вказано раніше. 200атм, а потім при тиску 500атм. Композицію ПФС готували змішуванням 40мл Склад отриманої емульсії: Cv=5об.%; співвідПФД з 360мл ПФОБ (співвідношення компонентів ношення ПФД/ПФОБ=5/5; відносний вміст ПФМЦП 1/9). До 360мл цієї композиції додавали 40мл становив 1%; концентрація СФЛ дорівнює ПФМЦП. Отримані 400мл 3-й компонентної суміші 0,5ваг.%; відносний вміст рицинової олії, взятої в ПФС прокапували в гомогенізатор, де знаходилось якості ад'юванта, становить 12%. Серія 6. 600мл отриманої суспензії ЯФЛ. Гомогенізацію Приклад 7. Готували суспензію з концентраціпроводили в два етапи: на першому - при тиску єю СФЛ, що дорівнює 0,2ваг.%. Для цього 20мл 250атм, на другому - при тиску 600атм. Розливали спиртового розчину СФЛ помістили в ротаційний і стерилізували емульсію у відповідності з прийнявипарник, відігнали спирт, помістили туди 0,02г в тою методикою. якості ад'юванта суміш двох олій соняшникової і Склад отриманої емульсії: Cv=40об.%; співвідрицинової у співвідношенні 1/1. Додали в колбу ношення ПФД/ПФОБ=1/9; відносна кількість доба980мл сольового розчину. Диспергування і стеривки ПФМЦП становить 10%; концентрація ЯФЛ в лізацію здійснювали як вказано в прикладі 6. емульсії (у вигляді суспензії) становить 5ваг.%; Композицію ПФД/ПФОБ отримали змішуванвідносний вміст ад'юванта - рицинової олії - дорівням 5мл ПФД і 16мл ПФОБ (співвідношення комнював 5%. Серія 8. понентів 2/8). До 19мл отриманої суміші ПФС доПриклад 9. Фторвуглецеву фазу емульсії готудали 1мл ПФМЦП. 20мл 3-й компонентної суміші, вали змішуванням 40мл ПФД з 360мл ПФОБ. До що утворилась, прокапували в гомогенізатор, в 320мл цієї композиції додавали 80мл суміші, що який попередньо було залито 980мл суспензії містить 40мл ПФМЦП і 40мл ПФОР. Суспензія СФЛ. Процес диспергування проводили так, як емульгатора містила 4,2ваг.% ЯФЛ, 4,2ваг.% СФЛ і вказано в попередньому прикладі, розливання і ад'ювант - суміш рицинової і соняшникової олій - у стерилізацію емульсії, що утворилася, здійснюваспіввідношенні 9/1 в кількості 4,2г, тобто 5% від ли за стандартною методикою. сумарного вмісту ЯФЛ. Склад отриманої емульсії: Cv=2об.%; співвідДля отримання емульсії в гомогенізатор залиношення ПФД/ПФОБ становить 2/8; відносний вали 600мл отриманої суспензії і прокапували в вміст ПФМЦП дорівнював 5%; концентрація СФЛ гомогенізатор 400мл 3-й компонентної суміші ПФС становить 0,2ваг.%; відносна кількість ад'юванта вищевказаного складу. Процеси гомогенізації, суміш соняшникової і соєвої олій у співвідношенні розливу і стерилізації здійснювали так, як і в попе1/1 - дорівнювала 1%. Серія 7. редньому прикладі. Приклад 8. Для отримання емульсії, що місСклад емульсії: Cv=40об.%; співвідношення тить 40об.%, приготовляли суспензію ЯФЛ в конПФД/ПФОБ=1/9; відносний вміст суміші ПФМЦП з центрації 5ваг.%. Для цього 500мл спиртового ПФОР становить 20%; концентрація ФЛ (суміш розчину ЯФЛ помішували в круглодонну колбу, ЯФЛ і СФЛ 1:1) в емульсії 5ваг.%; вміст ад'юванта відганяли спирт, вносили в неї 2,5г рицинової олії - 0,25% (суміш двох олій рицинової і соняшникової в якості ад'юванта, наливали в неї 600мл соєвого у співвідношенні 9/1). Серія 9. розчину, перемішували і диспергували на гомогеТаблиця 7 Склад отриманих емульсій ПФС, різних серій (приклади 1-9) № серії Cv об.% Співвідношення ПФД/ПФОБ №1 10 9/1 №2 10 9/ №3 20 8/2 №4, 20 8/2 №5 5 5/5 №6 5 5/5 №7 2 2/8 №8 40 1/9 №9 сій. 40 1/9 ПФС добавка, від- ФЛ (ваг.)% носний вміст ПФОР 20% ЯФЛ 1% ПФОР 20% ЯФЛ 1% ПФОР 20% СФЛ 2% ПФМЦП 15% СФЛ 2% ПФОР 1% ЯФЛ 0,5% ПФМЦП 1% СФЛ 0,5% ПФМЦП 5% СФЛ 0,2% ПФМЦП 10% ЯФЛ 5% ПФОР 10% ЯФЛ 2,5% ПФМЦП 10% СФЛ 2,5% В таблиці 7 наведено склад всіх серій емуль Далі в табличній формі (табл.8) наведені результати спостережень за змінами середнього рицин. рицин./сої 1/1 рицин./сої 2/1 рицин./сої 2/1 соняшн. сої сої/соняшн.1/1 рицин./соняшн .9/1 Ад'ювант віднос. вміст. % 10 10 15 15 12 12 1 5 рицин./соняшн.9/1 5 Вид ад'ювантів діаметра часток для нативної (нерозведеної) і розведеної водою емульсій в різні ПФС в різні терміни зберігання. 27 85220 28 Таблиця 8 Значення хвильового експонента і середнього діаметра часток для висхідної і розведеної водою зразків емульсії ПФВ, отриманих по прикладам 1,3,4,5,8,9 № серії Терміни зберігання, місяці 1-01 1-03 1-04 1-05 1-08 1-09 0 1 3 6 9 12 0 1 3 6 12 0 1 3 6 9 12 0 1 6 12 0 1 3 6 9 12 0 1 3 6 12 n вихід. 3,40 3,33 3,23 3,27 3,13 3,05 3,27 3,33 3,13 3,20 3,20 3,20 3,17 2,87 3,07 3,10 2,94 3,20 3,13 3,04 3,07 2,97 3,33 3,23 3,10 3,03 2,88 2,87 3,16 3,0 3,0 2,86 2,7 Розрахунки n виконувались за методом найменших квадратів. Середньоквардатична помилкау визначенні n дорівнювала 0,01-0,03. Звідси погрішність у визначенні n становить 0,3-1%. Параметр n є характеристичною функцією використаного методу спектра каламутності і обчислюється не менш, ніж по 3-5 точкам. Для тонкодисперсних емульсій ПФС n однозначно пов'язаний із середнім діаметром часток a [14]. Згідно отриманим даним, усереднені параметри n і а практично не змінювались впродовж 12 місяців зберігання. Розведення водою як стресвплив мало впливало на розмір часток. Дещо більшим було збільшення значень а для емульсій, що містять СФЛ, у віддалені терміни спостереження: 9-12 місяців. Інтервал змін хвильового експонента впродовж 1 року зберігання для всіх серій емульсій ПФВ/дисперсія ФЛ знаходився в межах 3,4-2,7. Це відповідало збільшенню середнього діаметра часток з 0,11 до 0,15-0,195мкм. Для спостереження за змінами розподілу часток за розмірами використали прийом фракціо a, мкм розв.1:2 3,20 3,33 3,20 3,23 3,30 3,14 3,33 3,33 3,20 3,27 3,13 3,13 3,0 3,10 3,10 3,07 2,85 3,27 3,07 3,07 3,03 3,10 3,27 3,26 3,20 3,11 3,10 2,9 3,20 3,13 3,07 3,02 3,07 вихідн. 0,114 0,119 0,128 0,124 0,136 0,143 0,125 0,119 0,136 0,130 0,130 0,13 0,132 0,165 0,141 0,138 0,155 0,13 0,136 0,146 0,141 0,148 0,113 0,128 0,139 0,14 0,164 0,165 0,134 0,148 0,148 0,182 0,195 розвед. 1:2 0,13 0,119 0,13 0,128 0,121 0,135 0,119 0,119 0,13 0,124 0,136 0,136 0,148 0,14 0,138 0,141 0,17 0,124 0,14 0,14 0,145 0,138 0,124 0,126 0,13 0,14 0,138 0,160 0,13 0,137 0,147 0,157 0,14 нування досліджуваних середовищ. Емульсії центрифугували в м'яких умовах (1500об/хвил) і виділяли (точно) 3 фракції: верхню - 20%, середню - 60%, нижню - 20% від загального об'єму проби (Рис.). Як показано на Рис., в емульсії ПФС, взятої за прототип, окрім трьох фракцій, що розрізняються за середнім розміром часток емульсії ПФС, є верхня легка фракція, яка містить вільні фосфоліпіди (ФЛв), що свідчить про слабкий зв'язок адсорбційного шару з перфторорганічною олійною фазою і про наявність не зв'язаних в адсорбційному шарі ПАР. Для кожної фракції знаходили значення n і а. Величини названих параметрів для фракціонованих емульсій заявленого складу при зберіганні впродовж 1-12 місяців представлені в таблиця 9. Виявилось, що n і а для верхньої і середньої фракцій практично не змінювались впродовж 1-12 місяців зберігання. У нижній фракції відмічено деяке збільшення розміру часток по мірі збільшення терміну зберігання. Це призводило до збільшення ширини розподілу часток за розмірами. При цьому 29 85220 30 максимальна ширина розподілу знаходилась в часток для нативних емульсій і при розведенні їх інтервалі 0,06-0,19мкм. водою (стрес-вплив) збільшувався незначно, заОтримані нами результати показали, що лишаючись в допустимих межах: менше 0,20мкм. впродовж 12 місяців зберігання середній діаметр Таблиця 9 Параметри n і a, що характеризують ширину розподілу часток за розмірами для емульсій ПФВ по прикладам 1, 2, 4, 5, 8, 9 впродовж 12 місяців зберігання (верх., осн., нижн. - фракції, які визначають після центрифугування) № серії t, місяці 0 1 1-01 3 6 12 0 1 1-03 3 6 12 0 1 1-04 3 6 12 0 1 1-05 3 6 12 0 1 1-08 3 6 12 розведення б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 верхи. 3,50 3,87 3,47 3,57 3,43 3,83 3,47 3,9 3,47 3,6 3,37 3,47 3,4 3,6 3,33 3,50 3,53 3,5 3,53 3,6 3,33 3,3 3,2 3,33 3,27 3,3 3,33 3,50 3,17 3,33 3,0 3,60 3,33 3,47 3,23 3,23 3,37 3,53 3,23 3,57 3,40 3,40 3,37 3,30 3,33 3,47 3,20 3,37 3,08 3,52 n осн. 3,27 3,39 3,27 3,43 3,33 3,30 3,27 3,4 3,27 3,33 2,87 3,47 3,08 3,26 3,23 3,33 3,33 3,33 3,27 3,4 3,07 3,17 3,13 3,23 3,03 3,2 3,17 3,20 3,07 3,20 3,23 3,33 3,17 3,27 3,13 3,29 3,17 3,23 3,07 3,2 3,37 3,20 3,30 3,20 3,17 3,40 3,06 3,14 2,97 3,16 нижн. 3,27 2,93 3,0 3,13 2,93 3,23 3,0 3,13 2,78 2,93 2,83 3,17 2,8 3,20 2,87 3,03 3,10 3,13 2,93 3,0 3,07 3,13 2,93 3,03 2,74 2,8 2,76 2,93 2,8 2,93 2,93 3,06 2,9 3,07 2,87 3,03 2,73 2,97 2,72 2,93 3,27 3,20 3,17 2,90 2,93 2,83 2,81 2,73 2,72 2,99 верхн. 0,105 0,05 0,107 0,095 0,11 0,062 0,106 0,044 0,107 0,09 0,118 0,108 0,114 0,09 0,119 0,104 0,101 0,104 0,10 0,09 0,119 0,121 0,13 0,119 0,124 0,121 0,119 0,104 0,132 0,119 0,148 0,09 0,119 0,106 0,127 0,127 0,116 0,101 0,128 0,095 0,114 0,114 0,116 0,122 0,119 0,106 0,13 0,124 0,14 0,10 а, мкм осн. 0,119 0,114 0,124 0,111 0,119 0,121 0,124 0,114 0,124 0,119 0,165 0,108 0,141 0,125 0,128 0,119 0,119 0,119 0,124 0,114 0,141 0,131 0,136 0,128 0,146 0,13 0,132 0,13 0,141 0,13 0,128 0,119 0,132 0,124 0,136 0,122 0,132 0,128 0,141 0,13 0,116 0,114 0,122 0,130 0,132 0,114 0,151 0,165 0,15 0,13 нижн. 0,124 0,157 0,148 0,136 0,157 0,128 0,148 0,136 0,185 0,156 0,175 0,133 0,183 0,13 0,165 0,146 0,139 0,136 0,157 0,148 0,141 0,136 0,157 0,145 0,195 0,182 0,195 0,157 0,182 0,157 0,157 0,141 0,162 0,141 0,166 0,146 0,195 0,151 0,198 0,157 0,124 0,13 0,132 0,161 0,158 0,175 0,181 0,196 0,198 0,15 31 85220 32 Продовження таблиці 9 1 2 3 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 б/р 1:2 0 1 1-09 3 6 12 4 3,27 3,27 3,03 3,30 3,13 3,17 3,11 3,40 3,08 3,33 Виявлене збільшення було пов'язано зі збільшенням ширини розподілу часток за розмірами за рахунок появи в емульсіях відносно крупних часток. Так, при фракціонуванні емульсій після 12 місяців зберігання розмір часток в нижній фракції зростав з 0,12 до 0,198мкм. В цілому ці результати відповідають основному механізму руйнування емульсій за Оствальдом (або молекулярної перегонки). Однак частка таких відносно крупних часток була настільки мала (~10%), що ця обставина не позначалась на збільшенні середнього діаметру часток. Варто підкреслити, що при фракціонуванні емульсій відмічалось тільки рівномірне осідання часток, що говорить про відсутність в емульсіях вільних ФЛ навіть через 1 рік зберігання, тобто характер розподілу часток в емульсіях не змінювався, залишаючись мономодальним. Отримані результати свідчать про збереження загальної структури отриманих нами емульсій ПФВ впродовж 1-12 місяців зберігання. В таблиці 10 наведені значення індексів взаємодії Кt часток досліджених емульсій із сироваткою крові, модифікованою додаванням 5%-ного розчину альбуміну у співвідношенні 1/1. Індекси взаємодії емульсій ПФВ із сироваткою крові Кt , які характеризують їх мікрострукту 5 3,13 3,30 3,0 3,03 3,07 3,10 3,01 3,17 2,91 3,15 6 2,87 2,83 2,77 2,93 2,73 3,0 2,78 2,34 2,78 2,81 7 0,124 0,125 0,146 0,122 0,136 0,132 0,148 0,124 0,14 0,12 8 0,136 0,122 0,149 0,139 0,141 0,138 0,156 0,136 0,16 0,135 9 0,167 0,175 0,188 0,157 0,196 0,148 0,185 0,162 0,185 0,18 ру, для емульсій ПФВ/ЯФЛ впродовж 12-ти місячного терміну спостережень коливались в деякому достатньо вузькому інтервалі (співвідношення сироватка: емульсія =1:0,05 і 1:0,1). При збільшенні співвідношення сироватка: емульсія до 1:0,10 інтервал коливання індексів Кt і Кt /n зростав. Для емульсій ПФВ/СФЛ вузький інтервал коливань Кt зберігався тільки до 6-ти місячного терміну зберігання. Як уже було зазначено, встановлені нами коливання Кt пов'язані, скоріш за все, з тим, що стандартизувати суміш складно. Разом з тим збереження інтервалу коливань індексу взаємодії емульсій із сироваткою крові у певних і достатньо вузьких межах для кожної серії свідчить про те, що поверхневі властивості часток при таких тривалих термінах зберігання (6-9 міс.) змінюються мало. Стрибок Кt до кінця терміну зберігання при відсутності в емульсіях вільних ФЛ може бути пов'язаний з виникненням додаткових взаємодій між частками і макромолекулами сироватки. Для перевірки цього припущення нами були розраховані експериментальні і розрахункові значення каламутності t - додаткового незалежного параметра оцінки цілісності структури емульсій ПФВ (таблиці 11 )[13]. Таблиця 10 Значення індексів взаємодії із сироваткою крові емульсій ПФВ різних серій зберігання при +4°С № сери 1-02 1-03 Термін зберігання 0 1 3 6 9 12 0 1 3 6 12 J 1:0,05 0,8±0,1 0,93±0.06 0,97±0,02 0,97±0,01 1,23±0,02 1,7 0,77±0,07 0,84±0,05 1,0±0,1 0,92±0 1,33±0 t Кt Співвідношення сироватка: емульсія 1:0,1 1:0,05 1,33±0,03 3,8±0,5 1,4±0,1 4,9±0,3 1,99±0,003 3,50±0,07 1,63±0,03 3,5±0,4 2,09±0,03 3,7±0,2 2,32±0,01 7,2±0,3 1,1±0,1 3,3±0,3 1,29±0,06 4,0±0,3 1,46±0,05 3,6±0,6 1,53±0 3,3±0,4 1,92±0 4,0±0,2 1:0,01 6,2±0,2 7,2±0,5 5,01±0,02 3,4±0,1 7,0±0,1 10,09±0,1 4,8±0,4 6,6±0,3 5,2±0 3,19±0,03 6,4±0 33 85220 34 Продовження таблиці 10 1 2 0 1 3 6 9 12 0 1 3 6 12 0 1 3 6 9 12 0 1 3 6 9 12 1-04 1-05 1-08 1-09 3 1,00±0,06 1,1±0,2 1,15±0± 1,18±0,02 1,83±0,04 1,30±0.04 0,98±0,05 1,1±0,1 1,1±0,3 1,18±0,02 1,0±0,01 0,77±0,05 0,95±0,02 1,10±0,1 1,4±0,1 1,52±0,03 1,38±0.08 0,81±0,02 1,2±0,1 1,2±0 1,2±0.2 1,9±0,1 1,52±0,03 За фізичним смислом t для дисперсних систем є сумою втрат потужності світлового пучка на окремих частках у випадку відсутності кооперативних ефектів і багатократного розсіювання. Співпадіння експериментальних і розрахункових значень t як для нативних, так і для розведених водою емульсій свідчило про те, що взаємодія 4 1,25±0,08 1,67±0,03 1,84±0,06 1,97±0,03 1,76±0,02 2,22±0,07 1,56±0,08 1,76±0,02 1,90±0,06 2,05±0,07 2,91 ±0,05 1,15±0 1,43±0,03 1,57±0,02 1,94±0,03 2,68±0,05 2,30±0,03 1,48±0,03 1,8±0 1,4±0,4 2,25±0,03 3,24±0,03 2,68±0 5 5,4±0,3 5,3±0,9 4,4±0,3 5,7±0,8 4,2±0,4 7,7±0,5 5,1±0,2 4,3±0,6 4,5±0,8 5,7±0,8 3,6±0,3 3,4±0,4 4,0±1,0 5±1 3,3±0,6 10±2 11±2 5,6±0,6 6±1 6,0±0,5 2,8±0,5 14±2 12±1 6 5,4±0,4 8,9±0,2 3,83±0,06 10,7±0,2 4,40±0,04 13,9±0,8 8,0±0,4 7,0±0,1 8,3±0,2 11,1±0,4 7,2±0,1 5,4±0,7 6,4±0,3 8,7±0,5 5,4±0,5 19±1 21,3±0,9 14,5±0,3 4,79±0,07 7±3 6,4±0,5 24±2 25,3±0,7 між частками і макромолекулами сироватки практично не змінюється навіть через 9-12 місяців зберігання при +4°С. Стрибок Кt скоріше за все, пов'язаний з появою у водному дисперсійному середовищі додаткових надмолекулярних структур ПФВ/ФЛ, причому співвідношення в них ПФВ і ФЛ залишається таким же, що і в емульсіях. Таблиця 11 Експериментальні і розрахункові значення каламутності для емульсій при різних термінах зберігання № серії (об'ємний вміст Термін зберігання, міс. ПФС) 1-01 (10об.%) 1-03 (20об.%) 1-04 (20об.%) 0 1 3 6 9 12 0 1 3 6 12 0 1 3 6 9 12 t500 експ. 9,9 11,7 12,2 13,8 13,8 16,1 8,23 9,66 12,4 13,3 13,1 12,3 13,8 21,0 16,1 17,2 20,9 Вихідна розрахунок 10,0 11,6 12,0 13,1 14,0 14,1 9,06 10,2 11,3 11,55 12,4 1,4 13,2 15,4 15,5 17,2 19,9 Розведена 1:2 експ. розрахунок 4,6 4,7 3,60 3,75 3,91 4,02 4,1 3,86 4,29 4,37 4,98 4,94 3,60 3,65 3,07 3,11 3,3 3,39 3,57 3,57 4,02 4,02 4,05 4,0 4,6 4,5 4,98 5,0 5,5 5,5 5,6 6,2 6,8 6,5 35 85220 36 Продовження таблиці 11 1 1-05 (5об.%) 1-08 (40об.%) 1-09 (40об.%) 2 0 1 3 6 12 0 1 3 6 9 12 0 1 3 6 9 12 3 12,88 14,03 19,1 16,8 18,9 8,97 11,7 13,8 16,0 21,8 21,2 14,03 19,3 19,09 21,8 26,2 26,9 4 13,11 13,25 16,9 16,15 18,5 8,74 11,6 13,6 15,4 18,9 19,7 14,44 17,5 18,72 18,2 23,9 25,5 Перш ніж говорити про переваги заявленого складу і способу отримання емульсій ПФС, варто підкреслити, що головними умовами виконання емульсіями ПФС газотранспортної функції при циркуляції в судинному руслі є збереження корпускулярної природи часток і відсутність реактогенності. З позиції колоїдної хімії і біофізики попадання емульсії ПФВ в судинне русло можна розглядати як стрес-вплив, який повинен призводити до змін властивостей дисперсного середовища. Цей вплив можна звести до наступних моментів. Розбавлення емульсії ПФС і зменшення концентрації вільного емульгатора в середовищі (швидка стадія). В результаті цього процесу відходить послаблення зв'язків молекул ПАР з поверхнею часток (уповільнена стадія). Ці зміни міцності зв'язків ПАР з ПФВ поглиблюються контактом і взаємодією часток з макромолекулами плазми, що може призвести до змін складу адсорбційного шару або руйнування часток. Означена послідовність процесів представляє собою дещо спрощену схему. В наших дослідах розведення емульсій водою моделює першу стадію - розбавлення емульсії і зменшення концентрації вільного емульгатора навколо часток. Вивчення взаємодії отриманих емульсій із сироваткою крові моделює другу стадію - вплив контакту макромолекул сироватки на властивості поверхні часток. Виявилося, що навіть через рік зберігання частки емульсій ПФВ зберігають свою "мікроструктуру": 5 4,22 4,68 5,6 5,3 5,4 2,91 3,53 4,14 4,68 5,6 6,2 4,29 5,75 5,52 6,13 7,7 4,91 6 4,38 4,71 5,56 5,3 4,5 2,81 3,47 4,0 4,59 5,6 6,2 4,15 5,61 5,34 8,71 7,8 4,3 розбавлення емульсій водою не впливало на розмір часток, що свідчило про міцність зв'язку адсорбційного шару ПАР з ядром часток - ПФС; не змінювався також індекс взаємодії часток емульсій із сироваткою крові (в межах погрішності вимірів), що свідчило про збереження поверхневих властивостей часток. Співпадали розрахункові значення t (після фракціонування) з експериментальними (до фракціонування), що підтверджує збереження "природи" часток (їх структури) і свідчить про відсутність вільних ФЛ в емульсіях через 1 рік зберігання. Використані нами методологічні підходи значно збільшують вірогідність прогнозу стабільності емульсій при попаданні в судинне русло. Підтвердженням сказаному є результати паралельних досліджень з вивчення стабільності і визначення індексу реактогенності (Ір) кількох серій емульсій ідентичного складу. І р знаходили за методом [3]. Приклад 10. Було отримано 4 серії однотипових емульсій складу, що відповідав прикладу 2: вміст фторвуглецевої основи становив 9±1об.%, співвідношення ПФД/ПФОБ 9:1; добавка ПФОР становила 20%; вміст ЯФЛ дорівнював 1ваг.%; кількість ад'юванта - рициновової олії і соєвої олії у співвідношенні 1:1 становила 8% від концентрації ЯФЛ. В таблиці 12 наведені значення n і а для цих серій різних термінів зберігання. Таблиця 12 Значення хвильового експонента n і середнього діаметра часток а для емульсій однакового складу ПФД/ПФОБ/ПФОР/ЯФЛ різних термінів зберігання № серії Термін зберігання (міс.) 5-03 0 1 6 n Вихідна 3,70±0,03 3,62±0,03 3,80±0,04 а, мкм 0,08 0,09 0,07 n а, мкм Розведена 3,81±0,07 0,06(5) 3,83±0,05 0,06(5) 3,76±0,06 0,07(5) 37 85220 1 2 0 1 6 0 1 6 0 1 6 5-04 5-05 5-06 3 3,36±0,02 3,30±0,04 3,37±0,05 3,35±0,05 3,07±0,07 3,37±0,03 3,32±0,02 3,07±0,07 3,45±0,04 38 Продовження таблиці 12 4 0,П7 0,122 0,117 0,116 0,141 0,117 0,12 0,141 0,108 5 3,58±0,01 3,53±0,05 3,08±0,08 3,47±0,04 3,24±0,09 3,13±0,02 3,35±0,05 3,09±0,08 3,26±0,09 6 0,09 0,10(1) 0,14 0,11 0,12(7) 0,13(6) 0,11(6) 0,139 0,12(5) Таблиця 13 Значення хвильового експонента n і середнього діаметра часток а, що характеризують ширину розподілу часток за розмірами, при фракціонуванні методом центрифугування для емульсій однакового складу ПФД/ПФОБ/ПФОР/ЯФЛ № сери Термін зберігання (міс.) 0 5-04 1 6 0 5-05 1 6 Розведення водою нативна 1/2 нативна 1/2 нативна 1/2 нативна 1/2 нативна 1/2 нативна 1/2 Згідно отриманим даним середній діаметр часток у всіх випадках для нативної і розведеної водою емульсії не змінювався впродовж 6 місяців зберігання, залишаючись в межах 0,06-0,17мкм. Ширина розподілу часток за розмірами для нативної і розведеної водою емульсії названого складу практично не змінювалась у вказаний період Верхн. 3,53 3,77 3,53 3,85 3,61 3,61 3,71 3,88 3,60 3,72 3,56 3,53 n Осн. 3,47 3,63 3,51 3,66 3,46 3,12 3,43 3,67 3,30 3,35 3,34 3,15 Нижн. 3,21 3,27 3,19 3,26 3,15 2,9 3,17 3,31 3,05 2,78 2,90 2,71 Верхн. 0,10 0,07 0,101 0,06 0,089 0,089 0,079 0,055 0,094 0,078 0,098 0,101 а, мкм Осн. 0,11 0,09 0,104 0,085 0,109 0,136 0,110 0,084 0,122 0,122 0,118 0,135 Нижн. 0,13 0,124 0,132 0,125 0,135 0,160 0,132 0,120 0,145 0,184 0,162 0,20 спостережень (таблиця 13). Індекс взаємодії отриманих емульсій з модифікованою сироваткою крові Кt з урахуванням відносної погрішності виміру (±10%) коливався в достатньо вузьких межах (таблиця 14). Таблиця 14 Значення індексу взаємодії Кt емульсій однакового складу ПФД/ПФОБ/ПФОР/ЯФЛ з модифікованою сироваткою крові в присутності альбуміну (80%) Номер серії 5-03 5-04 5-05 Термін зберігання (міс) 0 1 6 0 1 6 0 1 6 Співвідношення сироватка/емульсія 1:0,05 1:01 2,28 3,37 2,34 3,70 2,60 4,00 3,76 6,00 3,63 5,62 4,05 6,03 4,0 5,56 4,33 6,06 4,53 6,1 39 85220 Таблиця 15 Величини індексу реактогенності емульсій однакового складу ПФД/ПФОБ/АФОР/ЯФЛ (в якості контролю взята дисперсія ФЛ) Номер серії Дисперсія ФЛ 5-03 5-04 5-05 5-06 Тривалість зберігання (місяці) 0 1 6 1,4 2,83 1,68 1,92 1,14 2,14 2,24 1,83 1,83 1,70 2,42 1,35 2,63 Наведені результати свідчать про те, що в запропонованих емульсіях і способі їх отримання вдається досягти високої якості мікроструктури емульсій, не пошкодженої при зберіганні в не замороженому вигляді і наступних стресових впливів in vitro розведення водою, взаємодія з сироваткою крові, збагаченою альбуміном). Ре 40 зультати перевірки реактогенності тих же зразків емульсій повністю підтверджує дані модельних досліджень: ні в один із термінів дослідження індекс реактогенності не перевищив критичної величини, що дорівнює 3 (таблиця 15). Приклад 11. Збереження структури і аналіз рівня реактогенності емульсій зі зниженим об'ємним вмістом ПФС на рівні 5об.%. Склад емульсії ПФД/ПФОБ 1:1, ПФМЦП 1%, СФЛ - 0,5% ад'ювант олія сої - 12%. Ширина розподілу розмірів часток знаходилась в діапазоні 0,03 до 0,12мкм, вихідний індекс реактогенності становив 1,61. Дослідження змін при зберіганні середнього розміру нативних і розведених водою чотирьох однотипових емульсій (таблиця 16) і реактогенність після 6 місяців зберігання (таблиця 17). Як видно із наведених даних, спостережуване прирощення розміру часток при використаній рецептурі і запропонованому нами способі отримання забезпечують збереження низького рівня індексу реактогенності. Таблиця 16 Значення хвильового експонента n і середнього діаметра часток а для нативних і розведених водою емульсій однакового складу ПФД/ПФОБ/ПФОР/СФЛ Номер серії 6-02 6-03 6-05 6-06 Термін зберігання, місяці 1 6 1 6 1 6 1 n а, мкм вихідна 3,27±0,04 3,08±0,09 3,19±0,01 3,06±0,01 3,31±0,01 3,24±0,01 3,11 ±0,03 0,122 0,138 0,13 0,145 0,12 0,126 0,137 n а, мкм розведена водою 1:2 3,29±0,03 0,123 3,18±0,02 0,132 3,28±0,02 0,124 3,11±0,03 0,138 3,48±0,01 0,105 3,39±0,01 0,114 3,23±0,03 0,128 Таблиця 17 Величини індексу реактогенності Ір для емульсій з низьким вмістом ПФС через 6 місяців зберігання в незамороженому стані Серія емульсії Індекс реактогенності 6-02 1,87 Приклад 12. Тривале впродовж 18 місяців зберігання емульсії, що містить 10об.% ПФС, при співвідношенні ПФД/ПФОБ 8:2, ПФОР 20%, ЯФЛ 2%, ад'ювант рицинова олія 10%. Результати 6-03 6-05 6-06 2.00 1,36 1,8 дослідження змін середнього розміру часток при зберіганні і розведенні емульсії водою представлені в таблиці 18, динаміка індексу взаємодії емульсії із сироваткою крові, збагаченої альбуміном до 50% - в таблиці 19. Таблиця 18 Значення хвильового експонента n і середнього діаметра часток а для нативної і розведеної водою емульсій ПФД/ПФОБ/ПФОР/ЯФЛ в різні терміни зберігання в незамороженому вигляді Номер серії Термін зберігання, місяці 0 1 7-03 6 18 n a, мкм вихідна 3,70±0,03 3,62±0,03 3,80±0,04 3,81±0,04 0,08 0,09 0,07 0,065 n а, мкм розведена водою 1:2 3,81±0,07 0,065 3,83±0,05 0,065 3,76±0,06 0,07 3,77±0,06 0,07 41 85220 42 Таблиця 19 Значення індексу взаємодії Кt емульсії ПФД/ПФОБ/ПФОР/ЯФЛ із сироваткою крові в присутності альбуміну (50%) в різні терміни зберігання Номер сери 7-03 Кt Співвідношення сироватка/емульсія 1:0,05 1:1,01 1,74 2,37 1,68 2,25 1,48 2,74 1,22 1,78 Термін зберігання, місяці 0 1 6 18 Як видно із наведених даних, отримана емульсія зберігала вимірювані фізико-хімічні характеристики. Очевидно, завдяки цьому через 18 міс. зберігання індекс реактогенності Ір для емульсії ПФД/ПФОБ/ПФОР/ЯФЛ становив всього 1,5. Приклад 13. Зіставлення якості емульсій ПФС, отриманих за прототипом, емульсії Оксигент AF 0104 (фірми Alliance Therapeutic, США) та емульсії ПФС, отриманої запропонованим в даному винаході способом. Порівняння проводилось по змінам хвильового експонента і середнього діаметра часток при розведенні водою. В порівнювальних емульсіях при різному абсолютному вмісті ПФС дотримано рівне співвідношення компонентів ПФС/ФЛ. Вказані емульсії відрізняються за способом отримання. В результаті емульсія ПФОБ-2 (отримана по заявляємому способу) не містить після центрифугування вільної фосфоліпідної фази (Рис.Б), тоді як емульсія Оксигент і емульсія прототип ПФОБ-1 містить незв'язані в адсорбційному шарі часток вільні фосфоліпіди, які легко спливають при центрифугуванні (Рис.А). Саме тому при розведенні емульсій водою, коли відбувається руйнування агрегатів ФЛ і часток емульсій відбувалося "зменшення" середнього розміру часток емульсій в препараті Оксигент з 0,35 до 0,15. В емульсії прототипу (ПФОБ-1), очевидно, були відсутні такі грубі агрегати, але про їх відсутність свідчать, окрім результатів центрифугу вання і виділення фракції вільних ФЛ, різкі відмінності між розрахунковими і експериментально визначеними параметрами значень каламутності, які визначаються за правилами адитивності, для нативних і розведених водою емульсій. Тоді, як для препаратів емульсій ПФС, отриманих заявленим способом, спостерігалась практично повна відповідність по параметру каламутності між експериментальними і розрахунковими значеннями (таблиця 21). Варто зазначити, що за фізичним смислом параметр, що визначається, відображає суму втрат потужності світлового пучка на окремих частках за відсутності кооперативних ефектів і багатократного розсіювання. Невідповідність експериментальних і розрахункових значень каламутності для препаратів Оксигент та емульсія ПФОБ-1 (прототип) свідчило про недотримання правила адитивності для цих середовищ, тобто про наявність в названих дисперсних системах додаткових взаємодій між частками і світловим потоком. Ці взаємодії виразно виявляються при розведенні водою препарату Оксигент та емульсій ПФОБ-1, що відображає неоднорідність виду часток, зокрема наявність поруч з частками емульсії ПФС різних міцелярних структур ФЛ. Для емульсії ПФОБ-2 та емульсії ПФД/ПФОБ (серія 503) взаємодія між частками і світловим потоком підпорядковується правилу адитивності навіть через місяць зберігання в незамороженому стані. Таблиця 20 Склад різних емульсій ПФС, значення хвильового експонента n і середнього діаметра часток а для нативних і розведених водою емульсій (1:1) Препарат, вид ПФС Оксигент AF0104 (ПФОБ) Емульсія ПФОБ-1 прототип Склад n ПФС, ФЛ, вихідний розведення мас/об'єм мас.% Н2О 1:1 90ваг.% 4 2,34±0,04 2,93±0,10 45об.% 45ваг.% 2 2,91±0,09 2,82±0,10 22об.% Емульсія за запропонованим спосо-20% 10об.% бом (склад за прототипом ПОФБ-2) 1 3,38±0,02 3,33±0,05 а, мкм вихідний розведення Н2О 1:1 0,35 0,15 0,16 0,18 0,114 0,115 43 85220 44 Таблиця 21 Ступінь відповідності експериментальних (дослід) значень каламутності з розрахунковими значеннями цього параметра (розрахунок), які визначаються за правилом адитивності Препарат Оксигент ПФОБ-1 (прототип) ПФОБ-2 (заявлений спосіб) ПФД/ПФОБ9:1 (заявлені склад і спосіб, приклад 10) Таким чином, наведені приклади свідчать про цілий комплекс переваг описаного складу і способу отримання заявленої емульсії в порівнянні з прототипом і аналогами. Це зумовлено завдяки наступним синергічно взаємодіючим чинникам. 1. ПФД і ПФОБ взяті в якості основних компонентів тому, що саме ці ПФС перевірені за своїми біологічними і фізико-хімічними властивостями як біологічно припустимі, що мають високу швидкість виведення із організму, тобто із клітин ретикуло-ендотеліальної системи, акумулюючих частки ПФС. 2. Спільне використання ПФД і ПФОБ в ефективному співвідношенні формує змішану олійну фазу, властивості якої змінюються градуально від центра до периферії таким чином, що дозволяє використовува ти в рецептурі мало ліпофільні і негідрофільні перфторовані третинні аміни, які мають суттєво менший тиск пару (див. таблицю 1) та зменшують тим самим швидкість дифузійного проникнення ліпофільних молекул ПФД і ПФОБ у водяну фазу. Ця обставина уповільнює швидкість основного механізму руйнування емульсій - "дозрівання за Оствальдом" - і збільшує стабільність обраного складу емульсій ПФС. 3. Введення ПФОБ до складу емульсій збільшує їх кисневу ємність при цьому ж вмісту ПФС і надає їм додаткові рентгеноконтрастні властивості. 4. Наявність в складі композиції ПФОБ/ПФД і суміші перфторованих третинних амінів сприяє зниженню в'язкості кінцевої форми завдяки більш міцному зв'язуванню адсорбційного шару П АР навколо часток, що дозволяє повністю виключити вміст вільних міцелярних форм ФЛ у водній фазі емульсій. 5. Використання поруч з фосфоліпідами різних за фізико-хімічними характеристиками олій сприяє формуванню більш щільного мембраноподібного адсорбційного шару навколо часток при меншій кількості фосфоліпідів, перешкоджає утворенню міцелярних структур, що не містять ПФС. 6. Особливості використання водносольового середовища забезпечує збереження на поверхні часток негативного заряду, що перешкоджає їх злипанню при зберіганні і транспортуванні. 7. Поруч з технологічними прийомами, що забезпечують отримання висококаліброваної (з вузьким розподілом розмірів часток) емульсії, вищевказані прийоми послаблюють процес мо Нативна дослід розрахунок 133,9±1,0 33,2 26,6±0,3 18,6 9,3 10,9 12,9 11,2 Розведена водою 1:1 дослід розрахунок 59,3±0,5 23 16,4±0,2 5,21 2,35 2,31 3,24 3,17 лекулярної перегонки ПФС і також сприяють більш високому зберіганню емульсій. 8. Відсутність агрегатів часток і міцелярних форм ФЛ забезпечує зменшення адсорбційних і комплемент активуючи х властивостей емульсії при попаданні її в кровоток, що зумовлює низький рівень реактогенності і сприяє підвищення біосумісності емульсій запропонованого складу. III. Нижче наведені експерименти біомедичного використання запропонованих емульсій. Експеримент 1. Використання емульсії ПФС для масивного кровозаміщення. Здоровим щурам породи Wistar масою 250-300г (n=20) під нембуталовим наркозом проводили ізоволюмічну кровозаміну емульсій ПФС, приготовлених згідно прикладу 1 (розділ II). Визначали виживаємість щурів після масивної кровозаміни і збереження мітохондрій печінки після відшкодування крововтрати (метод див. [16]). Для забезпечення підтримки онкотичного тиску після масивної кровозаміни емульсію ПФС змішували перед інфузією тварині з 20% розчином людського альбуміну у співвідношенні 1 частина розчину 20% альбуміну і 6 частин емульсії ПФС так, щоб кінцева концентрація альбуміну становила 3,5% (з урахуванням того, що 10 об'ємних відсотків емульсії становлять ПФС). Під час операції кровозаміни щури дихали повітрям, збагаченим киснем з величиною FiO2 0,5, подаваємим під прозорий ковпак із оргскла, яким накривалась голова фіксованої на спині тварини. Із венозного синусу (правого передсердя) забирали шприцем 3,5мл крові і вводили 3,5 емульсії ПФС. Через 10 хвилин знову забирали 3,5мл крові і вводили рівну кількість емульсії ПФС. Потім знову повторювали процедур у кровозаміни так, щоб кінцевий об'єм взятої крові становив в середньому не менше 3,5% від маси тіла тварини, наприклад, у тварини масою 250г об'єм забираємої крові і об'єм вводимої емульсії ПФС становили по 8,8мл. До і після кровозаміни визначали вміст гемоглобіну в периферичній крові, парціальний тиск кисню і рН в артеріальній і венозній крові. В цій серії експериментів концентрація гемоглобіну знижувалась після кровозаміни в середньому 1,9 рази. В контрольній групі (n=20) тваринам замість емульсії ПФС вводили 0,15Μ розчин хлориду натрію, що містить 3,5% альбуміну. За допомогою ЯМРспектрометра визначали у тварин вміст ПФС в периферичній крові. Після операції кровозаміни тварини впродовж 5 днів утримувались в спеціальній камері з подачею повітря, збагаченого киснем при FiO2 0,5. 45 85220 46 У дослідній групі (кровозаміна емульсією проводжується різким падінням артеріального ПФС) всі тварини вижили і вміст гемоглобіну, тиску (до 50-60мм рт.ст.), двократним збільшенеритроцитів і лейкоцитів відновився впродовж 5 ням частоти серцевих скорочень, збільшенням днів. В контрольній групі 3 тварини загинули. Чеконцентрації лактату в плазмі крові до 20мМ. Через 5 діб всіх виживших тварин забивали під нерез годину після взяття крові тварині вводили мбуталовим наркозом і із тканини печінки виділякровозамінник в дозі, що перевищувала об'єм ли мітохондрії. Дихання мітохондрій печінки крововтрати на 15%; в дослідній групі -емульсію, реєстрували полярографічно в закритій термощо містила 10об.% ПФС по прикладу 1 з доданстатованій комірці при 27°С. Було виявлено, що в ням альбуміну до 3,5% (як в прикладі 14), в контконтрольній групі швидкість дихання в активному рольній групі вводили плазмоекспандер поліглюстані (при синтезі АТФ) і власне швидкість синтекін. Ще через годину тварин забивали і забирали зу АТФ при оскисленні НАД-залежного субстрату обидві нирки: одну для пересадки через годину 3-гідроксибутирату знижуються в середньому в собаці реципієнту, другу для дослідження пара1,5 рази, при 20% активації окислення сукцинату. метрів енергетичного обміну тканини нирки. Ці дані свідчать про перенесене тваринами поміВ контрольній групі відношення ATP/ADP рне ішемічне ураження тканини печінки. Тоді, як в знижувалося в 3 рази, а величина енергетичного мітохондріях печінки, виділених у тварин через 5 заряду ([ATP]+1 /2[ADP])/([ATP]+[ADP]+[AMP]) -до днів після відшкодування крововтрати емульсією 0,45. В дослідній групі (кровозаміна емульсією ПФС, спостерігалась активація всіх швидкостей ПФС) відношення ATP/ADP знижувалося не бідихання і синтезу АТФ в середньому на 25%, що льше, ніж в 2 рази, а величина енергетичного свідчило про наявність в анамнезі лише помірної заряду зменшувалась до 0,65-0,70. Відношення гіпоксії. лактат/піруват в тканині нирки у тварин контрольЕксперимент 2. Всі процедури проводили так ної групи зростало до 25-30, тоді як в дослідній само, як в попередньому прикладі, але викорисгрупі не перевищувало 6. товували емульсію, що містить 20об.% ПФС, і У всіх випадках при пересадці собакамвміст гемоглобіну знижували в 3 рази порівняно з реціпієнтам нирок, взятих у собак, пролікованих вихідним, заміщаючи в середньому 65-70% об'за допомогою емульсії ПФС, зразу ж після підєму циркулюючої крові. Об'єм взятої крові і ввеключення нирок до кровотоку починалось видіденого кровозамісного складу становив по лення сечі. В контрольній групі в 2 випадках із 5 12,25мл для тварин масою 250г. В результаті в після пересадки спостерігався розвиток репер дослідній групі вижили всі тварини, в контрольній фузійного пошкодження з різким набряком тканизагинуло 5 тварин. ни і повним припиненням кровотоку (нирки гинуЕксперимент 3. Всі процедури проводили так ли). У 3 випадках в контрольній групі кровоток в само, як в прикладі 1, за виключенням того, що пересадженій нирці відновлювався, але виділенпо 5 тварин в кожній групі забивали через 6 гоня сечі починалось лише через кілька годин. дин, 1 добу і 3 доби після кровозаміни. Виділяли Представлені дані свідчать про те, що лікумітохондрії із печінки і реєстрували параметри вання геморагічного шоку у собак з використанфосфорильованого дихання. У тварин контрольням отриманої емульсії ПФС забезпечує суттєвий ної групи у всі вказані терміни спостерігалось кращий захист органів від ішемічного і наступного різке пригнічення швидкостей дихання і фосфореперфузійного пошкодження. рилювання при окисленні як НАД-залежних субЕксперимент 5. Використання емульсії ПФС, стратів, так і сукцинату в середньому більше, ніж отриманої по прикладу 2, для збереження перна 50%, що характерно для тяжкого ішемічного фузійного серця кроля. Безпосередньо перед пошкодження мітохондрій. В дослідній групі через використанням (за 1-2 години) емульсія ПФС 6 днів після кровозаміни спостерігалось 40% акзмішувалась з ізотонічним розчином Кребсативація фосфорильованого дихання, яка зберігаХенселяйта у співвідношенні 2:1 400мл емульсії і лась через добу і становила не більше 25% через 200мл сольового розчину. До 600мл отриманої 3 доби після кровозаміни емульсій ПФС. Такі суміші додавали 80мл 20% розчину сироватковозрушення характерні для збережених мітохондрій го альбуміну. Контрольний склад для порівняльпечінки тварин, які перенесли гіпоксію, але не них досліджень містив 600мл сольового розчину ішемію. з доданням 7,2г манітолу і 80мл 20% розчину Експеримент 4. Збереження нирок у собак, альбуміну. Ці склади використовували в якості які перенесли геморагічний шок. Збереження перфузійного середовища для збереження серця нирок визначалось за відновленням функції никроля. Перфузію за Лангендорфом здійснювали в рок після пересадки тварині реціпієнту з обома рециркуляторному режимі при температурі 37°С. видаленими нирками (дослідження проводилось Реєстрували час збереження частоти і амплітуди за спеціальним дозволом етичного комітету скорочень серця. В контролі і в досліді було взято МОЗ), а також за результатами оцінки стану рівня по 8 сердець. При використанні перфузіату на аденілових нуклеотидів і вмістом лактату і піруоснові емульсії ПФОС скоротлива здатність ізовату і тканини нирки через годину після відшкольованого серця кроля зберігалась впродовж не дування крововтрати. Дослідження виконано на менше 6-8 годин, тоді як при перфузії контроль10 собаках, по 5 собак в кожній групі. ним складом через 2 години спостерігалось різке Хід дослідження. У інтубованої собаки масою зниження частоти і амплітуди скорочень аж до 20кг, яка знаходилась під загальним інгаляційним повної зупинки серця. наркозом з керованим диханням, із стегнової артерії струминно забирається 400мл крові, що су 47 85220 48 В заключения варто зазначити, що переваги 1. Журнал Всесоюзного химического общестперед прототипом і аналогами запропонованої ва им. И.Менделеева, 1985. - т.30, №4, С.387емульсії заключаються в наступному. 394. Представлені рецептура і спосіб отримання 2. J/G/Riess et al. // Физиологическая активемульсії ПФС забезпечують отримання тонкодисность фторсодержащих соединений (экспериперсної, каліброваної емульсії із заданим середмент и клиника): Сборник научн.тр уд. -п ущино, нім розміром часток в діапазоні від 0,06 до 1995. - С.73-90. 0,195мкм, що містить від 2 до 40об.% ПФС, ста3. М.В.Беркос, Автореф. диссертации... канд. білізованих фосфоліпідною дисперсією і в біоломед. наук, Ленинград, 1991, 24с. гічно припустимому водно-сольовому складі. По4. J/G/Riess // Chem.Rev.,2001, м.101, №9, казано високе збереження дисперсності і С.2797-2914. "мікроструктури" емульсій ПФС при зберіганні до 5. Патент РФ 2162692, кл.7 А61К3/02, 9/10, 18 місяців в незамороженому стані, що дозволяє 1999. зберігати високу біосумісність, яка виражається в 6. Патент РФ 2199311, кл.7 А61К9/107, низькому рівні реактогенності. Розроблені емуль31/02,2001. сії ПФС придатні для біомедичного використання, 7. Патент US №3 778, 381, 1973 зокрема, для відшкодування масивних крововт8. Патент US №6, 113, 919, 2000. рат, лікування геморагічного шоку, попередження 9. Патент US №4, 866, 096, А61К31/025, 1989. розвитку реперфузійних постішемічних пошко10. Патент US №5, 374,624, А61К31025, 1994. джень, підготовки до трансплантації, перфузіцно11. Патент РФ №2088217, 6 А61К9/10, 31/02, го збереження ізольованих органів, володіють 1997. достатньо вираженими киснетранспортними і 12. Биофизика, 1988, т.33, №1, 126-129. реалогічними властивостями, які забезпечують 13. И.Н.Кузнецова, Автореф. диссертации... попередження і ліквідацію ішемічних пошкоджень докт. биол. Наук, С-Пб., 1999г., 38с. киснезалежних функцій мітохондрій і підтримку 14. Химико-фармацевтический журнал, 1987, аеробного енергетичного обміну в тканинах в №12, С.1498-1503. умовах кровозаміни і лікування геморагічного 15. Журнал физической химии, 1993, т.67, шоку. №9, С.1884-1888. Джерела інформації: 16. Е.И.Маевский, Автореф. диссертации... докт. мед. наук, Москва, 1998г., 36с. Комп’ютерна в ерстка Т. Чепелев а Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMedical emulsion of perfluororganic compounds and method for production thereof
Автори англійськоюKuznietsova Iryna Mykolaivna, Maievskyi Yevhen Illich
Назва патенту російськоюЭмульсия перфторорганических соединений медицинского назначения и способ ее получения
Автори російськоюКузнецова Ирина Николаевна, Маевский Евгений Ильич
МПК / Мітки
МПК: A61K 31/02, A61K 31/685, A61P 7/08, A61K 9/107, A61P 7/00
Мітки: отримання, перфторорганічних, сполук, емульсія, призначення, спосіб, медичного
Код посилання
<a href="https://ua.patents.su/24-85220-emulsiya-perftororganichnikh-spoluk-medichnogo-priznachennya-ta-sposib-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Емульсія перфторорганічних сполук медичного призначення та спосіб її отримання</a>
Попередній патент: Спосіб дозованого навантаження сипучим матеріалом залізничних вагонів
Наступний патент: Спосіб виготовлення фібри з дроту
Випадковий патент: Шафа комплектного розподільного пристрою