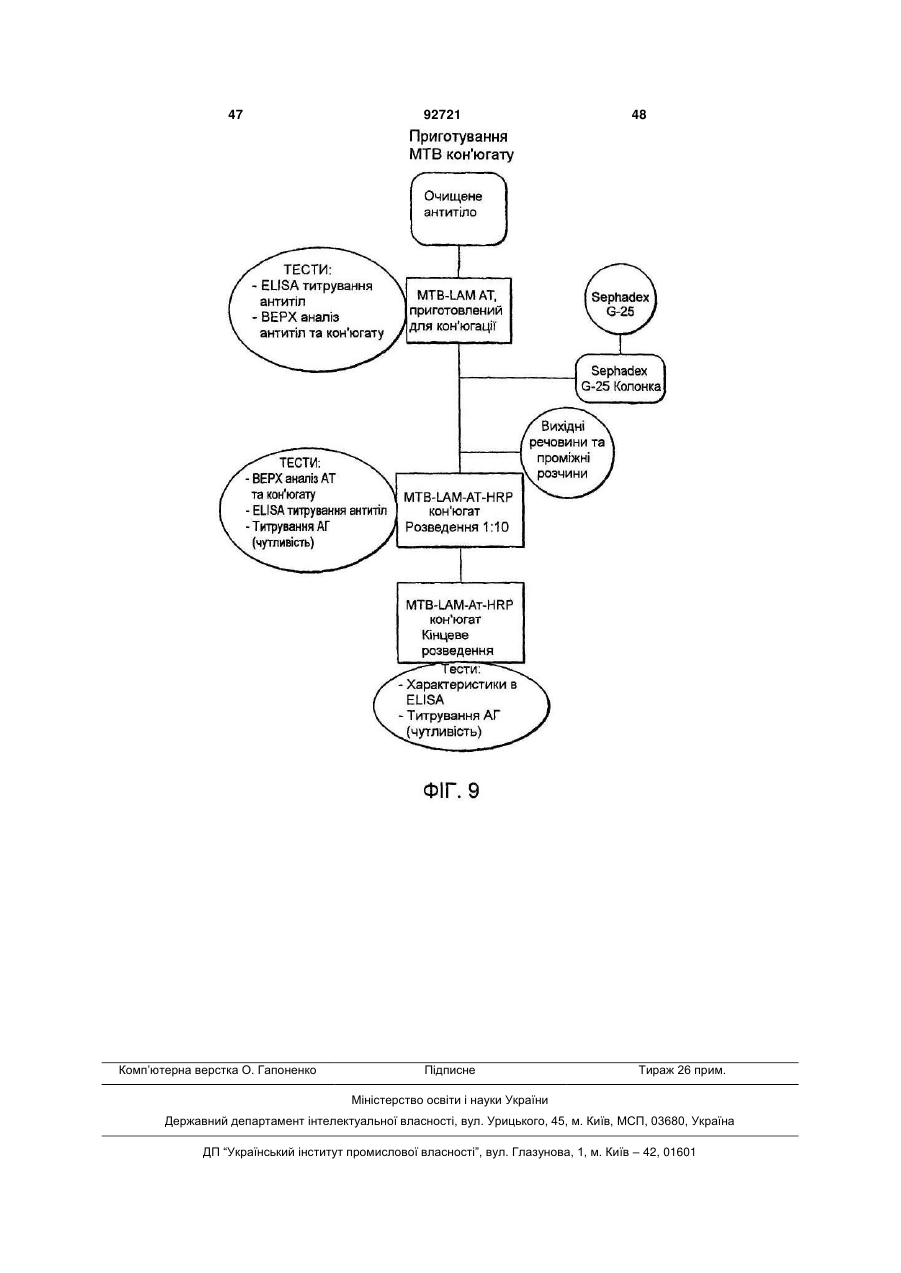
Збагачена популяція антитіл, високоспецифічних до антигену поверхневого полісахариду ліпоарабіноманану (lam) мікобактерії , спосіб виявлення мікобактеріальної інфекції в зразку та набір для виявлення мікобакт
Номер патенту: 92721
Опубліковано: 10.12.2010
Автори: Молокова Єлєна В., Кульчин Владімір А., Керрік Джіль Л.
Формула / Реферат
1. Збагачена популяція антитіл, високоспецифічних до антигену поверхневого полісахариду ліпоарабіноманану (LAM) мікобактерії, яку одержують шляхом виключення антитіл, що впізнають агент LAM, модифікований окисленням NaIO4.
2. Збагачена популяція антитіл за п. 1, де антитіло збагачують шляхом індукування в оточенні, що підтримує антигенно-активний антиген.
3. Збагачена популяція антитіл за п. 1, де антитіло збагачують за рахунок виключення антитіл, які впізнають відносно неактивний антиген.
4. Збагачена популяція антитіл за п. 2, де антитіло збагачують за рахунок виключення антитіл, які впізнають відносно неактивний антиген.
5. Збагачена популяція антитіл за п. 1, де мікобактерією є Mycobacterium tuberculosis.
6. Спосіб одержання збагаченої популяції антитіл високоспецифічних до антигену поверхневого полісахариду мікобактерії, який включає:
а) забезпечення ізольованої популяції антитіл до вказаного антигену поверхневого полісахариду; і
б) видалення з вказаної популяції антитіл такої популяції антитіл, які впізнають форму антигену поверхневого полісахариду, модифіковану окисленням NaIO4.
7. Спосіб одержання збагаченої популяції антитіл, високоспецифічних до антигену поверхневого полісахариду мікобактерії, який включає:
а) нанесення сироватки з ссавця, зараженого мікобактеріями, на перший афінний матрикс, приготовлений з використанням антигену поверхневого полісахариду мікобактерії, так що антитіло, специфічне до зазначеного антигену поверхневого полісахариду мікобактерії, утримується першим афінним матриксом;
б) виділення антитіла, специфічного до зазначеного антигену поверхневого полісахариду, з першого афінного матриксу;
в) нанесення виділеного антитіла на другий афінний матрикс, приготовлений з використанням форми зазначеного антигену поверхневого полісахариду мікобактерії, яка була модифікована за допомогою окислювального агента NaIO4, так що антитіло, специфічне до модифікованої форми зазначеного антигену поверхневого полісахариду, утримується другим афінним матриксом, а антитіло, що не має специфічність по відношенню до модифікованої форми зазначеного антигену поверхневого полісахариду, не втримується другим афінним матриксом; і
г) збір незатриманих антитіл.
8. Спосіб за будь-яким з пп. 6, 7, у якому мікобактерією є Mycobacterium tuberculosis.
9. Спосіб за п. 8, у якому поверхневим антигеном є ліпоарабіноманан (LAM).
10. Спосіб за п. 7, у якому агентом є періодат натрію.
11. Спосіб за будь-яким з пп. 6-7, у якому поверхневий антиген виділений з ад'юванту Фрейнда.
12. Спосіб виявлення мікобактеріальної інфекції в зразку, узятому в суб'єкта, який включає:
створення імунореактивного оточення, такого як оточення, розроблене на основі збагаченої популяції антитіл за будь-яким з пп. 1-4;
проведення реакції зразка в імунореактивному оточенні з використанням збагачених антитіл за будь-яким з пп. 1-4 для того, щоб виявити мікобактеріальну інфекцію.
13. Спосіб за п. 12, у якому мікобактеріальною інфекцією є M. tuberculosis.
14. Спосіб за п. 12, у якому імунореактивне оточення включає ELISA.
15. Спосіб за п. 12, у якому мікобактеріальна інфекція є хворобою Джона.
16. Спосіб за п. 12, у якому мікобактеріальною інфекцією є легенева форма інфекції Mycobacterium tuberculosis.
17. Спосіб за п. 12, у якому мікобактеріальною інфекцією є позалегенева форма інфекції Mycobacterium tuberculosis.
18. Спосіб за п. 12, у якому зразком є будь-який з таких: мокротиння, кров, сеча, тканина або інший придатний зразок.
19. Спосіб за п. 12, у якому зразком є необроблена неконцентрована сеча.
20. Набір для виявлення мікобактеріальної інфекції в зразку, який включає аналіз, що забезпечує імунореактивне оточення, де оточення включає збагачену популяцію антитіл за будь-яким з пп.1-4.
21. Набір за п. 20, у якому імунореактивне оточення включає ELISA.
22. Набір за п. 20, у якому мікобактеріальною інфекцією є Mycobacterium tuberculosis.
23. Набір за п. 20, у якому імунореактивне оточення виконане у вигляді стрип-тесту.
Текст
1. Збагачена популяція антитіл, високоспецифічних до антигену поверхневого полісахариду ліпоарабіноманану (LAM) мікобактерії, яку одержують шляхом виключення антитіл, що впізнають агент LAM, модифікований окисленням NaIO4. 2. Збагачена популяція антитіл за п. 1, де антитіло збагачують шляхом індукування в оточенні, що підтримує антигенно-активний антиген. 3. Збагачена популяція антитіл за п. 1, де антитіло збагачують за рахунок виключення антитіл, які впізнають відносно неактивний антиген. 4. Збагачена популяція антитіл за п. 2, де антитіло збагачують за рахунок виключення антитіл, які впізнають відносно неактивний антиген. 5. Збагачена популяція антитіл за п. 1, де мікобактерією є Mycobacterium tuberculosis. 2 (19) 1 3 92721 4 створення імунореактивного оточення, такого як 17. Спосіб за п. 12, у якому мікобактеріальною оточення, розроблене на основі збагаченої попуінфекцією є позалегенева форма інфекції ляції антитіл за будь-яким з пп. 1-4; Mycobacterium tuberculosis. проведення реакції зразка в імунореактивному 18. Спосіб за п. 12, у якому зразком є будь-який з оточенні з використанням збагачених антитіл за таких: мокротиння, кров, сеча, тканина або інший будь-яким з пп. 1-4 для того, щоб виявити мікобакпридатний зразок. теріальну інфекцію. 19. Спосіб за п. 12, у якому зразком є необроблена 13. Спосіб за п. 12, у якому мікобактеріальною неконцентрована сеча. інфекцією є M. tuberculosis. 20. Набір для виявлення мікобактеріальної інфек14. Спосіб за п. 12, у якому імунореактивне отоції в зразку, який включає аналіз, що забезпечує чення включає ELISA. імунореактивне оточення, де оточення включає 15. Спосіб за п. 12, у якому мікобактеріальна інфезбагачену популяцію антитіл за будь-яким з пп.1-4. кція є хворобою Джона. 21. Набір за п. 20, у якому імунореактивне оточен16. Спосіб за п. 12, у якому мікобактеріальною ня включає ELISA. інфекцією є легенева форма інфекції 22. Набір за п. 20, у якому мікобактеріальною інMycobacterium tuberculosis. фекцією є Mycobacterium tuberculosis. 23. Набір за п. 20, у якому імунореактивне оточення виконане у вигляді стрип-тесту. Область техніки, до якої належить винахід Даний винахід стосується діагностичних тестів для виявлення мікробних захворювань і станів, зокрема, діагностичних тестів та способів для виявлення туберкульозу. Рівень техніки Протягом останніх десятиліть туберкульоз (ТБ) перетворився з переважно легеневої інфекції на комплексну патологію із зростаючим числом позалегеневих форм. Дотепер програми з ефективної профілактики ТБ ускладнені через відсутність швидкого та працюючого в польових умовах масового перевірочного аналізу. У країнах з високим рівнем доходів культивування мікобактерій залишається діагностичним стандартом, але є трудомістким і відносно дорогим. Ідеально, мікроскопія мокротиння, основана на трьох мазках мокротиння, дозволяє виявити до 67% культурально позитивних випадків. Повідомлялося, що супутня ВІЛ інфекція погіршує виявлення Mycobacterium tuberculosis у мокротинні, хоча деякі дослідники не повідомляли про який-небудь вплив серостатусу по ВІЛ на діагностику кислотостійких бацил (AFB). Високий відсоток позалегеневого ТБ у AFBпозитивних ТБ пацієнтів додатково збільшує число AFB-негативних випадків ТБ. Це робить діагностику туберкульозу ще більше складною та підкреслює термінову необхідність удосконалення лабораторних методів для його діагностики. Існуючі підходи для виявлення ТБ є недостатніми. Тест мокротиння для діагностики легеневого ТБ не завжди ефективний, особливо, якщо в мокротинні немає визначуваної бактерії, або зразок мокротиння не може бути одержаний. Крім того, даний діагностичний тест вимагає мікроскопії та/або культивування бактерій для підтвердження діагнозу, і жоден із цих способів не є особливо придатним для діагностики в польових умовах. Використання спинномозкової рідини для діагностики туберкульозного менінгіту також є проблематичним, особливо в польових умовах, оскільки, у черговий раз, для підтвердження діагнозу звичайно потрібні мікроскопія та/або культивування бактерій та/або ELISA аналіз. Дослідження крові для діагностики ТБ також відомі, але мають низьку ефективність, будучи складними та недостовірними. Дослідження сечі простіші та більш достовірні, але існуючі способи вимагають обробки сечі перед здійсненням діагностичного аналізу - така обробка звичайно включає концентрування сечі. Серед знов розроблених методів запропоновані тести з використанням антитіл проти ряду антигенів мікобактерій, але жоден із цих тестів дотепер не досяг необхідної специфічності для рутинної діагностики. Зниження чутливості при ВІЛ-позитивних випадках також є основним обмеженням. Існує інший підхід для оцінки імунної відповіді на специфічні антигени Mycobacterium tuberculosis, такі як ESAT-6, але дотепер диференціація між латентною формою ТБ інфекції та захворюванням ТБ не представляється можливою. Туберкульоз є винятково складною патологією, що існує в множинних формах, але завжди починається як повітряно-краплинна інфекція. Легеневий туберкульоз виникає негайно при потраплянні мікроорганізму, а позалегеневий туберкульоз є результатом подальшого проникнення в організм пацієнта з найпоширенішими прикладами туберкульозного менінгіту та кісткового туберкульозу. Складність патології визначає велику кількість різних способів діагностики, випробуваних протягом цього сторіччя сучасною медициною. Крім того, клінічні та рентгенологічні прояви легеневого туберкульозу при супутній ВІЛ інфекції різко змінюються через імунодефіцит. Дані фактори істотно обмежують можливість ранньої симптоматичної діагностики туберкульозу у пацієнтів з ВІЛ/TБ і, також, збільшують небезпеку передачі ТБ родичам і суб'єктам, що доглядають за таким пацієнтом. Мікобактерії потенційно можуть бути витягнуті з різних видів клінічних зразків, включаючи проби з верхніх дихальних шляхів (мокротиння, бронхіальні змиви, бронхоальвеолярний лаваж, бронхіальні біопсії та інші); сечі, калу, крові, спинномозкової рідини (ЦСР), біопсії тканин і глибоких пункційних біопсій практично будь-яких тканин та органів. Ба 5 92721 6 ктеріальне культивування залишається золотим Існуючі зараз способи мають наступні недолістандартом для діагностики туберкульозу, але ки. воно може зайняти більше 6-8 тижнів для винеДля проведення досить широко розповсюджесення заключного діагнозу. Існує три основних ного швидкого мікроскопічного тесту потрібно кільспособи, що застосовуються для швидкої (більш ка годин, досвідчений лаборант і клінічне лаборашвидкої, ніж бактеріальне культивування) діагносторне приміщення. Інтерпретація даних тики мікобактеріальних інфекцій: дослідження є занадто важкою процедурою у по- Пряма мікроскопія мазків мокротиння; рівнянні з діючими стандартами швидкої діагнос- Аналізи, основані на ПЛР; тики на місці (Point of Care, РОС) для району інфе- Імунодіагностичні способи. кційних захворювань. Реальна вартість одного Пряма мікроскопія мазків мокротиння. Більше аналізу на одного пацієнта коливається в діапазоні сторіччя назад, Роберт Кох ідентифікував етіологі100-150 доларів у лікарнях США. Клінічна специчний агент туберкульозу шляхом його фарбування фічність тесту є дуже гарною, але будь-які поліпта культивування із клінічних зразків. На сьогодні, шення специфічності будуть більш ніж бажаними. діагноз туберкульозу звичайно встановлюється Шкірний тест має достатню чутливість, але запри використанні методів фарбування та культиймає багато часу і не надає інформації щодо стадії вування, які по суті не відрізняються від тих, що патологічного процесу та недостатньо диференцізастосовував Кох. Пряма мікроскопія мокротиння ює інфікованих і вакцинованих суб'єктів. зараз є стандартом для діагностики туберкульозу Серологічні тести звичайно не мають достатв країнах, що розвиваються, і є еталонним тестом, ньої чутливості. Результати тесту змінюються завідносно якого повинна бути визначена ефективлежно від змін індивідуальної імунної реактивності ність будь-якого нового тесту. Це є застосовним на антигени ТБ. Дані тести є практично незастосодля легеневого туберкульозу, але не дуже ефеквними для ВІЛ пацієнтів, інфікованих М. тивно для дітей або пацієнтів з початковими стадіtuberculosis. Даний фактор істотно обмежує їхню ями легеневого туберкульозу. застосовність в африканських та багатьох азіатсьАналізи, основані на полимеразній ланцюговій ких країнах. Крім того, у США дана група пацієнтів реакції (ПЛР). Порівняльне вивчення ефективності становить більшість пацієнтів, інфікованих ТБ. ПЛР тестів у сімох лабораторіях показало високий Тести ПЛР широко застосовуються в розвинерівень помилково позитивних результатів ПЛР, що них країнах, але є складними, дорогими та не доколивається від 3% до 20% (з найбільшим 77% в сить чутливими для виправдання їхнього застосуодній лабораторії). Така відносно низька продуквання як перевірочних тестів в країнах, що тивність є результатом недостатнього контролю розвиваються. кожної стадії способу та недооцінок необхідності Кращий спосіб швидкої діагностики інфекційбільш ретельного якісного контролю під час проних захворювань оснований на виявленні бактеріведення всіх стадій аналізу. ального антигену в зразку пацієнта, що дає однозІмунодіагностичні способи начний доказ активного інфекційного процесу, Шкірний тест на туберкульоз. Даний тест є, викликаного специфічним патогеном. Концепція імовірно, найбільш старим імунологічним тестом застосування прямого антигенного тесту для вина туберкульоз. Невелика кількість речовини, наявлення мікобактеріальних інфекцій була описана зиваної ППД туберкулін, вводиться прямо під верв деяких публікаціях. хній шар шкіри на передпліччі за допомогою малеНаприклад, про розробку одного з перших нької голки. Тест оцінюють через 48-72 годин після прямих антигенних аналізів для М. tuberculosis введення речовини. Як правило, набрякання в 10 повідомлялося в 1982 - радіоімуноаналіз для вимм чи більше вважають позитивним результатом. явлення антигенів М. tuberculosis у мокротинні Багато країн, що розвиваються, застосовують пропацієнтів з активним легеневим туберкульозом з титуберкульозне щеплення (БЦЖ) для захисту використанням кролячих антитіл, специфічних до проти ТБ. Після вакцинації БЦЖ, шкірний тест із цільних клітин М. bovis (вакцина БЦЖ). АвтоклавоППД звичайно стає позитивним. Результати шкірване та оброблене ультразвуком мокротиння виного тесту коливаються залежно від якості антигекористовувалося як зразок. Аналіз виявляв антину ППД, реактивності імунної системи і, можливо, ген в 38 з 39 зразків мокротиння від пацієнтів з навіть від раси людини. Даний тест також не надає активним легеневим туберкульозом. певних критеріїв, що стосуються стадії та локаліУ більш пізніх дослідженнях описана розробка зації інфекційного процесу. системи ELISA для виявлення мікобактеріальних Серологічні тести на М. tuberculosis. Даний антигенів у спинномозковій рідині пацієнтів з тубеспосіб, оснований на виявленні імунної відповіді ркульозним менінгітом, також з використанням антитіл на мікобактеріальні антигени, є одним із антитіл, специфічних для цільних клітин М. bovis. широко використовуваних у дослідницькому та Обидві системи демонстрували разюче високу клінічному середовищах. Всі серологічні тести маспецифічність. Незважаючи на те, що LAM був ють приблизно однакові чутливість і специфічність основним антигеном, відповідальним за виявлену тому випадку, якщо використовуються очищені ня, повідомлялося, що М. kansasii продемонструантигени. Чутливість найкращих тестів находиться вав перехресну реактивність в 5% випадків, і М. в межах 80% для зразків, позитивних за мазком, і intracellulare, Μ. avium, M. fortitum та Μ. vaccae 60-70% для зразків, негативних за мазком. Надаперехресно відповідали лише в 2% випадків. Інвана чутливість, як правило, вище і становить 95шими описувалося виявлення способом ELISA 100%. мікобактеріального антигену в ЦСР у дев'яти з 12 пацієнтів з туберкульозним менінгітом, що відпові 7 92721 8 дає чутливості 81,25%. Специфічність тесту стаарабіноманані, полісахариді, присутньому на поновила 95%. верхні Mycobacterium tuberculosis - мікроба, відпоПрактично всі попередні спроби розробки тесвідального за розвиток туберкульозу у людей, як ту для діагностики туберкульозу були спрямовані розкрито в заявці РСТ WO97/34149, Svenson. Розна виявлення легеневої форми захворювання. крита діагностична система виявляла наявність Позалегеневі форми, які загальновідомо є важкиLAM у сечі пацієнта у 81,3% AFB-позитивних паціми для діагностування, притягали відносно невеєнтів та у 57,4% AFB-негативних пацієнтів і демонлику увагу внаслідок низької поширеності порівняструвала застосовність виявлення мікобактеріально з легеневою формою. До 1950-х та 1960-х, ного антигену LAM для діагностики позалегеневі випадки ТБ становили тільки близько мікобактеріальних інфекцій. У тої же час, розкрита 10% всіх випадків туберкульозу. Початок пандемії система виявилася невдалою для скринінгових ВІЛ/СНІД повністю змінив дану ситуацію. Ці два цілей. Незважаючи на застосування афінноочизахворювання в остаточному підсумку з'єдналися щеного кролячого поліклонального антитіла, спев нову комплексну проблему суспільної охорони цифічного до антигену LAM, система не мала досздоров'я. На сьогоднішній день щонайменше у татньої чутливості при використанні необроблених 60% нелікованих ВІЛ пацієнтів виявляється активнеконцентрованих зразків сечі. Діагностична проний ТБ протягом їхнього життя та до 70% пацієнтів цедура займала приблизно 24-48 годин складних з ТБ є ВІЛ-інфікованими в Чорній Африці та Азії. маніпуляцій у біохімічній лабораторії, пов'язаних з Сполучення ВІЛ і ТБ змінило не тільки епідеміолоконцентруванням сечі пацієнтів та її підготовкою гію туберкульозу, але й перебіг самого захворюдля аналізу тестом ELISA. В цілому, чутливість вання. Протягом останніх десятиліть ТБ розвився аналізу по Svenson є недостатньою для практичз переважно легеневої інфекції на багатобічну ного застосування даного способу. Складність і патологію з постійно зростаючою перевагою позатривалість імуноаналізу також перешкоджають легеневих форм. Ці дані показують, що позалегейого практичному використанню як скринінгового неві випадки ТБ на сьогодні включають до 30% тесту для виявлення мікобактеріальних інфекцій, всіх випадків туберкульозу; дана цифра може бути оскільки він виявився занадто важким для застонавіть занижена через недолік методів швидкого сування в клінічних умовах, де швидкість, легкість скринінгу та діагностування позалегеневих форм використання та висока чутливість є надзвичайно туберкульозу. Крім того, навіть легеневий туберважливими для діагностичних тестів, застосовувакульоз у ВІЛ-інфікованих пацієнтів часто проявляних для виявлення хворобливих станів. ється атипічними симптомами. Наприклад, у таких Розкриття винаходу пацієнтів мокротиння звичайно не виробляється. У першому втіленні винахід пропонує антигенДані фактори значно обмежують можливість ранно-активну ізоформу ліпоарабіноманану з нього симптоматичного виявлення туберкульозу Mycobacterium tuberculosis, одержану шляхом окидля пацієнтів із сукупною інфекцією ВІЛ/ТБ і також снення LAM з використанням способів м'якого окизбільшують небезпеку перенесення ТБ родичам та снення, як, наприклад, обробка низькими концентособам, що доглядають за такими пацієнтами. раціями NalO4. В інших втіленнях, антигенноТерміново необхідний простий у застосуванні активна ізоформа LAM, одержана методами поміскринінговий тест, здатний виявити широкий рного окиснення, застосовується для приготування спектр патологій, обумовлених інфекцією М. високоспецифічних, високоочищених антитіл проtuberculosis, включаючи тест для позалегеневих ти інактивованої мікобактерії, зокрема, проти поформ ТБ. Така необхідність обговорювалася проверхневих полісахаридів, таких як LAM, для виявтягом довгого періоду часу без успіхів у досягненні лення полісахаридів (напр. LAM) у сечі, поставленої мети. На сьогоднішній день необхідмокротинні, крові, тканині чи інших зразках від доність такого тесту для суспільної охорони здоров'я сліджуваного пацієнта. Інші втілення показують стала надзвичайною. застосування високоспецифічного, високоочищеВ інших випадках легеневих бактеріальних інного антитіла, виробленого проти антигеннофекцій сучасний скринінговий спосіб вибору осноактивної форми LAM, для діагностики туберкульований на виявленні полісахаридних антигенів, секзу у досліджуваного пацієнта. ретованих у сечу пацієнта. Бактеріальні В іншому конкретному втіленні надається пополісахариди складаються з моносахаридів, непуляція збагачених антитіл, високоспецифічних до звичайних для людей і, отже, стійких до розщепантигену поверхневого полісахариду мікобактерії. лення ферментами людини. Це уможливлює їхню У даному втіленні, популяція збагачених антитіл секрецію в сечу в імунохімічно інтактних формах, може бути збагачена шляхом вироблення їх в сепридатних для виявлення шляхом полісахаридсредовищі, що містить антигенно-активний антиген. пецифічного імуноаналізу. Надзвичайно низькі Альтернативно або додатково, антитіло збагачуконцентрації бактеріальних полісахаридів, секреють шляхом видалення антитіл, які розпізнають тованих у сечу, вимагають дуже високої чутливості відносно неактивний антиген. У деяких втіленнях, імуноаналізу для застосування його як скринінгомікобактерією може бути Mycobacterium вого способу. tuberculosis. Так само, поверхневим полісахариГрупи дослідників зі Швеції та Норвегії, що дом може бути ліпоарабіноманан (LAM). працюють у співробітництві, спробували розробиВ іншому втіленні винаходу пропонується споти LAM-специфічну систему ELISA, здатну виявлясіб одержання збагаченого антитіла, високоспети антиген LAM у сечі пацієнта. У системі викорисцифічного до антигену мікобактерії. У даному втітовувався принцип антигенної пастки для ленні, спосіб включає вироблення та виділення виявлення туберкульозу в сечі, оснований на ліпоантитіла проти антигену мікобактерій; і відділення 9 92721 10 від виділених антитіл тієї популяції антитіл, що є включає імунореактивне оточення для проведення специфічною до відносно неактивного антигену, аналізу, де оточення містить збагачене антитіло, для приготування виділеного збагаченого антитіяк описано вище. У близьких втіленнях імунореакла. тивне оточення включає ELISA, і може бути викоВ іншому втіленні запропонований спосіб оденане у вигляді стрип-тесту. У наступних близьких ржання збагаченого антитіла, високоспецифічного втіленнях, мікобактеріальною інфекцією може бути до антигену мікобактерії. У даному втіленні, спосіб Mycobacterium tuberculosis і антитілом може бути включає виділення антигену з мікобактерії в умоліпоарабіноманан (LAM). вах збереження його антигенної активності; і виКороткий опис фігур роблення антитіл проти ізольованого антигену, Для кращого розуміння викладених вище відпоки його антигенна активність збережена. мітних ознак винаходу нижче приводяться приклаУ ще іншому втіленні запропонований спосіб ди здійснення винаходу з посиланнями на приклаодержання збагаченого антитіла, високоспецифічдені фігури, на яких: ного до антигену мікобактерії. В даному втіленні, Фігура 1 демонструє структурну модель мікоспосіб включає нанесення сироватки крові ссавців, бактеріальних ManLAM, PILAM та AraLAM. заражених мікобактеріями, на перший афінний Фігура 2 показує порівняння серологічної актиматрикс, приготовлений з ізольованим антигеном з вності для експериментів з LAM. мікобактерії, при цьому антитіло, специфічне до Фігура 3 показує ефективність препаратів виділеного антигену, утримується першим афінLAM-специфічного AT у зв'язуванні при ELISA. ним матриксом; виділення антитіла, специфічного Фігура 4А. Чутливість LAM ELISA при різних до виділеного антигену з першого афінного матриконцентраціях LAM у сечі. Границею відсікання ксу; нанесення виділеного антитіла на другий була оптична густина негативного контролю + 0,1, афінний матрикс, приготовлений з модифікованим що забезпечувало мінімальну межу чутливості в антигеном з мікобактерії, при цьому таке антитіло, 0,25 нг/мл. специфічне до модифікованого антигену, утримуФігура 4В. Зв'язування LAM-специфічних антиється другим афінним матриксом, у якому модифітіл в ELISA з немікобактеріальними антигенами кований антиген оброблений речовиною для його було виключено для таких бактеріальних видів: деактивації по відношенню до ізольованого антиKlebsiella pneumoniae, Streptococcus agalactiae, гену; виділення збагаченого антитіла, специфічноStreptococcus pneumoniae 14/12F, Pseudomonas го до ізольованого антигену, шляхом збирання aeruginosa, Staphylococcus aureus 25923/43300, ефлюенту із другого афінного матриксу, внаслідок Proteus vulgaris, E. coli 8739, Neisseria meningitidis чого збагачене антитіло є більш високоспецифічA/B/13102, Haemophilus influenzae A/B/D. ним і виявляє більш високу чутливість до антигену Фігура 4С. Чутливість LAM ELISA для різномамікобактерії, ніж незбагачене антитіло. нітних мікобактеріальних штамів. LAM M. bovis та У наступних близьких втіленнях, мікобактерія М. tuberculosis виявлялися з найбільшою чутливісможе бути Mycobacterium tuberculosis, і поверхнетю. вий полісахарид може бути ліпоарабіномананом Фігура 5. Кореляція між мікроскопічною щільні(LAM). стю мікобактерій AFB-позитивних пацієнтів і конВ інших втіленнях, речовиною для модифікуцентрацією їхнього антигену, вимірюваною LAM вання антигену з мікобактерії є періодат натрію. В ELISA у необробленій сечі. інших близьких втіленнях, поверхневий полісахаAFB + (світлова мікроскопія 1000 збільшення: рид може бути виділений з ад'юванту Фрейнда. 4-90 кислотостійких бацил/100 полей) 28 випадків. Інше втілення надає спосіб виявлення мікобаAFB ++ (1-9/поле) 23 випадки. ктеріальної інфекції в зразку, узятому із суб'єкта. В AFB +++ (~10/поле) 20 випадків. Стовпчаста даному втіленні, спосіб включає забезпечення діаграма показує процентиль 10, 25, 50, 75, 90 і імунореактивного оточення, такого як оточення, середню концентрацію антигену. утворене на основі збагаченого антитіла, як опиФігура 6 показує схему способу очищення ансано вище; і проведення реакції зразка в імуноретигену відповідно до конкретних втілень заявленоактивному оточенні для виявлення мікобактеріаго винаходу. льної інфекції. Фігура 7 показує схему приготування афінних Необов'язково, мікобактеріальною інфекцією колонок відповідно до конкретних втілень заявлеможе бути М. tuberculosis або хвороба Джона. Так ного винаходу. само, поверхневим полісахаридом може бути ліФігура 8 показує схему способу очищення анпоарабіноманан (LAM). У наступних близьких втітитіл відповідно до конкретних втілень даного виленнях, імунореактивне оточення включає ELISA і находу. може бути виконане у вигляді індикаторної смужки Фігура 9 показує схему приготування кон'югату (стрип-тесту). У близьких втіленнях мікобактеріавідповідно до конкретних втілень даного винаходу. льна інфекція може бути легеневою формою інфеЗдійснення винаходу кції Mycobacterium tuberculosis або позалегеневою Визначення формою інфекції Mycobacterium tuberculosis, і зраНаступні терміни будуть мати зазначені зназок може бути будь-чим з мокротиння, крові, сечі, чення, якщо тільки інше не потрібне за контекстом: тканини, або іншим придатним зразком. У близьТермін "імунореактивне оточення", у викорискому конкретному втіленні зразком може бути неотовуваному тут значенні, позначає оточення, приброблена неконцентрована сеча. значене для імунологічних аналізів, імунних реакІнші втілення пропонують набір для діагностицій, імунохімії та будь-якого іншого способу, ки мікобактеріальної інфекції в зразку, набір, що методу, методики чи системи, які включають, сто 11 92721 12 суються або ґрунтуються на імунологічній реакції тільки в зразках, взятих у пацієнтів з легеневою для досягнення бажаного результату. Прикладами формою ТБ, оскільки позалегеневі форми інфекції імунореактивних оточень є ті, що докладно описані часто не супроводжуються утворенням мокротинSwanson et al. у патенті США 5073484; і Guire et al. ня, що містить антигени мікобактерій. Попередні у патентах США 5654162 та 6020147, що розкридослідження із сечею вимагали значних попередвають спосіб та пристрій для кількісного визначенніх обробок і дій, обмежуючи такі процедури в ня досліджуваної речовини в розчині, де конкретні польових умовах. Жоден з них не був ефективним втілення використовують імунохімічні реакції, у для діагностування позалегеневих форм мікобакяких досліджувана речовина та діюча речовина теріальних інфекцій, наприклад, таких, що винипредставляють різні частини специфічно зв'язаної кають у ВІЛ-інфікованих. пари ліганд (антиген) - антитіло (анти-ліганд). Ці Втілення даного винаходу долають труднощі патенти стосуються технології, реалізованої у вивідомих способів шляхом надання збагачених англяді, як ми називаємо в описі та формулі винахотитіл, які можуть застосовуватися для виявлення ду, "стрип-тест". антигенів мікобактерій в широкому спектрі різно"Ад'ювант Фрейнда" фірми Sigma, США. видів зразків із суб'єкта. Дані різновиди зразків Нами розроблений високочутливий спосіб для включають сироватку крові, кров, мокротиння, виявлення антигенів мікобактерій, зокрема, антизмиви, тканину та необроблену, неконцентровану генів М. tuberculosis, таких як поверхневі полісахасечу, поряд з іншими. риди ліпоарабіноманан (LAM) і споріднені види, у Ліпоарабіноманан (LAM) e ліпополісахаридом біологічних рідинах, які включають, без обмеженз молекулярною масою 17500, специфічним для ня, сечу. Дотепер тести такого роду виявляли нероду мікобактерій. Ліпоарабіноманан є комплексдостатню чутливість і були непридатними для неним полісахаридним антигеном, що складається з оброблених зразків сечі або для виявлення манозного та арабінозного залишків, які формують позалегеневих форм ТБ інфекції. Зокрема, ми росильно розгалужену та складну структуру. Незвазробили збагачені антитіла, які виробляються прожаючи на більш ніж сорокарічні дослідження політи антигенів мікобактерій, де антитіло збагачуєтьсахаридних антигенів мікобактерій, у даних досліся шляхом індукування в оточенні, що містить дженнях згадується тільки про фрагменти цих антигенно-активний антиген. Ми називаємо спосіб структур або структурних доменів і загальні модеодержання даного першого класу збагаченого анлі. Новітня загальна модель структури LAM предтитіла «прямий спосіб», який більш докладно опиставлена нижче на Фіг. 1. сано далі. Як частина зовнішньої клітинної стінки, LAM Ми також розробили антитіло, яке збагачують секретується з метаболічно активних або дегенешляхом видалення тих антитіл, що розпізнають руючих бактеріальних клітин. Вважається, що в відносно неактивний антиген. Спосіб одержання активній фазі ТБ інфекції LAM надходить в циркуцього класу антитіл починається з "прямого спосоляцію, проходячи через нирки і, таким чином, мобу" одержання збагачених антитіл, але потім також же бути виявлений у сечі, відображаючи рівень проводиться виключення антитіл, які впізнають мікобактеріального обсіменіння. Оскільки LAM є відносно неактивний антиген. Ми називаємо спосіб вуглеводним антигеном із глікозидними зв'язками, одержання цього другого класу збагачених антитіл для яких у людини не існує руйнуючих глікозидаз, "спосіб збагачення", який також докладно описуто антиген присутній у сечі в інтактній формі. ється нижче. Антиген LAM мікобактерії складається з трьох Фігура 8 є схематичним зображенням, що деосновних структурних доменів: манозилмонструє стадії практичного втілення способу збафосфатидил-міо-інозитол (МІР) якірного домену, гачення. Оскільки спосіб збагачення ґрунтується що містить різну кількість жирних кислот з різною на прямому способі, то Фігура 8 також ілюструє довжиною ланцюга, мананового корового полісапрямий спосіб, якщо зупинитися після першої кохариду з різною кількістю манозних залишків; і лонки для афінної хроматографії. розгалужених ланцюжків арабінанового полісахаДалі ми показуємо, як дані збагачені антитіла, риду, зв'язаного з манановим ядром. Незважаючи кожне окремо або обидва разом, можуть застосона численні дослідження, зв'язування ділянки(нок) вуватися для виявлення легеневої та позалегенеарабінанових ланцюжків з манановим ядром завої форм туберкульозної інфекції в різноманітних лишається невідомим. Ланцюжки арабінанового зразках, включаючи, без обмеження ними, необполісахариду покривають манозні олігосахариди, роблені (тобто, неконцентровані) зразки сечі. (Інші що складаються з моно-( 1-2)-ди- і ( 1-2)-триможливі джерела зразків включають мокротиння, манозильних одиниць, різних за довжиною (кепуюспинномозкову рідину, кров, тканину, змиви). У чі мотиви). Рівень кепування міняється від штаму прикладах, які наведені далі, збагачені антитіла до штаму і, можливо, також залежить від умов виробляються проти епітопа ліпоарабіноманану росту. (LAM) в оточенні, що зберігає його антигенну актиНадзвичайно висока структурна складність і вність. варіабельність мікобактеріального LAM спричиняє Попередні способи виявлення поверхневих таку ж складність спектра антигенних епітопів. полісахаридів (LAM), що використовують різні біоСкладність вибраного діагностичного антигену логічні рідини, такі як сироватка крові, сеча або підштовхнула нас до застосування афінно очищемокротиння, пророблені, але мають сумнівне підтного поліклонального антитіла як основного реагевердження. У сироватці крові, виявлення LAM імонту для імуноаналізу. Тільки застосування поліквірно ускладнено через утворення імунних комлонального антитіла дозволяє охопити разом весь плексів. Виявлення LAM у мокротинні можливо спектр антигенних специфічностей, потенційно 13 92721 14 зв'язаних з LAM, присутнім у клінічних зразках. імуноаналізі. Фіг. 3 демонструє ефективність такоЩоб домогтися максимально високої можливості го антитіла при іммобілізації антитіла. Коли таке для аналітичної чутливості сендвіч-аналізу, ми антитіло було помічене пероксидазою хрону (HRP) використовуємо високу концентрацію антитіла, і застосовано як мічене антитіло, то також була специфічного до антигену, у зоні зв'язування і, крім продемонстрована більш висока активність, ніж у того, мічене антитіло. Антиген-специфічне афінне будь-якого іншого антитіла, тестованого або відоочищення для приготування такого антитіла є вімого. Спосіб ELISA, оснований на такому антитілі, домим. показав дуже високу чутливість і довів придатність Для приготування колонки для афінної хромадля тестування неконцентрованих зразків сечі. Це тографії, основаної на антигені, ми розробили сподозволило нам створити скринінговий LAMсіб виділення антигену та його пришивання на специфічний імуноаналіз із технічними характеритвердофазову основу. Спосіб виділення антигену стиками, придатними для швидкого тестування в LAM оснований, з деякими незначними модифікапольових умовах для випадків як легеневого, так і ціями, на способах виділення інших бактеріальних позалегеневого ТБ, що раніше було нездійсненполісахаридів, описаних у літературі та добре віним. Таким чином, незважаючи на те, що повідомдомих з рівня техніки, і описується нижче. лялося про виявлення LAM у замороженій сечі ТБ Попередній прямий антигенний імуноаналіз, пацієнтів, аналіз в описаних випадках має потребу оснований на визначенні LAM, описаний у літерау великій пробопідготовці і, отже, не є адаптоватурі, полягав у використанні поліклонального антиним для польових умов. тіла, очищеного шляхом антиген-специфічної Протоколи афінної хроматографії при використанні LAMВ даному розділі ми описуємо протоколи, присефарозної колонки. Відомий з рівня техніки підхід датні для здійснення "прямого способу" та "спосодо синтезу афінного матриксу був оснований на бу збагачення", описаних вище. Дане обговорення частковому NаlO4-окисненні полісахариду LAM з не розглядає строго по суті прямий спосіб і спосіб наступним приєднанням до NН2-сефарози. На наш збагачення, але описує специфічні способи пригоподив, наші дослідження показали, що NаlO4тування колонок, придатних для застосування в окиснення антигенну активність полісахариду LAM, будь-якому з двох способів або в обох разом, заяк можна побачити з Фіг. 2. лежно від ситуації. Фігура 8 показує схему прямого Оскільки ефективність зв'язування окисненого способу та способу збагачення. полісахариду з NН2-твердою підкладкою перебуВиділення сухих клітин М. tuberculosis з ад'юває в пропорційній залежності від ступеня окисванту Фрейнда нення, ми приєднували до сефарозної підкладки Спочатку флакони з ад'ювантом Фрейнда виза допомогою функціонального BSA-спейсера мотримують для осідання клітин протягом мінімум 1 лекулу антигену LAM, окиснену в 50 мМ NаlO4. тижня при кімнатній температурі до початку викоПри такому ступені окиснення полісахарид LAM ристання. Забравши кришку із флакона з ад'юванще зберігає певну антигенну активність, як показатом і не порушуючи шару клітин, що осіли на дні но нижче, але забезпечує високу ефективність флакона, видаляють всю кількість мінерального зв'язування. Нанесення імунної сироватки на такий масла. Невелика кількість мінерального масла афінний матрикс приводить до виділення фракції може бути залишена у флаконі як запобіжний захід кролячого антитіла з високим виходом. Тестування для запобігання видалення клітинного осаду. Затакого антитіла в стандартних планшетах для твебирають мінеральне масло, потім змішують 6,0 л рдофазового імуноферментного аналізу (ELISA) з етанолу та 6,0 л діетилового ефіру і додають 5 мл іммобілізованими антитілами показало певну фунсуміші етанол:діетиловий ефір в кожен флакон. кціональну активність, але не на рівні, достатньоПотім закривають флакон, перемішують на му для застосування у високочутливому імунохімівортексі та швидко переносять суспензію в 1 л чному аналізі, необхідному для скринінгу зразків у колбу Ерленмейера. На цьому етапі слід уникати випадку використання неконцентрованих зразків повторного осідання клітин у флаконах. Коли 1 л сечі. Ці дані пояснюють результати, одержані раколба Ерленмейера заповнена до лінії 1 л, дають ніше в літературі, де використовувалося LAMклітинам осісти протягом 1-1,5 год. Потім обережспецифічне афінно-очищене антитіло, але було но декантують розчин з колби Ерленмейера в чиснеобхідно концентрувати зразки сечі для виявленту 1 л посудину. Слід уникати скаламучування осіня LAM, присутнього в зразках. лих клітин та видалення їх разом з розчином. Несподівана зміна хімічного способу зв'язуЯкщо розчин, перелитий у посудину, є прозорим, вання LAM на більш м'який недеструктивний спойого можна вилити. Якщо значна кількість клітин сіб, оснований на активації полісахариду бромисбуде перелита з розчином, повертають вилитий тим ціаном (CNBr), привела до очищення LAMрозчин у колбу Ерленмейера та повторюють етап специфічного антитіла набагато кращої якості, що осадження. Використовуючи 20-30 мл аліквоти можна побачити на Фіг. 3. суміші етанол:діетиловйй ефір, переносять клітини Крім того, несподіване пропускання антитіла, на фільтр із пористого скла. очищеного на колонці з інтактним LAM (CNBrПромивають клітини 500 мл суміші етанолактивування), через колонку з антигеном LAM, діетиловий ефір, потім промивають 200 мл діетипісля глибокого інтенсивного відновлення NalO4 лового ефіру. Потім клітини на фільтрі висушують (див. нижче), приводило до одержання відносно на повітрі, при використанні вакууму 100 мм рт.ст. невеликої частки антитіла, приблизно 7-10% від ± 10 (низький вакуум). Періодично перемішують і використовуваної кількості, з дуже високою активгомогенізують клітинну масу, потім покривають ністю в LAM-специфічному прямому антигенному фільтр пористим матеріалом (напр., таким як без 15 92721 16 ворсові серветки) і залишають на фільтрі до висиЗв'язування антигену LAM з BSA-спейсером хання (приблизно на 15 годин, тобто, на ніч). шляхом активації CNBr. Зважують і записують загальну масу та розраСпочатку готують розчини 0,5М бікарбонату ховують масу сухих клітин. Потім щільно закриванатрію та 1М карбонату калію. Потім розчиняють ють гумовою пробкою та зберігають при темпера30,0 г очищеного АГ LAM в 1,5 мл деіонізованої турі 15-30°С. води. Використовують обробку ультразвуком (імФенольна екстракція неочищеного LAM антипульси по 10-20 сек) і перемішують до повного гену розчинення LAM АГ. Поміщають сухі клітини М. tuberculosis в 250Розчиняють 300 мг BSA-гідразинового ліганду мл флакони з пірексного скла та додають до клітин в 15 мл деіонізованої води. Обробляють імпультеплу деіонізовану воду. Перемішують та обробсами ультразвуку (імпульси по 10-20 сек) і переміляють суспензію імпульсами ультразвуку (імпульшують на вортексі до повного розчинення, потім си по ~20 секунд) на ультразвуковій водяній бані переносять у центрифужні пробірки та центрифудо одержання гомогенної суспензії. гують протягом 10 хв. при 10000 об./хв. За допоКлітини екстрагують фенолом, потім осаджумогою пастерівської піпетки акуратно збирають ють етанолом та осаджені клітини поміщають у прозорий супернатант із кожної пробірки та поєдхолодильник (2-8°C) на ніч (~16 годин) для випанують всі супернатанти в 20 мл флаконі. Уникають дання осаду. Будучи дуже уважними, не порушуюскаламучування осаду, що може утворитися. До чи осад, акуратно видаляють супернатант доти, флакону додають 1 мл 0,5М бікарбонату натрію та поки не залишиться близько 100 мл супернатанта, добре перемішують струшуванням. До розчину що покриває осад. Обережно перемішують і переLAM додають 150 мкл охолодженого 1М карбонату носять суспензію, що залишилася, у тефлонові калію та добре перемішують коротким струшуванцентрифужні пробірки та центрифугують при ням на вортексі. Поміщають одержаний розчин на 12000 об./хв. протягом 20 хвилин. Видаляють якольодяну баню (лід/вода). мога більше супернатанта з усіх пробірок без поГотують 5 мг/мл CNBr в ацетонітрилі для нерушення осаду, додають 5 мл деіонізованої води в гайного використання і додають 180 мкл розчину кожну пробірку і, використовуючи перемішування бромистого ціану до розчину LAM. Перемішують та імпульсний ультразвуковий вплив, розчиняють на вортексі та поміщають на лід приблизно на 15 осад у воді. Поєднують всі фракції з розчиненим хв. Додають цей розчин до розчину BSAосадом і поміщають в 500-мл флакон (примітка: не гідразинового ліганду (див. вище) за допомогою перевищувати 1/10 об'єму флакона). Випарюють пастерівської піпетки. Добре перемішують та інкуна роторному випарнику до мінімального об'єму, бують протягом ночі (16-24 години) при 2-8°C у але уникають затвердіння зразка. Повторно розщільно закритій посудині. чиняють плівку в приблизно 50 мл води і повтоЗв'язування антигену LAM з BSA-спейсером рюють висушування та повторне розчинення до шляхом активації NalO4 висихання зразка 3 рази. Повторно розчиняють в Розчиняють антиген LAM в 1,25 мл деіонізова50 мл води та висушують. ної води в 3-4 мл флаконі. Обробляють імпульсаОчищення антигену LAM за допомогою хромами ультразвуку та струшують на вортексі до повтографії на Sephadex G-25 ного розчинення. Готують 0,1М розчин періодату Розчиняють 800 мг неочищеного антигену (АГ) натрію: (в NaOAc буфері, рН 4,0). Додають 1,25 мл LAM в 15 мл 0,25% розчину оцтової кислоти. Пе0,1М розчину NalO4 до 1,25 мл розчину LAM. Перемішують та обробляють ультразвуком в ультраремішують на вортексі. Накривають флакон алюзвуковій бані для повного розчинення. Центрифумінієвою фольгою, поміщають його на платформу гують у мікроцентрифузі при 5000 об./хв. протягом шейкера для перемішування протягом 1 години + 5 хв. Збирають супернатант в 20-мл скляний фла5 хв. при кімнатній температурі. Розчиняють 250 кон, розділяють супернатант на 3 еквівалентні чамг BSA-гідразинового ліганду в 12,5 мл деіонізовастини для окремих хроматографічних аналізів, і ної води в 25-40 мл скляному флаконі для сировапотім обережно наносять 1/3 АГ LAM супернатантки. Використовують імпульси ультразвуку та пета, зібраного раніше, на хроматографічну колонку. ремішування на вортексі для повного розчинення, Після того, як через колонку пройде 100 мл, почипотім центрифугують приблизно 10 хвилин при нають збирання фракцій. Продовжують збирання 10000 об./хв. За допомогою пастерівської піпетки фракцій доти, поки з початку хроматографії не акуратно збирають прозорий супернатант із кожної пройде 350 мл рухомої фази. Закривають всі пропробірки та поєднують всі супернатанти в 25-40 мл бірки із фракціями та зберігають при 2-8°C. Випаскляному флаконі. Уникають скаламучування осарюють на роторному випарнику в 250-мл флаконі ду. Додають у флакон 12,5 мл 0,1М фосфату надля випарювання (об'єм не більш 25 мл). Випарютрію (рН 6,8) і добре перемішують коротким струють до мінімального об'єму, але уникають затвершуванням на вортексі. діння зразка. Розбавляють випарений матеріал 20 Спосіб зв'язування: мл води, обробляють ультразвуком, перемішують До BSA-гідразинового розчину додають окисдо повного розчинення і потім ліофілізують (прибнений розчин LAM і перемішують. Додають 100 мг лизно 8 годин). Збирають висушений матеріал за ціаноборогідриду натрію та закривають. Відбирадопомогою шпателя в попередньо зважену скляну ють 10 мкл кінцевого розчину та розбавляють 90 пробірку та зважують. мкл 1 PBS буфера (QC розчин) і зберігають для Вищевикладені стадії схематично зображені подальших аналізів (концентрація LAM буде стана Фігурі 6. новити приблизно 0,75 мг/мл). Активація сефарози за допомогою NalO4 17 92721 18 Відміряють аліквоту суспензії сефарози 4B-CL, вручну до утворення суспензії. Гель вносять на що відповідає 80 мл осілого гелю, і переносять на колонку відповідно до стандартних способів, викофільтр із пористого скла. Промивають 500 мл води ристовуючи 1 PBS. Урівноважують колонку 1 та висушують, використовуючи низький вакуум PBS, що містить 0,1% азиду натрію. (близько 300 мм рт. ст.), доти, поки не виявиться Загальна схема зв'язування ліганду LAM з акзерниста структура гелевої поверхні. Уникають тивованою сефарозою (для приготування І та II утворення повітряних тріщин на гелевому шарі. афінних колонок) Готують 0,1М буферний розчин ацетату натрію, рН Відміряють об'єм суспензії активованої сефа4,0, і використовують його для приготування 30мМ рози, що відповідає 100 мл осілого гелю, і перенорозчину NalO4 в 0,1М NaOAc. сять на фільтр із пористого скла. Висушують гель Додають до гелю 250 мл 30 мМ NalO4 і ретепри використанні низького вакууму (300 мм рт.ст.) льно перемішують. Покривають суміш у флаконі до того, як гель ущільниться та зерниста структура алюмінієвою фольгою та поміщають на шейкерну гелю не стане видна, але уникають утворення тріплатформу з кутом 45° при середній швидкості на щин на поверхні гелю. Залишають підсушений 1,5 години ± 10 хвилин при температурі навколишгель для наступного застосування. нього середовища. Переносять на фільтр із порисРозчин BSA-LAM ліганду: того скла та відмивають 1 л води з використанням Натрій-фосфатним буфером (рН 6,8) розвонизького вакууму (близько 300 мм рт.ст.). Активодять до 100 мл приблизно 27,5 мл розчину ліганду ваний гель повинен бути приготовлений максимум BSA-LAM в 250 мл флаконі з пірексу. До розчину за 4 години до використання. додають 100 мг кристалічного ціаноборогідриду Зв'язування BSA-LAM ліганду з активованою натрію. Щільно закривають флакон, сефарозою (для синтезу першої та другої афінних .використовуючи придатну пластмасову пробку. колонок) Добре перемішують шляхом короткого струшуванПриготування матриксу ня при використанні вортексу. Розчин може опалеГотують 0,1% розчин азиду натрію в 1 PBS сцирувати, однак він не повинен містити осад. (фосфатно-буферний сольовий розчин). ВідміряМожуть бути помітні мікроскопічні бульбашки газу, ють об'єм суспензії активованої сефарози, що відутворені ціаноборогідридом натрію. повідає 60 мл осілого гелю (або іншого придатного Стадія зв'язування: матриксу), і переносять на фільтр із пористого До розчину LAM, приготовленого, як описано скла. Висушують гель, використовуючи низький вище, додають підсушений активований гель севакуум (300 мм рт.ст.), доти, поки гель не ущільфарози. Щільно закривають відповідною пластманиться та не стане видна його зерниста структура, совою пробкою. Ретельно змішують суспензію, але уникають утворення тріщин на поверхні гелю. використовуючи м'яке перемішування (середня Розчин ліганду BSA-LAM: швидкість) та інкубують близько 4 годин при темПриблизно 17-20 мл розчину ліганду BSA-LAM пературі 37±2°C, перемішують реакційну суміш розбавляють натрій-фосфатним буфером (рН 6,8) (шляхом перекидання) щогодини. Додають 7,5 мл в 250-мл середній колбі до 90 мл. Додають до роз1,5М Tris буфера та щільно закривають. Продовчину 90 мг кристалічного ціаноборогідриду натрію. жують інкубацію при 37±2°C протягом близько 16 Щільно закривають колбу, використовуючи для годин (всю ніч). цього відповідну пластмасову пробку. Добре зміПереносять реакційну суміш на фільтр із пошують шляхом короткого перемішування на вортеристого скла та збирають рідку фазу в чисту 100ксі. Розчин може опалесцирувати, однак він не 200 мл колбу Бунзена при використанні низького повинен містити осаду. Можуть бути помітні мікровакууму (300 мм рт.ст.). Промивають LAMскопічні бульбашки газу, утворені ціаноборогідрисефарозовий гель на фільтрі приблизно 800 мл дом натрію. деіонізованої води. Продовжують промивання Стадія зв'язування: приблизно 1,2 л 1 PBS. До розчину LAM, приготовленому, як описано Заповнення та зберігання колонки: вище, додають підсушений активований гель сеДо приготовленого гелю в 250 мл лабораторфарози. Щільно закривають і ретельно змішують ній склянці додають приблизно 160 мл 1 PBS. суспензію, використовуючи м'яке перемішування. Перемішують вручну (шпателем/скляною паличІнкубують приблизно 4 години при температурі кою) до утворення суспензії. Заповнюють колонку 37±2°C, перемішують (шляхом перекидання) реаку відповідності зі стандартними способами, викоційну суміш щогодини. Додають 4,5 мл 1,5М Tris ристовуючи 1 PBS. Урівноважують колонку 1 буфера та знову щільно закривають пробку. ПроPBS, що містить 0,1% азиду натрію. довжують інкубацію при 37±2°C протягом близько Вищеописані стадії, що включають застосу16 годин (всю ніч). вання очищеного LAM і приготування афінних коПереносять реакційну суміш на фільтр із полонок І та II, схематично зображені на Фігурі 7. ристого скла та збирають рідку фазу в чисту 100Виділення антитіла за допомогою афінної 200 мл колбу Бунзена при використанні низького хроматографії - І ("Прямий спосіб"). вакууму (300 мм рт.ст.). Промивають LAMГотують такі маточні розчини: сефарозний гель 400 мл деіонізованої води на 1 літр 0,1М гліцинового буфера та доводять фільтрі та продовжують промивання 600 мл 1 рН до 2,5 за допомогою 1М НСІ. PBS. 1 літр 3 PBS розчину (розбавляють 10 PBS Заповнення та зберігання колонки: вихідний розчин деіонізованою водою) та перевіДо приготовленого гелю в 250 мл лабораторну ряють рН і, при необхідності, повторно доводять склянку додають 100 мл 1 PBS. Перемішують до 7,2-7 ,4 за допомогою 1М НСІ або 1М NaOH. 19 92721 20 Продовжують збирання антитіл в Gly-HCI бу200 мл 1 PBS, що містить 0,1% розчин азиду фері доти, поки сигнал не почне швидко зменшунатрію. ватися. Припиняють збирання фракцій в той мо100 мл 0,5М розчину динатрійфосфату мент, коли сигнал впаде до рівня сигналу на (Na2HPO4) початку збирання (10-15% повної шкали). НейтраПриготування сироватки лізують зібраний розчин антитіл шляхом додаванПовільно розморожують заморожену сироватня до кожної 5-мл фракції 0,5 мл 0,5М Na2HPO4 із ку в холодильнику (близько 16 годин/всю ніч) до кроком 0,1 мл. Загальний доданий об'єм повинен повного розморожування. Вимірюють об'єм сиростановити 10% об'єму фракцій до нейтралізації. ватки та зважують 2,9 г хлориду натрію на кожні В процесі додавання Na2HPO4 буфера розчин 100 мл сироватки і додають до неї. Акуратно пеакуратно перемішують і поєднують нейтралізовані ремішують обертовими рухами до повного розчифракції. Вимірюють оптичну густину (OD) антитіл нення: кінцева концентрація повинна становити при довжині хвилі 280 нм по відношенню до конт0,5М NaCI. рольної проби, що містить тільки 0,1М Gly-HCI Центрифугують (4-8°C) при ~8000 g протягом буфер, і розраховують концентрацію антитіл. За20 хвилин, пастерівською піпеткою видаляють сулишають антитіла, зібрані при 2-8°С, мінімум на 3 пернатант із всіх центрифужних пробірок. Не подні для осідання ушкоджених антитіл. рушують осад. Фільтрують супернатант через лійДогляд за колонкою: ку, закриту ватною пробкою, і збирають фільтрат. Урівноважують колонку 1 PBS до нейтральЗібраний фільтрат повинен бути злегка опалесценого рН (рН 7). Під час зберігання урівноважують нтним, але не повинен містити ніяких частинок колонку 1 PBS з 0,1% розчином азиду натрію та осаду. Поміщають профільтровану сироватку в холодильник до використання. зберігають колонку при температурі 4-8°C до наНанесення сироватки на колонку: ступного використання. Готують колонку І (не модифікований LAM, Діаліз приєднаний до матеріалу колонки) для нанесення Центрифугують приготовлені антитіла при сироватки шляхом урівноважування з 1 PBS. 10000 g протягом мінімум 5 хвилин. Переносять Установлюють швидкість потоку 2,0 мл/хв. і просупернатант у діалізну трубку з порогом відсікання довжують промивання 1 PBS доти, поки нульова по мол.вазі 12-14 кДа та проводять діаліз проти 1 базова лінія не буде залишатися на постійному PBS протягом 2-3 днів з 4-разовою заміною буферівні протягом щонайменше 1 години. Установлюра, при цьому співвідношення розчину антитіл до ють нульову відмітку для самописа та детектора, загального об'єму становить 1:20. Видаляють як необхідно. Як тільки нульова лінія стане постійантитіла з діалізної трубки. Вимірюють об'єм розною, установлюють швидкість потоку до 0,5-0,6 чину антитіл за допомогою скляного мірного цилімл/хв, і потім наносять сироватку, приготовлену ндра. У випадку, якщо там присутні які-небудь дораніше, на LAM афінну колонку І при швидкості даткові зруйновані/порушені (у вигляді осаду), потоку 0,5-0,6 мл/хв. Збирають вільний об'єм елюрозчин антитіл знову центрифугують при 10000 g енту (який повинен становити приблизно 30% протягом мінімум 5 хвилин. Вимірюють оптичну об'єму колонки). Здійснюють контроль фракцій за густину (OD) антитіл при 280 нм після встановлендопомогою УФ детектування при довжині хвилі ня нуля спектрофотометра по 1 PBS буферу. 260-280 нм і, коли сигнал збільшується, починають Розраховують концентрацію в мг/мл і поміщають збирання сироватки, пропускаючи через колонку на зберігання при 4-8°C. 500-1000 мл сироватки. Після того, як весь об'єм Виділення антитіла шляхом афінної хроматогсироватки нанесений на колонку, короткочасно рафії - II ("Спосіб збагачення") зупиняють протікання через колонку, вводять 3 Очищення високоспецифічних антитіл PBS буфер, і потім відновлюють течію рідини. Пропускають 1 PBS через LAM афінну колону Продовжують промивати колонку 3 PBS до зме2, приготовлену раніше (LAM, модифікований ншення сигналу приблизно на 50% від нульової шляхом сильного окиснення, з'єднаний з матеріалінії. В цей момент припиняють збирання сироватлом колонки при використанні NаlO4), при швидкоки та зберігають всі зібрані фракції. Змінюють сті потоку 2,0 мл/хв. поки нульова лінія не стане швидкість потоку до 2,0 мл/хв. і продовжують пропостійною протягом, щонайменше, 15 хвилин. мивати колонку PBS доти, поки нульова лінія не Установлюють самопис і детектор на нульовій стане приблизно 10-15%. Елюат викидають. Замівідмітці, як це необхідно. Продовжують контролюняють 3 PBS буфер на 1 PBS буфер і промивавати нульову лінію протягом наступних 30 хвилин ють приблизно 2-2,5 об'ємами колонки при швиді, як тільки вона стане постійною, наносять антитікості потоку 2,0 мл/хв. Елюат викидають. ла на колонку. Установлюють швидкість потоку Стадія елюювання антитіл: 0,5-0,6 мл/хв. і наносять об'єм антитіла, приготовУстановлюють швидкість потоку 1,0 мл/хв. Заленого раніше, що відповідає ~100-150 мг AT на міняють 1 PBS на охолоджений 0,1Μ Gly-HCI буLAM афінну колонку 2, застосовуючи перистальтифер, приготовлений раніше, і починають елюючний насос Есоnо або аналогічний пристрій. Збивання антитіл, що зв'язалися. Коли сигнал швидко рають вільний об'єм елюату (який буде становити збільшиться та досягне близько 10-15% повної приблизно 30% об'єму колонки), контролюючи OD шкали, починають збирання елюату в 15 мл конічні при 280 нм. Починають збирання антитіл у тої мопробірки, поміщені на льодяну баню (0°C ). Збимент, коли сигнал збільшиться на ~10-15% вище рають фракції по 5 мл. нульовій лінії, у чистий флакон для сироватки. Коли весь об'єм антитіл буде нанесений, коротко 21 92721 22 Установлюють Moduline 300 System на провечасно зупиняють потік рідини, наносять 1 PBS дення 3-х циклів промивання з наступним негайбуфер і відновлюють потік рідини при 0,5-0,6 ним проведенням зупинного циклу 312 мкл блокмл/хв. Продовжують збирати матеріал, що прохорозчину. Блок-розчин повинен бути застосований дить через колонку, контролюючи OD при 280 нм. протягом максимум 24 годин з моменту завершенКоли сигнал дійде до 10-15% вище початку збиня приготування. рання (30-50% вище нульової лінії), зупиняють Забирають планшети з холодильника і забизбирання розчину. рають накривні планшети з наборів у тому порядВимірюють OD високоспецифічних антитіл при ку, як вони були поміщені на Moduline, та відкла280 нм і розраховують концентрацію антитіл. Недають їх убік. Встановлюють таймер на 6 годин. гайно поміщають розчин антитіл для тимчасового Установлюють блоковані планшети, що надійшли зберігання при 4-8°C. з конвеєра, на послідовні пронумеровані підставки Промивання колонки та блокують протягом 5-6 годин при температурі Продовжують промивання колонки 1 PBS при навколишнього середовища (20-28°C). швидкості потоку 2,0-2,5 мл/хв. Пропускають як Поміщають планшети на підставках у сушильмінімум 3 об'єми колонки 1 PBS. Елююють матену камеру та інкубують при 20-23°C і відносній воріал, адсорбований на колонці, охолодженим 0,1Μ логості повітря 20-22% протягом 24-72 год. ВийGly-HCI буфером, приготовленим вище. Збирають мають сухі планшети із сушильної камери. елюйований матеріал у скляні флакони. Коли конПриготування МТВ-АТ для кон'югації з пероктрольний сигнал знизитися до ~10-15% від нульосидазою хрону (HRP) вої лінії, зупиняють збирання. Нейтралізують зіб(Приготування розчину МТВ-АТ повинно бути раний розчин антитіл шляхом додавання 10% від здійснене, щонайменше, за 7 днів до процедури загального об'єму 0,5М фосфату натрію, приготокон'югації). вленого раніше, додаючи по 0,5 мл. Вимірюють Діаліз: OD антитіл при 280 нм і розраховують концентраПроводять діаліз необхідної кількості розчину цію антитіл. Відразу ж поміщають зібраний розчин MTB-LAM-AT проти 1 PBS протягом мінімум антитіл при 4-8°C і залишають доти, поки буде 48год. з мінімум 4 замінами при 2-8°C. Використозавершений аналіз антитіл, зібраних на вищевкавують діалізні трубки з відсіканням по молекулярзаній стадії. Якщо концентрація вищевказаних анній вазі 12000-14000. Після діалізу центрифугують титіл становить менше 0,3 мг/мл, концентрують. розчин AT при 12000 об./хв. протягом 10 хв., і акуПромивають колонку 1 PBS, мінімум 3 об'єратно переносять супернатант в 15 мл градуйовані мами колонки, при швидкості потоку 2,0-2,5мл/хв. центрифужні пробірки. Колонку промивають знову 1 PBS з 0,1% азидом Вимірюють OD розчину AT після діалізу при натрію, 1 об'ємом колонки, і зберігають при 4-8°C 280 нм і розраховують концентрацію AT після діадо наступного використання. лізу. Якщо розчин AT після діалізу має Вищевикладені стадії, що демонструють видіOD280нм>2,8, розбавляють розчин AT 1x PBS у лення збагачених антитіл на афінних колонках І та співвідношенні 1:7. II за допомогою застосування прямого способу та Концентрування: способу збагачення, схематично представлені на Промивають пристрій фільтрів для центрифуФігурі 8. гування Amicon Ultrafree-15 1 PBS. Поміщають Спосіб сенсибілізації планшетів для ELISA. приблизно 15 мл розчину 1 PBS у пристрій і Пристрій системи Moduline 300 System центрифугують при 3500 об./хв. протягом приблиСенсибілізація антитілами повинна бути завезно 5 хв. Видаляють весь розчин з елементів приршена не пізніше 8 годин з моменту закінчення строю. Концентрують вищевказаний розчин AT приготування сенсибілізуючого розчину М815. Сепісля діалізу за допомогою пристрою фільтра для нсибілізуючий розчин антитіл повинен зберігатися центрифугування Ultrafree-15 до 4,5-5,5 мг/мл на льоду (0°C) протягом процесу іммобілізації. шляхом центрифугування на настільній центрифуПерша стадія зі (бакет-ротор) при 3500 об./хв. протягом близько Попередньо порівнюють і ретельно оглядають 5 хв., тричі. Акуратно видаляють концентрований порожні планшети та забирають будь-які зіпсовані розчин AT з фільтруючого елемента пристрою планшети. Розливають по 100 мкл MTB-LAM спеAmicon в 15 мл пробірку. Для максимального збицифічного сенсибілізуючого розчину AT в кожну рання, видаляють концентрований зразок відразу лунку кожного ряду планшета, застосовуючи ж після центрифугування та ресуспендують конModuline 300 System. Візуально перевіряють всі 96 центрований об'єм кілька разів за допомогою піпелунок у кожному планшеті для забезпечення рівтки для забезпечення оптимального перемішуванномірності заповнення лунок під час процесу імня та видалення AT. мобілізації. Зберігають невикористаний розчин AT Центрифугують концентрований розчин AT і зберігають при 2-8°C доти, поки не оброблять і не при 10000 об./хв. протягом близько 15 хв. і перевитратять весь набір планшетів. Укладають планносять супернатант з AT в 15 мл пробірку. Вимішети з розлитими AT в стопки по 10 планшетів у рюють OD280 розчину AT при розведенні 1:20 1 кожній та накривають верхній планшет порожнім PBS і розраховують концентрацію AT. планшетом, який використовується як кришка. Відбирають 0,1 мл розчину AT для аналізу меПідписують кожен планшет, що накриває набір, тодом ELISA. Зберігають при 2-8°C. цифрами від 1 до 18. Охолоджують набори планПриготування кон'югату MTB-LAM-AT-HRP шетів при 2-8°C та інкубують всю ніч (14-18 годин). Промивають всі скляні пробірки і магнітні міДруга стадія: шалки для стадії кон'югації та скляні пробірки для 23 92721 24 зберігання кон'югату розчином H2SO4 та ретельно Концентрування окисненої HRP прополіскують їх водопровідною водою та деіоніПопередньо промивають пристрій фільтра для зованою Н2О. центрифугування Ultrafree-15 1 мМ ацетату наПриготування колонки Sephadex G-25 для трію, рН 4,4, приблизно 15 мл 1 мМ ацетату нахроматографії: трію, рН 4,4, і центрифугують фільтруючий елемент протягом приблизно 5 хв. при 3500 об./хв. за Беруть колонку (1,5 30 см) із приблизним допомогою настільної центрифуги (бакет-ротор). V=50 мл, заповнену Sephadex G-25 (Fine). ЗаповПотім видаляють всі розчини з фільтруючого еленюють колонку, як описано вище. Установлюють мента. Негайно після хроматографії концентрують наступні умови хроматографії для урівноважуванокиснений розчин HRP (вищевказаний) до близько ня колонки 1 мМ ацетатом натрію: 2±0,2 мл за допомогою фільтра для центрифугу- Ацетатний буфер, рН 4,4. вання Ultrafree-15 (мембранний фільтр Віотах-10K) - УФ проточний спектрофотометр із довжиною шляхом центрифугування при 3500 об./хв. протяхвилі 280 нм гом приблизно 5 хв. Ретельно збирають концент- Чутливість спектрофотометра: 0,2 OD рований розчин HRP з фільтруючого елемента - Швидкість реєструючого записуючого припристрою в чисту скляну пробірку, вимірюють і строю: 2 мм/хв. записують об'єм і зберігають при 2-8°C. - Швидкість подачі рідини для промивання коКон'югація HRP з MTB-LAM-AT лонки: 60 мл/год. Розраховують об'єм розчину MTB-LAM-AT, неПромивають колонку приблизно 100-150 мл 1 обхідний для кон'югації з HRP. Поміщають MTBмМ ацетату натрію, рН 4,4, і встановлюють базову LAM-AT (вищевказаний) до V-подібної скляної лінію УФ спектрофотометра на нульову позицію. пробірки з трикутною магнітною мішалкою, не заСтежать за тим, щоб установлена базова лінія лишаючи розчин AT на стінках пробірки. Додають залишалася незмінною протягом близько 30 хв. 1/2 об'єму окисненого розчину HRP (вищевказаноРозраховують кількість розчину MTB-LAM-AT, него) до розчину MTB-LAM-AT, закривають пробірку обхідного для кон'югації, і центрифугують AT при алюмінієвою фольгою для захисту реакційної су12000 об./хв. протягом приблизно 10 хв. Акуратно міші від світла та перемішують реакційну суміш у збирають супернатант AT у чисту скляну пробірку. скляній пробірці протягом 30 хв. при кімнатній теВимірюють OD280нм розчину AT у розведенні 1:20 мпературі. Уникають утворення піни. 1 PBS і розраховують концентрацію нерозведеДодають 1М карбонат-НСІ для доведення до ного розчину AT. Зберігають розчин AT при 2-8°C рН 9,5 і перемішують при кімнатній температурі до використання. протягом двох годин. Захищають від світла та униОкиснення HRP (пероксидази хрону) з викорикають утворення піни. станням NаlO4: Готують 4 мг/мл борогідрид натрію (NaBH4) Зважують 8 мг HRP у V-подібній скляній пробібезпосередньо перед використанням і захищають рці. Додають 2,0 мл деіонізованої Н2О. Обережно від світла за допомогою алюмінієвої фольги. Неперемішують розчин протягом близько 2-3 хв. для гайно додають розраховану кількість NaBH4, необтого, щоб HRP розчинилася. Стежать за тим, щоб хідну для розчину MTB-LAM-AT, приготовленого не залишалося нерозчинених частинок HRP на раніше, та інкубують реакційну суміш при приблистінках скляної пробірки. зно 2-8°C протягом 2 год. Проводять діаліз реакГотують свіжий розчин 0,1М NalO4, рН 4,4, для ційної суміші проти 1 PBS протягом мінімум 48 використання протягом 5 хвилин та охороняють год. при 2-8°C з мінімум 4 замінами буфера з 8-16від потрапляння світла. Додають 0,4 мл 0,1М годинними інтервалами. Для діалізу використовуNalO4 до розчину HRP, приготовленого раніше, ють діалізну трубку з відсіканням по молекулярній при перемішуванні. Закривають пробірку алюмінівазі 12-14 кДа. євою фольгою для захисту суміші від потрапляння Збереження та аналіз кон'югату: світла. Інкубують суміш протягом 20 хв. при переПісля діалізу центрифугують розчин кон'югату мішуванні при температурі навколишнього серепри 4000 об./хв. протягом приблизно 4 хв. Акуратдовища. До реакційної суміші додають 4 краплі но витягають супернатант і поміщають розчин етиленгліколю та перемішують приблизно 2 хв. кон'югату в чисту 6 мл скляну пробірку. Відміряють Хроматографія та концентрування окисненої 18 мл стабілізатора кон'югату пероксидаHRP: зи/розріджувача Gardian в 50 мл скляну колбу з Негайно після завершення стадії 5.4.7 очищамагнітною мішалкою. Додають 2 мл кон'югату ють окиснену HRP шляхом гель-фільтрації на коMTB-AT-HRP і перемішують реакційну суміш пролонці Sephadex G-25 (Fine). Установлюють швидтягом приблизно 10 хв. Зберігають при 2-8°C і закість потоку рідини для елюції зразка приблизно 50 хищають від світла. мл/год. Ретельно переносять загальний об'єм окиВищевказані стадії, що стосуються приготусненої HRP, приготовленої раніше, на шар підсування кон'югату МТВ, схематично представлені на шеного гелю, але при цьому стежать за тим, щоб Фігурі 9. шар гелю не порушувався. Не допускають висиРезультати хання гелю. Збирають весь окиснений розчин HRP Далі ми представляємо результати дослі(забарвлений розчин) в одну 15 мл пробірку - педження безпосередньо антигену методом ELISA, рший пік на хроматографічній діаграмі який дозволяє виявляти LAM у необробленій не(OD280нм>0,05). Після завершення хроматографії, концентрованій сечі за допомогою "прямого споочищають колонку Sephadex G-25, викидають гель собу", що застосовується для приготування збагаі записують об'єм розчину HRP після хроматограченого антитіла. (Гадаємо, що ще кращий фії. 25 92721 26 результат буде досягнутий при застосуванні збазастосуванні селективного окиснення LAM, де дві гачених антитіл, приготовлених за допомогою ізоформи були повністю ідентифіковані та розріз«способу збагачення», описаного вище). Дослінені (дані не представлені). Одна ізоформа містидження, що представляють дані результати, були ла ділянки, чутливі до високих концентрацій періопроведені в області Мбея, що знаходиться на Півдату натрію (NalO4), так що при високих денно-Західному нагір'ї Танзанії, разом з Регіонаконцентраціях періодату натрію серологічна актильною програмою з ТБ та прокази та Медичним вність LAM зводилася до нуля. Інша ізоформа дослідницьким проектом Мбея (MMRP). В області зберігала серологічну активність навіть тоді, коли Мбея щорічно діагностується приблизно 3500 нопіддавалася впливу високих концентрацій періових випадків ТБ і лікування проводиться відповіддату натрію. Порівняння двох способів окиснення но до національної стратегії DOTS. Початок кожноLAM із застосуванням будь-яких м'яких окисників го лікування починається в центральному або низьких концентрацій NalO4 показало, що анвідділенні Мбейського лікувально-діагностичного тигенна активність LAM зберігається. Окиснення центра. Показник ефективності лікування ТБ стависокими концентраціями NalO4, однак, приводить новив 72,3% у 2002 р. Мета дослідження полягала до втрати антигенної активності LAM. у визначенні ефективності комерційно доступного Таким чином, тільки LAM, активований CNBr, аналізу ELISA з іммобілізованим LAM у клінічній або окиснений м'якими окисниками чи низькими практиці та порівнянні результатів із золотим стаконцентраціями NalO4, може використовуватися ндартом діагностики ТБ: мікроскопія мокротиння, для створення високоантигенного LAM для застоТБ-культивування, рентгенограма легенів і клінічне сування у приготуванні високоспецифічних, висодослідження. коочищених поліклональних антитіл для застосуМатеріали та методи вання у виявленні LAM у зразках сечі для Опис LAM-ELISA діагностування ТБ у обстежуваних пацієнтів. MTB-ELISA прямий імуноферментний сендвічДані результати є цілком несподіваними при аналіз антигену (MTB-ELISA, Chemogen, So. їхньому порівнянні зі способами виявлення, розкPortland, ME, США) є подібним до методу LAMритими Svenson et al. (див., напр., WO97/34149), у ELISA, розробленого іншими. Імунна сироватка яких застосовували тільки високі концентрації була одержана з білих новозеландських кроликів, NalO4 для окиснення мікобактеріального LAM, і яких імунізували інактивованими цільними кліткавідповідно порушувалася антигенна активність ми М. tuberculosis лінії H37Rv. Поліклональні LAMLAM, використаного для створення антитіл. Не специфічні антитіла були виділені шляхом афінної знаючи про те, що існує більш ніж одна ізоформа хроматографії при використанні іммобілізованого LAM, було неможливо раніше одержати високосLAM як ліганду. Тест-набір складається з 96пецифічні антитіла до антигенно-активної форми лункового планшета для ELISA, на якому попереLAM, оскільки ніхто до даних досліджень навіть не дньо іммобілізували LAM-специфічне антитіло, припускав існування особливої ізоформи, що виблокованого та закритого в пластиковому пакеті з являє антигенну активність, або того, що така акосушувачем; флакон з LАМ-специфічним HRPтивність втрачається під час проведення стандаркон'югованим LAM-специфічним поліклональним тних способів окиснення, а саме, обробки антитілом; флакона з однокомпонентною хромовисокими концентраціями NalO4. генною речовиною ТМВ; флакона з негативним Опис клінічних умов контрольним розчином, і трьох флаконів з калібПротягом восьми тижнів 242 пацієнта з підозрованими маркерами, що відповідають 0,5 нг/мл, рами на ТБ були прийняті в амбулаторних відді1,5 нг/мл та 4,5 нг/мл LAM у зразках сечі. Зразки леннях 5 клінічних центрів у Мбеї, Танзанія. Стансечі вважалися позитивними при аналізі ELISA, дартні протоколи обстеження включали клінічну якщо одержана оптична густина при 450 нм була оцінку, рентгенограму легенів, ШОЕ, кількість лейщонайменше на 0,1 вище сигналу негативного коцитів і тест на ВІЛ, 3-кратне AFB-фарбування контролю (>2SD). мокротиння (Циль-Нільсен) на 1, 2 та 3 дні, кульПроби сечі пацієнта об'ємом 0,1 мл поміщають тивування 2-х зразків мокротиння на середовищі у планшет для ELISA у двох повторах, інкубують Левенштейна-Йенсена та аналіз сечі та сироватки протягом 1 години та відмивають 0,05% розчином методом LAM-ELISA. Tween-20/PBS (PBST). Додають 0,1 мл LAMВсі пацієнти мали клінічні симптоми ТБ (каспецифічного HRP-кон'югату. Після 1 години інкушель >4 тижнів, нічна пітливість, втрата ваги, бації планшет промивають розчином PBST і довтрата апетиту). Сто тридцять сім з них мали ладають 0,1 мл субстрату ТМВ. Після 10 хвилин інбораторно підтверджену легеневу форму ТБ кубації зупиняють реакцію субстрату додаванням (ЛТБ), 9 мали сильну підозру на ЛТБ за результа0,1 мл 1М H2SO4 і забарвлення реєструють при тами рентгенографії (плевральні випоти або збі450 нм. льшені прикореневі лімфатичні вузли), і у 8 виявиВ інших втіленнях, специфічну ізоформу ліполися клінічні та рентгенологічні ознаки «воєнного» арабіноманану (LAM), визначувану за рівнем антиТБ. Пацієнти, що дали згоду, були протестовані на генної активності, застосовують для приготування ВІЛ статус і 70% були підтверджені як ВІЛвисокоспецифічних поліклональних антитіл, які позитивні. З результатами поводилися конфідензастосовують для виявлення ліпоарабіноманану ційно. Дослідження було схвалено місцевою Інстимікобактерії в сечі пацієнтів, обстежених на наявтутською наглядацькою радою та Національним ність активної форми туберкульозу, при застосукомітетом з етики Республіки Танзанія. ванні протоколів, подібних до описаних вище. Антигенно-активна ізоформа LAM була виявлена при 27 92721 28 Всі лабораторні процедури здійснювалися в ними та рентгенологічними ознаками і (3) хворі з лабораторному відділенні Мбейського медичного клінічними симптомами ТБ, які не були передбачудослідницького центра. ваними ТБ хворими, тому що результати всіх заМікроскопія та культивування зразків мокрогальнодоступних діагностичних методів (рентгенотиння графія, мікроскопія та культивування мокротиння) Забарвлення за методом Циль-Нільсена та мібули негативними. кроскопія здійснювалися досвідченим і добре підПерша група включала 137 пацієнтів, які мали готовленим техніком-лаборантом. Після спеціальлабораторно підтверджений легеневий ТБ. У 132 ної обробки зразки мокротиння культивували в було підтвердження культивуванням на середосередовищі Левенштейна-Йенсена у двох повтовищі Левенштейна-Йенсена і п'ятеро мали негатирах. Культури перевіряли щотижня на ріст протявний результат по культивуванню та AFBгом 8 тижнів. позитивний. З 132 позитивних випадків по культиЗразки сечі вуванню 62,12 % були AFB-позитивними. Від кожного пацієнта збирали 30 мл сечі в стеДруга група включала 17 інших пацієнтів, які рильний пластиковий контейнер, який позначали були включені в терапевтичну програму DOTS, на кодовим номером, що відповідає карті даних паціпідставі рентгенографічних та клінічних даних єнта. 100 мкл свіжої та необробленої сечі додава(Таблиця 1). 88 пацієнтів третьої групи мали негали в лунки планшета для ELISA у двох повторах. тивні результати мокротиння і у них не виявлялося Негативні контролі, низько-, середньо- і високопоспецифічних рентгенологічних ознак легеневого зитивні контролі також додавали до кожного ТБ, отже, вони не були включені в програму DOTS. планшета у двох повторах. Зразки оброблялися Середній вік учасників дослідження становив протягом 24 год. і потім зберігалися при -20°C для 34 роки. Співвідношення жінок до чоловіків станонаступного тестування в Німеччині. вило 41:59. Загальний рівень поширеності ВІЛ сеГрупи контролю з Танзанії та США ред 223 пацієнтів, які погодилися бути протестоваЗразки сечі 23 співробітників Мбейського Лікуними на ВІЛ, становив 69,1% (див. Таблицю 2). вально-діагностичного центра, 20 співробітників Рівень поширеності ВІЛ становив 73,2% серед Chemogen, Inc. і 200 пацієнтів з 2 клінік у Ньюпацієнтів з підтвердженим ТБ і 60,8% серед пацієЙорку були протестовані методом LAM ELISA. Всі нтів без підтвердженого ТБ. вони здавалися здоровими в процесі клінічного Клінічна оцінка ELISA дослідження та не мали ніяких симптомів респіраЗ 137 пацієнтів з підтвердженим легеневим ТБ торних інфекцій. (культивування або AFB-позитивне забарвлення) Результати 111 були LAM-ELISA позитивними (чутливість Доклінічна апробація способу ELISA 81,02 %) за попередньо визначеним відсіканням Фіг. 4А демонструє криву концентраційної за(оптична густина (OD) негативного контролю + лежності при використанні різних концентрацій 0,1). Середнє перевищення OD (= середнє арифLAM у сечі. Оптимальна точка відсікання визначаметичне OD - OD негативного контролю) для групи ється, відповідно до даної кривої, як концентрація (82), позитивної по мікроскопії мазка та культивуLAM, що забезпечує оптичну густину (OD), яка ванню, становило 0,604. Для негативних по мазку і перевищує OD негативного контролю на 0,1 OD, позитивних по культивуванню випадків (50) середщо відповідає більш ніж 2 стандартним відхиленнє збільшення OD дорівнювало 0,293, і для позиням вище сигналу зразка негативного контролю. тивних по мазку, але негативних по культивуванВсі зразки з оптичною густиною вище даного відсіню, випадків (5) - 0,249. кання вважалися ELISA-позитивними. Відсікання З 17 пацієнтів другої групи, які були негативвідповідало приблизно 0,25 нг/мл LAM у необробними за результатами культивування та AFBленій свіжій сечі. забарвлення, але мали рентгенологічні та клінічні MTB-ELISA оцінювали на перехресну реактивознаки ТБ, 13 (76,47%) мали позитивні результати ність з іншими видами та родами грампозитивних і тесту LAM-ELISA із середнім перевищенням OD грамнегативних бактерій, типових для інфекцій 0,183. З них 13 (76,47%) були ВІЛ-позитивними. сечової системи та бактеріальної пневмонії. ЖоРешта 88 пацієнтів, які потрапили в спеціаліден з тестованих зразків не показав якої-небудь зовану ТБ клініку із клінічними симптомами, що реактивності в оцінюваному способі LAM-ELISA, нагадують легеневу форму ТБ, були негативними навіть при високих тестованих концентраціях (Фіг. по культивуванню та AFB-фарбуванню і не мали 4В). Аналіз цільних клітин різних видів мікобактеспецифічних рентгенологічних ознак ТБ. З них 13 рій способом LAM-ELISA показує перехресну реак(14,77%) мали позитивні результати LAM-ELISA тивність всіх тестованих видів мікобактерій (М.) тесту (середнє OD перевищення 0,184). (Фіг. 4С), однак М. tuberculosis H37Rv та Μ. bovis Ґрунтуючись на відомій концентрації в низько-, виявляються з більшою чутливістю. Обидва види середньо- і високопозитивному контролі, що був дуже близькі з імунохімічної точки зору, тільки М. включений у кожен планшет, можна визначити bovis рідко є причиною мікобактеріальної інфекції приблизну концентрацію LAM у кожній пробі сечі, у людини. ґрунтуючись на величині OD ELISA. Чи корелює Дані учасників дослідження концентрація LAM з індивідуальним вмістом бакВідповідно до Таблиці 1, 242 досліджуваних з терій туберкульозу, було визначено у AFBпідозрою на ТБ були розділені на 3 основні катепозитивних пацієнтів. В тої час, як у пацієнтів з горії: (1) хворі легеневою формою ТБ із підтвернизькою щільністю бактерій туберкульозу за данидженим діагнозом за результатами мікроскопії ми мікроскопії (AFB+) середня концентрація антита/або культивування, (2) хворі з типовими клінічгену LAM у сечі становила 0,93 нг/мл, у пацієнтів із 29 92721 30 середньою щільністю кислотостійких бацил при більш низьких концентраціях (0,2 нг/мл), ніж (AFB++) середня концентрація антигену в сечі станаявні тести. Чутливість нового тесту становила новила 1,74 нг/мл, і у AFB+++ пацієнтів - 2,02 нг/мл 82,9% (для AFB+) для неконцентрованої та свіжої (Фіг. 5). Остання величина нижче, ніж реальна сечі в порівнянні із чутливістю 81,3% попередніх концентрація LAM у сечі AFB+++ пацієнтів, оскільтестів, у яких використовувалася оброблена та ки прилад для зчитування ELISA, використаний у заморожена сеча. Специфічність тесту становила танзанійській лабораторії, не був здатним зчитува98,36% в даному дослідженні, у порівнянні з 86,9% ти сигнали вище двох одиниць OD, що відповідав попередньому дослідженні. ють близько 4 нг/мл. Обмеження такого одноразового ТБ обстеВІЛ-серостатус не впливав на чутливість LAMження полягало в тому, що для певної кількості ELISA у пацієнтів з підтвердженим легеневим ТБ. пацієнтів з передбачуваним ТБ залишалися сумніЗ 124 пацієнтів з відомим ВІЛ-серостатусом і позиви в плані їхнього ТБ-статусу (група 2 та 3). Для тивним ТБ за результатами культивування та/або вирішення цього питання ми виділили три основні AFB-забарвлення, 73 з 89 ВІЛ-інфікованих пацієнкатегорії для аналізу: Група 1: лабораторно підттів (82,0%) мали позитивний результат LAM-ELISA верджений ТБ, Група 2: клінічно та рентгенологічу порівнянні з 26 з 35 неінфікованих індивідуумів но визначений ТБ, Група 3: немає лабораторних (74,3%). Подібним чином чутливість AFB не вклюабо рентгенологічних доказів ТБ. Хоча ми були чалася у ВІЛ-серостатус. Чутливість становила впевнені, що у учасників з категорії 1 є справжній 61,2% та 58,8% у ВІЛ-інфікованих і негативних ТБ, ми не могли виключити, що категорії 2 та 3 індивідуумів, відповідно. включають ряд пацієнтів, неправильно розподілеСпецифічність аналізу оцінювали при викорисних по групах. У зв'язку із цим ми виключили їх з танні сечі здорових танзанійських та американсьнашого розрахунку чутливості та специфічності. ких добровольців. Досліджували сечу 23 здорових При діагнозі ТБ часто потрібно тривале лікарське танзанійських працівників госпіталю. Жоден з тесспостереження за пацієнтами. Особливо, пацієнти тованих зразків не був позитивним по LAM-ELISA з негативними результатами мокротиння, але з (-0,047 середня відносна OD, специфічність незвичайними рентгенологічними ознаками, бу100%). Зразки сечі 220 здорових добровольців зі дуть мати потребу в декількох додаткових консуСША були зібрані та досліджені. В усіх, за винятльтаціях для того, щоб удруге досліджувати їхній ком 4, оптична густина була нижче лінії відсікання ТБ-статус. При тривалому дослідженні повторні в 0,1 OD (специфічність 98,18%). клінічні, так само як і діагностичні, огляди та реОбговорення зультати лікування ТБ можуть дати важливу додаКласичні способи діагностики ТБ - культивуткову інформацію для класифікації Груп 2 та 3 на вання мокротиння та мікроскопія мазків - мають хворих ТБ і не хворих ТБ пацієнтів. очевидні обмеження. Обидва способи виявляють Винятковий інтерес представляє питання, чи тільки випадки відкритої форми легеневого ТБ, що існує кількісна кореляція між бактеріальним обсізначно зменшує можливість виявлення всіх випадменінням М. tuberculosis та кількістю LAM, виявлеків активного ТБ незалежно від органного вияву. ним у сечі. Єдиний спосіб для відповіді на це пиОтже, у минулому була розроблена безліч нових тання при комплексному дослідженні полягав у методів, які могли б доповнювати класичні спосовстановленні кореляції величини AFBби, особливо, при наявних бідних технічних засозабарвлення мокротиння та концентрації LAM у бах. Критеріями, які були встановлені для таких сечі. Як показано на Фігурі 5, існувала очевидна нових методів, є а) більш висока чутливість, ніж у позитивна кореляція концентрації антигену в сечі мікроскопії, b) порівнянна специфічність, с) незната щільності туберкульозних бактерій у мокротинчна додаткова робота, d) можливість діагностики ні. Така кореляція розкриває деякі додаткові можТБ при негативному аналізі мокротиння, та e) чутливості застосування LAM-аналізу. Контроль за ливість, що не ослабляється при наявності коінуспішним лікуванням і раннє розпізнавання загосфекції ВІЛ. трень після завершення лікування представляють У першому наближенні, чутливість LAM-ELISA пряму практичну значимість. Сполучення зі здатні(81 % позитивних по культивуванню) перевершустю виявляти позалегеневу форму ТБ і ТБ при вала AFB-забарвлення (69%). Чутливість може AFB-негативних результатах дозволяє вважати бути далі підвищена за рахунок концентрування LAM-аналіз потужним інструментом в умовах зроссвіжої сечі, що, однак, спричинить додатковий таючого поширення позалегеневих форм ТБ і леоб'єм робіт для техніка-лаборанта. Імовірність вигеневих форм із нетиповими клінічними симптоявлення способом LAM-ELISA для випадків з рентмами. LAM-ELISA може бути застосований не генологічно підтвердженим «воєнним» ТБ (87,5%), тільки для діагностування пацієнтів із клінічними так само і для випадків з негативними результатасимптомами, але також для обстеження ВІЛми по мокротинню з типовими рентгенологічними позитивних пацієнтів та інших груп з високим стуознаками легеневого ТБ (67%), була обнадійлипенем ризику. Виявлення ТБ на початковій стадії вою, хоча число всіх випадків є не досить великим захворювання та ефективне лікування є двома для остаточного висновку. Для здорових індивідуопорами в успішній боротьбі проти ТБ. Для подаумів чутливість ELISA була високою (98,18% у льшого вивчення ролі LAM-аналізу в даній боротьСША та 100% у Танзанії). Коінфекція ВІЛ у випадбі ми в цей час запланували деякі перспективні та ках ТБ за позитивними результатами культивуванмногоцентрові дослідження. ня не впливає на чутливість LAM-ELISA. Таким чином, LAM-ELISA може бути з легкістю У порівнянні з попередніми опублікованими включений до рутинних діагностичних процедур результатами LAM-ELISA, новий тест виявляє LAM лабораторій як розвинених країн, так і країн, що 31 92721 32 розвиваються. Це легкий у використанні та надійзменшення оптичної густини. Знову розроблений ний метод. Виконання аналізу ELISA вимагає всьоMTB-ELISA для виявлення LAM у необробленій го 2,5 год., і велика кількість зразків може бути сечі має потенціал скринінг-тесту для застосуванпроаналізована одночасно. Оскільки антиген ліпоня також в польових умовах у країнах, що розвиарабіноманан є стабільним, можна було зберігати ваються. сечу в холодильнику протягом 3 днів без значного Таблиця 1 Аналіз екскреції LAM у сечі серед 242 пацієнтів, що надійшли в амбулаторне відділення із клінічними підозрами на ТБ, і контрольної групи з 243 клінічно здорових людей. Границею відсікання для позитивності по LAM-ELISA є 0,1 вище середньої оптичної густини негативного контролю на планшеті Група спостереження 1: Лабораторно підтверджений ТБ ТБ Діагноз LJ+ та/або AFB LJ+ та AFB+ Тільки LJ+ Тільки AFB+ Воєнний ТБ Учасники LAM + 137 111 (81,02%) 3: Лабораторно або рентгенологічно Тільки клінічні ознаки ТБ не підтверджений ТБ Не зареєстровані в DOTS 4: Немає клінічних ознак ТБ Негативна контрольна група 9 88 14 (17,1%) 12 (24%) 0 (0%) 1 (87,5%) Плевральний випот або збільшені прикореневі лімф. вузли 68 (82,9%) 38 (76%) 5 (100%) 7 (12,5%) 6 3 (67%) 2: Клінічно та рентгенологічно діагностований ТБ 82 50 5 8 LAM 26 (33%) 13 75 (14,77%) (85,23%) 4 (1,64%) 243 + = позитивний. Таблиця 2 Співвідношення ВІЛ-позитивних пацієнтів у різних групах. 223 з 242 дали згоду на ВІЛ-тестування Всі підозрілі на ТБ Культивування + (119) AFB+ (77) ЕХРТВ (17) ВІЛ + 69,1% 71,% 72,7% 76,47% 33 92721 34 35 92721 36 37 92721 38 39 92721 40 41 92721 42 43 92721 44 45 92721 46 47 Комп’ютерна верстка О. Гапоненко 92721 Підписне 48 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюEnriched antibody population, highly specific for an antigen of a surface polysaccharide lipoarabinomannan (lam) from a mycobacterium, method for detecting mycobacterial infection in a sample and a kit for detecting a mycobacterial infection
Автори англійськоюKoulchin Vladimir A., Molokova Elena V., Kerrick Jill L.
Назва патенту російськоюОбогащенная популяция антител, высокоспецифических к антигену поверхностного полисахарида липоарабиноманана (lam) микобактерии, способ выявления микобактериальной инфекции в образце и набор для выявления микобактериальной инфекции
Автори російськоюКульчин Владимир А., Молокова Елена В., Керрик Джиль Л.
МПК / Мітки
МПК: C07K 16/12, G01N 33/537
Мітки: інфекції, полісахариду, зразку, набір, мікобактерії, виявлення, поверхневого, високоспецифічних, антигену, спосіб, популяція, lam, мікобакт, мікобактеріальної, ліпоарабіноманану, збагачена, антитіл
Код посилання
<a href="https://ua.patents.su/24-92721-zbagachena-populyaciya-antitil-visokospecifichnikh-do-antigenu-poverkhnevogo-polisakharidu-lipoarabinomananu-lam-mikobakteri-sposib-viyavlennya-mikobakterialno-infekci-v-zrazku-ta.html" target="_blank" rel="follow" title="База патентів України">Збагачена популяція антитіл, високоспецифічних до антигену поверхневого полісахариду ліпоарабіноманану (lam) мікобактерії , спосіб виявлення мікобактеріальної інфекції в зразку та набір для виявлення мікобакт</a>
Наступний патент: Пристрій рятувального гальмування засобів пересування
Випадковий патент: Підводний апарат