Антитіло проти каспази-8, спосіб одержання та застосування вказаного антитіла для розробки elisa-аналізу
Формула / Реферат
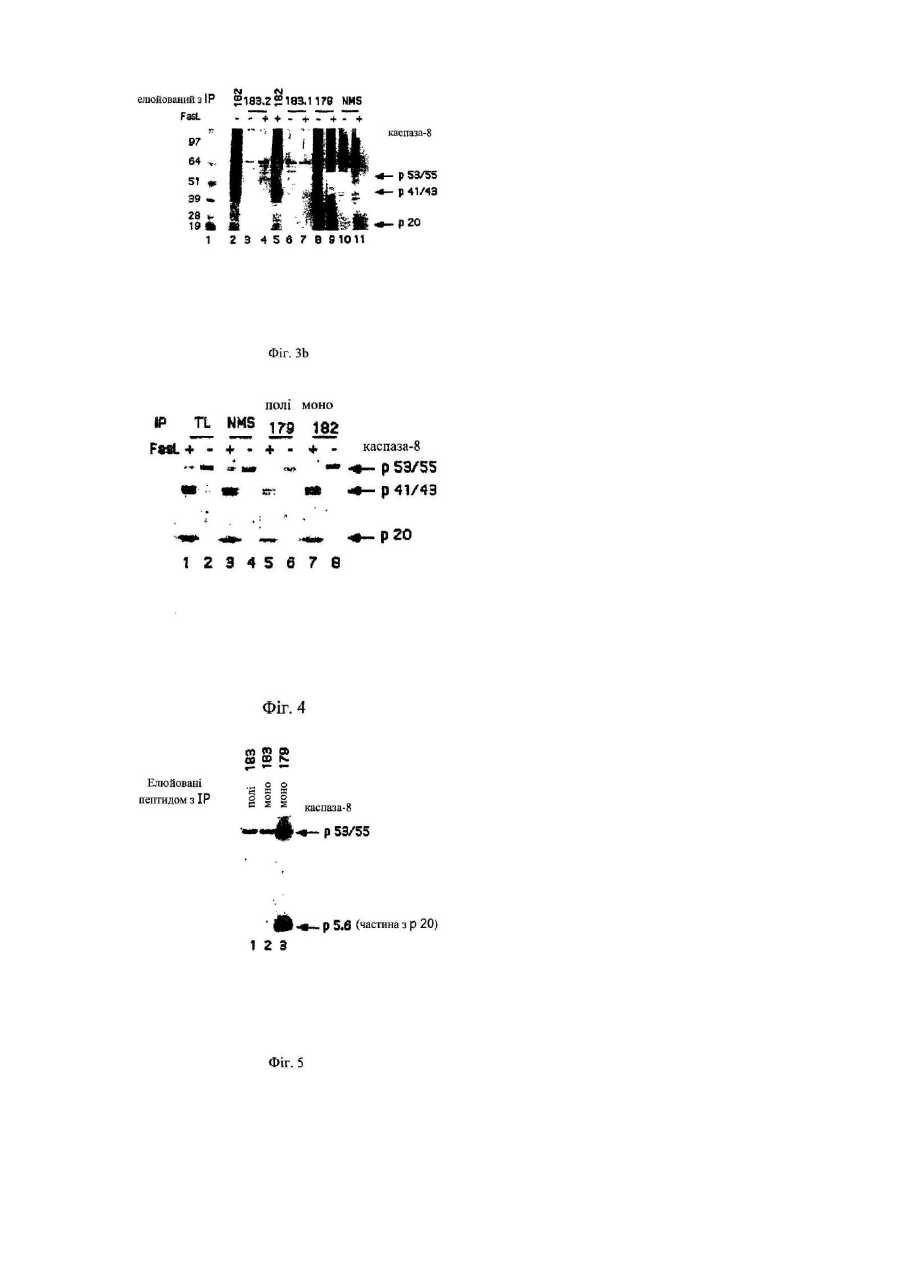
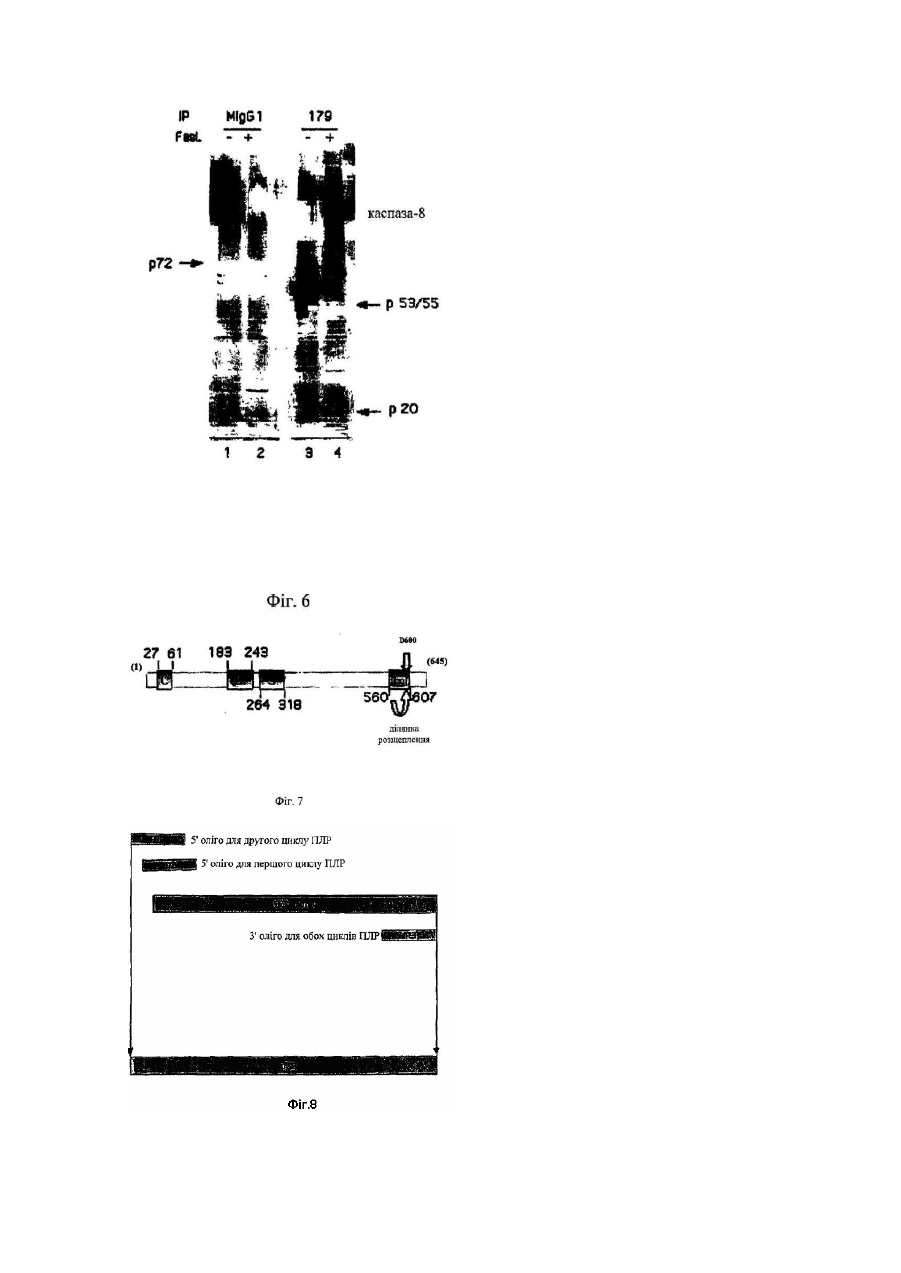
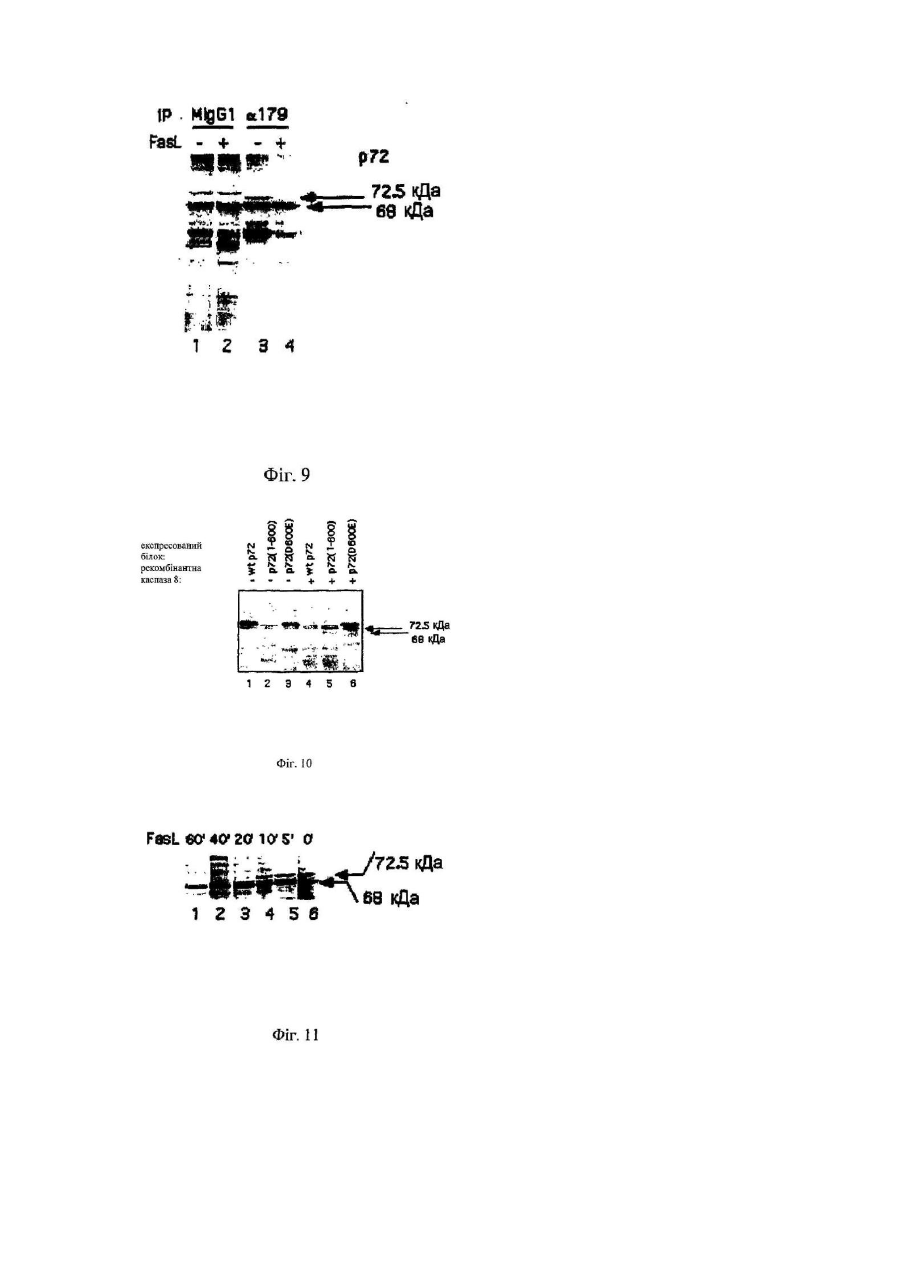
1. Антитіло, одержане імунізацією тварини пептидом з С-кінця одиниці Sub-1 каспази-8, та його фрагменти, де пептид, який використовується для імунізації, має амінокислотну послідовність CQGDNYQKGIPVETD (SEQ ID NO:4), здатні спів-імунопреципітувати вказану каспазу (як активну каспазу-8, так і прокаспазу-8) разом з прокаспазою-8, зв'язаною з білком р72 (SEQ ID NO:3), і здатні до ефективного вивільнення каспази та зв'язаного білка з імунного комплексу при елюції, з використанням пептиду, що відповідає SEQ ID NO:4.
2. Антитіло за п. 1, яке відрізняється тим, що є поліклональним антитілом або його фрагментом.
3. Антитіло за п. 1, яке відрізняється тим, що є моноклональним антитілом або його фрагментом.
4. Антитіло за п. 1, яке відрізняється тим, що є химерним антитілом або його фрагментом.
5. Антитіло за п. 1, яке відрізняється тим, що є повністю гуманізованим антитілом або його фрагментом.
6. Антитіло за п. 1, яке відрізняється тим, що є анти-анти-Id антитілом або його фрагментом.
7. Антитіло за будь-яким з пп. 1-6, яке відрізняється тим, що пептид, який використовується для імунізації, зв'язаний з KLH.
8. Антитіло за будь-яким з пп. 1-7, яке відрізняється тим, що є ізотипом імуноглобуліну IgG1.
9. Антитіло за п. 8, яке відрізняється тим, що запускає процесинг каспази-8.
10. Застосування антитіла за будь-яким з пп. 1-9 для розробки ELISA-аналізу.
11. Спосіб одержання антитіла за п. 1 або 2, що включає імунізацію тварини пептидом з С-кінця Sub-1 каспази-8, де пептид, що використовується для імунізації має амінокислотну послідовність CQGDNYQKGIPVETD (SEQ ID NO:4).
12. Спосіб за п. 11, який відрізняється тим, що антитіло є моноклональним.
13. Спосіб за будь-яким з пп. 11-12, який відрізняється тим, що імуноген зв'язаний з носієм.
14. Спосіб за п. 13, який відрізняється тим, що носій являє собою KLH.
15. Спосіб очищення каспази і білка, зв'язаного з каспазою, що включає контактування зразка, який містить каспазу і білок, зв'язаний з каспазою, з антитілом за будь-яким з пп. 1-9, співімунопреципітацію каспази і білка, зв'язаного з каспазою, промивання утвореного імунного комплексу, і діставання каспази і зв'язаного з каспазою білка з імунного комплексу, з використанням CQGDNYQKGIPVETD (SEQ ID NO:4) як конкуруючого пептиду.
16. Спосіб за п. 15, який відрізняється тим, що зразок вибраний з рідин організму, клітинних екстрактів і бібліотек ДНК, що експресуються.
17. Спосіб за будь-яким з пп. 15 або 16, який відрізняється тим, що конкуруючий пептид включає амінокислотну послідовність CQGDNYQKGIPVETD (SEQ ID NO:4).
18. Спосіб за будь-яким з пп. 15-17, який відрізняється тим, що клітини у зразку стимулювали перед екстракцією.
19. Спосіб за будь-яким з пп. 15-18, який відрізняється тим, що каспаза є каспазою-8.
20. Спосіб за будь-яким з пп. 15-19, який відрізняється тим, що додатково використовують антитіло, яке можна одержати імунізацією тварини пептидом SEQ ID NO:6.
21. Застосування епітопу 179 (SEQ ID NO:4) для одержання антитіла за будь-яким з пп. 1-6, що включає імунізацію тварини таким епітопом.
Текст
Винахід відноситься до антитіл до визначеної ділянки у каспазі-8 та до їх застосування. Фактор некрозу пухлини (TNF-альфа) і лімфотоксин (TNF-бета) є поліфункціональними прозапальними цитокінами, що продукуються, головним чином мононуклеарними лейкоцитами, які здійснюють численні ефекти на клітини [Wallach, D. (1986) In; Interferon 7 (Ion Gresser, ed), pp 83-122, Academic Press, London; і Beutler and Cerami (1987)]. TNF-альфа і TNF-бета починають діяти внаслідок зв'язування зі специфічними рецепторами клітинної поверхні. Ймовірно деякі з їх ефектів виявляються корисними для організму: вони можуть, наприклад, руйнувати пухлинні клітини або інфіковані вірусами клітини та посилювати протибактеріальну активність гранулоцитів. Таким чином, TNF бере участь у захисті організму проти пухлин та інфекційних агентів і сприяє відновленню після пошкодження. Так, TNF можна використовувати як протипухлинний агент, який при застосуванні зв'язується зі своїми рецепторами на поверхні пухлинної клітини і тим самим дає початок подіям, що ведуть до загибелі пухлинних клітин. TNF також можна використовувати як протиінфекцІйний агент. Однак TNF-альфа здійснює шкідливу дію. Є докази, що надпродукція TNF-альфа може грати основну патогенетичну роль при деяких захворюваннях. Наприклад, відомо, що дія TNF-альфа передусім на судинну систему є головною причиною симптомів септичного шоку [Tracey et al., 1994]. При деяких захворюваннях TNF може викликати надмірну втрату ваги (кахексію), пригнічуючи активність адипоцитів і викликаючи анорексію, і, тому, TNF-альфа називають кахектин. Він також описаний як медіатор ураження тканин при ревматоїдних захворюваннях [Beutler and Cerami, 1987] і як основний медіатор ураження, що спостерігається при реакціях «трансплантат проти хазяїна» [Grau GE et al., 1989]. Крім того, відомо, що TNF бере участь у процесі запалення і багатьох інших за хворюваннях. Два окремих рецептори, що незалежно експресуються, TNF-рецептори р55 (CD 120а) і р75 (CD 120b), які специфічно зв'язують як TNF-альфа, так і TNF-бета, ініціюють і/або опосередковують описані вище біологічні ефекти TNF. Зазначені два рецептори містять структурно несхожі внутрішньоклітинні домени, дозволяючи припустити, що вони по-різному передають сигнал [Дивись Hohmann et al, 1989; Engelmann et al., 1990; Brockhaus et al., 1990; Loetscher et al., 1990; Schall et al., 1990; Nophar et al., 1990; Smith et al., 1990]. Однак клітинні механізми, наприклад, різних білків і можливо інших факторів, які залучені до внутрішньоклітинної передачі сигналу CD 120а і CD120b, ще не встановлені. Він включає внутрішньоклітинну передачу сигналу, яка звичайно здійснюється після зв'язування ліганду, тобто, TNP (альфа або бета), з рецептором, який є відповідальним за початок каскаду реакцій, що зрештою приводить до відповіді, яка спостерігається, клітини на TNF. Що стосується зазначеного вище ефекту TNF, що руйнує клітину, у більшості вивчених досі клітин, згаданий ефект запускається, головним чином, CD 120а. Антитіла проти позаклітинного домену CD120a (лігандзв'язувальний домен) самі можуть запускати дію, що руйнує клітину [дивись ЕР 412486], яка корелює з ефективністю перехресного зв'язування рецептора антитілами, що, як вважають, є першою стадією у генерації процесу внутрішньоклітинної передачі сигналу. Крім того, мутаційні дослідження [Brakebusch et al., 1992; Tartaglia et al., 1993] показали, що біологічна функція CD 120а залежить від цілісності його внутрішньоклітинного домену, і, відповідно, було висловлене припущення, що ініціація внутрішньоклітинної передачі сигналу, яка веде до ефекту TNF, що руйн ує клітину, відбувається як наслідок асоціації двох або більше внутрішньоклітинних доменів CD 120а. Крім того, TNF (альфа або бета) зустрічається як гомотример і, як вважають, сам по собі індукує внутрішньоклітинну передачу сигналу через CD 120а завдяки його здатності зв'язуватися з рецепторними молекулами і зшивати їх, тобто, викликає агрегацію рецепторів [Engelmann H. et al., 1990]. Іншим представником суперсімейства рецепторів TNF/NGF є рецептор FAS/APO1 (CD95). CD95 опосередковує клітинну загибель у формі апоптозу [Itoh et al., 1991] і, як виявилося, служить як негативний селектор аутореактивних Т-клітин, тобто, під час дозрівання Т-клітин. CD95 опосередковує апоптотичну загибель Т-клітин, що розпізнають аутоантигени. Також встановлено, що мутації у гені CD95 (Ірг) викликають порушення лімфопроліферації у мишей, яке нагадує аутоімунне захворювання людини, системний червоний вовчак (SLE) [Watanabe-Fukanaga et al., 1992]. Ліганд для CD95 являє собою асоційовану з клітинною поверхнею молекулу, що переноситься, крім інших, Т-кілерами (або цитотоксичними Т-лімфоцитами - CTL), і, отже, коли такі CTL контактують з клітинами, що несуть CD95, вони здатні індукувати апоптотичну клітинну загибель клітин, шр несуть CD95. Крім того, були одержані моноклональні антитіла, специфічні для CD95, які здатні індукувати апоптотичну загибель клітин, які несуть CD95, включаючи мишачі клітини, трансформовані кДНК, що кодує CD95 людини [наприклад, Itoh et al., 1991]. Рецептор TNF і Fas-механізми передачі сигналу, що включають в себе різні рецептори, їх регуляцію та ідентифіковані молекули передачі сигналу детально розглянуті Wallach et al (1999). Встановлено, що визначені злоякісні клітини і ВІЛ-інфікованІ клітини, які містять CD95 на своїй поверхні, антитіла проти CD95 або ліганд CD95, можуть бути використані для запуску опосередкованої CD95 цитотоксичної дії у зазначених клітинах і, в зв'язку з цим, для забезпечення засобом для боротьби з такими злоякісними клітинами або ВІЛ-інфікованими клітинами [дивись, Itoh et al., 1991]. Тому відкриття ще інших шляхів збільшення цитотоксичної активності CD95 може мати терапевтичне значення. Вже давно існує потреба у забезпеченні способом модуляції клітинної відповіді на TNF (альфа або бета) і ліганд CD95. Наприклад, при згаданих вище патологічних ситуаціях, коли TNF або ліганд CD95 надекспресуються, виявляється бажаним інгібувати індуковані TNF або лігандом CD95 ефекти, що руйнують клітини, у той час як в інших ситуаціях, наприклад при застосуванні для загоєння ран, бажано посилити дію TNF, або у випадку CD95, у пухлинних клітинах або ВІЛ-інфікованих клітинах, бажано посилити дію, опосередковану CD95. Заявники використали ряд підходів [дивись наприклад, описи Європейських патентів № ЕР 186833, ЕР 308378, ЕР 398327 і ЕР 412486], щоб регулювати шкідливі дії TNF за допомогою інгібування зв'язування TNF з його рецепторами, застосовуючи анти-ТМР-антитіла або використовуючи розчинні рецептори TNF (по суті розчинні позаклітинні домени рецепторів), щоб конкурувати зі зв'язуванням TNF з TNF-рецепторами, зв'язаними з клітинною поверхнею (TNF-R). Далі, враховуючи, що зв'язування TNF з його рецепторами є необхідним для TNF-індукованих клітинних ефектів, використовували способи [дивись, наприклад, ЕР 568925], що дозволяють модулювати дію TNF модулюванням активності TNF-R. [ЕР 568925] відноситься до способу модулювання трансдукції сигналу і/або розщеплення TNF-R, при якому пептиди або інші молекули можуть взаємодіяти або з самим рецептором або ефекторними білками, що взаємодіють з рецептором, таким чином модулюючи нормальну функцію TNF-R. В [ЕР 568925] описують конструкцію і властивості різних мутантних форм CD 120а, що мають мутації у позаклітинному, трансмембранному і внутрішньоклітинному доменах. Таким чином, ділянки у зазначених вище доменах CD120a були ідентифіковані як істотні для функціонування рецептора, тобто, зв'язування ліганду (TNF) і подальшої трансдукції сигналу і вн утрішньоклітинної передачі сигналу, що зрештою приводить до дії, що спостерігається, TNF на клітини. Крім того, також описують ряд способів виділення та ідентифікації білків, пептидів або інших факторів, які здатні зв'язуватися з різними ділянками у зазначених вище доменах CD120a, білків, пептидів та інших факторів, які можуть бути залучені до регуляції або модулювання активності TNF-R. Також в [ЕР 368925] описують ряд способів виділення і клонування послідовностей ДНК, що кодують такі білки і пептиди; конструювання векторів, що експресують, для одержання зазначених білків і пептидів; та одержання антитіл або їх фрагментів, які взаємодіють з CD 120а або з зазначеними вище білками і пептидами, які зв'язують різні ділянки CD 120а. Однак в [ЕР 568925] не конкретизовані фактично існуючі білки і пептиди, які зв'язуються з внутрішньоклітинними доменами TNF-R. Аналогічно, в [ЕР 568925] не описані специфічні білки або пептиди, здатні зв'язувати вн утрішньоклітинний домен CD95. Таким чином, якщо бажано інгібувати дію TNF або ліганду CD95, потрібно знизити кількість або активність TNF-R або CD95 на поверхні клітини, в той час як виявляється необхідним збільшення кількості або активності TNF-R або CD95, коли прагнуть досягти підвищеної дії TNF або ліганду CD95. З цією метою секвенували і аналізували промотори як CD120a, так і CD120b і встановили ряд мотивів ключових послідовностей, які є специфічними відносно різних факторів, що регулюють транскрипцію, і по суті виявилося можливим контролювати експресію зазначених TNF-R за рівнем їх промоторів, тобто, інгібування транскрипції на промоторах для зниження кількості рецепторів і підвищення транскрипції на промоторах для збільшення кількості рецепторів [ЕР 606869 і WO 9531206]. Тоді як відомо, що рецептори фактора некрозу пухлини (TNF) і стр уктурно споріднений рецептор CD95 при стимуляції лігандами, що продукуються лейкоцитами, запускають у клітинах деструктивну активність, яка приводить до їх власної загибелі, механізми згаданого запуску ще недостатньо вивчені. Мутаційні дослідження показали, що до передачі сигналу CD95 і CD 120а для цитотоксичності залучені окремі ділянки в їх вн утрішньоклітинних доменах [Brakebusch et al., 1992; Tartaglia et al., 1993; Itoh and Nagata, 1993]. Зазначені ділянки («домени загибелі») характеризуються подібністю до послідовностей. «Домени загибелі» як CD95, так і CD 120а мають тенденцію до самоасоціації. їх самоасоціація очевидно стимулює агрегацію рецепторів, яка є необхідною для ініціації передачі сигналу [див. Bigda et al., 1994; Boldin et al., 1995], і при високих рівнях експресії рецепторів може приводити до запуску ліганднезалежної передачі сигналу [Boldin et al., 1995]. Деякі з цитотоксичних ефектів лімфоцитів опосередковані взаємодією ліганду, що продукується лімфоцитами, з CD95 клітини-мішені, також [дивись Nagata and Goldstein, 1995]. Загибель клітин під впливом мононуклеарних фагоцитів залучає TNF і його рецептор CD 120а [дивись також Vandenabeele et al., 1995]. Подібно до інших рецепторіндукованих ефектів, індукція клітинної загибелі рецепторами TNF і CD95 здійснюється через серію білок-білкових взаємодій, що ведуть від ліганд-рецепторного зв'язування до кінцевої активації ензиматичних ефекторних функцій, які, як було показано, включають неензиматичні білок-білкові взаємодії, які ініціюють передачу сигналу для загибелі клітини: зв'язування молекул тривимірного TNF або ліганду CD95 з рецепторами, подальша взаємодія їх вн утрішньоклітинних доменів [Brakebusch et al, 1992; Tartaglia et al., 1993; Itoh and Nagata, 1993], посилена схильністю мотивів «доменів загибелі» до самоасоціації [Boldin et al., 1995a], та індуковане зв'язування двох цитоплазматичних білків (які також можуть зв'язуватися один з одним) з внутрішньоклітинними доменами рецепторів - MORT-1 (або FADD) з CD95 [Boldin et al., 1995b; Chinnaiyan et al., 1995; Kischkel et al., 1995] і TRADD з CD120a [Hsu et al., 1996]. Крім їх зв'язування з CD95 і CD120a, MORT-1 і TRADD також здатні зв'язуватися один з одним, а також з іншими «доменами загибелі», що містять білки, такі як RIP [Stanger et al., 1995], що забезпечує функціональне «перехресне спілкування» між CD95 і CD120a. Згадані зв'язування здійснюються через мотив консервативної послідовності, «модуль домену загибелі», спільний з рецепторами та їх асоційованими білками. Крім того, хоча на двогібридній дріжджовій системі показали, що MORT-1 спонтанно зв'язується з CD95, у клітинах ссавців зазначене зв'язування має місце тільки після стимуляції рецептора, дозволяючи припустити, що MORT-1 бере участь в ініціації явищ передачі сигналу CD95. MORT-1 не містить якого-небудь мотиву послідовності, характерного для ензиматичної активності і тому виявилося, що його здатність запускати клітинну загибель не залучає активність, властиву самому MORT-1, a швидше активацію якогось іншого білка(ів), який зв'язує MORT-1 і діє далі у каскаді передачі сигналу. Показано, що клітинна експресія мутантів MORT-1, що не містять N-кінцеву частину молекули, блокує індукцію цитотоксичності за допомогою CD95 або CD120a [Hsu et al., 1996; Chinnaiyan et al., 1996], означаючи, що зазначена N-кінцева ділянка передає сигнал для ефекту, що р уйнує клітину, обох рецепторів через білок-бІлкову взаємодію. Група цитоплазматичних тіолових протеаз, які є структурно спорідненими протеазі CED3 Caenorhabditis elegans та інтерлейкін-1-бета-перетворюючому ферменту (ICE) ссавців, залучена до розвитку різних фізіологічних процесів клітинної загибелі [див. огляд Kumar, 1995 і Henkart, 1996]. Також є докази, що протеаза(и) зазначеного сімейства бере участь у клітинній цитотоксичності, індукованій CD95 і TNF-R. Виявлено, що специфічні пептидні інгібітори протеаз і два кодованих вірусами білки, які блокують їх функцію, білок сгпіА коров'ячої віспи і білок р35 бакуловірусу, забезпечують захист клітин проти зазначеної цитотоксичності [Enari et al., 1995; Tewari et al., 1995; Xue et al., 1995; Beidler et al., 1995]. Швидке розщеплення деяких спеціальних клітинних білків, очевидно опосередковане протеазою(ами) сімейства CED3/ICE (каспаза), може бути продемонстроване у клітинах невдовзі після стимуляції CD95 або TNF-R. Одна така протеаза та її різні ізоформи (включаючи її інгібітори), відома як МАСИ (нова каспаза-8), яка являє собою M0RT-1-зв'язувальний білок, була виділена, клонована, охарактеризована, а також описано її можливе застосування, що детально викладено в описі, у заявці PCT/US96/10521, що частково належить заявникам, та у п ублікації заявників [Boldin et al., 1996] і включено в даний опис у повному обсязі. Інша така протеаза та її різні ізоформи (включаючи її інгібітори), позначена Mch4 (також називається каспаза-10) була виділена і охарактеризована авторами винаходу (не опубліковано) та іншими дослідниками [Fernandes-Alnemri et al., 1996; Srinivasula et al., 1996]. Каспаза-10 також є MORT-1зв'язувальним білком. Таким чином, подробиці, що стосуються всіх аспектів, особливостей, характеристик і застосувань каспази-10 викладені у вказаних вище публікаціях, всі з яких включені в опис в їх повному обсязі цитуванням. Також потрібно зазначити, що каспази, каспаза-8 і каспаза-10, які містять подібні продомени [дивись Boldin et al., 1996; Muzio et al., 1996; Fernandes-Alnemri et al., 1996; Vincent and Dixit, 1997], взаємодіють через свої продомени з MORT-1, зазначена взаємодія здійснюється через "ефекторний домен загибелі", DED, присутній у N-кінцевій частині M0RT-1 і присутній у двох екземплярах у каспазі-8 і каспазі-10 [дивись Boldin et al., 1995b; Chinnalyan et al., 1995]. Каспази (цистеїнові аспартатспецифічні протеїнази) складають сімейство, що збільшується, цистеїнових протеаз, які характеризуються декількома спільними властивостями. Встановлено, що більшість з каспаз бере участь в ініціації та здійсненні запрограмованої клітинної загибелі або апоптозу, в той час як виявилося, що інші залучені до продукції прозапальних цитокінів [Nicholson DW et al., 1997, Salvesen GS et al., 1997, Cohen GM, 1997]. Вони синтезуються у вигляді каталітично майже неактивних попередників і звичайно активуються внаслідок розщеплення після специфічних залишків аспарагінової кислоти, розташованих у міждоменних зв'язках. Сайти розщеплення каспаз визначаються тетрапептидними послідовностями (X-X-X-D), а розщеплення завжди відбувається після аспарагінової кислоти. В результаті утворюються певні зрілі активні каспази і активують самих себе, а також інші неактивні попередники [Fernandes-Alnemri T et al., 1996, Srinivasula S.M. et al., 1996]. Активація процесу запрограмованої загибелі клітин в основному є специфічною і включає послідовний процесинг пізніх каспаз, які називаються «каспази-ефектори», який здійснюється ранніми каспазами, що називаються «каспази-ініціатори». Функціональні особливості двох класів каспаз також знаходять відображення в їх структурі. Дійсно, «каспази-ініціатори» містять більш довгі продоменні ділянки у порівнянні з «каспазами-ефекторами» [Salvesen G.S. et al., 1997; Cohen G.M., 1997]. Довгий продомен дозволяє ініціаторним або "апікальним" каспазам активуватися при запуску рецепторів загибелі з сімейства рецепторів TNF. Під час індукованої лігандом тримеризації рецепторів загибелі, каспази-ініціатори рекрутуються через їх довгий N-кінцевий продомен для взаємодії зі специфічними адапторними молекулами, щоб перетворити комплекс, що ініціює загибель, передачі сигналу [Cohen G.M., 1997; Kischkel F.C. et al., 1995]. Наприклад, каспаза-8/МАСН і, можливо, каспаза-10, які містять два DED, рекрутуються у рецепторний комплекс адапторними молекулами FADD/MORT-1, тоді як вважають, що каспаза-2 рекрутується за допомогою CRADD/RAIDD і RIP [Nagata S. et al., 1997; MacFarlane M. et al., 1997; Ahmad M. et al., 1997; Dual H. et al., 1997]. Вважають, що внаслідок тривимірної природи активованого рецепторного комплексу, принаймні, дві каспазні молекули підходять близько одна до одної, таким чином приводячи до їх активації внаслідок аутокаталітичного процесингу [Yang et al., 1998; Mu zio et al., 1998]. Каспази синтезуються у вигляді проферментів, що складаються з трьох основних субодиниць, N-кінцевого продомену і дво х субодиниць, які іноді розділяються лінкерним пептидом. Дві субодиниці були названі «довга» або субодиниця 1 (Sub-1), що містить головну частин у активного центра ферменту, і «коротка» або субодиниця 2 (Sub-2). Для повної активації ферменту, він піддається процесингу з утворенням продомену і двох суб-доменів. Дві субодиниці утворюють гетеродимер. На основі виведеної тривимірної структури каспази3 виявилося, що С-кінець довгого домену, а також N-кінець короткого субдомену повинні бути вільними, а Скінець короткої субодиниці повинен знаходитися у тісній близькості з N-кінцем довгої субодиниці, щоб утворився точно згорнутий і активний фермент [Rotonda et al., 1996; Mittl et al., 1997; Srinivasula et al., 1998]. Хоча завжди вважали, що метаболічні шляхи, які ведуть до апоптозу або некрозу, є абсолютно різними, останні дані дозволяють припустити, що каспази, які є головними медіаторами апоптозу, також можуть бути причетні до некрозу як у негативному, так і у позитивному значенні. Дійсно, показано, що надекспресія інгібітору каспаз CrmA у клітинах L929 підвищує у 1000 разів чутливість зазначених клітин до некротичної активності TNF [Vercammen et al., 1998], вказуючи на інгібіторну дію каспаз на TNF-індуковану некротичну активність. Крім того, нещодавно також було висловлене припущення, що TNFR1- і Fas-асоційовані "домени смерті", які виконують істотну роль в індукції апоптозу зазначеними лігандами [розглянуто Wallach et al., 1999] грають важливу роль в індукції некрозу (Boone et al., 2000). Показано, що FasL-індукований некроз печінки блокується інгібіторами каспаз [Kunstle et al., 1997]. Оскільки опосередкований каспазами протеоліз є вирішальним і центральним елементом апоптотичного процесу [Nicholson D.W. and Thornbeny, N.A. (1997), Villa et al., (1997) і Salvesen, G.S., and Dixit, V.M. (1997)], ідентифікація важливих пізніх молекулярних мішеней зазначених протеаз виявляється неминучою для розуміння трансдукції апоптотичного сигналу. Показано, що різні структурні і сигнальні білки розщеплюються каспазами під час апоптотичної загибелі [Nicholson D.W. and Thornberry, N.A. (1997), Villa P. et al., (1997)], включаючи ICAD, інгібітор D-нази, що активується каспазою, що є важливим для міжнуклеосомної деградації ДНК, але не для здійснення апоптозу [Enari, M. et al. (1998) і Sakahira et al., (1998)]. Гельсолін, актинрегулювальний білок, який модулює цитоплазматичну трансформацію актин-гельсолю [Yin, H.L. and Stossel, Т.Р. (1979)], залучений до апоптозу, судячи з (і) його розщеплення під час апоптозу in vivo [Kothakota, S. et al., (1997)], (ii) запобігання апоптозу при його надекспресії [Ohtsu, M. et al., (1997)] та (ііі) індукції апоптозу одним з розщеплених продуктів [Kothakota, S. et al., (1997)]. Гельсолін характеризується численними активностями, що активуються Са+2, роз'єднує актинові філаменти і швидко перекриває зростаючі кінці філаментів, а також утворює ядро актинової полімеризації [Yin, H.L. and Stossel, T.P., (1980), Kurth, M. and Bryan, J. (1984), Janmey, P.A., and Stossel, T.P. (1987)]. У [заявці WO 0039160] описані білки, що взаємодіють з каспазою-8, здатні взаємодіяти з Sub-1 і/або Sub-2 каспази-8. Білки, що взаємодіють з каспазою, виявлені при двогібридному скринінгу з використанням одноланцюгової конструкції каспази-8. Звичайно, одночасне очищення каспази-8 і білків, зв'язаних з каспазою-8, включає модифікацію міченого епітопу каспази-8 (наприклад, НА-злиття з каспазою-8, Roth et al) і застосування анти-мічених специфічних антитіл. Однак епітопне мічення білків може впливати на активність мічених білків. Є антитіла специфічні до каспази-8: Anti-Mach, № у каталозі - 218777, є полІклональними курячими антитілами фірми Calbiochem, які розпізнають як про-каспазу-8, так і активну каспазу-8. Для одержання зазначеного антитіла як імуноген використовують повнорозмірний білок рекомбінантної каспази-8 людини. Каспаза-8 (D384) 6В6 є моноклональним антитілом від Cell Signaling technology, одержаним імунізацією мишей синтетичним пептидом, зв'язаним з KLH, який відповідає залишкам, картованим на амінокінці Sub-2 каспази-8. Зазначені антитіла специфічно виявляють ендогенні рівні відщепленої невеликої субодиниці каспази-8 10 кДа при вестерн-блотингу. Зазначені Mab рекомендують для вестерн-блотингу, і вони не дають перехресної реакції з повнорозмірною каспазою-8. Антитіло В9-2 є моноклональним антитілом фірми Pharmingen (A Becton Dickinson Company), яке розпізнає смугу 55 кДа, що відповідає каспазі-8. Рекомбінантний білковий фрагмент каспази-8 людини, що відповідає амінокислотам 335-469 каспази-8, використовували як імуноген (Weaver et al. 2000). Згадане моноклональне антитіло рекомендують для контролю рівнів каспази-8 при аналізі за допомогою вестернблотингу. Ідентифікацію активної каспази-8 із застосуванням описаних Mabs неможливо проводити внаслідок того, що фрагмент, який використовується для утворення антитіл, виявляється інтактним тільки у неактивній каспазі-8. Каспаза-8 plO (S-19):sc-6135 являє собою афінно-очищене козяче поліклональне антитіло фірми Santa Cruz biotechnology, індуковане проти пептиду, картованого поблизу карбоксильного кінця Sub-2 каспази-8 людини. Зазначене поліклональне антитіло взаємодіє з субодиницею plO (Sub-2) і попередником каспази-8 людини при вестерн-блотингу, імунопреципітації та імуногістохімії. Воно не дає перехресної реакції з каспазою-8 р20 (Sub-1). Каспаза-8 1С12 являє собою моноклональне антитіло фірми Cell Signaling technology, одержане імунізацією мишей синтетичним пептидом, зв'язаним з KLH, який відповідає залишкам, картованим на карбоксильному кінці Sub-1 каспази-8. Зазначене антитіло специфічно розпізнає про-каспазу-8 і активну каспазу-8 при вестерн-блотингу. Точна послідовність пептиду, використаного для імунізації мишей для утворення Mab, невідома. Каспаза-8 р20 (H-134):sc-7890 являє собою кроляче поліклональне антитіло фірми Santa Cruz biotechnology, індуковане проти рекомбінантного білка, що відповідає амінокислотам 217-350, картованим у Sub-1 каспази-8 людини. Зазначене поліклональне антитіло взаємодіє з активною каспазою-8 і попередником каспази-8 миші, щура і людини при вестерн-блотингу, імунопреципітації та імуногістохімії. Однак не існує ніякої інформації відносно ефективності, при якій каспаза-8 імунопреципітує, і чи може зв'язаний білок співосаджуватися і, якщо так, чи можливо одержання каспази-8 і білків, зв'язаних з каспазою-8, з імунного комплексу. Таким чином, у наш час не описані поліклональні і моноклональні антитіла проти каспази-8, які володіють всіма наступними властивостями: здатні ефективно імунопреципітувати як про-каспазу-8, так і активну каспазу-8 і відділяти каспазу-8 з імунопреципітованого комплексу, допускаючи проведення одночасного очищення каспази-8 і білків, зв'язаних з каспазою-8. Тому, спосіб даного винаходу вирішує проблему, що існує тривалий час, в області спів-преципітації і очищення каспази-8 і білків, зв'язаних з каспазою-8. Антитіло (поліклональне, моноклональне, химерне, повністю гуманізоване анти-анти-И-антитіло або його фрагмент), яке одержують імунізацією тварини пептидом з С-кінця Sub-1-одиниці каспази-8 (наприклад, CQGDNYQKGIPVETD), і його фрагменти, здатні спів-імунопреципітувати зазначену каспазу (як активну каспазу-8, так і про-каспазу-8) разом з білком, зв'язаним з каспазою, і ефективно вивільняти каспазу і зв'язаний білок з імунного комплексу при елюції. Зокрема, пептид, що використовується для імунізації, переважно може бути зв'язаний з КLН. В одному аспекті, антитіло відповідно до винаходу являє собою ізотип імуноглобуліну IgG 1. В іншому аспекті антитіло винаходу запускає процесинг каспази-8. У ще одному аспекті, у винаході представлене антитіло, яке можна використовувати для розробки ELISAаналізу. У наступному аспекті, у винаході представлений спосіб одержання антитіла відповідно до винаходу і застосування антитіла у способі виділення асоційованих з каспазою білків, більш переважно асоційованого з каспазою білка, що містить амінокислотну послідовність SEQ ID NO:3, або ізоформи, алельного варіанту, фрагмента, функціонального аналога, злитого білка, їх мутанта або похідного, присутніх у клітинних зразках, наприклад клітинних екстрактах, бібліотеках кДНК, що експресуються, і геномних або комбінаторних пептидних бібліотеках. Більш конкретно, винахід відноситься до застосування зазначеного антитіла для виділення асоційованих з каспазою білків, причому каспазою є каспаза-8. У ще одному аспекті винаходу, імуноген, який використовується для імунізації, зв'язують з носієм, переважно KLH. У винаході також представлений спосіб очищення каспази, переважно каспази-8, та асоційованих з каспазою білків, що включає контактування матеріалу, який містить каспазу людини, з вказаним моноклональним антитілом. Зокрема, асоційовані з каспазою білки, елююють, переважно пептидом, використаним для імунізації. Крім того, у винаході представлений спосіб очищення регуляторних білків каспази-8, зв'язаних з С кінцевим доменом каспази-8, за допомогою антитіл, одержаних до С-кінцевого домену Sub-1 (наприклад, Mab 179), у комбінації з антитілами, одержаними до N-кінцевого домену Sub-1 (наприклад, Mab 182), що включає спочатку співосадження каспази-8 і регуляторних білків антитілами до N-кінцевого домену, а потім використання антитіл проти С-кінцевого домену для елюції регуляторних білків каспази-8. Крім того, у винаході представлене застосування епітопу 179 (SEQ ID:4) для одержання антитіла відповідно до винаходу, що включає імунізацію тварини таким епітопом. Короткий опис фігур На Фіг.1 представлена амінокислотна послідовність про-каспази-8. Пептидні послідовності з каспази-8, використані для одержання Mab, зображені жирним шрифтом і підкреслені. Пептид 179 - пептид CQGDNYQKGIPVETD, що відповідає С-кінцю великої субодиниці каспази-8 (Sub-1). Пептид 182 - пептид LSSPQTRYIPDEAD, що відповідає N-кінцю малої субодиниці каспази-8 (Sub-2, залишки Lys385-GIy399). Пептид 183 - пептид SESQTLDKVYQMKSKPR, що відповідає N-кінцю Sub-1 (залишки Ser217-Gly234). На Фіг.2 продемонстрована ефективна імунопреципітапія незначних кількостей каспази-8, виявлених у лізатах клітин BJAB, за допомогою моноклональних антитіл проти епітопу 179. Елімінація каспази-8 з лізатів клітин BJAB (одержаних до, -, і після, +, стимуляції рецептора Fas) імунопреципітацією різними антитілами представлена зліва направо: Доріжки 3 і 4, Mab 179, моноклональне антитіло, одержане проти пептиду, що відповідає С-кінцю Sub-1 (велика субодиниця каспази-8, залишки Cys360-Asp374). Доріжки 5 і 6, Mab 183.1 і доріжки 7 і 8, Mab 183.2, два моноклональних антитіла, одержаних проти пептиду, що відповідає N-кінцю Sub-1 (залишки Ser217-Gly234). Доріжки 9 і 10, Mab 182, моноклональне антитіло, одержане проти пептиду, що відповідає N-кінцю Sub-2 (мала субодиниця каспази-8) (залишки Lys385-Asp399). Доріжка 11, NMS - нормальна мишача сироватка. На фігурі представлені результати оцінки за допомогою вестерн-блотингу кількостей каспази-8, що залишилися у клітинних лізатах після імунопреципітації вказаними антитілами та у неосаджених спільних клітинних лізатах (доріжки 1 і 2). На Фіг.3а зображена елюція каспази-8, імунопреципітованої, як показано на Фіг.2, за допомогою конкуренції з пептидами, проти яких були одержані різні антитіла. Каспазу-8 в елюатах з імунопреципітатів, утворених вказаними антитілами, визначали за допомогою вестерн-блотинг-аналізу (як на Фіг.2). На Фіг.3b зображена елюція каспази-8, імунопреципітованої, як показано на Фіг.2, внаслідок конкуренції з пептидами, проти яких були одержані різні антитіла. Каспазу-8 в елюатах з імунопреципітатів, утворених вказаними антитілами, виявляли забарвлюванням сріблом. На Фіг.4 показана ефективна імунопреципітація незначних кількостей каспази-8, виявлених у лізатах клітин BJAB, при використанні полІклональної сироватки, одержаної при імунізації пептидом, що відповідає Скінцю Sub-1 (велика субодиниця каспази-8, залишки Cys360-Asp374). Елімінація каспази-8 з лізатів клітин BJAB (одержаних до, -, і після, +, стимуляції рецептора Fas) імунопреципітацією різними антитілами показана зліва направо. Каспазу-8, що залишилася у лізаті, визначали за допомогою вестерн-блотинг-аналізу після імунопреципітації наступними антитілами: Доріжки 3 і 4, NMS - нормальна мишача сироватка. Доріжки 5 і 6, анти-179 поліклональне антитіло, поліклональне антитіло кролика, одержане проти С-кінця Sub-1 (велика субодиниця каспази-8, залишки Cys360-Asp374). Доріжки 7 і 8, Mab 182. TL - спільний клітинний лізат. На Фіг.5 представлена каспаза-8, імунопреципітована та елюйована з лізатів нестимульованих клітин BJAB при використанні різних антитіл. Рівні каспази-8, представлені зліва направо, визначали методом вестерн-блотингу після елюції імунопреципітатів, проведеного з наступними антитілами: Доріжка 1, анти-183 поліклональна сироватка проти N-кінця Sub-1 (залишки Ser217-Gly234). Доріжка 2, Mab 183.2, моноклональне антитіло проти N-кінця Sub-1 (залишки Ser217-Gly234). Доріжка 3, Mab 179, моноклональне антитіло проти С-кінця Sub-1 (велика субодиниця каспази-8, залишки Cys360-Asp374). Невеликий (5,6кДа) фрагмент каспази-8, одержаний за допомогою нового режиму процесингу, індукованого Mab 179, відмічений стрілкою. На Фіг.6 представлена каспаза-8 і асоційований білок (Р72/Сагі), які були імунопреципітовані Mab 179 з лізатів клітин BJAB перед або після одногодинної стимуляції Fas-лігандом і елюйовані пептидом 179. Каспазу8 і асоційовані білки, імунопреципітовані МаЬ179, елюювали (як показано на Фіг.3b), розділяли за допомогою SDS-PAGE і забарвлювали сріблом. На доріжках 1 і 2 представлені контролі, в яких клітинні лізати імунопреципітували MIgGI (імуноглобулІн миші IgGl). На Фіг.7 зображене схематичне представлення мотивів білка Р72. Один згорнутий спіральний мотив (С) і два розташованих один за одним «мотиви SURP» (S) розташовані близько до N-кінця білка, а один мотив, «Gділянка», локалізований на С-кінці білка (G-мотив). Також вказаний залишок аспарагінової кислоти D600, присутній всередині мотиву G. D600 є мутантом, в якому залишок D600 у білці заміщений залишком глутамінової кислоти. На Фіг.8 зображене схематичне представлення підходу, що використовується для одержання повнорозмірної кДНК р72. Клон EST IMAGE 2964545, придбаний у фірми Incyte Genomics, в якому відсутня послідовність перших 21 нуклеотиду (які кодують перші 7 амінокислот), використовували як матрицю для першої полімеразної ланцюгової реакції (ПЛР) разом з парою праймерів: прямий праймер, Р2, що містить нуклеїнові кислоти, які перекриваються з клоном 5' EST, і додаткові 15 нуклеотидів з 21 відсутнього нуклеотиду, і зворотний праймер, Р3, що містить послідовності, які перекриваються з 3' EST. Одержаний продукт ПЛР використовували як матрицю для другої ПЛР разом з парою праймерів: прямий праймер Р1, що містить всі 21 відсутні нуклеотиди і 5 нуклеїнових кислот EST, і зворотний праймер РЗ, що містить послідовності, які перекриваються з 3' EST. На Фіг.9 продемонстрована спів-імунопреципітація каспази-8 і р72 за допомогою МаЬ179 з лізатів клітин BJAB у н ульовий час і після 20 хвилин стимуляції Fas-лігандом. Білки, елюйованІ після імунопреципітації МаЬ179, розділяли у гелях SDS-PAGE і виявляли забарвлюванням сріблом. Зону з припустимою молекулярною масою приблизно 72,5 кДа, що відповідає р72, співосаджували з про-каспазою-8 перед Fasлігандною стимуляцією (доріжка 3). Після 20 хвилинної стимуляції зона доріжки 72,5 кДа зменшувалася і виявляли нову зону, що відповідає білку з більш низькою припустимою молекулярною масою приблизно 68 кДа (доріжка 4), На доріжці 1 і 2 представлені негативні контролі, включаючи імунопреципітацію клітинних лізатів MIgGI, імуноглобулін миші IgGl. На Фіг.10 продемонстроване розщеплення р72 активною каспазою-8. Білок, що кодується кДНК р72, експресували in vitro у ретикулоцитних лізатах у присутності 835-метіоніну, використовуючи систему ретикулоцитних лізатів, зв'язану з TnT T7, і тестували після інкубації протягом 1 години при 37°С у присутності та за відсутності рекомбінантної активної каспази-8. Крім того, розщеплення р72 вивчали з продуктами ТпТ, що кодуються 2 різними мутантами кДНК р72: один, що кодує р72, в якому залишок D600, як вважають, є залишком-мішенню для каспази-8, мутували в Е [р72 (D600E)], та інший, в якому делегований ген, а в одержаному зрізаному білку відсутні залишки [D600 р72 (1-600)], що лежать нижче. Одержані білки розділяли при SDS-PAGE, а результати виявляли за допомогою фосфовізуалізації. На Фіг.11 представлені каспаза-8 і р72, які були спів-імунопреципітовані МаЬ179 з лізатів клітин BJAB до (0') або після 5, 10, 20, 40 і 60 хвилин стимуляції Fas-лігандом. Пептиди елюювали, розділяли у гелях SDSPAGE і виявляли забарвлюванням сріблом. До стимуляції (0') виявлений пептид з припустимою молекулярною масою 72,5 кДа. Після 5 і 10 хвилин стимуляції з'являвся новий білок з більш низькою припустимою молекулярною масою близько 68 кДа. Після 40 хвилин стимуляції зона доріжки 72,5 кДа повністю зникала, а визначали тільки зону 68 кДа. На 60 хвилині жоден із згаданих вище білків не співпреципітував з каспазою-8. Даний винахід відноситься до антитіл, направлених проти С-домену Sub-1 каспази-8. Встановлено, що антитіла, проти зазначеного домену, представляють інтерес завдяки їх здатності імунопреципітувати каспазу-8 (про-каспазу-8 і активну каспазу) з високою ефективністю, навіть якщо каспаза присутня у дуже низькій концентрації. Зазначені антитіла також можна застосовувати для ефективного співосадження і виділення білка, зв'язаного з каспазою-8. Антитіла відповідно до винаходу можуть бути полІклональними або, більш переважно, моноклональними. У переважному аспекті, пептид, одержаний з С-кінця Sub-1 каспази-8, що містить залишки Cys360-Asp374 і послідовність CQGDNYQKGIPVETD (пептид 179 SEQ ID:4), використовують для імунізації, щоб одержати антитіла. Пептид, що застосовується для імунізації, може бути синтезований, очищений за допомогою ВЕРХ з оберненою фазою і з'єднаний з будь-яким носієм, таким як KLH, переважно через його природний цистеїн або через штучно злитий цистеїн, щоб експонувати пептид на поверхні носія, і використаний для імунізації, наприклад, мишей для одержання моноклональних антитіл і кроликів для одержання поліклональних антитіл. В одному аспекті спів-імунопреципітацію каспази-8 і білків, зв'язаних з каспазою-8, проводять з використанням антитіла до каспази-8, специфічного до епітопу 179, виявленого на С-кінцевому домені Sub-1. Спів-імунопреципітацію відповідно до винаходу проводять на зразках, вибраних з клітинних лізатів стимульованих і таких, що знаходяться у стані спокою, клітин з бібліотек кДНК, що експресуються, з бібліотек геномних або комбінаторних пептидів. Клітини можна стимулювати перед лізисом та імунопреципітацією, використовуючи різні агенти, що індукують апоптоз, такі як обробка лімфокінами, наприклад Fas-лігандом, TNF, або факторами, зв'язаними з навколишнім середовищем, такими як голодування, тепловий шок і так далі. Використовуючи антитіла для спів-імунопреципітації відповідно до винаходу, можна ефективно елюювати каспазу-8 і зв'язаний з каспазою-8 білок, з імунопреципітованого комплексу і дістати у супернатант внаслідок конкуренції з пептидом, одержаним з CQGDNYQKGIPVETD каспази-8, тим же пептидом, який використовували для імунізації. Пептид 179 або епітоп 179 каспази-8 з послідовністю CQGDNYQKGIPVETD і SEQ ID N0:4 або мутеїн, його фрагмент, злитий білок або його похідне можна застосовувати для імунізації та утворення антитіл відповідно до винаходу. Пептид для імунізації може бути одержаний внаслідок хімічного синтезу, як описано вище, або технологією рекомбінантної ДНК у клітинах ссавця, або внаслідок розщеплення очищеного білка. Білок також може продукуватися у клітинах бактерій або комах, що детально описано в [Current Protocols in Molecular Biology, b yF.M. Ausubel, ISBN: 047150338X, 1988 chapter 16]. Даний винахід також відноситься до мутеїнів зазначеного вище епітопу 179 (SEQ ID N0:4) винаходу, які в основному зберігають ті ж властивості пептиду, що має, по суті, тільки послідовності пептиду, які зустрічаються у природі. Такі "мутеїни" можуть бути м утеїнами, в яких амінокислотні залишки можуть бути делетованІ, додані або заміщені іншими залишками так, що модифікації даного виду істотно не змінюють біологічні властивості пептидного мутеїну у порівнянні з самим пептидом. Зазначені мутеїни одержують за відомим способом синтезу і/або за способами сайт-направленого мутагенезу або будь-яким іншим відомим способом, придатним для цього. Переважними змінами для мутеїнів відповідно до даного винаходу є зміни, які відомі як "консервативні" заміщення. Консервативні амінокислотні заміщення включають подібні амінокислоти у межах групи, які мають досить подібні фізико-хімічні властивості, так що заміщення між представниками групи будуть зберігати біологічні функції молекули, [Grantham, Science, Vol. 185, рр 862-864 (1974)]. Зрозуміло, що інсерції та делеції з амінокислот також можуть бути здійснені в описаних вище послідовностях без зміни їх функції, особливо, якщо інсерції або делеції стосуються тільки декількох амінокислот, наприклад менше 3, і переважно менше 2, і не видаляють або заміщають амінокислоти, які є істотними для функціональної конформації. Переважно, подібними амінокислотними групами є групи, позначені у Таблиці І. Більш переважно, подібними амінокислотними групами є групи, позначені у Таблиці II; і найбільш переважно, подібними амінокислотними групами є групи, позначені у Таблиці III. ТАБЛИЦЯ II ТАБЛИЦЯ III Приклади здійснення амінокислотних заміщень у білках, які можна використовувати для одержання мутеїнів білків для застосування у даному винаході включають в себе будь-які відомі стадії способів, такі як описані у [патентах США RE 33653, 4959314 і 4737462 (Mark et al.); 5116943 (Koths et al.); 4965195 (Namen et al.); 4879111 (Chong et al); і 5017691 (Lee et al.); і лізин-заміщені білки, описані у патенті США № 4904584 (Straw et al]. Потім білок або пептид очищають з синтезованої суміші або з клітин, в яких він продукується. Способи очищення білка відомі фахівцям у даній області і детально описані, наприклад, у згаданих вище Current Protocols in Molecular Biology, chapter 16, та у Current Protocols in Protein Science, Wiley and Sons Inc. Chapter 5 and 6. Виявляється сприятливим, якщо пептид можна одержувати у вигляді гібрида з KLH або глута тіон-8трансферазою або тому подібним, або з послідовністю-міткою, такою як гістидин-мічена послідовність. Застосування злитих або мічених білків спрощує процедуру очищення, що детально описано у згаданих Current Protocols in Molecular Biology, chapter 16 та в інструкціях для вказаної вище експресії His-мітка-білка Qiagen і в інструкції до набору для очищення. Якщо білок або пептид експресують у вигляді злитого білка, партнер злиття потрібно видаляти перед застосуванням білка для одержання антитіл для того, щоб уникнути утворення антитіл проти партнера злиття. Розщеплення партнерів злиття і виділення бажаного білка описане у згаданих Current Protocols in Molecular Biology, chapter 16. Вектори, протоколи і реагенти для експресії і очищення мальтозазв'язувального білка, злитого з рекомбІнатними білками, також постачаються комерційно. При одержанні пептиду може не потребуватися видалення партнера злиття, оскільки злитий білок може стимулювати продукцію антитіл проти пептиду. Крім того, як зазначено вище, пептид також можна синтезувати хімічними способами, відомими в області хімії. Одержання поліклональних антитіл проти білків описане у chapter 2 of Current Protocols in Immunology, Wiley and Sons Inc. Одержання антитіл проти пептидів може потребувати деяких змін у протоколі, внаслідок звичайно більш низької антигенності пептидів у порівнянні з білками. Одержання поліклональних антитіл проти пептидів описане у вказаних Current Protocols in Immunology, chapter 9. Моноклональні антитіла можна одержувати з В-клітин, взятих з селезінки або лімфатичних вузлів імунізованих тварин, зокрема щурів або мишей, за допомогою злиття з імморталізованими В-клітинами в умовах, які сприяють росту гібридних клітин. Для злиття мишачих В-клітин переважні клітини лінії Ag-8. Спосіб одержання моноклональних антитіл описаний у багатьох стаття х і керівництвах, таких як Current Protocols in Immunology, Wiley and Sons Inc. Chapter 2. У розділі 9 описують імунізацію тварин пептидами. Клітини селезінки або лімфатичних вузлів зазначених тварин можна використовувати таким же чином, як використовують клітини селезінки або лімфатичних вузлів імунізованих білком тварин для одержання моноклональних антитіл, що описано у розділі 2 там же. Крім того, способи, що використовуються для одержання моноклональних антитіл, описані [Kohler and Milstein, (1975), та у патенті США 4376110]. Одержання антитіл з банку генів антитіл людини, у яких їх гіперваріабельні ділянки заміщають майже випадковими послідовностями, описане в [USP 5840479]. Такі антитіла є переважними, коли важко імунізувати тварину даним пептидом або білком. Деякі структури є поганими імуногенами і можуть залишатися такими, незважаючи на додавання ад'ювантів і зв'язування з іншими білками у злитих конструкціях. Крім того, антитіла, описані в [USP 5840479], виявляються переважними, якщо бажано застосовувати антитіла зі структурою подібною до антитіл людини, наприклад, коли потрібні антитіла, які мають низьку імуногенність у людини. Після ідентифікації придатного антитіла, може виявитися бажаним змінити його властивості. Наприклад, використовуючи химерне антитіло, можна досягти більш високого виходу у продукуванні. Крім того, химерні антитіла, в яких константні ділянки заміщають константними ділянками антитіл людини, потрібні, коли бажано, щоб антитіло володіло низькою імуногенністю у людини. Одержання химерних антитіл описане у ряді публікацій, таких як [Cabilly et al., 1984; Morrison etal., 1984; Boulianne et al., 1984; ЕР 125023, ЕР 171496, ЕР 173494, ЕР 184187, WO 86/01533, WO 87/02671 і Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988]. «Повністю гуманізовані антитіла» являють собою молекули, що містять як варіабельну, так і константну ділянку імуноглобуліну людини. Повністю гуманізовані антитіла потенційно можна використовувати для терапевтичного застосування, коли потрібне тривале лікування при хронічних і рецидивних захворюваннях, таких як аутоімуннІ захворювання. Один спосіб одержання повністю гуманізованих антитіл людини складається з «гуманізації» гуморальної імунної системи миші, тобто одержання мишачих ліній, здатних продукувати Ig людини (ксеномиші) внаслідок введення локусів імуноглобуліну (Ig) людини мишам, у яких ендогенні гени Ig були інактивовані. Локуси Ig є надзвичайно складними з точки зору як їх фізичної структури, так і реаранжування генів і способів експресії, необхідних, щоб викликати зрештою яскраво виражену імунну відповідь. Різноманітність антитіл досягається, головним чином, комбінаторним реаранжуванням між різними генами V, D і J, присутніми у локусах Ig. Зазначені локуси також містять різноманітні регуляторні елементи, які контролюють експресію антитіл, алельне виключення, зміну класів і дозрівання афінності. Введення нереаранжованих трансгенів Ig людини мишам продемонструвало, що мишачий механізм рекомбінації є сумісним з генами людини. Крім того, гібридому, що секретує антиген-специфічні hu-mAb різних ізотипів, можна одержувати внаслідок імунізації ксеномишей антигеном. Повністю гуманізовані антитіла і способи їх одержання відомі у даній області [Mendez et al, Nature Genetics 15:146-156 (1997); Buggemann et al., Eur. J. Immunol. 21:1323-1326 (1991); Tomizuka et al., Proc. Natl. Acad Sci. USA 97:722-727 (2000), патент WO 98/24893]. Іншим типом антитіла є антиідіотипічне антитіло. Антиідіотипічне (анти-Id) антитіло являє собою антитіло, яке розпізнає унікальні детермінанти, звичайно асоційовані з антигензв'язувальною ділянкою антитіла. Idантитіло можна одержувати імунізацією тварини того ж виду і генетичного типу (наприклад, мишачу лінію) як джерело Mab, до якого одержують анти-Id. Імунізована тварина буде розпізнавати і відповідати на ідіотипічні детермінанти антитіла, що імунізує, за допомогою продукції антитіла до зазначених ідіотипічних детермінант (анти-Id-антитіло). Дивись, наприклад, [патент США №4699880], який повністю включений в опис шляхом посилання. Анти-М-антитіло також можна використовува ти як "імуноген", щоб індук увати імунн у відповідь ще у іншої тварини, одержуючи так зване анти-анти-Id-антитіло. Анти-анти-Id може бути ідентичним за антигенними детермінантами первинному mAb, яке індукувало анти-Id. Таким чином, внаслідок використання антитіл до ідіотипічних детермінант mAb, виявляється можливим ідентифікувати інші клони, що експресують антитіла з ідентичною специфічністю. Відповідно, Mabs, одержані проти С-кінцевої субодиниці каспази-8, її аналогів, фрагментів або похідних даного винаходу можна використовува ти, щоб індукувати анти-И-антитіла у відповідних тварин, таких як миші BALB/c. Клітини селезінки від таких імунізованих мишей застосовують, щоб одержати анти-Id-гібридоми, які секретують анти-Id mAb. Крім того, анти-Id mAb можна зв'язувати з носієм, таким як гемоціанін лімфи равлика (KLH), і використовувати, щоб імунізувати додаткових мишей BALB/c. Сироватки від зазначених мишей будуть містити анти-анти-Id антитіла, які характеризуються зв'язувальними властивостями вихідних mAb, специфічних відносно епітопу згаданої вище каспази-8 або її аналогів, фрагментів і похідних. Таким чином, анти-Id-mAb містять свої власні ідіотипічні епітопи або "ідіотопи", які структурно подібні до оцінюваного епітопу. Термін "антитіло" також припускає включення обох інтактних молекул, а також їх фрагментів, таких як, наприклад, Fab і F(ab')2, які здатні зв'язувати антиген. Фрагменти Fab і F(ab')2 не містять фрагмент Fc інтактного антитіла, більш швидко виводяться з циркуляції і можуть характеризуватися меншим неспецифічним тканинним зв'язуванням, ніж інтактне антитіло [Wahl et al., 1983]. Потрібно розуміти, що Fab і F(ab')2 та інші фрагменти антитіл, що використовуються у даному винаході, можна застосовувати для виявлення і кількісного визначення білка р72 відповідно до способів, представлених в описі для інтактних молекул антитіл. Звичайно такі фрагменти одержують в результаті протеолітичного розщеплення, використовуючи ферменти, такі як папаїн (щоб одержати фрагменти Fab) або пепсин (щоб одержати фрагменти F(ab')2). Як зазначено, антитіло "здатне зв'язувати" молекулу, якщо воно може специфічно взаємодіяти з молекулою, щоб таким чином зв'язати молекулу з антитілом. Термін "епітоп", як вважають, відноситься до тієї частини будь-якої молекули, яка здатна зв'язуватися антитілом і яка також може бути розпізнана таким антитілом. Епітопи або "антигенні детермінанти" звичайно складаються з хімічно активних поверхневих угр уповань молекул, таких як амінокислоти або бічні ланцюги цукрів, і володіють специфічними особливостями тривимірної структури, а також специфічними характеристиками заряду. "Антиген" являє собою молекулу або частину молекули, здатну зв'язуватися антитілом, яка, крім того, здатна стимулювати тварину до продукції антитіла, здатного зв'язувати епітоп такого антигену. Антиген може мати один або більше епітопів. Припускається, що згадана вище специфічна реакція вказує, що антиген буде реагувати високоселективним способом зі своїм відповідним антитілом, а не з безліччю інших антитіл, які можуть бути індуковані іншими антигенами. Епітоп 179 винаходу можна використовува ти для створення поліклональних, моноклональних антитіл для вираженої імунопреципітації та елюції каспази-8 і білків, асоційованих з каспазою-8. Антитіла також можна використовува ти, щоб індукувати новий процесинг каспази-8. Антитіла, одержані до С-кінцевого домену Sub-1, такі як Mab 179, можна застосовувати у комбінації з антитілами, одержаними до N-кінцевого домену Sub-1, такими як Mab 183, щоб специфічно виділяти регуляторні білки каспази-8. Відомо, що С-кінцевий домен Sub-1 є частиною активного центра каспази-8 і, тому, регуляторні білки можуть зв'язувати його [Thornberry et al., 1997]. Співосадження каспази-8 і регуляторних білків, асоційоване спочатку з Mab 183, а потім із застосуванням Mab 179, може вивільняти регуляторні білки від каспази-8 у середовище і приводити до ідентифікації ключових білків, залучених до регуляції апоптозу. В одному аспекті, Сагі, білок, що зв'язує про-каспазу-8, виділяють, використовуючи імунопреципітацію за винаходом з Mab 179. Встановлено, що Сагі розщеплюється активною каспазою-8 і залучений до активації каспази-8 та апоптозу. Антитіла (або їх фрагменти), що використовуються у даному винаході, можна застосовувати гістологічно в імунофлуоресцентній або імуноелектронній мікроскопії для виявлення каспази-8 in situ. Виявлення in situ може бути досягнуте внаслідок видалення гістологічного препарату у пацієнта і застосування міченого антитіла даного винаходу для такого препарату. Переважно, антитіло (або фрагмент) застосовують, піддаючи контакту мічене антитіло або покриваючи ним (або фрагментом) біологічний препарат. Застосовуючи даний винахід, фа хівець у даній області повинен розуміти, що будь-який з великої різноманітності гістологічних способів (таких як процедури забарвлення) можна модифікувати, щоб успішно виконати подібне виявлення in situ. Біологічний зразок можна обробляти твердофазовою основою або носієм, таким як нітроцелюлоза або іншою твердою основою або носієм, які здатні іммобілізувати клітини, клітинні частинки або розчинні білки. Потім основу або носій можна промивати відповідним буфером з подальшою обробкою антитілом, міченим міткою, що виявляється, відповідно до даного винаходу, як зазначено вище. Потім твердофазову основу або носій можна промивати буфером, щоб другий раз видалити незв'язані антитіла. Кількість зв'язаної мітки на зазначеній твердій основі або носії потім можна визначати загальноприйнятими способами. Під терміном «твердофазова основа», «твердофазовий носій», «тверда основа», «твердий носій», «основа» або «носій» мають на увазі будь-яку основу або носій, які здатні зв'язувати антиген або антитіла. Добре відомі основи або носії включають скло, полістирол, поліпропілен, поліетилен, декстран, нейлонові амілази, природні та модифіковані целюлози, поліакриламіди, габро і магнетит. Для цілей даного винаходу носій може бути або розчинним до деякої міри, або нерозчинним. Матеріал основи фактично може мати будьяку можливу структурну конфігурацію, доки зв'язана молекула здатна зв'язуватися з антигеном або антитілом. Таким чином, конфігурація основи або носія може бути сферичною у вигляді гранул, циліндричною як внутрішня поверхня пробірки або зовнішня поверхня стрижня. Альтернативно, поверхня може бути плоскою як лист, тест-см ужка і так далі. Переважні основи або носії включають в себе полістиролові гранули. Фахівцям у даній області добре відомо багато інших відповідних носіїв для зв'язування антитіла або антигену, або вони зможуть їх вибрати при звичайному експериментуванні. Як зазначено вище, зв'язувальна активність даної партії антитіл винаходу може бути встановлена за допомогою добре відомих способів. Фахівці у даній області зможуть вибрати робочі та оптимальні умови дослідження для кожного визначення в результаті звичайного експериментування. Інші стадії, такі як промивання, перемішування, струшування, фільтрування і тому подібні, можуть бути додані до дослідження, оскільки є звичайними і необхідними за певної ситуації. Одним із способів, при якому антитіло відповідно до даного винаходу можна ефективно мітити, є зв'язування антитіла з ферментом і застосування в імуноферментному аналізі (ЕІА). У свою чергу, зазначений фермент при експозиції з відповідним субстратом, буде взаємодіяти з субстратом так, щоб утворити хімічний фрагмент, який можна визначати, наприклад, спектрофотометричним, флуориметричним або візуальним способом. Ферменти, які можна використовувати для детектованого мічення антитіла, не обмежуючись, включають малатдегідрогеназу, стафілококову нуклеазу, дельта-5-стероідизомеразу, алкогольдегідрогеназу дріжджів, альфа-гліцерофосфат-дегідрогеназу, триозофосфатізомеразу, пероксидазу хрону, лужну фосфа тазу, аспарагіназу, глюкозооксидазу, бета-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкозо-6фосфа тдегідрогеназу, глюкоамілазу і ацетилхолінестеразу. Виявлення можна проводити колориметричними способами, в яких застосовують хромогенні субстрати для ферменту. Виявлення також можна здійснювати візуальним порівнянням ступеню ензиматичної реакції з субстратом у порівнянні з реакцією, проведеною зі стандартами. Виявлення можна проводити, використовуючи будь-який з цілого ряду інших імуноаналізів. Наприклад, за допомогою радіоактивного мічення антитіл або фрагментів антитіл виявилося можливим визначати R-PTP-азу за допомогою застосування радіоімуноаналізу (RIA). Хороший опис RIA представлений в [Laboratory Techniques and Biochemistry in Molecular Biology, b y Work, T.S. et al., North Holland Publishing Company, NY (1978), особливо це стосується розділу, озаглавленого "An Introduction to Radioimmune Assay and Related Techniques" by Chard, T.], включеного в опис у вигляді посилання. Радіоактивні ізотопи можна виявляти такими способами, як застосування g-лічильника або сцинтиляційного лічильника або за допомогою авторадіографії. Також виявляється можливим мітити антитіло відповідно до даного винаходу флуоресцентною сполукою. Коли мічене флуоресцентною міткою антитіло піддають дії випромінювання належної довжини хвилі, присутність антитіла потім можна визначити за флуоресценцією. До числа багатьох звичайно використовуваних флуоресцентно мічених сполук відносяться флуоресцеїнізотіоціанат, родамін, фікоеритрин, пікоціанін, алофікоціанін, о-фтальальдегід і флуорескамін. Антитіло також можна ефективно мітити, використовуючи метали, що випромінюють флуоресценцію, такі як Е або інші з ряду лантанідів. Зазначені метали можна приєднувати до антитіла, застосовуючи такі металхелатуючі групи, як діетилентриамінпентаоцтова кислота (ЕТРА). Антитіло також можна мітити зв'язуванням його з хемілюмінесцентною сполукою. Потім присутність міченого хемілюмінесцентною сполукою антитіла виявляють за люмінесценцією, яка виникає під час хімічної реакції. Прикладами особливо придатних хемілюмінесцентно мічених сполук є лумінол, ізолумінол, складний ароматичний ефір акридинію, імідазол, сіль акридинію і складний ефір щавлевої кислоти. Аналогічно, біолюмінесцентну сполуку можна застосовувати для мічення антитіла даного винаходу. Біолюмінесценція є типом хемілюмінесценції, виявленої у біологічних системах, в яких каталітичний білок збільшує ефективність хемілюмінесцентної реакції. Присутність біолюмінесцентного білка виявляють, визначаючи люмінесценцію. Важливою біолюмінесцентною сполукою для цілей мічення є люциферин, люцифераза та ехіорин. Молекулу антитіла даного винаходу можна адаптувати для застосування в імунометричному аналізі, також відомому як "двошаровий" або "сендвіч" аналіз. У типовому імунометричному аналізі, кількість немічених антитіл (або фрагментів антитіл) зв'язують з твердою основою або носієм, а кількість розчинних антитіл, зв'язаних з міткою, що виявляється, додають, щоб мати можливість виявити і/або кількісно визначити потрійний комплекс, утворений між твердофазовим антитілом, антигеном і міченим антитілом. Типовий і переважний імунометричний аналіз включає в себе "прямий" аналіз, в якому антитіло, зв'язане з твердою фазою, спочатку контактує із зразком, що тестується, щоб екстрагувати антиген із зразка за допомогою утворення подвійного твердофазового комплексу антитіло-антиген. Після відповідного інкубаційного періоду, тверду основу або носій промивають, щоб видалити залишок рідкого зразка, включаючи антиген, що не прореагував, якщо він взагалі є, а потім контактують з розчином, що містить невідому кількість мічених антитіл (які функціонують як "репортерна молекула"). Після другого періоду інкубації, під час якої мічене антитіло має можливість утворити комплекс з антигеном, зв'язаним з твердою основою або носієм через немічене антитіло, тверду основу або носій промивають другий раз, щоб видалити мічені антитіла що не прореагували. В іншому типі "сендвіч" аналізу, який також можна застосовувати з антигенами даного винаходу, використовують так званий "одночасний" і "зворотний" аналіз. Одночасний аналіз включає одну стадію інкубації, при якій антитіло, зв'язане з твердою основою або носієм, і мічене антитіло одночасно додають до тестованого зразка. Після завершення інкубації, тверду основу або носій промивають, щоб видалити залишок рідкого зразка і не включені у комплекс мічені антитіла. Потім присутність мічених антитіл, асоційованих з твердою основою або носієм, фактично визначають за допомогою звичайного "прямого" седвіч-аналізу. У "зворотному" аналізі, застосовують спочатку ступінчате додавання розчину міченого антитіла до рідкого зразка з подальшим додаванням неміченого антитіла, зв'язаного з твердою основою або носієм, після відповідного періоду інкубації. Після другого періоду інкубації, тверду фазу промивають загальноприйнятим способом, щоб видалити з неї залишок тестованого зразка і розчину мічених антитіл, що не прореагували. Потім визначення мічених антитіл, асоційованих з твердою основою або носієм, проводять як в "одночасному" і "прямому" аналізі. Створення імуноаналізів, таких як RIA і ELISA, описане у багатьох статтях, керівництвах та інших публікаціях. Як посилання приведена [WO 97/03998, стор. 48, рядок 4 до стор. 52, рядок 27]. Імуноаналіз винаходу може бути двох звичайних типів. По-перше, імуноаналіз, в якому використовують іммобілізовану каспазу або еквівалент пептиду, може бути застосований для кількісного визначення каспази-8. По-друге, для визначення кількості каспазних білків можна застосовувати імуноаналіз, в якому використовують іммобілізовані антитіла, направлені проти епітопу каспази. Такий аналіз може бути використаний для діагностики, оскільки може бути необхідним оцінити рівень каспази та інших білків, залучених до апоптозних метаболічних шля хів, при цілому ряді порушень або синдромів, при яких є можливим залучення таких шляхів. В одному аспекті, білок, що взаємодіє з про-каспазою-8, позначений Сагі, виділяють за допомогою антитіл відповідно до винаходу. Однак якщо бажано імунопреципітувати білки, зв'язані з іншою каспазою, застосовуючи описаний вище спосіб імунопреципітації, можна використовувати антитіло, специфічне до Скінцевого домену Sub-1 іншої каспази, а не каспази-8. Оскільки антитіла відповідно до винаходу здатні осаджувати про-каспазу-8 або каспазу-8, білки, що зв'язують каспазу, можуть співосаджуватися разом з активною каспазою або про-каспазою при співімунопреципітації. Далі, винахід буде проілюстрований наступними прикладами, які не обмежують винахід. Приклади Приклад 1 Імунізація мишей для утворення моноклональних антитіл, специфічних до каспази-8 Після активації, каспазу-8 розщеплювали і збирали у дві субодиниці (Sub-1 і Sub-2). Для утворення антитіл, специфічних до нових можливих епІтопів, утворених після активації каспази-8, синтетичні пептиди, одержані з С-кінця Sub-1 і N-кінця Sub-1 і Sub-2, використовували для імунізації мишей. Наступні пептиди використовували для імунізації мишей для одержання моноклональних антитіл: Пептид 179 - Пептид CQGDNYQKGIPVETD (SEQ id:4), що відповідає С-кінцю великої субодиниці каспази-8 (Sub-1), (епітоп, який відповідає залишкам Cys360-Asp374, Фіг.1), синтезували, очищали методом ВЕРХ з оберненою фазою і зв'язували з носієм KLH через його природний цистеїн, щоб експонувати пептид на поверхні носія. Пептид 182 - Пептид LSSPQTRYIPDEADC (SEQ ID:5), що відповідає N-кінцю малої субодиниці каспази-8 (Sub-2, залишки Lys385-Cly399), синтезували, очищали методом ВЕРХ з оберненою фазою і зв'язували з носієм KLH через С, який не одержували з послідовності Sub-2. Пептид 183 - Пептид SESQTLDKVYQMKSKPRC (SEQ ID:6), що відповідає N-кінцю Sub-1 (залишки Ser217Gly234), синтезували, очищали методом ВЕРХ з оберненою фазою і зв'язували з носієм KLH через С, який не походить з послідовності Sub-1. Чотири імунізації та дві бустер-ін'єкції з однаковою кількістю антигену (пептид-KLH) вводили мишам наступним чином: Для першої імунізації 50мкг пептиду-KLH розчиняли у 50мкл PBS і гомогенізували з 50мкл повного ад'юванту Фрейнда і вводили у подушечку стопи кожної з п'яти самок мишей Balb/с у віці 7 тижнів. Для другої імунізації, яку проводили через два тижні після першої імунізації, мишам внутрішньом'язово робили бустер-ін'єкцію з такою ж кількістю пептиду в 50% (об./об.) розчині неповного ад'юванту Фрейнда. Для третьої імунізації, яку проводили через два тижні після другої імунізації, мишам внутрішньочеревинно вводили 50 мкг пептиду-KLH в 50 мкл PBS. Сироватки мишей, яким робили ін'єкції, тестували через 10 днів після другої і третьої імунізацій. Четверту імунізацію (виконували тільки для пептидів 182 і 183) проводили через місяць аналогічним чином, як третю імунізацію. Через один місяць після четвертої імунізації (або третьої імунізації для мишей, стимульованих пептидом 179) робили дві бустер-ін'єкції (таким же способом, як третю і четверту імунізацію) з дводенним інтервалом. Через чотири дні селезінку і пахові лімфатичні вузли двох мишей, що виявляли найвищу специфічну імунореактивність, брали для з'єднання з клітинами мієломи (Eshhar Z, 1985). Приклад 2 Імунізація кроликів для утворення поліклональних антитіл, специфічних до каспази-8 Кроликів імунізували 179-KLH і 183-KLH для утворення специфічних поліклональних антитіл. Першу імунізацію проводили з 100мкг пептиду-KLH, який розчиняли у 50мкл PBS і гомогенізували з 50мкл повного ад'юванту Фрейнда і вводили підшкірно. Другу імунізацію проводили через два тижні з такою ж кількістю пептиду-KLH і вводили внутрішньом'язово з неповним ад'ювантом Фрейнда. За описаними двома імунізаціями йшли дві бустер-ін'єкції такою ж кількістю пептиду-KLH, розчиненого у PBS, і вводили підшкірно з двотижневим інтервалом. Приклад 3 Одержання гібридоми, селекція клонів, що продукують антитіла, і очищення антитіл з асцитних рідин Процес злиття і відбір клітин гібридоми проводили відповідно до протоколу Eshhar Z, 1985. Коротко, проводили злиття суміші клітин селезінки та лімфатичних вузлів від 2 реактивних мишей 110x106 з 32x106 мієломних клітин варіанту мієломи NSO/1 при короткочасній інкубації з PEG. Спочатку PEG повільно розбавляли DMEM, а потім повністю видаляли центрифугуванням. Клітини повторно суспендували у середовищі DMEM-H AT, розподіляли у 96-ямкові планшети при концентрації приблизно 2,5х104 клітин/ямку та інкубували у 8% СО2-термостаті при 37°С. Середовище у всі х ямках з гібридомою замінювали на DMEM, доповнене 10% конячою сироваткою (HS). Зразки супернатанту гібридомної культури через два тижні після злиття перевіряли відносно присутності специфічних Mab за допомогою ELISA (описано у прикладі 12, нижче). Клітини з ямок, в яких у культуральному супернатанті виявляли присутність специфічних антитіл, переносили у 24-ямкові планшети. Позитивні клітини двічі субклонували; виявлено, що на описаній стадії всі субклони були позитивними. Клони вирощували у 24 ямках, а потім у 25 см 2-Т-колбах. Зростаючі культури контролювали відносно секреції специфічних Mab. Ампули з клітинами з позитивних культур заморожували і зберігали у рідкому азоті. Приблизно з 700 клонів, підданих скринінгу на виявлення специфічних антитіл до пептиду 179, виявили тільки один позитивний клон (Mab 179), з 700 клонів, підданих скринінгу на виявлення специфічних антитіл до пептиду 182, виявили тільки 1 позитивний клон (Mab 182) із 1100 клонів, підданих скринінгу на виявлення специфічних антитіл до пептиду 183, виявили тільки 2 позитивних клони (Mabs 183.1 і 183.2). Позитивні клони субклонували при обмежувальному розведенні у 96-ямкових планшетах. С упернатанти від зростаючих клонів декілька разів тестували на специфічні антитіла за допомогою ELISA (описано у прикладі 12). Позитивні гібридомні клони вирощували у тканинних культуральних колбах у D MEM, що містить 15% конячу сироватку, а ампули з матеріалом від частини культур заморожували. Паралельно, клітини різних гібридомних клонів вводили кожній з 2-4 мишей, щоб одержати асцитні рідини. Антитіла очищали з асцитної рідини методом афінної хроматографії, використовуючи гранули афігелю (афігель 15 Biorad), зшиті з BSA (Pierce Cat 77116), зв'язані з синтетичним пептидом, що використовується для імунізації мишей (пептиди 179, 182 або 183). Для очищення антитіл, асцити, осаджені 50% сульфатом амонію, діалізували проти PBS протягом 16 годин при 0°С. Після діалізу, аліквоти інкубували з 1 мл гранул афігель-В8А-пептид протягом 16 годин при 0°С і заздалегідь інкубовані гранули використовували для упаковки колонки 1мл. Спочатку колонку промивали 10мл PBS, за яким йшло промивання 10мМ Трисом, рН 7,5, що містить 1 М NaCl, і промивання PBS. Антитіла елюювали з колонки розчином, що містить 100 мМ гліцин-НСІ, рН 2,7, і 0,5 М NaCl. Фракції по 1 мл збирали у пробірки, що містять 40мкл основи Трису, для нейтралізації елюату. З 25мл асциту одержували приблизно 513,6мг очищених антитіл. Приклад 4 Ізотип моноклональних антитіл Ізотип моноклональних антитіл визначали, використовуючи комерційний набір для ізотипування (Southern Biotechnology Associates, INC cat 5300-05), відповідно до процедури аналізу виробника. Mabs 183 і 179 ідентифікували як IgGl, в той час як встановили, що Mab 182 належить до класу Ig M. Приклад 5 Імунопреципітація каспази-8 з Mab 179. 182 і 183 Різні моноклональні анти-каспаза-8 антитіла, описані вище у прикладі 3, тестували щодо їх здатності імунопреципітувати каспазу-8 (дивись приклад 12, нижче) з лізатів активованих і таких, що знаходяться у стані спокою, клітин BJAB. Лінія BJAB являє собою стабільну лінію клітин лімфоми, що походить від африканського різновиду лімфоми Беркіта [Clements G.B. et al., 1975]. Клітини BJAB стимулювали Fas-лігандом протягом однієї години. Лізати клітин одержували з клітин BJAB до і після стимуляції. Після імунопреципітації з Mab 179, 182 і 183 (як описано у прикладі 12) «виснажений лізат» і каспазу-8, елюйовані відповідними пептидами, аналізували за допомогою SDS-PAGE і забарвлювання сріблом або за допомогою вестерн-блотинг-аналізу, використовуючи анти-Sub-1 антитіло як перше антитіло [Cell Signaling Technology Caspase-8 ICI2 Cat 9746]. На Фіг.2 показаний вестерн-блотинг-аналіз (проведений, як описано у прикладі 10, нижче) цілих клітинних екстрактів і "виснажених лізатів", одержаних після імунопреципітаціїз Mab 179, 183.1 і 183.2 і 182. У нестимульованих клітинах (доріжки 2, 4, 6, 8 і 10), подвоєння смуг, що відповідають ізоформам аі і а2 про-каспази-8 (про-каспаза-8 53/55кДа), спостерігали у цілих клітинних екстрактах (доріжка 2) та у виснажених лізатах, одержаних з анти-183 і анти-182 антитілами (доріжки 6, 8 і 10), на противагу цьому про-каспази-8 не виявляли у виснажених лізатах, одержаних з Mab 179 (доріжка 4). У стимульованих клітинах рівні про-каспази-8 в цілому клітинному екстракті були нижчі (доріжка 1). Додаткові дрібніші смуги, що відповідають фрагментам активованої каспази-8, з'являлися після активації, тобто подвоєння частково процесованої каспази-8, що відповідає ізоформам аі і а2 (частково процесована каспаза-8 р 41/43, відсутність Sub-2), і невелика смуга, що відповідає Sub-1 (p 20). Виснаження невеликих кількостей про-каспази-8 і фрагментів активованої каспази-8 за допомогою Mab досліджували на лізатах клітин, стимульованих Fas-лігандом (Фіг.2, доріжки 3, 5, 7, 9 і 11). Потрібно зазначити, що також досліджували виснаження Sub-1 за допомогою Mab 182, специфічного до Sub-2, оскільки активована каспаза-8 містить Sub-1, зв'язаний з Sub-2, і, тому, видалення Sub-2 в результаті імунопреципітації з Mab 182 повинно, отже, приводити до виснаження Sub-1. Імунопреципітація каспази-8 зі стимульованих клітинних лізатів показала, що Mab 182, 183.1 і 183.2 подібно до контролю нормальної мишачої сироватки (Фіг.2, доріжка 11), не видаляли невеликі кількості прокаспази-8, що залишилася, або активних фрагментів каспази-8 (доріжки 9, 7, 5 і 11, відповідно). На противагу цим результатам, обробка клітинних лізатів Mab 179 (доріжка 3) ефективно приводила до видалення всієї прокаспази-8, а також активних фрагментів каспази-8. На Фіг.3а (вестерн-блотинг-аналіз) і 3b (визначення білка забарвлюванням сріблом) показано, що прокаспаза-8 і активні фрагменти каспази-8, імунопреципітовані Mab 179, 182 і 183.1 і антитілами 183.2, можуть ефективно відновлюватися у супернатанті внаслідок конкуренції з відповідними пептидами, проти яких були одержані різні антитіла (приклад 12). У нестимульованих клітинах (Фіг.3а, доріжки 2,4, 6, 8 і 10 і Фіг.3b, доріжки 2, 3,6, 8 і 10) про-каспазу-8 ефективно відновлювали імунопреципітацією з Mab 179 і конкуренцією з пептидом 179 (Фіг.3а і 3b, доріжка 8). У стимульованих клітинах, незважаючи на невелику кількість про-каспази-8, що залишилася після активації, імунопреципітація з Mab 179 приводила до ефективного відновлення білка (Фіг.3а і 3b, доріжка 9). Деяке відновлення про-каспази-8 за допомогою Mab 183.2 можна було спостерігати у неактивованих клітинах (Фіг.3а, доріжка 6) і активованих клітинах за допомогою Mab 183.1 (Фіг.3а, доріжка 5), де активні фрагменти каспази-8 можна було відновлювати у лізатах активованих клітин за допомогою Mab 182 (Фіг.3а, доріжка 3), 183.1 (Фіг.3а, доріжка 5) і 183.2 (Фіг.3а, доріжка 7, тільки р20). Одержані результати показали, що Mab 179, одержане проти пептиду, що відповідає С-кінцю Sub-1 (епітоп 179), є дуже ефективним для імунопреципітації та очищення про-каспази-8, присутньої навіть у слідових кількостях, а також активованої каспази-8. Поліклональне антитіло, специфічне до того ж епітопу 179 (одержаний, як описано у прикладі 1, вище), одержували, щоб дослідити, чи володіє епітоп 179 унікальною здатністю індукувати вироблення антитіл, які звичайно можна використовувати для е фективної імунопреципітації і очищення про-каспази-8 і активної каспази-8. Порівнювали «виснажені лізати», одержані імунопреципітацією з поліклональними антитілами, специфічними до епітопу 179 (доріжки 5 і 6 для активованих і неактивованих клітин, відповідно), або моноклональними антитілами, специфічними до епітопу 182 (доріжки 7 і 8 для активованих і неактивованих клітин, відповідно). Результати на Фіг.4 чітко показали, що про-каспаза-8 і фрагменти каспази-8 з лізатів стимульованих клітин дійсно більш ефективно видаляли з клітинних лізатів поліклональними анти-179 антитілами, ніж моноклональними анти-182 антитілами. Імунопреципітацію і відновлення про-каспази-8 з лізатів клітин, що знаходяться у стані спокою, проведені з Mab 183 і поліклональним антитілом, специфічним до епітопу 183 (описано у прикладі 1), порівнювали з імунопреципітацією і відновленням, проведеними з Mab 179. На Фіг.5 показано, що імунопреципІтація прокаспази-8 за допомогою Mab 183 і полі-183 виявилася неефективною, тоді як імунопреципІтація про-каспази-8 за допомогою 179 була просто чудовою. Додатковий фрагмент з каспази-8 близько 5,6кДа спостерігали тільки в імунопреципітатах, одержаних з Mab 179 (доріжка 3). Антитіла, одержані проти ділянки каспази-8, яка відповідає С-кінцю великої Sub-1 каспази, володіють унікальною здатністю піддавати каспазу новому режиму процесингу. Описані вище результати, вказують, що епітоп 179 каспази-8 на відміну від інших епітопів, характеризується особливою здатністю розпізнавати специфічні антитіла, які дуже ефективні для імунопреципітації про-каспази-8 і активованої каспази-8, та здатні індукувати а утопроцесинг каспази-8. Приклад 6: Виділення та ідентифікація білка, що зв'язує каспазу-8, (р72) Використовували Mab 179 внаслідок його здатності ефективно імунопреципітувати каспазу-8, щоб імунопреципітувати каспазу-8 і білки, асоційовані з каспазою-8. Клітини BJAB [Steinitz M, Klein G. 1975] стимулювали Fas-лігандом протягом однієї години, а клітинні лізати одержували з клітин до і після стимуляції. Після імунопреципітації та елюції, які описані у прикладі 12, білки, що дістали, розділяли за допомогою SDS-PAGE і визначали забарвлюванням сріблом. ІмунопреципІтація з мишачим IgGl служила як негативний контроль. Результати, представлені на Фіг.6, показали, що білок з припустимою молекулярною масою близько 72,5 кДа (який називається в описі р72) сшвпреципітували з про-каспазою-8 (р53/55) у лізатах клітин, що знаходяться у стані спокою, (доріжка 3), а не з активною каспазою-8 у лізатах стимульованих клітин (доріжка 4). Крім того, виявлено, що білок р72 також спів-імунопреципітував з про-каспазою-8 у лізатах, одержаних з нестимульованих клітин HeLa, Raji, H9, К562, HL-60, СЕМ і Hut78 (ATCC). Приведені результати дозволяють припустити, що звичайно білок р72 зв'язаний з про-каспазою-8, а не з активною каспазою-8. Смугу в SDS-PAGE, яка відповідає р72, вирізали, розщеплювали трипсином і піддавали обмеженому секвенуванню і мас-спектроскопічному аналізу. 7 пептидів, одержаних при трипсиновому розщепленні, використовували, щоб дослідити базу даних за структурою білків, виведених з нуклеотидних послідовностей (або EST). Білкова послідовність, що відповідає частині передбаченої послідовності білка клону EST людини (SEQ ID:1), виявлена у банку генів (номер доступу gi/2988397/gbAAC08052.1/(AC004475), функція якого невідома. Приклад 8 Одержання повнорозмірної кДНК, шо кодує р72 Повнорозмірну кДНК, що кодує р72, одержували наступним чином: EST з (прикладу 7) використовували, щоб скринувати генний показник TIGR людини і дані ТНС (ТНС510568 SEQ ID N0:1), що містять консенсусні послідовності всіх EST, щоб встановити відповідність цих послідовностей. Клон ДНК, що кодує частин у передбаченого білка, придбавали у фірми Incyte Genomics (IMAGE # 2964545). Клон не містив нуклеотидних послідовностей, що кодують перший метіонін і 6 наступних амінокислот (тобто 21 нуклеотид). Встановлено, що послідовності миші і людини згаданих білків характеризуються високою подібністю (близько 90% ідентичності), таким чином, нуклеотид ні послідовності, що кодують перший метіонін і 6 наступних амінокислот мишачого білка, які були відсутні в EST миші, порівнювали з робочою передбачуваною послідовністю геному людини для того, щоб заповнити відсутню послідовність людини. Одержали попадання, що відповідає послідовності хромосоми 19 Homo sapiens, клон LLNLR-232E12. Зазначений клон підтвердив нуклеотидну послідовність, яка кодує відсутні 7 амінокислот р72. Повнорозмірну кДНК р72 одержували внаслідок двох циклів ПЛР (використовували Takara ExTag, Takara, cat # R001A), які схематично представлені на Фіг.8. У першій ПЛР, клон, одержаний від фірми Incyte Genomics, використовували як матрицю з прямим праймером: синтезований CTCAAGATGGAC AACCGGGATGTTGC AGGAAAGG, який містить 15 (підкреслені) з 21 відсутнього нуклеотиду разом з існуючою послідовністю р72 (Фіг.8, праймер 2), і зворотним праймером: CCACTCGAGTC AGTAGTAAGGCCGTCTGGGATT, що містить У ділянку, яка кодує зі стоп кодоном (Фіг.8, праймер 3). У другій ПЛР як матрицю використовували продукт ПЛР з першого циклу ПЛР і прямий праймер: AATGGATCC ATGAGTCTC AAGATGGAC AACCGGGA, що містить всі 21 відсутніх нуклеотиди і 5 існуючих нуклеотидів (Фіг.7, праймер 1) і той же зворотний праймер (Фіг.7, праймер 3). Цілу кДНК, що кодує р72, виділяли і секвенували (SEQ ID N0:2), а амінокислотну послідовність передбачали з нуклеотидної послідовності (SEQ ID N0:3). Встановлено, що білок р72 містить три консервативних мотиви (Фіг.7): мотив С, спірально згорнутий мотив, два розташованих один за одним "SURP" (так звані мотиви "SWAP", позначені як S на Фіг.7) (Denhez F and Lafyatis R, 1994) близько до N-кінця білка, і одну G-ділянку, локалізовану на С-кінці (Фіг.8, позначена як G) (Ara vind L and Koonin E.V., 1999). Вважається, що мотиви як SURP, так і G-ділянки беруть участь у зв'язуванні РНК, дозволяючи припустити, що мішенню р72 може бути молекула РНК. Приклад 9 Розщеплення р72 каспазою-8 Як показано у прикладі 8, після однієї години стимуляції р72 зв'язаний тільки з про-каспазою-8, а не з активною каспазою-8. Деяку кількість про-каспази-8 ще можна було виявляти після 20 хвилин стимуляції. Щоб визначити, чи може р72 спів-преципітувати з каспазою-8 при більш коротких періодах стимуляції, клітини BJAB, активовані тільки протягом 20 хвилин, лізували та імунопреципітували з Mab 179. Після імунопреципітації та елюції, каспазу-8 і зв'язані білки розділяли за допомогою SDS-PAGE, а білки визначали забарвлюванням сріблом. Одна смуга 72,5 кДа (Фіг.9, доріжка 3), що відповідає р72, імунопреципітувала у лізатах клітин до стимуляції, тоді як після 20 хвилинної стимуляції визначали білок з більш низькою припустимою молекулярною масою близько 68 кДа (Фіг.9, доріжка 4). Обидва білки, 72,5 і 68 кДа, імунопреципітованІ з клітин BJAB, піддавали мас-спектроскопічному аналізу. Після трипсинізації, обидва білки виявляли однаковий пептидний профіль за винятком однієї чіткої відмінності: додатковий пептид з послідовністю FRPNPLNNPR (залишки 632-641) був присутнім у білці 72,5 кДа на С-кінці, але був відсутнім у білці 68 кДа. Результати дозволяють припустити, що при стимуляції клітини, фрагмент, близько 4,5 кДа, видалявся з Скінця р72, можливо при активації каспази-8, приводячи в результаті до утворення білка меншого розміру з припустимою молекулярною масою 68 кДа, який ще зв'язаний з про-каспазою-8, що залишилася. Зрозуміло, що залишок D600, локалізований на С-кінці р72 (Фіг.8), може бути кандидатом на залишок для розщеплення, оскільки передбачувані фрагменти, одержані після такого розщеплення, мають таку ж молекулярну масу, що і фрагменти р72, виявлені in vivo після 20 хвилин стимуляції. Щоб з'ясувати, чи є, як припускали, р72 субстратом каспази-8 і чи є D600 залишком-мішенню для розщеплення, транскрибований-трансльований і мічений радіоактивним ізотопом (S35)p72 (TnT-система) піддавали in vitro дії рекомбінантної активної каспази-8. Білок, що кодується кДНК р72, експресували in vitro у ретикулоцитних лізатах у присутності 358-метіоніну, використовуючи зв'язану систему ретикулоцитних лізатів TnT T7, і піддавали розщепленню рекомбінантною активною каспазою-8 (кожну субодиницю І і 2 одержували окремо в Е.соіі, змішували і повторно складали разом in vitro). Коротко, р72, in vitro синтезовані 35S-мічені білки, інкубували протягом 30 хвилин у протеазному буфері (25мМ Hepes, pH 7,5, 0,1% CHAPS, 5мМ EDTA і 2 мМ DTT) при 37°С у присутності продукованої бактеріями каспази-8. Білки та їх фрагменти розділяли при SDSPAGE, а результати оцінювали фосфо візуалізацією. Результати (Фіг. 10) показали, що за відсутності каспази-8 визначали тільки зону 72,5, що відповідає р72 (доріжка 1). Зазначена зона зникала після додавання активованої каспази-8 протягом 1 години і з'являвся новий менший за розміром фрагмент, що відповідає 68 кДа (доріжка 4). Одержані результати показали, що білок, який кодується кДНК р72, використаний як субстрат, ефективно розщеплювався каспазою-8. Крім того, також використовували систему транскрипції-трансляції ТпТ, щоб продукува ти in vitro 2 різних мутанти р72: р72, в якому залишок D600, як припускали за даними експериментів in vivo, є залишком-мішенню каспази-8, мутували в Е (D600E), і р72 з делецією, відсутність залишків нижче D600 (тобто експресований білок буде мати залишки 1-600). Досліджували розщеплення описаних вище двох мутантів р72 у присутності (Фіг.10, доріжки 5 і 6, відповідно) або за відсутності (доріжки 2 і 3, відповідно) активованої рекомбінантної каспази-8. Як показано на Фіг.10 (доріжки 3 і 6, відповідно), однаковий білковий профіль мутанта D600E р72 спостерігали у присутності або за відсутності каспази-8, що свідчить про те, що каспаза-8 не розщеплює мутант D600E р72. Мутант 1-600 р72 мігрував разом з фрагментом 68 кДа, утвореним після розщеплення дикого типу р72, і далі не розщеплювався при додаванні каспази-8 (доріжки 2 і 5). Одержані результати показали, що, після активації, каспаза-8 розщеплювала р72 по залишку D600. Проведені in vivo дослідження дозволили припустити, що розщеплення р72 відбувається у клітинах швидко протягом 5-20 хвилин після обробки Fas-лігандом (Фіг.11) і що розщеплений білок (або швидше - його більш великий фрагмент) може залишатися асоційованим з про-каспазою-8. Приклад 10 Вестерн-блотинг-аналіз для визначення імунореактивної сироватки каспази-8 Суміш рекомбінантних очищених Sub-1 і Sub-2 використовували для вестерн-блотинг-аналізу антитіл, одержаних до синтетичних пептидів. Коротко, на 12% SDS-поліакриламідний гель наносили 100 нг/доріжку суміші Sub-1 і Sub-2 при відновлювальних умовах (40мМ DTT). На одну доріжку наносили низькомолекулярні стандарти (LMW). Розділені на гелях білки переносили за допомогою електроелюції на PVDF-мембрани з високим вмістом Р (Amersham). Мембрани інкубували у PBS, що містить 5% молоко з низьким вмістом жиру, 0,05% Твін 20, протягом 16 годин. Мембрани розрізали на смужки і кожну смужку інкубували протягом 1 години при кімнатній температурі з мишачою антисироваткою (розведеною 1/2000). Смужки мембрани промивали PBS, що містить 0,05% Твін 20 (3 х 15 хвилин) та інкубували протягом однієї години з другим антитілом козячим антимишачим антитілом, кон'югованим з пероксидазою хрону (розведені 1:10000, Jakson) протягом 1 години при кімнатній температурі. Смужки промивали PBS, що містить 0,1% Твін 20 (3 х 15 хвилин). Позитивні смуги визначали за підвищенням хемілюмінесценції (ECL, Amersham). Для вестерн-блотингів, проведених у прикладі 55 використовували антитіла, специфічні до Sub-1 (Cell Signaling Technology Caspase-8 IC12 9746). Приклад 11 ELISA для скринінгу гібридомних клонів Прямий ELISA для скринінгу гібридоми, що продукує специфічні антитіла, проводили наступним чином: 96ямкові планшети покривали 50мкл/ямку BSA-пептидом (або тільки BSA для контрольних планшетів) у концентрації 2,5 мкг/мл у зв'язувальному розчині (0,1 М Na 2HPO4, pH 9) протягом 1 години при 37°С або 16 годин при 4°С. Згодом планшети промивали 3 рази PBS-T (PBS з 0,05% Твіном-20) і вносили по 200 мкл/ямку блокувального розчину (1% гемоглобін у PBS) протягом 1 години при 37°С і промивали 3 рази PBS. 50мкл супернатанту гібридомних культур або розбавлених стандартів (з PBS-T) вносили на ямку та інкубували протягом 1 години при 37°С або 4 годин при 22°С. Після вказаного періоду інкубації ямки промивали 6 разів PBS-T. Др уге антитіло, анти-мишаче антитіло, кон'юговане з HRP (Jackson 115-025-100), розбавляли 1:5000 у PBS-T, інкубували протягом 1 години при 37°С і вимивали шляхом шестиразового промивання PBS-Т. Субстрат для HRP готували свіжий (2,2мл 0,2М Na2HPO4, pH 9,2, 1,4мл 0,2М лимонної кислоти, рН 4,35, 6,4мл Н2О, 10 мг ABTS і 1мкл Н2О2) і 50мкл/ямку вносили та інкубували при 22°С доти, доки не з'являлося забарвлення (близько 5-80 хвилин). Кольорову реакцію зупиняли додаванням 50мкл/ямку 0,2М лимонної кислоти. Планшети зчитували при 405нм. Як позитивні контрольні антитіла використовували позитивні мишачі антисироватки, розведені 1:1000, а також як негативні контрольні середовища. Приклад 12 Імунопреципіташя каспази-8 Для кожної імунопреципітації використовували 108 клітин. Клітини збирали і лізували інкубацією в 1% лізуючому буфері NP-40 і з повним протеазним інгібітором (таблетки повного протеазного інгібіторного коктейлю від фірми Roche Molecular Biochemicals) при 0°С протягом 40 хвилин. Клітинні лізати переносили у вигляді аліквот у пробірки Епендорфа, центрифугували при 14000 обертів за хвилину протягом 10 хвилин при 4°С і відбирали супернатант у нові пробірки. Клітинні лізати піддавали стадії попереднього освітлення, призначеній для видалення білків, які неспецифічно зв'язуються з протеїн-С-сефарозою. Для попереднього освітлення, клітинний лізат пре-інкубували із заздалегідь промитою PBS протеїн-С-сефарозою (Pharmacia) і мишачим IgG протягом 2-3 годин при 4°С. Після описаної інкубації лізати центрифугували у пробірках Епендорфа при 14000 обертів за хвилину протягом 30 секунд, протеїн-С-сефарозу відкидали, а передосвітлений супернатант збирали. Очищені моноклональні антитіла (або мишачий IgG, 1 кап для негативних контролів) і протеїн-С-сефарозу, заздалегідь промиту PBS, змішували та інкубували з перед-освітленим супернатантом протягом 4-16 годин при 4°С. Після вказаного періоду інкубації незв'язаний матеріал, позначений «виснажений лізат», збирали центрифугуванням (30 секунд при 14000 обертів за хвилину), зв'язаний матеріал елюювали промиванням гранул сефарози 6 разів лізуючим буфером та інкубацією з «розчином, що елюює», який містить 0,2% лізуючого буфера NP-40, протеазні інгібітори і 400мкг/мл пептиду, що використовується для імунізації, (300 мкл буфера, що елюює/100мкл сефарози) протягом 2 годин при 22°С. Пробірки центрифугували протягом 5 хвилин при 5000 обертів за хвилину, а супернатант, позначений «елюат каспази-8» переносили у нові пробірки. Посилання Adelman Jp et al. 1983 DNA 2:183. Ahmad Metal.Cancer Res 1997; 57(4):615-9. Akagi Yetal.1997 Kidney Int. 51, p. 1265-9. Ara vind L and Koonin EV 1999 TIBS 24: 342-344. Artelt Pet al. 1988 Gene 68, 213-9. Barnikol-Watanabe S et al. Biol Chom Hoppe Seyler 1994; 375(8):497-512. BeidlerDretal. 1995. J Biol Chem 1995 Jul 14; 270(28):16526-8. Beutler and Cerami 1987 N Engl J Med 1987 Feb 12; 316(7):379-85. Bigda J et al. 1994 J Exp Med Aug 1; 180(2):445-60. Boldin MP et al. 1995 J Biol Chem Apr 7; 270(14):7795-8. Boldin MP et al. 1995a Biol Chem 1995 Jan 6; 270(l):387-91. Boldin MP et al. 1995b FEBS Lett 1995 Jun 19; 367(l):39-44. Boldin MP et al. 1996 Cell 1996 Jun 14; 85(6):803-15. Boone, E et al. J. Biol Chem. 275,37596-603, Boulianne GL et al. 1984 Nature 1984 Dec 13-19; 312(5995):643-6. Brakebusch C et al. 1992. EMBO J 1992 Mar; 11(3):943-50. Brockhaus M et al. 1990 Proc Natl Acad Sci USA 1990 Apr; 87(8):3127-31. Cabilly S et al. 1984 PNAS 81, 3273. Cantor etal. 1993 PNAS 90 109-32. Cao X et al. 1998 J Immunol 161,6238-44. Chen CJ et al. 1992 Ann. NY Acad. Sci. 660, 271-3. Chinnaiyan AM et al. 1995 Cell May 19; 81(4):505-12. Chinnaiyan AM et al. 1996 J Biol Chem Mar 1; 271(9):4961-5. Clements GB et al. 1975 Int J Cancer 16:125-33. Cohen OM 1997 Biochem J; 326 (Pt 1). 1-16. Daniel R et al. 1998 J Biomed Sci. 5, 383-94. Denhez Fand Lafyatis R 1994 J Biol Chem 269:16170-16179. Dirks, Wirth and Hauser 1983 Gene 128, 247-249. Duan H and Dixit VM. Nature 1997; 385(6611):86-9. Durfee T et al. Genes Dev 1993; 7(4).SSS-69. Edamatsu H, Kaziro Y, Itoh H. 1997, Gene 187,289-94. Edinger AL et al. 1998 Virology. 249, p.367-78. Enari M et al. 1995. Nature May 4; 375(6526):78-81. Enari M et al. 1998 Nature (London) 391,43-50. Engelmann H et al. 1990. J. Biol Chem Jan 25; 265(3):1531-6. Engelmann H et al. 1990 J. Biol. Chem. 265, p.14497-504. Eshhar Z, 1985 in "Hybridoma technology in the bioscience and medicine", Edited by Timothy A. Springer (Plenum Publishing Corporation, 1985; Chapter 1). Everett RD et al. 1983 Nucleic Acids Res. 11 2447-64. Fernandes-Alnemri T et al. 1996 Proc Natl Acad Sci USA; 93(15):7464-9. Fields S et al. 1989; Nature 340(6230):245-6. Flanagan, 1998 Cancer Metastasis Rev 17, 169-76. Furth PA et al. 1994 Proc Natl Acad Sci USA 91, 9302-6. Gerster M et al. 1998 Anal Biochem. 262,177-84. Graham A et al. 1991, Biochem Biophys Res Commun 177, 8-16. GrauGE 1989 Schweiz Med Wochenschr Dec 9; 119(49):1756-61. Griscelli F et al. 1998, Hum Gene Ther. 9, 1919-28. Guang-Lin M et al. 1998 Transplant Proc 30, 2923-4. Guinot and Temsamani, 1998 Pathol Biol (Paris) 46, p.347-54. Haendler В et al. E. EMBO J 1987; 6(4):947-50. Hemmi S et al. 1998 Hum Gene Ther 9, p.2363-73. Henkart, PA 1996. Immunity Mar; 4(3):195-201. Hohmann HP et al. 1989. J Biol Chem Sep 5; 264(25): 14927-34. Hsu H et al. 1996. Cell Jan 26; 84(2):299-308. Hming MT and Gorman CM. 1990 Nucleic Acids Res. 18, 937-47. Ihle JNCell 1996; 84(3). 331-4. Iloh N el al. 1991. Cell Jul 26; 66(2):233-43. Itoh andNagata 1993 J. Biol Chem May 25; 268(15):10932-7. Janmey, P.A., and Stossel, T.P. 1987 Nature (London) 352, 362-364. Joseph and Burke, 1993 J. Biol. Chem. 268, 24515. Kamine J et al. Feb 15; 216(2):357-66. King P and Goodbourn S. J Biol Chem 1998; 273(15) 8699-704. Kischkel FC et al. EMBO J1995; 1 4(22); 5579-88. Kohler and Milstein, 1975 Nature 256, 495-497. Kondo S et al. 1998 Oncogene 17, 2585-91. Kothakota, S et al. 1997 Science 278, 294-298. Kozak, M, 1984 Nucleic Acids Res. 12 p. 857-72. Kumar, 1995 Trends Biochem Sci Ma y; 20(5): 198-202. Kumar, 1997 Science 278(5343):1630-2. Kunstle, G et al. 1997 Immunol Lett. 55, 5-10, Kurth, M., and Bryan, J. 1984 J. Biol. Chem. 259, 10895-10903. LoetscherHetal. 1990 J Biol Chem 1990Nov25; 265(33):20131-8. MacFarlane M et al. J Biol Chem 1997; 272(41):25417-20. Meinkothetal.(1984). Meiri N et al. 1998 Proc Natl Acad Sci USA 95 15037-15042. Mittl PR et al J Biol Chem 1997; 272(10):6539-47. Miura K et al. Biochem Blophys Res Commun 1992; 1 87(1), 3 75 -80. Morrison et al., 1984 PNAS 81, 6851. Muranishi et al., 1991 Pharm. Research 8, 649. Mu zio et al. 1996. Cell Jun 14; 85(6):817-27. Mu zio M et al J Biol Chem 1998. 273(5):2926-30. Nagala and Goldstein 1995. Nagata S el al. Cell 1997; 88(3):355-65. Nakashima A et al. J Biol Chem 1997; 272(14):9567-72. Narumi et al., 199S Am J Respir Cell Мої Biol 19, 936-941. Nicholson D.W. and Thornberry, N.A. 1997 Trends Biochem. Sci. 22, 299-306. Nishida et al., 1998 Spine 23,2437-42. Nopharetal. 1990. Ohtsu, M et al, 1997 EMBO J. 16, 4650-4656. Pederson et al, 1998 J Gastrointest Surg 2, 283-91. Quelle FW et al. J Biol Chem 1995; 270(35):20775-80. Rotonda J et al Nat Struct Siol 1996; 3(7):619-25. Ruzicka et al. 1993 Science 260:487. Sakahira, H., et al. (1998) Nature (London) 391, 96-99. Salvesen, G.S., and Dixit, V.M. (1997) Cell 91, 443-446. Sambrook et al., 1989. Sano et al., (1991) Biotechniques 9:1378. Sano et al., (1992) Science 258:120. Schalletal.1990. Schek et al., Мої Cell Biol., p. 5386-93,1992. Schwarzenberger et al., 1998 J Immunol 161, 6383-9. Shevchenko A, et al. 1997 Rapid Commun Mass Spectrom. 11, p.1015-24. Shimayama et al., 1993 Nucleic Acids Symp Ser 29,177. Shoji et al., 1998 J Drug Target 5 261-73. Shore el al., 1993 Oncogene 8, 3183. Smith et al. 1990 J Infect Dis Dec; 162(6):1349-53. Soukchareun et al., 1998 Bioconjug Chem 9 466-75. Srinivasula SM et al. 1996 Proc Natl Acad Sci USA; 93(25):14486-91. Srinivasula SM et al. J Biot Chem 1998; 273(17) 10107-11. Stangeretal. 1995 Cell May 19; 81(4):513-23. Steinitz M and Klein G.Proc Natl Acad Sci USA 1975 Sep; 72(9):3518-20. Stix 1998 Sci Am. 279 46-50. Surinya et al.J Biol Chem. 273, p. 16798-809, 1998. Tartaglia et al. 1993 Cell Sep 10; 74(5):845-53. Teoh et al, 1998 Blood 92,4591-4601. Tewari et al. 1995 Cell Jun 2; 81(5):801-9. Thomsen, et al. 1984 PNAS 81 659-63. Thornberry NA et al. J Biol Chem 1997; 272(29): 17907-11. Tirode F et al. J Biol Chem 1997; 272(37):22995-9. Tokushige, et al., 1997 J Virol Me thods. 64 p. 73-80. Tracey et al. 1986 Annu Rev Med 45:491-503. Vandenabeele et al. 1995 Immunol Mar 15; 154(6):2904-13. Vercammen, D., et al. 1998 J Exp Med. 4, 1477-85. Vielkind and Swierenga 1989 Histochemistry; 91(l):81-8. Villa, P et al. (1997) Trends Biochem. Sci. 22, 388-393. Vincenz C and Dixit VM 1997. J Biol Chem. Mar 7; 272(10):6578-83. Wahl et al., 1983 J. Nucl. Med. 24:316-325. Wallach, D et al. 1999 Amu Rev Immunol. 17331-67. Wang, J 1998 Controlled Release 53,39-48. Weaver et al. 2000 Hybridoma Apr; 19 (2): 167-9. Xue et al. 1995 Nature Sep 21; 377(6546):248-51. Yamamoto et al. 1980. Cell 22, 787-97. YamamotoT et al. J Biol Chem 1997; 272(49):30595-8. Yang X et al. Мої Cell 1998; 1(2)319-25. Yehelal. 1998 J Bone Miner Res. 13.p.l870-9. Yin, H.L. and Stossel, T.P. (1979) Nature (London) 281, 583-586. Yin, H.L. and Stossel, T.P. (1980) J. Biol. Chem. 255, 9490-9493. Zacharia et al., 1991 Eur. J. Pharmacol. 203, 353. Zhang et al. 1998 Clin Cancer Res 4,2669-76. Zhao and Pick, 1993 Nature 365, 448. Список послідовностей
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibody against caspase-8, a process for preparation and use of said antibody for development of elisa-analysis
Назва патенту російськоюАнтитело против каспазы-8, способ получения и применения указанного антитела для разработки elisa-анализа
МПК / Мітки
МПК: C07K 16/40, G01N 33/573, G01N 33/537, C07K 1/32
Мітки: вказаного, антитіло, антитіла, одержання, elisa-аналізу, застосування, розробки, каспази-8, спосіб
Код посилання
<a href="https://ua.patents.su/25-78526-antitilo-proti-kaspazi-8-sposib-oderzhannya-ta-zastosuvannya-vkazanogo-antitila-dlya-rozrobki-elisa-analizu.html" target="_blank" rel="follow" title="База патентів України">Антитіло проти каспази-8, спосіб одержання та застосування вказаного антитіла для розробки elisa-аналізу</a>
Попередній патент: Насосний агрегат з пасовою передачею від приводу
Наступний патент: Регулярна насадка для тепломасообмінних апаратів
Випадковий патент: Спосіб одержання плівки з ag наночастинками для поверхневого підсилення комбінаційного розсіяння світла