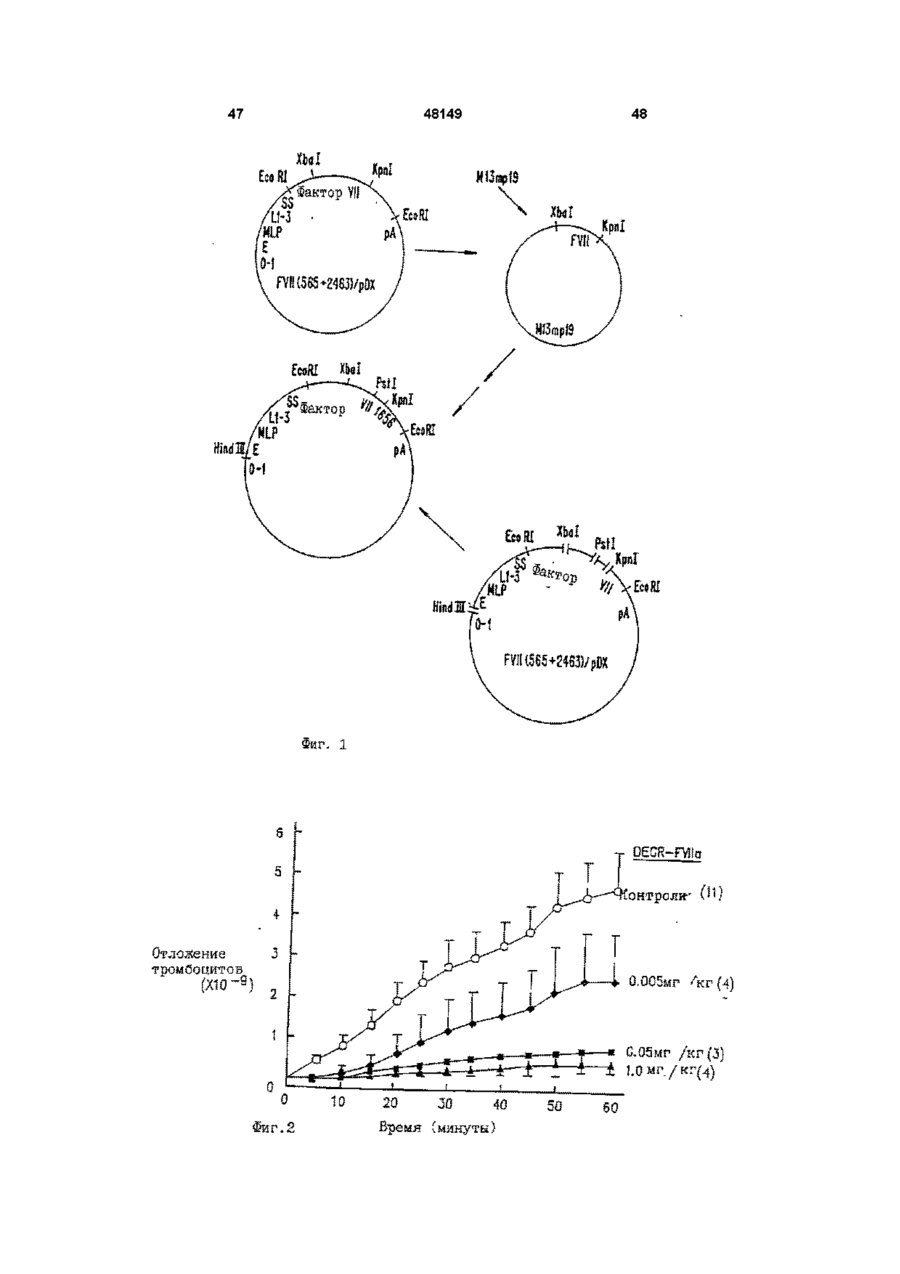
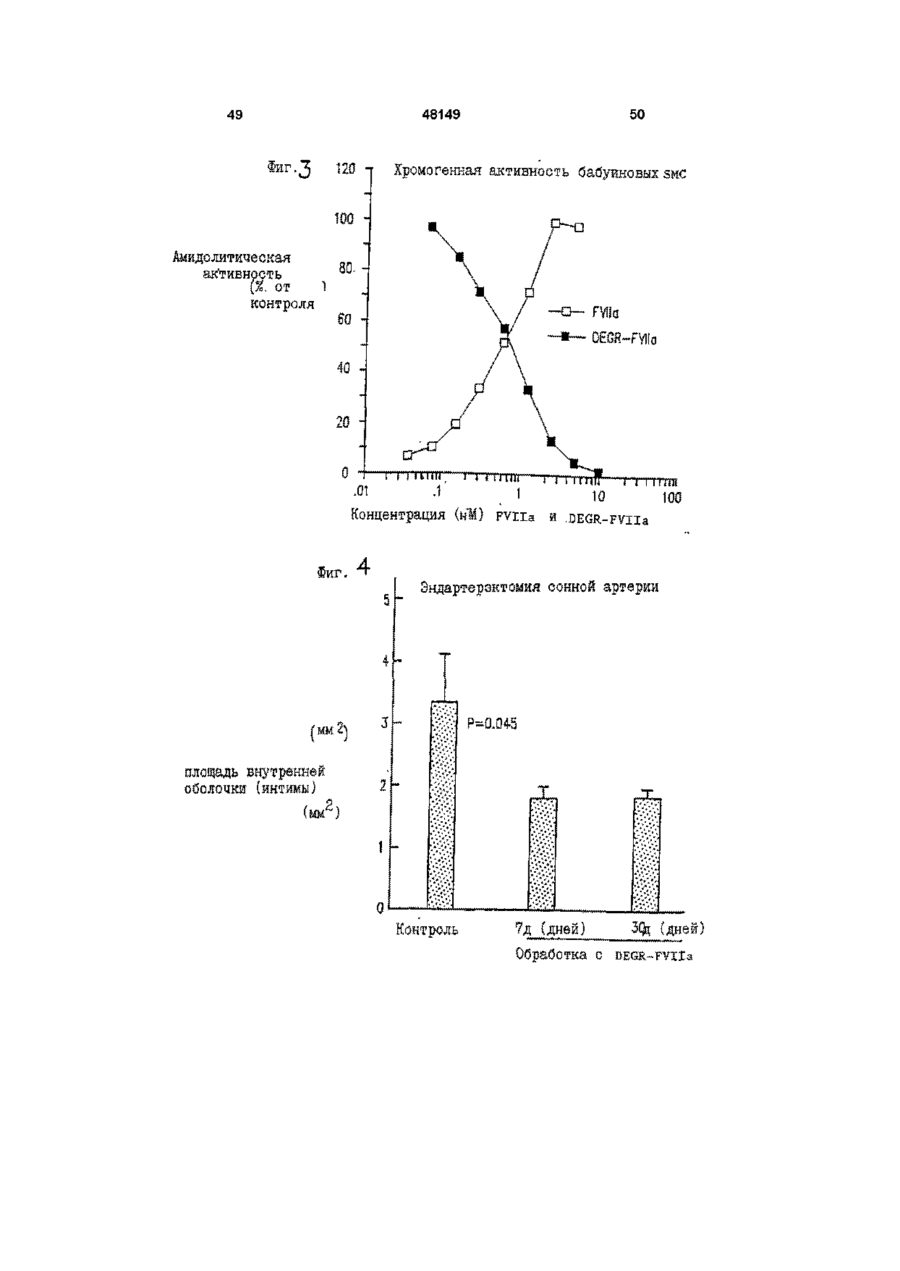
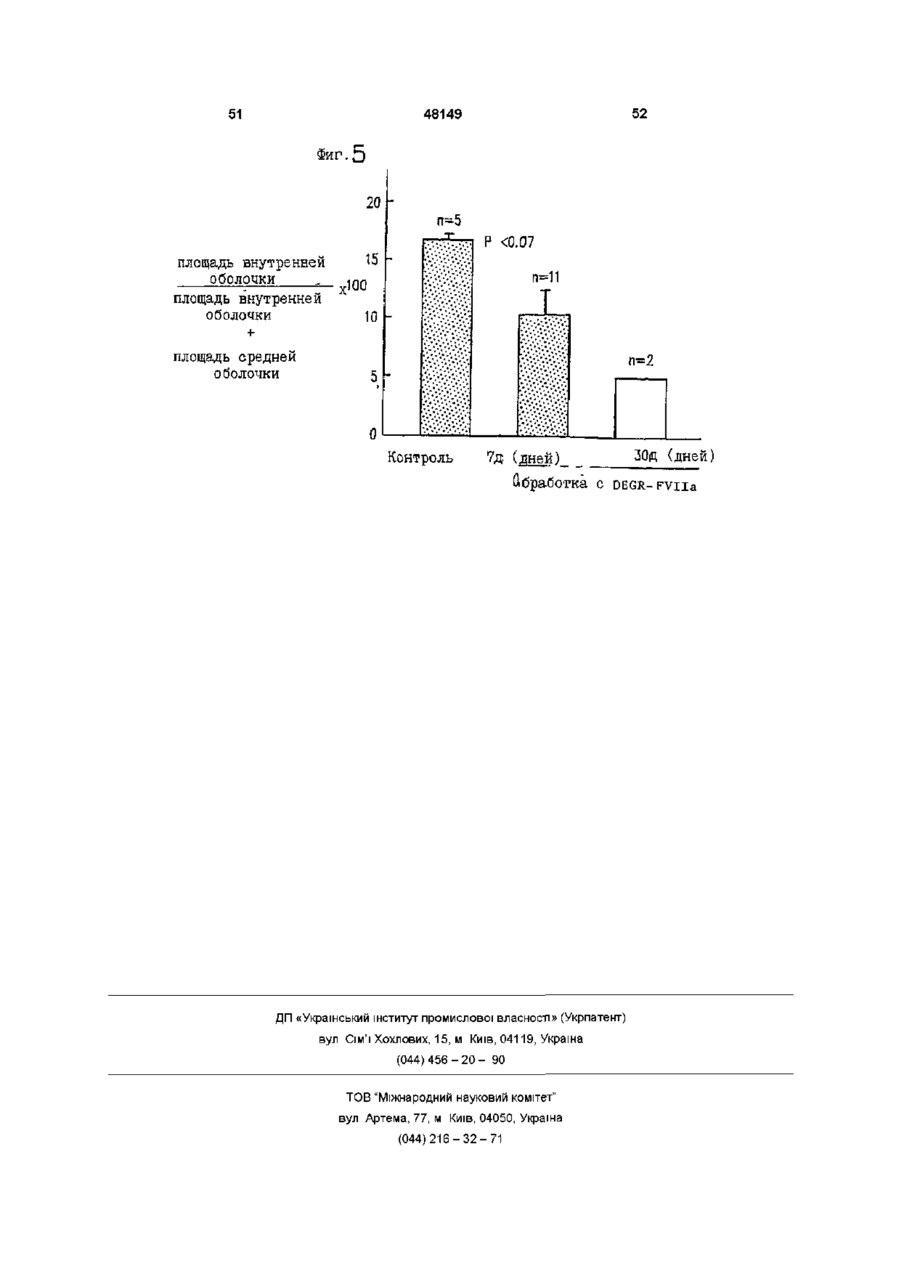
Спосіб інгібування активності фактора тканини, спосіб пригнічення відкладення тромбоцитів, спосіб пригнічення судинного рестенозу, спосіб лікування гострої закупорки коронарної артерії за допомогою модифіковано
Номер патенту: 48149
Опубліковано: 15.08.2002
Автори: Харт Чарльз Е., Петерсен Ларс Хрістіан, Брегенгор Клаус, Беркнер Кетлін Л., Хеднер Ула
Формула / Реферат
1. Способ ингибирования активности фактора ткани у пациента, заключающийся во введении пациенту терапевтически эффективной дозы состава, отличающийся тем, что упомянутый состав состоит из фактора VII, имеющего, по крайней мере, одну модификацию в своем активном центре, модификация которого существенно подавляет способность модифицированного фактора VII активировать плазматический фактор Х или IX.
2. Способ по п. 1, отличающийся тем, что модификация включает в себя реакцию фактора VII с ингибитором серинпротеазы.
3. Способ по п. 2, отличающийся тем, что ингибитор протеазы представляет собой фосфорорганическое соединение, сульфонилфторид, пептидсодержащий галометилкетон или азапептид.
4. Способ по п. 3, отличающийся тем, что ингибитор протеазы представляет собой пептидсодержащий галометилкетон, выбранный из Dansyl- Phe-Pro-Arg-хлорметилкетона, Dansyl-Glu-Gly-Arg-хлорметилкетона, Dansyl-Phe-Phe-Arg-хлорметилкетона и Phe-Phe-Arg-хлорметилкетона.
5. Способ подавления отложений тромбоцитов у пациента, заключающийся во введении пациенту терапевтически эффективной дозы состава, отличающийся тем, что упомянутый состав состоит из фактора VII, имеющего, по крайней мере, одну модификацию в своем активном центре, модификация которого существенно подавляет способность модифицированного фактора VII активировать плазматический фактор Х или IX.
6. Способ по п. 5, отличающийся тем, что модификация включает в себя реакцию фактора VII с ингибитором серинпротеазы.
7. Способ по п. 6, отличающийся тем, что ингибитор протеазы представляет собой фосфорорганическое соединение, сульфонилфторид, пептидсодержащий галометилкетон или азапептид.
8. Способ по п. 7, отличающийся тем, что ингибитор протеазы представляет собой пептидсодержащий галометилкетон, выбранный из DansyI- Phe-Pro-Arg-хлорметилкетона, Dansyl-Glu-Gly-Arg-хлорметилкетона, Dansyl-Phe-Phe-Arg-хлорметилкетона и Phe-Phe-Arg-хлорметилкетона.
9. Способ по п. 5, отличающийся тем, что модификация фактора VII включает в себя замену, включение или удаление, по крайней мере, одной аминокислоты в каталитической триаде Ser, Asp, His.
10. Способ подавления сосудистого рестеноза у больного, заключающийся во введении пациенту терапевтически эффективного количества состава, отличающийся тем, что упомянутый состав включает в себя фармакологически приемлемый фактор VII, имеющий, по крайней мере, одну модификацию в своем каталитическом центре, которая существенно подавляет способность модифицированного фактора VII активировать плазматический фактор Х или IX.
11. Способ по п. 10, отличающийся тем, что модификация фактора VII осуществляется реакцией фактора VII с ингибитором серинпротеазы.
12. Способ по п. 11, отличающийся тем, что ингибитор протеазы представляет собой фосфорорганическое соединение, сульфонилфторид, пептидсодержащий галометилкетон или азапептид.
13. Способ по п. 12, отличающийся тем, что ингибитор протеазы представляет собой пептидсодержащий галометилкетон, выбранный из Dansyl- Phe-Pro-Arg-хлорметилкетона, Dansyl-Glu-Gly-Arg-хлорметилкетона, Dansyl-Phe-Phe-Arg-хлорметилкетона и Phe-Phe-Arg-хлорметилкетона.
14. Способ по п. 10, отличающийся тем, что модификация фактора VII включает в себя замену, включение или удаление, по крайней мере, одной аминокислоты в каталитической триаде Ser, Asp, His.
15. Способ по п. 10, отличающийся тем, что он используется для рестеноза, являющимся вторичным по отношению к механическому повреждению артерии.
16. Способ по п. 15, отличающийся тем, что упомянутое механическое повреждение вызывается баллонной ангиопластикой, эндартерэктомией, редукционной атерэктомией, установкой стента, лазерной терапией или иссечением распадающейся ткани.
17. Способ по п. 15, отличающийся тем, что состав вводят пациенту в течение 24 часов до механического повреждения упомянутой артерии.
18. Способ по п. 15, отличающийся тем, что состав вводят пациенту после механического повреждения упомянутой артерии.
19. Способ по п. 10, отличающийся тем, что он используется для рестеноза, наблюдаемого в сосудистом имплантате, стенте, шунте или органном трансплантате.
20. Способ по п. 19, отличающийся тем, что состав вводят пациенту в течение 24 часов до установки упомянутого имплантата, стента, шунта и органного трансплантата.
21. Способ по п. 19, отличающийся тем, что состав вводят пациенту после установки упомянутого имплантата, стента, шунта и органного трансплантата.
22. Способ по п. 10, отличающийся тем, что он включает в себя дальнейшее введение упомянутого активатора тканевого плазминогена или стрептокиназы.
23. Способ лечения острой закупорки коронарной артерии у пациента, заключающийся во введении пациенту состава, отличающийся тем, что упомянутый состав включает в себя фармакологически приемлемый фактор VII, имеющий, по крайней мере, одну модификацию в своем каталитическом центре, которая существенно подавляет способность модифицированного фактора VII активировать плазматический фактор Х или IX в сочетании с активатором тканевого плазминогена или стрептокиназой.
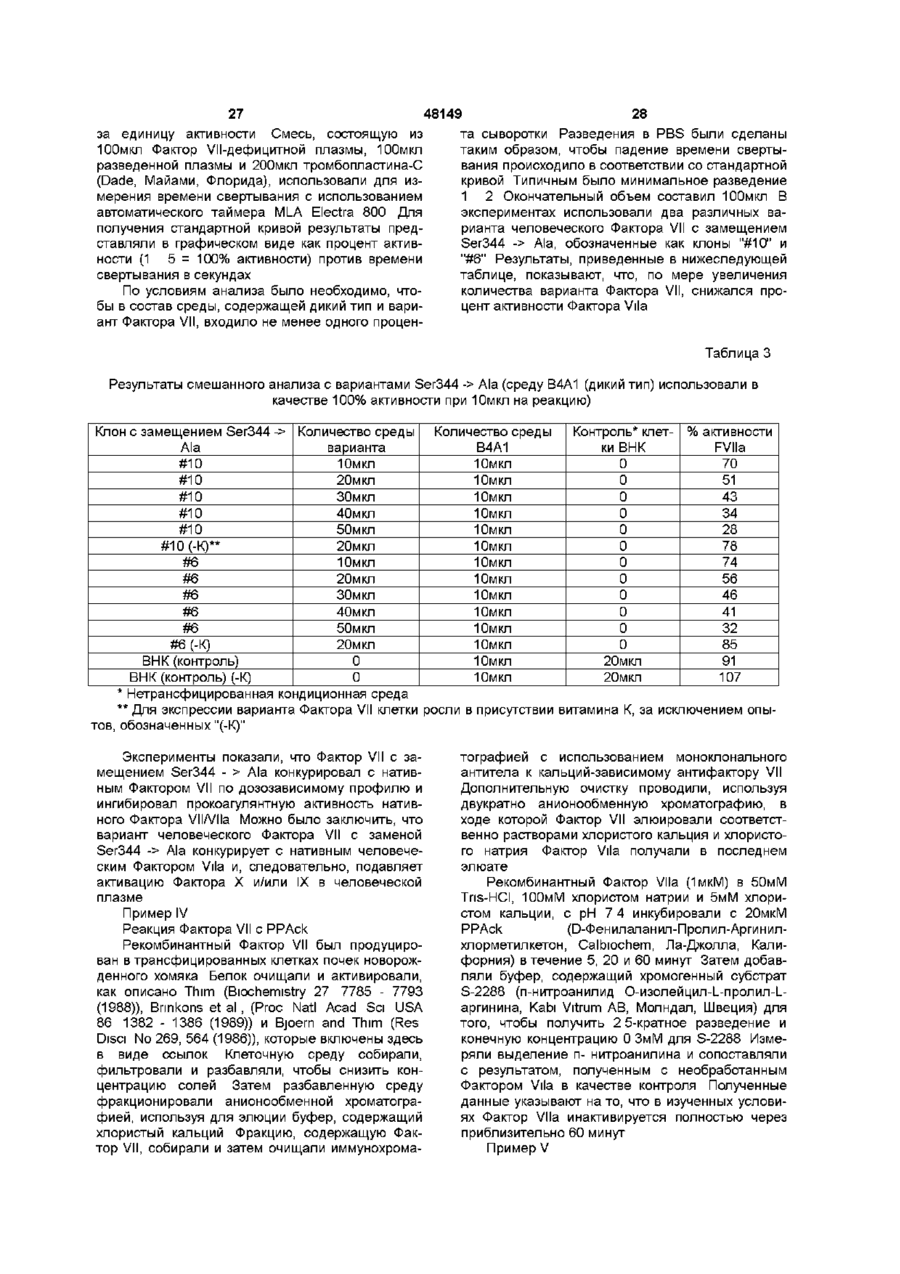
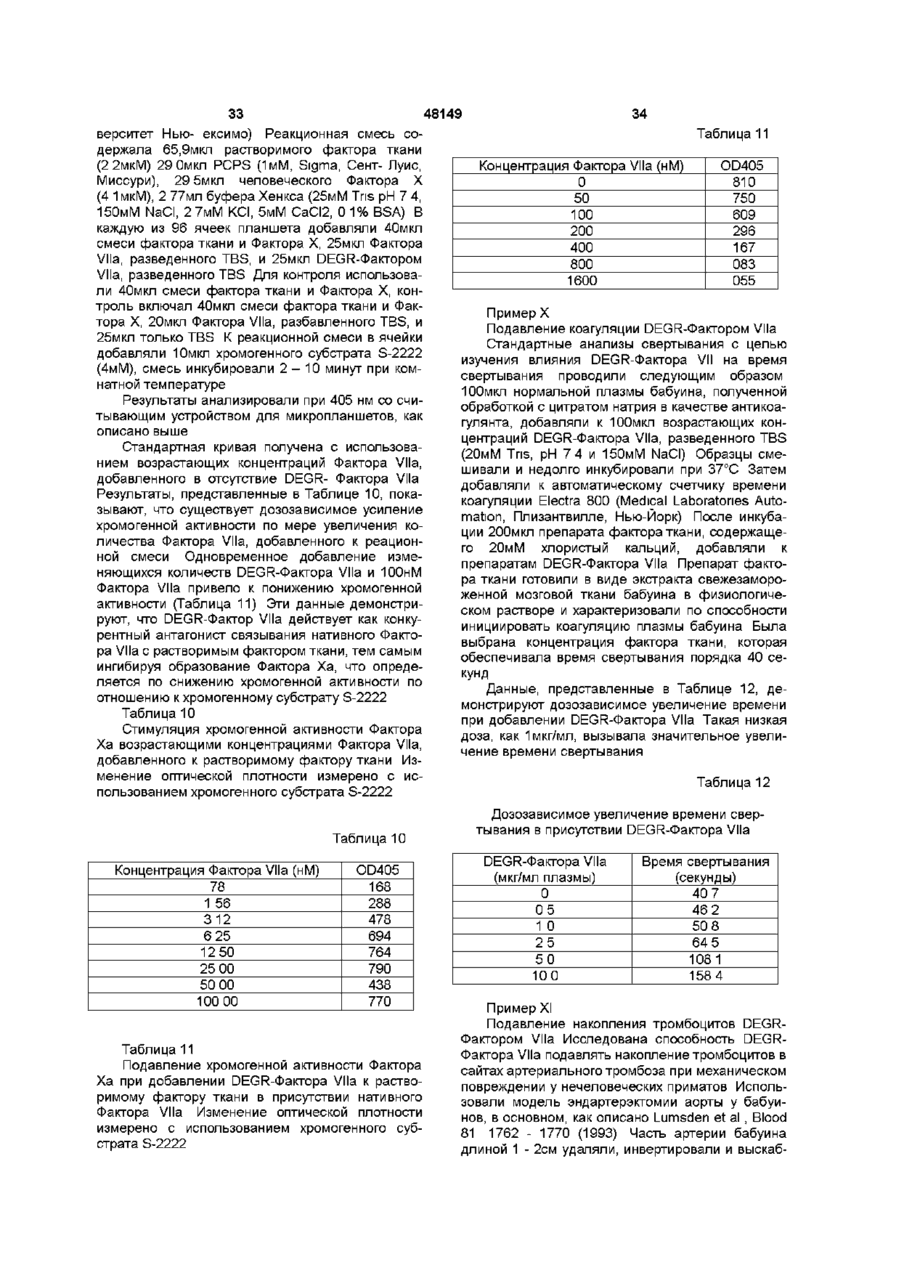
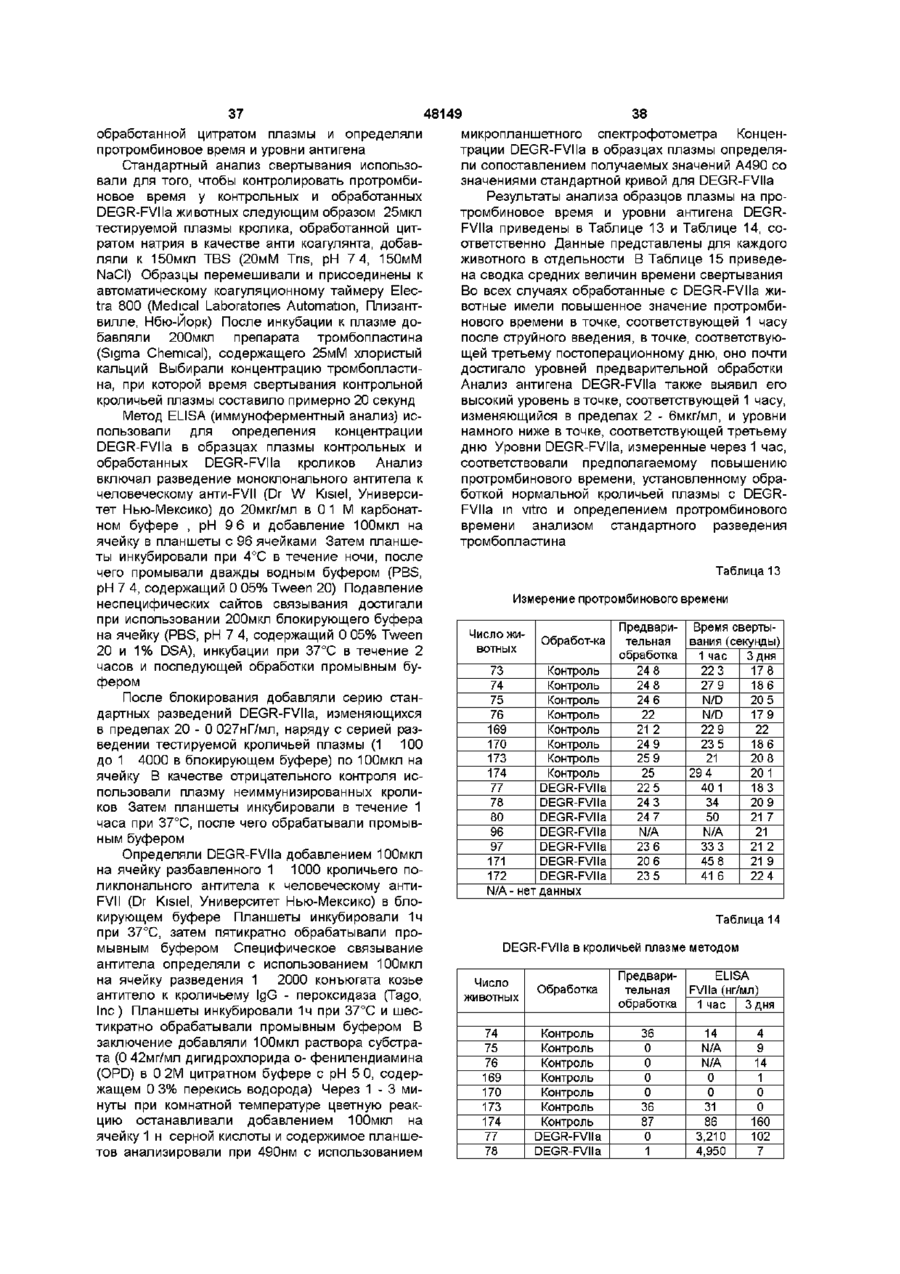
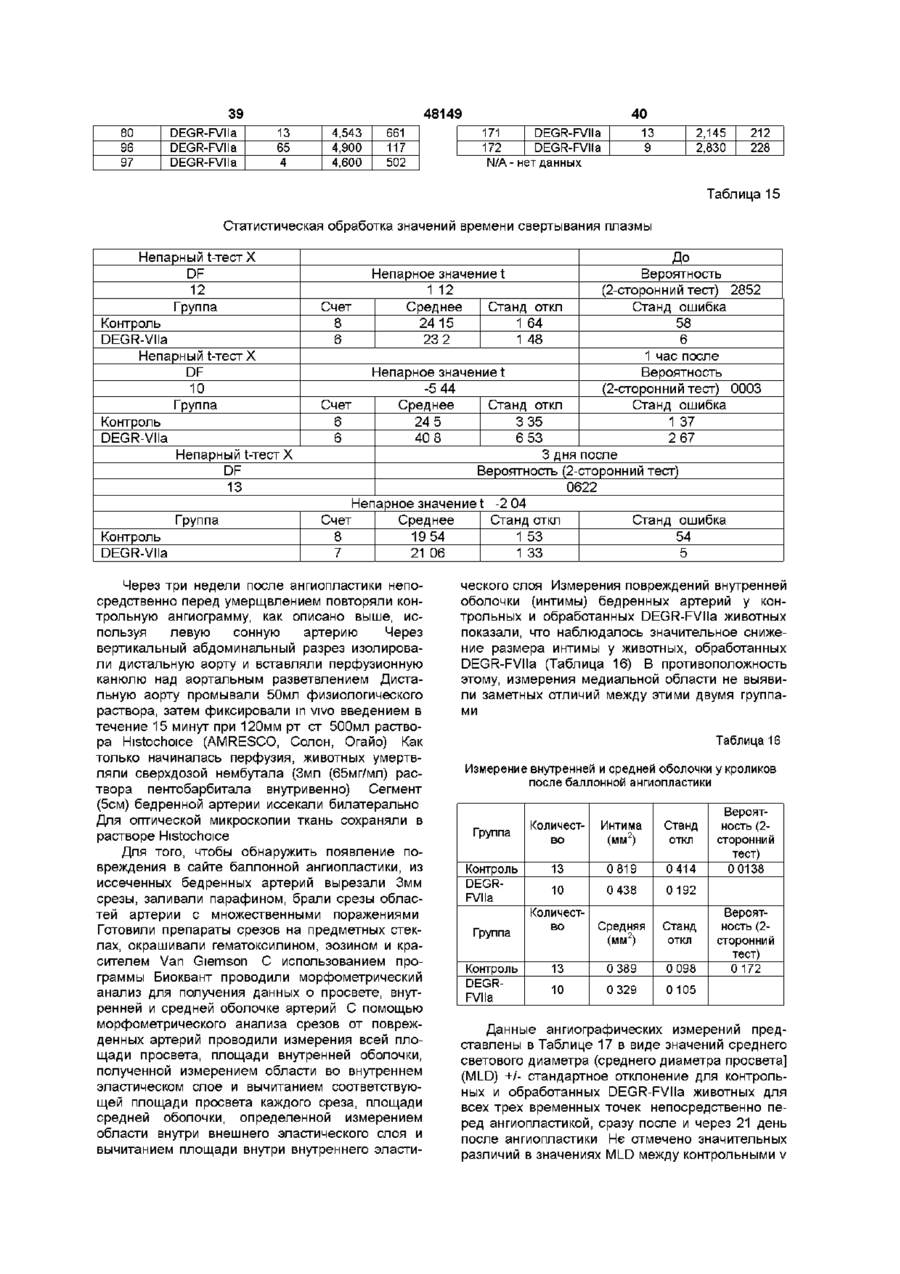
Текст
1 Способ ингибирования аісгивности фаісгора ткани у пациента, заключающийся во введении пациенту терапевтически эффективной дозы состава, отличающийся тем, что упомянутый состав состоит из фактора VII, имеющего, по крайней мере, одну модификацию в своем активном центре, модификация которого существенно подавляет способность модифицированного фактора VII активировать плазматический фактор X или IX 2 Способ по п 1, отличающийся тем, что модификация включает в себя реакцию фактора VII с ингибитором серинпротеазы 3 Способ по п 2, отличающийся тем, что ингибитор протеазы представляет собой фосфорорганическое соединение, сульфонилфторид, пептидсодержащий галометилкетон или азапептид 4 Способ по п 3, отличающийся тем, что ингибитор протеазы представляет собой пептидсодержащий галометилкетон, выбранный из DansylPhe-Pro-Arg-хлорметилкетона, Dansyl-Glu-Gly-Argхлорметилкетона, Dansyl-Phe-Phe-Argхлорметилкетона и Phe-Phe-Arg-хлорметилкетона 5 Способ подавления отложений тромбоцитов у пациента, заключающийся во введении пациенту терапевтически эффективной дозы состава, отличающийся тем, что упомянутый состав состоит из фактора VII, имеющего, по крайней мере, одну модификацию в своем активном центре, модификация которого существенно подавляет способность модифицированного фактора VII активировать плазматический фактор X или IX 6 Способ по п 5, отличающийся тем, что модификация включает в себя реакцию фактора VII с ингибитором серинпротеазы 7 Способ по п 6, отличающийся тем, что ингибитор протеазы представляет собой фосфорорганическое соединение, сульфонилфторид, пептидсодержащий галометилкетон или азапептид 8 Способ по п 7, отличающийся тем, что ингибитор протеазы представляет собой пептидсодержащий галометилкетон, выбранный из DansylPhe-Pro-Arg-хлорметилкетона, Dansyl-Glu-Gly-Argхлорметилкетона, Dansyl-Phe-Phe-Argхлорметилкетона и Phe-Phe-Arg-хлорметилкетона 9 Способ по п 5, отличающийся тем, что модификация фактора VII включает в себя замену, включение или удаление, по крайней мере, одной аминокислоты в каталитической триаде Ser, Asp, His 10 Способ подавления сосудистого рестеноза у больного, заключающийся во введении пациенту терапевтически эффективного количества состава, отличающийся тем, что упомянутый состав включает в себя фармакологически приемлемый фактор VII, имеющий, по крайней мере, одну модификацию в своем каталитическом центре, которая существенно подавляет способность модифицированного фактора VII активировать плазматический фактор X или IX 11 Способ по п 10, отличающийся тем, что модификация фактора VII осуществляется реакцией фактора VII с ингибитором серинпротеазы 12 Способ по п 11, отличающийся тем, что ингибитор протеазы представляет собой фосфорорганическое соединение, сульфонилфторид, пептидсодержащий галометилкетон или азапептид 13 Способ по п 12, отличающийся тем, что ингибитор протеазы представляет собой пептидсодержащий галометилкетон, выбранный из DansylPhe-Pro-Arg-хлорметилкетона, Dansyl-Glu-Gly-Arg q 00 З 48149 хлорметил кетона, Dansyl-Phe-Phe-Argсудистом имплантате, стенте, шунте или органном хлорметилкетона и Phe-Phe-Arg-хлорметилкетона трансплантате 14 Способ по п 10, отличающийся тем, что мо20 Способ по п 19, отличающийся тем, что содификация фактора VII включает в себя замену, став вводят пациенту в течение 24 часов до уставключение или удаление, по крайней мере, одной новки упомянутого имплантата, стента, шунта и аминокислоты в каталитической триаде Ser, Asp, органного трансплантата His 21 Способ по п 19, отличающийся тем, что со15 Способ по п 10, отличающийся тем, что он став вводят пациенту после установки упомянутоиспользуется для рестеноза, являющимся вторичго имплантата, стента, шунта и органного трансным по отношению к механическому повреждению плантата артерии 22 Способ по п 10, отличающийся тем, что он 16 Способ по п 15, отличающийся тем, что уповключает в себя дальнейшее введение упомянумянутое механическое повреждение вызывается того активатора тканевого плазминогена или баллонной ангиопластикой, эндартерэктомией, стрептокиназы редукционной атерэктомией, установкой стента, 23 Способ лечения острой закупорки коронарной лазерной терапией или иссечением распадаюартерии у пациента, заключающийся во введении щейся ткани пациенту состава, отличающийся тем, что упомянутый состав включает в себя фармакологиче17 Способ по п 15, отличающийся тем, что соски приемлемый фактор VII, имеющий, по крайней став вводят пациенту в течение 24 часов до мехамере, одну модификацию в своем каталитическом нического повреждения упомянутой артерии центре, которая существенно подавляет способ18 Способ по п 15, отличающийся тем, что соность модифицированного фактора VII активиростав вводят пациенту после механического повать плазматический фактор X или IX в сочетании вреждения упомянутой артерии с активатором тканевого плазминогена или стреп19 Способ по п 10, отличающийся тем, что он токиназой используется для рестеноза, наблюдаемого в со Настоящее изобретение является частичным продолжением заявки No 08/327,690, зарегистрированной 24 октября 1994 года, которая является частичным продолжением PCT/US 94/05779, зарегистрированной 23 мая 1994 года и частичным продолжением заявки No 08/065,725, зарегистрированной 21 мая 1993 года, которая является частичным продолжением PCT/US92/01636 и заявки No 07/662,920, зарегистрированной 28 февраля 1991 года с передачей прав заявки No 08/164,666, каждая из которых специально включена здесь во всей своей полноте в виде ссылок Область изобретения Настоящее изобретение относится к белкам, используемым в качестве антикоагулянтов Более подробно, настоящее изобретение относится к модифицированным формам Фактора VII, ингибирующим свертывание крови и фактор ткани Предпосылки к созданию изобретения Свертывание крови представляет собой процесс, включающий сложное взаимодействие различных компонентов крови или факторов, которое, в конечном счете, приводит к образованию фибринового сгустка Обычно компоненты крови, которые участвуют в том, что определяется как коагуляционный "каскад", являются проэнзимами или зимогенами, - энзиматически неактивными белками, которые превращаются в протеолитические ферменты при действии активатора, активированного фактора свертывающей системы крови Факторы свертывания, которые подвергаются такому превращению, обычно относятся к "активным факторам" и обозначаются добавлением прописного индекса "а" (например, Фактор Vila) Активированный Фактор X ("Ха") необходим для превращения протромбина в тромбин, который затем на заключительной стадии образования фибринового сгустка превращает фибриноген в фибрин Существуют две системы или два метаболических пути, способствующих активации Фактора X "Внутренний метаболический путь" охватывает те реакции, которые приводят к образованию тромбина посредством утилизации факторов, присутствующих только в плазме Серия опосредованных протеазой реакций в итоге генерирует Фактор IXa, который в сочетании с Фактором Villa расщепляет Фактор X в Ха Идентичный протеолиз во "внешнем метаболическом пути" осуществляется Фактором Vila и его кофактором, фактором ткани Фактор ткани представляет собой связанный с мембраной белок и обычно не циркулирует в плазме Однако при разрыве сосуда он может образовывать комплекс с Фактором Vila для катализа активации Фактора X или Фактора IX в присутствии иона Са++ и фосфолипида (Nemerson and Gentry, Biochem 25 4020 4033 (1986)) Несмотря на то, что относительное значение двух метаболических путей коагуляции в гемостазе остается неясным, в последние годы было найдено, что Фактор VII и фактор ткани играют основную роль в регуляции свертывания крови Фактор VII является маркерным гликопротеином плазмы, который циркулирует в крови в виде одноцепочечного зимогена Зимоген каталитически неактивен (Williams et al , J Biol Chem 264 7536 - 7543 (1989), Rao et al , Proc Natl Acad Sci USA 85 6687 - 6691 (1988)) Одноцепочечный 48149 Фактор VII может быть превращен in vitro в двухцепочечныи Фактор Vila Фактором Ха, Фактором ХПа, Фактором IXa или тромбином Фактор Ха считается основным физиологическим активатором Фактора VII Подобно некоторым другим белкам плазмы, включенным в гемостаз, Фактору VII для активности, связанной с гаммакарбоксил ированием многочисленных остатков глутаминовой кислоты, сосредоточенных на амино-конце белка, необходим витамин К Эти гаммакарбоксилированные глутаминовые кислоты необходимы для взаимодействия Фактора VII с фосфолипидами в присутствии ионов металла Было найдено, что, кроме антикоагулянтов, кратко описанных выше, некоторые природные белки обладают антикоагулянтной активностью Например, Reuteimgsperger (U S Patent No 4,736,018) выделил антикоагулянтные белки из бычьей аорты и сосудов человеческой пупочной вены Maki и др (US Patent No 4,732,891) открыли антикоагулянтные белки в человеческой плаценте Кроме того, в качестве терапевтического антикоагулянта был предложен ATIII (Schipper et al , Lancet 1 (8069) 854 - 856 (1978), Jordan, U S Patent No 4,386,025, Bock et al , U S Patent No 4,517,294) Превращение зимогенного Фактора VII в активированную двухцепочечную молекулу происходит при расщеплении внутренней пептидной связи, расположенной примерно в середине молекулы В человеческом Факторе VII сайт активационного расщепления находится при Argi52ІІЄ153 (Hagen et al , Proc Natl Acad Sci USA 83 24122416(1986), Thim et al , Biochem 27 7785 - 7793 (1988), обе работы включены здесь в виде ссылок) Бычий Фактор VII активируется расщеплением по аналогичной связи Агді52-ІІ©і5з (Takeya et al , J Biol Chem 263 14868 - 14877 (1988)) В присутствии фактора ткани, фосфолипидов и ионов кальция двухцепочечныи Фактор Vila ограниченным протеолизом быстро активирует Фактор X или Фактор IX Часто бывает необходимым селективно блокировать коагуляционный каскад у пациента Антикоагулянты, такие, как гепарин, кумарин, производные кумарина, индандиона или другие агенты, могут быть использованы, например, при почечном диализе или в лечении тромбоза глубоких вен, коагулопатии потребления (DIC) и множества других медицинских нарушений Например, обработка гепарином или экстракорпоральная обработка цитрат-ионом (U S Patent 4,500,309) могут быть использованы при диализе, чтобы предотвратить коагуляцию в ходе лечения Гепарин используется также для предотвращения тромбозов глубоких вен у пациентов, подвергающихся хирургической операции Пролиферация клеток гладкой мышцы (SMCs) сосудистой стенки является важным событием при возникновении сосудистых поражений при атеросклерозе, после восстановления сосудов или в ответ на другие сосудистые повреждения Например, лечение атеросклероза часто включает в себя очищение закупоренных сосудов ангиопластикой, эндартерэктомией или редукционной атерэктомией, или имплантацией шунтов, - хирургические процедуры, при которых ате рос кле роти чес кие бляшки спрессовываются или удаляются посредством катетеризации (ангиопластика), удаляются с артериальной стенки посредством рассечения (эндартерэктомия) или шунтируются природными или синтетическими имплантатами Эти процедуры удаляют сосудистый эндотелий, нарушают находящуюся под ним внутреннюю оболочку (интиму) и приводят к гибели медиальных SMCs Повреждение сопровождается пролиферацией медиальных SMCs и миграцией их во внутреннюю оболочку, что характерным образом проявляется в первые недели и вплоть до шести месяцев после повреждения и прекращается, когда происходит восстановление поверхностного эндотелиального слоя У людей эти повреждения составляют примерно 20% клеток и 80% внеклеточного матрикса Однако лечение гепарином и другими антикоагулянтами может иметь нежелательные побочные эффекты Все известные антикоагулянты, как правило, действуют по всему организму, а не специфично на сгусток Например, гепарин может вызвать тяжелое кровотечение Более того, имея время полувыведения примерно 80 минут, гепарин быстро исчезает из крови, тем самым, вызывая необходимость частого введения Из-за того, что гепарин действует как кофактор антитромбина III (ATIII), a ATIII быстро убывает при лечении DIC, бывает очень трудно поддерживать надлежащую дозировку гепарина, что вызывает необходимость продолжительного мониторинга ATIII и уровней гепарина Гепарин также неэффективен, если снижение ATIII экстремально Кроме того, продолжительное использование гепарина может усилить агрегацию тромбоцитов и понизить их количество и явиться одной из причин развития остеопороза Производные индандиона также могут иметь побочные токсические эффекты Примерно у 30% пациентов и более, подвергшихся ангиопластике, эндартерэктомии или шунтированию, тромбоз и/или пролиферация SMCs во внутреннюю оболочку вызывает повторное слипание сосуда и в результате этого несостоятельность восстановительной хирургии Такое закрытие сосуда после хирургического вмешательства известно как рестеноз Все еще существует необходимость в создании улучшенных составов с антикоагулянтной активностью, которые могут быть введены в сравнительно низких дозах и не дают нежелательных побочных эффектов, присущих традиционным антикоагулянтам Настоящее изобретение реализует эту необходимость, обеспечивая антикоагулянты, которые действуют специфически в сайтах повреждения и дополнительно обеспечивают другие родственные преимущества Сущность Приготовлены новые составы, включающие модифицированный Фактор VII, обладающие антикоагулянтными свойствами Составы с модифицированным Фактором VII ингибируют также фактор ткани Последовательность Фактора VII имеет, по крайней мере, одну аминокислотную модификацию, которая выбрана таким образом, что суще 48149 ственно снижает способность активированного Фактора VII катализировать активацию плазматических Факторов X или XI и, вследствие этого, возможность ингибировать свертывающую активность Новый Фактор VII имеет активный центр, модифицированный заменой, по крайней мере, одной аминокислоты и в своей модифицированной форме способен связывать фактор ткани Для составов модифицированного Фактора VII типичной является в значительной степени чистая форма Составы изобретения особенно полезны для лечения больных, когда превращены в фармацевтические составы, которые могут быть даны пациентам, страдающим от различных болезней, чтобы лечить связанные с коагуляцией состояния Такие молекулы модифицированного Фактора VII, способные связывать фактор ткани, но имеющие значительно сниженную способность катализировать активацию других факторов в свертывающем каскаде, могут обладать более длительным периодом полувыведения из плазмы и, вследствие этого, соответственно большей продолжительностью периода противосвертывающей активности по сравнению с другими антикоагулянтами Среди медицинских показаний для составов изобретения есть те, которые обычно лечат антикоагулянтами, такие, как, например, тромбоз глубоких вен, легочная эмболия, удар, коагулопатия потребления (DIC), отложения фибрина в легких и почках, связанные с грам-отрицательной эндотоксемией, и инфаркт миокарда Составы могут быть использованы для подавления сосудистого рестеноза, возникающего после механического повреждения сосуда, такого, как повреждение, вызванное баллонной ангиопластикой, эндартерэктомией, редукционной атерэктомией, установкой стента, лазерной терапией или иссечением распадающейся ткани, или возникающего дополнительно к сосудистым имплантатам, стентам, шунтам или трансплантатам органов Составы могут быть использованы для подавления отложения тромбоцитов и связанных с этим нарушений Метод подавления коагуляции, сосудистого рестеноза или отложения тромбоцитов состоит во введении пациенту состава, включающего в себя модифицированный Фактор VII, имеющий, по крайней мере, одну замененную аминокислоту в каталитической триаде Ser344, Asp242 и His193 в количестве, достаточном для эффективного подавления коагуляции, сосудистого рестеноза или отложения тромбоцитов Метод также находит применение в лечении острой закупорки коронарной артерии у больного и состоит во введении модифицированного Фактора VII, который включает в себя DEGR-Фактор VII в сочетании с активатором тканевого плазминогена (tPA) или стрептокиназой и может ускорять tPA-индуцированный тромболиз Характерно, что фармацевтические составы для введения людям будут состоять из белка модифицированного Фактора VII и фармацевтически приемлемых носителей и буферов В приведенных воплощениях человеческого и бычьего Фактора VII остаток Ser344 в активном центре модифицирован, заменен на Gly, Met, Thr или, предпочтительнее, на Ala Такая замена мо 8 жет быть сделана отдельно или в комбинации с заменой(нами) в других сайтах каталитической триады, которая включает Asp242 и His193 В другом аспекте изобретение связано с полинуклеотидной молекулой, состоящей из двух оперативно связанных областей кодирующих последовательностей, которые кодируют соответственно пре-пропептид и gla-домен витамин Кзависимого плазматического белка и лишенный gla-домена белок Фактора VII, при экспрессии упомянутый полинуклеотид кодирует молекулу Фактора VII, которая не активирует в достаточной степени плазматические Факторы X или IX, но способна связывать фактор ткани Молекула модифицированного Фактора VII, экспрессированная этим полинуклеотидом, является биологически активным антикоагулянтом, т е способна подавлять коагуляционный каскад и, следовательно, образование отложения фибрина или сгустка С целью экспрессии модифицированного Фактора VII молекула полинуклеотида трансфицируется в линии клеток млекопитающих, такие, как, например, ВНК, ВНК 570 или ВНК 293 Краткое описание рисунков Фиг 1 иллюстрирует конструкцию экспрессионного вектора с последовательностью ДНК для Фактора VII с модификацией Ser344 на Ala Использованы символы 0-1, последовательность единицы картирования 0-1 аденовируса 5, Е, генэнхансер (усилитель) вируса SV40, MLP, основной поздний промотор, SS, набор сайтов сплайсинга, и рА, сигнал полиаденилирования от SV40 в поздней ориентации Фиг 2 показывает влияние струйного введения DEGR-Фактора Vila на образование тромба (отложение тромбоцитов) на эндартерэктомизированной аорте бабуина по сравнению с обработанными физиологическим раствором контролями Артерии измеряли через 60 минут На данной модели острого сосудистого повреждения примата DEGR-Фактор Vila заметно подавлял развитие обогащенных тромбоцитами тромбов ФигЗ показывает результаты, полученные при инкубации клеток гладкой мышцы бабуина с возрастающимиконцентрациями или FVIIa (незакрашенные квадраты), или DEGR-FVIIa в присутствии постоянного количества FVIIa (5нМ) (закрашенные квадраты) Уровень активации FX был затем определен с использованием хромогенного субстрата S-2222 Данные представлены в виде амидолитической активности, а именно как процент от активности, генерированной в присутствии только 5нМ FVIIa Фиг 4 изображает размер площади внутренней оболочки после эндартерэктомии сонной артерии бабуина и обработки с DEGR-Фактором Vila в течение 7 или 30 дней по сравнению с контрольными животными Фиг 5 показывает отношение площади внутренней оболочки к сумме площадей внутренней и медиальной оболочки бедренной артерии бабуина после баллонного повреждения и обработки DEGR-Фактором Vila, контрольная группа включала 5 сосудов, при 7-дневной обработке обследованы 11 сосудов, при 30-дневной обработке обследованы 2 сосуда (п - число обследованных сосудов) Описание специфических воплощений Новый модифицированный Фактор VII, имеющий антикоагулянтную активность, обеспечивается настоящим изобретением Модифицированный Фактор VII может быть в форме зимогена (те одноцепочечной молекулы) или может быть расщеплен в активационном сайте Таким образом, понятие "модифицированный Фактор VII" включает в себя модифицированный Фактор VII и молекулы модифицированного Фактора Vila, которые связывают фактор ткани и подавляют активацию Фактора IX в IXa и Фактора X в Ха Составы модифицированного Фактора VII пригодны для введения различным млекопитающим, особенно человеку, с целью ингибирования коагуляционного каскада Модифицированный Фактор VII может быть введен пациенту в сочетании с другими антикоагулянтами или вместо них 48149 10 обычно производят по аминокислоте, которая входит в каталитическийи сайт или находится по соседству с ней В белках человеческого и бычьего Фактора VII аминокислотами, образующими каталитическую "триаду", являются Ser344, Asp242 и H1S193 (нижний цифровой индекс указывает положение в аминокислотной последовательности) Каталитические сайты Фактора VII других видов млекопитающих могут быть определены с использованием доступной техники, включая, помимо других, выделение белка и анализ аминокислотной последовательности Каталитические сайты могут быть также определены удлинением последовательности в присутствии других серинпротеаз, особенно химотрипсина, активный центр которого расшифрован ранее (Sigler et al , J Мої Biol 35 143-164 (1968), включено здесь в виде ссылки), устанавливая с помощью упомянутого удлинения аналогичные аминокислотные остатки активного центра Фактор VII играет важную роль в коагуляционном каскаде, особенно важным является включение его во внешний метаболический путь Присутствуя в циркулирующей плазме в виде неактивного одноцепочечного проферментного белка и подвергнувшись активации, Фактор Vila в сочетании с фактором ткани и ионами кальция активирует Фактор X в Ха и Фактор IX в ГХа с возможным образованием фибринового сгустка Настоящее изобретение обеспечивает возможность подавлять эту последовательность событий в коагуляционном каскаде, предотвращая или иным образом ингибируя активацию Факторов X и IX с помощью Фактора Vila Белок Фактора VII этого изобретения имеет каталитический центр, который модифицирован таким образом, чтобы снизить каталитическую активность Фактора Vila, но сохранить способность связывать фактор ткани Молекула модифицированного Фактора VII конкурирует с нативным Фактором VII и/или Vila за связывание с фактором ткани В результате подавляется активация Факторов X и IX В одном аспекте настоящего изобретения каталитическая активность Фактора Vila подавляется химической дериватизацией каталитического центра, или триады Дериватизация может быть осуществлена взаимодействием Фактора VII с необратимым ингибитором, таким, как фосфорорганическое соединение, сульфонилхлорид, пептидсодержащий галометилкетон или азапептид, или, например, ацилированием Предпочтительные пептидхсодержащие галометилкетоны включают РРАСК (D-Phe-Pro-Arg-хлорметилкетон, см U S Patent No 4,318,904, включенный здесь в виде ссылки), D-Phe-Phe-Argи Phe-Phe-Argхлорметилкетон, и DEGRck (Dansyl-Glu-Gly-Argхлорметил кетон) В другом аспекте, каталитическая активность Фактора Vila может быть также подавлена замещением, введением или удалением аминокислот В представленных воплощениях замены аминокислот производятся в аминокислотной последовательности каталитической триады Фактора VII, определяемой здесь как область, содержащая аминокислоты, которые способствуют активности каталитического сайта Фактора Vila Замещения, введения или удаления в каталитической триаде Замещения, введения или удаления аминокислот производятся таким образом, чтобы предотвратить или иным способом подавить активацию Факторов X и/или X Фактором Vila Модифицированный таким способом Фактор VII должен, однако, сохранять способность конкурировать с аутентичным Фактором VII и/или Фактором Vila за связывание с фактором ткани в коагуляционном каскаде Такая конкуренция легко определяется посредством, например, анализа свертываемости крови, как здесь описано, или анализом конкурентного связывания с использованием, например, клеточной линии, имеющей поверхностно-связанный фактор ткани, такой, как клетки человеческой карциномы мочевого пузыря линии J82 (Sakai et al , J Biol Chem 264 9980 9988 (1989), включено здесь в виде ссылки) Аминокислоты, которые образуют каталитический сайт Фактора VII, такие как Ser344, Asp242 и H1S193 человеческого и бычьего Фактора VII, могут быть или заменены, или удалены В рамках настоящего изобретения предпочтительнее изменить только одну аминокислоту, сводя таким образом к минимуму вероятность усиления антигенности молекулы или подавления ее способности связывать фактор ткани, однако могут быть сделаны изменения двух или более аминокислот (замены, добавления или удаления), а также могут проводиться сочетания замены(н), добавлениями) и удаления(ий) В избранном воплощении для человеческого и бычьего Фактора VII предпочтительнее замена Ser на Ala, но могут быть заменены Gly, Met, Thr или другие аминокислоты Предпочтительно заменить Asp на Glu и His на Lys или Arg В общем, замена подбирается таким образом, чтобы как можно меньше разрушать третичную структуру белка Модель Дайхоффа и др (в Атласе структуры белка 1978, Natl Biomed Res Found, Вашингтон, Колумбия), включенная здесь в виде ссылки, может быть использована в качестве руководства по выбору других аминокислотных заместителей Можно внести изменение, как описано выше, в каталитический сайт соответствующей последовательности Фактора VII человека, быка или другого вида и тестировать полученный белок на подавление 12 11 48149 каталитической активности и возникающую антиют существенно способность белка действовать в коагулянтную активность, как здесь описано Для качестве антикоагулянта Например, Фактор VII, модифицированного Фактора VII каталитическая модифицированный по каталитической триаде, активность будет существенно снижена, обычно может быть также модифицирован и по сайту акона составляет менее 5% от каталитической активационного расщепления с целью ингибировать тивности соответствующих образцов Фактора VII превращение зимогенного Фактора VII в его актидикого типа, преимущественно менее 1% вированную двухцепочечную форму, как описано в U S Patent 5,288,629, включенном здесь в виде Белки настоящего изобретения могут быть ссылки получены с использованием техники рекомбинантной ДНК В общем, клонированная последоЭкспрессионные векторы для использования в вательность ДНК Фактора VII дикого типа модиосуществлении настоящего изобретения будут фицируется, чтобы кодировать желаемый белок включать в себя промотор, способный направлять Эта модифицированная последовательность затранскрипцию клонированного гена или кДНК тем встраивается в экспрессионный вектор, котоПредпочтительными промоторами для использорый, в свою очередь, трансформируется или внования в культуре клеток млекопитающих являются сится в клетки хозяина Клетки высших эукариот, вирусные и клеточные промоторы Вирусные особенно культивированные клетки млекопитаювключают промотор от SV40 (Subramam et al , Мої щих, являются предпочтительными в качестве Cell Biol 1 854 - 864 (1981)) и промотор от CMV клеток хозяина Для человеческого Фактора VII (цитомегаловируса) (Boshart et al , Cell 41 521 известны полные нуклеотидная и аминокислотная 530 (1985)) Особо предпочтительным вирусным последовательности См U S Pat No 4,784,950 промотором является основной поздний промотор (который включен здесь в виде ссылки), где опиаденовируса 2 (Kaufman and Sharp, Мої Cell Biol саны клонирование и экспрессия человеческого 2 1 3 0 4 - 1 3 1 9 (1982)) Клеточные промоторы рекомбинантного Фактора VII Последовательвключают мышиный каппа-промотор (Bergman et ность бычьего Фактора VII описана в работе Таal , Proc Natl Acad Sci USA 81 7041 - 7045 k e y a e t a l . J Biol Chem 263 14868-14872(1988), (1983)) и мышиный VH промотор (Lori et al , Cell 33 которая включена в виде ссылки 85 - 93 (1983)) Особо предпочтительным клеточным промотором является мышиный металлотиоИзменения аминокислотной последовательнеиновый промотор I (Palmiter et al , Science 222 ности могут быть осуществлены различными ме809 - 814 (1983)) Экспрессионные вектору могут тодами Для модификации последовательности также содержать набор сайтов сплайсинга РНК, ДНК используют сайт-специфичный мутагенез расположенных по ходу транскрипции от промотоМетоды сайт-специфичного мутагенеза хорошо ра и против хода транскрипции от сайта включеизвестны и описаны, например, Золлером и Сминия для последовательности Фактора VII Предтом (ДНК 3 479 - 488 (1984)) Таким образом, испочтительные сайты сплайсинга РНК могут быть пользуя нуклеотидные и аминокислотные послеполучены из аденовирусов и/или генов иммуногдовательности Фактора VII можно осуществить лобуллина В экспрессионном векторе содержится изменения по выбору также сигнал полиаденилирования, расположенФактор VII, модифицированный в соответстный по ходу транскрипции от сайта включения вии с настоящим изобретением, включает в себя Особо предпочтительные сигналы полиаденилите белки, у которых амино-концевая область (glaрования включают ранний или поздний сигнал от домен) заменена gla-доменом одного из витамин SV40 (Kaufman and Sharp, там же), сигнал полиК-зависимых плазматических белков Фактора IX, аденилирования из области Elb аденовируса 5, Фактора X, протромбина, белка С, белка S или терминатор гена человеческого гормона роста (De белка Z gla-Домены витамин К-зависимых плазNoto er al , Nucl Acids Res 9 3719 - 3730 (1981)), матических белков характеризуются наличием сигнал полиаденилирования гена человеческого остатков гамма-карбоксиглутаминовой кислоты и Фактора VII или гена бычьего Фактора VII Эксобычно имеют протяженность от примерно 30 до прессионные векторы могут также включать неко40 аминокислот с С-концами, подобными положедирующую вирусную лидерную последовательниям на границах экзон-интрон соответствующих ность, такую, как у аденовируса 2, расположенную генов Методы получения Фактора VII с гетероломежду промотором и сайтами сплайсинга РНК, гичным gla-доменом раскрыты в U S Patent No энхансерные последовательности, такие, как эн4,784,950, включенном здесь в виде ссылки хансер от SV40 Последовательности ДНК для использования в рамках настоящего изобретения будут типично Клонированные последовательности ДНК кодировать пре-пропептид на аминоконце белка вводятся в культуру клеток млекопитающих, наФактора VII для установления надлежащего постпример, опосредованной фосфатом кальция трансляционного процессинга (например, гамматрансфекцией (Wigler et al , Cell 14 725 - 732 карбоксилирование остатков глутаминовой кисло(1978), Corsaro and Pearson, Somatic Cell Genetics ты) и секреции из клетки-хозяина Пре-пропептид 7 603 - 616, 1981, Graham and Van der Eb, Virology может быть таким, как в Факторе VII, или другим 52d 456 - 467 (1973)) или электропорацией (Neuвитамин К-зависимым плазматическим белком, mann et al , EMBO J 1 841 - 845 (1982)) Для таким, как Фактор IX, Фактор X, протромбин, белок идентификации и отбора клеток, экспрессирующих С или белок S Как признают специалисты, могут экзогенную ДНК, в клетки, наряду с основным гебыть осуществлены дополнительные модификаном или кДНК, обычно вводится ген, который опции аминокислотной последовательности модиределяет селектируемый фенотип (селектируефицированного Фактора VII, которые не ослаблямый маркер) Предпочтительные селектируемые 14 13 48149 маркеры включают гены, которые определяют гие клеточные линии, включая клетки Rat Hep I устойчивость к таким препаратам, как неомицин, (гепатома крысы, АТСС CRL 1600), клетки Rat Hep гигромицин и метотрексат Селектируемый маркер II (гепатома крысы, АТСС CRL 1548), клетки ТСМК может быть амплифицируемым селектируемым (АТСС CCL 139), клетки легких человека (АТСС маркером Предпочтительным амплифицируемым НВ 8065), клетки NCTC 1469 (АТСС CCL 9 1), селективным маркером является последовательклетки СНО (АТСС CCL 61) и клетки DUKX (Uriaub ность дигидрофолатредуктазы (DHFR) Селектиand Chasm, Proc Natl Soc Sci USA 77 4216 руемые маркеры рассмотрены Тилли (Технология 4220(1980) клетки млекопитающих Butterworth Publishers, В рамках настоящего изобретения для полуСтонхем, Массачусетс, включено здесь в виде чения модифицированного Фактора VII может ссылки) Выбор селектируемого маркера доступен быть использована технология трансгенных жидля обычного специалиста вотных Предпочтительнее продуцировать белки в молочных железах самок млекопитающих ЭксСелектируемые маркеры могут быть введены прессия в молочной железе и последующая секв клетку в отдельной плазмиде в одно и то же реция целевого белка в молоко преодолевают время с основным геном или могут быть введены многие трудности, связанные с выделением белв одной с ним плазмиде При расположении в одков из других источников Молоко легко собираетной и той же плазмиде селектируемый маркер и ся, доступно в больших количествах и хорошо основной ген могут контролироваться различными охарактеризовано биохимически Более того, оспромоторами или одним и тем же промотором, новные белки молока присутствуют в нем в высопоследняя схема дает дицистронную единицу геких концентрациях (обычно 1 - 15г/л) С коммерченетического кода Конструкции этого типа известской точки зрения очевидно, что ны специалистам (например, Levmson and Simonпредпочтительнее использовать в качестве хозяиsen, U S Patent 4,713,339) Полезным может быть на виды, которые дают большое количество молотакже прибавление дополнительной ДНК, известка В то время, как могут использоваться мелкие ной как "носитель ДНК", к смеси, которая вводится животные, такие, как мыши и крысы (которые явв клетку ляются предпочтительными при подтверждении После введения ДНК в клетки они растут в принципиального этапа), в рамках настоящего подходящей ростовой среде, обычно 1 - 2 дня, до изобретения предпочтительнее использовать доначала экспрессии целевого гена Использованмашних млекопитающих, включая (но не только) ный здесь термин "подходящая ростовая среда" свиней, коз, овец и крупный рогатый скот Овцы обозначает среду, содержащую питательные и др являются особо предпочтительными благодаря компоненты, необходимые для роста клеток и экстаким факторам, как предшествующая история прессии гена модифицированного Фактора VII трансгенеза у этого вида, выход молока, стоиСреда обычно включает источники углерода, азомость и высокая доступность оборудования для та, незаменимые аминокислоты, углеводы, витасбора овечьего молока Для сравнения факторов, мины, соли, фосфолипиды, белок и факторы росвлияющих на выбор вида хозяина см WIPO Publiта Для продукции гамма-карбоксил ированного cation WO 88/00239 Обычно желательно выбимодифицированного Фактора VII среда будет сорать ту породу животного-хозяина, которая разводержать витамин К, желательно в концентрации дится для получения молока, такую, как овца 0,1 - 5 мкг/мл Затем проводится подбор препарапороды East Fnesland, или интродуцировать мотов для селекции клеток, которые устойчиво экслочную породу размножением трансгенной линии прессируют селектируемый маркер Для клеток, на более позднем этапе В любом случае должно которые были трансфицированы амплифицируеиспользоваться известное животное и в хорошем мым селектируемым маркером, концентрация состоянии препарата может быть повышена, чтобы отобрать большее число копий клонированных последоваДля получения экспрессии в молочной железе тельностей, тем самым повышая уровни экспресиспользуют промотор гена молочного белка Групсии Затем клоны устойчивых трансфицированных пу генов молочного белка составляют гены, кодиклеток скринируются на экспрессию модифицирорующие казеин (см U S Patent No 5,304,489, ванного Фактора VII включенный здесь в виде ссылки), беталактоглобулин, альфа- лактоглобулин и кислый Предпочтительные линии клеток млекопибелок сыворотки Предпочтительным является тающих для использования в настоящем изобрепромотор бета-лактоглобулина В случае гена тении включают клетки COS-1 (АТСС CRL 1650), овечьего бета-лактоглобулина, как правило, будет клетки почек новорожденного хомяка (ВНК) и 293 использована проксимальная 5'-фланкирующая (АТСС CRL 1573, Graham et al , J Clm Virol 36 59 последовательность из 406 нуклеотидов, хотя - 72 (1977)) Предпочтительной линией клеток ВНК предпочтительными являются более значительявляется штамм tk ts13 (Waechter and Baserge, ные фрагменты 5'-фланкирующей последовательProc Nati Acad Sci USA 79 1106-1110(1982), ности, примерно до 5 тыс нуклеотидов, такие, как включено здесь в виде ссылки), в дальнейшем сегмент ДНК в 4 25 тыс нуклеотидов, окружающий отнесенный к ВНК 570 Линия клеток ВНК 570 за5'-фланкирующий промотор и некодирующую регистрирована в Американской коллекции типов часть гена бета-лактоглобулина См Whitelaw et культур (АТСС), 12301 Parklawn Dr, Роквилль, al , Biochem J 286 31 - 39 (1992) Применимы Мэриленд 20852, под номером CRL 10314 Линия также и подобные фрагменты промоторной ДНК клеток ВНК tk ts13 также известна в АТСС под других видов номером CRL 1632 Кроме того, в рамках настоящего изобретения могут быть использованы и друДругие области бета-глобулинового гена могут 15 48149 16 также включаться в конструкцию, т к могут эксмолока, и заменить кодирующую последовательпрессироваться геномные области гена Принято ность молока последовательностью полипептида считать, что, например, конструкции, лишенные модифицированного Фактора VII, тем самым созинтронов, экспрессируют плохо по сравнению с давая смешение генов, которе включает экспрестеми, которые содержат такие последовательносионные контрольные последовательности гена сти ДНК (см Brmster et al , Proc Natl Acad Sci белка молока В любом случае, клонирование эксUSA 85 836 -8 40 (1988), Palmiter et al , Proc Natl прессионных единиц в плазмидах или других векAcad Sci USA 88 478 - 482 (1991), Whitelaw et al , торах благоприятствует амплификации последоTransgemc Res 1 3 - 13 (1991), WO 89/01343, и вательности модифицированного Фактора VII WO 91/02318, каждый включен здесь в виде ссылАмплификацию удобно проводить в бактериальки) В этом отношении обычно предпочтительно ной клетке-хозяине (например, Е coh), таким обиспользовать, где возможно, геномные последоразом, векторы будут включать источник репликавательности, содержащие все или некоторые нации и селектируемый маркер в хозяйские тивные интроны гена, кодирующего целевой белок бактериальные клетки или полипептид, следовательно, дополнительное Экспрессионную единицу затем вводят в опвключение, по крайней мере, некоторых интронов, лодотворенные яйцеклетки (включая эмбрионов например, из бета-лактоглобулинового гена, явна ранней стадии развития) выбранного видаляется предпочтительным Одной из таких обласхозяина Введение гетерологичной ДНК может тей служит сегмент ДНК, который обеспечивает быть выполнено одним из нескольких способов, сплайсинг интрона и полиаденилирование РНК от включая микроинъекцию (например, U S Patent З'-некодирующего участка гена овечьего бетаNo 4,873,191), ретровирусную инфекцию лактоглобулина При замене на природные 3'(Jaemsch, Science 240 1468 - 1474 (1988)) или некодирующие последовательности гена этот направленную интеграцию с использованием овечий бета-лактоглобулиновый сегмент может стволовых клеток эмбриона (ES) (рассмотрено как усилить, так и стабилизировать уровни эксBradley et al , Bio/Technology 10 534 - 539 (1992)) прессии целевого белка или протеина В рамках Яйцеклеткам, имплантированным в фаллопиевы других воплощений область, окружающая ATG трубы или матки псевдобеременных самок, дают инициации модифицированного Фактора VII, заразвиваться до срока Потомок, несущий введенменяется соответствующими последовательноную ДНК в зачаточном состоянии, может передастями гена специфического белка молока Такая вать ДНК своему потомству нормальным спосозамена обеспечивает предполагаемое тканебом, по Менделю, с образованием трансгенного специфическое инициационное окружение для стада того, чтобы усилить экспрессию Удобно заменить Специалистам известны обычные процедуры полностью пре- про- и 5'-некодирующие последодля получения трансгенных животных известны вательности модифицированного Фактора VII поСм , например, Hoan et al , Манипулирование мыследовательностями, например, гена BLG, хотя шиным зародышем лабораторное руководство можно заменять и меньшие области Cold Spring Harbor Laboratory, 1986, Simons et al , ВюДесппоІоду 6 179-183 (1988), Wall et al , Biol Для экспрессии модифицированного Фактора Reprod 32 645 - 651 (1985), Buhler et al , ВюДеспVII у трансгенных животных сегмент ДНК, кодипоюду 8 140 - 143 (1990), Ebert et al , ВюДесппоІорующий модифицированный Фактор VII, операду 9 835 - 838 (1991), Knmpenfort et al , тивно связывается с дополнительными сегментаBio/Technology 9 844 - 847 (1991), Wall et al , J ми ДНК, необходимыми для его экспрессии, чтобы Cell Biochem 49 113 - 120 (1992), U S Patent No образовать экспрессионные единицы Такие до4,873,191 и 4,873,316, WIPO - WO полнительные сегменты включают вышеупомянутый промотор, а также последовательности, кото88/00239, WO 90/05188, WO 92/11757, и GB рые обеспечивают терминацию транскрипции и 87/00458, которые включены здесь в виде ссылок полиаденилирование мРНК Экспрессионные едиТехника введения последовательностей чужеродницы затем будут включать сегмент ДНК, кодиной ДНК млекопитающим и в эмбриональные рующий секреторную сигнальную последовательклетки других видов изначально отрабатывалась ность, оперативно связанную с сегментом, на мышах См , например, Gordon et al , Proc Natl кодирующим модифицированный Фактор VII СекAcad Sci USA 77 7380 - 7384 (1980), Gordon and реторная сигнальная последовательность может Ruddle, Science 214 1244 - 1246 (1981), Palmiter быть последовательностью нативного Фактора VII and Brmster, Cell 41 343 - 345 (1985), Bmster et al , или какого-либо другого белка, такого, как белок Proc Natl Acad Sci USA 82 4438 - 4442 (1985) и молока См , например, von Hemje, Nucl Acids Res Hogan et al , (там же) Впоследствии эти приемы 14 4683 - 4690 (1986), Meade et al , U S Patent No были адаптированны для использования на более 4,873,316, которые включены здесь в виде ссылок крупных животных, включая домашних животных (см , например, публикации WIPO - WO 88/00239, Конструирование экспрессионных единиц у WO 90/05188 и WO 92/117577, и Simons et al , Вютрансгенных животных удобно осуществлять ДесппоІоду 6 179-183 (1988) Итак, в большинствключением последовательности модифицирове известных до настоящего времени эффективванного Фактора VII в плазмиду или фаговый векных способов генерации трансгенных мышей или тор, содержащий дополнительные сегменты ДНК, домашних животных несколько сот линейных мохотя экспрессионная единица может быть сконстлекул ДНК, представляющих нтерес, вводят в одруирована с помощью других последовательноно из проядер оплодотворенной яйцеклетки в состей лигирования Особенно удобно создать векответствии с разработанными приемами Может тор, содержащий сегмент ДНК, кодирующий белок 17 48149 быть использована также инъекция ДНК в цитоплазму зиготы Можно также использовать получение трансгенных растений Экспрессия бывает генерализованной или направленной на отдельный орган, такой, как бугор См Hiatt, Nature 344 469 - 479 (1990), Edelbaum et al , J Interferon Res 12 449 - 453 (1992), Sijmons et al , ВюДесппоІоду 8 217 - 221 (1990), и публикация Европейского патентного бюро ЕР 255,378 Модифицированный Фактор VII, полученный в соответствии с настоящим изобретением, может быть очищен аффинной хроматографией на колонке с антителом к анти-Фактору VII Особо предпочтительным является использование кальций-зависимых моноклональных антител, как описано у Wakabayashi et al , J Btol Chem 261 11097 - 11108 (1986) и Thim et al , Biochem 27 7785 7793 (1988), включенных здесь в виде ссылок Дополнительная очистка может быть осуществлена традиционными методами химической очистки, такими, как высокоэффективная жидкостная хроматография Известны и другие методы очистки, включая осаждение цитратом бария, которые могут быть использованы для очистки модифицированного Фактора VII, описанного здесь (см , как правило, Scopes R, Очистка белков, SprmgerVerlag, N Y , 1982) Предпочтительным является достаточно чистый модифицированный Фактор VII, по меньшей мере, 90 - 95% гомогенности, самым предпочтительным - 98 - 99% гомогенности или более, используемый для фармацевтических целей Очищенный частично или, по желанию, до гомогенного состояния, модифицированный Фактор VII может использоваться в терапевтических целях В рамках одного из воплощений изобретения модифицированный Фактор VII расщепляется в сайте активации для того, чтобы превратить его в двухцепочечную форму Активация может осуществляться в соответствии с известными в этой области процедурами, такими, как описанные Osterud et al , Biochemistry 11 2853 - 2857 (1972), Thomas, US Patent No 4,456,591, Hedner and Kisiel, J Clm Invest 71 1836 - 1841 (1983), Kisiel and Fujikawa, Behnng Inst Mitt 73 29 - 42 (1983), которые включены здесь в виде ссылок Образующаяся молекула затем преобразуется в лекарственную форму и вводится, как описано ниже Молекулы модифицированного Фактора VII настоящего изобретения и фармацевтические составы на их основе особенно удобны для введения людям при лечении различных состояний, включая внутрисосудистую коагуляцию Например, хотя тромбоз глубоких вен и легочную эмболию можно лечить традиционными антикоагулянтами, модифицированный Фактор VII, описанный здесь, может быть использован для того, чтобы предотвратить возникновение тромбоэмболических осложнений у пациентов с установленным высоким риском, таких, как перенесшие хирургическую операцию или страдающие застойной сердечной недостаточностью Кроме того, модифицированный Фактор VII может действовать как антагонист опосредованной фактором ткани индукции коагуляции, тем самым, блокируя продукцию тромбина и последующее отложение фибри 18 на Модифицированный Фактор VII, как таковой может оказаться полезным в подавлении активности фактора ткани, приводя, в частности, к подавлению свертывания крови, тромбоза или отложения тромбоцитов Молекулы модифицированного Фактора VII настоящего изобретения могут быть особенно полезны в лечении гиперплазии внутренней оболочки или рестеноза вследствие острого сосудистого нарушения Острыми сосудистыми нарушениями являются те, которые возникают быстро (т е от дней до месяцев) по сравнению с хроническими сосудистыми нарушениями (например, атеросклерозом), которые развиваются в течение всей жизни Острые сосудистые нарушения часто возникают при хирургических процедурах, таких, как реконструкция сосудов, при которых используются приемы ангиопластики, эндартерэктомии, атерэктомии, шунтирования и т п Гиперплазия может также возникать как отсроченная реакция в ответ, например, на шунтирование или трансплантацию органа Поскольку модифицированный Фактор VII обладает более избирательным, чем гепарин, действием, обычно связывая только фактор ткани в сайтах повреждения, и, благодаря тому, что модифицированный Фактор VII не разрушает другие коагуляционные белки, он будет более эффективным, чем гепарин, и с меньшей вероятностью вызовет нежелательные кровотечения при профилактическом применении для предотвращения тромбоза глубоких вен Доза модифицированного Фактора VII для предотвращения тромбоза глубоких вен находится в пределах от примерно 50мкг до 500мг в день, более типично 1 200мг/день, предпочтительно 10 - 175мг/день для пациента весом 70кг, введение должно начинаться, по крайней мере, за 6 часов до хирургического вмешательства и продолжаться до перехода пациента на амбулаторный режим Доза модифицированного Фактора VII для лечения рестеноза будет различаться для каждого пациента, но, в общем, будет находиться в упомянутых выше пределах Последние достижения в лечении коронарных сосудистых заболеваний включают использование механического вмешательства для того, чтобы или удалить, или переместить виновную в нарушении бляшку с целью восстановления адекватного тока крови в коронарных артериях Несмотря на использование разнообразных форм механического вмешательства, включая баллонную ангиопластику, редукционную атерэктомию, установку сосудистых стентов, лазерную терапию или иссечение распадающейся ткани, эффективность этих приемов ограничивается примерно 40% рестенозов, возникающих в течение 6 месяцев после лечения Считается, что рестеноз является результатом сложного взаимодействия биологических процессов, включая отложение тромбоцитов и тромбообразование, высвобождение хемотаксисных и митогенных факторов и миграцию и пролиферацию клеток сосудистой гладкой мышцы во внутреннюю оболочку расширенного артериального сегмента Подавление аккумуляции тромбоцитов в сай 19 тах механического повреждения может лимитировать скорость рестеноза у человека Терапевтическое использование моноклонального антитела к тромбоциту Gpllb/llla способно снизить уровень рестеноза у человека (Cahff et al , N Engl J Med 330 956-961 (1994)) Антитело может связываться с рецептором Gpllb/llla на поверхности тромбоцитов и тем самым подавлять аккумуляцию тромбоцитов Эти данные предполагают, что подавление аккумуляции тромбоцитов в сайте механического повреждения коронарной артерии человека оказывает положительное воздействие на окончательный результат лечения Поскольку в сайтах острых сосудистых нарушений происходит аккумуляция тромбоцитов, то генерация тромбина в этих сайтах может быть ответственна за активацию тромбоцитов и их оследующее накопление Как показано в последующих примерах, модифицированный Фактор VII настоящего изобретения способен связывать находящийся на поверхности клетки фактор ткани Например, DEGRФактор Vila связывает поверхностный фактор ткани с одинаковым или более высоким сродством, чем Фактор Vila дикого типа Однако DEGR-Фактор Vila не имеет ферментной активности, но связывается с фактором ткани и действует как конкурентный антагонист Фактора Vila дикого типа, тем самым ингибируя последующие этапы внешнего метаболического пути коагуляции, приводящие к генерации тромбина Молекулы модифицированного Фактора VII настоящего изобретения, поддерживающие связывание фактора ткани, подавляют аккумуляцию тромбоцитов в сайте сосудистого нарушения путем блокирования продукции тромбина и последующего отложения фибрина Благодаря способности DEGR-Фактора VII блокировать генерацию тромбина и ограничивать отложение тромбоцитов в сайте острого сосудистого нарушения, молекулы модифицированного Фактора VII, которые обладают активностью связывания фактора ткани, но лишены ферментной активности, могут использоваться для подавления сосудистого рестеноза Таким образом, составы и методы настоящего изобретения имеют широкую область применения Например, они полезны для предотвращения или подавления рестеноза, сопровождающего типично механическое вмешательство, проведенное с целью либо удаления, либо замены виновного в нарушении материала бляшки при лечении повреждений коронарных или перифирических сосудов, таких, которые сопутствуют и/или следуют за баллонной ангиопластикой, редукционной атерэктомией, установкой сосудистых стентов, лазерной терапией, иссечением распадающихся тканей и т п Соединения будут типично вводиться за 24 часа до вмешательства и в течение 7 дней и более после него Введение может проводиться разнообразными способами, как описано в дальнейшем Соединения настоящего изобретения могут также вводиться системно и местно при установке сосудистых имплантатов (например, покрытием искусственных или модифицированных природных имплантатов артериальных сосудов) в сайтах анастомоза, хирургической эндартерэктомии (ти 48149 20 пично для эндартерэктомии сонной артерии), шунтирования и т п Модифицированные Факторы VII и Vila находят также применение для подавления гиперплазии внутренней соудистой оболочки, раннего склероза и венозной окклюзии, связанной с трансплантацией органов, например, возникающей после трансплантации костного мозга При лечении установленного тромбоза глубоких вен и/или легочной эмболии ударная и поддерживающая дозы модифицированного Фактора VII в зависмости от веса пациента и тяжести заболевания изменяются в пределах от примерно 50мкг до 500мг/день, более типично 1 - 200мг/день и более предпочтительно 10 - 175мг/день для пациента весом 70кг Благодаря сниженной вероятности нежелательных кровотечений при инфузии Фактора VII, можно заменить им гепарин или снизить дозу гепарина в ходе или после хирургического вмешательства в сочетании с тромбэктомией или эмболэктомией Составы модифицированного Фактора VII настоящего изобретения очень полезны для предотвращения кардиогенной эмболии и в лечении тромботических ударов Благодаря малой вероятности нежелательных кровотечений и избирательности действия, модифицированный Фактор VII можно давать перенесшим удар, и он может предотвратить распространение закупоривающих артериальных тромбов Количество введенного модифицированного Фактора VII будет меняться для каждого пациента в зависимости от характера и тяжести удара, но дозы, в основном, будут находиться в пределах, предложенных ниже Фармацевтические составы модифицированного Фактора VII, включающие DEGR-Фактор VII и представленные здесь, окажутся полезными в лечении острого инфаркта миокарда, благодаря способности модифицированного Фактора VII подавлять коагуляцию in vivo Модифицированный Фактор VII может быть дан в качестве адъюванта с активатором тканевого плазминогена или стрептокиназой в период острой фазы инфаркта миокарда и может ускорить tPA-индуцированный тромболиз При остром инфаркте миокарда пациенту дается ударная доза, по крайней мере, от 50мкг до 500мг/день, более типично 1 - 200мг/день и более предпочтительно 10 - 175 мг/день для больного весом 70кг в качестве ударной и поддерживающей дозы Модифицированный Фактор VII дается до, в сочетании или вскоре после введения тромболитического агента, такого, как активатор тканевого плазминогена Модифицированный Фактор VII настоящего изобретения полезен в лечении коагулопатии потребления (DIC) и других проявлений, связанных с грам-отрицательной бактеремией Для пациентов с DIC характерны широко распространенные микроциркуляторные тромбы и частые острые кровотечения, которые возникают от истощения необходимых факторов свертывания Благодаря своей избирательности действия, модифицированный Фактор VII не будет, как традиционные коагулянты, осложнять кровотечения, связанные с DIC, но задержит или подавит образование дополнительных микроваскулярных фибриновых отложений Таким образом, модифицированный Фактор VII 21 48149 данного изобретения, включая DEGR-Фактор VII и DEGR-Фактор Vila, полезен для подавления отложений фибрина, связанных с эндотоксемией и эндотоксиновым шоком и, следовательно, смягчает эффекты, вызываемые грам-отрицательной бактеремией Показано, что DEGR-Фактор Vila у мышей проявляет дозозависимый эффект при блокировании отложений фибрина в почках и легких, а у бабуинов увеличивает выживаемость леченых животных В случае острой бактеремии, эндотоксемии или DIC пациенту дается ударная доза, по крайней мере, от примерно 50мкг до 500мг/день, более типично 1 - 200мг/день и более предпочтительно 10 - 175мг/день при весе пациента 70кг, после этого поддерживающие дозы в пределах от 50мкг до 500мг/день, типично 1 200мг/день при весе пациента 70кг Фармацевтические составы предназначены для парентерального, местного или локального введения при профилактической и/или терапевтической обработке Предпочтительнее фармацевтические составы вводить парентерально, т е внутривенно, а также подкожно или внутримышечно Таким образом, это изобретение обеспечивает составы для парентерального введения, которые включают раствор молекул модифицированного Фактора VII в приемлемом носителе, предпочтительно в водном Могут использоваться разнообразные водные носители, например, вода, забуференная вода, 0 4% физиологический раствор, 0 3% глицин и т п Молекулы модифицированного Фактора VII также могут быть заключены в липосому в качестве лекарственной формы для доставки в (или нацеливания на) сайты повреждения Липосомные препараты, в общем, описанные, например, B U S 4,837,028, US 4,501,728 и US 4,975,282, включенных здесь в виде ссылок Составы могут стерилизоваться стандартными, хорошо известными приемами Получаемые в результате водные растворы могут переноситься в упаковку для использования или фильтроваться в асептических условиях и лиофилизоваться, причем лиофилизованные препараты перед введением смешиваются со стерильным водным раствором Составы могут содержать фармацевтически приемлемые вспомогательные вещества для приближения к физиологическим условиям, такие, как поддерживающие рН и буферные агенты, поддерживающие тонус агенты и т п , например, ацетат натрия, лактат натрия, хлористый натрий, хлористый калий, хлористый кальций и т д Концентрация модифицированного Фактора VII в этих лекарственных формах может широко меняться, а именно, от менее чем 0 5%, обычно 1% или, по крайней мере, около того, до 15 - 20% по весу и будет выбираться прежде всего по объему жидкости, вязкости и т д в соответствии с особенностями выбранного способа введения Таким образом, типичный фармацевтический состав для внутривенного вливания мог бы содержать 250мл стерильного раствора Рингера и 10мг модифицированного Фактора VII Применяемые методы приготовления вводимых парентерально препаратов известны профессионалам и более детально описаны, например, в Ремингтонской фармацевтической науке, 16-ое издание, 22 Mack Publishing Company, Истон, Пенсильвания (1982), которая включена здесь в виде ссылки Составы, содержащие модифицированный Фактор VII, могут вводиться при профилактической и/или терапевтической обработке При терапевтическом применении составы вводятся больному, как описано выше, в количестве, достаточном для лечения или, по крайней мере, для того, чтобы остановить болезнь и ее осложнения Количество, адекватное достижению этого, определяется как "терапевтически эффективная доза" В этом случае эффективное количество зависит от тяжести заболевания или нарушения, а также от веса и общего состояния пациента, но обычно изменяется в пределах 0 05 - 500мг модифицированного Фактора VII в день для пациента весом 70кг, причем чаще используются дозы 1 200мг модифицированного Фактора VII в день Следует помнить, что материалы настоящего изобретения могут, как правило, использоваться при серьезных заболеваниях или нарушениях, т е в угрожающих жизни или потенциально угрожающих ситуациях В таких случаях, с учетом минимизации посторонних веществ и общим отсутствием иммуногенности модифицированного Фактора VII у человека, возможно и может считаться желательным введение пациенту врачом значительного избытка составов модифицированного Фактора VII При профилактическом применении составы, содержащие модифицированный Фактор VII, вводятся пациенту, восприимчивому к заболеванию, или при опасности заболевания или нарушения для того, чтобы усилить у пациента собственные антикоагулятивные возможности Такое количество определяется как "профилактически эффективная доза" При таком использовании точные количества снова зависят от состояния здоровья пациента и его веса, но, как правило, изменяются в пределах 0 5 - 500мг при весе пациента 70кг, более часто 1 - 200мг/70кг Можно проводить однократное или многократные введения составов с дозами и режимом, выбранным лечащим врачом Для амбулаторных пациентов, которым необходимы ежедневные поддерживающие дозы, модифицированный Фактор VII может быть введен, например, непрерывной инфузией с использованием портативного насоса Местная доставка модифицированного Фактора VII может быть осуществлена, например, путем перфузии, с помощью двойных баллонных катетеров, стентов, гидрогелей, используемых для покрытия баллоннных катетеров, или другими хорошо известными методами В любом случае фармацевтические лекарственные формы должны обеспечить количество модифицированного Фактора VII данного изобретения, достаточное для эффективного лечения пациента Пример 1 Экспрессия Фактора VII с мутацией Ser344 -> Ala344 Для того, чтобы генерировать Фактор VII с мутацией Ser344 -> Ala344 в активном центре плазмиду FVII(565 + 2463)/pDX (US Patent No 4,784,950, включенный здесь в виде ссылки, 23 48149 плазмида зарегистрирована в Американской коллекции типов культур под номером 40205) расщепляли с ХЬа I и Крп I с образованием фрагмента в 0 6 тысяч нуклеотидов, включающего кодирующую серин-344 область Этот фрагмент клонировали в ХЬа I, Крп 1-расщепленный М13тр19, как показано на фиг Эта процедура и последующие этапы, описанные ниже, обычно осуществляются в соответствии со стандартными протоколами (как описано, например, Maniatis et al , Молекулярное клонирование Лабораторное руководство, Cold Spring Harbor Laboratory Press, Колд-СпрингХарбор, Нью-Йорк (1982), включено здесь в видессылки) Мутагенез проводили на матрице М13 в соответствии с методами Золлера и Смита, см выше, используя мутагенный олигонуклеотид ZC1656 (5' TGG GCC ТСС GGC GTC ССС СТТ З1) и "универсальный" второй праймер ZC87 (5' ТСС CAG ТСА CGA CGT 3') Продукты реакции скринировали с использованием обработанного киназой ZC1656 Позитивные бляшки собирали, получали матричную ДНК и секвенировали от Pst І-сайта при 1077 до Крп І-сайта при 1213 Анализ последовательности подтвердил наличие желаемой мутации Мутантный клон обозначили 1656 Затем с использованием клона 1656 был сконструирован экспрессионный вектор Последовательность с внесенной мутацией выделяли из вектора М13 в виде фрагмента Pst I-Kpn I с 0 14 тыс нуклеотидов Этот фрагмент лигировали к фрагменту Hind Ill-Xba I с 1 7 тыс нуклеотидов из FVII (565 + 2463)/pDX, к фрагменту Xba I-Pst I с 0 5 тыс нуклеотидов из FV1I (565 + 2463)/pDX и фрагменту Крп I-Hmd 111 с 4 3 тыс нуклеотидов из FVII (565 + 2463)/pDX, как показано на фиг Присутствие желаемой мутантной последовательности подтверждали расщеплением мутантного клона и клона дикого типа с Pst I, вставкой мутантного Фактора VII в М13 с Крп b Xba I, получением саузерн-блотов расщепленной ДНК и зондированием блотов с радиоактивномеченным ZC1656 Клетки почек новорожденного хомяка линии ВНК 570 (зарегистрированные в Американской коллекции типов культур клеток под номером 10314) трансфицировали двумя изолятами (обозначенными #544 и #545) экспрессионного вектора 1656 Клетки получали разбавлением 1 10 клеток ВНК 570 в пяти Юсм-планшетах с неселективной средой (модифицированной средой Игла (DMFM), содержащей 10% эмбриональную бычью сыворотку и 1% смесь антибиотиков PSN (GIBCO Life Technologies, Гайтерсбург, Мэриленд) Через 24 часа, когда клетки достигли 20 - 30% слияния, их сотрансфицировали с одним изолятом экспрессионного вектора, кодирующего мутацию 1656, плазмидой р486 (включающей аденовирус 5 on, энхансер от SV40, основной поздний промотор аденовируса 2, лидерную последовательность аденовируса 2, сайты 5'- и З'-сплайсинга, DHFRrкДНК и сигнал полиаденилирования от SV40 в pML- 1 (Lusky and Botchan, Nature 293 79 - 81 (1981)) и Юмкг ДНК-носителя (фрагментированной под действием ультразвука ДНК спермы лося), как показано в Таблице 1 В пробирки на 15мл 24 вносили ДНК, затем добавляли 0 5мл буфера HEPES-2X (25г HTHTS, 40г NaCI, 1 8г Kcl, 0 75г дигидрата Na2HPO4, 5г декстрозы, разбавленные до объема 2 5л дистиллированной водой, с рН 6 95 - 7 0) и перемешивали В каждой пробирке осаждали ДНК добавлением 0 5мл 0 25М раствора хлористого кальция при барботировании воздуха через раствор ДНК в буфере HEPES с помощью пастеровской пипетки Пробирки встряхивали, инкубировали при комнатной температуре в течение 15 минут, снова встряхивали Смесь, содержащую ДНК, прибавляли по каплям с помощью пипетки в планшеты с клетками Планшеты встряхивали и инкубировали при 37°С в течение 4 - 6 часов После инкубации в каждый планшет добавляли 2мл 20% глицерина в смеси Tns-буфера и физиологического раствора (0 375г KCI, 0 71 г Na2HPO4, 8 1 г NaCI, 3 Or Tns-HCI, 0 5г сахарозы, разбавленные до общего объема 1л, с рН 7 9) Планшеты встряхивали и выдерживали 2 минуты при комнатной температуре Затем из планшетов удаляли среду, заменяли ее 2 мл смеси Tns-буфера с физиологическим раствором Планшеты выдерживали 2 минуты при комнатной температуре, затем смесь буфера и физиологического раствора заменяли 10мл неселективной среды Планшеты инкубировали при 37°С в течение двух дней Таблица 1 Трансфекция* Наименование Контроль Контроль 544 545 плазмиды 544 545 Клон 544 15мкл ... 15мкл ... Клон 545 ... ЗОмкл ... ЗОмкл р486 1 5мкл 1 5мкл ... ... ДНК-носитель 1 бмкл 1 бмкл 1 бмкл 1 бмкл * Использованы концентрации ДНК клон 544, 0 7мкг/мл, клон 545, 0 Змкг/мл, р486, 1 49мкг/мл После двухдневной инкубации клетки разбавляли селекционной средой (DMEM, содержащая 10% диализованную эмбриональную бычью сыворотку, 1% смесь антибиотиков PSN и 150нМ метотрексат) и с разбавлением 1 100, 1 250 и 1 500 помещали в макси-планшеты Планшеты инкубировали при 37°С в течение недели Через неделю среду удаляли и заменяли селекционной средой, в планшетах контролировали образование колоний Через восемь дней, после образования колоний, произвольно отбирали двенадцать колоний из планшетов с разведением 1 500 трансфекции изолятов #544 и #545 Каждый клон помещали в ячейку 6- ячеечного планшета и выращивали в селекционной среде Через 7 дней планшеты сливали, и каждый клон помещали в десятисантиметровый планшет с селекционной средой Клоны, описанные выше, и контрольные клетки, трансфицированные с целью экспрессии Фактора VII дикого типа, были метаболически помечены 358метионин-цистеиновой смесью для мечения белков (NEN Dupont Biotechnology Systems, Уилмингтон, Дэлавер) Клоны выращивали и подготавли 25 вали к эксперименту с импульсной меткой в селективной среде Клетки смывали смесью физиологический раствор-фосфатный буфер (Sigma, Сент-Луис, Миссури) и в течение 4 часов подвергали импульсу от 35S-Cys-35S-Met в 20мкКи/мл Через 4 часа собирали супернатант и клетки Клетки лизировали, в основном, как описано Lenk and Penman (Cell 16 289 - 302 (1979)), и 400мкл каждого лизата проверяли со стафилококком на безвредность (Sigma, Сент-Луис, Миссури) Образцы метаболически меченых клеток подвергали радиоиммунопреципитациии (RIP) инкубацией с бмкл политональной антисыворотки анти-Фактора VII в течение 4 часов К каждому образцу добавляли бОмкл промытого белка А стафилококка, и образцы встряхивали при 4°С в течение 1 5 часа Образцы центрифугировали, супернатант отделяли Осадки промывали дважды 0 7М буфером RIPA (ЮмМ Tns, pH 7 4, 1% дезоксихолевая кислота (Calbiochem Corp, ЛаДжолла, Калифорния), 1% Тритон Х-100, 0 1% SDS, 5мМ EDTA, 0 7М NaCI) и один раз 0 15М буфером RIPA (ЮмМ Tns, pH 7 4, 1% дезоксихолевая кислота (Calbiochem Corp , Ла- Джолла, Калифорния), 1% Тритон Х-100, 0 1% SDS, 5 мМ EDTA, 0 15 М NaCI) К каждому образцу добавляли краситель в ЮОмкл буфера SDSxi (50мМ Tns-HCI, pH 6 8, ЮОмМ дитиотреит, 2% SDS, 0 1% бромфенол синий, 10% глицерин), образцы кипятили в течение 5 минут, после чего центрифугировали, чтобы удалить белок А Прогоняли 50мкл каждого образца в полиакриламидном геле Результаты показали, что 9 из 10 клонов секретировали модифицированный Фактор VII Пример II Антикоагулянтная активность модифицированного Фактора VII Способность белка модифицированного Фактора VII подавлять свертывание крови измеряли в одностадийном анализе с использованием Фактора VII дикого типа в качестве контроля Рекомбинантные белки получали, в основном, так, как описано выше, из клеток, культивированных в среде, содержащей 5мкг/мл витамина К Различные количества модифицированного Фактора VII (из клона 544) или рекомбинантного Фактора VII дикого типа разбавляли 50мМ Tns-буфером с рН 7 5, 0 1% BSA до объема ЮОмкл Смеси инкубировали со ЮОмкл Фактор Vll-дефицитной плазмы (George King Bio-Medical Inc, Оверленд-Парк, Канзас) и 200мкл тромбопластина С (Dade, Майами, Флорида, содержит тромбопластин кроличьего мозга и 11 8мМ Са++) Анализ свертывания проводили в автоматическом таймере коагуляции (MLA Electra 800, Medical Laboratory Automation Inc , Плизантвилле, Нью-Йорк), время свертывания преобразовывали в единицу активности Фактора VII с использованием стандартной кривой, полученной для нормальной объединенной человеческой плазмы (с допущением, что она содержит одну единицу активности Фактора VII на мл, получена объединением обработанных цитратом сывороток от здоровых доноров) с разведением от 1 5 до 1 640 По этому методу препараты модифицированного Фактора VII не обладали детектируемой коагулянтной активностью Таблица 2 показывает 48149 26 результаты анализа, выраженные во времени свертывания, для контрольных (нетрансфицированных), кондиционных для клеток ВНК сред (+/витамин К), Фактора VII дикого типа и двух изолятов клеток, экспрессирующих модифицированный Фактор VII Активность Фактора VII представлена как уменьшение времени свертывания по сравнению с контрольными образцами Таблица 2 Образец Контроль +К Контроль -К Фактор VII дикого типа Модифицированный Фактор VII (#6) Модифицированный Фактор VII (#10) Разведение 1 1 1 1 1 1 1 5 10 5 10 20 40 80 Время свертывания (сек) 33 1 33 4 34 3 33 2 190 21 5 23 3 1 1 33 5 1 1 32 5 Для того, чтобы определить влияние модифицированного Фактора VII на субстраты фактора плазмы, препараты одифицированного Фактора VII и рекомбинантного Фактора VII дикого типа или нативного Фактора VII инкубировали либо с Фактором X, либо с Фактором IX, их активацию контролировали анализом свертывания или электрофорезом в полиакриламидном геле Пример III Способность модифицированного Фактора VII связывать фактор ткани Способность модифицированного Фактора VII конкурировать с Фактором VII дикого типа за фактор ткани и подавлять его вертывающую активность была оценена одностадийным анализом свертывания в присутствии лимитирующего количества фактора ткани (тромбопластина) Время свертывания определяли одностадийным анализом подобно тому, как описано в примере II В смешанных экспериментах использовали лимитированное количество фактора ткани, постоянное количество Фактора VII дикого типа и увеличивающиеся количества генетического варианта Фактора VII Подавление прокоагулянтной активности Фактора Vll/Vlla проявилось бы как увеличение времени свертывания в опытах с нарастающими количествами генетического варианта Фактора VII Величину активности Фактора VII в тестируемых образцах вычисляли в процентах по стандартной кривой, полученной на основе измерений активности Фактора VII в нормальной объединенной плазме Стандартную кривую активности Фактора VII получали с использованием серии разведении нормальной объединенной плазмы в фосфатном буфере (PBS) в пределах от 1 5 до 1 640 С этой целью было принято допущение о том, что нормальная плазма содержит приблизительно 500нг/мл Фактора VII, и это было принято 27 48149 за единицу аісгивности Смесь, состоящую из ЮОмкл Фаісгор Vll-дефицитной плазмы, ЮОмкл разведенной плазмы и 200мкл тромбопластина-С (Dade, Майами, Флорида), использовали для измерения времени свертывания с использованием автоматического таймера MLA Electra 800 Для получения стандартной кривой результаты представляли в графическом виде как процент активности (1 5 = 100% активности) против времени свертывания в секундах По условиям анализа было необходимо, чтобы в состав среды, содержащей дикий тип и вариант Фактора VII, входило не менее одного процен 28 та сыворотки Разведения в PBS были сделаны таким образом, чтобы падение времени свертывания происходило в соответствии со стандартной кривой Типичным было минимальное разведение 1 2 Окончательный объем составил ЮОмкл В экспериментах использовали два различных варианта человеческого Фактора VII с замещением Ser344 -> Ala, обозначенные как клоны "#10" и "#6" Результаты, приведенные в нижеследующей таблице, показывают, что, по мере увеличения количества варианта Фактора VII, снижался процент активности Фактора Vila Таблица 3 Результаты смешанного анализа с вариантами Ser344 -> Ala (среду В4А1 (дикий тип) использовали в качестве 100% активности при Юмкл на реакцию) Клон с замещением Ser344 -> Количество среды Количество среды Контроль* клет- % активности Ala варианта В4А1 ки ВНК FVIIa #10 Юмкл Юмкл 0 70 #10 20мкл Юмкл 0 51 #10 ЗОмкл Юмкл 0 43 #10 40мкл Юмкл 0 34 #10 50мкл Юмкл 0 28 #10 (-К)** 20мкл Юмкл 0 78 #6 Юмкл Юмкл 0 74 #6 20мкл Юмкл 0 56 #6 ЗОмкл Юмкл 0 46 #6 40мкл Юмкл 0 41 #6 50мкл Юмкл 0 32 #6(-К) 20мкл Юмкл 0 85 ВНК (контроль) 0 Юмкл 20мкл 91 ВНК (контроль) (-К) 0 Юмкл 20мкл 107 * Нетрансфицированная кондиционная среда ** Для экспрессии варианта Фактора VII клетки росли в присутствии витамина К, за исключением опытов, обозначенных "(-К)" Эксперименты показали, что Фактор VII с замещением Ser344 - > Ala конкурировал с нативным Фактором VII по дозозависимому профилю и ингибировал прокоагулянтную активность нативного Фактора Vll/Vlla Можно было заключить, что вариант человеческого Фактора VII с заменой Ser344 -> Ala конкурирует с нативным человеческим Фактором Vila и, следовательно, подавляет активацию Фактора X и/или IX в человеческой плазме Пример IV Реакция Фактора VII с РРАск Рекомбинантный Фактор VII был продуцирован в трансфицированных клетках почек новорожденного хомяка Белок очищали и активировали, как описано Thim (Biochemistry 27 7785 - 7793 (1988)), Bnnkons et al , (Proc Natl Acad Sci USA 86 1382 - 1386 (1989)) и Bjoern and Thim (Res DISCI N O 269, 564 (1986)), которые включены здесь в виде ссылок Клеточную среду собирали, фильтровали и разбавляли, чтобы снизить концентрацию солей Затем разбавленную среду фракционировали анионообменной хроматографией, используя для элюции буфер, содержащий хлористый кальций Фракцию, содержащую Фактор VII, собирали и затем очищали иммунохрома тографией с использованием моноклонального антитела к кальций-зависимому антифактору VII Дополнительную очистку проводили, используя двукратно анионообменную хроматографию, в ходе которой Фактор VII элюировали соответственно растворами хлористого кальция и хлористого натрия Фактор Vila получали в последнем элюате Рекомбинантный Фактор Vila (1мкМ) в 50мМ Tns-HCI, ЮОмМ хлористом натрии и 5мМ хлористом кальции, с рН 7 4 инкубировали с 20мкМ РРАск (D-Фенилаланил-Пролил-Аргинилхлорметилкетон, Calbiochem, Ла-Джолла, Калифорния) в течение 5, 20 и 60 минут Затем добавляли буфер, содержащий хромогенный субстрат S-2288 (п-нитроанилид О-изолейцил-І_-пролил-І_аргинина, Kabi Vitrum АВ, Молндал, Швеция) для того, чтобы получить 2 5-кратное разведение и конечную концентрацию 0 ЗмМ для S-2288 Измеряли выделение п- нитроанилина и сопоставляли с результатом, полученным с необработанным Фактором Vila в качестве контроля Полученные данные указывают на то, что в изученных условиях Фактор Vila инактивируется полностью через приблизительно 60 минут Пример V 29 48149 Генерирование DEGR-Фаісгора Vila Рекомбинантный человеческий Фактор Vila был получен, как описано в Примере IV Рекомбинантный человеческий Фактор Vila в ЮмМ глициновом буфере с рН 8 0, ЮмМ хлористом кальции и 50мМ хлористом натрии разбавляли до концентрации 1 5 мг/мл К Фактору Vila прибавляли 10кратный избыток Dansyl-L-Glu-Gly-Arg- хлорметилкетона (Calbiochem, Ла-Джолла, Калифорния 92037), который был растворен в дистиллированной воде После двухчасовой инкубации при 37°С к смеси добавляли второй 10-кратный молярный избыток DEGRck и инкубировали еще 2 часа при 37°С Затем к Фактору Vila прибавляли третий 10кратный молярный избыток DEGRck и инкубировали приблизительно 16 часов при 4°С Для удаления свободного DEGRck образец DEGRФактора VII тщательно диализовали против Tnsзабуференного физиологического раствора (0 05М Tns-HCI, 0 М NaCI, рН 7 5) при 4°С Введением свободного DEGRck в смесь, содержащую Фактор Ха, получена стандартная кривая для измерения количества свободного DEGRck в растворе по мере ингибирования хромогенной активности Фактора Ха Анализ смеси с DEGR-Фактором Vila показал, что после экстенсивного диализа отношение свободного DEGRck к DEGR-Фактору Vila составило менее 0 5%, тем самым подтверждая, что ингибирование, наблюдаемое для DEGRФактора Vila в различных тест-системах, приведенных ниже, не связано с присутствием свободного DEGRck Пример VI Генерация Фактора Ха на клетках крысиной гладкой мышцы Клетки сосудистой гладкой мышцы были проанализированы на наличие поверхностного фактора измерением способности клеток стимулировать превращение Фактора X в Фактор Ха с использованием специфичного для Фактора Ха хромогенного субстрата Клетки крысиной сосудистой гладкой мышцы (Clowes et al , J Chn Invest 93 644 - 561 (1994)) помещали в 96-ячеечные планшеты (American Scientific Products, Чикаго, Иллинойс), 8000 клеток на ячейку в ростовой среде (Табл 4) Таблица 4 модифицированной среды Игла (DMEM) (GIBCO-BRL, Гейтерсбург, 500мл Мэриленд) 10% эмбриональная телячья сыворотка (Hyclone, Логан, Юта) пируват натрия (Irvine, Санта-Ане, 1мМ Калифорния) L-глутамина (Hazelton, Ленекса, Канзас) 1 х PSN, (100 х = 5мг/мл пени- 0 29 м г/мл циллина стрептомицина 5 м г/мл неомицина (GIBCO-BRL, Гейтерсбург, 10м г/мл Мэриленд) Через 48 часов инкубации при 37°С среду заменяли на сывороточную свободную среду (Таблица 5) 30 Таблица 5 модифицированной среды Игла 250мл (DMEM) среды Ham's F-12 (Fred Hutchinson Cancer Research Center, Сиэтл, Ва- 250мл шингтон) пируват натрия 1мМ L-глутамина 29 м г/мл трансферрин (JRH, Ленекса, Канзас) 20мкМ инсулин (GIBCO-BRL) 5мкМ селена (Aldnch, Мильвоки, Висконсин) 16нг бычьего сывороточного альбумина 1 мг/мл (Sigma, Сент-Луис, Миссури) Клетки инкубировали 72 часа при 37°С После инкубации к клеткам добавляли или Юнг/мл PDGF-BB (человеческого рекомбинантного фактора роста тромбоцитов), или 10% эмбриональную телячью сыворотку для стимуляции экспрессии фактора ткани (Taubman et al , J Chn Invest 91 547 - 552 (1993)) В параллельную серию клеток не добавляли ни PDGF, ни сыворотку для того, чтобы контролировать подлинную активность нести мули рованных клеток После 6-часовой инкубации к клеткам прибавляли рекомбинантный человеческий Фактор Vila с окончательной концентрацией ЮнМ Одна серия клеток не получала Фактор Vila в качестве отрицательного контроля Клетки инкубировали 2 часа при 37°С, промывали буфером HEPES (ЮмМ HEPES, 137мМ NaCI, 5мМ CaCI2, 11мМ глюкоза, 0 1% BSA) После промывания клетки инкубировали 5 минут с 50мкл на ячейку 200нМ очищенного Фактора X плазмы человека в Tns-забуференном физиологическом растворе с 5мМ СаСІ2 В каждую ячейку добавляли 25мкл 0 5М EDTA и 25мкл 800мкМ раствора хромогенного субстрата S-2222 (Kabi Pharmacia, Франклин, Огайо) Планшеты инкубировали 40 минут при комнатной температуре, затем анализировали при 405нм с использованием прибора THERMOMAX (Molecular Services, Менло-Парк, Калифорния) Таблица 6 показывает увеличение поглощения для ячеек, обработанных Фактором Vila, по сравнению с контрольными ячейками (без добавления Фактора VII) Увеличение поглощения является прямым измерением уровня Фактора Ха, генерированного в ячейках, и последующего расщепления им хромогенного субстрата, высвобождающего хромофор Эти данные демонстрируют также, что уровень хромогенной активности в клетках, предварительно обработанных или PDGF-BB, или 10% эмбриональной телячьей сывороткой (FCS), был выше, чем в нестимулированных клетках Таблица 6 Тестируемый образец Контроль Без стимуляции PDGF-BB 10% PCS OD405 043 247 360 342 31 48149 Эти результаты отчетливо показывают, что на поверхности клеток крысиной сосудистой гладкой мышцы наблюдается Фактор Vila-зависимая активация Фактора X в Фактор Ха Пример VII Ингибирование поверхностноклеточной хромогенной активности DEGR-Фактором Vila Клетки крысиной сосудиситой гладкой мышцы помещали в планшеты с 96 ячейками, как описано выше Клетки культивировали в течение 72 часов в бессывороточной среде, как описано выше, затем обрабатывали 10% эмбриональной телячьей сывороткой в течение 6 часов для стимуляции экспрессии фактора ткани После стимуляции в каждую ячейку добавляли только буфер (контроль), ЮнМ Фактор Vila или ЮнМ Фактор Vila + ЮОнМ DEGR-Фактор Vila Клетки инкубировали 2 часа при 37°С, затем промывали буфером HEPES После промывания клетки инкубировали в течение 5 минут с 50мкл на ячейку 200нМ Фактора X в Tns-забуференном физиологическом растворе с добавкой 5мМ хлористого кальция В каждую ячейку прибавляли 25мкл 0 5М EDTA и 25мкл хромогенного субстрата S-2222 (80мкМ) Клетки инкубировали при комнатной температуре в течение 40 минут Хромогенную активность анализировали при 405нм, как описано выше Таблица 7 показывает хромогенную активность в ячейках, обработанных только Фактором Vila, и торможение стимуляции, когда DEGRФактор Vila соинкубировали с Фактором Vila Эти результаты демонстрируют, что DEGR-Фактор Vila действует как конкурентный антагонист связывания Фактора Vila, тем самым подавляя активацию Фактора X в Фактор Ха и последующее расщепление хромогена S-2222 Таблица 7 Тестируемый образец Контроль Фактор Vila Фактор Vila + DEGR-Фактор Vila OD405 035 342 073 Пример VIII Дозозависимое ингибирование DEGRФактором Vila поверхностной хромогенной активности на клетках крысиной гладкой мышцы Клетки крысиной сосудистой гладкой мышцы помещали в планшеты с 96 ячейками при 4000 клеток на ячейку в ростовой среде с добавкой 1% эмбриональной телячьей сыворотки (как в Таблице 4, но без 10% эмбриональной телячьей сыворотки) Через 5 дней среду удаляли и к клеткам прибавляли или возрастающие концентрации только Фактора Vila, или ЮнМ Фактор Vila с возрастающими концентрациями DEGR-Фактора Vila Клетки инкубировали в течение часов при 37°С После инкубации клетки промывали, затем инкубировали с 50мкл 200нМ Фактора X в Tnsзабуференном физиологическом растворе в течение 5 минут при комнатной температуре В каждую ячейку добавляли 25мкл 0 5 М EDTA и 25мкл 800мкМ S-2222 (Kabi Pharmacia), планшеты инкубировали 40 минут при комнатной температуре Хромогенную активность анализировали при 32 405нм со считывающим устройством для икропланшетов, как описано выше Таблица 8 показывает дозозависимое повышение хромогенной активности по мере увеличения количеств Фактора Vila, добавленных в ячейки При добавлении в клетки смеси DEGR-Фактора Vila и ЮОнМ Фактора Vila (Таблица 9) наблюдалось дозозависимое ингибирование хромогенной активности При молярном соотношении DEGRФактора Vila к Фактору Vila, равном 1 1, ингибировалось приблизительно 95% хромогенной активности Эти данные позволяют предположить, что в этом эксперименте, в культуре клеток гладкой мышцы у DEGR- Фактора Vila было значительно более высокое сродство к поверхностному фактору ткани, чем у нативного Фактора Vila Если бы DEGR-Фактор Vila и Фактор Vila имели равное сродство к фактору ткани, то в том случае, когда две молекулы были добавлены к клеткам в равном молярном соотношении, уровень наблюдаемого ингибирования не был бы таким высоким Таблица 8 Концентрация Фактора Vila (нМ) 10 39 1 56 6 25 25 00 100 00 OD405 005 025 058 111 154 208 Таблица 9 показывает дозозависимое ингибирование DEGR-Фактором Vila хромогенной активности Фактора Ха на клетках крысиной гладкой мышцы Увеличивающие концентрации DEGRФактором Vila соинкубировали с ЮнМ Фактором Vila, хромогенную активность Фактора Ха определяли с использованием хромогенного субстрата S2222 Таблица 9 Концентрация Фактора Vila (нМ) 10 39 1 56 6 25 25 00 100 00 OD405 208 176 116 073 026 014 Пример IX Ингибирование образования Фактора Ха DEGR-Фактором Vila в анализе растворимого фактора ткани Превращение Фактора X в Фактор Ха с использованием очищенного рекомбинантного раствора фактора ткани установлено с помощью хромогенного анализа Фактор ткани был экспрессирован и выделен из Saccharomycec cerevisae (Shigemateu et al , J Biol Chem 267 21329 21337 (1992)) Растворимый фактор ткани был очищен и охарактеризован д-ром W Kisiel (Уни 33 48149 верситет Нью- ексимо) Реакционная смесь содержала 65,9мкл растворимого фактора ткани (2 2мкМ) 29 0мкл PCPS (1мМ, Sigma, Сент- Луис, Миссури), 29 5мкл человеческого Фактора X (4 1 мкМ), 2 77мл буфера Хенкса (25мМ Tns pH 7 4, 150мМ NaCI, 2 7мМ КСІ, 5мМ СаСІ2, О 1% BSA) В каждую из 96 ячеек планшета добавляли 40мкл смеси фактора ткани и Фактора X, 25мкл Фактора Vila, разведенного TBS, и 25мкл DEGR-Фактором Vila, разведенного TBS Для контроля использовали 40мкл смеси фактора ткани и Фактора X, контроль включал 40мкл смеси фактора ткани и Фактора X, 20мкл Фактора Vila, разбавленного TBS, и 25мкл только TBS К реакционной смеси в ячейки добавляли Юмкл хромогенного субстрата S-2222 (4мМ), смесь инкубировали 2 - 1 0 минут при комнатной температуре Результаты анализировали при 405 нм со считывающим устройством для микропланшетов, как описано выше Стандартная кривая получена с использованием возрастающих концентраций Фактора Vila, добавленного в отсутствие DEGR- Фактора Vila Результаты, представленные в Таблице 10, показывают, что существует дозозависимое усиление хромогеннои активности по мере увеличения количества Фактора Vila, добавленного к реационной смеси Одновременное добавление изменяющихся количеств DEGR-Фактора Vila и ЮОнМ Фактора Vila привело к понижению хромогеннои активности (Таблица 11) Эти данные демонстрируют, что DEGR-Фактор Vila действует как конкурентный антагонист связывания нативного Фактора Vila с растворимым фактором ткани, тем самым ингибируя образование Фактора Ха, что определяется по снижению хромогеннои активности по отношению к хромогенному субстрату S-2222 Таблица 10 Стимуляция хромогеннои активности Фактора Ха возрастающими концентрациями Фактора Vila, добавленного к растворимому фактору ткани Изменение оптической плотности измерено с использованием хромогенного субстрата S-2222 Таблица 10 Концентрация Фактора Vila (нМ) 78 1 56 312 6 25 12 50 25 00 50 00 100 00 OD405 168 288 478 694 764 790 438 770 Таблица 11 Подавление хромогеннои активности Фактора Ха при добавлении DEGR-Фактора Vila к растворимому фактору ткани в присутствии нативного Фактора Vila Изменение оптической плотности измерено с использованием хромогенного субстрата S-2222 34 Таблица 11 Концентрация Фактора Vila (нМ) 0 50 100 200 400 800 1600 OD405 810 750 609 296 167 083 055 Пример X Подавление коагуляции DEGR-Фактором Vila Стандартные анализы свертывания с целью изучения влияния DEGR-Фактора VII на время свертывания проводили следующим образом ЮОмкл нормальной плазмы бабуина, полученной обработкой с цитратом натрия в качестве антикоагулянта, добавляли к ЮОмкл возрастающих концентраций DEGR-Фактора Vila, разведенного TBS (20мМ Tns, pH 7 4 и 150мМ NaCI) Образцы смешивали и недолго инкубировали при 37°С Затем добавляли к автоматическому счетчику времени коагуляции Electra 800 (Medical Laboratories Automation, Плизантвилле, Нью-Йорк) После инкубации 200мкл препарата фактора ткани, содержащего 20мМ хлористый кальций, добавляли к препаратам DEGR-Фактора Vila Препарат фактора ткани готовили в виде экстракта свежезамороженной мозговой ткани бабуина в физиологическом растворе и характеризовали по способности инициировать коагуляцию плазмы бабуина Была выбрана концентрация фактора ткани, которая обеспечивала время свертывания порядка 40 секунд Данные, представленные в Таблице 12, демонстрируют дозозависимое увеличение времени при добавлении DEGR-Фактора Vila Такая низкая доза, как 1мкг/мл, вызывала значительное увеличение времени свертывания Таблица 12 Дозозависимое увеличение времени свертывания в присутствии DEGR-Фактора Vila DEGR-Фактора Vila (мкг/мл плазмы) 0 05 10 25 50 100 Время свертывания (секунды) 40 7 46 2 50 8 64 5 108 1 158 4 Пример XI Подавление накопления тромбоцитов DEGRФактором Vila Исследована способность DEGRФактора Vila подавлять накопление тромбоцитов в сайтах артериального тромбоза при механическом повреждении у нечеловеческих приматов Использовали модель эндартерэктомии аорты у бабуинов, в основном, как описано Lumsden et al , Blood 81 1762 - 1770 (1993) Часть артерии бабуина длиной 1 - 2см удаляли, инвертировали и выскаб 35 ливали для удаления внутренней и примерно 50% средней оболочки Артерию вновь инвертировали, канюлировали по обоим концам и помещали в экстракорпоральный шунт бабуина, тем самым освобождая посредством шунта механически поврежденную артерию бабуина от тока крови Перед пуском крови через шунт животному впрыскивали внутривенно собственные тромбоциты, меченные 111ІП Уровень накопления тромбоцитов в поврежденной артерии определяли с помощью видеомонитора гамма-камеры В исследовании способности DEGR-Фактора Vila ингибировать накопление тромбоцитов применяли струйное введение DEGR- Фактора Vila или физиологического раствора в качестве контроля, которые проводили перед открытием шунта Измерения поврежденных артерий проводили непрерывно в течение 60 минут DEGR-Фактор Vila в дозе 0 005мг/кг ингибировал накопление тромбоцитов При струйном введении 1мг/кг подавление накопления тромбоцитов составило примерно 90% через 1 час после введения препарата Эти результаты представлены на фиг 2 Пример XII DEGR-Фактор Vila подавляет сосудистый рестеноз, возникающий после баллонной ангиопластики у кроликов с атеросклерозом Исследована способность DEGR-FVIIa модулировать развитие патологических изменений после баллонной ангиопластики у кроликов породы Новозеландская белая (NZW) с атеросклерозом Эта модель хорошо охарактеризована и считается подходящей для оценки действия соединений с антитромботическими свойствами на развитие сосудистых нарушений Gimple et al , Circulation 86 1536 - 1546 (1992), Rogosta et al , Circulation 89 1262 - 1271 (1994)}) Животная модель, использованная для оценки DEGR-FVIIa, в основном, такая, как описанная Rogosta, там же Анестезию кроликам проводили внутримышечной инъекцией 5мг/кг ксилазина и 35мг/кг кетамина Проксимальные бедренные артерии подвергали веносекции ниже паховой связки с наложением проксимальной и дистальной лигатуры Выделенные сегменты канюлировали с иглами 27 размера Выходные отверстия создавали проколом иглы Выделенные сегменты промывали физиологическим раствором от оставшейся крови, сушили воздухом, пропускаемым со скоростью 80мл/мин в течение 8 минут После высушивания воздухом выделенные сегменты снова промывали физиологическим раствором и удаляли лигатуры Гемостаз поддерживали необтурирующим местным давлением Сегменты ограничивали металлическими зажимами Локальный спазм снимали местной обработкой 1% ксилокаином На следующий день после операции животных переводили на диету, включающую 1% холестерин и 6% масло земляного ореха, на один месяц до баллонной ангиопластики Для снятия постоперационной боли давали 10 мг/кгтиленола перорально в течение 3 - 5 дней После хирургической процедуры давали 1см3 амбипена в течение 3 - 5 дней Доставка тестируемого препарата животным включала начальное струйное введение непо 36 средственно перед баллонной ангиопластикой, сопровождаемое непрерывной системной инфузией через внутреннюю шейную вену с использованием осмотического насоса Продолжительность инфузии препарата составила 3 суток Контрольные животные получали 150 МЕ/кг гепарина струйно до баллонной ангиопластики, затем следовала инфузия физиологического раствора Животным, получавшим DEGR-FVIIa, провод ид и струйное введение с дозой 1мг/кг, сопровождавшееся инфузией 50мкг/кг/час При установке осмотических насосов для непрерывной системной инфузии у животных проводили анестезию, как описано выше, и поддерживали ее в течение всей процедуры дополнительными 1М инъекциями кетамина и ксилазина Через разрез вдоль средней линии шеи выделяли отслаиванием правую внутреннюю шейную вену, дистальный конец лигировали Силиконовую трубку (РЕ-160) вводили в правую внутреннюю шейную вену Подкожный тоннель был создан для прохода силиконовой трубки Эту трубку соединяли с осмотическим насосом Осмотический насос имплантировали подкожно на спине у кролика Правую общую сонную артерию выделяли отслаиванием, дистальный конец лигировали Посредством сосудистого скальпеля устанавливали интубатор 5F и перемещали его до соединения с дугой аорты Кровь брали для определения гемостатических параметров, содержания препаратов и холестерина Внутриартериально впрыскивали 20мг ксилокаина Контрольную ангиографию шейной артерии проводили посредством катетера Бермана 5F, расположенного под аортальным разветвлением с использованием 3 4мл ренографина, введенного вручную через 3 секунды 48149 После удаления катетера Бермана в нисходящую аорту вводили 0 014-дюймовый проволочный направитель и располагали его над аортальным разветвлением Под рентгеноскопическим контролем вводили баллонный катетер для ангиопластики соответствующего размера от 2 0 до 2 5мм, продвигали его над проволочным направителем и вводили в стеноз Баллон накачивали до батм в течение 60 секунд вручную Проводили три накачивания с интервалами в 60 секунд Эту процедуру выполняли в обеих бедренных артериях у каждого животного После баллонной дилатации ангиопластический катетер извлекали и снова вводили катетер Бермана в положение 3 см над аортальным разветвлением Для уменьшения спазма внутриартериально вводили 20мг лидокаина Постоперационная ангиограмма была получена, как описано выше Растр (1см) располагали на уровне бедренной артерии для того, чтобы рассчитать фактический диаметр Затем удаляли катетер Правую сонную артерию лигировали шелком 3 - 0, рану ушивали послойно Амбипен и ацетаминофен давали, как описано выше Протромбиновое время и концентрацию DEGR-FVIIa в крови определяли непосредственно перед струйным введением препарата, через 1 час после струйного введения и через 3 суток в конце непрерывного введения Получали 1 - 2мл 37 48149 обработанной цитратом плазмы и определяли протромбиновое время и уровни антигена Стандартный анализ свертывания использовали для того, чтобы контролировать протромбиновое время у контрольных и обработанных DEGR-FVIIa животных следующим образом 25мкл тестируемой плазмы кролика, обработанной цитратом натрия в качестве анти коагулянта, добавляли к 150мкп TBS (20мМ Tns, pH 7 4, 150мМ NaCI) Образцы перемешивали и присоединены к автоматическому коагуляционному таймеру Electra 800 (Medical Laboratories Automation, Плизантвилле, Нбю-Йорк) После инкубации к плазме добавляли 200мкл препарата тромбопластина (Sigma Chemical), содержащего 25мМ хлористый кальций Выбирали концентрацию тромбопластина, при которой время свертывания контрольной кроличьей плазмы составило примерно 20 секунд Метод ELISA (иммуноферментный анализ) использовали для определения концентрации DEGR-FVIIa в образцах плазмы контрольных и обработанных DEGR-FVIIa кроликов Анализ включал разведение моноклонального антитела к человеческому анти-FVII (Dr W Kisiel, Университет Нью-Мексико) до 20мкг/мл в 0 1 М карбонатном буфере , рН 9 6 и добавление ЮОмкл на ячейку в планшеты с 96 ячейками Затем планшеты инкубировали при 4°С в течение ночи, после чего промывали дважды водным буфером (PBS, рН 7 4, содержащий 0 05% Tween 20) Подавление неспецифических сайтов связывания достигали при использовании 200мкл блокирующего буфера на ячейку (PBS, рН 7 4, содержащий 0 05% Tween 20 и 1% DSA), инкубации при 37°С в течение 2 часов и последующей обработки промывным буфером После блокирования добавляли серию стандартных разведений DEGR-FVIIa, изменяющихся в пределах 20 - 0 027нГ/мл, наряду с серией разведении тестируемой кроличьей плазмы (1 100 до 1 4000 в блокирующем буфере) по ЮОмкл на ячейку В качестве отрицательного контроля использовали плазму неиммунизированных кроликов Затем планшеты инкубировали в течение 1 часа при 37°С, после чего обрабатывали промывным буфером Определяли DEGR-FVIIa добавлением ЮОмкл на ячейку разбавленного 1 1000 кроличьего политонального антитела к человеческому антиFVII (Dr Kisiel, Университет Нью-Мексико) в блокирующем буфере Планшеты инкубировали 1ч при 37°С, затем пятикратно обрабатывали промывным буфером Специфическое связывание антитела определяли с использованием ЮОмкл на ячейку разведения 1 2000 конъюгата козье антитело к кроличьему IgG - пероксидаза (Тадо, Inc) Планшеты инкубировали 1ч при 37°С и шестикратно обрабатывали промывным буфером В заключение добавляли ЮОмкл раствора субстрата (0 42мг/мл дигидрохлорида о- фенилендиамина (OPD) в 0 2М цитратном буфере с рН 5 0, содержащем 0 3% перекись водорода) Через 1 - 3 минуты при комнатной температуре цветную реакцию останавливали добавлением 1ООмкл на ячейку 1 н серной кислоты и содержимое планшетов анализировали при 490нм с использованием 38 микропланшетного спектрофотометра Концентрации DEGR-FVIIa в образцах плазмы определяли сопоставлением получаемых значений А490 со значениями стандартной кривой для DEGR-FVIIa Результаты анализа образцов плазмы на протромбиновое время и уровни антигена DEGRFVIIa приведены в Таблице 13 и Таблице 14, соответственно Данные представлены для каждого животного в отдельности В Таблице 15 приведена сводка средних величин времени свертывания Во всех случаях обработанные с DEGR-FVIIa животные имели повышенное значение протромбинового времени в точке, соответствующей 1 часу после струйного введения, в точке, соответствующей третьему постоперационному дню, оно почти достигало уровней предварительной обработки Анализ антигена DEGR-FVIIa также выявил его высокий уровень в точке, соответствующей 1 часу, изменяющийся в пределах 2 - бмкг/мл, и уровни намного ниже в точке, соответствующей третьему дню Уровни DEGR-FVIIa, измеренные через 1 час, соответствовали предполагаемому повышению протромбинового времени, установленному обработкой нормальной кроличьей плазмы с DEGRFVIIa in vitro и определением протромбинового времени анализом стандартного разведения тромбопластина Таблица 13 Измерение протромбинового времени Число животных Обработ-ка 73 74 75 76 169 170 173 174 77 78 80 96 97 171 172 N/A- нет Контроль Контроль Контроль Контроль Контроль Контроль Контроль Контроль DEGR-FVIIa DEGR-FVIIa DEGR-FVIIa DEGR-FVIIa DEGR-FVIIa DEGR-FVIIa DEGR-FVIIa данных Предвари- Время свертытельная вания (секунды) обработка 1 час 3 дня 24 8 22 3 178 24 8 27 9 186 24 6 N/D 20 5 22 N/D 179 21 2 22 9 22 24 9 23 5 186 25 9 21 20 8 25 29 4 20 1 22 5 40 1 183 24 3 34 20 9 24 7 50 21 7 N/A N/A 21 23 6 33 3 21 2 20 6 45 8 21 9 23 5 41 6 22 4 Таблица 14 DEGR-FVIIa в кроличьей плазме методом Число животных Обработка Предварительная обработка 74 75 76 169 170 173 174 77 78 Контроль Контроль Контроль Контроль Контроль Контроль Контроль DEGR-FVIIa DEGR-FVIIa 36 0 0 0 0 36 87 0 1 ELISA FVIIa (нг/мл) 1 час 3 дня 14 N/A N/A 0 0 31 86 3,210 4,950 4 9 14 1 0 0 160 102 7 39 DEGR-FVIIa DEGR-FVIIa DEGR-FVIIa 80 96 97 48149 13 65 4 4,543 4,900 4,600 661 117 502 171 172 DEGR-FVIIa DEGR-FVIIa N/A- нет данных 40 13 9 2,145 2,830 212 228 Таблица 15 Статистическая обработка значений времени свертывания плазмы Непарный t-тест Х До DF 12 Группа Контроль DEGR-Vlla Непарный t-тест Х DF 10 Группа Контроль DEGR-Vlla Непарный t-тест Х DF 13 Группа Контроль DEGR-Vlla Счет 8 6 Непарное значение t 1 12 Среднее Станд откл 24 15 1 64 23 2 1 48 Вероятность (2-сторонний тест) 2852 Станд ошибка 58 6 1 час после Непарное значение t Вероятность -5 44 (2-сторонний тест) 0003 Счет Среднее Станд откл Станд ошибка 6 24 5 3 35 1 37 6 40 8 6 53 2 67 3 дня после Вероятность (2-сторонний тест) 0622 Непарное значение t -2 04 Счет Среднее Станд откл Станд ошибка 8 19 54 1 53 54 7 21 06 1 33 5 Через три недели после ангиопластики непосредственно перед умерщвлением повторяли контрольную ангиограмму, как описано выше, используя левую сонную артерию Через вертикальный абдоминальный разрез изолировали дистальную аорту и вставляли перфузионную канюлю над аортальным разветвлением Дистальную аорту промывали 50мл физиологического раствора, затем фиксировали in vivo введением в течение 15 минут при 120мм рт ст 500мл раствора Histochoice (AMRESCO, Солон, Огайо) Как только начиналась перфузия, животных умертвляли сверхдозой нембутала (Змл (65мг/мл) раствора пентобарбитала внутривенно) Сегмент (5см) бедренной артерии иссекали билатерально Для оптической микроскопии ткань сохраняли в растворе Histochoice Для того, чтобы обнаружить появление повреждения в сайте баллонной ангиопластики, из иссеченных бедренных артерий вырезали Змм срезы, заливали парафином, брали срезы областей артерии с множественными поражениями Готовили препараты срезов на предметных стеклах, окрашивали гематоксилином, эозином и красителем Van Giemson С использованием программы Биоквант проводили морфометрический анализ для получения данных о просвете, внутренней и средней оболочке артерий С помощью морфометрического анализа срезов от поврежденных артерий проводили измерения всей площади просвета, площади внутренней оболочки, полученной измерением области во внутреннем эластическом слое и вычитанием соответствующей площади просвета каждого среза, площади средней оболочки, определенной измерением области внутри внешнего эластического слоя и вычитанием площади внутри внутреннего эласти ческого слоя Измерения повреждений внутренней оболочки (интимы) бедренных артерий у контрольных и обработанных DEGR-FVIIa животных показали, что наблюдалось значительное снижение размера интимы у животных, обработанных DEGR-FVIIa (Таблица 16) В противоположность этому, измерения медиальной области не выявили заметных отличий между этими двумя группами Таблица 16 Измерение внутренней и средней оболочки у кроликов после баллонной ангиопластики Группа Контроль DEGRFVIIa Группа Контроль DEGRFVIIa Количество Интима (мм2) Станд откл 13 0 819 0 438 0 414 0 192 10 Количество Средняя (мм2) 13 10 0 389 0 329 Станд откл 0 098 0 105 Вероятность (2сторонний тест) 0 0138 Вероятность (2сторонний тест) 0 172 Данные ангиографических измерений представлены в Таблице 17 в виде значений среднего светового диаметра (среднего диаметра просвета] (MLD) +/- стандартное отклонение для контрольных и обработанных DEGR-FVIIa животных для всех трех временных точек непосредственно перед ангиопластикой, сразу после и через 21 день после ангиопластики Не отмечено значительных различий в значениях MLD между контрольными v 41 48149 обработанными DEGR-FVIIa животными ни до, ни сразу после ангиопластики, Однако, заметное повышение значения MLD наблюдалось у животных, обработанных DEGR-FVIIa, на 21-ый день после ангиопластики Таблица 17 Измерение среднего светового диаметра (MLD) Измерение Количество Контроль 13 DEGR10 FVIIa Измерение Группа Группа Контроль DEGRFVIIa Группа Контроль DEGRFVIIa MLD перед ангиопластикой Станд Вероятность(2MLD откл сторонний тест) 1 202 0 24 0 3883 1 283 019 MLD после ангиопластикой Вероятность КолиСтанд MLD (2-сторонний чество откл тест) 13 1 492 0 551 0 5326 10 1 323 0 725 Измерение MLD через 21 день Вероятность Станд MLD (2-сторонний откл тест) 13 0 889 0 228 0 0001 Количество 10 1 393 0 242 Пример XIII Подавление DEGR-Фактором Vila генерации поверхностного Фактора X на SMCs бабуина Проведен поверхностноклеточный хромогенный анализ, в основном, как описано выше в Примере VIII, для определения эффективности DEGRFVIIa в подавлении связывания FVIIa с поверхностноклеточным фактором ткани и последующего превращения Фактора X в Фактор Ха на монослойных клетках гладкой мышцы (SMCs) бабуина Метод является модификацией методик, описанных Sakai et al , J Biol Chem 264 9980 - 9988 (1989), Wildgoose et al , Proc Nati Acad Sci USA 87 7290-7294(1990) Бабуиновые SMCs получали из Университета Вашингтона (Сиэтл, Вашингтон) и культивировали из имплантатов аорты Бабуиновые SMCs вносили в культуральные чашки с 96 ячейками в концентрации 8000 клеток на ячейку в 200мкл на ячейку среды DMEM с добавкой 10% эмбриональной телячьей сыворотки и выдерживали в этой среде в течение 4 дней при 37°С в атмосфере 5% СО2 При анализе удаляли 110мкл культуральной среды и в ячейки добавляли возрастающие концентрации FVIIa в комбинации с DEGR-FVIIa Была получена стандартная кривая для концентрации FVIIa, изменяющейся в пределах 5 - 0 4нМ Для оценки ингибиторного действия DEGR-FVIIa на активность FVIIa в тестируемые ячейки добавляли возрастающие концентрации DEGR-FVIIa в присутствии постоянного количества (5нМ) FVIIa И FVIIa, и DEGR-FVIIa разбавляли буфером HEPES (ЮмМ HEPES, 137мМ NaCL, 4мМ KCI, 5мМ CaCL2, 11мМ глюкоза, 0 1% BSA) и Юмкл 10х исходных растворов, добавленных к клеткам Клетки инкубировали с тестируемыми соединениями в течение 2 часов при 37°С, затем трижды промывали буфером 42 HEPES Затем в каждую ячейку прибавляли 50мкл 200нМ раствора Фактора X в Tns-буфере (25мМ Tns, рН 7 4, 150мМ NaCI, 2 7мМ КСІ, 5мМ СаСІ2, 0 1% BSA) Через 4 минуты при комнатной температуре добавляли 25мкл 0 5М EDTA для того, чтобы остановить превращение Фактора X в Ха Прибавляли 25мкл на ячейку 0 8М Фактор Хаспецифичного хромогенного субстрата S-2222 в Tns-буфере и через 60 минут измеряли поглощение при 405нм в микропланшетном считывающем устройстве Thermomax (Molecular Devices Corp , Менло-Парк, Калифорния) Результаты, представленные на фиг 3, демонстрируют дозозависимое увеличение амидолитической активности в ячейках, обработанных FVIIa (незаштрихованные квадраты) Повышение поглощения является прямым измерением уровня Фактора Ха, генерированного в ячейках, и последующего расщепления им хромогенного субстрата Добавление возрастающих количеств DEGRFVIIa при постоянном количестве FVIIa (5нМ) вызвало дозозависимое снижение амидолитической активности (закрашенные квадраты) Эквимолярные количества DEGR-FVIIa и FVIIa способны ингибировать более 90% хромогенной активности Даже при сниженном 10-кратно уровне DEGRFVIIa еще наблюдается 40% ингибирование хромогенной активности Фактора Ха Эти результаты подтверждают заключение о том, что DEGR-FVIIa является чрезвычайно сильным антагонистом активации Фактора X в Ха в присутствии FVIIa на поверхности интактного клеточного монослоя SMCs Пример XIV Влияние DEGR-Фактора Vila на возникновение сосудистого тромбоза и сосудистых нарушений у бабуинов Была исследована спосбность человеческого DEGR-Фактора Vila ингибировать фактор ткани (TF) и опосредованное активированным Фактором VII (FVIIa) образование сосудистых нарушений (VLF), индуцированных механическим повреждением сосудов у нечеловеческих приматов DEGR-Фактор Vila вводили внутривенно в течение 7 дней (5 животным) или 30 дней (1 животному), начиная непосредственно перед возникновением механического сосудистого повреждения Измерения образования сосудистого повреждения проводили на 30-ый день Результаты, полученные у 5 обработанных животных, сопоставляли с данными для 5 параллельных контролей с инфузией наполнителя в буфере Базовые значения получали при определении у животных а) количества тромбоцитов, нейтрофилов, моноцитов и эритроцитов, б) уровня плазменного фибриногена, в) уровней активности плазменных факторов коагуляции VII, Vila, X и V, наряду с антигенностью FVII, г) базовый образец плазмы для определения антител к анти-Фактору Vila При анестезии галотаном и стерильных операционных условиях животные, меченные аутологичными 111 Іп-тромбоцитами, получали внутривенные вливания с использованием всей системы непрерывного внутривенного введения (начальное струйное введение 1мг/кг, сопровождавшееся непрерывным внутривенным вливанием 50мкг/кг/час) Животным проводили хирургическую 43 эндартерэктомию сонной артерии, билатеральную ангиопластику плечевой или бедренной артерии с помощью катетера Фогарти DEGR-FVIIa вводили в течение 7 или 30 дней непрерывной инфузией через венозный катетер с использованием всей системы Через 30 дней после хирургического вмешательства животному давали галотановый наркоз и проводили фиксацию in situ методом перфузии под давлением с 4% параформальдегидом, содержащим 0 1% глутаровый альдегид, в течение 30 минут Затем отбирали сегменты (содержащие ранее поврежденные сайты) с использованием методик Harker et al , Circulation 83 41 - 44 (1991), Hanson et al , Hypertension 18 1170-1176(1991) Образцы подвергали вторичной фиксации in vitro (4% параформальдегидом, содержащим 0 1% глутаровый альдегид), замораживали и подготавливали для морфометрического анализа области поражения Исследовали 11 нормальных зрелых бабуинов (Раю anubis) Шесть животных получали вливания (50мкг/кг/час), остающееся пять служили контролем, не получавшим DEGR-FVIIa Животные были дегельминтизированы и находились под наблюдением, чтобы избежать заболеваний, в течение трех месяцев перед использованием Все процедуры были утверждены Институциональным комитетом по уходу и использованию животных и находились в соответствии с процедурами и методами, изложенными в "Руководстве Национального института здоровья по уходу и использованию лабораторных животных", и подобными институциональными правилами Инвазивные процедуры проводили под анестезией галотаном после индукции кетамином (10мг/кг внутримышечно) и валиумом (0 5мг/кг внутривенно) Для последующей кратковременной иммобилизации при проведении постоперационных экспериментальных процедур использовали гидрохлорид кетамина (5 - 20мг/кг внутримышечно) Эндартерэктомию сонной аотерии проводили посредством разреза по средней линии шеи с использованием приемов, описанных Hanson et al , Hypertension 18 1170 - 1176 (1991), Krupski et al , Circulation 84 1749 - 1757 (1991), включенных здесь в виде ссылок Эндартерэктомию использовали в качестве модели сосудистого нарушения вследствие ее клинической важности и потому, что, как было показано, VLF, вызванное эндартерэктомией нормальных артерий, является воспроизводимым Кратко, обычную сонную артерию иссекали из окружающих тканей от ключицы проксимально до бифуркации сонной артерии дистально Обычную артерию пережимали с использованием атравматических сосудистых зажимов на каждом конце выделенного сосуда через 3 минуты после струйного введения сульфата гепарина (ЮОМЕ/кг внутривенно, Elkms-Simm Inc , ЧерриХилл, Нью-Джерси) и отделяли 1см, проксимальный к дистальному пережиму Затем проксимальный артериальный сегмент выворачивали над изогнутым зажимом После того, как достигалось максимальное выворачивание, в выделенном в просвете сегменте накладывали одну пару полипропиленовых швов (7 - 0) на любую из сторон проксимально и вторую пару дистально Затем 48149 44 проводили Эндартерэктомию, начиная в 1см от отделенного конца вывернутого сосудистого сегмента и продолжая на измеренное расстояние в 1см Эта процедура включает механическое удаление нормальной внутренней оболочки и частичное уплотнение средней оболочки с использованием зажима и хирургического микроскопа (увеличение 32х) После эндартерэктомии сосуду возвращали его обычную конфигурацию и налагали анастомоз "конец-к-концу" с помощью полипропиленового шва (ТО) и постоянной техники при 2 5- кратном увеличении, рану зашивали послойно При морфометрическом анализе исследовали срезы, залитые парафином и обработанные красителем для компонентов соединительной ткани (коллаген, эластин) и смесью гематоксилин- эозин, с использованием фотоскопа (Zeiss), соединенного с системой обработки изображения (Thomas Optical Measurement Systems, Колумбус, Джорджия), состоящей из камеры микроскопа CCD высокого разрешения (580 линий), присоединенной к монитору высокого разрешения (700 линий), компьютеру IBM 386, 80 МБ с графическим вводом высокого разрешения для получения и хранения изображения Количественную обработку изображения проводили с использованием орфометрического програмного обеспечения (Optimas, Bioscan Inc , Эдмондс, Вашингтон) В артериальных поперечных срезах анализировали общую площадь пролиферативного повреждения неоинтимы и соответствующую площадь артериальной средней оболочки Для статистического анализа сравнение между группами проводили с использованием t-теста Стьюдента (двустороннего для парных и непарных данных) Результаты показали, что площадь интимы значительно снижена у животных, обработанных DEGR-Факторм Vila в течение 7 дней и наблюдавшихся до 30 дней, по сравнению с контрольными животными, которые не получали DEGRФактор Vila (фиг 4) Подобные результаты получены у животных, обработанных DEGR- Фактором Vila в течение 30 дней и наблюдавшихся до 30 дней Предварительные исследования с моделью баллонной ангиографии плечевой артерии не наводили на мысль о заметном преимуществе терапии с DEGR-Факторм Vila Однако, на бабуинах не было показано, что эта модель является протромботической, в которой ключевую роль играет фактор ткани Исследования баллонного повреждения бедренной артерии у бабуинов действительно показали статистически значимое преимущество DEGR-Фактора Vila по сравнению с контролем, как показано на фиг 5 Пример XIV Влияние DEGR-Фактора Vila на tPAиндуцированный тромболиз Постоянное образование коронарных тромбов при остром инфаркте миокарда опосредовано, в первую очередь, фактором ткани (TF) в комплексе с Фактором Vila через внешний коагуляционный метаболический путь Было изучено влияние дополнительного ингибирования коагупяционного 45 Таблица 18 Физ раствор DEGRVI la Время до возобновле32+- 13 20 +- 7* ния кровотока (мин) Продолжительность возобновле- 62 +- 45 70 +- 48 ния кровотока (мин) Изменение циклов кро- 70% 89% вотока Реокклюзия 70% 78% 46 рецидивирующим тромбообразованием, путем помещения внешнего зажима вокруг кроличьих артерий с поврежденным эндотелием (метод Фоттса) После помещения зажима вокруг артерии CFVs развивались со средней частотой 11 +1-2 циклов/час у 6 из 6 кроликов в то время, как скорость кровотока в сонной артерии составляла в среднем 5 +/- 2% от базовых значений при самом низком уровне CFVs После наблюдения CFVs в течение 30 минут животные получали вливание человеческого рекомбинантного блокированного по активному центру (Phe-Phe-Argхлорметилкетон) Фактора VII (FVIlai) (0 1мг/кг/мин в течение 10 минут) Фактор Vllai полностью снимал CFVs у 6 из 6 животных (частота CFV = 0 циклов/час, р < 0 05, скорость кровотока через сонную артерию равна 106 9% от базовых значений, р = NS против базовой линии) Через 30 минут после ингибирования CFVs вводили человеческий рекомбинантный FVIIa в дозе 0 1 мг/кг/мин в течение 10 минут Инфузия Фактора Vila восстанавливала CFVs у всех животных, тем самым показывая, что связывание Фактора Vila с TF было конкурентным Значения протромбинового времени, времени активации и агрегации тромбоцитов ex vivo в ответ на ADP (аденозиндифосфат) и тромбин после инфузии FVIlai не отличались при сравнении с базовыми значениями Таким образом, FVII-Vlla играет важную роль в инициировании тромбообразования in vivo Введение Фактора Vllai вызывает на этой модели сильные антитромботические эффекты, не оказывая воздействия на системную коагуляцию 48149 каскада в различных точках внешнего метаболического пути на эффективность тромболиза, индуцированного активатором тканевого плазминогена (tPA) Тридцати шести собакам с индуцированными электрическим током коронарными тромбами в ходе тромболиза с tPA (1мг/кг, дольше 20 минут) назначали одну из четырех дополнительных обработок 9 получали клещевой антикоагулянтный пептид (ТАР), селективный ингибитор Фактора Ха, в дозе 30мкг/кг/мин в течение 90 минут Комплекс TF-Фактор Vila подавляли рекомбинантным ингибитором метаболизма фактора ткани (TFRI) (100 150мкг/кг/мин в течение 90 минут) у 9 собак и DEGR-FVIIa (1 - 2мг/кг струйно) в качестве конкурентного антагониста активированного Фактора Vila у 9 собак В качестве контроля 9 собак получали физиологический раствор Собаки находились под наблюдением по поводу реокклюзии в течение 120 минут после тромболиза Данные о влиянии этих агентов на эффективность тромболиза приведены ниже в Таблице 18 (данные представлены в виде средних значений +/- SD) TFPI ТАР 21 +- 6* 18+- 10* 91 +- 35* 120 56% 0% 67% 0% * Значение отличается от контроля с физиологичесикм раствором с уровнем значимости альфа = 0 05 Из этих данных следует, что ингибирование внешнего метаболического пути либо Фактором Ха, либо блокадой комплекса TF-Фактор Vila с DEGR-FVIIa или TFPI ускоряло tPAиндуцированный тромболиз Селективное ингибирование Фактора Ха более эффективно поддерживает раскрытое состояние артерии после успешной реперфузии Пример XV Модифицированный Фактор Vila ингибирует образование внутрисосудистых тромбов, не оказывая воздействия на системную коагуляцию Для того, чтобы определить, приводит ли ингибирование связывания Фактора VII с TF к антитромботическим эффектам, были инициированы изменения циклов кровотока (CFVs), вызываемые Из всего упомянутого очевидно, что получены составы Фактора VII или Vila с модифицированными каталитическим сайтами, способные связывать фактор ткани, однако не способные существенно активировать Факторы X и IX Поскольку модифицированный Фактор VII специфически прерывает каскад свертывания, не нарушая или не удаляя факторы свертывания, введение препаратов модифицированного Фактора VII будет сопровождаться меньшими нежелательными побочными эффектами, чем те, которые известны по опыту современной терапии Далее, модифицированный Фактор VII, описанный здесь, может быть легко получен рекомбинантными способами Таким образом, эффективность, удобство и экономическая выгода от низких доз и снижения частоты введения, а также относительная потеря токсичности составляют преимущества, обеспечиваемые составами настоящего изобретения Хотя вышеупомянутое изобретение и описано достаточно подробно с привлечением иллюстраций и примеров для улучшения понимания, очевидно, что могут быть предприняты некоторые изменения и модификации в рамках прилагаемой формулы изобретения 47 48149 48 EcoRl •ЕсвЯІ НМЖ ЕсэЩ Фиг, 1 OEGR-FVIIa Отложение тромбоцитов 3D (минуты) 50 60 48149 49 50 Хромогенная активность бабуиновых SMC Амидолитическая ак'тивнреть (%. от 1 контроля — a — FVlJs —•—- DERR-FYlIo тттттШГ—,• "і і и nit Концентрация (ні) FVIIa Фиг. 4 И .DEGR-FYIIa Эндартерзктомил сонной Г площадь внутренне! (интимы) X Контроль .. .т . 7д (дней! Обработка С DEGR-FYIIa г ) 51 52 48149 Фиг. 5 20 --г 01 15 -площадь внутренней ,100 оболочки площадь внутренней 10 оболочки площадь средней оболочки 5 т 1 п=2 Контроль 7д. (дней) ЗОщ (дней) С DEGR-FVIIa ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for inhibiting tissue factor activity; method for inhibiting platelet deposition; method for inhibiting vascular restenosis; method for treating acute clogging of coronary artery using modified factor vii
Автори англійськоюBerkner Kathleen L.
Назва патенту російськоюСпособ ингибирования активности тканевого фактора, способ угнетения отложения тромбоцитов, способ угнетения сосудистого рестеноза, способ лечения острого закупоривания коронарной артерии с помощью модифицированного фактора vii
Автори російськоюБеркнер Кетлин Л.
МПК / Мітки
МПК: A61P 9/00, A61K 38/43, C12N 9/99, A61K 38/45, A61K 38/49, C12N 9/64, C12N 15/09, A61P 7/02, A61K 38/55, A61P 43/00, A61K 38/16, A61K 38/46
Мітки: судинного, артерії, інгібування, гострої, коронарної, пригнічення, фактора, лікування, закупорки, спосіб, допомогою, тканини, відкладення, тромбоцитів, модифікованої, рестенозу, активності
Код посилання
<a href="https://ua.patents.su/26-48149-sposib-ingibuvannya-aktivnosti-faktora-tkanini-sposib-prignichennya-vidkladennya-trombocitiv-sposib-prignichennya-sudinnogo-restenozu-sposib-likuvannya-gostro-zakuporki-koronarno-a.html" target="_blank" rel="follow" title="База патентів України">Спосіб інгібування активності фактора тканини, спосіб пригнічення відкладення тромбоцитів, спосіб пригнічення судинного рестенозу, спосіб лікування гострої закупорки коронарної артерії за допомогою модифіковано</a>