Тієнопіримідиндіони і їх використання у модуляції аутоімунних хвороб
Формула / Реферат
1. Сполука формули (І):
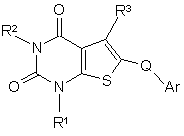 , (I)
, (I)
в якій
R1 і R2 кожна незалежно репрезентує С1-6алкіл, С3-6алкеніл, С3-5циклоалкілС1-3алкіл або С3-6циклоалкіл, кожен з яких може бути, як варіант, заміщений 1-3 атомами галогену;
R3 є групою CO-G або SO2-G, де G є 5 - або 6-членним кільцем, яке містить атом нітрогену і другий гетероатом, вибраний з оксигену і сульфуру і суміжний до нітрогену; причому це кільце заміщене щонайменше однією групою, вибраною з галогену або С1-4алкілу (який може бути, як варіант, заміщений 1-5 атомами галогену), і, як варіант, заміщене додатковими 1-4 групами, незалежно вибраними з галогену, гідроксилу і С1-4алкілу (який може бути, як варіант, заміщений 1-5 атомами галогену);
Q є CR4R5, де R4 - гідроген, флуор або С1-6алкіл, а R5 - гідроген, флуор або гідрокси;
Аr є 5-10-членною ароматичною кільцевою системою, в якій до 4 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфуру, причому ця кільцева система, як варіант, заміщена одним або більше замісниками, незалежно вибраними з С1-4алкілу (як варіант, заміщеного 1, 2 або 3-ма гідроксигрупами), С1-4алкокси, галогену, галогеналкілу, дигалогеналкілу, тригалогеналкілу, С1-4алкоксиС1-4алкілу, С1-4алкілтіо, С1-4алкоксикарбонілу, С2-4алканоїлу, оксогрупи, тіоксогрупи, нітрогрупи, ціаногрупи, -N(R6)R7 і -(СН2)pN(R8)R9, гідрокси, С1-4алкілсульфонілу, С1-4алкілсульфінілу, карбамоїлу, С1-4алкілкарбамоїлу, ди-(С1-4алкіл)карбамоїлу, карбокси, SO2N(R6)R7;
крім того, Аr може бути, як варіант, заміщена 5- або 6-членним ароматичним кільцем, яке має до 4 гетероатомів, незалежно вибраних з нітрогену, оксигену і сульфуру, і, як варіант, заміщена одним або більше замісниками, незалежно вибраними з С1-4алкілу (як варіант, заміщеного 1, 2 або 3-ма гідроксигрупами), С1-4алкокси, галогену, галогеналкілу, дигалогеналкілу, тригалогеналкілу, С1-4алкоксиС1-4алкілу, С1-4алкілтіо, С1-4алкоксикарбонілу, С2-4алканоїлу, оксогрупи, тіоксогрупи, нітрогрупи, ціаногрупи, -N(R6)R7 і -(СН2)pN(R8)R9, гідрокси, С1-4алкілсульфонілу, С1-4алкілсульфінілу, карбамоїлу, С1-4алкіл-карбамоїлу, ди-(С1-4алкіл)карбамоїлу, карбокси, SO2N(R6)R7;
р дорівнює 1, 2, 3 або 4;
R6 і R7 кожна незалежно репрезентує атом гідрогену, С1-4алканоїл або С1-4алкіл, або разом з атомом нітрогену, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце; і
R8 і R9 кожна незалежно репрезентує атом гідрогену, С1-4алканоїл або С1-4алкіл, або разом з атомом нітрогену, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце;
і її фармацевтично прийнятні солі і сольвати.
2. Сполука за п. 1, яка відрізняється тим, що в ній R1 є етилом, пропілом, бутилом або циклопропілом.
3. Сполука за п. 1 або п. 2, яка відрізняється тим, що в ній R2 є метилом.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що в ній R3 є групою CO-G.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що в ній Q є СН2.
6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що в ній Аr є 5-членним ароматичним кільцем з двома гетероатомами, як варіант, заміщеним, як це визначено у п. 1, або Аr є 9- або 10-членним дициклічним кільцем з 1, 2 або 3 гетероатомами, як варіант, заміщеним, як це визначено у п. 1, або є фенілом, як варіант, заміщеним, як це визначено у п. 1.
7. Сполука за п. 6, яка відрізняється тим, що в ній Аr є тієнільним, піразольним або тіазольним кільцем, кожне з яких заміщене двома або трьома алкільними, галогеновими, трифлуорметильними замісниками і/або заміщене також 2-піримідинільною або 2-піридильною групою.
8. Сполука за п. 6, яка відрізняється тим, що в ній Аr є групою субформули (і)
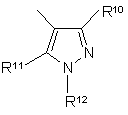 , (i)
, (i)
в якій
R10 і R11 незалежно вибрані з Н, С1-6алкілу або галогенС1-6алкілу, а R12 вибрана з Н, С1-6алкілу або галогенС1-6алкілу або 5-6-членної ароматичної кільцевої системи, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з оксигену, сульфуру і нітрогену, причому це кільце може бути, як варіант, заміщене одним або більше замісниками, незалежно вибраними з С1-4алкілу (як варіант, заміщеного 1, 2 або 3 гідроксигрупами), С1-4алкокси, галогену, галогеналкілу, дигалогеналкілу, тригалогеналкілу, С1-4алкоксиС1-4алкілу, С1-4алкілтіо, С1-4алкоксикарбонілу, С2-4алканоїлу, оксогрупи, тіоксогрупи, нітрогрупи, ціаногрупи, -N(R6)R7 і -(СН2)pN(R8)R9, гідрокси, С1-4алкілсульфонілу, С1-4алкілсульфінілу, карбамоїлу, С1-4алкілкарбамоїлу, ди-(С1-4алкіл)карбамоїлу, карбокси, або SO2NC(R6)R7, де R6, R7, R8, R9 і р є такими, що були визначені у п. 1.
9. Сполука за п. 8, яка відрізняється тим, що в ній R10 і R11 є метилом.
10. Сполука за п. 8 або п. 9, яка відрізняється тим, що в ній R12 вибрана з Н, С1-3алкілу (наприклад метилу) або 5-6-членної ароматичної кільцевої системи, в якій 3 кільцевих атоми можуть бути гетероатомами, незалежно вибраними з оксигену, сульфуру і нітрогену, і яка, як варіант, заміщена оксогрупою.
11. Сполука формули (І), яка відрізняється тим, що вибрана з таких сполук:
(S)-2-[[6-[(3,5-диметил-1Н-піразол-4-іл)метил]-1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4-ізоксазолідинол,
(S)-2-[[6-[(3,5-диметил-1Н-піразол-4-іл)метил]-1,2,3,4-тетрагідро-3-метил-1-(2-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4-ізоксазолідинол,
1-циклопропіл-6-[(3,5-диметил-1Н-піразол-4-іл)метил]-5-[[(4S}-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метилтієно[2,3-d]піримідин-2,4(1Н,3Н)-діон,
(S)-2-[[6-[(1Н-1,2,3-бензотриазол-1-іл)метил]-1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4-ізоксазолідинол,
(S)-2-[[6-[(4,5-дихлор-2-метил-1Н-імідазол-1-іл)метил]-1,2,3,4-тетрагідро-1-етил-3-метил-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4-ізоксазолідинол,
5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідинол]карбоніл]-3-метил-1-(2-метилпропіл)-6-(1Н-піроло[[2,3-b]піридин-3-ілметил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
(4S)-4-метил-2-[[1,2,3,4-тетрагідро-3-метил-2,4-діоксо-1-пропіл-6-(4-хінолінілметил)-тієно[2,3-d]піримідин-5-іл]карбоніл]-ізоксазолідинол,
(4S)-2-[[6-[(2,4-дихлор-5-тіазоліл)метил]-1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4-ізоксазолідинол,
(4S)-2-[[6-[(3-бром-2-тієніл)метил]-1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4-ізоксазолідинол,
5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-6-[[5-метил-3-(трифлуорметил)-1Н-піразол-4-іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон,
6-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4-іл]метил]-5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
5-[[(4S)-4-гідрокси-4-метилізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-6-(1Н-піроло[23-b]піридин-3-ілметил)-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон,
(4S)-2-[[6-[[3,5-диметил-1-(4-піридиніл)-1Н-піразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4-ізоксазолідинол,
(4S)-2-[[6-[[3,5-диметил-1-(2-піримідиніл)-1Н-піразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4-ізоксазолідинол,
5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-6-[(1-феніл-1Н-піразол-4-іл)метил]-тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
6-[(8-флуорхінолін-4-іл)метил]-5-{[(4S)-4-гідрокси-4-метилізоксазолідин-2-іл]карбоніл}-1-ізопропіл-3-метилтієно[2,3-d]піримідин-2,4(1Н,3Н)-діон,
5-{[(4S)-4-гідрокси-4-метилізоксазолідин-2-іл]карбоніл}-1-ізопропіл-3-метил-6-(4-піримідин-2-ілбензил)-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон,
5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-6-[(5-(2-пірідиніл)-2-тієніл)метил]-тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
6-[(1,3-диметил-1Н-5-піразоліл)метил]-5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
6-[(3,5-диметил-4-ізотіозоліл)метил]-5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]-карбоніл]-3-метил-1-(1-метилетил)-тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-6-[[1-(2-тіазоліл)-1Н-піразол-4-іл]метил]-тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
6-[(4-флуорфеніл)метил]-5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-6-(1Н-1,2,3-триазол-1-ілметил)-тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
6-[(6-хлорімідазо[1,2-a]піридин-3-іл)метил]-5-[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон,
5-[[(4S)-4-гідрокси-4-метилізоксазолідин-2-іл]карбоніл]-3-метил-1-(1-метилетил)-6-[[4-(2-піридиніл)феніл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон,
(4S}-4-метил-2-[[1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-6-[[5-метил-1-(2-піримідиніл)-3-(трифлуорметил)-1Н-піразол-4-іл]метил]-2,4-діоксотієнo[2,3-d]піримідин-5-іл]карбоніл]-4-ізоксазолідинол,
(4S)-2-[[6-[[3,5-диметил-1-(2-піримідиніл)-1Н-піразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-етил-4-ізоксазолідинол,
(4S)-2-[[6-[[1-(2,3-дигідро-2-оксо-4-піримідиніл)-3,5-диметил-1Н-піразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4-ізоксазолідинол,
5-[[(4R)-4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)-6-[[5-метил-3-(трифлуорметил)-1Н-піразол-4-іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон,
і їх фармацевтично прийнятних солей.
12. Сполука за будь-яким з пп. 1-11, призначена для використання у терапії.
13. Фармацевтична композиція, яка містить сполуку формули (І) або фармацевтично прийнятну сіль, визначені у будь-якому з пп. 1-11, разом з фармацевтичним носієм.
14. Спосіб створення імуносупресії, зокрема, у лікуванні відторгнення алотрансплантату, при якому пацієнтові вводять терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 1-11.
15. Спосіб лікування або зниження ризику хвороби дихальних шляхів, такої як астма або хронічна обструктивна легенева хвороба, у пацієнтів, що страждають від цих хвороб або мають підвищений ризик захворювання,
при якому пацієнтові вводять терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 1-11.
16. Спосіб одержання сполуки формули (І), в якому проводять одну з наведених нижче реакцію:
a) коли R3 є групою COG, реакцію сполуки формули (10):
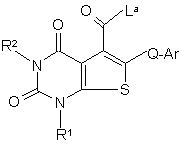 (10)
(10)
з G-Н;
b) коли Q є метиленом, реакцію сполуки формули (11):
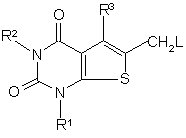 (11)
(11)
з сполукою формули Аr-Н;
c) коли Q є метиленом, відновлення сполуки формули (12):
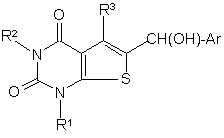 ; (12)
; (12)
d) реакцію сполуки формули (11) або (13) для утворення Аr через синтез первинного кільця
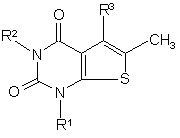 ; (13)
; (13)
e) реакцію сполуки формули (14) з R'-L2:
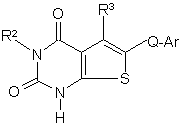 ; (14)
; (14)
f) коли R3 є SO2G, реакцію сполуки формули (15)
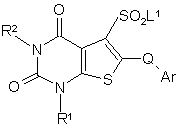 (15)
(15)
з сполукою G-H,
де La, L, L1 і L2 є відщеплюваними групами, a R1, R2, R3, G, Q і Аr є такими, що були визначені вище або є їх захищеними похідними, і необов'язково
після а), b), с), d), е) або f) перетворення сполуки формули (І) в іншу сполуку формули (І) і/або утворення її фармацевтично прийнятної солі або сольвату.
Текст
1. Сполука формули (І): O R3 2 R N Q S Ar O N 2 (19) 1 3 81788 варіант, заміщеним, як це визначено у п. 1, або Аr є 9- або 10-членним дициклічним кільцем з 1, 2 або 3 гетероатомами, як варіант, заміщеним, як це визначено у п. 1, або є фенілом, як варіант, заміщеним, як це визначено у п. 1. 7. Сполука за п. 6, яка відрізняється тим, що в ній Аr є тієнільним, піразольним або тіазольним кільцем, кожне з яких заміщене двома або трьома алкільними, галогеновими, трифлуорметильними замісниками і/або заміщене також 2піримідинільною або 2-піридильною групою. 8. Сполука за п. 6, яка відрізняється тим, що в ній Аr є гр упою субформули (і) R10 R11 N N R12 , (i) в якій R10 і R11 незалежно вибрані з Н, С1-6алкілу або галогенС 1-6алкілу, а R12 вибрана з Н, С1-6алкілу або галогенС 1-6алкілу або 5-6-членної ароматичної кільцевої системи, в якій до 3 кільцевих атомів можуть бути ге тероатомами, незалежно вибраними з оксигену, сульфур у і нітрогену, причому це кільце може бути, як варіант, заміщене одним або більше замісниками, незалежно вибраними з С 1-4алкілу (як варіант, заміщеного 1, 2 або 3 гідроксигрупами), С1-4алкокси, галогену, галогеналкілу, дигалогеналкілу, тригалогеналкілу, С1-4алкоксиС 1-4алкілу, С1-4алкілтіо, С1С2-4алканоїлу, оксогрупи, 4алкоксикарбонілу, тіоксогрупи, нітрогрупи, ціаногрупи, -N(R6)R7 і (СН2)pN(R8)R9, гідрокси, С1-4алкілсульфонілу, С14алкілсульфінілу, карбамоїлу, С 1-4алкілкарбамоїлу, ди-(С1-4алкіл)карбамоїлу, карбокси, або SO2NC(R6)R7, де R6, R7, R8 , R9 і р є такими, що були визначені у п. 1. 9. Сполука за п. 8, яка відрізняється тим, що в ній R10 і R11 є метилом. 10. Сполука за п. 8 або п. 9, яка відрізняється тим, що в ній R12 вибрана з Н, С1-3алкілу (наприклад метилу) або 5-6-членної ароматичної кільцевої системи, в якій 3 кільцевих атоми можуть бути гетероатомами, незалежно вибраними з оксигену, сульфур у і нітрогену, і яка, як варіант, заміщена оксогрупою. 11. Сполука формули (І), яка відрізняє ться тим, що вибрана з таких сполук: (S)-2-[[6-[(3,5-диметил-1Н-піразол-4-іл)метил]1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, (S)-2-[[6-[(3,5-диметил-1Н-піразол-4-іл)метил]1,2,3,4-тетрагідро-3-метил-1-(2-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, 1-циклопропіл-6-[(3,5-диметил-1Н-піразол-4іл)метил]-5-[[(4S}-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метилтієно[2,3d]піримідин-2,4(1Н,3Н)-діон, 4 (S)-2-[[6-[(1Н-1,2,3-бензотриазол-1-іл)метил]1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, (S)-2-[[6-[(4,5-дихлор-2-метил-1Н-імідазол-1іл)метил]-1,2,3,4-тетрагідро-1-етил-3-метил-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідинол]карбоніл]-3-метил-1-(2метилпропіл)-6-(1Н-піроло[[2,3-b]піридин-3ілметил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон, (4S)-4-метил-2-[[1,2,3,4-тетрагідро-3-метил-2,4діоксо-1-пропіл-6-(4-хінолінілметил)-тієно[2,3d]піримідин-5-іл]карбоніл]-ізоксазолідинол, (4S)-2-[[6-[(2,4-дихлор-5-тіазоліл)метил]-1,2,3,4тетрагідро-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, (4S)-2-[[6-[(3-бром-2-тієніл)метил]-1,2,3,4тетрагідро-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[[5-метил-3-(трифлуорметил)-1Н-піразол-4іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 6-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон, 5-[[(4S)-4-гідрокси-4метилізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)-6-(1Н-піроло[23-b]піридин-3-ілметил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, (4S)-2-[[6-[[3,5-диметил-1-(4-піридиніл)-1Н-піразол4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-метил-4-ізоксазолідинол, (4S)-2-[[6-[[3,5-диметил-1-(2-піримідиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-метил-4-ізоксазолідинол, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[(1-феніл-1Н-піразол-4-іл)метил]-тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон, 6-[(8-флуорхінолін-4-іл)метил]-5-{[(4S)-4-гідрокси4-метилізоксазолідин-2-іл]карбоніл}-1-ізопропіл-3метилтієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 5-{[(4S)-4-гідрокси-4-метилізоксазолідин-2іл]карбоніл}-1-ізопропіл-3-метил-6-(4-піримідин-2ілбензил)-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[(5-(2-пірідиніл)-2-тієніл)метил]-тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон, 6-[(1,3-диметил-1Н-5-піразоліл)метил]-5-[[(4S)-4гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3метил-1-(1-метилетил)-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 6-[(3,5-диметил-4-ізотіозоліл)метил]-5-[[(4S)-4гідрокси-4-метил-2-ізоксазолідиніл]-карбоніл]-3метил-1-(1-метилетил)-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 5 81788 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[[1-(2-тіазоліл)-1Н-піразол-4-іл]метил]-тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон, 6-[(4-флуорфеніл)метил]-5-[[(4S)-4-гідрокси-4метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)-тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-(1Н-1,2,3-триазол-1-ілметил)-тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон, 6-[(6-хлорімідазо[1,2-a]піридин-3-іл)метил]-5-[[(4S)4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3метил-1-(1-метилетил)-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 5-[[(4S)-4-гідрокси-4-метилізоксазолідин-2іл]карбоніл]-3-метил-1-(1-метилетил)-6-[[4-(2піридиніл)феніл]метил]-тієно[2,3-d]піримідин2,4(1Н,3Н)-діон, (4S}-4-метил-2-[[1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-6-[[5-метил-1-(2-піримідиніл)-3(трифлуорметил)-1Н-піразол-4-іл]метил]-2,4діоксотієнo[2,3-d]піримідин-5-іл]карбоніл]-4ізоксазолідинол, (4S)-2-[[6-[[3,5-диметил-1-(2-піримідиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-етил-4-ізоксазолідинол, (4S)-2-[[6-[[1-(2,3-дигідро-2-оксо-4-піримідиніл)-3,5диметил-1Н-піразол-4-іл]метил]-1,2,3,4-тетрагідро3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3d]піримідин-5-іл]карбоніл]-4-метил-4ізоксазолідинол, 5-[[(4R)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[[5-метил-3-(трифлуорметил)-1Н-піразол-4іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, і їх фармацевтично прийнятних солей. 12. Сполука за будь-яким з пп. 1-11, призначена для використання у терапії. 13. Фармацевтична композиція, яка містить сполуку формули (І) або фармацевтично прийнятну сіль, визначені у будь-якому з пп. 1-11, разом з фармацевтичним носієм. 14. Спосіб створення імуносупресії, зокрема, у лікуванні відторгнення алотрансплантату, при якому пацієнтові вводять терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 1-11. 15. Спосіб лікування або зниження ризику хвороби дихальних шляхів, такої як астма або хронічна обструктивна легенева хвороба, у пацієнтів, що страждають від цих хвороб або мають підвищений ризик захворювання, при якому пацієнтові вводять терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 1-11. 16. Спосіб одержання сполуки формули (І), в якому проводять одну з наведених нижче реакцію: a) коли R3 є групою COG, реакцію сполуки формули (10): 6 O O La R2 Q-Ar N O N S R1 (10) з G-Н; b) коли Q є метиленом, реакцію сполуки формули (11): R3 O R2 CH2 L N O N S R1 (11) з сполукою формули Аr-Н; c) коли Q є метиленом, відновлення сполуки формули (12): R3 O R2 CH(OH)-Ar N O N S R1 ; (12) d) реакцію сполуки формули (11) або (13) для утворення Аr через синтез первинного кільця R3 O R2 CH3 N O N S R1 ; (13) e) реакцію сполуки формули (14) з R'-L2: R3 O R2 Q-Ar N O N S H ; (14) f) коли R3 є SO2 G, реакцію сполуки формули (15) O SO2 L 1 2 R N Q Ar S O N R1 (15) з сполукою G-H, де La, L, L1 і L2 є відщеплюваними групами, a R1, R2, R3, G, Q і Аr є такими, що були визначені вище або є їх захищеними похідними, і необов'язково після а), b), с), d), е) або f) перетворення сполуки формули (І) в іншу сполуку формули (І) і/або 7 81788 8 утворення її фармацевтично прийнятної солі або сольвату. Винахід стосується тієнопіримідиндіонів, способів їх приготування, фармацевтичних композицій, що містять їх, і їх використання у терапії. Винахід також стосується їх використання у модуляції автоімунної хвороби. Т-клітини грають важливу роль в імунній реакції, однак при автоімунних хворобах Т-клітини невідповідним чином активуються проти певних тканин і проліферації, викликаючи, наприклад, запалення, пов'язане з ревматоїдним артритом. Інгібування проліферації Т-клітин є сприятливим у модуляції автоімунної хвороби. Винахід стосується сполук, які є корисними у модуляції автоімунної хвороби. Винахід стосується сполук формули (1): заміщене одним або більше замісниками, незалежно вибраними з С 1-4алкілу (як варіант, заміщеного 1, 2 або 3-ма гідроксигрупами), С1галогену, галогеналкілу, 4алкокси, дигалогеналкілу, тригалогеналкілу, С1-4алкоксиС 1С1-4алкілтіо, С1-4алкоксикарбонілу, С24алкілу, оксогрупи, тіоксогрупи, нітрогрупи, 4алканоїлу, ціаногрупи, -N(R6)R7 і -(CH2)pN(R8)R9, гідрокси, С14алкілсульфонілу, С 1-4алкілсульфінілу, карбамоїлу, С1-4алкілкарбамоїлу, ди-(С1-4алкіл)карбамоілу, карбокси, SO2 N(R6)R7; p дорівнює 1,2,3 або 4; R6 і R7 кожна незалежно репрезентує атом гідрогену, С1-4алканоїл або С 1-4алкіл, або разом з атомом нітрогену, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце; і R8 і R9 кожна незалежно репрезентує атом гідрогену, С1-4алканоїл або С 1-4алкіл, або разом з атомом нітрогену, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце; і її фармацевтично прийнятних солей і сольватів. Алкільні групи, одиночні або як частини іншої групи, можуть бути лінійними або розгалуженими. Вони можуть містити 1-6, частіше 1-4 атоми карбону. Прикладами галогеналкільних груп є галогенС 1-4алкільні групи, наприклад, хлор- або флуорметил. Прикладами дигалогеналкільних гр уп є дигалогенС1-4алкільні групи, наприклад, дифлуорабо дихлорметил. Прикладами тригалогеналкільних груп є тригалогенС 1-4алкільні групи, наприклад, трифлуорметил. Зрозуміло, що сполуки формули (І) або їх солі можуть виявляти таутомерію; креслення у цьому описі репрезентують лише одну з можливих таутомерних форм. Винахід включає будь-яку таутомерну форму. Деякі сполуки формули (1) можуть існувати у стереоізомерних формах. Винахід включає всі геометричні і оптичні ізомери сполук формули (1) і їх суміші, включаючи рацемати. Вони також утворюють аспект винаходу. Бажано, коли R1 - С1-6алкіл або С3-6циклоалкіл. Більш бажано, коли R1 - етил, пропіл, бутил або циклопропіл. Ще більш бажано, коли R1 - етил, бутил, пропіл або циклопропіл. Найкраще, коли R 1 - етил, ізобутил, ізопропіл або циклопропіл. Бажано, коли R2 - С1-6алкіл, наприклад, етил або метил, більше бажано, метил. Відповідно, G у групі R3 є 5-членним кільцем з атомом оксигену, наприклад, ізоксазолідиніловим кільцем. Бажано, щоб кільце G було заміщене С 14алкільною групою, наприклад, метилом. У даному втіленні, кільце G заміщене С1-4алкільною групою, наприклад, метилом і щонайменше ще одним замісником, вибраним з галогену, гідроксилу і С 14алкілу (які можуть бути як варіант, заміщені 1 - 5 в якій: R1 і R2 кожна незалежно репрезентує С 1-6алкіл, С3-6алкеніл, С3-5циклоалкілС 1-3алкіл або С36циклоалкіл, кожен з яких може бути, як варіант, заміщений 1-3 атомами галогену; R3 є групою CO-G або SO2-G, де G є 5-або 6членним кільцем, яке містить атом нітрогену і другий гетероатом, вибраний з оксигену і сульфур у і суміжний до нітрогену; причому це кільце заміщене щонайменше однією групою, вибраною з галогену або С 1-4алкілу (який може бути, як варіант, заміщений 1-5 атомами галогену), і як варіант, заміщене додатковими 1-4 групами, незалежно вибраними з галогену, гідроксилу і С 14алкілу, (який може бути, як варіант, заміщений 1-5 атомами галогену); Q є CR4R5, де R4 - гідроген, флуор або С 15 6алкіл, a R - гідроген, флуор або гідрокси; Аr є 5-10-членною ароматичною кільцевою системою, в якій до 4 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфур у, причому ця кільцева система як варіант, заміщена одним або більше замісниками, незалежно вибраними з С 14алкілу (як варіант, заміщеного 1, 2 або 3-ма гідроксигрупами), С1-4алкокси, галогену, галогеналкілу, дигалогеналкілу, тригалогеналкілу, С1-4алкоксиС 1-4алкілу, С1-4алкілтіо, С1С2-4алканоїлу, оксогрупи, 4алкоксикарбонілу, тіоксогрупи, нітрогрупи, ціаногрупи, -N(R6)R7 і (CH2)pN(R8)R9, гідрокси, С1-4алкілсульфонілу, С14алкілсульфінілу, карбамоїлу, С 1-4алкілкарбамоїлу, ди-(С1-4алкіл)карбамоїлу, карбокси, SO2N(R6)R7; крім того, Аr може бути, як варіант, заміщена 5- або 6-членним ароматичним кільцем, яке має до 4 гетероатомів, незалежно вибраних з нітрогену, оксигену і сульфур у, і, як варіант, 9 81788 атомами галогену). Зокрема, кільце G заміщене С1-4алкільною групою і гідроксигрупою, бажано, коли кільце G заміщене метилом і гідроксизамісником. Гідроксильний замісник може не бути приєднаний до кільцевого атому карбону, з'єднаного з кільцевим гетероатомом. Група G, бажано, має зв'язок з групами CO або SO2 через її кільцевий атом нітрогену. Прикладом групи G є 4-гідрокси-4-метилізоксазолідин-2-іл. Бажано, коли R3 є гр упою CO-G, визначеною вище, в якій кільце G має зв'язок через атом нітрогену. Більше бажано, коли R3 є групою CO-G, де G є 5-членним кільцем, описаним вище. Найкраще, коли R3 є 4-гідрокси-4-метилізоксазолідин-2-іл карбонілом. Q є CR5R6, де R5 - гідроген, С1-6алкіл, a R6 гідроген. Бажано, коли Q є СН 2. Прикладами 5-10-членних моноабо біциклічних ароматичних кільцевих систем для Аr є тієніл, фураніл, піроліл, піролопіридин, імідазоліл, піридил, піразиніл, піримідил, піридазиніл, триазиніл, оксазоліл, тіазоліл, ізоксазоліл, піразоліл, оксадіазоліл, тіадіазоліл, триазоліл, тетразоліл і хінолініл. Приклади 5-10-членної моно- або біциклічної ароматичної кільцевої системи для Аr включають тієніл, фураніл, піроліл, піролопіридин, імідазоліл, піридил, піразиніл, піримідил, піридазиніл, триазиніл, оксазоліл, тіазоліл, ізоксазоліл, піразоліл, оксадіазоліл, тіадіазоліл, триазоліл, тетразоліл і хіноліл. Конкретними прикладами є тієнільне, піразолільне, тіазолільне або триазолільне кільце, будь-яке з яких може бути, як варіант, заміщене. Прикладом Аr є феніл, який може бути, як варіант, заміщений, як це описано вище. Коли Аr є дициклічною ароматичною кільцевою системою, прикладами є бензотриазольне, піроло[[2,3-d]b]піридинове, хінолінове або імідазопірідинільне кільце, зокрема, бензотриазольне, піроло[[2,3-b]піридинове або хінолінове кільце. Бажано, коли Аr є 5-членним ароматичним кільцем з двома гетероатомами, як варіант, заміщене, як це було визначено вище, або Аr є 9або 10-членним дициклічним кільцем з 1, 2 або 3ма гетероатомами, як варіант, заміщеним, як це було описано вище. Бажано, коли Аr є 5-членним ароматичним кільцем з двома гетероатомами, як варіант, заміщеним, як це було описано вище. Зокрема, замісниками для групи Аr є один або більше замісників, незалежно вибраних з С 14алкілу, галогену, галогеналкілу, дигалогеналкілу, тригалогеналкілу або 5або 6-членного ароматичного кільця, яке має до 4 гетероатомів, незалежно вибраних з нітрогену, оксигену і сульфур у, і яке може саме бути, як варіант, заміщене, як це описано вище, зокрема, оксогрупою. Наприклад, Аr може бути як варіант, заміщена одним або більше замісниками вибраними з метилу, хлору, брому, флуору, трифлуорметилу, піримідинілу (наприклад, 2-піримідинілу), піридилу (наприклад, 2-піридил або 4-піридилу) або фенілу. 10 В одному з втілень, Аr є тієнільним, піразольним або тіазольним кільцем, кожне з яких може бути заміщене двома або трьома алкільними, галогеновими, трифлуорметильними замісники і/або також заміщене 2-піримідинільною або 2-піридильною групою. Прикладом Аr є, як варіант, заміщене піразольне кільце. Бажано, якщо Аr є заміщеним піразольним кільцем. Наприклад, Аr може бути гр упою субформули (і) де R10 і R11 незалежно вибрані з Н, С1-6алкілу, галогенС 1-4алкілу, a R12 вибрана з Н, С1-6алкілу, галогенС 1-4апкіпу або 5або 6-членної ароматичної кільцевої системи, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфур у, причому ця кільцева система, як варіант, заміщена одним або більше замісниками, незалежно вибраними з С 1-4алкілу (як варіант, заміщеного 1,2 або 3-ма алкоксигрупами), С14алкокси, галогену, гапогеналкілу, дигалогеналкілу, тригалогеналкілу, С1-4алкоксиС1-4алкілу, С1С1-4алкоксикарбонілу, С2-4алканоїлу, 4алкілтіо, оксогрупи, тіоксогрупи, нітрогрупи, ціаногрупи, N(R6)R7 і -(CH2)рN(R8)R9, гідрокси, С1алкілсульфонілу, С1-4алкілсульфінілу, карбамоїлу, 4 С1-4алкілкарбамоїлу, ди-(С1-4алкіл)карбамоїлу, карбокси або SO2N(R6)R7, де R6, R7, R8, R8 і р є такими, що були визначені вище. R10 і R11 вибрані з Η або С1-Залкілу, наприклад, метилу. Зокрема, обидві R10 і R11 є С1-3алкілом, наприклад, метилом. R12 вибрана з Н, С1-3алкілу (наприклад, метилу) або 5-6-членної ароматичної кільцевої системи, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з оксигену, сульфур у і нітрогену, як варіант, заміщеними оксогрупою. Якщо R12 є 5-6-членною ароматичною кільцевою системою, прикладами такої системи є феніл, піридил (наприклад, 2-піридил або 4піридил), піримідиніл (наприклад, 2-піримідинул) або тіазоліл (наприклад, 2-тіазоліл). Бажаною R12 є Н, піридил або піримідиніл, найкраще піридил або піримідиніл. У втіленні винаходу Аr є піразольним кільцем, заміщеним алкілом, наприклад, С1-6алкілом або галоген С1-6алкілом, трифлуорметильними замісниками і/або також 2-піримідинільною або 2піридильною групою. Коли R6 і R7 і R8 і R9 утворюють 5-7-членне насичене гетероциклічне кільце, прикладами такого кільця є морфолін, піперидин, піперазин і піролідин. Бажані сполуки формули (І) включають: (S)-2-[[6-[(3,5-диметил-1Н-піразол-4-іл)метил]1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4 11 діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, (S)-2-[[6-[(3,5-диметил-1Н-піразол-4-іл)метил]1,2,3,4-тетрагідро-3-метил-1-(2-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинолІ 1-циклопропіл-6-[(3,5-диметил-1Н-піразол-4іл)метил]-5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метилтієно[2,3d]піримідин-2,4-(1Н,3Н)-діон, (S)-2-[[6-[(1Н-1,2,3-бензотриазол-1-іл)метил]1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, (S)-2-[[6-[(4,5-дихлор-2-метил-1Н-імідазол-1іл)метил]-1,2,3,4-тетрагідро-1-етил-3-метил-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-гиетил4-ізоксазолідинол, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідинул]карбоніл]-3-метил-1-(2метилпропіл)-6-(1Н-піроло[[2,3-b]піридин-3ілметил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон, (4S)-4-метил-2-[{1,2,3,4-тетрагідро-3-метил2,4-діоксо-1-пропіл-6-(4-хінолінілметил)-тієно[2,3d]піримідин-5-іл]карбоніл]-ізоксазолідинол, (4S)-2-[[6-((2,4-дихлор-5-тіазоліл)метил]1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, (4S)-2-[[6-[(3-бром-2-тієніл)метил]-1,2,3,4тетрагідро-3-метил-1-(2-метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил-4ізоксазолідинол, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[[5-метил-3-(трифлуорметил)-1Н-піразол-4іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 6-{[3,5-диметил-1-(2-пірідиніл)-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон, 5-[[(4S)-4-гідрокси-4метилізокетзолідиніл]карбоніл]-3-метил-1-(1метилетил)-6-(1Н-піроло[23-b]піридин-3-ілметил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, (4S)-2-[[6-[[3,5-диметил-1-(4-піридиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-метил-4-ізоксазолідинол, (4S)-2-[[6-[[3,5-диметил-1-(2-піримідиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксо-тієно[2,3-d]піримідин-5іл]карбоніл]-4-метил-4-ізоксаволідинол, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[(1-феніл-1Н-піразол-4-іл)метил]-тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон, 6-[(8-флуорхінолін-4-іл)метил]-5-{[(4S)-4гідрокси-4-метилізоксазолідин-2-іл]карбоніл}-1ізопропіл-3-метилтієно[2,3-d]піримідин-2,4(1Н,3Н)діон, 5{[(4S)-4-гідрокси-4-метилізоксазолідин-2іл]карбоніл}-1-ізопропіл-3-метил-6-(4-піримідин-2ілбензил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 81788 12 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[(5-(2-пірідиніл)-2-тієніл)метил]-тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон, 6-[(1,3-диметил-1Н-5-піразоліл)метил]-5-[[(4S)4-гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3метил-1-(1-метилетил)-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 6-[(3,5-диметил-4-ізотіозоліл)метил]-5-[[(4S)-4гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3метил-1-(1-метилетил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідинілікарбонілі-3-метил-1-(1-метилетил)6-[[1-(2-тіазоліл)-1Н-піразол-4-іл]метил]тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон, 6-[(4-флуорфеніл)метил]-5-[[(4S)-4-гідрокси-4метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон, 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-(1Н-1,2,3-триазол-1-ілметил)тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон, 6-[(6-хлорімідазо[1,2-а]піридин-3-іл)метил]-5[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон, 5-[[(4S)-4-гідрокси-4-метилізоксазолідин-2іл]карбоніл]-3-метил-1-(1-метилетил)-6-[[4-(2піридиніл)феніл]метил]-тієно[2,3-d]піримідин2,4(1Н,3Н)-діон, (4S)-4-метил-2-[[1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-6-[[5-метил-1-(2-піримідиніл)-3(трифлуорметил)-1Н-піразол-4-іл]метил]-2,4діоксотіеніл[2,3-d]піримідин-5-іл]карбоніл]-4ізоксазолідинол, (4S)-2-[[6-[[3,5-диметил-1-(2-піримідиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотіено[2,3-d]піримідин-5іл]карбоніл]-4-етил-4-ізоксазолідинол, (4S)-2-[[6-[[1-(2,3-дигідро-2-оксо-4-піримідиніл)3,5-диметил-1Н-піразол-4-іл]метил]-1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол, 5-[[(4R)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[[5-метил-3-(трифлуорметил)-1Н-піразол-4іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон, і їх фармацевтично прийнятні солі. Солями, придатними для використання у фармацевтичній композиції, можуть бути фармацевтично прийнятні солі, але і інші солі можуть бути корисними у виготовленні сполук формули І і їх фармацевтично прийнятних солей. Фармацевтично прийнятні солі винаходу можуть, наприклад, включати кислотоадитивні солі сполук формули І, достатньо основні для утворення таких солей. Такі кислотоадитивні солі включають, наприклад, солі з неорганічними або органічними кислотами, які дають фармацевтично прийнятні аніони, наприклад, з гідрогалогеновими (зокрема, гідрохлоридною або гідробромідною кислотою, бажано, гідрохлоридною) або з сульфатними або фосфа тними кислотами, або з трифлуороцтовою, 13 81788 лимонною або малеїновою кислотами. Придатні солі включають гідрохлориди, гідроброміди, фосфа ти, сульфати, гідросульфати, алкілсульфонати, арилсульфонати, ацетати, бензоати, цитрати, малеати, фумарати, сукцинати, лактати і тартрати. Крім того, коли сполуки формули І є достатньо кислотними, фармацевтично прийнятні солі можуть бути утворені з неорганічними або органічними основами, які дають фармацевтично прийнятний катіон. Такі солі з неорганічними або органічними основами включають, наприклад, солі лужних металів, наприклад, сіль натрію або калію, солі лужноземельних металів, наприклад, кальцію або магнію сіль, амонієві солі або, наприклад, сіль з метиламіном, диметиламіном, триметиламіном, піперидином, морфоліном або трис-(2гідроксиетил)аміном. Бажані солі включають кислотоадитивні солі, наприклад, гідрохлорид, гідробромід, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат або р-толуолсульфонат, або солі лужних металів, наприклад, натрію або калію. Сполуки винаходу можна приготувати шляхами, подібними відомим у галузі. Конкретні приклади наведені нижче. Згідно з подальшим аспектом, винахід включає спосіб приготування сполуки формули (І), який включає: а) коли R3 є групою COG, реакцію сполуки формули (10): 14 d) реакцію сполуки формули (11) або (13) для утворення Аr через синтез первинного кільця e) реакцію сполуки формул (14) з R1-L2: або f) коли R3 є SO2G, реакцію сполуки формули (15) з G-H; b) коли Q є метиленом, реакцію сполуки формули (11): з сполукою формули Аr-Н; c) коли Q є метиленом, відновлення сполуки формули (12): зі сполукою G-H де Iа, L, L1 і L2 є відщеплюваними групами, a 1 R , R2, R3, G, Q і Аr є такими, що були визначені вище або є їх захищеними похідними, і, як варіант, після a), b), c), d), e) або f) перетворення сполук формули (1) в іншу сполуку формули (1) і/або утворення її фармацевтично прийнятних солі або сольвату. Зокрема, у сполуці формули (15) Q є метиленом. Придатні відщеплювані групи для La, L, L 1 і L2 є відомими фахівцям-хімікам і залежать від природи реакції, що проходить. Приклади відщеплюваних груп включають галоген, наприклад, хлор, бром або йод, ангідридні групи, наприклад, оцтовий ангідрид, естери, наприклад, мезилат або тозилат і гідроксил. Реакцію між сполуками формули (10) і сполукою G-H, де G є має нітроген, приєднаний до атому гідрогену, зручно проводити в умовах формування амідного зв'язку. У цьому випадку, La є гідроксилом, а реакцію проводять, наприклад, у присутності сполучаючого агента, наприклад, дициклогексилкарбодііміду або 1-етил-3-(3 15 81788 диметиламінопропіл)етилкарбодіімщу. Як варіант, можна застосовувати основу, бажано, органічну, наприклад, триетиламін. Придатними розчинниками звичайно є апротонні розчинники, наприклад, ДМФ, або хлоровані розчинники, наприклад, ДХМ або трихлорметан. Крім того, можуть бути присутні сполуки, які каталізують тип реакції з утворенням амідного зв'язку, наприклад, 1-гідроксибензотриазол. Температура звичайно становить від приблизно -30°С до приблизно 60°С і переважно дорівнює зовнішній температурі. Реакцію між сполукою формули (11) і Аr звичайно проводять у присутності сильної основи, наприклад, гідриду натрію Придатні відщеплювані групи включають галоген, зокрема, бром. Реакцію зручно проводити в інертному розчиннику, наприклад, ТГФ, бажано при приблизно зовнішній температурі. У деяких випадках, наприклад, коли Аr містить кільцеві атоми нітрогену, які не потребують депротонування, можна застосувати слабшу основу, наприклад, бікарбонат натрію. Цю реакцію доцільно застосовувати для приготування сполуки, в якій Аr має зв'язок через кільцевий атом нітрогену. Однак, цей спосіб можна використати для приготування сполук, в яких Аr має зв'язок через кільцевий атом карбону. Цього можна досягти застосуванням сильної основи і солі цинку, наприклад, хлориду цинку і, як варіант, йодиду натрію як каталізатора. Сполука формули (12) може бути відновлена до відповідної метиленової сполуки застосуванням стандартних відновлювальних умов для гідроксигрупи, відомих фахівцям., наприклад, її можна протонатувати кислотою, наприклад, трифлуороцтовою, і відновити триалкілсиланом. В іншому варіанті гідроксигрупу можна перетворити у сильнішу відщеплювану груп у, наприклад, мезилат або тозилат і отриману сполуку гідрогенувати у безгідроксильному розчиннику, бажано, ТГФ, з каталізатором, наприклад, паладієм на вугіллі, у температурних межах 0°С50°С, бажано, при зовнішній температурі і тиску 15бар. Групу -Q-Ar зручно формува ти на сполуках формул (11) або (13) синтезом первинного кільця [див. компендіум "The Chemistry of Hetrocyclic Compounds (Хімія гетероциклічних сполук)", Е,С. Taylor and A. Weissberger (John Wiley and Sons) і "Comprehensive Hetrocyclic Chemistry (Повна гетероциклічна хімія ", A.R Katritzky and С. W Rees (Pergamon Press (Elsevier)]. Отримання сполук формули (1), в яких Аr є 3,5-диметилпіразол-4ілом або 1,3,5-триметилпіразол-4-ілом, ілюстровано Прикладами 11 і 12 нижче. Сполука формули (14) може реагувати з сполукою формули R1-L2 у присутності слабої основи, наприклад, карбонату калію, у диполярному апротонному розчиннику, наприклад, ДМФ, при температурі від зовнішньої до 170°С. Прикладом L1 у формулі (15) є хлор. Сполуку формули (1) можна отримати з іншої сполуки формули (1) хімічним модифікуванням, наприклад, сполуку формули (1), в якій Q метилен, можна окислити до сполуки формули (1), в якій Q - карбоніл. Бажаним окислювачем є [2,3 16 d]дихлор-5,6-диціано-1,4-бензохінон (ДЦХ) в інертному органічному розчиннику, наприклад, ТГФ. У деяких випадках окислення можна проводити підданням метиленової сполуки дії повітря. В іншому варіанті, сполуки формули (І), де Аr є групою субформули (і) (див. вище), в якій R12 є гідрогеном, можна перетворити у сполуки формули (І), в якій R12 не є гідрогеном, реакцією з сполукою формули (XV): R12' -L" (XV) де R12' є групою R12, яка не є гідрогеном, a L" відщеплювана група, наприклад, галоген, зокрема, бром. Така реакція може бути проведена в органічному розчиннику, наприклад, ацетонітрилі або діоксані. Якщо необхідно, реакцію можна проводити у присутності основи, наприклад, карбонату лужного металу, зокрема, карбонату калію, і у присутності каталізатора, наприклад, солі міді, зокрема, йодиду міді. Реакцію можна проводити в інертній атмосфері, наприклад, у нітрогені. Інтермедіати формули (10) можуть бути приготовлені з сполуки формули (16): в якій R20 – С1-6алкіл, наприклад, метил або етил, a R21 - -CH2L (L визначено вище) або СН(ОН)Аr. Сполуку формули (16), в якій R21 - -СН2L можна ввести у реакцію з Аr в умовах, подібних описаним вище для операції b). Коли Аr приєднана через кільцевий атом карбону, сполуку формули (15), в якій R21 є СН(ОН)Аr, можна відновити в умовах, подібних описаним для операції с) (див.вище). Сполуку формули (12) або (16), в яких R21 є СН(ОН)Аr, можна приготувати реакцією сполуки формули (17): (де R22 - R3 або -CO2R 20) з сполукою формули Ar-СНО у присутності сильної основи, наприклад, діалкіламіду літію, зокрема, діізопропіламіду літію, в інертному органічному розчиннику, наприклад, ТГФ, спочатку при низькій температурі, наприклад, -78°С, з подальшим підвищенням до зовнішньої. Взагалі інтермедіати отримують з сполуки формули (18): 17 81788 18 температурі від 0°С до 30°С, у присутності сполуки формули R2-L1 (L1 - відщеплювана група, наприклад, йодид). Сполуку формули (20) можна отримати реакцією сполуки формули (20): R1-N=C=S з сполукою Віттіга, наприклад, з сполукою формули (22): в якій R23 є гідрогеном або метилом. Коли R21 - -СН(ОН)Аг, R23 є гідоогеном, і сполука формули (17) може реагувати з Аг-СНО, як описано вище для сполук формули (16). Коли R21 - -CH2L, R23 є метилом, який перетворюється у -CH2L, наприклад, галогенуванням. Коли L - бром, метильна група може бути бромінована з застосуванням стандартного бромінування, наприклад, Nбромсукцинімідом в стандартних умовах. Сполуку формули (18), в якій R23 - гідроген, можна утворити спочатку реакцією сполуки формули (19): (де R' - феніл або заміщений феніл, наприклад, толіл) в інертному розчиннику, наприклад, ТГФ, при температурі від 20°С до 80°С, і обробкою отриманого продукту там же сполукою формули (23): при температурі від -78°С до 60°С Сполуку формули (19) можна приготувати реакцією сполуки формули (24): з алкілбромпіруватом, наприклад, етилбромпіруватом, у присутності слабої основи, наприклад, лужного карбонату, наприклад, карбонату калію у полярному розчиннику, наприклад, ДМФ, при температурі 5 - 50°С, і потім обробкою отриманого продукту приєднання кислотою Льюїса, бажано, тетрахлоридом титану, в інертному розчиннику, наприклад, ДХМ, при температурі від -20°С до 50°С, бажано, від 0°С до 25°С. Сполуку формули (18), в якій R23 - метил, можна приготувати спочатку реакцією сполуки формули (19) з алкіл 3-бром-2-оксобутаноатом, наприклад, метил 3-бром-2-оксобутаноатом у присутності слабої основи, наприклад, лужного карбоксилату, зокрема, ацетату натрію, у полярному розчиннику, наприклад, ДМФ або воді, при температурі від 5°С до 50°С, і потім обробкою отриманого продукту приєднання кислотою Льюїса, бажано, тетрахлоридом титану, в інертному розчиннику, наприклад, ДХМ, при температурі від -20°С до 50°С, бажано, від 0°С до 25°С. Сполуку формули (18) можна отримати реакцією сполуки формули (20): (де R24 –С1-4алкіл, наприклад, етил) з ацетилціанатом в інертному розчиннику, наприклад, толуолі, при температурі від 0°С до 50°С, і потім обробкою продукту цього перетворення алкоксидом металу в алканолі (наприклад, метоксидом натрію у метанолі) при з тіолом лужного металу, наприклад, тіолом натрію, у полярному розчиннику, наприклад, спирті, зокрема, етанолі, при температурі від 10°С до 50°С. Сполуку формули (23) можна приготувати реакцією сполуки формули (25): з сполукою формули R'-L2 в умовах, описаних для операції e) вище. Сполуку формули (15) можна отримати реакцією сполуки формули (26): в якій L'" є відщеплюваною групою, зокрема, галогеном, наприклад, бромом, з реагентом Гриньяра з подальшими доданням SO2, окисленням і хлоруванням. Реакцію проводять у придатному розчиннику, наприклад, ТГФ, при температурі від -70°С до 30°С, бажано, від -20°С до 20°С. Отриману сульфінову кислоту можна 19 81788 окислити до відповідної сульфонової кислоти і хлорувати, наприклад, РСІ5. Сполуки формули (26) отримують обробкою відповідної галогенової похідної, наприклад, бромистої, сильною основою, наприклад, діізопропіламідом літію при зниженій температурі з подальшою обробкою сполукою АrСНО. Реакцію можна проводити у ТГФ при температурі від -70°С до 30°С, бажано, від -50°С до 0°С. Попередник галогенованої сполуки отримують галогенуванням, зокрема, бромінуванням, сполуки формули (27): Реакцію можна проводити, застосовуючи, наприклад, бром у хлороформі при температурі від -10°С до 60°С, бажано, при приблизно зовнішній температурі. Вихідними матеріалами є ті, що були визначені вище, доступні комерційно, або їх можна отримати, застосовуючи стандартну хімію. Сполуки формули (1) можна перетворити у фармацевтично прийнятні сіль або сольват. Деякі сполуки формули (1) можуть існувати у стереоізомерних формах. Винахід включає всі геометричні і оптичні ізомери сполук формули (1) і їх суміші, включаючи рацемати. Вони також утворюють аспект винаходу. Ізомери можуть бути розрізнені або розділені звичайними методами, наприклад, хроматографією або фракційною кристалізацією. Енантіомери можна ізолювати розділенням рацемічної або іншої суміші сполук, застосовуючи звичайні методи (наприклад, хіральну рідинну хроматографію високого розрізнення (РХВР)). Потрібні оптичні ізомери можна також приготувати реакцією придатних оптично активних вихідних матеріалів в умовах, що не викликають рацемізації, або дериватизацією, наприклад, гомохіральною кислотою, з подальшим розділенням діастереомерних похідних звичайними засобами (наприклад, РХВР, хроматографією на кремнеземі), або можна отримати з ахіральних вихідних матеріалів і хіральних реагентів. Всі стереоізомери входять в об'єм винаходу. Сполуки винаходу можуть бути ізольовані з реакційних сумішей з застосуванням звичайних процедур. Корисність сполук винаходу полягає в їх фармакологічній активності у людей і тварин. їх призначають як фармакологічні засоби у лікуванні (профілактиці) автоімунних, запальних, проліферативних і гіперпроліферативних хвороб і імунологічно опосередкованих хвороб, включаючи відторгнення трансплантованих органів або тканин і СНІД. Прикладами таких станів є: 20 (1) (респіраторні шляхи) обструктивна хвороба дихальних шляхів; астма, зокрема, бронхіальна, алергічна, внутрішня, зовнішня і пилова, хронічна або стійка (наприклад, застаріла астма і надчутливість ди хальних шляхів)); хронічна обструктивна легенева хвороба (ХОЛХ) (наприклад, незворотна ХОЛХ); бронхіт; гострий, алергічний, атрофічний риніт або хронічний риніт (наприклад, творожистий риніт, гіпертрофічний риніт, гнійний риніт, сикативний риніт), медикаментозний риніт, мембранний риніт (включаючи крупозний, фібринозний і псевдомембранний риніт), сезонний риніт (включаючи нервовий риніт (сінна пропасниця) і вазомоторний риніт); саркоїдоз; хвороби, пов'язані з фермерськими легенями; фіброїдні легені і пов'язані з ними хвороби і ідіопатична внутрішньотканинна пневмонія; (2) (кістки і суглоби) ревматоїдні артрити, серонегативні спондилоартропатії (наприклад, анкілозний спондиліт, псоріазний артрит і хвороба Рейтера), хвороба Бесе, синдром Сйоргена і системний склероз; (3) (шкіра) псоріаз, атопікальний дерматит, контактний дерматит, інші екзематичні дерматити, себорейний дерматит, Lichen pianus, пемфігус, бульйозний пемфігус, бульйозний епідермолізис, кропивниця, ангіодерми, васкуліти, еритеми, шкірні еозинофілі!', хронічні шкірні виразки, увеліт, виразкове ареатакомне облисіння і весінній кон'юнктивіт; (4) (шлунково-кишечний тракт) коеліатична хвороба, проктит, еозинофільний гастроентерит, мастоцитоз, хвороба Крона, виразковий коліт; харчові алергії з дією, віддаленою від кишечнику (наприклад, мігрень, риніт і екзема); (5) (інші тканинні і системні хвороби) множинний склероз, атеросклероз, СНІД, еритематозна волчанка; системна волчанка, еритематоз; тироїдит Хашімото, бульбоспинадьний параліч, діабет типу І, нефротичний синдром, еозинофілія fascitis, синдром гіпер-lgE, лепроматозна проказа, сезарний синдром і ідіопатична тромбоцитопенія pupura; (6) (відторгнення аллотрансплантату) гостре і хронічне, після, наприклад, трансплантації нирки, серця, печінки, легені, кісткового мозку, шкіри і роговиці; і хронічна хвороба несприяття трансплантату; і (7) рак. Відповідно, винахід стосується сполуки формули (1) або її фармацевтично прийнятної солі, визначених вище і призначених для використання у терапії. Ще одним аспектом винаходу є використання сполуки формули (1) або її фармацевтично прийнятної солі, визначених вище, у виго товленні медикаменту для використання у терапії. Тут термін "терапія" також включає "профілактику", якщо не визначено інше. Терміни "терапевтичний" і "терапевтично" слід розуміти відповідно. Профілактика є особливо доречною стосовно пацієнтів, які вже страждали від певних хвороби 21 81788 або стану, або вважаються більш сприйнятливими до них. Особи, яким загрожує ризик захворювання даними хворобою або станом загалом включають тих, що мають родинну історію таких захворювань, або тих, в яких шляхом генетичного тестування або скринінгу була виявлена особлива чутливість до розвитку таких хвороби або стану. Винахід також включає спосіб створення імуносупресії (наприклад, у лікуванні відторгнення алотрансплантату), який включає введення пацієнту терапевтично ефективності кількості сполуки формули (1) або її фармацевтично прийнятної солі, визначених ви ще. Винахід, крім того, включає спосіб лікування, або зниження ризику хвороб дихальних шляхів (наприклад, астми або ХОЛХ) у пацієнтів, що страждають від цих хвороб або мають підвищений ризик захворювання, який включає введення цьому пацієнту терапевтично ефективної кількості сполуки формули (1) або її фармацевтично прийнятної солі, визначених ви ще. У зазначеній вище терапії доза сполуки, яку вводять, залежить від типу сполуки, способу введення, типу терапії і розладу, для якого призначено терапію. Однак, взагалі для створення імуносупресії денна доза сполуки формули (1) має становити від 0,1мг/кг, бажано, від 0,3 мг/кг, більш бажано, від 0,5мг/кг, найкраще від 1мг/кг до 30мг/кг маси пацієнта (включно). При лікування хвороб дихальних шля хів денна доза сполуки формули (1) має становити від 0,001мг/кг до 30мг/кг маси пацієнта. Сполуки формули (1) і її фармацевтично прийнятні солі можна застосовувати як такі, але найчастіше вони мають вводитись у формі фармацевтичної композиції, яка містить сполуку формули (1) або її сіль/сольват (активний інгредієнт) разом з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. Залежно від способу введення, фармацевтична композиція переважно включає від 0,05 до 99% (за масою), бажано менше 80%(за масою), наприклад, від 0,10 до 70% (за масою), більш бажано, менше 50% (за масою) активного інгредієнта, від повної маси композиції. Отже, винахід також стосується фармацевтичної композиції, яка містить сполуку формули (1) або фармацевтично прийнятну сіль, визначені вище, разом з фармацевтично прийнятними ад'ювантом, розріджувачем або носієм. Винахід, крім того, стосується способу приготування фармацевтичної композиції винаходу, який включає змішування сполуки формули (1) або її фармацевтично прийнятної солі, визначених вище, з фармацевтично прийнятними ад'ювантом, розріджувачем або носієм. Фармацевтичну композицію винаходу можна вводити локально (наприклад, у легені і/або дихальні шляхи, на шкіру) у формі розчинів, суспензій, гептафлуоралканових аерозолів і сухих порошкових композицій; або системно, наприклад, оральним введенням у формі таблеток, капсул, сиропів, порошків або гранул, або парентеральним 22 введенням у формі розчинів або суспензій, або підшкірно, або ректально у формі супозиторіїв, або трансдермально. Здатність сполук інгібувати стимульовану РМА/іономіцином проліферацію мононуклеарних клітин у периферійній крові можна оцінити, наприклад, застосовуючи описану нижче процедуру. Винахід ілюструється наведеними далі Прикладами, в яких, якщо не зумовлено інше: (і) випарювання проводять обертальним випарюванням у вакуумі і процедури обробки проводять після видалення фільтруванням твердих залишків, наприклад, висушуючих засобів; (іі) операції проводять при зовнішній температурі, тобто при 18-25°С і в атмосфері інертного газу, наприклад, аргону або нітрогену; (ііі) вихід наведено лише для ілюстрації, і він не завжди є максимально можливим; (iv) стр уктура кінцевих продуктів формули (І) підтверджуються ядерним (звичайно протонним) магнітним резонансом (ЯМР) і масспектрографією; значення хімічного зсуву протонного магнітного резонансу виміряють за дельта-шкалою, а множинності піків позначено: s синглет; d - дублет; t - триплет; m - мультиплет; br -широкий; q - квартет, quin - квінтет; (ν) інтермедіати взагалі не одержують повної характеризації,а чистота оцінюється тонкошаровою хроматографією (ТШХ), рідинною хроматографією високого розрізнення (РХВР), мас-спектрометрією (МС), інфрачервоним (ІЧ) або ЯМР-аналізом; Абревіатури [2,3-d]дихлор-5,6-диціано~1,4-бензохінон ДДХ Диметилформамід - ДМФ Тетрагідрофуран - ТГФ Приклад 1 (S)-2-[[6-[(3,5-диметил-1Н-піразол-4-іл)метил]1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол a) 2-[[(2S)-2-метилоксираніл]метокси]-1Нізоіндол-1,3(2Н)-діон Суміш N-гідроксифталіміду (5,3г), [(2S)-2метилоксиран-2-іл]метил-3-нітробензолсульфонату (5,9г) і триетиламіну (10,6мл) у ДХМ (15мл) перемішують під азотом при зовнішній температурі 24год. Реакційну суміш вли вають у кремнеземну колонку і елююють ДХМ, отримуючи бажану сполуку як білу тверду речовину (3,1г). МС (АРСІ) 234 [М+Н]+ δ 1НCDCI3 1-63 (3Н, s), 2,69 (1Н, d), 2,76 (1Н, d), 4,17 (1Н, d), 4,21 (1Н, d), 7,73-7,78 (2Н, m), 7,827,87 (2Н, m). 23 81788 b) 2-[[(2R)-3-хлор-2-гідрокcи-2метилпропіл]окси]-1Н-ізоіндол-1,3(2Н)-діон. Продукт частини а) (3,0г) обробляють концентрованою хпоридною кислотою (12мл) і перемішують при зовнішній температурі 2год. Суміш розділяють між водою і ДХМ, органіку сушать і очищають хроматографією (ЕtOАс), отримуючи бажану сполуку як білу тверду речовину (3,3г). δ 1НДМСО 1,29 (3Н, s), 3,67 (1Н, d), 3,76 (1Н, d), 4,09 (1Н, d), 4,15 (1Н, d), 7,86 (4Н, s), 5,24 (1H,s). c) Ме тиловий естер 2-[[(4S)-4-гідрокси-4метил-2-ізоксазолідиніл]карбоніл]-бензойної кислоти Розчин продукту частини b) (3,3г) у метанолі (25мл) обробляють триетиламіном (3,4мл) і гріють під азотом при кипінні під зворотним холодильником протягом 1год. Суміш концентрують до сухості і очи щають хроматографією з градієнтним елюентом від ДХМ до 5% метанолу у ДХМ. Хіральну чистоту продукту підвищують рекристалізацією двічі з ацетонітрилу, отримуючи бажану сполуку як білу тверду речовину (1,92г). РХВР: (9010ТНІР.М) 50мм колонка chiracel AD, ee>99%. δ 1HCDCl3 1,52 (3Н, s), 3,59 (1Н, d), 3,81 (1Н, d), 3,88 (1Н, d), 4,04 (1Н, s), 4,34 (1Н, d), 3,92 (3Н, s), 7,45 (1Н, d), 7,49 (1Н, t), 7,62 (1Н, t), 8,00 (1Н, d). d) (4S)-4-метил-4-ізоксазолідинолгідрохлорид Розчин продукту частини с) (4,9г) у 2N хлоридній кислоті (30мл) гріють під азотом при кипінні під зворотним холодильником 4год. Після охолодження осад видаляють фільтруванням і рідини концентрують до сухості у вакуумі. Залишок перетирають з ацетонітрилом, отримуючи бажану сполуку як білу тверду речовину (1,79г). δ 1НДМСО 1-42 (3Н, s), 3,29 (1Н, d), 3,41 (1Н, dD), 3,87 (1Н, d), 4,05 (1Н, dd). e) Метиловий естер 6-[3,5-диметил-1Нпіразол-4-іл)метил]-1,2,3,4-тетрагідро-3-метил-1(2-метилпропіл-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти До розчину метилового естеру 6-(бромметил)1,2,3,4-тетрагідро-3-метил-1-(2-метил-пропіл)-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти (1,0г) у хлороформі (25мл) додають гідратацетилацетонат цинку (0,73г) і суміш гріють при кипінні під зворотним холодильником 30хвил. Після охолодження суміш енергійно перемішують з насиченим бікарбонатом натрію, органіку збирають і обробляють 35%-м водним гідразином (1,0мл) і перемішують при зовнішній температурі 16год. Реакційну суміш промивають водою і очищають хроматографією (етилацетат), отримуючи бажану сполуку як білу тверду речовину (1,04г). δ 1HCDCl3 0,93 (6Н, d), 2,21-2,26 (1Н, m), 2,21 (6Н, s), 3,39 (3Н, s), 3,68 (2Н, d), 3,90 (2H, s), 3,96 (3H, s). f) Мононатрієва сіль 6-[(3,5-диметил-1Нпіразол-4-іл)метил]-1,2,3,4-тетрагідро-3-метил-1(2-метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти 24 Продукт операції e) (19,0г) і гідроксид натрію (2,52г) розчиняють у ТГФ (400мл), воді (35мл) і метанолі (60мл). Після перемішування при зовнішній температурі протягом 24год. осад відфільтровують і промивають холодним ТГФ, одержуючи бажану сполуку як білу тверду речовину (17,2г). δ 1НD2О 0,90 (6Н, d), 2,18 (6Н, s), 2,20 (1Н, non), 3,34 (3Н, s), 3,72-3,77 (2Н, d), 3,89 (2H, s). g) (4S)-2-[[6-[(3,5-диметил-1Н-піразол-4іл]метил]-1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл-4-метил-4-ізоксазолідинол Суспензію продукту операції f) (200мг), продукту операції d) (81мг) і Pybrop (332мг) у ДХМ (10мл) обробляють триетиламіном (0,20мл) і суміш перемішують при зовнішній температурі протягом 16год., потім прямофазною (0% до 10% метанолу у ДХМ) і зворотнофазною (5% до 95% метанолу у 0,1% водного амонійацетату) хроматографією, отримуючи бажану сполуку як білу тверду речовину (90мг). δ 1НДМСО 130°С 0,90 (6Н, d), 1,41 (3Н, s), 2,08 (6Н, s), 2,18 (1Н, non), 3,23 (3Н, s), 3,67 (2Н, d), 3,59-3,72 (3Н, m), 3,77-3,82 (1Н, m), 3,78 (2Н, s), 4,92 (1Н, s), 11,67 (1Н, s). Приклад 2 (S)-2-[[6-[(3,5-диметил-1Н-піразол-4-іл)метил]1,2,3,4-тетрагідро-3-метил-1-(2-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол a) Метиловий естер 6-[(3,5-диметил-1Нпіразол-4-іл)метуіл]-1,2,3,4-тетрагідро-3-метил-1(2-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Отримують за процедурою Прикладу 1, операція e), застосовуючи метиловий естер 6(бромметил)-1,2,3,4-тетрагідро-3-метил-1-(2метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти. δ 1НCDCl3 1,53 (6Н, d), 2,21 (6Н, s), 3,36 (3Н, s), 3.59 (2Н, s), 3,96 (3Н, s), 4,47 (1H, s). b) Мононатрієва сіль 6-[(3,5-диметил-1Нпіразол-4-іл)метил]-1,2,3,4-тетрагідро-3-метил-1(2-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Отримують за процедурою Прикладу 1, операція f), з продукту операції а). δ 1НДMСО 1,44 (6Н, d), 2,10 (6Н, s), 3,17 (3Н, s), 3,72 (2Н, s), 4,32 (1Н, s). c) (4S)-2-[[6-(3,5-диметил-1Н-піразол-4іл)метил]-1,2,3,4-тетрагідро-3-метил-1-(2метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-метил-4-ізоксазолідинол Отримують за процедурою Прикладу 1, операція г), з продукту операції b) і продукту Прикладу 1, операція d). 25 81788 δ 1НДМСО 130°С 1,41 (3Н, s), 1,46 (6Н, d), 2,09 (6Н, s), 3,20 (3Н, s), 3,60-3,72 (3Н, m), 3,78-3,82 (1Н, m), 3,77 (2Н, s), 4,46 (1Н, sep), 4,94 (1Н, s), 11,71 (1Н, s). Приклад 3 1-цикпопропіл-6-[(3,S-диметил-1Н-піразол-4іл)метил]-5-[[(4S)-4-гідрокси-4-метил-2ізокcaзoлідиніл]карбоніл]-3-метилтієно[2,3d]піримідин-2,4(1Н,3Н)-діон. а) 3-етил-4-метиловий естер 2(циклопропіламіно)-5-метил-3.4тіосЬендикарбонової кислоти До розчину етилового естеру (трисренілфосфораніліден)-оцтової кислоти (15г) у безводному ТГФ (100мл) додають ізотіоціанатциклопропан (4,4г) і суміш витримують під зворотним холодильником в атмосфері азоту 20год. Після охолодження до зовнішньої температури реакційну суміш охолоджують до 78°С і додають розчин метилового естеру 3-бром2-оксо-бутанової кислоти (8,7г) у безводному ТГФ (10мл). Суміш залишають нагрітись до зовнішньої температури і потім витримують під зворотним холодильником 20год. і при зовнішній температурі ще 2 дні. Реакцію виливають у воду і екстрагують діетилетером. Зібраний органічний екстракт сушать над сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом і-гексан/етил ацетат (95:5), потім перетирають з і-гексан/діетилетером (8:2), отримуючи бажану сполуку як тверду речовину (7,5г). δ 1НСDСІ3 0,66 (2Н, m), 0,75 (2Н, m), 1,26 (3Н, t), 2,27 (3Н, s), 2,56 (1Н, m), 3,83 (3Н, s), 4,08 (2Н, quartet), 7,55 (1Η, bs). b) Метиловий естер 1-циклопропіл-1,2,3,4тетрагідро-6-метил-2,4-діоксотієно[2,3-d]піримідин-5-карбонової кислоти До суспензії ізоціанату срібла (4,4г) у безводному толуолі (30мл) краплями протягом 5хвил. додають ацетилхлорид (1,8мл) і суміш перемішують під азотом при зовнішній температурі протягом 35хвил. Додають розчин продукту частини а) (7,5г) у безводному толуолі (5мл) і суміш перемішують 20год. при зовнішній температурі. Реакцію розбавляють діетилетером і осад фільтрують. Фільтрат промивають розчином бікарбонату натрію, суша ть над сульфатом магнію, фільтрують і випарюють під зниженим тиском. Отримане масло (9г) обробляють розчином метоксиду натрію (21мл 25%-й (за масою) розчин у метанолі) і реакцію перемішують під азотом при зовнішній температурі протягом 20год. Суміш випарюють під зниженим тиском і отримане масло розділяють між етилацетатом і водою. Водний шар відділяють і фільтрують, отримуючи бажану сполуку як тверду речовину (3,16г). 26 MC (ESI) 281 [M+H]+ δ 1НДМСО 0,96 (2Н, m), 1,06 (2Н, m), 2,38 (3Н, s), 3,01 (1Н, m), 3,78 (3Н, s), 11,26 (1H, bs). c) Метиловий естер 1-циклопропіл-1,2,3,4тетрагідро-3,6-диметил-2,4-діоксотієно[2,3d]піримідин-5-карбонової кислоти До розчину продукту частини b) (3,15г) у безводному ДМФ (40мл) додають карбонат калію (1,9г) і метилйодид (0,84мл). Суміш перемішують під азотом при зовнішній температурі протягом 3 днів. Суміш виливають у воду і одержану тверду речовину збирають фільтруванням, отримуючи бажану сполуку як тверду речовину (2,8г). МС (ESI) 295 [М+Н]+ δ 1НДМСО 1,01 (2Н, m), 1,05 (2Н, m), 2,39 (3Н, s), 3,07 (1Н, m), 3,18 (3Н, s), 3,80 (3Н, s) d) Метиловий естер 6-(бромметил)-1циклопропіл-1,2,3,4-тетрагідро-3-метил-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти До суспензії продукту частини с) (2,8г) в етилацетаті (50мл) додають N-бромсукцинімід (1,9г) і азобіс-ізобутиронітрил (0,1г). Суміш гріють при кипінні під зворотним холодильником в атмосфері азоту 2год. і потім залишають охолонути. С уміш промивають холодним 0,5М розчином гідроксиду натрію, потім водою, сушать над сульфатом магнію, фільтрують і випарюють під зниженим тиском. Тверду речовину перетирають холодним діетилетером, отримуючи бажану сполуку як тверду речовину (2,8г). δ 1НСDСІ3 1,10 (2Н, m), 1,24 (2Н, m), 3,03 (1Н, m), 3,37 (3Н, s), 3,99 (3Н, s), 4,68 (2Н, s). е) Метиловий естер 1-циклопропіл-6-[(3,5диметил-1Н-піразол-4-іл)-метил]-1,2,3,4тетрагідро-3-метил-2,4-діоксотієно[2,3-d]піримідин5-карбонової кислоти Отримують з продукту частини d) за процедурою Прикладу 1, частини е), отримуючи бажану сполуку як тверду речовину. МС (ESI) 389 [М+Н]+ δ 1НДМСО 0,93 (2Н, m), 1,04 (2Н, m), 2,07 (6Н, m), 3,02 (1Н, m), 3,17 (3Н, s), 3,78 (3Н, s), 3,81 (2Н, s), 12,12 (1Н, bs) f) Мононатрієва сіль 1-циклопропіл-6-[(3,5диметил-1Н-піоазол-4-іл)метил]-1,2,3,4-тетрагідро3-метил-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Отримують з продукту частини е) за процедурою Прикладу 1, частини f), як тверду речовину. МС (ESI) 375 [М+Н]+ δ 1НДМСО 0,84 (2Н, m), 1,02 (2Н, m), 2,06 (6Н, s), 2,94 (1Н, m), 3,17 (3Н, s), 3,75 (2Н, s), 11,98 (1Н, bs). g) 1-цикпопропіл-6-[(3,5-диметил-1Н-піразол-4іл)метил]-5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метилтієно[2,3d]піримідин-2,4(1Н,3Н)-діон Отримують з продукту частини f) за процедурою Прикладу 1, частини g), як тверду речовину. МС (ESI) 460 [М+Н]+ δ 1НДМСО 0,93 (2Н, m), 1,03 (2Н, m), 1,37-1,42 (3Н, m), 2,08 (6Н, bs), 3,02 (1Н, m), 3,15 (3Н, m), 3,58-3,80 (6Н, m), 5,41 (1Н, br s) 27 81788 Приклад 4 (S)-2-[[6-[(1Η-1,2,3-бензотриазол-1-іл)-метил]1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол Отримують за процедурою Прикладу 1, частини g), з 6-[(1Н-1,2,3-бензотриазол-1іл)метил]-1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримщин-5карбонової кислоти (0,15г), у вигляді піни (0,042г). δ 1НСDСІ3 1,51 (9Н, m, вкл. Н2О), 3,34 (3Н, s), 3,47 (1Н, d), 3,82 (1Н, d), 3,97 (1Н, d), 4,52 (1Н, bm), 4,54 (1Н, d), 5,34 (1H,s), 6,00 (2Н, dd), 7,38 (1Н, t), 7,49 (1Н, t). Приклад 5 (S)-2-[[6-[(4,5-дихлор-2-метил-1Н-імідазол-1іл)метил]-1,2,3,4-тетрагідро-1-етил-3-метил-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол Отримують за процедурою Прикладу 1, частини g), застосовуючи 6-[(4,5-дихлор-2-метил1Н-імідазол-1-іл)метил]-1,2,3,4-тетрагідро-1-етил3-метил)-2,4-діоксотієно[2,3-d]піримідин-5карбонову кислоту, ви хід (0,094г), точка плавл. 130-133°С δ 1HCDCl3 1-38 (3Н, t), 1,52 (3Н, s), 2,40 (3Н, s), 3,39 (3Н, s), 3,43 (1Н, d), 3,38 (1Н, d), 3,96 (1Н, d), 4,00 (2Н, m), 4,46 (1Н, d), 5,23 (2Н, dd), 5,27 (1Н, s). Приклад 6 5-[[(S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(2метипропіл)-6-(1Н-піроло[[2,3-d]b]піридин-3ілметил)тієно[[2,3-d]b]піримідин-2,4-(1Н,3Н)-діон а) Метиловий естер 1,2,3,4-тетрагідро-3метил-1-(2-метилпропіл)-2,4-діоксо-6-(1Нпіроло[2,3-b]піридин-3-ілметил)тієно[23d]пiримідин-5-карбонової кислоти До розчину 7-азаіндолу (0,78г) у безводному ТГФ (30мл) краплями додають 2,5М n-BuLi у гексані (2,6мл) при 10°С під азотом. Після 15хвилинного перемішування до суміші додають 28 1,0М хлорид цинку в етері (6,61мл) і суміш перемішують при кімнатній температурі 2год. Розчинник видаляють у вакуумі і залишок розбавляють безводним толуолом (20мл) і потім додають розчин метилового естеру 6(бромметил)-1,2,3,4-тетрагідро-3-метил-1-(2метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти (2,0г) у безводному толуолі (10мл) і каталітичну кількість йодиду калію, і реакційну суміш перемішують під азотом 48год. Розчинник зливають, розбавляють водою і екстрагують етилацетатом, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом ігексан/етил ацетат (1:1), отримуючи бажану сполуку (1,37г). МС (ESI) 427 [М+Н]+ b) 1,2.3,4-тетрагідро-3-метил-1-(2метилпропіл)-2,4-діоксо-6-(1Н-піроло[2,3b]піридин-3-ілметил)тієно[2,3-d]піримідин-5карбонова кислота До розчину продукту частини а) у ТГФ (15мл) і метанолі (7,5мл) додають 1N гідроксид натрію (7,5мл) і суміш перемішують під азотом 18год., потім підкислюють 2,5N хлоридною кислотою і екстрагують ДХМ, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском, отримуючи бажану сполуку як тверду речовину (1,22г). MC (ESI) 413 [M+H]+ с) 5-[[4S)-4-гідрокси-4-метил-2ізоксазолідинілкарбонiл-3-метил-1-(2метилпропіл)-6-(1Н-піроло[2,3-b]піридин-3ілметил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон Отримують з продукту частини b) за процедурою Прикладу 1, частини g), отримуючи сполуку як тверду речовину. МС (АРСІ) 427 [М+Н]+ δ 1НДМСО 0,82-0,85 (6Н, m), 1,33-1,45 (3Н, m), 2,04-2,12 (1Н, m), 3,16-3,20 (3Н, m), 3,37-3,99 (6Н, m), 4,13423 (2Н, m), 5,45-5,48 (1Н, m), 6,99-7,02 (1Н, m), 7,42-7,43, (1Н, m), 7,91-7,96 (1Н, m), 8,188,19 (1Н, m), 11,52-11,55 (1Н, m) Приклад 7 (4S)-4-метил-2-[[1,2,3,4-тетрагідро-3-метил2,4-діоксо-1-пропіл-6-(4-хінолінілметил)-тієно[2,3d]піримiдин-5-іл]карбоніл]-4-ізоксазолідинол Отримують за процедурою Прикладу 1, операція g), з натрієвої солі 1,2,3,4-тетрагідро-3метил-2,4-діоксо-1-пропіл-6-(4хінолінілметил)тієно[2,3-d]піримідин-5-карбонової кислоти і продукту Прикладу 1, операція d). δ 1НДМСО 120°С 0,85 (3Н, t), 1,39 (3Н, s), 1,66 (2Н, sex), 3,23 (3Н, s), 3,63-3,87 (6Н, m), 4,59 (2Н, 29 81788 s), 5,03 (1Н, s), 7,42 (1Н, s), 7,61 (1Н, t), 7,74 (1Н, t), 8,04 (1Н, d), 8,23 (1H, d), 8,83 (1H, s). Приклад 8 (4S)-2-[[6-[(2,4-дихлоp-5-тіазолілметил]-1,2,3,4тетрагідpо-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол а) Етиловий естер 6-[(2,4-дихлор-5тіазоліл)гідроксиметил]-1,2,3,4-тетрагідро-3-метил1-(2-метилпропіл)-2,4-діоксотієно[2,3-d]піримідин5-карбонової кислоти До розчину етил 3-метил-1-(2-метилпропіл)2,4-діоксо-1,2,3,4-тетрагідротієно[2,3-d]-піримідин5-карбоксилату (1,5г), 2,4-дихлортіазол-5карбоксальдегіду (1,75г) і DMPU (1,2мл) у ТГФ (25мл) при -78°С додають LDA (10ммоль). Додають оцтову кислоту (3мл) і суміш залишають нагрітись до зовнішньої температури. Суміш розділяють між етилацетатом і водою, органіку збирають, сушать над сульфатом магнію і концентрують до сухості. Залишок очищають нормальнофазовою хроматографією (3:1 ігексан/етилацетат), отримуючи бажану сполуку як жовту піну (0,45г). δ 1HCDCI3 0,98 (3Н, d), 0,99 (3Н, d), 1,40 (3Н, t), 2,22-2,35 (1Н, m), 3,40 (3Н, s), 3,76 (1Н, d), 3,81 (1Н, d), 4,40-4,47 (2Н, m), 6,30 (1Н, s). b) Етиловий естер 6-[(2,4-дихлор-5тіазоліл)метил]1,2,3,4-тетрагідро-3-метил-1-(2метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Розчин продукту операції а) (0,45г) у ДХМ (2мл) обробляють трифлуороцтовою кислотою (2мл) і триетилсиланом (1,5мл). Розчин гріють при кипінні під зворотним холодильником 3год. Суміш концентрують до сухості і залишок очищають хроматографією на SiO2 (4:1 і-гексан/етилацетат), отримуючи бажану сполуку як жовте масло (294мг). δ 1HCDCI3 0,98 (6Н, d), 1,42 (3Н, t), 2,27 (1Н, non), 3,39 (3Н, s), 3,75 (2Н, d), 4,24 (2Н, s), 4,46 (2H, q). c) Натрієва сіль 6-[(2,4-дихлор-5тіазоліл)метил]-1,2,3,4-тетрагідро-3-метил-1-(2метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Отримують за процедурою Прикладу 1, операція f), з продукту операції b). δ 1НДМСО 0,92 (6Н, d), 2,18 (1Н, non), 3,27 (3Н, s), 3,75 (2Н, d), 4,50 (2Н, s). d) (4S)-2-[[6-[(2,4-дихлор-5-тіазоліл)метил]1,2,3,4-тетрагідро-3-метил-1-(2-мeтилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол 30 Отримують за процедурою Прикладу 1, операція g), з продукту операції с) і продукту Прикладі 1, операція d). δ 1НДМСО 120°С 0,93 (6Н, d), 1,40 (3Н, s), 2,22 (1Н, non), 3,23 (3Н, s), 3,65-3,81 (6Н, m), 4,25 (2H,s), 5,02 (1H, s). Приклад 9 (4S)-2-[[6-[(3-бром-2-тієніл)метил]-1,2,3,4тетрагідро-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол a) Етиловий естер 6-[(3-бром-2тієніл)гідроксиметил]-1,2.3,4-тетрагідро-3-метил-1(2-метилпропіл)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Отримують за процедурою Прикладу 8, операція а), з 3-бром-2-тіoфенкарбоксальдегіду. δ 1НCDCI3 0,96 (3Н, d), 0,97 (3Н, d), 1,38 (3Н, t), 2,27 (1Н, non), 3,39 (3Н, s), 3,66 (1Н, d), 3,71 (1Н, dd), 3,79 (1Н, dd), 4,38-4,46 (2Н, m), 6,38 (1Н, d), 6,98 (1Н, d), 7,35 (1Н, d). b) Етиловий естер 6-[(3-бром-2-тієніл)метил]1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти Отримують за процедурою Прикладу 8, операція b), з продукту операції а). δ 1НCDCI3 0,96 (6Н, d), 1,42 (3H, t), 2,25 (1Н, non), 3,39 (3Н, s), 3,72 (2Н, d), 4,32 (2Н, s), 4,47 (2Н, q), 6,96 (1Н, d), 7,23 (1Н, d). c) Натрієва сіль 6-[(3-бром-2-тієнілметил]1,2,3,4-тетрагідро-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти Отримують за процедурою Прикладу 1, операція f), з продукту операції b). δ 1ΗДМСО 0,87 (6Н, d), 2,16 (1Н, non), 3,21 (3Н, s), 3,66 (2Н, d), 4,20 (2Н, s), 7,04 (1Н, d),7,53 (1H, d). d) (4S)-2-[[6-[(3-бром-2-тієніл)метил]-1,2,3,4тетрагідро-3-метил-1-(2-метилпропіл)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол Отримують за процедурою Прикладу 1, операція g), з продукту операції с) і продукту Прикладу 1, операція d). δ 1НДМСО 120°С 0,91 (6Н, d), 1,40 (3Н, s), 2,19 (1Н, non), 3,23 (3Н, s), 3,65-3,81 (6Н, m), 4,24 (2Н, s), 5,00 (1Н, s), 7,01 (1H,d), 7,51 (1Н, d). Приклад 10 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[[5-метил-3-(трифлуорметил)-1Н-піразол-4іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон 31 81788 32 Приклади 6-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-4-метил-2Ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон а) 1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)6-[[5нметил-3-(трифлуорметил)-1Н-піразол-4іл]метил]-2,4-діоксотієно[2,3-d]піримідин-5карбонова кислота До суспензії метилового естеру 6(бромметил)-1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти (1,4г) у хлороформі (15мл) додають ацетат цинку (0,82г) і 1,1,1-трифлуор-2,4пентандіон (0,55мл). Суміш гріють при кипінні під зворотним холодильником 3год., потім залишають охолонути, розбавляють ДХМ і промивають розчином бікарбонату натрію. Органічний шар відділяють і водну фазу екстрагують ДХМ. Об'єднані органічні екстракти сушать над сульфатом магнію і випарюють під зниженим тиском. Отримане масло розчиняють в етанолі (15мл) і обробляють гідразинмоногідратом (0,24мл), реакцію перемішують при зовнішній температурі 20год., потім випарюють під зниженим тиском, розчиняють в ацетонітрилі (10мл), обробляють 2М розчином НСІ (10мл) і гріють при кипінні під зворотним холодильником 20год. Одержану тверду речовину збирають фільтруванням, промивають водою і діетилетером, отримуючи бажану сполуку як тверду речовину (0,68г). МС (ESI) 431 [М+Н]+ δ 1ΗДМСО 1,44 (6Н, d), 2,22 (3Н, s), 3,23 (3Н, s), 4,20 (2Н, s), 4,36 (1Н, bs), 13,44 (1Н, bs) b) 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[[5-метил-3-(трифлуорметил)-1Н-піразол-4іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон До суспензії продукту частини а) (0,2г) у безводному ДМФ (3мл), додають триетиламін (0,29мл), 1-гідроксибензотриазол (0,078г) і потім діетилхлорфосфа т (0,075мл) і суміш перемішують при зовнішній температурі під азотом 1год. 15 хвил. Додають (4S)-4-метил-4ізоксазолідинолгідрохлорид (0,07г) і реакційну суміш перемішують при зовнішній температурі протягом 20год., потім концентрують під зниженим тиском, розбавляють насиченим розчином бікарбонату натрію і екстрагують ДХМ. Органічні екстракти сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом ДХМ/метанол (98:2), потім ДХМ/метанол (96:4), отримуючи бажану сполуку як тверду речовину (0,11г). МС (ESI) 516 [М+Н]+ δ 1ΗДМСО 1,24-1,38 (3H, m), 1,44 (6H, s), 2,20 (3Н, s), 3,18 (3H, s), 3,62 (2Н, m), 3,75 (2Н, m), 3,82 (2Н, m), 4,37 (1Н, bs), 5,23-5,42 (1Н, m), 13,38 (1Н, bs). а) Метиловий естер 6-[[3,5-диметил-1-(2піридил)-1Н-піразол-4-іл]метил-1,2,3,4-тетрагідро3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3d]піримідин-5-карбонової кислоти Отримують з метилового естеру 6(бромметил)-1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти, гідратацетилацетонату цинку і 2-гідразинпіридину за процедурою Прикладу 1, частини е). MC (ESI) 468[M+H]+ δ 1ΗДМСО 1.45 (6Н, d), 2,16 (3Н, s), 2,56 (3Н, s), 3,18 (3Н, s), 3,78 (3Н, s), 3,95 (2Н, s), 4,40 (1Н, s, br), 7,31-7,34 (1Н, m), 1.19-1.Z2 (1Н, m), 7,93-7,97 (1Н, m), 8,45-8,47 (1H,m). b) 6-[[3,5-диметил-1-(2-піридил)-1Н-піразол-4іл]метил-1,2,3,4-тетрагідро-3-метил-1-(1метилетип)-2,4-діоксотієно[2,3-d]піримідин-5карбонов кислота. Отримують з продукту частини а) за процедурою Прикладу 6, частини b), як тверду речовину. MC (ESI) 454 [M+H]+ с) 6-[[3,5-диметил-1-(2-піридиніл-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4(1Н,3Р)-діон Отримують з продукту частини b) за процедурою Прикладу 1, частини g), як тверду речовину. МС (АРСІ) 539 [М+Н]+ δ 1ΗДМСО 1,23-1,46 (9Н, m), 2,17-2,18 (3Н, m), 2,55-2,58 (3Н, m), 3,18-3,19 (3Н, m), 3,57-3,94 (6Н, m), 4,38 (1Н, s, br), 5,42 (1Н, d), 7,30-7,34 (1Н, m), 7,81 (1Н, d), 7,93-7,97 (1Н, m), 8,45-8,47 (1Н, m) Приклад 12 5-[[(4S)-4-гідрокси-4метилізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)-6-(1Н-піроло[2,3-b]піридин-3іл]метил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон 33 81788 а) Натрієва сіль 1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксо-6-(1Н-піроло[2,3b]піридин-3-ілметил)-тієно[2,3-d]піримідин-5карбонової кислоти Отримують з метилового естеру 6(бромметил)-1,2,3,4-тетрагідро-3-метил-1-(1метил-етил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти (0,45г, 1,20ммоль) і 7азаіндолу (0,17г, 1,44ммоль), за процедурою Прикладу 6, частини а). Залишок очищають кремнеземною хроматографією з градієнтним елюентом від 50% етилацетату в ізогексан до 100% етилацетату, отримуючи безбарвне масло (0,27г). 0,1г цього масла розчиняють у ТГФ (2мл) і обробляють 1М розчином гідроксиду натрію (0,8мл) і 0,5мл метанолу. Через 5год. осад відфільтровують і промивають з ТГФ і етером, отримуючи бажану сполуку як блідожовту тверду речовину. MC (ES) 399 [M+H]+ b) 5-[[(4S)-4-гідрокси-4метилізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)-6-(1Н-піроло[2,3-b]піридин-3-ілметил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон Отримують з продукту Прикладу 12, частини а) (0,2г) і продукту Прикладу 1, частини d) (0,08г), за процедурою Прикладу 1, частини д). Залишок очищають зворотнофазовою РХВР (від 95% до 50% водного 0,1%-го амонійацетату в ацетонітрилі), отримуючи бажану сполук як білу піну (0,1г). МС (АРСІ) 484,1642 [М+Н]+ δ 1ΗДМСО 1,23-1,44 (9Н, d+s), 3,18 (3Н, s), 3,44,4 (7Н, межі у млн -1), 5,45 (1Н, bs), 7-7,06 (1Н, m), 7,43 (1Н, s), 7,93-7,99 (1Н, m), 8,18-8,20 (1Н, d), 11,53 (1Н, s). Приклад 13 (4S)-2-[[6-[[3,5-димeтил-1-(4-піридиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-метил-4-ізоксазолідинол a) Етиловий естер 6-[[3,5-диметил-1-(4піридиніл)-1Н-піразол-4-іл]метил]-1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти До розчину продукту Прикладу 2, операція а), (500мг) в ацетонітрилі (5мл) додають 4хлорпіридингідрохлорид (550мг). Суміш піддають мікрохвильовому опромінюванню (100Вт, 140°С) протягом 20хвил. Суміш концентрують до сухості і очищають хроматографією на SiO2 (EtOAc до 20% МеОН у ЕtOАс), отримуючи бажану сполуку як білу тверду речовину (200мг). 34 δ 1ΗДМСО 1,55 (6Н, d), 2,27 (3Н, s), 2,41 (3Н, s), 3,37 (3Н, s), 3,94 (3Н, в), 3,96 (2Н, в), 4,46 (1Н, s), 7,49 (2Н, dd), 8,69 (2Н, dd). b) Натрієва сіль 6-[[3,5-диметил-1-(4піридиніл)-1Н-піразол-4-іл]метил]-1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти Отримують за процедурою Прикладу 1, операція f), з продукту операції а). δ 1ΗДМСО 1,45 (6Н, d), 2,21 (3Н, s), 2,46 (3Н, s), 3,17 (3Н, s), 3,85 (2Н, s), 4,32 (1Н, s), 7,62 (2Н, dd), 8,63 (2Н, dd). с) (4S)-2-[[6-[[3,5-диметил-1-(4-піридиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно-[2,3-d]піримідин-5іл]карбоніл]-4-метил-4-ізоксазолідинол Отримують за процедурою Прикладу 1, операція g), з продукту операції b) і продукту Прикладу 1, операція d). δ 1ΗДМСО 120°С, 1,40 (3H,s), 1,48 (6Н, d), 2,18 (3H, s), 2,39 (3Н, s), 3,21 (3Н, s), 3,65 (1Η, s), 3,70 (2H, d), 3,80 (1H, d), 3,89 (2H, s), 4,47 (1H, sep), 7,55 (2H, d), 8,62 (2H, d). Приклад 14 (4S)-2-[[6-[[3,5-диметил-1-(2-піримідиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-метил-4-ізоксазолідинол a) Етиловий естер 6-[[3,5-диметил-1-(2піримідиніл)-1Н-піразол-4-іл]метил]-1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти Отримують за процедурою Прикладу 13, операція а), з 2-хлорпіримідину. δ 1НCDCI3 1,52 (6Н, d), 2,31 (3Н, s), 2,65 (3Н, s), 3,37 (3Н, s), 3,98 (5Н, s), 4,45 (1Н, s), 7,19 (1H, t), 8,78 (2H, d). b) Натрієва сіль 6-[[3,5-диметил-1-1-(4піримідиніл)-1Н-піразол-4-іл]метил]-1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти Отримують за процедурою Прикладу 1, операція f), з продукту операції а). δ 1HD2O 1,49 (6Н, s), 2,27 (3Н, s), 2,54 (3Н, s), 3,31 (3Н, s), 3,98 (1Н, s), 4,45 (1Н, s), 7,51 (1H, s), 8,86 (2H, s). c) (4S)-2-[[6-[[3,5-диметил-1-(4-піримідиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1—метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-метил-4-ізоксазолідинол Отримують за процедурою Прикладу 1, операція f), з продукту операції b). δ 1НДМСО 120°С 1,40 (3Н, s), 1,47 (6Н, d), 2,18 (3Н, s), 2,52 (3Н, s), 3,21 (3Н, s), 3,63-3,72 (3Н, m), 35 81788 3,78-3,83 (1Н, m), 4,46 (1Н, sep), 4,98 (1Н, s), 7,38 (1Н, t), 8,81 (2Н, d). Приклад 15 5-[[(4S)-4-гідрокси-4-метил-2-ізоксазол ідинілікарбонілі-3-метил-1-(1-метилетил)-6-[(1феніл-1Н-піразол-4-іл)метил]-тієно[2,3-d]піримідин2,4-(1Н,3Н)-діон a) Етиловий естер 1,2,3,4-тетрагідро-6[гідрокси(1-феніл-1Н-піразол-1-4-іл)метил]-3метил-1-(1-метилетил)-2,4-діоксотієно[2,3d]піримідин-5-карбонової кислоти До розчину етилового естеру 1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно-[2,3-d]піримідин-5-карбонової кислоти (2,0г), 1-феніл-1Н-піразол-4-карбоксальдегіду (1,39г) і 1,3-диметил-3,4,5,6-тетрагідро-2(1Н)піримідинону (1,63мл) у безводному ТГФ (35мл) при -78°С під азотом додають 2,0М розчин LDA (3,72мл) і суміш перемішують 3год. Додають льодяну оцтову кислот (1,5мл), суміш залишають нагрітись до кімнатної температури, розбавляють водою і екстрагують етилацетатом, органічні екстракти промивають водою, суша ть над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом з і-гексан/етил ацетат (4:1), потім і-гексан/етил ацетат (1:1), отримуючи бажану сполуку (2,32г). MC (ESI) 469 [M+H]+ b) Етиловий естер 1,2,3,4-тетрагідро-3-метил1-(1-метилетил)-2,4-діоксо-6-[(1-феніл-1Н-піразол4-іл)метил]тієно[2,3-d]піримідин-5-карбонової кислоти Розчин продукту частини а) (2,32г), трифлуороцтову кислоту (10мл) і триетилсилан (5мл) у ДХМ (5мл) гріють при 40°С під азотом 24год. Розчинник видаляють у вакуумі, залишок розбавляють водним розчином бікарбонату натрію і екстрагують ДХМ, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом ігексан/етил ацетат (9:1) і потім і-гексан/етил ацетат (4:1), отримуючи бажану сполуку (2,11г). MC (ESI) 453 [M+H]+ δ 1НДМСО 1,26 (3Η, t), 1,47 (6Н, d), 3,19 (3Н, s), 4,04 (2Н, s), 4,29 (2Н, q), 4,37 (1Н, s, br), 7,28-7,32 (1H, m), 7,47-7,51 (2H, m), 7,65 (1H, s), 7,78-7,81 (2H, m), 8,40 (1H, s) с) 1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)2,4-діоксо-6-[(1-феніл-1Н-піразол-4-іл)метил]тієно[2,3-d]піримідин-5-карбонова кислота 36 Отримують з продукту частини b) за процедурою Прикладу 6, частини b), як тверду речовину. MC (ESI) 425 [M+H]+ d) 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл)карбоніл]-3-метил-1-(1-метилетил)6-[(1-феніл-1Н-піразол-4-іл)метил]тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон До розчину продукту частини с) (0,5г), продукту Прикладу 1, частини d) (0,18г), і 1гідроксибензотриазолу (0,36г) у ДХМ (10мл) додають триетиламін (0,36мл) і гідрохлорид N-(3диметиламінопропіл)-N'-етилкарбодііміду (0,45г) і суміш перемішують при зовнішній температурі під азотом 18год., потім розбавляють водою і екстрагують ДХМ, органічні екстракти промивають 1.0N гідроксидом натрію і водою, суша ть над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі, з елюентом етилацетат/метанол (99:1) і потім етилацетат/метанол (49:1), отримуючи бажану сполуку як тверду речовину (0,14г). МС (АРСІ) 496 [М+Н]+ δ 1НДМСО 1,46-1,52 (6Н, m), 3,18-3,20 (3Н, m), 3,51412 (6Н, m), 4,41454 (1Н, m), 4,62-4,79 (1Н, m), 5,48-5,56 (1Н, m), 7,30 (1Н, t), 7,49 (2Н, t), 7,64-7,68 (1Н, m), 7,79 (2Н, d), 8,39 (1H, s). Приклад 16 6-[(8-Флуорхінолін-4-іл)метил]-5-{[(4S)-4гідрокси-4-метилізоксазолідин-2-іл]карбоніл}-1ізопропіл-3-метилтієно[2,3-d]піримідин-2,4(1,3Н)діон а) 8-Флуор-4-метилхінолін До розчину 2-флуораніліну (25мл) в етанолі (185мл) додають конц. хлоридну кислоту (21мл), хлоридгексагідрат заліза (III) (111г) і хлорид цинку (II) (4,1г) і суміш доводять до 60°С. Краплями протягом 45хвил. додають вінілкетон (25мл) і суміш гріють при кипінні під зворотним холодильником 2год. Реакційну суміш залишають охолонути, потім випарюють під зниженим тиском. Отримане масло підлужують до рН12 2М розчином гідроксиду натрію, фільтрують через арбосел і водну фазу екстрагують етилацетатом (´2). Об'єднані органічні екстракти сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом і-гексан/діетилетер (3:1) і потім і-гексан/діетилетер (2:1), отримуючи бажану сполуку як тверду речовину (8,25г). МС (ESI) 162 [М+Н]+. δ 1НCDCI3 2,72 (3Н, s), 7,28 (1Н, m), 7,39 (1Н, m), 7,49 (1Н, m), 7,77 (1Н, d), 8,83 (1H, d). b) 8-Флуор-4-хінолінкарбоксальдегід 37 81788 До розчину продукту частини а) (8,25г) у діоксані (20мл) при 70°С протягом 20хвил. додають краплями розчин діоксиду селену у діоксані (15мл) і воді (5мл). Реакційну суміш гріють при кипінні під зворотним холодильником 2,5год. і потім витримують при зовнішній температурі ще 20год. До суміші додають етилацетат і суспензію зливають з твердої речовини. Органічний шар випарюють під зниженим тиском і залишок очищають колонною хроматографією на кремнеземі з елюентом ДХМ/діетил етер (1:1), отримуючи бажану сполуку як тверду речовину (3,61г). MC (ESI) 176 [M+H]+ δ 1НCDCI3 7,54 (1Н, m), 7,67 (1Н, m), 7.S3 (1Н, d), 8,82 (1Н, d), 9,26 (1Н, d), 10,52 (1H, s). c) Етиловий естер 6-[(8-флуор-4хінолін)гідроксиметил]-1,2,3,4-тетрагідро-3-метил1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти До розчину етилового естеру 1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5-карбонової кислоти (1,5г), продукту частини b) (1,2г) і 1,3-диметил-3,4,5,6тетрагідро-2(1Н)-піримідинону (1,3мл) у безводному ТГФ (20мл) додають свіжий розчин LDA (2,4мл 2,5М n-BuLi, 0,92мл діізопропіламіну у безводному ТГФ (10мл)) при -78°С під азотом і суміш перемішують 1,5год. Додають льодяну оцтову кислоту (3мл), суміш залишають нагрітись до кімнатної температури, розбавляють насиченим розчином бікарбонату натрію і екстрагують ДХМ (´2), органічні екстракти сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом і-гексан/етилацетат (80:20), далі і-гексан/етилацетат (60:40) і потім ігексан/етилацетат (25:75), отримуючи бажану сполуку як тверду речовину (0,81г). MC (ESI) 472 [M+H]+ δ 1НCDCI3 1,40 (3Н, t), 1,46 (6Н, d), 3,35 (3Н, s), 3,76 (1Н, d), 4,36 (1Н, bs), 4,48 (2Н, quartet), 6,74 (1Н, d), 7,44 (2Н, m), 7,72 (1Н, d), 7,93 (1Н, d), 9,06 (1Н, d) d) Етиловий естер 6-[(8-флуор-4хінолін)метил]-1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти До дегазованого розчину продукту частини с) (0,8г) у безводному ТГФ (15мл) під азотом додають триетиламін (0,85мл) і трифлуороцтовий ангідрид (0,4мл). Реакційну суміш перемішують при зовнішній температурі 2год. До суміші під азотом додають 10% паладію на вугіллі (0,1г) і гідрогенують при 4бар і зовнішній температурі протягом 20год. Суміш фільтрують через подушку целіту під азотом, промивають етилацетатом і фільтрат випарюють під зниженим тиском. Отриману маслянисту тверду речовину перетирають з діетил/етилацетатом (95:5), фільтрують під азотом, промивають діетилетером і суша ть у вакуумі, отримуючи бажану сполуку як тверду речовину (0,42г). МС (ESI) 456 [М+Н]+ 38 δ 1НCDCI3 1-37 (3Н, t), 1,54 (6Н, d), 3,37 (3Н, s), 4,42 (2Н, quartet), 4,45 (1Н, bs), 4,60 (2Н, s), 7,38 (1Н, d), 7,43 (1Н, m), 7,56 (1Н, m), 7,92 (1Н, d), 8,95 (1Н, d) е) Натрієва сіль 6-[(8-флуор-4хінолініл)метил]-1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти До дегазованого розчину продукту частини d) (0,42г) у ТГФ (6мл)/метанолі (1мл) під азотом додають 1N розчин гідроксиду натрію (1,4мл) і суміш перемішують при зовнішній температурі 72год. Реакційну суміш випарюють під зниженим тиском, азеотропують з діетилетером (´2), перетирають з діетилетером, фільтрують і сушать у вакуумі, отримуючи бажану сполуку як тверду речовину (0,36г). МС (ESI) 428 [М+Н]+ δ 1ΗДМСО 1,38 (6Н, d), 4,25 (1Н, bs), 4,56 (2Н, s), 7,55 (2Н, m), 7,63 (1Н, d), 8,47 (1Н, m), 8,86 (1H, d). f) 6-[(8-флуорхінолін-4-іл)метил]-5-{[(4S)-4гідрокси-4-метилізоксазолідин-2-іл]карбоніл}-1ізопропіл-3-метилтієно[2,3-d]піримідин-2,4(1Н,3Н)діон До суспензії продукту частини e) (175мг) у ДХМ (3мл) додають 1-гідрокси-бензотриазол (66мг) і суміш перемішують при зовнішній температурі під азотом 20хвил. Додають гідрохлорид N-(3-диметиламінопропіл)-N'етилкарбодііміду (95мг) і суміш перемішують 1год. Додають продукт Прикладу 1, частини d), (70мг) і триетиламін (0,07мл) і суміш перемішують при зовнішній температурі під азотом 72год. Суміш розбавляють водою і екстрагують ДХМ (´3), об'єднані органічні екстракти сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом ДХМ/метанол (98:2) і потім очищають зворотнофазовою РХВР (95% до 50% водного 0,1%-го амонійацетату в ацетонітрилі), отримуючи бажану сполуку як білу тверду речовину (45мг). MC (ESI) 513 [М+Н]+ δ 1ΗДМСО 1,16-1,35 (3Η, m), 1,43 (6Н, m), 3,19 (3Н, m), 3,57-3,82 (4Н, m), 4,37 (1Н, bs), 4,60 (2Н, m), 5,22-5,48 (1Н, m), 7,61 (3Н, m), 8,11 (1Н, m), 8,91 (1Н, d) Приклад 17 5-{[(4S)-4-гідрокси-4-метилізоксазолідин-2іл)карбоніл}-1-ізопропіл-3-метил-6-(4-піримідин-2ілбензил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон До дегазованої суспензії 4-формілфенілборної кислоти (100мг), 2-бромпіримідину (107мг) і 39 81788 карбонату натрію (212мг) в ацетонггрилі (2мл) і воді (2мл) додають свіжий тетракіс(трифенілфосфін)паладій (0) (40мг) і суміш гріють при кипінні під зворотним холодильником пiд азотом 20год. Охолоджену реакційну суміш розбавляють водою і екстрагують етилацетатом (´2). Об'єднані органічні екстракти сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом ізо-гексан/етилацетат (75:25), отримуючи бажану сполуку як тверду речовину (90мг). b) Етиловий естер 1,2,3,4-тетрагідро-6[[гірокси[4-(2-піримідиніл)феніл]метил]-3-метил1(1-метилетил)-2-діоксотієно[2,3-d]піримідин-5карбонової кислоти Отримують з продукту частини а) за процедурою Прикладу 16, частини с), у вигляді піни. MC (ESI) 481 [М+Н]+ δ 1HCDCl3 1,36 (3Н, t), 1,55 (6Н, d), 3,36 (3Н, s), 3,50 (1Н, d), 4,39 (2Н, quartet), 4,51 (1Н, bs), 6,19 (1Н, d), 7,21 (1Н, t), 7,60 (2Н, d), 8,46 (2Н, d), 8,82 (2Н, d). c) Етиловий естер 1,2,3,4-тетрагідро-3-метил1-(1-метилетил)-2,4-діоксо-6-[[4-(2піримідиніл)феніл]метил]тієно[2,3-d]піримідин-5карбонової кислоти Розчин продукту операції b) (1,37г) у ДХМ (10мл) обробляють трифлуороцтовою кислотою (10мл) і триетилсиланом (10мл). Розчин гріють при кипінні під зворотним холодильником 48год. під азотом. Суміш залишають охолонути, концентрують до сухості і азеотропують з ДХМ. Залишок розчиняють у ДХМ і промивають насиченим розчином карбонату натрію (´4) і потім водою (´1), суша ть над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок перемішують в ізо-гексані 24год., фільтрують і промивають ізо-гексаном, отримуючи тверду речовину (800мг). З швидким перемішуванням до розчину цієї твердої речовини (800мг) в ацетоні (15мл) додають краплями насичений розчин перманганату калію в ацетоні (1мл) до утворення темнокоричневої суспензії. Суміш перемішують відкритою до повітря при зовнішній температурі 15хвил. Додають насичений розчин перманганату калію в ацетоні (0,5мл) і суміш перемішують 10хвил. (і ще двічі). Суміш фільтрують через арбосел і фільтрат випарюють під зниженим тиском. Арбосел суспендують в ацетоні, фільтрують, об'єдн ують з отриманим вище залишком і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом ізогексан/етилацетат (1:1), отримуючи бажану сполуку як тверду речовину (400мг). MC (ESI) 465 [M+H]+ δ 1HCDCl3 1,38 (3Н, t), 1,55 (6Н, d), 3,37 (3Н, s), 4,19 (2Н, s), 4;4б (2Н, quartet), 4,50 (1Н, bs), 7,18 (1Н, t), 7,39 (2Н, d), 8,42 (2Н, d), 8,78 (2Н, d) d) Моногідрохлорид 1,2,3,4-тетрагідро-3метил-1-(1-метилетил)-2,4-діоксо-6-[[4-(2 40 піримідиніл)Феніл1метил]-тієно[2,3-d]піримідин-5карбонової кислоти До суспензії продукту частини с) (560мг) в ацетонітрилі (5мл) додають 2М розчин хлоридної кислоти (5мл) і суміш гріють при кипінні під зворотним холодильником 4год. Суміш залишають охолонути і тверду речовину збирають фільтруванням, промивають водою і сушать у вакуумній печі при 50°С 20год., отримуючи бажану сполуку як тверду речовину (440мг). MC (ESI) 437 [M+H]+ δ 1НДМСО 1-45 (6Н, d), 3,23 (3Н, s), 4,35 (2Н, s), 4,44 (1Н, bs), 7,45 (3Н, m), 8,36 (2Н, d), 8,90 (2H, d). e) 5-{[(4S)-гідрокси-4-метилізоксазолідин-2ілікарбоніл}-1-ізопропіл-3-метил-6-(4-піримідин-2ілбензил)тіоніл[2,3-d]піримідин-2,4(1Н,3Н)-діон Отримують з продукту частини d) за процедурою Прикладу 16, частини f), як тверду речовину. MC (ESI) 522 [M+H]+ δ 1НДМСО 1,33-1,38 (3Н, m), 1,46 (6Н, m), 3,19 (3Н, s), 3,64-4,15 (6Н, m), 4,44 (1Н, bs), 5,45 (1Н, bs), 7,44 (3Н, m), 8,33(2Н, d), 8,89 (2Н, d) Приклад 18 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[(S)-(2-піридиніл)-2-тієніл)метил]тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон a) Етиловий естер 1,2,3,4-тетрагідро-6гідрокси-[(5-(2-піридиніп)-2-тієніп)метил]-3-метил1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Отримують за процедурою Прикладу 15 а) з 5(2-піридиніл)-2-тіофенкарбоксальдегіду. MC (ESI) 486 [М+Н]+ δ 1ΗДМСО 1,35 (3Н, t), 1,58 (6Н, d), 3,37 (3Н, s), 3,42 (1Н, d), 4,40 (2Н, q), 4,55 (1Н, b), 6,37 (1Н, d), 7,07 (1Н, d), 7,15 (1Н, m), 7,45 (1Н, d), 7,63 (1Н, d), 7,69 (1Н, td), 8,55 (1Н, m). b) Етиловий естер 1,2,3,4-тетрагідро-3-метил1-(1-метилетил)-2,4-діоксо-6-[(5-(2-піридиніл)-2тієніл)метил]-тієно[2,3-d]піримідин-5-карбонової кислоти Отримують з продукту частини а) за процедурою Прикладу 15, частини b). MC (ESI) 470 [M+H]+ δ 1НДМСО 1,40 (3Н, t), 1,55 (6Н, d), 3,37 (3Н, s), 4,34 (2Н, s), 4,4-4,5 (1Н, b), 4,45 (2Н, s, q), 6,94 (1Н, d), 7,14 (1Н, m), 7,43 (1Н, d), 7,61 (1Н, d), 7,67 (1Н, td), 8,54 (1Н, d) c) 1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)2,4-діоксо-6-[(5-(2-пірідиніл)-2-тієніл)-метил]тієно[2,3-d]піримідин-5-карбонова кислота Отримують з продукту частини b) за процедурою Прикладу 6, частини b), як тверду речовину. 41 81788 MC (ESI) 442 [M+H]+ d) 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[(5-(2-піридиніл)-2-тієніл)метил]тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон Отримують з продукту частини с) за процедурою Прикладу 15, частини d). МС (АРСІ) 540 [М+Н]+ δ 1НДМСО 1,48 (3Н, s), 1,53 (6Н, t), 2,32 (3Н, s), 2,26 (3Н, s), 3,35 (3Н, s), 3,43 (1Н, d), 3,86 (1Н, d), 3,97 (2Н, dd), 4,52 (2Н, m), 5,41 (1Н, s), 7,19 (1Н, t), 8,77 (2Н, d) Приклад 19 6-[{(1,3-диметил-1Н-5-піразоліл)метил]-5[[(4S)-4-гідрокси-4-метил-2-ізоксалідиніл]карбоніл]-3-метил-1-(1-метилетил)-тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон a) Етиловий естер 1,2,3,4-тетрагідро-6-[(1,3диметил-1H-5-піразол)метил]-3-метил-1-(1метилетил)-2,4-діоксо-тієно[2,3-d]піримідин-5карбонової кислоти Отримують за процедурою Прикладу 15 а) з 1,3-диметилпіразол-5-карбоксальдегіду. МС (ESI) 421 [М+Н]+ δ 1НДМСО 1-33 (3Н, t), 1,58 (6Н, m), 2,24 (3Н, s), 3,37 (3Н, s), 3,77 (3Н, s), 4,35 (2Н, m), 4,56 (1Н, b), 6,06 (1H, s), 6,13 (1H, d). b) Етиловий естер 1,2,3,4-тетрагідро-3-метил1-(1-метилетил)-2,4-діоксо-6-[(1,3-диметил-1Н-5піразоліл)метил]-тієно[2,3-d]піримідин-5карбонової кислоти Отримують з продукту частини а) за процедурою Прикладу 15, частини b). МС (ESI) 405 [М+Н]+ δ 1НДМСО 1,39 (3Н, t), 1,55 (6Н, d), 2,24 (3Н, s), 3,37 (3Н, s), 3,72 (3Н, s), 4,12 (2Н, s), 4,43 (2H, q), 4,50 (1H, b), 5,94 (1H, s). с) 1,2,3,4-тетpагідро-3-метил-1-(1-метилетил)2,4-діоксо-6-[(1,3-диметил-1Н-5-піразоліл)метил]тієно[2,3-d]піримідин-5-карбонова кислота Отримують з продукту частини b) за процедурою Прикладу 6, частини b), як тверду речовину. МС (ESI) 377 [М+Н]+ d) 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)[(1,3-диметил-1Н-піразоліп)метил]-тієно[2,3d]піримідин-2,4-(1H,3Н)-діон Отримують з продукту частини с) за процедурою Прикладу 15, частини d). МС (АРСІ) 462 [М+Н]+ δ 1НДМСО 1,42 (3Н, s), 1,48 (6Н, t), 2,08 (3Н, s), 3,18 (3Н, s), 3,29 (1Н, m), 3,63 (3Н, s), 3,74 (3Н, m), 4,08 (2Н, m), 4,44 (1Н, bm), 5,42 (1Н, s), 5,92 (1Н, s) Приклад 20 6-[(3,5-диметил-4-ізотіозоліл)метил]-5-[[(4S)гідрокси-4-метил-2-ізоксазолідиніл]карбоніл]-3 42 метил-1-(1-метилетил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон a) Етиловий естер 6-[(3,5-диметил-4ізотіазоліл)гідроксиметил]-1,2,3,4-тетрагідро-3метил-1-(1-метилетил)-2,4-діоксотієно[2,3d]піримідин-5-карбонової кислоти Отримують за процедурою Прикладу 15, частини а), з етилового естеру 1,2,3,4-тетрагідро3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3d]піримідин-5-карбонової кислоти і 3,5-диметил-4ізотіазолкарбоксальдегіду. MC (ESI) 438 [M+H]+ δ 1НДМСО 1,04 (3Н, t), 1,51-1,54 (6Н, m), 2,25 (3Н, s), 2,42 (3Н, s), 3,16 (3Н, s), 3,68-3,88 (2Н, m), 4,61 (1Н, s, br), 6,01 (1Н, d), 6,75 (1Н, d). b) Етиловий естер 6-[(3,5-диметил-4ізотіазоліл)метил]-1,2,3.4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Отримують з продукту частини а) за процедурою Прикладу 15, частини b). MC (ESI) 422 [М+Н]+ δ 1НДМСО 1,25 (3Н, t), 1,45 (6Н, d), 2,29 (3Н, s), 2,46 (3Н, s), 3,17 (3Н, s)s 4,07 (2Н, s), 4,21 (2H, q), 4,40 (1H, s.br). с) 6-[(3,5-диметил-4-ізотіазоліл)метил]-1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-карбонова кислота Розчин продукту операції b) (0,26г) в ацетонітрилі (10мл) і 2,5N хлоридну кислоту (10мл) гріють при кипінні під зворотним холодильником протягом 6год., потім концентрують у вакуумі, розбавляють водою і екстрагують у ДХМ, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском, отримуючи бажану сполуку. MC (ESI) 394 [M+H]+ d) 6-[(3,5-диметил-4-ізотіозоліл)метил]-5-[[(4S)4-гідрокси-4-метил-2-ізоксазолідиніл]-карбоніл]-3метил-1-(1-метилетил)тієно[2,3-d]піримідин-2,4(1,3Н)-діон Отримують з продукту частини с) за процедурою Прикладу 10, частини b). МС (АРСІ) 479 [М+Н]+ δ 1НДМСО 1,31-1,46 (9Н, m), 2,30-2,32 (3Н, m), 2,47-2,48 (3Н, m), 3,17-3,18 (3Н, m), 3,42-4,02 (6Н, m), 4,36 (1H, s, br), 5,41 (1H,d). Приклад 21 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[[1-(2-тіазоліл-1Н-піразоліл]метил]тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон 43 81788 а) Етиловий естер 1-(дифенілметил)-1Нпіразол-карбонової кислоти Суспензію етилового естеру 1Н-піразол-4карбонової кислоти (1,0г), бензогідрилхпориду (1,9мл) і карбонату калію (1,48г) у безводному 1метил-2-піролідиноні (10мл) гріють при 100°С під азотом 6год., потім розбавляють водою і екстрагують етилацетатом, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом ігексан/етилацетат (4:1) і потім і-гексан/етилацетат (2:1), отримуючи бажану сполуку (2,18г). δ 1НCDCI3 1-32 (3Н, t), 4,27 (2Н, q), 6,77 (1Н, s), 7,10-7,12 (4Н, m), 732-7,40 (10Н, m), 7,74 (1H,s), 7,99 (1H,s). b) 1-(дифенілметил-1Н-піразол-4карбоксальдегід До розчину продукту частини а) (2,18г) у безводному ТГФ (40мл) краплями при 0°С під азотом додають 1,1Μ розчин гідриду алюмінію у ТГФ (10мл) і суміш перемішують при кімнатній температурі 2год., після чого обережно виливають у воду, змішують з етилацетатом і фільтрують, потім екстрагують етилацетатом, органічні екстракти промивають водою, суша ть над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок розчиняють в ацетоні (6мл), розчин охолоджують до 10°С і потім обробляють розчином триоксиду хрому (0,66г) у воді (4мл) і сульфатною кислотою (0,53мл), перемішують при кімнатній температурі протягом 2год., екстрагують етилацетатом, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом і-гексан/етилацетат (9:1) і потім і-гексан/етилацетат (3:1), отримуючи бажану сполуку (1,2г). δ 1ΗДМСО 7,05 (1Н, s), 7,19-7,22 (4Н, m), 7,327,42 (6Н, m), 8,08 (1Н, s), 9,81 (1Н, s). c) Етиловий естер 6-[[1-(дифенілметил)-1Нпіразол-4-іл]гідроксиметил]-1,2,3,4-тетрагідро-3метил-1-(1-метилетил)-2,4-діоксотієно[2,3d]піримідин-5-карбонової кислоти Отримують з продукту частини b) і етилового естеру 1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)2,4-діоксотієно[2,3-d]піримідин-5-карбонової кислоти за процедурою Прикладу 15, частини а). МС (ESI) 559 [М+Н]+ 44 d) Етиловий естер 1,2,3,4-тетрагідро-3-метил1-(1-метилетил)-2,4-діоксо-6-(1Н-піразол-4ілметил)тієно[2,3-d]піримідин-5-карбоновоі кислоти Отримують з продукту частини с) за процедурою Прикладу 15, частини b). МС (ESI) 377 [М+Н]+ δ 1ΗДМСО 1,28 (3Н, t), 1,46 (ЄН, d), 3,19 (3Н, s), 3,96 (2Н, s), 4,30 (2Н, q), 4,48 (1Н, а, br), 7,51 (2H, s). e) 1,2,3,4-тетрагідро-3-метил-1-(1-метилетил2,4-діоксо-6-[[1-(2-тіазоліл)-1Н-піразол-4ілметил]тієно[2,3-d]піримідин-5-карбонова кислота До розчину продукту операції d) (500мг) в ацетонітрилі (2мл) додають 2-бромтіазол (0,24мл). Суміш піддають мікрохвильовому опромінюванню (200W, 140°С, 20хвил.), потім охолоджують, розбавляють ацетонітрилом (5мл), додають 2,5N НСІ (5мл) і суміш гріють при кипінні під зворотним холодильником 18год., після чого охолоджують, осаджену тверду речовину збирають фільтруванням і рекристалізують з ДМФ, отримуючи бажану сполуку (0,1г). МС (ESI) 432 [М+Н]+ f) 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніп]карбоніл]-3-метил-1-(1-метилетил)6-[[1-(2-тіазоліл)-1Н-піразол-4-іліметил]тієно[2,3d]піримідин-2,4-(1H,3Н)-діон Отримують з продукту частини є) за процедурою Прикладу 10, частини b). МС (АРСІ) 517 [М+Н]+ δ 1ΗДМСО 1,31-1,48 (9Н, m), 3,19-3,20 (3Н, m), 3,36-4,06 (6Н, m), 4,48 (1Н, s, br), 5,43-5,46 (1Н, m), 7,52 (1Н, d), 7,63 (1Н, d), 7,74-7,80 (1Н, m), 8,378,44 (1Н, m). Приклад 22 6-[(4-Флуорфеніл)метил)-5-[[(4S)-4-гідрокси-4метил-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон. а) Етиловий естер 6-[(4Флуорфеніл)гідроксиметил]-1,2,3,4-тетрагідро-3метил-1-(1-метилетил)-2,4-діоксотієно[2,3d]піримідин-5-карбонової кислоти Отримують за процедурою Прикладу 15, частини а), з етилового естеру 1,2,3,4-тетрагідро3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3d]піримідин-5-карбонової кислоти і 4флуорбензальдегіду. МС (ESI) 421 [М+Н]+ b) Етиловий естер 6-[(4-флуорфеніл)метил]1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти Отримують з продукту частини а) за процедурою Прикладу 15, частини b). MC (ESI) 405 [M+H]+ 45 81788 δ 1НДМСО 1,18 (3Н, t), 1,45 (6Н, d), 3,18 (3Н, s), 4,10 (2Н, s), 4,28 (2Н, q), 4,43 (1Н, S, br), 7,15-7,19 (2Н, m), 7,29-7,33 (2Н, m). c) 6-[(4-Флуорфеніл)метил]-1,2,3,4-тетрагідро3-метил-1-(1-метилетил)-2,4-діоксо-тієно[2,3d]піримідин-5-карбонова кислота Отримують з продукту частини b) за процедурою Прикладу 20, частини с). МС (ESI) 377 [М+Н]+ d) 6[(4-флуорфеніл)метил]-5-[[(4S)-4-гідрокси4-метил-2-ізоксазолідиніл]карбоніл-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4-(1Н,3Н)-діон Отримують з продукту частини с) за процедурою Прикладу 10, частини b). МС (АРСІ) 462 [М+Н]+ δ 1НДМСО 1,23-1,26 (9Н, m), 3,19-3,24 (3Н, m), 3,56-4,10 (6Н, m), 4,45 (1Н, s, br), 5,43 (1Н, s), 7,15 (2H, t), 7,30-7,37 (2Н, m). Приклад 23 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл)карбоніл]-3-метил-1-(1-метилетил)6-(1Н-1,2,3-триазол-1-ілметил)тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон a) Метиловий естер 6-(азидометил)-1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]-піримідин-5-карбонової кислоти До розчину метилового естеру 6-(бромметил)1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно-[2,3-d]піримідин-5-карбонової кислоти (0,5г) в ацетонітрилі (4мл) додають розчин азиду натрію (0,95г) в ацетонітрилі (1мл) і воду (0,5мл). Суміш перемішують при кімнатній температурі під азотом протягом 18год., потім розбавляють водою і екстрагують в етилацетат, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском, отримуючи бажану сполуку як тверду речовину (0,39г). МС (ESI) 338 [М+Н]+ δ 1НCDCI3 1,63 (6Н, d), 3,38 (3Н, s), 3,98 (3Н, s), 4,54 (2Н, s), 4,68 (1Н, s, br). b) Метиловий естер 6-[(4,5-диметил-1Н-1,2,3триазол-1-іл)метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Суміш продукту частини а) (0,39г), фенілвінілсульфоксид (1,0г) і хлорбензол (10мл) гріють при 130°С 8год., потім охолоджують і концентрують у вакуумі. Залишок очищають колонною хроматографією на кремнеземі з елюентом і-гексан/етилацетат (4:1) і потім ігексан/етилацетат (1:1), отримуючи бажану сполуку (0,39г). MC (ESI) 364 [M+H]+ 46 δ 1НДМСО 1,48 (6Н, d), 3,18 (3Н, в), 3,86 (3Н, в), 4,51 (1Н, s, br), 5,82 (2Н, в), 7,76 (1Н, s), 8,13 (1H, s). c) 6-[(4,5-диметил-1Н-1,2,3-триазол-1іл)метил]-1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5-карбонова кислота Отримують з продукту частини b) за процедурою Прикладу 20, частини с). МС (ЕSІ) 350 [М+Н]+ d) 5-[[(4S')-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-(1Н-1,2,3-триазол-1-ілметил)тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон Отримують з продукту частини с) за процедурою Прикладу 10, частини b). МС (АРСІ) 435 [М+Н]+ δ 1НДМСО 1,23-1,49 (9Η, m), 3,18-3,19 (3Н, m), 3,37-3,99 (4Н, m), 4,49 (1Н, s, br), 5,43-5,52 (1H, m), 5,70-5,81 (2Н, m),7,76 (1Н, s), 8,07-8,18 (1H, m). Приклад 24 6-[(6-хпорімідазо[1,2-а]піридин-3-іл)метил]-5[[(4S)-4-гідрокси-4-метил-2-ізоксазолідинілікарбонілі-3-метил-1-(1-метилетил)тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон a) Етиловий естер 6-[(6-хпорімідазо[1,2а]піридин-3-іл)гідроксиметил]-1,2,3,4-твтрагідро-3метил-1-(1-метилетил)-2,4-діоксотієно[2,3d]піримідин-5-карбонової кислоти Отримують з етилового естеру 1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5-карбонової кислоти і 6хлорімідазо[1,2-а]піридин-3-карбоксальдегіду за процедурою Прикладу 15, частини а). MC (ESI) 477 i 479 [M+H]+ δ 1НДМСО 1,02 (3Н, t), 1,52 (6Н, dd), 3,91-3,99 (2Н, m), 4,58 (1Н, s, br), 6,49 (1Н, d), 7,09 (1Н, d), 7,36 (1Η, dd), 7,48 (1Η, s), 7,67 (1Η, d), 8,55 (1Η, s). b) Етиловий естер 6-[([6-хлорімідазо[1,2а]піридин-3-іл)метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Отримують з продукту частини а) за процедурою Прикладу 15, частини b). MC (ESI) 461 i 463 [M+H]+ δ 1НДМСО 1,18 (3Н, t), 1,44 (6Н, d), 3,18 (3Н, s), 4,26 (2Н, q), 4,43 (1Н, s, br), 4,54 (3Н, s),7,32 (1Н, dd), 7,56 (1Н, s), 7,65 (1Н, d), 8,57 (1Н, s). c) 6-[(6-хлорімідазо[1,2-а]пiридин-3-іл)метил]1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-карбонова кислота Отримують з продукту частини b) за процедурою Прикладу 20, частини с). MC (ESI) 433 i 435 [M+H]+ d) 6-[(6-хпорімідаз[1,2-а]піридин-3-іл)метил]-5[[(4S)-4-гідрокси-4-метил-2-ізоксазолідиніл] 47 81788 карбоніл]-3-метил-1-(1-метилетил)тієно[2,3d]піримідин-2,4-(1Н,3Н)-діон Отримують з продукту частини с) за процедурою Прикладу 10, частини b). МС (АРСІ) 518 і 520 [М+Н]+ δ 1НДМСО 1,32-1,44 (9Н, m), 3,18-3,19 (3Н, m), 3,64-3,83 (4Н, m), 4,35-4,53 (3Н, m), 5,45-5,46 (1Н, m), 7,30 (1Н, dd), 7,59-7,65 (2Н, m), 8,64-8,71 (1Н, m). Приклад 25 5-[[(4S)-4-гідрокси-4-метилізоксазолідин-2іл]карбоніл]-3-метил-1-1-метилетил)-6-[[4-(2піридиніл)феніл]метил]тієно[2,3-d]піримідин2,4(1Н,3Н)-діон a) Етиловий естер 1,2,3,4-тетрагідро-6[гiдрокси[4-(2піридиніл)феніл]метил]-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонової кислоти Діізопропіламід літію, щойно отриманий доданням n-бутиллітію (1,1мл, 2,5М у гексанах) до розчину діізопропіламіну (0,46мл) у сухому ТГФ під азотом при 0°С з перемішуванням протягом 20хвил., додають до розчину етилового естеру 1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-карбонової кислоти (0,7г), 4-(2-піридил)-бензальдегіду (0,52г) і DMPU (0,57мл) у сухому ТГФ під азотом при -78°С. Реакційну суміш перемішують при -78°С 4год., потім гасять льодяною оцтовою кислотою (10мл) і залишають досягти кімнатної температури. Додають воду і суміш екстрагують етилацетатом (двічі). Органіку промивають розсолом, сушать над MgSO4 і концентрують у вакуумі, отримуючи коричневе масло, яке очищають хроматографією на кремнеземі з елюентом ізогексан/етил ацетат (1/1), отримуючи бажану сполуку у вигляді блідожовтої піни (0,47г). МС (ES) 480 [М+Н]+ δ 1ΗДМСО 1,15-1,23 (3Н, t), 1,47-1,53 (6Н, d), 3,17 (3Н, s), 4,16-4,24 (2Н, q), 4,55 (1H, bs), 5,975,98 (1Н, d), 6,82-6,84 (1Н, d), 7,32-7,37 (1Н, m), 7,47-7,50 (2Н, d), 7,84-7,96 (2H,m), 8,05-8,08 (2Н, d), 8,64-8,66 (1H, d). b) Етиловий естер 1,2,3,4-тетрагідро-3-метил1-(1-метилетил)-2,4-діоксо-6-[[4-(2піридиніл)]феніл]метил]-тієно[2,3-d]піримідин-5карбонової кислоти Продукт частини а) (0,47г) розчиняють у ДХМ (2мл), обробляють трифлуороцтовою кислотою (2мл) і триетилсиланом (1мл) і перемішують при зовнішній температурі 18год. ДХМ і трифлуороцтову кислоту випарюють. Додають воду і реакційну суміш підлужують карбонатом натрію і екстрагують ДХМ (двічі). Органіку промивають розсолом, сушать над MgSO 4 і концентрують у вакуумі, отримуючи білу тверду речовину, яку очищають хроматографією на 48 кремнеземі з елюентом ізогексан/етилацетат (3/2), отримуючи бажану сполуку як безбарвне масло, яке потім твердіє (0,39г). MC (ES) 464 [M+H]+ 1,23-1,28 (3H, t), 1,44-1,46 (6Н, d), 3,18 (3Н, s), 4,16 (2Н, s), 4,27-4,31 (2Н, q), 4,33 (1Н, bs), 7,327,36 (1Н, m), 7,36-7,38 (2Н, d), 7,85-7,89 (1Н, t), 7,93-7,95 (1Н, d), 8,04-8,06 (2H, d), 8,64-8,66 (1Η, d). c) 1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)2,4-діоксо-6-[[4-(2-піридиніл)феніл]-метил]тієно[2,3-d]піримідин-5-карбонова кислота Отримують з розчину продукту частини b) (0,39г) в ацетонітрилі (15мл), який обробляють 2М хлоридною кислотою (4мл) і гріють при кипінні під зворотним холодильником 15год. Суміш концентрують до сухості, залишок перетирають з водою, фільтрують і промивають етером і сушать у вакуумній печі при 55°С, отримуючи бажану сполуку як білу тверду речовину (0,22г). МС (ES) 436 [М+Н]+ d) 5-[[(4S)-4-гідрокси-4-метилізоксазолідин-2іл]карбоніл]-3-метил-1-(1-метилетил)-6-[[4-(2піридиніл)феніл]метил]-тієно[2,3-d]піримідин2,4(1Н,3Н)-діон До розчину продукту частини с) (0,22г) у ДХМ додають оксалілхлорид (0,132мл) і потім 2 краплі ДМФ під азотом. Реакційну суміш перемішують при зовнішній температурі 1год. і потім концентрують до сухості. Залишок розчиняють у ДХМ і додають до розчину (4S)-4-гідрокси-4метилізоксазолідинегідрохлориду (0,14г) і триетиламіну (0,3мл) у ДХМ. Реакційну суміш перемішують при кімнатній температурі 2год. і додають воду, потім розділяють і органіку сушать над MgSO4 і концентрують у вакуумі. Залишок очищають хроматографією на кремнеземі з елюентом 4% метанолу у ДХМ і потім етилацетат. Кінцеве очищення зворотнофазовою РХВР з елюентом ацетонітрил/0,2% NH3 у воді дає бажану сполуку як білу тверду речовину (0,1г). МС (АРСІ) 521.1860 [М+Н]+ δ 1ΗДМСО 1,52-1,56 (9Н, m), 3,35 (3Н, s), 3,423,46 (1Н, d), 3,86-4,01 (2Н, ABq), 4,18 (2Н, s), 4,524,56 (2Н, d+bs), 5,42 (1Н, s), 7,21-7,24 (1Н, m), 7,347,42 (2Н, d), 7,69-7,78 (2Н. т), 7,78-7,94 (2Н, d), 8,67-8,69 (1Н, d). Приклад 26 (S)-4-метил-2-[[1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-6-[[5-метил-1-(2-піримідиніл)-3(трифлуорметил)-1Н-піразол-4-іл]метил]-2,4діоксотієно[2,3-d]піримідин-5-іл]карбонілі-4ізоксазолідинол 49 81788 Суміш продукту Прикладу 10, частини b) (279мг), 2-бромпіримідин (300мг), йодид міді (І) (95мг), транс-циклогександіамін (55мг) і карбонат калію (300мг) у діоксані (2мл) гріють при 100°С протягом 16год. під азотом. Реакційну суміш концентрують до сухості і очи щають хроматографією на кремнеземі з градієнтним елюентом від етилацетату до 10% метанолу/етилацетат з подальшою зворотнофазовою РХВР, отримуючи бажану сполук як білу тверду речовину (105мг). МС (APCI+ve) 494 [М+Н]+ δ 1ΗДМСО 120°С 1,40 (3Н, s), 1,47 (6Н, d), 2,53 (3Н, s), 3,21 (3Н, s), 3,64-3,72 (3Н, m), 3,80 (1Н, d), 4,07 (2Н, s), 4,46 (sep, 1Н), 7,59 (1Н, t), 8,94 (2Н, d). Приклад 27 (4S)-2-[[6-[[3,5-диметил-1-(2-піримідиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-етил-4-ізоксазолідинол а) (S)-([2-етилоксираніл]метил) 3нітробензолсульфонат Суміш 2-етилпроп-2-ен-1-олу (1,5г) з доданням 3А°-молекулярного сита (620мг) і (-)-Dдіетилтартрату (177ц1) перемішують у ДХМ (35мл) під азотом 24год. Суміш охолоджують до -20°С і додають тетраізопропоксид титану (265мкл). Після 2-годинного перемішування при -20°С додають гідропероксид кумену (6,4мл) і через 2год. реакцію залишають нагрітись до -5°С і потім гасять повільним доданням триметилфосфіту (3,4мл) Додають послідовно триетиламін (3,7мл), DMAP (265мг) і розчин 3нітробензолсульфонілхлориду (3,95г) у ДХМ (25мл) і суміш перемішують при кімнатній температурі 3год. Реакційну суміш виливають у кремнезем ι елююють ДХМ, отримуючи бажану сполуку як жовте масло (4,8г). δ 1НCDCI3 0,91 (3Н, t), 1,61 (1Н, sex), 1,81 (1Н, sex), 2,68 (1Н, d), 2,70 (1Н, d), 4,09 (1Н, d), 4,31 (1Н, d), 7,81 (1Н, t), 8,25 (1Н, ddd), 8,53 (1Н, ddd), 8,77 (1Н, t). b) 2-[[(2S)-2-етилоксираніл]метокси]-1Нізоіндол-1,3(2Н)-діон Цю сполуку отримують за процедурою Прикладу 1, частини а), з продукту частини а). δ 1НCDCI3 1,04 (3Н, t), 1,89 (1Н, dq), 2,11 (1Н, dq), 2,72 (1Н, d), 2,75 (1Н, d), 4,22 (1Н, d), 4,25 (1Н, d), 7,72-7,77 (2Н, m), 7,82-7,87 (2Н, m). c) 2-[[(2R)-3-хлор-2-гідрокси-2етилпропіл]окси]-1Н-ізоіндол-1,3(2Н)-діон Цю сполуку отримують за процедурою Прикладу 1, частини b), з продукту частини b). 50 δ 1НCDCI3 1,01 (3Н, t), 1,71 (1Н, dq), 1,75 (1Н, dq), 3,70 (1Н, d), 3,75 (1Н, d), 4,08 (1Н, d), 4,50 (1H, d), 7,75-7,80 (2H, m), 7,84-7,88 (2H, m). d) Метиловий естер 2-[[(4S)-4-гідрокси-4-етил2-ізоксазолідиніл]карбоніл]-бензойної кислоти Цю сполуку отримують за процедурою Прикладу 1, частини с), з продукту частини с). δ 1НCDCI3 1,09 (3Н, t), 1,82 (2Н, q), 2,01 (1Н, s), 3,59 (1Н, d), 3,84 (1Н, d), 3,92 (3Н, s), 3,94 (1Н, d), 4,32 (1Н, d), 7,45 (1Н, d), 7,49 (1Н, t), 7,62 (1Н, t), 7,99 (1Н, d). РХВР: (9010ІНІΡ.Μ) колонка kromasil DMB 4,6´250мм, ее >99% e) (4S)-4-етил-4-ізоксазолідинолгідрохлорид Цю сполуку отримують, як у Прикпадуі 1, частини d), з продукту частини d). δ 1ΗДМСО 0,94 (3Н, t), 1,66-1,79 (2Н, m), 3,28 (1Н, d), 3,38 (1Н, d), 3,90 (1Н, d), 4,05 (1Н, d). f) (4S)-2-[[6-[[3,5-димeтил-1-(2-піримідиніл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2б4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-ізоксазолідинол Цю сполуку отримують з продукту Прикладу 11, частини b) за процедурою Прикладу 15, частини d). МС (APCI+ve) 554 [М+Н]+ δ 1ΗДМСО 120°С 0,94 (3Н, t), 1,47 (6Н, d), 1,71 (2Н, q), 2,18 (3Н, s), 2,52 (3Н, s), 3,20 (3Н, s), 3,64 (1Н, m), 3,74-3,8 (3Н, m), 3,89 (2Н, s), 4,46 (sep, 1Н), 7,38 (1Н, t), 8,81 (2H, d). Приклад 28 (4S)-2-[[6-[[1-(2,3-дигідро-2-оксо-4-піримідиніл)3,5-диметил-1Н-піразол-4-іл]метил]-1,2.3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол а) 6-[[1-(2,3-дигідро-2-оксо-4-піримідиніл)-3,5диметил-1Н-піразол-4-іл]метил]-1-1,2,3,4тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-карбонова кислота Суміш продукту Прикладу 2, частини b) (400мг), 2,4-дихлорпіримідину (160мг) і триетиламіну (310мкл) в ацетонприлі (50мл) гріють при кипінні під зворотним холодильником 2год. Суміш промивають водою і органіку концентрують до сухості, отримуючи бажану сполук як коричневе масло (150мг). δ 1ΗДМСО 1,45 (6Н, d), 2,18 (3Н, s), 2,57 (3Н, s), 3,22 (3Н, s), 4,12 (2Н, s), 4,35 (s, 1Η), 5,44 (1H, d), 7,34-7,41 (1Η, m). 51 81788 b) (4S)-2-[[6-[[1-(2,3-дигідро-2-оксо-4піримідиніл)-3,5-диметил-1Н-піразол-4-іл]метил]1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4діоксотієно[2,3-d]піримідин-5-іл]карбоніл]-4-метил4-ізоксазолідинол Цю сполуку отримують з продукту частини а) за процедурою Прикладу 15, частини d). МС (APCI+ve) 556 [M+H]+ δ 1ΗДМСО 120°С 1,40 (3Н, s), 1,47 (6Н, d), 2,17 (3Н, s), 2,54 (3Н, s), 3,20 (3Н, s), 3,66-3,80 (4Н, m), 3,88 (2Н, s), 4,46 (sep, 1Н), 6,13 (1Н, d), 7,87 (2Н, d). Приклад 29 5-[[(4S)-4-гідрокси-4-метил-2ізоксазолідиніл]карбонул]-3-метил-1-(1-метилетил)-6-[[5-метил-3-(триФлуорметил)-1Н-піразол-4іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон 5-[[(4R)-4-гідрокси-4-метил-2ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)6-[[5-метил-3-(трифлуорметил)-1Н-піразол-4іл]метил]-тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон До суспензії продукту Прикладу 10, частини а) (0,130мг), і (4R)-4-метил-4ізоксазолідинолгідрохлориду (42мг), отриманого за процедурою Прикладу 1, операції а) - d), з [(2R)-2метилоксиран-2-іл]метил-3нітробензолсульфонату, у безводному ТГФ (6мл), додають триетиламін (120мг) і суміш охолоджують у льодяній ванні. Додають гексафлуорфосфа т О(7-азабензотіазол-1-іл)-N,N,N',N'тетраметилуронію (120мг) і суміш залишають нагрітись, після чого перемішують 3год. Всі леткі компоненти видаляють у вакуумі і залишок хроматографують (SiO2/1:1 СН2СІ2-ЕtOАс) для первинного очищення. Подальше очищення зворотнофазовою РХВР дає бажану сполуку як тверду речовину (35мг). MC (ESI) 516 [M+H]+ δ 1ΗДМСО (120°С) 1,40 (3Н, s), 1,46 (6Н, d), 2,18 (3Н, s), 3,20 (3Н, s), 3,6-3,75 (3Н, or s + d), 3,81 (1Н, d), 3,94 (2Н, s), 4,5 (1Н, m), 4,95-5,05 (1Н, br s). CHN Отримано С 47,98%, Η 4,69%, Ν 13,48%, S 5,98%, для C21H24F3N5O 5×0,5 H2O - С 48,09%, Η 4,8%, Ν 13,35%, S 6,11%. Фармакологічні дані Інгібування РМА/iономіцин-стимульованої проліферації мононуклеарних клітин у периферійній крові Це дослідження проводили у 96-коміркових плоскодонних мікротитрувальних планшетах. Сполуки отримували як 10мМ маточні розчини у диметилсульфоксиді, з яких у 50-разовому розбавленні, отриманому у RPMI, були отримані послідовні розбавлення цього розчину. 10мкл 50разово розбавленого маточного розчину, або його розбавлень додавали до комірки, отримуючи концентрації, починаючи з 9,5мкМ і нижче. У кожну 52 комірку вносили 1´105 РВМС, отриманого з периферійної крові одного донора-людини, у середовищі RPMI1640 з доданням 10% сироватки людини, 2мМ глютаміну і пеніциліну/стрептоміцину. Додавали ацетат форболміристрату (РМА) (кінцева концентрація 0,5нг/мл) і іономіцин (кінцева концентрація 500нг/мл), і, отже, кінцевий об'єм аналізу становив 0,2мл. Клітини інкубували при 37°С у зволоженій атмосфері з 5% діоксиду карбону протягом 72год. Для кінцевих 6год. інкубування додавали 3Нтимідин (0,5мКі). Рівень радіоактивності, внесений клітинами, є мірою проліферації. У цьому випробування сполуки Прикладів показали значення lA50 менше 1´10-6М. Зокрема, для Прикладів 5, 7, 8 РІА50 становило 7,4, 8,6 і 9,0, відповідно.
ДивитисяДодаткова інформація
Назва патенту англійськоюThienopyrimidinediones and use thereof in modulation of autoimmune diseases
Автори англійськоюGuile Simon David
Назва патенту російськоюТиенопиримидиндионы и их использование в модуляции аутоиммунных заболеваний
Автори російськоюГил Саймон Дейвид
МПК / Мітки
МПК: C07D 495/04, A61P 37/02
Мітки: використання, тієнопіримідиндіони, хвороб, модуляції, аутоімунних
Код посилання
<a href="https://ua.patents.su/26-81788-tiehnopirimidindioni-i-kh-vikoristannya-u-modulyaci-autoimunnikh-khvorob.html" target="_blank" rel="follow" title="База патентів України">Тієнопіримідиндіони і їх використання у модуляції аутоімунних хвороб</a>
Попередній патент: Клапанний вузол
Наступний патент: Спосіб стиснення цифрових кольорових відеозображень, що містять вимірювальну інформацію
Випадковий патент: Ультразвуковий витратомір












