Комбінації антифолатного агента у лікуванні раку
Формула / Реферат
1. Застосування і) першої композиції, що містить пеметрексед, та іі) другої композиції, що містить метоксіамін, для комбінованого лікування пацієнта, у котрого діагностовано рак, вибраний з групи: рак немалих клітин легень, колоректальний рак та рак молочної залози, де співвідношення метоксіаміну та пеметрекседу є між 1:2 та 1:100.
2. Застосування за будь-яким з попередніх пунктів, де вказаний пеметрексед формують для внутрішньовенного або перорального застосування.
3. Застосування за будь-яким з попередніх пунктів, де вказаний метоксіамін формують для внутрішньовенного або перорального застосування.
4. Застосування за будь-яким з попередніх пунктів, де вказаний метоксіамін формують для перорального застосування.
5. Застосування за будь-яким з попередніх пунктів, де вказаний метоксіамін та вказаний пеметрексед застосовують послідовно.
6. Застосування за будь-яким з попередніх пунктів, де вказаний метоксіамін застосовують перед пеметрекседом.
7. Застосування за будь-яким з пп. 1-5, де вказаний пеметрексед застосовують перед метоксіаміном.
8. Застосування за будь-яким з попередніх пунктів, де вказаний пеметрексед у вказаній першій композиції є гептагідратом динатрієвої солі пеметрекседу.
9. Застосування за будь-яким з попередніх пунктів, де вказаний метоксіамін формують у кількості, достатній для сенсибілізації вказаного раку до вказаного пеметрекседу.
10. Застосування за будь-яким з попередніх пунктів, де вказаний метоксіамін та вказаний пеметрексед досягають синергічної дії при застосуванні до пацієнта.
11. Застосування за будь-яким з попередніх пунктів, де вказаний метоксіамін застосовують раз або двічі на добу.
12. Застосування за будь-яким з попередніх пунктів, де вказаний пацієнт є таким, що має рак, частково або повністю резистентний до лікування тільки пеметрекседом, та де вказаний другий медикамент, що містить метоксіамін, формують у кількості, ефективній для посилення активності пеметрекседу та подолання вказаної резистентності при застосуванні до пацієнта.
13. Застосування за будь-яким з попередніх пунктів, де співвідношенням метоксіаміну та пеметрекседу є співвідношення приблизно між 1:10 та 1:50; приблизно між 1:15 та 1:40; та приблизно між 1:20 та 1:30.
14. Застосування за будь-яким з попередніх пунктів, де вказаний пеметрексед формують у межах доз приблизно від 25 до 200 мг/м2 площі поверхні тіла; приблизно від 150 до 500 мг/м2 площі поверхні тіла; приблизно від 400 до 1000 мг/м2 площі поверхні тіла; приблизно від 900 до 5000 мг/м2 площі поверхні тіла; приблизно від 200 до 1000 мг/м2 площі поверхні тіла; та приблизно від 500 до 600 мг/м2 площі поверхні тіла.
Текст
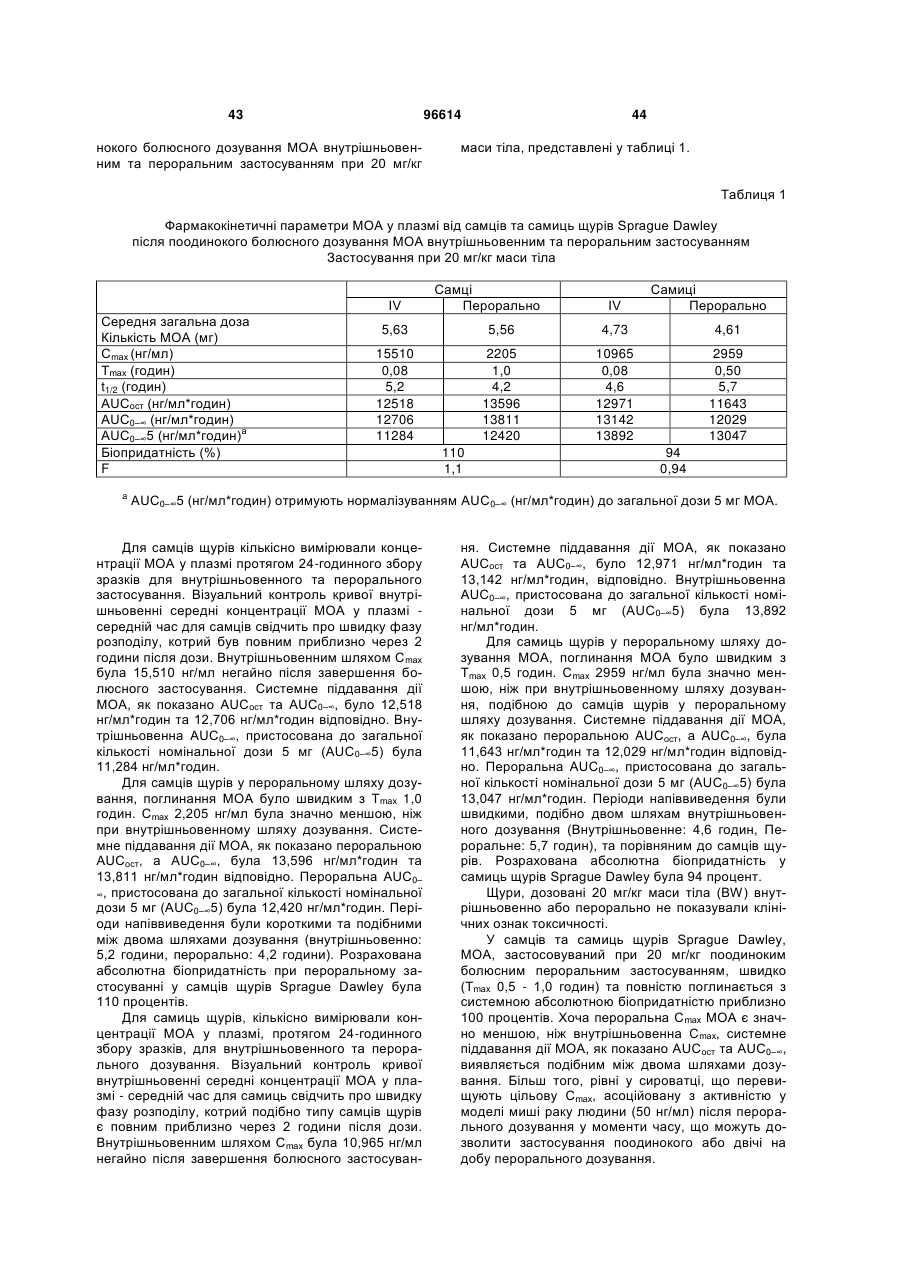
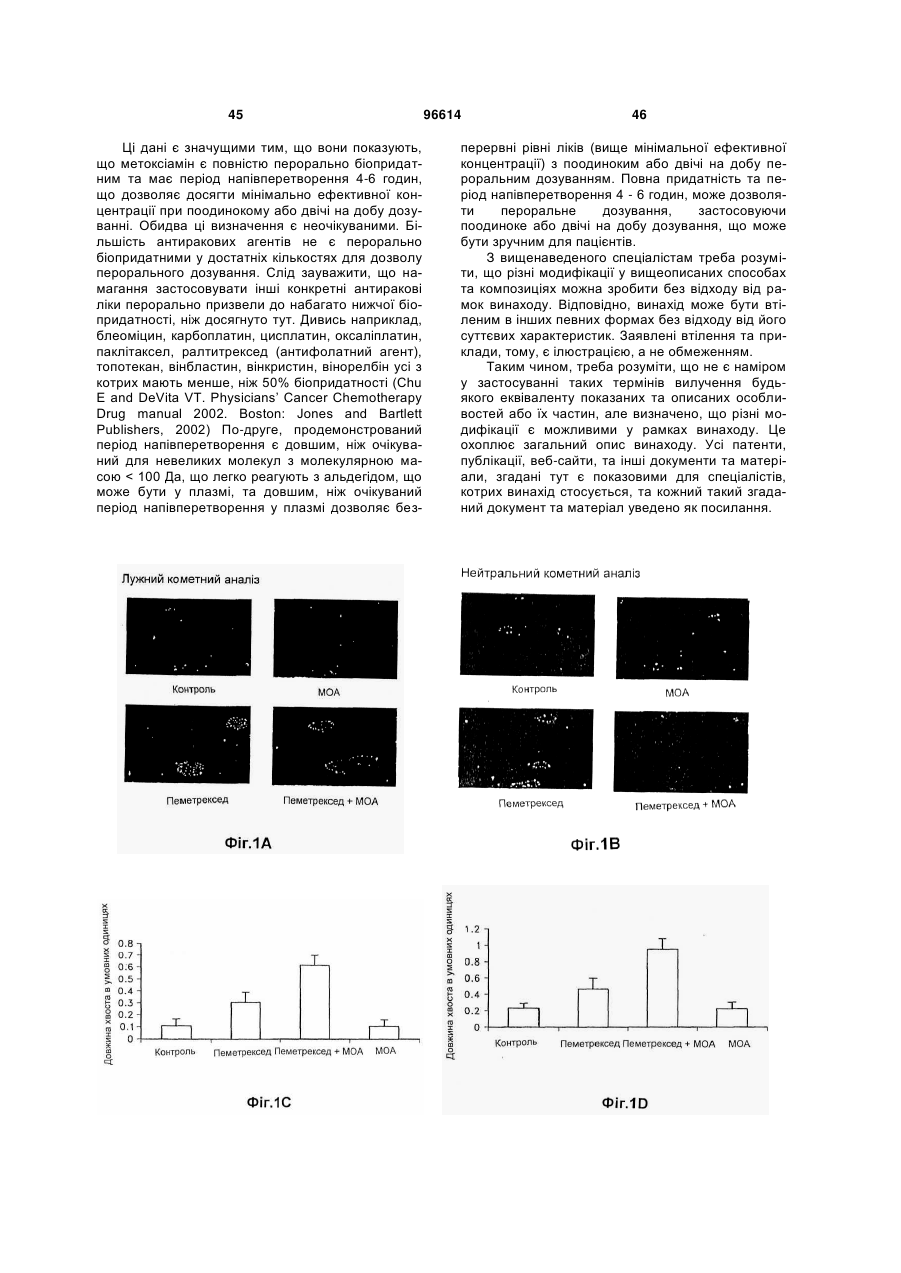
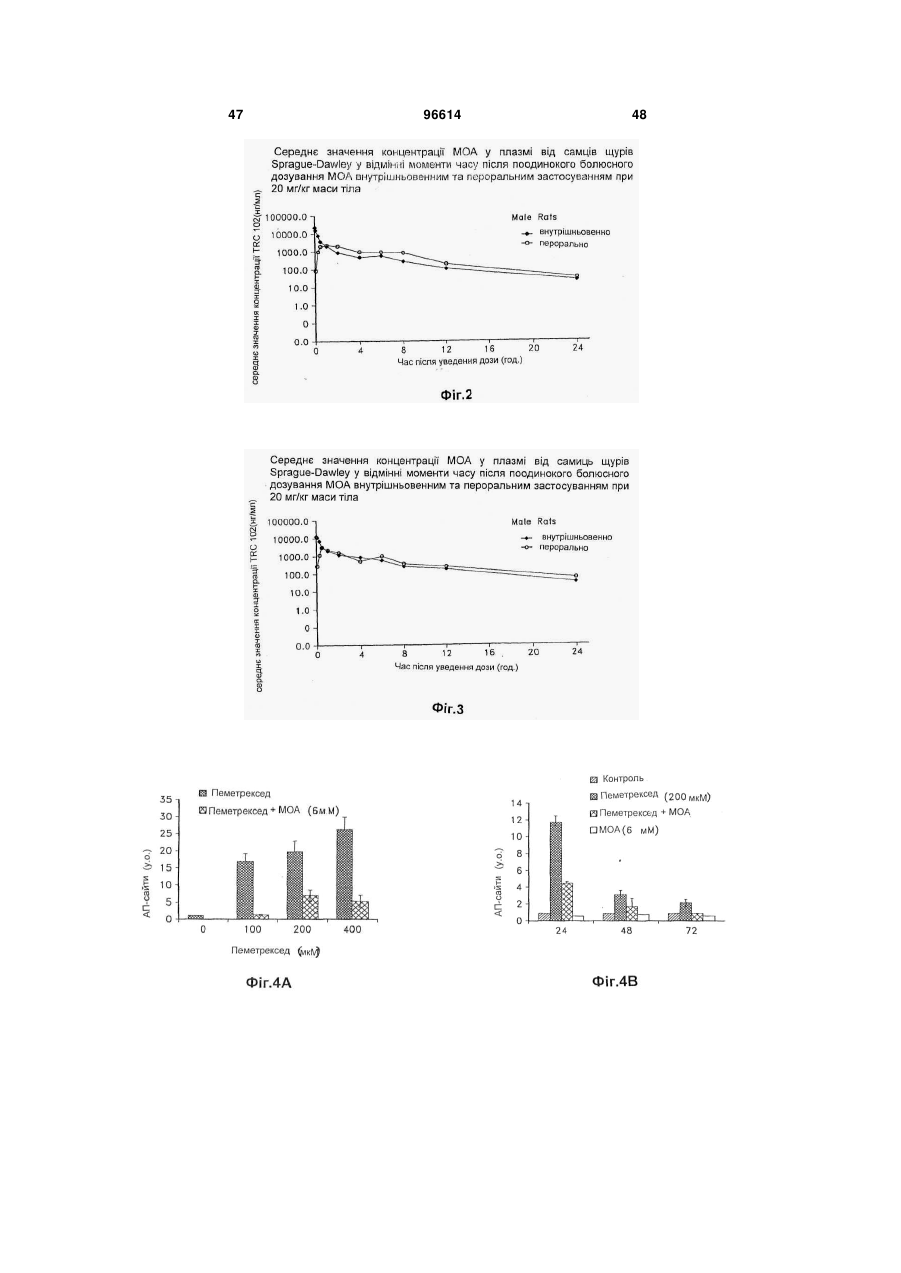
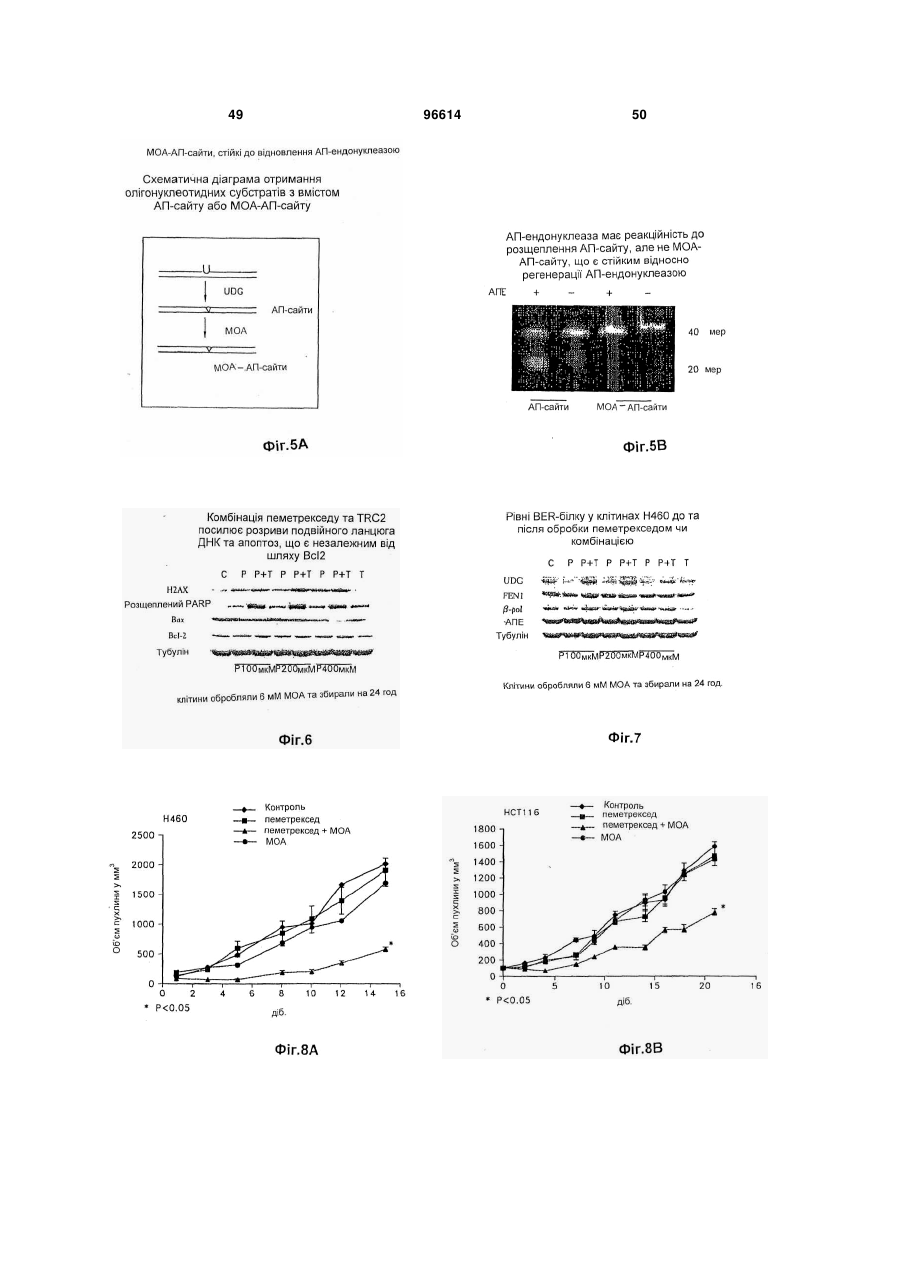
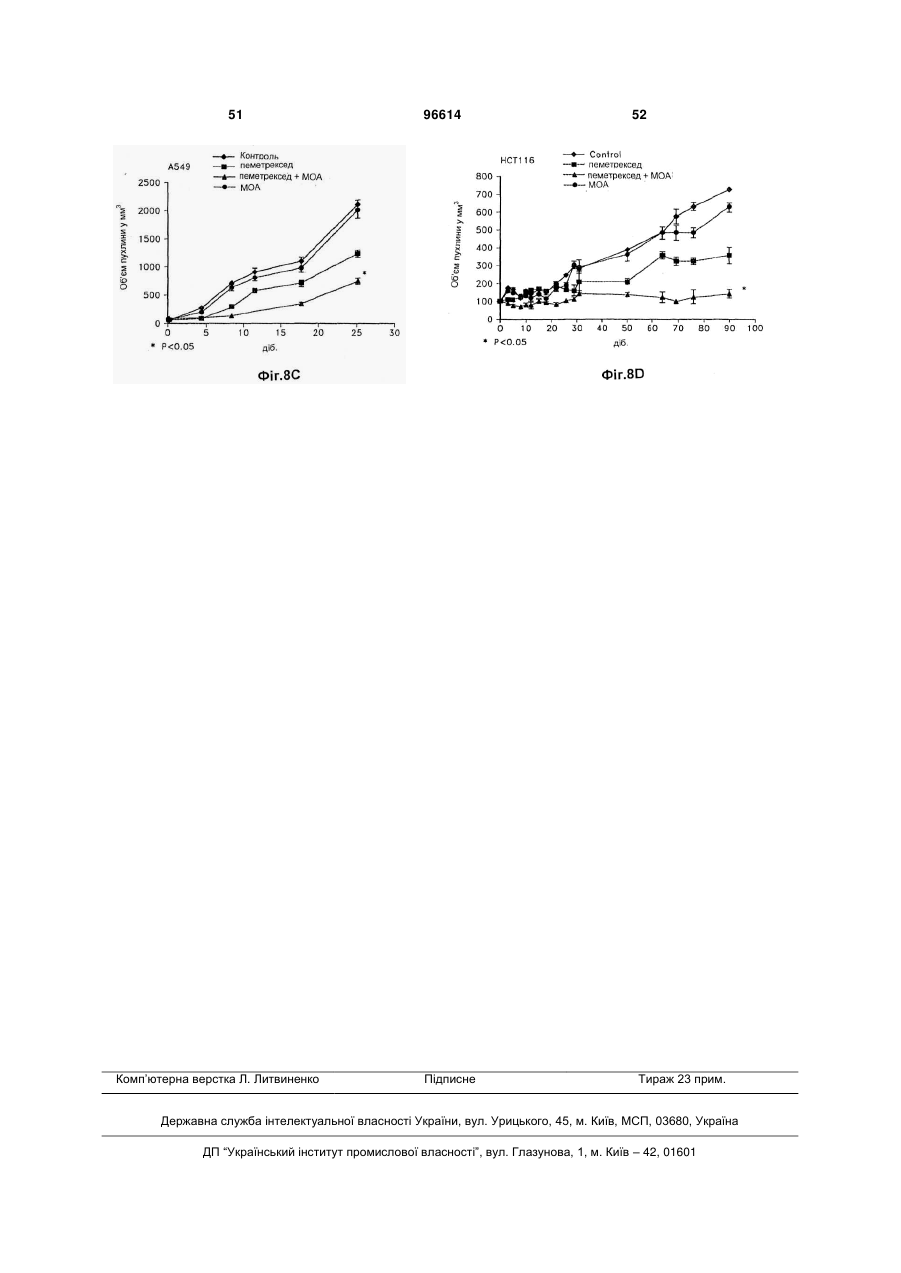
1. Застосування і) першої композиції, що містить пеметрексед, та іі) другої композиції, що містить метоксіамін, для комбінованого лікування пацієнта, у котрого діагностовано рак, вибраний з групи: рак немалих клітин легень, колоректальний рак та рак молочної залози, де співвідношення метоксіаміну та пеметрекседу є між 1:2 та 1:100. 2. Застосування за п. 1, де вказаний пеметрексед формують для внутрішньовенного або перорального застосування. 3. Застосування за будь-яким з попередніх пунктів, де вказаний метоксіамін формують для внутрішньовенного або перорального застосування. 4. Застосування за будь-яким з попередніх пунктів, де вказаний метоксіамін формують для перорального застосування. 2 (19) 1 3 Ця заявка претендує на пріоритет відносно попередньої заявки США № 60/877836, від 29,12,2006, Theuer et al., під назвою "ANTIMETABOLITE AGENT COMBINATIONS IN THE TREATMENT OF CANCER," попередньої заявки США № 60/883,266, від 03,01,2007, Theuer et al., під назвою " ANTIMETABOLITE AGENT COMBINATIONS IN THE TREATMENT OF CANCER," та попередньої заявки США № 60/883,959, від 08,01,2007, Theuer et al., під назвою " ANTIMETABOLITE AGENT COMBINATIONS IN THE TREATMENT OF CANCER," котрі є уведеними як посилання, у тому числі будь-які фігури. Заявлений винахід загалом стосується сполук, що мають різні переваги, у тому числі у застосуванні у дослідженнях, діагностиці та терапії. Більш конкретно, описані та запропоновані тут композиції, що містять метоксіамін та антиметаболітний антираковий агент, та способи лікування деяких типів раку застосуванням цих композицій. Рак є всесвітньою проблемою, а тому визначення нових композиції та способів лікування раку має великий інтерес. Лікування раку охоплює три загальні категорії: хіміотерапія, радіаційна терапія та хірургія. Часто, терапії комбінують, оскільки комбінація терапій часто збільшує ймовірність знищення раку порівняно зі стратегіями лікування поодинокою терапією. Звичайно, хірургічне вирізування пухлин великої маси супроводжують хіміотерапією та/або радіаційною терапією. Хіміотерапевтичні агенти можуть діяти кількома шляхами. Наприклад, хіміотерапевтичні агенти можуть діяти взаємодією з перебігом клітинного циклу або створенням розривів ланцюга ДНК. Якщо клітина раку не є здатною подолати блокаду клітинного циклу або пошкодження клітини, викликане терапевтичною сполукою, клітина часто гине за механізмами апоптозу. Застосування поодинокого хіміотерапевтичного агенту у лікування раку, з хірургією або радіацією чи без них, має кілька недоліків. Звичайно, клітини раку виявляють резистентність до хіміотерапевтичного агенту. Така резистентність призводить до потреби у вищих дозах ліків та/або поновлення росту раку. Хіміотерапевтичні агенти можуть бути токсичними для пацієнта. Тому, є практичне вище обмеження кількості, яку пацієнт може отримувати. Однак, якщо можна розробляти другий агент для інгібування провідного шляху, що викликає резистентність, клітини раку можуть ставати сприйнятливими до дії хіміотерапевтичного агенту. Створення ліків для подолання резистентності до хіміотерапевтичного лікування раку слід робити з метою 1) визначення комбінації, що усуває резистентність та не просто поліпшує активність хіміотерапевтичного агенту відносно активності стосовно пухлин, та 2) визначення других ліків, що не посилюють токсичну дію першого хіміотерапевтичного агенту. Ці умови потребують великої кількості емпіричних тестувальних агентів, відомих як такі, що мають антиракові властивості, з агентами, що можуть мати антиракові властивості, або мо 96614 4 жуть посилювати перший агент іншим шляхом. На жаль, такі підходи таким чином доказані значною мірою як невдалі для комбінації багатьох антиракових агентів. Тому, нема достатньої терапії, що усуває резистентність до хіміотерапії для лікування раку. Винаходи, описані та заявлені тут, мають багато ознак та втілень у тому числі, але без обмеження, описані або згадані тут. Винаходи, описані та заявлені тут не є обмеженими особливостями або втіленнями, ідентифікованими тут, котрі є тільки ілюстрацією, а не обмеженням. Ці та інші аспекти та втілення описаних та заявлених винаходів тут будуть зрозумілими з опису та формули винаходу. Розкритими тут є композиції та способи, корисні у лікуванні деяких типів раку. Зокрема, ця заявка базується на раніше невідомому визначенні, що деякі молекули, що спрямовують абазичні ураження або АП (апуринові/апіримідинові) сайти у ДНК поліпшують або посилюють ефективність антиметаболітних антиракових агентів. В інших втіленнях інгібітор шляху видалення основ, як-то метоксіамін, комбінують з антиметаболітним антираковим агентом. Антиметаболітний антираковий агент є хіміотерапевтичним зі структурою, подібною речовині (метаболіту), потрібній для нормальних біохімічних реакцій, ще достатньо відмінних для взаємодії з нормальними функціями клітин, у тому числі поділом клітин. Антифолатні агенти є кращим класом антиметаболітних агентів. Антифолатний антираковий агент є хіміотерапевтичним зі структурою, подібною фолієвій кислоті, ще достатньо відмінною для блокування активності фолієвої кислоти та порушення залежних від фолатів механізмів, необхідних для реплікації клітин. Ці антифолатні антиракові агенти охоплюють пеметрексед, капецитабін, едатрексат, метотрексат, лометрексол, нолатрексед, ралітрексед, РТ523, та триметрексат. Застосування будь-якого антифолатного антиракового агенту у комбінації з інгібітором BER (репарація видаленням основ) є розглянутим. В одному аспекті спосіб полягає у забезпеченні наступного: і) суб'єкт, у котрого діагнозовано рак, іі) перша композиція, що містить антифолатний антираковий агент та ііі) друга композиція, що містить метоксіамін; застосування вказаної першої композиції до вказаного суб'єкта; та застосування вказаної другої композиції до вказаного суб'єкта, де метоксіамін застосовують у кількості, достатній для посилення або збільшення дії антифолатного антиракового агента. Другу композицію можна застосовувати перорально. У ще одному аспекті спосіб полягає у забезпеченні наступного: і) пацієнт, у котрого діагнозовано рак, де вказаний рак є принаймні частково резистентним до лікування тільки пеметрекседом, іі) перша композиція, що містить пеметрексед; та ііі) друга композиція, що містить метоксіамін; застосування вказаної першої композиції до вказаного пацієнта; та застосування вказаної другої композиції до вказаного пацієнта, де метоксіамін застосовують у кіль 5 кості, достатній для посилення активності вказаного пеметрекседу, та долають вказану резистентність. У цих способах метоксіамін та антифолатний антираковий агент можна застосовувати як композицію. Також, метоксіамін та антифолатний антираковий агент можна застосовувати послідовно, у будь-якому порядку. Також, метоксіамін можна застосовувати перорально, а антифолатний антираковий агент можна застосовувати перорально або внутрішньовенно. Також, кількість вказаного метоксіаміну може бути кількістю, достатньою для сенсибілізації клітин раку без виклику надмірної сенсибілізації нормальних клітин. Також, метоксіамін та антифолатний антираковий агент можна застосовувати для досягнення синергічної дії. Також, антифолатний антираковий агент можна застосовувати перорально або внутрішньовенно, а вказаний метоксіамін можна застосовувати перорально, не більше, ніж двічі на добу, у кількості, достатній для посилення активності вказаного антифолатного антиракового агенту. Також, пацієнта можна вибрати як такого, що має рак, принаймні частково резистентний до лікування тільки антифолатним антираковим агентом, де вказану другу композицію, що містить метоксіамін, застосовують у кількості, ефективній для посилення активності вказаного антифолатного антиракового агенту та долають вказану резистентність. Також, співвідношення вказаного метоксіаміну до вказаного антифолатного антиракового агенту може бути між 1:5 та 1:500, переважно між 1:15 та 1:40, та навіть краще приблизно між 1:20 та приблизно 1:30. Також, рак можна вибрати з групи: карциноми, меланоми, саркоми, лімфоми, лейкемії, астроцитоми, гліоми, злоякісні меланоми, хронічна лімфоцитна лейкемія, типи раку легень, колоректальні типи раку, типи раку яєчнику, типи раку підшлункової залози, типи раку нирок, типи раку ендометрію, типи раку шлунку, типи раку печінки, типи раку голови та шиї, та типи раку молочної залози. У кращих втіленнях антифолатним антираковим агентом є пеметрексед. У ще одному втіленні розкрито поліпшений спосіб лікування раку у пацієнта, у котрого діагнозовано рак, який полягає у застосуванні антифолатного антиракового агенту до пацієнта, поліпшення полягає у застосуванні метоксіаміну до пацієнта у кількості, достатній для посилення токсичності вказаного антифолатного антиракового агенту. Також розкритими є антиракові композиції, що містять дозовану форму, що містить пеметрексед та дозовану форму, що містить синергічну кількість метоксіаміну, та способи застосування такої композиції згідно з розкритими способами лікування. У ще одному втіленні є розкритим поліпшене застосування метоксіаміну, застосування антифолатного антиракового агента для лікування раку у пацієнта, поліпшення полягає у застосуванні метоксіаміну у кількості, достатній для посилення токсичності вказаного антифолатного антиракового агенту у вказаного пацієнта. В одному аспекті заявлений винахід базується на раніше невідомому визначенні, що деякі молекули, як-то метоксіаміну, що спрямовують АПсайти, є повністю перорально біопридатними та 96614 6 підтримують мінімальні ефективні концентрації при пероральному застосуванні раз або двічі на добу. Антиракові агенти є звичайно застосовуваними як внутрішньовенний болюс, оскільки вони рідко добре поглинаються зі шлунково-кишкового тракту. Внутрішньовенне дозування має недоліки. По-перше, внутрішньовенна ін'єкція хіміотерапії потребує лікування у лікарні. По-друге, внутрішньовенну терапію звичайно застосовують як болюс, що призводить до дуже високої, але тимчасової дії ліків. Деякі антиракові агенти можуть бути найактивнішими після безперервного піддавання дії, що можна досягти за допомогою повторюваних пероральних доз. Це особливо стосується агентів, що інгібують механізми резистентності до хіміотерапії, де подовжене інгібування шляхів резистентності може бути необхідним для потрібної корисної дії. Подовженої дії ліків можна досягти, застосовуючи безперервне внутрішньовенне застосування. Однак, застосування антиракових агентів безперервним вливанням потребує складної апаратури для вливання ліків та внутрішньовенної катетеризації. Пероральне застосування позбавляє від необхідності безперервного внутрішньовенного вливання та є шляхом застосування кращого для пацієнтів. Однак, за нашими відомостями, інгібітори BER, що усувають резистентність до хіміотерапії та мають майже повну пероральну біопридатність, оскільки запропоновані тут не були розробленими досі. Пеметрексед є багатоспрямованим антифолатним агентом, що діє у стилі, що є механістично відмінним від 5-FU та інших раніше створених антиметаболітів. Пеметрексед є унікальним тим, що він є піролопіримідиновим антифолатним аналогом, що внутрішньоклітинно метаболізується до вищих поліглютаматних форм за допомогою фолілполіглютамат-синтетази (FPGS). Пентаглютаматна форма є домінуючим внутрішньоклітинним біотипом та поліглютамати пеметрекседу є приблизно 60-кратно більш потужними, ніж вихідний моноглютамат; поліглютамати пеметрекседу також виявляють подовжене клітинне утримання. Звідси, фармакологічна дія пеметрекседу утримується протягом багатьох діб після внутрішньовенного болюсного застосування. Пеметрексед інгібує тимідилат-синтазу (TS), дигідрофолат-редуктазу (DHFR) та гліцинамідрибонуклеотид-формілтрансферазу (GARFT), усі залежні від фолатів ферменти приймають участь у біосинтезі нуклеотидів тимідину та пурину. На відміну, 5-FU та інші раніше створені антиметаболіти спочатку інгібують тільки TS. Точний механізм, котрим пеметрексед викликає загибель клітин є ще невідомим, але охоплює більше, ніж інгібування TS. Звідси, тоді як у гетерогенній панелі невибраних ліній клітин раку товстої кишки людини, найкращим прогнозувальником сенситивності до 5FU була TS-активність, ряд детермінантів сенситивності були важливими для пеметрекседу, у тому числі FPGS-активність та кінетика TS-ферменту (van Triest В, Pinedo HM, van Hensbergen Y. Thymidylate synthase level as the main predictor parameter for sensitivity to 5-FU, but not for Folatebased Thymidylate Synthase Inhibitors, in 13 7 Nonselected Colon Cancer Cell Lines. Clin. Cancer. Res. 1999; 5:643-54). Наступне дослідження підтверджувало, що сенситивність ліній шлунковокишкових клітин до пеметрекседу не могла б бути прогнозованою за експресією TS (Kim JH, Lee KW, Jung Y et al. Cytotoxic effects of pemetrexed in gastric cancer cells. Cancer Sci. 2005; 96:365-71). Унікальна фармакологічна активність пеметрекседу стає ясною з дослідження in vitro активності на ряді ліній клітин раку порівняно з 5-FU. У серії з 13 ліній клітин раку товстої кишки, наприклад, пеметрексед був від 18 до 627-разів більш потужним, ніж 5-FU (van Triest et al., 1999). Це унікальна фармакологія, і факт, що пеметрексед, можна вважати, має ряд механізмів дії, що не є повністю зрозумілими, робить важким визначення, яким ефективним він міг би бути при комбінуванні з іншими конкретними антираковими агентами для лікування певних типів раку. Одним аспектом заявленого винаходу є визначення неочікуваного поліпшення у лікуванні типів раку комбінованим застосуванням метоксіаміну з антифолатною сполукою. Таким чином, одне описане тут втілення є спрямованим на способи, що полягають у забезпеченні наступного: і) пацієнт, у котрого діагнозовано рак, іі) перша композиція, що містить антифолатний антираковий агент та ііі) друга композиція, що містить метоксіамін; застосування першої композиції до пацієнта; та застосування другої композиції до вказаного пацієнта, де метоксіамін можна застосовувати у кількості, достатній для посилення або збільшення дії (тобто посилення активності) антифолатного антиракового агента. Будь-який антифолатний антираковий агент можна застосовувати, за умови, що у деяких втіленнях способу, 5-FU є конкретно вилученим. У загальному втіленні антираковий агент можна вибрати з групи: пеметрексед, едатрексат, метотрексат, лометрексол, нолатрексед, ралітрексед, РТ523, триметрексат, аміноптерин, 5,10-Дідеазатетрагідрофолієва кислота (DDATHF), піритрексим, ралтитрексед, GW1843 [(S)-2-[5-[(1,2дигідро-3-метил-1-оксобензо[f]хіназолін-9іл)метил]аміно-1-оксо-2-ізоіндолінілл]-глутарова кислота], їх фармацевтичні солі та будь-які комбінації. У більш загальному втіленні антираковий агент можна вибрати з групи: пеметрексед, едатрексат, метотрексат, лометрексол, нолатрексед, ралітрексед, РТ523, триметрексат, аміноптерин, їх фармацевтичні солі та будь-які комбінації. У найбільш загальному втіленні антираковим агентом може бути пеметрексед та його фармацевтично прийнятні солі. Наприклад, пеметрекседом може бути динатрієва сіль. У зразковому втіленні пеметрекседом може бути динатрієва сіль, гептагідрат. У загальному, але необмежувальному втіленні антифолатним антираковим агентом є пеметрексед. Метоксіамін та антифолатний антираковий агент можна застосовувати послідовно (у будьякому порядку) або застосовувати послідовно (у будь-якому порядку) або застосовувати разом як композицію. Пеметрексед можна, наприклад, застосовувати внутрішньовенно у дозі між 200 та 2 1000 мг/м площі поверхні тіла на добу, або у дозі 2 між 500 та 600 мг/м площі поверхні тіла на добу. У 96614 8 ще одному втіленні співвідношення метоксіаміну до антифолатного антиракового агенту може бути між 1:5 та 1:500. У ще одному аспекті метоксіамін можна застосовувати перорально у кількості, достатній для сенсибілізації раку без виклику надмірної сенсибілізації нормальної тканини. У необмежувальних кращих втіленнях метоксіамін застосовують перорально так, що він має значно підсилену біопридатність відносно інших антиракових агентів, застосовуваних перорально. В інших необмежувальних кращих втіленнях метоксіамін застосовують перорально так, щоб він підтримував мінімальну ефективну концентрацію при дозуванні раз на добу або двічі на добу. Одним шляхом для виміру пероральної біопридатності є порівняння досягнутих рівнів проти рівнів внутрішньовенно застосовуваного метоксіаміну. Таким чином у ще одному аспекті заявленого винаходу, метоксіамін застосовують перорально для отримання біопридатності принаймні 50% відносно внутрішньовенного застосування, принаймні 60% відносно внутрішньовенного застосування, принаймні 70% відносно внутрішньовенного застосування, принаймні 75% відносно внутрішньовенного застосування, принаймні 80% відносно внутрішньовенного застосування, принаймні 85% відносно внутрішньовенного застосування, принаймні 90% відносно внутрішньовенного застосування, принаймні 95% відносно внутрішньовенного застосування, або приблизно еквівалентно внутрішньовенному застосуванню. Це важливо для визначення, що на додаток до неочікувано високого ступеню біопридатності, досягнутого пероральним застосуванням, порівняно з внутрішньовенним застосуванням метоксіаміну, більш бажаний профіль рК отримують порівняно з внутрішньовенним застосуванням метоксіаміну. У ще одному аспекті заявленого винаходу, перорально застосовуваний метоксіамін підтримує мінімальну ефективну концентрацію після застосування раз або двічі на добу внаслідок періоду напівперетворення > 4 годин у плазмі. Ця перевага дозволяє бажаний режим перорального дозування для метоксіаміну, у тому числі раз або двічі на добу. Тоді як внутрішньовенне застосування пеметрекседу, комбіноване з пероральним застосуванням метоксіаміну, є необмежувальним кращим втіленням, інші шляхи застосування є розглянутими для кожного з антиракових агентів. У ще одному аспекті винаходу, способи є запропонованими для лікування деяких типів раку, що є резистентними до лікування тільки антираковим агентом. Відповідно, також запропоновані способи, що полягають у забезпеченні наступного: і) пацієнт, у котрого діагнозовано рак, де вказаний рак може бути резистентним до лікування тільки пеметрекседом, іі) перша композиція, що містить антифолатний антираковий агент; та ііі) друга композиція, що містить метоксіамін; застосування першої композиції до пацієнта; та застосування другої композиції до пацієнта, де метоксіамін можна застосовувати у кількості, достатній для посилення або збільшення дії (тобто посилення токсичності) антифолатного антирако 9 вого агенту. В одному втіленні, антифолатним антираковим агентом може бути пеметрексед. Метоксіамін та антифолатний антираковий агент можна застосовувати послідовно (у будь-якому порядку) або застосовувати послідовно (у будь-якому порядку) чи застосовувати разом як композицію. Пеметрексед можна застосовувати внутрішньовенно 2 у дозі між 200 та 1000 мг/м площі поверхні тіла на 2 добу, або у дозі між 500 та 600 мг/м площі поверхні тіла на добу. Співвідношення пеметрекседу до метоксіаміну може бути між 1:5 та 1:500. У ще одному втіленні кількість метоксіаміну можна застосовувати перорально у кількості, достатній для сенсибілізації раку без виклику надмірної сенсибілізації нормальної тканини. У ще одному втіленні кількість метоксіаміну можна застосовувати перорально раз на добу або двічі на добу у кількості, достатній для сенсибілізації раку без виклику надмірної сенсибілізації нормальної тканини. Тоді як пероральне застосування метоксіаміну є неочікувано кращим шляхом застосування, інші типи застосування є можливими. Ще одне втілення є спрямованим на спосіб лікування раку забезпеченням першої та другої композиції, де вказані перша композиція містить антифолатний агент, а друга композиція містить перорально застосовуваний метоксіамін. Першу композицію, що містить антифолатний агент можна застосовувати звичайними шляхами застосування, у тому числі внутрішньовенно. Необмежувальним кращим антифолатним агентом є пеметрексед. Відповідно, в одному втіленні антифолатним агентом є пеметрексед, а другу композицію, що містить метоксіамін, застосовують перорально у кількості, що є синергічно ефективною порівняно з лікуванням тільки пеметрекседом. У ще одному аспекті спосіб можна застосовувати для лікування типів раку, що є резистентними до пеметрекседу поодинці. Згідно з цими втіленнями пеметрексед застосовують у кількості, що усуває резистентність (та є тому синергічною) до антифолатного агенту поодинці. Таким чином в одному втіленні метоксіамін застосовують перорально у кількості, ефективній для посилення або збільшення токсичності пеметрекседу та долають резистентність раку до лікування пеметрекседом. Наприклад, ефективність пеметрекседу для лікування раку може бути зменшеною внаслідок розвитку резистентності протягом циклу лікування, застосування метоксіаміну може обійти розвинену резистентність, забезпечуючи більше, ніж адитивну дію стосовно лікування раку метоксіаміном або пеметрекседом поодинці. Також є запропонованими способи, що полягають у забезпеченні наступного: і) пацієнт, у котрого діагнозовано рак, де рак можна вибрати з групи: карциноми, меланоми, саркоми, лімфоми, лейкемії, астроцитоми, гліоми, злоякісні меланоми, хронічна лімфоцитна лейкемія, типи раку легень, колоректальні типи раку, типи раку яєчнику, типи раку підшлункової залози, типи раку нирок, типи раку ендометрію, типи раку шлунку, типи раку печінки, типи раку голови та шиї, та типи раку молочної залози, де рак може бути резистентним до лікування тільки пеметрекседом, іі) перша компо 96614 10 зиція, що містить антифолатний антираковий агент та ііі) друга композиція, що містить метоксіамін; застосування першої композиції до вказаного пацієнта; та застосування другої композиції до вказаного пацієнта, де метоксіамін можна застосовувати у кількості, достатній для посилення або збільшення дії антифолатного антиракового агенту. Метоксіамін та антифолатний антираковий агент можна застосовувати послідовно або застосовувати разом як композицію. Наприклад, метоксіамін можна застосовувати першим, а тоді антифолатний антираковий агент можна застосовувати останнім, або антифолатний антираковий агент можна застосовувати першим, а метоксіамін можна застосовувати останнім. У загальному втіленні антифолатним антираковим агентом може бути пеметрексед. Пеметрексед можна застосовувати внутрішньовенно у дозі 2 між 200 та 1000 мг/м площі поверхні тіла на добу, 2 або у дозі між 500 та 600 мг/м площі поверхні тіла на добу. Співвідношення пеметрекседу до метоксіаміну може бути між 1:5 та 1:500. У ще одному втіленні кількість метоксіаміну можна застосовувати перорально у кількості, достатній для виклику сприйнятливості ракових клітин до лікування антираковим агентом (тобто сенсибілізації) без виклику надмірного пошкодження нормальних клітин. У ще одному втіленні кількість метоксіаміну можна застосовувати перорально раз або двічі на добу у кількості, достатній для сенсибілізації раку без виклику надмірної сенсибілізації нормальної тканини. Ще одним втіленням може бути композиція, що містить метоксіамін та антифолатний антираковий агент, де метоксіамін можна застосовувати у кількості, достатній для посилення токсичності антифолатного антиракового агенту. Переважно, антифолатним антираковим агентом є пеметрексед. У ще одному втіленні співвідношення метоксіаміну до антифолатного антиракового агенту може бути між 1:5 та 1:500 у будь-якому зі способів, описаних вище. У ще одному втіленні другий антираковий агент можна застосовувати до або після лікування метоксіаміном та антифолатним антираковим агентом у будь-якому зі способів, описаних вище. У ще одному втіленні є описаним спосіб лікування раку у пацієнта, у котрого діагнозовано рак, який полягає у застосуванні антиметаболітного антиракового агенту до пацієнта, що має такі поліпшення: застосування метоксіаміну до пацієнта у кількості, достатній для посилення токсичності вказаного антиметаболітного антиракового агенту. Антиметаболітний антираковий агент може бути антифолатним антираковим агентом. Антифолатним антираковим агентом може бути пеметрексед, а співвідношення вказаного метоксіаміну до антифолатного антиракового агенту може бути між 1:5 та 1:500. Рак може бути резистентним до лікування тільки пеметрекседом. 11 Опис фігур Фіг. Фіг. 1А-В показують дію пеметрекседу та МОА на розривах ланцюга ДНК, застосовуючи лужний (Фіг. 1А) та нейтральний (Фіг. 1В) кометний аналіз. Фіг. Фіг. 1C-D показують порівняння довжини кометного хвоста між клітинами, обробленими пеметрекседом поодинці або МОА поодинці, та пеметрекседом плюс МОА у клітинах, підданих лужному (Фіг. 1С) та нейтральному (Фіг. 1D) кометним аналізам. Фіг. 2 є схемою, що показує середнє значення концентрації МОА у плазмі від самців щурів Sprague-Dawley у відмінні моменти часу після поодинокого болюсного дозування МОА внутрішньовенним та пероральним застосуванням при 20 мг/кг маси тіла. Фіг. 3 є схемою, що показує середнє значення концентрації МОА у плазмі від самиць щурів Sprague-Dawley у відмінні моменти часу після поодинокого болюсного дозування МОА внутрішньовенним та пероральним застосуванням при 20 мг/кг маси тіла. Фіг. 4А є схемою, що показує відносну кількість АП-сайтів, визначених у клітинах Н460 через 24 годин після лікування пеметрекседом та МОА. Фіг. 4В є схемою, що показує відносну кількість АП-сайтів, визначених у клітинах Н460 при 24 годинах, 48 годинах та 72 годинах. Фіг. 5А показує схематичну діаграму отримання субстратів ДНК з регулярними АП-сайтами або МОА-АП-сайтами. Фіг. 5В показує, що МОА-зв'язані АП-сайти є резистентними стосовно розщеплення АП- ендонуклеазою (АПЕ). Фіг. 6 показує дію пеметрекседу та МОА у комбінації на розриви подвійного ланцюга ДНК та апоптоз. Фіг. 7 показує дію пеметрекседу та МОА у комбінації на рівні BER-білку у клітинах Н460. Фіг. 8 показує дію пеметрекседу та МОА на серединний об'єм пухлин NCI-Н460, пухлин А549, пухлин НСТ116, та ріст пухлин MDA-MB-468 у безтимусних мишей. Деякі втілення винаходу загалом стосуються нових композиції, що містять метоксіамін та антифолатний антираковий агент, та лікування деяких типів раку, застосовуючи ці композиції. Визначення Якщо не визначене інше, наступні терміни мають нижченаведені значення при застосуванні тут та у зміненій формулі винаходу. Терміни, що не є визначеними нижче або будь-де в описі, мають їх визначені значення. Термін "агент" та "ліки" є застосовуваними тут в описі та у формулі винаходу для визначення хімічних сполук, сумішей хімічних сполук, біологічних макромолекул, або екстракти з біологічних матеріалів як-то клітин або тканин бактерій, рослин, грибів або тварин, особливо ссавців, що очікувано мають терапевтичні властивості. Агент або ліки можна очищати, по суті очищати або частково очищати. Термін "антиметаболіт" є застосовуваним тут в описі та у формулі винаходу для визначення хіміо 96614 12 терапевтичного агенту зі структурою, подібною речовині (метаболіту, наприклад, нуклеозиду) потрібною для нормальних біохімічних реакцій, ще достатньо відмінних для взаємодії з нормальними функціями клітин, у тому числі поділом клітин. Термін "антифолатний агент" є застосовуваним тут в описі та у формулі винаходу для визначення хіміотерапевтичного агенту зі структурою, подібною фолієвій кислоті, ще достатньо відмінних для блокування активності фолієвої кислоти та порушення залежних від фолатів механізмів, необхідних для реплікації клітин. Як застосовано тут, антифолатні агенти є одним класом антиметаболітів. Термін "антинеопластичний" є застосовуваним тут в описі та у формулі винаходу для визначення хіміотерапевтичного агенту для інгібування або попередження розвитку та проліферації новоутворень (пухлин), що можуть ставати злоякісними, націлюванням ДНК. Термін "проявлення" є застосовуваним тут в описі та у формулі винаходу для визначення будьяких відомих способів спеціалістам, що є застосовуваними для кращої візуалізації, розрізнення або ідентифікації певних компонентів та/або особливостей клітин або клітини. Термін "в операбельній комбінації", "в операбельному порядку" та "операбельно зв'язаний" є застосовуваним тут в описі та у формулі винаходу для визначення зв'язку послідовностей нуклеїнових кислот у такому стилі, щоб молекула нуклеїнової кислоти була здатною спрямовувати транскрипцію даного гена та/або синтез, щоб утворювати потрібну молекулу білку. Термін також стосується зв'язку послідовностей амінокислот у такому стилі, щоб утворювати функціональний білок. Термін "антиген" є застосовуваним тут в описі та у формулі винаходу для визначення білку, глікопротеїну, ліпопротеїну, ліпіду або іншої речовини, що є реактивними, антитілом специфічним для частини молекули. Термін "морфологія" є застосовуваним тут в описі та у формулі винаходу для визначення візуального зовнішнього вигляду клітин або організму. Термін "суб'єкт," "особа," та "пацієнт" є застосовуваними тут в описі та у формулі винаходу для визначення людини або іншої тварини (наприклад, морської свинки або мишей) здатних мати клітинний цикл визначеної хвороби, існуючої від народження або індукованої, у тому числі, але без обмеження, раку. Термін "усуває резистентність" означає, що застосування другого агенту у комбінації з первинним хіміотерапевтичним агентом є здатним продукувати значне зменшення об'єму пухлини на рівні статистичної значності (наприклад, р 13, 300 мМ NаОН, 1 мМ ЕДТА) та нейтральному розчині (1 Х ТВЕ) протягом 25 хвил при 18 В (0,6 В/см), 250 мА. Лужний електрофорез визначає поодинокі та розриви подвійного ланцюга ДНК, утворені від АП-сайтів, а також інші лужні лабільні адукти ДНК, тоді як нейтральний електрофорез визначає домінуючі розриви подвійного ланцюга ДНК. Слайди видаляли та промивали нейтралізаційним буфером (0,5 М Трис- НСl, рН 7,5) протягом 10 хвил, тоді БФФР залишали сохнути на повітрі протягом ночі при кімнатній температурі. ДНК фарбували, застосовуючи комплект проявлення сріблом (Тrеvіgеn), за інструкціями виробника. Комети візуалізовали, застосовуючи мікроскоп Оlуmрus. Зображення збирали, застосовуючи цифрову камер та аналізували, застосовуючи програму зображення NІН. Зображення комет показані на Фіг. 1А (лужний аналіз) та Фіг. 1В (нейтральний аналіз). Після лікування пеметрекседом та МОА, спостерігали відмінні комети, та довжина хвоста була приблизно у 4 рази більше, ніж з МОА поодинці, та приблизно у два рази більше, ніж з пеметрекседом поодинці (Фіг.Фіг. 1С-D). Результати з дослідження ефективності ксенотрансплантату, аналізу АП-сайтів та аналізу комет показують, що МОА діє як структурний модулятор АП-сайтів, підсилюючи терапевтичну дію антиметаболітного агенту пеметрекседу реверсуванням резистентність до хіміотерапії, створюючи тим синергічну дію. Приклад 4 Аналіз дії АП-сайту або МОА-АП-сайту на опосередковане ДНК-топоізомеразою ІІ розщеплення ДНК. Позиція-специфічний апуриновий сайт уводили заміщенням поодинокого нуклеозиду дезоксиуридином на сайт розщеплення топоізомеразою ІІ та тоді видаляли основу урацилу урацилДНК-глікозилазою, створенням АП-сайтів, що далі інкубують з МОА для продукування МОА-АП-сайтів (Фіг. 5А). По-перше, було визначено, чи АПЕ має диференційну дію між регулярними АП-сайтами та МОА-АП-сайтами, розташованими у позиції специфічного сайту для розщеплення топоізомеразою 96614 40 ІІ. Результати показують, що АПЕ є здатною до розщеплення регулярних АП-сайтів краще, ніж зв‟язані з МОА АП-сайти (Фіг. 5В), однак, АП та МОА-АП-сайти розщеплюються топоізомеразою ІІ, вказуючи, що МОА-АП-сайти є здатними стимулювати опосередковане ДНК-топоізомеразою ІІ розщеплення ДНК. Приклад 5 Дослідження пероральної та внутрішньовенної біопридатності МОА поодиноким болюсним застосуванням до щурів Sрrаguе Dаwlеу (Nоn-GLР) Дослідження, описані нижче, виконували для оцінки біопридатності метоксіаміну (МОА) при безпечному рівні доз порівнянням фармакокінетичних параметрів після поодинокого болюсного перорального та внутрішньовенного застосування МОА Тест-тварини. 30 самців та 30 самиць щурів Sрrаguе Dаwlеу по 250- 350 г, 7-10 тижнів віку, були застосовуваними протягом дослідження. Отримання та концентрація доз. Одну дозу розчину отримували на ту ж добу застосування дози для досягнення концентрації 4,00 мг/мл “активного” МОА, 816,77 мг МОА розчиняли у 5% декстрозі у 200-мл мірній колбі. Отриманий розчин порівну ділили на дві жовті пляшки для перорального або внутрішньовенного застосування. Аліквоти відбирали для аналізу при отриманні та після дозування переносили на сухий лід та зберігали при < –70 °С. Застосування доз. Усіх тварин зважували на добу застосування дози. Дози були на основі маси тіла. Було застосовано постійний об‟єм доз 5 мл/кг. Внутрішньовенні дози застосовували поодинокою болюсною ін‟єкцією у вену хвоста, застосовуючи шприц на 3-мл з голкою 26G 1”. Внутрішньовенну дозу застосовували при швидкості приблизно 2 мл/хвил. Пероральні дози застосовували як поодинокий болюс з голкою 18G 2”, приєднаною до шприца 3-мл. Збирання зразків крові. Зразки крові збирали через 5, 15, 30 хвилин, та 1, 2, 4, 6, 8, 12 та 24 годин після дози зі збиранням у два моменти часу для кожної тварини. Зразки крові збирали через шийну вену протягом попереднього моменту часу та через абдомінальну вену при вбиванні в останній момент часу. Кров переносили шприцом у тубу на 2 мл для збирання крові, що містить К 3-ЕДТА як антикоагулянт та інвертували до суміші. Збирання крові з абдомінальної вени виконували негайно після евтаназії СО2. Отримання зразків плазми та умови зберігання. Тубу з кров‟ю поміщали на вологий лід перед центрифугуванням для отримання плазми. Цілі зразки крові центрифугували при 3000 об/хвил при 4 °С, протягом 10 хвил. Плазму переносили піпеткою у туби та спочатку поміщали на сухий лід та зберігали при
ДивитисяДодаткова інформація
Назва патенту англійськоюCombinations of antifolate agent in the treatment of cancer
Автори англійськоюTheuer, Charles, P., Adams, Bonne, Jean
Назва патенту російськоюКомбинации антифолатного агента в лечении рака
Автори російськоюТеуэр Чарльз П., Адамс Бонн Джейн
МПК / Мітки
МПК: A61K 31/131, A61K 31/519, A61P 35/00
Мітки: лікуванні, раку, антифолатного, комбінації, агента
Код посилання
<a href="https://ua.patents.su/26-96614-kombinaci-antifolatnogo-agenta-u-likuvanni-raku.html" target="_blank" rel="follow" title="База патентів України">Комбінації антифолатного агента у лікуванні раку</a>
Попередній патент: Спосіб диференціальної діагностики дилятаційної кардіоміопатії і хронічного міокардиту
Наступний патент: Комбінований перетворювач сонячної енергії
Випадковий патент: Комплекс сонячного ставка і підземного теплоакумулятора свердловинного типу