Невірусний вектор для введення нуклеїнової кислоти та спосіб його одержання, конденсований комплекс поліпептид/нуклеїнова кислота та спосіб вбудовування нуклеїнової кислоти, що представляє інтерес, в еукаріотич
Номер патенту: 77393
Опубліковано: 15.12.2006
Автори: Мюррей Карл, Алтон Ерік, Пєрузель Ерік, Менвелл Мішель, Меттьюз Девід, Руссель Віллі, Міллєр Ендрю Девід, Тагава Тошіакі
Формула / Реферат
1. Невірусний вектор для введення нуклеїнової кислоти, який містить конденсований комплекс поліпептид/нуклеїнова кислота і катіонний ліпід, де комплекс включає
(а) нуклеотидну послідовність (NOI), що представляє інтерес; і
(б) один або декілька аденовірусних поліпептидів або їх похідних, які упаковують нуклеїнову кислоту, де поліпептиди або їх похідні (І) мають здатність зв'язуватися з NOI; і (II) мають здатність конденсувати NOI; і де NOI є гетерологічною стосовно поліпептиду.
2. Вектор за п. 1, де аденовірусний поліпептид являє собою Mu1, pV або pVII або його похідне.
3. Вектор за п. 1 або п. 2, який додатково включає поліпептид, який містить послідовність ядерної локалізації (NLS).
4. Вектор за п. 3, де поліпептид, який містить послідовність ядерної локалізації (NLS), являє собою аденовірусний pV або його похідне.
5. Конденсований комплекс поліпептид/нуклеїнова кислота, який містить катіонний ліпід, поліпептидний компонент і компонент, що являє собою нуклеїнову кислоту, призначений для введення компонента, що являє собою нуклеїнову кислоту, у ядро еукаріотичної клітини, де
(І) поліпептидний компонент є аденовірусним поліпептидом або його похідним, який упаковує нуклеїнову кислоту;
(II) поліпептидний компонент або його похідне має здатність зв'язуватися з NOI; і
(III) поліпептидний компонент або його похідне має здатність конденсувати NOI; і де нуклеїнова кислота є гетерологічною стосовно поліпептиду.
6. Комплекс за п. 5, де аденовірусний поліпептид являє собою Mu1, pV або pVII або його похідне
7. Комплекс за п. 5 або п. 6, який додатково включає поліпептид, який містить послідовність ядерної локалізації (NLS).
8. Комплекс за п. 7, де поліпептид, який містить послідовність ядерної локалізації (NLS), являє собою аденовірусний pV або його похідне.
9. Комплекс за будь-яким з пп. 5-8, де співвідношення катіонний ліпід:NOI:поліпептид складає 2-20:1:0,5-1, переважно 10-14:1:0,5-0,7, більш переважно 12:1:0,6.
10. Спосіб одержання невірусного вектора, призначеного для введення нуклеїнової кислоти, який містить конденсований комплекс поліпептид/нуклеїнова кислота і катіонний ліпід, який полягає в тому, що
(а) нуклеотидну послідовність (NOI), що представляє інтерес, приводять у контакт із аденовірусним поліпептидом або його похідним, який упаковує нуклеїнову кислоту, де поліпептидний компонент або його похідне, (І) має здатність зв'язуватися з NOI; і (II) має здатність конденсувати NOI; і де NOI є гетерологічною стосовно поліпептиду; і
(б) утворений у результаті цей комплекс нуклеїнова кислота/поліпептид приводять у контакт із катіонним ліпідом.
11. Спосіб вбудовування нуклеїнової кислоти (NOI), що являє інтерес, у еукаріотичну клітину, який полягає в тому, що клітину приводять у контакт із комплексом за будь-яким з пп. 5-9, де комплекс містить NOI.
12. Спосіб за п. 11, де клітина являє собою нервову клітину, ракову клітину або епітеліальну клітину.
13. Застосування аденовірусного поліпептиду або його похідного, який упаковує нуклеїнову кислоту, де поліпептид або його похідне (І) мають здатність зв'язуватися з NOI; і (II) мають здатність конденсувати NOI; і де NOI є гетерологічною стосовно поліпептиду, для одержання невірусного вектора для введення нуклеїнової кислоти за п. 1.
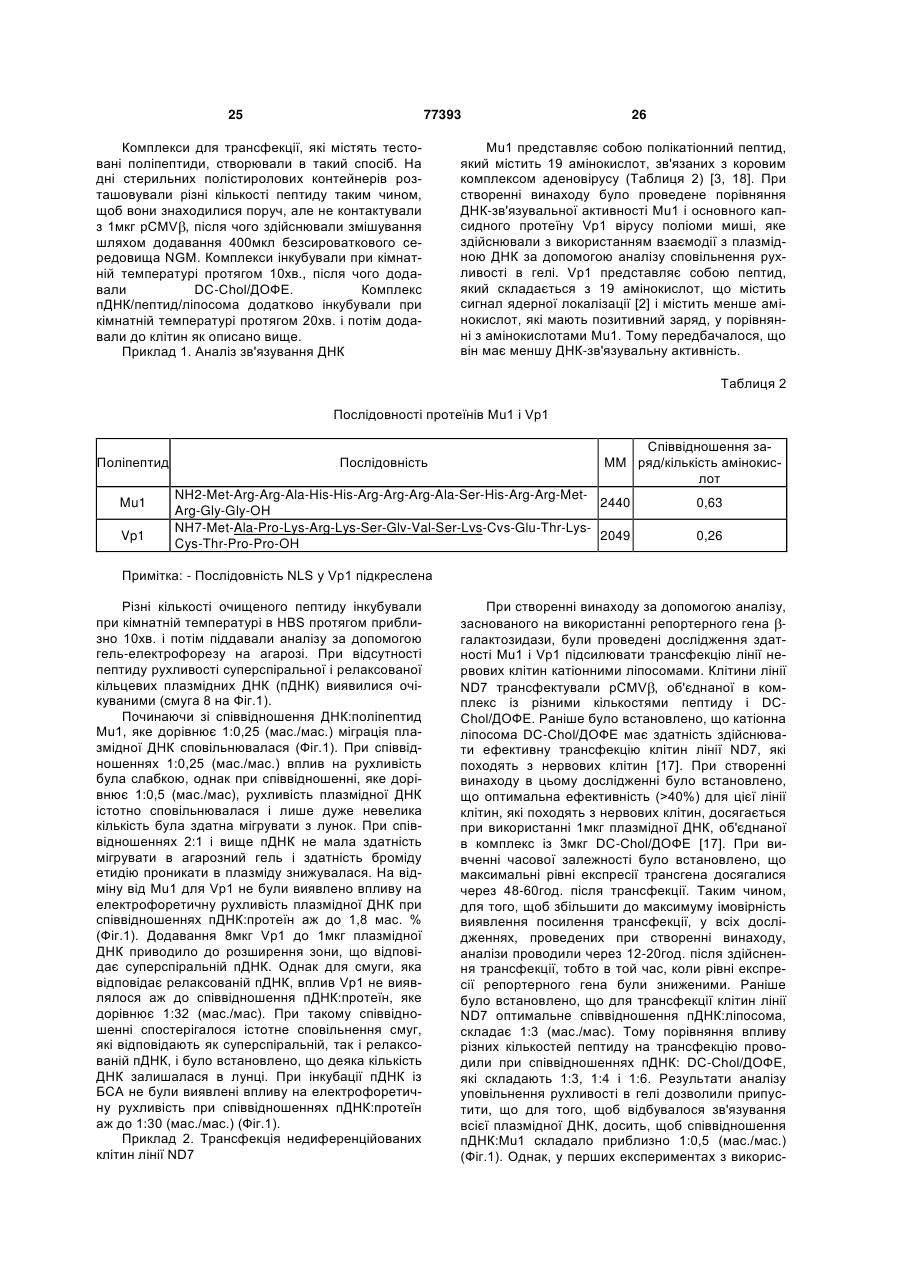
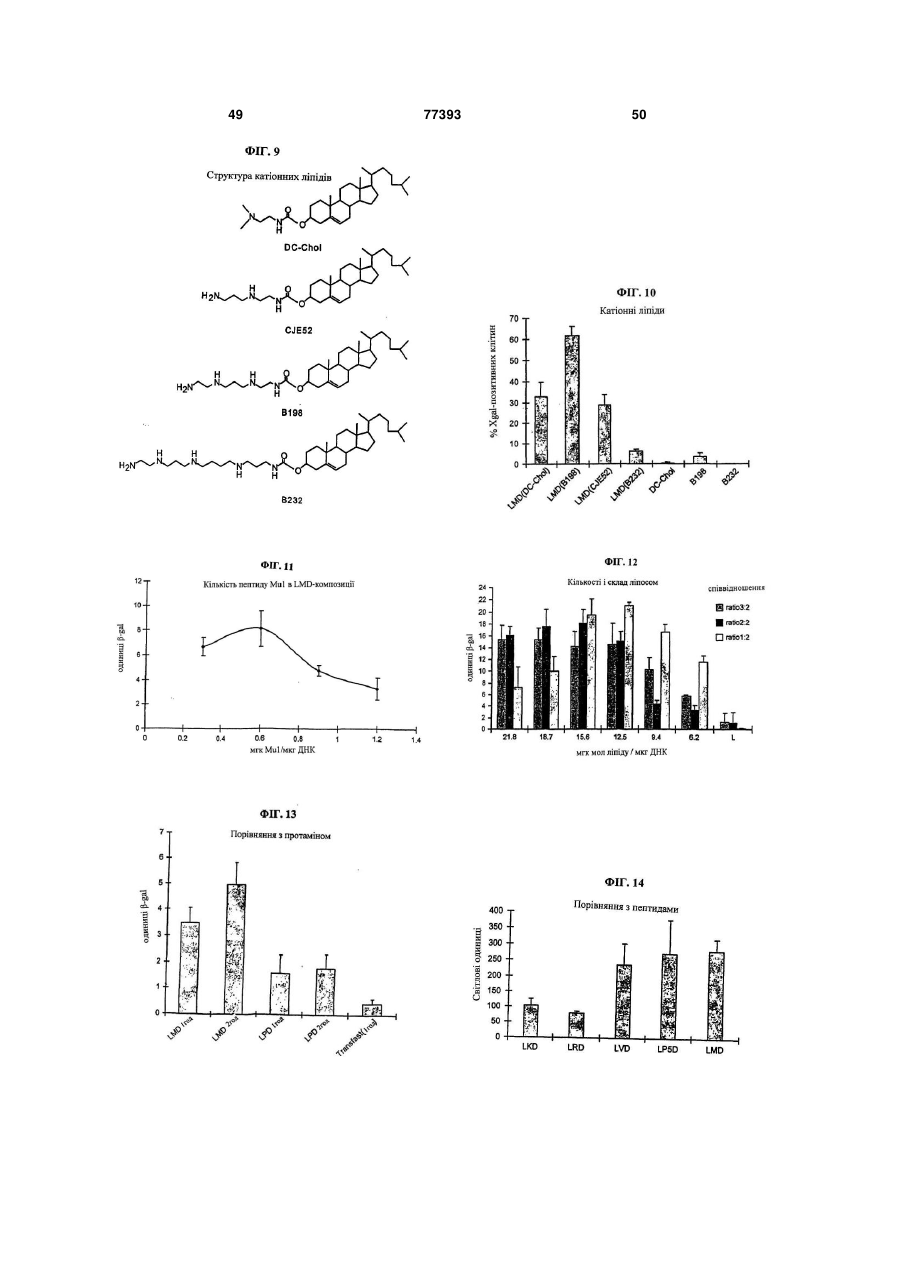
Текст
1. Невірусний вектор для введення нуклеїнової кислоти, який містить конденсований комплекс поліпептид/нуклеїнова кислота і катіонний ліпід, де комплекс включає (а) нуклеотидну послідовність (NOI), що представляє інтерес; і (б) один або декілька аденовірусних поліпептидів або їх похідних, які упаковують нуклеїнову кислоту, де поліпептиди або їх похідні (І) мають здатність зв'язуватися з NOI; і (II) мають здатність конденсувати NOI; і де NOI є гетерологічною стосовно поліпептиду. 2. Вектор за п.1, де аденовірусний поліпептид являє собою Mu1, pV або pVII або його похідне. 2 (19) 1 3 77393 4 20:1:0,5-1, переважно 10-14:1:0,5-0,7, більш переважно 12:1:0,6. 10. Спосіб одержання невірусного вектора, призначеного для введення нуклеїнової кислоти, який містить конденсований комплекс поліпептид/нуклеїнова кислота і катіонний ліпід, який полягає в тому, що (а) нуклеотидну послідовність (NOI), що представляє інтерес, приводять у контакт із аденовірусним поліпептидом або його похідним, який упаковує нуклеїнову кислоту, де поліпептидний компонент або його похідне, (І) має здатність зв'язуватися з NOI; і (II) має здатність конденсувати NOI; і де NOI є гетерологічною стосовно поліпептиду; і (б) утворений у результаті цей комплекс нуклеїнова кислота/поліпептид приводять у контакт із катіонним ліпідом. 11. Спосіб вбудовування нуклеїнової кислоти (NOI), що являє інтерес, у еукаріотичну клітину, який полягає в тому, що клітину приводять у контакт із комплексом за будь-яким з пп.5-9, де комплекс містить NOI. 12. Спосіб за п.11, де клітина являє собою нервову клітину, ракову клітину або епітеліальну клітину. 13. Застосування аденовірусного поліпептиду або його похідного, який упаковує нуклеїнову кислоту, де поліпептид або його похідне (І) мають здатність зв'язуватися з NOI; і (II) мають здатність конденсувати NOI; і де NOI є гетерологічною стосовно поліпептиду, для одержання невірусного вектора для введення нуклеїнової кислоти за п.1. Даний винахід стосується комплексів типу катіонний ліпід/протеїн/нуклеїнова кислота, які містять вірусні упаковувальні протеїни, і їх застосування для ефективного введення нуклеїнових кислот в клітини, такі як нервові клітини. При створенні винаходу були проведені дослідження вірусних протеїнів, зв'язаних із ДНК, у відношенні їх здатності підсилювати опосередковуване ліпосомами перенесення генів. Зокрема, проводили порівняння кодованого вірусом синтетичного пептиду Mu1 і рекомбінантного протеїну Vp1 аденовірусу і вірусу поліоми відповідно. Mul може відігравати роль у конденсації аденовірусної хромосоми, у той час як Vp1 є лише структурним протеїном вірусу поліоми, який має ДНКзв'язувальну активність [1-3]. Vp1 на відміну від Mu1 містить вбудований класичний сигнал ядерної локалізації (NLS), аналогічний до сигналу, виявленому в HMG-1,2 і nls-Hl [2]. Було встановлено, що Mu1 на відміну від Vp1 істотно підсилює опосередковуване катіонними ліпосомами перенесення генів у клітини, виділені з нервової системи і нирки. Було також встановлено, що опосередковуване Mu1 посилення проявлялося в більшому ступені в клітинах, які диференціюються, що свідчить про можливу застосовність даного підходу для нервових клітин in vivo. Одержані результати можна використовувати в експериментальних і терапевтичних цілях для опосередковуваного ліпосомами введення ДНК у клітини ЦНС. Таким чином, об'єктом даного винаходу є невірусний вектор для введення нуклеїнової кислоти, який містить конденсований комплекс поліпептид/нуклеїнова кислота і катіонний ліпід, де комплекс включає (а) нуклеотидну послідовність (N0I), що представляє інтерес; і (б) один або декілька вірусних поліпептидів або їх похідних, які упаковують нуклеїнову кислоту, де поліпептиди або їх похідні (І) мають здатність зв'язуватися з N0I; і (II) мають здатність конденсу вати N0I; і де N0I є гетерологічною стосовно поліпептиду. Переважно принаймні один поліпептид представляє собою аденовірусний поліпептид або його похідне, що упаковує нуклеїнову кислоту. Більш переважно аденовірусний поліпептид представляє собою Mu1, pV або ρVII або його похідне. Поняття "гетерологічний стосовно поліпептиду" означає, що в цьому випадку відсутні вірусні N0I, які зустрічаються в природних умовах у комбінації з вірусним упаковувальним поліпептидом. У переважному варіанті вектор додатково включає поліпептид, який містить послідовність ядерної локалізації (NLS). Більш переважно поліпептид, який містить послідовність ядерної локалізації (NLS), представляє собою аденовірусний pV або його похідне. Об'єктом даного винаходу є також конденсований комплекс поліпептид/нуклеїнова кислота, який включає катіонний ліпід, поліпептидний компонент і компонент, що представляє собою нуклеїнову кислоту, призначений для введення компонента, що представляє собою нуклеїнову кислоту, у ядро еукаріотичної клітини, де: (I) компонент, який представляє собою поліпептид, є вірусним поліпептидом або його похідним, що упаковує нуклеїнову кислоту; (II) компонент, який представляє собою поліпептид або його похідне, має здатність зв'язуватися з N0I; і (III) компонент, що представляє собою поліпептид або його похідне має здатність конденсувати N0I; і де нуклеїнова кислота є гетерологічною стосовно поліпептиду. Переважно принаймні один поліпептид представляє собою аденовірусний поліпептид або його похідне, що упаковує нуклеїнову кислоту. Більш переважно аденовірусний поліпептид представляє собою Mu1, pV або pVII або його похідне. У переважному варіанті здійснення комплекс також містить послідовність ядерної локалізації (NLS). Більш переважно поліпептид, який містить 5 послідовність ядерної локалізації (NLS), представляє собою аденовірусний pV або його похідне. Даний винахід стосується також способу одержання невірусного вектора, призначеного для введення нуклеїнової кислоти, що містить конденсований комплекс поліпептид/нуклеїнова кислота і катіонний ліпід, який полягає в тому, що: (а) нуклеотидну послідовність (N0I), що представляє інтерес, приводять у контакт із вірусним поліпептидом або його похідним, що упаковує нуклеїнову кислоту, де компонент, що представляє собою поліпептид або його похідне, (І) має здатність зв'язуватися з N0I; і (II) має здатність конденсувати N0I; і де N0I є гетерологічною стосовно поліпептиду; і (б) утворений в результаті комплекс нуклеїнова кислота/поліпептид приводять у контакт із катіонним ліпідом. Даний винахід стосується також способу вбудовування нуклеотидної послідовності (N0I), що представляє інтерес, у еукаріотичну клітину, який полягає в тому, що клітину приводять у контакт із комплексом за винаходом, який містить N0I. Переважно клітина представляє собою нервову, ракову або епітеліальну клітину. В альтернативному варіанті замість або на додаток до вірусного поліпептиду, що упаковує нуклеїнову кислоту, можна використовувати вірусний поліпептид, що здійснює ядерну локалізацію/введення нуклеїнової кислоти. У дійсності деякі вірусні поліпептиди мають обидві ці функції. А. Поліпептидні компоненти 1. Вірусні поліпептиди, що упаковують нуклеїнову кислоту Поняття "вірусний поліпептид, що упаковує нуклеїнову кислоту" звичайно включає поліпептиди, які кодуються вірусними геномами, які присутні в природних умовах у вірусних частинках, функція яких полягає в упакуванні, зокрема в конденсації, і введенні в ядро нуклеїнових кислот, які утворюють вірусний геном віріону. Під це поняття також підпадають описані нижче їх гомологи і похідні, а також фрагменти. Прикладами вірусних поліпептидів, що упаковують нуклеїнову кислоту, є вірусні корові протеїни, такі як коровий антиген вірусу гепатиту В і аденовірусні корові протеїни, Mu1, pV і pVII, а також еквівалентні до них протеїни інших аденовірусів, таких як Mastadenoviruses (аденовіруси ссавців) і Aviadenoviruses (аденовіруси птахів). Найбільш переважним для застосування згідно із даним винаходом вірусним поліпептидом, що упаковує нуклеїнову кислоту, є поліпептид Mu1, послідовність якого: NH2-Met-Arg-Arg-Ala-His-His-Arg-Arg-Arg-ArgAla-Ser-His-Arg-Arg-Met-Arg-Gly-Gly-OH (SEQ ID NO: 1). Вірусні поліпептиди, що упаковують нуклеїнову кислоту, які можна застосовувати відповідно до даного винаходу, мають здатність зв'язуватися з нуклеїновими кислотами, як правило, неспецифічним чином, переважно викликаючи при цьому конденсацію нуклеїнової кислоти. Для забезпечення оптимальної ефективності введення в клітинумішень у цілому переважно, щоб довжина конден 77393 6 сованої N0I дорівнювала або не перевищувала 200нм, наприклад, становила від 50нм до 200нм. Здатність вірусних поліпептидів зв'язуватися з нуклеїновими кислотами можна оцінювати в дослідах in vitro за допомогою таких методів, як гельелектрофорез, у тому числі за допомогою аналізу на уповільнення рухливості в гелі, електрофоретичного аналізу зміни рухливості смуг у гелі, аналізу, заснованого на виділенні за допомогою броміду етидію, і афінної хроматографії, наприклад, з використанням одноланцюгової або дволанцюгової ДНК-целюлози. Здатність вірусних поліпептидів конденсувати нуклеїнові кислоти можна оцінювати, наприклад, за допомогою спектроскопії на основі методу циркулярного дихроїзму (ЦД) [4]. Як правило, при фізіологічних значеннях рН (наприклад, рН 7,4) вірусні поліпептиди або їх гомологи або похідні містять велику кількість позитивно заряджених амінокислотних залишків. Переважно чистий сумарний заряд вірусного поліпептиду при фізіологічному значенні рН є позитивним. Зокрема, переважно, щоб співвідношення заряд:кількість амінокислотних залишків складало принаймні +0,3, переважно принаймні +0,4, +0,5 або +0,6. Переважно, щоб вірусні поліпептиди або їх гомологи або похідні містили залишки аргініну, а не залишки лізину, або їх суміш. Найбільш переважно, щоб вірусні поліпептиди або їх гомологи або похідні містили також один або декілька залишків гістидину, переважно два або більше залишки гістидину. Крім того, вірусні поліпептиди або їх гомологи або похідні, як правило, повинні містити велику кількість залишків амінокислот, що мають високу гідрофобність, таких як аланін, наприклад, два або більше гідрофобні залишки. Слід розуміти, що амінокислотні послідовності, · які можна застосовувати відповідно до винаходу, не обмежені вірусними поліпептидами, які зустрічаються в природних умовах і які упаковують нуклеїнову кислоту, а також включають гомологічні послідовності, одержані з будь-якого джерела, наприклад, споріднені вірусні/бактеріальні протеїни, клітинні гомологи і синтетичні пептиди, а також їх варіанти і похідні, такі як фрагменти. У контексті даного опису гомологічна послідовність означає послідовність, що містить амінокислотну послідовність, яка принаймні на 60-90%, переважно принаймні на 95% або 98%, ідентична до принаймні 10, переважно до принаймні 20-50 амінокислот вірусного коревого поліпептиду, наприклад, послідовність Mu1, представлену у вигляді SEQ ID NO: 1. Гомологію слід оцінювати насамперед для тих ділянок, які як відомо є важливими для зв'язування нуклеїнової кислоти, а не для сусідніх ділянок, які не мають вирішального значення. Хоча гомологію можна оцінювати також з погляду подібності (тобто кількості амінокислотних залишків, які мають подібні хімічні властивості/функції), у контексті даного опису переважно гомологію оцінювати з погляду ідентичності послідовностей. Оцінку гомології можна проводити візуально або, що є більш зручним, за допомогою вже засто 7 совуваних програм порівняння послідовностей. Такі доступні на комерційній основі комп'ютерні програми дозволяють розраховувати відсоток гомології двох або декількох послідовностей. Відсоток гомології можна розраховувати для неперервних послідовностей, тобто коли одну послідовність порівнюють з іншою послідовністю і кожну амінокислоту в одній послідовності безпосередньо зіставляють з відповідною амінокислотою в іншій послідовності, кожного разу з один залишок з іншим залишком. Ця процедура називається "порівнянням послідовностей без урахування прогалин". Як правило, такі порівняння без урахування прогалин здійснюють лише для відносно невеликої кількості залишків, наприклад, для менше ніж 50 суміжних амінокислот. Хоча даний метод є дуже простим і несуперечливим, він виявляється непридатним, наприклад, при аналізі пар послідовностей, ідентичних за винятком однієї вставки або делеції, він приводити до виключення з розгляду наступних за ними амінокислотних залишків і до значного зменшення відсотку гомології при здійсненні глобального порівняння послідовностей. Внаслідок цього більшість методів порівняння послідовностей створені для того, щоб мати можливість здійснення оптимального порівняння, що враховує можливі вставки і делеції, при якому не відбувається надмірного зменшення загальної оцінки ступеня гомології. Це досягається шляхом введення "прогалин" при порівнянні послідовностей з метою максимізації локальної гомології. Однак, оскільки при використанні цих більш складних методів для кожної прогалини, який зустрічається при проведенні порівняння, приписується "штраф за прогалину", то існує можливість, що для однієї і тієї ж кількості ідентичних амінокислот даний метод порівняння послідовностей у випадку мінімальної кількості прогалин, що відповідає більш високій подібності двох порівнюваних послідовностей, вони дають більш високу оцінку, ніж для послідовностей з великою кількістю прогалин. Для того, щоб зберегти відносно високу ціну за наявність прогалини і більш низький штраф за кожен наступний залишок у прогалині, як правило, застосовують "ціну за афінну прогалину". Такий метод представляє собою найбільш часто застосовувану систему оцінки з використанням прогалин. Природно, що високі штрафи за прогалину дозволяють робити більш оптимальні оцінки послідовностей, які мають невелику кількість прогалин. Для більшості програм порівняння послідовностей є можливість коректування штрафів за прогалину. Однак при використанні такого програмного забезпечення для порівняння послідовностей переважно застосовувати параметри, які задаються за умовчанням. Наприклад, при використанні пакета програм GCG Winsconsin Bestfit [5] штраф, що задається за умовчанням, за прогалину в амінокислотній послідовності складає -12, а за кожне подовження прогалини складає -4. Таким чином, обчислення відсотка гомології, насамперед, вимагає проведення оптимального порівняння послідовностей з урахуванням штрафів за прогалину. Для здійснення такого порівнян 77393 8 ня можна використовувати комп'ютерну програму GCG Winsconsin Bestfit [5]. Приклади інших програм, які дозволяють забезпечувати порівняння послідовностей, включають (але не обмежуючись ними) пакет програм BLAST [6], FASTA [7] і набір для порівняння послідовностей GENEWORKS. Програми BLAST і FASTA можна використовувати для дослідження як у режимі off-line, так і on-line, однак переважно використовувати програму GCG Winsconsin Bestfit. Хоча кінцевий відсоток гомології можна оцінювати з погляду ідентичності, сам процес порівняння послідовностей звичайно не заснований на порівнянні пар за принципом "так-ні". Замість цього застосовують матрицю відносних балів подібності, відповідно до якої при кожному порівнянні пар на основі хімічної подібності або еволюційної відстані одержують певний бал. Прикладом такої звичайно використовуваної матриці є матриця BLOSUM62 матриця, що задається за умовчанням, для пакета програм BLAST. У програмах GCG Winsconsin Bestfit, як правило, використовують або відомі значення, що задаються за умовчанням, або придатну для конкретного випадку таблицю порівняльних символів (більш докладно див. посібник для користувача). Для пакета програм GCG переважно застосовувати відомі значення, які задаються за умовчанням, а у випадку використання іншого програмного забезпечення слід застосовувати матрицю, що задається за умовчанням, таку як BLOSUM62. Після того, як за допомогою програмного забезпечення здійснене оптимальне порівняння послідовностей, можна розраховувати % гомології, переважно % ідентичності послідовностей. Звичайно це здійснюють за допомогою програмного забезпечення як певний етап порівняння послідовностей і видають у вигляді чисельного результату. Поняття "похідне" стосовно до амінокислотних послідовностей за даним винаходом стосується будь-якого заміщення, зміни, модифікації, заміни, делеції або додавання однієї (або декількох) амінокислот у послідовності, які дозволяють одержувати кінцеву амінокислотну послідовність, яка має активність у відношенні зв'язування з нуклеїновими кислотами і їх конденсації, що переважно має принаймні таку же активність, як і немодифіковані поліпептиди. Для застосування згідно із даним винаходом можна модифікувати вірусні поліпептиди. Звичайно здійснюють такі модифікації, які зберігають здатність послідовності зв'язуватися з нуклеїнової кислотою і конденсувати її. Кількість амінокислотних замін може складати, наприклад, від 1, 2 або 3 до 10, 20 або 30 за умови, що модифікована послідовність зберігає здатність зв'язуватися з нуклеїнової кислотою і конденсувати її. Амінокислотні заміни можна робити з використанням аналогів, які не зустрічаються в природних умовах, наприклад, з метою збільшення часу напівжиття в плазмі поліпептиду, що вводитися з терапевтичною метою. Зокрема, може виявитися доцільним здійснювати амінокислотні заміни для того, щоб збільшувати при фізіологічному значенні рН чистий пози 9 77393 тивний заряд вірусного упаковувального поліпептиду, який зустрічається в природних умовах. Позитивно заряджені амінокислоти включають аргінін, лізин і гістидин. Аргінін має найбільший заряд серед амінокислот, які зустрічаються в природних умовах, і тому є найбільш переважним. Консервативні заміни можна здійснювати, наприклад, відповідно до Таблиці 1. Таблиця 1 Консервативні заміни амінокислот Полярність Аліфатич- Неполярні ні Полярні - які не мають електричного заряду Полярні - які мають електричний заряд Ароматичні Амінокислоти GAP ILV CSTM NQ DE KR HFWY Консервативні заміни можна здійснювати, наприклад, відповідно до наведеної вище таблиці. Амінокислоти, вказані у Таблиці 1 в одному й тому ж блоці в другому стовпчику й переважно в одному й тому ж рядку в третьому стовпчику, можна замінювати одну на одну. Поліпептиди, призначені для застосування відповідно до винаходу, можна одержувати рекомбінантними методами, наприклад, як описано нижче. Однак їх можна також одержувати синтетичним шляхом за допомогою добре відомих фахівцям у даній галузі методів, таких як метод твердофазного синтезу. Поліпептиди, призначені для застосування відповідно до винаходу, можна створювати також у вигляді злитих протеїнів, наприклад, для цілей екстракції й очищення. Прикладами компонентів злитих протеїнів є глутатіон-S-трансфераза (GST), 6xHis, GAL4 (ДНК-зв'язувальні домени і/або домени, які активують транскрипцію ) і галактозидаза. Може виявитися доцільним вбудовувати сайт протеолітичного розщеплення між компонентом, що представляє собою злитий протеїн, і послідовністю протеїну, що представляє інтерес, для того, щоб мати можливість видаляти послідовності злитого протеїну. Переважно компонент, що представляє собою злитий протеїн, не знижує біологічну активність протеїну, який має послідовність, що представляє інтерес. Поліпептиди, призначені для застосування відповідно до винаходу, можуть знаходитися в практично виділеній формі. Це означає, що поліпептиди можна змішувати з носіями або розріджувачами, які не впливають на цільову функцію поліпептидів і тому останні можна розглядати як практично виділені. Поліпептиди можуть знаходитися також у практично очищеній формі, де як правило більше 90%, наприклад, 95, 98 або 99% протеїну в композиції містить поліпептиди, призначені для застосування відповідно до винаходу. 10 2. Поліпептиди, які містять послідовності ядерної локалізації В переважному варіанті здійснення вектор для введення/комплекс за винаходом додатково включає поліпептид, який містить послідовність ядерної локалізації (NLS). У цілому NLS добре відомі в даній галузі [8]. Однак найбільше переважно використовувати NLS аденовірусного корового протеїну pV. NLS протеїну pV представляє собою послідовність RPRRRATTRRJITTTGTRRRRRRR (SEQ ID NO: 2). Послідовність SEQ ID NO: 2 відповідає амінокислотам 315-337 (D. Mattews, не опубліковано). Ще одна NLS розташована на N-кінці: (KPRKLKRVKKKKK ( SEQ ID NO: 3), хоча переважно, щоб NLS була розташована на С-кінці. NLS може бути присутнім на поліпептидній молекулі, відмінній від упакувального поліпептиду, або у вигляді частини одного і того ж ланцюга такого поліпептиду, наприклад, у складі злитого протеїну. Б. Нуклеотидні послідовності, які представляють інтерес Нуклеотидні послідовності (N0I), що представляють інтерес, які потрібно вводити в клітини за допомогою призначеного для введення вектора або комплексу за винаходом, можуть містити ДНК або РНК. Вони можуть бути одноланцюговими або дволанцюговими. Вони можуть також представляти собою полінуклеотиди, які містять одержані синтетичним шляхом або модифіковані нуклеотиди. У даній галузі відомо велика кількість різних типів модифікацій олігонуклеотидів. Вони включають використання метилфосфонатних і фосфортіоатних каркасів, введення акридинових або полілізинових ланцюгів на 3’- і/або 5’-кінці молекули. Слід розуміти, що для цілей даного винаходу вказані в даному описі полінуклеотиди можна модифікувати будь-яким відомим в даній галузі методом. Такі модифікації можна здійснювати для того, щоб підвищувати активність in vivo або тривалість життєвого циклу N0I. Як правило N0I містять гетерологічний ген. Поняття "гетерологічний ген" стосується будьякого гена. Гетерологічний ген може представляти собою будь-який алельний варіант гена дикого типу або може представляти собою мутантний ген. Поняття "ген" стосується нуклеотидних послідовностей, які мають принаймні здатність до транскрипції. Таким чином, вказане поняття включає послідовності, які кодують мРНК, тРНК і пРНК, а також антисмислові конструкції. Нуклеїнові кислоти можуть представляти собою, наприклад, рибонуклеїнову кислоту (РНК) або дезоксирибонуклеїнову кислоту (ДНК) або їх аналоги. Послідовності, які кодують мРНК, можуть необов'язково містити деякі або всі 5'- або 3'-транскрибовані, але не трансльовані фланкуючі послідовності, природним або іншим способом зв'язані з трансльованою кодувальною послідовністю. Вони можуть необов'язково додатково містити зв'язані з транскрипцією послідовності, як правило зв'язані з транскрибованими послідовностями, наприклад, сигнали термі 11 нації транскрипції, сайти поліаденілювання і розташовані по ходу транкрипції енхансерні елементи. Транскрибована послідовність гетерологічного гена переважно функціонально зв'язують з контролюючою послідовністю, що дозволяє здійснювати експресію гетерологічного гена в клітинах ссавців, переважно в нервових клітинах, таких як клітини центральної і периферичної нервової системи, ракові або епітеліальні клітини. Поняття "функціонально зв'язаний" стосується такого розташування розглянутих компонентів, яке дозволяє їм здійснювати свої функції необхідним чином. Контролюючу послідовність, функціонально зв'язану з кодувальною послідовністю вбудовують шляхом лігування таким чином, щоб експресія кодувальної послідовності відбувалася в умовах, які є прийнятними для контролюючої послідовності. Контролююча послідовність містить промотор, який забезпечує експресію гетерологічного гена, і сигнал термінації транскрипції. Промотор вибирають з числа промоторів, які можуть функціонувати в клітинах ссавців, переважно в клітинах людини. Промотор можна одержувати з промоторних послідовностей еукаріотичних генів. Наприклад, він може представляти собою промотор, одержаний з генома клітини, у якій може здійснюватися експресія гетерологічного гена, переважно клітини центральної або периферичної нервової системи ссавця. Промотори з еукаріотичних клітин можуть представляти собою промотори, які здійснюють свою функцію незалежно від типу тканини (такі як промотори -актину, тубуліну), або в альтернативному варіанті тканинноспецифічним чином (такі як промотори генів піруваткінази). Вони можуть представляти собою також промотори, які реагують на певні стимули, наприклад, промотори, які зв'язуються з рецепторами стероїдних гормонів. Можна використовувати також вірусні промотори, наприклад, промотор довгого кінцевого повтору (LTR) вірусу мишиного лейкозу Молоні (MMLV), або промотори генів вірусу герпесу. Може виявитися переважним використовувати також такі індуцибельні промотори, які дозволяють регулювати рівні експресії гетерологічного гена протягом життєвого циклу клітини. Індуцибельність означає, що можна регулювати контрольовані промотором рівні експресії.' Крім того, будь-який з цих промоторів можна модифікувати шляхом введення додаткових регуляторних послідовностей, наприклад, енхансерних послідовностей. Можна використовувати також химерні промотори, які містять елементи послідовностей із двох або більшої кількості різних вказаних вище промоторів. Крім того, може виявитися доцільним використовувати ділянки контролю локусу (LCR). Гетерологічний ген, як правило, кодує поліпептид, призначений для терапевтичних цілей. NOI послідовності за даним винаходом включають (але не обмежуючись ними) такі послідовності, які можна застосовувати для терапевтичних і/або діагностичних цілей: послідовності, які кодують цитокіни, хемокіни, гормони, антитіла, сконструйовані імуно 77393 12 глобулінподібні молекули, одноланцюгове антитіло, злиті протеїни, ферменти, молекули для імунної костимуляції, імуномодуляторні молекули, антисмислову РНК, трансдомінантний негативний мутант протеїну-мішені, токсин, умовний токсин, антиген, протеїн-супресор пухлини і фактори росту, мембранні протеїни, вазоактивні протеїни і пептиди, антивірусні протеїни і рибозими і їх похідні (такі, які містять зв'язану репортерну групу). Прикладами поліпептидів, які можна застосовувати для терапевтичних цілей, є нейротрофні фактори, такі як фактор росту нервової тканини (NGF), циліарний нейротрофічний фактор (CNTF), нейротрофічний фактор головного мозку (BNTF) і нейтрофіни (такі як NT-3, NT-4/5), які потенційно можна застосовувати як терапевтичні агенти для лікування неврологічних захворювань, таких як хвороба Паркінсона. N0I, що можна застосовувати відповідно до даного винаходу для лікування або профілактики раку, включають N0I, які кодують протеїни, які: руйнують клітину-мішень (наприклад, рибосомний токсин), діють як: супресори пухлини (такі як р53 дикого типу); активатори протипухлинних імунних механізмів (такі як цитокіни, молекули для імунної костимуляції і імуноглобуліни); інгібітори ангіогенезу; або протеїни, які підсилюють чутливість до лікарських засобів (такі як ферменти, які активують проліки); непрямо стимулюють руйнування клітини-мішені природними ефекторними клітинами (наприклад, сильний антиген, який стимулює імунну систему або перетворюючий субстанціюпопередник у токсичну субстанцію, яка руйнує клітину-мішень (наприклад, фермент, який активує проліки)). Кодовані протеїни можуть також руйнувати присутні пухлинні клітини (наприклад, за допомогою секретованого злитого протеїну, який має протипухлинну активність: антитіло-рибосомний токсин), стимулювати непрямим чином руйнування присутніх пухлинних клітин (наприклад, цитокінами, стимулюючи імунну систему, або прокоагулянтними протеїнами, викликаючи місцеву закупорку судин) або перетворювати субстанцію-попередник у токсичну субстанцію, яка руйнує присутні пухлинні клітини (наприклад, фермент, який активує проліки, перетворюючи їх в лікарський засіб, який має здатність до дифузії). Можна застосовувати N0I, які кодують антисмислові транскрипти або рибозими, які впливають на експресію клітинних або патогенних генів, наприклад, на експресію клітинних генів, які обумовлюють персистентність до пухлини (наприклад, у відношенні аберрантних myc-транскриптів при лімфомі Беркітта або у відношенні bcr-ablтранскриптів при хронічному мієлоїдному лейкозі). Можна застосовувати також комбінації таких N0I. Замість цього або разом з цим, N0I або декілька N0I, якщо вони вибірково експресуються в тканинах-мішенях, можна використовувати для кодування ферменту або ферментів, що активує(ють) проліки, які не робить вираженої дії або не робить шкідливої дії доти, поки індивідуума не обробляють одним або декількома проліками, на які впливають фермент або ферменти. У присутності активної N0I обробка індивідуума відповідними 13 проліками приводить до більш значного зниження росту пухлини або підвищує виживання. Для лікування раку фермент, який активує проліки, можна вводити в ділянку пухлини. У кожному випадку для лікування пацієнта застосовують необхідні проліки в сполученні з відповідним активувальним проліки ферментом. Відповідні проліки вводять у сполученні з вектором. Прикладами проліків є: етопозидфосфат (у сполученні з лужною фосфатазою); 5-флуорцитозин (у сполученні з цитозиндеаміназою); доксорубіцин-N-napaгідроксифеноксіацетамід (у сполученні з пеніцилінV-амідазою); napa-N-біс(2хлоретил)амінобензоїлглутамат (у сполученні з карбоксипептидазою G2); цефалоспоринові азотні гірчичні карбамати (у сполученні з -лактамазою); SR4233 (у сполученні з редуктазою Р450); ганцикловір (у сполученні з тимідинкіназою HSV); проліки на основі гірчиці, які містять нітроредуктазу і циклофосфамід (у сполученні з Р450). Прикладами ферментів, які активують проліки, які можна застосовувати відповідно до винаходу, є тимідинфосфорилаза, яка активує 5флуорурацилові проліки капсетабін і фуртулон; тимідинкіназа вірусу герпесу простого, яка активує ганцикловір; цитохром Р450, які активує такі проліки, як циклофосфамід, з утворенням агента, який пошкоджує ДНК; і цитозиндеаміназа, яка активує 5-флуорцитозин. Переважно використовують фермент, який виробляється в організмі людини. N0I можуть також кодувати корові поліпептиди, які застосовують як вакцини. Переважно такі антигенні поліпептиди одержують з патогенних організмів, наприклад, з бактерій або вірусів. Прикладами таких антигенних поліпептидів є антигени вірусу гепатиту С, поверхневі або ядерні антигени вірусу гепатиту В, антигени ВІЛ, токсин коклюшу, токсин холери або токсин дифтерії. N0I можуть включати також маркерні гени (наприклад, які кодують -галактозидазу або зелений флуоресцентний протеїн) або гени, продукти яких регулюють експресію інших генів (наприклад, фактори, які регулюють транскрипцію). У тому випадку, якщо захворювання викликається дефектним геном, наприклад, у випадку кістозного фіброзу, можна вводити N0I, які кодують повний функціонально активний алель гена. В даний час виявлена причина різних генетичних порушень на молекулярному рівні і клоновані функціональні послідовності дикого типу. Для заміни дефектного гена шляхом гомологічної рекомбінації може виявитися доцільним включати в N0I фланкуючі послідовності для генів, застосовуваних для терапевтичних цілей, які є гомологічними до відповідних фланкуючих послідовностей геному. Для здійснення генної терапії, а також для інших цілей, може бути потрібним введення декількох генів. При лікуванні різних станів може виявитися переважною експресія декількох генів. Оскільки немає обмежень на розмір N0I, яку можна вбудовувати в здійснюючий введення вектор або комплекс за винаходом, то може виявитися можливим здійснювати спрямоване перенесення у клітини одночасно декількох генів. В. Катіонні ліпіди 77393 14 У даній галузі відомо велика кількість катіонних ліпідів [9], деякі з яких наведені нижче. Приклади структур катіонних ліпідів, які можна застосовувати відповідно до даного винаходу, наведені в [9]. У цілому в композиціях і способах за винаходом можна застосовувати будь-які катіонні ліпіди, як одновалентні, так і полівалентні. Як правило, переважними є полівалентні катіонні ліпіди. Катіонні ліпіди містять насичену і ненасичену алкільну групу та аліциклічні прості і складні ефіри амінів, амідів або їх похідних. Алкільні або алкенові групи катіонних ліпідів, які мають прямий або розгалужений ланцюг, можуть містити від 1 до приблизно 25 атомів вуглецю. Переважними є алкільні або алкенові групи з прямим або розгалуженим ланцюгом, які містять шість або більше атомів вуглецю. Аліциклічні групи можуть містити приблизно 6-30 атомів вуглецю. Переважно аліциклічні групи містять холестерин або інші стероїдні групи. Катіонні ліпіди можна одержувати з використанням різних протиіонів (аніонів), які включають серед іншого: хлорид, бромід, йодид, фторид, ацетат, трифторацетат, сульфат, нітрит і нітрат. Широко відомим катіонним ліпідом є хлорид N[1-(2,3-діолеїлокси)пропіл]-Ν,Ν,Ν-триметиламонію (ДОТМА). ДОТМА та аналогічний складний діефір ДОТАП (1,2-біс(олеїлокси)-3-(триметиламоній)пропан) є в продажу. Інші катіонні ліпіди, які мають подібну до ДОТАП структуру, описані у [10], включеному в даний опис як посилання. Інші групи катіонних ліпідів, споріднені ДОТМА і ДОТАП, які можна застосовувати відповідно до винаходу, звичайно називають простими DORIефірами або складними DORI-ефірами. DORIліпіди відрізняються від ДОТМА і ДОТАП тим, що в них одна з метильних груп у групі триметиламонію заміщена гідроксіетильною групою. Олеїлові групи DORI-ліпідів можна заміщувати іншими алкільними або алкеновими групами, такими як пальмітоїольна або стеароїльна групи. Гідроксильну групу ліпідів DORI-типу можна використовувати як сайт для наступної функціоналізації, наприклад, для етерифікації з утворенням амінів, таких як карбоксиспермін. Інші катіонні ліпіди, які можна застосовувати в призначених для введення векторах або комплексах за даним винаходом, включають ліпіди, описані в [11] як вектори, придатні для трансфекції клітин. Згідно із даним винаходом можна застосовувати також катіонні стерольні похідні, наприклад, 3 -[N-(N',N'диметиламіноетан)карбамоїл]холестерин (DCChol), у якому холестерин зв'язаний із триалкіламонійною групою. Є дані про те, що DC-Chol забезпечує для тих самих ліній клітин більш ефективну трансфекцію і меншу токсичність, ніж ліпосоми, які містять ДОТМА. Можна також застосовувати поліамінові похідні DC-Choi, такі як описані в [12]. У призначених для введення векторах або комплексах за винаходом можна застосовувати також полікатіонні ліпіди, які містять карбоксиспермін. В [13] описаний карбоксиспермін, який міс 15 тить катіонні ліпіди, у тому числі 5карбоксиспермілгліциндіоктадециламід (ДОГС) і дипальмітоїлфосфатидилетаноламін-5карбоксисперміламід (ДПФЕС). Інші катіонні ліпіди можна одержувати шляхом заміщення октадецильних і пальмітоїльних груп ДОГС і ДПФЕС відповідно іншими алкільними або алкеновими групами. У призначених для введення векторах або комплексах за винаходом катіонні ліпіди необов'язково можна об'єднувати з некатіонними допоміжними ліпідами, переважно нейтральними ліпідами, з утворенням ліпосом або ліпідних агрегатів. Нейтральні ліпіди, які можна застосовувати відповідно до даного винаходу, включають серед іншого: лецитини; фосфатидилетаноламіни, такі як ДОФЕ (діолеїлфосфатидилетаноламін), ПОФЕ (пальмітоїлолеїлфосфатидилетаноламін) і ДСФЕ (дистеароїлфосфатидилетаноламін); фосфатидилхолін; фосфатидилхоліни, такі як ДОФХ (діолеїлфосфатидилхолін), ДПФХ (дипальмітоїлфосфатидилхолін), ПОФХ (пальмітоїлолеїлфосфатидилхолін) і ДСФХ (дистеароїл фосфатидилхолін); фосфатидилгліцерин; фосфатидилгліцерини, такі як ДОФГ (діолеїлфосфатидилгліцерин), ДПФГ (дипальмітоїлфосфатидилгліцерин) і ДСФГ (дистеароїлфосфатидилгліцерин); фосфатидилсерини, такі як діолеоїл- або дипальмітоїлфосфатидилсерин; дифосфатидилгліцерини; ефіри жирних кислот; складні ефіри гліцерину; сфінголіпиди; кардоліпин; цереброзиди і цераміди; та їх суміші. Нейтральні ліпіди включають також холестерин і інші 3DOHстероли. Крім того, у призначені для введення вектор або комплекси за винаходом необов'язково можна включати одну або декілька амфіфільних сполук для модифікації їх поверхневих властивостей. Амфіфільні сполуки, які можна застосовувати відповідно до даного винаходу, включають серед іншого неогліколіпиди, такі як GLU4 і GLU7, наведені на Фіг.22, поліетиленглікольні ліпіди, такі як N( -метокси(поліоксіетилен)оксикарбоніл)фосфатидилетаноламін, N-монометокси (поліоксіетилен)сукцинілфосфатидилетаноламін і простий ефір поліоксіетилену і холестерину; неіоногенні поверхнево-активні речовини, такі як алкілглікозиди, алкілметилглюкаміди, складні ефіри сахарози, прості алкілові ефіри полігліцерину, прості алкілові ефіри поліоксіетилену і прості алкілові ефіри сорбітану й оксіетилену і стероїдні прості ефіри оксіетилену; блок-співполімери, такі як блокспівполімери поліоксіетилену і поліоксипропілену. Відповідно до одного з варіантів здійснення катіонний ліпід за даним винаходом модифікують за допомогою фрагмента цукру або фрагмента поліетиленгліколю (ПЕГ). Ще одним об'єктом винаходу є комплекс за винаходом, який додатково містить сполуку, яка має здатність функціонувати як катіонний ліпід, причому сполука містить холестеринову групу, приєднану за допомогою аміногрупи, фрагмента цукру або поліетиленгліколевого фрагмента. Як це продемонстровано в прикладах, при створенні винаходу було встановлено, що найбільш переважно застосовувати катіонні ліпіди, модифіковані з використанням цукру/ПЕГ. Таким чином, ще одним об'єктом даного винаходу є спо 77393 16 лука, яка має здатність функціонувати як катіонний ліпід, де сполука містить холестеринову групу, приєднану за допомогою аміногрупи, фрагмента цукру або поліетиленгліколевого фрагмента. Переважна сполука містить 1-7 залишків цукру або залишків поліетиленгліколю. Сполука може містити суміш залишків цукру і залишків поліетиленгліколю. Переважно фрагмент цукру представляє собою глюкозу або D-глюкозу або є її похідним. Г. Комплекси катіонний ліпід/NOI/упаковувальний поліпептид Призначений для введення вектор/комплекс за даним винаходом, як правило, одержують, здійснюючи спочатку контакт упаковувального поліпептиду з N0I у стерильній пробірці протягом приблизно 10хв. при кімнатній температурі, у результаті чого утворюється конденсований комплекс поліпептид/NOI. Стандартний метод полягає в тому, що в пробірці наносять паралельно одна до одної плями нуклеїнової кислоти і протеїну, які не контактують одна з одною, і потім ініціюють змішування шляхом додавання декількох сотень мікролітрів рідкого носія, такого як фармацевтично прийнятний носій, ексципієнт або розріджувач. Ще одним переважним способом одержання призначеного для введення вектора/комплексу за даним винаходом є приведення упаковувального поліпептиду у контакт із N0I шляхом безперервного обертання. Як правило, використовують співвідношення N0I і поліпептиду, що складає принаймні 1:1, переважно від 1:1 до 2:1, більш переважно від 1,4:1 до 1,9:1, найбільш переважно від 1,5:1 до 1,8:1. При створенні винаходу було встановлено, що найбільш ефективно використовувати співвідношення N0I і поліпептиду, що складає приблизно 1:0,6 ( 1,7:1). У деяких варіантах здійснення винаходу звичайно використовується співвідношення поліпептиду до N0I від 0,2 до 1,5, переважно від 0,3 до 1,2 (мас./мас.), більш переважно від 0,2 до 0,7. В інших варіантах здійснення співвідношення поліпептиду і N0I звичайно складає принаймні 10:1 або принаймні 20:1 (мас./мас.). Однак оптимальне співвідношення може залежати від співвідношення заряд кількість амінокислоти в упаковувальному поліпептиді. Як правило чим нижче співвідношення заряд:кількість амінокислот, тим більш високе співвідношення поліпептид:N0I слід використовувати. Потім у комплекс додають катіонні ліпіди. Відповідно до одного з варіантів здійснення катіонні ліпіди можуть представляти собою частину заздалегідь сформованих ліпосом, що включає два або декілька ліпідних компонентів, таких як DC-Chol і ДОФЕ. Катіонні ліпіди звичайно інкубують з комплексом поліпептид/NOI протягом приблизно 20хв. при кімнатній температурі. Ще один і переважний метод додавання катіонних ліпідів представляє собою додавання у вигляді суспензії катіонних ліпосом. Такий кінцевий комплекс із додаванням 10% сахарози (мас./мас.) можна зберігати до застосування при температурі приблизно -80°С. Співвідношення кількості ліпосом і N0I звичайно складає приблизно від 3:1 до 20:1, переважно від 6:1 до 15:1, більш переважно від 8:1 до 14:1. 17 При створенні винаходу було встановлено, що найбільш переважне співвідношення кількості ліпосом і N0I складає 12:1. В інших варіантах здійснення співвідношення кількості ліпосом і N0I звичайно складає приблизно від 2:1 до 10:1 або від 3:1 до 6:1. Якщо катіонні ліпіди застосовують у сполученні з нейтральними ліпідами, то співвідношення як правило складає приблизно 1:1. У найбільш переважному варіанті співвідношення кількостей ліпосоми: N0I:поліпептид складає 3-20:1:0,5-1, переважно 8-14:1:0,5-0,7, більш переважно 12:1: 6. Після цього призначений для введення вектор/комплекс готовий до застосування. Хоча переважно змішувати різні компоненти в вказаному вище порядку, можна об'єднувати компоненти в довільному порядку. Якщо необхідно додавати інші поліпептидні компоненти, то їх можна додавати на будь-якій стадії, однак переважно додавати в сполученні з упаковувальним поліпептидом. Може виявитися доцільним включати до складу векторів/комплексів інші компоненти, наприклад, ліганди, які здійснюють зв'язування з рецепторами на поверхні клітин, для того, щоб надати векторам/комплексам певну ступінь вибірковості у відношенні типу клітин. Ліганди включають пептиди, глікопротеїни, олігосахариди, лектини й антитіла та їх фрагменти. Д. Введення Для одержання фармацевтичної композиції (яку можна застосовувати для людини або тварини) призначений для введення вектор/комплекс за винаходом переважно об'єднують з фармацевтично прийнятним носієм або розріджувачем. Придатні носії і розріджувачі включають ізотонічні соляні розчини, наприклад, забуферений фосфатом соляний розчин. Композицію за винаходом можна вводити безпосередньо шляхом ін'єкції. Композицію можна виготовляти у формі, придатній для парентерального, внутрішньом'язового, внутрішньовенного, підшкірного, інтраокулярного або трансдермального введення або введення шляхом інгаляції. Як правило, кожну N0I можна вводити в дозі, що складає від 10нг/(кг ваги тіла) до 10мкг/(кг ваги тіла), переважно від 0,1мкг/(кг ваги тіла) до 10мкг/(кг ваги тіла), більш переважно від 0,1мкг/(кг ваги тіла) до 1мкг/(кг ваги тіла). В альтернативному варіанті трансфекцію клітин пацієнта можна здійснювати ex vivo шляхом виділення тканини пацієнта, здійснення її трансфекції з використанням призначеного для введення вектора/комплексу за винаходом, і наступної повторної імплантації трансфектованої тканини. Описані шляхи введення і дози наведені лише як приклад, оскільки фахівець у даній галузі може легко визначати оптимальний шлях введення і дози для конкретного пацієнта і стану. Е. Застосування Призначені для введення вектори/комплекси за даним винаходом можна застосовувати для здійснення ефективної трансфекції N0I еукаріотичних клітин, зокрема клітин ссавців. Було встановлено, що призначені для введення вектори/комплекси більш ефективні в порівнянні з існуючими композиціями для трансфекції нервових 77393 18 клітин. їх можна застосовувати конкретно, поперше, для наукових досліджень, у яких використовуються нервові клітини, і, по-друге, у клінічній практиці, коли необхідно здійснювати введення N0I у клітини центральної або периферичної нервової системи людини або тварини. Більш конкретно призначені для введення вектори/комплекси за даним винаходом можуть знайти застосування в галузях, пов'язаних із введенням N0I, таких як генна терапія, введення ДНК-вакцини і дослідження, пов'язані з трансфекцією in vitro. Прикладами захворювань, які можна лікувати з використанням комплексів/векторів за винаходом, є захворювання периферичної або центральної нервової системи, такі як нейродегенеративні захворювання і порушення нервової тканини в результаті пошкодження/травми, у тому числі внаслідок "ударів". Нейродегенеративні захворювання включають, зокрема, прогресуючу м'язову атрофію, деякі вроджені захворювання, такі як сімейна вегетативна дисфункція і спінальна м'язова атрофія дітей раннього віку, а також нейродегенеративні захворювання, які розвиваються в похилому віці, такі як хвороби Паркінсона і Альцгеймера. Призначені для введення вектори/комплекси за винаходом можна використовувати також для введення в терапевтичних цілях генів пацієнту, що страждає від злоякісних захворювань. Прикладами злоякісних захворювань, які можна лікувати таким чином, є рак молочної залози, шийки матки, ободової кишки, прямої кишки, ендометрію, нирки, легені, яєчника, підшлункової залози, передміхурової залози, шкіри, шлунка, сечового міхура, ЦНС, стравоходу, голови або шиї, печінки, яєчок, тимусу або щитовидної залози. Об'єктом лікування можуть бути також злоякісні захворювання кров'яних клітин, клітин кісткового мозку, В-лімфоцитів, Т-лімфоцитів, попередників лімфоцитів або попередників мієлоїдних клітин. Пухлина може представляти собою тверду пухлину або нетверду пухлину, і вона може бути основною пухлиною або дисемінованою метастатичною (вторинною) пухлиною. Нетверді пухлини включають мієлому; лейкоз (гострий або хронічний, лімфозний або мієломний), такий як гострий мієлобластний, гострий промієлозний, гострий мієломоноцитарний, гострий моноцитарний лейкоз, еритролейкоз; і лімфоми, такі як лімфома Ходжкіна, не-ходжкінска лімфома і лімфома Беркітта. Тверді пухлини включають карциному, карциному ободової кишки, дрібноклітинну карциному легені, недрібноклітинну карциному легені, аденокарциному, меланому, базально-клітинну або плоскоклітинну карциному. мезотеліому, нейробластому, гліому, астроцитому, медуллобластому, ретинобластому, саркому, остеосаркому, рабдоміосаркому, фібросаркому, остеогенну саркому, гепатому і семіному. До інших захворювань, які представляють інтерес, належать захворювання, які викликаються мутаціями (вродженими або соматичними) нормальних клітинних генів, такі як кістозний фіброз, таласемії і т.п. Інші галузі застосування, що представляють інтерес, включають лікування пов'язаних з імунною 19 системою порушень, таких як відторгнення трансплантата органа та аутоімунні захворювання. Спектр аутоімунних захворювань охоплює як специфічні для органа захворювання (такі як тиреоїдит, інсуліт, розсіяний склероз, іридоцикліт, увеїт, орхіт, гепатит, хвороба Аддісона, важка псевдопаралітична міастенія), так і системні хвороби, такі як ревматоїдний артрит і інші ревматичні захворювання, або системний червоний вовчок. До інших порушень належать імунна гіперреактивність, наприклад, алергічні реакції, зокрема пов'язані з виробленням гістаміну, і астма. Нижче винахід більш докладно пояснений за допомогою прикладів, які наведені лише з метою ілюстрації і не служать для обмеження обсягу винаходу. Опис креслень На Фіг.1 наведене зображення пластини; На Фіг.2 наведений графік; На Фіг.3 наведене зображення пластини; На Фіг.4 наведений графік; На Фіг.5 наведений графік; На Фіг.6 наведений графік; На Фіг.7 наведений графік; На Фіг.8 наведений графік; На Фіг.9 наведені структури; На Фіг.10 наведений графік; На Фіг.11 наведений графік; На Фіг.12 наведений графік; На Фіг.13 наведений графік; На Фіг.14 наведений графік; На Фіг.15 наведений графік; На Фіг.16 наведене зображення пластини; На Фіг.17 наведений графік; На Фіг.18 наведений графік; На Фіг.19 наведена структура; На Фіг.20 наведена реакційна схема; На Фіг.21 наведена реакційна схема; На Фіг.22 наведена структура; На Фіг.23 представлений принцип включення міцел; На Фіг.24 наведений графік; На Фіг.25 наведений графік. Докладний опис креслень (фігури 1-6) Фіг.1 - Аденовірусний коровий протеїн Mu1 має більшу ефективність у відношенні зв'язування з плазмідною ДНК (пДНК), ніж коровий протеїн Vp1 вірусу поліоми. А) Присутність БСА (бичачий сироватковий альбумін) не впливало на електрофоретичну рухливість пДНК. pCMV (lмкг) інкубували з 0мкг (смуга 2), 5мкг (смуга 3), 10мкг (смуга 4), 15мкг (смуга 5), 20мкг (смуга 6), 25мкг (смуга 7) і 30мкг (смуга 8) БСА протягом 10хв. при кімнатній температурі в 1xHBS. Потім зразки аналізували в 1% агарозному гелі у відношенні зміни рухливості. Не було виявлено ніяких змін електрофоретичної рухливості при додаванні БСА. Б) На відміну від БСА пептид Mu1 сильно впливав на рухливість пДНК. Аналогічно до методу, описаному в розділі A, pCMV (lмкг) інкубували з 0,25мкг (смуга 2), 0,5мкг (смуга 3), 1мкг (смуга 4), 2мкг (смуга 5), 4мкг (смуга 6), 6мкг (смуга 7) і 0мкг (смуга 8) рекомбінантного пептиду. Хоча при співвідношенні кількості протеїну і пДНК, яке дорівнює 77393 20 0,25 (мас/мас.) (смуга 2), рухливість релаксованої форми pCMV не змінювалася (верхня смуга), спостерігалася невелике сповільнення рухливості суперспіральної пДНК (нижня смуга). Однак при співвідношеннях вказаних кількостей, які дорівнюють або перевищують 0,5 (мас/мас), міграція обох форм пДНК істотно сповільнюється. В) Протеїн Vp1 вірусу поліоми мав набагато меншу ефективність у відношенні зниження рухливості пДНК. pCMV (1мкг) інкубували з 2мкг (смуга 2), 4мкг (смуга 3), 6мкг (смуга 4), 8мкг (смуга 5), 16мкг (смуга 6), 32мкг (смуга 7) і 0мкг (смуга 8) Vp1. Лише при співвідношеннях протеїн:пДНК (мас/мас), які дорівнюють або перевищують 6, спостерігалося істотне уповільнення рухливості суперспіральної пДНК (смуга 6, нижня зона). Так само, доти, поки вказане співвідношення не досягало 32 (мас/мас), не спостерігалося впливу на міграцію релаксованої форми пДНК (смуга 7, верхня зона). Для всіх описаних гельелектрофоретичних дослідів смуга 1 відповідала ДНК-маркеру довжиною 1 т.п.н (фірма BRL). Фіг.2 - -Галактозидазна активність у клітинах лінії ND7, трансфектованих комплексами пДНКMu1-катіонна ліпосома Клітини лінії ND7 висівали з щільністю 5x104 клітин/лунку в 24-лункові культуральні планшети за 24год. до здійснення трансфекції. Безпосередньо перед трансфекцією клітини промивали безсироватковим середовищем. Комплекси одержували шляхом спільної інкубації pCMV і Mu1 і наступного додавання катіонної ліпоми DCChol/ДОФЕ. Для кожного варіанта 1мкг pCMV поєднували з 0,6, 6, 12 і 21мкг пептиду Mu1. Після цього кожну з вказаних комбінацій поєднували з 3, 4 і 6 мкг DC-Chol/ДОФЕ. Клітини лінії ND7 приводили в контакт із призначеними для трансфекції комплексами протягом 2год., після чого витримували при 37°С в атмосфері, яка містить 5% СО2, ще протягом 24год., після чого їх збирали й обробляли для аналізу -галактозидазної активності. Наведені дані представляють собою середні значення С.К.В., n=3. Фіг.3 - Mu1 збільшує опосередковувану катіонними ліпосомами ефективність трансфекції лінії нервових клітин ND7. Нейрони лінії ND7 висівали в 24-лункові культуральні планшети з щільністю 4x104 клітин/лунку і вирощували протягом 24год. Потім недиференційовані нейрони лінії ND7 трансфектували або лише pCMV (A), або pCMV , об'єднаної в комплекс із DC-Chol/ДОФЕ (1:З мас./мас.) (Б), або pCMV , об'єднаної в комплекс із Mu1 і DC-Chol/ДОФЕ (1:12:6) (В). Через 48год. клітини фіксували й обробляли для здійснення виявлення X-Ga1 гістохімічним методом. Як видно на панелі В, включення Mu1 у комплекс в оптимальному співвідношенні приводило до істотного збільшення кількості XGa1-позитивних клітин (пофарбовані в синій колір). Фіг.4 - Mu1 має більшу ефективність у відношенні посилення опосередковуваної катіонними ліпосомами трансфекції клітин лінії ND7, ніж Vp1. 21 ДНК плазміди pCMV об'єднували в комплекс із різними кількостями полікатіонного пептиду і потім змішували з катіонними ліпосомами в співвідношенні 1:3 (pCMV :ліпосоми, мас./мас). Після швидкого промивання безсироватковими середовищами клітини лінії ND7 приводили в контакт із комплексами ліпосома-полікатіон-ліпосома протягом 2год. і потім знову поміщали в безсироваткові середовища. Через 24год. клітини збирали й обробляли для виявлення -галактозидазної активності. Кожен варіант умов відтворювали в трьох повторах і кожен експеримент повторювали три рази. Дані представляють собою середні значення С.К.В. Фіг.5 - Mu1 підсилює опосередковувану DCChol/ДОФЕ трансфекцію клітин лінії COS-7 Клітини COS висівали з щільністю, яка забезпечує 60-80% конфлюентність, у 24-лункові культуральні планшети за 24год. до здійснення трансфекції. Безпосередньо перед трансфекцією клітини промивали безсироватковим середовищем. Шляхом інкубації pCMV разом з Mu1 і наступного додавання катіонної ліпосоми DCChol/ДОФЕ одержували комплекси, які дозволяють здійснювати трансфекцію клітин. Для кожного варіанта 1мкг pCMV об'єднували в комплекс із 12мкг пептиду Mu1, який, як було встановлено, є оптимальним для клітин лінії ND7. Після цього комплекси pCMV :Mu1 змішували з 3, 4 і 6мкг DCChol/ДОФЕ. Клітини COS приводили в контакт із призначеними для трансфекції комплексами протягом 2год., після чого витримували при 37°С в атмосфері, яка містить 5% СО2, ще протягом 24год., після чого їх збирали й обробляли для проведення аналізу -галактозидазної активності. Наведені дані представляють собою середні значення С.К.В., n=3. Фіг.6 - Ефективність трансфекції диференційованих клітин лінії ND7 за допомогою комплексів pCMV -Mu1-катіонна ліпосома Клітини лінії ND7 висівали в 24-лункові культуральні планшети з щільністю 4x104 клітин/лунку в нормальне середовище для росту (яке містить сироватку). Через 24год. середовище заміняли середовищем для диференціювання і клітини вирощували ще протягом 24год. Використовували три різні середовища для диференціювання: безсироваткове середовище (-сироватка), нормальне середовище для росту, доповнене 1мм цАМФ (середовище цАМФ) або середовище, яке містить знижену кількість сироватки (0,5%), доповнене 1мм цАМФ і 50нг/мл фактора росту нервової тканини (NGF). Потім клітини трансфектували pCMV , об'єднаною в комплекс або лише з DC-Chol/ДОФЕ, або з Mu1 і DC-Chol/ДОФЕ. Через 48год. клітини фіксували й обробляли для гістохімічного аналізу з метою виявлення X-Ga1 і оцінювали відсоток позитивних клітин. В усіх випадках присутність Mu1 приводило до збільшення кількості позитивних клітин. Представляє інтерес той факт, що кількість трансфектованих клітин як у присутності Mu1, так і без нього, виявлялося великим у тому випадку, якщо клітини вирощували в присутності цАМФ. 77393 22 Приклади Матеріали і методи Синтез пептидів Пептиди Vp1 і Mu1 синтезували за допомогою твердофазного синтезатора пептидів типу Shimadzu PSSM-8 з використанням 5-кратного надлишку L-амінокислот, які мають захисні групи Fmoc ((9-фтореніл)метоксикарбоніл) (фірма Novabiochem), і реагентів FastMoc (гексафторфосфат/гідроксибензотриазол 2-(1Нбензотриазол-1-iл)-1,1,3,3-тетраметилуронію (ГБТУ/ГОБТ) (фірма Advanced Chemical Europe) як агента для здійснення амідного сполучення. Після відщеплення від смоли і видалення захисних груп здійснювали знесолення шляхом гель-фільтрації з використанням колонки типу Р2 Biogel (2x28см, фірма Biorad), приєднаної до системи для рідинної експрес-хроматографії білків (FPLC) (фірма Amersham Pharmacia Biotech, Великобританія), з використанням як елюента 0,1% водного розчину ТФК (трифтоцтова кислота) при швидкості потоку 0,5-0,75мл/хв. Остаточне очищення за допомогою препаративної хроматографії із оберненою фазою здійснювали на колонці типу Vydac (С18, 5мкм, 2x25см, фірма Hichrom), приєднаної до системи для РХВР типу Gilson (фірма Anachem). Пептиди елюювали при швидкості потоку 5мл/хв. із використанням лінійного градієнта ацетонітрилу в 0,1% водному розчині ТФК і спостереження за процесом елюювання здійснювали при довжині хвилі 220230нм. Пептид Vp1 одержували з використанням суперкислотної лабільної смоли, попередньо завантаженої L-Pro-2-хлортритилом (фірма Novabiochem) (100мг, 1,05ммол/г, 0,1ммол). Для того, щоб включити всі амінокислотні залишки від шостого (Lys) до N-кінцевого залишку, використовували більш тривалі проміжки часу для здійснення реакції сполучення. Після автоматичного видалення N-кінцевої захисної групи Fmoc за допомогою піперидину (20 об. %) у диметилформаміді смолу виділяли, промивали диметилформамідом (10мл) і метанолом (15мл), після чого сушили у вакуумі. Неочищений пептид відщеплювали від смоли з використанням охолодженої на льоду ТФК (8мл), що містить фенол (7% мас./об.), етандитіол (2 об. %), тіоанізол (4 об. %) і воду (4 об. %) (позначена як суміш А), і потім осаджували за допомогою охолодженого на льоді метил-третбутилового ефіру (МТБЕ) (30мл). Потім утворені пелети знесолювали і неочищену пептидну суміш очищали за допомогою РХВР із оберненою фазою. Після елюювання фракцій, які містять цільовий пептид (елюювання здійснювали з використанням ацетонітрилу 68,5 об. %), об'єднували і ліофілізували, одержуючи пептид у вигляді порошку білого кольору. Загальний вихід: 32мг (15мкмол, 15%); МС (MALDI-TOF) C85H151N26O26S3: [M+H]+, розраховано 2049,5, виявлено 2050,2. Послідовність перевіряли шляхом аналізу складу амінокислот і аналізу послідовності. За даними аналізу з використанням РХВР гомогенність складала 95%. Пептид Mu1 одержували з використанням смоли Gly-Wang (фірма Novabiochem) (40мг, 0,67ммол/г, 0,03ммол). У цьому процесі викорис 23 товували звичайні проміжки часу для здійснення реакції сполучення. Після автоматичного видалення відповідно до описаного вище методу Nкінцевої захисної групи Fmoc смолу виділяли, промивали дихлорметаном (20мл) і метанолом (20мл), після чого смолу сушили у вакуумі. Неочищений пептид відщеплювали від смоли з використанням суміші А (8мл) і осаджували за допомогою МТБЕ (30мл), повністю дотримуючись описаного вище процесу. У завершення неочищену пептидну суміш знесолювали й очищали за допомогою РХВР із оберненою фазою. Після елюювання фракції, які містять цільовий пептид (елюювання здійснювали з використанням ацетонітрилу, 17,2%), об'єднували і ліофілізували, одержуючи пептид у вигляді порошку білого кольору. Загальний вихід: 65мг (26мкмол, 80%); МС (ES) C95H170N52O21S2: [М+Н]+, розраховано 2440,7, виявлено 2440,6. За даними аналізу з використанням РХВР гомогенність складала >95%. Аналіз зв'язування ДНК Очищені пептиди відновлювали в стерильній дистильованій Н2О до концентрації 3мг/мл. Пептид і пДНК об'єднували в комплекс у 20мкл забуференого HEPES фізіологічного розчину (137мМ NaCl, 5мМ КСl, 0,75мМ Na2HPO4, 19мМ HEPES, рН 7,4) протягом 20хв. при кімнатній температурі. Потім комплекси пептид:пДНК аналізували за допомогою електрофорезу на агарозному гелі (1%). Контрольні інкубації для оцінки звичайних макромолекулярних взаємодій пДНК здійснювали з використанням різних кількостей бичачого сироваткового альбуміну, який має достатню для застосування в галузі молекулярної біології чистоту (фірма Sigma). Клітинні культури ND7 представляє собою добре вивчену лінію клітин, одержану шляхом злиття клітин нейробластоми (N18Tg2) із сенсорними нейронами новонароджених щурів [14]. Лінію клітин підтримували в нормальному середовищі для росту (NGM) (середовище Лейбовіца L-15 (фірма BRL), доповнене 10% фетальної бичачої сироватки (фірма BRL), 4г/л глюкози, 4г/л бікарбонату натрію (фірма BRL), 100мод/мл пеніциліну/стрептоміцину (фірма BRL)) при 37°С в атмосфері, яка містить 5% СО2. Клітини висівали в 24-лункові планшети (фірма Costar) з такою щільністю, яка забезпечувала через 24год. 70% конфлюентність. Диференціювання клітин лінії ND7 здійснювали за допомогою трьох описаних раніше методів [14, 15]. Клітини лінії ND7 висівали в NGM з щільністю 4x104 клітин на лунку в 24-лункові культуральні планшети (фірма Nunc). Через 24год. середовище замінювали або a) NGM, доповнене 1мМ циклічним аденозин-3':5'монофосфатом (цапф, фірма Sigma), або б) безсироватковим середовищем для диференціювання (50% середовища Хама F12, 50% DMEM, 5мкг/мл трансферину, 250нг/мл інсуліну, 0,3мкМ селеніт натрію) або в) середовищем для фактора росту нервової тканини (NGF) з низьким вмістом (середовище L-15, доповнене 2мМ глутаміном, 4г/л глюкози, 4г/л бікарбонату натрію, 10од./мл пеніциліну, 10г/мл стрептоміцину, 0,5% ФТС, !мМ цАМФ, 50нг/мл NGF (фірма 77393 24 Alomone Labs)). Диференційовані клітини лінії ND7 перед здійсненням трансфекції вирощували у відповідному середовищі протягом 24год. при 37°С в атмосфері, яка містить 5% СО2. Клітини лінії COS-7 (одержані з нирки зеленої мавпи) вирощували в середовищі RPMI 1640 (фірма BRL), доповненому 10% фетальної бичачої сироватки (фірма BRL) і 100од./мл пеніциліну/стрептоміцину (фірма BRL). Плазмідні конструкції Усі трансфекції здійснювали з використанням репортерної плазміди pCMV (фірма Clontech, Пало Альта, штат Каліфорнія), яка містить повнорозмірну послідовність -галактозидази Е.coli, розташовану по ходу транскрипції відносно безпосереднього раннього промотора/енхансера людського цитомегаловірусу (фірма Clontech). Лінії плазмідної ДНК одержували за допомогою стандартного методу молекулярного клонування й очищали з використанням системи очищення плазмід, яка не містить ендотоксин, фірми Qiagen (фірма Qiagen, Доркінг, Великобританія). Ліпосоми Ліпосоми DC-Chol/ДОФЕ одержували відповідно до описаного вище методу [16, 17]. У цілому метод полягав у тому, що до продистильованого перед дослідом СН2СІ2 (5мл) додавали в атмосфері азоту 6мкмол DC-Chol і 4мл ДОФЕ (у вигляді розчину з концентрацією 10мг/мл у СН2С12). До суміші додавали 5мл 20мМ Hepes (ρΗ 7,8) і її опромінювали ультразвуком протягом 3хв. Органічні розчинники видаляли при зниженому тиску і утворену суспензію ліпосом опромінювали ультразвуком ще протягом 3хв. Ліпосомні препарати зберігали при 4°С. Протокол трансфекції Оскільки в перших експериментах було встановлено, що присутність фетальної бичачої сироватки інгібує трансфекцію клітин лінії ND7, то для усіх варіантів трансфекції використовували безсироваткове середовище для диференціювання. На дні стерильного контейнера типу Bijou (фірма Bibby Sterlin Ltd., Стаффордшир, Великобританія) розміщували різні кількості ДНК і ліпосом так, щоб вони не знаходилися в контакті одна з одною. ДНК і ліпосоми об'єднували шляхом додавання 400мкл безсироваткового середовища для диференціювання й обережного струшування. Суміш ДНК:ліпосоми інкубували при кімнатній температурі протягом 20-30хв. перед її додаванням до клітин. Потім суміш ДНК:ліпосоми додавали до клітин і інкубували при 37°С в атмосфері, яка містить 5% СО2, протягом 2год., після чого це середовище замінювали свіжим повним середовищем. Після закінчення 24-48год. клітини фіксували й обробляли для гістохімічного аналізу з використанням Xga1 відповідно до методу, описаному в [17], або їх збирали для аналізу -галактозидазної активності (фірма Promega Corp.). Підрахунок клітин здійснювали при 40кратному збільшенні з використанням інвертованого мікроскопа типу Nikon Diapot. Кожен варіант трансфекції повторювали принаймні тричі і для кожної лунки виконували принаймні три незалежних підрахунки. 25 77393 Комплекси для трансфекції, які містять тестовані поліпептиди, створювали в такий спосіб. На дні стерильних полістиролових контейнерів розташовували різні кількості пептиду таким чином, щоб вони знаходилися поруч, але не контактували з 1мкг pCMV , після чого здійснювали змішування шляхом додавання 400мкл безсироваткового середовища NGM. Комплекси інкубували при кімнатній температурі протягом 10хв., після чого додавали DC-Chol/ДОФЕ. Комплекс пДНК/пептид/ліпосома додатково інкубували при кімнатній температурі протягом 20хв. і потім додавали до клітин як описано вище. Приклад 1. Аналіз зв'язування ДНК 26 Mu1 представляє собою полікатіонний пептид, який містить 19 амінокислот, зв'язаних з коровим комплексом аденовірусу (Таблиця 2) [3, 18]. При створенні винаходу було проведене порівняння ДНК-зв'язувальної активності Mu1 і основного капсидного протеїну Vp1 вірусу поліоми миші, яке здійснювали з використанням взаємодії з плазмідною ДНК за допомогою аналізу сповільнення рухливості в гелі. Vp1 представляє собою пептид, який складається з 19 амінокислот, що містить сигнал ядерної локалізації [2] і містить менше амінокислот, які мають позитивний заряд, у порівнянні з амінокислотами Mu1. Тому передбачалося, що він має меншу ДНК-зв'язувальну активність. Таблиця 2 Послідовності протеїнів Mu1 і Vp1 Поліпептид Mu1 Vp1 Послідовність Співвідношення заMM ряд/кількість амінокислот NH2-Met-Arg-Arg-Ala-His-His-Arg-Arg-Arg-Ala-Ser-His-Arg-Arg-Met2440 Arg-Gly-Gly-OH NH7-Met-Ala-Pro-Lys-Arg-Lys-Ser-Glv-Val-Ser-Lvs-Cvs-Glu-Thr-Lys2049 Cys-Thr-Pro-Pro-OH 0,63 0,26 Примітка: - Послідовність NLS у Vp1 підкреслена Різні кількості очищеного пептиду інкубували при кімнатній температурі в HBS протягом приблизно 10хв. і потім піддавали аналізу за допомогою гель-електрофорезу на агарозі. При відсутності пептиду рухливості суперспіральної і релаксованої кільцевих плазмідних ДНК (пДНК) виявилися очікуваними (смуга 8 на Фіг.1). Починаючи зі співвідношення ДНК:поліпептид Mu1, яке дорівнює 1:0,25 (мас./мас.) міграція плазмідної ДНК сповільнювалася (Фіг.1). При співвідношеннях 1:0,25 (мас./мас.) вплив на рухливість була слабкою, однак при співвідношенні, яке дорівнює 1:0,5 (мас./мас), рухливість плазмідної ДНК істотно сповільнювалася і лише дуже невелика кількість була здатна мігрувати з лунок. При співвідношеннях 2:1 і вище пДНК не мала здатність мігрувати в агарозний гель і здатність броміду етидію проникати в плазміду знижувалася. На відміну від Mu1 для Vp1 не були виявлено впливу на електрофоретичну рухливість плазмідної ДНК при співвідношеннях пДНК:протеїн аж до 1,8 мас. % (Фіг.1). Додавання 8мкг Vp1 до 1мкг плазмідної ДНК приводило до розширення зони, що відповідає суперспіральній пДНК. Однак для смуги, яка відповідає релаксованій пДНК, вплив Vp1 не виявлялося аж до співвідношення пДНК:протеїн, яке дорівнює 1:32 (мас./мас). При такому співвідношенні спостерігалося істотне сповільнення смуг, які відповідають як суперспіральній, так і релаксованій пДНК, і було встановлено, що деяка кількість ДНК залишалася в лунці. При інкубації пДНК із БСА не були виявлені впливу на електрофоретичну рухливість при співвідношеннях пДНК:протеїн аж до 1:30 (мас./мас.) (Фіг.1). Приклад 2. Трансфекція недиференційованих клітин лінії ND7 При створенні винаходу за допомогою аналізу, заснованого на використанні репортерного гена галактозидази, були проведені дослідження здатності Mu1 і Vp1 підсилювати трансфекцію лінії нервових клітин катіонними ліпосомами. Клітини лінії ND7 трансфектували pCMV , об'єднаної в комплекс із різними кількостями пептиду і DCChol/ДОФЕ. Раніше було встановлено, що катіонна ліпосома DC-Chol/ДОФЕ має здатність здійснювати ефективну трансфекцію клітин лінії ND7, які походять з нервових клітин [17]. При створенні винаходу в цьому дослідженні було встановлено, що оптимальна ефективність (>40%) для цієї лінії клітин, які походять з нервових клітин, досягається при використанні 1мкг плазмідної ДНК, об'єднаної в комплекс із 3мкг DC-Chol/ДОФЕ [17]. При вивченні часової залежності було встановлено, що максимальні рівні експресії трансгена досягалися через 48-60год. після трансфекції. Таким чином, для того, щоб збільшити до максимуму імовірність виявлення посилення трансфекції, у всіх дослідженнях, проведених при створенні винаходу, аналізи проводили через 12-20год. після здійснення трансфекції, тобто в той час, коли рівні експресії репортерного гена були зниженими. Раніше було встановлено, що для трансфекції клітин лінії ND7 оптимальне співвідношення пДНК:ліпосома, складає 1:3 (мас./мас). Тому порівняння впливу різних кількостей пептиду на трансфекцію проводили при співвідношеннях пДНК: DC-Chol/ДОФЕ, які складають 1:3, 1:4 і 1:6. Результати аналізу уповільнення рухливості в гелі дозволили припустити, що для того, щоб відбувалося зв'язування всієї плазмідної ДНК, досить, щоб співвідношення пДНК:Мu1 складало приблизно 1:0,5 (мас./мас.) (Фіг.1). Однак, у перших експериментах з викорис 27 танням цього співвідношення і ліпосом не було виявлено впливу на ефективність трансфекції (дані не наведені). Причина полягала в тому, що об'єми, які використовувалися для одержання комплексів для трансфекції, були набагато більше за ті, які використовуються при здійсненні аналізу уповільнення рухливості в гелі (400мкл у порівнянні з 20мкл). Тому були проведені дослідження з використанням великих кількостей Mu1, що дозволяли одержувати концентрацію в розчині, аналогічну до тієї, яка використовувалася в аналізі уповільнення рухливості в гелі. Була зроблена порівняльна оцінка впливу присутності 0,6, 6, 12 і 21мкг пептиду Mu1 на опосередковувану DCChol/ДОФЕ трансфекцію. Було встановлено, що Mu1 мав здатність підсилювати ефективність опосередковуваної катіонною ліпосомою трансфекції більше ніж у 4 рази. Найбільше посилення трансфекціїспостерігалося при використанні відносного співвідношення pCMV :Mu1:(DC-Chol/ДОФЕ) (мас./мас./мас.), що складає 1:12:6. Така комбінація приводила до посилення трансфекції в 11 разів у порівнянні з трансфекцією при використанні лише ДНК (Фіг.2). Аналіз на основі застосування репортерного гена -галактозидази дозволяв оцінювати загальний рівень продукованої -галактозидази, однак він не давав інформації про кількість трансфектованих клітин. Внаслідок цього при створенні винаходу також проводили досліди, які дозволяють здійснювати підрахунок кількості трансфектованих клітин лінії ND7. Клітини висівали з щільністю 4x104 у 24-лункові планшети для культур клітин. Через 24год. клітини швидко промивали безсироватковим середовищем і трансфектували pCMV , об'єднаної в комплекс із DC-Chol/ДОФЕ і пептидом Mu1. При цьому використовували співвідношення pCMV :Мu1:(DC-Chol/ДОФЕ), яке було виявлено як оптимальне в аналізі з використанням репортерного гена, а саме 1:12:6. При використанні такого співвідношення було виявлено 6-кратне збільшення кількості позитивних у відношенні галактозидази клітин (Фіг.3, 6). Не було виявлено помітного зменшення кількості клітин при використанні комплексу з Mu1 у всіх досліджених концентраціях. Аналогічно до цього, концентрація протеїну в клітинних лізатах, застосовуваних в аналізі з використанням репортерного гена галактозидази, не змінювалися істотно в порівнянні з нетрансфектованими клітинами (дані не наведені). На відміну від цього при використанні Vp1 не було виявлено ніякого посилення ефективності трансфекції (Фіг.4). Не було виявлено ніякого посилення ефективності трансфекції при використанні pCMV у комплексі лише з одним Mu1 у порівнянні з використанням "оголеної" ДНК. Для того, щоб встановити, чи можна досягти посилення трансфекції в інших типах клітин, були проведені аналогічні аналізи з використанням клітин лінії COS-7. Присутність Mu1 також підсилювало опосередковувану ліпосомою трансфекцію клітин лінії COS-7 (Фіг.5). Було встановлено, що співвідношення пДНК:Мг1:ліпосома, яке є оптимальним для клітин лінії ND7, також є оптимальним і 77393 28 для клітин лінії COS-7. Був виявлений аналогічний ступіньпосилення трансфекції (у 3,7 рази) у порівнянні з трансфекцією, здійснюваною при використанні лише катіонної ліпосоми. Приклад 3. Трансфекція диференційованих клітин лінії ND7 При створенні винаходу були проведені також дослідження здатності Mu1 підсилювати опосередковувану катіонною ліпосомою трансфекцію диференційованих клітин лінії ND7. Клітини лінії ND7 одержували шляхом злиття первинних нейронів спинномозкового вузла (DRG) щурів і клітин мишиної нейробластоми лінії N18Tg2 [14]. Клітини лінії ND7 можна піддавати диференціюванню різними методами, наприклад, шляхом видалення сироватки, введення цАМФ або піддаючи їх впливу середовища зі зниженим вмістом сироватки з додаванням цАМФ і фактора росту нервової тканини. Диференціювання клітин лінії ND7 приводить до появи властивостей клітин, пов'язаних з їх батьківськими ноцицептивними сенсорними нейронами, що включають зменшення поділу клітин і початок росту аксонів нервової клітини. Клітини лінії ND7 висівали в 24-лункові культуральні планшети і через 24год. ініціювали диференціювання. Через 1520год. після початку диференціювання їх піддавали трансфекції відповідно до описаного вище методу. Через 15-20год. після здійснення трансфекції клітини фіксували й обробляли для гістохімічного аналізу з використанням X-gal. Відповідно до одержаних раніше даних ефективність трансфекції в значній мірі змінювалась між трьома групами диференційованих клітин. Для клітин лінії ND7, які диференціювалися в результаті видалення сироватки, були виявлені найбільш низькі рівні трансфекції (1,3%), у той час як для групи, яка була піддана впливу цАМФ, спостерігалися максимальні рівні (8%), для групи, обробленої середовищем з низьким вмістом сироватки/цАМФ/NGF були виявлені проміжні рівні (4,7%) (Фіг.5). Однак у всіх трьох випадках введення поліпептиду Mu1 у комплекс для трансфекції приводило до посилення трансдукції диференційованих клітин лінії ND7. Ефективність трансфекції клітин лінії ND7, диференційованих під дією або лише цАМФ, або під дією середовища з низьким вмістом сироватки/цАМФ/NGF, підвищувалася більше ніж у 6 разів (Фіг.5). Однак, найбільше посилення ефективності трансфекції спостерігалося для групи, яка піддавалася диференціюванню в результаті видалення сироватки. У даному випадку спостерігалося посилення більш ніж у 10 раз. Комплекси, які містять пептид Mu1 і ДНК Як продемонстровано в прикладі 1 за допомогою гель-електрофорезу (аналіз зв'язування ДНК), при співвідношенні Mu1:ДНК, яке перевищує 0,5:1,0 (мас./мас.) рухливість плазмідної ДНК істотно сповільнювалася і лише невелика кількість ДНК мігрувала з лунки. Це свідчить про те, що пептид Mu1 сильно взаємодіє з ДНК і може привести до нейтралізації і конденсації нуклеїнових кислот з утворенням невеликих частинок, які можна застосовувати для введення генів. Була проведена оцінка розмірів частинок Мu1:ДНК (МД) у діапазоні співвідношень Mu1:ДНК, вказаних на Фіг.7. 29 Частинки МД одержували шляхом змішування. У цілому метод полягав у тому, що відповідні аліквоти пептиду Mu1 у деіонізованій воді додавали до плазмідної ДНК (pCMV ) (у кінцевій концентрації 220мкг/мл) у 20мМ буфері Hepes, pH 7,0. Після ретельного перемішування кожну суміш інкубували протягом 10хв. при 20°С. Відразу після інкубації кожну суміш розбавляли буфером Hepes (кінцева концентрація ДНК 24мкг/мл) і проводили аналіз розмірів частинок методом фотонно-кореляційної спектроскопії (аналізатор типу N4 plus, фірма Coultier). Усі вимірювання проводили при 20°С, дані одержували при куті, що дорівнює 90°. Для обчислення середнього розміру частинок і стандартного відхилення (С.В.) застосовували унімодальний аналіз. Становить інтерес той факт, що, хоча Mu1 мав здатність зв'язувати ДНК і утворювати комплекси у всьому дослідженому діапазоні, розмір частинок істотно змінювався залежно від співвідношення Мu1:ДНК. Стабільні малі частинки розміром порядку нанометра утворювалися в діапазоні співвідношень Mu1:ДНК від 0,3 до 1,2 (діапазон L) і величинах цього співвідношення, що перевищують 5 (діапазон Н). При проміжних величинах цього співвідношення відбувалася виражена агрегація, при цьому розмір частинок комплексу зростав протягом періоду інкубації, досягаючи більше ніж 2мкм (Фіг.7). Приклад 4. Одержання LMD у діапазоні L При створенні винаходу було проведене дослідження того, чи можуть комплекси ліпосомаМu1-ДНК, що характеризуються низьким співвідношенням MD:ДНК, утворювати стабільні частинки з розміром порядку нанометра і чи можуть утворюючі комплекс частинки мати високу ефективність у відношенні трансфекції. Одержання ліпосом: DC-Chol (30мкмоль) і ДОФЕ (20мкмоль) об'єднували в дихлорметані. Органічний розчинник видаляли при зниженому тиску за допомогою роторного випарника і залишок сушили в вакуумі протягом 3год. Після цього до ліпідної плівки при змішуванні шляхом обертання додавали 4мм буфер Hepes, рН 7,0 (3мл). Після короткочасного опромінення ультразвуком (2-3хв.) утворену суспензію катіонних ліпосом тричі екструдували за допомогою екструдера (фірма Lipex Biomembranes) через два накладених один на одного полікарбонатних фільтри (типу Millipore 0,2мкм), а потім десять разів через два накладених один на одного полікарбонатних фільтри (типу Millipore 0,1мкм), у результаті чого утворювалися ліпосоми малого розміру (середній діаметр 109нм за даними PCS) (приблизно 8-10мг/мл, що визначалося розкидом при використанні даного методу одержання). Одержання комплексів ліпосома:Мu1:ДНК (LMD): Пептид Mu1 (0,12мг у деіонізованій воді, концентрація пептиду 3,5мг/мл) додавали при безперервному перемішуванні до розчину плазмідної ДНК (pCF1-CAT) (0,2мг, типова концентрація плазміди 1,0мг/мл) у 4мМ буфері Hepes. Потім вносили суспензію катіонних ліпосом (загальний вміст ліпідів 2,4мг, 4мкмоль), у результаті чого відбувалося утворення частинок малого розміру, які хара 77393 30 ктеризуються вузьким діапазоном розподілу (168±58нм) за даними аналізу за допомогою PCS. Одержаний комплекс LMD (кінцева концентрація ДНК 0,14мг/мл) з додаванням 10% сахарози (%мас./об.) зберігали до застосування при -80°С. Протягом місяця не були виявлені зміни розмірів частинок. Комплекси ліпосома:ДНК (LD) (ліпокомплекси) для контрольних експериментів одержували з використанням співвідношення ліпосома:ДНК, що складає 3:1 (мас./мас.), характерного для оптимальної композиції для трансфекції клітин лінії ND7. Трансфекція клітин лінії ND7: Клітини лінії ND7 висівали в нормальне середовище для росту (NGM) (що містить 10% сироватки) із щільністю приблизно 4х104 клітин на лунку в 24-лункові культуральні планшети. Через 24год. клітини швидко промивали середовищем NGM (безсироватковим) і потім обробляли протягом вказаних проміжків часу розчинами, які містили комплекси LMD або LD, попередньо розведеними NMG (безсироватковим) (у всіх випадках кінцева концентрація ДНК складала 3,2мкг/мл). Потім клітини знову промивали і інкубували протягом ще 48год, після чого їх збирали. Рівні трансфекції оцінювали за допомогою ферментного аналізу на основі хлорамфеніколтрансферази (CAT) з використанням як субстрату 14 С-САМ (фірма Promega). Активність трансфекції виражали у вигляді відсотка (%) перетворення ферментом внесеного І4С-САМ. При використанні опосередковуваної LMD трансфекції була виявлена значно більша експресія репортерного гена, ніж при опосередковуваній LD трансфекції. Так, опосередковувана LMD трансфекція викликала через 10 хв після здійснення трансфекції в 16 разів більш високу ферментативну активність CAT, а через 60хв. після здійснення трансфекції - у 6 разів більш високу активність у порівнянні з опосередковуваною LD трансфекцією (Фіг.8). При використанні LMD значні рівні трансфекції були виявлені навіть у тому випадку, якщо тривалість трансфекції була менше 10хв. Ці дані служать ілюстрацією того, наскільки швидко LMDчастинки здатні проникати в клітини. Приклад 5. Варіанти катіонного ліпіду (цитофектину) При створенні винаходу було проведене вивчення можливості поліпшення характеристик комплексів LMD шляхом вбудовування полікатіонних холістеринових ліпідів [18]. Замість DC-Chol для одержання катіонних ліпосом використовували CDAN (D198), ACHx (CJE52) і СТАР (В232) (Фіг.9). Кожна система катіонних ліпосом містила 60 мол. % катіонного ліпіду і 40 мол. % ДОФЕ, і їх одержували відповідно до методу, описаному в прикладі 4. Одержували і порівнювали наступні різні системи комплексу на основі LMD: LMD (DCChol), LMD (В198), LMD (CJE52) і LMD (B232). Усі системи LMD одержували відповідно до описаного вище методу з використанням катіонних ліпосом (загальний вміст ліпідів 20мкмоль) і 0,6мг пептиду Mu1 на 1,0мг ДНК (рСМV ). Було встановлено, що частинки мають діаметр менше 200нм. Для контрольних експериментів одержували суміші комплексів ліпосома:ДНК (LD) (ліпоплекси) 31 зі співвідношенням ліпосома:ДНК, що складає 3:1 (мас./мас.), яке є оптимальним для композиції для трансфекції клітин лінії ND7. Трансфекція клітин лінії ND7: Клітки лінії ND7 висівали в середовище NGM (що містить 10% сироватки) із щільністю приблизно 4x104 клітин на лунку в 24-лунковий культуральний планшет. Через 24год. клітини швидко промивали NGM (безсироватковим) і потім протягом 1год. обробляли розчинами, які містять комплекси LMD або LD, попередньо розведеними NMG (безсироватковим) (у всіх випадках кінцева концентрація ДНК складала 2,5мкг/мл). Потім клітини знову промивали і інкубували ще протягом 48год. для обробки з метою фарбування за допомогою X-gal для гістохімічного аналізу. Кількість клітин, пофарбованих у блакитний колір, підраховували за допомогою інвертованого мікроскопа. В усіх випадках композиції, які містять LMD, мали більшу ефективність, ніж відповідні LDсистеми, одержані з використанням тих же самих полікатіонних холестеринових ліпідів (Фіг.10). Рівні ефективності трансфекції розташовувалися в такий спосіб: LMD (B198)>LMD (DC-Chol)>LMD (CJE52)>LMD (B232). Таке ж розташування, а саме B198>DC-Chol>B232, спостерігалося при використанні відповідних систем на основі LD. Приклад 6. Кількість пептиду Mu1 у діапазоні L При створенні винаходу проводилося дослідження впливу співвідношення Mu1:ДНК (у діапазоні L, вказаному на Фіг.7) на ефективність трансфекції. Катіонні ліпосоми, які містять катіонний ліпід В198 і ДОФЕ (3:2 мас./мас.), одержували тим же методом, що описаний у прикладі 4. Готували серії сумішей MD-комплексу (співвідношення Мu1:ДНК змінювалося від 0,3 до 1,2) і їх об'єднували в комплекс із катіонними ліпосомами. Одержані LMDсистеми характеризувалися співвідношеннями ліпосома:Мu1:ДНК(рСМV ), що складали 12:0,3:1, 12:0,6:0,6, 12:0,9:1 і 12:1,2:1 мас./мас./мас. відповідно. Виміряні розміри LMD-частинок складали приблизно 150нм. Ефективність трансфекції оцінювали в дослідах in vitro з використанням клітин лінії Раnс-1 (лінія клітин раку підшлункової залози людини). Клітини висівали з щільністю приблизно 5x104 клітин на лунку в 24-лунковий культуральний планшет у середовище RPMI, доповнене 10% ФТС, і вирощували протягом 24год. в атмосфері, яка містить 5% СО2, при 37°С. Клітини швидко промивали середовищем RPMI і потім протягом 30хв. обробляли розчинами LMD-комплексів, попередньо розведених RPMI (у всіх випадках кінцева концентрація ДНК складала 5,0мкг/мл). Після цього клітини знову промивали і інкубували ще протягом 48год. у середовищі RPMI, доповненим 10% ФТС, після чого їх збирали і піддавали аналізу у відношенні галактозидазної активності з використанням стандартного набору для аналізу (фірма Promega). Як показано на Фіг.11, оптимальне для трансфекції клітин лінії Раnс-1 співвідношення ліпосома:Мu1:ДНК складало 12:0,6:0,6. В інших варіантах з використанням цих LMD-комплексів з 77393 32 низьким вмістом Mu1 також були одержані дуже високі значення ефективності трансфекції. Приклад 7. Кількість і склад ліпідів Для того, щоб досліджувати, як впливає зміна співвідношення кількостей катіонних ліпідів і ДОФЕ, а також співвідношення кількостей усіх ліпідів до Mu1 і ДНК, одержували серії LMD-систем з використанням В198 як переважного катіонного ліпіду. Одержували катіонні ліпосоми, які містять 60 мол. % В198 і 40 мол. % ДОФЕ (3:2 моль/моль), 50 мол. % В198 і 50 мол. % ДОФЕ (1:1 моль/моль) і 33 мол. % В198 і 67 мол. % ДОФЕ (1:2 моль/моль), і об'єднували їх відповідно до методу, описаному в прикладі 4, зі стандартною сумішшю MDкомплексу (Мu1:ДНК як 0,6:1 мас./мас.) у співвідношеннях, вказаних на Фіг.12. Для контрольних експериментів одержували суміші (ліпоплекси), які містять комплекс ліпосома:ДНК (LD) зі співвідношенням ліпосома:ДНК, що складає 3:1 (мас./мас.). Було встановлено, що всі LMD-системи мали більший середній розмір у тому випадку, коли до складу MD-комплексів вводили менші кількості катіонних ліпосом. Однак розмір LMD-частинок, що містять понад 12мкмоль ліпідів на 1мг ДНК, залишався менше 200мкм, у той час як розмір частинок, що містять від 12 до 6 мкмоль ліпідів на 1мг ДНК, перевищував це значення. У процесі одержання LMD-систем, що містять 6 мкмоль ліпідів на 1мг ДНК, іноді спостерігалася агрегація. З використанням клітин лінії Раnс-1 оцінювали ефективність трансфекції (Фіг.12). Клітини висівали з щільністю приблизно 5х104 клітин на лунку в 24-лунковий планшет у середовище DMEM, доповнене 10% ФТС, і вирощували протягом 24год. в атмосфері, яка містить 5% СО2, при 37°С. Клітини промивали протягом невеликого періоду часу середовищем DMEM і потім обробляли протягом 2год. розчинами, що містять LMD- або LDкомплекси, попередньо розведені DMEM (у всіх випадках кінцева концентрація ДНК складала 5,0мкг/мл). Потім клітини знову промивали і інкубували ще протягом 48год. у середовищі DMEM, доповненим 10% ФТС, після чого збирали і піддавали аналізу у відношенні -галактозидазної активності з використанням стандартного набору для аналізу (фірма Promega). Максимальна ефективність трансфекції не істотно відрізнялася від тієї, яка спостерігалася для трьох досліджених композицій з різними співвідношеннями катіонний ліпід:ДОФЕ. У випадку LMDсистем, одержаних з використанням В198:ДОФЕ (1:2 моль/моль) максимальний рівень трансфекції спостерігали при співвідношенні ліпосома:ДНК, що складає приблизно 12,5мкмоль ліпіду на 1мг ДНК. Ефективності трансфекції для LMD-систем, одержаних з використанням катіонних ліпосом, що мають співвідношення В198:ДОФЕ як 3:2ммоль/ммоль і В198:ДОФЕ як 2:2ммоль/ммоль, виходили на постійний рівень при співвідношеннях ліпосома:ДНК, що перевищують 12,5мкмоль ліпіду на 1мг ДНК. Для всіх проаналізованих LMD-систем виявлена тенденція до меншої ефективності трансфекції при низьких співвідношеннях ліпосома:ДНК (Фіг.12). Це свідчить про те, що для LMD 33 композицій, які містять невеликі кількості пептиду Mu1, повинні вимагатися великі кількості катіонних ліпосом у порівнянні з композиціями, одержаними з використанням великих кількостей пептиду Mu1, для того, щоб відповідні LMD-системи виявляли свою максимальну активність у відношенні трансфекції. Приклад 8. Порівняння пептиду Mu1 і протаміну Протамін представляє собою катіонний пептид, який зустрічається в природних умовах, що є присутнім у великій кількості в спермі риб, який має сильну здатність нейтралізувати і конденсувати ДНК. Проводили порівняння активності протаміну у відношенні трансфекції і пептиду Mu1. Пептид Mu1 або сульфат протаміну (фірма Sigma, ступінь чистоти X, одержаний з лосося) об'єднували в комплекс із ДНК (pCMV ) і потім з катіонними ліпосомами (В198:ДОФЕ в співвідношенні 3:2), одержуючи співвідношення ліпосома:пептид:ДНК 12:0,6:1 (мас./мас./мас.). Активність у відношенні трансфекції досліджували з використанням клітин лінії Swiss 2T3. Клітини висівали з щільністю приблизно 2x104 клітин на лунку в 24-лункові культуральні планшети в середовище DMEM, доповнене 10% ФТС, і вирощували протягом 48год. до конфлюентності в атмосфері, яка містить 5% СО2, при 37°С. Клітини швидко промивали середовищем DMEM і потім обробляли протягом 1 або 2год. розчинами, які містять LMDабо LD-комплекси, попередньо розведеними DMEM (у всіх випадках кінцева концентрація ДНК складала 5,0мкг/мл). Після цього клітини знову промивали і інкубували ще протягом 48год. у середовищі DMEM, доповненим 10% ФТС, після чого збирали. Рівень -галактозидазної активності визначали за допомогою стандартного набору для аналізу (фірма Promega). Як показано на Фіг.13, комплекси, які містять Mu1, мали більшу ефективність у відношенні трансфекції таких конфлюентних клітин, ніж комплекси, які містять протамін. Приклад 9. Інші катіонні пептиди Для дослідження впливу різних інших катіонних пептидів на ефективність трансфекції одержували серії комплексів ліпосома:катіонний пептид:ДНК і досліджували in vitro їх відносні здатності здійснювати трансфекцію. Як пептиди використовували гідрохлорид полілізину (середня молекулярна маса 3970, фірма Sigma), гідрохлорид поліаргініну (середня молекулярна маса 1180, фірма Sigma), пептид, одержаний із протеїну V, pV (p5, послідовність наведена нижче), пептид, який є аналогом Mu1 (V, послідовність наведена нижче) і сам пептид Мu1. Пептид р5 і пептид V синтезували з використанням того ж методу твердофазного синтезу пептидів, який застосовували для одержання пептиду Mu1. Кожен пептид об'єднували з катіонної ліпосомою (DC-Сho1:ДОФЕ, 3:2 ммоль/ммоль) і ДНК (pCMV ) у співвідношенні ліпосома: пептид:ДНК, що складає 12:0,6:1 (мас./мас./мас.) відповідно до описаного в прикладі 4 методу. Активності у відношенні трансфекції досліджували з використанням клітин лінії HeLa (людські епітеліальні кліти 77393 34 ни). Клітини висівали з щільністю приблизно 5x104 клітин на лунку в 24-лунковий культуральний планшет у середовище DMEM, доповнене 10% ФТС, і вирощували протягом 24год. в атмосфері, яка містить 5% CO2, при 37°С. Клітини швидко промивали середовищем DMEM і потім обробляли протягом 30хв. розчинами, які містять LMD- або LD-комплекси, попередньо розведені середовищем ОРТІМЕМ (фірма Gibco) (у всіх випадках кінцева концентрація ДНК складала 1,0мкг/мл). Потім клітини знову промивали і інкубували ще протягом 48год. у середовищі DMEM, доповненим 10% ФТС, після чого їх збирали. Рівень ферментативної активності -галактозидази визначали з використанням стандартного набору для аналізу (набір для вимірювання хемілюмінесценції, фірма Roche). Як показано на Фіг.14, катіонні пептиди, одержані з аденовірусу (Mu1 і р5), і аналог Mu1 (V) мали дуже високу активність у відношенні трансфекції в порівнянні з комплексами, одержаними з використанням синтетичних катіонних поліпептидів, полілізину і поліаргініну. Амінокислотні послідовності р5, V і Mu1: р5: RPRRRATTRRRTTTGTRRRRRRR V: VRRVHHRRRRVSHRRVRGG Mu1: MRRAHHRRRRASHRRMRGG Приклад 10. Порівняння з комплексом Transfast з використанням лінії клітин Раnс-1 LMD і LD одержували відповідно до методу, описаному в прикладі 4, за винятком того, що не використовували pCMV . Комплекс Transfast (фірма Promega) одержували відповідно до протоколу виробника. Активності у відношенні трансфекції оцінювали в дослідах in vitro з використанням клітин лінії Раnс-1. Клітини висівали з щільністю приблизно 5x104 клітин на лунку в 24-лунковий культуральний планшет у середовище RPMI, доповнене 10% ФТС, і вирощували протягом 24год. в атмосфері, яка містить 5% СО2, при 37°С. Клітини швидко промивали середовищем RPMI і потім обробляли протягом вказаних періодів часу розчинами, які містять LMD- і LD-комплекси, попередньо розведені середовищем RPMI (у всіх випадках концентрація ДНК складала 5,0мкг/мл). Після цього клітини знову промивали і інкубували ще протягом 48год. у середовищі RPMI, доповненим 10% ФТС, після чого збирали. Рівень ферментативної активності -галактозидази визначали з використанням стандартного набору для аналізу (фірма Promega). Трансфекцію з використанням комплексу Transfast:ДHK здійснювали протягом 1год. у безсироватковому середовищі (оптимальні умови). Як продемонстровано на Фіг.15, LMD мав більш високу активність у відношенні трансфекції, ніж комплекс Transfast:ДНК і LD. Ці результати знаходяться в повній відповідності з результатами, одержаними з використанням клітин лінії ND-7. Приклад 11. Порівняння з ліпофектаміном при використанні людських бронхіальних клітин Активність LMD-комплексів у відношенні трансфекції порівнювали з активністю ліпофектаміну (фірма Gibco) у комплексі з ДНК із використанням клітин НВЕ (епітеліальні клітини бронхів людини). 35 Клітини висівали в 12-лунковий культуральний планшет у середовище DMEM, доповнене 10% ФТС, і вирощували протягом 24год. в атмосфері, яка містить 5% СО2, при 37°С Клітини швидко промивали середовищем DMEM і потім обробляли протягом вказаних проміжків часу розчинами, що містять або LMD-комплекс (одержаний відповідно до методу, описаному в прикладі 4), або LDкомплекс (одержаний з використанням співвідношення ліпофектамін:ДНК, що дорівнює 12:1 (мас./мас.)), попередньо розведені середовищем ОРТІМЕМ (фірма Gibco) (у всіх випадках кінцева концентрація складала 5,0мкг/мл) (Фіг.16). Після цього клітини знову промивали і інкубували ще протягом 48год. у середовищі DMEM, доповненим 10% ФТС, після чого піддавали обробці для фарбування для проведення гістохімічного аналізу з використанням X-gal. Було встановлено, що LMD мав більш високу активність у відношенні трансфекції, ніж ліпофектамін (Фіг.16) і більш швидко поглинався клітинами лінії НВЕ. Аналогічні результати були одержані для клітин ліній ND7 і Раnс-1. Приклад 12. Порівняння з LT1 з використанням головного мозку щурів: експеримент ex vivo При створенні винаходу були проведені дослідження активності у відношенні трансфекції на органотипічних культурах клітин з головного мозку щурів з використанням репортерної ДНК (pCMV ) з метою імітації умов, які існують in vivo. Зрізи головного мозку поміщали на прозорі пористі мембрани і вживали заходів для того, щоб зберегти в максимальному ступені властиві цій тканині зв’язність і цитоархітектуру. LMD і LD одержували відповідно до описаного в прикладі 4 методу. LT1 представляє собою поліамінний реагент для трансфекції, який виробляється фірмою PanVera Co. Одержували комплекс, який містить катіонні ліпосоми (DC-Chol/ДОФЕ, 3:2 ммоль/моль), LT-1 і плазміду pCMV у співвідношенні 3:3,2:1 (мас./мас./мас.). Зрізи головного мозку обробляли протягом 2год. розчинами, які містять LMD, LD або комплекс ліпосоми:LT1:ДНК [19]. В усіх випадках у ході експерименту не було виявлено морфологічних змін у зрізах. Після завершення трансфекції й інкубації протягом 48год. клітини збирали, фарбували за допомогою X-gal і підраховували кількість клітин блакитного кольору в зрізі (Фіг.17). При використанні ДНК у дозі 5,0мкг (об'єм культури 2мл) у присутності LMD після фарбування з використанням X-gal була виявлена істотно більша кількість пофарбованих у блакитний колір клітин, ніж у присутності LD або LT1-комплексу. При використанні в кількості, що складає всього 129нг, LMD мав значну активність у відношенні трансфекції, яка все ще перевищувала активність LD (DCChol/ДОФЕ в комплексі з ДНК, співвідношення 3:1 (мас./мас.) (доза ДНК 5,0мкг). Було виявлено, що експресія репортерного гена в присутності була набагато більшою, ніж у випадку трансфекції, опосередковуваної комплексами LD або ліпосома:LТ1:ДНК. Так, при використанні порівнянних доз ефективність опосередковуваної LMD трансфекції перевищувала в 19 разів ефективність тра 77393 36 нсфекції, опосередковуваної LD, і в 4 рази перевищувала ефективність трансфекції, опосередковуваної комплексом ліпосома:LT1:ДНК. Приклад 13. Порівняння з катіонними ліпосомами GL-67: експеримент in vivo з використанням легені миші Активність LMD (одержаного відповідно до методу, описаному в прикладі 4, з використанням катіонних ліпосом на основі DC-Chol/ДОФЕ (3:2моль/моль) і плазміди pCF1-CAT) у відношенні трансфекції оцінювали в дослідах in vivo з використанням легені миші шляхом порівняння з активністю у відношенні трансфекції катіонних ліпосом GL-67:ДОФЕ:DМРЕ-ПЕГ5000 (1:2:0,05 моль/моль/моль), об'єднаних у комплекс із плазмідою pCF1-CAT (LD) (співвідношення ліпосома:ДНК 5,4:1мас./мас.), які використовували для підвищення дії при проведенні клінічних досліджень на легені [20]. LMD (кінцева концентрація ДНК 0,14мг/мл; об'єм 100мкл; доза ДНК 14мкг) вводили у вигляді крапель у легені мишей лінії Ba1b/c. GL67:ДОФЕ:DМРЕ-ПЕГ5000 (1:2:0,05моль/моль/моль) об’єднували в комплекс із плазмідою pCF1-CAT (кінцева концентрація ДНК 0,8мг/мл; об'єм 100мкл; доза ДНК 80мкг) і цей LD-комплекс вводили аналогічним чином у вигляді крапель у легені мишей лінії Ba1b/c. Через 48год. легені гомогенізували і проводили аналіз у відношенні активності CAT. "Вуси" представляють собою С.К.В. Одержані результати (Фіг.18) свідчать про те, що система LMD і система GL-67, яка містить LD, забезпечували практично еквівалентні рівні трансфекції in vivo, хоча за допомогою системи LMD вводили в п'ять разів більш низьку дозу ДНК. Приклад 14. Системи LMD, модифіковані з використанням цукру Для застосувань in vivo необхідно мінімізувати неспецифічні взаємодії LMD з біологічним навколишнім середовищем. Наприклад, при внутрішньовенному введенні істотними перешкодами є небажані взаємодії з компонентами крові (солями, протеїнами і т.д.) і клітинами, які не є мішенями. Так, одним з перших етапів існуючого в природних умовах процесу видалення чужорідних частинок за допомогою вродженої імунної системи є опсонізація чужорідних частинок протеїнами плазми. Для того, щоб зменшити зв'язування протеїнів і індуковану присутністю солей агрегацію, з LMD можна зв'язати полісахариди, які зустрічаються в природних умовах. Такі модифікації LMD, здійснювані з використанням вуглеводів, можна успішно застосовувати для здійснення спрямованого перенесення LMD до вуглеводних рецепторів. Для досягнення необхідної дії були сконструйовані неогліколіпіди, представлені на Фіг.19. Основою цих сполук є три різних домени. ACHx (CJE 52): Цей ліпід (Фіг.9) був вибраний як загальний ліпідний каркас для розглянутих неогліколіпідів. Аліфатична- кільцева холестеринова система представляє собою ділянку, яка має виражену гідрофобність, що знаходиться всередині ліпідної оболонки LMD і LD частинок, яка діє як неогліколіпідний якір. 37 Вуглеводний мотив: Вибір олігосахаридів був обмежений внаслідок складності будь-якого хімічного методу, у якому використовуються модифікації вуглеводів. При створенні винаходу для доказу принципової можливості застосування вуглеводів використовували вуглеводи, які надходять у продаж, з довгим ланцюгом, такі як мальтотетраоза і мальтогептаоза. Лінкер: Застосування хемоселективного зв'язку виявилося ефективним і зручним, і це при створенні винаходу дозволило синтезувати велику різноманітність неогліколіпідів. Такий хемоселективний метод заснований на перетворенні CJE52 у гідроксиламіноліпід, який здатний безпосередньо зв'язуватися з незахищеними вуглеводами. Схема синтезу типового комплексу гідроксиламіно-СJЕ52 представлена на Фіг.20 (cхема 1), при цьому реакція сполучення вуглеводного фрагмента з лінкером заснована на глікозилюванні O-заміщеного гідроксиламіну (принцип взаємодії з глюкозою проілюстрований на Фіг.21 (схема 2)). З використанням цієї стратегії здійснювали реакцію сполучення з мальтотетраозою і мальтогептаозою, одержуючи сполуки GLU4 і GLU7 (структури наведені на Фіг.22). Модифікації LMD за допомогою глікозилювання засновані на природній здатності неогліколіпідних міцел піддаватися дисоціації, після чого вільні ліпіди вбудовуються в мембрани LMD. Спочатку готували LMD з використанням катіонних ліпосом DС-Сho1:ДОФЕ, пептиду Mu1 і плазміди pCMV відповідно до методу, описаному в прикладі 4. Потім до сумішей, які містять LM, додавали суспензію неогліколіпідних міцел у буфері Hepes, pH 7,0, і інкубували протягом 30хв. при 20°С, після чого поміщали на зберігання при -80°С (Фіг.23). Стабілізація LMD за допомогою неогліколіпідів: Стабілізуюча дія на LMD, модифікований за допомогою неогліколіпіду, оцінювали при введенні в LMD 7,5 мол. % GLU4 або GLU7. Відомо, що ліпідний шар LD-систем піддається агрегації після впливу солей. Тому були зроблені оцінки розмірів частинок LD (кінцева концентрація ДНК 1мкг/мл) після витримування протягом 30хв. при 37°С в середовищі ОРТІМЕМ, які проводили методом фотонно-кореляційної спектроскопії (пристрій типу N4 plus, фірма Coultier). Для оцінки середнього розміру частинок застосовували метод унімодального аналізу. Збільшення середнього розміру LDчастинок у відсотках представлено на Фіг.24. Таку ж процедуру здійснювали для основної LMDсистеми, LMD (GLU4) і LMD (GLU7) (кінцеві концентрації ДНК 1мкг/мл). Результати свідчать про те, що LMD є більш стабільним у розчині, ніж LD, однак вони також показують, що присутність GLU4 і GLU7 виявляє підвищену антиагрегуючу стабілізуючу дію на LMD-частинки при 7,5 мол. %. Ефективність трансфекції in vitro: Активність у відношенні трансфекції визначали з використанням клітин лінії HeLa, які висівали з щільністю 5x104 клітин на лунку в 24-лункові культуральні планшети і вирощували до досягнення 70% конфлюентності в середовищі DMEM, доповненим ФТС, при 37°С в атмосфері, яка містить 5% СО2. Клітини 77393 38 промивали ЗФР і потім протягом 30хв. обробляли розчинами, які містять LMD-комплекси, попередньо розведеними середовищем DMEM, що містить ФТС у вказаній концентрації (%) (у всіх випадках кінцева концентрація ДНК складала 5,0мкг/мл). Після цього клітини ще раз промивали і потім інкубували ще протягом 48год. у нормальному середовищі (NGM), після чого збирали. Рівень експресії -галактозидази визначали за допомогою стандартного набору для аналізу (набір для хемілюмінесцентного аналізу, фірма Roche). Результати свідчать про збільшення ефективності трансфекції у випадку модифікації з використанням цукру як в умовах, коли середовище містило 0%, так і в умовах, коли середовище містило 50% сироватки (Фіг.25). Обговорення результатів Раніше було встановлено, що ліпосоми DCChol/ДОФЕ, мають ефективність у відношенні трансфекції клітин лінії ND7, одержаної з нервових клітин [17]. Відомо, що DC-Chol успішно застосовували для різних тканин, відмінних від тканин ЦНС, і проводили клінічні дослідження можливості застосування для генної терапії кістозного фіброзу [21, 22]. Було встановлено також, що ліпосоми, які містять DC-Chol, не мали побічних цитотоксичних дій [23, 24]. Внаслідок цього була поставлена задача розробити композиції цих ліпосом, які мають поліпшені характеристики, які можна застосовувати для нервових клітин. Даний винахід стосується застосування кодованого вірусом протеїну для трансфекції клітин. Було встановлено, що Mu1 при його застосуванні в комбінації з катіонною ліпосомою DC-Chol/ДОФЕ має здатність істотно підсилювати трансфекцію клітин. Найбільш імовірно, що це зумовлюється тим, що Mu1 має здатність конденсувати пДНК, і вказану дію можна оптимізувати шляхом зміни співвідношень поліпептиду, пДНК і катіонної ліпосоми. Важливо, що посилення ефективності трансфекції є більш вираженим у випадку диференційованих клітин. Як вказувалося вище, клітини лінії ND7 були одержані з первинних DRG. При диференціюванні клітин лінії ND7 виникає фенотип, аналогічний до фенотипу батьківських периферичних чутливих нейронів, що включає індукцію росту аксону нервової клітини, зменшення загальної проліферації і зменшення здатності до трансфекції [14, 25]. Посилення ефективності трансфекції диференційованих клітин лінії ND7 може відображати підвищену здатність стимулювати трансфекцію первинних нейронів in vivo. Успіх застосування невірусних носіїв, які забезпечують введення генів, як реальну альтернативу для систем, заснованих на використанні вірусних векторів, залежить від створення комплексів, які мають більш високу і більш тривалу ефективність у відношенні трансфекції. Відтоді, коли вперше було встановлено, що катіонні ліпосоми можна застосовувати як носії для перенесення генетичного матеріалу в клітини, були докладені значні зусилля з метою створення композицій на основі катіонних ліпосом, які мають поліпшені характеристики [26, 27]. Більшість підходів до поліпшення характеристик катіонних ліпосом базували 39 ся на структурних модифікаціях самої молекули [16]. Були розроблені нові композиції, які характеризуються підвищеною ефективністю трансфекції [16]. Однак для різних типів клітин ефективність трансфекції, здійснюваної з використанням катіонних ліпосом, є різною. Наприклад, при створенні винаходу було встановлено, що поліпептид Mu1 підсилює опосередковувану катіонними ліпосомами трансфекцію в більшому ступені, ніж Vp1. Це може бути зумовлене тим, що Mu1 має більше співвідношення заряд/маса. У той час, як обидва пептиди мають приблизно однакову молекулярну масу, загальне співвідношення заряду і маси для Mu1 більше ніж у два рази перевищує відповідне значення для Vp1 (Таблиця 2). Відповідно до цього Mu1 мав здатність сповільнювати електрофоретичну рухливість плазмідної ДНК у 60 разів більш низької концентрації, що свідчить про те, наскільки сильно Mu1 здатний зв'язуватися з ДНК. Хоча в тому випадку, коли 0,25мкг Mu1 об'єднували в комплекс із 1мкг рСМV , була виявлена невелика зміна рухливості пДНК, після додавання 0,5мкг Mu1 майже всі плазміди залишалися поблизу лунки, у яку вони були завантажені (Фіг.1). Співвідношення Mu1 і pCMV , що складає 0,5:1,0 (мас./мас.), відповідає молярному співвідношенню 1000:1. Кожна молекула Mu1 містить 12 залишків, які потенційно можуть нести позитивний заряд. Теоретичне співвідношення зарядів Mu1 і pCMV повинне складати 1,6 (12000 катіонів Mu1 стосовно 7500 аніонів pCMV ). Таке співвідношення повинне повністю нейтралізувати негативні заряди pCMV і тим самим повністю виключити його міграцію, як це видно з представлених результатів. Пряме порівняння кількості Mu1, яка істотно сповільнює міграцію плазмідної ДНК, і кількості, яка оптимальним чином підсилює трансфекцію, не проводилося, оскільки використовувалися різні методи одержання. Призначені для трансфекції комплекси пептид-пДНК-ліпосома одержували в більш великих об'ємах (див. розділ Матеріали і методи). Хоча для досягнення оптимального посилення ефективності трансфекції була потрібна в 24 рази більша кількість Mu1 (12мкг на 1 мкг pCMV ), ніж для сповільнення міграції в агарозному гелі, концентрація в розчині була аналогічною (25нг/мл для сповільнення міграції пДНК; 30нг/мл для оптимальної трансфекції). Присутність Mu1 приводила також до зміни взаємодії катіонних ліпосом і пДНК. Оптимальне співвідношення DCChol/ДОФЕ і pCMV у присутності Mu1 складало 6:1, що в два рази перевищувало оптимальне співвідношення, встановлене раніше для нервових клітин [17, 28]. З теоретичної точки зору використовувана кількість Mu1 повинна повністю нейтралізувати позитивні заряди, які є на pCMV , що могли перешкоджати подальшому утворенню комплексів з DC-Chol/ДОФЕ. Очевидно, що це не мало місця, оскільки виявилося можливим одержати набагато більш високі ефективності трансфекції. Імовірно, це зумовлено тим, що при використанні вказаного в розглянутих дослідженнях буфера не всі можливі заряджені амінокислоти були депротоновані. Невідомо, чому для посилення трансфекції потрібно більша кількість катіонних 77393 40 ліпосом, тому в даний час проводяться дослідження для вирішення даного питання. Нарешті, слід зробити зауваження, які стосуються сигналу ядерної локалізації, що міститься в Vp1. Останні дані, одержані при створенні винаходу (дані не опубліковані), а також наведені в інших роботах [29-32], дозволяють припустити, що при ліпофекції транспорт трансфектованого продукту в ядро може виявитися неефективним. Внаслідок цього для посилення поглинання трансфектованої ДНК ядром були розпочаті спроби здійснити попередню конденсацію ДНК за допомогою полікатіонів, що містять послідовності пептидів, для яких відомо, що вони мають здатність здійснювати ядерну локалізацію [33-35]. Однак при створенні винаходу було встановлено, що з погляду підвищення ефективності трансфекції більш ефективна здатність Mu1 конденсувати ДНК значно переважує здатність Vp1 здійснювати ядерну локалізацію. Аналогічно до цього Fritz зі співавторами [35] не виявили відмінностей в ефективностях трансфекції, здійснюваних з використанням рекомбінантного людського гістону (Н1) і модифікованої версії, яка містить велику послідовність ядерної локалізації Τ антигену SV40. Результати інших досліджень дозволяють припустити, що наявність NLS може поліпшувати нагромадження трансфектованої пДНК у ядрі, хоча це здійснюється специфічними внутрішньоклітинними шляхами [36, 37]. В цей опис як посилання, влючені і інші публікації [38-55]. Для фахівця в даній галузі повинно бути очевидно, що можуть бути зроблені різні модифікації і варіації описаних методів і систем без відхилення від обсягу і суті винаходу. Хоча винахід був описаний з посиланням на конкретні переважні варіанти здійснення, слід розуміти, що заявлений винахід не обмежений цими конкретними варіантами здійснення. В обсязі наведеної нижче формули винаходу можуть бути зроблені різні модифікації описаних варіантів здійснення винаходу, що є очевидними для фахівців в галузі молекулярної біології і споріднених галузей. Список джерел інформації 1. Gillock E.T. et al. Polyomavirus major capsid protein VP1 is capable of packing cellular DNA when expressed in the baculovirus system // J. Virol. – 1997. – 71. – P. 2857-2865. 2. Chang D., Cai X., Consigli R.A. Characterization of the DNA binding properties of polyomavirus capsid proteins // Journal of Virology. 1993. – 67. – P. 6327-6331. 3. Anderson C.W., Young M.E., Flint S.J. Characterization of the adenovirus 2 virion protein, mu // Virology. – 1989. – 172. – P. 506-512. 4. Sato, Hosokawa // J. Biol. Chem. – 1984. – 95. – P. 1031-1039. 5. Devereux et al. // Nucleic Acids Research. – 1984. – 12. – P. 387. 6. Ausubel et al. Short Protocols in Molecular Biology. 4th Ed. - John Wiley & Sons, Inc., 1999. 7. Altschul et al. // J. Моl. Віоl. – 1990. – P. 403410. 8. Dingwall, Laskey // Trends. Biochem. Sci. – 1991. – 16. – P. 478-481. 9. W0, 95/02698, 1995. 41 10. US, 4,897,355. 11. WO, 91/15501, 1991. 12. WO, 97/45442, 1997. 13. ЕР, 304111, А. 14. Wood J.N. et al. Novel Cell-Lines Display Properties of Nonciceptive Sensory Neurons // Proceedings of the Royal Society of London Series BBiological Sciences. – 1990. – 241. – P. 187-194. 15. Budhrammahadeo V., Lillycrop Κ. Α. The Levels of the Antagonistic Pou Family Transcription Factors Brn-3a and Brn-3b in Neuronal Cells Are Regulated in Opposite Directions By Serum GrowthFactors // Neurosci. Lett.. – 1995. – 185. – P. 48-51. 16. Cooper R.G. et al. Polyamine analogues of 3beta-[N-(N',N'dimethylaminomethan)carbamoil]cholesterol (DCChol) as agents for gene delivery // Chemistry-a European Journal. – 1998. – 4. – P. 137-151. 17. McQuillin А. et al. Optimization of liposome mediated transfection of neuronal cell line // Neuroreport. – 1997. – 8. - P. 1481-1484. 18. WO, 97/45442. 19. Murray et al. // Gene Ther. – 1999. - 6. – P. 190-197. 20. Alton et al. // Lancet. – 1999. – 353. – P. 947954. 21. Caplen N.J. et al. Liposome-Mediated Cftr Gene-Transfer to the Nasal Epithelium of patients With Cystic-Fibrosis // Nature Med. – 1995. – 1. – P. 39-46. 22. Nabel G., Chang Α., Nabel E. Clinical Protocol: Immunotherapy of malignancy by in vivo gene transfer into tumors // Hum. Gene Ther. – 1992. – 3. – P. 399-4100. 23. Nabel G. et al. Direct gene-transfer with DNA liposome complexes in melanoma-expression, biological activity, and of toxicity in humans // Proc. Natl. Acad. Sci. USA. – 1993. – 90. – P. 1130711311. 24. Stewart M.J. et al. Gene-transfer in vivo with DNA liposome complexes - safety and acute toxicity in mice // Hum. Gene Ther. – 1992. – 3. – P. 267-275. 25. Murray K.D. et al. DC-Chol/DOPE mediated transfections in differentiated sensory neurons // In preparations. - 1999. 26. Lee R.J., Huang L. Lipidic vector systems for gene transfer // Critical Reviews in Theraupetic Drug Carrier Systems. - 1997. – 14. - P. 173-206. 27. Feigner P.L. et al. Lipofection - a Highly Efficient, Lipid-mediated DNA-Transfection Procedure // Proc. Natl. Acad. Sci. USA. – 1987. – 84. – P. 74137417. 28. Murray K.D. et al. Cationic liposomemediated transfection in organotipic explant cultures // Gene Ther. – 1999. – 6. – P. 190-197. 29. Labat-Moleur F. et al. An electron microscopy study into the mechanism of gene transfer with lipopolyamines // Gene Ther. 1996. – 3. – P. 10101017. 30. Zabner J. et al. Cellular and molecular barriers to gene transfer by a cationic lipid // J. Biol. Chem. 1995. – 270. – P. 18997-19007. 31. Thierry A.R. et al. Characterization of liposome-mediated gene delivery: Expression, 77393 42 stability and pharmacokinetics of plasmid DNA // Gene Ther. - 1997. – 4. – P. 226-237. 32. Coonrod A., Li F.Q, Horwitz M. On the mechanism of DNA transfection: efficient gene transfer without viruses // Gene Ther. – 1997. – 4. – P. 1313-1321. 33. Sorgi F.L., Bhattacharya S., Huang L. Protamine sulfate enhances lipid-mediated gene transfer // Gene Ther. – 1997. – 4. – P. 961-968. 34. Namiki Y., Takahashi Т., Ohno Т. Gene transduction for disseminated intraperitoneal tumor using cationic liposomes containing non-histone chromatin proteins: cationic liposomal gene therapy of carcinomatosa // Gene Ther. – 1998. – 5. – P. 240246. 35. Fritz J.D. et al. Gene transfer into mammalian cells using histone-condensed plasmid DNA // Hum. Gene Ther. – 1996. – 7. – P. 1395-1404. 36. Sebestyen M.G. et al. DNA vector chemistry: the covalent attachment of signal peptides to plasmid DNA // Nat. Biotechnol. – 1998. – 16. – P. 80-85. 37. Hagstronr J.B. et al. Nuclear import of DNA in digitonin-permeabilized cells // J. Cell Sci. – 1997. 110(Pt. 18). – P. 2323-2331. 38. Wood M.J.A. et al. Inflammatory effects of gene-transfer into CNS with defrctiveHSV-1 vectors // Gene Ther. – 1994. – 1. – P. 283-291. 39. Byrnes A.P. et al. Adenovirus gene-transfer causes inflammation in the brain // Neuroscience. 1995. – 66. – P. 1015-1024. 40. Naldini L. et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector // Science. – 1996. – 272. – P. 263-267. 41. Miller A.D. Cationic liposomes for gene delivery // Angewandte Chemie-International Edition. – 1998. – 37. – P. 1769-1785. 42. Gao X., Huang L. Cationic liposome-mediated gene-transfer // Gene Ther. – 1995. – 2. – P. 710722. 43. Farhood H., Serbina N., Huang L. The role of dioleyl phosphatidilethanolamine in cationic liposome mediated gene transfer // Biochim. Biophys. Acta. – 1995. – 1235. – P. 289-295. 44. Caplen N.J. et al. In-vivo liposome-mediated DNA transfection of epithelial-cell lines using cationic liposome DC-Chol/DOPE // Gene Ther. – 1995. – 2. – P. 603-613. 45. Feigner P.L. et al. Enhanced Gene Delivery and Mechanism Studies With a Novel Series Of Cationic Lipid Formulations // J. Biol. Chem. – 1994. – 269. – P. 2550-2561. 46. Sahenk Z. et al. Gene Delivery to Spinal Motor Neurons // Brain Res. – 1993. – 606. – P. 126129. 47. Iwamoto Y. et al. Liposome-Mediated Bdnf Cdna Transfer In Intact and Injured Rat-Brain // Neuroreport. – 1996. – 7. – P. 609-612. 48. Roessler B.J., Davidson B.L. Direct plasmidmediated transfection of adult murine brain-cells in vivo using cationic liposomes // Neurosci. Lett. – 1994. – 167. – P. 5-10. 49. Zhou X, Huang L. DNA transfection mediated by cationic liposomes containing lipopolylysine: characterization and mechanism of action // Biochim. Biophys. Acta. – 1994. – 1189. – P. 195-203. 43 50. Li S., Huang L. Protamine sulfate provides enhanced and reproducible intravenous gene transfer by cationic liposome/DNA complex // Journal of Liposome Research. – 1997. – 7. – P. 207-219. 51. Vitiello L. et al. Condensation of plasmid DNA with polylysine improves liposome-mediated gene transfer into established and primary muscle cells // Gene Ther. – 1996. – 3. – P. 396-404. 52. Gao X., Huang L. Potentiation of cationic liposome-mediated gene delivery by polycations // Biochem. – 1996. – 35. – P. 9286-9286. 77393 44 53. Hagstrom J.E. et al. Complexes of noncationic liposomes and histone HI mediate efficient transfection of DNA without encapsulation // Biochim. Biophys. Acta. – 1996. – 1284. – P. 47-55. 54. Isaka Y. The HVJ liposome method // Exp. Nephrol. – 1998. – 6. – P. 144-147. 55. Hosokawa K., Sung M.T. Isolation and characterization of an extremely basic protein from adenovirus type 5 // J. Virol. – 1976. – 17. – P. 924934. 45 77393 46 47 77393 48 49 77393 50 51 77393 52 53 Комп’ютерна верстка В. Сердюк 77393 Підписне 54 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNon-viral vector for introduction of nucleic acid and a process for preparation thereof, condensed complex polypeptide/nucleic acid and a process for insertion of nucleic acid of interest, into eukaryotic cell
Назва патенту російськоюНевирусный вектор для введения нуклеиновой кислоты и способ его получения, конденсированный комплекс полипептид/нуклеиновая кислота и способ встраивания нуклеиновой кислоты, которая представляет интерес, в эукариотическую клетку
МПК / Мітки
МПК: A61K 47/48, A61P 43/00, A61K 38/00, C12N 15/34, A61P 35/00, A61K 48/00, C07K 14/075, C12N 15/88, A61P 35/02, A61P 25/28, C12N 15/09, A61P 25/00, A61K 9/127
Мітки: кислота, нуклеїнової, конденсований, спосіб, одержання, невірусний, представляє, комплекс, еукаріотич, введення, вбудовування, інтерес, кислоти, вектор
Код посилання
<a href="https://ua.patents.su/27-77393-nevirusnijj-vektor-dlya-vvedennya-nuklenovo-kisloti-ta-sposib-jjogo-oderzhannya-kondensovanijj-kompleks-polipeptid-nuklenova-kislota-ta-sposib-vbudovuvannya-nuklenovo-kisloti-shho.html" target="_blank" rel="follow" title="База патентів України">Невірусний вектор для введення нуклеїнової кислоти та спосіб його одержання, конденсований комплекс поліпептид/нуклеїнова кислота та спосіб вбудовування нуклеїнової кислоти, що представляє інтерес, в еукаріотич</a>
Попередній патент: Спосіб обробляння заселеного мікроорганізмами насіння
Наступний патент: Застосування мелатоніну у вигляді медикаменту керованого вивільнення для лікування несприйнятливості до гіпотензивних засобів та пов’язаних з нею станів
Випадковий патент: Пальник для запалювального горна агломераційної машини