Антитіла до fсrcн5, їх імунокон’югати й способи їхнього застосування
Номер патенту: 104460
Опубліковано: 10.02.2014
Автори: Хонго Джо-Енн, Ебенс Аллен, Чжен Бін, Елкінс Крісті, Адамс Камелія, Джунутула Джагатх Р., У Янь, Полсон Ендрю
Формула / Реферат
1. Виділене моноклональне антитіло до FcRH5, що містить:
(a) варіабельний домен легкого ланцюга, який містить:
(і) HVR-L1, що містить послідовність SEQ ID NO:26;
(іі) HVR-L2, що містить послідовність SEQ ID NO:27; і
(ііi) HVR-L3, що містить послідовність SEQ ID NO:28; і
(b) варіабельний домен важкого ланцюга, який містить:
(і) HVR-H1, що містить послідовність SEQ ID NO:35;
(іі) HVR-H2, що містить послідовність SEQ ID NO:36; і
(ііі) HVR-H3, що містить послідовність SEQ ID NO:37.
2. Антитіло за п. 1, яке відрізняється тим, що антитіло являє собою фрагмент антитіла, вибраний із фрагментів Fab, Fab'-SH, Fv, scFv або (Fab')2.
3. Антитіло за будь-яким з пп. 1-2, яке відрізняється тим, що антитіло являє собою гуманізоване антитіло.
4. Антитіло за будь-яким з пп. 1-2, яке відрізняється тим, що антитіло являє собою химерне антитіло.
5. Антитіло за будь-яким з пп. 1-4 яке відрізняється тим, що антитіло містить послідовність каркасної ділянки, і щонайменше частина послідовності каркасної ділянки являє собою консенсусну послідовність каркасної ділянки людини.
6. Антитіло за будь-яким з пп. 1-5, яке відрізняється тим, що антитіло містить κ консенсусну послідовність каркасної ділянки підгрупи I людини.
7. Антитіло за будь-яким з пп. 1-6, яке відрізняється тим, що антитіло містить консенсусну послідовність каркасної ділянки підгрупи III важкого ланцюга людини.
8. Антитіло за будь-яким з пп. 1-7, яке відрізняється тим, що варіабельний домен важкого ланцюга містить амінокислотну послідовність SEQ ID NO:40.
9. Антитіло за будь-яким з пп. 1-8, яке відрізняється тим, що варіабельний домен легкого ланцюга містить амінокислотну послідовність SEQ ID NО:30.
10. Антитіло за будь-яким з пп. 1-9, яке відрізняється тим, що антитіло містить одну ділянку Fab, приєднану до ділянки Fc.
11. Антитіло за будь-яким з пп. 1-10, яке відрізняється тим, що антитіло містить СН1, який містить амінокислотну послідовність SEQ ID NO:38, і/або Fc, який містить амінокислотну послідовність SEQ ID NO:39.
12. Антитіло за будь-яким з пп. 1-11, яке відрізняється тим, що антитіло містить СН1, який містить амінокислотну послідовність SEQ ID NO:29.
13. Виділене моноклональне антитіло до FcRН5, отримане способом, який включає:
(а) культивацію клітини, що експресує антитіло, що складається з варіабельного домену важкого ланцюга і варіабельного домену легкого ланцюга за будь-яким із пп. 1-12; і
(b) виділення антитіла із вказаної культивованої клітини.
14. Антитіло за будь-яким з пп. 1-13, яке відрізняється тим, що містить один або більше вільних залишків цистеїну.
15. Антитіло за п. 14, яке відрізняється тим, що один або більше вільних залишків цистеїну мають значення реакційної здатності тіолової групи в діапазоні від 0,6 до 1,0.
16. Антитіло за будь-яким з пп. 14-15, яке відрізняється тим, що один або більше вільних залишків цистеїну знаходяться в легкому ланцюзі.
17. Антитіло за будь-яким з пп. 14-16, яке відрізняється тим, що послідовність важкого ланцюга містить амінокислотну послідовність SEQ ID NO:42.
18. Антитіло за будь-яким з пп. 14-16, яке відрізняється тим, що послідовність важкого ланцюга містить амінокислотну послідовність SEQ ID NO:44.
19. Антитіло за будь-яким з пп. 14-18, яке відрізняється тим, що послідовність легкого ланцюга містить амінокислотну послідовність SEQ ID NO:41.
20. Антитіло за будь-яким з пп. 14-18, яке відрізняється тим, що послідовність легкого ланцюга містить амінокислотну послідовність SEQ ID NO:43.
21. Антитіло за будь-яким з пп. 14-16, яке відрізняється тим, що вільний залишок цистеїну знаходиться в положенні 205, 114 і/або 400 легкого ланцюга згідно з нумерацією за Kabat.
22. Виділене антитіло, яке зв'язується з тим самим епітопом, що й антитіло за будь-яким з пп. 1-21.
23. Антитіло за будь-яким з пп. 1-22, яке відрізняється тим, що антитіло є моновалентним й містить ділянку Fc.
24. Антитіло за будь-яким з пп. 1-23, яке відрізняється тим, що антитіло є біспецифічним.
25. Антитіло за п. 24, яке специфічно зв'язується з CD3.
26. Полінуклеотид, що кодує антитіло за будь-яким з пп. 1-25.
27. Вектор, що містить полінуклеотид за п. 26.
28. Клітина-хазяїн, що містить вектор за п. 27.
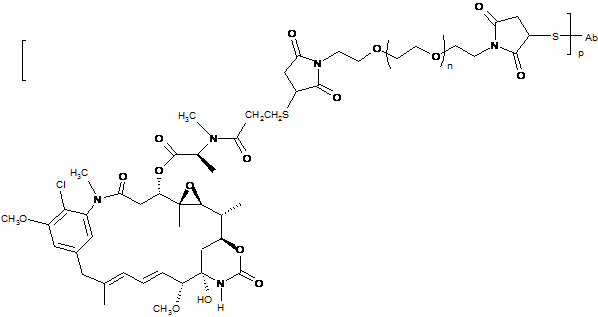
29. Імунокон'югат, що містить антитіло за будь-яким з пп. 1-25, ковалентно приєднане до цитотоксичного засобу.
30. Імунокон'югат за п. 29, який відрізняється тим, що цитотоксичний засіб вибраний з токсину, хіміотерапевтичного засобу, молекули препарату, антибіотика, радіоактивного ізотопу і нуклеази.
31. Імунокон'югат, що містить антитіло за будь-яким з пп. 1-25, ковалентно приєднане до захоплюваної мітки, мітки, що визначається, або твердого субстрату.
32. Імунокон'югат за п. 31, який відрізняється тим, що антитіло ковалентно приєднане до захоплюваної біотинової мітки.
33. Імунокон'югат за п. 31, який відрізняється тим, що антитіло ковалентно приєднане до мітки, що визначається, - флуоресцентного барвника.
34. Імунокон'югат за п. 33, який відрізняється тим, що флуоресцентний барвник вибраний з барвників флуоресціюючого типу, родамінового типу, дансилу, лісаміну, ціаніну, фікоеритрину, техаського червоного і їх аналогів.
35. Імунокон'югат за п. 31, який відрізняється тим, що антитіло ковалентно приєднане до радіонуклідної мітки, що визначається, яку вибирають з 3Н, 11С, 14С, 18F, 32Р, 35S, 64Cu, 68Ga, 86Y, 99Tc, 111Ιn, 123І, 124Ι, 125Ι, 131Ι, 133Xe, 177Lu, 211At i 213Bi.
36. Iмунокон'югат, що має формулу Ab-(L-D)p, де:
(a) Аb є антитілом за будь-яким з пп. 1-25;
(b) L є лінкером;
(c) D є молекулою препарату;
(d) p – від 1 до 8.
37. Імунокон'югат за п. 36, який відрізняється тим, що L містить лінкер, вибраний з 6-малеімідокапроїлу (МС), малеімідопропаноїлу (МР), валін-цитруліну (val-cit), аланін-фенілаланіну (ala-phe), р-амінобензилоксикарбонілу (РАВ), N-сукцинімідил-4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(N-малеїмідометил)циклогексан-1-карбоксилату (SMCC), ефіру 4-(2-піридилдитіо)масляної кислоти й N-гідроксисукциніміду (SPDB), й N-сукцинімідил(4-йодоацетил) амінобензоату(SIAB).
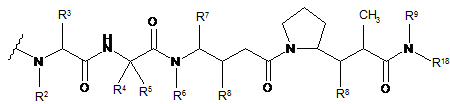
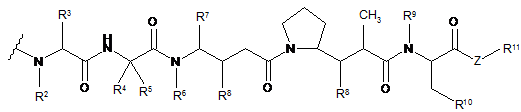
38. Імунокон'югат за будь-яким з пп. 36-37, який відрізняється тим, що D являє собою ауристатин або долостатин, і D являє собою лікарську сполуку формули DE або DF:
 DE,
DE,
DF,
де R2 і R6 являють собою метил, R3 і R4 являють собою ізопропіл, R7 являє собою вторинний бутил, кожен R8 незалежно вибраний з СН3, О-СН3, ОН і Н, R9 являє собою Н, R10 являє собою арил, Ζ являє собою -О- або -ΝΗ-, R11 являє собою Н, С1-С8алкіл або -(СН2)2-О-(СН2)2-О-(СН2)2-О-СН3, R18 являє собою -C(R8)2-C(R8)2-apил.
39. Імунокон'югат за будь-яким з пп. 36-37, який відрізняється тим, що D вибраний з ММАЕ або MMAF.
40. Імунокон'югат за будь-яким з пп. 36-37, який відрізняється тим, що імунокон'югат представлений формулою Ab-(L-MMAE)р, де p варіює від 2 до 5.
41. Імунокон'югат за будь-яким з пп. 36-37, який відрізняється тим, що імунокон'югат представлений формулою Ab-(L-MMAF)p, де p варіює від 2 до 5.
42. Імунокон'югат за будь-яким з пп. 36-41, який відрізняється тим, що L містить val-cit, МС, РАВ і/або МС-РАВ.
43. Імунокон'югат за п. 36, який відрізняється тим, що D являє собою майтансиноїд, вибраний з DM1, DM3 і DM4.
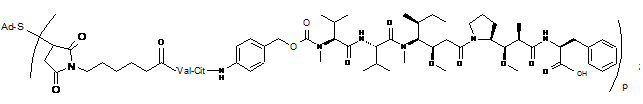
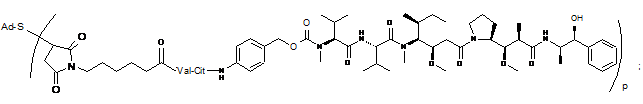
44. Імунокон'югат за будь-яким з пп. 36-37, який відрізняється тим, що імунокон'югат вибраний з наступних структур:
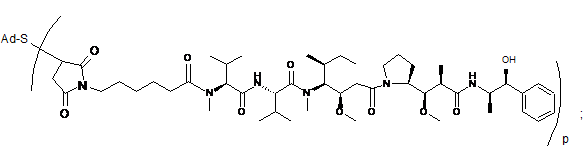

 ,
,
де Val являє собою валін, a Cit являє собою цитрулін.
45. Фармацевтична композиція, яка містить антитіло за будь-яким з пп. 1-25 або імунокон'югат за будь-яким з пп. 36-44 і фармацевтично прийнятний носій.
46. Застосування антитіла за будь-яким з пп. 1-25 або імунокон'югата за будь-яким з пп. 36-44 для одержання лікарського засобу для інгібування росту клітини, що експресує FcRH5.
47. Застосування за п. 46, яке відрізняється тим, що зазначене антитіло кон'юговане із цитотоксичним засобом.
48. Застосування за будь-яким з пп. 46-47, яке відрізняється тим, що лікарський засіб додатково містить ефективну кількість іншого терапевтичного засобу.
49. Застосування антитіла за будь-яким з пп. 1-25 або імунокон'югата за будь-яким з пп. 36-44 для одержання лікарського засобу для лікування проліферативного розладу.
50. Застосування за п. 49, яке відрізняється тим, що вказаний проліферативний розлад являє собою злоякісне новоутворення.
51. Застосування за п. 50, яке відрізняється тим, що вказане злоякісне новоутворення вибране з лімфоми, неходжкінської лімфоми (НХЛ), агресивної форми НХЛ, рецидивуючої агресивної форми НХЛ, рецидивуючої уповільненої НХЛ, рефрактерної НХЛ, рефрактерної уповільненої НХЛ, хронічного лімфоцитарного лейкозу (ХЛЛ), дрібноклітинної лімфоцитарної лімфоми, лейкозу, волохато-клітинного лейкозу (ВКЛ), гострого лімфоцитарного лейкозу (ГЛЛ) і лімфоми з клітин мантійної зони.
52. Застосування за будь-яким з пп. 49-51, яке відрізняється тим, що зазначене антитіло кон'юговане із цитотоксичним засобом.
53. Застосування за будь-яким з пп. 49-52, яке відрізняється тим, що лікарський засіб додатково містить ефективну кількість іншого терапевтичного засобу.
54. Застосування за п. 53, яке відрізняється тим, що терапевтичний засіб вибраний із групи, що включає: антитіло, хіміотерапевтичний засіб, цитотоксичний засіб, антиангіогенний препарат, імуносупресант, проліки, цитокін, антагоніст цитокінів, цитотоксичну радіотерапію, кортикостероїд, протиблювотний препарат, антиканцероматозну вакцину, анальгетик або препарат - інгібітор росту.
55. Застосування за п. 54, яке відрізняється тим, що терапевтичний агент вибраний із групи, яка включає: велкаде, ревлімід, тамоксифен, летрозол, екземестан, анастрозол, іринотекан, цетуксимаб, фулвестрант, вінорелбін, ерлотиніб, бевацизумаб, вінкристин, іматиніб, сорафеніб, лапатиніб або трастузумаб, цисплатин, гемцитабін, метотрексат, вінбластин, карбоплатин, паклітаксел, пеметрексед, 5-фторурацил, доксорубіцин, бортезоміб, леналідомід, мелфалін, преднізон, дексаметазон або доцетаксел.
56. Спосіб in vitro визначення присутності білка FcRH5 у біологічному зразку, що підозрюється на вміст білка FcRH5, що складається з in vitro впливу на вказаний зразок антитілом за будь-яким з пп. 1-25, і визначення зв'язування згаданого антитіла з білком FcRH5 у представленому зразку, при цьому зв'язування антитіла з білком FcRH5 у представленому зразку є індикатором присутності білка в заданому зразку.
57. Спосіб одержання сполуки кон'югата антитіло-препарат, що містить антитіло до FcRH5 (Ab) за будь-яким з пп. 1-25 і молекулу препарату ауристатин або майтансиноїд (D), де антитіло приєднують через одну або більше введених у ході рекомбінації амінокислот цистеїну за допомогою лінкерної молекули (L) до D; сполука представлена Формулою І:
Ab-(L-D)p (I),
де p дорівнює 1, 2, 3 або 4; спосіб містить наступні етапи:
(a) реакцію доданої в ході рекомбінації групи цистеїну антитіла з лінкерним реагентом з утворенням проміжної речовини антитіло-лінкер Ab-L; і
(b) реакцію Ab-L з активованою молекулою препарату D з утворенням кон'югата антитіло-препарат; або містить наступні етапи:
(a) реакцію нуклеофільної групи молекули препарату з лінкерним реагентом з утворенням проміжної речовини препарат-лінкер D-L; і
(b) реакцію D-L з доданою в ході рекомбінації групою цистеїну антитіла з утворенням кон'югата антитіло-препарат.
58. Імунокон'югат, який має формулу Ab-(L-D)p, де:
(a) Аb є антитілом, яке являє собою виділене моноклональне антитіло до FcRH5, що містить:
і) варіабельний домен легкого ланцюга, який містить:
a) HVR-L1, що містить послідовність SEQ ID NO: 26;
b) HVR-L2, що містить послідовність SEQ ID NO:27; і
с) HVR-L3, що містить послідовність SEQ ID NO:28; і
іі) варіабельний домен важкого ланцюга, який містить:
a) HVR-H1, що містить послідовність SEQ ID NO:35;
b) HVR-H2, що містить послідовність SEQ ID NO:36; і
с) HVR-H3, що містить послідовність SEQ ID NO:37;
(b) L - лінкер, що являє собою MC-VC-PAB;
(c) D - молекула препарату, що являє собою ММАЕ; та
(d) р = від 1 до 8.
59. Імунокон'югат за п. 58, який відрізняється тим, що варіабельний домен важкого ланцюга містить амінокислотну послідовність SEQ ID NO:40 і варіабельний домен легкого ланцюга містить амінокислотну послідовність SEQ ID NO:30.
Текст
Реферат: Даний винахід належить до антитіл, специфічних до FcRH5, композицій, що містять вказані антитіла і прийнятні для використання в лікуванні гематобластозів у ссавців, а також способи застосування вказаних композицій для вказаних цілей. UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на родинні заявки на винахід Дана заявка на винахід заявляє про пріоритет відповідно до Розділу 119(д) і має перевагу перед попередньою заявкою на патенти США No. 61/211695 від 1 квітня 2009 р., 61/166217 від 2 квітня 2009 р. і 61/266972 від 4 грудня 2009 р., опис яких включено сюди у всій своїй повноті за допомогою посилання. Посилання на список послідовностей Дана заявка на винахід містить перелік послідовностей, що був отриманий за допомогою EFS-Web і включений у даний документ за допомогою посилання у всій своїй повноті. Зазначена копія ASCII була створена 10.08.2012, файл був названий GNE0350NATIONAL2.txt і має розмір 93407 байт. ГАЛУЗЬ ТЕХНІКИ Даний винахід описує композиції, які використовують для лікування гематобластозів у ссавців, а також способи використання таких композицій для зазначених цілей. РІВЕНЬ ТЕХНІКИ Злоякісні пухлини (рак) є другою провідною причиною смертності в Сполучених Штатах Америки після серцево-судинних захворювань (Boring et al., CA Cancel J. Clin. 43:7 (1993)). Рак характеризується збільшенням кількості патологічних клітин (або клітин новоутворення), що відбулися зі здорової тканини, з утворенням пухлинної маси, інвазією таких клітин новоутворення в прилягаючі тканини й утворенням злоякісних клітин, які, зрештою, поширюються за допомогою кровоносної або лімфатичної системи в регіональні лімфатичні вузли й віддалені ділянки організму в результаті процесу, який має назву метастази. При наявності раку клітини проліферують в умовах, при яких здорові клітини не почали б зростати. Рак проявляє себе у вигляді цілого ряду форм, які характеризуються по різній ступені інвазивності й агресивності. Види раку, що включають клітини, які утворюються в ході гематопоезу, тобто процесу утворення клітинних елементів крові, таких як лімфоцити, лейкоцити, тромбоцити, еритроцити й клітини - природні кілери, відносяться до гематобластозів. Лімфоцити, що знаходяться у крові й лімфатичній тканині, відіграють важливу роль в імунній відповіді й підрозділяються на два основних класи лімфоцитів: В-лімфоцити (В-клітини) і Т-лімфоцити (Т-клітини), які опосередковують гуморальний й клітинно-опосередкований імунітет, відповідно. В-клітини дозрівають у кістковому мозку, і при виході з кісткового мозку такі клітини мають можливість експресуювати на своїй поверхні антигензв’язуюче антитіло. При першій зустрічі нативного антитіла з антигеном, до якого специфічно мембранозв’язане антитіло, клітина починає швидко ділитися, і її потомство диференціює в В-клітини пам'яті й ефекторні клітини, які мають назву «плазмоцити». В-клітини пам'яті мають більшу тривалість життя й продовжують експресуювати мембранозв’язане антитіло з такою ж самою специфічністю, що й вихідна батьківська клітина. Плазмоцити не виробляють мембранозв’язане антитіло, але замість цього виробляють антитіло у формі, що припускає секрецію. Секретовані антитіла є основною молекулою-ефектором у гуморальному імунітеті. Т-клітини дозрівають у тимусі, що забезпечує середовище для проліферації й диференціації незрілих Т-клітин. Під час дозрівання Т-клітин, останні піддаються реаранжуванню генів, відповідальних за рецептор Т-клітин і позитивний і негативний відбір, що дозволяє визначити фенотип клітинної поверхні зрілої Т-клітини. Характерними маркерами клітинної поверхні зрілих Т-клітин є комплекс CD3: T-клітинний рецептор і один із со-рецепторів (CD4 або CD8). У спробах відкрити ефективні клітинні мішені для лікування раку, дослідники вирішили ідентифікувати трансмембранні або зв'язані іншим чином з мембраною поліпептиди, які специфічним чином експресуються на поверхні ракових клітин одного або декількох окремих видів у порівнянні з одним або декількома типами здорових неракових клітин. Часто такі мембранозв’язані поліпептиди експресуються у більшій кількості на поверхні ракових клітин, ніж на поверхні неракових клітин. Ідентифікація таких пухлиноасоційованих антигенів-поліпептидів клітинної поверхні дозволила специфічно використовувати ракові клітини як мішень для їхнього руйнування в ході терапії, яка ґрунтується на використанні антитіл. У цьому випадку повідомляється, що терапія, яка ґрунтується на використанні антитіла, виявилася дуже ефективною в лікуванні певних видів рака. Наприклад, ГЕРЦЕПТИН® і РІТУКСАН® (обидва виробництва Genentech Inc., Південний Сан-Франциско, шт. Каліфорнія) є антитілами, які з успіхом використовувалися для лікування раку молочної залози й неходжкинської лімфоми, відповідно. Зокрема, ГЕРЦЕПТИН® є рекомбінантним гуманізованим ДНК-похідним моноклональним антитілом, що вибірково зв'язується з позаклітинним доменом протоонкогену людського епідермального фактора росту 2 (HER2). Гіперекспресія білка HER2 відзначається в 25-30% випадків первинного раку молочної залози. РІТУКСАН® був отриманий шляхом генної 1 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 інженерії й представлений химерним мишачим/людським моноклональним антитілом, дія якого спрямована проти антигену CD20, що перебуває на поверхні нормальних і злоякісних Влімфоцитів. Обидва таких антитіла виробляються рекомбінантним способом у клітинах яєчників китайського хом'ячка ( CHO-клітинах). У ході інших спроб відкрити ефективні клітинні мішені для лікування раку дослідники ідентифікували (1) не пов'язані з мембраною поліпептиди, які специфічно виробляються одним або декількома типами ракових клітин у порівнянні з одним або декількома окремими типами неракових здорових клітин, (2) поліпептиди, які виробляються раковими клітинами на такому рівні експресії, що істотно перевищує такий самий рівень однієї або декількох здорових неракових клітин, або (3) поліпептиди, експресія яких особливо обмежена тільки одним (або дуже обмеженою кількістю різних типів) типом тканини як при наявності, так і при відсутності раку (наприклад, здорова тканина передміхурової залози й тканина пухлини передміхурової залози). Такі поліпептиди можуть залишатися локалізованими усередині клітини або можуть секретуватися раковими клітинами. Більше того, такі поліпептиди можуть експресуюватися не тільки раковими клітинами, але також й клітинами, які виробляють і/або секретують поліпептиди, що володіють впливом, який посилює або підвищує зростання ракових клітин. Подібні секретуючі поліпептиди часто представлені білками, що надають раковим клітинами перевагу в зростанні в порівнянні зі здоровими клітинами, і включають, наприклад, ангіогенні фактори, фактори клітинної адгезії, фактори росту й т.п. Ідентифікація антагоністів подібних, не пов'язаних з мембраною поліпептидів, як очікується, може допомогти виявити ефективні терапевтичні агенти для лікування подібних типів раку. Більше того, ідентифікація схеми експресії таких поліпептидів виявиться корисною для діагностики окремих типів раку в ссавців. Незважаючи на представлені вище досягнення в лікуванні раку в ссавців, існує велика потреба в додаткових терапевтичних агентах, що дозволяють визначити наявність пухлини в ссавця й ефективно інгібувати зростання клітин новоутворення, відповідно. Відповідно до цього, метою даного винаходу є ідентифікація поліпептидів, пов'язаних із клітинною мембраною, секретованих або внутрішньоклітинних поліпептидів, експресія яких особливо обмежена тільки одним типом тканини (або дуже обмеженою кількістю типів тканин), кровотворними тканинами, як у присутності, так і у відсутності раку, а також використання таких поліпептидів і їхніх кислот, що кодують, для одержання композицій, які можуть використовуватися для лікування й/або визначення гематобластозів у ссавців. При В-клітинних злоякісних новоутвореннях, включаючи В-клітинний лімфому і мієлому, часто зустрічаються аномалії хромосоми 1q21, однак гени, які задіяні в ході таких аберацій, здебільшого невідомі. Хромосомні аномалії дисків 1q21-q23 зустрічаються найчастіше серед порушень геному при В-клітинної неходжкинській лімфомі й множинній мієломі. Серед підтипів неходжкинської лімфоми, точки розриву транслокацій 1q21-q23, включаючи транслокації й дуплікації, часто відзначалися у вигляді одиночної хромосомної аномалії при фолікулярній і дифузійній В-крупноклітинній лімфомі (ДВКЛ), В-клітинному лімфомі маргінальної зони й лімфомі Беркитта. Шляхом клонування точок розриву хромосомальної транслокації t(1:14)(q21:q32) у клітинній лінії мієломи було виявлено два гени, які були названі геном рецептора суперсімейства імуноглобулінів, асоційованим із транслокацією (IRTA), 1 і IRTA2. IRTA2 ідентичний послідовностям, які позначають BXMAS1 (Nakayama et al., Biochm. Biophys. Res. Commun. 285:830-7, 2001) і FcRH5 (Davis et al., Proc. Natl. Acad. Sci. USA 98:9772-7, 2001). IRTA1 і IRTA2 є членами сімейства родинних генів IRTA. FcRH5 (або IRTA2) є поверхневим клітинним рецептором, гомологічним сімейству рецепторів Fc. Він звичайно експресує в зрілих В-клітинах і має різний розподіл у периферічних лімфоїдних органах у порівнянні з FcRH4 (IRTA1). IRTA1 експресує в В-клітинах маргінальної зони, у той час як IRTA2 також експресує в центроцитах і імунобластах зародкового центру. Експресія IRTA2 припиняється в клітинних лініях множинної мієломи й лімфоми Беркитта з аномаліями 1q21 (див. Miller et al., Blood 99:2662-2669, 2002). Висока частота залучення структурних перебудов 1q21 в В-клітинах злоякісних новоутворень вказує, що IRTA1 і IRTA2 відіграють критичну роль у патогенезі таких захворювань (див. опубліковану PCT заявку No. WO 01/38490; опубліковану заявку на патент США No. 20080292632, зміст якої включено в даний документ у всій своїй повноті за допомогою посилання) (див. також Polson, et al. Int Immunol. 2006 Sep;18(9):1363-73). Беручи до уваги експресію FcRH5, кращим буде вироблення терапевтичних антитіл до антигену FcRH5, ніж створення мінімальної або відсутньої антигенності при введенні пацієнтам, особливо при хронічному лікуванні. Даний винахід задовольняє такій й іншій потребам. Даний винахід представляє антитіла до FcRH5, які допоможуть перебороти обмеження терапевтичних композицій, що використовують у цей час, а також додаткові переваги, які виявляться 2 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 очевидними на основі представленого нижче докладного опису. Використання кон’югатів антитіло-препарат (КАП), тобто імунокон’югатів, для локальної поставки цитотоксичних або цитостатичних агентів, тобто препаратів для загибелі або інгібування пухлинних клітин при лікуванні раку (Lambert, J. (2005) Curr. Opinion in Pharmacology 5:543-549; Wu et al (2005) Nature Biotechnology 23(9):1137-1146; Payne, G. (2003) Cancer Cell 3:207-212; Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drug Del. Rev. 26:151-172; US 4975278), дозволяє робити цілеспрямовану поставку молекули препарату до пухлин, а також їхнє внутрішньоклітинне нагромадження, при цьому системне введення таких некон’югованих лікарських препаратів може призвести до неприпустимих рівнів токсичності для здорових клітин, а також пухлинних клітин, які повинні елімінуватися (Baldwin et al (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) “Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review,” в Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al (ed.s), pp. 475-506). Спроби для поліпшення терапевтичного індексу, тобто максимальної ефективності й мінімальної токсичності КАП, були спрямовані на вибірковість поліклональних (Rowland et al (1986) Cancer Immunol. Immunother., 21:183-87) і моноклональних антитіл (МАТ), а також властивості зв'язування й вивільнення препарату (Lambert, J. (2005) Curr. Opinion in Pharmacology 5:543-549). Молекули препаратів, які використовують у кон’югатах препарату з антитілом, включають білки бактеріальних токсинів, такі як дифтерійний токсин, білки токсинів рослин, такі як рицин, невеликі молекули, такі як аурістатини, гелданаміцин (Mandler et al (2000) J. of the Nat. Cancer Inst. 92(19):15731581; Mandler et al (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al (2002) Bioconjugate Chem. 13:786-791), майтансіноїди (EP 1391213; Liu et al (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623), калихіміцин (Lode et al (1998) Cancer Res. 58:2928; Hinman et al (1993) Cancer Res. 53:3336-3342), дауноміцин, доксорубіцин, метотрексат і віндесин (Rowland et al (1986) див. вище). Молекули препаратів можуть впливати на цитотоксичні й цитостатичні механізми, включаючи зв'язування тубуліну, зв'язування ДНК або інгібування топоізомерази. Деякі цитотоксичні препарати можуть бути неактивними або менш активними при кон'югації з більшими антитілами або лігандами білкових рецепторів. Білки аурістатин, аурістатин E (AE) і монометилаурістатин (MMAE), синтетичні аналоги доластатина (WO 02/088172), були кон’юговані у вигляді молекул препарату з: (i) химерними моноклональними антитілами cBR96 (специфічними до антигену Y Льюїса карциноми); (ii) cAC10, специфічному до CD30 гемобластозів (Klussman, et al (2004), Bioconjugate Chemistry 15(4):765-773; Doronina et al (2003) Nature Biotechnology 21(7):778-784; Francisco et al (2003) Blood 102(4):1458-1465; US 2004/0018194; (iii) антитілами до CD20, такими як рітуксан (WO 04/032828) для лікування видів рака з експресією CD20 і імунних розладів; (iv) антитілами до EphB2R 2H9 для лікування колоректального раку (Mao et al (2004) Cancer Research 64(3):781788); (v) антитілом до E-селектину (Bhaskar et al (2003) Cancer Res. 63:6387-6394); (vi) трастузумабом (ГЕРЦЕПТИН®, US 2005/0238649), і (vi) антитілами до CD30 (WO 03/043583). Варіанти аурістатина E описані в патентах США No. 5767237 і 6124431. Монометиловий аурістатин Е, кон’югований з моноклональними антитілами, описаний в Senter et al, Proceedings of the American Association for Cancer Research, Том 45, номер анотації 623 (від 28 березня 2004 р.). Аналоги аурістатина MMAE і MMAF були кон’юговані із цілим рядом антитіл (US 2005/0238649). Стандартні способи приєднання, тому що зв'язування за допомогою ковалентних зв'язків, молекули препарату з антитілом звичайно призводять до гетерогенної суміші молекул, у якій молекули препаратів приєднані до цілого ряду ділянок антитіла. Наприклад, цитотоксичні препарати звичайно кон’юговані з антитілами за допомогою численних залишків лізина антитіла, що призводить до утворення гетерогенної суміші кон’югата антитіло-препарат. Залежно від умов реакції, гетерогенна суміш звичайно складається з антитіл з 0 до приблизно 8 або більше приєднаними молекулами. Крім того, у кожній підгрупі кон’югатів з тим або іншим цілочисловим співвідношенням молекул препаратів до антитіла існує потенційно гетерогенна суміш, у якій молекула препарату приєднана до різних ділянок антитіла. Аналітичні й препаративні способи можуть виявитися недостатніми для сепарації й характеристики молекул кон’югатів антитіло-препарат у гетерогенній суміші, яка утворена в результаті реакції кон'югації. Антитіла представлені великими, комплексними й структурно різними біомолекулами, що часто містять багато реакційних функціональних груп. Їхня реакційна здатність із лінкерними реагентами й проміжними сполуками препарат-лінкер залежать від факторів, таких як рН, концентрація, концентрація солі й ко-розчинники. Більше того, багатоетапний процес кон'югації може бути невідтворним через труднощі в контролі умов реакції й характеристики реагентів і проміжних речовин. 3 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 Тіоли (цистеїн) реакційноздатні при нейтральному значенні рН, на відміну від більшості амінів, які протоновані й менш нуклеофільні при рН близько 7. Оскільки незв'язані групи тіолів (меркаптани, сульфгідрил) відносно реакційноздатні, білки із цистеїновими залишками часто існують в окисленій формі у вигляді дисульфідно-зв'язаних олігомерів або мають внутрішні дисульфідні групи. Позаклітинні білки звичайно не мають вільних тіолів (Garman, 1997, NonRadioactive Labelling: A Practical Approach, Academic Press, London, стор. 55). Цистеїнові тіолові групи антитіла звичайно більше реакційноздатні, тобто більш нуклеофільні, відносно електрофільних реагентів кон'югації, ніж амінні або гідроксильні групи антитіла. Цистеїнові залишки були включені в білки шляхом процедур генної інженерії (рекомбінації) для утворення ковалентних зв'язків з лігандами або утворення нових внутрімолекулярних дисульфідних містків (Better et al (1994) J. Biol. Chem. 13:9644-9650; Bernhard et al (1994) Bioconjugate Chem. 5:126132; Greenwood et al (1994) Therapeutic Immunology 1:247-255; Tu et al (1999) Proc. Natl. Acad. Sci USA 96:4862-4867; Kanno et al (2000) J. of Biotechnology, 76:207-214; Chmura et al (2001) Proc. Nat. Acad. Sci. USA 98(15):8480-8484; US 6248564). Проте, процедура рекомбінації у тіолових групах цистеїну шляхом мутації різних амінокислотних залишків білка в цистеїнові амінокислоти потенційно проблематична, особливо у випадку неспарених (незв'язаного Цис) залишків або залишків, які відносно доступні для реакції або окислювання. У концентрованих розчинах білка, наприклад, періплазмі E. coli, супернатанта культури або частково, або повністю очищеного білка, неспарені залишки Цис на поверхні білка можуть зв'язуватися й окислятися з утворенням міжмолекулярних дисульфідних зв'язків, і, отже, димерів або мультимерів. Утворення дисульфідного димеру приводить до неактивності нового Цис для кон'югації із препаратом, лігандом або іншою міткою. Крім того, якщо білок при окислюванні утворить внутрімолекулярний дисульфідний місток між новими включеними й існуючими залишками Цис, обидві тіолові групи Цис недоступні для активної ділянки й взаємодій. Крім того, білок може залишатися неактивним або неспецифічним при неправильному скручуванні або втраті третинної структури (Zhang et al (2002) Anal. Biochem. 311:1-9). Антитіла з уведеним шляхом рекомбінації цистеїном були розроблені у вигляді фрагментів антитіла FAB (тіоFab) і експресуються у вигляді моноклональних антитіл IgG повної довжини (ТіоМАТ) (Junutula, J.R. et al. (2008) J Immunol Methods 332:41-52; US 2007/0092940, зміст включений у вигляді посилання). ТіоFab і ТіоМАТ були кон’юговані за допомогою лінкерів у положенні нових уведених тіолів цистеїну з використанням тіо-реакційних лінкерних реагентів і препарат-лінкерних реагентів для одержання кон’югатів антитіло-препарат (Тіо КАП). Всі процитовані тут посилання, включаючи заявки на патенти й публікації, включені у вигляді посилання у всій своїй повноті. СУТНІСТЬ ВИНАХОДУ Винахід описує антитіла до FcRH5 або їхні функціональні фрагменти, а також спосіб їх використання в лікуванні гематобластозів . В одному аспекті винахід описує антитіло, що зв'язується, переважно специфічно, з кожним з описаних вище або нижче поліпептидів. У деяких випадках антитіло представлене моноклональним антитілом, фрагментом антитіла, включаючи фрагменти Fab, Fab', F(ab') 2 і Fv, діатілом, антитілом з одним доменом, химерним антитілом, гуманізованим антитілом, одноланцюговим антитілом або антитілом, що конкурентним чином інгібує зв'язування поліпептидного антитіла до FcRH5 з відповідною антигенною детермінантою. Антитіла даного винаходу можуть бути в деяких випадках представлені у вигляді кон’югатів із препаратамиінгібіторами росту або цитотоксичним агентом, наприклад, токсином, включаючи, наприклад, аурістатин, майтансиноїд, похідне долостатину або каліхіміцину, антибіотик, радіоактивний ізотоп, нуклеолітичний фермент або т.п. Антитіла даного винаходу можуть у деяких випадках вироблятися в клітинах CHO або бактеріальних клітинах, і переважно індукувати загибель клітини, з якої вони зв'язуються. З метою визначення, антитіла даного винаходу можуть бути позначені, приєднані до твердого субстрату або т.п. В одному аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що моновалентна афінність (тобто афінність антитіла як фрагмента Fab до FcRH5) або афінність у двовалентній формі антитіла до FcRH5 (тобто афінність антитіла як фрагмента IgG до FcRH5) практично така ж сама, нижче або вище, ніж моновалентна афінність або афінність у двовалентній формі, відповідно, мишачого антитіла (наприклад, афінність мишачого антитіла як фрагмента Fab або фрагмента IgG до FcRH5) або химерного антитіла (наприклад, афінність химерного антитіла як фрагмента Fab або фрагмента IgG до FcRH5), що складається або включає послідовність варіабельного домену легкого ланцюга й важкого ланцюга, як це зазначено на Фігурі 9 (SEQ ID NO: 19) й Фігурі 10 (SEQ ID NO:21). В іншому своєму аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється 4 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 тим, що афінність антитіла в його двовалентній формі до FcRH5 (наприклад, афінність антитіла у вигляді IgG до FcRH5) становить 0,4 нМ, 0,2 нМ або 0,5 нМ. В одному аспекті винаходу описане антитіло, що зв'язується з FcRH5 і відрізняється тим, що таке антитіло складається, щонайменше, з одного, двох, трьох, чотирьох, п'яти або шести гіперваріабельних ділянок (HVR), які вибирають з наступних груп: (i) HVR-L1, що включає послідовність KASQDVSTAVA (SEQ ID NO: 26) (ii) HVR-L2, що включає послідовність SASYRYT (SEQ ID NO: 27) (iii) HVR-L3, що включає послідовність QQHFSSPRT (SEQ ID NO: 28) (iv) HVR-H1, що включає послідовність GFTFSSYAVS (SEQ ID NO: 69) (v) HVR-H2, що включає послідовність ATISSGGSLTFYLDSVR (SEQ ID NO: 70); і (vi) HVR-H3, що включає послідовність PIPDYYALDY (SEQ ID NO: 71). В іншому варіанті втілення винаходу HVR-H2 має послідовність SEQ ID NO: 36. В іншому варіанті втілення винаходу антитіло включає 1 консенсусну послідовність каркасної ділянки підгрупи k людини. У ще одному варіанті втілення винаходу антитіло складається з консенсусної послідовності каркасної ділянки підгрупи III важкого ланцюга людини. В іншому варіанті втілення винаходу антитіло включає варіабельний домен легкого ланцюга, що має, щонайменше, 90% ідентичність амінокислотної послідовності в порівнянні з амінокислотною послідовністю SEQ ID NO: 19. В одному варіанті втілення винаходу антитіло включає варіабельний домен важкого ланцюга, що має, щонайменше, 90% ідентичність амінокислотної послідовності в порівнянні з амінокислотною послідовністю SEQ ID NO: 21. В іншому варіанті втілення винаходу антитіло включає варіабельний домен легкого ланцюга, що має, щонайменше, 90% ідентичність амінокислотної послідовності в порівнянні з амінокислотною послідовністю SEQ ID NO: 19. У ще одному варіанті втілення винаходу антитіло включає варіабельний домен важкого ланцюга, що має, щонайменше, 90% ідентичність амінокислотної послідовності в порівнянні з амінокислотною послідовністю SEQ ID NO: 21. В одному варіанті втілення винаходу антитіло включає варіабельний домен важкого ланцюга, що складається з одного, двох, трьох або чотирьох амінокислотних послідовностей каркасних ділянок, які вибирають з SEQ ID NO: 31, 32, 33 і 34. В інших варіантах втілення винаходу антитіло включає варіабельний домен легкого ланцюга, що складає з одного, двох, трьох або чотирьох амінокислотних послідовностей каркасних ділянок, які вибирають з SEQ ID NO: 22, 23, 24 і 25. В іншому варіанті втілення винаходу антитіло включає варіабельний домен важкого ланцюга, що складається з одного, двох, трьох або чотирьох амінокислотних послідовностей каркасних ділянок, що мають, щонайменше, 90% ідентичність амінокислотної послідовності в порівнянні з амінокислотними послідовностями, вибраними з SEQ ID NO: 31, 32, 33 і 34. В інших варіантах втілення винаходу антитіло включає варіабельний домен легкого ланцюга, що складається з одного, двох, трьох або чотирьох амінокислотних послідовностей каркасних ділянок, що мають, щонайменше, 90% ідентичність амінокислотної послідовності в порівнянні з амінокислотними послідовностями, вибраними з SEQ ID NO: 22, 23, 24 і 25. В одному аспекті винаходу описане антитіло, що зв'язується з FcRH5 і відрізняється тим, що зазначене антитіло складається, щонайменше, з одного варіанта HVR, при цьому послідовність такого варіанта HVR включає модифікацію, щонайменше, одного залишку послідовності, що зазначена як SEQ ID NO: 26, 27, 28, 35, 36 або 37. В одному варіанті втілення винаходу модифікація представлена заміщенням, вставкою або делецією. В іншому варіанті втілення винаходу, щонайменше, ділянка послідовності каркасної ділянки представлена консенсусною послідовністю каркасної ділянки. В іншому варіанті втілення винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що моновалентна афінність антитіла до людського FcRH5 практично така ж сама, що й моновалентна афінність мишачого антитіла, що включає послідовність варіабельного домену легкому ланцюгу й важкому ланцюгу, як це зазначено на Фігурі 9 (SEQ ID NO: 19) і Фігурі 10 (SEQ ID NO: 21). В одному аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що моновалентна афінність антитіла до людського FcRH5, щонайменше, в 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 разів більше, ніж моновалентна афінність мишачого антитіла, що включає послідовність варіабельного домену легкому ланцюгу й важкому ланцюгу, як це зазначено на Фігурі 9 (SEQ ID NO: 19) і Фігурі 10 (SEQ ID NO: 21). В одному аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що моновалентна афінність антитіла до людського FcRH5, щонайменше, в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55 або 60 разів менше, ніж моновалентна афінність мишачого антитіла, що включає послідовність варіабельного домену легкому ланцюгу й важкому ланцюгу, як це зазначено на Фігурі 9 (SEQ ID NO: 18) і Фігурі 10 5 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 (SEQ ID NO: 20). В іншому аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що афінність антитіла в його двовалентній формі до людського FcRH5 практично така ж сама, що й афінність мишачого антитіла в його двовалентній формі, що включає послідовність варіабельного домену легкому ланцюгу й важкому ланцюгу, як це зазначено на Фігурі 9 (SEQ ID NO: 18) і Фігурі 10 (SEQ ID NO: 20). В одному аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що афінність антитіла до людського FcRH5 у його двовалентній формі, щонайменше, в 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 разів більше, ніж афінність мишачого або химерного антитіла в його двовалентній формі, що включає послідовність варіабельного домену легкому ланцюгу й важкому ланцюгу, як це зазначено на Фігурі 9 (SEQ ID NO: 18) і Фігурі 10 (SEQ ID NO: 20). В іншому аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що афінність антитіла до людського FcRH5 у його двовалентній формі, щонайменше, в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55 або 60 разів менше, ніж афінність мишачого або химерного антитіла в його двовалентній формі, що включає послідовність варіабельного домену легкому ланцюгу й важкому ланцюгу, як це зазначено на Фігурі 9 (SEQ ID NO: 18) і Фігурі 10 (SEQ ID NO: 20). У ще одному аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що афінність такого антитіла в його двовалентній формі до людського FcRH5 становить 0,4 нМ. В одному варіанті втілення винаходу афінність антитіла в його двовалентній формі до людського FcRH5 становить 0,4 ±0,04 нМ. У ще одному аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що афінність такого антитіла в його двовалентній формі до людського FcRH5 становить 0,2 нМ. В одному варіанті втілення винаходу афінність антитіла в його двовалентній формі до людського FcRH5 становить 0,2 ±0,02 нМ. У ще одному аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що афінність такого антитіла в його двовалентній формі до людського FcRH5 становить 0,5 нМ. В одному варіанті втілення винаходу афінність антитіла в його двовалентній формі до людського FcRH5 становить 0,5 ±0,01 нМ. У всіх аспектах винаходу афінність зв'язування виражена у вигляді значення K d. В одному аспекті винаходу афінність зв'язування виміряється за допомогою аналізу Biacore або радіоімуноаналізу. У ще одному аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що гуманізоване антитіло при його кон'югації із цитотоксичним агентом інгібує ріст клітин пухлини. В іншому аспекті винахід описує гуманізоване антитіло до FcRH5, що відрізняється тим, що гуманізоване антитіло при його кон'югації із цитотоксичним агентом інгібує ріст клітин пухлини. В одному варіанті втілення винаходу гуманізоване антитіло й химерне антитіло є моновалентними або бівалентними. В іншому варіанті втілення винаходу гуманізоване антитіло й химерне антитіло включають одну ділянку Fab, приєднану до ділянки Fc. В іншому аспекті винахід описує антитіло, що складається з варіабельного домену важкого ланцюга, що включає послідовність HVR1-HC, HVR2-HC і/або HVR3-HC, зазначену на Фігурі 11 (SEQ ID NO: 35-37). В одному варіанті втілення винаходу варіабельний домен включає послідовність FR1-HC, FR2-HC, FR3-HC і/або FR4-HC, зазначену на Фігурі 11 (SEQ ID NO: 3134). В іншому варіанті втілення винаходу антитіло включає послідовність CH1 і/або Fc, зазначену на Фігурі 11 (SEQ ID NO: 38 і/або 39). У ще одному аспекті винахід описує антитіло, що складається з варіабельного домену легкого ланцюга, що включає послідовність HVR1-LC, HVR2-LC і/або HVR3-LC, зазначену на Фігурі 11 (SEQ ID NO: 26-28). В одному варіанті втілення винаходу варіабельний домен включає послідовність FR1-LC, FR2-LC, FR3-LC і/або FR4-LC, зазначену на Фігурі 11 (SEQ ID NO: 22-25). В іншому варіанті втілення винаходу антитіло включає послідовність CL1, зазначену на Фігурі 11 (SEQ ID NO: 29). В одному аспекті винахід описує поліпептид, що складається з послідовності, що зазначена на Фігурі 10 (SEQ ID NO: 21). В іншому аспекті винахід описує поліпептид, що складається з послідовності, що зазначена на Фігурі 9 (SEQ ID NO: 19). В іншому аспекті винахід описує антитіло, отримане в процесі (а) культивації клітини, яка експресує антитіло, що складається з описаного тут варіабельного домену важкого ланцюга й описаного тут варіабельного домену легкого ланцюга; і (б) ізоляції антитіла із зазначеної клітини, що культивується. В іншому аспекті винахід описує антитіло, що складається з описаного тут варіабельного 6 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 домену важкого ланцюга й описаного тут варіабельного домену легкого ланцюга. В одному варіанті втілення винаходу антитіло моновалентно й включає ділянку Fc. В одному аспекті винахід описує полінуклеотид, що кодує описане тут антитіло. В одному варіанті втілення винахід описує вектор, що складається з полінуклеотида. В іншому варіанті втілення винахід описує клітину-хазяїна, що включає вектор. [0001] В одному аспекті винахід включає антитіло до FcRH5 із включеним у ході рекомбінації цистеїном і складається з одного або декількох незв'язаних амінокислот цистеїн і послідовності, яка вибрана з SEQ ID NO: 251-298. Антитіло до FcRH5 із включеним у ході рекомбінації цистеїном може зв'язуватися з поліпептидом FcRH5. Антитіло до FcRH5 із включеним у ході рекомбінації цистеїном може бути отримане шляхом процесу, що включає заміну одного або декількох амінокислотних залишків вихідного антитіла до FcRH5 цистеїном. В одному аспекті винахід включає антитіло до FcRH5 із включеним у ході рекомбінації цистеїном, що включає одну або кілька незв'язаних амінокислот цистеїн, при цьому антитіло до FcRH5 із включеним у ході рекомбінації цистеїном зв'язується з поліпептидом FcRH5 й таке антитіло одержують за допомогою процесу, що складається із заміни одного або декількох амінокислотних залишків вихідного антитіла до FcRH5 цистеїном, при цьому вихідне антитіло включає, щонайменше, одну послідовність HVR, яка вибрана з: (i) HVR-L1, що включає послідовність KASQDVSTAVA (SEQ ID NO: 26) (ii) HVR-L2, що включає послідовність SASYRYT (SEQ ID NO: 27) (iii) HVR-L3, що включає послідовність QQHFSSPRT (SEQ ID NO: 28) (iv) HVR-H1, що включає послідовність GFTFSSYAVS (SEQ ID NO: 69) (v) HVR-H2, що включає послідовність ATISSGGSLTFYLDSVR (SEQ ID NO: 70); і (vi) HVR-H3, що включає послідовність PIPDYYALDY (SEQ ID NO: 71). Антитіло до FcRH5 із включеним у ході рекомбінації цистеїном може бути представлено моноклональним антитілом, фрагментом антитіла, химерним антитілом, гуманізованим антитілом, одноланцюговим антитілом або антитілом, що конкурентним чином інгібує зв'язування поліпептидного антитіла до FcRH5 з відповідною антигенною детермінантою. Антитіла даного винаходу можуть бути в деяких випадках представлені кон’югатами з агентом, що інгібує зростання, або цитотоксичним агентом, таким як токсин, включаючи, наприклад, аурістатин або майтансиноїд. Антитіла даного винаходу можуть у деяких випадках вироблятися в клітинах CHO або бактеріальних клітинах, і переважно інгібують зростання або проліферацію або індукують загибель клітини, з якої вони зв'язуються. З метою діагностики, антитіла даного винаходу можуть бути позначені, приєднані до твердого субстрату або т.п. В одному аспекті винахід описує способи для одержання антитіл по винаходу. Наприклад, винахід описує спосіб одержання антитіла до FcRH5 (який, як це визначено в даній заявці, включає антитіло повної довжини або його фрагмент), і такий спосіб включає експресію в підходящій клітині-хазяїні рекомбінантного вектора по винаходу, що кодує зазначене антитіло (або його фрагмент), і відновлення зазначеного антитіла. В іншому аспекті винахід описує біспецифічне антитіло, здатне зв'язуватися з одною клітиною, що експресує FcRH5, і іншою клітиною, що експресує антиген-мішень на клітинній поверхні. В одному варіанті втілення винаходу друга клітина представлена Т-клітиною. В одному варіанті втілення винаходу антиген-мішень на клітинній поверхні представлений CD3. У певних варіантах втілення винаходу біспецифічне антитіло представлене антитілом з опуклістю. В одному варіанті втілення винаходу біспецифічне антитіло аглікозильовано. В одному варіанті втілення винаходу біспецифічне антитіло виробляється в клітині-хазяїні Escherichia coli. В одному варіанті втілення винаходу біспецифічне антитіло не містить одну або більше ефекторних функцій Fc. В одному варіанті втілення винаходу біспецифічне антитіло не володіє АЗКЦ. В одному аспекті винахід представлений фармацевтичною композицією, що включає антитіло по винаходу або кон’югат антитіло-препарат, а також фармацевтично прийнятний розріджувач, носій або допоміжну речовину. В одному аспекті винахід описує готовий виріб, що складається з контейнера, що включає композицію, при цьому композиція складається з одного або декількох антитіл до FcRH5. В одному аспекті винахід описує набір, що складається з одного контейнера з композицією, що включає одне або кілька антитіл до FcRH5, і іншого контейнера, що включає буфер. В одному аспекті винахід описує використання антитіла до FcRH5 у вигляді лікарської форми для терапевтичного й/або профілактичного використання для лікування захворювання, такого як рак, пухлина й/або порушення проліферації клітин. В одному аспекті винахід описує використання готового продукту у вигляді лікарської форми для терапевтичного й/або профілактичного використання для лікування захворювання, такого 7 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 як рак, пухлина й/або порушення проліферації клітин. В одному аспекті винахід описує використання набору у вигляді лікарської форми для терапевтичного й/або профілактичного використання для лікування захворювання, такого як рак, пухлина й/або порушення проліферації клітин. В одному аспекті винахід описує спосіб інгібування росту клітини, що експресує FcRH5, і зазначений спосіб містить у собі контакт згаданої клітини з антитілом по винаходу, що призводить до інгібування росту що зазначена клітини. В одному варіанті втілення винаходу антитіло кон’юговано із цитотоксичним агентом. В одному варіанті втілення винаходу антитіло кон’юговано з агентом-інгібітором росту. В одному аспекті винахід описує спосіб терапевтичного лікування ссавця, що має ракову пухлину, що складається із клітин, що експресує FcRH5, і зазначений спосіб складається із введення згаданому ссавцеві терапевтично ефективної кількості антитіла по винаходу, що дозволяє ефективно вилікувати зазначеного ссавця. В одному варіанті втілення винаходу антитіло кон’юговано із цитотоксичним агентом. В одному варіанті втілення винаходу антитіло кон’юговано з агентом-інгібітором росту. В одному аспекті винахід описує спосіб лікування або запобігання порушення проліферації клітин, що викликається гіперекспресією FcRH5; зазначений спосіб складається із введення пацієнтові, що потребує у такому лікуванні, ефективної кількості антитіла по винаходу, що дозволяє ефективно вилікувати або запобігти згаданому порушенню клітинної проліферації. В одному варіанті втілення винаходу згадане порушення проліферації представлене раком. В одному варіанті втілення винаходу антитіло кон’юговано із цитотоксичним агентом. В одному варіанті втілення винаходу антитіло кон’юговано з агентом-інгібітором росту. В одному аспекті винахід описує спосіб інгібування росту клітини, при цьому ріст такої клітини, щонайменше, залежить від ефекту, що потенціює зростання FcRH5; зазначений спосіб складається з контакту згаданої клітини з ефективною кількістю антитіла по винаходу, що призводить до інгібування росту згаданої клітини. В одному варіанті втілення винаходу антитіло кон’юговано із цитотоксичним агентом. В одному варіанті втілення винаходу антитіло кон’юговано з агентом-інгібітором росту. В одному аспекті винахід описує спосіб терапевтичного лікування пухлини у ссавця, при цьому зростання такої пухлини, щонайменше, залежить від ефекту, що потенціює зростання FcRH5; зазначений спосіб складається з контакту згаданої клітини з ефективною кількістю антитіла по винаходу, що призводить до ефективного лікування згаданої пухлини. В одному варіанті втілення винаходу антитіло кон’юговано із цитотоксичним агентом. В одному варіанті втілення винаходу антитіло кон’юговано з агентом-інгібітором росту. В одному аспекті винахід описує спосіб лікування рака, що складається із введення пацієнтові фармацевтичної композиції, що включає описаний тут кон’югат, прийнятний розріджувач, носій або допоміжну речовину. В одному аспекті винахід описує спосіб інгібування проліферації В-клітин, що складається із впливу на клітину імунокон’югатом, що включає антитіло по винаходу, в умовах, що забезпечують зв'язування імунокон’югата з FcRH5. Спосіб даного винаходу може додатково включати інші етапи лікування. Наприклад, в одному варіанті втілення винаходу спосіб додатково включає етап, у ході якого клітина-мішень і/або тканина-мішень (наприклад, ракова клітина) піддається впливу лікуванню опроміненням або препаратом хіміотерапії. В одному аспекті винахід описує способи, що складаються із введення ефективної кількості антитіла до FcRH5 у комбінації з ефективною кількістю іншого терапевтичного агента (наприклад, антиангіогеного препарату, іншого антитіла, хіміотерапевтичного препарату, цитотоксичного агента, імуносупресанта, проліків, цитокіна, цитотоксичної радіотерапії, кортикостероїда, противоблювотного препарату, антиканцероматозної вакцини, анальгетика або препарата-інгібітора росту). Наприклад, антитіла до FcRH5 або імунокон’югати використовуються в комбінаціях із протираковим препаратом або антиангіогеним препаратом для лікування різних станів новоутворень і станів при відсутності новоутворень. В окремих прикладах антитіла до FcRH5 використовуються в комбінації із препаратами Велкаде® (бортезоміб), Ревлімід® (леналідомід), тамоксифен, летрозол, екземестан, анастрозол, іринотекан, цетуксимаб, фулвестрант, вінорелбін, бевацизумаб, вінкрістин, цисплатин, гемцитабін, метотрексат, вінбластин, карбоплатин, паклітаксел, доцетаксел, пеметрексед, 5фторурацил, доксорубіцин, бортезоміб, леналідомід, дексаметазон, мелфалан, преднізон, вінкрістин, талідомід. Залежно від специфічних показань щодо виду раку, що піддається лікуванню, комбінована терапія по винаходу може бути скомбінована з додатковими терапевтичними агентами, такими 8 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 як препарати хіміотерапії, або додатковими видами терапії, такими як променева терапія або хірургія. У комбінованій терапії по винаходу може використовуватися багато відомих хіміотерапевтичних препаратів. Переважно будуть використовуватися ті хіміотерапевтичні препарати, які є стандартними для лікування за специфічними показниками. Доза або частота прийому кожного терапевтичного агента, що використовується в комбінованій терапії, переважно такі ж самі або менші, ніж доза або частота прийому відповідного агента, що використовується при монотерапії. В іншому аспекті винахід описує будь-які представлені тут антитіла до FcRH5, що відрізняються тим, що антитіло до FcRH5 включає обумовлену мітку. В одному аспекті винахід описує спосіб визначення присутності FcRH5 у зразку, що підозрюється на вміст FcRH5; зазначений спосіб містить у собі вплив згаданого зразка антитілом по винаходу з наступним визначенням зв'язування згаданого антитіла з FcRH5 у зразку, при цьому таке зв'язування антитіла з FcRH5 у зразку є доказом присутності білка в згаданому зразку. В одному аспекті винахід описує спосіб діагностики порушення проліферації клітин, що викликається підвищенням кількості клітин, таких як В-клітин, що експресують FcRH5; спосіб полягає в контакті досліджуваних клітин у біологічному зразку з кожним із зазначених вище антитіл, визначенні рівня антитіла, пов'язаного з досліджуваними клітинами в зразку, шляхом визначення зв'язування антитіла з FcRH5, і порівнянні рівня пов'язаного із клітинами антитіла в контрольному зразку, при цьому рівень зв'язаного антитіла нормалізується щодо кількості FcRH 5- клітин, що експресують у досліджуваних і контрольних зразках, і, крім того, більш високий рівень зв'язаного в досліджуваному зразку антитіла в порівнянні з контрольним зразком указує на присутність порушення клітинної проліферації, викликаної клітинами, що експресують FcRH5. В одному аспекті винахід описує спосіб виявлення розчинного FcRH5 у крові або сироватці, і такий спосіб полягає у контакті досліджуваного зразка крові або сироватки ссавця, підозрюваного на наявність порушення В-клітинній проліферації, з антитілом до FcRH5 з наступним визначенням підвищення розчинного FcRH5 у досліджуваному зразку в порівнянні з контрольним зразком крові або сироватки здорового ссавця. В одному аспекті винахід описує спосіб зв'язування антитіла по винаходу із клітиною, що експресує FcRH5, і такий спосіб полягає в контакті згаданої клітини з антитілом по винаходу. В одному варіанті втілення винаходу антитіло кон’юговано із цитотоксичним агентом. В одному варіанті втілення винаходу антитіло кон’юговано з агентом-інгібітором росту. КОРОТКИЙ ОПИС ФІГУР Фігура 1 відображає легкий ланцюг химерного антитіла 7D11 до FcRH5 людини (ДНК). Фігура 2 відображає легкий ланцюг химерного антитіла 7D11 до FcRH5 людини (амінокислоти). Фігура 3 відображає важкий ланцюг химерного антитіла 7D11 до FcRH5 людини (ДНК). Фігура 4 відображає важкий ланцюг химерного антитіла 7D11 до FcRH5 людини (амінокислоти). Фігура 5 відображає легкий ланцюг химерного антитіла до FcRH5 (mAb10A8) людини (ДНК). Фігура 6 відображає легкий ланцюг химерного антитіла до FcRH5 (mAb10A8) людини (амінокислоти). Фігура 7 відображає важкий ланцюг химерного антитіла до FcRH5 (mAb10A8) людини (ДНК). Фігура 8 відображає важкий ланцюг химерного антитіла до FcRH5 (mAb10A8) людини (амінокислоти). Фігура 9 відображає вирівнювання варіабельних легких ланцюгів мишачого антитіла 10А8 і гуманізованого антитіла 10A8v1 відносно консенсусної послідовності домену VL капа 1 (huKI) (SEQ ID NO: 64). Фігура 10 відображає вирівнювання варіабельних легких ланцюгів мишачого антитіла 10А8 і гуманізованого антитіла 10A8v1 щодо підгрупи консенсусної послідовності людського домену VH (huIII) (SEQ ID NO: 65). Фігура 11 представляє амінокислотні послідовності антитіла по винаходу (Hu10A8 v1). Фігура 12 представляє амінокислотні послідовності поліпептидних ланцюгів Тіо-МАТ по винаходу із включеним у ході процедури рекомбінації цистеїном. Фігура 13 представляє амінокислотні послідовності поліпептидних ланцюгів Тіо-МАТ по винаходу із включеним у ході процедури рекомбінації цистеїном. Фігура 14 представляє перехресну реакційноздатність антитіл до FcRH5. Фігура 15 представляє перехресну реакційноздатність антитіл до FcRH5. Фігура 16 представляє перехресну реакційноздатність антитіл до FcRH5. 9 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігура 17 представляє FACS-аналіз антитіл до FcRH5. Фігура 18 представляє титрацію антитіла до FcRH5. Фігура 19 представляє титрацію антитіла до FcRH5. Фігура 20 представляє FACS-аналіз Тіо-МАТ по винаходу. Фігура 21 представляє FACS-аналіз Тіо-МАТ по винаходу. Фігура 22 представляє FACS-аналіз Тіо-МАТ по винаходу. Фігура 23 представляє FACS-аналіз Тіо-МАТ по винаходу. Фігура 24 представляє FACS-аналіз кон’югованого антитіла по винаходу. Фігура 25 представляє FACS-аналіз кон’югованого антитіла по винаходу. Фігура 26 представляє вплив антитіл по винаходу на середній об’єм пухлини. Фігура 27 представляє вплив антитіл по винаходу на середню масу тіла. Фігура 28 представляє вплив антитіл по винаходу на середній об’єм пухлини. Фігура 29 представляє вплив антитіл по винаходу на середню масу тіла. Фігура 30а представляє вплив кон’югатів антитіл по винаходу на середній об’єм пухлини. Фігура 30b представляє вплив кон’югатів антитіл по винаходу на середню масу тіла. Фігура 31 представляє аналіз відповіді на одиничну дозу сполуки. Фігура 32 представляє аналіз відповіді на одиничну дозу сполуки. Фігура 33 представляє нуклеотидну послідовність (SEQ ID NO: 58) PRO820 кДНК, при цьому SEQ ID NO: 58 є клоном, позначеним у тексті даної заявки як «DNA56041-1416» (який також вказаний у цьому тексті як «FcRH5»). Нуклеотидна послідовність, що кодує FcRH5 разом зі старт- і стоп-кодонами, зазначена жирним і підкресленим шрифтом. (Див. Goddard et al. патент США No. 7491529). Фігура 34 представляє амінокислотну послідовність (SEQ ID NO: 59), яку отримано з послідовності, що кодує, SEQ ID NO: 59, що зазначена на Фігурі 33. (Див. Goddard et al. патент США No. 7491529). Фігура 35A-B представляє нуклеотидну послідовність (SEQ ID NO: 602) PRO52387 кДНК, при цьому SEQ ID NO: 60 є клоном, позначеним у тексті даної заявки як «DNA257845» (який також вказаний у цьому тексті як «FcRH5»). Нуклеотидна послідовність, що кодує FcRH5 разом зі старт- і стоп-кодонами, зазначена жирним і підкресленим шрифтом (див. Chang et al. Опублікована заявка на патент США No. 20060251662). Фігура 36 представляє амінокислотну послідовність (SEQ ID NO: 61), що отримана з послідовності, що кодує, SEQ ID NO: 61, що зазначена на Фігурі 36A-B (див. Chang et al. Опублікована заявка на патент США No. 20060251662). Фігура 37 представляє нуклеотидну послідовність (SEQ ID NO: 62) PRO314992 кДНК, при цьому SEQ ID NO: 62 є клоном, позначеним у тексті даної заявки як «DNA676969» (який також вказаний у цьому тексті як «FcRH5»). Фігура 38 представляє амінокислотну послідовність (SEQ ID NO: 63), отриману з послідовності, що кодує, SEQ ID NO: 63, що зазначена на Фігурі 37. Фігура 39 представляє вплив комбінованого введення імунокон’югата антитіла й, щонайменше, одного хіміотерапевтичного препарату на середній об’єм пухлини у мишей. Фігура 40 представляє процентну зміну маси тіла для тварин у кожній групі прийому доз. Фігура 41 представляє вплив комбінованого введення імунокон’югата антитіла й, щонайменше, одного хіміотерапевтичного препарату на середній об’єм пухлини в мишей. Фігура 42 представляє процентну зміну маси тіла для тварин у кожній групі прийому доз. Фігура 43 представляє вплив комбінованого введення імунокон’югата антитіла й, щонайменше, одного хіміотерапевтичного препарату на середній об’єм пухлини в мишей. Фігура 44 представляє процентну зміну маси тіла для тварин у кожній групі прийому доз. Фігура 45 представляє вплив кон’югатів антитіл по винаходу на середній об’єм пухлини. Фігура 46 представляє вплив кон’югатів антитіл по винаходу на середню масу тіла. Фігура 47 представляє вплив кон’югатів антитіл по винаходу на середній об’єм пухлини. Фігура 48 представляє вплив кон’югатів антитіл по винаходу на середню масу тіла. ДЕТАЛЬНИЙ ОПИС КРАЩИХ ВАРІАНТІВ ВТІЛЕННЯ ВИНАХОДУ Винахід описує способи, композиції, набори й готові вироби для ідентифікації композицій для лікування гематобластозів у ссавців, а також способи використання таких композицій для даних цілей. У даній заявці на винахід надається опис способів, композицій, наборів і готових виробів. I. Загальні способи Практичне застосування даного винаходу буде включати, якщо інше не зазначено, стандартні способи молекулярної біології (включаючи процедури рекомбінації), мікробіології, цитології, біохімії й імунології, відомі фахівцеві в даній області. Подібні способи у всій своїй 10 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 повноті описані в літературі, наприклад, в “Molecular Cloning: A Laboratory Manual”, second edition (Sambrook et al., 1989); “Oligonucleotide Synthesis” (M. J. Gait, ed., 1984); “Animal Cell Culture” (R. I. Freshney, ed., 1987); “Methods in Enzymology” (Academic Press, Inc.); “Current Protocols in Molecular Biology” (F. M. Ausubel et al., eds., 1987, and periodic updates); “PCR: The Polymerase Chain Reaction”, (Mullis et al., ed., 1994); “A Practical Guide to Molecular Cloning” (Perbal Bernard V., 1988); “Phage Display: A Laboratory Manual” (Barbas et al., 2001). II. Визначення Для інтерпретації даного винаходу будуть застосовуватися представлені нижче визначення й, де це можливо, терміни, які використовували в однині, будуть приводитися в множині й навпаки. У випадку якщо будь-яке визначення йде врозріз будь-якому включеному в дану заявку документу у вигляді посилання, вирішальним буде визначення яке тут представлене. У контексті даного винаходу термін «поверхневий маркер В-клітини» або «поверхневий антиген В-клітини» позначає антиген, що експресується що експресується на поверхні Вклітини, що може служити мішенню для антагоніста, що з ним зв'язується, і може бути представлений (не обмежуючись) антитілами до поверхневого антигену В-клітин або розчинній формі поверхневого антигену В-клітини, що приводить до антагонізму зв'язування ліганду з антигеном В-клітини, що зустрічається в природі. Поверхневі маркери В-клітин включають лейкоцитарні поверхневі маркери CD19, CD20, CD21, CD22, CD23, CD24, CD25, CD37, CD53, CD72, CD73, CD74, CD75, CD77, CD79a, CD79b, CD80, CD81, CD82, CD83, CD84, CD85 і CD86 nd (опис див. в The Leukocyte Antigen Facts Book, 2 Edition. 1997, ed. Barclay et al. Academic Press, Harcourt Brace & Co., New York). Інші поверхневі маркери В-клітин включають RP105, FcRH2, Bcell CR2, CCR6, P2X5, HLA-DOB, CXCR5, FCER2, BR3, BAFF, BLyS, Btig, NAG14, SLGC16270, FcRH1, IRTA2, ATWD578, FcRH3, IRTA1, FcRH6, BCMA і 239287. Окремий поверхневий маркер В-клітин, що цікавить, переважно експресується на В-клітинах у порівнянні з іншими тканинами ссавців, що не містять В-клітин, і такий маркер може експресуюватися на попередниках В-клітин й зрілих В-клітинах. У контексті даного винаходу термін «FcRH5» відноситься до будь-якого нативного FcRH5, що отриманий в будь-якого хребетного, включаючи ссавців, таких як примати (наприклад, людина, яванський макак) і гризуни (наприклад, миші й пацюки), якщо не зазначене інше. У контексті даного винаходу людський FcRH5 також вказується як «TAHO18» або «PRO85143» (SEQ ID NO: 2) і кодується нуклеотидною послідовністю (SEQ ID NO: 1), також вказується як «DNA340394». У контексті даного винаходу FcRH5 яванського макака також вказується як «cyno FcRH5». Термін «FcRH5» охоплює не підданий процесінгу FcRH5 «повної довжини», а також будь-яку форму FcRH5, одержувану в результаті процесінгу в клітині. Термін також включає варіанти FcRH5, що зустрічаються в природі, наприклад, сплайс-варіанти, алельні варіанти й ізоформи. Описані тут поліпептиди FcRH5 можуть бути ізольовані із цілого ряду джерел, таких як різні типи тканин людини або інших джерел, або отримані шляхом рекомбінації або синтезу. Термін «поліпептид FcRH5 з нативною послідовністю» включає поліпептид, що має таку ж амінокислотну послідовність, що й відповідний поліпептид FcRH5, що зустрічається в природі. Такі поліпептиди FcRH5 з нативною послідовністю можуть бути ізольовані із природних джерел або отримані шляхом рекомбінації або синтезу. Термін «поліпептид FcRH5 з нативною послідовністю» включає, зокрема, вкорочені або секретуючі форми специфічного поліпептиду FcRH5, що зустрічаються в природі (наприклад, послідовність позаклітинного домену), варіантні форми, що зустрічаються в природі (наприклад, сплайс-форми) і алельні варіанти поліпептиду, що зустрічаються в природі. У певних варіантах втілення винаходу описані тут поліпептиди FcRH5 з нативною послідовністю представлені зрілими поліпептидами або поліпептидами з нативною послідовністю повної довжини, які включають амінокислотні послідовності повної довжини, представлені на супровідних фігурах. Старт- і стоп-кодони (якщо зазначені) приводяться на фігурах жирним підкресленим шрифтом. Залишки нуклеїнових кислот, зазначені на супровідних фігурах як «N», являють собою залишок будь-якої нуклеїнової кислоти. Однак на супровідних фігурах описані тут поліпептиди FcRH5 починаються із залишків метіоніну, зазначених на фігурах у положенні 1, при цьому приблизно й можливо, що інші залишки метіоніну, розташовані у верхнім і нижнім положеннях від положення 1 на фігурах, можуть використовуватися в якості стартового амінокислотного залишку для поліпептидів FcRH5. У контексті даного винаходу «mu10A8» або «MA10A8» або «антитіло до FcRH5 (10A8) миші» або «мишаче антитіло до FcRH5 (10A8)» специфічним чином відноситься до мишачого моноклонального антитіла до FcRH5, при цьому таке мишаче моноклональне антитіло до FcRH5 складається з варіабельного домену легкого ланцюга з послідовністю SEQ ID NO: 18 (Фігура 9) і варіабельного домену важкого ланцюга з послідовністю SEQ ID NO: 20 (Фігура 10). 11 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 Мишаче моноклональне антитіло до FcRH5 може бути придбане у комерційних джерел. У контексті даного винаходу «ch10A8» або «chMAFcRH5 (10A8)» або «chFcRH5 (10A8)» або «химерне антитіло MAFcRH5 (10A8)» специфічним чином відноситься до химерного антитіла до людського FcRH5, при цьому таке химерне антитіло до людського FcRH5 складається з легкого ланцюга з послідовністю SEQ ID NO: 15 (Фігура 6). Легкий ланцюг з послідовністю SEQ ID NO: 15 надалі включає варіабельний домен, представлений на Фігурі 9, а також константний домен легкого ланцюга IgG1 людини. Химерне антитіло до людського FcRH5 (10A8) додатково містить важкий ланцюг з послідовністю SEQ ID NO: 17 (Фігура 8). Важкий ланцюг з послідовністю SEQ ID NO: 17 надалі включає варіабельний домен, представлений на Фігурі 10, а також константний домен важкого ланцюга IgG1 людини. У контексті даного винаходу «ch7D11» або «chMAFcRH5 (7D11)» або «chFcRH5 (7D11)» або «химерне антитіло MAFcRH5 (7D11)» специфічним чином відноситься до химерного антитіла до людського FcRH5, при цьому таке химерне антитіло до людського FcRH5 складається з легкого ланцюга з послідовністю SEQ ID NO: 11 (Фігура 2), що включає константний домен легкого ланцюга людського IgG1. Химерне антитіло до людського FcRH5 (7D11) додатково містить важкий ланцюг з послідовністю SEQ ID NO: 13 (Фігура 4), що включає константний домен важкого ланцюга людського IgG1. У контексті даного винаходу «антитіло до cynoFcRH5» або «антитіло до cyno FcRH5» відноситься до антитіл, що зв'язуються з FcRH5 яванського макака. У контексті даного винаходу «10A 8-щеплений» або «10A 8-щеплене «гуманізоване» антитіло» або «щеплений hu10A8» специфічним чином відноситься до щепленого фрагмента, яке одержане шляхом щеплення гіперваріабельних ділянок з мишачого антитіла 10A8 до FcRH5 (mu10A8) до акцептора – консенсусної послідовності VL капа I (huKI) людини й консенсусної послідовності VH (huIII) підгрупи III людини (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992)) (див. Приклад 1 і Фігури 9 (SEQ ID NO: 19) і 10 (SEQ ID NO: 21)). У контексті даного винаходу «hu10A8» або «hu10A8 v1» специфічним чином відноситься до гуманізованого антитіла 10A8. У контексті даного винаходу термін «модифікація» амінокислотного залишку/положення відноситься до зміни первинної послідовності амінокислот у порівнянні з вихідною послідовністю амінокислот, при цьому така зміна виникає в результаті зміни послідовності, що утягує зазначені амінокислотні залишки/положення. Наприклад, типові модифікації включають заміну залишку (або в зазначеному положенні) іншою амінокислотою (наприклад, заміна консервативної або неконсервативної амінокислоти), вставку однієї або декількох (звичайно менш 5 або 3) амінокислот, що прилягають до зазначеного залишку/положення, і делецію зазначеного залишку/положення. Термін «заміна амінокислоти» або його варіанти відноситься до заміни існуючого залишку амінокислоти в попередньо певній (вихідної) амінокислотної послідовності іншим амінокислотним залишком. Звичайно й більш переважно, щоб така модифікація приводила до зміни щонайменше в показнику фізикобіохімічної активності варіантного поліпептиду в порівнянні з поліпептидом, що включає вихідну амінокислотну послідовність (тобто послідовність «дикого типу»). Наприклад, у випадку антитіла, фізикобіохімічна активність, що піддається зміні, може бути представлена афінністю зв'язування, здатністю зв'язування й/або ефектом зв'язування на молекулу-мішень. Термін «антитіло» використовується в самому широкому своєму вмісті й специфічним чином охоплює, наприклад, одиночні моноклональні антитіла до FcRH5 (включаючи агоністичні, антагоністичні, нейтралізуючі антитіла, інтактні моноклональні антитіла або антитіла повної довжини), композиції з антитілом до FcRH5, що володіють поліепітопною специфічністю, поліклональні антитіла, мультивалентні антитіла, мультиспецифічні антитіла (наприклад, біспецифічні антитіла доти, поки вони мають необхідну біологічну активність), утворені, по меншій мері із двох інтактних антитіл, одноланцюгові антитіла до FcRH5, а також фрагменти антитіл до FcRH5 (див. нижче), включаючи фрагменти Fab, Fab’, F(ab’) 2 і Fv, діатела, антитіла з одним доменом (sdАТ) доти, поки вони мають необхідну біологічну або імунологічну активність. У даному тексті термін «імуноглобулін» (Ig) використовується взаємозамінним чином з антитілом. Антитіло може бути представлено людським, гуманізованим антитілом і/або антитілом з дозрілою афінністю. Термін «антитіло до FcRH5» або «антитіло, що зв'язується з FcRH5» відноситься до антитіла, яке здатне зв'язуватися з FcRH5 з достатньою афінністю, таким чином, зазначене антитіло може використовуватися в якості діагностичного й/або терапевтичного агента при зв'язуванні з FcRH5. Найкраще, щоб ступінь зв'язування антитіла до FcRH5 з неспорідненим і не стосовним до FcRH5 білком становила менш 10% від показника зв'язування антитіла з FcRH5, як це обмірювано, наприклад, за допомогою радіоімуноаналізу (РІА). У певних 12 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантах втілення винаходу антитіло, що зв'язується з FcRH5, має константу дисоціації (Kd), рівну ≤ 1 мкМ, ≤ 100 нМ, ≤ 10 нМ, ≤ 1 нМ або ≤ 0,1 нМ. У певних варіантах втілення винаходу антитіло до FcRH5 зв'язується з антигенною детермінантою FcRH5, що є присутньою в FcRH5, отриману від різним видів. «Ізольоване антитіло» представлено антитілом, що було ідентифіковано й виділене й/або відновлене з компонента в природному середовищі. Забруднюючі (домішкові) компоненти в природному середовищі являють собою матеріали, які можуть перешкодити терапевтичному використанню антитіла, і такі матеріали можуть включати ферменти, гормони й інші білкові й небілкові розчинені речовини. У кращих варіантах втілення винаходу антитіло буде очищатися (1) до значення більше 95% по вазі антитіла, як це визначено по способі Фоліна-Чикальтеу, і найбільш переважно більш ніж 99% по вазі; (2) до ступеня, достатнього для одержання щонайменше 15 залишків N-кінцевої або внутрішньої амінокислотної послідовності шляхом використання секвенатору з обертовою склянкою; або (3) до досягнення однорідності, обумовленої способом електрофореза в поліакриламідному гелі в умовах, що відновлюють і, що не відновлюють, з використанням Кумасси синього або серебрянки. Ізольоване антитіло включає антитіло in situ у рекомбінантних клітинах, при цьому, щонайменше, один компонент природного середовища антитіла буде відсутній. Як правило, ізольоване антитіло будуть одержувати, щонайменше, з одним етапом очищення. Основна одиниця 4-ланцюгового антитіла представлена гетеротетрамерним глікопротеїном, що складається із двох ідентичних легких (L) ланцюгів і двох ідентичних важких (H) ланцюгів (антитіло до IgM складається з 5 основних гетеротетрамерних одиниць разом з додатковим поліпептидом, що має назву J-ланцюга, і, отже, включає 10 ділянок зв'язування антигену, у той час як секретуючі антитіла до IgA можуть полімеризуватися з утворенням полівалентних комплексів, що включають 2-5 основних 4-ланцюгових одиниць разом з J-ланцюгом). У випадку IgG, 4-ланцюгова одиниця звичайно має масу 150 000 дальтон. Кожний L-ланцюг приєднується до H-ланцюга одним ковалентним дисульфідним зв'язком, у той час як два Н-ланцюги приєднуються один до одного одним або декількома дисульфідними зв'язками залежно від ізотипа Н-ланцюга. Кожен H- і L-ланцюг також має дисульфідні містки між ланцюгами, розташовані на однаковій відстані. Кожний Н-ланцюг на своєму N-кінці має варіабельний домен (VH), за яким йдуть три константних доменів (CH) для кожної α і γ ланцюгів, і чотири домена C H для ізотипів μ і ε. Кожний L-ланцюг на своєму N-кінці має варіабельний домен (VL), за яким треба константний домен (CL) на іншому кінці. VL розташований відносно VH і CL розташований щодо першого константного домену важкого ланцюга (CH1). Окремі амінокислотні залишки, як вважається, утворюють границю зіткнення між варіабельними доменами легкого й важкого ланцюга. Комплементарне спарювання VH і VL утворює одну антигензв’язуючу ділянку. Структура й властивості різних класів антитіл представлені, наприклад, в Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, стор. 71 і Розділі 6. L-ланцюг, отриманий у будь-кого з видів хребетних, може відноситься до одного із двох чітко, видів,що різняться, що мають назву капа й лямбда, ґрунтуючись на амінокислотних послідовностях їх константних доменів. Залежно від амінокислотної послідовності константного домену важких ланцюгів (CH), імуноглобуліни можуть відноситься до різних класів або ізотипам. Існує п'ять класів імуноглобулінів: IgA, IgD, IgE, IgG і IgM, що мають важкі ланцюги, що позначають як α, β, γ, ε і μ, відповідно. Класи γ і α надалі підрозділяються на підкласи на основі щодо невеликих розходжень у послідовності CH і функціях, наприклад, у людини виробляються наступні підкласи: IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2. Термін «варіабельна ділянка» або «варіабельний домен» антитіла відноситься до домену на амінному кінці важкого або легкого ланцюга антитіла. Варіабельний домен важкого ланцюга може позначатися як «VH». Варіабельний домен легкого ланцюга може позначатися як «VL». Ці домени є звичайно найбільш варіабельнийми ділянками антитіла й містять антигензв’язуючі ділянки. Термін «варіабельний» відноситься до того факту, що певні сегменти варіабельних доменів істотно різняться у своїй послідовності в антитілах. Домен V опосередковує зв'язування антигену й визначає специфічність окремого антитіла до свого окремого антигену. Однак, варіабельність уздовж амінокислотної послідовності варіабельних доменів з 110 залишків розподілена нерівномірно. Навпроти, ділянки V включають відносно інваріантні фрагменти, які мають назву каркасні ділянки (КД), з 15-30 амінокислот, розділених більше короткими ділянками із сильною варіабельністю, які називаються «гіперваріабельними ділянками» і мають довжину 912 амінокислот. Варіабельні домени нативних важких і легких ланцюгів складаються із чотирьох КД, що здобувають здебільшого β -конфігурацію, і приєднані до трьох 13 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 гіперваріабельним ділянкам, які утворюють петлю, що з'єднує й у деяких випадках утворюючу частину β -структури. Гіперваріабельні ділянки в кожному ланцюзі втримуються в безпосередній близькості КД й разом з гіперваріабельнийми ділянками іншого ланцюга сприяють утворенню антигензв’язуючої ділянки антитіл (див. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Константні домени не беруть участь безпосереднім чином у зв'язування антитіла з антигеном, але мають різні ефекторні функції, такі як участь антитіла у виникненні антитілозалежної клітинно-опосередкованної цитотоксичності (АЗКЦ). «Інтактне» антитіло являє собою антитіло, що складається з антигензв’язуючої ділянки й C L, а також, щонайменше, константних доменів важкого ланцюга C H1, CH2 і CH3. Константні домени можуть бути представлені константними доменами з нативною послідовністю (наприклад, константні домени з нативною послідовністю людини) або варіантом нативної амінокислотної послідовності. Переважно, інтактне антитіло володіє однією або декількома ефекторними функціями. У контексті даного винаходу термін «незв'язане антитіло» позначає антитіло, що не кон’юговано із цитотоксичноюмолекулою або радіоміткою. «Фрагменти антитіла» включають ділянку інтактного антитіла, переважно антигензв’язуючий або варіабельну ділянку інтактного антитіла. Приклади фрагментів антитіла включають фрагменти Fab, Fab', F(ab')2 і Fv, діатіла, лінійні антитіла (див. патент США No. 5641870, Приклад 2; Zapata et al., Protein Eng. 8(10): 1057-1062 [1995]), молекули одноланцюгових антитіл і мультиспецифічні антитіла, утворені із фрагментів антитіл. В одному варіанті втілення винаходу фрагмент антитіла складається з антигензв’язуючої ділянки інтактного антитіла зі збереженою здатністю зв'язувати антиген. Розщеплення антитіл папаїном призводить до утворення двох ідентичних антигензв’язуючих фрагментів, що мають назву «Fab» фрагменти, і залишкового «Fc» фрагмента, позначення якого відображає легку здатність до кристалізації. Фрагмент Fab складається з повного Lланцюга разом з доменом варіабельного ділянки Н-ланцюга (VH) і першим константним доменом важкого ланцюга (CH1). Кожний Fab фрагмент моновалентен щодо зв'язування антигену, тобто має одну антигензв’язуючу ділянку. Розщеплення антитіла пепсином призводить до утворення одного великого фрагмента F(ab') 2, що орієнтовно відповідає дисульфідно приєднаним фрагментам Fab; такий великий фрагмент має двовалентну антигензв’язуючу активність і усе ще здатний брати участь у перехресному зв'язуванні антигену. Фрагменти Fab’ відрізняються від фрагментів Fab по декількох додатковим залишкам на карбоксильному кінці домену CH1, включаючи один або кілька залишків цистеїна із шарнірної ділянки антитіла. У контексті даного винаходу Fab'-SH позначає Fab', у якому цистеїновий залишок (-ки) константних доменів несуть незв'язану тіоліву групу. Фрагменти антитіла F(ab') 2 первісно були отримані як пари фрагментів Fab', що мають між собою шарнірні залишки цистеїну. Також відомі й інші хімічні взаємодії між фрагментами антитіла. Фрагмент Fc складається з карбоксильних кінців обох Н-ланцюгів, які втримуються разом дисульфідними зв'язками. Ефекторні функції антитіл визначаються по послідовності в ділянці Fc, і така ділянка також є крапкою розпізнавання для рецепторів Fc (FcR), що перебувають на певних типах клітин. «Fv» є найменшим фрагментом антитіла, що містить повну ділянку розпізнавання й зв'язування антигену. Такий фрагмент складається з димера варіабельногодомену одного легкого й одного важкого ланцюгів, що перебувають у близькому, нековалентному зв'язку. В одноланцюгових видах Fv (scFv) один варіабельний домен важкої й один варіабельний домен легкого ланцюга можуть бути ковалентно приєднані з використанням гнучкого пептидного лінкера, таким чином, важкі й легені ланцюги можуть брати участь в «димерній» структурі, аналогічній такій структурі двухланцюгових видів Fv. При скручуванні таких двох доменів утвориться шість гіперваріабельних петель (3 петлі для кожного ланцюга H і L), що сприяють зв'язуванню антигену амінокислотними залишками й надають антигензв’язуючу специфічність антитілу. Однак навіть одиночний варіабельний домен (або половина Fv, включаючи тільки три CDR, специфічних для антигена) має здатність розпізнавати й зв'язуватися з антигеном, але при більш низькій афінності, ніж вся ділянка зв'язування. «Одноланцюгові Fv» (або в скороченому виді «sFv» або «scFv») являють собою фрагменти антитіла, що включають домени антитіла VH і VL, з'єднані в один поліпептидний ланцюг. Переважно, поліпептид sFv буде додатково включати поліпептидний лінкер між доменами V H і VL, що дозволить sFv утворювати необхідну структуру для зв'язування антигену. Більше докладний опис sFv див. в Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrebaeck 1995 14 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 (нижче). Термін «діатіла» відноситься до фрагментів антитіла із двома антигензв’язуючими ділянками, і такі фрагменти включають варіабельний домен важкого ланцюга (VH), приєднаний до варіабельного домену легкого ланцюга (VL) в одному і тому ж поліпептидному ланцюзі (VHVL). Невеликі фрагменти антитіла одержують шляхом конструювання фрагментів sFv (див. попередню главу) з короткими лінкерами (приблизно 5-10 залишків) між доменами VH і VL, таким чином, досягається міжланцюгове (але не внутришньоланцюгове) спарювання V доменів, що приводить до утворення двовалентного фрагмента, тобто фрагмента із двома антигензв’язуючими ділянками. Діатіла можуть бути двовалентними або біспецифічними. Біспецифічні антитіла представлені гетеродимерами із двох «кросоверних» фрагментів, у яких домени VH і VL двох антитіл присутні у двох різних поліпептидних ланцюгах. Діатіла описані більш докладно в EP 404,097; WO 93/11161; Hudson et al., Nat. Med. 9:129-134 (2003); і Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993). Тріатіла й тетратіла також описані в Hudson et al., Nat. Med. 9:129-134 (2003). Термін «моноклональне антитіло» у контексті даного винаходу відноситься до антитіла, яке отримане з популяції практично однорідних антитіл, тобто окремих антитіл, що становлять популяцію і є ідентичними за винятком можливих і виникаючих природно мутацій, які можуть бути присутні у незначних кількостях. Моноклональні антитіла є високоспецифічними й спрямовані щодо однієї ділянки антигену. Крім того, на відміну від композицій з поліклональними антитілами, які включають різні антитіла, спрямовані щодо різних детермінант (епітопів), кожне моноклональне антитіло спрямоване щодо однієї детермінанти антигену. Крім своєї специфічності, моноклональні антитіла мають перевагу, тому що вони можуть бути синтезовані при відсутності домішок інших антитіл. Модифікатор «моноклональний» не повинен тлумачитися як потребуючий виробництва антитіла яким-небудь окремим способом. Наприклад, моноклональні антитіла, які можуть використовуватися в даному винаході можуть бути отримані способом гібридоми, що був уперше описаний Kohler et al., Nature, 256:495 (1975), або шляхом рекомбінації ДНК у клітинах бактерій, еукаріотів або рослин (див., наприклад, патент США No. 4816567). «Моноклональні антитіла» також можуть бути ізольовані з фагових бібліотек з використанням способів, описаних, наприклад, в Clackson et al., Nature, 352:624-628 (1991) and Marks et al., J. Mol. Biol., 222:581-597 (1991). Описані тут моноклональні антитіла включають «химерні» антитіла, у яких ділянка важкого й/або легкого ланцюгів ідентична або гомологічна відповідним послідовностям в антитілах, що отримані в окремих видах або приналежні окремому класу або підкласу антитіл, і ділянка ланцюга (-ів) ідентична або гомологічна відповіднимям в антитілах, отриманих в інших видів або приналежних іншим класам або підкласам антитіл, а також фрагменти таких антитіл, що володіють необхідною біологічною активністю (патент США No. 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Описані тут химерні антитіла включають «приматизовані» антитіла, що включають варіабельний домен антигензв’язуючих послідовностей, отриманих у нелюдиноподібних приматів (наприклад, мавп Старого світа й т.д.), а також ділянок константних послідовностей людини. «Гуманізовані» форми антитіл тварин (наприклад, гризунів) представлені химерними антитілами, які містять мінімальну послідовність, отриману з антитіла тварин. Для більшої частини гуманізовані антитіла представлені людськими імуноглобулінами (антитіло-реципієнт), у яких залишки гіперваріабельних ділянок реципієнта заміщені залишком гіперваріабельної ділянки тварини ( антитіла-донора), наприклад, миші, пацюка, кролика або нелюдиноподібного примата, при цьому збережена необхідна специфічність, афінність і функціональність. У деяких випадках залишки каркасної ділянки (КД) імуноглобуліну людини заміщаються відповідними залишками тварин. Більш того, гуманізовані антитіла можуть включати залишки, не присутні в антитілі-донорі або антитілі-реципієнті. Такі модифікації здійснюються для посилення дії антитіла. У цілому, гуманізоване антитіло буде складатися практично повністю з, щонайменше, одного, але звичайно двох варіабельних доменів, у яких всі або практично всі гіперваріабельні петлі відповідають імуноглобуліну тварин, і всі або практично всі КД відповідають послідовності імуноглобуліну людини. Гуманізоване антитіло буде включати, щонайменше, частину константної ділянки імуноглобуліну (Fc), як правило, імуноглобуліну людини. Додаткову інформацію див. в Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988); and Presta, Curr. Op. Struct. Biol., 2:593-596 (1992). Див. також наступні оглядові статті й наведені посилання: Vaswani and Hamilton, Ann. Allergy, Asthma and Immunol., 1:105-115 (1998); Harris, Biochem. Soc. Transactions, 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech., 5:428-433 (1994). У контексті даного винаходу термін «тіо» відноситься до антитіла із приєднаним у ході 15 UA 104460 C2 5 10 15 20 25 30 35 рекомбінації цистеїном, при цьому приставка «hu», при її використанні, відноситься до гуманізованого антитіла. «Людське антитіло» представлено антитілом, що несе амінокислотну послідовність, що відповідає такій послідовності антитіла, що виробляється людиною й/або, що використовується в кожному зі способів для одержання людських антитіл відповідно до представленого тут описа. Таке визначення людського антитіла специфічним чином виключає гуманізоване антитіло, що включає антигензв’язуючі залишки тваринного походження. Людські антитіла можуть бути отримані з використанням різних відомих науці способів, включаючи бібліотеки фагових дисплеїв. Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991). Для одержання людських моноклональних антитіл також доступні способи, описані в Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147(1):86-95 (1991). Див. також van Dijk and van de Winkel, Curr. Opin. Pharmacol., 5: 368-74 (2001). Людські антитіла можуть бути отримані шляхом введення антигену трансгенній тварині, що було модифіковано для вироблення таких антитіл у відповідь на вплив антигеном, але при цьому ендогенні локуси були наведені в неактивний стан, наприклад, введення мишам лінії Xenomouse (див., наприклад, патенти США No. 6075181 і 6150584 про технологію TM XENOMOUSE ). Див. також, наприклад, Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006) про людські антитіла, отримані за допомогою способу В-клітинної гібридоми людини. У контексті даного винаходу термін «гіперваріабельна ділянка», «HVR» або «HV» відноситься до ділянок варіабельності домену антитіла, що відрізняється гіперваріабельністю послідовності й/або утворює структурно обумовлену петлю. Як правило, антитіла включають шість гіперваріабельних ділянок: три в VH (H1, H2, H3) і три в VL (L1, L2, L3). Кількість що відображені гіперваріабельних ділянок описано в тексті даної заявки. Гіперваріабельні ділянки по Kabat (CDR) ґрунтуються на варіабельності послідовності й використовуються найбільш часто (Kabat et al., Sequenc.es of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Розташування структурних петель визначається по Chothia (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Кінець петлі Chothia CDR-H1 при нумерації з використанням системи нумерації по Kabat варіює від H32 до H34 залежно від довжини петлі (це пояснюється тим, що схема нумерації по Kabat розташовує вставки в H35A і H35B; при відсутності 35A і 35B, петля закінчується на 32; у випадку присутності тільки 35А, петля закінчується на 33; у випадку присутності 35А и 35В, петля закінчується на 34). Гіперваріабельні ділянки МАТ являють собою компромісне рішення між Kabat CDR і структурними петлями Chothia, і використовуються програмним комплексом для моделювання МАТ Oxford Molecular. «Контактні» гіперваріабельні ділянки ґрунтуються на аналізі наявних складних кристалічних структур. Залишки кожної з таких гіперваріабельних ділянок зазначені нижче. Петля Kabat -------L1 L24-L34 L2 L50-L56 L3 L89-L97 H1 H31-H35B (Нумерація по Kabat) H1 H31-H35 (Нумерація по Chothia) H2 H50-H65 H3 H95-H102 МАТ --L24-L34 L50-L56 L89-L97 H26-H35B Chothia ------L24-L34 L50-L56 L89-L97 H26-H32..34 Контакт ------L30-L36 L46-L55 L89-L96 H30-H35B H26-H35 H26-H32 H30-H35 H50-H58 H95-H102 H52-H56 H95-H102 H47-H58 H93-H101 40 45 50 Гіперваріабельні ділянки можуть включати наступні «розширені гіперваріабельні ділянки»: 24-36 або 24-34 (L1), 46-56 або 50-56 (L2) і 89-97 (L3) в VL і 26-35B (H1), 50-65, 47-65 або 49-65 (H2) і 93-102, 94-102 або 95-102 (H3) в VH. Залишки варіабельногодомену пронумеровані згідно Kabat et al. (всі визначення представлені вище). Залишки «каркасної ділянки» або «КД» представлені залишками варіабельного домену на відміну від залишків гіперваріабельної ділянки, певних у тексті даної заявки. Термін «залишок варіабельного домену, пронумерованого по Kabat» або «нумерація положення амінокислоти по Kabat», а також його варіації відносяться до системи нумерації, що використовується для варіабельних доменів важкого ланцюга або варіабельних доменів легкого ланцюга при зіставленні антитіл і описаної в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991). З 16 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 використанням такої системи нумерації фактична лінійна послідовність амінокислот може містити менше або більше амінокислот, що відповідає вкороченню або вставці в КД або CDR варіабельного домену. Наприклад, варіабельний домен важкого ланцюга може включати одну амінокислотну вставку (залишок 52а згідно Kabat) після залишку 52 Н2 і вставлені залишки (наприклад, залишки 82a, 82b, 82c і т.д. згідно Kabat) після залишку 82 КД важкого ланцюга. Нумерація залишків по Kabat може проводитися для окремого антитіла шляхом вирівнювання гомологічних ділянок у послідовності антитіла з «стандартною» пронумерованою послідовністю Kabat. Система нумерації по Kabat звичайно використовується при вказівці залишку у варіабельному домені (зразкова кількість залишків у легкому ланцюзі 1-107 і у важкому ланцюзі 1-113) (наприклад, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). «Система нумерації EU» або «індекс EU» звичайно використовується при вказівці залишку в константній ділянці важкого ланцюга імуноглобуліну (наприклад, індекс EU повідомляється в Kabat et al., див. вище). Термін «індекс EU по Kabat» відноситься до нумерації залишку людського антитіла до IgG1. Якщо не зазначене інше, посилання на номери залишків у варіабельному домені антитіл позначають нумерацію залишку по системі нумерації Kabat. Якщо не зазначене інше, посилання на номери залишків у варіабельному домені антитіл позначають нумерацію залишку по системі нумерації EU (наприклад, див. попередня заявка на патент США No. 60/640323, Фігури, що відображають нумерацію по EU). Антитіло з «дозрілою афінністю» представлено антитілом з одним або декількома змінами в одному або декількох ГВУ, що призводить до поліпшення афінності антитіла стосовно антигену в порівнянні з вихідним антитілом, що не володіє такими змінами. Кращі антитіла з дозрілою афінністю будуть мати показники афінності щодо антигену-мішені, вимірювані в наномолях або пікомолях. Антитіла з дозрілою афінністю одержують із використанням способів, відомих науці. Marks et al. Bio/Technology 10:779-783 (1992) описує дозрівання афінності шляхом перестановки домену VH і VL. Випадковий мутагенез залишків HVR і/або каркасної ділянки описаний у наступних джерелах: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); and Hawkins et al, J. Mol. Biol. 226:889-896 (1992). «Блокуюче» антитіло, або антитіло - «антагоніст» представлено антитілом, що інгібує або що знижує біологічну активність антигену, з яким воно зв'язується. Переважні блокуючі антитіла або антитіла-антагоністи значно або повністю інгібують біологічну активність антигену. У контексті даного винаходу «антитіло-агоніст» позначає антитіло, що імітує щонайменше, одну функціональну властивість поліпептиду, що цікавить. «Видозалежне антитіло», наприклад, антитіло ссавця до IgE людини, представлено антитілом, що має більшу афінність зв'язування з антигеном одного виду ссавця в порівнянні з гомологом такого антигену іншого виду ссавця. Як правило, видозалежне антитіло «специфічно зв'язується» з антигеном людини (тобто має значення афінності зв'язування (Kd) не більш ніж -7 -8 приблизно 1×10 М, переважно не більш ніж приблизно 1×10 М и найбільше переважно не більш ніж приблизно 1×10-9 М), але володіє афінністю зв'язування з гомологом антигену іншого виду тварини (ссавця), що, щонайменше, приблизно в 50 разів, або, щонайменше, приблизно в 500 разів, або, щонайменше, приблизно в 1000 разів слабкіше, ніж афінність зв'язування з антигеном людини. Видозалежне антитіло може бути представлено кожним з різних типів антитіл, як це визначено вище, але переважно представлене гуманізованим або людським антитілом. Термін «афінність зв'язування» звичайно відноситься до сумарної сили всіх нековалентних взаємодій між одним центром зв'язування молекули (наприклад, антитіла) і його партнером, що зв’язує (наприклад, антигеном). Якщо інше не зазначено, у контексті даного винаходу «афінність зв'язування» відноситься до властивої антитілу афінності зв'язування, що відображає 1:1 взаємодію між членами пари, що зв’язується (наприклад, антитіла й антигену). Афінність молекули Х до свого партнера Y може бути звичайно представлена по константі дисоціації (Kd). Афінність може бути обмірювана з використанням загальних і відомих науці способів, включаючи способи, описані в даній заявці. Антитіла з низькою афінністю звичайно зв'язуються з антигеном повільно й легко дисоціюють, у той час як антитіла з високої афінністю звичайно зв'язуються з антигеном більш швидко й залишаються зв'язаними довше. У науці відомий цілий ряд способів виміру афінності зв'язування, і будь-який такий спосіб може використовуватися з метою даного винаходу. Нижче представлені специфічні ілюстративні варіанти втілення винаходу. У контексті даного винаходу термін «або краще» відноситься до афінності зв'язування, 17 UA 104460 C2 5 10 15 20 25 30 35 40 45 50 55 60 тобто більш сильному зв'язуванню між молекулою і її партнером, що зв’язує. При використанні в контексті даного винаходу термін «або краще» відноситься до більше сильного зв'язування й відображається меншим числовим значенням Kd. Наприклад, антитіло зі значенням афінності до антигену «0,6 нМ» або краще може мати значення афінності щодо антигену, рівне
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-fcrh5 antibodies and immunoconjugates and methods of use
Автори англійськоюElkins, Kristi, Polson, Andrew, Ebens, Allen, Adams, Camelia, Zheng, Bing, Junutula, Jagath, R., Hongo, Jo-Anne, Wu, Yan
Автори російськоюЭлкинс Кристи, Полсон Эндрю, Эбенс Аллен, Адамс Камелия, Чжен Бин, Джунутула Джагатх Р., Хонго Джо-Енн, У Янь
МПК / Мітки
МПК: C07K 19/00, G01N 33/574, C07K 16/28, C12N 5/20, A61K 39/395, A61K 35/02, C12N 15/13
Мітки: імунокон'югати, способи, їхнього, антитіла, fсrcн5, застосування
Код посилання
<a href="https://ua.patents.su/272-104460-antitila-do-fsrcn5-kh-imunokonyugati-jj-sposobi-khnogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антитіла до fсrcн5, їх імунокон’югати й способи їхнього застосування</a>
Попередній патент: Антитіла проти fgfr3 і способи їх застосування
Наступний патент: Спосіб одержання електропровідних полімерних композитів
Випадковий патент: Спосіб визначення порушень васкуляризації печінкової паренхіми у хворих на хронічний вірусний гепатит с на тлі стеатозу печінки












